Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической химии и включает способ предупреждения формирования геля гидрофобного пептида, а также композиции гидрофобного пептида и противоиона.
Уровень техники
Часто существует необходимость доставки биологически активных пептидов животным и человеку в композициях, обеспечивающих замедленное высвобождение активного компонента. Данные композиции могут быть получены путем введения активного компонента в биодеградируемые и биосовместимые полимеры в форме микрокапсул, микрогранул или имплантируемых стержней или, альтернативно, посредством использования механических устройств, таких как микронасосы или небиодеградируемые контейнеры. Если пептид имеет высокую растворимость в водной среде, он может быть получен в виде комплекса с небиодеградируемыми полимерами, такими как производные целлюлозы, или смешан с растворами полимеров, формирующими при парентеральной инъекции гель, из которого медленно высвобождается активный пептид.
Все вышеупомянутые композиции имеют недостатки и ограничения, такие как большой объем суспендируемых жидкостей или необходимость удаления недеградируемого устройства. В случае гелеобразующих пептидов часто возникает проблема биодоступности, которая нарушает желательное длительное действие активного компонента.
Некоторые проблемы, обусловленные физико-химическими свойствами пептидов, были описаны в статье R.Deghenghi "Антареликс" ("Antarelix") в монографии "Проблемы и перспективы лечения с использованием аналогов GnRH (рилизинг-гормона гонадотропина)" ("Treatment with GnRH Analogs: Controversies and Perspectives"), под ред М.Filicori и С.Flamigni, The Parthenon Publishing Group, New York and London, c.89-91, (1996). Дополнительные проблемы проиллюстрированы в статье J. Rivier "Перспективы применения аналогов GnRH в следующем тысячелетии" ("GnRH analogues towards the next millennium") в монографии "Аналоги GnRH" ("GnRH Analogues") под ред. В.Lunenfeld, The Parthenon Publishing Group, New York and London, c.31-45, (1999) и в работах других авторов, например в статье M.F.Powell и соавт., "Парентеральные пептидные композиции - химические и физические свойства нативного LHRH (рилизинг-гормона лютеинизирующего гормона) и гидрофобных аналогов в водном растворе" ("Parenteral Peptide Formulations: Chemical and Physical Properties of Native LHRH and Hydrophobia Analogues in Aqueous Solution"), Pharmaceutical Research, 8:1258-1263, (1991).
Соответственно, существует потребность в новых композициях и способах введения, позволяющих избежать этих проблем, и данное изобретение направлено на реализацию этой потребности.
Раскрытие изобретения
Изобретение касается способа предупреждения формирования геля гидрофобного пептида. В основном данный способ предусматривает контактирование гидрофобного пептида с противоионом в количестве и в молярном соотношении, достаточных для обеспечения образования жидкой, подобной молоку, микрокристаллической водной суспензии пептида без формирования геля.
Изобретение касается также жидкой, подобной молоку, микрокристаллической водной суспензии гидрофобного пептида и противоиона в воде, где пептид и противоион присутствуют в количестве и в молярном соотношении, достаточных для образования суспензии при перемешивании без формирования геля.
Возможность избежать образования геля позволяет приготовить суспензию, пригодную для инъекционного введения. При парентеральной (т.е. подкожной или внутримышечной) инъекции данных водных суспензий млекопитающему, такому как человек, обеспечивается высвобождение гидрофобного пептида в течение длительного времени.
Предпочтительно, когда противоион представляет собой соль сильной кислоты, такой как трифторуксусная кислота или серная кислота. Кроме того, гидрофобный пептид может быть представлен аналогом GnRH и предпочтительно является антагонистом GnRH. Более предпочтительно, когда антагонисты GnRH выбраны из групп Азалина В, Абареликса, Антида, Ганиреликса, Цетрореликса или FE 200486 в форме их солей сильных кислот, например, трифторацетата или сульфата. Наиболее предпочтительными соединениями являются
Ac-D-Nal-D-Cpa-D-Pal-Ser-Tyr-D-Hci-Leu-llys-Pro-D-Ala-NH2 трифторацетат и
Ac-D-Nal-D-Cpa-D-Pal-Ser-Tyr-D-Hci-Leu-llys-Pro-D-Ala-NH2 сульфат.
Предпочтительным является суспендирование соли гидрофобного пептида в водной среде при концентрации, равной или превышающей 25 мг/мл при молярном соотношении кислоты и пептида по меньшей мере 1,6:1. Соль пептида находится по меньшей мере частично в форме игл с размером частиц между приблизительно 5 и 150 мкм.
Если это желательно, водная суспензия может содержать изотонический агент, такой как маннит. Кроме того, водная суспензия может содержать фармацевтически приемлемый наполнитель. Целесообразно высушивание суспензии до лиофилизированного состояния, из которого ее восстанавливают смешиванием с водой или буферным раствором. Лиофилизированные композиции, содержащие данные высушенные суспензии, а также способы приготовления высушенных суспензий представляют дополнительные варианты осуществления изобретения.
Перечень чертежей и иных материалов
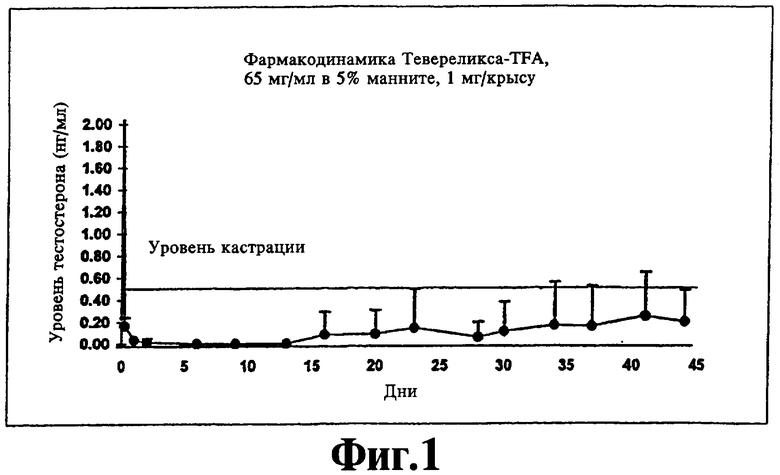
На фиг.1 представлен график, иллюстрирующий фармакодинамический эффект (супрессия тестостерона), полученный при подкожной инъекции крысам суспензии Тевереликса® трифторацетата в соответствии с изобретением.
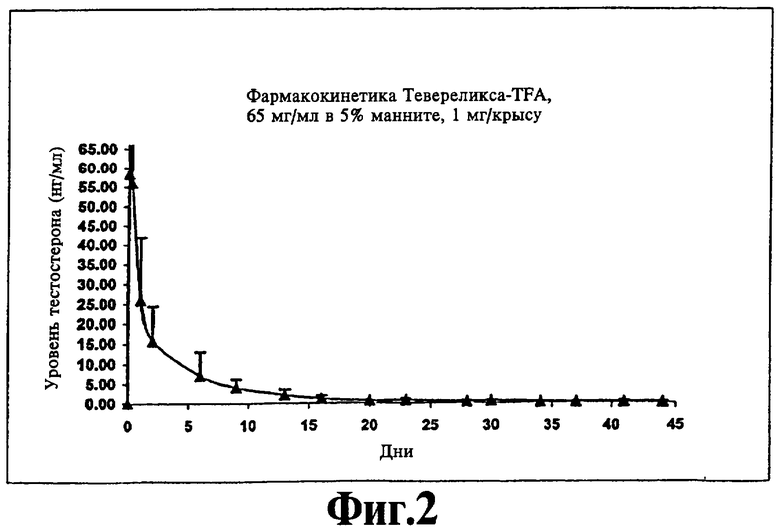
На фиг.2 представлен график, иллюстрирующий замедленное высвобождение Тевереликса® трифторацетата в течение нескольких недель у крыс, которым инъецирована суспензия Тевереликса® трифторацетата в соответствии с изобретением.
Осуществление изобретения
Неожиданно обнаружено, что высококонцентрированная водная суспензия пептида формулы
Ac-D-Nal-D-pCIPhe-D-Pal-Ser-Tyr-D-Hci-Leu-Lys(iPr)-Pro-D-Ala-NH2 (Тевереликс®, антагонист GnRH) в виде трифторацетата (TFA) или сульфата не формирует гель, как можно было бы ожидать, судя по ее гидрофобному характеру, но вместо этого образует микрокристаллическую, подобную молоку, суспензию, которую легко парентерально вводить в виде инъекции животным или человеку и которая высвобождает активный компонент в течение нескольких недель (см. фиг.1 и 2). Такое поведение не показано для других солей, таких как ацетат, которые в результате ожидаемым, но нежелательным образом формируют гели с низкой биодоступностью in vivo.
Данное изобретение представляет простое и изящное решение проблемы подавления образования геля гидрофобными пептидами при получении пролонгированной замедленной доставки таких пептидов в форме микрокристаллических высококонцентрированных суспензий.
Дополнительным преимуществом данного открытия является маленький объем таких суспензий, дающий возможность парентеральных инъекций с использованием тонкой иглы и таким образом улучшающий местную переносимость инъецированного материала. При таких инъекциях количество пептида находится в интервале от приблизительно 1,0 до 5 мг/кг массы тела млекопитающего, которому должна быть введена суспензия.
Предпочтительным является количество противоиона, которое находится в избытке относительно необходимого для образования соли. Данное количество, как правило, составляет по меньшей мере 1,6 моль кислоты/моль пептида и предпочтительно составляет 2 моль/моль или больше. Кроме того, инъекционная суспензия должна быть концентрированной для получения наиболее желательных профилей выхода. Под термином "концентрированная" имеют в виду, что количество пептида должно составлять более 2,5% от общей массы композиции.
Суспензии могут быть высушены путем лиофилизации или распылительной сушки с образованием лиофилизированных композиций, которые могут храниться в полученном виде и могут быть восстановлены водой или буферными растворами при необходимости приготовления композиции для инъекции.
ПРИМЕРЫ
Пример 1
200 мкл 5% маннита добавляют к приблизительно 15 мг антагониста LAHR Тевереликса® трифторацетата. Смесь перемешиваютс использованием устройства для перемешивания в течение одной минуты и получают текучую, подобную молоку, суспензию жемчужного цвета. Суспензия состоит из микрокристаллов длиной приблизительно 10 мкм. Микрокристаллы могут слипаться, образуя ежевидные структуры. Суспензию (1 мг) подкожной инъекцией вводят крысам и получают фармакодинамический эффект супрессии тестостерона в течение более чем 45 дней (см. фиг.1). Фармакокинетический анализ показывает замедленное высвобождение пептида в течение нескольких недель (см. фиг.2).
Пример 2
200 мкл воды добавляют к приблизительно 15 мг антагониста LHRH Тевереликса® трифторацетата. Смесь перемешивают с использованием устройства для перемешивания в течение одной минуты и получают текучую, подобную молоку, суспензию жемчужного цвета.
Пример 3
200 мкл воды добавляют к приблизительно 15 мг антагониста LHRH Тевереликса® ацетата. Смесь перемешивают с использованием устройства для перемешивания в течение одной минуты и получают прозрачный гель. Добавление к гелю 20 мкл TFA (трифторуксусной кислоты) (3 моль/моль) приводит к формированию жидкой, текучей, подобной молоку, суспензии жемчужного цвета.
Пример 4
200 мкл 100 мМ TFA добавляют к приблизительно 15 мг антагониста LHRH Тевереликса® ацетата (2 моль/моль) для получения текучей, подобной молоку, суспензии. Кроме того, перемешивание 200 мкл 75 мМ TFA с приблизительно 15 мг антагониста LHRH Тевереликса® ацетата (1,5 моль/моль) приводит к тому, что после перемешивания образуется прозрачный гель. В другом исследовании 100 мкл TFA в различных концентрациях добавляют к 7,5 мг антагониста LHRH Тевереликса® ацетата при молярном соотношении, лежащем в интервале от 1 до 3. Текучую, подобную молоку, суспензию получают при молярных соотношениях ≥1,6, тогда как гели получают при других молярных соотношениях.
Пример 5
200 мкл 150 мМ TFA добавляют к количествам антагониста LHRH Тевереликса® ацетата, лежащим в интервале от 5 до 30 мг (концентрации лежат в интервале от 25 до 150 мг/мл). Текучую, подобную молоку, суспензию получают при концентрациях до 100 мг/мл.
Пример 6
200 мкл 150 мМ TFA добавляют к приблизительно 15 мг антагониста LHRH Тевереликса® ацетата (3 моль/моль) и после перемешивания получают текучую, подобную молоку, суспензию. Суспензию лиофилизируют в течение ночи. К лиофилизату добавляют 200 мкл воды или 5% маннита и после перемешивания и восстановления получают текучую, подобную молоку, суспензию.
Пример 7
1 мл 150 мМ TFA добавляют к приблизительно 75 мг антагониста LHRH Тевереликса® ацетата (3 моль/моль) и после перемешивания получают текучую, подобную молоку, суспензию. Суспензию лиофилизируют в течение ночи. К лиофилизату добавляют 1 мл воды и 0,2 М ацетатный буфер рН 4,0 и после перемешивания и восстановления получают текучую, подобную молоку, суспензию. Данные суспензии стабильны по меньшей мере в течение 3 дней при комнатной температуре.
Пример 8
100 мкл 250 мМ Н2SO4 добавляют к приблизительно 7,5 мг антагониста LHRH Тевереликса® ацетата (5 моль/моль) и через несколько часов получают текучую, подобную молоку, суспензию. Суспензия состоит из микрокристаллов длины приблизительно 100 мкм. Микрокристаллы собираются вместе с формированием ежеподобных структур. Суспензию лиофилизируют в течение ночи. К лиофилизату добавляют 100 мкл воды или 5% маннита и после перемешивания и восстановления получают текучую, подобную молоку, суспензию.
Изобретение относится к фармацевтической химии и медицине, в частности способу предупреждения формирования геля гидрофобных пептидов, а именно Тевереликса, путем контактирования его с противоионом в количестве и в молярном соотношении, достаточных для получения жидкой, подобной молоку, микрокристаллической водной суспензии пептида без формирования геля. Изобретение касается также жидкой, подобной молоку, микрокристаллической водной суспензии Тевереликса и противоиона в воде, где пептид и противоион присутствуют в количествах и молярном соотношении, достаточных для образования суспензии без формирования геля при перемешивании. Изобретение обеспечивает повышение стабильности пептида. 8 н. и 27 з.п. ф-лы, 2 ил.
| GB 2052258, 28.01.1981 | |||
| WO 9825642, 18.06.1998 | |||
| DE 19813849, 30.09.1999 | |||
| УСТРОЙСТВО ДЛЯ ПЕРЕДАЧИ БРЕВЕН С ТРАНСПОРТИРУЮЩЕЙ ИХ ЛЕСОТАСКИ ПО НАКЛОННОЙ ПЛАТФОРМЕ НА ДРУГУЮ ЛЕСОТАСКУ, РАСПОЛОЖЕННУЮ ПЕРПЕНДИКУЛЯРНО К ПЕРВОЙ | 1935 |
|
SU47234A1 |
Авторы
Даты
2007-11-27—Публикация
2002-08-27—Подача