Предполагаемое изобретение относится к способам получения гетероциклических соединений, конкретно к способу получения 2,3-диалкил-1,10-фенантролинов общей формулы
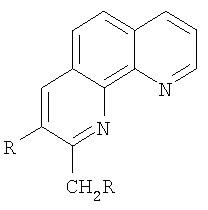
где R=С2Н5, С3Н7, С4Н9,
которые могут найти применение в тонком органическом синтезе или аналитической химии в качестве индикаторов окислительно-востановительных реакций
Известен способ (Ф.А.Селимов, У.М.Джемилев, О.А.Пташко. Металлокомплексный катализ в синтезе пиридиновых оснований. М.: Химия, 2003, с.223-233) получения 2,3-диалкил-1,10-фенантролинов в реакции конденсации 8-аминохинолина с алифатическими альдегидами под действием трехкомпонентной системы PrCl3:PPh3:диметилформамид (ДМФА), при мольном соотношении, равном 1:3:10, и температуре реакции 150-180°С, в автоклаве продолжительностью 6-8 ч. Максимальный выход 2,3-диалкил-1,10-фенантролинов 40-51%.
К недостаткам данного способа относятся большие энергозатраты (высокая температура, давление), необходимость использования специального оборудования (автоклав) и лиганда активатора PPh3, а также высокая себестоимость безводного PrCl3 (малодоступного), что вызывает необходимость его предварительного получения (энергозатратный, трудоемкий синтез, в агрессивной среде).
Известен способ (патент РФ 2249479, опубликовано: 10.04.2005, Бюл. №10) получения 2,3-диалкил-1,10-фенантролинов в реакции конденсации 8-аминохинолина с алифатическими альдегидами под действием катализатора - комплекса [Pr(NO3)5]·[С5Н5NH]2. Реакция осуществляется в автоклаве при температуре 150°С в течение 6 ч в смешанном растворителе, состоящем из этанола и ДМФА, взятых в соотношении 3:1 (объемные). Выход 2,3-диалкил-1,10-фенантролинов 40-54%.
К недостаткам данного способа относятся большие энергозатраты (высокая температура, давление), необходимость использования специального оборудования (автоклав), а также предварительный синтез катализатора (в агрессивной среде - HNO3)
Предлагается новый способ получения 2,3-диалкил-1,10-фенантролинов.
Сущность способа заключается во взаимодействии 8-аминохинолина с алифатическими альдегидами в присутствии катализатора кристаллогидратов: трихлорида тербия TbCl3·6Н2O или нитрата тербия Tb(NO3)3·6Н2О, взятых в мольном соотношении 45:100:1.2. Реакцию проводят при атмосферном давлении, в интервале температур 20-100°С, в течение 5-24 ч, в растворителе ДМФА. Реакция протекает по схеме:

R=С2Н5, С3Н7, С4Н9; K-Ln=TbCl3·6Н2O, Tb(NO3)3·6Н2О
При увеличении температуры раствора сокращается время синтеза, но увеличивается содержание продуктов осмоления.
Существенные отличия предлагаемого способа
1. В предлагаемом способе в качестве катализатора используют коммерческие кристаллогидраты: трихлорид тербия TbCl3·6Н2О или нитрат тербия Tb(NO3)3·6Н2О. Реакцию проводят при атмосферном давлении в интервале температур 20-100°С в течение 5-24 ч в растворителе ДМФА с более высоким выходом целевого продукта. В известных способах используются более дорогие безводные соединения: LnCl3 (малодоступные) или [Sm(NO3)5]·[C5H5NH]2 (не выпускаемый промышленностью) и требующие предварительного специального синтеза.
Предлагаемый способ обладает следующими преимуществами.
1. Способ не требует предварительного получения безводных солей LnCl3 или комплекса [Sm(NO3)5]·[С5Н5NH]2 (трудоемкий, длительный синтез в коррозионно-агрессивной среде).
2. Способ позволяет увеличить выход целевого продукта до 60-65%.
3. Способ позволяет существенно уменьшить температуру от 150 до 20°С, не требует специального оборудования (автоклава) и тем самым позволяет существенно упростить синтез и снизить себестоимость целевого продукта.
Способ поясняется следующими примерами.
ПРИМЕР 1. Конденсацию 8-аминохинолина с капроновым альдегидом проводят в стеклянной колбе (V=20 мл). К навеске катализатора TbCl3·6Н2О (0,54 ммоль) при 20°С добавляют ДМФА (7 мл) и включают перемешивание. После полного растворения TbCl3·6Н2О последовательно загружают 8-аминохинолин (20 ммоль), капроновый альдегид (44 ммоль) и реакцию проводят при 20°С в течение 24 ч при постоянном перемешивании. Затем реакционную массу трижды экстрагируют эфиром (3×50 мл), объединенные экстракты сушат над безводным MgSO4, отгоняют растворитель, а остаток хроматографируют на колонке с AI2О3 (гексан-эфир, 1:10).
Другие примеры, подтверждающие способ, приведены в таблице 1.
Все опыты проводили в ДМФА при мольном соотношении С6Н5NH2:RCH2СНО:TbCl3·6Н2O, равном 45:100:1.2.
Полученные соединения имеют следующие физико-химические характеристики:
2-Пропил-3-этил-1,10-фенантролин. Маслянистая жидкость, Ткип=208-210°С (1 мм рт.ст.). Найдено, %: С, 81.3; N, 10.8; Н, 7.9. C17H18N2. Вычислено, %: С, 81.6; N, 11.2; Н, 7.2. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.08т (3Н, СН3); 1.35т (3Н, СН3); 1.95м (2Н, CH2); 2.91к (2Н, СН2); 3.15т (2Н, СН2); 7.67-9.20м (6Н, аром.). Спектр ЯМР 13С (CDCl3, δ, м.д.): 14.48к (С17); 14.48к (С19); 23.62т (С16); 25.18т (С18); 38.27т (С15); 122.18д (С5); 125.35д (С6); 126.3д (С4); 127.52 с (С11); 128.34с (С13); 134.45д (С8); 135.88д (С7); 143.50 с (С3); 146.13 с (С12); 150.15д (С9); 150.43с (С14); 162.23с (С2).
2-Бутил-3-пропил-1,10-фенантролин маслянистая жидкость. Ткип=214-216°С (1 мм рт.ст.). Найдено, %: С, 81.7; N, 10.2; Н, 8.1. C19H22N2. Вычислено, %: С, 82.0; N, 10.1; Н, 7.9. Спектр ЯМР 1Н (CDCl3, 5, м.д.): 0.96т (3Н, СН3); 1.23т (3Н, СН3); 1.50-2.10м (6Н, СН2); 2.91-3.30м (4Н, СН2); 7.50-9.21м (6Н, аром.). Спектр ЯМР 13С (CDCl3, δ, м.д.): 14.15к (С18); 14.35к (С21); 23.31т (С17); 24.30т (С20); 28.61т (С16); 31.7т (С19); 34.60т (С15); 122.9д (С5); 125.96д (С6); 126.44д (С4); 127.42с (С11); 128.21с (С13); 128.77д (С8); 131.86д (С7); 132.25с (С3); 135.91с (С12); 142.57с (С14); 150.01д (С9); 160.84с (С2).
2-Амил-3-бутил-1,10-фенантролин маслянистая жидкость, Ткип=198-210°С (1 мм рт.ст.). Найдено, %: С, 82.8; N, 9.0; Н, 8.2. C21H26N2. Вычислено, %: С, 82.4; N, 9.1; Н, 8.5. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.93т (3Н, СН3); 0.98т (3Н, СН3); 1.40-1,90 м (10Н, CH2) 2.85т (2Н, СН2); 3.20т (2Н, СН2); 7.50-9.20 м (6Н, аром.). Спектр ЯМР 13С (CDCl3, δ, м.д.): 14.01к (С19); 14.18к (С23); 22.59т (С18); 22.88т (С22); 30.80т (С17); 32.06т (С21); 32.38т (С16); 32.82т (С20); 36.49т (С15); 122.21д (С5); 125.36д (С6); 126.26д (С4); 127.41с (С11); 128.33с (С13); 135.38д (С8); 135.90д (С7); 135.99с (С3); 143.99с (С12); 146.18 с (С14); 150.17д (C9); 162.56c (C2).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-7,8-БЕНЗО-1,6-НАФТИРИДИНОВ | 2006 |
|
RU2313526C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛХИНОЛИНОВ | 2006 |
|
RU2309952C1 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1,10-ФЕНАНТРОЛИНОВ | 2003 |
|
RU2249478C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1,10-ФЕНАНТРОЛИНОВ | 2003 |
|
RU2249479C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛПРОИЗВОДНЫХ ХИНОЛИНА | 2005 |
|
RU2283836C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛПРОИЗВОДНЫХ ХИНОЛИНА | 2005 |
|
RU2283837C1 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-5,6-БЕНЗО-1,7 НАФТИРИДИНОВ | 2003 |
|
RU2249480C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-7,8-БЕНЗО-1,6-НАФТИРИДИНОВ | 2003 |
|
RU2249477C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ЭТИЛ-3,5-ДИМЕТИЛПИРИДИНА | 2007 |
|
RU2333908C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3,5-ТРИАЛКИЛПИРИДИНОВ | 2007 |
|
RU2334739C1 |
Изобретение относится к области органического синтеза, конкретно к способу получения 2,3-диалкил-1,10-фенантролинов. Сущность способа заключается во взаимодействии 8-аминохинолина с алифатическими альдегидами в присутствии катализатора кристаллогидратов: трихлорида тербия TbCl3·6Н2О или нитрата тербия Tb(NO3)3·6Н2O при молярном соотношении 8-аминохиналина:RCH2СНО:Tb, равном 45:100:1.2, при атмосферном давлении, в интервале температур 20-100°С, в течение 5-24 ч, в растворителе ДМФА. Фенантролин и его производные используют в аналитической химии в качестве индикаторов окислительно-востановительных реакций. 1 табл.
Способ получения 2,3-диалкил-1,10-фенантролинов общей формулы

где R=C2H5, С3Н7, С4Н9,
путем взаимодействия 8-аминохинолина с алифатическими альдегидами общей формулы RCH2CHO (где R имеет указанные выше значения) в присутствии катализатора, отличающийся тем, что в качестве катализатора используют кристаллогидраты: трихлорид тербия TbCl3·6Н2О или нитрат тербия TbCl3·6Н2О при мольном соотношении 8-аминохиналина:RCH2СНО:Tb, равном 45:100:1.2 и реакцию проводят при атмосферном давлении, в интервале температур 20-100°С, в течении 5-24 ч в растворителе ДМФА.
| СЕЛИМОВ Ф.А | |||
| и др | |||
| Металлокомплексный катализ в синтезе пиридиновых оснований | |||
| - М.: Химия, 2003, с.223-233 | |||
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1,10-ФЕНАНТРОЛИНОВ | 2003 |
|
RU2249479C2 |
| Ptashko O.A | |||
| et al | |||
| "New complex catalysts based on Tb, Ho and Lu in the synthesis of 1,6- and 1,7-naphthyridines" | |||
| Ufa | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Bashkirskii Khimicheskii Zhumal, 10 (4), p.67-69 | |||
| Dzhemilev U.M | |||
| et al | |||
| "Synthesis of | |||
Авторы
Даты
2007-12-27—Публикация
2006-05-04—Подача