Изобретение относится к области медицины и молекулярной биологии и может быть использовано для этиологической диагностики кишечных вирусных инфекций на основе выявления вирусной РНК в биологических субстратах методом обратной транскрипции/полимеразной цепной реакции (ОТ-ПЦР), а также для изучения обнаруженных геномных последовательностей кишечных вирусов. Актуальным является обнаружение таких РНК-содержащих вирусов, как ротавирусы, энтеровирусы, калицивирусы, астровирусы, вирус гепатита А.
Известны следующие способы выделения вирусной РНК из биологических образцов, основанные на различных методических подходах:
1. Фенол-хлороформная экстракция [Chomczynski P., Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chroroform extraction // Anal. Biochem. - 1987. - v.162. - P.156-159].
2. Экстракция перхлоратом натрия в присутствии додецилсульфата натрия [Халл Р. Очистка, биофизическая и биохимическая характеристика вирусов (преимущественно вирусов растений) // Вирусология. Методы: пер. в англ. - М.: Мир, 1988. - С.35-36].
3. Экстракция в присутствии высоких концентраций хлорида натрия с очисткой РНК с помощью панкреатической ДНК-азы. [Авторское свидетельство SU 1448448 А1 от 24.02.87 «Способ получения двунитевой рибонуклеиновой кислоты ротавирусов» / Новикова Н.А., Епифанова Н.В., Тамойкина Н.А.].
Первый из этих способов пригоден для получения чистых нуклеиновых кислот (ДНК и РНК), но многостадиен, трудоемок и вреден для здоровья при проведении массовых исследований. Второй способ был предложен для выделения нуклеиновых кислот из предварительно очищенных вирионов вирусов растений, на последующее проведение ОТ-ПЦР не рассчитан, поскольку используемый при выделении додецилсульфат натрия является ингибитором реакции обратной транскрипции. Третий способ разработан для выделения РНК ротавирусов с целью последующего анализа методом электрофореза в полиакриламидном геле и не рассчитан на использование конечного продукта в ферментативных реакциях.
Наиболее близким к предлагаемому изобретению является метод выделения РНК, основанный на аффинной сорбции силикагелем [Boom R., Sol С., Salimans М. et al. Rapid and simple method for the purification of nucleic acids. // J. Clin. Microbiol. - 1990. - v.28. - P.495-503]. Этот метод позволяет эффективно выделять РНК из большинства используемых в диагностике инфекционных заболеваний биологических субстратов (сывороток крови, спинномозговой жидкости, носоглоточных смывов, эпителиальных соскобов и т.п.) для последующего анализа с использованием метода ОТ-ПЦР и положен в основу коммерческих тест-систем («РИБО-сорб», ООО «ИнтерЛабСервис», Москва). Однако метод аффинной сорбции недостаточно эффективен при использовании в качестве исследуемого материала фекальных образцов от больных кишечными вирусными инфекциями или образцов сточной воды, т.к. не позволяет избавиться от ингибиторов ферментативных реакций, содержащихся в этих образцах. Для этого требуется введение дополнительных ингредиентов (в частности, сыворотки КРС, α-казеина и т.п.).
Целью изобретения является исключение ингибирования реакции обратной транскрипции и повышение чувствительности метода ОТ-ПЦР при анализе образцов копроматериала и сточной воды.
Сущность изобретения заключается в том, что образец биологического материала, после прогревания в присутствии лизирующего агента, подвергают фракционированию путем центрифугирования в растворе перхлората натрия.
Метод осуществляют следующим образом.
Готовят 10-20%-ную суспензию фекалий в дистиллированной стерильной воде или стерильном физиологическом растворе, пробу осветляют центрифугированием при 3-5 тыс. об/мин в течение 10 мин. Образец сточной воды осветляют при тех же условиях центрифугирования.
К 100 мкл исследуемого образца добавляют равный объем лизирующего буфера, содержащего 4М гуанидинтиоционата, 50 мМ трис-HCl, рН 7,6, 100 мМ ЭДТА, 1% β-меркаптоэтанола. Смесь инкубируют в течение 10 мин при 65°С, охлаждают при 0°С, к суспензии добавляют ×3-кратный объем 100%-ного (вес/объем) раствора перхлората натрия. После встряхивания смесь центрифугируют в течение 5 мин при 3 тыс. об./мин. Водную фазу переносят в чистую микропробирку, содержащую охлажденный изопропанол в объеме вносимой водной фазы, перемешивают и центрифугируют в течение 15-20 мин при 12-16 тыс. об./мин. Осадок РНК отмывают 70%-ным этанолом, высушивают и ресуспендируют в 30-50 мкл 2 мМ раствора дитиотриитола (ДТТ).
Пример 1. Выявление РНК кишечных вирусов.
Выявление РНК кишечных вирусов (ротавирусов, астровирусов, калицивирусов, энтеровирусов, вируса гепатита А) проводят с использованием лабораторных методов ОТ-ПЦР на основе праймеров, специфичных в отношении искомого генома. Применяют пары праймеров, представленные в литературе для обнаружения ротавирусов [Gentsch J.R., Glass R.I., Woods P. et al. Identification of group A rotavirus gene 4 types by polymerase chain reaction // J. Clin. Microbiol. - 1992. - V.30. - P.1365-1373.], астровирусов [Belliot G., Laveran H., Monroe S.S. Detection and genetic differentiation of human astroviruses: phylogenetic grouping varies by coding region // Arch Virol. 1997. V.142. №7. P.1323-1334], калицивирусов [Jiang X., P.W.Huang, W.M.Zhong et al. T. Design and evaluation of a primer pair that detects both Norwalk - and Sapporo-like caliciviruses by RT-PCR // J. of Virological Methods. - 1999. - V.83. - P.145-154], вируса гепатита A [Abbasdegan M., Stewart P., LeChevalier M. A strategy for detection of viruses in ground water by PCR // Applied and Environmental Microbiol. - 1999. - V.65. - N 8, P.444-449]. Олигонуклеотидные праймеры синтезируют в фирме «Литех», Москва. Используют реагенты для разных этапов ПЦР-анализа производства ЦНИИЭ, Москва (ООО «ИнтерЛабСервис).
Реакцию обратной транскрипции осуществляют при 42°С в течение 45 мин в объеме 5 мкл. Предварительно 2,3 мкл выделенной РНК денатурируют в присутствии 2 мМ статистических гексануклеотидов в течение 5 мин при 94°С. Затем в пробирки вносят 1,7 мкл смеси, содержащей буфер для ревертазы М-MLV, 0,2 мМ каждого нуклеозидтрифосфата (дНТФ) и 2 е.а. ревертазы М-MLV. Амплификацию кДНК, полученной в результате ОТ, проводят в объеме 25 мкл в термоциклере с активным регулированием «Терцик» («ДНК-технология», Россия). Для этого к 5 мкл продукта ОТ добавляют реакционную смесь, содержащую 10 мМ Трис-HCl, рН 8,3, 50 мМ КСl, 1,5 мМ MgCl2, 0,2 мМ каждого дНТФ, 2 е.а. Taq-полимеразы, 2 мкМ соответствующих праймеров.
Реакцию на каждый вирус проводят в отдельной пробирке со своей парой праймеров. Для постановки ПНР используют следующую программу: [95°С - 1 мин; (94°С - 10 сек, 55°С - 10 сек, 72°С - 10 сек) - 42 цикла; 72°С - 5 мин]. Результатом амплификации является фрагмент кДНК, специфический для каждого искомого вирусного агента.
Идентификацию продуктов амплификации проводят методом электрофореза в 1,5% агарозном геле в присутствии бромида этидия с использованием 0,089 М трис-боратного буферного раствора, рН 8,0, при 110 V на гель в течение 20 минут.
Пример 2. Сравнение предлагаемого метода солевой очистки РНК с классическим методом фенол-хлороформной депротеинизации нуклеиновых кислот.
Для сравнительного анализа аналитической чувствительности методов использовали фекальные экстракты. Три образца фекалий контаминировали культуральной жидкостью, содержащей 1,0, 0,1 и 0,01 TCID50 полиовируса вакцинного происхождения (в расчете на 1 реакцию ОТ-ПЦР). Из проб параллельно была выделена РЫК с использованием фенол-хлороформной смеси и солевым способом, затем проанализированы в ОТ-ПЦР с использованием универсальных для энтеровирусов праймеров. В таблице 1 видно, что аналитическая чувствительность солевого метода выделения РНК соответствует фенол/хлороформной депротеинизации. Оба метода позволяют обнаружить 0,1 TCID50 энтеровирусов. На следующем этапе проведено сравнение методов при обследовании 78 пациентов с подозрением на энтеровирусную инфекцию. Из таблицы 2 видно, что частота обнаружения энтеровирусов методом ОТ-ПЦР при тестировании одних и тех же биопроб не отличалась достоверно в зависимости от способа экстракции РНК.
Таким образом, представленные результаты свидетельствуют, что предлагаемый способ выделения РНК кишечных вирусов по своей аналитической и относительной чувствительности не уступает классическому референтному способу фенол-хлороформной депротеинизации нуклеиновых кислот.
Пример 3. Сравнение солевого метода выделения РЫК и метода «РИБО-сорб» (OOO «ИнтерЛабСервис»).
Сравнение было проведено с использованием образцов фекалий, заведомо содержащих ротавирусы, астровирусы и энтеровирусы.
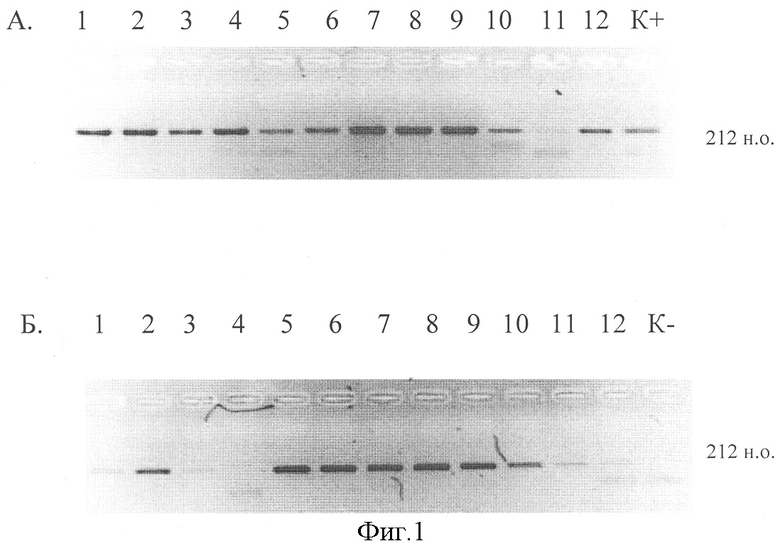
На фиг.1 представлены результаты проведения ОТ-ПЦР после выделения РНК ротавирусов с использованием двух методов. Как видно на электрофореграмме, солевая экстракция позволяет выявить ротавирусную РНК во всех 12 пробах (100%). В случае использования системы «РИБО-сорб» в пробах №1, 3, 12 наблюдалась менее эффективная амплификация, а в пробе №4 - ингибирование реакции. Полученные результаты свидетельствуют о большей эффективности солевого метода выделения РНК кишечных вирусов из фекалий.
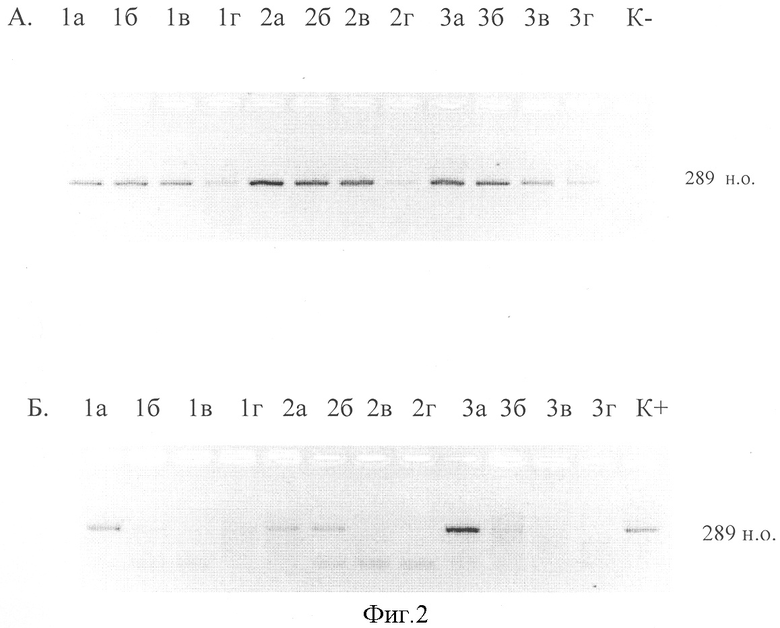
Проведено исследование проб при серии десятикратных разведений исходного материала (1:10, 1:100, 1:1000) на примере астровирусов. Как видно на фиг.2, при солевой экстракции интенсивность сигнала амплификации незначительно снижается только при разведении исходной пробы 1:1000, аффинная сорбция уже при разведении 1:10 не позволяет уверенно выявить РНК астровируса.
Представленные результаты убедительно свидетельствуют о большей чувствительности солевого метода выделения РНК кишечных вирусов.
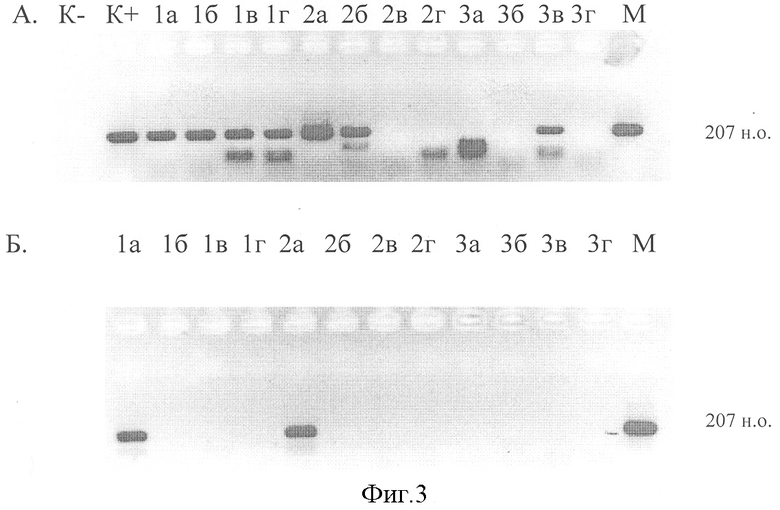
Сравнительный анализ солевого и сорбционного методов выделения РНК с использованием титрования образцов проведен и при индикации РНК энтеровирусов (фиг.3). Для выявления РНК энтеровирусов использовали набор реагентов «АмплиСенс Энтеровирус-207» (000 «ИнтерЛабСервис», Москва). На фиг.3 видно, что солевой метод выделения РНК позволяет обнаружить РНК энтеровирусов не только в исходных пробах, но и при разведениях 1:1000 (проба 1) и 1:10 (проба 2), при аффинной сорбции - только в исходной пробе. В пробе №3, содержащей ингибиторы для обратной транскрипции, солевой метод выделения РНК позволил обнаружить энтеровирусы при разведении пробы в 100 раз. Метод аффинной сорбции дажепри таком разведении пробы сорбировал ингибиторы ферментативных реакций.
Таким образом, использование предлагаемого солевого способа выделения РНК кишечных вирусов для их индикации методом ОТ-ПЦР обеспечивает следующие преимущества:
- по сравнению с аналогом (1) исключает использование технического вещества (фенола) за счет очистки целевого продукта путем фракционирования в присутствии перхлората натрия;
- в отличие от аналога (2) предлагаемый способ применен для выделения РНК вирусов человека из образцов клинического материала от больных;
- в отличие от аналога (3) конечный продукт не содержит компонентов, способных препятствовать реакции обратной транскрипции (додецилсульфат натрия, ДНК-аза).
По сравнению с прототипом солевой метод выделения РНК позволяет избавиться от ингибиторов ферментативных реакций и повысить выход конечного продукта, что подтверждается успешным выявлением вирусной РНК при многократном разведении исследуемых проб.
Краткое описание чертежей
Фиг.1. Обнаружение ротавирусов в фекальных образцах методом ОТ-ПЦР после выделения РНК с использованием солевой экстракции (А) и набора реагентов «РИБО-сорб» (Б).
К+ - положительный контроль;
К- - отрицательный контроль;
212 н.о. - размер фрагмента кДНК.
Фиг.2. Обнаружение астровирусов в образцах фекалий методом ОТ-ПЦР после выделения РНК с использованием солевой экстракции (А) и набора реагентов «РИБО-сорб» (Б) при титровании образцов.
1а, 2а, 3а - исходные образцы; б - 1:10; в - 1:100; г - 1:1000;
К+ - положительный контроль;
К- - отрицательный контроль;
289 н.о. - размер фрагмента кДНК.
Фиг.3.Обнаружение энтеровирусов в образцах фекалий методом ОТ-ПЦР после выделения РНК с использованием солевой экстракции (А) и набора реагентов «РИБО-сорб» (Б) при титровании образцов.
1а, 2а, 3а - исходные образцы; б - 1:10; в - 1:100; г - 1:1000;
К+ - положительный контроль;
К- - отрицательный контроль;
М - Маркер;
207 н.о. - размер фрагмента ДНК.
| название | год | авторы | номер документа |
|---|---|---|---|
| Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченых ДНК-зондов для идентификации РНК энтеровирусов, ротовирусов, вирусов гепатита А и Е, аденовирусов, норовирусов и астровирусов из водной среды методом мультиплексной ПЦР | 2015 |
|
RU2610434C1 |
| СПОСОБ ВЫЯВЛЕНИЯ КИШЕЧНЫХ ВИРУСОВ В КЛИНИЧЕСКИХ ОБРАЗЦАХ И ВОДЕ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПЦР С ДЕТЕКЦИЕЙ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ И ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2506317C2 |
| НАБОР ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕННОГО ЗОНДА ДЛЯ ИДЕНТИФИКАЦИИ РНК ЭНТЕРОВИРУСОВ МЕТОДОМ ОБРАТНОЙ ТРАНСКРИПЦИИ - ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С ГИБРИДИЗАЦИОННО-ФЛУОРЕСЦЕНТНОЙ ДЕТЕКЦИЕЙ | 2011 |
|
RU2459830C1 |
| НАБОР ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕНЫХ ДНК-ЗОНДОВ ДЛЯ ИДЕНТИФИКАЦИИ РНК ЭНТЕРОВИРУСОВ, РИНОВИРУСОВ, ВИРУСОВ ГЕПАТИТА А И Е ИЗ ВОДНОЙ СРЕДЫ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПЦР | 2013 |
|
RU2542968C2 |
| Способ выявления генома возбудителя ротовирусной инфекции у сельскохозяйственных животных | 2018 |
|
RU2689718C1 |
| СПОСОБ ВЫЯВЛЕНИЯ РНК ВИРУСА ЛУЙО МЕТОДОМ ОБРАТНОЙ ТРАНСКРИПЦИИ И ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С УЧЕТОМ РЕЗУЛЬТАТОВ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ | 2020 |
|
RU2744665C1 |
| Способ генотипирования энтеровирусов методом секвенирования 1A-1B участка генома | 2019 |
|
RU2701145C1 |
| Способ амплификации области VP1 генома энтеровирусов вида Enterovirus B | 2021 |
|
RU2774424C1 |
| Способ выявления РНК вируса Хунин методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822164C1 |
| Тест-система для обнаружения генома возбудителя ротовируса типа А у сельскохозяйственных животных с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2694501C1 |
Изобретение относится к области медицины и молекулярной биологии и может быть использовано для этиологической диагностики кишечных вирусных инфекций на основе выявления вирусной РНК в биологических субстратах способом обратной полимеразной цепной реакции (ОТ-ПЦР), а также для изучения обнаруженных геномных последовательностей кишечных вирусов. Сущность способа: вирионы разрушают путем прогревания в лизирующем буфере, лизат фракционируют путем центрифугирования в присутствии перхлората натрия, РНК осаждают охлажденным изопропиловым спиртом. Преимущество изобретения заключается в исключении ингибирования реакции обратной транскрипции и повышении чувствительности метода ОТ-ПЦР при анализе образцов копроматериала и сточной воды. 3 ил., 2 табл.
Способ выделения РНК кишечных вирусов для анализа с использованием обратной транскрипции/полимеразной цепной реакции, включающий разрушение вирионов путем прогревания в лизирующем буфере, фракционирование лизата и осаждение целевого продукта, отличающийся тем, что фракционирование лизата проводят путем центрифугирования в присутствии перхлората натрия, РНК осаждают охлажденным изопропиловым спиртом.
| BOOM R | |||
| et al., Rapid and simple methods of nucleic acids., J | |||
| Clin | |||
| Microbiol, 1990, v.28, №3, pp.495-503 | |||
| ВИРУСОЛОГИЯ | |||
| Методы, под ред | |||
| Мейхи Б., 1988, М., Мир, стр.33-36 | |||
| ТРАНСКРИПЦИЯ И ТРАНСЛЯЦИЯ | |||
| Методы, под ред | |||
| Хеймса Б | |||
| и Хиггинса С., 1987, М., Мир, стр.254-275 | |||
| КЛОНИРОВАНИЕ ДНК | |||
| Методы, под ред | |||
| Гловера Д., 1988, М., Мир, стр.358, 367-371 | |||
| МАНИАТИС Т | |||
| и др | |||
| Молекулярное клонирование, М., Мир, 1984, стр.186-195. |
Авторы
Даты
2007-12-27—Публикация
2006-04-10—Подача