Изобретение относится к области медицины, в частности к лабораторной диагностике, конкретно к способу определения РНК вируса Луйо (сем. Arenaviridae) методом обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) в режиме реального времени в материале от людей, животных и из объектов окружающей среды, и может быть использовано в научно-исследовательских и медицинских учреждениях, службах Роспотребнадзора.
В августе-сентябре 2008 г. на территории Южной Африки были выявлены случаи геморрагической лихорадки, которая сопровождалась повышением температуры, головной болью, рвотой, диареей, артралгией и кровоизлияниями. Летальность составила 80%, основным путем передачи возбудителя (кроме первичного, где источник заражения так и не был установлен) являлся контактный. В последующем было доказано, что этиологическим агентом данного заболевания является ранее неизвестный вирус, обозначенный как Луйо (Lujo mammarenavirus (LUJV)) и относящийся к семейству Arenaviridae [1, 2]. Было сделано предположение, что естественным резервуаром возбудителя в природе являются грызуны неустановленных видов, которые выделяют вирус с мочой [3].
В связи с увеличением числа наших соотечественников, посещающих страны Африки с рабочими или туристическими целями, большим количеством иностранных студентов, обучающихся в высших учебных заведениях России, не исключен завоз возбудителя геморрагической лихорадки Луйо (ГЛЛ) на территорию нашей страны, что показывает необходимость разработки методов диагностики данной инфекции.
В основе лабораторной диагностики лихорадки, вызванной вирусом Луйо, лежат молекулярно-генетические методы исследований, которые характеризуются высокой чувствительностью и специфичностью. Так, Atkinson В. с соавторами [4] были разработаны праймеры (размер 100 п.н.) и зонды, позволяющие выявлять РНК вируса Луйо в различных видах материала методом ОТ-ПЦР в режиме реального времени. Было показано, что чувствительность составила 105 копий/мл, а специфичность - 100%. Однако данный способ выявления РНК вируса Луйо не позволяет осуществлять проведение лабораторного анализа в условиях лаборатории, т.к. отсутствует комплект реагентов и контрольная панель для проведения анализа и учета качества реакции.
Известен способ выявления РНК вируса Луйо с использованием полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией [5]. Однако в данной методике отсутствуют положительные контрольные образцы (К+) и внутренний контрольный образец (ВКО), которые позволяли оценивать качество проводимых исследований.
Проведенный заявителем анализ данных по разработке препаратов для выявления РНК вируса Луйо, включающий поиск по патентам и научно-техническим источникам информации, не выявил сведения о других способах, методах и диагностических препаратах, позволяющих проводить индикацию и идентификацию возбудителя ГЛЛ.
Задачей изобретения является разработка способа выявления РНК вируса Луйо методом обратной транскрипции и полимеразной цепной реакции с учетом результатов в режиме реального времени.
Технический результат заявляемого изобретения заключается в обеспечении быстрой и надежной детекции РНК вируса Луйо в пробах клинического и биологического материала.
Технический результат достигается способом выявления РНК вируса Луйо методом обратной транскрипции и полимеразной цепной реакции с учетом результатов в режиме реального времени, позволяющий с высокой точностью и за короткий срок (5-6 часов) получить результат, а также характеризуется высокой чувствительностью, специфичностью и наличием контролей на всех этапах проведения исследований (ВКО, К+, ПКО).
Для выполнения задачи заявляемого изобретения провели анализ известных генетических последовательностей вируса Луйо, представленных в международной базе данных GenBank (https://www.ncbi.nlm.nih.gov/genbarik/). На первом этапе работы были подобраны и определены консервативные участки генома. В качестве мишени для детекции были выбраны два консервативных фрагмента гена полимеразы. Осуществлен дизайн олигонуклеотидных праймеров и флуоресцентных зондов, протяженность детектируемых фрагментов составила 108 и 133 пары оснований соответственно. Последовательности олигонуклеотидов и зондов, использующихся для проведения исследований:
SEQ ID NO: 1

SEQ ID NO: 2

Экспериментально установлен оптимальный состав реакционной смеси для проведения ПЦР, подобрано сочетание праймеров и зондов, необходимое и достаточное соотношение компонентов реакционной смеси, режим постановки ОТ-ПЦР, а также разработаны контрольные образцы К+, ВКО, ПКО.
Для контроля качества прохождения этапов выделения РНК, обратной транскрипции и ПЦР были разработаны: внутренний контрольный образец (ВКО), ПКО и рекомбинантные положительные контрольные образцы (К+). Ввиду отсутствия генетического материала вируса Луйо, матрицу для создания К+ готовили синтетическим методом на основе ампликона, включающего в себя первую диагностическую область-мишень и фланкирующие последовательности нуклеотидов. Ампликон получали методом «степ-аут» ПЦР. Конечный ПЦР-продукт лигировали в плазмидный вектор pGEM-T («Promega», США) под контролем промотора Т7 РНК полимеразы и трансформировали им Escherichia coli (штамм XL 1-Blue). Рекомбинантные плазмиды из индивидуальных клонов проверяли на правильность ориентации целевой последовательности и отсутствие мутаций в области посадки праймеров и зонда. Проверку осуществляли методом Сэнгера с помощью прибора для автоматического капиллярного секвенирования ABI PRISM 3500x1 («Applied Biosystems», США). Соответствующие заданным критериям рекомбинантные плазмиды применяли для приготовления положительного контрольного образца этапа ПЦР (К+). Для этого определяли концентрацию ДНК в растворе рекомбинантной плазмиды и разводили ДНК - буфером до рабочей концентрации 1×106 - 1×107 копий/мл.
Рекомбинантные плазмиды применялись для создания рекомбинантного РНК-содержащего положительного контрольного образца с защитной белковой оболочкой MS2-фага (ПКО). Для полученного продукта также производили определение концентрации, затем разводили РНК-буфером (ООО «Интерлабсервис», Россия) до рабочей концентрации 1×106 - 5×107 копий/мл, которую использовали в качестве препарата ПКО.
Оценку аналитической чувствительности разработанной методики производили на разведениях РНК-содержащего рекомбинантного положительного контрольного образца (ПКО), из которых экстрагировали РНК с помощью набора для выделения нуклеиновых кислот «Рибо-Преп» (ООО «Интерлабсервис», Россия), а затем с помощью специфических праймеров и зондов определяли минимальное разведение, детектируемое как положительное в 100% случаев. Определенная таким образом аналитическая чувствительность методики составила 5×103 ГЭ/мл.
Специфичность метода оценивали с помощью панели РНК из 23 видов вирусов, принадлежащих к 10 различным семействам, а также 30 образцов клинического материала (плазма крови) от клинически здоровых людей. В результате исследования перекрестных реакций не зафиксировано.
Способ выявления РНК вируса Луйо методом обратной транскрипции и полимеразной цепной реакции с учетом результатов в режиме реального времени включает следующие этапы:
1) Подготовка проб и выделение РНК;
2) Проведение ОТ-ПЦР;
3) Анализ результатов.
Подготовку и обеззараживание проб проводят согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности». Материалом для исследования могут служить: клинические и биологические образцы, а также пробы из объектов окружающей среды. К общему количеству исследуемых проб добавляют отрицательный контрольный образец (ОКО), ПКО. Во все пробирки добавляют ВКО. Выделение РНК осуществляют с помощью коммерческих наборов «Рибо-преп» или «Рибо-Сорб» (ООО «Интерлабсервис», Россия) в соответствии с инструкциями к препаратам.
После этапа выделения РНК приступают к сборке реакционных смесей. Для этого отбирают необходимое количество микропробирок, соответствующее числу исследуемых проб, а также по одной пробирке для положительного и отрицательного контроля. Для упрощения и стандартизации подготовки реактивов перед началом постановки ПЦР готовят две реакционные смеси.
Первая реакционная смесь в расчете на каждую реакцию включает:
- диагностические праймеры и праймеры на ВКО в концентрации 0,5 пмоль/мкл;
- флуоресцентные зонды в концентрации 0,3 пмоль/мкл;
- смесь дезоксинуклеозидтрифосфатов (дНТФ): дАТФ, дТТФ, дГТФ, дЦТФ в концентрации 0,44 мМ;
- стерильную воду до объема 10 мкл.
Первая реакционная смесь может быть приготовлена заранее и подлежит хранению при температуре не выше минус 18°С.
Вторая реакционная смесь в расчете на одну реакцию содержит:
- 5х реакционный буфер для ферментов с MgCl2 в концентрации 15 мМ - 5 мкл;
- обратная транскриптаза - 0,25 мкл;
- дитиотрейтол в концентрации 1 мМ - 0,25 мкл;
- полимераза TaqF - 0,5 мкл.
Вторая реакционная смесь готовится непосредственно перед постановкой реакции и хранению не подлежит.
Для постановки ОТ-ПЦР отбирают необходимое количество микропробирок объемом 0,2 мл, соответствующее числу исследуемых проб, а также по две пробирки для положительных и отрицательных контролей. Далее по числу исследуемых проб смешивают реакционные смеси: 10 мкл первой и 5 мкл второй на каждую реакцию. По 15 мкл полученной смеси вносят в подготовленные пробирки, затем добавляют 10 мкл РНК-пробы, экстрагированной из исследуемого материала.
Готовят 4 контрольные реакции. Для этого в пробирку для положительного контроля ПЦР вносят 10 мкл К+, в пробирку для положительного контроля обратной транскрипции - 10 мкл образца, экстрагированного из ПКО, в пробирку для отрицательного контроля ПЦР - 10 мкл стерильной воды, в пробирку для отрицательного контроля экстракции - 10 мкл пробы, экстрагированной из ОКО. Конечный объем реакционной смеси составляет 25 мкл. Микропробирки переносят в прибор для проведения ОТ-ПЦР роторного типа и проводят амплификацию при следующих температурных режимах:
1. обратная транскрипция при температуре 50°С - 15 мин (1 цикл);
2. прогревание при температуре 95°С - 5 мин (1 цикл);
3. полимеразная цепная реакция (42 цикла): 95°С - 10 с, 60°С - 20 с.
Детекцию флуоресцентного сигнала производят при 60°С по каналам для флуорофоров Green (FAM) и Yellow (JOE).
3) Учет результатов
Учет и анализ результатов проводят с помощью программного обеспечения прибора на основании отсутствия или наличия сигнала флуоресценции в исследуемых пробах по детектируемым каналам. Интерпретацию результатов реакции проводят в соответствии с таблицей 1.
В случае несоответствия полученных результатов данным таблицы реакцию необходимо переставить, начиная с этапа экстракции РНК.
Заявляемое изобретение иллюстрируется следующими примерами.
Пример 1. Выявление РНК вируса Луйо в крови людей.
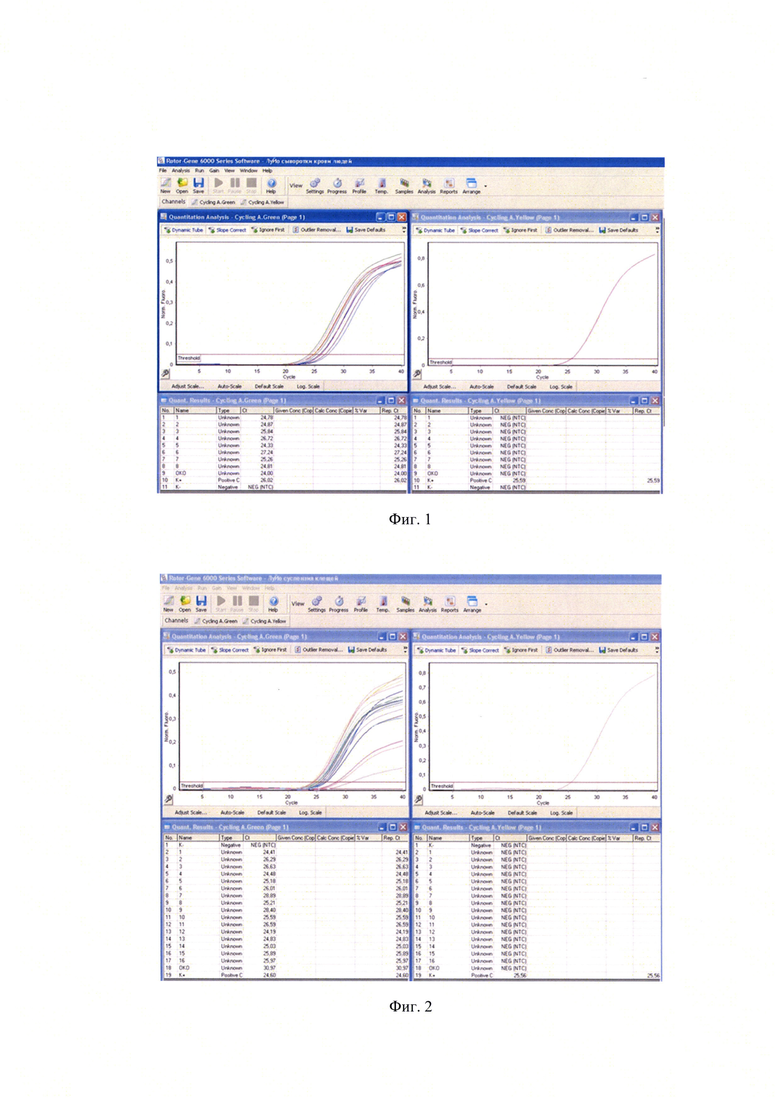
Для выявления РНК вируса Луйо было исследовано 265 образцов сывороток крови жителей Гвинеи, наблюдающихся в медицинских организациях по поводу лихорадки неясной этиологии. Пробы забирали по общепринятой методике в количестве 5 мл. РНК выделяли из 100 мкл образца, который добавляли в лизирующий буфер на основе 6 М гуанидинизотиоцианата в объеме, указанном в инструкции к набору для выделения РНК, и инкубировали 15 минут при температуре (65±1)°С. Во все пробирки, включая контроль выделения, добавляли 10 мкл внутреннего контрольного образца (ВКО), прогревали еще 5 минут при температуре (65±1)°С. Выделение РНК осуществляли с помощью наборов «Рибо-преп» или «Рибо-Сорб» (ООО «Интерлабсервис», Россия) в соответствии с инструкциями к препаратам. В результате проведенных исследований во всех случаях были получены отрицательные результаты. На фиг 1 показаны результаты исследования сывороток крови людей, собранных на территории Гвинейской Республики.
Пример 2. Выявление РНК вируса Луйо из суспензий клещей
Эктопаразитов определяли до вида, объединяли в пробы в соответствии с местом сбора, полом, стадией развития и степенью упитанности. Всего было исследовано 83 пула клещей 3 видов. Пробоподготовку проводили в соответствии с МУ 1.3.2569-09. Затем из 100 мкл полученных образцов выделяли РНК, проводили ОТ-ПЦР как указано в примере 1. Результаты учитывали в режиме реального времени по интенсивности накопления флуоресцентного сигнала на приборе роторного типа. Положительных проб выявлено не было. Пример проведения исследований отражен на фиг 2.
Пример 3. Выявление РНК вируса Луйо из органов мелких млекопитающих (легкие + почки, печень + селезенка, головной мозг), отловленных на территории Гвинейской Республики.
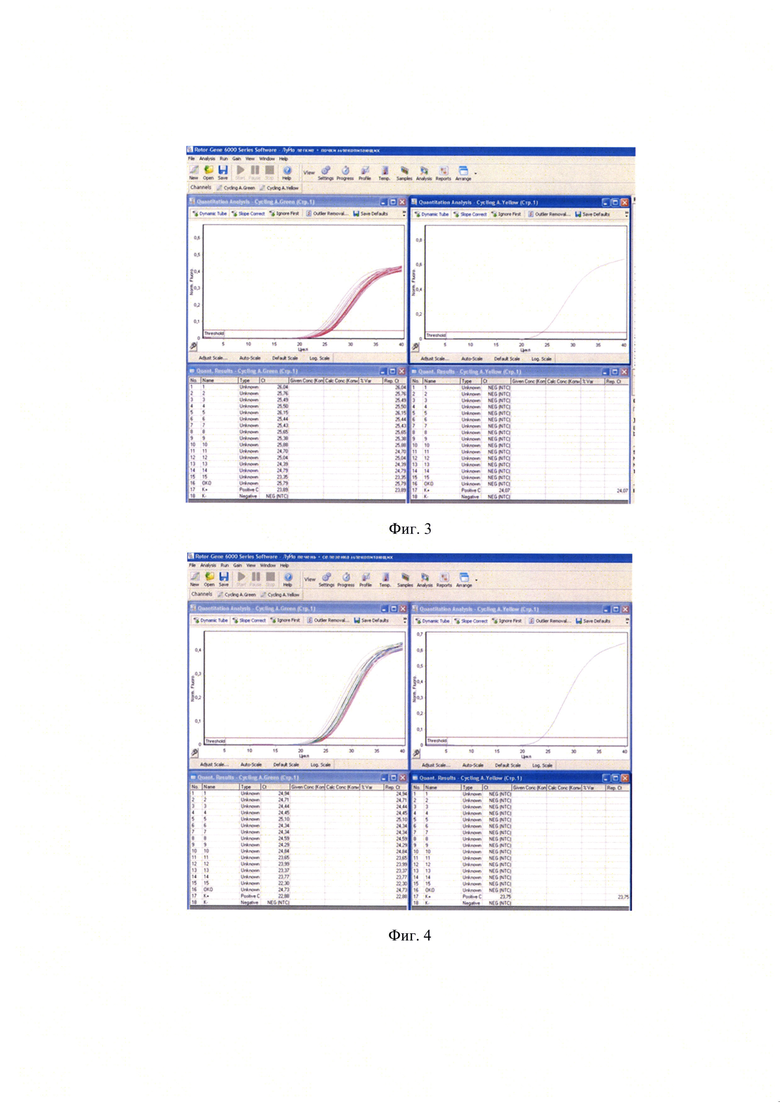
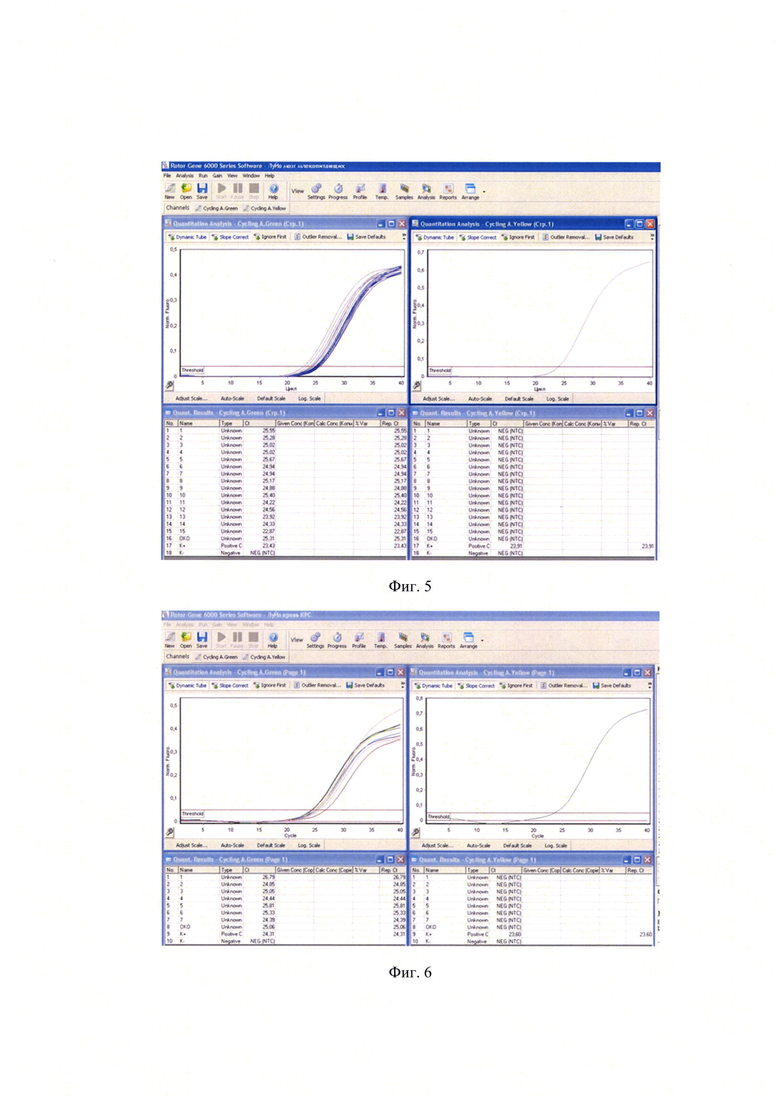
Пробоподготовку проводили в соответствии с МУ 1.3.2569-09. Затем из 100 мкл образца выделяли РНК и проводили ПЦР в режиме реального времени с этапом обратной транскрипции, как описано в примере 1. Учет результатов проводили гибридизационно-флуоресцентным методом. Положительных образцов выявлено не было. На фиг. 3 приведены результаты исследования суспензий органов мелких млекопитающих (легкие + почки), на фиг. 4 - результаты исследования суспензий органов мелких млекопитающих (печень + селезенка), на фиг. 5 - результаты исследования суспензий органов мелких млекопитающих (головной мозг).
Пример 4. Выявление РНК вируса Луйо в сывороток крови крупного рогатого скота.
Были исследованы сыворотки крови крупного рогатого скота, собранные на территории Гвинейской Республики. Всего исследовано ПО образцов. Пробоподготовку проводили в соответствии с МУ 1.3.2569-09. Выделение РНК проводили из 100 мкл образца с последующей постановкой ПЦР в режиме реального времени с этапом обратной транскрипции и гибридизационно-флуоресцентным учетом результатов, таким же образом, как в примере 1. Положительных образцов обнаружено не было. Результаты исследования представлены на фиг. 6.
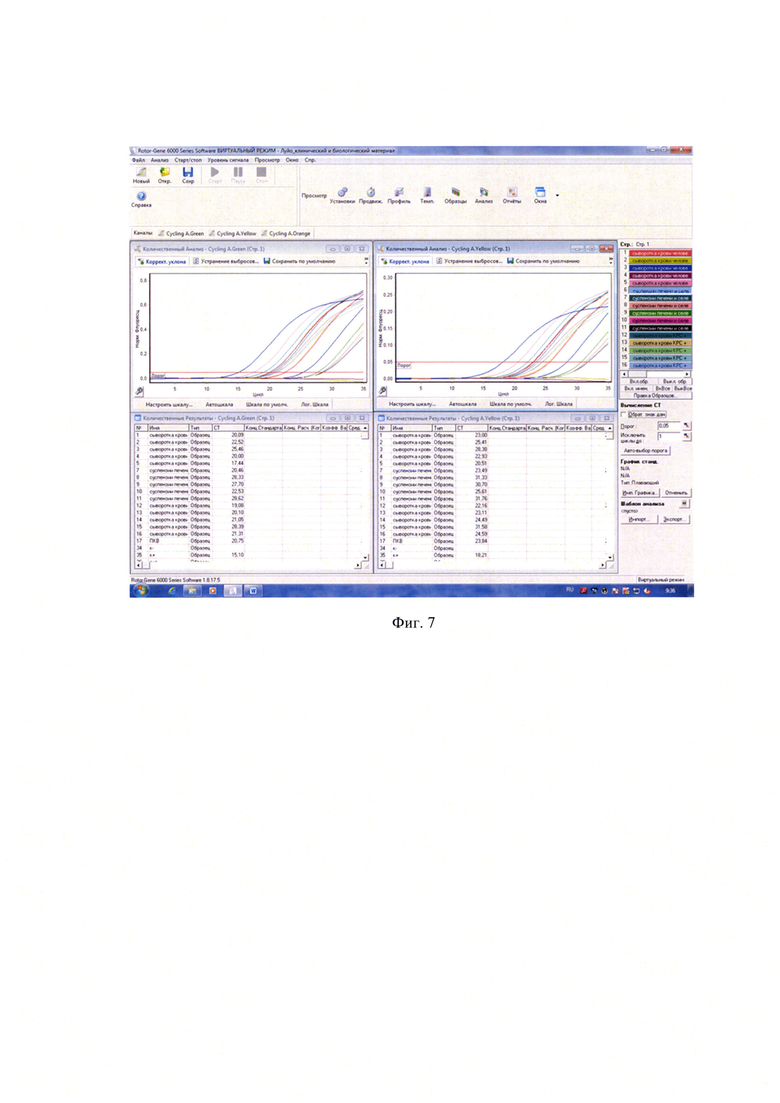
Пример 5. Исследование различных биологических образцов, искусственно контаминированных РНК-содержащим рекомбинантным положительным контрольным образцом (ПКО)
В качестве исследуемого материала были использованы 5 образцов сывороток крови здоровых людей, 5 сывороток крови КРС, 5 образцов суспензий органов (печень + селезенка) от мелких млекопитающих (лабораторные мыши), для чего в 100 мкл пробы добавляли 10 мкл ПКО в концентрации 5×103 ГЭ/мл. Этап выделения РНК и постановку ПЦР в режиме реального времени с этапом обратной транскрипции и гибридизационно-флуоресцентным учетом результатов проводили так же, как и в примере 1. Во всех случаях результат был положительным. Результаты исследования представлены на фиг. 7.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. Paweska J.T., Sewlall N.H., Ksiazek T.G., Blumberg L.H., Hale M.J., Lipkin W.I., Weyer J., Nichol S.T., Rollin P.E., McMullan L.K., Paddock C.D., Briese Т., Mnyaluza J., Dinh Т.Н., Mukonka V., Ching P., Duse A., Richards G., de Jong G., Cohen C., Ikalafeng В., Mugero C., Asomugha C., Malotle M.M., Nteo D.M., Misiani E., Swanepoel R., Zaki S.R. Nosocomial outbreak of novel arenavirus infection, southern Africa. Emerging Infectious Diseases, Vol. 15, No. 10, October 2009, doi: 10.3201/eidl510.090211.
2. Briese T, Paweska JT, McMullan LK, Hutchison SK, Street C, Palacios G, Khristova ML, Weyer J, Swanepoel R, Egholm M, Nichol ST, Lipkin WI. Genetic detection and characterization of Lujo virus, a new hemorrhagic fever-associated arenavirus from southern Africa. PLoS Pathog. 2009 May; 5 (5):e1000455. doi: 10.1371/journal.ppat.l000455. Epub 2009 May 29.
3. Ishii A, Thomas Y, Moonga L, Nakamura I, Ohnuma A, Hang'ombe BM, Takada A, Mweene AS, Sawa H. Molecular surveillance and phylogenetic analysis of Old World arenaviruses in Zambia. J Gen Virol. 2012 Oct; 93 (Pt 10):2247-51. doi: 10.1099/vir.0.044099-0. Epub 2012 Jul 18.
4. Atkinson B, Chamberlain J, Dowall SD, Cook N, Bruce C, Hewson R. Rapid molecular detection of Lujo virus RNA. J Virol Methods. 2014 Jan; 195:170-3. doi: 10.1016/j.jviromet.2013.09.006. Epub 2013 Oct 4.
5. Найденова E.B., Дедков В.Г., Сафонова M.B., Сеничкина A.M., Агафонов Д.А., Захаров К.С., Щербакова С.А., Кутырев В.В. Разработка методики выявления РНК вируса Луйо с использованием полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией // Сборник трудов Международной научно-практической конференции «Молекулярная диагностика-2018», г. Минск, стр. 453-454.


| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления вируса кори методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822430C1 |
| Способ выявления вируса клещевого энцефалита методом ОТ-ПЦР в реальном времени | 2019 |
|
RU2744187C1 |
| Способ выявления вируса Nipah методом ОТ-ПЦР в реальном времени | 2022 |
|
RU2816270C2 |
| Способ выявления РНК вируса Хендра вида Hendra henipavirus методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822161C1 |
| Способ выявления РНК вируса Bandavirus dabieense (SFTSV) методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2831410C1 |
| Способ выявления РНК вируса Mammarenavirus guanaritoense методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2839982C1 |
| Способ выявления РНК модифицированного вакцинного полиовируса типа 2 (nOPV2) методом ОТ-ПЦР в реальном времени | 2022 |
|
RU2795703C1 |
| Способ выявления РНК вируса Хунин методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822164C1 |
| Способ выявления РНК вируса геморрагической лихорадки Крым-Конго методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2834908C1 |
| Набор для выявления вируса SARS-CoV методом ОТ-ПЦР в реальном времени | 2020 |
|
RU2744198C1 |
Изобретение относится к области медицины, в частности к медицинской диагностике, конкретно к способу определения РНК вируса Луйо (сем. Arenaviridae) методом обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) в режиме реального времени в материале от людей, животных и из объектов окружающей среды, и может быть использовано в научно-исследовательских и медицинских учреждениях, службах Роспотребнадзора. Задачей изобретения является разработка способа выявления РНК вируса Луйо, который предполагает проведение обратной транскрипции и ПЦР с учетом результатов в режиме реального времени с использованием соответствующих праймеров и зондов с последующей детекцией по наличию и отсутствию пересечения кривой флуоресценции на каждом из используемых каналов с установленной на соответствующем уровне пороговой линией. Накопление флуоресцентного сигнала по каналу JOE в исследуемых пробах свидетельствует о наличии РНК вируса Луйо, при этом результат считается валидным, если параллельно в этих же образцах по каналу FAM регистрируется накопление флуоресцентного сигнала ВКО. 5 пр., 1 табл., 7 ил.
Способ выявления РНК вируса Луйо методом полимеразной цепной реакции с обратной транскрипцией с гибридизационно-флуоресцентным учетом результатов, предусматривающий проведение обратной транскрипции и ПЦР с использованием праймеров и зондов с набором SEQ ID NO: 1

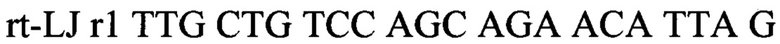
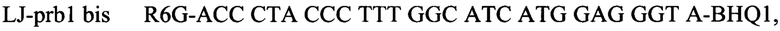
предназначенным для детекции внутреннего контрольного образца (ВКО), и набором SEQ ID NO: 2
предназначенным для выявления специфических фрагментов РНК вируса Луйо с последующей оценкой результатов по наличию и отсутствию пересечения кривой флуоресценции на каждом из используемых каналов с установленной на соответствующем уровне пороговой линией: накопление флуоресцентного сигнала по каналу JOE в исследуемых пробах свидетельствует о наличии РНК вируса Луйо, при этом результат считается валидным, если параллельно в этих же образцах по каналу FAM регистрируется накопление флуоресцентного сигнала ВКО.
| СПОСОБЫ, КОМПОЗИЦИИ И НАБОРЫ ДЛЯ ОПРЕДЕЛЕНИЯ ВИРУСА ГЕПАТИТА А | 2012 |
|
RU2595822C2 |
| Набор олигонуклеотидных праймеров и зондов для идентификации вируса клещевого энцефалита, вируса лихорадки Западного Нила, боррелий и риккетсий методом мультиплексной ПЦР в режиме реального времени | 2016 |
|
RU2629604C1 |
| Под редакцией д.м.н., профессора И.И | |||
| ГЕНЕРАЛОВА, Медицинская вирусология, учебное пособие, Витебск, 2017, 306 с | |||
| MARCELA AGNE FLVES VALONES, et al, Principles and applications of polymerose chain reaction in medical diagnostic fields: a review, Brazilian journal of Microbiology, 2009, 40: | |||
Авторы
Даты
2021-03-12—Публикация
2020-06-02—Подача