Изобретение относится к области молекулярной биологии, вирусологии и медицины, касается способа видоспецифичной амплификации кДНК энтеровирусов вида Enterovirus методом «гнездовой» полимеразной цепной реакции и может быть использовано для получения полной нуклеотидной последовательности гена 1D, кодирующего капсидный белок VP1.
Энтеровирусы (сем. Picornaviridae, род Enterovirus) характеризуются иммунологическим и генетическим многообразием. В настоящее время известно более 100 типов энтеровирусов, которые могут вызывать заболевания человека, полиморфные по клиническим проявлениям (полиомиелит, нейропатии, серозный менингит, миокардиты, гастроэнтерит, респираторные заболевания, конъюнктивиты и т.д.) и различные по тяжести течения.
На основе особенностей молекулярной организации энтеровирусы, патогенные для человека, разделены на 4 вида: Enterovirus А (ЭВ-А) (Коксаки А 2-8, 10, 12, 14, 16; ЭВ-А71, 76, 89-91, 114, 120-125), Enterovirus В (ЭВ-В) (Коксаки В1-6; Коксаки А9; ECHO 1-7, 9, 11-21, 24-27, 29-33; ЭВ-В69, 73-75, 77-88,93, 97, 98, 100, 106, 107, 110-114), Enterovirus С (ЭВ-С) (полиовирусы типа 1-3; Коксаки А1, 11, 13, 17, 19-22, 24; ЭВ-С 95, 96, 99, 102, 104,105, 109, 113, 116, 117, 118) и Enterovirus D (ЭB-D)(ЭBD68, 70, 94, 111, 120) [www.picomaviridae. com]. Циркуляция энтеровирусов наблюдается повсеместно. С конца XX века и до настоящего времени во многих странах фиксируется высокий уровень заболеваемости энтеровирусной инфекцией, обусловленный формированием и распространением эпидемических вариантов энтеровирусов. Наиболее часто у больных с энтеровирусной инфекцией выявляют вирусы видов Enterovirus А и Enterovirus В. Вирусы вида Enterovirus А являются основными возбудителями экзантемных форм энтеровирусной инфекции, вирусы вида Enterovirus В - энтеровирусного менингита.
В настоящее время для генотипирования энтеровирусов используют способы частичного секвенирования области VP1 генома, в результате которых получают нуклеотидную последовательность размером 375 н.о. [Nix W.A., Oberste M.S. and Pallansch M.A. Sensitive, seminested PCR amplification of VP1 sequences for direct identification of all enterovirus serotypes from original clinical specimen // J. Clin. Microbiol. - 2006. - Vol.44. №. 8. - P. 2698-2704; патент РФ №2743352, 2021]. Фрагмента такого размера достаточно для определения типа энтеровируса и первичной филогенетической характеристики изучаемого штамма, но не достаточно для полной характеристики гена 1D, кодирующего структурный белок VP1 энтеровируса, и, в большинстве случаев, для достоверности и информативности филогенетического анализа.
Наиболее близким к заявляемому способу по назначению и совокупности существенных признаков является способ дифференциальной амплификации фрагментов кДНК энтеровирусов видов Enterovirus A-D методом ОТ-ПЦР для последующего секвенирования с использованием специфических праймеров (таблица 1) для получения полной нуклеотидной последовательности гена VP1 энтеровирусов [Oberste M.S., Maher К, Williams A.J., Dybdahl-Sissoko N., Brown B.A., Gookin M.S., 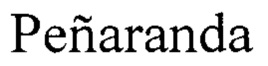 S., Mishrik N., Uddin M., Pallansch M.A. Species-specific RT-PCR amplification of human enteroviruses: a tool for rapid species identification of uncharacterized enteroviruses // J. Gen. Virol. - 2006. - Vol.87(Pt 1). - P. 119-128.]. Известный способ представляет собой вариант ОТ-ПЦР области VP1 генома, позволяющий успешно проводить амплификацию фрагментов кДНК энтеровирусов всех видов, пассированных в клеточных культурах, но недостаточно эффективный для анализа первичного материала.
S., Mishrik N., Uddin M., Pallansch M.A. Species-specific RT-PCR amplification of human enteroviruses: a tool for rapid species identification of uncharacterized enteroviruses // J. Gen. Virol. - 2006. - Vol.87(Pt 1). - P. 119-128.]. Известный способ представляет собой вариант ОТ-ПЦР области VP1 генома, позволяющий успешно проводить амплификацию фрагментов кДНК энтеровирусов всех видов, пассированных в клеточных культурах, но недостаточно эффективный для анализа первичного материала.

Задачей, решаемой изобретением, является разработка способа амплификации полной последовательности гена 1D, кодирующего белок VP1 энтеровирусов вида Enterovirus В.
Технический результат, достигаемый при реализации изобретения, заключается в разработке эффективного способа ОТ-ПЦР фрагмента кДНК области VP1 генома вирусов вида Enterovirus В для получения полной нуклеотидной последовательности гена 1D энтеровирусов вида Enterovirus В в результате увеличения выхода продуктов амплификации.
Указанный технический результат достигается использованием при проведении «гнездовой» ПЦР кДНК области VP1 генома вирусов вида Enterovirus В набора видоспецифичных олигонуклеотидных праймеров:
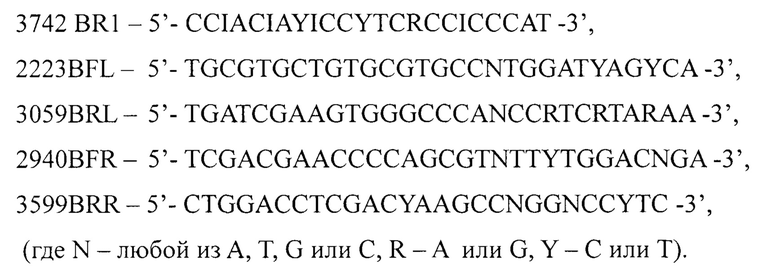
Способ осуществляется следующим образом.
Выделенную из образца энтеровирус-содержащего первичного материала РНК используют в качестве матрицы для получения кДНК в реакции обратной транскрипции с последующей амплификацией кДНК генома вирусов вида Enterovirus. В первом раунде ПЦР для амплификации кДНК используют праймеры 224 и 3742 BR1, во втором раунде ПЦР для амплификации фрагмента кДНК 5' области гена 1D используют пару праймеров 2223BFL и 3059BRL, для 3' области - пару праймеров 2940BFR и 3599BRR.
Сущность заявленного изобретения поясняется чертежами, где: на Фиг. 1 изображена электрофореграмма кДНК 5' (1 ряд) и 3' (2 ряд) областей гена 1D 11 штаммов разных типов энтеровирусов вида Enterovirus В (Коксаки А9 (CVA9), Коксаки В2 (CVB2), ЕСНО6 (Е6), ECHO 11 (E11), ЕСНО 20 (Е20), выделенных на культуре ткани RD. Трек k-1 - отрицательный контроль 1-го раунда ПЦР, трек k-2 - отрицательный контроль 2-го раунда ПЦР, М - маркер размера фрагмента кДНК;
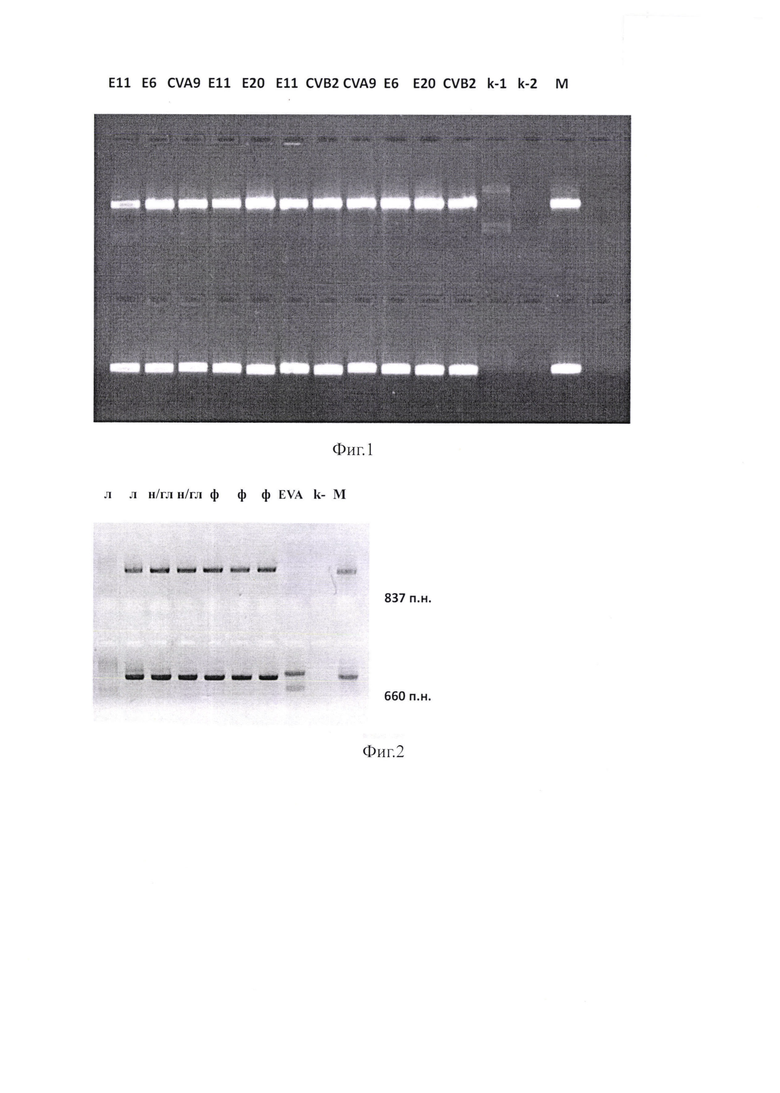
на Фиг. 2 изображена электрофореграмма кДНК 5' (1 ряд) и 3'(2 ряд) областей гена 1D штаммов вируса ЕСНО9, выявленного в пробах клинического материала: ликворе (л), носоглоточных мазках (н/гл), фекальных образцах (ф). Трек EVA - результат амплификации пробы, содержащей вирус вида Enterovirus А, трек k- - отрицательный контроль 2-х раундов ПЦР, М - маркер размера фрагмента кДНК;
на Фиг. 3 изображена электрофореграмма кДНК 5' (1 ряд) и 3'(2 ряд) областей гена 1D штаммов вируса ЕСНО3О, выявленного в пробах клинического материала: ликворе (л), фекальных образцах (ф). Трек k-1 -отрицательный контроль 1-го раунда ПЦР, трек k-2 - отрицательный контроль 2-го раунда ПЦР, М - маркер размера фрагмента кДНК;
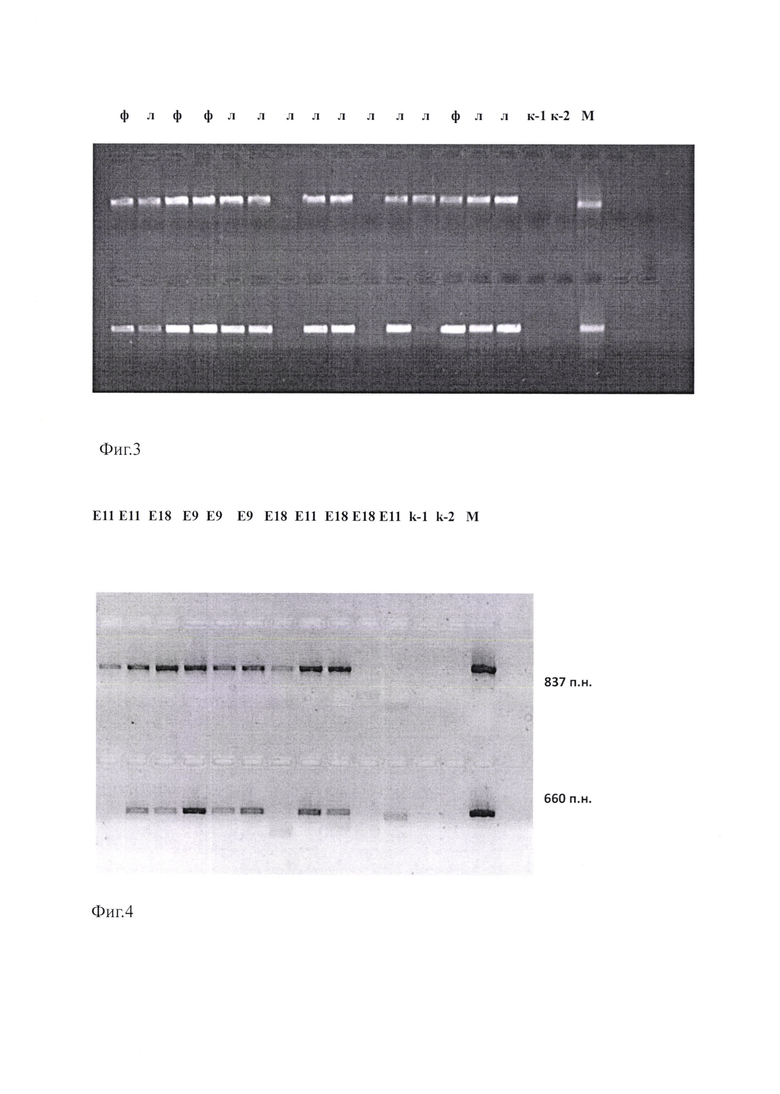
на Фиг. 4 изображена электрофореграмма кДНК 5' (1 ряд) и 3'(2 ряд) областей гена 1D штаммов вирусов ЕСНО9 (Е9), ECHO 11 (E11) и ECHO 18 (El8), выявленных в носоглоточных мазках. Трек k-1 - отрицательный контроль 1-го раунда ПЦР, трек k-2 - отрицательный контроль 2-го раунда ПЦР, М - маркер размера фрагмента кДНК.
Сущность способа поясняется примерами.
Пример 1. Осуществление способа.
Для исследования использовали штаммы вирусов вида Enterovirus В, выделенные на культуре чувствительных клеток, и образцы первичного материала: ликвор, фекальные экстракты, носоглоточные смывы, водные концентраты, содержащие вирусы вида Enterovirus В. РНК энтеровирусов выделяли при помощи коммерческого набора для выделения вирусной РНК «РИБО-преп» (Интерлабсервис, Россия) в соответствии с инструкцией фирмы-производителя. Выделенную РНК использовали в качестве матрицы для получения кДНК в реакции обратной транскрипции. Реакцию проводили в 20 мкл реакционной смеси, содержащей 10 мкл РНК, 2 пкмоль каждого праймера (AN32, AN33, AN34 и AN35), буфер для M-MLV-ревертазы, 0,15 мМ каждого дНТФ, 40 ед. РНКазина, 20 ед. M-MLV-ревертазы. Смесь инкубировали в течение 30 минут при температуре 42°С и в течение 5 минут при температуре 95°. Первый раунд ПЦР проводили в 25 мкл реакционной смеси для 1-го раунда, содержащей 5 мкл кДНК, буфер для Taq-полимеразы, 0,2 мМ каждого дНТФ, 25 пкмоль каждого из праймеров для 1-го раунда ПЦР, 1,5 ед. Taq-полимеразы. Реакцию проводили в режиме: 94°С - 2 мин, (94°С - 15 с, 42°С - 15 с, 60°С - 30 с) × 42 цикла, 72°С - 2 мин.Во втором раунде амплификацию фрагментов к ДНК 5' и 3' областей гена 1D вирусов вида Enterovirus В проводили отдельно, в разных пробирках.
Для постановки 2-го раунда ПЦР по 5 мкл амплификата 1-го раунда вносили в каждую из двух пробирок с реакционной смесью, содержащей буфер для Taq-полимеразы, 0,2 мМ каждого дНТФ, 25 пкмоль каждого из праймеров для 2-го раунда ПЦР (Таблица 2), 1,5 ед. FastStart Taq-полимеразы или Hot Taq-полимеразы или любой другой Taq-полимеразы для ПЦР с «горячим» стартом. Объем реакционной смеси - 25 мкл. Реакцию проводили в режиме: 94°С - 2 мин, (94°С - 15 с, 55°С - 15 с, 72°С - 30 с) × 42 цикла, 72°С - 2 мин. Продукты амплификации (приблизительно 800-850 пар нуклеотидов для фрагмента кДНК 5' области гена 1D, и 620-670 пар нуклеотидов для фрагмента кДНК 3' области гена 1D) визуализировали методом электрофореза в 1,5% агарозном геле, содержащем 0,5 мг/мл бромида этидия.
Амплифицированные фрагменты кДНК энтеровирусов секвенировали на любом автоматическом генетическом анализаторе, в соответствии с инструкцией производителя, с использованием для мечения фрагментов кДНК 5' и 3' областей гена 1D вирусов вида Enterovirus В соответствующих праймеров (Таблица 2).

Пример 2. Исследование штаммов вирусов вида Enterovirus В, содержащихся в образцах первичного материала.
Провели амплификацию фрагментов кДНК 5' и 3' областей гена 1D 11 штаммов энтеровирусов вида Enterovirus В (Коксаки А9 (CVA9), Коксаки В2 культуре чувствительных клеток. С использованием заявленного способа эффективно амплифицировались фрагменты к ДНК 5' и 3' областей гена 1D всех исследованных штаммов энтеровирусов вида Enterovirus В, относящихся к разным типам.
Пример 3. Исследование штаммов вирусов вида Enterovirus В, обнаруженных в образцах первичного материала.
Провели амплификацию фрагментов кДНК 5' и 3' областей гена 1D 33 штаммов энтеровирусов вида Enterovirus В разных типов (ЕСНО9, ЕСНО11, ЕСНО18, ЕСНО30), обнаруженных в образцах первичного материала: ликворе, носоглоточных смывах, фекальных образцах. Установлено, что оба фрагмента кДНК: 5' и 3' областей гена 1D, с использованием заявляемого способа амплифицировались у 26 из 33 исследованных штаммов вирусов вида Enterovirus В, обнаруженных в первичных пробах клинического материала, что составило 78,79%. При исследовании первичных проб клинического материала, содержащих вирусы вида Enterovirus В, способом-прототипом эффективность амплификации, в среднем, составила 27,59%.
Проведенные исследования подтвердили высокую эффективность амплификации полной последовательности гена 1D, кодирующего белок VP1 энтеровирусов вида Enterovirus В, при анализе первичных образцов клинического материала, что свидетельствует о достижении технического результата.
Метод разработан и апробирован на базе лаборатории молекулярной эпидемиологии вирусных инфекций с референс-центром по мониторингу энтеровирусных инфекций ФБУН «ННИИЭМ им. академика И.Н. Блохиной» Роспотребнадзора.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дифференциальной амплификации фрагмента области VP1 генома энтеровирусов видов Enterovirus A и Enterovirus B | 2020 |
|
RU2743352C1 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ ДЛЯ ПОЛУЧЕНИЯ ПОЛНОЙ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА VP1 ЭНТЕРОВИРУСА КОКСАКИ А10 | 2020 |
|
RU2762236C1 |
| СПОСОБ ОБНАРУЖЕНИЯ И ДИФФЕРЕНЦИАЦИИ РНК ЭНТЕРОВИРУСОВ | 2000 |
|
RU2189396C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ 5'-НТР ГЕНОМА ЭНТЕРОВИРУСОВ ГЕНОГРУППЫ ЭВI И ГЕНОГРУППЫ ЭВII С ИСПОЛЬЗОВАНИЕМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2010 |
|
RU2441917C2 |
| Способ генотипирования энтеровирусов методом секвенирования 1A-1B участка генома | 2019 |
|
RU2701145C1 |
| ШТАММ ЭНТЕРОВИРУСА А71 ТИПА СУБГЕНОТИПА С4, ИСПОЛЬЗУЕМЫЙ ДЛЯ ДИАГНОСТИКИ И ИЗУЧЕНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2014 |
|
RU2565811C1 |
| ШТАММ ЭНТЕРОВИРУСА КОКСАКИ В6, СЕЛЕКТИВНО ИНФИЦИРУЮЩИЙ И ЛИЗИРУЮЩИЙ ОПУХОЛЕВЫЕ КЛЕТКИ ЧЕЛОВЕКА in vitro | 2012 |
|
RU2496873C1 |
| НАБОР ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ И ФЛУОРЕСЦЕНТНО-МЕЧЕННОГО ЗОНДА ДЛЯ ИДЕНТИФИКАЦИИ РНК ЭНТЕРОВИРУСОВ МЕТОДОМ ОБРАТНОЙ ТРАНСКРИПЦИИ - ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С ГИБРИДИЗАЦИОННО-ФЛУОРЕСЦЕНТНОЙ ДЕТЕКЦИЕЙ | 2011 |
|
RU2459830C1 |
| СПОСОБ ВЫЯВЛЕНИЯ КИШЕЧНЫХ ВИРУСОВ В КЛИНИЧЕСКИХ ОБРАЗЦАХ И ВОДЕ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПЦР С ДЕТЕКЦИЕЙ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ И ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2506317C2 |
| ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ, СПОСОБ И ТЕСТ-СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ ГЕНОМА ВИРУСА БОЛЕЗНИ НАЙРОБИ ОВЕЦ МЕТОДОМ ОБРАТНОЙ ТРАНСКРИПЦИИ - ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ | 2009 |
|
RU2416647C1 |

Изобретение относится к области молекулярной биологии, вирусологии и медицины. Описан способ амплификации области VP1 генома энтеровирусов вида Enterovirus В методом «гнездовой» полимеразной цепной реакции с использованием олигонуклеотидных праймеров:
в 1-ом раунде ПЦР 224: 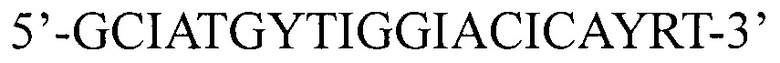 и 3742 BR1 - 5'-
и 3742 BR1 - 5'-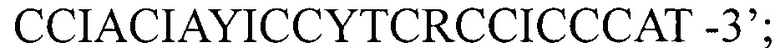 во 2-ом раунде ПЦР 2223BFL: 5'-
во 2-ом раунде ПЦР 2223BFL: 5'-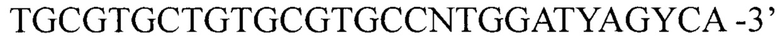 и 3059BRL:
и 3059BRL: 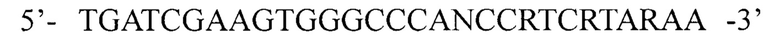 для амплификации кДНК фрагмента кДНК 5' области гена 1D вирусов вида Enterovirus В и олигонуклеотидные праймеры:
для амплификации кДНК фрагмента кДНК 5' области гена 1D вирусов вида Enterovirus В и олигонуклеотидные праймеры:
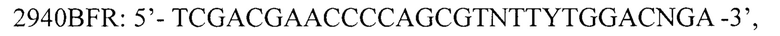
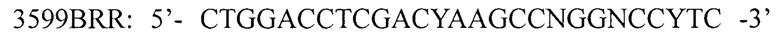
для амплификации кДНК фрагмента кДНК 3' области гена 1D вирусов вида Enterovirus В, где N - любой из А, Т, G или С, R - А или G, Y - С или Т; I - инозин. Изобретение расширяет арсенал средств для генотипирования энтеровирусов. 4 ил., 2 табл., 3 пр.
Способ амплификации области VP1 генома энтеровирусов вида Enterovirus В, включающий выделение геномной РНК, проведение реакции обратной транскрипции с использованием олигонуклеотидных праймеров AN32: GTYTGCCA, AN33: GAYTGCCA, AN34: CCRTCRTA, AN35: RCTYTGCCA, «гнездовой» полимеразной цепной реакции с использованием олигонуклеотидного праймера
224: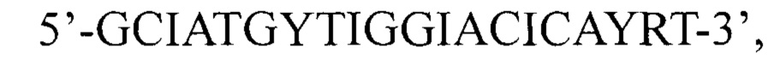 отличающийся тем, что при проведении полимеразной цепной реакции в первом раунде используют олигонуклеотидный праймер
отличающийся тем, что при проведении полимеразной цепной реакции в первом раунде используют олигонуклеотидный праймер
3742 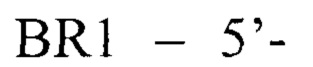

во втором раунде олигонуклеотидные праймеры
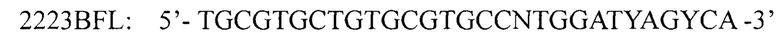 и
и

для амплификации кДНК фрагмента кДНК 5' области гена 1D вирусов вида Enterovirus В и олигонуклеотидные праймеры:
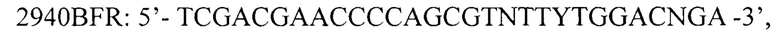
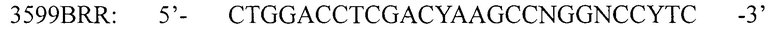 для амплификации кДНК фрагмента кДНК 3' области гена 1D вирусов вида Enterovirus В, где N - любой из А, Т, G или С, R - А или G, Y - С или Т; I - инозин.
для амплификации кДНК фрагмента кДНК 3' области гена 1D вирусов вида Enterovirus В, где N - любой из А, Т, G или С, R - А или G, Y - С или Т; I - инозин.
| Способ дифференциальной амплификации фрагмента области VP1 генома энтеровирусов видов Enterovirus A и Enterovirus B | 2020 |
|
RU2743352C1 |
| СПОСОБ ВЫЯВЛЕНИЯ КИШЕЧНЫХ ВИРУСОВ В КЛИНИЧЕСКИХ ОБРАЗЦАХ И ВОДЕ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПЦР С ДЕТЕКЦИЕЙ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ И ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2506317C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ МЕТОДОМ МУЛЬТИПЛЕКСНОЙ ПЦР С ДЕТЕКЦИЕЙ В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ И ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2010 |
|
RU2460803C2 |
| СПОСОБ ДЕМОНТАЖА ГЛУБИННОЙ АВИАБОМБЫ | 2008 |
|
RU2365870C1 |
Авторы
Даты
2022-06-21—Публикация
2021-12-15—Подача