Область техники, к которой относится изобретение
Настоящее изобретение относится к способу разделения для регенерации бетаина и более конкретно к способу фракционирования раствора, содержащего бетаин и сахарозу, с использованием сочетания нанофильтрации и хроматографии. В типовом варианте осуществления изобретения бетаин регенерируют из раствора, полученного из сахарной свеклы, такого как раствор черной патоки.
Уровень техники
Бетаин является ценным соединением, которое используется в кормах для животных, а также в фармацевтической и косметической областях применения.
Бетаин встречается в корнях, семенах и стеблях самых различных растений. Его концентрация в сахарной свекле относительно высока, от 1,0 до 1,5% в расчете на сухое твердое вещество. Когда сахарная свекла обрабатывается для регенерации сахарозы, бетаин концентрируется в черной патоке. Свекольная черная патока обычно содержит от 3 до 8% бетаина в расчете на сухое твердое вещество.
Бетаин является амфотерным соединением, имеющим формулу:
(H3C)3N+-CH2-COO-
Из уровня техники известна регенерация бетаина из свекольной черной патоки, остаточной патоки или винассы ионным обменом, кристаллизацией, экстракцией органическим растворителем или хроматографией.
Хроматографический способ регенерации бетаина из свекольной черной патоки описан в патенте США № 4359430 (Suomen Sokeri Oy). Это хроматографический способ, в котором черная патока, которая содержит бетаин, такая как свекольная черная патока, вводится в верхнюю часть колонки, содержащей полистиролсульфонатную катионообменную смолу, обычно в форме со щелочным металлом. Вымывание водой проводится для регенерации бетаина, сахарозы и остаточной черной патоки из потока, отходящего от слоя смолы.
Другой способ регенерации бетаина из черной патоки был описан в патенте США № 5127957 (Heikkla et al.); в нем используют хроматографическую систему с имитированным подвижным слоем, имеющую по меньшей мере три хроматографических колонки, соединенных последовательно. Бетаин и сахароза регенерируются как фракции отдельных продуктов во время одного и того же цикла хроматографической системы с имитированным подвижным слоем. Колонки хроматографической системы обычно заполняются сильно кислотной катионообменной смолой в одновалентной ионной форме, предпочтительно натриевой и/или калиевой.
Другой способ фракционирования черной патоки был описан в патенте США № 6093326 (Danisco Finland Oy). В этом способе по меньшей мере одна фракция продукта регенерируется во время многоэтапной последовательности операций в двух или более петлях в хроматографической системе с имитированным подвижным слоем. Один вариант осуществления этого способа относится к способу сепарации сахарозы и бетаина из черной патоки для регенерации сахарозной фракции и бетаиновой фракции. Хроматографическая система содержит по меньшей мере два частично заполненных слоя материала. Заполняющим материалом колонок обычно является сильно кислотная гелеобразная катионообменная смола в одновалентной ионной форме, предпочтительно натриевая и/или калиевая.
WO 96/10650 (Cultor Oy) относится к способу разделения сахарозы и дополнительно второго компонента, такого как бетаин, из содержащего сахарозу раствора, полученного из сахарной свеклы. Способ включает воздействие на раствор двух последовательных хроматографических фракционирований посредством способа с имитированным подвижным слоем для получения одной или больше фракций, обогащенных сахарозой, и одной фракции, обогащенной указанным вторым компонентом. Хроматографическое разделение обычно проводится в сильно кислотном катионообменнике в натриевой и/или калиевой форме.
В DE-OS 2362211 (Suddeutsche Zucker AG) раскрыт способ хроматографического разделения для разделения черной патоки на сахарную фракцию и на несахарную фракцию, с использованием катионообменной смолы в Ca2+-форме. Способ имеет тот недостаток, что Ca2+-форма смолы не находится в равновесии с катионной композицией подвижной фазы.
В патенте США № 4333770 (UOP Inc.) раскрыт способ отделения сахарозы из водной смеси источника сахара, такого как черная патока, контактированием указанной смеси с адсорбентом, состоящим из углеродного пирополимера. Способ плохо отделяет бетаин от солей. В патенте США № 4405377 (UOP Inc.) раскрыт способ отделения моносахаридов от питающей смеси, содержащей водный раствор моносахаридов, контактированием указанного раствора с адсорбентом, содержащим кристаллический алюмосиликат, такой как цеолит. Питающая смесь разбавляется этанолом перед обработкой адсорбентом. Питающей смесью может являться глюкоза, например, такая как кукурузная патока. Этот способ не используется для отделения бетаина. В патенте США № 4405378 (UOP Inc.) раскрыт способ выделения сахарозы из водного раствора, содержащего сахарозу, бетаин и/или минеральные соли, контактированием указанного раствора с адсорбентом, содержащим порошок активированного угля, связанный органическим полимером (нитратом целлюлозы, эфиром целлюлозы или их смесью). Этот способ плохо отделяет бетаин от солей.
В патенте США № 6379554 (Amalgamated Research Inc.) раскрыта система, где большинство хроматографических операций разделения, включая первую операцию с имитированным подвижным слоем, связаны в один способ, который функционирует предпочтительно посредством применения непрерывной вытесняющей хроматографии для регенерации фракции, обогащенной небольшими органическими молекулами, особенно бетаиновыми и/или инвертированного сахара, из сахарозных растворов, обеспечивающей последующее получение сахарозного продукта высокой чистоты.
В EP 0 411780 (Kampen Willen Hemmo) раскрыт способ регенерации бетаина из свекольных дистиллятов, полученных от ферментации и дистилляции сахарной свеклы. Способ включает стадии (а) осветления продукта дистилляции с использованием способа микрофильтрации с перекрестным потоком и с неорганическими мембранами, имеющими размер пор в диапазоне от 0,1 до 10 мкм, для удаления твердых веществ и (b) проведения на осветленном дистилляте хроматографического разделения с исключением ионов для отделения бетаина. Хроматографическое разделение ионным исключением может проводиться с подходящими смолами, такими как SM-51-Na смола (IWT), IWT-AM-63 или DOWEX 50-WX8 (Dow Chemical). Помимо бетаина этот способ может регенерировать другие продукты, такие как этанол, глицерин, янтарная кислота, молочная кислота, сульфат калия и L-пироглутаминовая кислота.
Нанофильтрация является сравнительно новым способом мембранной фильтрации под давлением для разделения растворимых компонентов, подаваемых на нанофильтрацию, находящимся между обратным осмосом и ультрафильтрацией. Нанофильтрация обычно удерживает двухвалентные соли и органические молекулы с молярной массой больше чем 300 г/моль. Наиболее важными мембранами для нанофильтрации являются композиционные мембраны, изготовленные межповерхностной полимеризацией. Полиэфирсульфоновые мембраны, сульфированные полиэфирсульфоновые мембраны, полиэфирные мембраны, полисульфоновые мембраны, мембраны из ароматического полиамида, мембраны из поливинилового спирта и полипиперазиновые мембраны являются примерами широко используемых мембран для нанофильтрации. Для нанофильтрации также могут быть использованы неорганические и керамические мембраны.
Из уровня техники известно применение нанофильтрации для отделения глюкозы от дисахаридов и более высокомолекулярных сахаридов. Исходной смесью, включающей глюкозу, может являться, например, гидролизат крахмала. Один способ отделения глюкозы от дисахаридов и более высоких сахаридов нанофильтрацией, например, был раскрыт в WO 99/28490 (Novo Nordisk).
Патент США № 4511654 (UOP Inc.) относится к способу получения сиропа высокомолекулярных глюкозы или мальтозы обработкой сырья, содержащего глюкозу/мальтозу, энзимом, выбранным из амилглюкозидазы и β-амилазы, для образования частично гидролизованной реакционной смеси, пропусканием полученной частично гидролизованной реакционной смеси через ультрафильтрующую мембрану для получения ретентата и пермеата, рециркуляцией ретентата на этап обработки энзимом и регенерацией пермеата, включающего сироп высокомолекулярной глюкозы или мальтозы.
В WO 01/14594 A2 (Tate & Lyle Inc.) раскрыт способ мембранной фильтрации для получения сахарозы из пульпы сахарной свеклы. Мембранная фильтрация может осуществляться, например, на ультрафильтрирующей мембране или нанофильтрующей мембране. В одном варианте осуществления указанного способа мембранная фильтрация проводится с использованием двух последовательных ступеней ультрафильтрации, возможно в сочетании с диафильтрацией, за которой следует стадия нанофильтрации, с получением, таким образом, пермеата нанофильтрации и ретентата нанофильтрации. Ретентат нанофильтрации содержит большую часть сахарозы от свеклы. В предпочтительном варианте осуществления способа ретентат нанофильтрации содержит приблизительно по меньшей мере от 89 до 91 мас.% сахарозы (в расчете на сухое вещество). Пермеат нанофильтрации, с другой стороны, как показано, содержит приблизительно по меньшей мере от 25 до 50% бетаина, присутствующего в материале для нанофильтрации. Свободные нанофильтрующие мембраны с приблизительно 10% отводом NaCl, как показано, хорошо подходят для стадии нанофильтрации.
Вышеупомянутая ссылка WO 01/14594 A2 также предлагает хроматографическое разделение для дальнейшей очистки содержащего сахарозу ретентата, полученного от ультрафильтрации/диафильтрации. Таким образом получают очищенную сахарозную фракцию.
Однако сочетание хроматографии и нанофильтрации для регенерации бетаина из растворов, полученных из сахарной свеклы, не было раскрыто в уровне техники и из него не следует.
Краткое описание изобретения
Таким образом, целью настоящего изобретения является разработка способа регенерации бетаина из раствора, содержащего бетаин и сахарозу, такого как раствор, полученный из сахарной свеклы, например раствор черной патоки. Цели изобретения достигаются способом, который отличается тем, что изложено в независимых пунктах формулы изобретения. Предпочтительные варианты осуществления изобретения раскрыты в зависимых пунктах формулы.
Изобретение основано на сочетании нанофильтрации и хроматографии для регенерации бетаина. Способ по изобретению обеспечивает повышенную чистоту и/или выход конечного продукта бетаина. Кроме того, помимо бетаина могут регенерироваться этим способом другие продукты с хорошим выходом и/или чистотой. Сочетая нанофильтрацию с хроматографией в соответствии с настоящим изобретением, можно улучшить экономичность способа и/или эффективность разделения всего способа разделения.
Краткое описание чертежей
Следующие чертежи иллюстрируют варианты осуществления изобретения и не предназначены для ограничения каким-либо образом объема изобретения.
Фиг. 1 является графическим изображением варианта осуществления по п.6.
Фиг. 2 является графическим изображением варианта осуществления по п.7.
Фиг. 3 является графическим изображением варианта осуществления по п.8.
Подробное описание изобретения
Изобретение относится к способу регенерации бетаина из раствора, содержащего бетаин и сахарозу, путем осуществления хроматографического фракционирования и нанофильтрации указанного раствора в любой желаемой последовательности с регенерацией фракции, обогащенной бетаином, и, если требуется, фракции, обогащенной сахарозой.
Способ по изобретению может также включать стадии дальнейшего хроматографического фракционирования и/или нанофильтрации для регенерации другой фракции или других фракций, обогащенных бетаином, и возможно другой фракции или других фракций, обогащенных сахарозой, и/или фракций других продуктов и/или их смесей. В указанных других стадиях фракции, полученные от хроматографического фракционирования и/или нанофильтрации, подвергаются дальнейшим разделениям для дальнейшей очистки продукта, чтобы повысить выход и/или регенерировать фракции других продуктов и/или их смесей.
Такие стадии хроматографического фракционирования и/или нанофильтрации могут проводиться последовательно в любой желаемой последовательности. Стадии хроматографического фракционирования и/или нанофильтрации могут также проводиться параллельно. Способ может также включать сочетание последовательных и параллельных стадий хроматографического фракционирования и/или нанофильтрации.
Указанный раствор, содержащий бетаин и сахарозу, обычно является раствором, полученным из сахарной свеклы, содержащим растворы, полученные на различных этапах обработки сахарной свеклы, и фракции, полученные от хроматографического фракционирования соков сахарной свеклы. Такой раствор, полученный из сахарной свеклы, может быть выбран, например, из свекольного сока, густого сока, конечной черной патоки и маточных сиропов, полученных от кристаллизации сахара.
Особенно подходящим сырьевым материалом для регенерации бетаина является черная патока сахарной свеклы, которая обычно содержит от 3 до 8% бетаина в расчете на сухие твердые вещества. В дополнение к бетаину свекольная черная патока содержит, например, сахарозу, соли, аминокислоты и другие неорганические и органические компоненты.
В дополнение к черной патоке как остаточная черная патока от способа обессахаривания, так и барда от способа ферментации могут иметь высокое содержание бетаина и естественно также являются очень подходящими сырьевыми материалами.
В одном варианте осуществления изобретения способ по изобретению включает следующие стадии:
(а) осуществления на растворе, содержащем бетаин и сахарозу, хроматографического фракционирования и регенерации фракции, обогащенной бетаином и сахарозой, и возможно остаточной фракции,
(b) осуществления нанофильтрации указанной фракции, обогащенной бетаином и сахарозой, с регенерацией фракции, обогащенной бетаином, и возможно фракции, обогащенной сахарозой.
Этот вариант осуществления изобретения представлен на Фиг. 1.
Хроматографическое фракционирование этапа (а) может проводиться как периодический способ или способ с имитированным подвижным слоем. Способ с имитированным подвижным слоем может быть непрерывным или последовательным. В одном предпочтительном варианте осуществления хроматографическое фракционирование стадии (а) проводится как непрерывный способ с имитированным подвижным слоем, обеспечивающий обычно две фракции: фракцию, обогащенную бетаином и сахарозой, и остаточную фракцию.
В стадии (b) нанофильтрации фракцию, обогащенную сахарозой, обычно получают как ретентат нанофильтрации, и фракцию, обогащенную бетаином, получают как пермеат нанофильтрации.
В этом варианте осуществления изобретения способ может также включать нанофильтрацию указанной остаточной фракции, полученной на стадии (а), и регенерацию фракции, обогащенной бетаином, фракции, обогащенной сахарозой, фракции, обогащенной рафинозой, и/или фракции, обогащенной красящими соединениями, в зависимости от состава остаточной фракции. Таким образом может быть повышен выход бетаина и/или сахарозы.
Указанные красящие соединения обычно присутствуют как примеси в растворах, полученных из сахарной свеклы, главным образом содержащих большие молекулы, имеющие молярную массу от более чем 1000 до миллионов (г/моль).
Указанная фракция, обогащенная красящими соединениями (нежелательными примесями), и указанная фракция, обогащенная рафинозой, обычно регенерируются как ретентат нанофильтрации. Способ может также включать регенерацию пермеата нанофильтрации, который может быть возвращен на стадию (а) хроматографического фракционирования для использования в нем как элюента.
Указанная фракция, обогащенная бетаином, и/или указанная фракция, обогащенная сахарозой, полученная на стадии (b) нанофильтрации, может быть подвергнута одному или двум дальнейшим стадиям нанофильтрации и/или хроматографического фракционирования для дальнейшей очистки продукта и/или повышения выхода.
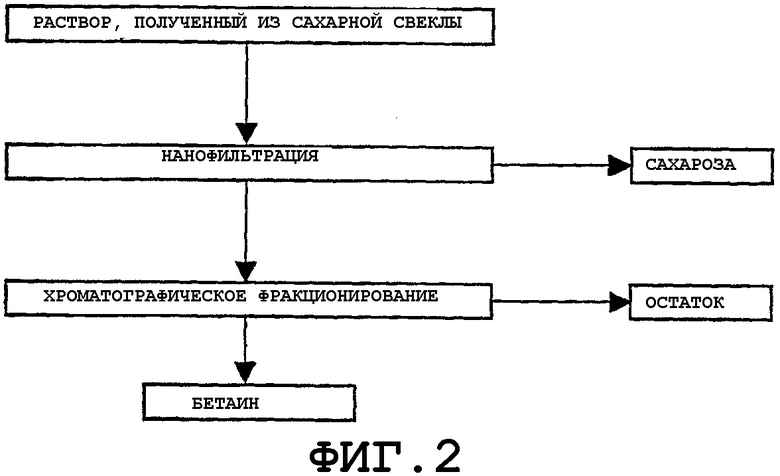
В другом варианте осуществления изобретения способ включает следующие стадии:
(а) осуществления нанофильтрации указанного раствора, содержащего бетаин и сахарозу, с регенерацией фракции, обогащенной бетаином, и возможно остаточной фракции и/или фракции, обогащенной сахарозой,
(b) проведения на указанной фракции, обогащенной бетаином, хроматографического фракционирования с регенерацией фракции, обогащенной бетаином, и возможно остаточной фракции и/или фракции, обогащенной сахарозой.
Этот вариант осуществления изобретения представлен на Фиг. 2.
На стадии (а) нанофильтрации указанная фракция, обогащенная бетаином, обычно регенерируется как пермеат нанофильтрации, и указанная фракция, обогащенная сахарозой, регенерируется как ретентат нанофильтрации.
В этом варианте осуществления изобретения хроматографическое фракционирование стадии (b) может проводиться как периодический способ или способ с имитированным подвижным слоем. В предпочтительном варианте осуществления хроматографическое фракционирование проводится как способ с имитированным подвижным слоем, который может быть непрерывным или последовательным.
Этот вариант осуществления способа по изобретению может также включать нанофильтрацию или хроматографическое фракционирование указанной остаточной фракции, полученной на стадии (b), и регенерацию фракции, обогащенной бетаином, фракции, обогащенной сахарозой, фракции, обогащенной рафинозой, и/или фракции, обогащенной красящими соединениями, в зависимости от состава остаточной фракции. Таким образом можно повысить выход бетаина и/или сахарозы.
Указанная фракция, обогащенная красящими соединениями (нежелательными примесями), и указанная фракция, обогащенная рафинозой, обычно регенерируются как ретентат нанофильтрации. Способ может также включать регенерацию пермеата нанофильтрации, который может быть возвращен на стадию (b) хроматографического фракционирования для использования в нем как элюента.
Этот вариант осуществления способа может также включать стадию, где указанная фракция, обогащенная бетаином, полученная на стадии (b), подвергается нанофильтрации и/или хроматографии, где регенерируются вторая фракция, обогащенная бетаином, и возможно другая фракция. Указанная другая фракция, например, может включать сахара, аминокислоты и инозит. Сахара обычно содержат сахарозу, глюкозу, фруктозу и галактозу. Сахара, аминокислоты и инозит могут регенерироваться в качестве продуктов.
Указанная фракция, обогащенная бетаином, и/или указанная фракция, обогащенная сахарозой, полученные на стадии (а) нанофильтрации, могут быть подвергнуты одному или больше дальнейшим стадиям нанофильтрации для дальнейшей очистки продукта и/или повышения выхода.
Еще в одном варианте осуществления изобретения способ включает следующие стадии:
(а) осуществления на указанном растворе, содержащем бетаин и сахарозу, хроматографического фракционирования с регенерацией фракции, обогащенной бетаином, и возможно фракции, обогащенной сахарозой, и/или остаточной фракции,
за которым следует по меньшей мере одна из следующих стадий:
(b) осуществления нанофильтрации указанной остаточной фракции с регенерацией фракции, обогащенной сахарозой, и/или фракции, обогащенной бетаином, и возможно одной или более других фракций,
(с) осуществления нанофильтрации указанной фракции, обогащенной сахарозой, с регенерацией второй фракции, обогащенной сахарозой, и/или фракции, обогащенной бетаином, и возможно одной или более других фракций,
(d) осуществления нанофильтрации указанной фракции, обогащенной бетаином, с регенерацией второй фракции, обогащенной бетаином, и возможно одной или более других фракций.
Этот вариант осуществления изобретения представлен на Фиг. 3.
Хроматографическое фракционирование стадии (а) может проводиться как периодический способ или способ с имитированным подвижным слоем. Способ с имитированным подвижным слоем может быть непрерывным или последовательным. В предпочтительном варианте осуществления хроматографическое фракционирование стадии (а) проводится как последовательный способ с имитированным подвижным слоем, дающим обычно три фракции: фракцию, обогащенную бетаином, фракцию, обогащенную сахарозой, и остаточную фракцию.
В этом варианте осуществления изобретения остаточная, и/или сахарозная, и/или бетаиновая фракция, полученные от хроматографического фракционирования, могут подвергаться нанофильтрации по отдельности.
В стадии (b) этого варианта осуществления изобретения указанная одна или больше других фракций обычно содержат фракцию, обогащенную рафинозой, и/или фракцию, обогащенную красящими соединениями. В зависимости от состава остаточной фракции бетаин и сахароза регенерируются для повышения общего выхода, и рафиноза также может быть регенерирована. Указанная фракция, обогащенная рафинозой, и указанная фракция, обогащенная красящими соединениями, обычно регенерируются как ретентат нанофильтрации. Указанная фракция, обогащенная бетаином, обычно регенерируется как пермеат нанофильтрации. Пермеат, полученный от нанофильтрации, может использоваться как элюент в хроматографическом фракционировании стадии (а).
Указанная одна или больше других фракций, регенерированных на стадии (с) этого варианта осуществления изобретения, обычно содержат фракцию, обогащенную инозитом, фракцию, обогащенную аминокислотами, фракцию, обогащенную моносахаридами, и/или фракцию, обогащенную рафинозой. Бетаин, инозит, аминокислоты, моносахариды и рафиноза могут быть регенерированы в качестве продуктов. Указанная фракция, обогащенная рафинозой, обычно регенерируется как ретентат нанофильтрации. Указанная фракция, обогащенная бетаином, обычно регенерируется как пермеат нанофильтрации. В то же время сахарозная фракция дополнительно очищается от бетаина, инозита, аминокислот, моносахаридов и рафинозы.
Указанная другая фракция, регенерированная на стадии (d) этого варианта осуществления изобретения, может содержать фракцию, обогащенную сахарами, фракцию, обогащенную инозитом, и/или фракцию, обогащенную аминокислотами. Сахара, инозит и аминокислоты могут регенерироваться в качестве продуктов. В то же время бетаиновая фракция дополнительно очищается от сахаров, инозита, аминокислот и других возможных соединений. При правильном выборе мембраны или сочетания мембран бетаиновая фракция может одновременно очищаться и концентрироваться, что уменьшает необходимость в выпаривании на следующей стадии.
Указанная остаточная фракция, возможно регенерируемая в различных вариантах осуществления изобретения, обычно содержит соли. Соли возникают из сырьевого материала, такого как сахарная свекла, и на ранних этапах обработки сырьевого материала. В соответствии со способом по изобретению соли таким образом могут быть эффективно удалены из бетаина и/или сахарозы.
Стадию хроматографического фракционирования способа согласно изобретению можно проводить, используя материал для наполнения колонок, выбранный из катионообменных смол и из анионообменных смол.
Указанная катионообменная смола может быть сильно кислотной катионообменной смолой или слабо кислотной катионообменной смолой. Смола может быть в одновалентной и/или двухвалентной металлической форме, такой как Na+- и/или K+-форма, или Ca2+-, Ba2+-, Mg2+- и/или Sr2+-форма.
Смолы могут иметь стироловый или акриловый скелет. Смолы предпочтительно поперечно сшиты с помощью примерно от 1 до 20% дивинилбензола, предпочтительно примерно от 3 до 8% дивинилбензола.
Указанной анионообменной смолой обычно является слабо основная анионообменная смола, имеющая предпочтительно акриловый скелет.
Средний размер частиц смолы обычно составляет от 10 до 2000 мкм, предпочтительно от 100 до 400 мкм.
Смолы предпочтительно являются смолами в виде геля.
Производителями смол являются, например, Finex, Dow, Bayer и Rohm & Haas.
Цеолиты, пирополимеры углерода и активированный уголь, связанный с полимером, также являются пригодными материалами для заполнения колонок.
В операции хроматографического фракционирования катионы/анионы смолы предпочтительно находятся в существенном равновесии с катионами/анионами подвижной фазы системы.
Особенно предпочтительным материалом для заполнения колонок на стадии хроматографического фракционирования способа по изобретению является сильно кислотная катионообменная смола в одновалентной металлической форме, которая предпочтительно находится в виде Na+ и/или K+. Смола имеет предпочтительно стироловый скелет, и смола предпочтительно поперечно сшита дивинилбензолом.
Элюентом, используемым на стадии хроматографического разделения в различных вариантах осуществления изобретения, описанных выше, является предпочтительно вода, но используются также растворы солей в воде. Кроме того, пригодными элюентами являются спирты, такие как этанол, и смеси воды и спирта, такие как смесь воды и этанола.
Температура хроматографического фракционирования зависит, например, от выбранной смолы. Температура хроматографического фракционирования обычно находится в диапазоне от 50 до 100°С, предпочтительно от 55 до 90°С.
В способе с имитированным подвижным слоем хроматографическое фракционирование обычно проводится с использованием от 3 до 14 колонок, соединенных последовательно. Колонки связаны трубопроводами. Скорость потока в колонках обычно от 0,5 до 10 м3/(м2·ч) площади сечения колонки. Колонки заполнены материалом для заполнения колонок, выбранным, например, из материалов, описанных выше. Колонки снабжены подающими линиями и линиями для продуктов, так что в колонки могут быть поданы питающий раствор и элюент, и из колонки могут быть собраны фракции продуктов. Линии для продуктов снабжены линейными инструментами, чтобы можно было контролировать качество/количество продукции во время операции.
Перед хроматографическим фракционированием питающий раствор может быть подвергнут одному или более стадиям предобработки, выбранным из размягчения ионнообменной обработкой или карбонизации, разбавления, концентрации, например выпариванием, регулировки pH и, например, фильтрации. В типовой операции предобработки питающий раствор, такой как свекольная черная патока, разбавляется водой до концентрации приблизительно от 40 до 60 мас.% и фильтруется с использованием, например, диатомовой земли как вспомогательного средства для фильтрования. Перед подачей в колонки питающий раствор и элюент нагреваются до температуры фракционирования, описанной выше (например, до диапазона от 50 до 85°С).
Во время хроматографического разделения с ИПС питающий раствор циркулирует через колонки посредством насосов. Добавляется элюент и собираются сахароза, бетаин и остаточные фракции, а также другие возможные фракции продуктов.
В одном примере хроматографического фракционирования в способе по изобретению содержание сахарозы в полученной сахарозной фракции может колебаться от около 85% до около 99% в расчете на сухие твердые вещества, и содержание бетаина в сахарозной фракции может колебаться от около 0,01 до около 10% в расчете на сухие твердые вещества. Содержание бетаина в бетаиновой фракции может колебаться от около 20 до около 95% в расчете на сухие твердые вещества, и содержание сахарозы в бетаиновой фракции может колебаться от около 5 до около 40%. Содержание сахарозы в остаточной черной паточной фракции может колебаться от около 5 до около 25% в расчете на сухие твердые вещества и содержание бетаина в остаточной черной паточной фракции может колебаться от около 1 до около 35% в расчете на сухие твердые вещества.
pH зависит от состава исходного раствора и мембраны, используемой для нанофильтрации, и от стабильности регенерируемых компонентов. Если нужно, перед нанофильтрацией подстраивают pH исходного раствора до желаемой величины. Нанофильтрация для регенерации бетаина обычно проводится при pH от 1 до 12, предпочтительно от 4 до 12.
Нанофильтрация обычно проводится при давлении от 10 до 50 бар, предпочтительно от 15 до 35 бар. Типовая температура нанофильтрации от 5 до 95°С, предпочтительно от 30 до 80°С. Нанофильтрация для регенерации бетаина обычно проводится при температуре от 5 до 95°С, предпочтительно от 30 до 80°С.
Нанофильтрация обычно проводится при потоке от 5 до 100 л/(м2·ч).
Мембрана для нанофильтрации, используемая в настоящем изобретении, может быть выбрана из полимерных и неорганических мембран, имеющих величину пропускания 100-2500 г/моль, предпочтительно 150-1000 г/моль, наиболее предпочтительно 150-500 г/моль.
Типовые полимерные мембраны для нанофильтрации, используемые в настоящем изобретении, включают, например, полиэфирсульфоновые мембраны, сульфированные полиэфирсульфоновые мембраны, полиэфирные мембраны, полисульфоновые мембраны, мембраны из ароматических полиамидов, мембраны из поливинилового спирта и полипиперазиновые мембраны и их сочетания. Мембраны для нанофильтрации, используемые в настоящем изобретении, также могут быть выбраны из ацетатцеллюлозных мембран.
Типовые неорганические мембраны включают, например, ZrO2- и Al2O3-мембраны.
Мембраны для нанофильтрации, которые используются в настоящем изобретении, могут иметь отрицательный или положительный заряд. Мембраны могут быть ионными мембранами, т.е. они могут содержать катионные или анионные группы, но используются также нейтральные мембраны. Мембраны для нанофильтрации могут быть выбраны из гидрофобных или гидрофильных мембран.
Одной формой мембран для нанофильтрации является плоская пленочная форма. Конфигурация мембран может также выбираться, например, из трубок, спиральных мембран и полых волокон. Могут также использоваться мембраны с "высоким сдвигом", такие как вибрирующие мембраны и вращающиеся мембраны.
Перед процедурой нанофильтрации мембраны для нанофильтрации могут быть предварительно обработаны, например, щелочными детергентами или этанолом.
В типовой операции нанофильтрации обрабатываемый сироп, такой как сироп черной патоки, подается через мембрану для нанофильтрации в условиях температуры и давления, описанных выше. Сироп, таким образом, фракционируется на фракцию с низкой молярной массой, включающую бетаин (пермеат), и фракцию с высокой молярной массой, включающую сахарозу и другие высокомолекулярные компоненты раствора черной патоки (ретентат).
Оборудование для нанофильтрации, используемое в настоящем изобретении, содержит по меньшей мере один мембранный элемент для нанофильтрации, разделяющий подаваемый материал на ретентатную и пермеатную части. Оборудование для нанофильтрации обычно также включает средства для управления давлением и потоком, такие как насосы и вентили и измерители потока и давления и контроллеры. Оборудование может также включать несколько мембранных элементов для нанофильтрации в различных их сочетаниях, расположенных параллельно или последовательно.
Поток пермеата меняется в соответствии с давлением. Вообще в нормальном рабочем диапазоне чем выше давление, тем выше поток. Поток также меняется с температурой. Повышение рабочей температуры увеличивает поток. Однако при более высоких температурах и при более высоких давлениях имеется повышенная склонность к разрыву мембраны. Для неорганических мембран могут быть использованы более высокие диапазоны температур и давлений и pH, чем для полимерных мембран.
Нанофильтрация в соответствии с настоящим изобретением может проводиться периодически или непрерывно. Процедура нанофильтрации может повторяться один или несколько раз. Может также использоваться рециркуляция пермеата и/или ретентата обратно в питающую емкость.
В добавление к стадиям хроматографического фракционирования и нанофильтрации, описанным выше, способ по изобретению может включать другие обработки, выбранные, например, из размягчения ионнообменной обработкой или карбонизацией, разбавления, концентрации, например выпариванием, регулировки pH и фильтрации перед, после и/или между стадиями хроматографического фракционирования и нанофильтрации.
Бетаин, полученный от хроматографического разделения и/или нанофильтрации, описанных выше, может концентрироваться выпариванием и затем дальше очищаться кристаллизацией, ионным обменом и/или другими общепринятыми способами очистки.
В примерах и во всем описании и в формуле изобретения были использованы следующие определения:
DS обозначает содержание сухого вещества, измеренное титрованием по Karl Fischer и выраженное в мас.%.
Поток обозначает количество (литров) раствора, проникающее через мембрану для нанофильтрации в течение одного часа, рассчитанное на один квадратный метр поверхности мембраны, л/(м2 ·ч).
Удерживание обозначает долю отмеренного соединения, удерживаемую мембраной. Чем выше величина удерживания, тем меньше количество соединения, переносимое через мембрану:
Удерживание (%)= [(Питание - Пермеат)/Питание] × 100,
где "Питание" обозначает концентрацию соединения в питающем растворе (выраженную, например, в г/л) и "Пермеат" обозначает концентрацию соединения в пермеатном растворе (выраженную, например, в г/л).
HPLC означает жидкостную хроматографию.
SMB означает хроматографию с имитированным подвижным слоем.
NF означает нанофильтрацию.
DVB означает дивинилбензол.
Например, в настоящем изобретении используются следующие мембраны.
- Desal-5 DK (четырехслойная мембрана, состоящая из слоя полиэфира, слоя полисульфона и двух фирменных слоев, имеющая предельную величину пропускания от 150 до 300 г/моль, проницаемость (25°С) 5,4 л/(м2·ч·бар) и MgSO4-удерживание 98% (2 г/л), производитель Osmonics),
- Desal-5 DL (четырехслойная мембрана, состоящая из слоя полиэфира, слоя полисульфона и двух фирменных слоев, имеющая предельную величину пропускания от 150 до 300 г/моль, проницаемость (25°С) 7,6 л/(м2·ч·бар), MgSO4-удерживание 96% (2 г/л), производитель Osmonics),
- NTR-7450 (мембрана из сульфированного полиэфирсульфона, имеющая предельную величину пропускания от 500 до 1000 г/моль, проницаемость (25°С) 9,4 л/(м2·ч·бар), NaCl-удерживание 51% (5 г/л), производитель Nitto Denco), и
- NF-200 (полипиперазиновая мембрана, имеющая предельную величину пропускания 200 г/моль, проницаемость (25°С) 7-8 л/(м2·ч·бар), NaCl-удерживание 70%, производитель Dow Deutschland),
- TS-80 (производитель Trisep),
- AFT-60 (производитель PTI Advanced Filtration Inc.),
- Desal AG (производитель Osmonics),
- Desal G10 (тонкопленочная мембрана из ароматического полиамид/полисульфонового материала, имеющая предельную величину пропускания 2500 г/моль, проницаемость (25°С) 3,4 л/(м2·ч·бар), NaCl-удерживание 10%, удерживание декстрана (1500 г/мл) 95%, удерживание глюкозы 50%, производитель Osmonics),
- ASP 10 (мембрана, состоящая из сульфированного полисульфона на полисульфоне, имеющая проницаемость (25°С) 16 л/(м2·ч·бар), NaCl-удерживание 10%, производитель Advanced Membrane Technology),
- TS 40 (мембрана, состоящая из полностью ароматического полиамида, имеющая проницаемость (25°С) 5,6 л/(м2·ч·бар), производитель TriSep),
- ASP 20 (мембрана, состоящая из сульфированного полисульфона на полисульфоне, имеющая проницаемость (25°С) 12,5 л/(м2·ч·бар), NaCl-удерживание 20%, производитель Advanced Membrane Technology),
- UF-PES-4H (мембрана, состоящая из полиэфирсульфона на полипропилене, имеющая предельную величину пропускания около 4000 г/моль, проницаемость (25°С) от 7 до 17 л/(м2·ч·бар), производитель Hoechst),
- NF-PES-10 (полиэфирсульфоновая мембрана, имеющая предельную величину пропускания 1000 г/моль, проницаемость (25°С) от 5 до 11 л/(м2·ч·бар), NaCl-удерживание менее 15% (5 г/л), производитель Hoechst),
- NF45 (мембрана, состоящая из ароматического полиамида, имеющая проницаемость (25°С) 4,8 л/(м2·ч·бар), NaCl-удерживание 45%, производитель Dow Deutschland),
- SR-1 (производитель Koch),
- XN-40 (производитель Trisep),
- MPF-34 (композиционная мембрана, имеющая предельную величину пропускания 200 г/моль и удерживание глюкозы 95% для 5% раствора глюкозы, производитель Koch).
Предпочтительные мебраны для нанофильтрации для регенерации бетаина выбираются из сульфированных полисульфоновых мембран и полипиперазиновых мембран. Например, особыми используемыми мембранами являются: Desal-5 DK и Desal-5 DL для нанофильтрации (производитель Osmonics), NF-45 и NF-200 для нанофильтрации (производитель Dow Deutschland), SR-1 для нанофильтрации (производитель Koch) и NTR-7450 для нанофильтрации (производитель Nitto Denko).
Следующие примеры иллюстрируют изобретение. Примеры не истолковываются для какого-либо ограничения изобретения.
Пример 1
Разделение бетаина и сахарозы нанофильтрацией
Этот пример иллюстрирует разделение бетаина и сахарозы с использованием различных мембран для нанофильтрации. Питающий раствор, используемый для нанофильтрации, являлся раствором, полученным из кристаллов сахарозы и бетаина, содержащим 50% бетаина и 50% сахарозы. Питающий раствор имел pH 9,2 и DS 12,7%. Оборудованием, использованным для нанофильтрации, было DSS Labsta M20-фильтр. Нанофильтрация проводилась с использованием полной фильтрации в режиме рециркуляции (постоянная концентрация питания). Давление при нанофильтрации было 30 бар, скорость поперечного потока около 0,7 м/с и температура от 65 до 70°С. Мембраны, используемые для нанофильтрации, приведены ниже в Таблице 1.
Таблица 1 показывает содержание бетаина (%) в пермеате на основе хроматографического анализа (сумма сахарозы и бетаина составляет 100%).
Содержание бетаина в пермеате, полученном при нанофильтрации раствора, содержащего бетаин и сахарозу
Результаты показывают, что нанофильтрация значительно увеличивает содержание бетаина в сухом веществе пермеата нанофильтрации.
Пример 2: Фракционирование свекольной черной патоки хроматографией
Для фракционирования использовалось опытное последовательное хроматографическое оборудование с SMB. Оборудование состояло из 6 последовательно соединенных колонок, питающего насоса, насосов для циркуляции и насоса для элюентной воды, а также впускных вентилей и вентилей для продуктов в обрабатываемых потоках. Каждая колонка имела высоту 4,0 м и диаметр 0,111 м. Каждая колонка заполнена сильно кислотной катионообменной смолой в виде геля в Na+-форме, со средним размером частиц смолы 0,36 мм и DVB-содержанием 5,5%. Температура колонок была 80°С и в качестве элюента использовалась вода. Перед хроматографическим разделением свекольная черная патока карбонизировалась карбонатом натрия (доза 1,5% от сухого вещества, температура 60°С, время реакции 3 часа) и фильтровалась Seitz фильтром под давлением с использованием вспомогательного фильтрующего средства Kenite 300 (предпокрытие 1 кг/м2, загущающее питание 1,0% от сухого вещества).
Хроматографическое разделение проводилось в 9-ступенчатой последовательности следующим образом (операции а, b и с происходят одновременно):
Ступень 1: Питание накачивалось в колонку 1 и разбавляющая фракция вымывалась из колонки 6.
Ступень 2а: Питание накачивалось в колонку 1 и остаточная фракция вымывалась из колонки 1.
Ступень 2b: Вода подавалась в колонку 2 и остаточная фракция вымывалась из колонки 4.
Ступень 2c: Вода подавалась в колонку 5 и разбавляющая фракция вымывалась из колонки 6.
Ступень 3а: Питание накачивалось в колонку 1 и остаточная фракция вымывалась из колонки 1.
Ступень 3b: Вода подавалась в колонку 2 и остаточная фракция вымывалась из колонки 4.
Ступень 3с: Вода подавалась в колонку 5 и сахарозная фракция вымывалась из колонки 6.
Ступень 4: Питание накачивалось в колонку 1 и сахарозная фракция вымывалась из колонки 6.
Ступень 5: Вода подавалась в колонку 1 и сахарозная фракция, обогащенная бетаином, для нанофильтрации вымывалась из колонки 6.
Ступень 6а: Вода подавалась в колонку 1 и остаточная фракция вымывалась из колонки 2.
Ступень 6b: Вода подавалась в колонку 3 и остаточная фракция вымывалась из колонки 5.
Ступень 6с: Вода подавалась в колонку 6 и бетаиновая фракция вымывалась из колонки 6.
Ступень 7: Вода подавалась в колонку 1 и бетаиновая фракция вымывалась из колонки 6.
Ступень 8а: Вода подавалась в колонку 1 и остаточная фракция вымывалась из колонки 3.
Ступень 8b: Вода подавалась в колонку 4 и остаточная фракция вымывалась из колонки 6.
Ступень 9: Циркуляция во всех колонках.
Объемы и скорости потоков в различных ступенях показаны в Таблице 2.
Объемы (литры) и скорости потоков (литры/час) вступенях 1-9
на НФ
Ступени 1-9 повторялись (от 5 до 7 раз), пока не достигалось существенное равновесие. Способ был продолжен в равновесной стадии. Фракции собирались и анализировались посредством HPLC (смола Na+-формы, 0,8 мл/мин, 0,002 M Na2SO4, 85°С). Составы питания и собираемых фракций показаны в Таблице 3.
Концентрация и состав питания и собираемых фракций
на НФ
Пример 3. Нанофильтрация сахарозной фракции, обогащенной бетаином, полученной от хроматографического разделения
Обогащенная бетаином сахарозная фракция, содержащая 80,9% сахарозы и 14,5% бетаина, полученная согласно Примеру 2, была подвергнута нанофильтрации.
Нанофильтрация проводилась с использованием такого же оборудования, как в Примере 1. Питание, подаваемое на нанофильтрацию, имело DS 15,6 г/100 мл, температура нанофильтрации была 70°С и давление нанофильтрации было 28 бар. Мембранами для нанофильтрации были Desal-5 DL и Desal-5 DK. Содержание бетаина в пермеате нанофильтрации, полученном от нанофильтрации с Desal-5 DL, было 65,4%, и содержание сахарозы в пермеате было 31,1%. Когда использовали Desal-5 DK как мембрану для нанофильтрации, содержание бетаина в пермеате нанофильтрации, полученном таким образом, было 61,2% и содержание сахарозы в пермеате было 31,3 от DS.
Пример 4: Нанофильтрация обогащенной сахарозной бетаиновой фракции, полученной от хроматографического разделения
Свекольная черная патока подвергалась хроматографическому фракционированию, как описано в Примере 2, и была собрана обогащенная сахарозной бетаиновая фракция, содержащая 17,9% сахарозы от DS и 76,6% бетаина от DS. Полученный таким образом раствор был предварительно обработан для подгонки концентрации раствора до 17,3 г/100 мл, после чего он был подвергнут нанофильтрации.
Нанофильтрация проводилась с использованием такого же оборудования, как в Примере 1. Питание, подаваемое на нанофильтрацию, имело DS 15,3 г/100 мл, температура нанофильтрации была 70°С и давление нанофильтрации было 48 бар. Мембранами для нанофильтрации были Desal-5 DL и Desal-5 DK. Содержание бетаина в пермеате нанофильтрации, полученном от нанофильтрации с Desal-5 DL, было 79,2% и содержание сахарозы было 1,5% от DS. Когда использовали Desal-5 DK как мембрану для нанофильтрации, содержание бетаина в пермеате нанофильтрации, полученном таким образом, было 81,3% и содержание сахарозы в пермеате было 1,3% от DS.
Бетаиновая фракция, полученная от хроматографического разделения, была таким образом очищена нанофильтрацией для получения пермеата нанофильтрации, содержащего только незначительные количества сахарозы. В то же время сахароза регенерировалась из бетаиновой фракции посредством концентрации ее в ретентате нанофильтрации.
Пример 5: Хроматографическое фракционирование свекольной черной патоки
В фракционировании использовалось последовательное хроматографическое оборудование с SMB. Оборудование состояло из трех последовательно соединенных колонок, питающего насоса, циркуляционных насосов и насоса для элюентной воды, а также впускных вентилей и вентилей для продуктов для обрабатываемых потоков. Колонки имели общую длину 11,1 м (колонки 1, 2 и 3 имели длину соответственно 4,35 м, 2,70 м и 4,05 м) и диаметр колонки 0,20 м. Колонки заполнялись сильно кислотной катионообменной смолой в виде геля в Na+-форме, средний размер частиц смолы был 0,41 мм и содержание DVB 6,5%. Температура колонок была 80°C и вода использовалась как элюент. Перед хроматографическим разделением питающий раствор фильтровался фильтром Seitz под давлением с использованием как вспомогательного средства для фильтрования Kenite 300 (предпокрытие 1 кг/м2, подаваемый загуститель 1% в расчете на сухое вещество).
Хроматографическое разделение проводилось в 7-ступенчатой последовательности следующим образом (операции а, b и с происходят одновременно):
Ступень 1а: Питание накачивалось в колонку 1 и остаточная фракция вымывалась из колонки 2.
Ступень 1b: Вода подавалась в колонку 3 и бетаиновая фракция вымывалась из колонки 3.
Ступень 2: Питание накачивалось в колонку 1 и бетаиновая фракция вымывалась из колонки 3.
Ступень 3: Циркуляция во всех колонках.
Ступень 4а: Вода подавалась в колонку 1 и остаточная фракция вымывалась из колонки 1.
Ступень 4b: Вода подавалась в колонку 2 и остаточная фракция вымывалась из колонки 3.
Ступень 5: Вода подавалась в колонку 1 и остаточная фракция вымывалась из колонки 3.
Ступень 6: Вода подавалась в колонку 1 и фракция, содержащая сахарозу и бетаин, вымывалась из колонки 3.
Ступень 7: Вода подавалась в колонку 3 и остаточная фракция вымывалась из колонки 2.
Объемы и скорости потоков в различных ступенях показаны в Таблице 4.
Объемы (литры) и скорости потоков (литры/час) в ступенях 1-7
Ступени 1-7 повторялись (от 5 до 7 раз) пока не достигалось равновесие. Способ продолжался в равновесном состоянии. Фракции собирались и анализировались посредством HPLC (смола в Na+-форме, 0,8 мл/мин, 0,002 M Na2SO4, 85°C). Составы питания и собираемых фракций показаны в Таблице 5.
Концентрация и состав питания и собираемых фракций
бетаиновая на НФ
Пример 6. Нанофильтрация фракции, содержащей сахарозу и бетаин, полученной от хроматографического фракционирования
Фракция, содержащая 45,9% сахарозы и 5,1% бетаина, полученная от хроматографического фракционирования, проведенного в соответствии с Примером 5, была подвергнута нанофильтрации.
Нанофильтрация проводилась с таким же оборудованием, как в Примере 1. Условия нанофильтрации были следующие: pH 10,1, температура 70°С, скорость поперечного потока около 0,5 м/с. Мембраной для нанофильтрации была Desal-5 DL. Нанофильтрация проводилась с использованием режима диафильтрации. Она прекращалась, когда около 50% исходных сухих твердых веществ пропускалось через мембрану. Объем питания был 5 литров и объем концентрата в конце был 3,6 литров.
Состав питания и пермеата, полученного от нанофильтрации, приведены в Таблице 6. Удерживания приведены в Таблице 7.
Состав питания и пермеата в нанофильтрации
DL(1)
DL(2)

Пример 7: Хроматографическое фракционирование свекольной черной патоки
Во фракционировании использовалось опытное последовательное хроматографическое оборудование с SMB. Оборудование, смола и условия, используемые для хроматографии, были такими же, как описано в Примере 2, за исключением того, что хроматографическое разделение проводилось в соответствии со следующей 9-ступенчатой последовательностью (операции а, b и с происходят одновременно):
Ступень 1: Питание накачивалось в колонку 1 и разбавленная фракция вымывалась из колонки 6.
Ступень 2а: Питание накачивалось в колонку 2 и остаточная фракция вымывалась из колонки 1.
Ступень 2b: Вода подавалась в колонку 2 и остаточная фракция вымывалась из колонки 4.
Ступень 2с: Вода подавалась в колонку 5 и разбавленная фракция вымывалась из колонки 6.
Ступень 3а: Питание накачивалось в колонку 1 и остаточная фракция вымывалась из колонки 1.
Ступень 3b: Вода подавалась в колонку 2 и остаточная фракция вымывалась из колонки 4.
Ступень 3с: Вода подавалась в колонку 5 и сахарозная фракция вымывалась из колонки 6.
Ступень 4: Питание накачивалось в колонку 1 и сахарозная фракция вымывалась из колонки 6.
Ступень 5: Вода накачивалась в колонку 1 и фракция, содержащая сахарозу и бетаин (сахарозная+бетаиновая фракция), вымывалась из колонки 6.
Ступень 6а: Вода подавалась в колонку 1 и остаточная фракция вымывалась из колонки 2.
Ступень 6b: Вода подавалась в колонку 3 и остаточная фракция вымывалась из колонки 5.
Ступень 6с: Вода подавалась в колонку 6 и бетаиновая фракция вымывалась из колонки 6.
Ступень 7: Вода подавалась в колонку 1 и бетаиновая фракция вымывалась из колонки 6.
Ступень 8а: Вода подавалась в колонку 1 и остаточная фракция вымывалась из колонки 3.
Ступень 8b: Вода подавалась в колонку 4 и остаточная фракция вымывалась из колонки 6.
Ступень 9: Циркуляция во всех колонках.
Объемы и скорости потоков в различных ступенях показаны в Таблице 8.
Объемы (литры) и скорости потоков в ступенях 1-9
Ступени 1-9 повторялись (от 5 до 7 раз) пока не достигалось равновесие. Способ продолжался в равновесном состоянии. Фракции собирались и анализировались посредством HPLC (смола Na+-формы, 0,8 мл/мин, 0,002 M Na2SO4, 85°С). Концентрация и состав питания и собираемых фракций показаны в Таблице 9.
Концентрация и состав питания и собираемых фракций
на НФ
% от DS
% от DS
% от DS
Пример 8. Нанофильтрация фракции, содержащей 88% сахарозы и 10% бетаина, полученной от хроматографического разделения
Фракция, содержащая 88% сахарозы и 10% бетаина (сахарозная+бетаиновая фракция), полученная от хроматографического фракционирования, сделанного в соответствии с Примером 7, была подвергнута нанофильтрации. Нанофильтрация проводилась с таким же оборудованием, как в Примере 1, мембраной для нанофильтрации была NTR-7450, давление нанофильтрации было 15 бар и другие условия нанофильтрации представлены в Таблице 13. Питание имело DS 8,7%. В операции нанофильтрации пермеат и концентрат (ретентат) регенерировались обратно в питающую емкость (постоянное питание).
Содержание сахарозы и бетаина в пермеате нанофильтрации представлено в Таблице 10.
Условия нанофильтрации и состав пермеата
% от DS
°С
Пример 9: Хроматографическое разделение нанофильтрата
Пермеат, полученный от нанофильтрации в Примере 8, подвергался хроматографическому фракционированию для разделения сахарозы и бетаина. Во фракционировании использовалось опытное последовательное хроматографическое оборудование с SMB. Оборудование состояло из 3 последовательно соединенных колонок, питающего насоса, циркуляционных насосов и насоса для элюентной воды, а также впускных вентилей и вентилей для продуктов для обрабатываемых потоков. Каждая колонка имела высоту 4,0 м и диаметр 0,111 м. Колонки были заполнены сильно кислотной катионообменной смолой в виде геля в Na+-форме, средний размер частиц смолы был 0,35 мм и содержание DVB 5,5%. Температура колонок была 80°C и вода использовалась как элюент. Перед хроматографическим разделением нанофильтрат концентрировался до содержания сухого вещества 51,5%.
Хроматографическое разделение проводилось в 8-ступенчатой последовательности следующим образом (операции а, b и с происходят одновременно).
Ступень 1: Питание накачивалось в колонку 1 и разбавленная фракция вымывалась из колонки 3.
Ступень 2а: Питание накачивалось в колонку 1 и сахарозная фракция вымывалась из колонки 1.
Ступень 2b: Вода подавалась в колонку 2 и разбавленная фракция вымывалась из колонки 3.
Ступень 3а: Питание накачивалось в колонку 1 и сахарозная фракция вымывалась из колонки 1.
Ступень 3b: Вода подавалась в колонку 2 и бетаиновая фракция вымывалась из колонки 3.
Ступень 4: Циркуляция во всех колонках.
Ступень 5: Вода подавалась в колонку 3 и сахарозная фракция вымывалась из колонки 2.
Ступень 6: Циркуляция во всех колонках.
Ступень 7: Вода подавалась в колонку 1 и сахарозная фракция вымывалась из колонки 3.
Ступень 8: Циркуляция во всех колонках.
Объемы и скорости потоков в различных ступенях показаны в Таблице 11.
Объемы (литры) и скорости потоков (литры/час) в ступенях 1-8
Ступени от 1 до 8 повторялись (от 5 до 7 раз), пока не достигалось равновесие. Способ продолжался в равновесном состоянии. Фракции собирались и анализировались посредством HPLC (смола в Na+-форме, 0,8 мл/мин, 0,002 M Na2SO4, 85°C). Концентрация и состав питания и фракций показаны в Таблице 12.
Концентрация и состав питания и собираемых фракций
г/100 мл
% от DS
% от DS
% от DS
Выход сахарозы в хроматографической сепарации был 99,4% и выход бетаина был 100,0%.
Для специалиста в этой области очевидно, что по мере развития техники понятие изобретения может реализовываться различным образом. Изобретение и его варианты осуществления не ограничиваются описанными выше примерами, но могут изменяться в пределах объема формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ БЕТАИНА | 2007 |
|
RU2445969C2 |
| СПОСОБ ФРАКЦИОНИРОВАНИЯ РАСТВОРА, СОДЕРЖАЩЕГО САХАРОЗУ | 1995 |
|
RU2170261C2 |
| СПОСОБ ФРАКЦИОНИРОВАНИЯ РАСТВОРА | 1995 |
|
RU2136345C1 |
| НИЗКОЛАКТОЗНЫЙ И БЕЗЛАКТОЗНЫЙ МОЛОЧНЫЙ ПРОДУКТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2009 |
|
RU2551230C2 |
| НИЗКОЛАКТОЗНЫЙ И БЕЗЛАКТОЗНЫЙ МОЛОЧНЫЙ ПРОДУКТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2009 |
|
RU2550274C2 |
| СПОСОБ ПРОИЗВОДСТВА САХАРА | 2000 |
|
RU2260056C2 |
| СПОСОБ ПОЛУЧЕНИЯ КСИЛОЗЫ И ЦЕЛЛЮЛОЗЫ ДЛЯ ХИМИЧЕСКОЙ ПЕРЕРАБОТКИ | 2009 |
|
RU2512339C2 |
| СПОСОБ ФРАКЦИОНИРОВАНИЯ МЕЛАССЫ | 1994 |
|
RU2140989C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ФОСФОНОМЕТИЛГЛИЦИНА | 2002 |
|
RU2274641C2 |
| ВЫДЕЛЕНИЕ И ОЧИСТКА КОМПОНЕНТОВ СЫВОРОТКИ | 2010 |
|
RU2522491C2 |

Изобретение относится к способу разделения при фракционировании раствора, содержащего бетаин и сахарозу, путем осуществления на указанном растворе хроматографического фракционирования и нанофильтрации и регенерации фракции, обогащенной бетаином, и возможно фракции, обогащенной сахарозой, причем хроматографическое разделение проводят с использованием материала для заполнения колонок, выбираемого из катионообменных смол и анионообменных смол, а нанофильтрация проводится с мембраной для нанофильтрации, выбираемой из полимерных и неорганических мембран, имеющих предельную величину пропускания от 100 до 2500 г/моль. Раствор для фракционирования в соответствии с настоящим изобретением является обычно раствором, полученным из сахарной свеклы, например, раствором черной патоки. 39 з.п. ф-лы, 12 табл., 3 ил.
(b) осуществления нанофильтрации указанной фракции, обогащенной бетаином и сахарозой, с регенерацией фракции, обогащенной бетаином, и, возможно, фракции, обогащенной сахарозой.
(b) осуществления на указанной фракции, обогащенной бетаином, хроматографического фракционирования с регенерацией второй фракции, обогащенной бетаином, и, возможно, остаточной фракции.
(b) осуществление нанофильтрации указанной остаточной фракции с регенерацией фракции, обогащенной сахарозой, и/или фракции, обогащенной бетаином, и возможно одной или более других фракций,
(c) осуществление нанофильтрации указанной фракции, обогащенной сахарозой, с регенерацией второй фракции, обогащенной сахарозой, и/или фракции, обогащенной бетаином, и, возможно, одной или более других фракций,
(d) осуществление нанофильтрации указанной фракции, обогащенной бетаином, с регенерацией второй фракции, обогащенной бетаином, и, возможно, одной или более других фракций.
| СПОСОБ ПОЛУЧЕНИЯ БЕТАИНА И САХАРОЗЫ ИЗ МЕЛАССЫ | 1989 |
|
RU2054045C1 |
| НЕПРЕРЫВНЫЙ СПОСОБ ВЫДЕЛЕНИЯ БЕТАИНА | 1990 |
|
RU2022018C1 |
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| US 4359430 А, 16.11.1982 | |||
| Paananen H | |||
| et al | |||
| Chromatographic separation of components | |||
| Zuckerindustrie, 2000, 125 (12), p.978-981. | |||
Авторы
Даты
2008-01-10—Публикация
2003-06-23—Подача