Область техники
Настоящее изобретение относится к композиции энтеросолюбильного покрытия, содержащего лектин, в частности для экстракта омелы. Изобретение также относится к композиции микрокапсул с энтеросолюбильным покрытием, содержащих лектин в качестве основного ингредиента.
Известный уровень техники
Лектин может быть получен из различных растений, таких как омела, кизил Cornus officinalis, энотера, фасоль обыкновенная, бобы, Liriope muscari, пион, sangryuk, папайя, физалис, todangui, плющ, марь, guallugun, агариковый гриб shitake, Lentinus edodes, Pinellia ternata, самшит, акация, а также различных природных материалов морского происхождения, таких как морские звезды и ильная рыба. В настоящее время многие лектины производятся в промышленных масштабах, и конканавалин A (con А) или лектин фасоли обыкновенной (фитогемагглютинин, РНА), рицин, абрин и т.д. используются во многих исследованиях. Лектин представляет собой гликопротеин или глюкозосвязывающий белок, имеющий более двух участков связывания глюкозы. Он агглютинирует эритроциты и другие кровяные клетки и преципитирует углеводные соединения. Разные биохимические и иммунологические свойства пектина обеспечивают возможность его использования в терапии, диагностике и исследовательских методах биологических наук (Chung et al., Arch. Pharm. Res., vol.40(4): 387-393, 1996).
Одним из наиболее важных биохимических и иммунологических свойств пектина является селективное агглютинирование опухолевых клеток, специфичность по отношению к кровяным клеткам человека, митогенная активность, которая стимулирует дифференцировку лимфоцитов при закупорке и т.д. Лектины, содержащие от 2 до 6 участков связывания глюкозы, имеют В-цепь (связывающая цепь), способную связываться с рецептором клеточной поверхности (специфические углеводы) и, тем самым, обеспечивающую попадание в клетку А-цепи (активная цепь), которая инактивирует рибосомы, приводя к ингибированию белкового синтеза. Связывание углеводов клеточной поверхности с В-цепями аналогично реакции антиген-антитело, и такая специфичность связывания играет важную роль в регулировании иммунной системы или противоопухолевой активности. Сообщалось, что раковые лимфоциты отличаются от нормальных лимфоцитов, способных агглютинироваться пектином, и этот факт послужил основой для проведения исследований изменения мембран раковых клеток при использовании лектина. При взаимодействии лектина с лимфоцитами, ранее дифференцированные лимфоциты делятся и пролиферируют до лимфобластов.
Одной из иммунологических особенностей физиологической активности лектина является митогенная активность по отношению к лимфоцитам. В зависимости от типа лектина, он стимулирует Т- или В-клетки. Механизм для Т-клеток заключается в том, что лектин стимулирует макрофаги секретировать интерлейкин-1 (IL-1) и, тем самым, активирует секрецию IL-2 хелперными Т-клетками для пролиферации Т-клеток. Механизм В-клеток заключается в том, что лектин оказывает непосредственное действие или хелперные Т-клетки секретируют интерферон-γ (IFN-γ), IL-4, IL-5 и IL-6, способствуя пролиферации В-клеток.
Во-вторых, наблюдается противоопухолевая активность. Как рост популяции одной клетки вызывается антителом, активированным антигеном раковой клетки, так лектин ингибирует рост раковых клеток за счет ингибирования белкового синтеза (Vieta et al., Science, 219: 644, 1983), макрофаги или многоядерные лейкоциты лизируют раковые клетки, содержащие лектин (Ohkuma et al., Cancer Res., 45, 4397, 1985). Был также описан механизм противоопухолевой активности цитокинов (IFN-γ, IL-2, TNF-α), секретируемых Т-клетками или макрофагами, активируемыми лектином (Tamura et al., FEBS Lett., 175:325-328, 1984).
Кроме того, лектин проявляет инсулиноподобную активность. Описаны связывание с инсулиновым рецептором адипоцитов с промотированием транспорта и метаболизма глюкозы, промотирование липогенеза и пируватдегидрогеназная активность, промотирование синтеза гликогена и Mg-АТФазная активность, ингибирование липолиза и аденилатциклазная активность лектина (Suya et al., J. Biochem. 92: 1251-1257, 1982).
Тем не менее, как указывалось выше, несмотря на то, что лектин, содержащийся в природных источниках, проявляет разные виды физиологической активности, мы теряем ценные свойства лектина вследствие расщепления в малой кишке пектинового белка на аминокислоты, всасываемые в систему кровообращения (Pusztai A. Lectins. Toxicants in plant origin, Vol.III, 1987).
Омела (Viscum album), одно из лектинсодержащих растений, в течение длительного времени используется для лечения рака и проявляет незначительное количество побочных эффектов, обладая в то же время прекрасной противоопухолевой активностью (Hajto et al., Cancer Research, 50: 3322-3326, 1990; Jassen et al., Drug Research, 43 (11); 1221-1227, 1993; Am. Soc. Biochem. and Molec. Biol. 267 (33); 23722-23727, 1992). Сообщалось, что это растение эффективно непосредственно уничтожает раковые клетки и обеспечивает комплексный эффект активации иммунитета, стимулирования гуморального и клеточно-опосредованного иммунитета, активации макрофагов и природных клеток-убийц (NK), ингибируя раковые клетки и повышая показатели выживаемости онкологических пациентов (Jassen et al., Drug Research, 43 (11): 1221-1227, 1993).
Это растение содержит лектин с молекулярным весом 60 кДа, вискотоксин, полисахариды, другие активные факторы, причем лектин является наиболее эффективным компонентом (Bussing et al., Cancer Lett., 92: 199-205, 1995; Cancer Lett., 99: 59-72, 1996; Jung et al., Cancer Letters, 51: 103-108, 1990). Противоопухолевые эффекты, создаваемые противоопухолевыми средствами, индуцируют гибель или ингибируют аномальный рост опухолевых клеток. Цитотоксичность омелы по отношению к опухолевым клеткам и лейкоцитам является результатом индуцирования апаптоза, и сообщалось, что только лектин может индуцировать этот процесс (Bussing et al., Cancer Lett., 94: 199-205, 1995; Cancer Lett., 99: 59-72, 1996).
Сообщалось также, что корейская омела (Viscum album L. coloratum), разновидность европейской омелы, превосходит европейскую омелу по своей эффективности, но была недостаточно исследована (Park et al., Arch. Pharm. Res., vol. 38 (4): 418-424, 1994; Arch. Pharm. Res., vol. 39 (1): 24-30, 1995; Arch. Pharm. Res., 20 (4): 306-312, 1997; Arch. Pharm. Res., 21 (40): 429-435, 1998; Foods and Biotechnology, 8 (4): 232-237, 1999).
Авторы настоящего изобретения экстрагировали лектин из корейской омелы, и оказалось, что она обладает цитотоксичными свойствами, аналогичными европейской омеле, теряя эту активность при удалении лектина из экстракта омелы (Park et al., Food Sci. and Biotechnol., 8: 391-396, 1999; Foocte and Biotechnol., 8 (4); 232-237, 1999). Кроме того, они проанализировали гены и аминокислотные последовательности и методом хроматографии на колонке экстрагировали чистый лектин, который, как оказалось, повышает иммунитет и обладает противоопухолевым действием, и подали патентную заявку (корейская патентная заявка №2000-83383) на ELLA (иммуноферментный анализ на лектин), который используется для определения концентрации лектина омелы. Кроме того, водный экстракт омелы обладает небольшим количеством побочных эффектов и эффективно ингибирует метастазирование всех видов рака, включая рак кожи. Более того, они разработали обогащенный пектином экстракт омелы и содержащую его противоопухолевую композицию, использующую цитотоксичность, вызванную апоптозом, антиангиогенез, ингибирование пектином теломеразной активности, и подготовили и подали заявку на патент (корейская патентная заявка №2001-0061118) на лекарственное средство, которое может наноситься непосредственно на пораженный участок кожи или опухоль полости рта.
Несмотря на то, что основным фактором противоопухолевого эффекта является лектин, производимые в настоящее время лекарственные средства на основе омелы представляют собой сложные смеси водных экстрактов, и утверждается, что они более эффективны, чем один лишь лектин. Это связано с тем, что другие соединения, такие как вискотоксин, алкалоид и другие, проявляют вместе синергические эффекты. В частности, сообщалось, что вискотоксин 5 кДа также обладает противоопухолевым действием (Schaller et al., Phytotherapy Res., 10: 473-477). Другой причиной может быть то, что лектин в комплексных соединениях более стабилен, чем лектин в чистом виде.
Таким образом, омела проявляет эффективную противоопухолевую активность без побочных эффектов. Поэтому, если возможна доставка оральным путем, она может широко использоваться для лечения и профилактики рака. Сообщалось, что при введении лектина перорально в дозах, в 10-1000 раз превышающих дозы при подкожной инъекции (0,05 мг - 3 мг/кг веса тела), он сильно связывается с М-клетками пейеровых бляшек, ингибирует рост опухолевых клеток, промотирует секрецию цитоксина TNF-α, IL-1β и т.д. (Pusztai et al., J. Nutr. Biochem., 9: 31-36, 1998). Однако прием высоких доз лектина с учетом расстройства пищеварительной системы неэкономичен, а другие соединения, не перевариваемые в кишечнике, могут давать побочные эффекты. Таким образом, несмотря на то, что экстракт омелы мог бы широко использоваться для лечения и профилактики опухолей, был разработан только препарат для инъекций, что не позволяет широко его использовать.
Пероральное введение преимущественно используется при изготовлении лекарственных средств, и для проявления своего действия препарат должен пройти через барьеры и попасть в кровообращение. Перорально введенный препарат проходит по пищеводу и кишечнику, растворяясь и выделяя лекарственные вещества. Пищеварительная система человека имеет в длину несколько метров, и для прохождения по ней требуется много времени. В процессе прохождения, рН в пищеварительном тракте меняется от кислотного до нейтрального и слабощелочного, и лекарственный препарат подвергается воздействию разных ферментов и содержимого кишечника. При этом лекарственное средство растворяется до молекул и всасывается через слизистые оболочки пищеварительной системы. Большая часть лекарственных средств поступает в печень по брыжеечной вене желудка и создает первичный проходящий эффект. Таким образом, вследствие нестабильности в кишечнике или низкой проницаемости через слизистую оболочку, трудно разработать лекарственное средство для перорального приема. В частности, при оральном введении, белок или пептиды, такие как инсулин, интерферон и гликопротеины, такие как пектин, расщепляются на аминокислоты или малые пептиды. Пептиды в эпителии малой кишки, быстро разлагаемые до аминокислот аминопептидазой, всасываются в кровообращение. Вследствие этого, использование орального метода введения приводит к ослаблению действия препарата.
В данном случае, мы можем повысить стабильность лекарственного средства в кишечнике для улучшения всасывания. Во-первых, лекарственное средство не должно растворяться в желудочном соке. Поэтому были разработаны лекарственные средства с энтеросолюбильным покрытием во избежание разложения инкапсулированных лекарственных средств под действием кислоты или пепсина. Лекарственные средства с энтеросолюбильным покрытием (таблетка или гранула) не растворяются при кислотном или нейтральном рН, но при поступлении в кишечник растворяются в щелочных кишечных соках, и поэтому могут селективно высвобождать лекарственные вещества. Кроме того, для решения проблемы разложения пытались использовать систему, содержащую ингибиторы протеиназы (например, апротинин, ингибитор соевого трипсина, бестатин и т.д.) (Drug Delivery Rev., 4: 171, 1990).
В общем, низкомолекулярные соединения (с молекулярным весом (MW) менее 5000), присутствующие в межклеточном пространстве, могут проходить по капиллярным сосудам, поступая в циркуляцию. Наоборот, высокомолекулярные соединения, частицы и вещества, образующие большие хиломикроны вследствие своих липофильных свойств, слишком велики для прохождения по капиллярам, чтобы они могли пройти через слизистые оболочки и попасть в лимфатические сосуды и в организм. В кишечной слизистой оболочке имеется небольшое количество пейеровых бляшек, которые содержат М-клетки (складчатые клетки) и лимфатические системы. Однако лимфоток составляет 1/200-1/500 от кровотока, поэтому трудно достичь всасывания лекарственного средства в лимфатические сосуды. Определенные соединения, такие как витамин А, липиды, такие как холестерин, витамин В12 и его производные, лектинсодержащие соединения, липосомы и ультрамикрочастицы (диаметр менее 10 мкм) и другие, не проходят через М-клетки в лимфатические сосуды, а попадают непосредственно в кровеносные сосуды. Поэтому, если мы обеспечим проницаемость этих соединений через стенку кишечника, они могут быть использованы в качестве носителей для лимфатических сосудов.
Если лекарственное средство способно всасываться в лимфатическую систему, то оно сначала проходит по кишечному лимфатическому сосуду и торакальному лимфатическому сосуду в кровеносный сосуд в обход печени. Поэтому, если мы обеспечим проницаемость лектина через слизистую оболочку, то он будет проходить через М-клетки в пейеровых бляшках и по лимфатическому сосуду прямо в кровеносный сосуд в обход печени, что позволяет использовать его в качестве носителя для лимфатических сосудов. В частности, лимфатическая система образует проходы для раковых метастаз или бактериальной инфекции, так что лимфатические узлы могут быть причиной болезни. Вследствие этого, лектин может быть использован для селективной доставки противоопухолевых препаратов или антибиотиков к лимфатическим узлам для лечения или диагностики.
Лекарственное средство готовят так, чтобы оно было удобным для применения и обеспечивало максимальную эффективность. После его приема лекарственное вещество высвобождается, а затем, в процессе всасывания, распределения, метаболизма и выведения, оно оказывает лечебное действие. Для обеспечения более стабильного и эффективного действия нам необходим способ контроля действия лекарственного средства. Система доставки лекарственных средств (DDS) предназначена для снижения побочных эффектов и усиления эффектов, способствующих доставке требуемого количества лекарственного средства. Система с контролируемым высвобождением включает капсулы для перорального введения, матричный стилет, микрокапсулы для перорального введения или инъекции, микросферы, микрочастицы, наночастицы, липосомы, имплантаты и другие.
Микрокапсулы могут быть описаны по-разному в зависимости от их формы и размера. Конкретнее, микрокапсула представляет собой частицу сферической формы, в центральном ядре которой размещены твердые или жидкие лекарственные вещества, а микросфера представляет собой многоядерную микрокапсулу, содержащую распределенные твердые или жидкие лекарственные вещества. Кроме того, микрочастицы включают как микрокапсулы, так и микросферы и в зависимости от типа частицы носитель содержит высокомолекулярную матрицу или липидные частицы. Некоторые из них имеют диаметр менее 1 мкм и называются наносферами (или наночастицами). В дальнейшем, за исключением случаев использования других значений, эти термины имеют указанные выше значения.
Липосомы имеют строение, аналогичное мембранам, и поэтому используются в системах доставки лекарственных средств для обеспечения их функционирования. Липосомы включают фосфолипиды, растворенные в организме и не обладающие цитотоксичностью, и благодаря своим амфифильным свойствам удерживают как гидрофильные, так и гидрофобные лекарственные вещества. Кроме того, они удерживают лекарственные вещества в своей центральной части, ингибируя инактивацию лекарственного вещества, повышают степень использования лекарственного вещества в пептидной форме, позволяют вводить любой вид лекарственного вещества почти любым из каналов доставки, обеспечивают целевую доставку в специфические ткани для усиления лечебного действия. Липосомы могут быть разделены на многослойные везикулы (MLV), имеющие бислой с многочисленными складками, и однослойные везикулы, имеющие однослойную структуру, причем указанные однослойные везикулы могут быть классифицированы на малые однослойные везикулы (SUV), большие однослойные везикулы (LUV) и другие, в зависимости от размеров. SUV имеют размеры 20-50 нм, а LUV-100-1000 нм.
Твердофазно-липидные наночастицы (SLN) представляют собой наночастицы систем оральной доставки, предназначенные для введения гидрофобных лекарственных веществ. По сравнению с высокомолекулярными частицами или липосомами, они повышают химическую стабильность захваченных лекарственных веществ, контролируют высвобождение лекарственного вещества и ингибируют агрегацию частиц.
Микрокапсулирование представляет собой методику, по которой на мелкие твердые или жидкие частицы наносятся различные материалы покрытия или обрабатывают смеси с размерами частиц от 0,1 мкм до сотен микрон. Другими словами, микрокапсула представляет собой частицу, полученную с помощью специальных реакций или приемов с целью инкапсулирования лекарственных веществ, материалов покрытия, добавок и растворителей. Таким образом, мы можем капсулировать твердые вещества, жидкости, газы в микроскопическом масштабе.
При микрокапсулирования белков они подвергаются чрезмерным нагрузкам. Белки имеют высокий молекулярный вес и, поскольку их активность и физические свойства зависят от трехмерной структуры, имеют большую склонность к денатурированию, чем другие химически синтезированные лекарственные вещества. Поэтому в процессе микрокапсулирования белковые лекарственные вещества должны быть защищены от воздействия избыточного тепла, сдвиговых нагрузок, резких изменений рН, органических растворителей, замораживания, высыхания. Кроме того, микрокапсулированный белок может гидратироваться при хранении, что легко приводит к агрегации, денатурации и инактивации. Вследствие этого, необходимо использовать биодеградирующие полимеры, денатурация должна быть заблокирована, а эффективность инкапсулирования при изготовлении микрокапсул, содержащих белки или пептиды, должна быть достаточно высокой. Кроме того, должны обеспечиваться простота технологии, минимальное использование органических растворителей и возможность массового производства.
Используются различные методы микрокапсулирования, так что вещество сердцевины и размер готовых частиц зависят от процесса. Используемые в процессе вещества являются различными синтетическими и природными высокомолекулярными соединениями. Используются также высокомолекулярные вещества, разлагающиеся в организме, такие как альбумин, желатин, коллаген, фибриноген, альгинат, крахмал, полиаминокислоты, полилактиды (PLA), полигликолиды (PGA), поли-D-оксимасляная кислота (РНВ), поликапролактон, полиангидриды, полиортоэфиры и PLGA, представляющие их смеси. Кроме того, используются методы распыления в воздухе, разделения фаз, разбрызгивания, разбрызгивания через сопло под действием центробежной силы (orifice/centrifugal method), сверхкритических жидкостей, обваливания, выпаривания растворителя, распылительной сушки и коагуляции, поверхностной полимеризации, охлаждения расплавов.
Метод выпаривания растворителя многократных эмульсий заключается в растворении высокомолекулярного растворителя в летучем органическом растворителе (OS), в котором растворено лекарственное вещество, в дистиллированной воде или буферном растворе (внутренняя водная фаза: IWP) без смешения с водой. После эмульгирования IWP в органическом растворителе и приготовления первичной эмульсии ("вода в масле", W/O) ее выливают в эмульгатор, содержащий внешнюю водную фазу (OWP) и перемешивают для получения вторичной эмульсии ("вода в масле в воде", W/O/W). Непрерывно перемешивают эту многократную эмульсию и выпаривают органический растворитель, индуцируя осаждение высокомолекулярного компонента и получая в результате микрочастицы, содержащие лекарственное вещество. Эмульгатор в OWP играет важную роль в образовании сферических микрочастиц. Он необходим для предотвращения коагуляции частиц при выпаривании органических растворителей.
Как правило, в качестве эмульгатора используют поливиниловый спирт (PVA), но может быть использован также поливинилпирролидон, альгинаты, метилцеллюлоза, желатин. Органические растворители могут быть удалены при нормальном или пониженном давлении.
Наиболее распространенным способом доставки лекарственных средств является пероральное введение. Однако его сложно обеспечить вследствие нестабильности при переваривании в кишечнике или низкой проницаемости слизистой оболочки. Например, инсулин, интерферон и другие белки или пептиды, гликопротеины, такие как пектин, расщепляются до аминокислот или малых пептидов. Можно сказать, что лекарственные средства для орального введения растворяются и высвобождают свои лекарственные вещества, проходя по пищеварительной системе вследствие изменения рН в пищеварительной системе от кислотного до нейтрального и основного, а также контакта с разными ферментами. Пептиды, попадающие в эпителиальные клетки малой кишки, разлагаются на аминокислоты под действием аминопептидазы и всасываются в кровообращение переносчиками аминокислот. Таким образом, белки теряют свою функцию.
Вследствие этого природные вещества пектина при оральном введении не могут широко использоваться несмотря на их применение в лечебных целях. В этом случае, мы можем улучшить всасывание путем повышения стабильности лекарственных веществ в пищеварительной системе. С этой целью были разработаны различные лекарственные средства с энтеросолюбильным покрытием для предотвращения разложения в желудке и воздействия кислоты и пепсиноподобных белков. Лекарственные средства с энтеросолюбильным покрытием (таблетки или гранулы) выдерживают низкие рН в желудке и затем растворяются в кишечнике под действием высоких рН, селективно высвобождая лекарственные вещества. Энтеросолюбильное покрытие может наноситься не только на таблетки, но и на гранулы, а толщина покрытия может регулироваться. Для получения энтеросолюбильного покрытия используют шеллак, фталат гидроксипропилметилцеллюлозы, поли(винилацетат-фталат), ацетат-фталат целлюлозы, зеин, Eudragit L100, S100, альгинат, желатин, крахмал и другие вещества в чистом или смешанном виде. Существует много способов нанесения покрытий, таких как использование аппарата для нанесения покрытий с крыльчатой мешалкой, устройства для нанесения покрытий в псевдоожиженном слое, метод нанесения покрытия набрызгиванием, метод нанесения порошкообразного покрытия с использованием статического электричества, сухое нанесение покрытий, нанесение покрытий из расплава и других, которые могут использоваться по отдельности или в сочетаниях.
Вследствие этого настоящее изобретение предусматривает способ получения таблеток или гранул, содержащих экстракт омелы и лектин, которые трудно ввести пероральным путем, и получения лекарственных средств с энтеросолюбильным покрытием путем нанесения покрытия на таблетки или гранулы с использованием средств нанесения покрытий и пластификаторов при низких температурах. Более того, настоящее изобретение предусматривает способы получения микрокапсул с двойным энтеросолюбильным покрытием после получения лектинсодержащих микрокапсул.
Краткое описание чертежей
На Фигуре 1 приведена фотография поверхностной структуры микрокапсулы с двойным слоем соли альгиновой кислоты.
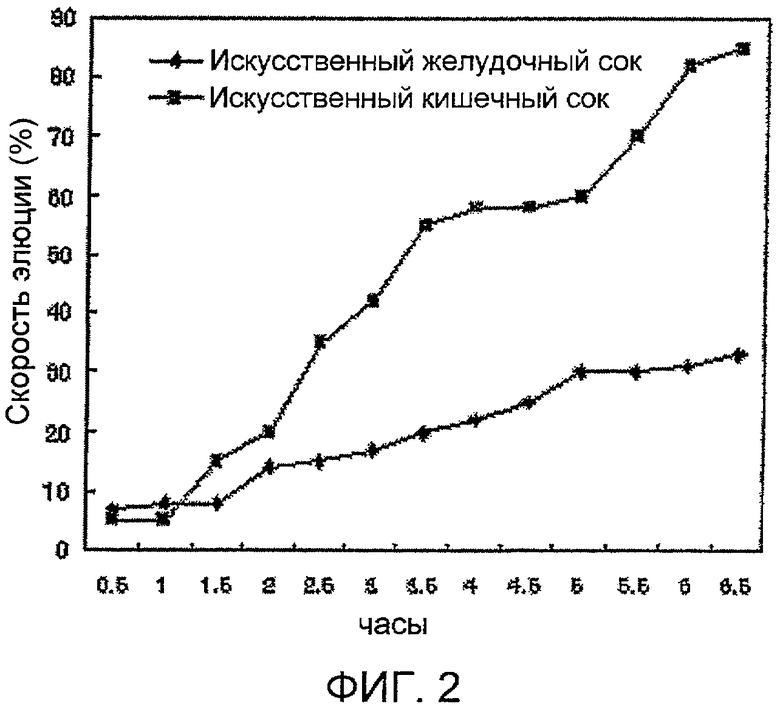
Фигура 2 показывает скорость элюции экстракта омелы, содержащего лектин, из микрокапсулы с двойным слоем альгиновой кислоты.
Раскрытие изобретения
Техническая задача
Целью настоящего изобретения является создание эффективной композиции лекарственного средства с энтеросолюбильным покрытием на основе экстракта омелы, содержащего лектин, и эффективной композиции микрокапсул с энтеросолюбильным покрытием, содержащим лектин в качестве основного ингредиента.
Техническое решение
Настоящее изобретение осуществляется путем получения эффективной композиции лекарственного средства с энтеросолюбильным покрытием на основе экстракта омелы, содержащего лектин, и получения эффективной композиции микрокапсул с энтеросолюбильным покрытием, содержащих лектин в качестве основного ингредиента.
Эксципиент для лекарственного средства с энтеросолюбильным покрытием на основе экстракта омелы, содержащего лектин, включает маннит в качестве эксципиента - 115 г, микрокристаллическая целлюлоза Avicel PH 101 (фирма FMC BioPolimer, США) - 18 г, двузамещенный фосфат кальция - 17 г, гидроксипропилметилцеллюлозу в качестве раствора связующего - 20 г, воду -100 мл, этанол - 100 мл, экстракт кукурузного белка зеин Zein-DP (фирма Showa Sangyo Co., Ltd. Япония) в качестве раствора для нанесения покрытия - 25 г, шеллак - 35 г, 80% этанол - 180 мл.
Кроме того, микрокапсулы с энтеросолюбильным покрытием, содержащие лектин в качестве основного ингредиента, включают PLGA/CH2Cl2 - 4 мл, 1% поливиниловый спирт - 50 мл, Span 80 - 2 мл в качестве поверхностно-активного агента, пищевое масло - 48 мл, 1-4% раствор альгината натрия - 8 мл, 0,02-0,2М раствор CaCl2 - 60 мл.
Энтеросолюбильное покрытие для экстракта омелы, содержащего лектин, было получено с использованием специальных материалов покрытия, взятых по отдельности или в сочетаниях, таких как шеллак, фталат гидроксипропилметилцеллюлозы (НРМСР, Pharmacoat 606, Pharmacoat 645), поли(винилацетат-фталат), ацетат-фталат целлюлозы, зеин, Eudragit L100, Eudragit S100, альгинат, желатин, крахмал и другие. Для нанесения покрытия использовались, по отдельности или в комбинациях, разные процессы, например, аппарат для нанесения покрытий с крыльчатой мешалкой, устройство для нанесения покрытий в псевдоожиженном слое, нанесение покрытия набрызгиванием, сухое нанесение покрытий, нанесение покрытий из расплава и другие.
Экстракт омелы, содержащий лектин, предпочтительно составляет 1-95 весовых процентов (%) от целой частицы с покрытием. Раствор для нанесения покрытия получают путем растворения реагента для нанесения покрытия и пластификатора в пригодном растворителе. Реагенты для нанесения покрытия в данном процессе используются по отдельности или в сочетаниях и включают сополимер метакриловой кислоты Eudragit (зарегистрированный товарный знак) Е-100, Eudragit L3D (фирма Rohm & Haas, Германия), экстракт кукурузного белка (Zein-DP) и искусственно полученные продукты, например, альгинат натрия, альгиновую кислоту, шеллак, карбоксивинильный полимер (карбомер (зарегистрированный товарный знак)), фталат гидроксипропилметилцеллюлозы, ацетатсукцинат гидроксипропилметилцеллюлозы, гидроксипропилметил-ацетатсукцинат, карбоксиметилцеллюлозу, ацетат-фталат целлюлозы, гидроксипропилцеллюлозу, этилцеллюлозу, метилцеллюлозу, поли(винилацетат-фталат), соевый белок, пшеничный белок, продукты переработки соевого или пшеничного белка, хитин, хитиновую кислоту, продукты переработки хитина или хитиновой кислоты, желатин, каррагенан, пектин, гуаровую смолу, смолу рожкового дерева, ксантановую смолу, геллановую смолу, гуммиарабик, сополимер метакриловой кислоты и этилакрилата Kollicoat МАЕ 30 DP (фирма BASF, Германия), триглицериды со средней длиной цепи, содержащие 6-12 атомов углерода. Реагент для нанесения покрытия, предпочтительно, составляет 1-50 мас.% от частицы с покрытием.
Пластификатор в настоящем изобретении используется в виде индивидуального вещества или смеси, включающей полиэтиленгликоль, сложные эфиры глицерина и жирных кислот, сложные эфиры сорбитана и жирных кислот, пропиленгликоль, глицерин, триэтиллимонную кислоту, триацетин, цетиловый спирт, стеароиловый спирт, причем доля пластификатора, предпочтительно, составляет 0,5-50 мас.%. Если вышеуказанный реагент для нанесения покрытий и пластификаторы используются в количестве, выходящем за указанные пределы, то растворимость частиц с покрытием уменьшается, что приводит к нестабильности покрытия и запаздыванию действия лекарственного средства.
Растворитель в настоящем изобретении используется в виде индивидуального вещества или смеси и включает воду, этанол, спирт (метанол, изопропиловый спирт), ацетон, ацетонитрил, метиленхлорид, эфир, нуклеотиды, хлороформ, 1,4-диоксан, тетрагидрофуран, диметилсульфоксид, этилацетат, метилацетат.
Эксципиент по настоящему изобретению представляет собой маннит, крахмал, лактозу, некристаллическую целлюлозу, легкую безводную кремнекислоту, двузамещенный фосфат кальция, натрия кроскармеллозу Ac-di-sol (фирма FMC BioPolymer, США), поливинилпирролидон (PVP) K-30 и другие, причем доля эксципиента, предпочтительно, составляет 0,5-90% мас. от частицы с покрытием.
Для приготовления лекарственного средства с энтеросолюбильным покрытием необходимы установка с псевдоожиженным слоем, высокоскоростной смеситель, гранулятор цилиндрического типа. Из аппаратуры необходимы установка для нанесения покрытий с псевдоожиженным слоем, CF-гранулятор и особенно, в соответствии с настоящим изобретением, установка для нанесения покрытий с псевдоожиженным слоем Granula-40 (Freund Co., Япония), которая аналогична указанным выше использованным устройствам; могут быть использованы другие подобные устройства.
Температура аппарата, необходимая для получения гранул с энтеросолюбильным покрытием, составляет 35-70°С. Кроме того, внутри аппарата на всех технологических стадиях температура, предпочтительно, составляет 25-60°С, поскольку ниже 25°С гигроскопичные гранулы агрегируют, а выше 60°С гранулы разрушаются при введении в процесс или при формовании. При этом нормальная температура для нанесения покрытия зависит от времени года и должна контролироваться, например, во время сезона дождей или зимой температура должна поддерживаться немного выше, а летом - немного ниже.
Кроме того, для микрокапсулирования пектинового белка используется метод двойной эмульсии. Могут быть использованы способные разлагаться высокомолекулярные вещества, например, альбумин, желатин, коллаген, фибриноген, полилактид (PLA), полилактид-ко-гликолид(PLGA)-подобные оксикислоты, полилактид-ко-гликолиды (PLGA), ПЭГ, полиоксимасляная кислота (РНВ), поликапролактон, полиангидриды, полиортоэфиры, полилактид-ко-гликолиды (PLGA), полиуретан, полибутилаты, поливалераты, полилактид-ко-капролактон и его производные, сополимеры или смеси. Слово "производные" означает высокомолекулярные соединения, способные трансформироваться за счет взаимодействия химических групп, таких как алкил или алкилен. В общем, биодеградирующие высокомолекулярные соединения подвергаются как ферментативному, так и неферментативному гидролизу, приводящему к поверхностной или объемной эрозии.
Ниже описано микрокапсулирование пектина с использованием процедуры выпаривания растворителя двойной эмульсии.
Прибавляют раствор пектина к раствору высокомолекулярного соединения (например, PLGA/дихлорметан (DCM)) для получения первичного эмульсионного раствора и медленно прибавляют его к эмульгатору (например, 1% раствор ПВА), получая в результате вторичный эмульсионный раствор. После этого перемешивают до отверждения высокомолекулярного соединения, центрифугируют для выделения частиц, и трижды промывают водой для получения микрокапсул.
Композиция с контролируемым выделением лектина может включать фармакологически приемлемые эксципиенты, носители или добавки. Она также может быть изготовлена в виде композиции для введения ингаляцией, для перорального введения, для инъекции, для всасывания через склеру. Кроме того, используя преимущества ранее известной технологии формования, может быть получена композиция с контролируемым выделением лектина с использованием микрокапсул (например, кристалл (crystal)/PLGA).
Кроме того, методом обращеннофазового выпаривания (REV), а именно путем ультразвуковой обработки системы, представляющей собой раствор лектина в фосфатидилхолине, растворенном в эфире и буферном растворе, для испарения эфира, получают липосомы.
Микрокапсулы с двойным энтеросолюбильным покрытием, содержащие лектин, получают также путем нанесения на вышеупомянутые микрокапсулы или липосомы покрытия из соли альгиновой кислоты, стабильной в желудке, но разлагающейся в кишечнике.
Приведенные ниже примеры детально описывают настоящее изобретение.
Однако приведенные примеры не определяют объем изобретение и могут быть модифицированы рядовым специалистом в данной области техники в пределах, определяемых технологией и пунктами формулы настоящего изобретения.
Кроме того, приведенные ниже примеры описывают изобретение, но не ограничивают объем притязаний.
Полезные эффекты
Настоящее изобретение направлено на получение эффективной композиции лекарственного средства с энтеросолюбильным покрытием на основе экстракта омелы, содержащего лектин, и на получение эффективной композиции микрокапсул с энтеросолюбильным покрытием, содержащих лектин в качестве основного ингредиента. Была решена связанная с пероральным введением проблема нестабильности в пищеварительной системе и повышена эффективность лекарственного средства и эффективность лечения, что является положительным эффектом с точки зрения медицины.
Наилучший способ осуществления изобретения
Пример 1: Получение лектинсодержащего порошкообразного экстракта омелы, водного экстракта, порошка водного экстракта.
Помимо омелы, лектин может быть получен из различных растений, таких как кизил Cornus officinalis, энотера, фасоль обыкновенная, бобы, Liriope muscari, пион, sangryuk, папайя, физалис, todangui, плющ, марь, guallugun, агариковый гриб shitake, Pinellia temata, самшит, акация, а также различных природных материалов морского происхождения, таких как морская звезда и ильная рыба, однако в настоящем изобретении использовалась омела, как описано ниже.
Распределяют побеги омелы на листья, плоды и стебли и промывают дистиллированной водой, а затем лиофилизируют или высушивают в хорошо проветриваемом помещении при температуре ниже 35°С. Порошок получали при температуре ниже 35°С с помощью валковой дробилки, шаровой мельницы и других мельничных машин или дробилок. Кроме того, свежую омелу замораживают жидким азотом таким же образом. Размер частиц контролируют в зависимости от назначения. Было определено, что 1 мг порошка содержит 92 нг лектина (VCA).
Экстракт получали по методике (корейская патентная заявка №2000-83383 и 2001-0061118), разработанной автором настоящего изобретения. Промывают каждую порцию листвы, плодов и стеблей и хранят их при -70°С. Прибавляют к материалу 10-кратное количество воды при измельчении и перемешивают при 4°С в течение 24 часов. Фильтруют смесь через марлю, центрифугируют при 12000 об./мин в течение 30 минут, фильтруют супернатант через мембранные фильтры 20 мкм, 0,45 и 0,22 мкм для удаления бактерий и прибавляют стерилизованный фосфатно-солевой буфер (PBS) для доведения концентрации раствора до 100 мг/мл. 100 мг/мл означает, что 1 мл раствора содержит 100 мг экстракта омелы, а при количественном анализе методом ELLA (иммуноферментное детектирование пектина) в 1 мл VCE с концентрацией 1 мг/мл содержится 30 нг пектина (VCE). Раствор, также профильтрованный через указанный выше мембранный фильтр, лиофилизуют, получая коричневый порошок.
Экстракт корейской омелы (Viscum album L. var. coloratum), содержащий пектин (VCA), получали описанным выше методом (корейская патентная заявка №2000-83383 и 2001-0061118), очищали с помощью асиалофетуин-сефарозы, и измеряли концентрацию методом ВСА, а также активность лектина с помощью реакций агглютинирования кровяных клеток.
Пример 2: Процесс формования гранул
<Пример 2-1>
Гранулированную затравку, изготовленную из смеси целлюлоза : крахмал : сахар : желатин = 30:30:30:10, смешивают с описанными выше экстрактом омелы или раствором лектина с помощью гомогенизатора Уоринга. Влажную массу высушивают при 4°С, вакуумируют, размалывают до частиц требуемой дисперсности, пропускают через сито и хранят при 4°С под вакуумом.
<Пример 2-2>
Смешивают лектин в виде порошка или порошка водного экстракта по примеру 1-150 г, маннит в качестве эксципиента - 115 г, Avicel PH 101-18 г, двузамещенный фосфат кальция - 17 г, ожижают в устройстве для нанесения покрытий с псевдоожиженным слоем и разбрызгивают связующий раствор (гидроксипропилметилцеллюлоза 20 г, вода 100 мл и этанол 100 мл) для получения затравочных гранул с покрытием. В качестве эксципиента использовали маннит, крахмал, лактозу и воду, или глюкозу и PV К-30, Avicel и воду, или лактозу, маннит, Ac-di-sol, гидроксипропилцеллюлозу и 70% этанол, или крахмал, лактозу, альгинат натрия и воду, или маннит и белый сахар, смешанные в соответствующих пропорциях. Омела и эксципиент внутри устройства для нанесения покрытий должны находиться при температуре 25-50°С. Температура подаваемого воздуха составляла 35-70°С, а скорость вращения ротора - 100-350 об./мин.
Пример 3: Процесс нанесения энтеросолюбильного покрытия
<Пример 3-1>Процесс нанесения на гранулы энтеросолюбильного покрытия
В качестве затравки используют гранулы по примеру 2, которые ожижают в устройстве для нанесения покрытия с псевдоожиженным слоем и разбрызгивают раствор для нанесения покрытия (Zein-DP 25 г, шеллак 35 г, 80% этанол 180 мл). Температуру материалов внутри устройства поддерживают в интервале 25-60°С, температуру подаваемого воздуха - 35-70°С, а скорость вращения ротора составляет 100-350 об./мин.
Реагенты для нанесения покрытия в данном процессе применяют в виде индивидуальных веществ или в смеси, используя сополимер метакриловой кислоты Eudragit (зарегистрированный товарный знак) Е-100, Eudragit L3D (фирма Rohm & Hass, Германия), экстракт кукурузного белка (Zein-DP) и искусственные продукты переработки, полученные на основе, например, альгината натрия, альгиновой кислоты, шеллака, карбоксивинилполимера (карбомера (зарегистрированный товарный знак)), фталата гидроксипропилметилцеллюлозы, ацетатсукцината гидроксипропилметилцеллюлозы, гидроксипропилметилацетат-сукцината, карбоксиметилцеллюлозы, ацетат-фталата целлюлозы, гидроксипропилцеллюлозы, этилцеллюлозы, метил целлюлозы, поли(винилацетат-фталата), соевого белка, пшеничного белка, продуктов переработки соевого или пшеничного белка, хитина, хитиновой кислоты, продуктов переработки хитина или хитиновой кислоты, желатина, каррагенана, пектина, гуаровой смолы, смолы рожкового дерева, ксантановой смолы, геллановой смолы, гуммиарабика, Kollicoat МАЕ 30 DP (фирма BASF), триглицеридов со средней длиной цепи, содержащих 6-12 атомов углерода. Реагент для нанесения покрытия, предпочтительно, составляет 1-50 мас.% от веса гранул с покрытием.
После получения первичных гранул с покрытием с использованием одной из перечисленных выше композиций, получают гранулы с двойным покрытием с использованием другого раствора для нанесения покрытия.
<Пример 3-2> Процесс нанесения энтеросолюбильного покрытия на таблетки
Сухой растительный порошок или порошок растительного экстракта и сухой порошок лектина и порошок эксципиента, пропускают через сито 48 меш (размер отверстий около 320 микрон) для получения смеси с требуемым соотношением компонентов и добавляют 5 мг стеарата магния в качестве смазывающего агента, равномерно перемешивают и прессуют в таблетки. В качестве эксципиента для прямого сухого прессования используют различные производные гидроксипропилметилцеллюлозы (НРМС) и этилцеллюлозы (ЕС), метилцеллюлозы (МС) и другие.
Реагенты для нанесения покрытия по данному способу используют в виде индивидуальных веществ или в смеси, используя для этого сополимер метакриловой кислоты Eudragit (зарегистрированный товарный знак) Е-100, Eudragit L3D (фирма Rohm & Haas, Германия), экстракт кукурузного белка (Zein-DP) и искусственные продукты переработки, такие как альгинат натрия, альгиновая кислота, шеллак, карбоксивинилполимер (карбомер (зарегистрированный товарный знак)), фталат гидроксипропилметилцеллюлозы, ацетатсукцинат гидроксипропилметилцеллюлозы, гидроксипропилметилацетат-сукцинат, карбоксиметилцеллюлоза, ацетатфталат целлюлозы, гидроксипропилцеллюлоза, этилцеллюлоза, метилцеллюлоза, поли(винилацетат-фталат), соевый белок, пшеничный белок, продукты переработки соевого или пшеничного белка, хитин, хитиновая кислота, продукты переработки хитина или хитиновой кислоты, желатин, каррагенан, пектин, гуаровая смола, смола рожкового дерева, ксантановая смола, геллановая смола, гуммиарабик, Kollicoat МАЕ 30 DP (фирма BASF), триглицериды со средней длиной цепи, содержащие 6-12 атомов углерода. Реагент для нанесения покрытия, предпочтительно, составляет 1-50 мас.% от общего веса таблетки с покрытием.
После получения первичных гранул с покрытием с использованием одной из перечисленных выше композиций, получают гранулы с двойным покрытием с использованием другого раствора для нанесения покрытия.
Пример 4: Процесс получения лектинсодержащих микрокапсул с энтеросолюбильным покрытием
<Пример 4-1> Микрокапсулирование путем выпаривания растворителя двойной эмульсии
1н. раствор уксусной кислоты, содержащий раствор лектина, выливают в 4 мл PLGA/CH2CI2 и полученный с помощью гомогенизатора для тканей первичный эмульсионный раствор медленно выливают в 1% поливиниловый спирт (50 мл) для получения вторичного эмульсионного раствора. После перемешивания в течение трех часов и удаления CH2Cl2 центрифугируют в течение 5 минут при 2300 об./мин. и супернатанты отбрасывают. Затем промывают водой 3 раза для получения микрокапсул.
<Пример 4-2> Процесс получения липосом
Раствор лектина требуемой концентрации (3 мл) прибавляют к раствору фосфатидилхолина (PC) в диэтиловом эфире и гомогенизируют смесь с помощью ультразвукового генератора до получения однофазной системы. Для полного удаления диэтилового эфира пропускают газообразный азот и вещества, не включенные в липосомы, удаляют на колонке Sephadex G-25. Полученный после центрифугирования осадок липосом разбавляют фосфатным буфером (2 мл) и прибавляют Triton X-100 для разрушения липосом. Экспериментально определенная эффективность включения лектина составила 68%.
<Пример 4-3> Процесс получения двойных микрокапсул с солью альгиновой кислоты
Смешивают поверхностно-активный агент Span 80 (2 мл) и пищевое масло (48 мл) и перемешивают их с раствором альгината натрия (8 мл) и микрокапсулами по примеру 4-1 или липосомами по примеру 4-2, разведенными в 0,15М растворе NaCl. После эмульгирования двухслойной системы быстро и равномерно вливают 60 мл раствора CaCl2 (0,02-0,2 M) для разрушения эмульсии вода/масло, перемешивают полученную смесь в течение 30 минут и оставляют. После образования двойных микрокапсул с солью альгиновой кислоты центрифугируют и надосадную жидкость отбрасывают. Осажденные микрокапсулы промывают несколько раз водой и ацетоном и сушат при комнатной температуре. Сухие двойные микрокапсулы с солью альгиновой кислоты (0,05 г) разводят фосфатным буфером рН 7,4 (10 мл) и перемешивают при 37°С. Эффективность включения лектина после фильтрования составляет 59%.
Экспериментальный пример 1: Гранулометрическое распределение гранул омелы с энтеросолюбильным покрытием.
На стадии формования гранул Примера 2 смешивали лектинсодержащий порошок омелы или порошок водного экстракта 150 г, Avicel PH101 18 г и двузамещенный фосфат кальция 17 г и разбрызгивали связующий раствор (гидроксипропилметилцеллюлоза 20 г, вода 100 мл и этанол 100 мл) для получения гранул, используемых в качестве затравки в устройстве для нанесения покрытий с псевдоожиженным слоем, и разбрызгивали раствор для нанесения покрытия 1 (Zein-DP 25 г, шеллак 35 г, 80% этанол 180 мл) для определения гранулометрического распределения гранул с покрытием 1. Затем на гранулы с первичным покрытием наносили раствор для нанесения покрытия 2 (Eudragit L30 165 мл, вода 30 мл, триэтилуксусная кислота 5 г) для определения гранулометрического распределения гранул с покрытием 2, которые, как оказалось, имеют равномерное распределение, причем фракция гранул с покрытием 30-40 меш (600-425 микрон) составляет более 80% (Таблица 1).
Экспериментальный пример 2: Скорость элюции гранул с энтеросолюбильным покрытием и таблеток в искусственном желудочном соке, кишечном соке.
Была определена скорость элюции гранул с энтеросолюбильным покрытием 1 и 2 по Экспериментальному примеру 1 и таблеток омелы с энтеросолюбильным покрытием, приготовленных по Примеру 3-2, в искусственном желудочном и кишечном соке. Образцы анализировали через каждые 15 минут в течение часа, а затем через каждые 30 минут по методу с вращающейся пробиркой №1 испытаний на растворимость в соответствии с 7-й редакцией Корейской фармакопеи. Для этого гранулы с покрытием 1 и 2 помещали в искусственный желудочный сок (рН 1,2, NaCl-HCl буферный раствор) и искусственный кишечный сок (рН 6,8, фосфатный буфер), каждый в количестве 100 мл, при 37°С и затем перемешивали со скоростью 100 об./мин для определения концентрация фильтрующегося пектина по методу ВСА в реальном масштабе времени. Измерения скорости элюции в воде не требовали перемешивания, поэтому материалы оставляли на определенное время, а затем проводили измерения. Результаты приведены на Фигуре 2. Гранулы с энтеросолюбильным покрытием 1 и 2 не растворялись в искусственном желудочном соке, но в искусственном кишечном соке они растворялись в течение 30 минут. В воде для достижения степени элюции 50% требовалось более недели. Таким образом, гранулы с покрытием могут вводиться в сиропы, соки, напитки, молоко, йогурт и др. Для таблеток с энтеросолюбильным покрытием потребовалось 5,5 часов для достижения степени элюции 50% в искусственном желудочном соке и час в искусственном кишечном соке.
Экспериментальный пример 3: Структура поверхности и гранулометрическое распределение двойных микрокапсул с солью альгиновой кислоты
Измерения лектинсодержащих двойных микрокапсул с солью альгиновой кислоты, полученных по Примеру 4-3, выполненные методом светорассеяния на частицах, показали, что средний размер частиц уменьшался с уменьшением концентраций CaCl2 и альгината натрия (Таблица 2).
Двойные микрокапсулы с альгинатом натрия, полученные при использовании 4% раствора альгината натрия и 0,2М CaCl2, полностью высушивали при комнатной температуре и наблюдали с помощью сканирующего электронного микроскопа (SEM); частицы микрокапсул имели сферическую форму (Фиг.1).
Экспериментальный пример 4: Элюция лектина из двойных микрокапсул с солью альгиновой кислоты
Измеряли скорость элюции лектинсодержащих двойных микрокапсул с солью альгиновой кислоты по Примеру 4-3 в искусственном желудочном соке и искусственном кишечном соке. Образцы анализировали каждые 30 минут по методу с вращающейся пробиркой №1 испытаний на растворимость в соответствии с 7-й редакцией Корейской фармакопеи. Для этого 1 г двойных микрокапсул с солью альгиновой кислоты помещали в искусственный желудочный сок, содержащий протеазу и липазу (рН 1,4, NaCl-HCl буферный раствор) и кишечный сок (рН 7,4, фосфатный буферный раствор), по 100 мл каждого, и перемешивали при 37°С, 50 об./мин. Затем фильтровали в требуемое время, прибавляли Triton Х-100 для разрушения липосом и проводили измерения пектина по методу ВСА. Скорость элюции пектина из двойных микрокапсул с солью альгиновой кислоты в искусственном желудочном соке через 6 часов составляла 31%, а в искусственном кишечном соке через 6 часов - 85%.
Экспериментальный пример 5: In vitro противоопухолевая активность лекарственного средства с энтеросолюбильным покрытием по отношению к раковым клеткам.
Противоопухолевую активность элюируемой жидкости гранул омелы с энтеросолюбильным покрытием по Экспериментальному примеру 2, обрабатываемых в течение 6 часов в искусственном кишечном соке, и элюируемой жидкости двойных микрокапсул с солью альгиновой кислоты по Экспериментальному примеру 4, обрабатываемых таким же образом, определяли методом анализа с тиазолил синим-тетразолийбромидом (МТТ-анализ). Концентрация образца для гранул с покрытием пересчитывалась на вес омелы, использованной для приготовления гранул, а для двойных микрокапсул с солью альгиновой кислоты - на количество пектина, использованного для приготовления липосом.
Раковые клетки высеивали на 96-луночный планшет, прибавляли разные концентрации образцов и через 48 часов анализировали рост клеток с использованием МТТ-метода для определения IC50 (ингибирующая концентрация), соответствующей значению концентрации образца, убивающего 50% раковых клеток.
Согласно результатам, приведенным в Таблице 3, в случае гранул с энтеросолюбильным покрытием значение IC50 возрастает после нанесения покрытия, что указывает на возможность незначительной потери активности в процессе или при элюции, однако они проявляют противоопухолевую активность по отношению к карциноме ротовой полости, раку гортани, раку шейки матки, раку желудка, раку печени, раку молочной железы, миелогенной лейкемии и другим, что заслуживает нашего внимания. Кроме того, в случае двойных микрокапсул с солью альгиновой кислоты, значение показателя аналогично возрастает, что может указывать на потерю активности в процессе или при элюции, но при этом они сохраняют значительную противоопухолевую активность по отношению к раковым клеткам.
А: Вес порошка омелы (мкг/мл), использованного для получения 1 мл экстракта.
В: Вес порошка омелы (мкг/мл), использованного для получения 1 мл жидкости, элюированной в результате обработки гранул с энтеросолюбильным покрытием в искусственном кишечном соке в течение 6 часов.
С: Концентрация пектина омелы (нг/мл).
D: Вес пектина (нг/мл), использованного для получения 1 мл жидкости, элюированной в результате обработки изготовленных из пектина двойных микрокапсул с солью альгиновой кислоты в искусственном кишечном соке в течение 6 часов.

Группа изобретений относится к композиции энтеросолюбильного покрытия, содержащего лектин, в частности для экстракта омелы; и также относится к композиции микрокапсул с энтеросолюбильным покрытием, содержащих лектин в качестве основного ингредиента. Гранулированная композиция включает: маннит 115 г в качестве эксципиента, Avicel PH 101 18 г, двузамещенный фосфат кальция 17 г, гидроксипропилметилцеллюлозу 20 г в качестве связующего раствора, воду 100 мл, этанол 100 мл, Zein-DR 25 г в качестве раствора для нанесения покрытия, шеллак 35 г и 80% этанол 180 мл, в которой раствор для нанесения покрытия приготовлен путем растворения 50 весовых процентов реагента для покрытия и 50 весовых процентов пластификатора. Композиция для таблетирования лектинсодержащих микрокапсул с энтеросолюбильным покрытием включает: PLGA/CH2Cl2 4 мл, 1% поливиниловый спирт 50 мл, Span 80 2 мл в качестве поверхностно-активного агента, пищевое масло 48 мл, 1-4% раствор альгината натрия 8 мл и 0,02-0,2М раствор CaCl2 60 мл. Изобретение обеспечивает решение проблемы, связанной с нестабильностью в пищеварительной системе при пероральном введении, что повышает эффективность лекарственного средства и эффективность лечения в терапевтических учреждениях. 2 н. и 2 з.п. ф-лы, 3 табл., 2 ил.
| СОСТАВЫ, СОДЕРЖАЩИЕ ЛЕКТИН, И ИХ ПРИМЕНЕНИЕ | 1997 |
|
RU2202361C2 |
| ЛЕКТИН ROBINIA PSEUDOACACIA И ЕГО ПРИМЕНЕНИЕ | 1998 |
|
RU2214259C2 |
| Способ получения лектина | 1989 |
|
SU1725903A1 |
| Основание секции шахтной механизированной крепи | 1972 |
|
SU481701A1 |
| WO 9813053, 02.04.1998 | |||
| US 5565200, 15.10.1996. | |||
Авторы
Даты
2008-01-27—Публикация
2004-03-19—Подача