Изобретение относится к медицинской нанодиагностике, вирусологии, в частности к прикладной иммунологии.
Нанодиагностическая медицинская система, использующая чувствительные элементы, имеющие наноразмеры, то есть размеры порядка нескольких сотен нанометров, в которых или посредством которых происходит измерение, или чувствительные элементы в ней изготовленные с использованием нанотехнологий.
Поверхностный антиген вируса гепатита В (HBsAg) - белковый комплекс, который составляет наружную оболочку данного вируса, обнаруживается в крови людей при остром или хроническом гепатите В и при так называемом "здоровом" носительстве. Поэтому определению вируса HBsAg отводится ключевая роль в диагностике заболеваний, вызванных вирусом гепатита В.
Для детекции HBsAg использованы практически все биологические методы выявления антигена - от преципитации в геле до радиоиммунного анализа.
В настоящее время основными методами определения маркеров инфекционных заболеваний, в том числе вируса гепатита, является иммуноферментный анализ (ИФА) и полимеразная цепная реакция (ПЦР).
В ИФА антитела, иммобилизованные на подложке, инкубируются в сыворотке крови, содержащей антигены, после чего к образованным на подложке комплексам антиген/антитело добавляются вторичные антитела с ковалентно "пришитыми" молекулами ферментов (пероксидазы или щелочной фосфатазы). После завершения реакции комплексообразования в среду добавляются субстраты для названных ферментов, дающие после гидролиза цветную реакцию, пропорционально количеству связавшихся вторичных антител, что и отражает содержание антигена в исследуемой пробе.
В ПЦР происходит амплификация с помощью полимеразы участков ДНК вируса заболевания с последующей регистрацией полученных таким образом набором олигонуклеотидов.
Несмотря на высокую чувствительность, эти методы имеют ряд недостатков: длительность и сложность постановки, отсутствие жесткого контроля качества тест-систем, возможность загрязнения исследуемых образцов ДНК или РНК (в случае ПЦР), высокая стоимость реактивов и приборов.
В настоящее время в фармакологических и протеомных исследованиях нашли применения методы биосенсорной диагностики на основе анализа гибридизации специфической ДНК-пробы с ДНК исследуемого образца (мишени) (Quinn J.G. O`Neill S., Doyle A et al. (2000) Anal. Biochem., 281, 135-143; Welschof M., Terness P., Kipriynov S.M. Proc. Natl. Acad. Sci USA, 94, 1902-1907), (Koval V.V., Gnedenko O.V., Ivanov Yu.D., Fedorova O.S., Archakov A.I., Knorre D.G.. Real - time oligonucleotide hybridization kinetics monitored by resonant mirror technique. IUBMB LIFE, 1999, 48, 1-4).
Появившийся в 90-х годах метод регистрации белок-белковых взаимодействий с помощью оптического биосенсора характеризуется высокой чувствительностью, возможностью определять кинетические параметры образования и распада комплексов и быстротой анализа. Методом с использованием оптического биосенсора можно регистрировать гибридизацию макромолекул напрямую в режиме реального времени без дополнительных процедур очистки и модификации мишени. По времени этот анализ занимает вместо 1-4 часов порядка 10-30 минут (Koval V.V., Gnedenko O.V., Ivanov Yu.D., Fedorova O.S., Archakov A.I., Knorre D.G.. Real - time oligonucleotide hybridization kinetics monitored by resonant mirror technique. IUBMB LIFE, 1999, 48, 1-4).
Наиболее близким по существенным признакам к предлагаемому техническому решению является способ диагностирования, в соответствии с которым вначале получают олигонуклеотид, комплементарный всей или части олигонуклеотидной последовательности, характерной для РНК или ДНК исследуемого материала, и иммобилизованный на поверхности волновода детектора затухания колебаний, затем полученный иммобилизованный олигонуклеотид обрабатывают раствором образца материала или ДНК, или РНК, полученных из этого материала в условиях, позволяющих ДНК или РНК гибридизоваться с иммобилизованным олигонуклеотидом, после чего проводят связывание иммобилизованного олигонуклеотида с флуоресцентно детектируемым агентом, при этом условия подбирают таким образом, чтобы флуоресцентно детектируемый агент связывался с продуктом гибридизации, измеряют количество флуоресцентного детектируемого агента, используя детектор затухания колебаний, при этом олигонукпеотид иммобилизовывается на поверхности детектора затухания колебаний на оптическом волноводе (пат. России 2116349, 1998 г.).
Недостатком данного способа использования оптического биосенсора является необходимость модифицировать олигонуклеотиды с помощью флуоресцирующего материала либо добавлять флуоресцирующие материалы в зоны реакции, поскольку сами олигонуклеотиды не флуоресцируют в видимом диапазоне спектра.
В настоящее время разработаны несколько конструкций биосенсоров, из которых можно выделить два типа оптических биосенсоров: первый, основанный на использовании плазменного резонанса, и второй - так называемое "оптическое резонансное зеркало". В обоих случаях детекция межмолекулярного взаимодействия основана на регистрации изменения показателя преломления среды при образовании комплекса белка, иммобилизованного в резонансном слое измерительной кюветы, с его партнером с очень высокой чувствительностью за счет использования резонансных эффектов. Оценки показывают, что теоретическая чувствительность оптического биосенсора типа "резонансное зеркало" на порядок выше, чем на основе плазменного резонанса за счет оптимального подбора оптических структур, формирующих данный тип конструкции [Cush, R., Cronin, J.M., Stewart, W.J., Maule, C.H., Molloy, J., and Goddard, N.J., Biosensor and Bioelectronics 1993, 8, 347-353, IAsys Cuvette System /User's Guide/ Fisonss Ahhiied Sensor Technology/ 1993 ].
В биосенсоре "Резонансное зеркало" измерительная кювета представляет из себя призму, сопряженную с волноводом, изготовленным из наноструктур. В качестве чувствительного элемента используется затухающая волна, которая зондирует зону реакции формирования комплексов размером от мономолекулярного слоя до 200-300 нм в зависимости от толщины иммобилизованного слоя макромолекулярных зондов. Так как чувствительный элемент зондирует среду реакции в области 200-300 нм, то такая измерительная система представляет из себя наноизмерительную систему.
Задача выявления маркеров заболевания гепатитами В и С созданием нанодиагностической тест-системы с применением оптического биосенсора "резонансное зеркало" решается впервые.
Для решения поставленной задачи создана нанодиагностическая тест-система для выявления заболевания гепатитами В и С, включающая использование двухканального биосенсора "резонансное зеркало" с биочипом, который представляет из себя биосенсорную кювету, в основании которой расположена призма с сопряженным с ней волноводом, образованным из слоя среды с высоким показателем преломления - "nel" и слоя кварца с низким показателем преломления "ncl" толщинами порядка нескольких сотен нанометров в зависимости от материала слоя, к чувствительной поверхности которого, являющейся одновременно поверхностью дна кюветы, иммобилизуются молекулы-зондов, образующих в биологической жидкости специфичные комплексы с макромолекулярными маркерами заболеваний в поверхностном к волноводу слое размером нескольких сотен нанометров, путем взаимодействия молекул антител (анти-HBs) и HBsAg (антигена вируса гепатита В) и/или взаимодействия поверхностного нуклеокапсидного антигена гепатита С и антитела к нему и/или гибридизацией олигонуклеотидов с комплементарными участками к ДНК вируса гепатита В и/или гибридизацией олигонуклеотидов с комплементарными участками к РНК вируса гепатита С с последующим определением изменения коэффициента преломления света в поверхностном слое на границе волновода.
Сущность изобретения поясняется на чертежах.
На фиг.1 приведена схема оптического биосенсора с нанобиочипом.
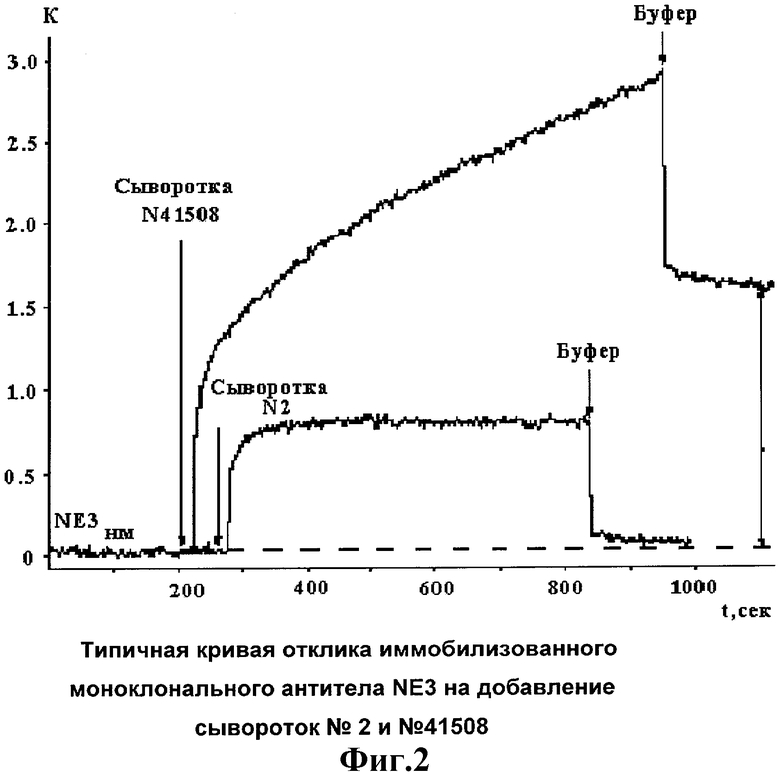
На фиг.2 показана типичная кривая взаимодействия (комплексообразования) иммобилизованного на поверхности биочипа антитела (анти-HBs) с антигеном вируса гепатита В, присутствующим в сыворотке крови N 41508, полученная с применением оптического биосенсора. Для сравнения на том же чертеже приведена кривая взаимодействия иммобилизованныхъ антител с сывороткой крови N 2, не содержащей антигена HBsAg.
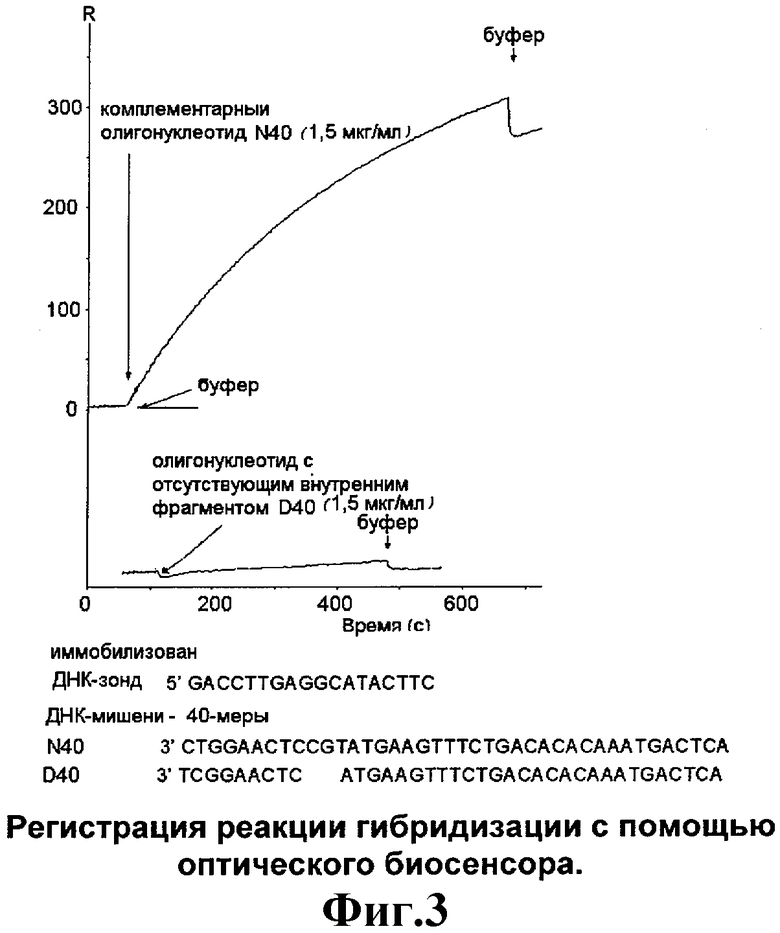
На фиг.3 показана типичная кривая гибридизации присутствующего в растворе олигонуклеотида, идентичного участку ДНК вируса гепатита В, с иммобилизованным олигонуклеотидным зондом, полученная с применением оптического биосенсора и биочипа к нему с иммобилизованным олигонуклеотидным зондом.
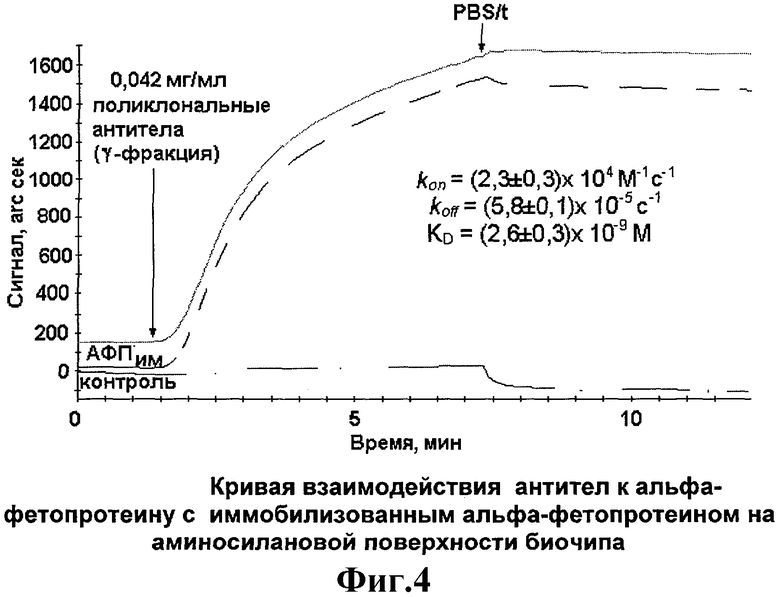
На фиг.4 показан результат выявления в растворе антител к альфа-фетопротеину.
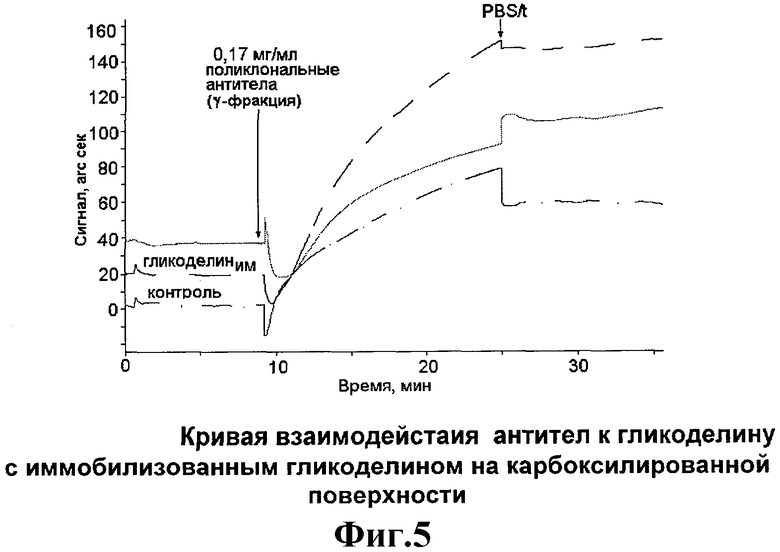
На фиг.5 показан результат выявления антител к гликоделину с помощью биочипа с ковалентно иммобилизованным гликоделином.
Оптический биосенсор, используемый в предлагаемой нанодиагностической тест-системе, представленный на фиг.1, содержит измерительную кювету - нанобиочип, дно которой состоит из стеклянной призмы, сопряженной с волноводом, образованным из слоя среды с высоким показателем преломления - "net" и слоя кварца с низким показателем преломления "ncl", с толщинами порядка нескольких сотен нанометров в зависимости от материала слоя. К чувствительной поверхности волновода, являющейся одновременно поверхностью дна кюветы, иммобилизуется слой (это может быть монослой либо слой толщиной до нескольких сот нанометров) одного из партнеров взаимодействующей пары.
Луч лазера падает на границу призма-кварц под углом больше угла полного внутреннего отражения и отражается, при этом формируется поле затухающей световой волны, интенсивность которой экспоненциально спадает с расстоянием от поверхности границы. Часть света при этом туннелирует в среду с высоким показателем преломления через кварцевый слой на расстоянии нескольких сот нанометров и при определенном резонансном угле падения распространяется вдоль волновода, а затем туннелирует обратно в призму и затем выходит из призмы с регистрацией полученного резонансного угла. При добавлении в кювету второго партнера, образующего комплекс с иммобилизованным компонентом, увеличивается показатель преломления в чувствительном слое толщиной несколько сот нанометров и, соответственно, наблюдается смещение максимума отраженного света по угловой координате в зависимости от времени.
Таким образом мониторинг изменения положения резонансного угла падения лазерного луча в зависимости от времени позволяет регистрировать кинетическую кривую образования комплексов. Регистрируя эти кривые для различных концентраций, можно рассчитать константы скорости ассоциации и диссоциации.
Реакцию комплексообразования иммобилизованного партнера А с добавляемым в кювету партнеров В можно описать уравнением
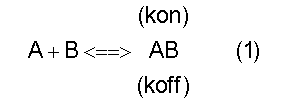
согласно инструкции к прибору IAsys + (Affinity Sensors, UK).
Сигнал R оптического биосенсора на образование комплекса можно записать как
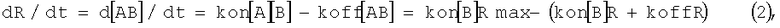
где kon, koff - константы скорости образования и диссоциации комплексов, R - сигнал биосенсора.
По величине R можно определить количество образовавшихся комплексов, то есть количественно можно охарактеризовать концентрацию комплексов зонд-маркер заболевания, а по уравнению (2) рассчитать еще и kon, koff, характеризующие кинетический процесс их образования и распада. При замене в кювете раствора с лигандом на буферный раствор наблюдается диссоциация комплекса.
Для выявления HBsAg в сыворотке крови человека с помощью оптического биосенсора были разработаны биочипы. С этой целью при изготовлении биочипа для диагностики заболевания гепатитом В по реакции формирования комплекса антиген/антитело: на поверхности кюветы оптического биосенсора IAsys (Affinity Sensors) были иммобилизованы моноклональные антитела: NE 2, NE 3 или CEN-24 в растворе.
При изготовлении биочипа для диагностики заболевания гепатитом В по реакции гибридизации: стрептавидин (или авидин) ковалентно иммобилизовывали через входящие в его структуру аминогруппы и карбоксигруппы поверхности карбоксиметилированного декстрана на поверхности волновода кюветы биосенсора посредством карбодиимид с N-гидроксисукцинимидом олигонуклеотидов, а олигонуклеотидный зонд биотинировали и инкубировали в этой кювете для иммобилизации зонда посредством связи стрептавидин (или авидин)/ биотин.
Для диагностики гепатита С биочип создавали следующим образом. Белок - антиген HCcore ковалентно иммобилизовали биосенсора через его аминогруппы и аминогруппы аминосилановой кюветы оптического биосенсора.
Полученные биочипы с иммобилизованными антителами к HBsAg использовали для контрольных экспериментов по регистрации HBsAg в стандартном буфере PBS/Твин 20. Было обнаружено, что иммобилизованные моноклональные антитела NE2 и NE3 образовывают комплекс с HBsAg, что регистрировалось по изменению коэффициента преломления в поверхностном чувствительном слое с помощью оптического биосенсора. Моноклональные антитела NE2 имели настолько высокое сродство к HBsAg, что образованные комплексы не удалось полностью разрушить применением ни одного из следующих отмывочных буферов: 1) 1 М NaCl, содержащим 0,5% холат Na, 2) 10 мМ HCl, 3) 50 мМ HCl, 4) 3 М KNCS. В результате биочип на основе NE2 был нечувствителен к повторной добавке HBsAg в PBS/Твин 20, что указывало на невозможность использования его в многоразовом тесте.
Контрольные эксперименты с биочипом на основе NE3 или CEN-24 показали, что с его помощью можно регистрировать образование комплексов моноклональное антитело/HBsAg, причем эти комплексы могут быть диссоациированы 10 мМ HCl. Поэтому такой биочип можно использовать многократно для регистрации HBsAg антигена.
Тестирование образцов сыворотки пациентов на наличие HBsAg основывалось на следующем принципе. В кювету с иммобилизованными моноклональными антителами к HBsAg (NE3 или CEN-24) добавляли 5-20 мкл сыворотки. В том случае, если сыворотка содержала HBsAg, образовывались комплексы, в результате чего менялся индекс преломления вблизи поверхности, что регистрировалось прибором IAsys + (Affinity Sensors, Англия). Для регистрации процессов диссоциации этих комплексов сыворотку из кюветы удаляли и добавляли туда стандартный буфер (PBS/Твин 20).
Экспериментальные кривые, отражающие связывание антиген-антитело, были апроксимированы полиномом первой степени и представлены в виде значений поверхностных концентраций HBsAg (К), связанного с антителами, рассчитанных по следующей формуле:
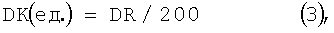
где DR=(R1-R2); R1 и R2 - смещение резонансного угла прибора при Dt=10 сек; 200 - масштабный множитель; 200 ед. соответствует поверхностной концентрации связавшегося белка 1 нг/мм2.
При подготовке к диагностированию олигонуклеотидный зонд с последовательностью, соответствующему участку ДНК вируса гепатита В, ковалентно иммобилизуется на поверхности кюветы оптического биосенсора с карбоксиметилированным декстраном, при этом добавляемый в биочип олигонуклеотид N40 (1,5 мг/мл) - полностью комплементарен иммобилизованному зонду. Гибридизационный буфер: 5xssc, 5x раствор Денхарда, 5 мм натрий-фосфатный буфер (ph 6,8) и 0,1% (v/v) Твин-20. Регенерационный буфер: 50 мм naoh, T=250°C.
Если добавляемый в кювету оптического биосенсора олигонуклеотид не полностью комплементарен иммобилизованному зонду как, например, в случае D40 (олигонуклеотид с отсутствующими двумя основаниями в участке комплементарности), то, как видно из фиг.3, наблюдается гораздо меньший сигнал оптического биосенсора на добавку D40 олигонуклеотида, по сравнению с добавкой полностью комплементарного олигонуклеотида N-40.
На фиг.4 видно, что после добавления раствора антител к альфа-фетопротеину в биочип с ковалентно иммобилизованным альфа-фетопротеином наблюдается их взаимодействие, что выражается в росте синала оптического биосенсора. После промывки кюветы буфером наблюдается медленная диссоциация комплекса.
Из кривых формирования комплексов и их диссоциационных кривых можно рассчитать константы скорости формирования и распада комплексов, которые в нашем случае составляли значения, kon=(2,3±0,3)104M-1c-1, koff=(5,7±0,1)×10-5с-1, а константа диссоциации KD=5,7×10-8М.
По данным иммуноферметного анализа сыворотка №41508 содержала HBsAg, а сыворотка №2 - нет. По приведенной на фиг.2 типичной кривой отклика иммобилизованного моноклонального антитела NE3 на добавление сывороток №2 и №41508 видно, что после добавления сыворотки в измерительную кювету наблюдался рост сигнала, связанный как с процессом специфического, так и неспецифического связывания. Результаты, полученные на двух видах кювет (″CM-Dextran″ и "Carboxylate"), были аналогичными. После записи кривой ассоциации сыворотку в кювете заменяли на PBS/Твин - 20 буфер и наблюдали десорбцию неспецифически связанного вещества. В результате кривая выходила на плато, которое характеризует количество образовавшихся комплексов антиген/антитело.
На кривой фиг.2 видно, что для сыворотки №2 наблюдается только неспецифическое связывание, так как адсорбированное вещество практически полностью отмывается PBS/Твин - 20 буфером. В случае сыворотки №41508 наблюдался высокий уровень образования комплексов антиген/антитело после отмывки буфером неспецифически сорбированных молекул на поверхности кюветы.
Для диагностики заболевания гепатитом С оптическим биосенсором согласно предлагаемому изобретению осуществляется регистрация взаимодействия между молекулами нуклекапсидного антигена, формующими поверхностный слой биочипа биосенсорной кюветы, и антикор антителами.
При использовании двухканальной кюветы один из каналов можно использовать как контрольный, а в рабочем канале проводится иммобилизация олигонуклеотидного зонда или антитела (или антигена). В контрольном канале не производится иммобилизация или иммобилизуются макромолекулы, которые не формируют комплексы с маркерами выявляемого заболевания.
Применение двухканальной кюветы позволило использовать второй канал оптического биосенсора для выявления антител против нуклеокапсидного антигена ВГС. Свободные после посадки антигена реакционные центры были закрыты бычим сывороточным альбумином. Плотность посадки кор антигена составляла 4 нг/мм2. Для обнаружения в биологической жидкости наличия антигена против нуклеокапсидного антигена ВГС в кювету оптического биосенсора добавлялся этот раствор и регистрировалось формирование комплекса антиген/антитело на поверхности оптического биосенсора, при этом наблюдался рост сигнала, связанный с формированием комплексов антиген/антитело. Для регистрации процессов распада этих комплексов из кюветы удаляли раствор и добавляли стандартный фосфатно-солевой буфер с твином - 20 (PBS-T).
На кривой фиг.2 видно, что в случае, когда в сыворотке содержится HBsAg, при добавлении сыворотки в биочип наблюдается существенно более сильный сигнал оптического биосенсора. При этом после промывки биочипа буфером, в случае сыворотки, содержащей антиген HbsAg, наблюдается существенно меньшая диссоциация комплексов, сформированных на поверхности биочипа. По сравнению со случаем, когда в биочип добавляется сыворотка, не содержащая антиген HBsAg. Это позволяет использовать биочип для выявления HbSAg в сыворотке крови.
При тестировании образцов сыворотки на наличие анти-кор антител в кювету добавлялось по 6 мл сыворотки. Если сыворотка содержала антитела, образовывались комплексы на поверхности биочипа, в результате чего менялся индекс преломления в кювете. Для регистрации процессов распада этих комплексов сыворотку из кюветы удаляли и добавляли стандартный фосфатно-солевой буфер с твином - 20 (PBS/t).
Сравнительный анализ выявления этих антител оптического биосенсора и иммуноферментного анализа показал высокую специфичность и чувствительность выявления анти-кор антител с помощью оптического биосенсора.
Для одновременной регистрации маркеров двух заболеваний-гепатитов В и С в одном из каналов оптического биосенсора иммобилизуется зонд на одно из заболеваний, а в другом на другое заболевание. Например, осуществляется одновременная регистрация маркеров заболевания гепатитом В по реакции гибридизации, в случае иммобилизации в этом канале олигонуклеотидного зонда с участком, идентичным участку ДНК вируса гепатита В (или, если в этом канале регистрируется образование иммунокомплексов, то иммобилизуется антитело к HBsAg) и гепатитом С по реакции комплексообразования антиген/антитело, в случае иммобилизации во втором канале антигена HCCore.
Примеры результатов использования предлагаемой диагностической тест-системы для определения маркеров заболевания соматическими заболеваниями, связанными с изменением уровня антител/, к альфа-фетапротеину или гликоделину, показаны на фиг.4 и 5.
Кривая фиг.4 показывает результат определения антител к альфа-фетопротеину. Альфа-фетопротеин иммобилизован на поверхности рабочего канала аминосилановой кюветы оптического биосенсора. Поверхность контрольного канала блокирована бычим сывороточным альбумином. В оба канала добавлен раствор поликлональных антител (Y-фракция). Верхняя кривая фиг.4 показывает разностный сигнал между рабочим и контрольным каналом, средняя - сигнал рабочего канала, нижняя - сигнал контрольного канала. На кривых фиг. 4 видно, что при нанодиагностировании регистрируется разностный сигнал взаимодействия иммобилизованного альфа-фетопротеина с антителами в растворе.
На кривой фиг.5 показан результат определения антител к гликоделину. Гликоделин иммобилизован на поверхности карбоксилированной кюветы оптического биосенсора. Поверхность контрольного канала блокирована бычим сывороточным альбумином. В оба канала добавлен раствор поликлональных антител (Y-фракция). Верхняя кривая на фиг.5 показывает - разностный сигнал между рабочим и контрольным каналом, средняя - сигнал рабочего канала, нижняя - сигнал контрольного канала. Видно, что регистрируется разностный сигнал взаимодействия иммобилизованного гликоделина с антителами в растворе.
В качестве оптического биосенсора при диагностике заболеваний гепатитами В и С вместо биосенсора "резонансное зеркало" может использоваться любой биосенсор, в основе измерения которого лежит регистрация изменения оптических свойств среды (показатель преломления) при комплексообразовании, в частности, например, биосенсор с использованием поверхностного плазменного резонанса или колориметрический биосенсор,
В предлагаемой нанодиагностической тест-системе возможно использовать и многоканальный оптический биосенсор с количеством каналов более 2, что позволит одновременно регистрировать более двух заболеваний одновременно.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РЕГИСТРАЦИИ СПЕЦИФИЧЕСКИХ МАКРОМОЛЕКУЛ В БИОЛОГИЧЕСКОЙ ПРОБЕ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2006 |
|
RU2338199C2 |
| ДИАГНОСТИЧЕСКАЯ ТЕСТ-СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ ЗАБОЛЕВАНИЯ | 2007 |
|
RU2361215C1 |
| СПОСОБ ВЫЯВЛЕНИЯ АНТИТЕЛ К АНТИГЕНАМ ВИРУСОВ ГЕПАТИТОВ | 2006 |
|
RU2360253C2 |
| СПОСОБ РЕГИСТРАЦИИ МАКРОМОЛЕКУЛ ПРИ ПРОВЕДЕНИИ ПРОТЕОМНЫХ ИССЛЕДОВАНИЙ И БИОЧИП, ИСПОЛЬЗУЕМЫЙ ПРИ ИХ РЕГИСТРАЦИИ | 2004 |
|
RU2283496C2 |
| СПОСОБ ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И РАКА ЯИЧНИКОВ | 2017 |
|
RU2696114C2 |
| Способ оценки уровня антител, специфичных к различным вариантам HBsAg вируса гепатита В | 2016 |
|
RU2616236C1 |
| НАНОБИОЧИП, ИСПОЛЬЗУЕМЫЙ ДЛЯ РЕГИСТРАЦИИ БЕЛКОВ И БЕЛКОВЫХ КОМПЛЕКСОВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ РЕГИСТРАЦИИ БЕЛКОВ И БЕЛКОВЫХ КОМПЛЕКСОВ С ИСПОЛЬЗОВАНИЕМ ЗОНДОВОЙ МИКРОСКОПИИ | 2007 |
|
RU2362169C2 |
| Способ ранней диагностики онкологического заболевания | 2022 |
|
RU2790290C1 |
| СПОСОБ ОБНАРУЖЕНИЯ ИДЕНТИФИКАЦИИ И/ИЛИ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ МАТЕРИАЛА, НАБОР ДЛЯ АНАЛИЗА, ОПТИЧЕСКИЙ ВОЛНОВОД, БИОСЕНСОР | 1992 |
|
RU2116349C1 |
| СПОСОБ РЕГИСТРАЦИИ И ИДЕНТИФИКАЦИИ МАКРОМОЛЕКУЛ ПРИ ПОМОЩИ СОПРЯЖЕННОЙ СИСТЕМЫ НА ОСНОВЕ СКАНИРУЮЩЕЙ ПРОБНОЙ МИКРОСКОПИИ И МАСС-СПЕКТРОМЕТРИИ | 2006 |
|
RU2351932C2 |
Изобретение относится к медицинской нанодиагностике, вирусологии, к прикладной иммунологии. Для выявления вируса гепатита В используют биосенсор "резонансное зеркало" с биочипом. Биочип состоит из биосенсорной кюветы, в основании которой расположена призма с сопряженным с ней волноводом, образованным из слоя среды с высоким показателем преломления - "nel" и слоя среды с низким показателем преломления "ncl" толщинами порядка нескольких сотен нанометров в зависимости от материала слоя, к чувствительной поверхности которого, являющейся одновременно поверхностью дна кюветы, иммобилизуют олигонуклеотидный зонд, комплементарный участку ДНК вируса гепатита В, - 5' GACCTTGAGGCATACTTC. Регистрируют изменение преломления света в поверхностном слое на границе волновода при реакции гибридизации. 5 ил.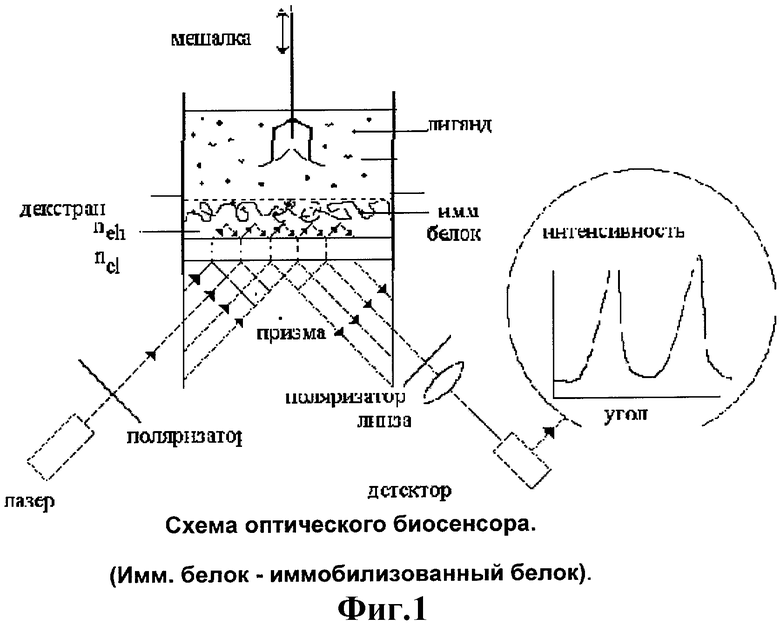
| ИВАНОВ Ю.Д | |||
| и др | |||
| Детекция поверхностного антигена вируса гепатита В с помощью оптического биосенсора | |||
| Вопросы медицинской химии | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| ИВАНОВ Ю.Д | |||
| и др | |||
| Детекция поверхностного антигена вируса гепатита В с помощью оптического биосенсора | |||
| Журнал микробиологии, эпидемиологии и иммунобиологии | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| - апр.), с.58-62 | |||
| АРЧАКОВ | |||
Авторы
Даты
2008-01-27—Публикация
2004-11-24—Подача