Предлагаемое изобретение относится к области органической химии, в частности к способу получения 3-дихлорметилпиридина.
Моно-, ди- и тригалоидсодержащие производные пиридина и α-, β-, γ-пиколинов обладают ярко выраженной биологической активностью и широко используются для получения гербицидов фунгицидов, дефолиантов, ингибиторов нитрификации, инсектицидов и др. (Ковганко Н.В., Кашкан Ж.Н.// Достижения неоникотиноидов. ЖОХ, 2004, т.40, вып.12, с.1759-1775[1]).
3-Дихлорметилпиридин является исходным сырьем для получения производных 4-(5-трифторметилпиридил-2-окси)-феноксиалканкарбоновой кислоты, проявляющих высокую гербицидную активность (Патент Японии JP 55022617, 1980 [2]).
3-Дихлорметилпиридин обычно получают каталитическим хлорированием труднодоступного 3-метилпиридина (пиколина) с использованием конц. H2SO4 и ледяной уксусной кислоты, в присутствии инициатора радикальных реакций азо-бис-изобутиронитрила (Патент США US 5116993, 1992 [3]).
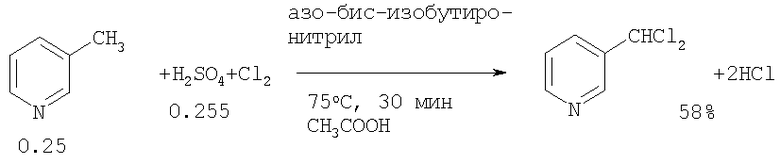
Японскими авторами 3-дихлорметилпиридин был синтезирован реакцией 3-метилпиридина с Cl2 в присутствии органической и неорганической кислот, а также с использованием радикальных инициаторов (Патент Японии JP 11140053, 1999 [4]). При газофазном хлорировании 3-метилпиридина 16 молями Cl2 в 6 молях CCl4 при температуре 350°С были получены продукты, хлорированные как по боковой цепи, так и по пиридиновому кольцу (Патент Корейской Республики KR 8201021, 1982 [5]).
Недостатки методов:
1. Использование большого избытка свободного хлора (4-6 молей на 1 моль 3-метилпиридина).
2. Труднодоступность и дороговизна 3-метилпиридина, который выделяют из каменноугольной смолы, где он содержится в количестве 0,14%.
3. Большой расход кислот: H2SO4 и СН3СООН.
4. Значительные трудности при выделении целевого продукта из-за необходимости применения агрессивных кислот.
5. Образование в качестве побочных продуктов 2 молей HCl на 1 моль целевого продукта.
3-Дихлорметилпиридин был получен хлорированием 3-пиридинальдегида в присутствии пиридина, с помощью хлорирующего агента PCl5 (Рубина К.И., Иовель И.Г., Гольдберг Ю.Ш., Шиманская М.В. // Свободнорадикальное хлорирование метилпроизводных пиридина, пиразина и тиазола N-хлорсукцинимидом. Химия гетероциклических соединений, 1989, №4, С.543-5466 [6]). Реакция протекает с образованием 3-дихлорметилпирина с выходом ˜38%.
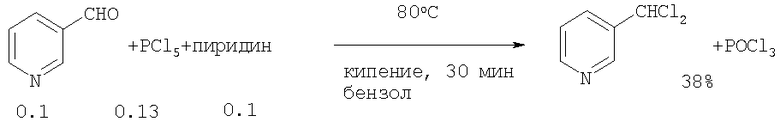
Недостатки метода:
1. Труднодоступность и дороговизна PCl5.
2. Большой расход хлорирующего агента (стехиометрические количества).
3. Образование в качестве отхода POCl3.
4. 3-пиридинальдегид является дефицитным и дорогостоящим соединением, его получают окислением 3-метилпиридина с низким выходом. Его синтез требует больших энергозатрат из-за необходимости проведения реакций при повышенной температуре. Кроме того, процесс получения 3-пиридинальдегида является взрыво- и пожароопасным.
Известно, что 3-пиридинальдегид (1) с выходом 25% образуется при окислении 3-метилпиридина (2) О2 на катализаторе V2O5/MoO3 на кизельгуре при температуре 400-440°С, при использовании катализатора β-VO(РО3)2 окисление кислородом воздуха конверсия 3-метилпиридина составляет 30%, а селективность по альдегиду 20% (Шиманская М.В., Лейтис Л.Я., Сколмейстере Р.А., Иовель И.Г., Голендер Л.О./ Ванадиевые катализаторы окисления гетероциклических соединений., п/р Шиманской М.В., Рига: Зинатне. АН Латвийской ССР. 1990, 256 с. [7]).
В этой же работе была сделана попытка получить целевой продукт 3-дихлорметилпиридин хлорированием 3-пиколина N-хлорсукцинимидом в присутствии перекиси бензоила, но реакция прошла неселективно с образованием смеси трех продуктов последовательного хлорирования метальной группы.
Следует отметить, что предлагаемое изобретение имеет лишь одно сходство с известными способами - по конечному продукту и существенно отличается по всем другим признакам, в связи с этим выбор прототипа представляется затруднительным.
Авторами предлагается способ получения 3-дихлорметилпиридина, не имеющий вышеперечисленных недостатков.
Сущность способа заключается во введении в молекулу пиридина дихлорметильной группы реакцией пиридина с помощью CCl4 и МеОН в присутствии катализатора FeBr2 при 140°С в течение 6 ч, при мольном соотношении [FeBr2]:[PyH]:[CCl4]:[MeOH]=1:100:200:200,
Данная реакция при отсутствии метанола не проходит.
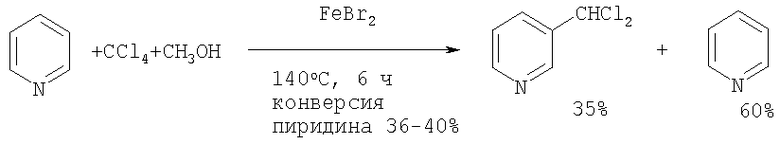
Существенные отличия предлагаемого способа от прототипов.
1. Исходным сырьем для получения 3-дихлорметилпиридина является пиридин, который реагирует с системой CCl4-МеОН-FeBr2, в которой FeBr2 выполняет роль катализатора.
Преимущества предлагаемого метода.
1. Доступность и дешевизна исходных реагентов - пиридина, CCl4 и метанола и катализатора FeBr2.
2. Отсутствие агрессивных кислот (H2SO4, СН3СООН), используемых в известных способах в качестве растворителя.
3. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат.
4. Одностадийность процесса
5. Селективность процесса: конверсия пиридина составляет ˜40%, а селективность по целевому продукту составляет ˜95%.
Предлагаемый способ поясняется примером:
ПРИМЕР. Реакции проводили в стеклянной ампуле (V=20 мл) или микроавтоклаве из нержавеющей стали (V=17 мл).
В микроавтоклав (ампулу) под аргоном помещают 0.1 ммоль FeBr2, 10 ммоль пиридина, 20 ммоль CCl4 и 20 ммоль МеОН (которые играют роль реагента и растворителя одновременно), автоклав герметично закрывают (ампулу запаивают) и нагревают при 140°С в течение 6 часов. После окончания реакции микроавтоклав (ампулу) охлаждают до ˜20°С, вскрывают, реакционную массу при проведении реакции в метаноле фильтруют через слой силикагеля (2 г), непрореагировавший метанол отгоняют, реакционную массу нейтрализуют 10% водным раствором Na2CO3 (перемешивание на магнитной мешалке в течение 0.5-1 часа), экстрагируют CCl4 (или диэтиловым эфиром). Растворитель отгоняют, остаток перегоняют в вакууме.
Выделенный 3-дихлорметилпиридин имеет т.кип. 90°С/15Па, ИК-спектр (ν, см-1): 1150, 3600 (ОН). Спектр ЯМР 13Н (CDCl3, δ, м.д., TMS): 6.7 (1Н, с, CHCl2, 7.2-8.9 (4Н, М, Ar), m/z (Jотн (%)): 161 [М+] (22), 38 (2), 39 (2), 51 (3), 63 (7), 64 (3), 65 (7), 73 (4), 78 (7), 90 (5), 91 (5), 99 (12), 101 (5), 106 (4), 125 (5), 126 (100), 127 (7), 128 (34), 129 (3), 161 (22), 162 (2), 163 (17).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА 5-АЦЕТИЛПИРРОЛ-2-КАРБОНОВОЙ КИСЛОТЫ | 2008 |
|
RU2404162C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА 5-АЦЕТИЛФУРАН-2-КАРБОНОВОЙ КИСЛОТЫ | 2008 |
|
RU2404173C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЦЕТИЛИЗОХИНОЛИНА | 2009 |
|
RU2404166C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТАНА | 2011 |
|
RU2486169C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИХЛОРАДАМАНТАНА | 2011 |
|
RU2459797C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ДИХЛОРМЕТИЛИЗОХИНОЛИНА | 2008 |
|
RU2402535C2 |
| СПОСОБ ПОЛУЧЕНИЯ 7,7-ДИМЕТОКСИБИЦИКЛО[2.2.1]-ГЕПТАДИЕНА-2,5 | 2006 |
|
RU2331627C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИХЛОРАДАМАНТАНА | 2000 |
|
RU2178401C2 |
| СПОСОБ ПОЛУЧЕНИЯ МОНО- И ДИФТОРБЕНЗИЛХЛОРИДОВ | 2015 |
|
RU2596872C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТАНА, 1- И 4-ХЛОРДИАМАНТАНОВ | 2000 |
|
RU2185364C1 |
Изобретение относится к способу получения 3-дихлорметилпиридина взаимодействием пиридина с четыреххлористым углеродом и метанолом в присутствии катализатора бромида железа (II) при температуре 140°С в течение 6 ч при мольном соотношении [FeBr2]:[пиридин]:[CCl4]:[метанол]=1:100:200:200. Технический результат - выход 3-дихлорметилпиридина 35%, селективность 95-100%, конверсия пиридина 36-40%.
Способ получения 3-дихлорметилпиридина формулы
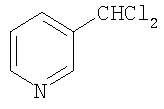 ,
,
заключающийся в том, что пиридин подвергают взаимодействию с четыреххлористым углеродом (CCl4) и метанолом (МеОН) в присутствии катализатора бромида железа (II) (FeBr2) при температуре 140°С в течение 6 ч при мольном соотношении [FeBr2]:[пиридин]:[CCl4]:[метанол]=1:100:200:200.
| РУБИНА К.И | |||
| и др., Свободнорадикальное хлорирование метилпроизводных пиридина, пиразина и тиазола N-хлорсукцинимидом, Химия гетероциклических соединений, 1989, №4, с.543-546 | |||
| KR 8201021 А, 07.06.1982 | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| US 5116993 A, 26.05.1992 | |||
| Устройство для управления каналами связи | 1973 |
|
SU548855A1 |
| US 4172203 A, 23.10.1979. | |||
Авторы
Даты
2008-02-10—Публикация
2006-05-04—Подача