Предлагаемое изобретение относится к области органической химии, в частности к способу получения 7,7-диметоксибицикло[2.2.1]гептадиена-2,5.
7,7-Диметоксибицикло[2.2.1]гептадиен-2,5 (7,7-диметоксинорборнадиен) является исходным реагентом для синтеза тетраметоксиэтилена, являющегося сильным восстановительным и метилирующим агентом (Л. Физер, М. Физер. Реагенты для органического синтеза. М.: Мир, 1971, 412-413 [1]).
7,7-Диметоксинорборнадиен (2) получают из 3,3-диметокситетрацикло[3.2.0.02,7.04,6]гептана (1) изомеризацией (катализатор - PdCl2) (R.W. Hoffmann, R. Hirsch, R. Fleming, M.T. Reetz. Chem. Ber., 105, 3532-3541 (1972) [2]).

Однако (1) является труднодоступным соединением, а его синтез представляет собой многостадийный процесс. Исходным соединением для получения (1) является тетрацикло[3.2.0.02,7.04,6]гептан-3-он (3), который был получен из 7-ацетоксибицикло[2.2.1]гептадиена (4) по следующей схеме (P.G. Gassman, D.S. Patton. J. Am. Chem. Soc., 90, 7276-7282 (1968) [3]):
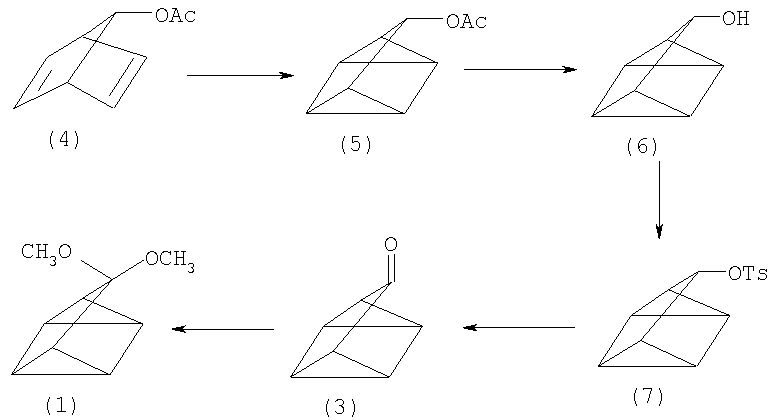
Общий выход (3) в расчете на прореагировавший (4) составляет 51%. Так, при облучении (4) в растворе пентана в течение 2 часов лампой Hanovia 450-W был получен 3-ацетокситетрацикло[3.2.0.02,7.04,6]гептан (5) (выход 90%), при восстановлении которого алюмогидридом лития (безводный эфир, 0°С) образуется 3-гидрокситетрацикло[3.2.0.02,7.04,6]гептан (6) (выход 92%). Затем к охлажденному раствору (6) в сухом пиридине добавляют п-толуолсульфонилхлорид и выдерживают смесь при -12°С в течение 12 часов, после соответствующей обработки (добавление концентрированной HCl, промывка водой, сушка, кристаллизация) были получены белые кристаллы 3-тозилокситетрацикло[3.2.0.02,7.04,6]гептана (7) с выходом 72%. Затем (7) растворяют в сухом диметилсульфоксиде и при 100°С быстро добавляют к смеси бикарбоната натрия в ДМСО, через 4-5 мин смесь выливают в лед, после многократной экстракции пентаном получают (3) (85%). После перемешивания (3) (20°С, 9 ч) в растворе метанола с триметилортоформиатом и п-толуолсульфокислотой и добавления в конце метоксида натрия, был получен (1) (87%) - исходное соединение для синтеза целевого продукта (2) [3]:

Метод имеет ряд существенных недостатков:
1. Многостадийный синтез.
2. Необходимость выделения промежуточных продуктов.
3. Необходимость проведения фотохимической реакции (синтез (5) проводится в стеклянных и кварцевых реакторах, объем которых строго ограничен).
4. Использование обезвоженных растворителей при синтезе промежуточных соединений (1), (6), (7).
5. Сложность обеспечения условий синтеза (6) (0°С) и (7) (-12°С).
6. Использование дорогостоящего катализатора хлорида палладия.
7. Сложности из-за образования побочных продуктов и значительного количества отходов.
В работе (R. Bicker, M. Kempf, H. Kessler. Synthesis, N7, 427-428 (1975) [4]) предложен улучшенный синтез диметилацеталя норборнадиенона (2):
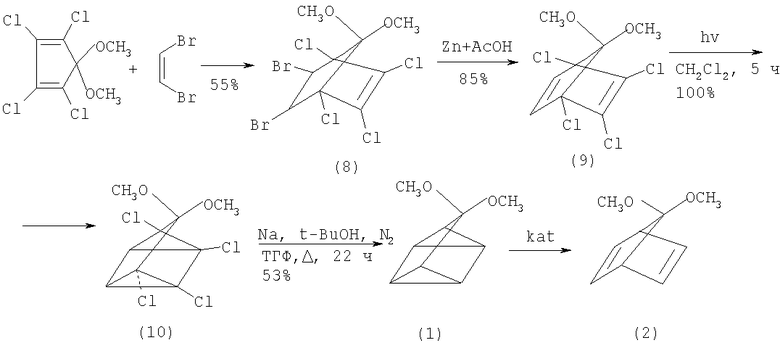
Конденсацией 5,5-диметокситетрахлорциклопентадиена с цис-1,2-дибромэтиленом с выходом 55% получен эндо-цис-5,6-дибром-1,2,3,4-тетрахлор-7,7-диметоксибицикло[2,2,1]гептен-2 (8), который при действии Zn и АсОН с выходом 85% превращается в 7,7-диметокси-1,2,3,4-тетрахлорбицикло[2,2,1]гептадиен-2,5 (9). Затем 6 г соединения (9) в 1400 мл СН2Cl2 облучают в фотореакторе (λ-254 нм) в течение 5 ч, после хроматографирования на силикагеле (бензол-петролейный эфир-этилацетат) вымывают 7,7-диметокси-1,2,3,4-тетрахлортетрацикло[3.2.0.02,7.04,6]гептан (10) (выход 100%). К смеси 26 ммолей (10), 23.4 г трет-BuOH и 52 мл абс. ТГФ прибавляют 0.69 г-атома Na, кипятят 22 часа в атмосфере N2, декантируют, выливают в 1000 мл воды, экстрагируют петролейным эфиром, растворитель упаривают и выделяют перегонкой в вакууме 7,7-диметокситетрацикло[3.2.0.02,7.04,6]гептан (1) (53%). Каталитическая изомеризация (1) приводит к (2) с выходом 85%.
Недостатки метода:
1. Многостадийность процесса.
2. Проведение реакции в среде N2 (синтез (1)).
3. Использование большого количества растворителей при фотооблучении (1400 мл СН2Cl2 на 6 г (9)).
4. Использование 4 молей металлического натрия для восстановления (10) в (1).
5. Длительность процесса (22 ч при синтезе (1)).
6. Образование неорганических отходов и сточных вод, которые необходимо утилизировать.
В работе (Р.И. Хуснутдинов, Н.А. Щаднева, А.Р. Байгузина, Ю.Ю. Лаврентьева, Р.Ю. Бурангулова, А.М. Атнабаева, У.М. Джемилев. Нефтехимия, т.44, №5, 382-389 (2004) [5]) описан метод синтеза 7,7-диметокси-НБД, основанный на взаимодействии 7-третбутоксинорборнадиена с системой CCl4-СН3-Мо(СО)6. Реакция проходит в 2 стадии: в начальном этапе 7-третбутокси-НБД претерпевает переэтерификацию с образованием 7-метокси-НБД, который на завершающей стадии окисляется метилгипохлоритом (СН3OCl генерируется из CCl4 и СН3ОН в условиях реакции) с образованием целевого 7,7-диметокси-НБД. Процесс проходит при большом избытке CCl4 и метанола при следующем соотношении реагентов [катализатор]:[7-t-BuO-НБД]:[CCl4]:[СН3ОН]=1:100:300:700.
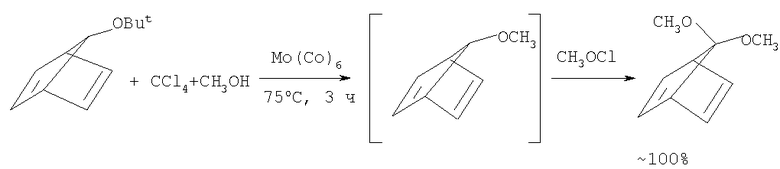
Этот метод взят нами за прототип.
Прототип имеет следующие недостатки:
1. Большой расход CCl4.
2. Огромный расход токсичного метанола (для успешного протекания реакции необходим семикратный избыток СН3ОН по отношению к 7-t-BuO-НБД).
3. Образование значительного количества побочных продуктов за счет превращения метанола в условиях реакции. Как следует из данных цитированной статьи [5], метанол в присутствии комплексов переходных металлов энергично окисляется с помощью CCl4 с образованием диметоксиметана (СН2(ОСН3)2, т.кипения 41°С) и метилформиата (т. кипения 34°С). Кроме того часть метанола превращается в диметиловый эфир (т. кипения 24°С).
Ниже приводится схема превращений СН3ОН и CCl4 под действием Мо(СО)6.
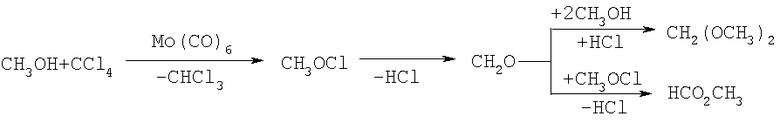
Как видно из схемы, в реакционной массе наряду с СН3ОН, CCl4, 7-t-BuO-НБД и 7-МеО-НБД присутствуют хлороформ, диметиловый эфир, метилформиат, диметоксиметан и HCl.
Из этой многокомпонентной смеси очень сложно выделить целевой 7-(МеО)2-НБД. Особые трудности в плане аппаратурного оформления процесса создают 2 газообразных продукта HCl и диметиловый эфир, концентрация которых тем выше, чем больше взято СН3ОН и CCl4 для реакции. Эти газы создают давление, величина которого постоянно повышается в ходе протекания процесса.
Задачей изобретения является упрощение технологического оформления процесса, уменьшение расхода реагентов, особенно токсичного метанола, упрощение и удешевление технологической стадии выделения целевого 7,7-диметоксинорборнадиена.
Для этого процесс получения 7,7-диметоксинорборнадиена путем переэтерификации 7-1-BuO-НБД метанолом в присутствии CCl4 и Мо-содержащего катализатора Мо(СО)6 с последующим окислением промежуточного 7-МеО-НБД метилгипохлоритом (метилгипохлорит генерируется в условиях реакции in situ из СН3ОН и CCl4 под действием катализатора) предлагается проводить при температуре 80-100°С и мольном соотношении реагентов [Мо(СО)6]:[t-BuO-НБД]:[CCl4]:[МеО]=1:100:100÷200:100÷400 в течение 2 ч по следующей схеме:

Преимущества предлагаемого метода.
1. Уменьшение продолжительности реакции (2 ч).
2. Уменьшение расхода токсичных реагентов (метанола - в 1,8÷7 раза, CCl4 - 1,3÷3 раза).
3. Упрощение и удешевление технологической стадии выделения целевого продукта.
Способ поясняется примерами:
ПРИМЕР 1. Реакции проводят в стеклянной ампуле (V=20 мл) или микроавтоклаве из нержавеющей стали (V=17 мл).
В микроавтоклав (ампулу) помещают под аргоном 0.1 ммоль Мо(СО)6, 10 ммоль 7-третбутоксинорборнадиена, 10 ммоль CCl4 и 10 ммоль МеОН (который играет роль реагента и растворителя одновременно), автоклав герметично закрывают (ампулу запаивают) и нагревают при 80°С в течение 2 часов. После окончания реакции микроавтоклав (ампулу) охлаждают до ˜20°С, вскрывают, реакционную массу фильтруют через слой силикагеля (2 г), непрореагировавшие метанол и CCl4 отгоняют, остаток перегоняют в вакууме.
Выделенный 7,7-диметоксибицикло[2.2.1]гептадиен-2,5 имел т.кип. 63°С/10 Па. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 6.32-6.37 (м, 4Н, 4СН), 3.28 (м, 2Н, 2СН), 2.90 (м, 6Н, СН3). Спектр ЯМР 13С (CDCl3, δ, м.д.): 51.74 (С-1, С-4); 138.90 (С-2, С-3); 138.84 (С-5, С-6); 132.82 (С-7); 51.68 (ОСН3, С-8, С-9). Найдено, %: С 70.88; Н 8.01. С9Н12O2. Вычислено, %: С 71.02; Н 7.95.
Другие примеры, подтверждающие способ, приведены в таблице 1.
7,7-диметоксибицикло[2.2.1]гептадиена-2,5 с помощью МеОН и CCl4 под действием молибденсодержащего катализатора - Мо(СО)6
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЦИКЛОГЕПТАТРИЕНА-1,3,5 | 2005 |
|
RU2285689C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-ВИНИЛЦИКЛОГЕКСЕНА-1 | 2008 |
|
RU2378243C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА 5-АЦЕТИЛПИРРОЛ-2-КАРБОНОВОЙ КИСЛОТЫ | 2008 |
|
RU2404162C2 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВЫХ ЭФИРОВ 2-ТИОФЕНКАРБОНОВОЙ КИСЛОТЫ И ЕЕ ПРОИЗВОДНЫХ | 2007 |
|
RU2359968C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИМЕТИЛОВОГО ЭФИРА 2,5-ТИОФЕНДИКАРБОНОВОЙ КИСЛОТЫ ИЗ 2-ТИОФЕНКАРБОНОВОЙ КИСЛОТЫ | 2008 |
|
RU2402541C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТАНА | 1996 |
|
RU2126784C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ДИХЛОРМЕТИЛПИРИДИНА | 2006 |
|
RU2316547C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЦЕТОФЕНОНА (МЕТИЛФЕНИЛКЕТОНА) | 2002 |
|
RU2237055C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ДИХЛОРМЕТИЛИЗОХИНОЛИНА | 2008 |
|
RU2402535C2 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТАНОЛА-1 | 2010 |
|
RU2448942C2 |
Изобретение относится к способу получения 7,7-диметоксибицикло[2.2.1]гептадиена-2,5, который является исходным реагентом для синтеза тетраметоксиэтилена, являющегося сильным восстановительным и метилирующим агентом. Способ заключается в переэтерификации 7-третбутоксинорборнандиена (7-t-BuO-НБД) метанолом в присутствии четыреххлористого углерода и Mo-содержащего катализатора Мо(СО)6, с последующим окислением промежуточного 7-метоксинорборнадиена метилгипохлоритом, образующегося in situ из четыреххлористого углерода и метанола. При этом реакцию проводят при 80-100°С в течение 2 ч и мольном соотношении [Mo(CO)6]:[t-BuO-НБД]:[CCl4]:[МеОН]=1:100:100÷200:100÷400. Способ позволяет уменьшить продолжительность реакции, расход токсичных реагентов, упростить и удешевить технологическую стадию выделения целевого продукта. 1 табл.
Способ получения 7,7-диметоксибицикло[2.2.1]-гептадиена-2,5 формулы

путем переэтерификации 7-третбутоксинорборнандиена (7-t-BuO-НБД) метанолом в присутствии четыреххлористого углерода и Мо-содержащего катализатора Мо(СО)6, с последующим окислением промежуточного 7-метоксинорборнадиена метилгипохлоритом, образующегося in situ из четыреххлористого углерода и метанола, отличающийся тем, что реакцию проводят при 80-100°С в течение 2 ч и мольном соотношении [Мо(СО)6]:[t-BuO-НБД]:[CCl4]:[МеОН]=1:100:100÷200:100÷400.
| ХУСНУТДИНОВ Р.И | |||
| и др | |||
| Присоединение CCl к ненасыщенным соединениям, катализируемое комплексами марганца, ванадия и молибдена | |||
| Нефтехимия, 2004, т.44, N5, с.380-387 | |||
| R.BICKER et al | |||
| Improved synthesis of norbornadienone dimethyl acetal | |||
| Synthesis, 1975, N7, pp.427-428 | |||
| P.G.GASSMAN et al | |||
| Acid-catalyzed rearrangement of quadricyclanone and |
Авторы
Даты
2008-08-20—Публикация
2006-06-01—Подача