Область изобретения
Настоящее изобретение относится к новым производным индолинона, которые могут быть полезны в качестве лекарственных средств, к способам получения указанных соединений, промежуточным соединениям, полезным при получении указанных соединений, к фармацевтическим композициям, включающим данные соединения, и к применению данных соединений в качестве лекарственных средств.
Предпосылки изобретения
WO 96/40116 раскрывает, что определенные пирролзамещенные производные 2-индолинона, являющиеся ингибиторами рецептора тирозинкиназы, полезные при лечении состояний, чувствительных к ингибиторам рецептора тирозинкиназы, например пролиферативных нарушений, таких как рак. Предпочтительным соединением, описанным на странице 17, является 3-(2,3-диметилпиррол-5-ил)метилен]-2-индолинон, так же известный как SU5416. К сожалению, обнаружено, что это соединение проявляет слабую растворимость в воде и низкую биодоступность при пероральном и внутривенном введении.
WO 99/61422 описывает последующие пирролзамещенные производные 2-индолинона как ингибиторы рецептора тирозинкиназы. Предпочтительным соединением, описанным как соединение 5 на странице 214, является 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илметил)-1Н-пиррол-3-ил]пропионовая кислота, так же известная как SU6668. Обнаружено, что это соединение обладает очень высокой пероральной активностью относительно SU5416, но сообщается о недостаточной способности этого соединения ингибировать рецептор тирозинкиназы Flt-3 (Abstract 497, Anne-Marie O'Farrell et al., America Society of Hematology Meeting, Orlando, Florida, USA, December 7-11, 2001). Flt-3 является важной мишенью для ингибитора тирозинкиназы, особенно при лечении острой миелоидной лейкемии (ОМЛ), поскольку у около 30% пациентов с ОМЛ обнаруживается наличие мутантных форм Flt-3, которые приводят к конститутивному тирозин-фосфорилированию Flt-3 (Levis et al., Blood, 1 August, 2001, Vol. 98. No. 3, рр. 885-887).
WO 01/60814 описывает пирролзамещенные производные 2-индолинона, содержащие определенные амидные заместители, непосредственно присоединенные к пиррольному кольцу как ингибиторы рецептора тирозинкиназы.
WO 02/055517 описывает индолиноны, содержащие арильные заместители в положении 4, которые проявляют способность модулировать протеинкиназу.
WO 01/42243 описывает определенные соединения, содержащие две или более пирролзамещенные 2-индолиноновые группы, ковалентно связанные вместе через положение 3 каждого пиррола одной или более связующими группами, так же полезные как ингибиторы рецептора тирозинкиназы.
Тем не менее, с учетом тяжести состояний, отвечающих на ингибиторы рецептора тирозинкиназы и недавней идентификации специфических мишеней ингибитора киназы, требуется наличие новых ингибиторов рецептора тирозинкиназы с различными свойствами.
Краткое описание изобретения
В настоящее время обнаружено, что пирролзамещенные производные 2-индолинона, содержащие определенные карбоксиамидоэтильные группы в положении 4 пиррола, являются ингибиторами рецептора тирозинкиназы в соответствии с требуемыми свойствами.
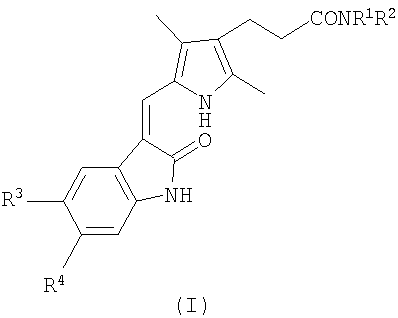
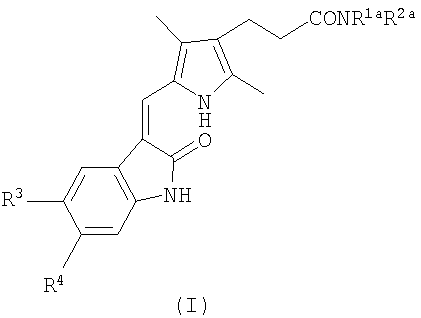
Соответственно настоящее изобретение предоставляет соединение формулы (I):

где (i) R1 представляет атом водорода или (1-4C)алкильную группу; и R2 представляет группу формулы -А1-NR5R6, в которой каждый из заместителей R5 и R6 независимо представляет атом водорода или (1-4C)алкильную группу, и А1 представляет (СН2)m, (СН2)n-А2-(СН2)p или (CH2CH2O)qCH2CH2, где m равно целому числу от 2 до 10, и каждое из n и p равно целому числу от 1 до 6, А2 представляет СН=CH, фенилен, бифенилен, циклогексилен или пиперазинилен, и q равно 1, 2 или 3;
(ii) R1 и R2 вместе представляют -A3-NR7-А4,где каждый из А3 и А4 независимо представляет (СН2)r или (CH2CH2O)sСН2СН2, где r равно целому числу от 2 до 6, s равно 1, 2 или 3, и R7 представляет атом водорода или (1-4C)алкильную группу;
(iii) R1 и R2 вместе с атомом азота, к которому они присоединены, представляют пиперидинильную группу, где пиперидинильная группа содержит заместитель формулы -А5-R8 в положении 4, в которой А представляет (1-4C)алкилен, и R8 представляет пиперидин-4-ил; или
(iv) R1 и R2 вместе с атомом азота, к которому они присоединены, представляют пирролидинильную, пиперидинильную или морфолиногруппу; и
R3 и R4, каждый независимо представляет атом водорода, атом галогена, (1-4C)алкильную группу, (1-4C)алкоксигруппу, фенильную группу, которая незамещена или замещена одним или двумя заместителями, выбранными независимо из атома галогена, (1-4C)алкильной группы и (1-4C)алкоксигруппы, группы формулы R9S(О)2NR10-, группы формулы R11N(R12)S(О)2-, группы формулы R13С(О)N(R14)- или группы формулы R15N(R16)С(О)-, в которых каждый из R9, R11, R13 и R15 независимо представляет (1-4C)алкильную группу или фенильную группу, незамещенную или замещенную одним или двумя заместителями, выбранными независимо из атома галогена, (1-4C)алкильной группы и (1-4C)алкоксигруппы, и каждый из R10, R12, R14 и R16 независимо представляет атом водорода или (1-4C)алкильную группу;
или фармацевтически приемлемую соль данного соединения.
Обнаружено, что соединения формулы (I) являются сильными и селективными ингибиторами одного или более рецепторов тирозинкиназы PDGFR (фактор роста, выбранный из тромбоцитов), с-Kit, VEGFR (фактор роста сосудистого эндотелия) и Flt-3 в исследованиях в цельных клетках.
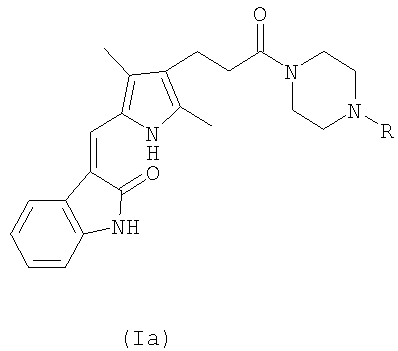
Изобретение также предоставляет соединения формулы (Ia):
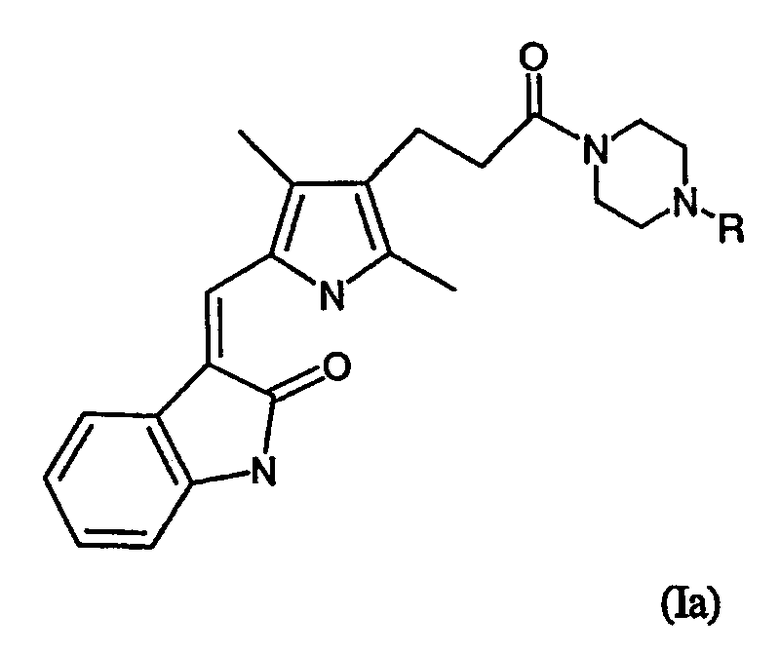
где R представляет водород, метил или этил; или их фармацевтически приемлемые соли.
Изобретение также предоставляет фармацевтические композиции, включающие соединения изобретения или их фармацевтически приемлемые соли и фармацевтически приемлемый носитель.
Кроме того, изобретение обеспечивает способ лечения состояния, восприимчивого к ингибитору тирозинкиназы; причем способ включает введение пациенту соединения изобретения в эффективном количестве.
Далее изобретение относится к соединению изобретения, как указано выше, для применения в медицинской терапии, а также к применению соединения изобретения в производстве лекарственного средства или композиций для лечения заболевания или состояния восприимчивого к ингибитору тирозинкиназы.
Подробное описание изобретения
Настоящее изобретение предоставляет замещенные производные 2-индолина, которые содержат в положении 4 пиррольного кольца карбоксиамидометильные заместители.
Как использовано в данном описании, термины "алкил" и "алкилен" означают разветвленную или неразветвленную группу. Тем не менее, названия специфических групп, таких как этил, этилен, пропил, пропилен, бутил или бутилен означают неразветвленные группы или радикалы, если не указано иначе, такие как, например, проп-2-ил. Примерами алкильных групп являются метил, этил, пропил, проп-2-ил и бутил.
Примерами алкиленовых групп являются метилен, этилен, пропилен и бутилен.
Термин "атом галогена" включает фтор, хлор и бром.
Термин "терапевтически эффективное количество" означает количество, достаточное для проведения лечения при введении пациенту, нуждающемуся в указанном лечении.
Термин "лечение", используемый в данном описании, относится к лечению заболевания или клинических состояний пациента, такого как млекопитающее (в частности, человека) и включает:
(а) предотвращение заболевания или клинического состояния, т.е. профилактическое лечение пациента;
(b) улучшение состояния при заболевании или клиническом состоянии, т.е. излечение или регрессию причины заболевания или клинического состояния пациента;
(с) подавление болезни или клинического состояния, т.е. замедление или прекращение развития заболевания или клинического состояния пациента; или
(d) облегчение симптомов заболевания или клинического состояния пациента.
Термин "фармацевтически приемлемая соль" относится к соли, полученной из основания или кислоты, которая является приемлемой для введения пациенту, такому как млекопитающее. Такие соли могут быть производными фармацевтически приемлемых неорганических или органических кислот.
Соли, производные фармацевтически приемлемых кислот, включают соли уксусной, бензолсульфоновой, бензойной, камфорсульфоновой, лимонной, этансульфоновой, фумаровой, глюконовой, глутаминовой, бромистоводородной, хлористоводородной, молочной, малеиновой, малоновой, миндальной, метансульфоновой, муконовой, азотной, пантотеиновой, фосфорной, янтарной, серной, винной, п-толуолсульфоновой, ксинафоновой (1-гидрокси-2-нафтойной) и подобных кислот. Особенно предпочтительными являются соли, производные фумаровой, бромистоводородой, хлористоводородной, уксусной, серной, фосфорной, метансульфоновой, п-толуолсульфоновой, ксинафоновой, винной, лимонной, малеиновой, малоновой, янтарной и бензойной кислот.
Предпочтительной подгруппой соединений формулы (I) является та, в которой:
(i) R1 представляет атом водорода или (1-4C)алкильную группу; и R2 представляет группу формулы -А1-NR5R6, в которой каждый из заместителей R5 и R6 независимо представляет атом водорода или (1-4C)алкильную группу, и А1 представляет (СН2)m, (СН2)n-А2-(СН2)p или (CH2CH2O)qCH2CH2, где m равно целому числу от 2 до 10, и каждое из n и p равно целому числу от 1 до 6, А2 представляет СН=CH, фенилен, бифенилен, циклогексилен или пиперазинилен, и q равно 1, 2 или 3;
(ii) R1 и R2 вместе представляют -A3NR7-A4-, где каждый из A3 и А4 независимо представляет (СН2)r или (СН2СН2O)sСН2СН2, где r равно целому числу от 2 до 6, s равно 1, 2 или 3, и R7 представляет атом водорода или (1-4C)алкильную группу; или
(iii) R1 и R2 вместе с атомом азота, к которому они присоединены, представляют пиперидинильную группу, где пиперидинильная группа содержит заместитель формулы -А5-R8 в положении 4, в которой А представляет (1-4C)алкилен, и R8 представляет пиперидин-4-ил.
Обнаружено, что соединения, принадлежащие к указанной выше предпочтительной подгруппе, показывают хорошую растворимость в воде и хорошую абсорбцию при пероральном введении.
В данной подгруппе соединений предпочтительно
(i) R1 представляет атом водорода или (1-4C)алкильную группу; и R2 представляет группу формулы -А1-NR5R6, в которой каждый из заместителей R5 и R6 независимо представляет атом водорода или (1-4C)алкильную группу, и А1 представляет (СН2)m, (СН2)n-А2-(СН2)p или (CH2CH2O)qCH2CH2, где m равно целому числу от 2 до 10, и каждое из n и p равно целому числу от 1 до 6, А2 представляет СН=CH, фенил-1,3-ен, фенил-1,4-ен, бифенил-2,2'-ен, циклогексил-1,3-ен или пиперазинил-1,4-ен, и q равно 1, 2 или 3;
(ii) R1 и R2 вместе представляют -A3-NR7-A4-, где каждое из A3 и А4 независимо представляет (СН2)r или (СН2СН2O)sСН2СН2, где r равно целому числу от 2 до 6, s равно 1, 2 или 3, и R7 представляет атом водорода или (1-4C)алкильную группу; или
(iii) R1 и R2 вместе с атомом азота, к которому они присоединены, представляют пиперидинильную группу, где пиперидинильная группа содержит заместитель формулы -А5-R8 в положении 4, в которой А представляет (1-4C)алкилен, и R8 представляет пиперидин-4-ил.
Предпочтительно
(i) R1 представляет метильную группу; и R2 представляет группу формулы -А1-NR5R6, в которой заместитель R5 представляет атом водорода, R6 представляет метильную группу, и А1 представляет (СН2)m, (СН2)n-А2-(СН2)p или (CH2CH2O)qCH2CH2, где m равно целому числу от 2 до 10, и каждое из n и p равно 1 или 2, А2 представляет СН=CH, фенил-1,3-ен, фенил-1,4-ен, бифенил-2,2'-ен, циклогексил-1,3-ен или пиперазинил-1,4-ен, и q равно 1, 2 или 3;
(ii) R1 и R2 вместе представляют -A3-NR7-A4-, где каждое из A3 и А4 независимо представляет (СН2)r или (СН2СН2O)sСН2СН2, где r равно целому числу от 2 до 6, s равно 1 или 2, и R7 представляет атом водорода или (1-4C)алкильную группу; или
(iii) R1 и R2 вместе с атомом азота, к которому они присоединены, представляют пиперидинильную группу, где пиперидинильная группа содержит заместитель формулы -А5-R8 в положении 4, в которой А представляет пропилен, и R8 представляет 4-пиперидинил.
Более предпочтительно
(i) R1 представляет метильную группу; и R2 представляет группу формулы -А1-NR5R6, в которой заместитель R5 представляет атом водорода, R6 представляет метильную группу, и А1 представляет (СН2)m, где m равно 2, 3, 4, 5, 6, 7, 8, 9 или 10; (СН2)n-А2-(СН2)p, где каждое из n и p равно 1, и А2 представляет СН=CH, фенил-1,3-ен, фенил-1,4-ен, бифенил-2,2'-ен или циклогексил-1,3-ен; (СН2)n-А2-(СН2)p, где каждое из n и p равно 2, и А2 представляет пиперазинил-1,4-ен; или (CH2CH2O)qCH2CH2, где q равно 2 или 3;
(ii) R1 и R2 вместе представляют -(СН2)2-NH-(СН2)2-, -(СН2)2-N(СН3)-(СН2)2-, -(СН2)2-N(СН2СН3)-(СН2)2-, -(СН2)2-NH-(СН2)3- или -(СН2СН2О)2СН2СН2-NH-(СН2СН2О)СН2СН2-; или
(iii) R1 и R2 вместе с атомом азота, к которому они присоединены, представляют пиперидинильную группу, где пиперидинильная группа содержит заместитель формулы -А5-R8 в положении 4, в которой А представляет пропилен, и R8 представляет пиперидин-4-ил.
Особенно предпочтительна подгруппа соединений, где R1 представляет метильную группу и R2 представляет группу формулы -А1-NR5R6, в которой заместитель R5 представляет атом водорода, R6 представляет метильную группу и А1 представляет (СН2)m или СН2-СН=СН2-СН2, где m равно целому числу от 2 до 6.
Обнаружено, что соединения, принадлежащие к данной подгруппе, демонстрируют особенно хорошую активность как ингибиторы одного или более указанных выше рецепторов тирозинкиназы.
В пределах данной подгруппы предпочтительно А1 представляет (СН2)m или СН2-СН=СН2-СН2, где m равно 2, 3 или 4.
Более предпочтительно, если А1 представляет (СН2)2, (СН2)3 или СН2-СН=СН2-СН2.
Особенно предпочтительными являются соединения, где А1 представляет (СН2)2.
Другой предпочтительной подгруппой соединений являются соединения, где R1 и R2 вместе представляют -A3-NR7-A4-, где каждый из A3 и А4 независимо представляет (СН2)r или (СН2СН2O)sСН2СН2, где r равно целому числу от 2 до 6, s равно 1, 2 или 3, и R7 представляет атом водорода или (1-4C)алкильную группу.
Обнаружено, что соединения, принадлежащие к данной подгруппе, также проявляют особенно хорошую активность.
В данной подгруппе предпочтительно R1 и R2 вместе представляют -(СН2)2-NR7-(СН2)2- или -(СН2)2-NR7(СН2)3-, в особенности -(СН2)2-NR7-(СН2)2-.
Примерами конкретных значений R7 являются водород, метил, этил, пропил, проп-2-ил и бутил.
Соединения, где R7 означает водород, являются особенно предпочтительными.
При рассмотрении R3 и R4 примерами конкретных значений являются:
водород;
для атома галогена: фтор, хлор или бром, особенно бром;
для (1-4С)алкильной группы: метил;
для (1-4С)алкоксигруппы: метокси;
для незамещенной или замещенной фенильной группы: фенил;
для R8, R10, R12 и R14: метил или фенил;
для R9, R11, R13 и R15: водород; и
для группы, формулы R12С(О)N(R13)-: CH3С(О)NH- и C6H5С(О)NH-.
Предпочтительно каждый из R3 и R4 независимо представляет атом водорода, атом брома, СН3С(О)NH- или С6Н5С(О)NH-. Более предпочтительно, если каждый из R3 и R4 независимо представляет атом водорода.
Другой предпочтительной группой соединений формулы (I) являются соединения, где:
(i) R1 представляет метильную группу, и R2 представляет группу формулы -А1-NHCH3, в которой А1 представляет (СН2)m, CH2CH=CHCH2, CH2-фенилен-CH2 или CH2-циклогексилен-CH2, где m равно целому числу от 2 до 8; или
(ii) R1 и R2 вместе представляют -(СН2)2-NH-(СН2)2-, -(СН2)2-N(СН3)-(СН2)2-, -(СН2)2-N(СН2СН3)-(СН2)2- или -(СН2)2-NH-(СН2)3-; и
R3 и R4 каждый независимо представляет атом водорода.
Обнаружено, что соединения, принадлежащие к данной подгруппе, показывают особенно хорошую активность как ингибиторы одного или более указанных выше рецепторов тирозинкиназы. В частности, такие соединения имеют значение IC50 для ингибирования VEGFR тирозинкиназы менее чем 1 мкмоль в внутриклеточном Ca2+ FLIPR или в методе иммунопреципитации, описанном ниже.
Более предпочтительной подгруппой соединений в пределах указанной выше подгруппы являются соединения, где:
(i) R1 представляет метильную группу, и R2 представляет группу формулы -А1-NHCH3, в которой А1 представляет (СН2)m, CH2CH=CHCH2 или CH2-(1,4-фенилен)-CH2, где m равно 2 или 3; или
(ii) R1 и R2 вместе представляют -(СН2)2-NH-(СН2)2-, -(СН2)2-N(СН3)-(СН2)2-, -(СН2)2-N(СН2СН3)-(СН2)2- или -(СН2)2-NH-(СН2)3-.
Соединения, принадлежащие к данной более предпочтительной подгруппе, имеют значение IC50 для ингибирования как VEGFR, так и PDGFR тирозинкиназы менее чем 1 мкмоль в внутриклеточном Ca2+ FLIPR или в методе иммунопреципитации, описанном ниже.
Особенно предпочтительной подгруппой соединений формулы (I) являются соединения формулы (Ia):

в которой R представляет водород, метил или этил, и их фармацевтически приемлемые соли.
Заслуживающими особого внимания соединениями формулы (Ia) являются:
3-[3,5-диметил-4-(3-оксо-3-пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-он и
3-[3,5-диметил-4-[3-оксо-3-(4-этил)пиперазин-1-илпропил]-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-он.
Особенно предпочтительным является соединение, 3-[3,5-диметил-4-(3-оксо-3-пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-он и его фармацевтически приемлемые соли.
Обнаружено, что данное соединение является очень сильным и селективным ингибитором PDGFR, с-Kit, VEGFR и Flt-3. Обнаружено также, что оно обладает высокой растворимостью в воде и замечательной абсорбцией при пероральном введении крысам.
Другим соединением формулы (I), заслуживающим особого внимания, является 3-[3,5-диметил-4-(3-оксо-3-гомопиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-он.
Соединения формулы (I) являются полезными в качестве ингибиторов рецептора тирозинкиназы при лечении пролиферативных нарушений, таких как формы рака, включая, но, не ограничиваясь ими, острую миелоидную лейкемию, мелкоклеточный рак легких, рак простаты, гастроинтестинальный рак, рак груди и рак мозга, и прочие пролиферативные нарушения, такие как рестеноз. Данные соединения также могут быть полезны для ограничения роста солидных опухолей.
В соответствии с другим аспектом настоящее изобретение относится к способу получения соединения формулы (I), включающий
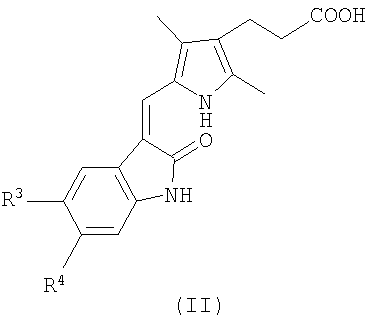
(а) взаимодействие соединения формулы (II)

или его реакционноспособного производного с соединением формулы (III)

или его солью, где значения R1, R2, R3, и R4 определены выше, или
(b) для соединения формулы (I), в которой R5 или R7 представляют атом водорода, снятие защиты в соединении формулы (IV)
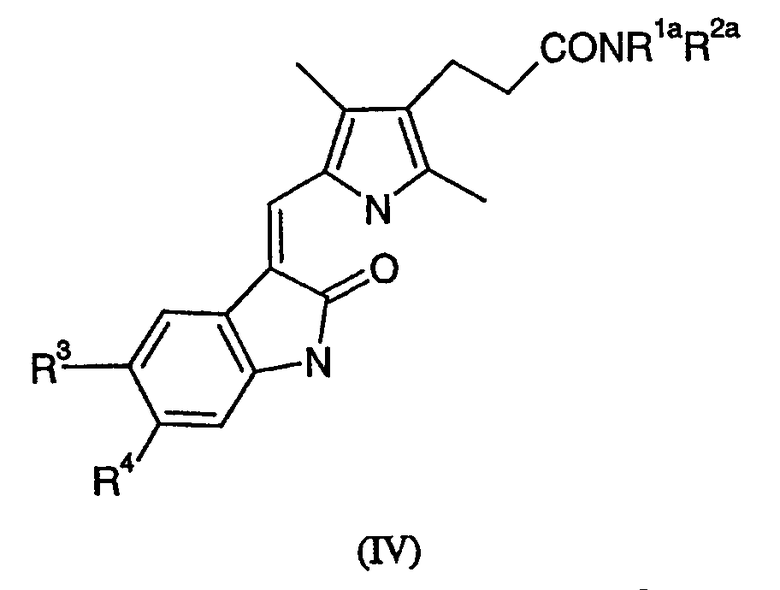
в которой R1a и R2a имеют значения, определенные выше для R1 и R2, кроме тех, в которых R5 или R7 заменены группами R5a или R7a соответственно, где R5a или R7a, каждый представляет аминозащитную группу, и значения R3 и R4 определены выше;
с последующим, если необходима фармацевтически приемлемая соль, получением фармацевтически приемлемой соли.
В способе (а) взаимодействие соединения формулы (II) с соединением формулы (III) можно удобно проводить, используя стандартный метод образования амида. Например, кислоту формулы (II) можно обработать таким конденсирующим агентом, как гексафторфосфат бензотриазол-1-илокситриспирролидинфосфония (РуВОР) или гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU), в присутствии основания, такого как N,N-диизопропилэтиламин и 1-гидрокси-7-азабензотриазол (HOAt), с последующим добавлением соединения формулы (III). Подходящие растворители включают апротонные органические растворители, такие как диметилформамид. Температура проведения реакции находится в пределах от 0 до 50°С. Альтернативно соединение формулы (II) может быть преобразовано в галогенангидрид кислоты, например хлорангидрид, и затем подвергнуто взаимодействию с соединением формулы (III).
В способе (b) аминозащитная группа, представленная R5a или R7a, может быть общепринятой аминозащитной группой. Примеры аминозащитных групп приведены в Greene and Wuts, Protecting Groups in Organic Syntesis, 2nd Edition, John Wiley & Sons, NY, 1991 и McOmie, Protecting Groups in Organic Chemistry, Plenum Press, NY, 1973. Примеры аминозащитных групп включают ацильные группы, например (1-6С)алканоильные группы, такие как ацетил; (1-6С)алкоксикарбонильные группы, такие как трет-бутоксикарбонил; арилметоксикарбонильные группы, такие как бензилоксикарбонил; и арилметильные группы, такие как бензил.
Ацильная аминозащитная группа может быть легко удалена действием кислоты, такой как трифторуксусная кислота.
Соединения формулы (IV) могут быть получены взаимодействием соединения формулы (II) с амином формулы (V)
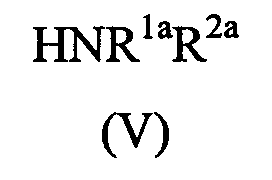
в которой R1a и R2a определены выше в способе получения(а).
Соединения формулы (II) известны, например, из WO 99/61422. Их также получают взаимодействием соединения формулы (VI)

с соединением формулы (VII)
Взаимодействие удобно проводить в присутствии основания, такого как пиридин, в органическом растворителе, таком как этанол, и при кипячении с обратным холодильником.
Соединения формулы (VII) известны, например, из WO 99/61422.
Соединения формулы (VI) могут быть получены взаимодействием соединения формулы (VIII)
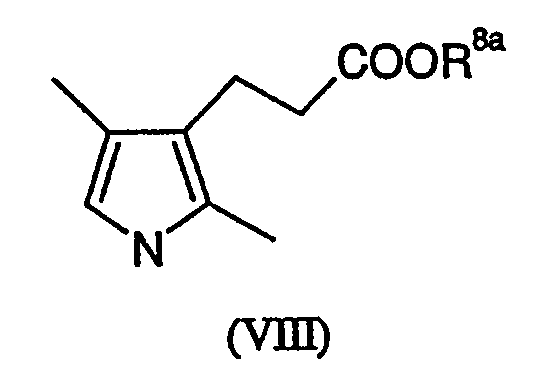
в которой R8a представлен карбоксизащитной группой, например (1-6С)алкильной группой, такой как метил, с оксихлоридом фосфора и диметилформамидом, с последующим удалением защитной группы R8a, например щелочным гидролизом.
Соединения формулы (VIII) могут быть получены через соответствующую кислоту (R8a представляет водород), следуя методикам, описанным в прилагаемых примерах.
Некоторые из промежуточных соединений, описанных выше, являются, как полагают, новыми, например соединение формулы (VI). Все такие новые промежуточные соединения предоставлены как дополнительные аспекты изобретения.
Фармацевтические композиции
При применении в качестве лекарственных средств соединения изобретения обычно следует вводить в виде фармацевтических композиций. Композиции включают соединение изобретения в качестве активного ингредиента вместе с фармацевтически приемлемым разбавителем или носителем. Композиции могут производиться для какого-либо способа введения в организм, в частности для перорального, ректального, трансдермального, подкожного, внутривенного, внутримышечного или интраназального введения. Композиции могут производиться в какой-либо из удобных форм, например в форме таблеток, капсул, растворов, суспензий, дисперсий, сиропов, спреев, гелей, суппозиториев, пластинок и эмульсий.
Получение фармацевтических композиций, пригодных для частных способов введения, хорошо известно специалисту в области фармации. Дополнительно ингредиенты для таких композиций являются коммерчески доступными, например, от Sigma (St. Louis, MO). Стандартная методика получения фармацевтических композиций, которая приводится ниже в качестве иллюстрации, описана в Remington: The Science and Practice of Pharmacy, 20th Edition, Lippincott Williams & White, Baltimore, MD (2000); и H.C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th Edition, Lippincott Williams & White, Baltimore, MD (1999).
В соответствии с другим аспектом настоящее изобретение предоставляет фармацевтические композиции, которые включают терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли вместе с фармацевтически приемлемым разбавителем или носителем.
В предпочтительном варианте фармацевтические композиции изобретения пригодны для перорального введения. Пригодные для перорального введения фармацевтические композиции могут быть в форме капсул, таблеток, пилюль, пластинок, саше, драже, порошков, гранул или в форме растворов или жидкой суспензии и тому подобное; каждое содержит предписанное количество соединения настоящего изобретения в качестве активного компонента.
Композиция в форме таблеток может быть изготовлена, используя любой пригодный фармацевтический носитель(ли), обычно используемый(ые) для приготовления твердых композиций. Примеры таких носителей включают стеарат магния, крахмал, лактозу, сахарозу, микрокристаллическую целлюлозу и связующее вещество, например, поливинилпирролидон. Кроме того, активное соединение может быть введено в единичную дозированную форму с контролируемым высвобождением, такую как таблетка, заключенная в гидрофильную или гидрофобную матрицу.
Композиция в форме капсулы может быть приготовлена, используя обычные методики инкапсулирования, например введение активного соединения и наполнителя в жесткую желатиновую капсулу. Альтернативно может быть приготовлена и помещена в жесткую желатиновую капсулу полутвердая матрица активного соединения и полиэтиленгликоля с высокой молекулярной массой; или раствор активного соединения в полиэтиленгликоле или суспензия в съедобном масле может быть приготовлена и помещена в мягкую желатиновую капсулу.
В другом предпочтительном воплощении соединение изобретения может быть приготовлено для инъекции, например для внутривенной инъекции. Типичная композиция для внутривенной инъекции состоит из стерильного водного изотонического раствора, содержащего, например, активное соединение и декстрозу или хлорид натрия, или смесь декстрозы и хлорида натрия. Другие примеры пригодных эксципиентов включают лактатную инъекцию Рингера, лактатную инъекцию Рингера плюс декстрозную инъекцию, Normosol-М и декстроза, Isolyte Е, ацилированную инъекцию Рингера и тому подобное. Дополнительно могут быть включены в фармацевтическую композицию сорастворитель, например полиэтиленгликоль; хелатный агент, например этилендиаминтетрауксусная кислота; стабилизирущий агент, например циклодекстрин; и антиоксидант, например метабисульфит натрия.
В соответствии с другим аспектом настоящее изобретение предусматривает соединение формулы (I) или его фармацевтически приемлемую соль для применения в терапии.
Соединения формулы (I) полезны как ингибиторы рецептора тирозинкиназы. Согласно другому аспекту настоящее изобретение рассматривает применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения состояния, чувствительного к ингибиторам тирозинкиназы.
Согласно еще одному аспекту настоящее изобретение предоставляет фармацевтическую композицию для лечения состояния, чувствительного к ингибиторам тирозинкиназы, которая включает соединение формулы (I) или его фармацевтически приемлемую соль.
Настоящее изобретение дополнительно предоставляет способ лечения состояния, чувствительного к ингибитору тирозинкиназы, который включает введение пациенту, нуждающемуся в указанном лечении, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.
Пациент может быть, например, млекопитающим, таким как домашнее животное или предпочтительно человек.
Доза (или эффективное количество) соединения, вводимая пациенту, может зависеть от многих факторов, включая конкретное используемое соединение, природу и тяжесть состояния, которое лечат, вид, к которому относится пациент, массу пациента и способ введения препарата. В общем, вводят дозу в пределах от 0,01 до 100 мкмоль на 1 кг массы тела.
Следующие неограничивающие примеры иллюстрируют типичные фармацевтические композиции изобретения.
Пример фармацевтической композиции А
Твердые желатиновые капсулы для перорального введения получают следующим образом:
Типичная методика: компоненты тщательно смешивают и затем заполняют жесткую желатиновую капсулу (460 мг композиции на капсулу)
Пример фармацевтической композиции В
Твердые желатиновые капсулы для перорального введения получают следующим образом:
Типичная методика: компоненты тщательно смешивают, затем просеивают через сито No.45 U.S. и заполняют жесткую желатиновую капсулу (200 мг композиции на капсулу).
Пример фармацевтической композиции С
Капсулы для перорального введения получают следующим образом:
Типичная методика: компоненты тщательно смешивают и затем заполняют жесткую желатиновую капсулу (300 мг композиции на капсулу).
Пример фармацевтической композиции D
Таблетки для перорального введения получают следующим образом:
Типичная методика: компоненты тщательно смешивают и затем заполняют жесткую желатиновую капсулу (460 мг композиции на капсулу).
Пример фармацевтической композиции Е
Инъекционное лекарственное средство получают следующим образом:
Типичная методика: компоненты тщательно смешивают и рН доводят до 4±0,5, используя HCl (0,5N) или NaOH (0,5N).
Примеры синтеза
Следующие примеры синтезов приведены для иллюстрации изобретения и никоим образом не должны рассматриваться как ограничивающие объем изобретения.
Общая часть
Используемые реагенты и растворители получены от коммерческих поставщиков, если не указано иное. Все реакции проводят при комнатной температуре и без изоляции от окружающей атмосферы, если не указано иное. Масс-спектры ионного распыления (IS-МС) получены с помощью масс-спектрометра PE Sciex API150EX. Спектры ядерного магнитного резонанса (ЯМР) записаны при 300 МГц. Химический сдвиг в слабом поле (δ) выражается в миллионных долях относительно тетраметилсилана. Аналитическую ВЭЖХ с обращенной фазой (ОФ-ВЭЖХ) выполняли на приборе HP1100 с применением колонки 2,1 мм × 50 мм, 3,5 мкм С18 Zorbax Plus Bonus-RP. Для аналитического разделения, за 0,5 минут изократического периода следует 4,5 минут градиента смеси 0,1% трифторуксусная кислота/ацетонитрил 0,1% в воде при объемном расходе 0,5 мл/минута. Препаративную ОФ-ВЭЖХ выполняли, используя буфер трифторуксусной кислоты (ТФУК) в градиенте смеси ацетонитрил/вода на системе Varian ProStar с использованием колонки 2,5 или 10 см × 25 см, 8 мкм С18 Raining Dynamax при объемном расходе 10 или 50 мл/минута, соответственно.
Получение промежуточных соединений
Промежуточное соединение 1
2-Карбоксиэтил-3,5-диметил-1Н-пиррол-4-карбоновая кислота.
Диэтиловый эфир 3,5-диметил-2,4-пирролдикарбоновой кислоты (200 г, 836 ммоль) помещают в химический стакан объемом 1 л и обрабатывают 400 мл концентрированной серной кислоты (H2SO4). Смесь перемешивают, нагревают до 45°С с помощью тепловой пушки и затем выдерживают 25 минут при 36-42°С. Реакционную смесь выливают в 3 л колотого льда и перемешивают в течение 30 минут. Желтое твердое вещество выделяют фильтрованием и промывают 200 мл воды. Твердое вещество переносят в 4 л колбу Эрленмейера и обрабатывают 2 л 1N раствора гидроксида натрия (NaOH), затем 100 мл 10N NaOH. Основную смесь фильтруют и желтый твердый остаток отбрасывают. Фильтрат подкисляют H2SO4. Получившиеся в результате твердое вещество выделяют вакуумным фильтрованием и промывают 2×500 мл воды. После аспирационной сушки соединение помещают в 6 л колбу Эрленмейера и кипятят непродолжительное время в 4 л ацетона. После ночи стояния при комнатной температуре (КТ) твердое вещество отделяют фильтрованием и сушат в вакуумном эксикаторе с получением 139 г, 659 ммоль, 79% указанного в заголовке соединения. 1Н ЯМР (ДМСО-d6)δ: 4,22 (кв, 2Н), 2,44 (с, 3Н), 2,38 (с, 3Н), 1,27 (т, 3Н).
Промежуточное соединение 2
2-Карбоксиэтил-3,5-диметил-1Н-пиррол
Промежуточное соединение 1 (137 г, 650 ммоль) помещают в 500 мл колбу Эрленмейера и обрабатывают этаноламином (80 г, 1,3 моль). Затем смесь нагревают до 220°С греющей рубашкой, спустя приблизительно 30 минут образуется коричневый раствор, к этому времени выделение газа почти заканчивается. Реакционную смесь нагревают еще 30 минут, затем выливают в 2 л ледяной воды. Неочищенный продукт выделяют вакуумным фильтрованием и затем кипятят в 700 мл 95% этанола (EtOH). Смесь фильтруют в горячем виде, фильтрат медленно охлаждают до КТ и затем до -20°С. Образовавшиеся кристаллы выделяют вакуумным фильтрованием и сушат в вакуумном эксикаторе с получением 75,6 г, 453 ммоль, 70% указанного в заголовке соединения. 1Н ЯМР (ДМСО-d6)δ: 5,72 (с, 1Н), 4,17 (кв, 2Н), 2,18 (с, 3Н), 2,13 (с, 3Н), 1,25 (т, 3Н).
Промежуточное соединение 3
2-Карбоксиэтил-3,5-диметил-1Н-пиррол-4-карбоксальдегид
Промежуточное соединение 2 (75,6г, 453 ммоль) помещают в сухую трехгорлую круглодонную колбу емкостью 1 л. Твердое вещество обрабатывают безводным N,N-диметилформамидом (ДМФА, 43,8 мл, 566 ммоль). Колбу встряхивают, пока ДМФА не распределится во всей массе твердого вещества. Колбу охлаждают на ледяной бане и к смеси в течение 30 минут через капельную воронку добавляют оксихлорид фосфора (POCl3, 52,7 мл, 566 ммоль). Колбу встряхивают до полного распределения реагентов. Затем колбу погружают на масляную баню с температурой 100°С и нагревают при перемешивании магнитной мешалкой в течение 6 часов. Образовавшуюся глубоко-красную смесь охлаждают на бане с ледяной водой и обрабатывают 200 мл ледяной воды, что приводит к бурной экзотермической реакции. После добавления ледяной воды (200 мл) смесь доводят до рН 5 насыщенным раствором ацетата натрия (NaOAc). Неочищенный продукт выделяют вакуумным фильтрованием и перекристаллизовывают из 700 мл горячей смеси EtOH:вода 1:1, получая 65,8г, 337 ммоль, 74% указанного в заголовке соединения в виде темных игл. 1Н ЯМР (ДМСО-d6)δ: 9,88 (с, 1Н), 4,23 (кв, 2Н), 2,46 (с, 3Н), 2,43 (с, 3Н), 1,28 (т, 3Н).
Промежуточное соединение 4
3-(5-Карбоксиэтил-2,4-диметил-1Н-пиррол-3-ил)пропеновая кислота
Промежуточное соединение 3 (65,8 г, 337 ммоль) и малоновую кислоту (39,0г, 375 ммоль) смешивают в одногорлой круглодонной колбе объемом 500 мл, обрабатывают 350 мл абсолютного EtOH и кипятят с обратным холодильником в течение 30 минут. К полученному темному раствору добавляют анилин (34,0 мл, 375 ммоль) и смесь кипятят с обратным холодильником еще 5 часов. Растворитель отгоняют при пониженном давлении и твердое вещество обрабатывают 450 мл 2,5М хлористоводородной кислоты (HCl), нагревают и затем дают остыть до КТ. Пурпурное твердое вещество выделяют вакуумным фильтрованием, переносят в 1 л стакан и обрабатывают 250 мл 2N NaOH при перемешивании. Образовавшуюся суспензию фильтруют и полученное твердое вещество промывают 100 мл разбавленного основания. Пурпурный остаток отбрасывают. Красный фильтрат охлаждают на ледяной бане, перемешивают и подкисляют приблизительно 70 мл 6М HCl. Образовавшуюся плотную белую пасту отфильтровывают в вакууме, промывают водой и сушат на воздухе, получая таким образом указанное в заголовке соединение. 1Н ЯМР (ДМСО-d6)δ: 7,52 (д, 1Н), 5,93 (д, 1Н), 4,22 (кв, 2Н), 2,35 (с, 3Н), 2,31 (с, 3Н), 1,28 (т, 3Н).
Промежуточное соединение 5
3-(2-Карбоксиэтил-2,4-диметил-1Н-пиррол-3-ил)пропионовая кислота
Промежуточное соединение 4 растворяют в 220 мл 2N NaOH и смешивают c 3,5 г 10% палладия на активированном угле. Смесь гидрогенизуют при 50 psi (344,7 кПа) 28 часов, затем фильтруют в вакууме через Целит. Целит промывают 50 мл воды. Аликвоту фильтрата упаривают досуха и полноту восстановления до указанного в заголовке соединения подтверждают 1Н ЯМР (D2O)δ: 4,07 (кв, 2Н), 2,46 (т, 2Н), 2,06 (с, 3Н), 2,05 (т, 2Н), 2,00 (с, 3Н), 1,13 (т, 3Н). Остальной фильтрат используют на следующей стадии без дополнительной обработки.
Промежуточное соединение 6
3-(2,4-Диметил-1Н-пиррол-3-ил)пропионовая кислота
Фильтрат, полученный на предыдущей стадии, содержащий промежуточное соединение 5, обрабатывают 30 мл 10N NaOH и кипятят с обратным холодильником в течение 20 часов. Аликвоту реакционной смеси подкисляют и упаривают досуха. Полноту гидролиза/декарбоксилирования до указанного в заголовке соединения подтверждают 1Н ЯМР (ДМСО-d6)δ: 9,86 (с, 1Н), 6,18 (д, 2Н), 2,42 (м, 2Н), 2,03 (с, 3Н), 1,93 (м, 2Н), 1,87 (с, 3Н). Реакционную смесь используют на следующей стадии без дополнительной обработки.
Промежуточное соединение 7
Метил 3-(2,4-диметил-1Н-пиррол-3-ил)пропионат
Раствор промежуточного соединения 6, полученного на предыдущей стадии, концентрируют при 60°С и пониженном давлении приблизительно до объема 200 мл, охлаждают на бане с ледяной водой и подкисляют до рН 2 приблизительно 50 мл 50% H2SO4. Образовавшуюся смесь фильтруют через стеклянный фильтр. Фильтрат экстрагируют 2×100 мл диэтилового эфира (Et2O) и остаток экстрагируют 3×100 мл Et2O. Объединенные красные органические экстракты промывают 2×100 мл воды, переносят в 2 л колбу Эрленмейера и обрабатывают при перемешивании 680 мл эфирного раствора диазометана. После перемешивания 30 минут при КТ избыток диазометана гасят ледяной уксусной кислотой (HOAc). Реакционную смесь экстрагируют 2×200 мл насыщенного водного раствора бикарбоната натрия (NaHCO3), сушат над безводным сульфатом магния (MgSO4), фильтруют и упаривают, получая 52,6 г неочищенного красного масла. Масло очищают перегонкой при 145°С и 0,2 мм ртутного столба, получая указанное в заголовке соединение (38,4 г, 211 ммоль, 63% из расчета на промежуточное соединение 3). 1Н ЯМР (ДМСО-d6)δ: 9,92 (с, 1Н), 6,22 (с, 1Н), 3,54 (с, 3Н), 2,52 (т, 2Н), 2,32 (т, 3Н), 2,02 (с, 3Н), 1,87 (с, 3Н).
Промежуточное соединение 8
3-(5-Формил-2,4-диметимл-1Н-пиррол-3-ил)пропионовая кислота
В сухую 250 мл трехгорлую круглодонную колбу добавляют безводный ДМФА (13,8 г, 189 ммоль). Охлаждают на ледяной водяной бане и по каплям в течение 10 минут обрабатывают POCl3 (15,0 мл, 160 ммоль). Смесь разбавляют 120 мл безводного 1,2-дихлорэтана (ДХЭ) и нагревают до КТ, получая бледно-оранжевый раствор. Смесь охлаждают до -10°С на ледяной бане с солью, при этой температуре образуется твердое вещество. В течение 10 минут по каплям добавляют промежуточное соединение 7 (14,5 г, 80,0 ммоль), растворенный в 30 мл ДХЭ. Реакционную смесь удаляют с охлаждающей бани, перемешивают при КТ в течение 10 минут и затем упаривают при пониженном давлении при 30°С. Остаток переносят в 2 л стакан, используя приблизительно 100 мл метанола (МеОН), обрабатывают 800 мл 2N NaOH, нагревают до 90°C и затем дают остыть до КТ. Оранжевый раствор экстрагируют 2×200 мл Et2O, нагревают до 50°C, обрабатывают активированным углем, охлаждают до КТ и фильтруют через слой Целита. Фильтрат охлаждают на бане с ледяной водой и подкисляют до рН 3, используя приблизительно 120 мл 6N HCl. Образовавшееся твердое вещество выделяют вакуумным фильтрованием, промывают 3×40 мл воды и сушат на воздухе, получая 11,2 г, 57,0 ммоль указанного в заголовке соединения в виде коричневого порошка. 1Н ЯМР (ДМСО-d6)δ: 9,40 (с, 1Н), 2,52 (т, 2Н), 2,29 (т, 3Н), 2,19 (с, 3Н), 2,14 (с, 3Н).
Промежуточное соединение 9
3-[2,4-Диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]пропионовая кислота
Промежуточное соединение 8 (11 г, 57 ммоль) и оксииндол (7,6 г, 57 ммоль) смешивают в 200 мл круглодонной колбе, суспендируют в 150 мл EtOH, обрабатывают пиперидином (8,5 мл, 86 ммоль) и кипятят с обратным холодильником в течение 4 часов. Реакционную смесь охлаждают до КТ, обрабатывают HOAc (14,4 мл, 250 ммоль), снова кипятят с обратным холодильником некоторое время, охлаждают и фильтруют. Оранжевое твердое вещество выделяют вакуумным фильтрованием, промывают 100 мл горячей смеси HOAc:EtOH 1:1, затем 100 мл горячего EtOH и сушат на воздухе, получая 15 г, 50 ммоль, 87% указанного в заголовке соединения. 1Н ЯМР (ДМСО-d6)δ: 10,8 (с, 1Н), 7,71 (д, 1Н), 7,55 (с, 1Н), 7,07 (т, 1Н), 6,95 (т, 1Н), 6,96 (д, 1Н), 2,63 (т, 2Н), 2,33 (т, 2Н), 2,28 (с, 3Н), 2,25 (с, 3Н).
Промежуточное соединение 10
Трет-бутиловый эфир 4-{3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]пропионил}пиперазин-1-карбоновой кислоты
Промежуточное соединение 9 (6,2 г, 20 ммоль), моно-Вос-пиперазин (4,1 г, 22 ммоль) и 1-гидрокси-7-азабензотриазол (НОАТ, 3,0 г, 22 ммоль) растворяют в 50 мл безводного ДМФА и обрабатывают N,N-диизопропилэтиламином (DIEA, 3,5 мл, 20 ммоль) и затем гексафторфосфатом бензотриазол-1-илокситриспирролидинофосфония (PyBOP, 11.4 г, 22 ммоль). Образовавшуюся смесь перемешивают ночь при КТ, получая желтое твердое вещество. Твердое вещество выделяют вакуумным фильтрованием, промывают ДМФА и ацетонитрилом и сушат, получая таким образом 1,3 г промежуточного соединения 10. Фильтрат упаривают и фракционируют хроматографией на 700 см3 силикагеля, используя в качестве элюента 5% МеОН в дихлорметане (ДХМ). Фракции, содержащие продукт, объединяют и выпаривают, затем поглощают 100 мл ацетонитрила. После охлаждения до КТ отделяют мелкое желтое твердое вещество вакуумным фильтрованием, промывают 2×20 мл ацетонитрила и сушат, получая дополнительно 5,7 г указанного в заголовке соединения. В общем, получают 7,0 г, 15 ммоль, 75% продукта. 1Н ЯМР (ДМСО-d6)δ: 10,7 (с, 1Н), 7,70 (д, 1Н), 7,55 (с, 1Н), 7,07 (т, 1Н), 6,95 (т, 1Н), 6,84 (д, 1Н), 3,41-3,19 (м, 8Н), 2,62 (т, 2Н), 2,43 (т, 2Н), 2,28 (с, 3Н), 2,24 (с, 3Н), 1,35 (с, 9Н). IS-МС, вычислено m/z для C27H34N4O4[M]+: 478; найдено 478,2.
Пример 1
Трифторацетат 3-[3,5-диметил-4-(3-оксо-3-пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она
Промежуточное соединение 10 (4,78 г, 10,0 ммоль) суспендируют в 20 мл ДХМ и обрабатывают при комнатной температуре ТФУК. Через 30 минут реакционную смесь выпаривают при пониженном давлении, затем растворяют в 20 мл хлороформа и повторно выпаривают. Остаток снова растворяют в 20 мл хлороформа и по каплям прибавляют к 200 мл Et2O. Образовавшееся желтое твердое вещество выделяют вакуумным фильтрованием, промывают 3×20 мл Et2O и сушат, получая 4,8 г, 9,7 ммоль 97% указанного в заголовке соединения. 1Н ЯМР (ДМСО-d6)δ: 10,8 (с, 1Н), 8,74 (уш.с, 2Н), 7,71 (д, 1Н), 7,56 (с, 1Н), 7,07 (т, 1Н), 6,96 (т, 1Н), 6,85 (д, 1Н), 3,62 (уш.с, 4Н), 3,02 (уш.с, 4Н), 2,62 (т, 2Н), 2,5 (т, 2Н), 2,28 (с, 3Н), 2,25 (с, 3Н). IS-МС, вычислено m/z для C22H26N4O2[M+Н+]+: 379,2; найдено 379,0.
Пример 1а (альтернативный способ)
Трифторацетат 3-[3,5-диметил-4-(3-оксо-3-пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она
Промежуточное соединение 9 (0,31 г, 1,0 ммоль) растворяют в 3 мл безводного ДМФА и обрабатывают НОАТ (0,14 г, 1,0 ммоль) и гексафторфосфатомО-(7-азабензтриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU, 0,38 мг, 1,0 ммоль). После 10 минут перемешивания при КТ реакционную смесь прибавляют к раствору пиперазина (0,17 г, 2,0 ммоль) и перемешивают двое суток. Затем реакционную смесь фракционируют препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяют и лиофилизуют, получая 0,16 г, 0,34 ммоль, 34% указанного в заголовке соединения.
Пример 2
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(2-метиламиноэтил)пропионамида
Промежуточное соединение 10 (0,062 г, 0,20 ммоль) растворяют в 0,67 мл безводного ДМФА и обрабатывают НОАТ (0,030 г, 0,22 ммоль) и HATU (0,084 г, 0,22 ммоль). После 15 минут перемешивания при КТ активированную кислоту прибавляют к раствору N,N'-диметилендиамина (0,043 мл, 0,40 ммоль) в 0,50 мл безводного ДМФА. Реакционную смесь перемешивают ночь на вращающемся шейкере, затем разбавляют 0,50 мл 30% водного раствора ТФУК, фильтруют и фракционируют препаративной ВЭЖХ с обращенной фазой. Соответствующие фракции объединяют и лиофилизуют, получая 0,005 г, 0,010 ммоль, 5% указанного в заголовке соединения. IS-МС, вычислено m/z для C22H28N4O2[M+Н+]+: 381,2; найдено 381,0.
Примеры 3-24
По методикам, аналогично описанным выше в примерах 1а и 2, взаимодействием промежуточного соединения 10 с другими аминами получают соединения примеров 3-24.
Пример 3
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(3-метиламинопропил)пропионамида
IS-MC, вычислено m/z для C23H30N4O2[M+Н+]+: 395,2; найдено 395,0.
Пример 4
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(4-метиламинобутил)пропионамида
IS-MC, вычислено m/z для C24H32N4O2[M+Н+]+: 409,3; найдено 409,0.
Пример 5
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(5-метиламинопентил)пропионамида
IS-MC, вычислено m/z для C25H34N4O2[M+Н+]+: 423,3; найдено 423,2.
Пример 6
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(6-метиламиногексил)пропионамида
IS-MC, вычислено m/z для C26H36N4O2[M+Н+]+: 437,3; найдено 437,2.
Пример 7
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(7-метиламиногептил)пропионамида
IS-MC, вычислено m/z для C27H38N4O2[M+Н+]+: 451,3; найдено 451,2.
Пример 8
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(8-метиламинооктил)пропионамида
IS-MC, вычислено m/z для C28H40N4O2[M+Н+]+: 465,3; найдено 465,2.
Пример 9
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(9-метиламинононил)пропионамида
IS-MC, вычислено m/z для C29H42N4O2[M+Н+]+: 479,3; найдено 479,2.
Пример 10
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(10-метиламинодецил)пропионамида
IS-MC, вычислено m/z для C30H44N4O2[M+Н+]+: 493,4; найдено 492,8.
Пример 11
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(12-метиламинододецил)пропионамида
IS-MC, вычислено m/z для C32H48N4O2[M+Н+]+: 521,4; найдено 520,8.
Пример 12
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(4-метиламинобут-2-енил)пропионамида
IS-MC, вычислено m/z для C24H30N4O2[M+Н+]+: 407,2; найдено 407,0.
Пример 13
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(8-метиламино-3,6-диоксиоктил)пропионамида
IS-MC, вычислено m/z для C26H36N4O4[M+Н+]+: 469,3; найдено 469,0.
Пример 14
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(11-метиламино-3,6,9-триоксиундецил)пропионамида
IS-MC, вычислено m/z для C28H40N4O5[M+Н+]+: 513,3; найдено 512,8.
Пример 15
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(3-метиламинометилфенилметил)пропионамида
IS-MC, вычислено m/z для C28H32N4O2[M+Н+]+: 457,3; найдено 457,0.
Пример 16
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(4-метиламинометилфенилметил)пропионамида
IS-MC, вычислено m/z для C28H32N4O2[M+Н+]+: 457,3; найдено 457,2.
Пример 17
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(3-метиламинометилциклогексилметил)пропионамида
IS-MC, вычислено m/z для C28H38N4O2[M+Н+]+: 463,3; найдено 463,0.
Пример 18
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(2'-метиламинометилбифен-2-илметил)пропионамида
IS-MC, вычислено m/z для C34H36N4O2[M+Н+]+: 533,3; найдено 533,2.
Пример 19
Трифторацетат 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1Н-пиррол-3-ил]-N-метил-N-(3-[4-(3-метиламинопропил)пиперазин-1-ил]пропил)пропионамида
IS-MC, вычислено m/z для C30H44N6O2[M+Н+]+: 521,4; найдено 521,2.
Пример 20
Трифторацетат 3-[3,5-диметил-4-(3-оксо-3-пиперидин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она
IS-MC, вычислено m/z для C23H27N3O2[M+Н+]+: 378,2; найдено 378,0.
Пример 21
Трифторацетат 3-[3,5-диметил-4-(3-оксо-3-(пиперидин-4-илпропил)пиперидин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она
IS-MC, вычислено m/z для C31H42N4O2[M+Н+]+: 503,3; найдено 503,2.
Пример 22
Трифторацетат 3-[3,5-диметил-4-(3-оксо-3-(4-этил)пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она
IS-MC, вычислено m/z для C24H30N4O2[M+Н+]+: 407,2; найдено 407,0.
Пример 23
Трифторацетат 3-[3,5-диметил-4-(3-оксо-3-гомопиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она
IS-MC, вычислено m/z для C23H28N4O2[M+Н+]+: 393,2; найдено 393,0.
Пример 24
Трифторацетат 3-[3,5-диметил-4-(3-оксо-3-(1,4,10-триокса-7,13-диазациклопентадекан-1-ил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она
IS-MC, вычислено m/z для C28H38N4O5[M+Н+]+: 511,3; найдено 511,0.
Следуя методикам Примеров 1а и 2, также получают следующие соединения:
5-бром-3-[3,5-диметил-4-(3-оксо-3-(4-проп-2-ил)пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-он и
трифторацетат 5-бром-3-[3,5-диметил-4-(3-оксо-3-(4-проп-2-ил)гомопиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она.
Биологические анализы
Способность тестируемых соединений к ингибированию рецептора тирозинкиназы показаны в следующих анализах.
Сокращения
HEPES - 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота
EDTA - этилендиаминтетрауксусная кислота
PDGF - фактор роста, полученный из тромбоцитов
PDGFR - рецепторы фактора роста, полученного из тромбоцитов
VEGF - фактор роста, полученный из сосудов эндотелия
VEGFR - рецепторы фактора роста, полученного из сосудов эндотелия
HEK клетки - эмбриональные клетки почки человека
Flt-3 - fms-связанная тирозинкиназа 3
BSA - бычий сывороточный альбумин
AML - острая миелоидная лейкемия
ITD - внутренняя тандемная дупликация
MTT - 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолбромид
HUVEC - умбиллические венозные эпителиальные клетки человека
Анализ выделения Ca2+ (FLIPR Анализ)
Связывание факторов роста с соответствующими им рецепторами приводит к аутофосфорилированию рецептора. Это первый шаг в сигнальном каскаде, который приводит к выделению Ca2+ из внутренних источников и притока внеклеточного Ca2+.
Повышение уровня внутриклеточного Ca2+ определяют при нагружении клеток флуоресцентным красителем перед стимуляцией фактора роста с последующей оценкой флуоресцентного сигнала на Flourometric Image Plate Reader (FLIPR). Ингибитор киназы, который может проникнуть через клеточную мембрану, ингибирует аутофосфорилирование рецептора, следовательно, выделение Ca2+ замедляется или прекращается.
Для определения IC50 тестируемых соединений против VEGFR в анализе FLIPR применяют HUVEC (Walkersville, MD). Для определения IC50 против PDGFR использовали линию клеток HEK, которая экспрессирует PDGFR человека. 40-50000 клеток на лунку наносят на 96 луночный планшет. Клетки инкубируют 3-4 часа до прилипания к пластинке. Затем клетки дважды промывают FLIPR буфером (1XHBS, 2мМ CaCl2, 10мМ HEPES, рН 7,4, 2,5мМ пробенецид, 0,1% BSA). После второй промывки 50 мкл Са2+ чувствительного красителя FLUO-3 (FLUO-3 (AM) TEF Labs, 50 мкг в 10 мл FLIPR буфера) добавляют до остатка 50 мкл буфера в каждую лунку. После нанесения клеток в течение одного часа клетки дважды промывают и добавляют тестируемые соединения в 50 мкл как 2Х раствор в 50 мкл буфера в каждую лунку. Клетки инкубируют с соединениями 30 мин и затем добавляют VEGFR (40 нг/мл, BioSourse International) для VEGFR или PDGF (40 нг/мл, BioSourse International) для PDGFR. Изменения интенсивности флуоресценции измеряют на Flourometric Image Plate Reader (FLIPR) (Molecular Devices).
Анализ Пролиферации и Жизнеспособности (МТТ)
Считают, что ингибирование мутанта Flt-3 ITD воздействует на эффект пролиферации и жизнеспособности AML клеток с данной мутацией. Для того чтобы измерить активность тестируемых соединений анализ пролиферации и жизнеспособности (Roche Molecular Biochemicals, Indianapolis, IN) МТТ проводят с клеточной линией AML, называемой MV4-11. Клетки MV4-11 экспрессируют Flt-3 ITD. 50000 клеток на лунку в 100 мкл среды наносят на 96 луночный планшет и инкубируют с возрастающими концентрациями соединения в течение 48 часов. После инкубационного периода добавляют 10 мкл реакционной смеси для мечения МТТ. Реагент мечения МТТ метаболизируется жизнеспособными клетками до формазана, нерастворимой синей соли. Чтобы растворить формазановую соль добавляют 100 мкл солюбилизационного раствора. Планшет инкубируют при 37 градусах по Цельсию и затем определяют оптическую плотность лунок спектрофотометрически при 550 нм. Оптическая плотность растворов в клетках отражает эффект воздействия соединения на жизнеспособность клеток.
Иммунопреципитация/Western (IP/Western)
Связь факторов роста с рецепторными тирозинкиназами, подобным Flt-3 или PDGFR, ведет к аутофосфорилированию рецепторов. Ингибирование аутофосфорилирования является целью, преследуемой ингибиторами киназы. При проведении эксперимента IP/Western уровень аутофосфорилирования рецептора может быть зарегистрирован непосредственно.
5×106 клеток (HEK PDGFR клеточная линия для PDGFR, HEK c-Kit для c-Kit и THP-1, LH-60 или MV4-11 для Flt-3) инкубируют 30 минут в 2,5 мл культурной среды с определенной концентрацией тестируемого соединения. Для того чтобы стимулировать аутофосфорилирование рецептора, в течение 5 мин добавляют фактор роста (PDGF, SCF или Flt-3 лиганды, соответственно 50 нг/мл, Biosource International, Camarillo, СА). Затем клетки центрифугируют и лизируют в 500 мл лизисного буфера (50mM Tris рН 7,4, 1% NP-40, 150мM NaCl, 1mM EDTA, 1мМ NaЗV04). Лизат центрифугируют и добавляют 10 мкл антитела против соответствующего рецептора к супернатанту (анти-PDGFR(P20), анти-c-Kit (C19) и анти-Flt-3(S-18), Santa Cruz Biotechnology, Inc.). Иммунокомплексы выделяют с помощью гранул Protein G (Sigma, St.Louis, MO) и выполняют PAGE. Вестерн-блоттинг выполняют, используя антитела против остатков фосфотирозина (4G10, Upstate Biotechnology, Lake Placid, NY). Интенсивность сигнала фосфотирозина, соответствующую различным концентрациям лекарственного средства, предоставляет путь к определению IC50 тестируемого соединения для ингибирования аутофосфорилирования.
В общем, обнаружено, что соединения, описанные выше, имеют IC50 менее чем 10 мкМ в одном или более указанных выше анализов.
Фармакокинетика
Для определения фармакокинетики самцам крыс Sprague Dawley (линия CD, Charles River Laboratories, Wilmington, МА) вводят дозами тестируемые соединения внутривенно при концентрации 1 мг/кг и перорально (PO) при концентрации 10 мг/кг. Образцы крови берут у животных до введения доз и через 2, 5, 15 и 30 минут, а также через 1, 2, 4, 6 и 24 часа после введения доз. Концентрацию в плазме определяют жидкостной хроматографией-масс-спектрометрией (LC-MS)(MDS SCIEX API 4000, Applied Biosystems, Foster City, СА). Стандартные параметры фармакокинетики оценивают некомпартментными методами, использующими пакет WinNonlin версии 3.2 (Pharsight, Mountain View, СА). Пероральную биоактивность определяют как отношение площади под кривой (ОПК) на графике плазменной концентрации против времени для PO введения к соответствующему количеству для внутривенного введения. Пероральная биоактивность на крысах, например, 3-[3,5-диметил-4-(3-оксо-3-пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она, определенная данным методом, составила 50,6%.
Результаты сравнительных анализов
В Таблице 1 приведены результаты анализов для двух соединений изобретения, соединения Примера 1, трифторацетата 3-[3,5-диметил-4-(3-оксо-3-пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она, и соединения Примера 22, трифторацетата 3-[3,5-диметил-4-(3-оксо-3-(4-этил)пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она. Для сравнения в Таблице 1 также приведены результаты анализов для двух предшествующих соединений, 3-[2,4-диметил-5-(2-оксо-1,2-дигидроиндол-3-илиденметил)-1H-пиррол-3-ил]пропионовой кислоты, идентифицированной как SU6668, и 3-(2,3-диметилпиррол-5-ил)метилен]-2-индолинона, идентифицированного, как SU5416. Получение первого соединения известно из уровня техники и описано выше как промежуточное соединение 9. Последнее соединение получают, как описано у Sun et al., J. Med. Chem. 1998, Vol. 41, No. 14, рр 2588-2603. Способность тестируемых соединений к ингибированию мутанта Flt-3 ITD определяют анализом на цитотоксичность. Ингибирование VEGFR и PDGFR киназ тестируют Ca2+FLIPR анализом, кроме специально указанных случаев. Как показано ниже, соединения Примеров 1 и 22 показывают субмикромолярную активность в Flt-3, VEGFR и PDGFR анализах.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ АЗОТИСТЫЕ ПРОИЗВОДНЫЕ ПИРРОЛА, ИХ ПОЛУЧЕНИЕ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2008 |
|
RU2473543C2 |
| СОЕДИНЕНИЯ 2-(2-ОКСОИНДОЛИН-3-ИЛИДЕН)МЕТИЛ-5-(2-ГИДРОКСИ-3-МОРФОЛИН-4-ИЛПРОПИЛ)-6,7 ДИГИДРО-1-Н-ПИРРОЛ[3,2-С]ПИРИДИН-4(5Н)-ОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2008 |
|
RU2472792C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ КАК ИНГИБИТОРЫ ПРОТЕИНКИНАЗЫ | 2005 |
|
RU2406725C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИНДОЛИНОНА | 2003 |
|
RU2299209C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОИНДОЛОНА | 2009 |
|
RU2468022C2 |
| ПОЛИМОРФЫ ПИРРОЛЗАМЕЩЕННЫХ 2-ИНДОЛИНОНОВЫХ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2004 |
|
RU2335502C2 |
| ФЕНИЛЭТЕНИЛ- ИЛИ ФЕНИЛЭТИНИЛПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ ГЛУТАМАТНОГО РЕЦЕПТОРА | 2001 |
|
RU2284323C9 |
| ТИАЗОЛИНОН-2-ЗАМЕЩЕННЫЕ ХИНОЛИНЫ | 2005 |
|
RU2395509C2 |
| КАРБАМАТЫ ХИНУКЛИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2296762C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛО[3,2-c]ПИРИДИН-4-ОН 2-ИНДОЛИНОНА В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2007 |
|
RU2410387C2 |
Изобретение относится к новым производным индолина формулы (I)
где (i) R1 означает Н, (1-4С)алкил; R2 означает -A1-NR5R6, в которой каждый из заместителей R5 и R6 независимо означает Н, (1-4С)алкил, А1 означает (СН2)m, (СН2)n-А2(СН2)p или (CH2CH2O)qCH2CH2, где m равно целому числу от 2 до 10, и каждое из n и p равно целому числу от 1 до 6, А2 означает СН=СН, фенилен, бифенилен, циклогексилен или пиперазинилен, и q равно 1, 2 или 3;
(ii) R1 и R2 вместе представляют -A3-NR7-A4, где каждый из А3 и А4 независимо означают (СН2)r или (CH2CH2O)sCH2CH2, где r равно целому числу от 2 до 6, s равно 1, 2 или 3, и R7 означает Н, (1-4С)алкил;
(iii) R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пиперидинил, которая содержит заместитель формулы -A5-R8 в положении 4, в которой А5 представляет (1-4С)алкилен, и R8 представляет пиперидин-4-ил; или
(iv) R1 и R2 вместе с атомом азота, к которому они присоединены, образуют пиперидинил и
каждый из R3 и R4 независимо означает Н или его фармацевтически приемлемая соль. Соединения ингибируют рецепторы тирозинкиназы, что позволяет использовать их в формацевтических композициях для лечения. Описаны способы получения соединения I.
7 н. и 8 з.п. ф-лы. 1 табл.
(57) 1. Производные индола формулы (I)

где (i) R1 представляет атом водорода или (1-4С)алкильную группу; и R2 представляет группу формулы -A1-NR5R6, в которой каждый из заместителей R5 и R6 независимо представляет атом водорода или (1-4С)алкильную группу, и А1 представляет (СН2)m, (СН2)n-А2-(СН2)p или (CH2CH2O)qCH2CH2, где m равно целому числу от 2 до 10, и каждое из n и p равно целому числу от 1 до 6, А2 представляет СН=СН, фенилен, бифенилен, циклогексилен или пиперазинилен, и q равно 1, 2 или 3;
(ii) R1 и R2 вместе представляют -A3-NR7-А4, где каждый из А3 и А4 независимо представляют (СН2)r или (CH2CH2O)sCH2CH2, где r равно целому числу от 2 до 6, s равно 1, 2 или 3, и R7 представляет атом водорода или (1-4С)алкильную группу;
(iii) R1 и R2 вместе с атомом азота, к которому они присоединены, представляют пиперидинильную группу, где пиперидинильная группа содержит заместитель формулы -A5-R8 в положении 4, в которой А5 представляет (1-4С)алкилен, и R8 представляет пиперидин-4-ил; или
(iv) R1 и R2 вместе с атомом азота, к которому они присоединены, представляют пиперидинильную группу; и
каждый из R3 и R4 независимо представляет атом водорода;
или его фармацевтически приемлемая соль.
где (i) R1 представляет метильную группу; и R2 представляет группу формулы -A1-NR5R6, в которой заместитель R5 представляет атом водорода, R6 представляет метильную группу, и А1 представляет (СН2)m, где m равно 2, 3, 4, 5, 6, 7, 8, 9 или 10; (СН2)n-А2-(СН2)p, где каждый из n и p равно 1, А2 представляет СН=СН, фенил-1,3-ен, фенил-1,4-ен, бифенил-2,2′-ен или циклогексил-1,3-ен; (СН2)n-А2-(СН2)p, где каждый из n и p равно 2, А2 представляет пиперазин-1,4-илен; или (CH2CH2O)qCH2CH2, где q равно 2 или 3;
(ii) R1 и R2 вместе представляют -(CH2)2-NH-(CH2)2-, -(CH2)2-N(CH3)-(СН2)2-, -(CH2)2-N(CH2CH3)-(CH2)2-, -(CH2)2-NH-(CH2)3- или -(CH2CH2O)2CH2CH2-NH-(CH2CH2O)CH2CH2-; или
(iii) R1 и R2 вместе с атомом азота, к которому они присоединены, представляют пиперидинильную группу, где пиперидинильная группа содержит заместитель формулы -A5-R8 в положении 4, в которой А представляет пропилен, и R8 представляет пиперидин-4-ил.
(i) R1 представляет метильную группу; и R2 представляет группу формулы -A1-NHCH3, в которой А1 представляет (СН2)m, СН2СН=СНСН2, СН2-фенилен-СН2 или СН2-циклогексилен-СН2, где m равно целому числу от 2 до 8; или
(ii) R1 и R2 вместе представляют -(CH2)2-NH-(CH2)2-, -(CH2)2-N(CH3)-(СН2)2-, -(CH2)2-N(CH2CH3)-(CH2)2- или -(CH2)2-NH-(CH2)3-; и
R3 и R4, каждый независимо представляет атом водорода.
(i) R1 представляет метильную группу; и R2 представляет группу формулы -А1-NHCH3, в которой А1 представляет (СН2)m, СН2СН=СНСН2 или СН2-(1,4-фенилен)-СН2, где m равно 2 или 3; или
(ii) R1 и R2 вместе представляют -(CH2)2-NH-(CH2)2-, -(CH2)2-N(CH3)-(СН2)2-, -(CH2)2-N(CH2CH3)-(CH2)2- или -(CH2)2-NH-(CH2)3-.
3-[3,5-диметил-4-(3-оксо-3-пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она;
3-[3,5-диметил-4-[3-оксо-3-(4-этил)пиперазин-1-илпропил]-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она;
3-[3,5-диметил-4-(3-оксо-3-гомопиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она;
и их фармацевтически приемлемых солей.
в которой R представляет водород, метил или этил; или их фармацевтически приемлемые соли.
3-[3,5-диметил-4-(3-оксо-3-пиперазин-1-илпропил)-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она;
3-[3,5-диметил-4-[3-оксо-3-(4-этил)пиперазин-1-илпропил]-1Н-пиррол-2-илметилен]-1,3-дигидроиндол-2-она и их фармацевтически приемлемых солей.
или его реакционноспособного производного с соединением формулы (III)

или его соли, где R1, R2, R3 и R4 такие, как определено в п.1,
с последующим, если необходима фармацевтически приемлемая соль, получением фармацевтически приемлемой соли.
в которой R1a и R2a имеют значения, определенные в п.1 для R1 и R2, кроме тех, в которых R5 или R7 заменены группами R5a или R7a
соответственно, где каждый из R5a или R7a представляет аминозащитную группу, и значения R3 и R4 определены в п.1,
с последующим, если необходима фармацевтически приемлемая соль, получением фармацевтически приемлемой соли.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ЗАМЕЩЕННЫЕ ПИРРОЛЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1990 |
|
RU2142460C1 |
Авторы
Даты
2008-02-10—Публикация
2002-12-20—Подача