Настоящее изобретение относится к медицинской промышленности, а именно к производству лекарственных средств, содержащих ингибитор ангиотензинпревращающего фермента (АПФ)-S-(3-меркалто-2-метил-1-оксо-пропил)-L-пролин (калтоприл) и применяемых при артериальной гипертензии и хронической сердечной недостаточности.
В настоящее время в медицине широко применяются таблетированные лекарственные формы каптоприла. Отличительной особенностью каптоприла является высокая вариабельность дозировки (от 12,5 до 250 мг) в зависимости от индивидуальной чувствительности пациента. Наиболее часто выпускаются таблетки с содержанием действующего вещества 25 и 50 мг [1]. Для обеспечения гибкой дозировки каптоприла, необходим прием дробных доз. Таким образом, существенным обстоятельством, определяющим потребительское качество таблеток каптоприла, является однородность разламывания таблетки на две половинки. Поэтому состав и технология таблетирования должны обеспечивать оптимальную твердость таблеток.
Каптоприл легко окисляется по механизму свободно радикального окисления с образованием дисульфидного производного. Реакция разрушения каптоприла значительно ускоряется в процессе влажного гранулирования и сушки, а также при высокой влажности готовой лекарственной формы.
Известно, что введение антиокислителей и изменение кислотности таблеточной смеси благоприятно сказывается на стабильности каптоприла при переработке и в таблетках.
В патенте [2] заявлен способ стабилизации тиогруппы каптоприла путем введения в состав таблеточной массы аскорбиновой кислоты, натрия аскорбата, натрия бисульфита или метабисульфита.
Предложен способ получения стабильных лекарственных форм каптоприлсодержащих препаратов за счет введения в их состав аминокислот или их солей [3], трилона Б и аскорбиновой кислоты [4]. Однако введение аскорбиновой кислоты затруднено возможными аллергическими реакциями, кроме того, аскорбиновая кислота является лабильным веществом, изменяющим цвет при хранении [6].
Известен состав таблеток каптоприла 0,025 и 0,05 г содержащий целлюлозу микрокристаллическую, крахмал картофельный, сахар молочный, кислоту стеариновую или стеарат кальция и способ их получения в соответствии с которым смесь ингредиентов наполнителя и каптоприла прессуют пуансонами роторного таблеточного пресса [5]. Наиболее близким по составу и последовательности технологических операций являются таблетки каптоприла [6], прототип, включающие наполнитель и дезинтегрант, лубрикант и скользящий агент, отличающиеся тем, что наполнитель состоит из смеси лактозы и микрокристаллической целлюлозы в соотношении - 1.5:1-1:1 и общая сумма указанной смеси составляет 60-80% от веса таблетки. Таблетки содержат 1-20% дезинтегранта (крахмал, модифицированный крахмал, карбоксиметилцеллюлозу или кроссповидон), 0.2-3,0% лубриканта (стеариновая кислота, ее соли, гидрогенизированное касторовое масло), и 0,2-1,0% скользящего агента (аэросил) для улучшения сыпучести таблеточной массы.
Заявлен процесс для получения таблеток каптоприла, в соответствии с которым таблеточную смесь прессуют пуансонами таблеточного пресса. Реализация данного способа позволяет получать таблетки, массой 0,1-0,5 г, распадающиеся в воде за 15 минут [5, 6].
Недостатками данного лекарственного средства являются:
- присутствие в его составе гигроскопичных веществ, поглощающих влагу из окружающей среды (микрокристаллической целлюлозы, крахмала) и, как следствие, недостаточная стабильность действующего вещества при хранении;
- относительно высокая себестоимость таблетированной лекарственной формы.
Целью настоящего изобретения является разработка таблетированного гипотензивного лекарственного средства, отличающегося улучшенной стабильностью при хранении, а следовательно, фармакологической безопасностью при условии снижения его стоимости, устойчивого таблетирования и полного соответствия требованиям фармакопеи [7]: внешний вид (таблетки круглой формы с плоскими поверхностями, цельными краями однородной белой окраски), прочность на истираемость (не менее 97%), раздавливание (не менее 1,0 кг), отклонение в массе отдельных таблеток (не более ±5,0%), распадаемость, не более 15 минут, стабильность при хранении в течение пяти лет в сравнении с прототипом - 4 года [5].
Поставленная цель достигается тем, что разработано гипотензивное средство в виде таблеток массой от 0,1 до 0,3, содержащих 50 мг и 25 мг каптоприла соответственно, содержащее каптоприл, наполнитель, лубрикант, отличающееся тем, что оно содержит компоненты при следующем соотношении, мас.%: каптоприл 8,0-55,0, наполнитель 91,7-44,0, лубрикант 0,3-1,0.
При этом предложено использовать в качестве:
- наполнителя - смесь лактозы, с размером частиц более 0,2 мм и микрокристаллической целлюлозы в соотношении от 73:1 до 49:25;
- лубриканта - стеариновую кислоту, стеараты кальция, магния, лейцин, масло касторовое гидрогенизированное, натрия лаурилсульфат, натрия стеарилфумарат и/или их смеси.
Таким образом, сущностью изобретения является то, что в заявленном составе, по сравнению с известным:
- предложено использовать в качестве наполнителя лактозу с размером частиц более 0,2 мм;
- в составе таблеток исключен фармацевтический дезинтегрант (крахмал) и скользящее вещество (аэросил);
- заявлено новое соотношение ингредиентов таблеточной массы.
Известно, что таблетирование порошков предъявляет определенные требования к реологическим свойствам прессуемой смеси. Основным критерием, определяющим качество прессования, является высокая сыпучесть смеси. В роторных таблеточных машинах сыпучесть оказывает решающее влияние на погрешность массы таблетки и производительность. Для повышения сыпучести рекомендуется введение в состав скользящих веществ [8]. В частности, для повышения сыпучести в состав известного гипотензивного лекарственного средства вводят аэросил (см. пример №2 опыты №№1-3). Техническое решение, предложенное в заявленном способе: использование крупнокристаллического наполнителя, исключение крахмала и снижение микрокристаллической целлюлозы позволяет повысить сыпучесть смеси в два раза в сравнении с прототипом (см. пример 2, опыты №№3 и 4 соответственно).
Для увеличения прочности в состав таблеток вводят наполнители аморфной структуры [9]. В составе известного лекарственного средства используется микрокристаллическая целлюлоза. Вследствие высокой склонности к пластической деформации разно заряженные частицы данного наполнителя приближаются друг к другу, создавая бесчисленное количество водородных связей. Поэтому таблетки микрокристаллической целлюлозы обладают высокой прочностью и процесс таблетирования отличается устойчивым прессованием [10].
Однако микрокристаллическая целлюлоза является достаточно гигроскопичным веществом, и, как следствие, хранение таблеток в условиях повышенной влажности сопровождается повышением влагосодержания (см. пример 1 опыты №№4-9). Снижение концентрации данного наполнителя позволяет снизить гигроскопичность таблеток (см. пример 1, опыт №3 в сравнении с опытами №№4-8), а следовательно, скорость гидролиза действующего вещества и стабильность качества при хранении (см. примеры 4 и 6).
Для ускорения распадаемости в состав таблетированных лекарственных форм вводят дезинтегранты. Известное лекарственное средство содержит 1-20% крахмала. Вспомогательные вещества данного класса ускоряют распадаемость таблеток в 2-3 раза, однако уменьшают прочность таблеток и повышают их гигроскопичность (см. пример 1 опыты №№1-3). Исключение из состава таблеток дезинтегранта позволяет повысить прочность до уровня прототипа при удовлетворительной распадаемости 4-11 минут (см. пример 3 опыт №№1-4). При хранении в течение 5 лет распадаемость таблеток без дезинтегранта ухудшается, но не превышает нормируемого фармакопеей предела - 15 минут (см. пример 6).
Таким образом, новым в составе гипотензивного лекарственного средства является исключение из состава дезинтегрантов, скользящих веществ и использование другого наполнителя.
Предлагаемое соотношение действующих и вспомогательных веществ является оптимальным и позволяет получать таблетки, распадающиеся в течение 15 минут, соответствующие требованиям фармакопеи по всем показателям, стабильные при производстве и хранении в течение пяти лет.
Уменьшение или увеличение параметров ведения процесса в сторону от заявленных пределов приводит к снижению качества получаемых таблеток или затрудняет их прессование.
Гипотензивное лекарственное средство получают следующим образом.
В смеситель загружают навески каптоприла, стеарата кальция, лактозы и микрокристаллической целлюлозы. Заявленный концентрационный предел определен по минимальному и максимальному соотношению ингредиентов в составе таблеток массой 0,1 и 0,28 г, содержащих 50 мг и 25 мг каптоприла соответственно (см. пример 5).
Увеличение концентрации ингредиентов таблеточной массы выше заявленных пределов нецелесообразно, т.к. приводит к ухудшению распадаемости таблеток (см. пример 5).
В промышленных условиях (см. пример 6) подтверждено устойчивое прессование заявленной таблеточной массы при высоких скоростях таблетирования (14 оборотов ротора таблеточного пресса РТМ-41 в минуту). Возможно использование в качестве лубрикантов стеариновой кислоты, стеаратов кальция, магния, лейцина, масла касторового гидрированного, натрия лаурилсульфата или стеарилфумарата при устойчивой работе таблеточного пресса без налипания таблеточной массы к поверхности пуансонов.
Массу в смесителе перемешивают и таблетируют пуансонами диаметром 6 или 8 мм роторного таблеточного пресса РТМ-41 со скоростью 14 оборотов в минуту. Средняя масса таблеток 0,1 и 0,21 г (предпочтительно).
В настоящем изобретении заявлена масса таблеток 0,1-0,3 г и отклонение от средней массы ±5% что соответствует пределу, разрешенному в Государственной фармакопее XI изд. [8].
Как видно из вышеизложенного, только предложенные интервалы соотношений ингредиентов являются оптимальными и позволяют получить более эффективное и дешевое гипотензивное средство в виде таблеток, соответствующих требованиям научно-технической документации [7] по всем показателям и стабильных при хранении в течение 5 лет (см. пример 6).
Пример 1
В ступку, содержащую смесь каптоприла, кальция стеарата, аэросила, лактозы и крахмала, загружали различные количества микрокристаллической целлюлозы, перемешивали; 0,10 г таблеточной массы прессовали пуансонами диаметром 6 мм при давлении 100 АТИ. Распадаемость таблеток анализировали по методике Государственной фармакопеи [7 с.117]. Прочность измеряли с помощью прибора RTU EL-102.
Одновременно исследовали прочность и распадаемость, таблеток, полученных в полном соответствии с составом прототипа (см. табл. 1, опыты №№1-3). Для определения гигроскопичности таблетки помещали в эксикатор над насыщенным раствором сульфата аммония при температуре 60°С. Через пять суток исследовали влагосодержание таблеток.
<0,1 мм
>0,2 мм
Результаты экспериментов, представленные в таблице 1, показывают, что увеличение лактозы увеличивает прочность таблеток на раздавливание. Микрокристаллическая целлюлоза увеличивает прочность таблеток по показателю истираемость. Полностью исключить микрокристаллическую целлюлозу из состава не удается, т.к. получаемые таблетки обладают высокой хрупкостью. В результате кромки таблеток разрушаются и не удается достичь нормируемого фармакопеей показателя истираемости более 97% (см. таблицу 1, опыт №4). Минимальное соотношение лактоза: микрокристаллическая целлюлоза составляет 73:1. Таблетки, полученные в данном эксперименте, соответствуют всем требованиям фармакопеи и распадаются за 7 минут. Максимальное соотношение лактоза:микрокристаллическая целлюлоза составляет 49:25. Дальнейшее увеличение данного соотношения приводит к снижению прочности таблеток менее нормируемого значения (1,0 кг) и ускорению распадаемости до 1 минуты, что нецелесообразно.
В опытах установлено влияние крахмала на гигроскопичность таблеток. Введение в состав таблеточной массы 10% крахмала увеличивает влагопоглощение с 2,82 до 4% (см. опыты №№1 и 3 соответственно). Микрокристаллическая целлюлоза также способствует гигроскопичности таблеток, но в меньшей степени. Если учесть, что вода катализирует реакцию разложения калтоприла в дисульфид, исключение из состава крахмала и снижение концентрации микрокристаллической целлюлозы является рациональным.
Результаты экспериментов, представленные в таблице 1, показывают, что крахмал ускоряет распадаемость таблеток (см. опыты №№1-3). Однако все варианты без крахмала распались за 4-8 минут, что значительно ниже нормируемого ГФ XI показателя - 15 минут. Поэтому исключение крахмала из состава таблеточной массы является рациональным.
Таким образом, предложено оптимальное соотношение лактозы с размером частиц более 0,2 мм и микрокристаллической целлюлозы в составе наполнителя: от 73:1 до 49:25. Заявленное соотношение значительно меньше предложенного в прототипе от 1,5:1 до 1:1 что позволяет снизить гигроскопичность таблеток в два раза при их соответствии всем требованиям фармакопеи.
Пример 2
В ступку, содержащую смесь 2,5 г каптоприла, 0,1 г кальция стеарата, 3,7 г лактозы, 3,7 г микрокристаллической целлюлозы, загружали различные количества аэросила, перемешивали и определяли сыпучесть с помощью прибора ВП-12А по методике [8 с.96].
Одновременно исследовали сыпучесть смеси, содержащей 2,5 г каптоприла, 0,1 г кальция стеарата, 2,5 г микрокристаллической целлюлозы и 4,9 г лактозы с кристаллами размером более 0,2 мм.
Влияние состава таблеточной массы на сыпучесть
Результаты экспериментов, представленные в таблице 2, показывают, что введение 1,0% аэросила позволяет увеличить сыпучесть смеси с 3,42 до 4,72±0,28 г/см2 сек. Применение крупнокристаллической лактозы, исключение из состава крахмала и аэросила позволяет повысить сыпучесть смеси до 8,02±0,46 г/см2 сек.
Пример 3
В ступку помещали навески каптоприла, лактозы с кристаллами более 0,2 мм, микрокристаллической целлюлозы, кальция стеарата. Перемешивали. Таблетировали пуансонами диаметром 5, 6, 8, 9, 12 мм давлением 50 ати. Таблетки диаметром 12 мм прессовали давлением 150 ати. Масса таблеток 0,07, 0,1, 0,21, 0,28, 0,7 г соответственно.
В таблице 3 представлены данные влияния массы таблеток на распадаемость.
Влияние состава таблеточной массы на распадаемость
Данные таблицы показывают, что все варианты массой от 0,1 до 0,30 г распадаются за время, ограниченное пределами фармакопеи (не более 15 минут).
Представленные данные позволяют определить массу таблеток каптоприла от 0,1 г до 0,3 г. Увеличение массы таблетки более 0,3 г нецелесообразно, т.к. приводит к нерациональному перерасходу вспомогательных материалов без улучшения качества или потребительских свойств таблеток.
Пример 4
В ступку помещали навески 2,50 г каптоприла, 16,46 г лактозы с кристаллами более 0,2 мм, 0,33 г микрокристаллической целлюлозы, 0,21 г магния стеарата. Перемешивали. Таблетировали пуансонами диаметром 8 мм давлением 150 ати. Масса таблеток 0,21 г (опыт).
Одновременно получали таблетки в полном соответствии с прототипом, для чего 11,13 г лактозы смешивали с 11,12 г микрокристаллической целлюлозы, 2,5 г каптоприла, 0,28 г магния стеарата и 0,17 г аэросила. Таблетировали пуансонами диаметром 9 мм. Масса таблетки 0,28 г (контроль).
Таблетки укладывали в банки БДС-10 из стекла ОС-1 по 20 штук, герметично укупоривали крышками из полиэтилена. Стабильность качественных характеристик исследовали методом «ускоренное старение» при термостатировании 60 град. С.
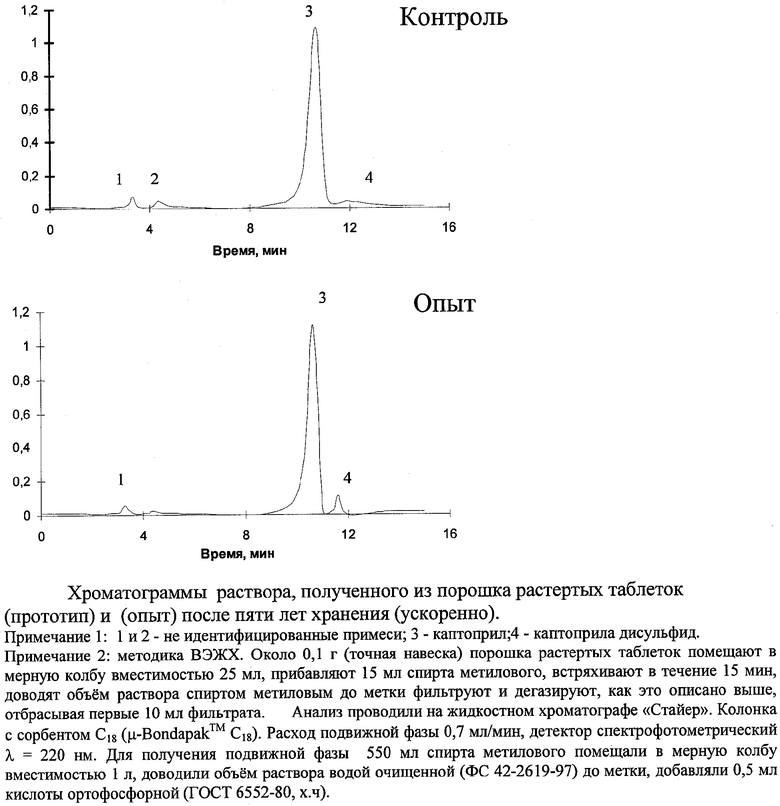
Представленные на чертеже хроматограммы опытных и контрольных образцов после пяти лет эквивалентного хранения показывают, что оба варианта выдержали хранение пять лет. Концентрация каптоприла дисульфида составила 1,09 и 1,17% соответственно при нормируемом [7] показателе, не более 3,0%. При хранении таблеток каптоприла наблюдается рост примеси дисульфида и двух других неустановленных веществ (см. фиг.1 №№ пиков 4, 1 и 2 соответственно). При этом массовая доля неустановленных примесей в опыте (0,82 и 0,13%) значительно меньше, чем в контроле (0,89 и 0,78%).
Таким образом, исключение из состава микрокристаллической целлюлозы, крахмала, аэросила благоприятно сказывается на стабильности каптоприла в таблетках при хранении.
Пример 5
Для определения оптимального состава таблеток проводили эксперименты, в которых различные навески каптоприла, магния стеарата и наполнителя в виде смеси лактозы с частицами размером более 0,2 мм, микрокристаллической целлюлозы, взятых в соотношении 49:1, смешивали и таблетировали пуансонами диаметром 5 - 9 мм при давлении 100 ати; исследовали распадаемость полученных таблеток. Данные таблицы 4 показывают, что заявленное соотношение действующих и вспомогательных веществ, мас.%: каптоприл 8,0-55,0, наполнитель 91,7-44,0, магния стеарат 0,3-1,0; является оптимальным и позволяет получать таблетки, распадающиеся в течение 15 минут.
Уменьшение или увеличение параметров ведения процесса в сторону от заявленных пределов приводит к увеличению времени распадаемости выше нормируемого ГФ XI предела - 15 минут.
Таблица 4
Влияние состава таблеток и их массы на распадаемость
Пример 6
В смеситель загружают 25,0 кг каптоприла, 0,3 кг кальция стеарата, 0,7 кг стеариновой кислоты, 25 кг микрокристаллической целлюлозы и 49,0 кг лактозы с размером кристаллов более 0,2 мм, перемешивают в течение 15 минут. Полученную таблеточную массу прессуют пуансонами диаметром 6,0 мм таблеточного пресса РТМ 41 со скоростью 14 оборотов ротора в минуту.
Получено 96,9 кг таблеток каптоприла. Средняя масса таблеток 0,0987 г.Отклонение в массе отдельных таблеток от +7,5%, до -6,2%. Распадаемость - 6,7±1,1 минут. Прочность по показателю: истираемость - 99,2%, раздавливание - 1,6±0,4 кг. Количественное определение каптоприла 0,0248 г.Примеси каптоприла дисульфида 1,02%.
В результате хранения методом «Ускоренное старение» 5 лет (эквивалентный срок хранения) распадаемость таблеток увеличилась до 11,5+0,2 минут, примесь каптоприла дисульфида - до 1,29%. Количественное содержание каптоприла уменьшилось до 0,0242 г в одной таблетке. Внешний вид таблеток соответствует требованиям фармакопеи (таблетки белого цвета, однородной поверхности и кромками).
Литература
1. Машковский М.Д. Лекарственные средства. - М.: Медицина, 1982.
2. Патент Японии №8636127.
3. Патент Японии №82112367.
4. Патент США №5158777.
5. ФСП 42-01861810-01.
6. WO 9810753 Captopril tablets GORA LASZLONE; LADY BLANKA; FEKETE PAL; KRISZTIAN MARIA; PALFI ZOLTANNE; SZENTGROTI PALNE. Опублик. 1998-03-19 (прототип).
7. Государственная фармакопея СССР, XI изд., Вып.2, Москва, (1990), с.154.
8. М.Б.Вальтер, О.Л.Тютенков, Н.А.Филлипин. Постадийный контроль в производстве таблеток. - М.: Медицина. - 1982. - с.114.
9. I.E.Gordon, The science of strong materials. Harmondsworth: Penguin Books Ltd. - 1973. - p.98-120.
10. G.E.Reier, R.F.Shangraw. Microcrystallame cellulose in tableting // J. Pharm. Sci. - 1966. - V.55. - p.510-514.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО НА ОСНОВЕ СУХОГО ЭКСТРАКТА ПУСТЫРНИКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2015 |
|
RU2589507C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ТВЕРДОЙ ФОРМЕ С АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2545861C1 |
| ПОДСЛАЩИВАЮЩЕЕ СРЕДСТВО | 2007 |
|
RU2376886C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЦЕРЕБРОВАСКУЛЯРНЫХ РАССТРОЙСТВ И СПОСОБЫ ИХ ИЗГОТОВЛЕНИЯ | 2012 |
|
RU2559776C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ВИДЕ ТВЕРДОЙ ПЕРОРАЛЬНОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ, СОДЕРЖАЩАЯ СИГЕТИН (ВАРИАНТЫ) | 2007 |
|
RU2338523C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТАБЛЕТОК ТЕРИФЛУНОМИДА | 2013 |
|
RU2536258C1 |
| ПЕРОРАЛЬНЫЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ МЕМАНТИН (ВАРИАНТЫ) И СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2007 |
|
RU2326660C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО В ВИДЕ КАПСУЛ, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНЫМ И ИНТЕРФЕРОНОГЕННЫМ ДЕЙСТВИЕМ | 2010 |
|
RU2446803C1 |
| КОРОНАРОДИЛАТИРУЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2013 |
|
RU2526118C1 |
| ПЕРОРАЛЬНЫЙ ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ОСНОВЕ ГИНДАРИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2007 |
|
RU2360675C1 |
Гипотензивное лекарственное средство в виде таблеток содержит каптоприл, смесь лактозы с размером частиц более 0,2 мм и микрокристаллической целлюлозы при их соотношении, соответственно, от 73:1 до 49:25, и лубрикант. Средство выполнено в виде таблеток массой от 0,1 до 0,3 г с содержанием каптропила 25 или 50 мг. Изобретение позволяет получать таблетки каптоприла, распадающиеся в течение 15 минут, соответствующие требованиям фармакопеи по всем показателям, стабильные при производстве и хранении в течение 5 лет. 2 з.п. ф-лы, 1 ил., 4 табл.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ | 2001 |
|
RU2203051C1 |
| US 5158777 A, 27.10.1992 | |||
| US 5433951 A, 18.07.1995. | |||
Авторы
Даты
2008-02-20—Публикация
2006-05-04—Подача