Изобретение относится к полиалкиленгликолевым кислотам и к их связыванию с терапевтически активными биофармацевтическими препаратами с целью получения терапевтически активных коньюгатов полиалкиленгликоля с указанными биофармацевтическими препаратами.
Химическое связывание гидрофильных линейных полимеров полиалкиленгликоля (известных как ПАГ) с биофармацевтическими препаратами, такими как белки и пептиды, является известным приемом и широко используется в биотехнологии. Наиболее известным соединением полиалкиленгликоля является полиэтиленгликоль (известный как ПЭГ).
В качестве примера биотехнологического применения ПАГ можно указать некоторые активные производные ПАГ, связанные с биофармацевтическими препаратами, такими как белки и ферменты, и обладающие ценными свойствами. Поскольку ПАГ растворим в органических растворителях, то ПАГ, связанный с такими биофармацевтическими препаратами, как ферменты и белки, образует коньюгаты, растворимые и активные в органических растворителях. Связывание ПАГ с белком может уменьшать иммуногенные свойства коньюгата ПАГ-белок и скорость его клиренса в печени по сравнению с немодифицированным белком. Кроме того, связывание ПАГ с биофармацевтическими препаратами, такими как белок, может существенно увеличить полупериод циркуляции таких коньюгатов в крови.
При получении комплексов ПАГ с биофармацевтическими препаратами, такими как белок, эффективность и продолжительность действия такого лекарственного средства зависит от фармакокинетических свойств конкретного биофармацевтического препарата. В связи с иммуногенными свойствами, нерастворимостью в воде и коротким биохимическим полупериодом биофармацевтических препаратов, прежде всего белков и полипептидов, наиболее важным фактором, позволяющим обеспечить пролонгированное действие таких лекарственных препаратов, становится снижение клиренса указанных биофармацевтичсских препаратов. Снижение клиренса достигается за счет исключения или ингибирования гломерулярной фильтрации благодаря изменению заряда белка и его мол. массы (Brenner и др., Am, J. Physiol., 234, F455 (1978)). Установлено, что при повышении объема молекулы и маскировании возможных эпитопов модификация терапевтических биофармацевтических препаратов, таких как полипептид и белок, при связывании с полимером является эффективным способом снижения скорости клиренса, а также антигенности биофармацевтических препаратов, прежде всего белков. Улучшение фармакокинетических свойств лекарственных препаратов при связывании полимера ПАГ с молекулами биофармацевтических препаратов, таких как полипептиды и белки, можно объяснить следующими факторами: снижение протеолиза, повышение растворимости в воде, снижение почечного клиренса и пространственное торможение клиренса, опосредованного рецептором. Так в US 4129337 (Davis и др.) описано коньюгирование ПЭГ с белками, такими как ферменты и инсулин, для получения менее иммуногенного продукта, сохраняющего существенную часть биологической активности таких биофармацевтических препаратов.
Известно множество активных производных ПАГ, прежде всего ПЭГ, реагентов, которые предложены для модификации биофармацевтических препаратов, таких как белки (см., например, монографию Zaiipsky и др., и Harris и др., Poly (ethylengiycot) Chemistry: Biotechnical and Biomedicat Application, J.M.Harris ed., Plenum Press, New York, гл.21 и 22 (1992), большинство из которых включают промежуточную группу между ПЭГ и биофармацевтическими препаратами. Некоторые из указанных реагентов недостаточно устойчивы в водной среде, в которой обычно проводят коньюгирование. Кроме того, конъюгация часто приводит к потере биологической активности in vitro, что вызывается рядом причин, главной их которых является пространственное блокирование активного центра белков. Следовательно, требуется создание нового реагента, более устойчивого в водной среде, который можно использовать для сайт-специфичной модификации белка.
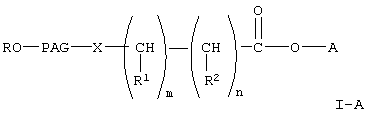
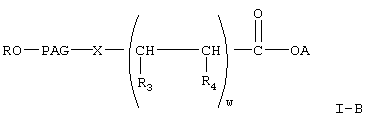
В настоящем изобретении предлагается новый класс активированных полиалкиленгликолевых кислот и реагентов на основе их активированных эфиров для коньюгирования с биофармацевтическими препаратами, такими как полипептиды, сахара, белки и терапевтически активные низкомолекулярные соединения. Указанные реагенты представляют собой соединения любой из формул
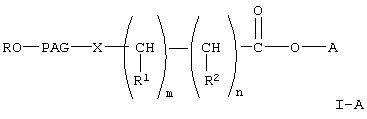
где R, R1 и R2 каждый независимо означает водород или (низш.)алкил,
Х означает -О- или -NH-,
PAG (ПАГ) означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется мол. массой от 1000 до 50000 Да,
n означает целое число от 0 до 1,
m означает целое число от 4 до 8,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир, или его гидролизуемые сложные эфиры, если А означает водород;
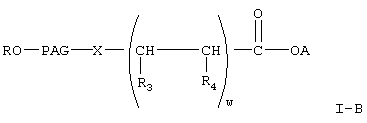
где R, PAG, X и А имеют значения, указанные выше,
w означает целое число от 1 до 3,
один из R3 и R4 означает (низш.)алкил, а другой означает водород или (низш.)алкил;
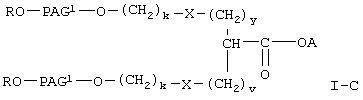
где R, А и Х имеют значения, указанные выше,
PAG1 означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется мол. массой от приблизительно 500 до приблизительно 25000 Да,
у означает целое число от 0 до 3,
v означает целое число от 1 до 3,
k означает целое число от 1 до 2.
Среди соединений формулы I-А, указанной выше, предпочтительны соединения формулы
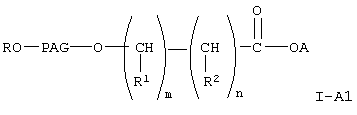
где A, R, PAG, R1, R2, m и n имеют значения, указанные выше.
Другими предпочтительными соединениями формулы I-А, указанной выше, являются соединения формулы
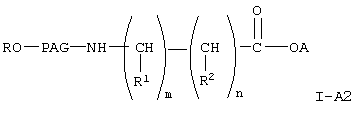
где A, R, PAG, R1, R2, m и n имеют значения, указанные выше.
Предпочтительными соединениями формулы I-В, указанной выше, являются соединения формулы
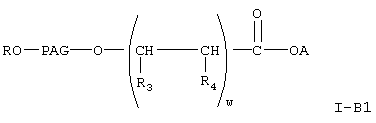
где А, R, PAG, R3, R4 и w имеют значения, указанные выше.
Предпочтительными соединениями формулы I-С, указанной выше, являются соединения формулы
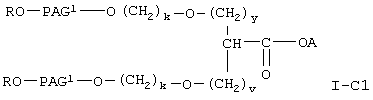
где R, PAG1, A, v, у и k имеют значения, указанные выше.
Предпочтительно А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир, или гидролизуемые сложные эфиры, более предпочтительно А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир.
В указанных выше соединениях А предпочтительно означает водород. Кроме того, предпочтительны указанные выше соединения, в которых А означает активированную уходящую группу. В указанных выше соединениях, прежде всего в соединениях формулы I-С1, где А предпочтительно означает активированную уходящую группу, А предпочтительно означает N-гидроксисукцинимидил.
В другом предпочтительном варианте R означает метил. Кроме того, предпочтительны указанные выше соединения, в которых ПАГ означает ПЭГ, двухвалентный остаток полиэтиленгликоля, образованный за счет удаления двух концевых гидроксильных групп. Предпочтительно ПЭГ характеризуется мол. массой от 10000 до 40000, более предпочтительно от 20000 до 35000. В соединениях формулы I-С, описанных выше, где ПАГ1 означает ПЭГ1, ПЭГ1 предпочтительно характеризуется мол. массой от 500 до 15000.
В другом предпочтительном варианте изобретения n равно 0, a m равно 4. Предпочтительно w равно 1.
В еще одном предпочтительном варианте настоящее изобретение относится к способу получения активированного эфира формулы
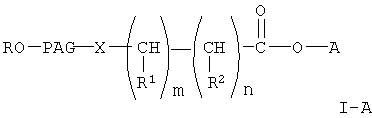
где R, R1 и R2 каждый независимо означает водород или (низш.)алкил,
Х означает -О- или -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гдроксильных групп, причем указанный остаток характеризуется мол. массой от 1000 до 50000 Да,
n означает целое число от 0 до 1,
m означает целое число от 4 до 8,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир, причем указанный способ включает конденсацию соединения формулы
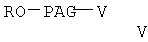
с соединением формулы
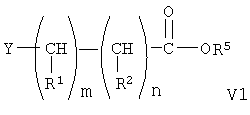
где R5 означает защитную гидролизуемую группу сложного эфира, Y означает галоген, а R1, R2, m и n имеют значения, указанные выше, с образованием сложного эфира формулы
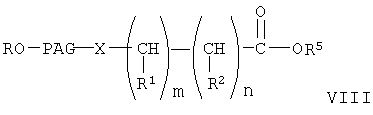
где R, PAG, X, R1, R2, R5, m и n имеют значения, указанные выше, гидролиз указанного сложного эфира с образованием свободной кислоты формулы
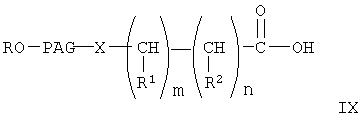
где R, PAG, X, R1, R2, m и n имеют значения, указанные выше,
и взаимодействие указанной свободной кислоты с галогенидом активированной уходящей группы в присутствии конденсирующего агента с образованием указанного активированного эфира.
В еще одном предпочтительном варианте настоящее изобретение относится к способу получения активированного эфира формулы

где R означает водород или (низш.)алкил,
Х означает -О- или -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется мол. массой от 1000 до 50000 Да,
w означает целое число от 1 до 3,
один из R3 и R4 означает (низш.)алкил, а другой означает водород или (низш.)алкил,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир, причем указанный способ включает конденсацию соединения формулы
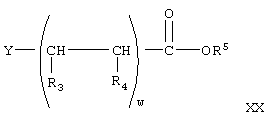
где w, R3, R4 имеют значения, указанные выше, Y означает галоген, a R5 означает гидролизуемую защитную группу сложного эфира с соединением формулы
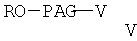
где R и РАС имеют значения, указанные выше, V означает -ОН или -NH2 с образованием сложного эфира формулы
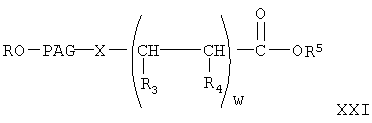
где w, R, PAG, X, R3, R4 и R5 имеют значения, указанные выше, гидролиз указанного сложного эфира с образованием свободной кислоты формулы
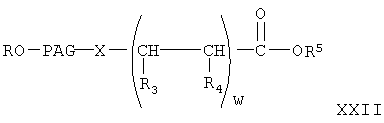
где w, R, PAG, X, R3, R4 и R5 имеют значения, указанные выше, и взаимодействие указанной свободной кислоты с галогенидом активированной уходящей группы в присутствии конденсирующего агента с образованием указанного активированного эфира.
В другом предпочтительном варианте настоящее изобретение относится к способу получения активированного эфира формулы
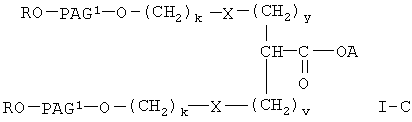
где R означает водород или (низш.)алкил,
Х означает -О- или -NH-,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир,
PAG1 означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется мол. массой от приблизительно 500 до приблизительно 25000 Да,
у означает целое число от 0 до 3,
v означает целое число от 1 до 3,
k означает целое число от 1 до 2,
причем указанный способ включает конденсацию соединения формулы
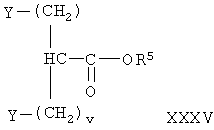
где у и v имеют значения, указанные выше, Y означает галоген, а R5 образует гидролизуемую защитную группу сложного эфира с соединением формулы
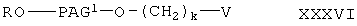
где R, PAG1 и k имеют значения, указанные выше, V означает -ОН или -NH2 с образованием сложного эфира формулы

где R, PAG1, X, R5, k, v и у имеют значения, указанные выше, гидролиз указанного сложного эфира с образованием свободной кислоты формулы
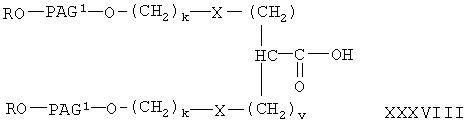
где R, PAG1, X, R5, k, v и у имеют значения, указанные выше,
и взаимодействие указанной свободной кислоты с галогенидом активированной уходящей группы в присутствии конденсирующего агента с образованием указанного активированного эфира.
В указанных выше способах указанная уходящая группа предпочтительно означает N-гидроксисукцинимидил.
Кроме того, предпочтительный вариант настоящего изобретения относится к коньюгату формулы
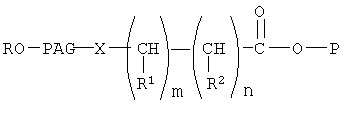
где Р означает остаток биофармацевтического препарата, содержащего концевую гидроксильную группу, причем концевая гидроксильная группа удалена,
R, R1 и R2 каждый независимо означает водород или (низш.)алкил,
Х означает -О- или -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется мол. массой от 1000 до 50000 Да,
n означает целое число от 0 до 1,
m означает целое число от 4 до 8.
В описанном выше коньюгате Р предпочтительно означает гликозид или остаток AZT. Предпочтительно Х означает -О-, предпочтительно PAG означает остаток полиэтиленгликоля с мол. массой от 10000 до 15000, R предпочтительно означает метил.
Другим предпочтительным вариантом настоящего изобретения является коньюгат формулы

где Р означает остаток биофармацевтического препарата, содержащего концевую гидроксильную группу, причем концевая гидроксильная группа удалена,
R, R1 и R2 каждый независимо означает водород или (низш.)алкил,
Х означает -О- или -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется мол. массой от 1000 до 50000 Да,
n означает целое число от 0 до 1,
m означает целое число от 4 до 8.
В описанном выше коньюгате Р предпочтительно означает остаток белка или полипептида, более предпочтительно Р означает полипептид Т-20, характеризующийся последовательностью SEQ ID №:1. Предпочтительно Х означает -О-, предпочтительно PAG означает остаток полиэтиленгликоля с мол. массой от 10000 до 15000.
Указанные соединения используются в качестве реагентов при получении коньюгатов биофармацевтических препаратов, таких как полипептиды, сахара, белки и гликозиды. При образовании коньюгатов с биофармацевтическими препаратами, такими как белки, пептиды и гликозиды, соединения формул I-А, I-В и I-С улучшают их фармакокинетические и фармакодинамические свойства. Клинически ценные свойства коньюгатов включают, наряду в прочими премуществами, более продолжительный полупериод циркуляции in vivo, сниженный клиренс и повышенную активность, изменение биораспределения, приводящее к увеличению активности, пониженную иммуногенность, сниженную токсичность, более высокую физическую и термическую устойчивость, устойчивость к действию протеаз. Устойчивость соединений формул I-А, I-В и I-С позволяет получать коньюгаты с биофармацевтическими препаратами и таким образом исключить возможность денатурации.
Реагенты формул I-А, I-В и I-С можно коньюгировать с амино- или гидроксигруппой в составе биофармацевтических препаратов с образованием коньюгатов, которые в существенной степени сохраняют биологическую активность исходного биофармацевтического препарата. В общем случае для целей коньюгирования предпочтительно, чтобы амино- и гидроксигруппы с составе биофармацевтических препаратов были локализованы в концевом фрагменте цепи. Реагенты по изобретению могут связываться именно с концевыми амино- и карбоксигруппами с образованием конюгатов по настоящему изобретению. Реагенты по изобретению устойчивы в водной среде и легко взаимодействуют с биофармацевтическими препаратами с образованием коньюгатов, которые можно вводить в терапевтических целях в водной среде.
Термин полиалкиленгликоль означает радикалы поли((низш.)алкилен)гликоля, где алкиленовый радикал означает радикал с прямой или разветвленной цепью, содержащей от 2 до 7 атомов углерода. Термин "(низш.)алкилен" означает двухвалентный алкиленовый радикал с прямой или разветвленной цепью, содержащей от 2 до 7 атомов углерода, такой как полиэтилен, поли-н-пропилен, полиизопропилен, поли-н-бутилен и полизобутилен, а также полиалкиленгликоли, образованные из смешанных алкиленгликолей, такие как полимеры, содержащие смесь радикалов полиэтилена и полипропилена, и полимеры, содержащие смесь радикалов полиизопропилена, полиэтилена и полиизобутилена. Радикалы алкиленгликоля с разветвленной цепью содержат в полимерной цепи (низш.)алкильные группы, содержащие от 2 до 4 атомов углерода, и в зависимости от числа атомов углерода, содержащихся в прямой цепи алкиленовой группы, общее число атомов углерода в любом алкиленовом остатке в составе полиалкиленгликолевого заместителя составляет от 2 до 7 атмов углерода. Термин "(низш.)алкил" включает (низш.)алкильные группы, содержащие от 1 до 7 атомов углерода, предпочтительно от 1 до 4 атомов углерода, такие как метил, этил, пропил, изопропил и т.п., прежде всего предпочтителен метил.
В предпочтительном варианте настоящего изобретения ПАГ в соединениях формул I-А, I-В и I-С означает остаток полиэтиленгликоля, образованный при удалении двух концевых гидроксильных групп. Кроме того, остатки ПАГ по настоящему изобретению в соединении формулы I-А и I-В характеризуются мол. массой от приблизительно 10000 до приблизительно 50000, наиболее предпочтительно от приблизительно 20000 до приблизительно 40000, прежде всего предпочтительно от приблизительно 25000 до приблизительно 35000. В соединении формулы I-С в общем случае предпочтительно, чтобы общая мол. масса двух радикалов ПАГ1 составляла от приблизительно 10000 до приблизительно 50000, предпочтительно от приблизительно 20000 до приблизительно 40000, наиболее предпочтительно от приблизительно 25000 до приблизительно 35000.
Реагенты формулы I-А, I-В и I-С можно коньюгировать с любым известным биофармацевтичсским препаратом, который содержит свободную гидрокси- или аминогруппу. Конденсацию можно проводить со свободной кислотой или с активированным эфиром.
Соединения формул I-А, I-В и I-С по настоящему изобретению можно вводить в реакцию со свободной гидрокси- или свободной аминогруппой биофармацевтического препарата, который содержит белковый, пептидный или небольшой органический фрагмент, с образованием коньюгата в виде сложного эфира или амида.
Коньюгаты по настоящему изобретению в виде сложного эфира или амида можно получать с использованием реагентов по изобретению по следующим схемам. При образовании коньюгатов в виде сложного эфира реагенты взаимодействуют с биофармацевтическим препаратом, содержащим концевую гидроксигруппу, как показано ниже
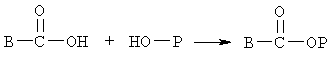
где Р означает остаток биофармацевтического препарата, содержащего концевую гидроксигруппу, причем указанная концевая группа удалена.
На указанной схеме В означает остаток соединений I-А, I-В и I-С, не содержащий концевой реакционно-способной карбоксильной группы или уходящей группы активированного эфира. При проведении указанной реакции можно использовать любой стандартный метод получения сложного эфира, включающий взаимодействие реакционно-способной карбоксильной группы со спиртом, с образованием коньюгата в виде сложного эфира. Предпочтительным методом является конденсация кислоты со спиртом в присутствии конденсирующего агента, такого как дициклогексилкарбодиимид, с использованием катализатора конденсации. При этом можно использовать любой стандартный катализатор конденсации, такой как 1-гидроксибензотриазол и (4-диметиламино)пиридин, или их смеси. В общем случае реакцию проводят в инертном органическом растворителе. Реакцию можно проводить со свободной кислотой или с ее активированным эфиром. При проведении реакции с активированным эфиром нет необходимости использовать катализатор конденсации и/или конденсирующий агент. При проведении указанной реакции температура и давление не имеют решающего значения и реакцию можно проводить при комнатной температуре. Однако при необходимости реакцию можно проводить при более высоких или более низких температурах. На схеме Р может означать остаток любого биофармацевтического препарата, содержащего концевую гидроксигруппу. При получении указанных сложных эфиров предпочтительные биофармацевтические препараты, содержащие концевую гидроксигруппу, включают нуклеозиды, такие как АЗТ (AZT). Кроме того, Р может означаеть любой низкомолекулярный биофармацевтический препарат, содержащий концевую гидроксигруппу.
При получении амидов используют соединение, показанное на следующей схеме
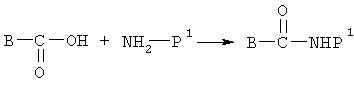
где Р1 означает остаток биофармацевтического препарата, содержащего концевую аминогруппу, причем указанная концевая аминогруппа удалена.
На приведенной схеме остаток В имеет значения, указанные выше. Р1 может означать остаток любого биофармацевтического препарата, содержащего концевую аминогруппу, такого как белок или пептид или низкомолекулярный биофармацевтический препарат, содержащий концевую аминогруппу. Предпочтительные белки и пептиды включают интерферон-α, интерферон-β, консенсус интерферон, гранулоцит-колонийстимулирующий фактор (GCSF), гранулоцит/макрофаг-колонийстимулирующий фактор (GM-CSF), интерлейкины, колонийстимулирующий фактор, а также иммуноглобулины, такие как IgG, IgE, IgM, IgA и IgD, и их фрагменты. Другие предпочтительные биофармацевтические препараты, содержащие аминогруппу, включают пептиды, указанные в US 5464933, прежде всего пептид Т-20, характеризующийся аминокислотной последовательностью
Tyr Thr Ser Leu Ile His Ser Leu Ile Glu Glu Ser Gln Asn Gln Gln Glu Lys Asn Glu Gln Glu Leu Leu Glu Leu Asp Lys Trp Ala Ser Leu Trp Asn Trp Phe (SEQ ID:1).
Реакцию получения амида проводят любым стандартным методом конденсации кислоты или активированного эфира (ОА) с амином с образованием пептидной связи. При получении коньюгата для образования пептидной связи используют любой стандартный метод взаимодействия кислоты и амина с образованием амида.
ОА по изобретению может означать любую уходящую группу активированной кислоты. Предпочтительные уходящие группы активированных кислот включают галогены, такие как хлор и бром, N-сукцинимидилокси, сульфо-N-сукцинимидилокси, 1-бензотриазолилокси, 1-имидазолил, пара-нитрофенилокси, 2,3,4-трихлорфенилокси, пентахлорфенилокси, пентафторфенилокси, N-фталимидилокси, N-тетрагидрофталимид, N-глутаримид, 1-гидроксипиперидин, 5-хлор-8-гидроксихинолин, N-норборнен-2,3-дикабоксимид и гидрокси-7-азабензотриазол.
Соединение формулы I-А, где Х равно 0
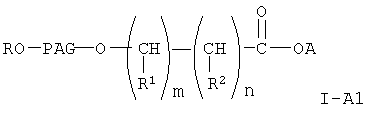
где A, R, PAG, R1, R2, m и n имеют значения, указанные выше, получают при взаимодействии соединения PAG-гидрокси формулы
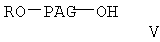
где R и РАС имеют значения, указанные выше,
с соединением формулы

где R5 образует гидролизуемую защитную группу сложного эфира, Y означает галоген, а R1, R2, m и n имеют значения, указанные выше, по следующей схеме
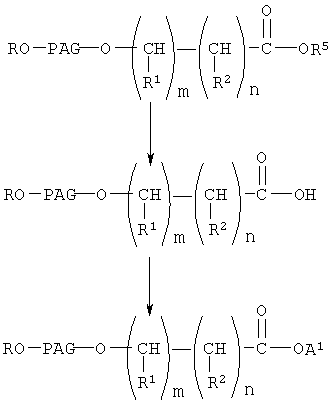
где R, PAG, m и n имеют значения, указанные выше, а А1 означает активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир.
При конденсации соединения формулы V с соединением формулы VI получают соединение формулы VIII. При проведении указанной реакции соединение формулы V взаимодействует с соединением формулы VI в органическом растворителе при кипячении с обратным холодильником в присутствии гидрида щелочного металла, такого как гидрид натрия. При этом используют любой стандартный метод конденсации спирта с галогенидом. В общем случае предпочтительно используют инертный органический растворитель из группы ароматических углеводородов, такой как бензол и толуол. Однако при проведении реакции можно использовать любой пригодный инертный органический растворитель. В соединении формулы VI группа R3 может означать любую известную гидролизуемую защитную группу сложного эфира. В общем случае, указанные гидролизуемые защитные группы сложных эфиров включают (низш.)алкильные защитные группы. Соединение формулы VIII гидролизуют с образованием соединения формулы IX обычными методами, такими как гидролиз в присутствии основания, такого как гидроксид щелочного металла в водной среде. Затем кислоту формулы IX переводят в активированную форму, соединение формулы X, с использованием активирующей уходящей группы, такой как N-гидроксисукцинимидильная группа, при взаимодействии с N-гидроксисукцинимидом. Однако при получении соединения формулы Х можно использовать любые известные активирующие уходящие группы, такие как указанные выше. Для получения соединения формулы Х можно использовать любой известный метод получения активированного эфира карбоновой кислоты, содержащего активированную уходящую группу, такую как N-гидроксисукцинимидильная группа.
Получение соединения I-А-1, которое включает соединения формулы IX и X, конденсацией соединения формулы V с соединеним формулы VI по вышеуказанной схеме иллюстрируется следующими общими методиками.
5 г соединения ПЭГ формулы V (мол. масса от 1000 до 40000) в 50-100 мл толуола сушили азеотропной перегонкой при кипячении с обратным холодильником в течение 1-3 ч, а затем удаляли 20-30 мл толуола. Полученную смесь растворяли в 20-30 мл безводного тетрагидрофурана и добавляли по каплям к гидриду натрия (5-10-кратный молярный избыток) в безводном тетрагидрофуране в атмосфере аргона, помещенному в круглодонную колбу. Полученную смесь кипятили с обратным холодильником в течение ночи. При получении соединения формулы VIII использовали следующие сложные эфиры галогенсодержащих кислот формулы VI: метиловый эфир 5-бромвалериановой кислоты; или этиловый эфир 5-иодвалериановой кислоты; или этиловый эфир 6-бромгексановой кислоты, этиловый эфир ω-хлорвалериановой кислоты; или метиловый эфир 6-бромгексановой кислоты; или метиловый эфир 7-бромгептановой кислоты; или этиловый эфир 7-бромгептановой кислоты; или метиловый эфир 8-бромоктановой кислоты; или этиловый эфир 8-бромоктановой кислоты; или метиловый эфир 10-бромдекановой кислоты; или этиловый эфир ω-бромундекановой кислоты; или метиловый эфир 11-бромундекановой кислоты, или метиловый эфир броммиристиновой кислоты; или этиловый эфир 15-бромпентадекановой кислоты; или метиловый эфир 16-бромгексадекановой кислоты; или метиловый эфир 17-бромгептадекановой кислоты; или метиловый эфир 3-хлорбутановой кислоты, метиловый эфир 3-бромбутановой кислоты; или этиловый эфир 3-бромбутановой кислоты, этиловый эфир β-бромвалериановой кислоты; или этиловый эфир β-бромкапроновой кислоты. Сложный эфир указанной кислоты (5-10-молярный избыток) добавляли к реакционной смеси с использованием шприца и реакционную смесь кипятили с обратным холодильником в течение ночи. Затем реакционную смесь концентрировали на роторном испарителе, к остатку, содержащему соединение формулы VIII, добавляли 2-пропанол/диэтиловый эфир (1:1), осадок, соединение формулы VIII, отделяли фильтрованием и высушивали в вакууме.
Сложный эфир ПЭГ-кислоты формулы VIII (4 г) растворяли в 50-100 мл 1 н. раствора гидроксида натрия и раствор перемешивали при комнатной температуре в течение ночи. К смеси добавляли 1-6 н. соляную кислоту до рН 2,5-3,0 и смесь экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, ПЭГ-кислоту формулы IX, отделяли фильтрованием и высушивали в вакууме.
ПЭГ-кислоту формулы IX (2 г) растворяли в безводном дихлорметане (10-20 мл), добавляли N-гидроксисукцинимид (1,05-2,0-кратный молярный избыток) и дициклогексилкарбодиимид (1,05-2,0-кратный молярный избыток) и смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем смесь фильтровали, концентрировали и продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1). Продукт высушивали в вакууме в течение ночи, при этом получали активированный эфир формулы Iа1 (соединение формулы X).
Соединение формулы I-А, где Х означает NH, формулы
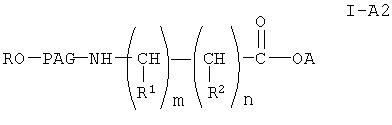
где A, R, PAG, R1, R2, m и n имеют значения, указанные выше, получают из соединения
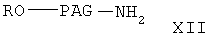
где R и РАС имеют значения, указанные выше,
сначала при взаимодействии соединения формулы XII с соединением формулы VI с образованием соединения формулы
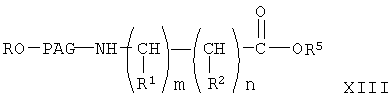
где R, R1, R2, R5, PAG, m и n имеют значения, указанные выше.
Соединение формулы XIII получают конденсацией амина формулы XII с галогенпроизводным формулы VI. При этом можно использовать любой стандартный метод конденсации амина с галогенсодержащим соединением. Затем из соединения формулы XIII получают соединение формулы I-А2, где А означает уходящую группу, через промежуточное соединение формулы
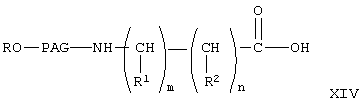
где R, PAG, R1, R2, m и n имеют значения, указанные выше.
Указанную реакцию с образованием соединения формулы XIV проводят обычным гидролизом в присутствии основания, как описано выше. Из соединения формулы XIV получают соединение формулы 1А2, где А означает актвированную уходящую группу, которая вместе с присоединенным кислородом образует сложный эфир, аналогично тому, как описано при превращении соединения формулы IX в соединение формулы X.
В общем случае способ получения соединения формулы 1А2, где А означает активированную уходящую группу, которая вместе с присоединенным кислородом образует сложный эфир, с использованием сначала взаимодействия соединения формулы XII с соединением формулы VI с образованием соединения формулы 1А2, иллюстрируется следующей общей схемой.
Первая стадия
5 г ПЭГ-амина формулы XII (мол. массы от 1000 до 40000) растворяли в 25-50 мл абсолютного этанола. Затем к раствору ПЭГ добавляли соединение формулы VI, которое может означать метиловый эфир 5-бромвалериановой кислоты или (этиловый эфир 5-йодвалериановой кислоты; или этиловый эфир 6-бромгексановой кислоты, или этиловый эфир ω-хлорвалериановой кислоты; или метиловый эфир 6-бромгексановой кислоты; или метиловый эфир 7-бромгептановой кислоты; или этиловый эфир 7-бромгептановой кислоты; или метиловый эфир 8-бромоктановой кислоты; или этиловый эфир 8-бромоктановой кислоты; или метиловый эфир 10-бромдекановой кислоты; или этиловый эфир ω-бромундекановой кислоты; или метиловый эфир 11-бромундекановой кислоты, или метиловый эфир броммиристиновой кислоты; или этиловый эфир 15-бромпентадекановой кислоты; или метиловый эфир 16-бромгексадекановой кислоты; или метиловый эфир 17-бромгептадекановой кислоты; или метиловый эфир 3-хлорбутановой кислоты, метиловый эфир 3-бромбутановой кислоты; или этиловый эфир 3-бромбутановой кислоты, этиловый эфир β-бромвалериановой кислоты; или этиловый эфир β-бромкапроновой кислоты) (5-10-кратный избыток) и полученную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь концентрировали на роторном испарителе, продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1), отделяли фильтрованием и высушивали в вакууме, при этом получали соединение формулы XIII.
Вторая стадия
Сложный эфир ПЭГ-кислоты формулы XIII (4 г) растворяли в 50-100 мл 1 н. раствора гидроксида натрия и раствор перемешивали при комнатной температуре в течение ночи. К смеси добавляли 1-6 н. соляную кислоту до рН 2,5-3,0 и смесь экстрагировали дихлорметаном. Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, ПЭГ-кислоту формулы XIV, отделяли фильтрованием и высушивали в вакууме.
ПЭГ-кислоту формулы XIV (2 г) растворяли в безводном дихлорметане (10-20 мл), добавляли N-гидроксисукцинимид (1,05-2,0-кратный молярный избыток) и дициклогексилкарбодиимид (1,05-2,0-кратный молярный избыток) и смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем смесь фильтровали, концентрировали и продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1). Продукт высушивали в вакууме в течение ночи, при этом получали соединение формулы I-А2, где А означает активированную уходящую группу, которая вместе с присоединенным кислородом образует сложный эфир.
Соединение формулы I-В, где Х равно 0, формулы

где A, R, PAG, R3, R4, w и n имеют значения, указанные выше,
получают при взаимодействии соединения формулы V с соединением формулы

где w, Y, R3, R4 и R5 имеют значения, указанные выше,
с образованием соединения формулы
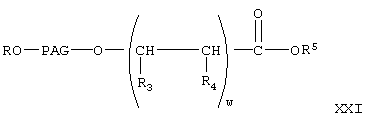
где w, R, PAG, R3, R4 и R5 имеют значения, указанные выше.
Реакцию соединения формулы XX с соединением формулы V с образованием соединений формулы XXI проводят аналогично тому, как описано при взаимодействии соединения формулы V с соединением VI с образованием соединения VII. Затем соединение формулы XX гидролизуют в присутствии основания в условиях, описанных выше, с образованием соединения формулы
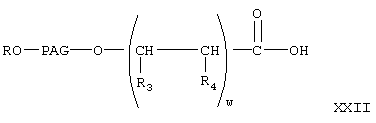
где R, PAG, R3 и R4 имеют значения, указанные выше.
Затем из соединения формулы XXII получают соединение формулы I-В1, где А означает активированную уходящую группу, которая вместе с присоединенным кислородом образует сложный эфир. Указанную реакцию проводят аналогично тому, как описано при получении соединения формулы Х из соединения IX.
Соединение формулы I-В, где Х означает NH, формулы
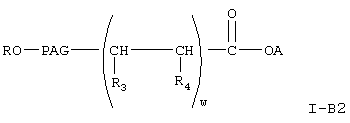
где A, R, PAG, R3, R4 и w имеют значения, указанные выше,
получают при взаимодействии соединения формулы XII с соединением формулы XX, при этом получают соединение формулы
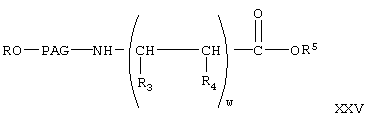
где R, ПАГ, R3, R4 и R5 имеют значения, указанные выше.
Реакцию соединения формулы XX с соединением формулы XII с образованием соединения формулы XXV проводят аналогично тому, как описано для реакции соединения формулы XII с соединением формулы VI с образованием соединения XIII. Затем соединение формулы XXV гидролизуют в присутствии основания в условиях, описанных выше, с образованием соединения формулы
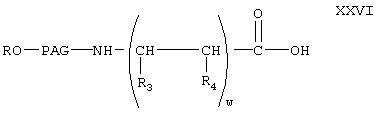
где R, PAG, R3 и R4 и w имеют значения, указанные выше.
Получение соединения формулы I-В2 по реакции соединения формулы XX с соединением формулы III проводят аналогично тому, как описано при получении соединения формулы I-А2, при замене соединения формулы XX на соединение формулы VI.
Соединение формулы I-С, где Х равно 0, формулы
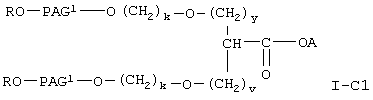
где R, PAG1, A, v, у и k имеют значения, указанные выше, получают при взаимодействии соединения формулы

где Y, R5, у и v имеют значения, указанные выше,
с соединением формулы
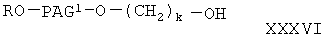
где R, PAG и k имеют значения, указанные выше.
Получение соединения формулы I-С1 проводят, как показано на следующей схеме
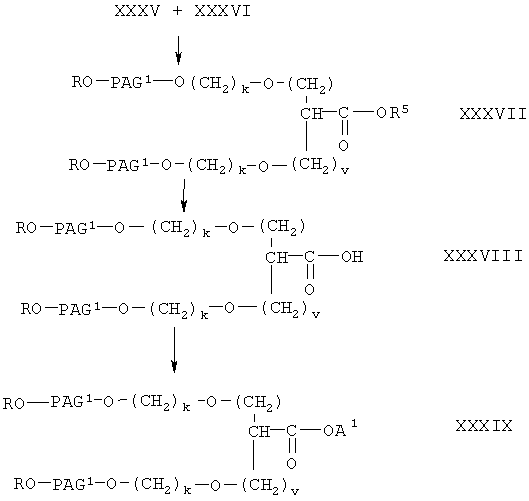
где A1, R, PAG1, n и v имеют значения, указанные выше.
При получении соединения формулы I-С1 два моля соединения формулы XXXVI вводят в реакцию с одним молем соединения формулы XXXV. Указанную реакцию проводят в условиях, описанных выше при взаимодействии соединения формулы V с соединением формулы VI, при этом получают соединение формулы XXXVII. Соединение формулы XXXVII гидролизуют с образованием соединения формулы XXXVIII аналогично тому, как описано при гидролизе соединения формулы VIII с образованием соединения фомрулы IX. На последней стадии карбоксильную группу в соединении формулы XXXVIII превращают в активированную уходящую группу аналогично тому, как описано при получении соединения формулы IX. При этом из соединения формулы XXXVIII получают соединение формулы I-С1, где А означает активированную уходящую группу, которая вместе с присоединенным кислородом образует сложный эфир.
Соединение формулы I-С, где Х означает NH, т.е. соединение формулы
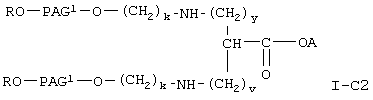
где A, R, PAG1, v, w и у имеют значения, указанные выше,
получают при взаимодействии соединения формулы XXXV, указанного выше, с соединением формулы
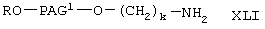
где R, PAG1 и k имеют значения, указанные выше, по следующей схеме:
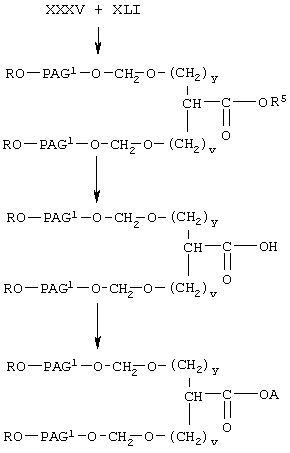
На первой стадии соединение формулы XXXV вводят в реакцию с соединением формулы XLI с образованием соединения формулы XLII. Указанную реакцию проводят аналогично тому, как описано при взаимодействии соединения формулы VII с соединением формулы VI с образованием соединения формулы XIII. На следующей стадии соединение XLII гидролизуют с образованием соединения формулы XLIII аналогично тому, как описано при гидролизе соединения формулы XIII. Затем карбоксильную группу в соединении формулы XLII превращают в активированную уходящую группу, как описано выше, с образованием соединения формулы I-С-2, где А означает активированную уходящую группу, которая вместе с присоединенным кислородом образует сложный эфир. Указанную реакцию проводят аналогично тому, как описано при получении соединения I-А2 из соединения XIV.
Примеры
Пример 1
Получение сукцинимидилового эфира альфа-метокси-PEG-омега-валериановой кислоты
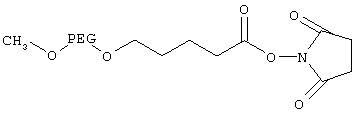
Соединение формулы V, где R означает метил, a PAG означает PEG с мол. массой 10000 Да (5,0 г, 0,5 ммоля) в 50 мл толуола сушили азеотропной перегонкой при кипячении с обратным холодильником в течение 2 ч, а затем удаляли 40 мл толуола. Полученную смесь растворяли в 30 мл безводного тетрагидрофурана и добавляли по каплям к гидриду натрия (0,12 г, 5 ммолей) в безводном тетрагидрофуране (20 мл), помещенному в круглодонную колбу, в атмосфере аргона. Полученную смесь кипятили с обратным холодильником в течение ночи. Затем к смеси добавляли с использованием шприца этиловый эфир 5-бромвалериановой кислоты (0,79 мл, 5 ммолей) и реакционную смесь кипятили с обратным холодильником в течение ночи. Затем реакционную смесь концентрировали на роторном испарителе, к остатку добавляли 2-пропанол/диэтиловый эфир (1:1), осадок отделяли фильтрованием и высушивали в вакууме, при этом получали указанное в заголовке соединение (этиловый эфир м-PEG-валериановой кислоты) (выход 4,5 г), где PEG характеризуется мол. массой 1000 Да.
Этиловый эфир м-PEG-валериановой кислоты (4 г) растворяли в 100 мл 1 н. раствора гидроксида натрия и раствор перемешивали при комнатной температуре в течение ночи. К смеси добавляли 6 н. соляную кислоту до рН 2,5 и смесь экстрагировали дихлорметаном (50 мл, 40 мл и 30 мл). Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, м-PEG-валериановую кислоту, где PEG характеризуется мол. массой 1000 Да, отделяли фильтрованием и высушивали в вакууме (выход 3 г).
1H-ЯМР (ДМСО-d6): 1,50 (q, 2H, -СН2СН2-СООН), 2,21 (t, 2H, -СН2СН2-СООН), 3,21 (s, -OCH3), 3,5 (s, -O-CH2CH2-O-).
м-PEG-валериановую кислоту (2 г, 0,2 ммоля) растворяли в безводном дихлорметане (10 мл), добавляли N-гидроксисукцинимид (47 мг, 0,41 ммоля) и дициклогексилкарбодиимид (87 мг, 0,42 ммоля) и смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем смесь фильтровали, концентрировали, продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1) и высушивали в вакууме в течение ночи, при этом получали 1,6 г указанного в заголовке соединения.
1H-ЯМР (ДМСО-d6): 1,58-1,67 (m, 4Н, -СН2СН2СН2-СОО-), 2,69 (t, 2H, -СН2СН2СН2-СОО-), 2,81 (s, 4H, NHS), 3,21 (s, -ОСН3), 3,5 (s, -O-CH2CH2-O-).
Пример 2
Получение сукцинимидилового эфира альфа-метокси-PEG-бета-бутановой кислоты
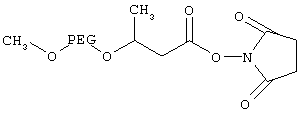
Соединение формулы I, где PAG означает PEG с мол. массой 10000 Да (5,0 г, 0,5 ммоля) в 50 мл толуола сушили азеотропной перегонкой при кипячении с обратным холодильником в течение 2 ч, а затем удаляли 40 мл толуола. Полученную смесь растворяли в 30 мл безводного тетрагидрофурана и добавляли по каплям к гидриду натрия (0,12 г, 5 ммолей) в безводном тетрагидрофуране (20 мл), помещенному в круглодонной колбе, в атмосфере аргона. Полученную смесь кипятили с обратным холодильником в течение ночи. Затем к смеси добавляли с использованием шприца этиловый эфир бета-бромбутановой кислоты (0,74 мл, 5 ммолей) и реакционную смесь кипятили с обратным холодильником в течение ночи. Затем реакционную смесь концентрировали на роторном испарителе, продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1) и высушивали в вакууме, при этом получали этиловый эфир м-PEG-бета-бутановой кислоты (выход 4,5 г), где PEG характеризуется мол. массой 1000 Да.
1H-ЯМР (ДМСО-d6): 0,83 (t, 3Н, -O-СН2-СН3), 1,05 (t, 3Н, -СН3), 1,57 (m, 1H, -СНСН2СО-), 3,21 (s, -ОСН3), 3,5 (s, -O-CH2CH2-O-).
Этиловый эфир м-PEG-масляной кислоты (3 г) растворяли в 50 мл 1 н. раствора гидроксида натрия и раствор перемешивали при комнатной температуре в течение ночи. К смеси добавляли 6 н. соляную кислоту до рН 2,5 и смесь экстрагировали дихлорметаном (25 мл, 20 мл и 20 мл). Органический слой сушили над сульфатом натрия, фильтровали, концентрировали и продукт осаждали добавлением диэтилового эфира. Продукт, м-PEG-бутановую кислоту, где PEG характеризуется мол. массой 41000 Да, отделяли фильтрованием и высушивали в вакууме (выход 2,4 г).
1H-ЯМР (ДМСО-d6): 0,88 (t, 3Н, -СН3), 1,61 (m, 1Н, -СНСН2СО-), 3,21 (s, -ОСН3), 3,5 (s, -O-CH2CH2-O-).
м-PEG10k-бета-бутановую кислоту (1 г, 0,1 ммоля) растворяли в безводном дихлорметане (5 мл), добавляли N-гидроксисукцинимид (24 мг, 0,20 ммоля) и дициклогексилкарбодиимид (43 мг, 0,21 ммоля) и смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем смесь фильтровали, концентрировали, продукт осаждали добавлением добавлением 2-пропанола/диэтилового эфира(1:1) и высушивали в вакууме в течение ночи, при этом получали указанное в заголовке соединение (выход 6,6 г), где PEG характеризуется мол. массой 13000 Да.
Пример 3
Получение коньюгата PEG-AZT
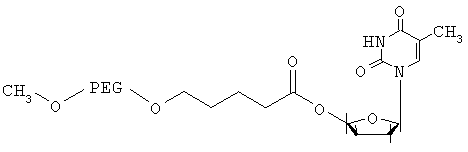
м-PEG10k-валериановую кислоту (см. пример 1) (0,2 г, 0,02 ммоля) растворяли в безводном диметилформамиде (2 мл), а затем добавляли 3'-азидо-3'-дезокситимидин (AZT) (10,7 мг, 0,04 ммоля), 1-гидроксибензотриазол (НОВТ) (9,8 мг, 0,04 ммоля), (4-диметиламино)пиридин (DMAP) (5,7 мг, 0,042 ммоля) и дициклогексилкарбодиимид (DCC) (9,5 мг, 0,046 ммоля) и полученную смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем смесь фильтровали, концентрировали, продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1) и высушивали в вакууме в течение ночи (выход 0,17 г).
1H-ЯМР (ДМСО-d6): 1,18 (m, 3Н, H1), 1,51 (m, 2Н, Н9), 2,23 (m, 1Н, Н4), 2,37 (t, 2Н, Н8), 3,21 (s, Н12), 3,5 (s, Н11), 4,2 (m, 1H, H5), 6,12 (m, Н3, Н6), 7,45 (s, 1H, Н2), 11,35 (ушир., 1Н, Н10).
Пример 4
Пэгилирование Т-20 реагентом м-PEG10k-SVA
Сукцинимидилиовый эфир альфа-метокси-ПЭГ-омега-валериановой кислоты (где PEG характеризуется мол. массой 10 кДа), полученный, как описано в примере 1, добавляли к пептиду Т-20, характеризующемуся аминокислотной последовательностью
Tyr Thr Ser Leu Ile His Ser Leu Ile Glu Glu Ser Gln Asn Gln Gln Glu Lys Asn Glu Gln Glu Leu Leu Glu Leu Asp Lys Trp Ala Ser Leu Trp Asn Trp Phe (SEQ 1), в 1,0 мл 50 мМ боратного буферного раствора (рН 8,0) в молярном соотношении реагент/лиганд 2:1 и полученный раствор перемешивали при комнатной температуре в течение 4 ч. Пэгилированный Т-20 отделяли от немодифицированного Т-20 ионообменной хроматографией (колонка QA, элюент: градиент концентрации NaCl в 20 мМ трис-буферном растворе, рН 7,5, от 100 мМ до 1 М).
Пример 5
Пэгилирование эритропоэтина (ЭПО) реагентом м-PEG30k-β-SBA
1. Ферментация и очистка ЭПО человека
Примечание: методы ферментации и очистки ЭПО человка аналогичны описанным в Европейской заявке ЕР 1064951 F2, стр.7-9.
2. Реакция пэгилирования
К 5 мг ЭПОsf (653 мкл основного раствора ЭПОsf, 7,66 мг/мл, 0,274 мкмоля) добавляли 347 мкл 100 мМ боратного буферного раствора (рН 8,0), содержащего 8,2 мг (0,274 мкмоля) метокси-PEG-β-SBA (мол. масса 30 кДа) и смесь перемешивали при 4°С в течение 4 ч. Конечная коцентрация белка составляла 5 мг/мл, а соотношение белок/реагент PEG составляло 1:1. Через 4 ч реакцию останавливали добавлением ледяной уксуной кислоты до рН 4,5 и смесь хранили при -20°С до проведения очистки.
3. Очистка
Реакционную смесь, полученную на предыдущей стадии, разбавляли 1:5 добавлением 10 мМ раствора ацетата натрия (рН 4,5) и наносили на колонку (18×143 мм) с SP-сефарозой FF (катионообменник, содержащий сульфопропильную группу). Предварительно колонку промывали указанным буферным раствором. В элюате регистрировали поглощение при 280 нм с использованием проточного денситометра Gilson UV, снабженного самописцем фирмы Kipp&Zonen. Колонку промывали 100 мл (или одним объемом) исходного буферного раствора для удаления избытка реагентов, побочных продуктов реакции и олигомерного PEG-ЭПО. Затем колонку промывали двумя объемами 100 мМ раствора NaCl для удаления ди-PEG-ЭПО. Затем 200 мМ раствором NaCl элюировали моно-PEG-ЭПО. При элюировании моно-PEG-ЭПО первые 50 мл, содержащих белок, отбрасывали, а затем собирали фракцию, содержащую моно-PEG-ЭПО, объемом 150 мл. Немодифицированный ЭПОsf элюировали 750 мМ раствором NaCl. Все растворы NaCl готовили на исходном буферном растворе (10 мМ ацетат натрия, рН 4,5). Полученные образцы анализировали с использованием электрофореза в геле (SDS-PAGE) и масс-спектрометрии (MALDI-TOF). Образец моно-PEG-ЭПО выделяли из фракции объемом 150 мл, которая по результатам анализа не содержала ЭПОsf. Указанную фракцию концентрировали (˜5,0 мг/мл) и подвергали диафильтрации в буферном растворе для хранения (10 мМ фосфат калия, 100 мМ NaCl, рН 7,5). Концентрирование/диафильтрацию проводили при комнатной температуре с использованием системы Labscale™ TFF (фирма Millipore) на мембране Pellicone XL Biomax 50 (НОММ 5 кДа) (фирма Millipore). Концентрат моно-PEG-ЭПО стерилизовали мембранной фильтрацией и хранили при -20°С.
Пример 6
Пэгилирование ЭПО реагентом м-PEG10k-β-SVA
Различные аликвотные части ЭПОsf, использованного в примере 5, обрабатывали реагентом метокси-PEG-SVA (где РЕО характеризуется мол. массой 10 кДа). Реакцию проводили при соотношении белок/реагент 1:2, а полученные образцы очищали по методике, описанной в примере 5.
Пример 7
Определение активности пэгилированного ЭПО in vivo на мышах с нормоцитемией
Биоиспытание на мышах с нормоцитемией известно в данной области техники (Pharm. Europa Spec. Issue Erithropoietin BRP Bio 1997(2)), а метод описан в монографии по эритропоэтину (см. Ph. Eur. BRP). Образец разбавляли фосфатно-солевым буферным раствором, содержащим БСА. Здоровым мышам возрастом 7-15 недель вводили подкожно 0,5 мл фракции ЭПО, содержащей непэгидированный ЭПО (40 нг/мышь), и монопэгилированный ЭПО (10 или 40 нг/мышь), полученные как описано в примере 5 или 6. Через 6 сут у животных отбирали образцы крови пункцией хвостовой вены и разбавляли таким образом, чтобы в 1 мл 0,15 М раствора красителя акридинового оранжевого содержался 1 мкл крови. Время окрашивания составляло от 3 до 10 мин. Затем в образцах определяли абсолютное количество ретикулоцитов (в расчете на 30000 проанализированных клеток крови). Для представленных данных каждая группа включала 5 мышей/сут, причем кровь отбирали однократно. Результаты показали, что образцы пэгилированного эритропоэтина характеризуются более высокой активностью и продолжительным биохимическим полупериодом, о чем свидетельствует заметно более высокие количества ретикулоцитов и сдвиг максимального количества ретикулоцитов при введении вышеуказанной дозы на мышь (10 нг) по сравнению с введением более высокой дозой (40 нг) немодифицированного ЭПО.
Пример 8
Получение разветвленной метокси-PEG-кислоты и ее сукцинимидилового эфира

Соединение формулы VI, где PAG означает PEG с мол. массой 1000 Да (м-PEG-амин с мол. массой 10000), (1,0 г, 0,1 ммоля) растворяли в 5 мл абсолютного этанола при 40°С, добавляли этиловый эфир 3-бром-2-(бромметил)пропионовой кислоты (7,6 мкл, 0,048 ммоля) и полученную смесь перемешивали в атмосфере аргона при 40°С в течение ночи. Реакционную смесь концентрировали на роторном испарителе, продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1), отделяли фильтрованием и высушивали в вакууме в течение ночи (выход 0,89 г).
Сложный эфир разветвленной м-PEG-кислоты (0,89 г) растворяли в 20 мл 1 н. раствора гидроксида натрия и раствор перемешивали при комнатной температуре в течение ночи. К смеси добавляли 6 н. соляную кислоту до рН 2,5 и смесь экстрагировали дихлорметаном (10 мл, 5 мл и 5 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Продукт, м-PEG-валериановую кислоту, осаждали добавлением диэтилового эфира, отделяли фильтрованием и высушивали в вакууме (выход 0,64 г).
Разветвленную м-PEG-кислоту (0,64 г, 0,032 ммоля) растворяли в безводном дихлорметане (5 мл), добавляли N-гидроксисукцинимид (11 мг, 0,098 ммоля) и дициклогексилкарбодиимид (20 мг, 0,099 ммоля) и смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем реакционную смесь фильтровали и концентрировали. Продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1) и высушивали в вакууме в течение ночи (выход 0,58 г).
Пример 9
Получение разветвленной PEG-кислоты и ее сукцинимидилового эфира
Соединение метокси-PAG формулы V, где PAG означает PEG с мол. массой 2000 (м-PEG-амин с мол. массой 10000), (1,0 г, 0,1 ммоля) растворяли в 5 мл абсолютного этанола при 40°С, добавляли этиловый эфир 3-бром-2-(бромметил)пропионовой кислоты (7,6 мкл, 0,048 ммоля) и полученную смесь перемешивали в атмосфере аргона при 40°С в течение ночи. Реакционную смесь концентрировали на роторном испарителе, продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1), отделяли фильтрованием и высушивали в вакууме в течение ночи (выход 0,89 г).
Сложный эфир разветвленной м-PEG-кислоты (0,89 г) растворяли в 20 мл 1 н. раствора гидроксида натрия и раствор перемешивали при комнатной температуре в течение ночи. К смеси добавляли 6 н. соляную кислоту до рН 2,5 и экстрагировали дихлорметаном (10 мл, 5 мл и 5 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали. Продукт, м-PEG-валериановую кислоту, осаждали добавлением диэтилового эфира, отделяли фильтрованием и высушивали в вакууме (выход 0,64 г).
Разветвленную м-PEG-кислоту (0,64 г, 0,032 ммоля) растворяли в безводном дихлорметане (5 мл), добавляли N-гидроксисукцинимид (11 мг, 0,098 ммоля) и дициклогексилкарбодиимид (20 мг, 0,099 ммоля) и смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Затем реакционную смесь фильтровали и концентрировали. Продукт осаждали добавлением 2-пропанола/диэтилового эфира (1:1) и высушивали в вакууме в течение ночи (выход 0,58 г).

| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ПРИМЕНЕНИЯ | 2002 |
|
RU2345983C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ КОНЪЮГАТОВ | 2006 |
|
RU2401283C2 |
| НОВОЕ ПРИМЕНЕНИЕ ЭРИТРОПОЭТИНА ПРИ СЕРДЕЧНЫХ ЗАБОЛЕВАНИЯХ | 2003 |
|
RU2324494C2 |
| ДИПЕПТИДЫ, СОДЕРЖАЩИЕ НА N-КОНЦЕВОМ АМИНОКИСЛОТНОМ ОСТАТКЕ 2-ТИОАЦИЛЬНУЮ ГРУППУ, В КАЧЕСТВЕ ИНГИБИТОРОВ ВАЗОПЕПТИДАЗЫ | 2002 |
|
RU2298559C2 |
| УЛУЧШЕННЫЕ ХЕЛАТНЫЕ КОНЪЮГАТЫ | 2002 |
|
RU2298012C2 |
| ИНСУЛИН-ОЛИГОМЕРНЫЕ КОНЪЮГАТЫ, ИХ ПРЕПАРАТЫ И ПРИМЕНЕНИЯ | 2005 |
|
RU2527893C2 |
| ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ В КАЧЕСТВЕ АНТАГОНИСТОВ IP | 2001 |
|
RU2268258C2 |
| БИЦИКЛИЧЕСКИЕ ПИРИДИНЫ И ПИРИМИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ Р38 | 2003 |
|
RU2301233C2 |
| ЦИКЛИЧЕСКИЕ ТИОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ АМИДА АЦИЛАМИНОКИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1998 |
|
RU2193556C2 |
| ТРАНС-ОЛЕФИНОВЫЕ АКТИВАТОРЫ ГЛЮКОКИНАЗЫ | 2000 |
|
RU2245332C2 |
Изобретение относится к полиалкиленгликолевым кислотам и к их связыванию с терапевтически активными биофармацевтическими препаратами, такими как полипептиды, сахара, белки и терапевтически активные низкомолекулярные соединения, с целью получения терапевтически активных коньюгатов полиалкиленгликоля с указанными биофармацевтическими препаратами. Заявлены соединения общей формулы, где X означает -NH- для соединений I-A и I-B, и X означает -О- или -NH- для соединения I-C:
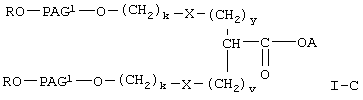
Заявлены также способы получения указанных соединений, которые включают конденсацию соединения формулы 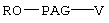 (для соединений I-А и I-B) или
(для соединений I-А и I-B) или  (для соединения I-C), где V означает -ОН или -NH2, с соответствующим галогенидом, гидролиз полученного сложного эфира с образованием соответствующей свободной кислоты и, при необходимости, взаимодействие указанной свободной кислоты с галогеном активированной уходящей группы в присутствии конденсирующего агента с образованием указанного активированного сложного эфира. Также заявлены конъюгаты общей формулы, которые указаны в описании. Указанные реагенты являются более устойчивыми в водной среде и их можно использовать для сайт-специфичной модификации белка. Заявленные соединения обладают более высокой активностью и продолжительным биохимическим полупериодом. 8 н. и 11 з.п. ф-лы.
(для соединения I-C), где V означает -ОН или -NH2, с соответствующим галогенидом, гидролиз полученного сложного эфира с образованием соответствующей свободной кислоты и, при необходимости, взаимодействие указанной свободной кислоты с галогеном активированной уходящей группы в присутствии конденсирующего агента с образованием указанного активированного сложного эфира. Также заявлены конъюгаты общей формулы, которые указаны в описании. Указанные реагенты являются более устойчивыми в водной среде и их можно использовать для сайт-специфичной модификации белка. Заявленные соединения обладают более высокой активностью и продолжительным биохимическим полупериодом. 8 н. и 11 з.п. ф-лы.
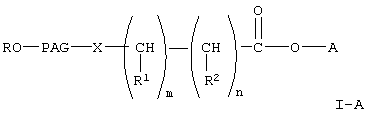
где R, R1 и R2 каждый независимо означает водород или (низш.)алкил,
X означает -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется молекулярной массой от 1000 до 50000 Да,
n означает целое число от 0 до 1,
m означает целое число от 4 до 8,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир.
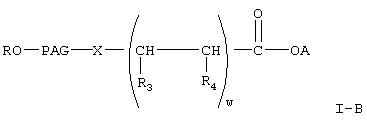
где R означает водород или (низш.)алкил,
X означает -О- или -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется молекулярной массой от 1000 до 50000 Да,
w означает целое число от 1 до 3,
один из R3 и R4 означает (низш.)алкил, а другой означает водород или (низш.)алкил,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир.

где R означает водород или (низш.)алкил,
X означает -О- или -NH-,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир,
PAG1 означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется молекулярной массой от приблизительно 500 до приблизительно 25000 Да,
у означает целое число от 0 до 3,
v означает целое число от 1 до 3,
а k означает целое число от 1 до 2,
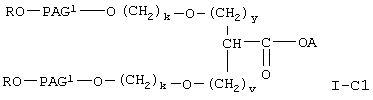
где R, PAG1, A, v, у и k имеют значения, указанные в п.3.

где R, R1 и R2 каждый независимо означает водород или (низш.)алкил,
X означает -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется молекулярной массой от 1000 до 50000 Да,
n означает целое число от 0 до 1,
m означает целое число от 4 до 8,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир,
причем указанный способ включает конденсацию соединения формулы
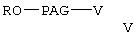
где R и PAG имеют значения, указанные выше, а V означает -ОН или -NH2,
с соединением формулы
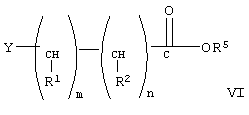
где R5 образует гидролизуемую защитную группу сложного эфира, Y означает галогенид, a R1, R2, m и n имеют значения, указанные выше,
с образованием соединения формулы
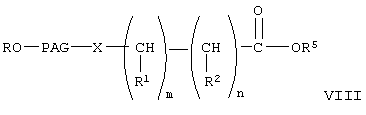
где R, PAG, X, R1, R2, R5, m и n имеют значения, указанные выше,
гидролиз указанного сложного эфира с образованием свободной кислоты формулы
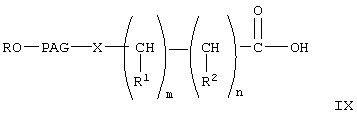
где R, PAG, X, R1, R2, m и n имеют значения, указанные выше,
и при необходимости взаимодействие указанной свободной кислоты с галогеном активированной уходящей группы в присутствии конденсирующего агента с образованием указанного активированного сложного эфира.

где R означает водород или (низш.)алкил,
X означает -О- или -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется молекулярной массой от 1000 до 50000 Да,
w означает целое число от 1 до 3,
один из R3 и R4 означает (низш.)алкил, а другой означает водород или (низш.)алкил,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир,
причем указанный способ включает конденсацию соединения формулы
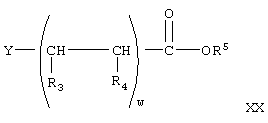
где w, R3, R4 имеют значения, указанные выше, Y означает галогенид, a R5 образует гидролизуемую защитную группу сложного эфира,
с соединением формулы
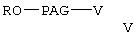
где R и PAG имеют значения, указанные выше, а V означает -ОН или -NH2,
с образованием соединения формулы
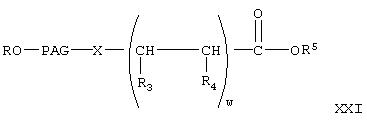
где w, R, PAG, X, R3, R4 и R5 имеют значения, указанные выше,
гидролиз указанного сложного эфира с образованием свободной кислоты формулы
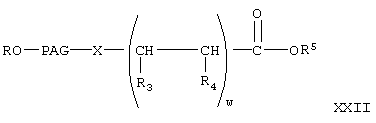
где w, R, PAG, X, R3, R4 имеют значения, указанные выше, и R5 означает Н,
и при необходимости взаимодействие указанной свободной кислоты с галогеном активированной уходящей группы в присутствии конденсирующего агента с образованием указанного активированного сложного эфира.

где R означает водород или (низш.)алкил,
X означает -О- или -NH-,
А означает водород или активированную уходящую группу, которая вместе с присоединенным атомом кислорода образует сложный эфир,
PAG1 означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется молекулярной массой от приблизительно 500 до приблизительно 25000 Да,
у означает целое число от 0 до 3,
v означает целое число от 1 до 3,
k означает целое число от 1 до 2,
включающий конденсацию соединения формулы

где у и v имеют значения, указанные выше, Y означает галогенид, a R5 образует гидролизуемую защитную группу сложного эфира,
с соединением формулы
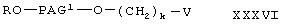
где R, PAG1 и k имеют значения, указанные выше, V означает -ОН или -NH2,
с образованием сложного эфира формулы
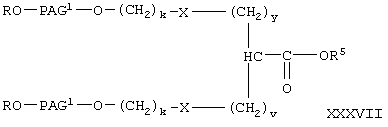
где R, PAG1, X, R5, k, v и у имеют значения, указанные выше,
гидролиз указанного сложного эфира с образованием свободной кислоты формулы

где R, PAG1, X, k, v и у имеют значения, указанные выше,
и при необходимости взаимодействие указанной свободной кислоты с галогеном активированной уходящей группы в присутствии конденсирующего агента с образованием указанного активированного сложного эфира.
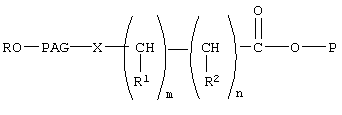
где Р означает остаток биофармацевтического препарата, содержащего концевую гидроксильную группу, в котором концевая гидроксильная группа удалена, такого, как азидотимидин (AzT),
R, R1 и R2 каждый независимо означает водород или (низш.)алкил,
X означает -О- или -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется молекулярной массой от 1000 до 50000 Да,
n означает целое число от 0 до 1,
m означает целое число от 4 до 8.
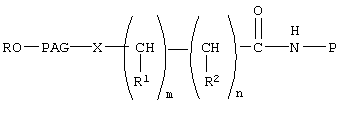
где Р означает остаток биофармацевтического препарата, содержащего концевую гидроксильную группу, в котором концевая гидроксильная группа удалена,
R, R1 и R2 каждый независимо означает водород или (низш.)алкил,
X означает -NH-,
PAG означает двухвалентный остаток полиалкиленгликоля, образованный при удалении двух концевых гидроксильных групп, причем указанный остаток характеризуется молекулярной массой от 1000 до 50000 Да,
n означает целое число от 0 до 1,
m означает целое число от 4 до 8.
| Способ регенерации хромоникелевого катализатора | 1961 |
|
SU146291A1 |
| US 4670417 А, 02.06.1987 | |||
| КОМПЛЕКСЫ НУКЛЕИНОВЫХ КИСЛОТ - ЛИГАНДОВ СОСУДИСТОГО ЭНДОТЕЛИАЛЬНОГО ФАКТОРА РОСТА (VEGF) | 1997 |
|
RU2177950C2 |
Авторы
Даты
2008-02-27—Публикация
2003-07-16—Подача