Изобретение относится к биохимии, конкретно к биологически активным пептидам, обладающим антимикробным действием, которые могут найти применение в биотехнологии и медицине.
Стремительный рост числа структурно новых антибиотиков, вводимых в клиническую практику, наблюдавшийся в 40-50-х годах прошлого столетия, сменился длительным инновационным кризисом, который продолжается и сегодня [Walsh С. Where will new antibiotics come from? // Nat. Rev. Microbiol. - 2003. - Vol.1. - P.65-70]. Широкое применение антибиотиков в качестве лечебных препаратов вызывает быстрое накопление устойчивых форм микроорганизмов, у которых клинически существенная резистентность возникает за период от нескольких месяцев до нескольких лет. Распространены случаи устойчивости целого ряда патогенов человека (Enterococcus faecalis, Mycobacterium tuberculosis, Pseudomonas aeruginosa. Salmonella typhi, Staphylococcus aureus. Streptococcus pneumoniae, Vibrio cholerae и многих других) практически к любому из применяемых препаратов [Walsh С. Molecular mechanisms that confer antibacterial drug resistance. // Nature. - 2000. - Vol. 406. - P.775-781].
По-видимому, принципиально новым классом природных антибиотиков, которые будут введены в клиническую практику, являются так называемые антимикробные пептиды [Finlay В.В., Hancock R.E.W. Can innate immunity be enhanced to treat microbial infections? // Nat. Rev. Microbiol. - 2004. - Vol.2. - P.497-504]. Несмотря на существование более сильных антибиотиков, действующих при меньших концентрациях, антимикробные пептиды обладают рядом преимуществ. Способность быстро убивать клетки-мишени, широкий спектр действия, активность в отношении штаммов, резистентных к другим антибиотикам, а также относительная трудность в селекции устойчивых мутантов in vitro, позволяют рассматривать эти вещества в качестве основы для создания эффективных лекарств, особенно на фоне снижения потенциала обычных антибиотиков [Hancock R.E.W., Lehrer R. Cationic peptides: a new source of antibiotics. // Trends Biotechnol. - 1998. - Vol.16. - P.82-88].
Известно несколько сотен антимикробных пептидов [Brahmachary M. et al. ANTIMIC: a database of antimicrobial sequences. // Nucleic Acids Res. - 2004. - Vol.32. - P.D586-D589]. Для большинства антимикробных пептидов мишенью действия, по-видимому, являются мембраны клеток патогенных организмов, а механизмом действия - нарушение нормальной проницаемости этих мембран. Для подавляющего большинства антимикробных пептидов характерны следующие структурные и функциональные особенности: общий положительный заряд молекулы и склонность к формированию амфипатических структур, что, как полагают, является основой их взаимодействия с мембранами, а также способность к ингибированию роста целого ряда микроорганизмов в концентрациях порядка 1-10 мкМ [Brogden K.A. Antimicrobial peptides: pore formers or metabolic inhibitors in bacteria? // Nat. Rev. Microbiol. - 2005. - Vol.3. - P.238-250].
Особое место занимают антимикробные пептиды, не содержащие в своем составе остатков цистеина, поскольку такая структурная особенность значительно облегчает их производство химическим или биотехнологическим путем и снижает себестоимость. Много внимания уделяется линейным пептидам, склонных к организации в амфипатическую α-спираль при контакте с мембранами, обсуждаются подходы к оптимизации их свойств с целью повышения терапевтического потенциала [Tossi A., Sandri L., Giangaspero A. Amphipathic, α-helical antimicrobial peptides. // Biopolymers. - 2000. - Vol.55. - P.4-30].
Наиболее близким к заявляемым пептидам по структуре и антимикробным свойствам является пептид магайнин 2 из кожи лягушки Xenopus laevis [Zasloff M. Magainins, a class of antimicrobial peptides from Xenopus skin: isolation, characterization of two active forms, and partial cDNA sequence of a precursor. // Proc. Natl. Acad. Sci. U.S.A. - 1987. - Vol.84. - P.5449-5453].
Этот линейный пептид, приобретающий α-спиральную конформацию при контакте с мембранами, состоит из 23 аминокислотных остатков, полностью ингибирует рост ряда бактерий в концентрациях 2-40 мкМ и не проявляет гемолитической активности при 60 мкМ.
Изобретение решает задачу расширения ассортимента антимикробных пептидов.
Поставленная задача решается за счет структуры пептида латарцина, имеющего следующую аминокислотную последовательность:
H2N-Gly1-Phe2-Phe3-Gly4-Lys5-Met6-Lys7-Glu8-Tyr9-Phe10-Lys11-Lysl2-X13-Glyl4-Alal5-Serl6-Phe17-Lys18-Arg19-Arg20-Phe21-Ala22-Asn23-Leu24-Lys25-Lys26-Arg27-Leu27-NH2,
где Х является остатком фенилаланина Phe13 (латарцин-5, LtAMP-5) или триптофана Trp13 (латарцин-5а, LtAMP-5a).
Заявляемые пептиды проявляют антимикробную активность в отношении ряда грамположительных (Arthrobacter globiformis, Bacillus subtilis, Micrococcus luteus, Rhodococcus equi, Staphylococcus aureus) и грамотрицательных (Escherichia coli, Pseudomonas aeruginosa, Pseudomonas fluorescens) бактерий. Для полного ингибирования роста перечисленных организмов in vitro необходимы микромолярные концентрации пептидов. При этом латарцин-5 характеризуются выраженным токсическим эффектом (в концентрациях 10-20 мкМ) по отношению к клеткам промиелоцитарной лейкемии человека и низкой цитотоксичностью в отношении нормальных лейкоцитов (эффекты отсутствуют при концентрации пептида 40 мкМ). Техническим результатом предлагаемого изобретения является высокая антимикробная активность заявляемых пептидов.
Заявляемые латарцины состоят из 28 аминокислотных остатков, т.е. являются сравнительно небольшими молекулами, что упрощает их получение химическим синтезом. Кроме того, пептиды являются линейными и не содержат остатков цистеина, что также упрощает их получение химическим синтезом или биотехнологически, поскольку исключает риск образования неактивных форм за счет некорректного замыкания дисульфидов.
Пептид латарцин-5 (LtAMP-5) получают из природного источника - яда среднеазиатского паука Lachesana tarabaevi Zonstein et Ovtchinnikov, 1999, который относится к семейству Zodariidae, отряду Araneae, классу Arachnida, типу Arthropoda.
Пептид латарцин-5а (LtAMP-5a) получают химическим синтезом, он отличается от латарцина-5 на один аминокислотный остаток в положении 13 (триптофан вместо фенилаланина) и демонстрирует сходные биологические свойства.
Заявляемые пептиды представляют собой новые соединения и не являются близкими гомологами других белков или пептидов.
Изобретение иллюстрируют примеры.
Пример 1.
Выделение антимикробного пептида латарцина-5 (LtAMP-5) из яда паука Lachesana tarabaevi.
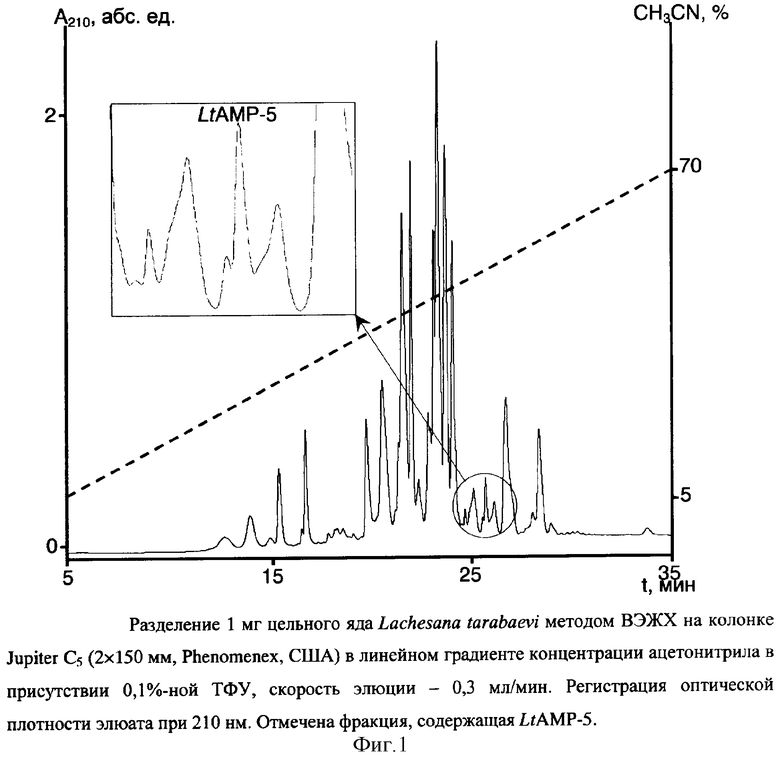
Цельный яд паука Lachesana tarabaevi подвергают разделению по методу ВЭЖХ на колонке с обращенной фазой Jupiter C5 (2×150 мм, размер пор 300 Å, диаметр частиц 5 мкм, Phenomenex, США). Фракционирование проводят в линейном градиенте концентрации ацетонитрила от 0 до 70% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 35 минут со скоростью элюции 0,3 мл/мин. Детекцию осуществляют по оптическому поглощению при 210 нм. Полученные фракции тестируют на способность ингибировать рост Escherichia coli DH5α. Пептид LtAMP-5 элюируется со временем удерживания 25,5 минут (фиг.1).
Содержание примесей в очищенной фракции, соответствующей LtAMP-5, составляет 5%, что подтверждается разделением по методу ВЭЖХ на аналитической колонке Luna Cig (1×150 мм, размер пор 100 Å, диаметр частиц 3 мкм, Phenomenex, США) в линейном градиенте концентрации ацетонитрила от 20 до 60% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 60 минут со скоростью элюции 50 мкл/мин, детекцию осуществляют по оптическому поглощению при 210 им.
Пример 2.
Установление аминокислотной последовательности латарцина-5.
Определение N-концевой аминокислотной последовательности очищенного пептида LtAMP-5 проводят методом ступенчатой деградации по Эдману на автоматическом секвенаторе Precise 492 (Applied Biosystems, США). В результате устанавливают полную аминокислотную последовательность латарцина-5, состоящую из 28 аминокислотных остатков:
H2N-Gly-Phe-Phe-Gly-Lys-Met-Lys-Glu-Tyr-Phe-Lys-Lys-Phe-Gly-Ala-Ser-Phe-Lys-Arg-Arg-Phe-Ala-Asn-Leu-Lys-Lys-Arg-Leu
Пример 3.
Определение относительной молекулярной массы латарцинов.
Индивидуальность очищенных веществ подтверждают масс-спектрометрическим анализом. Масс-спектры получают на MALDI-времяпролетном масс-спектрометре ultraflex II TOF/TOF (Bruker Daltonik, Германия), с идентификацией положительных ионов в рефлекторном режиме. В качестве матрицы используют α-циано-4-гидроксикоричную кислоту (10 мг/мл) в 50%-ном (v/v) ацетонитриле, содержащем 0,1%-ную (v/v) трифторуксусную кислоту. Для калибровки прибора используют стандартную смесь пептидов с диапазоном молекулярных масс 700-3500 Да (Sigma, США).
Измеренная моноизотопная молекулярная масса природного пептида LtAMP-5 составляет 3428,1 Да. Расчетная моноизотопная молекулярная масса пептида составляет 3428,9 Да, т.е. отличается от измеренной на 0,8 Да. С учетом точности метода определения масс, выносится заключение о наличии особой посттрансляционной модификации у данного пептида - С-концевого амидирования. Анализ аминокислотной последовательности латарцина-5 (распределение гидрофобных и гидрофильных остатков, общий заряд молекулы) позволяет предположить склонность этого пептида к образованию амфипатической α-спирали при взаимодействии с мембранами.
Пример 4.
Химический синтез латарцинов.
Пептид LtAMP-5 синтезируют твердофазньм методом путем наращивания цепи с С-концевого остатка на 4-(2',4'-диметоксифенил-Ртос-аминометил)-фенокси (Ринк-амидной) смоле (PepChem, Германия) с нагрузкой 0,51 ммоль/г, для временной защиты α-NH2-групп используют флуоренилметоксикарбонильную группу (Fmoc) [Chan W.C., White P.D. Fmoc Solid Phase Peptide Synthesis. - 2000. - University Press, Oxford]. Защиту боковых групп аминокислотных остатков выбирают с расчетом на конечное деблокирование трифторуксусной кислотой: для защиты боковых групп остатков Ser и Туг используют третбутильную группу, для Glu - O-третбутильную группу, для Lys - третбутилоксикарбонильную группу, для Arg - 2,2,4,6,7-пентаметилдегидробензофуран-5-сульфонильную группу, для Asn - тритильную группу.
Аминокислотные остатки присоединяют к пептидил-полимеру с образованием гидроксибензотриазолового эфира в присутствии 1,3-диизопропилкарбодиимида, для активации 1 экв. аминокислоты используют 1,2 экв.N-гидроксибензотриазола и 1 экв 1,3-диизопропилкарбодиимида. Для наращивания полипептидной цепи в ходе каждого синтетического цикла проводят конденсацию пептидил-полимера с 5 экв активированной Fmoc-аминокислоты при 37°С, содержание непрореагировавших аминогрупп контролируют визуально по окрашиванию рН-зависимого индикатора бромфенолового синего.
Отщепление продукта от полимера с одновременным деблокированием боковых групп проводят смесью трифторуксусной кислоты, воды и этандитиола (95:2,5:2,5, v/v/v) из расчета 1 мл смеси на 50 мг смолы. Суспензию перемешивают в течение 2 часов, затем раствор пептида в трифторуксусной кислоте отфильтровывают от полимера. Продукт высаживают 10-кратным избытком (по объему) охлажденного диэтилового эфира, отфильтровывают, дважды промывают эфиром, после чего высушивают лиофильно. Восстановление окисленных остатков метионина проводят обработкой раствора пептида (2 мг/мл) в 10%-ной (v/v) уксусной кислоте метилмеркаптоацетамидом (10 экв. на 1 экв. остатков метионина) в течение 36 часов при 37°С.
Синтезированный пептид подвергают очистке по методу ВЭЖХ на колонке с обращенной фазой Luna C18 (10×250 мм, размер пор 100 Å, диаметр частиц 10 мкм, Phenomenex, США). Фракционирование проводят в линейном градиенте концентрации ацетонитрила от 0 до 60% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 60 минут со скоростью элюции 2 мл/мин. Детекцию осуществляют по оптическому поглощению при 210 нм.
Содержание примесей в синтетическом препарате LtAMP-5 составляет 1%, что подтверждается разделением по методу ВЭЖХ на аналитической колонке Luna Cig (1×150 мм, размер пор 100 Å, диаметр частиц 3 мкм, Phenomenex, США) в линейном градиенте концентрации ацетонитрила от 20 до 60% (v/v) в 0,1%-ной (v/v) трифторуксусной кислоте в течение 60 минут со скоростью элюции 50 мкл/мин, детекцию осуществляют по оптическому поглощению при 210 нм.
Идентичность синтезированного LtAMP-5 природному доказывают при помощи масс-спектрометрического анализа, сравнением хроматографических подвижностей при разделении на аналитической колонке Luna C18 (1×150 мм, Phenomenex, США), а также сравнением биологических свойств.
Пептид LtAMP-5a синтезируют аналогичным способом, для защиты боковой цепи Trp используют третбутилоксикарбонильную группу.
Пример 5.
Получение спектров кругового дихроизма пептидов LtAMP-5 и LtAMP-5a.
Спектры КД (фиг.2) измеряют с помощью спектрополяриметра J-810 (Jasco, Япония) в кювете с длиной оптического пути 0,01 см в диапазоне длин волн 190-250 нм с шагом 1 нм. Исследуется конформация пептидов LtAMP-5 и LtAMP-5a в воде (рН˜5), в смеси воды с трифторэтанолом в объемном соотношении 1:1, в мицеллах додецилсульфата натрия (ДСН) и в суспензии липосом, формируемых диолеилфосфатидилхолином (ДОФХ) или диолеоилфосфатидилглицеролом (ДОФГ), диаметром 100 нм. В суспензии липосом присутствует 50 мМ натрий-фосфатный буфер (рН 7,5) и 110 мМ NaCl.
Моноламеллярные ДОФХ и ДОФГ липосомы готовят методом экструзии. К сухому липиду (10 мг) добавляют 50 мМ натрий-фосфатный буфер (рН 7,5, 1 мл) и выдерживают взвесь при перемешивании в течение 60 мин при комнатной температуре. Затем проводят 10 циклов замораживания-оттаивания взвеси с использованием холодильника на основе жидкого азота. Полученную суспензию липида продавливают с помощью экструдера (Avanti, США) 20 раз через поликарбонатную мембрану с размером пор 100 нм при комнатной температуре. В результате получают суспензию больших (диаметр 100 нм) моноламеллярных липосом в концентрации по липиду 10 мг/мл.
Концентрация пептидов в воде составляет 0,1 мМ, в растворе вода-трифторэтанол - 0,05 мМ, в мицеллах ДСН - 0,084 мМ, в суспензии липосом - 0,05 мМ. Молярное соотношение детергент/липид составляет 150:1, липид/пептид - 100:1. Спектры КД приведены (фиг.2) в единицах молярной эллиптичности [Θ], рассчитанной по формуле: [Θ]=115×Θэкспер/(10×С×l), где Θэкспер - наблюдаемая эллиптичность в миллиградусах, С - концентрация пептида в мг/мл, l - длина оптического пути (толщина кюветы) в см, 115 - средний молекулярный вес одного аминокислотного остатка.
Оценку содержания элементов вторичной структуры (табл.1) проводят по программе CONTINLL [Provencher, S.W., Glockner, J. Estimation of globular protein secondary structure from circular dichroism. //Biochemistry. - 1982. - Vol.20. - P.33-37] для глобулярных белков.
Анализ полученных спектров показывает, что (1) в водной среде латарцины LtAMP-5 и LtAMP-5a не склонны к образованию упорядоченной структуры, (2) в окружении, имитирующем мембраны (трифторэтанол), латарцины принимают а-спиральную конформацию, (3) LtAMP-5 и LtAMP-5a взаимодействуют с мембранами, по крайней мере, состоящими из диолеилфосфатидилхолина или диолеоилфосфатидилглицерола, (4) при взаимодействии с мембранами пептиды образуют упорядоченную структуру типа α-спирали, (5) взаимодействие с мембранами разного липидного состава различно, что в первом приближении объясняет селективность действия латарцинов в отношении бактерий (ДОФХ липосомы имитируют мембраны клеток эукариот, ДОФГ липосомы - цитоплазматические мембраны бактериальных клеток).
Пример 6.
Антимикробные свойства латарцинов LtAMP-5 и LtAMP-5a.
Для определения антимикробной активности фракций, полученных в ходе хроматографического разделения компонентов яда паука Lachesana tarabaevi, очищенного латарцина-5, а также синтетических LtAMP-5 и LtAMP-5a используют следующие штаммы микроорганизмов: Arthrobacter globiformis Ac-1112, Bacillus subtilis B-501, Escherichia coli C600, Escherichia coli DH5α, Escherichia coli MH1, Micrococcus luteus Ac-2230, Pseudomonas aeruginosa PA01, Pseudomonas fluorescens B-894, Rhodococcus equi Ac-953, Staphylococcus aureus 209-P, антимикробная активность оценивается по методу ингибирования роста культуры в жидкой среде. Определение минимальных концентраций пептидов, необходимых для полного ингибирования роста микроорганизмов (минимальных ингибирующих концентраций), проводят методом серийных разведении.
Бактерии культивируют в жидкой среде Muller-Hinton (0,4% сухой говяжий экстракт, 0,15% крахмал, 1,75% гидролизат казеина, рН 7) при 37°С и перемешивании со скоростью 150 об/мин. Полученные культуры разбавляют в 200 раз, используя те же среды, и выращивают в тех же условиях в течение 4 ч до достижения экспоненциальной фазы роста (оптическая плотность культуры при 620 нм OD620˜0,3-0,5), после чего снова разбавляют, используя исходные среды, до концентрации клеток порядка 105 колоний образующих единиц (КОЕ) в 1 мл. Культуры помещают в стерильные 96-луночные планшеты, по 90 мкл в лунку, куда затем добавляют по 10 мкл растворов тестируемых веществ различных концентраций, получаемых серийными разведениями. Отрицательным контролем служит культура клеток с добавлением 10 мкл чистой воды, положительным - чистая среда для культивирования. Планшеты инкубируют в условиях, описанных выше, в течение 20 ч, после чего измеряют OD595, минимальные ингибирующие концентрации определяют как наименьшие концентрации веществ, полностью подавляющие рост микроорганизмов. Опыт проводят в трех независимых повторах.
Результаты определения минимальных ингибирующих концентраций для латарцинов LtAMP-5 и LtAMP-5a. представлены в таблице 2. Биологическая активность синтетического латарцина-5 идентична активности природного пептида.
Пример 7.
Тестирование латарцинов LtAMP-5 и LtAMP-5a на гемолитическую активность. Гемолитическую активность пептидов определяют с использованием эритроцитов человека (группа В, Rh+). 100 мкл капиллярной крови (из digitus anultaris) собирают в пробирку, содержащую 0,9 мл среды RPMI-1640 (без глутамина) и гепарин (10 ед/мл). Клетки осаждают центрифугированием в течение 5 мин при 180-220 g, ресуспендируют в полной среде RPMI-1640 (без фенолового красного, без глутамина) до концентрации 1×107 кл/мл. Смешивают 15 мкл раствора пептида требуемой концентрации с 135 мкл полученной суспензии, в качестве отрицательного контроля к суспензии клеток добавляют 15 мкл воды (milliQ). Инкубируют при 37°С и перемешивании со скоростью 120 об/мин в течение 3 ч, после чего клетки осаждают центрифугированием в течение 3-5 мин при 2700 g. 100 мкл супернатанта отбирают в стерильные 96-луночные планшеты, выход гемоглобина из эритроцитов оценивают по оптической плотности при 414 нм. Гемолитическая активность образцов выражается в % от максимально возможного гемолиза, максимально возможный лизис эритроцитов (положительный контроль) получают при ресуспендировании клеток в чистой воде вместо среды RPMI также до концентрации 1×107 кл/мл. Эксперимент проводят в двух независимых повторах.
На основании результатов, полученных для серии последовательных разведении латарцинов (фиг.3), определяют концентрацию, при которой гемолитическая активность составляет 50%: 12,3 мкМ для LtAMP-5,9,8 мкМ для LtAMP-5a.
Пример 8.
Тестирование латарцина LtAMP-5 на цитотоксичность по отношению к лейкоцитам и клеткам острой промиелоцитарной лейкемии человека.
Оценку цитотоксических свойств пептида LtAMP-5 для лейкоцитов человека проводят на фракции крови здорового донора (группа В, Rh+), обогащенной лейкоцитами, которую получают отстаиванием гепаринизированной (10 ед./мл) крови в течение 2 ч. Отбирают фракцию выше эритроцитарного столба, соотношение лейкоцитов и эритроцитов в которой 1:10, клетки помещают в среду RPMI-1640 с добавлением 2 мМ L-глутамина и 8% эмбриональной бычьей сыворотки (ЭБС), рассаживают в 96-луночные плоскодонные культуральные планшеты (0,3×106 клеток/мл, 150 мкл среды RPMI-1640, содержащей 2 мМ L-Gin и 8% ЭБС, на лунку).
Клетки острой промиелоцитарной лейкемии человека HL-60 культивируют в среде RPMI-1640 с добавлением 2 мМ L-глутамина и 8% ЭБС при 37°С, 100%-ной влажности в атмосфере с 5%-ным содержанием CO2.
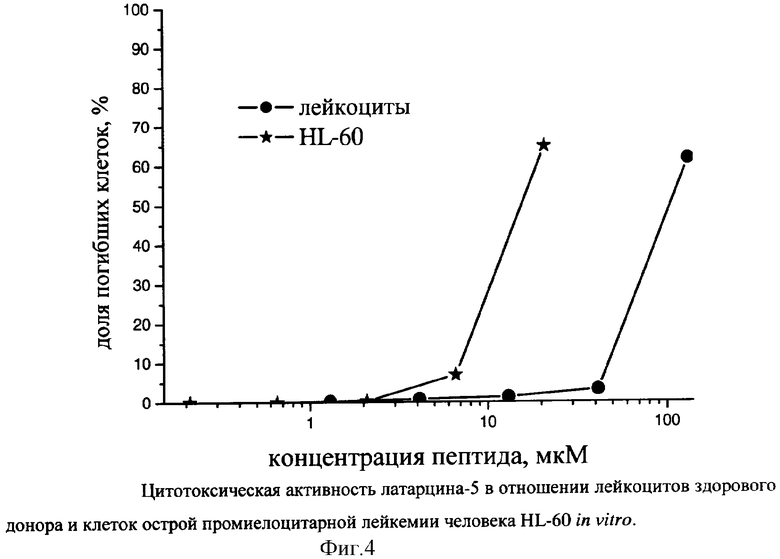
В лунки вносят исследуемые пептиды в нужной концентрации, в качестве отрицательного контроля в лунки добавляют чистую воду. Клетки (HL-60 и лейкоциты) инкубируют с различными концентрациями пептидов в течение 3 ч при 37°С, затем в лунки вносят флуоресцентные красители Hoechst33342 (10 мкМ, окрашивает ядра всех клеток) и пропидиум иодид (10 мкМ, окрашивает ядра мертвых клеток) и через 10 мин регистрируют флуоресцентные изображения клеток с помощью инвертированного флуоресцентного микроскопа Axiovert 200M (Zeiss, Германия) с цифровой камерой AxioCam MRc (Zeiss, Германия) в области флуоресценции Hoechst33342 (фильтры на возбуждение - ВР 365/12, на эмиссию - LP 397) и в области флуоресценции пропидиум иодида (фильтры на возбуждение - ВР 510-560, на эмиссию - LP 590). По этим изображениям для каждой концентрации пептида подсчитывают общее число клеток (от 500 до 1000 клеток на одно измерение) и число мертвых клеток среди них, а затем рассчитывают концентрацию пептида, вызывающую гибель 50% клеток, ИК50. Результаты (фиг.4) усредняют по трем независимым экспериментам.
В результате получают, что латарцин LtAMP-5 обладает выраженной цитотоксичностью в отношении клеток промиелоцитарной лейкемии человека, ИК50=16,7 мкМ. Вместе с тем пептид слабо токсичен по отношению к нормальным лейкоцитам человека, ИК50=114 мкМ.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДЫ ЛАТАРЦИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2005 |
|
RU2302466C1 |
| ПЕПТИДЫ ЛАТАРЦИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2005 |
|
RU2302467C1 |
| ПЕПТИДЫ ЛАТАРЦИНЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2006 |
|
RU2306148C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИМИКРОБНЫХ ПЕПТИДОВ С ПОНИЖЕННОЙ ГЕМОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 2006 |
|
RU2316336C1 |
| ПЕПТИДЫ, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 2005 |
|
RU2302425C2 |
| ПЛАЗМИДНЫЙ ВЕКТОР pET-His8-TrxL-Acip1, ШТАММ БАКТЕРИИ Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1 ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АЦИПЕНСИНА-1 И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2015 |
|
RU2580031C2 |
| Плазмидный вектор pET-mChBac75Na, штамм бактерии Eschrichia coli BL21(DE3/ pET-mChBac75Na для экспрессии антимикробного пептида минибактенецина ChBac7.5 Nα и способ получения указанного пептида | 2016 |
|
RU2618850C2 |
| Пептид, проявляющий антибактериальные и противоопухолевые свойства | 2019 |
|
RU2702661C1 |
| Катионный пептид, проявляющий антибактериальные свойства | 2021 |
|
RU2778856C1 |
| ПРОИЗВОДНЫЕ ГЕМИНА, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОСТЬЮ, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМКОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2009 |
|
RU2415868C1 |


Изобретение относится к биологически активным пептидам, обладающим антимикробным действием, которые могут найти применение в биотехнологии и медицине. Пептид латарцин имеет аминокислотную последовательность: H2N-Gly1-Phe2-Phe3-Gly4-Lys5-Met6-Lys7-Glu8-Tyr9-Phe10-Lys11-Lys12-X13-Gly14-Ala15-Ser16-Phe17-Lys18-Arg19-Arg20-Phe21-Ala22-Asn23-Leu24-Lys25-Lys26-Arg27-Leu28-NH2, где Х является остатком фенилаланина Phe13 или триптофана Trp13, обладает широким спектром антимикробной активности, а также выраженным токсическим эффектом по отношению к клеткам промиелоцитарной лейкемии человека. Использование изобретения позволит расширить ассортимент природных пептидных антибиотиков, не содержащих остатков цистеина и обладающих высокой антимикробной активностью. 4 ил., 2 табл.
Пептид латарцин, проявляющий антимикробную активность, имеющий следующую аминокислотную последовательность:
H2N-Gly1-Phe2-Phe3-Gly4-Lys5-Met6-Lys7-Glu8-Tyr9-Phe10-Lys11-Lys12-X13-Gly14-Ala15-Ser16-Phe17-Lys18-Arg19-Arg20-Phe21-Ala22-Asn23-Leu24-Lys25-Lys26-Arg27-Leu28-NH2, где X является остатком фенилаланина Phe13 или триптофана Trp13.
| ПЕПТИДЫ АРЕНИЦИНЫ, ВЫДЕЛЕННЫЕ ИЗ МОРСКОГО КОЛЬЧАТОГО ЧЕРВЯ ArenicolA marina, ОБЛАДАЮЩИЕ АНТИМИКРОБНЫМ ДЕЙСТВИЕМ | 2004 |
|
RU2261866C1 |
| МАССОВЫЙ РАСХОДОМЕР | 0 |
|
SU231144A1 |
| US 5981469 А, 09.11.1999. | |||
Авторы
Даты
2008-03-20—Публикация
2006-09-06—Подача