Изобретение относится к гидрометаллургии цветных металлов, в частности к способам гидрометаллургической переработки руд и полупродуктов металлургического производства, содержащих минералы, в которые никель входит в закисной форме. К рудным материалам такого типа относятся, например, окисленные никелевые руды, а в качестве полупродукта металлургического производства, характерного для предприятий России, следует выделить промышленную закись никеля - продукт обжига никелевого концентрата флотации файнштейна. Наряду с этими типичными материалами переработке по предлагаемому способу могут подвергаться и другие материалы, в которых никель представлен, например, бунзенитом или треворитом.
Глубокий перевод никеля в раствор из окисленных никелевых руд обычно удается осуществить только при температурах 230-270°С, что соответствует практике работы ряда действующих предприятий, этот же прием заложен в основу большинства современных проектов. Известен способ атмосферного выщелачивания окисленной никелевой руды [Патент US №5571308 С22В 26/22] растворами минеральных кислот, основными недостатками которого являются низкая степень перевода никеля в раствор и повышенный расход кислоты, связанный с необходимостью поддержания высокой кислотности конечного раствора, причем глубина извлечения никеля существенным образом колеблется в зависимости от химического и минералогического состава исходной руды. Следует отметить, что по этому способу предпочтительным в плане извлечения цветных металлов в раствор является использование соляной кислоты. Кроме того, этот способ не применим к более упорным, хорошо кристаллизованным минералам, характерным для полупродуктов металлургического производства. Так, бунзенит и треворит в атмосферных условиях очень медленно и неполно вскрываются при выщелачивании водными растворами соляной кислоты и не вскрываются вообще при использовании серной кислоты [Д.П.Богацкий. Диаграмма состояния системы Ni-О2 и физико-химическая природа твердых фаз в этой системе. Журнал общей химии, том XXI, выпуск 1, 1951] вне зависимости от ее расхода, их выщелачивание требует повышенных температур. Для безавтоклавного выщелачивания таких материалов необходимо их предварительное термическое восстановления до металла, что требует высоких энергетических затрат и приводит к повышению механических потерь ценных компонентов. На предприятиях ОАО «ГМК «Норильский никель» закись никеля, полученную в процессе обжига никелевого концентрата флотации файнштейна, подвергают анодной плавке с последующим рафинированием металлических анодов [Никель: В 3 т. Т.3. Сульфидные медно-никелевые руды. Руды и месторождения. Пирометаллургия. Гидрометаллургия. Рафинирование никеля. Производство и потребление никеля в мире. Резник И.Д., Ермаков Г.П., Шнеерсон Я.М. М. ООО «Наука и технология». 2003].
На комбинате «Североникель» был разработан способ переработки закиси никеля путем термического восстановления и выщелачивания полученного металлизированного материала раствором серной кислоты в присутствии катализатора с получением раствора и твердого остатка [Патент RU 2140461 С22В 3/08, 3/00]. По этому способу в качестве канализатора при выщелачивании используют медьсодержащий материал, который предварительно вводят с избытком в раствор серной кислоты до полного ее срабатывания. Полученным раствором сульфата меди обрабатывают металлизированный материал, например восстановленную закись никеля. Процесс ведут при температуре 85±5°С и рН 2,0-4,5 в течение 1,5-2 часов. Наработку раствора медного купороса производят из нерастворимого остатка выщелачивания восстановленной закиси никеля, представляющего собой цементную медь, путем кислотного его растворения при температуре 80±5°С в течение не менее 1,5 часов.
Недостатком способа является необходимость проведения операций предварительного восстановительного обжига никелевого концентрата и наработки раствора медного купороса, и недостаточно высокое извлечение никеля.
Наиболее близким к предлагаемому техническим решением, пригодным для перевода никеля в раствор из материалов, содержащих никель в закисной форме, является способ выщелачивания окисленных никелевых руд растворами серной кислоты при температурах ниже точки кипения пульпы при атмосферном давлении [Патент US 6261527 С22В 1/00, 3/00]. По этому способу в начале выщелачиванию подвергается лимонитовая фракция латеритовой руды с высоким содержанием железа (не менее 25%) и низким содержанием магния (0,5-6%). Содержание твердого в исходной пульпе составляет 5-35%. Расход серной кислоты на выщелачивание высок и составляет более 1 кг на 1 кг исходной руды. Поддержание потенциала на уровне менее 1000 мВ за счет подачи в пульпу восстановителя, например диоксида серы, обеспечивает высокую степень перевода кобальта в раствор. Продолжительность этого периода процесса составляет ˜3 часа. На второй стадии процесса в пульпу добавляется соль щелочного металла для формирования ярозита. В качестве нейтрализатора выделяющейся свободной кислоты используется сапролитовая руда. Продолжительность второй стадии составляет 15-18 часов. Суммарное извлечение никеля и кобальта в раствор из лимонита и сапролита составляет, соответственно, 80-83 и 89-90%. Общий расход кислоты - 650-680 кг/т руды (лимонит + сапролит) или 42-52 кг на кг никеля, перешедшего в раствор.
К недостаткам этого способа в первую очередь следует отнести низкую степень перевода никеля в раствор, большую общую продолжительность процесса и повышенный расход кислоты, связанный с необходимостью поддержания высокой кислотности конечного раствора.
Задача изобретения - разработка способа прямого атмосферного выщелачивания никеля из различных, в том числе и упорных, материалов, содержащих его в закисной форме. Технический результат изобретения заключается в повышении извлечения никеля в раствор при упрощении способа.
Заявленный технический результат достигается за счет того, что в способе переработки материалов, содержащих никель в закисной форме, путем выщелачивания их растворами минеральных кислот, согласно изобретению выщелачивание закиси никеля в растворах минеральных кислот ведут при атмосферном давлении при потенциале пульпы не ниже 1,2 В относительно водородного электрода.
В литературе имеются противоречивые данные о растворимости закиси никеля в растворах минеральных кислот, что, по-видимому, связано с различием в структуре и большим разнообразием оксидных форм никеля. Так, в работе [Д.П.Богацкий. Диаграмма состояния системы Ni-O2 и физико-химическая природа твердых фаз в этой системе. / Журнал общей химии, том XXI, выпуск 1, 1951] показано, что в чистом виде NiO может быть получен только при температурах выше 1100°С, в более мягких условиях образуются твердые растворы NiO-Ni2O3. В любом случае бунзенит, полученный при высокой температуре, хорошо кристаллизован и является очень упорным к воздействию кислых растворов материалом. Выщелачивание NiO (бунзенита) растворами серной кислоты (в зависимости от кристалличности минералов) либо не удается осуществить в атмосферных условиях, либо реализация этого процесса крайне затруднена.
Как показали результаты предшествующих поисковых исследований, прокалка NiO при различных температурах как в окислительной (кислород), так и в нейтральной атмосферах, по данным рентгенографического анализа не влияет на его структуру и не позволяет при последующем атмосферном выщелачивании добиться перевода даже небольшой части никеля в раствор. В то же время, пробы закиси никеля, полученные низкотемпературным (300-500°С) обжигом его карбоната, характеризуются мелкодисперсной высокодефектной структурой и легко растворяются при атмосферных условиях, как в растворах серной кислоты, так и медного купороса.
С точки зрения термодинамики реакция взаимодействия закиси никеля с серной кислотой:
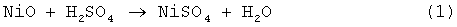
осуществима и не требует жестких параметров процесса. Сложность ее реализации связана с кинетическими затруднениями, обусловленными прочной кристаллической структурой материала.
Легкость растворения низкотемпературных образцов может наряду с дефектностью структуры объясняться присутствием в пробах трехвалентного никеля (Ni2О3). Как было сказано выше, по данным [Д.П.Богацкий. Диаграмма состояния системы Ni-O2 и физико-химическая природа твердых фаз в этой системе. / Журнал общей химии, том XXI, выпуск 1, 1951], при температурах в диапазоне 300-1100°С формируются твердые растворы закиси-окиси никеля, причем содержание в них Ni2O3 снижается с повышением температуры. В той же статье на основании лабораторных экспериментов показано, что в отличие от закиси, окись никеля растворяется в сернокислых растворах в атмосферных условиях.
На основании вышесказанного можно предположить, что в какой-то мере различие в применимости атмосферного выщелачивания к разным пробам окисленных никелевых руд связано как с различной структурированностью никелевых минералов, так и с тем, что часть никеля может находится в трехвалентной форме, а, кроме того, в ряде латеритовых руд содержится относительно большое количество MnO2 и других минералов, являющихся сильными окислителями.
Поскольку термодинамические характеристики не зависят от пути протекания реакции, можно было бы представить процесс (1) как сумму реакций окисления и растворения, например:


с регенерацией необходимого для реакции (2) сильного окислителя (атомарного кислорода). Таким образом, можно было бы реализовать процесс растворения закиси никеля в сернокислых растворах при низких параметрах.
Для зажигания процесса (начала протекания реакции (2)) необходимо создать высокий потенциал (согласно диаграмме Пурбэ при рН˜1 Eh 1200 мВ). В дальнейшем высокий окислительный потенциал системы может поддерживаться благодаря присутствию в системе атомарного кислорода, выделяющегося по реакции (3), т.е. можно ожидать, что расход реагента-возбудителя реакции будет меньше стехиометрического по реакции (2) и определится протеканием побочных процессов.
Таким образом, для зажигания процесса необходимо ввести в систему окислитель для обеспечения начального значения потенциала на указанном выше уровне. Кроме того, некоторое количество дополнительного окислителя может потребоваться для восполнения потерь атомарного кислорода за счет рекомбинации его в молекулярную форму.
Для создания исходного потенциала может использоваться любой достаточно сильный окислитель, как-то: озон, персульфаты щелочных металлов и т.д.
Предлагаемый способ представляется эффективным для рафинирования файнштейна (никелевого концентрата) в схемах с электроэкстракцией Ni в сернокислой среде.
Пример 1 (по аналогии с прототипом).
Пробу промышленной закиси никеля (огарок обжига никелевого концентрата флотации файнштейна) выщелачивали в растворе серной кислоты в течение 3 часов при температуре 90°С. Расход кислоты составлял 130% от стехиометрии по реакции (1) при исходной ее концентрации - 60 г/дм3. Процесс осуществляли в открытом реакторе, установка была снабжена мешалкой (четырехлопастная турбинка) со скоростью вращения вала 500 об/мин (Re=5,8·103) / Окислительно-восстановительный потенциал (ОВП) находился на уровне 0,7 В (относительно водородного электрода). Никель в раствор не переходил.
Пример 2 (по предлагаемому способу).
Процесс вели как в примере 1, но после нагрева пульпы до температуры 90°С вводили окислитель (K2S2O8) до достижения заданной величины ОВП. По ходу опыта окислитель подавался для поддержания ОВП (в случае его снижения) на заданном уровне. При подаче окислителя протекала реакция:
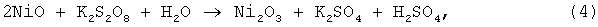
далее растворение окиси никеля протекало по реакции (3). Результаты опытов представлены в таблице.
Исходя из полученных результатов (табл.1) расход окислителя был многократно ниже, чем степень перехода никеля в раствор. То есть в основном процесс реализовывался по реакциям (2) и (3) без участия вводимого окислителя, а минимальная величина ОВП - 1,2 В, лучше 1,35-1,45 В.
Пример 3 (по предлагаемому способу).
Процесс вели как в примере 2, но в качестве окислителя использовали KMnO4. При подаче окислителя протекала реакция:
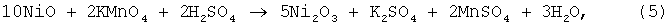
далее растворение окиси никеля протекало по реакции (3). Результаты опытов представлены в таблице 2.
Пример 4 (по предлагаемому способу).
Процесс вели как в примере 3, но в качестве растворителя использовали соляную кислоту, расход которой составлял 130% от стехиометрии по реакции:
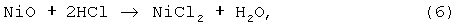
а в качестве окислителя наряду с KMnO4 использовали Cl2. При использовании KMNO4 окисление закиси никеля протекало по реакции:
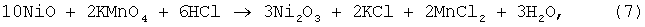
а в случае применения Cl2 по реакции:
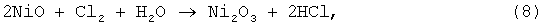
далее растворение окиси никеля протекало по реакции:
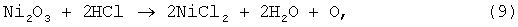
Результаты опытов представлены в таблице 3.
Таким образом, процесс можно вести при использовании любых окислителей, позволяющих поддерживать потенциал на уровне не менее 1,2 В по отношению к нормальному водородному электроду, а для растворения использовать любую минеральную кислоту.
Источники информации
1. Патент США №5571308, С22В 26/22.
2. Д.П.Богацкий. Диаграмма состояния системы Ni-O2 и физико-химическая природа твердых фаз в этой системе. // Журнал общей химии, том XXI, выпуск I, 1951 г.
3. Никель. В 3 т. Т 3. Сульфидные медно-никелевые руды. Руды и месторождения. Пирометаллургия. Гидрометаллургия. Рафинирование никеля. Производство и потребление никеля в мире. Резник И.Д., Ермаков Г.П., Шнеерсон Я.М. М. ООО "Наука и технология". 2003 - 608 стр. Библиогр.: 509 назв. Ил.175. Табл.98.
4. Патент РФ №2140461, С22В 3/08, 3/00.
5. Патент США №6261527, С22В 1/00, 3/00.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЕРЕРАБОТКИ ПЛАВЛЕНЫХ СУЛЬФИДНЫХ МЕДНО-НИКЕЛЕВЫХ МАТЕРИАЛОВ, СОДЕРЖАЩИХ КОБАЛЬТ, ЖЕЛЕЗО И МЕТАЛЛЫ ПЛАТИНОВОЙ ГРУППЫ | 2003 |
|
RU2252270C1 |
| СПОСОБ ПРОИЗВОДСТВА КОНЦЕНТРАТА ДРАГОЦЕННЫХ МЕТАЛЛОВ ИЗ СУЛЬФИДНОГО МЕДНО-НИКЕЛЕВОГО СЫРЬЯ | 2010 |
|
RU2444573C2 |
| СПОСОБ ПОЛУЧЕНИЯ НИКЕЛЯ ИЗ РУДНОГО СУЛЬФИДНОГО СЫРЬЯ | 2012 |
|
RU2492253C1 |
| СПОСОБ ПЕРЕРАБОТКИ СУЛЬФИДНЫХ РУД И ПИРРОТИНОВОГО КОНЦЕНТРАТА | 2008 |
|
RU2367691C1 |
| СПОСОБ ПЕРЕРАБОТКИ СУЛЬФИДНЫХ МЕДЬСОДЕРЖАЩИХ МАТЕРИАЛОВ | 2003 |
|
RU2244031C2 |
| СПОСОБ ПЕРЕРАБОТКИ ПРОДУКТОВ, СОДЕРЖАЩИХ СУЛЬФИДЫ МЕТАЛЛОВ | 2003 |
|
RU2245380C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭЛЕКТРОЛИТНОГО НИКЕЛЯ | 2005 |
|
RU2303086C2 |
| СПОСОБ ПОЛУЧЕНИЯ НИКЕЛЯ И КОНЦЕНТРАТА ДРАГОЦЕННЫХ МЕТАЛЛОВ ИЗ МЕДНО-НИКЕЛЕВОГО ФАЙНШТЕЙНА | 2009 |
|
RU2415956C1 |
| Способ переработки измельченного металлизированного медно-никелевого промпродукта, содержащего благородные металлы | 2022 |
|
RU2810029C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ГИДРАТА ЗАКИСИ НИКЕЛЯ ДЛЯ АККУМУЛЯТОРНОЙ ПРОМЫШЛЕННОСТИ | 2000 |
|
RU2178931C1 |
Изобретение относится к гидрометаллургии цветных металлов и может быть использовано при разработке технологий рафинирования файнштейнов и переработки других материалов, содержащих никель в закисной форме. Способ включает растворение этих продуктов в растворах минеральных кислот при потенциале не ниже 1,2 В по водородному электроду, для чего в исходную пульпу вводят окислитель, который при необходимости используют также по ходу процесса для поддержания требуемой величины ОВП. Способ позволяет выщелачивать упорные минеральные формы, содержащие закись никеля, в атмосферных условиях с получением растворов, содержащих менее 10 г/дм3 свободной кислоты при вариантной концентрации никеля. Техническим результатом является повышение извлечения никеля в раствор при упрощении способа. 1 з.п. ф-лы, 3 табл.
| US 6261527 А, 17.07.2001 | |||
| СПОСОБ ПЕРЕРАБОТКИ ОКИСЛЕННЫХ НИКЕЛЕВЫХ РУД | 0 |
|
SU276118A1 |
| Способ переработки медно-никелевых руд | 1982 |
|
SU1122727A1 |
| Ключ переменного тока | 1983 |
|
SU1228257A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2008-03-20—Публикация
2006-05-02—Подача