Настоящее изобретение относится к применению замещенных аминометилхроманов формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -ОСН2СН3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl, или
R1 и R2 вместе образуют радикал формулы

R3 представляет собой циклопентил, циклогексил, циклогептил или следующий радикал, обозначенный как о-бензолсульфимидил
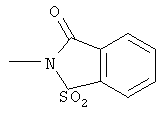
и
n представляет собой 1, 2, 3, 4 или 5,
и их оптических изомеров и фармацевтически приемлемых солей, в частности (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемых солей для приготовления лекарственного средства для лечения нежелательных действий противопаркинсонических лекарственных средств при экстрапирамидных нарушениях движений и/или для приготовления лекарственного средства для лечения экстрапирамидных симптомов (EPS), вызванных нейролептиками.
В заявках ЕР-А-0352613, ЕР-А-0540914 и ЕР-А-0749970 описаны производные аминометилхроманов, которые пригодны для профилактики, защиты центральной нервной системы и лечения образования инфарктов головного мозга (кровоизлияний в головной мозг), таких как удар и ишемия головного мозга.
Терапевтическая эффективность соединений, описанных в этом документе, неизвестна. Основа состава аминометилхроманов, которые применяются согласно изобретению, описаны в заявках ЕР-А-0352613, ЕР-А-0540914 и ЕР-А-0749970.
Предпочтительными соединениями согласно настоящему изобретению являются соединения общей формулы I

где
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -ОСН2СН3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl, или
R1 и R2 вместе образуют радикал формулы

R3 представляет собой о-бензолсульфимидил,
n=3 или 4;
и аминометилхроманы общей формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3 или -ОСН(СН3)2, или
R1 и R2 вместе образуют радикал формулы

n=1 и
R3 представляет собой циклогексил или циклогептил.
Более предпочтительное соединение (-)-(R)-2-(4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид известно из заявки ЕР-А-0352613, пример 92. Это соединение, на которое здесь ссылаются, описано в патенте в качестве антагониста рецептора 5-HT1A. Следовательно, описывается применение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его фармацевтически приемлемой соли для приготовления лекарственного средства для профилактики и регуляции последствий инфаркта головного мозга (кровоизлияния в головной мозг), такого как удар и ишемия головного мозга, для профилактики и регуляции церебральных расстройств, например мигрени, для лечения состояний тревоги, напряженных и депрессивных состояний, половых расстройств, вызванных центральной нервной системой, расстройств сна или поглощения пищи.
В настоящем изобретении соединения аминометилхроманов формулы I могут быть представлены в разнообразных стереоизомерных формах, например в форме их (+) или (-) энантиомеров или в виде смеси этих энантиомеров (рацемат). Для разделения рацематов на энантиомеры могут применяться соответствующие способы, известные в данной области техники.
Согласно настоящему изобретения также могут применяться физиологически приемлемые соли. Физиологически приемлемые соли замещенных 2-аминометилхроманов формулы I могут представлять собой соли соединений в соответствии с изобретением с подходящими органическими или неорганическими кислотами, в частности с минеральными кислотами, карбоновыми кислотами или сульфоновыми кислотами. Более предпочтительными являются соли, например, с соляной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, толуолсульфокислотой, бензолсульфоновой кислотой, нафталиндисульфоновой кислотой, уксусной кислотой, пропионовой кислотой, молочной кислотой, винной кислотой, лимонной кислотой, фумаровой кислотой, малеиновой кислотой или бензойной кислотой.
Объектом изобретения является обеспечение новых применений замещенных аминометилхроманов формулы I, в частности (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида и его физиологически приемлемых солей.
Было обнаружено, что замещенные аминометилхроманы формулы I, в частности (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или физиологически приемлемые соли, также обладают терапевтической активностью в отношении экстрапирамидных расстройств движений, таких как дискинетические, хореатические или дистонические синдромы, тремор, синдром Жилль де ла Туретта, крупноразмашистый гиперкинез конечностей, миоклонус, синдром усталых ног или гепатоцеребральная дистрофия, а также экстрапирамидных двигательных расстройств [синонимом являются экстрапирамидные симптомы (EPS)], вызванных нейролептиками.
Дополнительно было обнаружено, что замещенные аминометилхроманы формулы I, в частности (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или физиологически приемлемые соли, также обладают терапевтической активностью в отношении нежелательных действий противопаркинсонических лекарственных средств при экстрапирамидных расстройствах движений, в частности, в отношении допаминомиметических нежелательных действий противопаркинсонических лекарственных средств при идиопатической болезни Паркинсона или паркинсонических синдромах.
Было обнаружено, что (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или физиологически приемлемые соли обладают чрезвычайными способностями в обратном развитии каталепсии. Экстрапирамидные двигательные побочные действия, например у грызунов, вызываются способностью лекарственного средства индуцировать каталепсию. Каталепсией называется состояние, при котором животное длительное время находится в ненормальном (нефизиологическом 'неудобном') положении тела (например: М.Е.Stanley и S.D.Glick, Neuropharmacology, 1996; 15: 393-394; C.J.E.Niemegeers и Р.Janssen, Life Sci., 1979, 201-2216). Например, если заднюю лапу крысы расположить на приподнятом уровне, например на платформе, поднятой на 3 см выше уровня земли, то нормальная крыса немедленно отдергивает заднюю лапу с платформы до уровня земли. Каталептическая крыса остается в такой неестественной позе даже в течение нескольких минут.
Ранее были описаны благотворные воздействия на экстрапирамидную двигательную систему для других лекарственных средств с агонистическим 5-HT1A действием. Так, например, буспирон, который по природе является седативным средством, обнаруживает умеренные противодискинетические свойства у больных с прогрессируемой болезнью Паркинсона (В.Kleedorfer и др., J Neural Neurosurg Psychiatry, 1991, 54: 376-377; V.Bonifati и др., Clin Neuropharmacol, 1994, 17: 73-82). Основным механизмом такого действия, очевидно, является стимуляция при помощи рецепторов 5-HT1A рефлекторных путей передачи сигнала через черное тело и полосатое тело.
У крыс, значение ED50 при пероральном введении (то есть вычисленная доза, которая вызывает обратное развитие каталепсии на 50%) для моногидрохлорида (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида представляет собой 0,6 мг/кг, что неожиданно является в 30-100 раз более эффективным по сравнению с другими агонистами 5-HT1A, такими как ипзапирон (ED50 23 мг/кг), буспирон (ED50 30 мг/кг), гепирон (ED50 16 мг/кг) или тандозирон (ED50 60 мг/кг).
Таким образом, настоящее изобретение относится к применению замещенных аминометилхроманов формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -ОСН2СН3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl,
или R1 и R2 вместе образуют радикал формулы

R3 представляет собой циклопентил, циклогексил, циклогептил или следующий радикал, обозначенный как о-бензолсульфимидил:

и
n представляет собой 1, 2, 3, 4 или 5,
и их оптических изомеров и фармацевтически приемлемых солей для приготовления лекарственного средства для лечения экстрапирамидных нарушений движений.
Более предпочтительным соединением формулы I является (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль.
Таким образом, изобретение относится к применению (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или фармакологически приемлемой соли для приготовления лекарственного средства для лечения экстрапирамидных нарушений движений.
Предпочтительной солью (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Следовательно, изобретение относится к применению для приготовления лекарственного средства для лечения экстрапирамидных нарушений движений, где фармакологически приемлемая соль представляет собой моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил }-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Кроме того, изобретение относится к применению фармацевтической композиции, содержащей по крайней мере одно соединение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одну из его биосовместимых солей для лечения экстрапирамидных нарушений движений.
(-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или физиологически приемлемая соль является пригодной для лечения экстралирамидных нарушений движений, в частности для лечения дискинетических, хореатических или дистонических синдромов, экстрапирамидных двигательных побочный действий нейролептиков, тремора, синдрома Жилль де ла Туретта, крупноразмашистого гиперкинеза конечностей, миоклонуса, синдрома усталых ног или гепатоцеребральной дистрофии и/или пригодной для лечения нежелательных действий при идиопатической болезни Паркинсона или паркинсонических синдромах, включая нижеприведенные композиции лекарственных средств, и предпочтительно вводятся в дозах от 0,01 до 100 мг, предпочтительно в интервале около 0,1 и 10 мг. Композиция может вводиться в виде суточных доз. Индивидуальная доза для каждого пациента зависит от многих факторов, например от активности конкретного применяемого соединения, от возраста, веса тела, общего состояния здоровья, от пола, питания, времени и способа введения, от скорости выделения, сочетания лекарственных средств и от тяжести конкретного заболевания, которое поддается лечению. Пероральное введение является предпочтительным, но также могут использоваться парентеральные пути введения (например, внутривенный или чрезкожный).
Противопаркинсонические лекарственные средства представляют собой стандартные лекарственные средства, такие как 1-допа (леводопа) и леводопа в сочетании с бензеразидом или карбидопой, агонистами допамина, такими как бромкриптин, апомокриптин, каберголин, прамипексол, ропинирол, перголид, дигидро-α-эргокриптин или лизурид, а также все лекарственные средства, действующие посредством стимулирования допаминовых рецепторов, ингибиторы катехол-О-метил трансферазы (СОМТ), такие как энтакапон или толкапон, ингибиторы моноаминооксидазы (МАО), такие как селегилин, и антагонисты рецепторов N-метил-D-аспартата (NMDA), такие как амантадин или будипин.
Нежелательные действия указанных противопаркинсонических лекарственных средств включают все типы дискинезий, такие как хореическая, дистоническая, баллистическая и миоклоническая дискинензия, а также двигательные (ответные) колебания или психотические состояния.
Следовательно, настоящее изобретение относится к применению замещенных аминометилхроманов формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -ОСН2СН3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl, или
R1 и R2 вместе образуют радикал формулы

R3 представляет собой циклопентил, циклогексил, циклогептил или следующий радикал, обозначенный как о-бензолсульфимидил:

и
n представляет собой 1, 2, 3, 4 или 5,
и их оптических изомеров и фармацевтически приемлемых солей для приготовления лекарственного средства для лечения нежелательных действий противопаркинсонических лекарственных средств при идиопатической болезни Паркинсона.
Более предпочтительным соединением формулы I является (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль.
Следовательно, изобретение относится к применению (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или фармакологически приемлемой соли для приготовления лекарственного средства для лечения нежелательных действий противопаркинсонических лекарственных средств при идиопатической болезни Паркинсона.
Лечение нежелательных действий стандартных противопаркинсонических лекарственных средств, как указано выше, исследовалось на модифицированной животной модели паркинсонизма у обезьян рода Cynomolgus в соответствии с P.J.Blanchet и др., Exp. Neurology 1998; 153: 214-222. У обезьян вызывали паркинсонизм путем повторных введений 1-метил-4-фенил-1,2,3,6-тетрагидропиридина (МРТР). Обезьян с паркинсонизмом подвергали длительному лечению при помощи стандартной терапии с использованием леводопы в соответствии с P.J.Blanchet и др., Mov. Disord., 1998; 13: 798-802. Длительное лечение с использованием леводопы вызывало экстралирамидные двигательные побочные действия и психотические состояния, которые как качественно, так и количественно, определялись при помощи шкалы анормальных непроизвольных движений (P.J. Blanchet и др., Mov. Disord. 1998; 13: 798-802) на различных частях тела (лице, шее, туловище, каждой конечности) и путем оценки психотических состояний при помощи наблюдения за внимательностью, реактивностью и подвижностью обезьян. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид полностью уменьшал проявление хореических форм дискинезий и дистонических дискинезий, а также психотических состояний.
Обычное исследование для изучения эффективности соединений по изобретению относительно нежелательных действий при лечении болезни Паркинсона описано далее. 40 больных каждого пола с идиопатической прогрессирующей болезнью Паркинсона, осложненной "максимальной" дискинезией, принимали участие в двойном слепом исследовании. Главным включенным критерием является фаза Hoehn & Yahr > 2,5 (литература: Hoehn H.M. и др, Neurology 1967; 17: 427-442), возраст больных 40-75 лет, симптомы наблюдаются по крайней мере в течение 5 лет и лечение леводопой продолжается в течение по крайней мере 3 лет. Моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или плацебо вводили в качестве "дополнения" к обычному лечению паркинсонизма, которое оставалось неизмененным в течение всего исследования. Дозу слепого лекарственного средства подбирали в течение 3 недель в диапазоне от 2,5 до 10 мг путем введения дважды в день. Затем на протяжении 3 недель лечение оставалось постоянным. Перед началом определения дозы и в конце периода лечения пациенты записывали наблюдения в карту-дневник с тридцатиминутными интервалами в течение 48 часов. В карте-дневнике различали 5 разных стадий: (1) "on" без дискинезий, (2) "on" с дискинезией, причиняющей беспокойство, (3) "on" с дискинезией, не причиняющей беспокойства, (4) "off" время и (5) время сна (Nauser RA и др., Clin. Neuropharmacol., 2000, 23, 75-81). Первичный результат переменной протокола представлял собой изменение "on" времени дискинезии, причиняющей беспокойство. Статистический анализ полученных ежедневных данных свидетельствует о существенном уменьшении "on" времени с дискинезией, причиняющей беспокойство, при лечении с применением моногидрохлорида (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида, в то время как "on" время без дискинезии существенно увеличивается. Другие параметры не изменялись.
Предпочтительной солью (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Следовательно, изобретение относится к применению для приготовления лекарственного средства для лечения нежелательных действий противопаркинсонических лекарственных средств при идиопатической болезни Паркинсона, где фармакологически приемлемой солью является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Кроме того, изобретение относится к применению фармацевтической композиции, содержащей по крайней мере одно соединение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одну из его биосовместимых солей для лечения нежелательных действий противопаркинсонических лекарственных средств при идиопатической болезни Паркинсона.
Ограничительным фактором лечения паркинсонизма при помощи леводопы и/или агонистов допамина часто является возникновение психозов или дискинезии и других двигательных колебаний.
Было обнаружено, что (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль усиливают противопаркинсоническое действие противопаркинсонических лекарственных средств, как указано выше, не вызывая при этом экстрапирамидных побочных действий.
Следовательно, дополнительная терапия при помощи (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли, в частности моногидрохлорида (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида, сейчас открывает возможности для увеличения доз леводопы, и/или агонистов допамина, и/или других противопаркинсонических лекарственных средств, как указывалось выше, для того, чтобы нейтрализовать периоды неудовлетворительной подвижности ("off" фазы) без провоцирования вышеупомянутых побочных действий. Это представляет собой совершенно новый подход в лечении болезни Паркинсона, что обеспечивает существенное преимущество для пациентов.
Таким образом, изобретение относится к фармацевтической композиции, содержащей в качестве активных компонентов, (i) (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемую соль, и (ii) по крайней мере одно противопаркинсоническое лекарственное средство, в сочетании с одним или более фармацевтически приемлемых наполнителей.
Более предпочтительно, изобретение относится к фармацевтической композиции, содержащей в качестве активных компонентов (i) моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида и (ii) леводопу или леводопу в сочетании с бензеразидом или карбидопой, в сочетании с одним или более фармацевтически приемлемых наполнителей.
Соотношения соответствующих количеств (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или одной из его физиологически приемлемых солей и обычного противопаркинсонического лекарственного средства могут быть разными. Предпочтительно, массовое соотношение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или одной из его физиологически приемлемых солей к обычному противопаркинсоническому лекарственному средству находится в интервале от 1:1 до 1:100, предпочтительно от 1:10 до 1:90 и наиболее предпочтительно от 1:40 до 1:60.
Другим объектом настоящего изобретения является, кроме того, применение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или одной из его физиологически приемлемых солей в сочетании по крайней мере с одним противопаркинсоническим лекарственным средством для приготовления комбинированного лекарственного средства, предназначенного для усиления противопаркинсонического действия указанных противопаркинсонических лекарственных средств.
Согласно изобретению понятие "комбинированное лекарственное средство" относится к любой фармацевтической композиции, как указано выше, в которой два активных компонента или соединения являются составными компонентами одной композиции, или к набору, содержащему две отдельные композиции, первая из которых содержит (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одну из его физиологически приемлемых солей в качестве единственного активного компонента, и вторая содержит по крайней мере одно противопаркинсоническое лекарственное средство в качестве активного соединения.
Если комбинированное лекарственное средство представлено в виде набора, введение двух композиций, составляющих этот набор, несмотря на отдельное выполнение, является одновременным для комбинированной терапии. Предпочтительным является применение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида в форме моногидрохлорида.
Нежелательные действия противопаркинсонических лекарственных средств, как указано выше, кроме того, известны как паркинсонические синдромы.
Паркинсонические синдромы представляют собой, например, множественную системную атрофию (MSA), синдром Стил-Ричардсон-Олзевски (= прогрессирующий надъядерный паралич), кортико-базальную дегенерацию, оливомостомозжечковую атрофию или синдром Шай-Дрэгера.
Следовательно, изобретение относится к применению замещенных аминометилхроманов формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -ОСН2СН3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl, или
R1 и R2 вместе образуют радикал формулы

R3 представляет собой циклопентил, циклогексил, циклогептил или следующий радикал, обозначенный как о-бензолсульфимидил:

и
n представляет собой 1, 2, 3, 4 или 5,
и их оптических изомеров и фармацевтически приемлемых солей для приготовления лекарственного средства для лечения нежелательных действий противопаркинсонических лекарственных средств при паркинсонических синдромах.
Более предпочтительным соединением формулы I является (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль.
Таким образом, изобретение относится к применению (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или фармакологически приемлемой соли для приготовления лекарственного средства для лечения нежелательных действий противопаркинсонических лекарственных средств при паркинсонических синдромах.
Обычной животной моделью являются резерпинированные крысы или мыши (например, M.S.Starr и B.S.Starr, J.Neural Transm. - Park. Dis. Dement. Sect, 1994; 7: 133-142; M.Gossel и др., J. Neural Transm. - Park. Dis. Dement. Sect, 1995; 10: 27-39; N.R.Hughes и др., Mov. Disord., 1998; 13: 228-233). Резерпин существенно истощает количество моноаминов и особенно образуется при полной акинезии у обеих видов. Известно, что через 24 часа после введения пройденное расстояние и время активности приблизительно равны нулю, в то время как при обычной активности составляет метры. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его фармацевтически приемлемая соль в зависимости от дозы уменьшают акинезию, то есть восстанавливают пройденное расстояние и время активности до значений, наблюдаемых у обычных животных.
Другой более современной моделью на животных является подход, предусматривающий дегенерацию черного и полосатого ядер у крыс в соответствии с G.K.Wenning и др., J.Neural Transm. Suppl, 1999; 55: 103-113. Крыс подвергали одностороннему ведению 6-гидроксидопамина в левый медиальный переднемозговой пучок с последующим введением хинолиновой кислоты в полосатое тело, находящееся на той же стороне тела, вызывая дегенерацию черного и полосатого ядер. Эта дегенерация проявляется в крутящемся поведении, которое вызывается введением допаминомиметиков, таких как апоморфин или амфетамин. Крутящееся поведение измеряется автоматизированным регистрирующим устройством. Такому крутящемуся поведению, индуцированному апоморфином или амфетамином, противодействует в зависимости от дозы (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его фармацевтически приемлемая соль.
Множественная системная атрофия (MSA) развивается вследствие обширной дегенерации нейронов в экстрапирамидной системе и вегетативной нервной системе, что приводит к синдрому Паркинсона, сопровождающемуся акинезией и вегетативными расстройствами. В отличие от идиопатической болезни Парксинсона плотность центральных допаминовых рецепторов заметно уменьшается, и поэтому больные MSA плохо поддаются лечению при помощи допаминергических лекарственных средств. Хотя (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его фармацевтически приемлемая соль действуют преимущественно через рецепторы серотонина в экстрапирамидной системе, они способны улучшать двигательную активность у этих пациентов, которые в большинстве случаев не поддаются другому лечению.
Обычное исследование для изучения эффективности соединений по изобретению на пациентах с MSA осуществляли на 30 больных каждого пола, у которых симптом продолжался по крайней мере 5 лет и существенное уменьшение центральных допаминовых рецепторов подтверждалось при помощи позитронной эмиссионной томографии (PET). Исследование проводили подобно к вышеописанному для болезни Паркинсона. Подбирали дозу моногидрохлорида (-)-(R)-2-(4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или плацебо в качестве "дополнения" к обычному лечению (в интервале доз 1-20 мг три раза в день). После периода двойного слепого дозозависимого исследования в течении 3 недель, на протяжении которого определяли индивидуальную дозу для каждого пациента на основании переносимости и эффективности, доза оставалась постоянной в течение 3 дополнительных недель. Перед началом определения дозы и в конце периода лечения для каждого пациента проводили полную оценку UPDRS (первичный измеренный результат). Статистический анализ UPDRS свидетельствует о существенном клиническом улучшении в течение симптомов паркинсонизма после лечения с моногидрохлоридом (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Предпочтительной солью (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Следовательно, изобретение относится к применению для приготовления лекарственного средства для лечения нежелательных действий противопаркинсонических лекарственных средств при паркинсонических синдромах, где фармакологически приемлемой солью является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Дополнительно, изобретение относится к применению фармацевтической композиции, содержащей по крайней мере одно соединение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или одну из его биосовместимых солей для лечения нежелательных действий противопаркинсонических лекарственных средств при паркинсонических синдромах.
Настоящее изобретение, кроме того, относится к применению замещенных аминометилхроманов формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -OCH2CH3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl, или
R1 и R2 вместе образуют радикал формулы

R3 представляет собой циклопентил, циклогексил, циклогептил или следующий радикал, обозначенный как о-бензолсульфимидил:

и
n представляет собой 1, 2, 3, 4 или 5,
и их оптических изомеров и фармацевтически приемлемых солей для приготовления лекарственного средства для лечения дискинетического и/или хореатического синдромов.
Более предпочтительным соединением формулы I является (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль.
Следовательно, изобретение относится к применению (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или фармакологически приемлемой соли для приготовления лекарственного средства для лечения дискинетического и/или хореатического синдромов.
Дискинетический и/или хореатический синдромы представляют собой, например, болезнь Хантингтона, малую хорею или хорею беременных. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль являются, в частности, пригодными для лечения болезни Хантингтона.
Обычной моделью на животных является модель системного введения 3-нитропропионовой кислоты (3-NP) крысам в соответствии с C.V.Borlongan и др., Brain Res., 1995; 697: 254-257. Крысам вводили селективный нейротоксин полосатого тела 3-NP внутрибрюшинно каждый четвертый день (C.V.Borlongan и др., Brain Res. Protocols, 1997; 1: 253-257). После двух инъекций 3-NP у крыс наблюдались ночные рефлекторные симптомы повышенной активности ранней болезни Хантингтона, тогда как после четырех инъекций 3-NP у крыс наблюдались ночные рефлекторные симптомы акинезии (пониженной активности) поздней болезни Хантингтона. Ночная активность автоматически измерялась в обычных клетках для измерения активности при помощи инфракрасных лучей. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его фармацевтически приемлемая соль уменьшает как ночную повышенную активность, так и акинезию.
Обычный опыт для изучения действия соединений по изобретению при хорее на произвольную двигательную активность и функциональную нетрудоспособность у больных с болезнью Хантингтона проводился на 32 пациентах с генетически подтвержденным диагнозом. Моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или плацебо вводились как "дополнение" к обычному лечению, которое оставалось постоянным на протяжении всего исследования. Дозу слепого лекарственного средства определяли в течение 3 недель в диапазоне от 2,5 до 20 мг при введении дважды в день. Затем лекарственное средство вводили в постоянной дозе в течение 1 недели. Оценку проводили за одну неделю перед и в последний день испытания. Оценку хореи осуществляли с помощью шкалы аномальных непроизвольных движений (AIMS, W.Guy, в: ECDEU пособие по осуществлению. Rockville MD: Департамент здоровья, образования и социального обеспечения США, 1976: 534-537), единой оценочной шкалы болезни Хантингтона (UHDRS, исследовательская группа Хантингтона, 1996, Movement Disord, 11: 136-42), и оценки видеонаблюдений. Произвольную двигательную активность измеряли при помощи двигательной шкалы UHDRS. Пациенты и их помощники заполняли анкету относительно функциональной нетрудоспособности. Статистический анализ данных свидетельствует о существенном улучшении произвольной и непроизвольной двигательной активности у пациентов с болезнью Хантингтона после лечения с (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксидом или его физиологически приемлемой соль.
Предпочтительной солью (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Следовательно, изобретение относится к применению для приготовления лекарственного средства для лечения дискинетического и/или хореатического синдромов, в частности для лечения болезни Хантингтона, где фармакологически приемлемая соль представляет собой моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Дополнительно изобретение относится к применению фармацевтической композиции, содержащей по крайней мере одно соединение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одну из его биосовместимых солей для лечения дискинетического и/или хореатического синдромов.
Настоящее изобретение относится к применению замещенных аминометилхроманов формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -OCH2CH3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl, или
R1 и R2 вместе образуют радикал формулы

R3 представляет собой циклопентил, циклогексил, циклогептил или следующий радикал, обозначенный как о-бензолсульфимидил:

и
n представляет собой 1, 2, 3, 4 или 5,
и их оптических изомеров и фармацевтически приемлемых солей для приготовления лекарственного средства для лечения дистонических синдромов.
Более предпочтительным соединением формулы I является (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль.
Следовательно, изобретение относится к применению (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или фармакологически приемлемой соли для приготовления лекарственного средства для лечения дистонических синдромов.
Дистонические синдромы представляют собой, например, спазматическую кривошею, писчий спазм, тонический блефароспазм, синдром Мейга или допачувствительную дистонию. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль являются особенно пригодными для лечения спазматической кривошеи и/или тонического блефароспазма.
Обычной животной моделью являются мутантные дистонический хомячки в соответствии с A.Richter и W.Löscher, Prog. Neurobiol. 1998; 54: 633-677. У этих генетически дистонических хомячков дистонические приступы провоцируются при доставании животных из клетки и помещении их на весы. Дистонический синдром включает последовательность аномальных движений, и тяжесть отдельных симптомов оценивается при помощи системы количественных показателей. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его фармацевтически приемлемая соль в зависимости от дозы уменьшают тяжесть дистонических симптомов.
Для доказательства эффективности соединений по изобретению при дистонических синдромах проводили двойное слепое исследование с плацебо в качестве контроля на пациентах с шейной дистонией (спазматическая кривошея), которые не переносят введения ботулинического токсина. Подбирали дозу моногидрохлорида (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида, как описано выше, вводя в дозах от 2,5 до 20 мг дважды в день. В качестве первичного измеренного результата использовали оценочную шкалу спазматической кривошеи Торонто вестерн (TWSTRS, C.L. Cornelia и др., 1997, Movement Disord, 12: 570-575). У пациентов, подвергнутых лечению (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксидом или одной из его фармацевтически приемлемых солей отмечали существенное улучшение значений шкалы TWSTRS.
Предпочтительной солью (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Следовательно, изобретение относится к применению для приготовления лекарственного средства для лечения дистонических синдромов, в частности спазматической кривошеи и/или тонического блефароспазма, где фармакологически приемлемая соль представляет собой моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Дополнительно изобретение относится к применению фармацевтической композиции, содержащей по крайней мере одно соединение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одну из его биосовместимых солей для лечения дистонических синдромов.
Настоящее изобретение относится к применению замещенных аминометилхроманов формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -ОСН2СН3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl, или
R1 и R2 вместе образуют радикал формулы

R3 представляет собой циклопентил, циклогексил, циклогептил или следующий радикал, обозначенный как о-бензолсульфимидил:

и
n представляет собой 1, 2, 3, 4 или 5,
и их оптических изомеров и фармацевтически приемлемых солей для приготовления лекарственного средства для лечения экстрапирамидных симптомов, вызванных нейролептиками.
Более предпочтительным соединением формулы I является (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль.
Следовательно, изобретение относится к применению (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или фармакологически приемлемой соли для приготовления лекарственного средства для лечения экстрапирамидных симптомов, вызванных нейролептиками.
Экстрапирамидные нарушения движений, вызванные нейролептиками, представляют собой, например, раннюю дискинезию, дистонию, акатизию, паркинсоноидное состояние, в частности брадикинезию, или позднюю дискинезию.
(-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль являются пригодными особенно для лечения акатизии, и/или поздней дискинезии, и/или паркинсоноидного состояния.
Обычной животной моделью является ригидность мышц у крыс, вызванная нейролептиками, в соответствии с S.Wolfarth и др., Arch. Pharmacol. 1992; 345: 209-212. Крысам вводили обычное нейролептическое лекарственное средство галоперидол, что вызывало усиление тонуса мышц. Тонус мышц измеряли электромеханически как сопротивление к пассивному сгибанию и разгибанию задней лапы. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его фармацевтически приемлемая соль уменьшали повышенный тонус мышц, вызванный галоперидолом.
Другой обычной животной моделью являются обезьяны, сенсибилизированные нейролептиками в соответствии с D.E.Casey, Psychopharmacology, 1996; 124: 134-140. Обезьяны, подвергнутые повторному лечению обычными нейролептиками, являются очень чувствительными к последующему провокационному введению нейролептических лекарственных средств. При провокации у обезьян незамедлительно проявляются экстрапирамидные двигательные побочные эффекты, такие как дистония, дискинезии, акатизия и брадикинезия, которые измеряются при помощи системы количественных показателей. Обычное нейролептическое лекарственное средство галоперидол вводится в качестве провокатора. Если наблюдаются вышеупомянутые экстрапирамидные двигательные побочные эффекты, вводят (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его фармацевтически приемлемую соль; (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид уменьшает в зависимости от дозы экстрапирамидные двигательные побочные эффекты.
Поздняя дискинезия является распространенным побочным действием при длительном лечении нейролептиками. Обычное исследование для изучения эффективности соединений по изобретению при поздней дискинезии описано ниже. Исследование проводилось на 32 больных шизофренией (DSM-III-R), которые находились на стационарном лечении, возраст 25-60 лет, которые получали длительное постоянное антипсихотическое лечение (которое продолжалось по крайней мере 5 лет). Вводили моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или плацебо в качестве "дополнения" к антипсихотическому лечению, которое оставалось постоянным в течение всего исследования. Дозу слепого лекарственного средства подбирали на протяжении 3 недель в диапазоне от 1 до 20 мг три раза в день. Затем введение лекарственного средства осуществляли в условиях двойного слепого исследования в течение 2 недель. После двухнедельного периода выведения переходили на введение тестируемых лекарственных средств. Оценку поздней дискинезии при помощи шкалы анормальных непроизвольных движений (AIMS, см. выше) и паркинсонических экстрапирамидных побочных эффектов (UPDRS, см. выше) осуществляли до и после лечения. Значения шкалы AIMS на протяжении лечения с моногидрохлоридом (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида были существенно ниже, чем в период введения плацебо.
Предпочтительной солью (-)-(R)-2-{4-[[3,4-дигидро-2Н˜бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Следовательно, изобретение относится к применению для приготовления лекарственного средства для лечения экстрапирамидных симптомов, вызванных нейролептиками, в частности акатизии и/или поздней дискинезии, где фармакологически приемлемая соль представляет собой моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Дополнительно изобретение относится к применению фармацевтической композиции, содержащей по крайней мере одно соединение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одну из его биосовместимых солей для лечения экстралирамидных симптомов, вызванных нейролептиками.
Настоящее изобретение относится к применению замещенных аминометилхроманов формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -ОСН2СН3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl, или
R1 и R2 вместе образуют радикал формулы

R3 представляет собой циклопентил, циклогексил, циклогептил или следующий радикал, обозначенный как о-бензолсульфимидил:

и
n представляет собой 1, 2, 3, 4 или 5,
и их оптических изомеров и фармацевтически приемлемых солей для приготовления лекарственного средства для лечения тремора.
Более предпочтительное соединение формулы I представляет собой (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемую соль.
Следовательно, изобретение относится к применению (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или фармакологически приемлемой соли для приготовления лекарственного средства для лечения тремора.
Тремор включает все виды треморов, такие как эссенциальное (наследственное) дрожание, активированный физиологический тремор, мозжечковый тремор, ортостатическое дрожание или тремор, вызванный лекарственными средствами.
(-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль являются особенно пригодными для лечения эссенциального тремора и/или тремора, вызванного лекарственными средствами.
Обычными животными моделями являются модели, в которых используются либо генетические мутантные животные, либо модели, в которых тремор вызывается фармакологическим средством (для обзора см.: Н.Wilms и др., Mov. Disord., 1999; 14: 557-571).
Стандартными генетическими моделями на мутантных животных являются синдром Campus на свиньях Pietrain в соответствии с A.Richter и др. (Exp. Neurology, 1995; 134: 205-213) или мутантные мыши Weaver в соответствии с J.R.Simon и В.Ghetti (Mol. Neurobiol, 1994; 9: 183-189). На модели синдрома Campus, у этих мутантных свиней наблюдался высокоинтенсивный тремор при стоянии и при перемещении, но не при лежании в состоянии покоя. Тремор оценивали при помощи акцелерометрической регистрации. У мышей с мутацией Weaver дегенеративная мозжечковая атрофия обнаруживалась в сочетании с тремором, неустойчивой походкой и опрокидыванием на бок через несколько шагов. Неустойчивая походка и опрокидывание приводили к существенному уменьшению двигательной активности, которая измерялась пройденным расстоянием и временем, требуемым для вставания, в обычных клетках для измерения активности.
(-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одна из его фармацевтически приемлемых солей улучшают течение синдрома Campus у свиней Pietrain, то есть уменьшают инвалидизирующий тремор при стоянии и при перемещении, и усиливают двигательную активность у мутантных мышей Weaver.
Обычной животной моделью для тремора, вызванного лекарственными средствами, является термор, вызванный оксотреморином (например, Н.Hallberg и О.Almgren, Acta Physiol. Scand., 1987; 129: 407-13; J.G.Clement и W.R.Dyck, J. Pharmacol. Meth., 1989; 22: 25-36). Оксотреморин вызывает тремор, который измеряется при помощи шкалы оценок. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино] бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одна из его фармацевтически приемлемых солей ингибирует тремор, вызванный оксотреморином.
Предпочтительной солью (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Следовательно, изобретение относится к применению для приготовления лекарственного средства для лечения треморов, в частности эссенциальных треморов и/или треморов, вызванных лекарственными средствами, где фармакологически приемлемая соль представляет собой моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Дополнительно изобретение относится к применению фармацевтической композиции, содержащей по крайней мере одно соединение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одну из его биосовместимых солей для лечения тремора.
Настоящее изобретение относится к применению замещенных аминометилхроманов формулы I

в которой
R1 представляет собой водород,
R2 представляет собой водород, гидроксил или радикал формулы -ОСН3, -ОСН2СН3, -ОСН(СН3)2 или -СН2С(СН3)2-Cl, или
R1 и R2 вместе образуют радикал формулы

R3 представляет собой циклопентил, циклогексил, циклогептил или следующий радикал, обозначенный как о-бензолсульфимидил:

и
n представляет собой 1, 2, 3, 4 или 5,
и их оптических изомеров и фармацевтически приемлемых солей для приготовления лекарственного средства для лечения экстрапирамидных двигательных расстройств, выбранных из группы, включающей синдром Жилль де ла Туретта, крупноразмашистый гиперкинез конечностей, миоклонус, синдром усталых ног или гепатоцеребральную дистрофию.
Более предпочтительньм соединением формулы I является (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его физиологически приемлемая соль.
Следовательно, изобретение относится к применению (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или фармакологически приемлемой соли для приготовления лекарственного средства для лечения экстрапирамидных нарушений движений, выбранных из группы, включающей синдром Жилль де ла Туретта, крупноразмашистый гиперкинез конечностей, миоклонус, синдром усталых ног и гепатоцеребральную дистрофию.
Обычной животной моделью для миоклонуса является миоклонус, индуцированный острой гипоксией в соответствии с D.D.Truong и др., Mov. Dsiord., 1994; 9: 201-206. При такой модели постгипоксического миоклонуса у крыс происходит остановка сердца в течение 8 минут, а затем их реанимируют. Миоклонические конвульсии возникают самопроизвольно, но могут провоцироваться звуковым раздражителем, к тому же ухудшаются через несколько дней после остановки сердца. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одна из его фармакологически приемлемых солей в зависимости от дозы уменьшают количество самопроизвольных и вызванных звуком миоклонических конвульсий.
Предпочтительной солью (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида является моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Следовательно, изобретение относится к применению для приготовления лекарственного средства для лечения экстрапирамидных нарушений движений, выбранных из группы, включающей синдром Жилль де ла Туретта, крупноразмашистый гиперкинез конечностей, миоклонус, синдром усталых ног и гепатоцеребральную дистрофию, где фармакологически приемлемая соль представляет собой моногидрохлорид (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида.
Дополнительно, изобретение относится к применению фармацевтической композиции, содержащей по крайней мере одно соединение (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или одну из его биосовместимых солей для лечения экстрапирамидных нарушений движений, выбранных из группы, включающей синдром Жилль де ла Туретта, крупноразмашистый гиперкинез конечностей, миоклонус, синдром усталых ног и гепатоцеребральную дистрофию.
Экстрапирамидные нарушения движения, такие как синдром Стил-Ричардсон-Олзевски (= прогрессирующий надъядерный паралич), кортико-базальная дегенерация, оливомостомозжечковая атрофия, синдром Шай-Дрэгера, малая хорея, хорея беременных, писчий спазм, тонический блефароспазм, синдром Мейга, допачувствительная дистония, синдром Жилль де ла Туретта, крупноразмашистый гиперкинез конечностей, миоклонус, синдром усталых ног и гепатоцеребральная дистрофия, не так часто встречаются, чтобы можно было произвести результативное двойное слепое исследование. Однако существует неотложная медицинская потребность в данной области, так как на данный момент нет удовлетворительных методов лечения.
Поэтому открытые категоризированные наблюдения за некоторыми выбранными пациентами являются адекватным способом подтверждения эффективности (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли.
Все фармацевтические составы, которые применяются для лечения экстрапирамидных нарушений движений и/или для лечения нежелательных действий противопаркинсонических лекарственных средств при экстрапирамидных нарушениях движений, включая комбинированное лекарственное средство, могут применяться в качестве фармацевтических препаратов при лечении людей и в ветеринарии.
Композиции по изобретению предпочтительно вводятся парентерально либо также перорально, хотя другие пути введения, например, такие как ректальное введение, не исключаются.
Подходящие наполнители представляют собой органические или неорганические вещества, которые являются подходящими для энтерального (например, перорального), парентарального или местного применения и не реагируют с (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксидом и/или одной из его биосовместимых солей, например вода, растительные масла, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, глицеролтриацетат, желатин, углеводороды, такие как лактоза или крахмал, стеарат магния, тальк, вазелин. Формами, которые применяют для перорального введения, являются, в частности, таблетки, пилюли, таблетки с сахарным покрытием, капсулы, порошки, гранулы, сиропы, растворы или капли; формами для ректального введения являются суппозитории; формами для парентерального введения являются растворы предпочтительно на масляной основе или водные растворы, а также суспензии, эмульсии или имплантанты, и формами для местного введения являются трансдермальные пластыри, мази, кремы или порошки. (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил] амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид и/или одна из его фармацевтически приемлемых солей также могут быть лиофилизированы и полученные лиофилизаты могут использоваться, например, для приготовления инъекционных препаратов. Вышеуказанные препараты могут стерилизоваться и/или включать вспомогательные вещества, такие как смазывающие вещества, консерванты, стабилизаторы и/или смачивающие вещества, эмульсификаторы, соли для модификации осмотического давления, буферные вещества, красители, ароматизаторы и/или другие активные компоненты, например один или несколько витаминов. Составы могут, при необходимости, предназначаться для замедленного высвобождения (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его биосовместимой соли.
Нижеприведенные примеры относятся к фармацевтическим препаратам
Пример А: Флаконы для инъекций
рН раствора 100 г (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли и 5 г Na2HPO4 в 3 л бидистиллированной воды устанавливали на 6,5, используя 2 н. соляную кислоту, стерилизовали фильтрацией, переносили во флаконы для инъекций, лиофилизировали в стерильных условиях и запечатывали в стерильных условиях. Каждый флакон для инъекций содержит 5 мг активного компонента.
Пример В: Суппозитории
Смесь 20 г (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли расплавляли с 100 г соевого лецитина и 1400 г какаового масла, смесь разливали в пресс-формы и охлаждали. Каждый суппозиторий содержит 20 мг активного компонента.
Пример С: Раствор
Раствор приготавливали с 1 г (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли, 9,38 г NaH2PO4·2Н2О, 28,48 г Na2HPO4·12 H2O и 0,1 г бензалконийхлорида в 940 мл бидистиллированной воды. рН раствора устанавливали на 6,8, и объем раствора доводили до 1 л и стерилизовали путем облучения. Этот раствор может использоваться в форме глазных капель.
Пример D: Мазь
500 мг (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил] амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли смешивали с 99,5 г вазелина в асептических условиях.
Пример Е-1: Таблетки
Смесь 1 кг (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния таблетировали обычным способом таким образом, чтобы каждая таблетка содержала 10 мг активного компонента.
Пример Е-2: Таблетки
Смесь 100 г моногидрохлорида (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида, 1 кг леводопы, 250 г бензеразида, 4 кг лактозы, 1,6 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния таблетировали обычным способом таким образом, чтобы каждая таблетка содержала 5 мг моногидрохлорида (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида, 50 мг леводопы и 12,5 мг бензеразида.
Пример F: Таблетки с сахарным покрытием
Смесь таблетировали аналогично Примеру Е и затем таблетки покрывали обычным способом покрытием из сахарозы, картофельного крахмала, талька, трагаканта и красителя.
Пример G: Капсулы
2 кг (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли помещали в твердые желатиновые капсулы обычным способом таким образом, что каждая капсула содержала 20 мг активного компонента.
Пример Н: Ампулы
Раствор 1 кг (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли в 60 л бидистиллированной воды стерилизовали фильтрацией, переносили в ампулы, лиофилизировали в стерильных условиях и запечатывали в стерильных условиях. Каждая ампула содержит 10 мг активного компонента.
Пример I: Аэрозоль для ингаляции
14 г (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида или его физиологически приемлемой соли растворяли в 10 л изотонического раствора NaCl и полученный раствор помещали в коммерчески доступные емкости для аэрозоля с насосным устройством. Раствор можно распылять в рот или нос. Одно распыление (приблизительно 0,1 мл) соответствует дозе приблизительно 0,14 мг.
Изобретение относится к лекарственным средствам и касается применения (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]-бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксида и его фармацевтически приемлемых солей для приготовления лекарственного средства для лечения нежелательных действий противопаркинсонических лекарственных средств при идиопатической болезни Паркинсона, для лечения нежелательных действий противопаркинсонических лекарственных средств при паркинсонических синдромах, а также для лечения экстрапирамидных симптомов, вызванных нейролептиками. 4 н. и 8 з.п. ф-лы.
(i) (-)-(R)-2-{4-[[3,4-дигидро-2Н-бензопиран-2-ил)-метил]амино]бутил}-1,2-бензизотиазол-3-(2Н)-он-1,1-диоксид или его фармацевтически приемлемую соль в эффективном количестве,
и (ii) L-допу,
в сочетании с одним или более фармацевтически приемлемыми наполнителями.
| US 6235774 В1, 22.05.2001 | |||
| УГРЮМОВ М.В | |||
| и др | |||
| Генная и генно-клеточная терапия и нейродегенеративные заболевания, №3, 2000 [найдено 16.06.2006] найдено из Интернет <http://www.medi.ru> | |||
| ПЕТРОВСКИЙ Б.В | |||
| Большая медицинская энциклопедия | |||
| - М.: Советская энциклопедия, 1986, т | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| Способ получения 1,2-дихлорэтана | 1976 |
|
SU900568A1 |
| US 4983400 A, 08.01.1991. | |||
Авторы
Даты
2008-03-27—Публикация
2002-08-09—Подача