Данная заявка представляет собой частичное продолжение заявки на выдачу патента США с серийным № 10/081128, поданную 22 февраля 2002 года, содержание которой включено в качестве ссылки в данную заявку, и притязает на приоритет указанной заявки.
На всем протяжении данной заявки различные публикации обозначены арабскими цифрами. Полные ссылки для данных публикаций можно найти в конце данного описания непосредственно перед формулой изобретения. Описание данных публикаций включено в качестве ссылки в данную заявку для более полного описания области, к которой относится данное изобретение.
Предпосылки изобретения
Вирус иммунодефицита человека типа 1 (HIV-1) для проникновения в клетки-мишени вызывает слияние мембран вируса и клетки (8, 15, 66). Первое высокоаффинное взаимодействие между вирионом и клеточной поверхностью представляет собой связывание гликопротеина gp120 на вирусной поверхности с антигеном CD4 (13, 30, 41, 42). Это в свою очередь индуцирует конформационные изменения в gp120, позволяющие ему взаимодействовать с одним из нескольких рецепторов хемокинов (4, 5, 21, 36). Рецептор CC-хемокинов CCR5 представляет собой основной корецептор для тропных к макрофагам (R5) штаммов и играет ключевую роль в половом переносе HIV-1 (4, 5, 21, 36). Тропные к линиям T-клеток (X4) вирусы для проникновения в клетки-мишени используют CXCR4 и, как правило, но не всегда, появляются в ходе заболевания позднее или как результат размножения вируса в культуре ткани (4, 5, 21, 36). Некоторые первичные изоляты HIV-1 обладают двойной тропностью (R5X4), так как они могут использовать оба корецептора, хотя и не всегда с одинаковой эффективностью (11, 57). Исследования мутагенеза, сопряженные с разрешением кристаллической структуры белкового кора gp120, показали, что связывающий корецептор участок на gp120 содержит несколько консервативных остатков (32, 53, 65).
Показано, что тирозиновые остатки и остатки с отрицательным зарядом в N-концевом домене (Nt) CCR5 существенны для связывания gp120 с корецептором и для слияния с HIV-1 и проникновения HIV-1 (6, 18, 20, 22, 28, 31, 52, 54). Остатки во внеклеточных петлях (ECL) 1-3 CCR5 являлись несущественными для корецепторной функции, однако междоменная конфигурация CCR5 являлась необходимой для поддержания оптимального слияния и проникновения вируса (24). Это привело к заключению, что или gp120 взаимодействует с диффузной поверхностью на ECL, или что связи с остатками в ECL поддерживают Nt в функциональной конформации. Исследования с химерными корецепторами и моноклональными антителами против CCR5 также показали важность внеклеточных петель для проникновения вируса (5, 54, 64).
Молекулы, специфически связывающиеся с CCR5 и CXCR4 и блокирующие взаимодействие с их лигандами, представляют собой действенное средство для дальнейшего исследования структурных/функциональных связей корецепторов. Классификация таких соединений также может содействовать разработке эффективных терапевтических средств, мишенями которых являются опосредованные корецепторами стадии проникновения вируса. Ингибиторы корецепторных функций CCR5 или CXCR4, идентифицированные до настоящего времени, различаются по своей природе и включают низкомолекулярные соединения, пептиды, хемокины и их производные и моноклональные антитела (mAb). Механизмы действия низкомолекулярных соединений, блокирующих проникновение посредством ингибирования функции CXCR4 в качестве корецептора, не совсем понятны (17, 49, 55, 68). Один такой ингибитор, низкомолекулярное анионное соединение AMD3100, для того чтобы ингибировать проникновение вируса, зависит от остатков в ECL2 и четвертом трансмембранном домене (TM) CXCR4, но не ясно делает ли оно это посредством нарушения связывания gp120 с CXCR4 или посредством нарушения стадий после связывания, приводящих к слиянию мембран (16, 34, 55). До настоящего времени не сообщалось о низкомолекулярных соединениях, специфически блокирующих опосредованное CCR5 проникновение HIV-1. Хемокины опосредуют ингибирование проникновения HIV-1, по меньшей мере, двумя различными механизмами: блокирование взаимодействия gp120/корецептор и интернализация комплекса хемокин/рецептор (3, 26, 59, 63). Вариант AOP-RANTES также ингибирует рециркуляцию CCR5 к клеточной поверхности (40, 56). Такие варианты как RANTES 9-68 и Met-RANTES только предотвращают взаимодействие gp120/CCR5 и не супрессируют CCR5 (67). Варианты SDF-1 вероятно действуют, блокируя опосредованное CXCR4 проникновение вируса посредством сходного механизма (12, 27, 39). Только одно mAb против CXCR4, 12G5, охарактеризовано по его противовирусным свойствам. Сообщалось, что эффективность ингибирования проникновения вируса посредством 12G5 зависит и от клетки, и от изолята (43, 58). Данное mAb связывается в CXCR4 с ECL2, но механизм, по которому оно ингибирует проникновение, неизвестен (7). Некоторые охарактеризованные до настоящего времени mAb против CCR5 эффективно предотвращают проникновение HIV-1 (28, 64). Интересно, что mAb, эпитопы для которых лежат в Nt-домене CCR5, содержащем участок связывания gp120, ингибируют слияние с вирусом и проникновение вируса менее эффективно, чем mAb 2D7, эпитоп для которого лежит в ECL2. 2D7 также является антагонистом действия CC-хемокинов (64).
Выделили и охарактеризовали панель из шести мышиных mAb, обозначенных PA8, PA9, PA10, PA11, PA12 и PA14. Все шесть mAb специфически связывались с CCR5+-клетками, но с различными эффективностями, которые зависели от типа клеток. Исследования по картированию эпитопов идентифицировали остатки, важные для связывания mAb, а также предоставили информацию об укладке и взаимодействиях внеклеточных доменов CCR5. Все mAb ингибировали слияние и проникновение HIV-1, но корреляции между способностью mAb ингибировать слияние и проникновение и его способностью ингибировать связывание gp120/sCD4 с CCR5+-клетками не наблюдали.
Сущность изобретения
Данное изобретение относится к антителу против CCR5, содержащему (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагменту такого антитела, связывающемуся с CCR5 на поверхности клетки человека.
Данное изобретение также относится к антителу против CCR5, содержащему две легких цепи, где каждая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 6, и две тяжелых цепи, где каждая тяжелая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 9.
Данное изобретение также относится к антителу против CCR5, содержащему две легких цепи, где каждая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 6, и две тяжелых цепи, где каждая тяжелая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 12.
Данное изобретение также относится к изолированной нуклеиновой кислоте, кодирующей полипептид, содержащий последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 6. В указанном осуществлении нуклеиновая кислота содержит последовательность, указанную в SEQ ID № 5.
Данное изобретение также относится к изолированной нуклеиновой кислоте, кодирующей полипептид, содержащий последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 9. В указанном осуществлении нуклеиновая кислота содержит последовательность, указанную в SEQ ID № 8.
Данное изобретение также относится к изолированной нуклеиновой кислоте, кодирующей полипептид, содержащий последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID № 12. В указанном осуществлении нуклеиновая кислота содержит последовательность, указанную в SEQ ID № 11.
Данное изобретение также относится к композиции, содержащей, по меньшей мере, одно антитело против CCR5 или его фрагмент, как описано выше, вместе с носителем.
Данное изобретение также относится к композиции, содержащей антитело против CCR5 или его фрагмент с присоединенным к нему веществом, таким как радиоизотоп, токсин, полиэтиленгликоль, цитотоксическое средство и/или детектируемая метка.
Данное изобретение также относится к способу ингибирования инфицирования CD4+-клеток, включающему контактирование CD4+-клеток с антителом, содержащим (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагментом такого антитела, связывающимся с CCR5 на поверхности CD4+-клетки, в таком количестве и в таких условиях, чтобы слияние HIV-1 или инфицированной HIV-1 клетки с CD4+-клеткой являлось подавленным, ингибируя таким образом инфицирование CD4+-клетки HIV-1.
Данное изобретение также относится к способу лечения пораженного HIV-1 субъекта, включающему введение субъекту эффективной для лечения HIV-1 дозы антитела против CCR5, содержащего (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагмента такого антитела, связывающегося с CCR5 на поверхности клетки человека, в условиях, эффективных для лечения инфицированного HIV-1 субъекта.
Данное изобретение также относится к способу профилактики субъекта от заражения HIV-1, включающему введение субъекту эффективной для профилактики инфицирования HIV-1 дозы антитела против CCR5, содержащего (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагмента такого антитела, связывающегося с CCR5 на поверхности клетки человека, в условиях, эффективных для профилактики инфицирования субъекта HIV-1.
Данное изобретение также относится к конъюгату антитела против CCR5, включающему антитело против CCR5, содержащее (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии или плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), или фрагмент такого антитела, связывающийся с CCR5 на поверхности клетки человека, конъюгированные, по меньшей мере, с одним полимером.
Данное изобретение также относится к способу ингибирования инфицирования CCR5+-клеток HIV-1, включающему введение субъекту с риском инфицирования HIV-1 описанного выше конъюгата в количестве и в условиях, эффективных для ингибирования инфицирования CCR5+-клеток субъекта HIV-1.
Данное изобретение также относится к способу лечения инфекции HIV-1 у субъекта, включающему введение описанного выше конъюгата инфицированному HIV-1 субъекту в количестве и в условиях, эффективных для лечения инфекции HIV-1 у субъекта.
Данное изобретение также относится к трансформированной клетке-хозяину, содержащей, по меньшей мере, два вектора, где, по меньшей мере, один вектор содержит последовательность нуклеиновой кислоты, кодирующую тяжелые цепи антитела против CCR5, и, по меньшей мере, один вектор содержит последовательность нуклеиновой кислоты, кодирующую легкие цепи антитела против CCR5, где антитело против CCR5 содержит две тяжелые цепи с аминокислотной последовательностью, указанной в SEQ ID № 9, и две легкие цепи с аминокислотной последовательностью, указанной в SEQ ID № 6.
Данное изобретение также относится к трансформированной клетке-хозяину, содержащей, по меньшей мере, два вектора, где, по меньшей мере, один вектор содержит последовательность нуклеиновой кислоты, кодирующую тяжелые цепи антитела против CCR5, и, по меньшей мере, один вектор содержит последовательность нуклеиновой кислоты, кодирующую легкие цепи антитела против CCR5, где антитело против CCR5 содержит две тяжелые цепи с аминокислотной последовательностью, указанной в SEQ ID № 12, и две легкие цепи с аминокислотной последовательностью, указанной в SEQ ID № 6.
Данное изобретение также относится к вектору, содержащему последовательность нуклеиновой кислоты, кодирующую тяжелую цепь антитела против CCR5, где тяжелая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 9.
Данное изобретение также относится к вектору, содержащему последовательность нуклеиновой кислоты, кодирующую тяжелую цепь антитела против CCR5, где тяжелая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 12.
Данное изобретение также относится к способу получения антитела против CCR5, включающему культивирование клетки-хозяина, содержащей (i) плазмиду, обозначенную pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) или плазмиду, обозначенную pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмиду, обозначенную pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), в условиях, позволяющих продукцию антитела, содержащего две легких цепи, кодируемых плазмидой, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и две тяжелых цепи, кодируемых или плазмидой, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмидой, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), так что таким образом образуется антитело против CCR5.
Данное изобретение также относится к способу получения антитела против CCR5, включающему a) трансформацию клетки-хозяина (i) плазмидой, обозначенную pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и (ii) или плазмидой, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмидой, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), и b) культивирование трансформированной клетки-хозяина в условиях, позволяющих продукцию антитела, содержащего две легких цепи, кодируемых плазмидой, обозначенной pVK:HuPRO140-VK (инвентарный номер в ATCC - PTA-4097), и две тяжелых цепи, кодируемых или плазмидой, обозначенной pVg4:HuPRO140 HG2-VH (инвентарный номер в ATCC - PTA-4098), или плазмидой, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (инвентарный номер в ATCC - PTA-4099), так что таким образом образуется антитело против CCR5.
Данное изобретение также относится к набору для применения в способе получения антитела против CCR5. Набор включает a) вектор, содержащий последовательность нуклеиновой кислоты, кодирующую легкую цепь антитела против CCR5, где легкая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 6, и b) вектор, содержащий последовательность нуклеиновой кислоты, кодирующую тяжелую цепь антитела против CCR5, где тяжелая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 9, или вектор, содержащий последовательность нуклеиновой кислоты, кодирующую тяжелую цепь антитела против CCR5, где тяжелая цепь содержит аминокислотную последовательность, указанную в SEQ ID № 12.
Краткое описание чертежей:
Фигура 1:
Связывание моноклональных антител против CCR5 с CCR5+-клетками
Для выявления экспрессии белка CCR5 на поверхности CCR5+-клеток L1.2 и только что выделенных, стимулированных PHA/IL-2 PBMC применяли проточную цитометрию. Клетки инкубировали с насыщающими концентрациями каждого mAb, которые выявляли меченным PE репортерным антителом против мышиных IgG. Представлены результаты типичного эксперимента. Результаты для каждого mAb выражены и как средние интенсивности флуоресценции (m.f.i.), и как % собранных клеток. Так как PA8-PA12 и PA14 все представляют собой подкласс IgG1, их m.f.i. сравнимы непосредственно. 2D7 представляет собой IgG2a.
Фигура 2:
Значения CI для различных сочетаний mAb и вирусных ингибиторов:
Для различных сочетаний ингибиторов проникновения вирусов проводили эксперименты, подобные экспериментам, описанным в подписи к фигуре 7. mAb против CCR5 тестировали в сочетании с каждым из других, CC-хемокинами и CD4-IgG2, которые ингибируют присоединение HIV-1 к клетке-мишени. Диапазон концентраций PA11 и PA12 составлял 0-250 мкг/мл; диапазон концентраций 2D7 и PA14 составлял 0-25 мкг/мл; диапазон концентраций RANTES составлял 0-250 мкг/мл; диапазон концентраций CD4-IgG2 составлял 0-25 мкг/мл. Концентрации отдельных средств или их смесей, необходимые для получения 50% и 90% ингибирования слияния или проникновения, количественно сравнивали при помощи условия, известного как комбинационный индекс (CI).
Фигура 3:
Значения IC50 для ингибирования слияния клетка-клетка, проникновения вируса и связывания gp120/sCD4 mAb против CCR5:
Для целей сравнения авторы настоящего изобретения суммировали значения IC50, полученные в различных анализах, где тестировали mAb против CCR5. Значения IC50 подсчитывали только для тех mAb, которые способны ингибировать >90% слияния, проникновения или связывания.
Фигура 4:
Картирование эпитопов mAb против CCR5:
Для оценки связывания mAb с мутантными белками CCR5, меченными на C-конце пептидом HA, применяли протокол окрашивания двумя красителями. Клетки HeLa, экспрессирующие точечные мутанты CCR5, инкубировали с насыщающими концентрациями каждого mAb с последующей детекцией меченными PE антителами против мышиных IgG. Экспрессию корецептора на поверхности клетки измеряли двойным окрашиванием клеток меченным FITC mAb против HA. Четыре сетки соответствуют четырем внеклеточным доменам CCR5. Первая строка каждой сетки обозначает аминокислотную последовательность соответствующего внеклеточного домена CCR5 (SEQ ID №№ 1-4). Связывание mAb против CCR5 с аланиновым мутантом по каждому из остатков выражено как процент от связывания с CCR5 дикого типа, как описано в "материалах и методах".
Фигура 5:
Ингибирование мобилизации кальция в CCR5+-клетках mAb против CCR5:
В CCR5+-клетки L1.2 вводили Indo-1AM и последовательно стимулировали mAb против CCR5 или PBS с последующим RANTES (a). Изменения в флуоресценции измеряли спектрофлуориметром, а кривая мониторинга представлена из типичного эксперимента. Ингибирование выхода кальция посредством PA14 и 2D7 тестировали для широкого диапазона концентраций mAb (b). Результаты представлены как % ингибирования выхода кальция = [1- (относительная флуоресценция в присутствии mAb ÷ относительная флуоресценция в отсутствии mAb)] × 100% и представляют собой средние значения трех независимых экспериментов.
Фигура 6:
Ингибирование корецепторной функции CCR5 посредством mAb против CCR5:
Ингибирование слияния клетка-клетка mAb против CCR5 тестировали в анализе RET (a). К смеси клеток HeLa-EnvJR-FL + и PM1, меченных F18 и R18 соответственно, добавляли 0-250 мкг/мл PA8-PA12 или 0-25 мкг/мл PA14 или 2D7. Флуоресценцию в RET измеряли после 4 часов инкубации. Результаты представляют собой средние значения из трех независимых экспериментов и представлены как % ингибирования слияния = [1-(% RET в присутствии mAb ÷ % RET в отсутствие mAb)] × 100%. Ингибирование проникновение HIV-1 посредством mAb против CCR5 тестировали в одном раунде основанного на репликации люциферазы анализа проникновения (b). Клетки U87-CD4+CCR5+ инфицировали несущим оболочку JR-FL репортерным вирусом NLluc+env+ в присутствии 0-250 мкг/мл PA8-PA12 или 0-25 мкг/мл PA14 или 2D7. Люциферазную активность (относительные световые единицы, r.l.u.) измеряли в клеточных лизатах через 72 часа после заражения. Результаты приведены из типичного эксперименты и представлены как % ингибирования проникновения = [1- (r.l.u. в присутствии mAb ÷ r.l.u. в отсутствие mAb)] × 100%. Связывание биотинилированных [b] gp120, sCD4 и комплексов b-gp120-CD4 с CCR5+-клетками L1.2 (c). Сильное связывание наблюдали, когда происходящий из вируса R5 HIV-1JR-FL gp120 образовывал комплекс с эквимолярным количеством sCD4. В отсутствие sCD4 или для происходящего из вируса HIV-1LAI X4 gp120 связывания не наблюдали. Из всех кривых вычли фоновое связывание с CCR5+-клетками L1.2. Ингибирование связывания gp120/sCD4 с CCR5+-клетками L1.2 тестировали в присутствии различных концентраций каждого антитела (d). Клетки предварительно инкубировали в 96-луночных планшетах с mAb против CCR5 с последующей инкубацией с насыщающими концентрациями биотинилированных gp120/sCD4. В заключение измеряли связывание меченного PE стрептавидина с клетками с применением устройства для считывания флуоресценции в планшетах. Результаты приведены из типичного эксперименты и представлены как % ингибирования связывания gp120/sCD4 = [1- (m.f.i. в присутствии mAb ÷ m.f.i. в отсутствие mAb)] × 100%.
Фигура 7:
Синергическое ингибирование слияния клетка-клетка посредством PA12 и 2D7:
Для mAb, применяемых отдельно или в сочетании, получены кривые доза-ответ. К смеси клеток HeLa-EnvJR-FL + и PM1, меченных R18 и F18, соответственно, добавляли 0-50 мкг/мл PA12, 0-25 мкг/мл 2D7 или их сочетание в соотношении 2:1. Флуоресценцию в RET измеряли после 4 часов инкубации. Результаты представлены как % ингибирования слияния и представляют собой средние значения из трех независимых экспериментов. Данные анализировали с применением принципа срединного эффекта, который можно записать как
f=1/[1+(K/c)m] (1)
где f представляет собой долю пораженных/ингибированных, c представляет собой концентрацию, K представляет собой концентрацию средства, необходимую для получения срединного эффекта, и m представляет собой эмпирический коэффициент, описывающий форму кривой доза-ответ. Уравнение (1) представляет собой обобщенную форму уравнений, описывающих ферментативную кинетику Михаэлиса-Ментен, изотермы адсорбции Лэнгмюра и ионизационные равновесия Гендерсона-Хассельбалха, для которых m=1. В настоящем случае K эквивалентно значению IC50. K и m определяли аппроксимацией по точкам кривых доза-ответ, а уравнение (1) меняли для обеспечения расчета c по данному f. Наиболее соответствующие параметры для K и c представляют собой 8,8 мкг/мл и 0,54 для PA12, 0,36 мкг/мл и 0,68 для 2D7 и 0,11 мкг/мл и 1,1 для их сочетания. Данные кривые изображены и указывают на приемлемую степень согласия между экспериментом и теорией.
Фигура 8:
На данной фигуре указаны аминокислотная последовательность вариабельной области легкой цепи гуманизированного варианта мышиного антитела против CCR5 PA14 (SEQ ID № 6) и последовательность нуклеиновой кислоты, кодирующая ее (SEQ ID № 5), по данному изобретению. SEQ ID № 7 идентифицирует область в SEQ ID № 5, кодирующую аминокислотную последовательность, указанную в SEQ ID № 6. Данная вариабельная область легкой цепи присутствует в антителе, обозначенном в настоящем описании как PRO140 № 1 и № 2. Определяющие комплементарность области ("CDR") подчеркнуты.
Фигура 9:
На данной фигуре указаны аминокислотная последовательность первой вариабельной области тяжелой цепи гуманизированного варианта мышиного антитела против CCR5 PA14 (SEQ ID № 9) и последовательность нуклеиновой кислоты, кодирующая ее (SEQ ID № 8), по данному изобретению. SEQ ID № 10 идентифицирует область в SEQ ID № 8, кодирующую аминокислотную последовательность, указанную в SEQ ID № 9. Данная вариабельная область тяжелой цепи присутствует в антителе, обозначенном в настоящем описании как PRO140 № 2. CDR подчеркнуты.
Фигура 10:
На данной фигуре указаны аминокислотная последовательность второй вариабельной области тяжелой цепи гуманизированного варианта мышиного антитела против CCR5 PA14 (SEQ ID № 12) и последовательность нуклеиновой кислоты, кодирующая ее (SEQ ID № 11), по данному изобретению. SEQ ID № 13 идентифицирует область в SEQ ID № 11, кодирующую аминокислотную последовательность, указанную в SEQ ID № 12. Данная вариабельная область тяжелой цепи присутствует в антителе, обозначенном в настоящем описании как PRO140 № 1. CDR подчеркнуты.
Фигура 11:
Однократная доза гуманизированного антитела против CCR5 эффективно уменьшает вирусные нагрузки in vivo:
Мышей SCID восстанавливали нормальными человеческими PBMC и инфицировали HIV-1JR-CSF. При достижении стационарного состояния вируса животных подвергали однократному воздействию 1 миллиграмма внутрибрюшинной дозы гуманизированного антитела против CCR5 (PRO140) или изотипического контрольного антитела и следили за плазматической РНК HIV (Roche Amplicor Assay).
Фигура 12:
Продолжительное уменьшение вирусной нагрузки:
Мышей SCID восстанавливали нормальными человеческими PBMC и инфицировали HIV-1JR-CSF. При достижении стационарного состояния вируса животных каждые трое суток подвергали воздействию 0,1 мг внутрибрюшинных доз гуманизированного антитела против CCR5 (PRO140) и следили за плазматической РНК HIV (Roche Amplicor Assay).
Фигура 13:
Демонстрирует, что при применении полученного по данному изобретению антитела против CCR5 (PRO140) уменьшения лимфоцитов не наблюдали.
Фигура 14:
Гуманизированное антитело против CCR5 (PRO140) эффективно блокирует опосредованное CCR5 слияние клетка с HIV-1-клетка.
Мышиное антитело против CCR5 гуманизировали с применением способа прививки определяющих комплементарность областей (CDR) и замен в каркасе. Гуманизированные антитела против CCR5 (PRO140 №1 и PRO140 №2) экспрессировали в клетках Sp2/0, очищали посредством хроматографии с белком A и тестировали на способность блокировать опосредованное репликацией env HIV-1JR-FL слияние мембран, как описано (Litwin, et al., J. Virol., 70:6437, 1996).
Фигура 15:
Гуманизированное антитело против CCR5 (PRO140) опосредует эффективное, независимое от подтипа ингибирование HIV-1.
Антитела против CCR5 (PRO140 №1 и №2) по данному изобретению тестировали на их способность блокировать репликацию HIV-1 дикого типа в мононуклеарных клетках периферической крови (PBMC), как описано (Trkola et al., J. Virol., 72:396, 1998). Степень репликации вируса измеряли посредством оценки содержания антигена p24 в супернатантах 7-дневных культур PBMC.
Фигура 16:
На данной фигуре представлена карта плазмиды pVK-HuPRO140, кодирующей вариабельную область легкой цепи, представленной на фигуре 8, а также константные области человеческой Каппа, как описано у Co et al., J. Immunol., 148:1149, 1992.
Фигура 17:
На данной фигуре представлена карта плазмиды pVg4-HuPRO140 HG2, кодирующей вариабельную область тяжелой цепи, представленной на фигуре 9, а также константные области человеческих тяжелых цепей человека, CH1, шарнирный участок, CH2 и CH3 IgG4, как описано у He et al., J. Immunol., 160:1029 (1998).
Фигура 18:
На данной фигуре представлена карта плазмиды pVg4-HuPRO140 (mut B+D+I), кодирующей вариабельную область тяжелой цепи, представленной на фигуре 10, а также константные области человеческих тяжелых цепей, CH1, шарнирный участок, CH2 и CH3 человеческого IgG4, как описано у He et al., J. Immunol., 160:1029 (1998).
Фигура 19:
Hu PRO140 блокирует HIV-1, но не передачу сигнала RANTES
Антитела PRO140 по данному изобретению тестировали на их способность блокировать индуцируемую RANTES мобилизацию кальция в CCR5+-клетках L1.2 (Olson, et al., J. Virol., 72:396, 1998). На данной фигуре показано, что гуманизированное антитело против CCR5 (PRO140) блокирует HIV-1, но не передачу сигнала RANTES.
Подробное описание изобретения
Плазмиды, обозначенные как HuPRO140-VK, HuPRO140 (mut+B+D+I)-VH и HuPRO140 HG2-VH, которые на фигурах 16, 18 и 17 обозначены как pVK-HuPRO140, pVg4-HuPRO140 (mut B+D+I) и pVg4-HuPRO140 HG2 соответственно, депонировали в Американской коллекции типовых культур (АТСС), Manassas, Va., U.S.A. 20108 22 февраля 2002 года под инвентарными номерами ATCC PTA 4097, PTA 4099 и PTA 4098 соответственно. Данные депонирования осуществлены в соответствии с условиями будапештского соглашения о международном признании депонирования микроорганизмов для цели процедуры выдачи патентов (будапештское соглашение).
Данное изобретение относится к композиции для ингибирования инфицирования HIV-1, содержащей, по меньшей мере, два соединения в обладающих синергическим эффектом для ингибирования инфицирования HIV-1 количествах, где, по меньшей мере, одно из двух соединений предотвращает продуктивное взаимодействие между HIV-1 и корецептором для слияния с HIV-1.
Как применяют в настоящем описании, "композиция" означает смесь. Композиции включают в качестве неограничивающих примеров композиции, пригодные для перорального, ректального, интравагинального, местного, назального, глазного или парентерального введения субъекту. Как применяют в настоящем описании "парентеральный" включает в качестве неограничивающих примеров подкожную, внутривенную, внутримышечную или интрастернальную инъекции или способы инфузии.
Как применяют в настоящем описании, "HIV-1" означает вирус иммунодефицита человека типа 1. HIV-1 включает в качестве неограничивающих примеров внеклеточные вирусные частицы и формы HIV-1, найденные в инфицированных HIV-1 клетках.
Как применяют в настоящем описании, "инфицирование HIV-1" означает введение генетической информации HIV-1 в клетку-мишень, например, посредством слияния мембраны клетки-мишени с HIV-1 или клетки, несущей гликопротеин оболочки HIV-1. Клетка-мишень может представлять собой клетку организма субъекта. В предпочтительном осуществлении клетка-мишень представляет собой клетку организма человека.
Как применяют в настоящем описании, "ингибирование инфекции HIV-1" означает уменьшение количества HIV-1 - генетической информации, вводимой в популяцию клеток-мишеней, по сравнению с количеством, которое могло бы вводиться без указанной композиции.
Как применяют в настоящем описании, "соединение" означает молекулу, включая в качестве неограничивающих примеров пептиды, полипептиды и другие органические и неорганические молекулы и их сочетания.
Как применяют в настоящем описании, "обладающие синергическим эффектом" означает, что совместный эффект соединений при применении в сочетании выше, чем их суммарные эффекты при применении отдельно.
Как применяют в настоящем описании, "продуктивное взаимодействие" означает, что взаимодействие HIV-1 и корецептора для HIV-1 может вести к слиянию указанного HIV-1 или клетки, несущей гликопротеин оболочки HIV-1, и несущей данный корецептор мембраны.
Как применяют в настоящем описании, "предотвращает продуктивное взаимодействие" означает, что степень взаимодействия снижена по сравнению с той степенью, которая могла бы иметь место без данного соединения. Взаимодействия можно предотвратить посредством маскировки или изменения взаимодействующих областей на корецепторе или HIV-1 или посредством изменения экспрессии, агрегации, конформации или состояния ассоциации корецептора.
Как применяют в настоящем описании, "корецептор для слияния с HIV-1" означает клеточный рецептор, опосредующий слияние экспрессирующей рецептор клетки-мишени и HIV-1 или клетки, несущей гликопротеин оболочки HIV-1. Корецепторы для слияния с HIV-1 включают в качестве неограничивающих примеров CCR5, CXCR4 и другие рецепторы хемокинов.
Данное изобретение также относится к ингибирующей слияние HIV-1 или клетки, несущей гликопротеин оболочки HIV-1, с клеткой-мишенью композиции, содержащей, по меньшей мере, два соединения в количествах, обладающих синергическим эффектом для ингибирования слияния HIV-1 или клетки, несущей гликопротеин оболочки HIV-1 с клеткой-мишенью, где, по меньшей мере, одно из соединений предотвращает продуктивное взаимодействие между HIV-1 и корецептором для слияния с HIV-1.
Как применяют в настоящем описании, "слияние" означает соединение или объединение липидных двухслойных мембран, находящихся на клетках млекопитающих или таких вирусах, как HIV-1. Данный процесс отличается от присоединения HIV-1 к клеткам-мишеням. Присоединение опосредуется связыванием наружного гликопротеина HIV-1 с человеческим рецептором CD4, не являющимся корецептором для слияния.
Как применяют в настоящем описании, "ингибирует" означает, что количество по сравнению с количеством, которое могло бы иметь место без композиции, уменьшено.
Как применяют в настоящем описании, "клетка-мишень" означает клетку, способную подвергаться заражению HIV-1 или инфицированной HIV-1 клеткой или слиянию с ними.
Как применяют в настоящем описании "хемокин" означает цитокин, который может стимулировать перемещение лейкоцитов. Их можно классифицировать или как cys-cys, или как cys-X-cys, в зависимости от того расположены ли два аминоконцевых остатка цистеина непосредственно рядом друг с другом или разделены одной аминокислотой. Они включают в качестве неограничивающих примеров RANTES, MIP-1α, MIP-1β, SDF-1 или другой хемокин, блокирующий инфицирование HIV-1.
В одном осуществлении указанных выше композиций корецептор представляет собой рецептор хемокинов. В предпочтительном осуществлении указанных выше композиций рецептор хемокинов представляет собой CCR5 или CXCR4. Известно, что некоторые другие хемокиновые и родственные им рецепторы функционируют в качестве корецепторов для HIV и включают в качестве неограничивающих примеров CCR2, CCR3, CCR8, STRL33, GPR-15, CX3CR1 и APJ (69).
Как применяют в настоящем описании, "рецептор хемокинов" означает представителя гомологичного семейства семь раз пронизывающих мембрану клеточных поверхностных белков, связывающих хемокины.
Как применяют в настоящем описании, "CCR5" представляет собой рецептор хемокинов, связывающий представителей C-C-группы хемокинов, и аминокислотная последовательность которого содержит аминокислотную последовательность, представленную под инвентарным номером 1705896 в GenBank, и родственные полиморфные варианты.
Как применяют в настоящем описании, "CXCR4" представляет собой рецептор хемокинов, связывающий представителей C-X-C-группы хемокинов, и аминокислотная последовательность которого содержит аминокислотную последовательность, представленную под инвентарным номером 400654 в GenBank, и родственные полиморфные варианты.
В одном осуществлении указанных выше композиций, по меньшей мере, одно из соединений представляет собой непептидную молекулу. В одном осуществлении непептидная молекула представляет собой бицикламное соединение AMD3100. (16).
Как применяют в настоящем описании, "непептидная молекула" означает молекулу, не целиком состоящую из линейной последовательности аминокислот, соединенных пептидными связями. Однако непептидная молекула может содержать одну или несколько пептидных связей.
В одном осуществлении указанных выше композиций, по меньшей мере, одно из соединений представляет собой антитело. В одном осуществлении антитело представляет собой моноклональное антитело. В другом осуществлении антитело представляет собой антитело против рецептора хемокинов. В одном осуществлении антитело представляет собой антитело против CXCR4. В дополнительном осуществлении антитело против CXCR4 представляет собой 12G5. (43). В предпочтительном осуществлении антитело представляет собой антитело против CCR5. Антитело против CCR5 включает в качестве неограничивающих примеров PA8, PA9, PA10, PA11, PA12, PA14 и 2D7. В данной композиции соединения находятся в подходящем соотношении. Соотношение находится в диапазоне от 1:1 до 1000:1.
Моноклональные антитела PA8, PA9, PA10, PA11, PA12 и PA14 депонированы в соответствии с условиями и в удовлетворение требований будапештского соглашения о международном признании депонирования микроорганизмов для целей процедуры патентования в Американской коллекции типовых культур (ATCC), 10801 University Boulevard, Manassas, Virginia 20110-2209 2 декабря 1998 года под следующими инвентарными №№: в ATCC: № HB-12605 (PA8), № HB-12606 (PA9), № HB-12607 (PA10), № HB-12608 (P11), № HB- 12609 (PA12), № HB-12610 (PA14).
В другом осуществлении указанных выше композиций два или более соединений представляют собой антитела. В одном осуществлении изобретения антитела включают в качестве неограничивающих примеров PA8, PA9, PA10, PA11, PA12, PA14 и 2D7. В данной композиции антитела находятся в подходящем соотношении. Соотношение находится в диапазоне от 1:1 до 50:1.
Как применяют в настоящем описании, "антитело" означает содержащую две тяжелые цепи и две легкие цепи иммуноглобулиновую молекулу, распознающую антиген. Иммуноглобулиновая молекула может происходить из любого из общеизвестных классов, включающих в качестве неограничивающих примеров IgA, секреторный IgA, IgG и IgM. Подкласс IgG также хорошо известен специалистам в данной области и включает в качестве неограничивающих примеров человеческие IgGl, IgG2, IgG3 и IgG4. В виде примера он включает и встречающиеся в природе, и не встречающиеся в природе антитела. Конкретно, "антитело" включает поликлональные и моноклональные антитела и их моновалентные и бивалентные фрагменты. Кроме того, "антитело" включает химерные антитела, полностью синтетические антитела, одноцепочечные антитела и их фрагменты. Необязательно, антитело можно метить детектируемым маркером. Детектируемые маркеры включают, например, радиоактивные или флуоресцентные маркеры. Антитело может представлять собой человеческое антитело и отличное от человеческого антитело. Отличное от человеческого антитело можно гуманизировать рекомбинантными способами для уменьшения его иммуногенности у человека. Способы гуманизации антител известны специалистам в данной области.
Как применяют в настоящем описании, "моноклональное антитело", также обозначаемое как mAb, применяют для описания молекул антител, чьи первичные последовательности существенно идентичны и которые проявляют одинаковую антигенную специфичность. Моноклональные антитела можно получать посредством гибридомы, рекомбинантным, трансгенным и другими известными специалисту в данной области способами.
Как применяют в данном описании, "антитело против рецептора хемокинов" означает антитело, распознающее и связывающееся с эпитопом на рецепторе хемокинов. Как применяют в данном описании, "антитело против CCR5" означает моноклональное антитело, распознающее и связывающееся с эпитопом на рецепторе хемокинов CCR5.
Как применяют в настоящем описании, "подходящее соотношение" означает массовое или молярное соотношения, при которых соединения обладают синергическим эффектом.
В одном осуществлении указанных выше композиций, по меньшей мере, одно соединение представляет собой хемокин или производное хемокина. Хемокины включают в качестве неограничивающих примеров RANTES, MIP-1α, MIP-1β, SDF-1 или их сочетания. В данной композиции соединения находятся в походящем соотношении. Производные хемокинов включают в качестве неограничивающих примеров Met-RANTES, AOP-RANTES, RANTES 9-68 или их сочетания.
Как применяют в настоящем описании, "производное хемокина" означает химически модифицированный хемокин. Химические модификации включают в качестве неограничивающих примеров аминокислотные замены, добавления или делеции, добавления непептидных соединений или способы окисления. Специалист в данной области способен получить такие производные.
В другом осуществлении указанных выше композиций, по меньшей мере, одно соединение представляет собой антитело и, по меньшей мере, одно соединение представляет собой хемокин или производное хемокина. В данной композиции соединения находятся в подходящем соотношении. Соотношение находится в диапазоне от 100:1 до 1000:1.
В другом осуществлении указанных выше композиций, по меньшей мере, одно соединение связывается с субъединицей gp41 гликопротеина оболочки HIV-1. В одном осуществлении, по меньшей мере, одно соединение представляет собой пептидный ингибитор проникновения HIV-1 T-20 (70).
В другом осуществлении указанных выше соединений, по меньшей мере, одно из соединений ингибирует присоединение HIV-1 к клетке-мишени. В одном осуществлении, по меньшей мере, одно соединение связывается с CD4. В одном осуществлении, по меньшей мере, одно соединение представляет собой гликопротеин оболочки HIV-1. В одном осуществлении, по меньшей мере, одно соединение представляет собой антитело против CD4. В одном осуществлении, по меньшей мере, одно соединение связывается с гликопротеином оболочки HIV-1. В одном осуществлении, по меньшей мере, одно соединение представляет собой антитело к гликопротеину оболочки HIV-1. В одном осуществлении, по меньшей мере, одно соединение представляет собой основанный на CD4 белок. В одном осуществлении, по меньшей мере, одно соединение представляет собой CD4-IgG2.
В другом осуществлении указанных выше композиций, по меньшей мере, одно соединение представляет собой антитело и, по меньшей мере, одно соединение связывается с гликопротеином оболочки HIV-1. В одном осуществлении соединение представляет собой основанный на CD4 белок. В одном осуществлении соединение представляет собой CD4-IgG2. В данной композиции соединения находятся в подходящем соотношении. Соотношение находится в диапазоне от 1:1 до 10:1.
Как применяют в настоящем описании, "присоединение" означает процесс, опосредуемый связыванием гликопротеина оболочки HIV-1 с человеческим рецептором CD4, который не является корецептором для слияния.
Как применяют в настоящем описании, "CD4" означает зрелый, природный, связанный с мембраной белок CD4, содержащий цитоплазматический домен, гидрофобный трансмембранный домен и внеклеточный домен, связывающийся с гликопротеином оболочки HIV-1 gp120.
Как применяют в настоящем описании, "гликопротеин оболочки HIV-1" означает кодируемый HIV-1 белок, содержащий поверхностный белок gp120, трансмембранный белок gp41 и их олигомеры и предшественники.
Как применяют в настоящем описании, "основанный на CD4 белок" означает любой белок, содержащий, по меньшей мере, одну последовательность аминокислотных остатков, соответствующую той части последовательности CD4, которая необходима для формирования комплекса CD4 с гликопротеином оболочки HIV-1 gp120.
Как применяют в настоящем описании, "CD4-IgG2" означает гетеротетрамерный гибридный белок человеческого IgG2 и CD4 кодируемый экспрессирующим вектором, депонированным под инвентарными номерами ATCC 75193 и 75194.
В одном осуществлении указанных выше композиций, по меньшей мере, одно из соединений содержит полипептид, связывающийся с эпитопом CCR5. В одном осуществлении эпитоп расположен на N-конце одной из трех областей внеклеточных петель или их сочетаний. В одном осуществлении эпитоп расположен на N-конце. Эпитоп может содержать N13 и Y15 на N-конце. Эпитоп может содержать Q4 на N-конце. В другом осуществлении эпитоп содержит остатки на N-конце и во второй внеклеточной петле. Эпитоп может содержать D2, Y3, Q4, S7, P8 и N13 на N-конце и Y176 и T177 во второй внеклеточной петле. Эпитоп может содержать D2, Y3, Q4, P8 и N13 на N-конце и Y176 и T177 во второй внеклеточной петле. Эпитоп может содержать D2 на N-конце и R168 и Y176 во второй внеклеточной петле. В одном осуществлении эпитоп расположен во второй внеклеточной петле. Эпитоп может содержать Q170 и K171 во второй внеклеточной петле. Эпитоп может содержать Q170 и E172 во второй внеклеточной петле.
Как применяют в настоящем описании, на всем его протяжении для обозначения конкретных аминокислот применяют следующие стандартные сокращения:
Как применяют в настоящем описании, "полипептид" означает две или более аминокислоты, связанных пептидной связью.
Как применяют в настоящем описании, "эпитоп" означает часть молекулы или молекул, формирующую поверхность для связывания антител или других соединений. Эпитоп может содержать смежные или несмежные аминокислоты, углеводы или другие непептидные группы или специфичные для олигомера поверхности.
Как применяют в настоящем описании, "N-конец" означает последовательность аминокислот, охватывающую начальный метионин и первую трансмембранную область.
Как применяют в настоящем описании, "вторая внеклеточная петля" означает последовательность аминокислот, охватывающую четвертую и пятую трансмембранные области и представленную на поверхности.
В одном осуществлении указанных выше композиций, по меньшей мере, одно из соединений содержит легкую цепь антитела. В другом осуществлении указанных выше композиций, по меньшей мере, одно из соединений содержит тяжелую цепь антитела. В другом осуществлении указанных выше композиций, по меньшей мере, одно из соединений содержит Fab-фрагмент антитела. В другом осуществлении указанных выше композиций, по меньшей мере, одно из соединений содержит вариабельный домен антитела. В другом осуществлении антитело получают в виде антитела из единственного полипептида или "единичной цепи", которая содержит вариабельные домены тяжелой и легкой цепи, генетически сцепленные посредством промежуточной последовательности аминокислот. В другом осуществлении указанных выше композиций, по меньшей мере, одно из соединений содержит одну или несколько частей CDR антитела.
Как применяют в настоящем описании, "тяжелая цепь" означает более большой полипептид молекулы антитела, состоящий из одного вариабельного домена (VH) и трех или четырех константных доменов (CH1, CH2, CH3 и CH4) или их фрагментов.
Как применяют в настоящем описании, "легкая цепь" означает более маленький полипептид молекулы антитела, состоящий из одного вариабельного домена (VL) и одного константного домена (CL) или их фрагментов.
Как применяют в настоящем описании, "Fab" означает моновалентный связывающий антиген фрагмент иммуноглобулина, состоящий из одной легкой цепи и части тяжелой цепи. Его можно получить кратковременным расщеплением папаином или рекомбинантными способами.
Как применяют в настоящем описании, "F(ab')2" означает бивалентный связывающий антиген фрагмент иммуноглобулина, состоящий из обеих легких цепей и части обеих тяжелых цепей. Его можно получить кратковременным расщеплением пепсином или рекомбинантными способами.
Как применяют в настоящем описании, "CDR" или "определяющая комплементарность область" означает высоковариабельную последовательность аминокислот в вариабельном домене антитела.
Данное изобретение относится к указанным выше композициям и фармацевтически приемлемому носителю. Фармацевтически приемлемые носители хорошо известны специалистам в данной области. Такие фармацевтически приемлемые носители могут включать в качестве неограничивающих примеров водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей представляют собой пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, солевые и буферные среды. Парентеральные носители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактат Рингера или жирные масла. Внутривенные носители включают жидкие и питательные добавки, добавки электролитов, такие как добавки, основанные на декстрозе Рингера и т.п. Также могут присутствовать консерванты и другие добавки, такие как, например, противомикробные препараты, антиоксиданты, хелатирующие средства, инертные газы и т.п.
Данное изобретение относится к способу лечения пораженного HIV-1 субъекта, который включает введение субъекту эффективной дозы указанных выше композиций.
Как применяют в настоящем описании, "субъект" означает любое животное или искусственно модифицированное животное, способное заразиться HIV. Искусственно модифицированное животное включает в качестве неограничивающих примеров мышей SCID с человеческими иммунными системами. Животные включают в качестве неограничивающих примеров мышей, крыс, собак, морских свинок, хорьков, кроликов и приматов. В предпочтительном осуществлении субъект представляет собой человека.
Как применяют в настоящем описании, "лечение" означает или замедление, остановку или обращение развития нарушения, вызванного HIV-1. В предпочтительном осуществлении "лечение" означает обращение развития до момента устранения нарушения. Как применяют в настоящем описании, "лечение" также означает снижение числа вирусных инфекций, снижение числа инфекционных вирусных частиц, снижение числа инфицированных вирусами клеток или облегчение симптомов, ассоциированных с HIV-1.
Как применяют в настоящем описании, "пораженный HIV-1" означает, что у субъекта присутствует, по меньшей мере, одна клетка, инфицированная HIV-1.
Как применяют в настоящем описании, "введение" можно осуществлять или проводить с применением любых известных специалистам в данной области способов. Способы могут включать внутривенный, внутримышечный или подкожный способы.
Доза композиции по изобретению варьирует в зависимости от субъекта и в зависимости от конкретного применяемого пути введения. Дозы могут находиться в диапазоне от 0,1 до 100000 мкг/кг. Основываясь на композиции, дозу можно доставлять непрерывно, например посредством непрерывного вливания, или через периодические интервалы. Например, при одном или нескольких отдельных удобных случаях. Специалист в данной области без чрезмерного экспериментирования может определить желательные временные интервалы для многократных доз конкретной композиции.
Как применяют в настоящем описании, "эффективная доза" означает достаточное количество или для лечения субъекта, или для предотвращения заражения субъекта HIV-1. Специалист в данной области может провести простые эксперименты по титрованию для определения количества, необходимого для лечения субъекта.
Данное изобретение относится к способу предотвращения заражения субъекта HIV-1, включающему введение субъекту эффективной дозы указанных выше композиций.
Как применяют в настоящем описании, "заражение HIV-1" означает инфицирование HIV-1, генетическая информация которого реплицируется в клетках-хозяевах и/или внедряется в них.
Данное изобретение относится к моноклональному антителу против CCR5. Антитело включает в качестве неограничивающих примеров следующее: PA8 (инвентарный номер в ATCC HB-12605), PA9 (инвентарный номер в ATCC HB-12606), PA10 (инвентарный номер в ATCC HB-12607), PA11 (инвентарный номер в ATCC HB-12608), PA12 (инвентарный номер в ATCC HB-12609) и PA14 (инвентарный номер в ATCC HB-12610).
Данное изобретение относится к гуманизированным формам указанных выше антител.
Как применяют в настоящем описании, "гуманизированный" описывает антитела, где некоторые, большинство или все аминокислоты вне областей CDR заменены на соответствующие аминокислоты, полученные из человеческих иммуноглобулиновых молекул. В одном осуществлении гуманизированных форм антител некоторые, большинство или все аминокислоты вне областей CDR заменены на аминокислоты, полученные из человеческих иммуноглобулиновых молекул, но некоторые, большинство или все аминокислоты в одной или нескольких областях CDR не изменены. Небольшие добавления, делеции, вставки, замены или модификации аминокислот являются допустимыми до тех пор, пока они не лишают антитела способности связываться с данным антигеном. Пригодные человеческие иммуноглобулиновые молекулы могут включать молекулы IgGl, IgG2, IgG3, IgG4, IgA и IgM. "Гуманизированное" антитело может сохранять сходную с первоначальным антителом антигенную специфичность, т.е., по настоящему изобретению, способность связываться с CCR5.
Специалисты в данной области знают, как получить гуманизированные антитела по данному изобретению. Различные публикации, некоторые из которых включены в качестве ссылки в данную заявку, также описывают то, как получить гуманизированные антитела. Например, описанные в патенте США № 4816567 (71) способы включают получение химерных антител с вариабельной областью из одного антитела и константной областью из другого антитела.
В патенте США № 5225539 (72) описан другой подход для получения гуманизированного антитела. В данном патенте описано применение технологии рекомбинантных ДНК для получения гуманизированного антитела, где CDR вариабельной области одного иммуноглобулина заменяют CDR иммуноглобулина с другой специфичностью так, что гуманизированное антитело может распознавать желательную цель, но его значимым образом не может распознать иммунная система человека. Конкретно, для прививки CDR в каркас применяют сайт-специфический мутагенез.
Другие подходы для гуманизации антитела описаны в патентах США №№ 5585089 (73) и 5693761 (74) и WO 90/07861, описывающих способы получения гуманизированных антител. Они несут одну или несколько CDR и, возможно, дополнительные аминокислоты из донорного иммуноглобулина и каркасную область из акцептирующего человеческого иммуноглобулина. В данных патентах описан способ увеличения аффинности антитела для желательного антигена. Некоторые аминокислоты в каркасе выбирают так, чтобы они являлись такими же аминокислотами, как аминокислоты на тех же позициях в доноре, а не в акцепторе. Конкретно, в данных патентах описано получение гуманизированного антитела, связывающегося с рецептором, посредством объединения CDR мышиного моноклонального антитела с каркасной и константной областями человеческого иммуноглобулина. Человеческие каркасные области можно выбрать так, чтобы максимизировать гомологию с мышиной последовательностью. Для идентификации аминокислот в каркасной области, возможно взаимодействующих с CDR или конкретным антигеном, можно применять компьютерную модель, а затем на данных позициях для создания гуманизированного антитела можно применять мышиные аминокислоты.
В указанных выше патентах 5585089, и 5693761, и WO 90/07861 (75) также предлагаются четыре возможных критерия, которые можно применять при конструировании гуманизированных антител. Первое предложение состояло в том, чтобы для акцептора применять каркас из конкретного человеческого иммуноглобулина, как можно более гомологичного донорному иммуноглобулину для гуманизации, или применять консенсусный каркас из множества человеческих антител. Второе предложение состояло в том, что если аминокислота в каркасе из человеческого иммуноглобулина необычна, а аминокислота донора в данной позиции типична для последовательностей у человека, то можно выбрать аминокислоту донора, а не акцептора. Третье предложение состояло в том, что в позициях, непосредственно примыкающих к 3 CDR в цепи гуманизированного антитела, можно выбирать аминокислоту донора, а не акцептора. Четвертое предложение представляло собой применение аминокислоты донора, находящейся в таких позициях каркаса, в которых предсказано, что у аминокислоты в трехмерной модели антитела атом боковой цепи расположен в 3Е от CDR, и предсказано, что она способна к взаимодействию с CDR. Указанные выше способы представлены только для иллюстрации некоторых способов, которые может применять специалист в данной области для получения гуманизированных антител. Аффинность и/или специфичность связывания гуманизированного антитела можно увеличить с применением методов направленной эволюции, как описано у Wu et al. (1999) J. Mol. Biol. 284:151 и в патентах США №№ 6165793, 6365408 и 6413774.
В одном осуществлении изобретения гуманизированная форма антитела содержит вариабельную аминокислотную последовательность легкой цепи, как указано в SEQ ID № 6. В другом осуществлении антитело содержит вариабельную аминокислотную последовательность тяжелой цепи, как указано в SEQ ID № 9. В дополнительном осуществлении антитело может содержать вариабельную аминокислотную последовательность тяжелой цепи, как указано в SEQ ID № 12.
В другом осуществлении гуманизированное антитело содержит вариабельную аминокислотную последовательность легкой цепи, как указано в SEQ ID № 6, и вариабельную аминокислотную последовательность тяжелой цепи, как указано в SEQ ID № 9. Альтернативно, антитело может содержать вариабельную аминокислотную последовательность легкой цепи, как указано в SEQ ID № 6, и вариабельную аминокислотную последовательность тяжелой цепи, как указано в SEQ ID № 12.
Вариабельные области гуманизированного антитела можно соединить, по меньшей мере, с частью иммуноглобулиновой константной области человеческого иммуноглобулина. В одном осуществлении гуманизированное антитело содержит константные области легкой цепи и тяжелой цепи. Константная область тяжелой цепи, как правило, включает CH1, шарнирный участок, CH2, CH3 и, иногда, область CH4. В одном осуществлении константные области гуманизированного антитела представляют собой области изотипа человеческого IgG4.
Данное изобретение относится к изолированным молекулам нуклеиновых кислот, кодирующим данные моноклональные антитела против CCR5 или их гуманизированные версии. Молекула нуклеиновой кислоты может представлять собой РНК, ДНК или кДНК. В одном осуществлении молекула нуклеиновой кислоты кодирует легкую цепь. В одном осуществлении молекула нуклеиновой кислоты кодирует тяжелую цепь. В одном осуществлении молекула нуклеиновой кислоты кодирует и тяжелую, и легкую цепи. В одном осуществлении одна или несколько молекул нуклеиновых кислот кодируют Fab-фрагмент. В одном осуществлении одна или несколько молекул нуклеиновых кислот кодируют CDR-фрагменты. В одном осуществлении молекула нуклеиновой кислоты кодирует вариабельный домен. В другом осуществлении молекула нуклеиновой кислоты кодирует вариабельный домен и один или несколько константных доменов.
Предпочтительно, аналоги приведенных для примера гуманизированных антител против CCR5 отличаются от приведенных для примера гуманизированных антител против CCR5 консервативными заменами аминокислот. С целями классификации замен аминокислот как консервативных или не консервативных, аминокислоты можно сгруппировать, как указано ниже: группа I (гидрофобные боковые цепи): met, ala, val, leu, ile; группа II (нейтральные гидрофильные боковые цепи): cys, ser, thr; группа III (кислые боковые цепи): asp, glu; группа IV (основные боковые цепи): asn, gln, his, lys, arg; группа V (остатки, влияющие на ориентацию цепи): gly, pro; и группа VI (ароматические боковые цепи): trp, tyr, phe. Консервативные замены включают замены аминокислот того же класса. Неконсервативные замены представляют собой замену представителя одного из данных классов на представителя другого.
Аналоги гуманизированных антител против CCR5 демонстрируют существенную идентичность аминокислотной последовательности с приведенными здесь для примера гуманизированным PRO140 №1 или гуманизированным PRO140 №2. Вариабельные области тяжелой и легкой цепи аналогов кодируются последовательностями нуклеиновых кислот, гибридизующимися с кодирующими вариабельные области тяжелой и легкой цепи гуманизированного PRO140 №1 или гуманизированного PRO140 №2 нуклеиновыми кислотами, или их вырожденными формами в жестких условиях.
Вследствие вырожденности генетического кода гуманизированное антитело против CCR5 по настоящему изобретению кодируется множеством последовательностей нуклеиновых кислот. В определенных осуществлениях антитело кодирует молекула нуклеиновой кислоты, высокогомологичная указанным выше молекулам нуклеиновых кислот. Предпочтительно гомологичная молекула нуклеиновой кислоты включает нуклеотидную последовательность, по меньшей мере, приблизительно на 90% идентичную предоставленной здесь нуклеотидной последовательности. Более предпочтительно, чтобы нуклеотидная последовательность была, по меньшей мере, приблизительно на 95% идентична, по меньшей мере, приблизительно на 97% идентична, по меньшей мере, приблизительно на 98% идентична или, по меньшей мере, приблизительно на 99% идентична предоставленной здесь нуклеотидной последовательности. Гомологию можно рассчитать с применением различного, находящегося в свободном доступе программного инструментария, хорошо известного специалисту в данной области. Примеры инструментария включают систему BLAST, доступную с web-страницы National Center for Biotechnology Information (NCBI) в National Institutes of Health.
Один из способов идентификации высокогомологичных нуклеотидных последовательностей представляет собой гибридизацию нуклеиновых кислот. Таким образом, изобретение также включает гуманизированные антитела против CCR5 со свойствами связываться с CCR5 и другими описанными здесь функциональными свойствами, которые кодируются молекулами нуклеиновых кислот, гибридизующимися с указанными выше молекулами нуклеиновых кислот в очень жестких условиях. Идентификации родственных последовательностей также можно добиться с применением полимеразной цепной реакции (ПЦР) и других способов амплификации, подходящих для клонирования родственных последовательностей нуклеиновых кислот. Предпочтительно, праймеры для ПЦР выбирают для амплификации частей интересующей последовательности нуклеиновой кислоты, например CDR.
Как применяют в настоящем описании, термин "очень жесткие условия" относится к известным в данной области параметрам. Параметры гибридизации нуклеиновых кислот можно найти в ссылках, в которых собрана информация о таких способах, например, Molecular Cloning: A Laboratory Manual, J. Sambrook, et al., eds., Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989, или Current Protocols in Molecular Biology, F. M. Ausubel, et al., eds., John Wiley & Sons, Inc., New York. Один из примеров очень жестких условий представляет собой гибридизацию при 65 градусах по Цельсию в гибридизационном буфере (3,5× SSC, 0,02% фиколл, 0,02% поливинилпирролидон, 0,02% бычий сывороточный альбумин, 2,5 мМ NaH2PO4 (pII7), 0,5% SDS, 2 мМ ЭДТА). SSC представляет собой 0,15 М хлорид натрия/0,015 М цитрат натрия, pH 7; SDS представляет собой додецилсульфат натрия, а ЭДТА представляет собой этилендиаминтетрауксусную кислоту. После гибридизации мембрану, на которую перенесена нуклеиновая кислота, отмывают, например, в 2× SSC при комнатной температуре и затем в 0,1-0,5× SSC/0,1× SDS при температурах до 68 градусов по Цельсию.
Последовательности нуклеиновых кислот экспрессируются в хозяевах после того, как последовательности функционально связывают (т.е. располагают так, чтобы гарантировать функционирование) с контролирующей экспрессию последовательностью. Данные экспрессирующие векторы, как правило, реплицируются в организмах-хозяевах или как эписомы, или как интегральная часть хромосомной ДНК хозяина. Как правило, экспрессирующие векторы содержат селектируемые маркеры, например, тетрациклин или неомицин, для обеспечения определения того, что данные клетки трансформированы желательными последовательностями ДНК (см., например, патент США № 4704362, включенный сюда в качестве ссылки).
E. coli представляет собой прокариотического хозяина, особенно пригодного для клонирования последовательностей ДНК по настоящему изобретению. Другие пригодные для применения микробные хозяева включают бацилл, таких как Bacillus subtilus, и других энтеробактерий, таких как Salmonella, Serratia и различные виды Pseudomonas. В данных прокаритических хозяевах также можно получить экспрессирующие векторы, как правило, содержащие контролирующие экспрессию последовательности, совместимые с данной клеткой-хозяином (например, начало репликации). Кроме того, может присутствовать любое число из множества хорошо известных промоторов, таких как лактозная промоторная система, триптофановая (trp) промоторная система, β-лактамазная промоторная система или промоторная система фага. Промоторы, как правило, контролируют экспрессию, необязательно, при помощи операторной последовательности, и несут последовательности сайта связывания с рибосомой и т.п. для инициации и завершения транскрипции и трансляции.
Также пригодными для экспрессии могут являться другие микроорганизмы, такие как дрожжи. Предпочтительным хозяином являются Saccharomyces, с пригодными векторами, обладающими контролирующими экспрессию последовательностями, например промоторами, включающими 3-фосфоглицераткиназу или другие гликолитические ферменты и начало репликации, терминаторные последовательности и т.п., как необходимо.
Кроме микроорганизмов для экспрессии и получения полипептидов по настоящему изобретению также можно применять тканевую клеточную культуру млекопитающего (см., Winnacker, "From Genes to Clones", VCH Publishers, New York, New York (1987)). По существу эукариотические клетки являются предпочтительными, так как в данной области разработан ряд пригодных линий клеток-хозяев, способных к секреции интактных иммуноглобулинов, и они включают линии клеток CHO, различные линии клеток COS, клетки HeLa, предпочтительно линии клеток миеломы, и т.п. и трансформированные B-клетки или гибридомы. Экспрессирующие векторы для данных клеток могут включать контролирующие экспрессию последовательности, такие как начало репликации, промотор, энхансер (Queen, et al., Immunol. Rev., 89, 49-68 (1986), включенная в настоящее описание в качестве ссылки) и необходимые участки обработки информации, такие как сайты связывания рибосом, сайты сплайсинга РНК, сайты полиаденилирования и последовательности терминации транскрипции. Предпочтительные контролирующие экспрессию промоторы представляют собой промоторы, полученные из генов иммуноглобулинов, SV40, аденовируса, цитомегаловируса, вируса папилломы крупного рогатого скота и т.п.
Содержащие интересующие участки ДНК векторы (например, кодирующие тяжелую и легкую цепи последовательности и последовательности, контролирующие экспрессию) можно перенести в клетку-хозяина при помощи общеизвестных способов, изменяющихся в зависимости от типа клеточного хозяина. Например, для прокариотических клеток, как правило, применяют трансфекцию с хлоридом кальция, тогда как для других клеточных хозяев можно применять обработку фосфатом кальция или электропорацию (в общих чертах см. Maniatis et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press (1982), включенный сюда в качестве ссылки).
После экспрессии, целые антитела, их димеры, отдельные легкие и тяжелые цепи или другие формы иммуноглобулинов по настоящему изобретению можно очистить стандартными способами данной области, включающими осаждение сульфатом аммония, аффинные колонки, хроматографию на колонке, гель-электрофорез и т.п. (в общих чертах см. R. Scopes, "Protein Purification", Springer-Verlag, New York (1982)). Для фармацевтических применений предпочтительны в значительной степени очищенные иммуноглобулины, по меньшей мере, приблизительно от 90 до 95% гомогенности, а наиболее предпочтительно - от 98 до 99% гомогенности. После частичной очистки или очистки до гомогенности, как желательно, полипептиды затем можно применять терапевтически (включая экстракорпоральное применение) или для разработки и проведения процедур анализа, иммунофлюоресцентных окрашиваний и т.п. (в общих чертах см. Immunological Methods, Vols. I and II, Lefkovits and Pernis, eds., Academic Press, New York, New York (1979 и 1981)).
Для целей диагностики или детекции антитела могут быть или мечеными или немечеными. Немеченые антитела можно применять в сочетании с другими мечеными антителами (вторичными антителами), взаимодействующими с гуманизированным антителом, такие как антитела, специфичные к константным областям человеческого иммуноглобулина. Альтернативно, антитела можно метить непосредственно. Можно применять широкое множество меток, например радиоизотопы, флуоресцирующие средства, ферменты, субстраты ферментов, кофакторы ферментов, ингибиторы ферментов, лиганды (особенно гаптены) и т.п. Для определения экспрессирующих CCR5 клеток или определения изменения CCR5 на клетках, способных экспрессировать CCR5, доступны и хорошо известны специалистам в данной области многочисленные типы иммунологических анализов.
Настоящее изобретение также относится к конъюгатам фрагмент антитела-полимер, с видимым размером или молекулярной массой, увеличивающими время полужизни в сыворотке, увеличивающими среднее время удержания в системе циркуляции (MRT) и/или уменьшающими клиренс из сыворотки по сравнению с недериватизированными фрагментами антител.
Конъюгаты фрагмент антитела-полимер по изобретению можно получить дериватизацией желательного фрагмента антитела инертным полимером. Ясно, что для применения в конструировании конъюгатов фрагмент антитела-полимер по изобретению пригоден любой инертный полимер, обеспечивающий конъюгат желательного среднего размера или обладающий выбранной фактической молекулярной массой.
Для применения в лекарственных препаратах пригодно множество инертных полимеров. См., например, Davis et al., Biomedical Polymers: Polymeric Materials and Pharmaceuticals for Biomedical Use, pp. 441-451 (1980). Во всех осуществлениях изобретения применяют небелковые полимеры. Небелковый полимер, как правило, представляет собой гидрофильный синтетический полимер, т.е. полимер, иначе в природе не встречающийся. Однако также пригодны полимеры, существующие в природе и полученные рекомбинантными способами или способами in vitro, а также полимеры, выделенные из природных источников. В объем данного изобретения попадают гидрофильные поливиниловые полимеры, например поливиниловый спирт и поливинилпирролидон. Особенно пригодными являются полиалкиленовые сложные эфиры, такие как полиэтиленгликоль (PEG); полиоксиалкилены, такие как полиоксиэтилен, полиоксипропилен и блоксополимеры полиоксиэтилена и полиоксипропилена (Pluronics); полиметакрилаты; карбомеры; разветвленные или неразветвленные полисахариды, содержащие сахаридные мономеры D-маннозы, D- и L-галактозы, фукозы, фруктозы, D-ксилозы, L-арабинозы, D-глюкуроновой кислоты, сиаловой кислоты, D-галактуроновой кислоты, D-маннуроновой кислоты (например, полиманнуроновая кислота или альгиновая кислота), D-глюкозамина, D-галактозамина, D-глюкозы и нейраминовой кислоты; включающие гомополисахариды и гетерополисахариды, такие как лактоза, амилопектин, крахмал, гидроксиэтилкрахмал, амилоза, декстрансульфат, декстран, декстрины, гликоген, или полисахаридную подгруппу кислых мукополисахаридов, например гиалуроновую кислоту, полимеры сахарных спиртов, такие как полисорбит и полиманнит, гепарин или гепарон. Полимер до перекрестного связывания не обязательно должен являться, но предпочтительно является, водорастворимым, но полученный в результате конъюгат должен являться водорастворимым. Предпочтительно, чтобы конъюгат проявлял растворимость в воде, по меньшей мере, приблизительно 0,01 мг/мл и более предпочтительно - по меньшей мере, приблизительно 0,1 мг/мл, а еще более предпочтительно - по меньшей мере, приблизительно 1 мг/мл. Кроме того, полимер не должен ни являться высокоиммуногенным в форме конъюгата, ни обладать вязкостью, т.к. это не совместимо с внутривенным вливанием или внутривенной инъекцией, если конъюгат предназначен для введения такими путями.
В одном осуществлении полимер содержит только одну взаимодействующую группу. Это помогает избежать перекрестного связывания белковых молекул. Однако в объем данного изобретения входит максимальное улучшение условий реакции для уменьшения перекрестного связывания или для очистки продуктов реакции гель-фильтрацией или ионообменной хроматографией для получения по существу гомогенных производных. В других осуществлениях полимер содержит две или более взаимодействующих групп для целей связывания нескольких фрагментов антител с полимерной основой. Также можно применять гель-фильтрацию или ионообменную хроматографию для получения желательного производного по существу в гомогенной форме.
Молекулярная масса полимера может находиться в диапазоне приблизительно до 500000 Да и предпочтительно представляет собой, по меньшей мере, приблизительно 20000 Да, или, по меньшей мере, приблизительно 30000 Да, или, по меньшей мере, приблизительно 40000 Да. Выбранная молекулярная масса может зависеть от эффективного размера конъюгата, который необходимо получить, природы (например, структуры, такой как линейная или разветвленная) полимера и степени дериватизации, т.е. количества полимерных молекул на фрагмент антитела, и сайта или сайтов присоединения полимера на фрагменте антитела.
Полимер может являться ковалентно связанным с фрагментом антитела посредством многофункционального средства для образования перекрестных связей, взаимодействующего с полимером и одним или несколькими аминокислотными остатками фрагмента антитела, которые необходимо связать. Однако в объем изобретения также входит непосредственное образование перекрестных связей с полимером посредством взаимодействия дериватизирующего полимера с фрагментом антитела или наоборот.
Сайты образования ковалентных перекрестных связей на фрагменте антитела включают N-концевые аминогруппы и e-аминогруппы, находящиеся на остатках лизина, а также другие амино-, имино-, карбоксильные, сульфгидрильные, гидроксильные или другие гидрофильные группы. Полимер можно ковалентно связывать непосредственно с фрагментом антитела без применения многофункционального (как правило, бифункционального) средства для образования перекрестных связей, как описано в патенте США № 6458355.
Уровень замещения таким полимером, как правило, зависит от количества взаимодействующих сайтов на фрагменте антитела, молекулярной массы, гидрофильности и других характеристик полимера и конкретных выбранных участков дериватизации на фрагменте антитела. Как правило, конъюгаты содержат от 1 до 10 полимерных молекул, но также рассматривают большие количества полимерных молекул, присоединенных к фрагментам антител по изобретению. Желательного уровня дериватизации легко достичь, применяя экспериментальную матрицу, в которой для изменения степени замещения изменяют время, температуру и другие условия реакции, после чего уровень замещения полимером в конъюгатах определяют посредством гель-фильтрации или другими известными в данной области способами.
Функционализированные полимеры PEG для модификации фрагментов антител по изобретению доступны в Shearwater Polymers, Inc. (Huntsville, Ala.). Такие коммерчески доступные производные PEG включают в качестве неограничивающих примеров амино-PEG, сложные эфиры PEG с аминокислотами, PEG-гидразид, PEG-тиол, PEG-сукцинат, карбоксиметилированный PEG, PEG-пропионовая кислота, PEG-аминокислоты, PEG-сукцинимидилсукцинат, PEG-сукцинимидилпропионат, сукцинимидиловый сложный эфир карбоксиметилированного PEG, PEG-сукцинимидилкарбонат, сукцинимидиловые сложные эфиры PEG-аминокислот, PEG-оксикарбонилимидазол, PE-нитрофенилкарбонат, PEG-трезилат, PEG-глицидный эфир, PEG-альдегид, PEG-винилсульфон, PEG-малеинимид, PEG-ортопиридилдисульфид, гетерофункциональные PEG, виниловые производные PEG, силаны PEG и фосфолиды PEG. Условия реакции для связывания данных производных PEG варьируются в зависимости от белка, желательного уровня PEGилирования и применяемого производного PEG. Некоторые факторы, касающиеся выбора производных PEG, включают желательный участок присоединения (например, лизин или цистеиновые R-группы), устойчивость к гидролизу и реактивность производных, стабильность, токсичность и антигенность связи, стабильность для анализа и т.п. Точные инструкции для применения любого конкретного производного доступны у производителя. Конъюгаты по данному изобретению отделяют от не вступивших во взаимодействие исходных веществ гель-фильтрацией или ионообменной высокоэффективной хроматографией.
Антитела против CCR5 или их фрагменты можно применять в сочетании с одним или несколькими дополнительными противовирусными средствами, выбранными из группы, состоящей из ненуклеозидных ингибиторов обратной транскриптазы (NNRTI), нуклеозидного ингибитора обратной транскриптазы, ингибитора протеазы HIV-1, ингибитора проникновения вируса или их сочетаний.
Известные соединения NNRTI, которые можно применять в композиции по настоящему изобретению, включают в качестве неограничивающих примеров эфавиренз, UC-781, HBY 097, невирапин (11-циклопропил-5,11-дигидро-4-метил-6H-дипиридо[3,2-b:2'3'-][1,4]диазепин-6-он), делавирдин ((Рескриптор™; Pharmacia Upjohn) (пиперазин,1-[3-[(1-метилэтил)амино]-2-пиридил]-4-[[5-[(метилсульфонил)амино]-1H-индол-2-ил]карбонил]-(монометансульфонат), SJ-3366 (1-(3-циклопентен-1-ил)метил-6-(3,5-диметилбензоил)-5-этил-2,4-пиримидиндион), MKC-442 (6-бензил-1-(этоксиметил)-5-изопропилурацил), GW420867x (S-3-этил-6-фтор-4-изопропоксикарбонил-3,4-дигидрохиноксалин-2(1H)-он; Glaxo), HI-443 (N'-[2-(2-тиофен)этил]-N'-[2-(5-бромпиридил)]тиомочевина) и т.п.
Нуклеозидные ингибиторы обратной транскриптазы, которые можно применять в композиции в сочетании, по меньшей мере, с одним антителом против CCR5 или его фрагментом по настоящему изобретению включают в качестве неограничивающих примеров абакавир (Зиаген™, GlaxoSmithKline) ((1S,cis)-4-[2- амино-6-(циклопропиламино)-9H-пурин-9-ил]-2-циклопентен-1-метанолсульфат (соль)), ламивудин (Эпивир™, GlaxoSmthKline) ((2R,cis)-4-амино-1-(2-гидроксиметил-1,3-оксатиолан-5-ил)-(1H)-пиримидин-2-он), зидовудин (Ретровир™; GlaxoSmithKline) (3'-азидо-3'-дезокситимидин), ставудин (Зерит; Bristol-Myers Squibb) (2',3'-дидегидро-3'-дезокситимидин), зацитабин (Хивид™; Roche Laboratories) (4-амиер-1-β-D2',3'-дидезоксирибофуранозил-2-(1H)-пиримидон), диданозин и т.п.
Ингибиторы протеазы HIV-1, которые можно применять в композиции в сочетании с антителом против CCR5 или его фрагментами по настоящему изобретению, включают в качестве неограничивающих примеров лопинавир (1S-[1R*,(R*),3R*,4R*]]-N-4-[[(2,6-диметилфенокси)ацетил]амино]-3-гидрокси-5-фенил-1-(фенилметил)пентил]тетрагидро-α-(1-метилэтил)-2-оксо-1-(2H)-пиримидинацетамид), саквинавир (N-трет-бутилдекагидро-2-[2(R)-гидрокси-4-фенил-3(S)-[[N-(2-хинолилкарбонил)-L-аспарагинил]амино]бутил]-(4aS,8aS)-изохинолин-(3S)-карбоксамид), нелфинавира мезилат ([3S-[2 (2S*,3S*),3а,4β,8aβ]]-N-(1,1-диметилэтил)декагидро-2-[2-гидрокси-3-[(3-гидрокси-2-метилбензоил)амино]-4-(фенилтио)бутил]-3-изохинолинкарбоксамид монометансульфонат), индинавира сульфат (([1(1S,2R),5(S))]-2,3,5-тридезокси-N-(2,3-дигидро-2-гидрокси-1H-инден-1-ил)-5-[2-[[(1,1-диметилэтил)амино]карбонил]-4-(3-пиридинилметил)-1-пиперазинил]-2-(фенилметил)-D-эритропентонамида сульфата (1:1) соль), ампренавир ((3S)-тетрагидро-3-фурил-N-[(1S,2R)-3-(4-амино-N-изобутилбензолсульфонамидо)-1-бензил-2-гидроксипропил]карбамат), ритонавир ((10-гидрокси-2-метил-5-(1-метилэтил)-1-[2-(1-метилэтил)-4-тиазолил]-3,6-диоксо-8,11-бис(фенилметил)-2,4,7,12-тетраазатридекан-13-овая кислота, 5-тиазолилметиловый сложный эфир, [5S-(5R*,8R*,10R*,11R*)]) и т.п.
Ингибиторы слияния с HIV-1 или проникновения вируса, которые можно применять в сочетании с антителом против CCR5 или его фрагментами по настоящему изобретению, включают PRO 542 (Progenics Pharmaceuticals, Inc., Tarrytown, NY), T-20 (Trimeris, Inc., Durham, NC) (патенты США №№ 5464933; 6133418; 6020459), T-1249 (патенты США №№ 6345568; 6258782) и т.п.
Для лечения сочетанием антитело против CCR5 или его фрагмент по настоящему изобретению можно вводить субъекту до, после или одновременно с одним или несколькими традиционными противовирусными средствами.
Данное изобретение будет более понятным из приведенных ниже подробностей экспериментов. Однако специалист в данной области без труда поймет, что конкретные обсуждаемые способы и результаты приведены только для иллюстрации изобретения, описанного более полно в формуле изобретения, следующей далее.
Подробности экспериментов:
Пример 1
A. Материалы и методы
1) Реактивы
MAb 2D7 приобрели в Pharmingen (San Diego, CA), а CC- и CXC-хемокины получили из R&D Systems (Minneapolis, MN). CD4-IgG2 (1), растворимый(е) CD4 (2) и рекомбинантный gp120 HIV-1JR-FL получили из Progenics Pharmaceuticals, Inc. (59).
2) Выделение и очистка mAb против CCR5
CCR5+-клетки L1.2 (63) инкубировали 16 часов в присутствии 5 мМ бутирата натрия, активирующего транскрипцию с промотора цитомегаловируса (CMV), контролирующего экспрессию CCR5, что приводило к 10-кратному увеличению плотности корецептора на клеточной поверхности. Самок мышей Balb/c внутрибрюшинно иммунизировали 107 CCR5+-клеток L1.2 с 3-недельными интервалами и повторно иммунизировали внутривенным введением 107 L1.2 CCR5+-клетки за трое суток до удаления селезенки. Спленоциты сливали с клеточной линией Sp2/0. При первом скринировании протестировали супернатанты десяти тысяч культур гибридом; сто двадцать из них при анализе резонансного переноса энергии (RET), описанного ранее (19, 38), ингибировали опосредованное оболочкой HIV-1 слияние клеток PM1 (10), по природе экспрессирующих CCR5 и CD4, и клеток HeLa-EnvJR-FL +. Гибридомы, продуцирующие наиболее эффективно ингибирующие супернатанты и также окрашивающие CCR5+-клетки, субклонировали посредством лимитирующих разведений. Посредством Harlan Bioproducts из Science, Inc. (Indianapolis, IN) у мышей Balb/c, которым инъецировали гибридомы, продуцирующие mAb против CCR5 PA8, PA9, PA10, PA11, PA12 и PA14, получали асцитные жидкости. mAb по отдельности очищали до > 95% гомогенности преципитацией сульфатом аммония с последующей хроматографией с белком A. Все mAb ресуспендировали в фосфатно-солевом буфере (PBS) при конечной концентрации 5 мг/мл.
3) Анализ активируемой флуоресценцией сортировкой клеток (FACS) и картирование эпитопов mAb против CCR5
Для определения реакционной способности mAb PA8-PA12 и PA14 к клеточной поверхности с CCR5 применяли проточную цитометрию. Обработанные бутиратом натрия CCR5+-клетки L1.2 (106) в течение 20 мин инкубировали с 25 мкг антитела при 4°C в 50 мкл PBS Дульбекко (DPBS) с 0,1% азида натрия (NaN3). mAb 2D7 против CCR5 применяли в качестве положительного контроля, неспецифические мышиные IgG1 применяли в качестве отрицательного контроля. Клетки центрифугировали, отмывали и инкубировали с меченными фикоэритрином козьими антителами против IgG мышей (Caltag, Burlingame, CA), разведенными 1:100, в тех же условиях, что и первая инкубация с антителом. В заключение клетки анализировали проточной цитометрией. PBMC выделяли и стимулировали, как описано ранее (60), и окрашивали с применением аналогичных способов.
Аналогичную процедуру применяли для картирования эпитопов mAb против CCR5. Описана панель из семидесяти точковых мутантов по CCR5 (20, 24, 52). Кодирующие последовательности данных белков субклонировали в вектор pcDNA3.1 (Stratagene), с которого можно проводить транскрипцию под контролем 5' промотора полимеразы T7. Мутанты CCR5 на C-конце несут гемагглютининовую (HA) метку из 9 остатков для определения белка в клеточных лизатах или посредством проточной цитометрии. Клетки HeLa (2×106) 5 часов инкубировали в OPTI-MEM (Life Technologies, Gaithersburg, MD) с 20 мкг/мл липофектина и равным количеством экспрессирующей CCR5 дикого типа или мутантный CCR5 плазмиды. Затем клетки 12 часов инфицировали 2×107 p.f.u. vTF7 (23) для усиления экспрессии CCR5, отделяли 2 мМ этилендиаминтетрауксусной кислотой (ЭДТА) в PBS и однократно отмывали буфером для связывания (1% БСА, 0,05% NaN3 в DPBS). Поверхность клеток (2×106) метили mAb, как описано в предыдущем параграфе, однократно отмывали инкубационным буфером и 30 минут ресуспендировали в 1 мл 1× FACSlyse в воде (Becton Dickinson) при комнатной температуре для нарушения проницаемости клеточной мембраны. Затем клетки центрифугировали, отмывали инкубационным буфером и 1 час при 37°C инкубировали с 4 мкг/мл меченных флуоресцеин-изотиоционатом (FITC) мышиных mAb против HA (BabCo, Richmond, CA) для внутриклеточного мечения. В заключение клетки однократно отмывали буфером для связывания и однократно DPBS, ресуспендировали в 1% формальдегиде в PBS и анализировали проточной цитометрией. Количество связавшегося с мутантным CCR5 mAb определяли посредством уравнения (m.f.i. мутантного CCR5 с PE / m.f.i. wt CCR5 с PE) / (m.f.i. мутантного CCR5 с FITC /m.f.i. wt CCR5 с FITC) × l00%. Оно нормализует связывание mAb для уровней экспрессии мутантного корецептора.
4) анализ связывания gp120/sCD4
gp120 биотинилизировали с применением NHS-биотина (Pierce, Rockford, IL) согласно инструкциям производителя, а несвязавшийся биотин удаляли диафильтрацией. Обработанные бутиратом натрия CCR5+-клетки L1.2 1 час при комнатной температуре инкубировали с различными разведениями эквимолярной смеси sCD4 и биотинилированного gp120 или 1,25 мкг/мл sCD4 и 2,5 мкг/мл биотинилированного gp120, в присутствии различных концентраций mAb PA8-PA12, PA14, 2D7 против CCR5 или неспецифических мышиных IgG1 в DPBS с 0,1% NaN3. Клетки отмывали инкубационным буфером и 1 час при комнатной температуре инкубировали со стрептавидином-PE (Becton Dickinson), разведенным 1:50. В заключение клетки отмывали буфером для связывания и анализировали с применением устройства для считывания флуоресценции в планшетах (Perspective Biosystems, Framingham, MA).
5) Ингибирование опосредованного оболочкой слияния клетка-клетка и проникновения HIV-1 посредством mAb против CCR5
Опосредованное оболочкой HIV-1 слияние клеток HeLa-EnvJR-FL + и PM1 определяли с применением анализа RET. Равные количества (2×104) меченных флуоресцеин-октадециловым сложным эфиром (F18), экспрессирующих оболочку клеток и меченных октадецилродамином (R18) клеток PM1 помещали в 96-луночные планшеты в 15% фетальную телячью сыворотку в DPBS и 4 часа при 37°C инкубировали в присутствии различных концентраций mAb PA8-PA12, PA14, 2D7 против CCR5 или неспецифических мышиных IgG1. Флуоресценцию в RET измеряли при помощи Cytofluor plate-reader (PerSeptive Biosystems), а % RET определяли, как описано ранее (38).
Вирусы NLluc+env-, дополненные в trans гликопротеинами оболочки из JR-FL или Gun-1, получали как описано ранее (20). Клетки U87MG-CD4+CCR5+ (14) в присутствии различных концентраций отдельных mAb заражали химерными репортерными вирусами, содержащими 50-100 нг/мл p24. После 2 часов при 37°C содержащую вирусы среду заменяли свежей, содержащей mAb средой. Через 12 часов снова добавляли свежую среду без антител. После 72 часов в сумме к клеткам добавляли 100 мкл лизирующего буфера (Promega) и измеряли активность люциферазы (r.l.u.), как описано (20). Процент (%) ингибирования заражения HIV-1 определяли как [1-(r.l.u в присутствии антитела/r.l.u в отсутствие антитела)] × 100%.
6) Анализ передачи сигнала при помощи кальция
К обработанным бутиратом натрия CCR5+-клеткам L1.2 добавляли флуорохром Indo-1AM (Molecular Probes, Eugene, OR) в конечной концентрации 5 мкМ. После 30 мин инкубации при 37°C клетки однократно отмывали и ресуспендировали в буферном солевом растворе Хенкса. Клетки (106) последовательно стимулировали mAb против CCR5 или PBS и через 60 с. RANTES. MAb PA8-PA12 и PA14 применяли в концентрации 100 мкг/мл, 2D7 - при 20 мкг/мл и RANTES - при 250 нг/мл. Ингибирование выхода кальция посредством PA14 и 2D7 также тестировали для широкого диапазона концентраций mAb, находящихся в диапазоне от 0 до 100 мкг/мл. Мониторинг внутриклеточных уровней кальция проводили с применением флуоресцентного спектрофотометра Perkin-Elmer LS-50S посредством измерения соотношения испусканий флуоресценции при 402 нм (связанный краситель) и при 486 нм (свободный краситель) после возбуждения при 358 нм.
B. Результаты и обсуждение
1) Выделение моноклональных антител против CCR5 PA8, PA9, PA10, PA11, PA12 и PA14
Обнаружено, что соответствующие внеклеточным доменам CCR5 пептиды неэффективны для стимуляции специфических ответов в виде антител с высоким титром против нативного рецептора клеточной поверхности (50). Поэтому мышей Balb/C иммунизировали CCR5+-клетками L1.2, а супернатанты культур гибридом при анализе RET тестировали на их способность ингибировать опосредованное оболочкой JR-FL слияние мембран с CD4+CCR5+-клетками PM1 (19, 38). Хотя супернатанты, в количестве, значительно большем, чем сто, ингибировали слияние клетка-клетка более чем на 50%, только шесть, обозначенных PA8, PA9, PA10, PA11, PA12 и PA14, специфически и интенсивно окрашивали CCR5+-L1.2, но не родительские клетки L1.2, что продемонстрировано посредством проточной цитометрии (данные не показаны). Основываясь на предыдущем опыте, предположили, что другие способные ингибировать слияние клетка-клетка mAb, вероятно, направлены против молекул адгезии на клеточной поверхности, таких как LFA-1 (37). Посредством изотипирования с помощью ELISA (Cappell, Durham, NC) определили, что гибридомы PA8-PA12 и PA14 секретируют mAb IgG1. У мышей Balb/C, которым инъецировали данные шесть гибридом, получали асцитные жидкости, и очищали фракции IgG1. PA8, PA9, PA11, PA12 и PA14 продемонстрировали различные профили при изоэлектрической фокусировке, тогда как PA10 обладал очень сходным профилем с профилем PA9 и, следовательно, может представлять собой второй изолят того же mAb (данные не показаны).
2) Связывание MAb с CCR5+-клетками
Ни одно из очищенных mAb против CCR5 не окрашивало родительскую линию клеток L1.2 (данные не показаны). Однако mAb PA9-PA12 и PA14 окрашивали >90%, а PA8 окрашивали ≈70%, CCR5+-клеток L1.2, как определено проточной цитометрией, демонстрируя то, что они распознают CCR5 (фигура 1). mAb против CCR5 2D7, служившее в экспериментах авторов данного изобретения контролем, также окрашивало >90% CCR5+-клеток L1.2. PA8-PA12 и PA14 все представляют собой IgG1 и в равной степени хорошо взаимодействуют с козьими антителами против мышиных IgG, тогда как 2D7 представляет собой IgG2a и может взаимодействовать с репортерным антителом иначе. Следовательно, непосредственно сравнимыми являются средние интенсивности флуоресценции (m.f.i.) только для mAb PA8-PA12 и PA14. Порядок ранжирования средних интенсивностей флуоресценции (m.f.i.) представлял собой PA12 ≈ PA11 > (2D7=) PA14 ≈ PA10 ≈ PA9 > PA8. Различие между m.f.i. PA12 и m.f.i. PA8 являлось трехкратным. Различия в интенсивности окрашивания между PA8 и другими mAb оставались постоянными в широком диапазоне концентраций (данные не показаны) и, вероятно, не соответствуют различиям в аффинностях mAb к CCR5. Это означает, что PA8 взаимодействует только с подгруппой молекул CCR5, присутствующих на поверхности CCR5+-клеткок L1.2.
По сравнению с CCR5+-клетками L1.2 стимулированные митогеном PBMC проявляли различные профили окраски посредством mAb против CCR5. 2D7 и PA14 окрашивали >20%, PA11 и PA12 окрашивали ≈10%, PA8, PA9 и PA10 окрашивали <5% PBMC (фигура 1). Средние интенсивности флуоресценции окрашенных PBMC являлись примерно в десять раз ниже, чем средние интенсивности флуоресценции, полученные с CCR5+-клетками L1.2 для каждого mAb; их порядок ранжирования составлял (2D7 >) PA14 > PA12 ≈ PA11 ≈ PA10 ≈ PA9 ≈ PA8. Это снова немного отличалось от порядка реакционной способности, наблюдаемого для трансфектантов CCR5. Различие между m.f.i. PA9 и m.f.i. PA14 являлось семикратным. В других группах наблюдали сходные различия в способности mAb против CCR5 окрашивать стабильные CCR5+-клетки по сравнению с PBMC (28). Это может происходить вследствие специфичных для клеток различий в конформации, посттрансляционной модификации или олигомеризации CCR5. Альтернативно, для разных клеток может отличаться ассоциация с другими молекулами на клеточной поверхности. Так как очевидным выбором для такой молекулы мог быть антиген клеточной поверхности CD4, отсутствовавший на CCR5+-клетках L1.2 и присутствующий на PBMC, авторы данного изобретения также протестировали способность PA8-PA12, PA14 и 2D7 окрашивать клетки HeLa, транзиторно экспрессирующие CCR5 отдельно или вместе с CD4. В способности любого из mAb окрашивать CCR5 на клеточной поверхности в присутствии CD4 различий не наблюдали (данные не показаны). Если и существует ассоциация между данными двумя свойствами, в нее не вовлечены эпитопы, распознающиеся доступными авторам данного изобретения mAb против CCR5. Альтернативно, ассоциация между CCR5 и CD4 может существовать только на первичных лимфоцитах.
3) Картирование эпитопов mAb с применением аланиновых мутантов CCR5
Ни одно из антител не являлось способным детектировать редуцированный и денатурированный белок CCR5 при Вестерн-блоттинге, указывая на то, что они распознают конформационно-зависимые эпитопы (данные не показаны). С применением панели семидесяти аланиновых точковых мутантов по остаткам в Nt и ECL CCR5 проводили исследования по картированию эпитопов mAb. Клетки HeLa подвергали липофекции кодирующими последовательностями мутантного CCR5 или CCR5 дикого типа с добавленными на C-конце HA-метками и инфицировали vTF7 (23) для увеличения экспрессии корецептора. Затем клетки инкубировали с mAb против CCR5, а их связывание выявляли посредством меченных PE козьих антител против мышиных IgG. Во-вторых, проводили внутриклеточное окрашивание меченными FITC mAb против HA (BabCo). Данный внутренний контроль позволял непосредственную нормализацию окрашивания посредством mAb против CCR5 для уровней экспрессии мутантного корецептора на клеточной поверхности. Следовательно, связывание mAb с каждым мутантом выражено как процент от связывания с CCR5 дикого типа (фигура 4).
Определенные точковые мутации уменьшали связывание всех антител с CCR5 более чем на 50%. Как правило, данный класс мутантов, включающий мутантов по паре цистеинов C101A и C178A, мутантов по Y10A, D11A, K25A в Nt, мутантов по D95A в ECL1, мутантов по K171A/E172A, Q188A, K191A/N192A в ECL2, и мутантов по F263A и F264A в ECL3, больше всего влиял на PA8-PA12 и меньше влиял на PA14 и 2D7 (фигура 1). Одна из интерпретаций представляет собой то, что данные остатки сами по себе не являются частью эпитопов mAb, но изменение их на аланиновые остатки вызывает конформационные возмущения, оказывающие общий эффект на связывание всех mAb. Авторы данного изобретения предположили, что если мутация уменьшала связывание индивидуального mAb более чем на 75%, а также не уменьшала связывание большинства других антител, остаток, вероятно, являлся непосредственным участником эпитопа, распознаваемого данным mAb. С применением таких строгих принципов, заключили, что семь mAb против CCR5 распознают перекрывающиеся, но различные эпитопы (фигура 4). Связывание MAb PA8 с CCR5 зависело от N13 и Y15 в Nt. Для MAb PA9 и PA10 необходимыми являлись D2, Y3, Q4, P8 и N13 в Nt, и Y176 и T177 в ECL2. Также для MAb PA9 необходимым являлся S7 в Nt. Связывание MAb PA11 и PA12 зависело от Q4 в Nt. Для PA14 необходимыми являлись D2 в Nt и R168 и Y176 в ECL2. Наконец, для mAb 2D7 для того, чтобы связаться с CCR5, необходимыми являлись Q170 и K171/E172 в ECL2.
4) Передача сигнала хемокинами в присутствии mAb против CCR5
Связывающие рецепторы хемокинов средства могут являться антагонистами или, более редко, агонистами опосредованной рецепторами передачи сигналов внутри клетки. Альтернативно, они могут не оказывать никакого эффекта на передачу сигнала. CCR5 способен к связыванию с тремя CC-хемокинами, RANTES, MIP-1α и MIP-1β, и передавать сигнал, регулирующий цитозольные уровни кальция. Поэтому авторы данного изобретения протестировали активность различных концентраций mAb PA8-PA12, PA14 и 2D7 в качестве агонистов/антагонистов. Изменения внутриклеточных концентраций кальция измеряли в CCR5+-клетках L1.2 с введенным в них Indo-1. Отсутствие стимуляции посредством mAb изменения в (Ca2+)i означало, что они не являются агонистами CCR5. PA8-PA12 также являлись неспособными ингибировать выход Ca2+, индуцированный RANTES (фигура 5 и данные не показаны), даже при таких высоких концентрациях, как 100 мкг/мл, демонстрируя то, что они также не являются антагонистами. Данные концентрации обеспечивают насыщающее связывание mAb с CCR5+-клетками L1.2, как показано посредством проточной цитометрии и анализом связывания gp120/CCR5 (фигура 6D и данные не показаны). Однако mAb PA14 и 2D7 блокировали индуцированную RANTES мобилизацию кальция, хотя и с различными эффективностями (фигуры 5A, 5B). IC50 для ингибирования выхода кальция посредством PA14 составлял 50 мкг/мл, что приблизительно в 8 раз выше, чем IC50 для 2D7 (фигура 5B). Каждый из индуцированных RANTES, MIP-1α и MIP-1β выходов кальция ингибировался сходными концентрациями PA14 (данные не показаны). Ни одно из mAb не влияло на индуцированную SDF-1 мобилизацию кальция в CCR5+-клетках L1.2, эндогенно экспрессирующих CXCR4 (данные не показаны). Наконец, ни mAb, ни CC-хемокины не влияли на цитозольные уровни кальция в родительских клетках L1.2 (данные не показаны).
5) Ингибирование посредством mAb функции CCR5 в качестве корецептора
MAb PA8-PA12 и PA14 изначально выбрали на основании их способности ингибировать опосредованное оболочкой HIV-1 слияние клетка-клетка. Данную активность подтвердили и измерили для очищенных mAb. Как и ожидалось все шесть mAb, а также mAb 2D7 блокировали слияние клеток PM1 CD4+CCR5+ и клеток HeLa-EnvJR-FL + при анализе RET. Порядок ранжирования эффективности составлял 2D7 ≈ PA14 > PA12 > PA11 > PA10 ≈ PA9 ≈ PA8 (фигура 6A). Значения IC50 для PA14 и 2D7 составляли 1,7 мкг/мл и 1,6 мкг/мл соответственно, для PA11 и PA12 они составляли 25,5 мкг/мл и 10,0 мкг/мл, соответственно (фигура 3). PA8, PA9 и PA10 при 300 мкг/мл ингибировали слияние только на 10-15%. Ни одно из mAb не влияло на слияние клеток PM1 и клеток HeLa-EnvLAI +, экспрессирующих полноразмерный белок оболочки вируса X4 (данные не показаны).
Также тестировали способность различных mAb против CCR5 ингибировать проникновение прототипического вируса R5, JR-FL и вируса R5X4, Gun-1 в одном раунде, основанном на репликации люциферазы анализа проникновения. Порядок ранжирования эффективности в анализе проникновения являлся сходным с порядком, определенным в анализе слияния клетка-клетка (фигура 6B). Получить более чем 50% ингибирования проникновения JR-FL или Gun-1 с применением PA8-PA11 являлось невозможным. Значение IC50 для PA12 составляло 2,5 мкг/мл. Однако получить ингибирование проникновения при применении данного mAb более чем 60% не удавалось. Определили, что значения IC50 для ингибирования проникновения JR-FL для PA14 и 2D7 составляли 0,024 и 0,026 мкг/мл соответственно (фигура 3) и являлись в 60 раз меньшими, чем значения IC50, полученные в анализе слияния. Проникновение Gun-1, обладающего двойной тропностью, являлось в 2-3 раза более чувствительным к ингибированию посредством mAb против CCR5, чем проникновение JR-FL (данные не показаны).
MAb против корецептора могут ингибировать опосредованное оболочкой слияние, или непосредственно влияя на взаимодействие gp120/CCR5 или препятствуя стадиям после связывания, вовлеченным в формирование активного комплекса для слияния. Для определения механизма ингибирования слияния с вирусом и проникновения вируса посредством PA8-PA12 и PA14 тестировали способность различных mAb блокировать взаимодействие gp120/CCR5. Для этого применяли анализ, определяющий связывание с CCR5+-клетками L1.2 биотинилированных gp120 HIV-1JR-FL в комплексе с sCD4. Связывания биотинилированных gp120 в отсутствие sCD4 или CCR5, или когда применяли gp120 HIV-1LAI, не наблюдали (фигура 6C).
За исключением PA8 все mAb полностью нарушали связывание gp120/sCD4 с CCR5+-клетками L1.2 (Fig. 6D). Ингибирование посредством PA8 доходило до ≈40%, что совпадает с данными проточной цитометрии (фигура 1) в предположении, что данное mAb связывается только с подгруппой молекул CCR5 на CCR5+-клетках L1.2. MAb PA9, PA10, PA11 и PA12 ингибировали связывание со значениями IC50, составляющими 0,24, 0,13, 0,33, 0,24 мкг/мл, соответственно (фигура 3). Неожиданно mAb PA14 и 2D7 оказались двумя наименее эффективными ингибиторами связывания gp120/sCD4 со значениями IC50, составляющими 1,58 и 1,38 мкг/мл, соответственно (фигура 3). Следовательно, корреляции между способностью mAb ингибировать опосредованное gp120/CD4/CCR5 слияние мембран и проникновение и его способностью блокировать связывание gp120/sCD4 с корецептором не существовало.
6) Синергическое ингибирование слияния с HIV-1 сочетанием mAb против CCR5 и других ингибиторов проникновения вирусов
Специфичные к корецептору средства могут действовать на многих стадиях процесса проникновения вируса и проявлять неаддитивные эффекты, когда их применяют в сочетании. Исходя из перспективы для клинической практики, важно определить взаимодействия специфичных к корецептору кандидатов в лекарственные средства с эндогенными хемокинами, что может предоставить некоторый уровень защиты против развития заболевания. Поэтому mAb против CCR5 тестировали в сочетании с каждым другим mAb или с RANTES или с CD4-IgG2, связывающихся с gp120 HIV-1, для ингибирования присоединения к клеткам-мишеням. Для данных средств, применяемых индивидуально или в сочетании, в анализах слияния или проникновения получали кривые доза-ответ. Данные анализировали с применением принципа срединного эффекта (9). Концентрации индивидуальных средств или их сочетаний, необходимые для получения данного эффекта, количественно сравнивали при помощи условия, известного как комбинационный индекс (CI). Значение CI, большее чем 1, означает антагонизм, CI≈1 означает аддитивный эффект, а CI<1 означает синергический эффект, где присутствие одного средства усиливает эффект другого.
Сочетания PA12 и 2D7 являлись наиболее синергичными, со значениями CI в диапазоне от 0,02 до 0,29, в зависимости от соотношения антител (фигура 7 и фигура 2). Известно, что степень синергии изменяется в зависимости от стехиометрических соотношений средств. Результаты анализов слияния с вирусом и проникновения вируса при идентификации комбинаций mAb, являющихся высокосинергическими, PA12 и 2D7; умеренно синергическими, PA12 и PA14; аддитивными, PA11 и PA12, и слабо антагонистическими, PA14 и 2D7, как правило, совпадали. Отсутствие синергии между PA14 и 2D7 не является неожиданным, так как данные mAb взаимно конкурируют за связывание с CCR5+-клетками, как определено проточной цитометрией (данные не показаны). Наблюдение аддитивного эффекта между PA11 и PA12 может являться указанием на то, что данные mAb связываются в CCR5 с незначительно отличающимися эпитопами, при этом разделяя зависимость от остатка Q4 в Nt.
Также протестировали способность mAb PA12, PA14 и 2D7 к синергии с RANTES при блокировании слияния клетка-клетка. Сочетания PA12 и RANTES проявляли умеренную синергию (фигура 2). PA14 и 2D7 не проявляли синергии с RANTES, что согласуется с тем, что данные mAb являются ингибиторными для связывания и передачи сигнала RANTES (фигура 5A, 5B). Наконец, авторы данного изобретения протестировали синергию между mAb PA12, PA14, 2D7 и CD4-IgG2, которые взаимодействуют с gp120. Авторы данного изобретения наблюдали умеренную синергию между PA12 и CD4-IgG2, но отсутствие синергии между PA14 или 2D7 и CD4-IgG2 (фигура 2).
Обсуждение эксперимента
Выделено и охарактеризовано шесть мышиных mAb IgG1 против CCR5. Тогда как PA8, PA9, PA11, PA12 и PA14 представляют собой отдельные молекулярные разновидности, PA9 и PA10 являлись неразличимыми посредством анализов и, следовательно, вероятно, являются одним и тем же mAb. Все выделенные mAb распознают комплексные конформационные эпитопы, что часто имеет место с mAb, полученными против нативных белков клеточной поверхности. Картирование эпитопов проводили для всех mAb с применением панели аланиновых точковых мутантов CCR5. Предположили, что остатки, сходным образом влияющие на связывание всех mAb, вызывают конформационные возмущения в корецепторе и не являются частью эпитопов данных mAb. Показано, что только два таких остатка, Y10 и D11, влияют на проникновение HIV-1 (20, 52). Эпитопы PA8, PA11 и PA12 расположены исключительно в Nt-домене. В согласии с данным результатом при анализе ELISA PA8 являлся способным связываться с биотинилированным пептидом Nt, содержащим остатки от D2 до R31 (данные не показаны). Однако PA11 и PA12, связывание которых строго зависит только от Q4, не связывались с пептидом Nt в растворе (данные не показаны). Одним из возможных объяснений является то, что пептид Nt не принимает правильную конформацию для распознавания посредством PA11 и PA12, тогда как связывание PA8 может являться менее зависимым от конформации. Альтернативно, PA11 и PA12 могут взаимодействовать с теми остатками, которые не подвергались мутагенезу авторами данного изобретения, или формируют слабые связи с аминокислотами, расположенными в других доменах CCR5, или связываются с атомами в пептидной цепи, презентация которых не изменялась при мутагенезе. Антитела PA9, PA10 и PA14 распознавали эпитомы, включающие остатки и в Nt-, и в ECL2-доменах CCR5, тогда как эпитоп 2D7 располагался исключительно в домене ECL2.
Эпитоп PA14 содержит и D2 в Nt, и R168 в ECL2, что означает, что данные два остатка расположены близко один к другому по результатам футпринтинга mAb. Они даже могут непосредственно взаимодействовать один с другим посредством их противоположных зарядов.
MAb PA8-PA12 и PA14 окрашивали CCR5+-клетки с различными интенсивностями и зависящим от типа клетки способом. Все mAb, за исключением PA8, окрашивали более чем в 90% CCR5+-клетки L1.2, с наибольшей средней интенсивностью флуоресценции, наблюдаемой для PA11 and PA12. Однако PA14 и 2D7 окрашивали наибольший процент PBMC, а также создавали наибольшие средние интенсивности флуоресценции для данных клеток. Hill et al. (28) недавно охарактеризовали панель mAb против CCR5, которая сходным образом окрашивала трансфицированные клетки, но только два из восьми окрашивали PBMC и ни одно не окрашивало первичные моноциты. Низкая аффинность к CCR5, вероятно, объясняется отсутствием взаимодействия двух из mAb с первичными клетками, но маловероятно, что это является объяснением неспособности к реакции для остальных четырех. В панели mAb авторов данного изобретения авторы наблюдали наиболее интенсивное окрашивание PBMC посредством mAb 2D7 и PA14, обладающих эпитопами, расположенными целиком или частично в первых десяти остатках ECL2. Однако Hill et al. сообщали, что специфичные к Nt и ECL1 mAb окрашивают PBMC, тогда как специфичные к ECL2 и ECL3 mAb не окрашивают PBMC, так что непротиворечивый профиль реактивности не идентифицировали. Одним из объяснений зависимого от типа клетки окрашивания посредством mAb может являться то, что активированные PBMC (и моноциты) секретируют CC-хемокины, связывающиеся с CCR5 на клеточной поверхности, маскируя некоторые эпитопы mAb. Однако можно ожидать, что это окажется особенно справедливым для PA14 и 2D7, которые являются антагонистами индуцированной цитокинами мобилизации кальция и, возможно, конкурируют с CC-хемокинами за связывание с CCR5. Однако данные mAb окрашивают PBMC с наибольшей интенсивностью. Альтернативно, различная экспозиция эпитопа CCR5 может отражать специфичную для типа клетки олигомеризацию рецептора, ассоциацию с другими молекулами клеточной поверхности или различные посттрансляционные модификации, такие как гликозилирование. Авторы данного изобретения показали, что различия в связывании mAb, вероятно, не отражают специфичные для типов клеток различия во взаимодействиях CD4/CCR5.
MAb PA8-PA12 не ингибировали индуцированную CC-хемокинами мобилизацию кальция в CCR5+-клетках и не опосредовали передачу сигнала посредством CCR5. MAb 2D7 and PA14 являлись ингибиторами индуцированной CC-хемокинами мобилизации кальция, но 2D7 являлось почти на порядок более эффективным, чем PA14. Это может происходить потому, что эпитоп PA14 менее перекрывается со связывающим CC-хемокины доменом на CCR5, чем эпитоп 2D7. Все данные mAb также блокировали проникновение HIV-1 и опосредованное оболочкой HIV-1 слияние мембран, но ингибирование слияния клетка-клетка в некоторых случаях требовало почти на два порядка больше антитела, чем являлось необходимым для блокирования проникновения вируса. Вероятно, что во время слияния клетка-клетка устанавливается и действует совместно большее число взаимодействий gp120/CD4/CCR5, а также взаимодействий между молекулами адгезии, по сравнению со слиянием вирус-клетка, делая его более трудным для ингибирования. Как правило, это наблюдают для антител к LFA-1 или к гликопротеину оболочки HIV-1 (45, 51). PA8, PA9 и PA10 являлись неспособными блокировать слияния клетка-клетка более чем на 15% и проникновения вируса более чем на 40% даже при наибольших концентрациях антител. Однако более 90% ингибирования слияния являлось возможным достичь с применением PA11, PA12 и PA14, и более 90% ингибирования проникновения являлось возможным достичь с применением PA14. Наиболее эффективным из шести mAb при блокировании слияния и проникновения являлось PA14, являвшееся таким же эффективным, как 2D7. Неожиданно, PA14 и 2D7 являлись одними из наименее эффективных ингибиторов связывания gp120/sCD4 с CCR5+-клетками L1.2, тогда как PA9-PA12 блокировали со сходными эффективностями, а PA8 оказалось неспособным блокировать более чем 40% связывания gp120/sCD4. Данные наблюдения поднимают вопросы о природе молекул CCR5, представленных на различных клетках, и о механизмах ингибирования слияния с вирусом и проникновения вируса. Может быть, что CCR5 на клетках L1.2, применяемых в анализах связывания mAb и gp120, не находится в конформации, идентичной конформации CCR5 в PBMC, применяемых для анализа связывания mAb, или конформации CCR5 на клетках PM1 и U87MG, применяемых для анализов слияния и проникновения.
Слабое окрашивание PBMC и частичное ингибирование слияния и проникновения некоторыми из mAb авторов данного изобретения указывает на то, что они способны связываться только с подгруппой молекул CCR5, экспрессирующихся на клеточных линиях первичных лимфоцитов, PM1 и U87MG-CD4+CCR5+. Однако все mAb, кроме PA8, являются способными окрашивать более чем 90% CCR5+-клеток L1.2 и полностью блокировать связывание комплекса gp120/sCD4 с данными клетками. По меньшей мере, одно отличие между CCR5+-клетками L1.2 и другими клетками, которые использовали авторы данного изобретения, представляет собой плотность белка корецептора на клеточной поверхности. Действительно, авторы данного изобретения определили, что CCR5+-клетки L1.2 экспрессируют количество корецептора на клеточной поверхности от 10 до 100 раз большее, чем клетки PM1 и U87MG-CD4+CCR5+. Но когда клетки HeLa конструировали так, чтобы транзиторно экспрессировать такое же количество корецептора, как и в CCR5+-клеточной линии L1.2, авторы данного изобретения все еще не могли выявить связывание gp120/sCD4 с ними (данные не показаны). Следовательно, избыточная экспрессия CCR5 на L1.2 вместе с другими специфичными для клеток факторами может благоприятствовать конформации корецептора, которая заметно экспонирует Nt, делая его более доступным и для mAb, и для gp120. Такую конформацию могут индуцировать олигомеризация рецептора, ослабленные или измененные ассоциации с белками клеточной поверхности или взаимодействия рецептора с G-белками (25, 62). Могут ли несколько конформаций CCR5 совместно существовать на клеточной поверхности, и все ли они способствуют проникновению вируса? Профили реактивности mAb позволяют предположить такое, так как в присутствии концентраций mAb, насыщающих эпитопы, необходимые для связывания gp120 с CCR5+-клетками L1.2, может происходить проникновение HIV-1 и слияние с HIV-1, хотя и на меньших уровнях. Авторы данного изобретения поддерживают гипотезу, что представленные на CCR5+-клетках L1.2 молекулы корецептора обладают одной конформацией, подходящей для проникновения HIV-1, тогда как молекулы CCR5 на PBMC, PM1 и CCR5+U87MG находятся в нескольких подходящих для проникновения состояниях, что демонстрирует различные реакционные способности mAb. Тогда как PA14 и 2D7 могут распознавать все конформации, другие mAb не могут. Почему клетки L1.2 способствуют конкретной подходящей для слияния конформации, остается необходимым выяснить.
Недавно показано, что домен связывания с gp120 лежит в первых двадцати остатках Nt-домена CCR5. MAb к домену связывания с gp120 на CCR5 эффективно блокируют данное взаимодействие, но они не являются столь же эффективными при ингибировании слияния с HIV-1 и проникновения HIV-1 в клетки-мишени, как PA14 и 2D7, эпитопы которых лежат вне данной области. PA14 распознает конец Nt и остатки в ECL2, тогда как эпитоп 2D7 расположен исключительно в ECL2. О механизме действия данных mAb можно только строить предположения. Может быть, что их связывание с первыми немногими остатками ECL2 наводит конформационные изменения в корецепторе, что предотвращает слияние мембран. Альтернативно, блокада эпитопов в ECL2 может препятствовать олигомеризации корецептора и формированию подходящего для слияния комплекса белков. Еще одной возможностью является то, что остатки на ECL2 обращены внутрь поры слияния, а связывание mAb препятствует gp41 внедрить белок слияния в плазматическую мембрану. Напротив mAb PA8-PA12, вероятно, ингибируют слияние и проникновения только посредством создания непосредственного препятствия для связывания с комплексами gp120/CD4. Авторы данного изобретения не располагают сведениями о том, определяют ли другие, кроме экспозиции эпитопов и аффинности к CCR5, параметры эффективность ингибирования проникновения вируса данными mAb. Остается неясным, почему ингибирование последующих за взаимодействием gp120/корецептор стадий может являться более эффективным, чем непосредственное блокирование данного взаимодействия. Одним из возможных объяснений этому может являться предположение, что снижение связывания gp120 с CCR5 существенно меньше, чем повышение связывания mAb с CCR5. Таким образом, каждый раз, когда mAb отделяется от молекулы корецептора, ассоциированная с вирионом молекула gp120 замещает его квазинеобратимым способом, так как каждое взаимодействие ведет к слиянию мембран.
Синергия между сочетаниями mAb против CCR5, вероятно, представляет собой результат их взаимодействия с различными эпитопами, вовлеченными во взаимно независимые последовательные стадии проникновения HIV-1. Степень наблюдаемой синергии между PA12 и 2D7 (CI<0,1 при многих условиях) является необычной, так как значения CI<0,2 для сочетаний антител против HIV-1 (33, 35, 61), ингибиторов обратной транскриптазы (29) или ингибиторов протеазы (44) наблюдали редко. Ввиду его эффективности сочетание PA12:2D7 исследовали во многих видах анализов и при многих соотношениях концентраций, в которых последовательно наблюдали высокие уровни синергии. Умеренную синергию наблюдали для PA12, объединенного с PA14. Авторы данного изобретения наблюдали умеренную синергию между PA12 и CD4-IgG2. Комплекс CD4/gp120 метастабилен и, если он не способен взаимодействовать с рецептором, распадается до состояния, не способного к слиянию (45-48). Так как PA12 непосредственно блокирует участок связывания gp120 на CCR5, его присутствие может сдвинуть равновесие в сторону инактивации комплекса gp120/CD4. Это может объяснить, почему авторы данного изобретения наблюдали синергию между CD4-IgG2 и mAb PA12 по отношению к ингибированию слияния и проникновения. Отсутствие синергии между mAb PA14 и CD4-IgG2 позволяет предположить, что они действуют на двух непоследовательных и независимых стадиях проникновения вируса. Для определения точных механизмов синергии различных соединений в отношении ингибирования слияния с вирусом и проникновения вируса необходим комплекс дальнейших исследований.
Указанные выше результаты согласуются с моделью, в которой проникновение HIV-1 происходит в три различных стадии, включающих связывание рецептора, связывание корецептора и опосредованное корецептором слияние мембран. Предположить отдельные стадии связывания корецептора и слияния позволяет отсутствие корреляции между способностью моноклональных антител блокировать связывание gp120 и слиянием/проникновением HIV-1. Хронологию событий во время слияния дополнительно позволяют предположить профили наблюдаемой синергии. Такие средства как PA12, эффективно ингибирующие срединную стадию процесса, то есть связывание gp120, синергически действуют с ингибиторами предыдущей или последующей стадий.
Пример 2
Предпосылки: Увеличенная доля лекарственной полирезистентности HIV-1 заставляет искать новые классы средств против ретровирусов. CCR5 представляет собой необходимый для слияния первичных изолятов HIV-1 корецептор и является многообещающей целью для противовирусной терапии. PRO140 представляет собой моноклональное антитело против CCR5, эффективно ингибирующее проникновение и репликацию HIV-1 при концентрациях, не влияющих на активность рецептора хемокинов CCR5 in vitro. В настоящем исследовании авторы данного изобретения оценили терапевтический потенциал PRO140 in vivo с применением терапевтической модели заражения HIV-1 на животных.
Методы: Мышей CD-17 SCID восстанавливали нормальными человеческими PBMC и инфицировали изолятом R5 HIV-1JR-CSF. При достижении стационарного состояния вируса животных интраперитонеально подвергали воздействию PRO140 или контрольного антитела и следили за вирусной нагрузкой с применением Roche Amplicor Assay. В начальных исследованиях проверяли однократную дозу 1 мг PRO140. При исследовании многократных доз PRO140 вводили один раз каждые трое суток три недели при дозах, составляющих от 0,1 до 1,0 мг. В отдельном эксперименте для проверки возможности снижения количества лимфоцитов после инъекции PRO140 применяли проточную цитометрию.
Результаты: И однократная, и многократные дозы PRO140 уменьшали вирусные нагрузки до невыявляемых уровней у всех подвергнутых воздействию животных, и снижение вирусной нагрузки находилось в интервале до 1,8 log 10. После однократной инъекции PRO140 наблюдали временный контроль репликации вируса, тогда как многократные инъекции приводили к продолжительному контролю без признаков восстановления вируса в течение лечения. Наблюдали зависимые от дозы различия в кинетике опосредованных PRO140 уменьшений вирусной нагрузки. Анализ проточной цитометрией показал, что лечение посредством PRO140 не приводило к снижению количества лимфоцитов, подтверждая то, что влияние на вирусную репликацию in vivo происходило только из-за блокады CCR5.
Выводы: PRO140 является высокоэффективным для контроля полученного в модели инфекции HIV-1 у мышей hu-PBL-SCID заражения HIV-1. Данные факты предоставляют решающие эксперименты in vivo для лечения посредством PRO140, в частности, и для лечения ингибиторами CCR5, в общем.
Пример 3
Методы:
Гуманизированное антитело против CCR5 (huPRO140) тестировали на способность блокировать индуцированную RANTES мобилизацию кальция в CCR5+-клетках L1.2 и блокировать репликацию HIV-1 CASE C 1/85 в человеческих PBMC с применением описанных здесь способов.
Результаты: Результаты, приведенные на фигуре 19, демонстрируют, что гуманизированное антитело против CCR5 эффективно блокирует HIV-1, но не RANTES.
ССЫЛКИ
1. Allaway, G.P., K.L. Davis-Bruno, B.A. Beaudry, E.B. Garcia, E.L. Wong, A.M. Ryder, K.W. Hasel, M.C. Gauduin, R.A. Koup, J.S. McDougal and P.J. Maddon. 1995. Expression and characterization of CD4-IgG2, a novel heterotetramer that neutralizes primary HIV type 1 isolates. AIDS Res Hum Retroviruses 11: 533-539.
2. Allaway, G.P., A.M. Ryder, G.A. Beaudry and P.J. Maddon. 1993. Synergistic inhibition of HIV-1 envelope-mediated cell fusion by CD4-based molecules in combination with antibodies to gp120 or gp41. AIDS Res Hum Retroviruses 9: 581-587.
3. Amara, A., S.L. Gall, O. Schwartz, J. Salamero, M. Montes, P. Loetscher, M. Baggiolini, J.L. Virelizier and F. Arenzana-Seisdedos. 1997. HIV coreceptor downregulation as antiviral principle: SDF-1a-dependent internalization of the chemokine receptor CXCR4 contributes to inhibition of HIV replication. J. Exp. Med. 186: 139-146.
4. Berger, E.A. 1997. HIV entry and tropism: the chemokine receptor connection. AIDS 11 (suppl A): S3-S16.
5. Bieniasz, P.D. and B.R. Cullen. 1998. Chemokine receptors and human immunodeficiency virus infection. Frontiers in Bioscience 3: d44-58.
6. Bieniasz, P.D., R.A. Fridell, I. Aramori, S.S.G. Ferguson, M.C. Caron and B.R. Cullen. 1997. HIV-1-induced cell fusion is mediated by multiple regions within both the viral envelope and the CCR5 co-receptor. EMBO 16: 2599-2609.
7. Brelot, A., N. Heveker, O. Pleskoff, N. Sol and M. Alizon. 1997. Role of the first and third extracellular domains of CXCR4 in human immunodeficiency virus coreceptor activity. J. Virol. 71: 4744-4751.
8. Chan, B.C. and P.S. Kim. 1998. HIV entry and its inhibition. Cell 93: 681-684.
9. Chou, T.C. and B.C. Rideout. Synergism and antagonism in chemotherapy. New York: Academic Press, 1991
10. Cocchi, F., A.L. DeVico, A. Garzino-Berno, S.K. Arya, R.C. Gallo and P. Lusso. 1995. Identification of RANTES, MIP-1α and MIP-1β as the major HIV-suppressive factors produced by CD8 T- cells. Science 270: 1811-1815.
11. Connor, R.I., K.E. Sheridan, D. Ceradini, S. Choe and N.R. Landau. 1997. Change in co-receptor use correlates with disease progression in HIV-1 infected individuals. J. Exp. Med. 185: 621-628.
12. Crump, M.P., J.H. Gong, P. Loetscher, K. Rajarathnam, A. Amara, F. Arenzana-Seisdedos, J.L. Virelizier, M. Baggiolini, B.D. Sykes and I. Clark-Lewis. 1997. Solution structure and basis for functional activity of stromal-cell derived factor-1; disassociation of CXCR4 activation from binding and inhibition of HIV-1. EMBO 16: 6996-7007.
13. Dalgleish, A.G., P.C.L. Beverly, P.R. Clapham, D.H. Crawford, M.F. Greaves and R.A. Weiss. 1984. The CD4 (T4) antigen is an essential component of the receptor for the AIDS retrovirus. Nature 312: 763-766.
14. Deng, H.K., R. Liu, W. Ellmeier, S. Choe, D. Unutmaz, M. Burkhart, P. DiMarizio, S. Marmon, R.E. Sutton, C.M. Hill, S.C. Peiper, T.J. Schall, D.R. Littman and N.R. Landau. 1996. Identification of a major co-receptor for primary isolates of HIV-1. Nature 381: 661-666.
15. Dimitrov, D.S. 1997. How do viruses enter cells? The HIV Co-receptors teach us a lesson of complexity. Cell 91: 721-730.
16. Donzella, G.A., D. Schols, S.W. Lin, K.A. Nagashima, P.J. Maddon, G.P. Allaway, T.P. Sakmar, E.D. Clercq and J.P. Moore. 1998. JM3100, a small molecule that interacts with the CXCR4 co-receptor to prevent HIV-1 entry. Nat. Med. 4: 72-77.
17. Doranz, B.J., K. Grovit-Ferbas, M.P. Sharron, S.H. Mao, M.B. Goetz, E.S. Daar, R.W. Doms and W.A. O'Brien. 1997. A small molecule inhibitor directed against the chemokine receptor CXCR4 prevents its use as an HIV-1 co-receptor. J. Ex. Med. 186: 1395-1400.
18. Doranz, B.J., Z.-H. Lu, J. Rucker, T.-Y. Zhang, M. Sharron, Y.-H. Cen, Z.-X. Wang, H.-H. Guo, J.-G. Du, M.A. Accavitti, R.W. Doms and S.C. Peiper. 1997. Two distinct CCR5 domains can mediate co-receptor usage by human immunodeficiency virus type 1. J. Virol. 71: 6305-6314.
19. Dragic, T., V. Litwin, G.P. Allaway, S.R. Martin, Y. Huanh, K.A. Nagashima, C. Cayanan, P.J. Maddon, R.A. Koup, J.P. Moore and W.A. Paxton. 1996. HIV-1 entry into CD4+ cells is mediated by the chemokine receptor CC-CKR-5. Nature 381: 667-673.
20. Dragic, T., A. Trkola, X.W. Lin, K.A. Nagashima, F. Kajumo, L. Zhao, W.C. Olson, L. Wu, C.R. Mackay, G.P. Allaway, T.P. Sakmar, J.P. Moore and P.J. Maddon. 1998. Amino terminal substitutions in the CCR5 co-receptor impair gp120 binding and human immunodeficiency virus type 1 entry. J. Virol. 72: 279-285.
21. Dragic, T., A. Trkola and J.P. Moore. 1997. HIV co-receptors: Gateways to the cell. Advances in Research and Therapy 7: 2-13.
22. Farzan, M., H. Choe, L. Vaca, K. Martin, Y. Sun, E. Desjardins, N. Ruffing, L. Wu, R. Wyatt, N. Gerard, C. Gerard and J. Sodroski. 1998. A tyrosine-rich region in the N-terminus of CCR5 is important for human immunodeficiency virus type l entry and mediates an association between gp120 and CCR5. J. Virol. 72: 1160-1164.
23. Fuerst, T.R., E.G. Niles, F.W. Studier and B. Moss. 1986. Eukaryotic transient-expression system based on recombinant vaccinia virus that synthesizes bacteriophage T7 RNA polymerase. Proc. Natl. Acad. Sci. USA. 83: 8122-8126.
24. Genoud, S., F. Kajumo, Y. Guo, D.A.D. Thompson and T. Dragic. CCR5-mediated human immunodeficiency virus entry depends on an amino-terminal domain gp120-binding site and - on the conformational integrity of all four extracellular domains. J. Virol. submitted.
25. Gether, U. and B.K. Kobilka. 1998. G protein- coupled receptors. J. Biol. Chem 273: 17979-17982.
26. Gordon, C., M. Muesing, A.E.I. Proudfoot, C.A. Power, J.p. Moore and A. Trkola. 1998. Enhancement of human immunodeficiency virus type 1 infection by the CC-chemokine RANTES is independent of the mechanism of virus-cell fusion. J. Virol. in press.
27. Heveker, N., M. Montes, L. Germeroth, A. Amara, A. Trautmann, M. Alizon and J. Schneider-Mergener. 1998. Dissociation of the signaling and antiviral properties of SDF-1-derived small peptides. Current Biology 8: 369-376.
28. Hill, C.M., D. Kwon, M. Jones, C.B. Davis, S. Marmon, B.L. Daugherty, J.A. DeMartino, M.S. Springer, D. Unutmaz and D.R. Littman. 1998. The amino terminus of human CCR5 is required for its function as a receptor for diverse human and simian immunodeficiency virus envelope glycoproteins. Virology 248: 357-371.
29. Johnson, V.A., D.P. Merrill, J.A. Videler, T.C. Chou, R.E. Byington, J.J. Eron, R.T. D'Aquila and M.S. Hirsch. 1991. Two-drug combinations of zidovudine, didanosine, and recombinant interferon-alpha A inhibit replication of zidovudine-resistant human immunodeficiency virus type 1 synergistically in vitro. J Infect Dis 164: 646-655.
30. Klatzmann, D., E. Champagne, S. Chamaret, J.M. Gruest, D. Guetard, T. Hercend, J.C. Gluckman and L. Montagnier. 1984. T-lymphocyte T4 molecule behaves as the receptor for human retrovirus LAV. Nature 312: 382-385.
31. Kuhmann, K.E., E.J. Platt, S.L. Kozak and D. Rabat. 1997. Polymorphism in the CCR5 genes of African green monkeys and mice implicate specific amino acids in infections by simian and human immunodeficiency viruses. J. Virol. 71: 8642-8656.
32. Kwong, P.D., R. Wyatt, J. Robinson, R.W. Sweet, J. Sodroski and W.A. Hendrickson. 1998. Structure of an HIV gp120 envelope glycoprotein in complex with the CD4 receptor and a neutralizing human antibody. Nature 393: 648-659.
33. Laal, S., S. Burda, M.K. Corny, S. Karwowska, A. Buchbinder and S. Zolla-Pazner. 1994. Synergistic neutralization of human immunodeficiency virus type l by combinations of human monoclonal antibodies. J. Virol. 68: 4001-4008.
34. Labrosse, B., A. Brelot, N. Heveker, N. jSol, D. Schols, E.D. Clercq and M. Alizon. 1998. Determinants for sensitivity of human immunodeficiency virus co-receptor CXCR4 to the bicyclam AMD3100. J. Virol. 72: 6381-6388.
35. Li, A., H. Katinger, M.R. Posner, L. Cavacini, S. Zolla-Pazner, M.K. Gorny, J. Sodroski, T.C. Chou, T.W. Baba and R.M. Ruprecht. 1998. Synergistic neutralization of simian-human immunodeficiency virus SHIV-vpu+ by triple and quadruple combinations of human monoclonal antibodies and high-titer anti-human immunodeficiency virus type 1 immunoglobulins. J. Virol. 72: 3235-3240.
36. Littman, D.R. 1998. Chemokine receptors: keys to AIDS pathogenesis. Cell 93: 677-680.
37. Litwin, V. unpublished results.
38. Litwin, V., K. Nagashima, A.M. Ryder, C.H. Chang, J.M. Carver, W.C. Olson, M. Alizon, K.W. Hasel, P.J. Maddon and G.P. Allaway. 1996. Human immunodeficiency virus type 1 membrane fusion mediated by a laboratory-adapted strain and a primary isolate analyzed by resonance energy transfer. J. Virol. 70: 6437-6441.
39. Loetscher, P., J.H. Gong, B. Dewald, M. Baggioloni and I. Clark-Lewis. 1998. N-terminal peptides of stromal cell derived factor-l with CXC chemokine receptor 4 agonist and antagonist activities. J. Biol. Chem. 273: 22279-22283.
40. Mack, M., B. Luckow, P.J. Nelson, J. Cihak, G. Simmons, P.R. Clapham, N. Signoret, M. Marsh, M. Stangassinger, F. Borlat, T.N.C. Wells, D. Schlondorff and A.E.I. Proudfoot. 1998. Aminooxypentane-RANTES induces CCR5 internalization but inhibits recycling: a novel inhibitory mechanisms of HIV infectivity. J. Ex. Med. 187: 1215-1224.
41. Maddon, P.J., A.G. Dalgleish, J.S. McDougal, P.R. Clapham, R.A. Weiss and R. Axel. 1986. The T4 gene encodes the AIDS virus receptor and is expressed in the immune system and the brain. Cell 47: 333-348.
42. McDougal, J.S., M.S. Kennedy, J.M. Sligh, S.P. Cort, A. Mawle and J.K.A. Nicholson. 1986. Binding of HTLVIII / LAV to T4+ T cells by a complex of the 110K viral protein and the T4 molecule. Science 231: 382-385.
43. McKnight, A., D. Wilkinson, G. Simmons, S. Talbot, L. Picard, M. Ahuja, M. Marsh, J.A. Hoxie and P.R. Clapham. 1997. Inhibition of human immunodeficiency virus fusion by a monoclonal antibody to a co-receptor (CXCR4) is both cell type and virus strain dependent. J. Virol. 71: 1692-1696.
44. Merrill, D.P., D.J. Manion, T.C. Chou and M.S. Hirsch. 1997. Antagonism between human immunodeficiency virus type 1 protease inhibitors indinavir and saquinavir in vitro. J Infect Dis 176: 265-268.
45. Moore, J.P., Y. Cao, L. Qing, Q.J. Sattentau, J. Pyati, R. Koduri, J. Robinson, C.F. Barbas, D.R. Burton and D.D. Ho. 1995. Primary isolates of human immunodeficiency virus type 1 are relatively resistant to neutralization by monoclonal antibodies to gp120 and their neutralization is not predicted by studies with monomeric gp120. J. Virol. 69: 101-109.
46. Moore, J.P., B.A. Jameson, R.A. Weiss and Q.J. Sattentau. The HIV-cell fusion reaction. Boca Raton: CRC Press Inc., 1993 (J. Bentz, ed. Viral Fusion Mechanisms).
47. Moore, J.P., J.A. McKeating, Y. Huang, A. Ashkenazi and D.D. Ho. 1992. Virions of primary human immunodeficiency virus type 1 isolates resistant to soluble CD4 (sCD4) neutralization differ in sCD4 binding and glycoprotein gpl20 retention from sCD4-sensitive isolates. J. Virol. 66: 235-243.
48. Moore, J.P. and R.W. Sweet. 1993. The HIV gpl20- CD4 interaction: a target for pharmacological and immunological intervention. Prospect in Drug Discovery and Design 1: 235-250.
49. Murakami, T., T. Nakajima, Y. Koyanagi, K. Tachibana, N. Fujii, H. Tamamura, N. Yoshida, M. Waki, A. Matsumoto, O. Yoshie, T. Kishimoto, N. Yamamoto and T. Nagasawa. 1997. A small molecule CXCR4 inhibitor that blocks T cell line-tropic HIV-1 infection. J. Ex. Med. 186: 1389-1393.
50. Olson, W.C. unpublished results.
51. Pantaleo, G., G. Poli, L. Butini, C. Fox, A.I. Dayton and A.S, Fauci. 1991. Dissociation between syncytia formation and HIV spreading. Suppression of syncytia does not necessarily reflect inhibition of HIV infection. Eur. J. Immunol. 21: 1771-1774.
52. Rabut, G.E.E., J.A. Konner, F. Kajumo, J.P. Moore and T. Dragic. 1998. Alanine substitutions of polar and non-polar residues in the amino-terminal domain of CCR5 differently impair entry of macrophage- and dual-tropic isolates of the human immunodeficiency virus type 1. J. Virol. 72: 3464-3468.
53. Rizzuto, C., R. Wyatt, N. Hernandez-Ramos, Y. Sun, P. Kwong, W. Hendrickson and J. Sodroski. 1998. Identification of a conserved human immunodeficiency virus gp120 glycoprotein structure important for chemokine receptor binding. Science 280: 1949-1953.
54. Rucker, J., M. Samson, B.J. Doranz, F. Libert, J.F. Berson, Y. Yi, R.J. Smyth, R.G. Collman, C.C. Broder, G. Vassart, R.W. Doms and M. Parmentier. 1996. Regions in the β-chemokine receptors CCR-5 and CCR-2b that determine HIV-1 cofactor specificity. Cell 87: 437-446.
55. Schols, D., S. Struyf, J.V. Damme, J.A. Este, G. Henson and E.D. Clercq. 1997. Inhibition of T-tropic HIV strains by selective antagonization of the chemokine receptor CXCR4. J. Ex. Med. 186: 1383-1388.
56. Simmons, G., P.R. Clapham, L. Picard, R.E. Offord, M.M. Rosenkilde, T.W. Schwartz, R. Buser, T.N.C. Wells and A.E.I. Proudfoot. 1997. Potent inhibition of HIV-l infectivity in macrophages and lymphocytes by a novel CCR5 antagonist. Science 276: 276-279.
57. Simmons, G., D. Wilkinson, J.D. Reeves, M.T. Dittmar, S. Beddows, J. Weber, G. Carnegie, U. Desselberger, P.M. Gray, R.A. Weiss and P.R. Clapham. 1996. Primary, syncytiutn-inducing human immunodeficiency virus type-1 isolates are dual-tropic and most can use either LESTR or CCR5 as co-receptor for virus entry. J. Virol. 70: 8355-8360.
58. Strizki, J.M., J. Davis-Turner, R.G. Collman, J. Hoxie and F. Gonzalez-Scarano. 1997. A monoclonal antibody (12G5) directed against CXCR4 inhibits infection with the dual-tropic human immunodeficiency virus type 1 isolate HIV-1 89.6 but not the T-tropic isolate HIV-1 HxB. J. Virol. 71: 5678-5683.
59. Trkola, A., T. Dragic, J. Arthos, J. Binley, W.C. Olson, G.P. Allaway, C. Cheng-Mayer, J. Robinson, P.J. Maddon and J.P. Moore. 1996. CD4-dependent, antibody sensitive interactions between HIV-1 and its co-receptor CCR-5. Nature 384: 184-187.
60. Trkola, A., W.A. Paxton, S.P. Monard, J.A. Hoxie, M.A. Siani, D.A. Thompson, L. Wu, C.R. Mackay, R. Horuk and J.P. Moore. 1997. Genetic subtype- independent inhibition of human immunodeficiency virus type-l replication by CC- and CXC chemokines. J. Virol. 72: 396-404.
61. Vijh-Warrier, S., A. Pinter, W.J. Honnen and S.A. Tilley. 1996. Synergistic neutralization of human immunodeficiency virus type 1 by a chimpanzee monoclonal antibody against the V2 domain of gp120 in combination with monoclonal antibodies against the V3 loop and the CD4-binding site. J. Virol. 70: 4466-4473.
62. Ward, S.G., K. bacon and J. Westwick.. 1998. Chemokines and lymphocytes: more than an attraction. Immunity 9: 1-11.
63. Wu, L., N.P. Gerard, R. Wyatt, H. Choe, C. Parolin, N. Ruffing, A. Borsetti, A.A. Cardoso, E. Desjardin, W. Newman, C. Gerard and J. Sodroski. 1996. CD4-induced interaction of primary HIV-1 gp120 glycoproteins wi-th the chemokine receptor CCR-5. Nature 384: 179-183.
64. Wu, L., G. LaRosa, N. Kassam, C.J. Gordon, H. Heath, N. Ruffing, H. Chen, J. Humblias, M. Samson, M. Parmentier, J.P. Moore and C.R. Mackay. 1997. Interaction of chemokine receptor CCR5 with its ligands: multiple domains for HIV-1 gpl20 binding and a single domain for chemokine binding. J. Exp. Med. 186: 1373-1381.
65. Wyatt, R., P.D. Kwong, E. Desjardins, R. Sweet, J. Robinson, W. Hendrickson and J. Sodroski. 1998. The antigenic structure of the human immunodeficiency virus gp120 envelope glycoprotein. Nature 393: 705-711.
66. Wyatt, R. and J. Sodroski. 1998. The HIV-1 envelope glycoproteins: fusogens, antigens and immunogens. Science 280: 1884-1888.
67. Ylisastigui, L., J.J. Vizzavona, E. Drakopoulou, P. Paindavoine, C.F. Calvo, M. Parmentier, J.C. Gluckman, C. Vita and A. Benjouad. 1998. Synthetic full length and truncated RANTES inhibit HIV-l infection of primary macrophages. AIDS 12: 977-984.
68. Zhang, J.L., H. Choe, B.J. Dezube, M. Farzan, P.L. Sharma, X.C. Zhou, L.B. Chen, M. Ono, S. Gillies, Y. Wu, J.G. Sodroski and C.S. Crumpacker. 1998. The bis-azo compound FP-21399 inhibits HIV-l replication by preventing viral entry. Virology 244: 530-541.
69. Cairns, J.S., D'Souza. M.P., 1998. Chemokines and HIV-1 second receptors: the therapeutic connection. Nature Medicine. 1998. Vol 4, No. 5: 563.
70. Kilby, J.Michael, et al. 1998. Potent suppression of HIV-l replication in humans by T-20, a peptide inhibitor of gp41-medicated virus entry. Nature Medicine. Vol. 3, No. 11: 1302.
71. Патент США № 4816567, выданный 28 марта 1989 года Cabilly et al.
72. Патент США № 5225539, выданный 6 июля 1993 года Gregory Winter.
73. Патент США № 5585089, выданный 17 декабря 1996 года Queen et al.
74. Патент США № 5693761, выданный 2 декабря 1997 года Queen et al.
75. PCT International Application № PCT/US89/05857, поданная 28 декабря 1989 года, опубликованная 26 июля 1990 года, WO 90/07861.

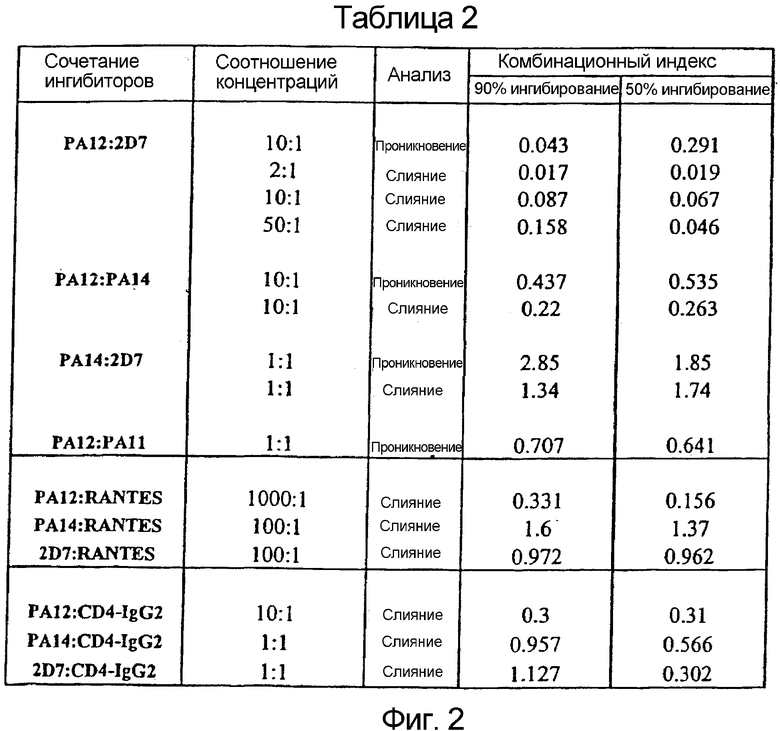



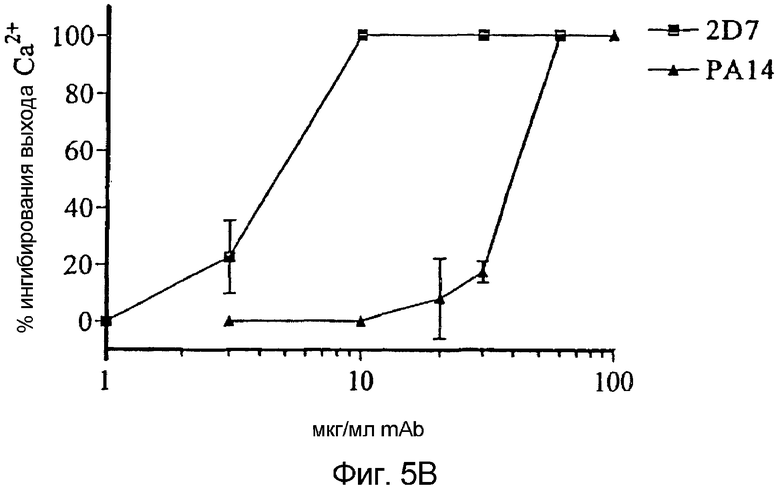
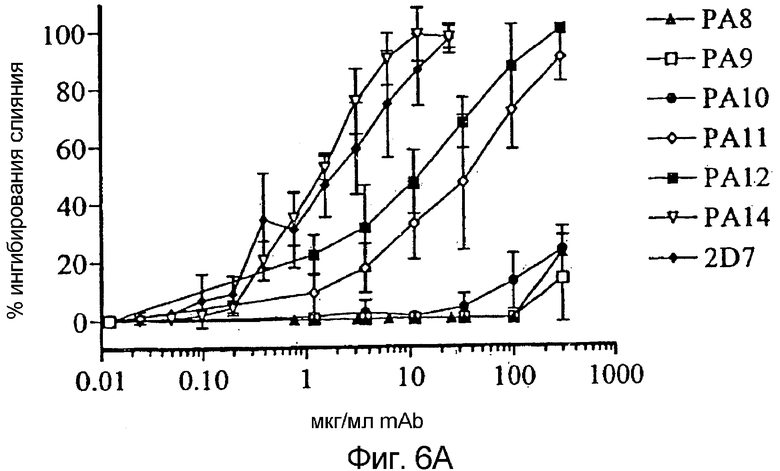

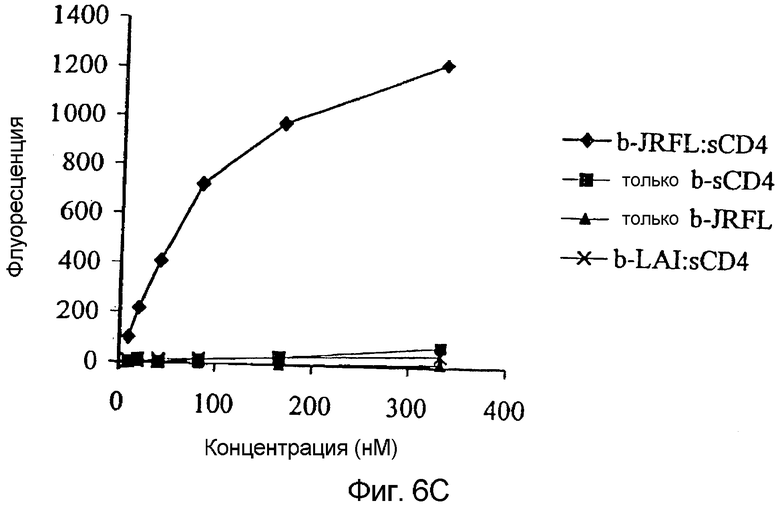
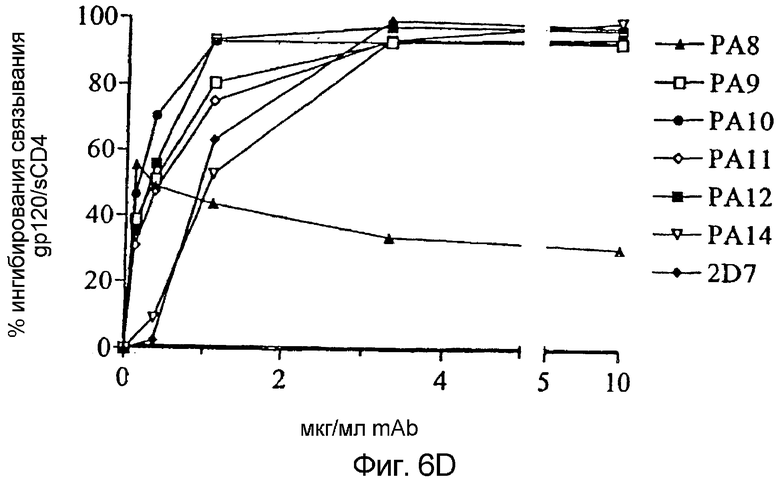

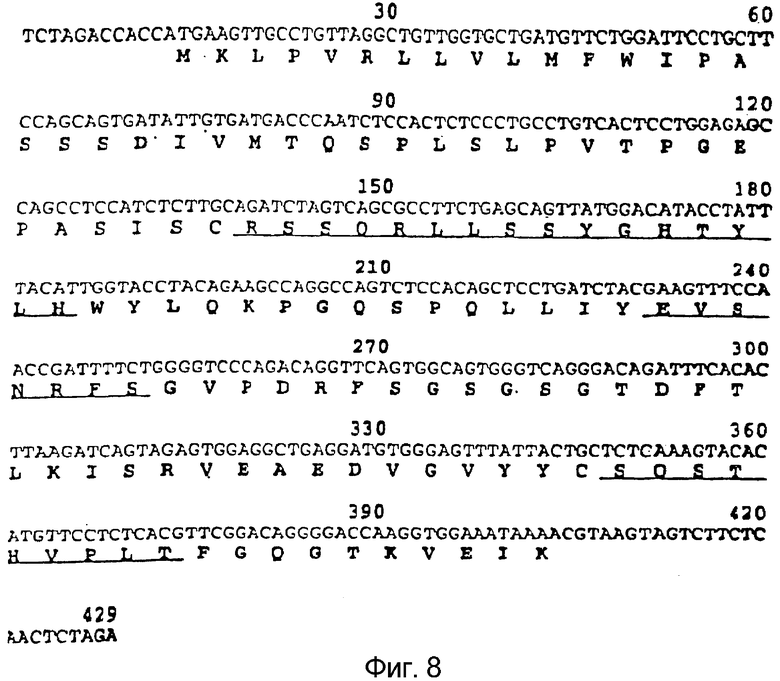
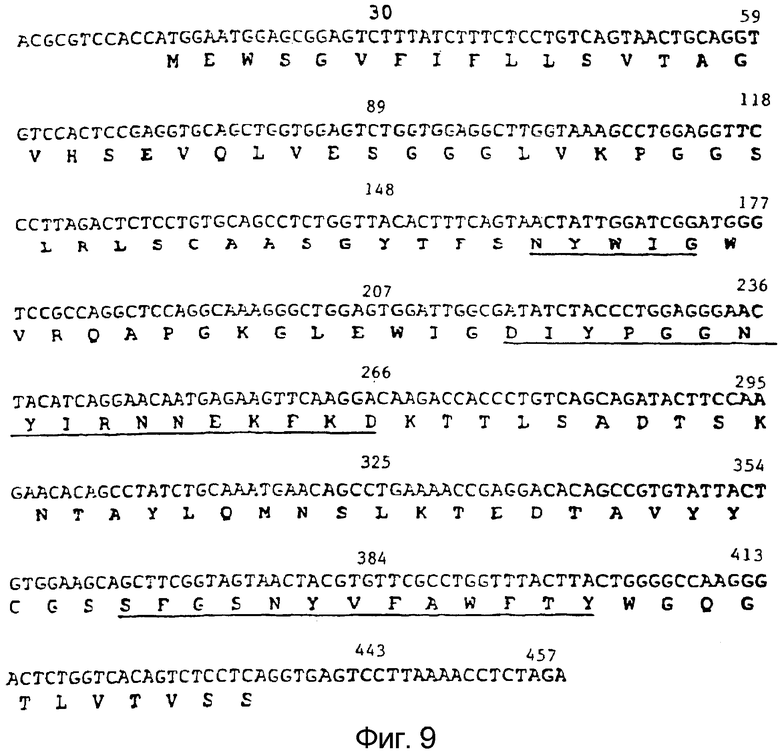

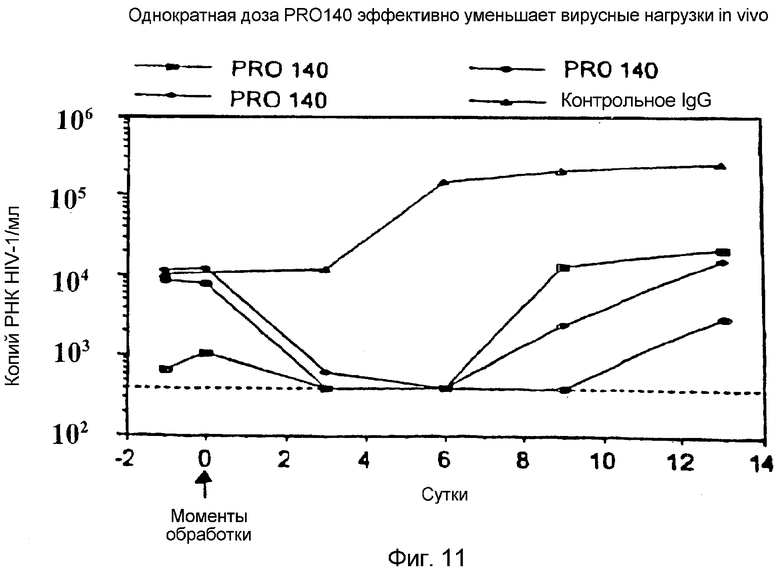
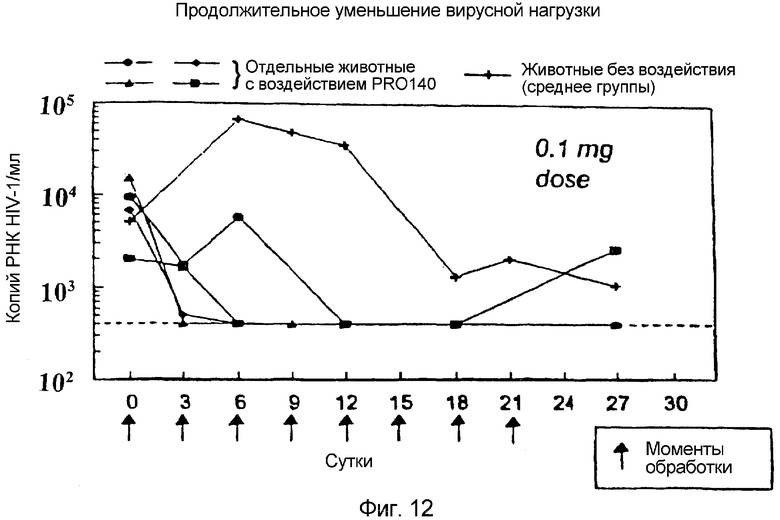


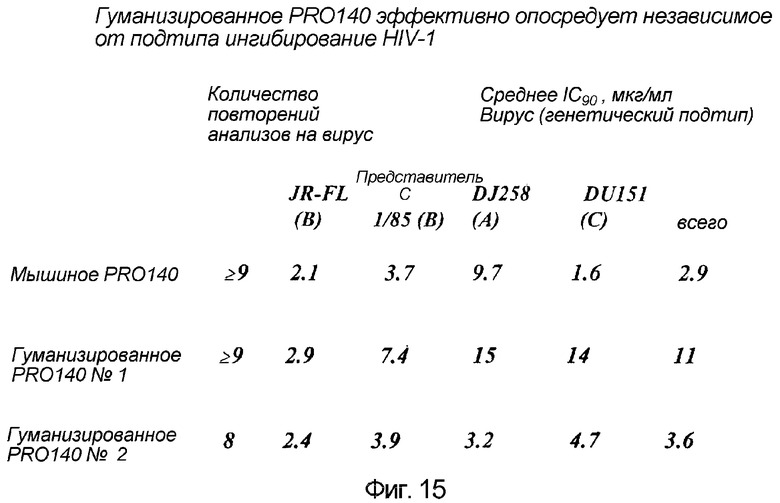

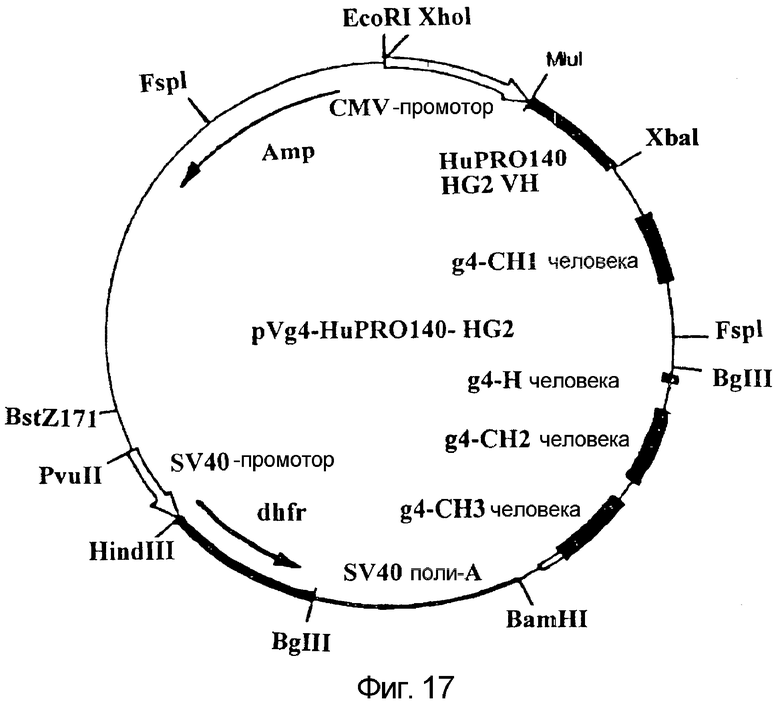
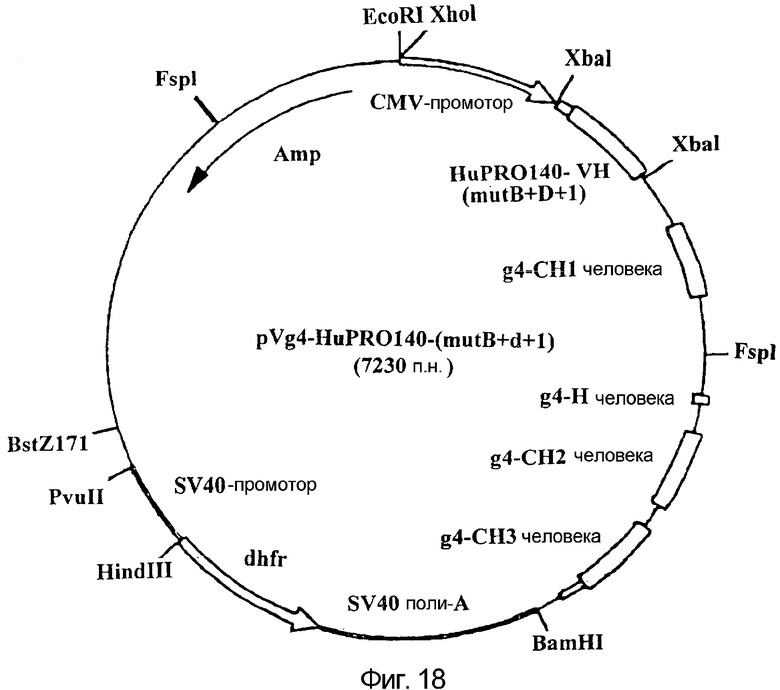
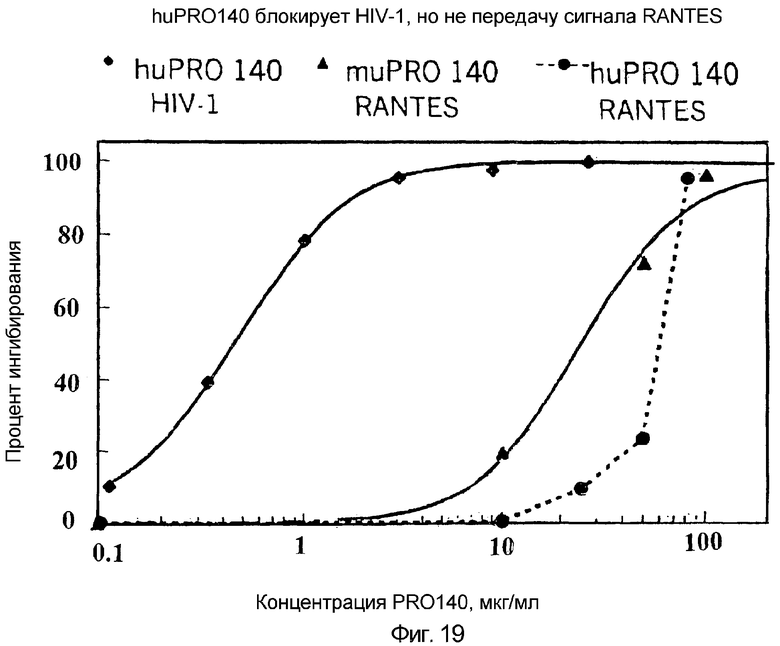
Изобретение относится к антителу против CCR5, содержащему (i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK (АТСС - РТА-4097), и (ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии плазмиды, обозначенной pVg4:HuPRO140 HG2-VH (АТСС - РТА-4098) или плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH (АТСС - РТА-4099), или фрагменту такого антитела, связывающемуся с CCR5 на поверхности клетки человека. Изобретение охватывает нуклеиновые кислоты, кодирующие легкие и тяжелые цепи антитела, вектор экспрессии, клетку-хозаина, трансформированного, по меньшей мере, одним вектором, а также способ получения антитела. Антитело по изобретению используется в качестве активного компонента в композиции для ингибирования инфицирования клеток CD4+HIV-1, а также в фармацевтической композиции для лечения пациента с инфекцией HIV-1. Изобретение охватывает также конъюгат антитела против CCR5 и его применение. Использование антител позволит повысить эффективность профилактики и лечения инфекции HIV-1. 14 н. и 17 з.п. ф-лы, 23 ил.
(i) две легких цепи, где каждая легкая цепь содержит продукт экспрессии плазмиды, обозначенной pVK:HuPRO140-VK, депонированной в АТСС под номером РТА-4097, и
(ii) две тяжелых цепи, где каждая тяжелая цепь содержит продукт экспрессии либо плазмиды, обозначенной pVg4:HuPRO140 HG2-VH, депонированной в АТСС под номером РТА-4098, либо плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH, депонированной в АТСС под номером РТА-4099,
или его фрагмент, который связывается с CCR5 на поверхности клетки человека.
две легких цепи, где каждая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID NO:6, и
две тяжелых цепи, где каждая тяжелая цепь содержит последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID NO:9 или SEQ ID NO:12,
или его фрагмент, который связывается с CCR5 на поверхности клетки человека.
(a) нуклеиновой кислоты, кодирующей полипептид, содержащий последовательные аминокислоты, аминокислотная последовательность которых указана в SEQ ID NO:6, 9 или 12;
(b) нуклеиновой кислоты, содержащей последовательные нуклеотиды, последовательность которых указана в SEQ ID NO:5, 8 или 11; и
(c) нуклеиновой кислоты, кодирующей полипептид, содержащий последовательные аминокислоты, где последовательные аминокислоты представляют собой аминокислоты, экспрессированные плазмидой, обозначенной pVK:HuPRO140-VK, депонированной в АТСС под номером РТА-4097, плазмидой, обозначенной pVg4:HuPRO140 HG2-VH, депонированной в АТСС под номером РТА-4098, или плазмидой, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH, депонированной в АТСС под номером РТА-4099.
a) трансформацию клетки-хозяина (i) плазмидой, обозначенной pVK:HuPRO140-VK, депонированной в АТСС под номером РТА-4097, и (ii) либо плазмидой, обозначенной pVg4:HuPRO140 HG2-VH, депонированной в АТСС под номером РТА-4098, либо плазмидой, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH, депонированной в АТСС под номером РТА-4099; и
b) культивирование трансформированной клетки-хозяина в условиях, позволяющих продукцию антитела, содержащего две легких цепи, кодируемые нуклеиновой кислотой плазмиды, обозначенной pVK:HuPRO140-VK, депонированной в АТСС под номером РТА-4097, и две тяжелых цепи, кодируемые нуклеиновой кислотой либо плазмиды, обозначенной pVg4:HuPRO140 HG2-VH, депонированной в АТСС под номером РТА-4098, либо плазмиды, обозначенной pVg4:HuPRO140 (mut B+D+I)-VH, депонированной в АТСС под номером РТА-4099, так что образуется антитело против CCR5.
| JP 200198798, 18.07.2000 | |||
| Приемно-прессующее устройство к ротационным печатным машинам | 1961 |
|
SU142308A1 |
| Способ рекуперации органических растворителей | 1960 |
|
SU143779A1 |
| RU 94045248 A1, 02.06.1994 | |||
| СПОСОБ ПРЕДОТВРАЩЕНИЯ ИЛИ ИНГИБИРОВАНИЯ ИНФИЦИРОВАНИЯ Т-ЛИМФОЦИТОВ ЧЕЛОВЕЧЕСКИМ ВИРУСОМ ИММУНОДЕФИЦИТА (HIV) И РЕПЛИКАЦИИ IN VIVO | 1989 |
|
RU2145856C1 |
Авторы
Даты
2008-04-20—Публикация
2003-02-21—Подача