Настоящее изобретение относится к новым антителам, в частности мышиным моноклональным антителам, химерным и гуманизированным, способным специфически связываться с хемокиновыми рецепторами (CXCR), а также амино- и нуклеиновокислотным последовательностям, кодирующим такие антитела. Согласно одному из аспектов изобретение относится к новым антителам, функциональным фрагментам или производным, способным специфически связываться с CXCR4 и обладающим высокой активностью против инфекции вирусом иммунодефицита человека (ВИЧ). Изобретение также включает применение таких антител, функциональных фрагментов или производных в качестве лекарственного средства для превентивного и/или терапевтического лечения ВИЧ-инфекции.
Хемокины представляют собой небольшие секретируемые пептиды, которые регулируют миграцию лейкоцитов по направлению химического градиента (концентрации) лиганда, известного как хемокиновый градиент, в особенности при иммунных реакциях (ZIotnick А. и соавт., 2000). Они подразделяются на два основных подсемейства, СС и СХС, в зависимости от расположения их NH2-концевых цистеиновых остатков, и связываются с G-белок-связанными рецепторами, два основных подсемейства которых обозначаются как CCR и CXCR. К настоящему времени описано более 50 человеческих хемокинов и 18 хемокиновых рецепторов.
Некоторые члены семейства хемокиновых рецепторов функционируют в качестве корецепторов вместе с важнейшим рецептором CD4, облегчая проникновение различных штаммов ВИЧ 1 типа в клетки, при этом основными корецепторами являются CCR5 и CXCR4. Обладающие тропностью к Т-клеткам Х4-ВИЧ-1 для проникновения в клетки используют CD4 и CXCR4, тогда как макрофагтройные R5 ВИЧ-1 используют CD4 и CCR5. Штаммы с двойной тропностью в качестве корецепторов могут использовать как CXCR4, так и CCR5. CCR3, CCR2, CCR8, CXCR6, CXCR7, CX3CR1, среди других хемокиновых рецепторов, могут функционировать в качестве корецепторов для более ограниченной подгруппы штаммов ВИЧ.
SDF-1, природный лиганд CXCR4, а также лиганды CCL3, CCL4, CCL4-L1 и CCL5 для CCR5 способны ингибировать слияние клеток и инфекцию различными штаммами ВИЧ-1. Эти данные способствовали разработке терапевтических средств против ВИЧ, направленных на хемокиновые рецепторы, приведшей к получению разрешения на проведение испытаний маравирока (CELSENTRI®), низкомолекулярного антагониста CCR5, в комбинации с другими агентами против ВИЧ-1 на пациентах, инфицированных CCR5-тропным ВИЧ-1. Однако, маравирок не применяется ни на пациентах, инфицированных ВИЧ-1 с двойной тропностью, ни на пациентах, инфицированных CXCR4-тропным ВИЧ-1 (справочник ВИДАЛЬ, 2009). Таким образом, существует очевидная потребность медицины в распространении этого типа терапии на пациентов, инфицированных как Х4-тропным ВИЧ, так и ВИЧ с двойной тропностью, терапии, основанной на идентификации антагонистов CXCR4, способных ингибировать репликацию Х4-тропного ВИЧ.
Хемокиновый рецептор 4 (также известный как фусин, CD184, LESTR или HUMSTR) существует в виде двух изоформ, содержащих 352 или 360 аминокислот. Остаток Asn11 гликозилирован, остаток Tyr21 модифицирован путем присоединения сульфатной группы, a Cys109 и 186 связаны с помощью дисульфидного мостика на внеклеточной части рецептора (Juarez J. и соавт., 2004).
Этот рецептор экспрессируется разными видами нормальных тканей, наивными Т-клетками, не являющимися клетками памяти, регуляторными Т-клетками, В-клетками, нейтрофилами, эндотелиальными клетками, первичными моноцитами, дендритными клетками, природными клетками-киллерами, CD34+гематопоэтическими стволовыми клетками и на низком уровне в сердце, толстом кишечнике, печени, почках и головном мозге. CXCR4 играет ключевую роль в миграции лейкоцитов, В-клеточном лимфопоэзе и миелопоэзе.
Уникальным лигандом рецептора CXCR4, описанным к настоящему времени, является фактор-1 стромальных клеток (SDF-1) или CXCL12. SDF-1 секретируется в большом количестве в лимфоузле, костном мозге, печени, легком и в меньшей степени секретируется почками, головным мозгом и кожей. CXCR4 также распознается антагонистическим хемокином, вирусным макрофагальным воспалительным белком II (vMIP-II), кодируемым вирусом человеческого герпеса III типа.
Как упомянуто ранее, рецептор CXCR4 является важнейшим корецептором для обладающих тропностью к Т-клеткам изолятов ВИЧ-1 (Х4-тропных вирусов). Оказание противодействия этому рецептору должно ингибировать репликацию Х4-тропных вирусов очень эффективным образом.
Один из аспектов настоящего изобретения заключается в создании мышиных моноклональных антител (Mab), ингибирующих репликацию ВИЧ. Изобретение охватывает CXCR4-Mab 515H7 (или его фрагменты), способное связываться с гомодимерами CXCR4 и обладающее высокими активностями против ВИЧ-инфекции. Изобретение также охватывает CXCR4-Mab 301аЕ5 (или его фрагменты), способное связываться с гомодимерами CXCR4 и обладающее высокими активностями против ВИЧ-инфекции.
Неожиданно акторам изобретения удалось создать моноклональные антитела, способные связываться с CXCR4, а также способные индуцировать конформационные изменения гомодимеров CXCR4 и способные ингибировать репликацию первичного изолята Х4-ВИЧ-1 в РВМС. Более конкретно, антитела по изобретению также могут быть способны ингибировать репликацию первичного изолята Х4/Р5-ВИЧ-1 в РВМС.
Предпочтительно, соединение CXCR4 представляет собой одну из двух изоформ CXCR4 человека, выбранную из группы, состоящей из:
- изоформы b хемокинового (мотив С-Х-С) рецептора 4 (Homo sapiens), имеющей последовательность, которая представлена в SEQ ID No.27 под номером доступа в Genbank NP_003458:
MEGISIYTSDNYTEEMGSGDYDSMKEPCFREENANFNKIFLPTIYSIIFLTGIVGNGLVILVMGYQKKLRSMTDKYRLHLSVADLLFVITLPFWAVDAVANWYFGNFLCKAVHVIYTVNLYSSVLILAFISLDRYLAIVHATNSQRPRKLLAEKWYVGVWIPALLLTIPDFIFANVSEADDRYICDRFYPNDLWWVFQFQHIMVGLILPGIVILSCYCIIISKLSHSKGHQKRKALKTTVILILAFFACWLPYYIGISIDSFILLEIIKQGCEFENTVHKWISITEALAFFHCCLNPILYAFLGAKFKTSAQHALTSVSRGSSLKILSKGKRGGHSSVSTESESSSFHSS;
- изоформы а хемокинового (мотив С-Х-С) рецептора 4 (Homo sapiens), имеющей последовательность, которая представлена в SEQ ID No.28 под номером доступа в Genbank NP_001008540:
MSIPLPLLQIYTSDNYTEEMGSGDYDSMKEPCFREENANFNKIFLPTIYSIIFLTGIVGNGLVILVMGYQKKLRSMTDKYRLHLSVADLLFVITLPFWAVDAVANWYFGNFLCKAVHVIYTVNLYSSVLILAFISLDRYLAIVHATNSQRPRKLLAEKWYVGVWIPALLLTIPDFIFANVSEADDRYICDRFYPNDLWWVFQFQHIMVGLILPGIVILSCYCIIISKLSHSKGHQKRKALKTTVILILAFFACWLPYYIGISIDSFILLEIIKQGCEFENTVHKWISITEALAFFHCCLNPILYAFLGAKFKTSAQHALTSVSRGSSLKILSKGKRGGHSSVSTESESSSFHSS;
- их альтернативного варианта транскрипции и сплайсинга или природного варианта, имеющего по меньшей мере 95% идентичности с одной из этих изоформ b или а, имеющей SEQ ID No.27 или 28; и
- их фрагмента, способного быть специфически распознанным их природным лигандом - фактором-1 стромальных клеток (SDF-1) - и содержащего предпочтительно по меньшей мере 100, 150 и 200 аминокислот.
CXCR2 выбран из группы, состоящей из:
- бета-рецептора интерлейкина 8 (Homo sapiens), имеющего последовательность, которая представлена под номером доступа в Genbank NP_001548SEQIDNo.29:
MEDFNMESDSFEDFWKGEDLSNYSYSSTLPPFLLDAAPCEPESLEINKYFWIIYALVFLLSLLGNSLVMLVILYSRVGRSVTDVYLLNLALADLLFALTLPIWAASKVNGWIFGTFLCKWSLLKEVNFYSGILLLACISVDRYLAIVHATRTLTQKRYLVKFICLSIWGLSLLLALPVLLFRRTVYSSNVSPACYEDMGNNTANWRMLLRILPQSFGFIVPLLIMLFCYGFTLRTLFKAHMGQKHRAMRVIFAWLIFLLCWLPYNLVLLADTLMRTQVIQETCERRNHIDRALDATEILGILHSCLNPLIYAFIGQKFRHGLLKILAIHGLISKDSLPKDSRPSFVGSSSGHTSTTL;
- его альтернативного варианта транскрипции и сплайсинга или природного варианта, имеющего по меньшей мере 95% идентичности с бета-рецептором интерлейкина 8, имеющим SEQ ID No.29; и
- его фрагмента, способного быть специфически распознанным IL-8 и содержащего предпочтительно по меньшей мере 100, 150 и 200 аминокислот.
Изобретение также включает способ отбора соединения, обладающего активностью против ВИЧ, или которое может быть использовано для изготовления композиции для лечения ВИЧ-инфекции, где указанный способ включает стадию:
В первом аспекте объектом настоящего изобретения является способ создания и отбора антител по изобретению.
Более конкретно, изобретение относится к способу отбора антитела против CXCR4 или одного из его функциональных фрагментов или производных, способных ингибировать репликацию ВИЧ, включающему следующие стадии:
1) скрининг созданных антител и отбор антител, способных специфически связываться с CXCR4;
2) тестирование отобранных на стадии (1) антител и отбор антител, способных связываться с мононуклеарными клетками периферической крови (РВМС),
3) тестирование отобранных на стадии (2) антител и отбор антител, способных связываться с гомодимером CXCR4, и затем
4) тестирование отобранных на стадии (3) антител и отбор антител, способных ингибировать репликацию первичных изолятов Х4-тропного ВИЧ-1 в РВМС.
В другом воплощении изобретение относится к способу отбора антитела против CXCR4 или одного из его функциональных фрагментов или производных, способных ингибировать репликацию ВИЧ, включающему следующие стадии:
1) скрининг созданных антител и отбор антител, способных специфически связываться с CXCR4;
2) тестирование отобранных на стадии (1) антител и отбор антител, способных связываться с мононуклеарными клетками периферической крови (РВМС),
3) тестирование отобранных на стадии (2) антител и отбор антител, способных связываться с гомодимером CXCR4, и затем
4) тестирование отобранных на стадии (3) антител и отбор антител, способных ингибировать репликацию первичных изолятов Х4-тропного ВИЧ-1 в РВМС и/или способных ингибировать репликацию первичных изолятов X4/R5-тропного ВИЧ-1 в РВМС.
Получение антител может быть реализовано любым способом, известным специалисту в данной области, таким как, например, слияние миеломной клетки с клетками селезенки из иммунизированных мышей или других видов, совместимых с отобранными миеломными клетками (Kohler & Milstein, 1975, Nature, 256: 495-497). Иммунизированные животные могут включать трансгенных мышей с локусами иммуноглобулинов человека, которые затем при этом непосредственно продуцируют человеческие антитела. Другое возможное воплощение может состоять в использовании методов фагового дисплея для скрининга библиотек.
Стадии (1) и (2) скрининга могут быть реализованы любым способом или способом, известным специалисту в данной области. В качестве неограничивающих примеров можно упомянуть ELISA, BIAcore, иммуногистохимию, анализ вестерн-блоттинг с использованием CXCR4-экспрессирующих экстрактов клеточных мембран или очищенного CXCR4, анализ с применением FACS и функциональный скрининг. Предпочтительный способ заключается в скрининге посредством FACS-анализа на CXCR4-трансфектантах (стадия 1) и по меньшей мере на РВМС (стадия 2), чтобы иметь уверенность в том, что продуцируемые антитела будут также способны распознавать нативную конформацию рецептора CXCR4 на поверхности клетки-мишени. Этот способ будет описан более подробно в следующих далее примерах.
Стадия (3) скрининга может быть реализована любым способом или способом, известным специалисту в данной области. В качестве неограничивающего, но предпочтительного примера, можно упомянуть методы вестерн-блоттинга и/или иммунопреципитации с использованием представляющих интерес антител на экстракте мембран из CXCR4-трансфицированных клеток или РВМС.
Стадия (4) скрининга может быть реализована любым способом или способом, известным специалисту в данной области. В качестве неограничивающего, но предпочтительного примера, можно упомянуть способ, заключающийся в скрининге антител по их способности ингибировать репликацию первичных изолятов Х4-ВИЧ-1 и/или первичных изолятов Х4/Р5-ВИЧ-1 в РВМС с использованием протокола, описанного Holl и соавт. (J. Immunol. 2004, 173, 6274-83).
В предпочтительном воплощении стадии (3) отбора способа по изобретению указанная стадия (3) заключается в оценке антител с использованием BRET-анализа на клетках, экспрессирующих CXCR4-RLuc/CXCR4-YFP, и отборе антител, способных ингибировать по меньшей мере 40%, предпочтительно 45%, 50%, 55% и наиболее предпочтительно 60% сигнала BRET.
Известно, что технология BRET представляет собой репрезентативную технологию димеризации белков (Angers et al., PNAS, 2000, 97: 3684-89).
Технология BRET, используемая на стадии (3) способа, хорошо известна специалисту в данной области и будет подробно рассмотрена в следующих далее примерах. Более конкретно, BRET (резонансный перенос энергии биолюминесценции) представляет собой безизлучательный перенос энергии между донором биолюминесценции (люциферазой Renilla (Rluc)) и акцептором флуоресценции, мутантом GFP (зеленого флуоресцентного белка) или YFP (желтого флуоресцентного белка). В настоящем случае использовали EYFP (усиленный желтый флуоресцентный белок). Эффективность переноса зависит от ориентации донора и акцептора и расстояния между ними. Так, перенос энергии может происходить, только если эти две молекулы находятся в непосредственной близости (1-10 нм). Это свойство используют для разработки анализов белок-белковых взаимодействий. Действительно, чтобы изучить взаимодействие между двумя партнерами, осуществляют слияние на генетическом уровне первого из них с люциферазой Renilla, а второго - с желтым мутантом GFP. Слитые белки, как правило, но не обязательно, экспрессируют в клетках млекопитающих. В присутствии своего субстрата (коэлентеразина), для которого мембрана является проницаемой, Rluc испускает голубой свет.Если мутант GFP располагается относительно Rluc на расстоянии меньше 10 нм, может произойти перенос энергии, и можно зарегистрировать дополнительный желтый сигнал. Сигнал BRET измеряют как соотношение интенсивности света, испущенного акцептором, и интенсивности света, испущенного донором. Таким образом, сигнал BRET будет возрастать по мере того, как эти два слитых белка будут сближаться друг с другом, или если конформационное изменение сблизит Rluc и мутант GFP.
Если BRET-анализ применяется в предпочтительном воплощении, то для измерения конформационных изменений димеров CXCR4 может быть использован любой другой метод, известный специалисту в данной области. Можно упомянуть, без ограничения, следующие технологии: FRET (резонансный перенос энергии флуоресценции), HTRF (гомогенную флуоресценцию с разрешением по времени), FLIM (визуализирующую микроскопию времени жизни флуоресценции) или SW-FCCS (одноволновую флуоресцентную кросс-корреляционную спектроскопию).
Также можно было использовать другие классические технологии, такие как ко-иммунопреципитация, технология AlphaScreen, химическое перекрестное сшивание, двухгибридная система, аффинная хроматография, ELISA или дальний вестерн-блоттинг.
В конкретном аспекте способа по изобретению стадия (3) заключается в оценке антител с использованием BRET-анализа на клетках, экспрессирующих одновременно обе конструкции CXCR4-RLuc/CXCR4-YFP, и отборе антител, способных ингибировать по меньшей мере 40% сигнала BRET.
Во втором аспекте объектом изобретения являются выделенные антитела или один из их функциональных фрагментов либо одно из их производных, причем полученные указанным способом. Указанные антитела или один из их функциональных фрагментов либо одно из их производных способны специфически связываться с человеческим CXCR4, причем указанные антитела также способны индуцировать конформационные изменения гомодимеров CXCR4.
Из литературы известно, что CXCR4-Mab типа, например, клона А120, способны ингибировать проникновение лабораторного штамма ВИЧ-1 (X4HIV-1NL4-3) в РВМС (Tanaka R. et al., J. Virol., 2001, 75, 11534-11543). Кроме того, также известно, что CXCR4-Mab способны ингибировать первичные изоляты Х4-ВИЧ-1 в клеточных линиях, экспрессирующих CXCR4. С другой стороны, никогда не описывалось антитело, способное ингибировать такой вирус в его природном окружении, то есть не только лабораторные вирусы или клеточные линии. Как бы то ни было, новый и неочевидный аспект изобретения заключается в том, что CXCR4-Mab способны ингибировать первичные изоляты Х4-ВИЧ-1 в РВМС.
Выражение "функциональные фрагменты и производные" будет определено подробно в описании настоящего изобретения позже.
Здесь должно быть понятно, что изобретение не относится к антителам в природной форме, другими словами, что они не находятся в их природном окружении, но что они могут быть выделены или получены очисткой из природных источников, или еще получены с использованием генетической рекомбинации, или посредством химического синтеза, и что они могут, кроме того, содержать неприродные аминокислоты, как будет описано далее.
Более конкретно, согласно другому аспекту изобретения заявлены выделенные антитела или один из их функциональных фрагментов либо одно из их производных, причем указанные антитела содержат по меньшей мере один определяющий комплементарность участок CDR, выбранный из CDR, содержащих аминокислотную последовательность SEQ ID No.1-6 и 30-33, как определено по системе нумерации IMGT (база данных по иммуногенетике (от англ. ImMunoGeneTics database)).
Согласно первому аспекту изобретение относится к выделенному антителу или его функциональному фрагменту либо производному, содержащему по меньшей мере один CDR, выбранный из CDR с последовательностями SEQ ID No.1-6, как определено по системе нумерации IMGT, или по меньшей мере один CDR, последовательность которого идентична по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностями SEQ ID No.1-6.
Согласно второму аспекту изобретение относится к выделенному антителу или его функциональному фрагменту либо производному, содержащему по меньшей мере один CDR, выбранный из CDR с последовательностями SEQ ID No.1, 2 и 30-33, как определено по системе нумерации IMGT, или по меньшей мере один CDR, последовательность которого идентична по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностями SEQ ID No.1, 2 и 30-33.
"Функциональный фрагмент" антитела означает, в частности, такой фрагмент антитела, как фрагменты Fv, scFv (sc=одноцепочечный), Fab, F(ab')2, Fab', scFv-Fc или диатела, или любой фрагмент, период полувыведения которого увеличен. Такие функциональные фрагменты будут изложены подробно в описании настоящего изобретения позже.
"Дериватизированное соединение" или "производное" антитела означает, в частности, связывающий белок, состоящий из пептидного каркаса и по меньшей мере одного из CDR исходного антитела для сохранения его способности распознавать CXCR4. Такие дериватизированные соединения, хорошо известные специалисту в данной области, будут изложены более подробно в описании настоящего изобретения позже.
Более предпочтительно, изобретение включает антитела, их дериватизированные соединения или их функциональные фрагменты по настоящему изобретению, в особенности химерные или гуманизированные, полученные с использованием генетической рекомбинации или химического синтеза.
В соответствии с предпочтительным воплощением антитело по изобретению или его дериватизированные соединения либо функциональные фрагменты характеризуются тем, что состоят из моноклонального антитела.
Под термином "моноклональное антитело" понимается антитело, происходящее из почти гомогенной популяции антител. Более конкретно, индивидуальные антитела популяции являются идентичными за исключением немногочисленных возможных природных мутаций, которые могут быть обнаружены с минимальным относительным содержанием. Другими словами, моноклональное антитело представляет собой гомогенное антитело, являющееся результатом роста одного клеточного клона (например, гибридомы, эукариотической клетки хозяина, трансфицированной молекулой ДНК, кодирующей гомогенное антитело, прокариотической клетки хозяина, трансфицированной молекулой ДНК, кодирующей гомогенное антитело, и т.д.), и, как правило, характеризуется наличием тяжелых цепей одного и только одного класса и подкласса и легких цепей только одного типа. Моноклональные антитела являются высокоспецифичными и направлены против индивидуального антигена. К тому же, в противоположность препаратам поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант или эпитопов, каждое моноклональное антитело направлено против единственного эпитопа данного антигена.
Более конкретно, в соответствии с первым предпочтительным воплощением изобретения антитело или его дериватизированные соединения либо функциональные фрагменты характеризуются тем, что содержат легкую цепь, содержащую по меньшей мере один CDR, выбранный из CDR-L1, CDR-L2 и CDR-L3, где:
- CDR-L1 содержит аминокислотную последовательность SEQ ID No.1,
- CDR-L2 содержит аминокислотную последовательность SEQ ID No.2,
- CDR-L3 содержит аминокислотную последовательность SEQ ID No.3.
В соответствии с другим воплощением антитела по изобретению или одно из их дериватизированных соединений либо один из их функциональных фрагментов, характеризуются тем, что они содержат легкую цепь, содержащую по меньшей мере один из трех CDR с последовательностями SEQ ID No.1, 2 или 3, или по меньшей мере одну последовательность, идентичную по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностями SEQ ID No.1, 2 или 3.
Антитело по изобретению или один из его функциональных фрагментов либо одно из его производных также характеризуется тем, что содержит легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, где CDR-L1 содержит аминокислотную последовательность SEQ ID No.1, CDR-L2 содержит аминокислотную последовательность SEQ ID No.2 и CDR-L3 содержит аминокислотную последовательность SEQ ID No.3.
В другом воплощении антитело по изобретению или один из его функциональных фрагментов либо одно из его производных характеризуется тем, что содержит легкую цепь с последовательностью, содержащей аминокислотную последовательность SEQ ID No.7, или по меньшей мере одну последовательность, идентичную по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностями SEQ ID No.7.
В соответствии со вторым предпочтительным воплощением изобретения антитело или его дериватизированные соединения или функциональные фрагменты характеризуются тем, что содержат легкую цепь, содержащую по меньшей мере один CDR, выбранный из CDR-L1, CDR-L2 и CDR-L3, где:
- CDR-L1 содержит аминокислотную последовательность SEQ ID No.1,
- CDR-L2 содержит аминокислотную последовательность SEQ ID No.2,
- CDR-L3 содержит аминокислотную последовательность SEQ ID No.30.
В соответствии с другим воплощением антитела по изобретению или одно из их дериватизированных соединений либо один из их функциональных фрагментов характеризуются тем, что они содержат легкую цепь, содержащую по меньшей мере один из трех CDR с последовательностями SEQ ID No.1, 2 или 30, или по меньшей мере одну последовательность, идентичную по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностями SEQ ID No.1, 2 или 30.
Антитело по изобретению или один из его функциональных фрагментов либо одно из его производных также характеризуется тем, что содержит легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, где CDR-L1 содержит аминокислотную последовательность SEQ ID No.1, CDR-L2 содержит аминокислотную последовательность SEQ ID No.2 и CDR-L3 содержит аминокислотную последовательность SEQ ID No.30.
В другом воплощении антитело по изобретению или один из его функциональных фрагментов либо одно из его производных характеризуется тем, что содержит легкую цепь с последовательностью, содержащей аминокислотную последовательность SEQ ID No.34, или по меньшей мере одну последовательность, идентичную по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностями SEQ ID No.34.
Более конкретно, антитела по изобретению или одно из их дериватизированных соединений либо один из их функциональных фрагментов характеризуются тем, что они содержат тяжелую цепь, содержащую по меньшей мере один CDR, выбранный из CDR-H1, CDR-H2 и CDR-H3, где:
- CDR-H1 содержит аминокислотную последовательность SEQ ID No.4,
- CDR-H2 содержит аминокислотную последовательность SEQ ID No.5,
- CDR-H3 содержит аминокислотную последовательность SEQ ID No.6.
В соответствии с другим воплощением антитела по изобретению или одно из их дериватизированных соединений либо один из их функциональных фрагментов характеризуются тем, что они содержат тяжелую цепь, содержащую по меньшей мере один из трех CDR с последовательностями SEQ ID No.4, 5 или 6, или по меньшей мере одну последовательность, идентичную по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностями SEQ ID No.4, 5 или 6.
В соответствии с другим конкретным воплощением антитела или одно из их дериватизированных соединений либо один из их функциональных фрагментов характеризуются тем, что они содержат тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, где CDR-H1 содержит аминокислотную последовательность SEQ ID No.4, CDR-H2 содержит аминокислотную последовательность SEQ ID No.5 и CDR-H3 содержит аминокислотную последовательность SEQ ID No.6.
В другом воплощении антитело по изобретению или один из его функциональных фрагментов либо одно из его производных характеризуется тем, что содержит тяжелую цепь с последовательностью, содержащей аминокислотную последовательность SEQ ID No.8, или по меньшей мере одну последовательность, идентичную по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностями SEQ ID No.8.
Более конкретно, антитела по изобретению или одно из их дериватизированных соединений либо один из их функциональных фрагментов характеризуются тем, что они содержат тяжелую цепь, содержащую по меньшей мере один CDR, выбранный из CDR-H1, CDR-H2 и CDR-H3, где:
- CDR-H1 содержит аминокислотную последовательность SEQ ID No.31,
- CDR-H2 содержит аминокислотную последовательность SEQ ID No.32,
- CDR-H3 содержит аминокислотную последовательность SEQ ID No.33.
В соответствии с другим воплощением антитела по изобретению или одно из их дериватизированных соединений либо один из их функциональных фрагментов характеризуются тем, что они содержат тяжелую цепь, содержащую по меньшей мере один из трех CDR с последовательностями SEQ ID No.31, 32 или 33, или по меньшей мере одну последовательность, идентичную по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностями SEQ ID No.31, 32 или 33.
В соответствии с другим конкретным воплощением антитела или одно из их дериватизированных соединений либо один из их функциональных фрагментов характеризуются тем, что они содержат тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, где CDR-H1 содержит аминокислотную последовательность SEQ ID No.31, CDR-H2 содержит аминокислотную последовательность SEQ ID No.32 и CDR-H3 содержит аминокислотную последовательность SEQ ID No.33.
В другом воплощении антитело по изобретению или один из его функциональных фрагментов либо одно из его производных характеризуется тем, что содержит тяжелую цепь с последовательностью, содержащей аминокислотную последовательность SEQ ID No.35, или по меньшей мере одну последовательность, идентичную по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностью SEQ ID No.35.
Антитело по изобретению или один из его функциональных фрагментов либо одно из его производных характеризуется тем, что содержит легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотную последовательность SEQ ID No.1, 2 и 3; и тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотную последовательность SEQ ID No.4, 5 и 6.
И наконец, антитело по изобретению или один из его функциональных фрагментов либо одно из его производных также может характеризоваться тем, что содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID No.7, и тяжелую цепь, содержащую аминокислотную последовательность SEQ ID No.8.
Антитело по изобретению или один из его функциональных фрагментов либо одно из его производных характеризуется тем, что содержит легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотную последовательность SEQ ID No.1, 2 и 30; и тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотную последовательность SEQ ID No.31, 32 и 33.
И наконец, антитело по изобретению или один из его функциональных фрагментов либо одно из его производных также может характеризоваться тем, что содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID No.34, и тяжелую цепь, содержащую аминокислотную последовательность SEQ ID No.35.
В настоящем описании термины "полипептиды", "полипептидные последовательности", "пептиды" и "белки, присоединенные к являющимся антителами соединениям или к их последовательностям" являются взаимозаменяемыми.
Здесь должно быть понятно, что изобретение не относится к антителам в природной форме, то есть их не берут в своем природном окружении, а выделяют или получают очисткой из природных источников или получают методом генетической рекомбинации или химический синтезом, и поэтому они могут нести неприродные аминокислоты, которые будут описаны ниже.
В первом воплощении определяющий комплементарность участок или CDR означает гипервариабельные участки тяжелых и легких цепей иммуноглобулинов согласно определению по Kabat, как определено Kabat и соавт. (Kabat et al., Sequences of proteins of immunological interest, 5th Ed., U.S. Department of Health and Human Services, NIH, 1991 и более поздние издания). Существуют три CDR тяжелой цепи и три CDR легкой цепи. Здесь термин "CDR" в единственном и множественном используются для указания, в зависимости от случая, одного или более либо даже всех участков, содержащих большинство аминокислотных остатков, ответственных за аффинность связывания антитела с антигеном или эпитопом, который он распознает.
Во втором воплощении под CDR-участками или просто CDR подразумевается указание на гипервариабельные участки тяжелых и легких цепей иммуноглобулинов, которые определены по IMGT.
Уникальная система нумерации по IMGT была установлена для сравнения вариабельных доменов любых антигенных рецепторов, типов цепей или разновидностей (Lefranc M.-P., Immunology Today, 18, 509 (1997)/Lefranc M.-P., The Immunologist, 7, 132-136 (1999)/Lefranc, M.-P., Pommie, С., Ruiz, M., Giudicelli, V, Foulquier, E., Truong, L, Thouvenin-Contet, V. and Lefranc, Dev. Сотр. Immunol., 27, 55-77 (2003)). Согласно уникальной системе нумерации по IMGT консервативные аминокислоты всегда имеют одно и то же положение, например, цистеин 23 (1-й CYS), триптофан 41 (КОНСЕРВАТИВНЫЙ TRP), гидрофобная аминокислота 89, цистеин 104 (2-й CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). Уникальная система нумерации по IMGT обеспечивает стандартизированное определение границ каркасных областей (FR) (FR1-IMGT: положения 1-26, FR2-IMGT:39-55, FR3-IMGT:66-104 и FR4-IMGT: 118-128) и определяющих комплементарность участков: CDR1-IMGT:27-38, CDR2-IMGT:56-65 и CDR3-IMGT:105-117. Поскольку разрывы представляют собой незанятые положения, протяженности CDR-IMGT (показаны в скобках и разделены точками, например [8.8.13]) становятся важной информацией. Уникальная система нумерации по IMGT используется для двумерных (2D) графических представлений, называемых IMGT Colliers de Perles (жемчужное ожерелье) (Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002)/Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)), и для трехмерных (3D) структур в базе данных IMGT/3Dstructure-DB (Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids Res., 32, D208-D210 (2004)).
Существуют три CDR в тяжелой цепи и 3 CDR в легкой цепи. Термин CDR или CDR во множественном числе используется здесь для того, чтобы указать, согласно данному случаю, один из этих участков или несколько либо даже все эти участки, которые содержат большинство аминокислотных остатков, ответственных за аффинное связывание антитела с антигеном или эпитопом, который он распознает.
Для большей ясности необходимо понимать, что в следующем далее описании, и более конкретно в Таблицах 2 и 3 CDR будут определены согласно системе нумерации по IMGT и согласно системе нумерации по Kabat.
Система нумерации по IMGT определяет CDR в соответствии с системой IMGT, которая определена выше, в то же время система нумерации по Kabat определяет CDR в соответствии с системой по Kabat, которая определена выше.
Более конкретно, относительно антитела, обозначенного как 515Н7, CDR-L1 состоит из SEQ ID No.1 согласно системе нумерации по IMGT и из SEQ ID No.9 согласно системе нумерации по Kabat. Что касается CDR-L2, то он состоит из SEQ ID No.2 согласно системе нумерации по IMGT и из SEQ ID No.10 согласно системе нумерации по Kabat. CDR-L3 состоит из SEQ ID No.3 согласно каждой из двух этих систем нумерации. Что касается тяжелой цепи, то CDR-H1 состоит из SEQ ID No.4 согласно системе нумерации по IMGT и из SEQ ID No.11 согласно системе нумерации по Kabat. CDR-H2 состоит из SEQ ID No.5 согласно системе нумерации по IMGT и из SEQ ID No.12 согласно системе нумерации по Kabat. И наконец, CDR-Н3 состоит из SEQ ID No.6 согласно системе нумерации по IMGT, тогда как согласно системе нумерации по Kabat он состоит из SEQ ID No.13.
Далее, что касается антитела, обозначенного как 301аЕ5, то CDR-L1 состоит из SEQ ID No.1 согласно системе нумерации по IMGT и из SEQ ID No.9 согласно системе нумерации по Kabat. Что касается CDR-L2, то он состоит из SEQ ID No.2 согласно системе нумерации по IMGT и из SEQ ID No.36 согласно системе нумерации по Kabat. CDR-L3 состоит из SEQ ID No.30 согласно системе нумерации по IMGT и из SEQ ID No.37 согласно системе нумерации по Kabat. Что касается тяжелой цепи, то CDR-H1 состоит из SEQ ID No.31 согласно системе нумерации по IMGT и из SEQ ID No.38 согласно системе нумерации по Kabat. CDR-H2 состоит из SEQ ID No.32 согласно системе нумерации по IMGT и из SEQ ID No.39 согласно системе нумерации по Kabat. И наконец, CDR-H3 состоит из SEQ ID No.33 согласно системе нумерации по IMGT, тогда как согласно системе нумерации по Kabat он состоит из SEQ ID No.40.
"Процент идентичности" между двумя последовательностями нуклеиновых кислот или аминокислот в контексте настоящего изобретения означает процент идентичных нуклеотидов или аминокислотных остатков между двумя этими сравниваемыми последовательностями, полученный после оптимального выравнивания, причем этот процент является чисто статистическим, и различия между двумя этими последовательностями распределены случайным образом по всей их длине. Сравнение двух нуклеиновокислотных или аминокислотных последовательностей традиционно проводят, сравнивая эти последовательности после выравнивания их оптимальным образом, причем указанное сравнение может быть проведено по сегментам или с использованием "окна сравнения". Оптимальное выравнивание последовательностей для их сравнения может быть осуществлено, в дополнение к сравнению вручную, с применением алгоритма локальной гомологии Smith и Waterman (1981) (Ad. App. Math. 2: 482), с применением алгоритма локальной гомологии Neddleman и Wunsch (1970) (J. Mol. Biol., 48: 443), с применением метода поиска сходства Pearson и Lipman (1988) (Proc. Natl. Acad. Sci. USA, 85: 2444) или с применением компьютерного программного обеспечения, использующего эти алгоритмы (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Madison, WI, или даже с применением для такого сравнения программного обеспечения BLAST N или BLAST Р).
Процент идентичности между двумя нуклеиновокислотными или аминокислотными последовательностями определяют путем сравнения этих двух последовательностей, выравненных оптимальным способом, при этом сравниваемая нуклеиновокислотная или аминокислотная последовательность может иметь вставки или делеции по сравнению с последовательностью сравнения, для осуществления оптимального выравнивания между двумя этими последовательностями. Процент идентичности рассчитывают, определяя число идентичных положений, в которых нуклеотидный или аминокислотный остаток будет одинаковым в двух этих последовательностях, предпочтительно в двух полных последовательностях, производя деление этого числа идентичных положений на общее число положений в окне выравнивания и производя умножение полученного результата на 100 для получения процента идентичности между двумя этими последовательностями.
Например, можно использовать программу BLAST "BLAST 2 sequences" (Tatusova et al., "Blast 2 sequences - a new tool for comparing protein and nucleotide sequences", FEMS Microbiol. 1999, Lett. 174: 247-250), доступную на сайте http://www.ncbi.nlm.nih.gov/gorf/bI2.html, с параметрами по умолчанию (в частности, что касается параметров "штраф за создание разрыва" ("gap open penalty"): 5, и "штраф за длину разрыва" ("extension gap penalty": 2; при этом выбранной матрицей является, например матрица "BLOSUM 62", предложенная этой программой); процент идентичности между обеими сравниваемыми последовательностями вычисляется непосредственно этой программой.
Что касается аминокислотной последовательности, демонстрирующей по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% идентичности с аминокислотной последовательностью сравнения, предпочтительные примеры включают последовательности, содержащие последовательность сравнения, некоторые модификации, а именно, делецию, вставку или замену по меньшей мере одной аминокислоты, укорочение или удлинение. В случае замены одной или более чем одной следующих одна за другой или не следующих одна за другой аминокислот предпочтительны замены, в которых заменяемые аминокислоты заменены на "эквивалентные" аминокислоты. Здесь выражение "эквивалентные аминокислоты" означает указание на любые аминокислоты, которые могут заменять одну из структурных аминокислот, однако без изменения биологических активностей соответствующих антител, и конкретные примеры таковых приведены ниже.
Эти эквивалентные аминокислоты можно определить, полагаясь либо на их структурную гомологию с аминокислотами, которых они заменяют, либо на результаты сравнительных тестирований биологической активности между разными антителами, которые могут быть проведены.
В качестве неограничивающего примера в приведенной ниже Таблице 1 суммированы возможные замены, которые могут быть проведены без большого изменения биологической активности соответствующего модифицированного антитела, в тех же условиях естественно возможны обратные замены.
В конкретном воплощении настоящее изобретение относится к мышиным антителам или их дериватизированным соединениям либо функциональным фрагментам.
Как показано выше, изобретение также относится к любому соединению, происходящему из антител, описанных в данном изобретении.
Более конкретно, антитело по изобретению или его дериватизированные соединения либо функциональные фрагменты характеризуются тем, что указанное дериватизированное соединение состоит из связывающего белка, содержащего пептидный каркас, на который привит по меньшей мере один CDR таким образом, что при этом сохраняются все распознающие свойства или часть распознающих свойств, определяемых паратопом исходного антитела.
Одна или более последовательностей среди последовательностей CDR, описанных в настоящем изобретении, также может быть представлена на различных иммуноглобулиновых белковых каркасах. В этом случае белковая последовательность делает возможным воссоздание пептидного остова, благоприятного для фолдинга привитых CDR, позволяя их паратопам сохранять антиген-распознающие свойства.
Как правило, специалисту в данной области известно, как определить тип белкового каркаса, на который можно привить по меньшей мере один из CDR, происходящих из исходного антитела. Более конкретно, известно, что для того, чтобы быть выбранными, такие каркасы должны соответствовать огромному количеству критериев, которые приведены ниже (Skerra A., J. Mol. Recogn., 2000, 13: 167-187):
- хорошая филогенетическая сохранность;
- известная пространственная структура (например, определенная с использованием кристаллографии, спектроскопии ЯМР или любого другого метода, известного специалисту в данной области);
- небольшой размер;
- незначительное количество или отсутствие посттранскрипционных модификаций; и/или
- легкость в получении, экспрессии и очистке.
Исходным материалом таких белковых каркасов могут быть, но этим не ограничиваться, структуры, выбранные из: фибронектина и предпочтительно домена 10 фибронектина III типа, липокалина, антикалина (Skerra A., J. Biotechnol., 2001, 74(4): 257-75), белка Z, происходящего из домена В белка A Staphylococcus aureus, тиоредоксина А или белков с повторяющимся мотивом, таким как "анкириновый повтор" (Kohl et al., PNAS, 2003, vol.100, No.4, 1700-1705), "повтор armadillo", "богатый лейцином повтор" и "тетратрикопептидный повтор".
Также следует упомянуть каркасы, происходящие из токсинов, таких как, например, токсины из скорпионов, насекомых, растений, моллюсков и т.д., и белковых ингибиторов нейронной синтазы NO (PIN).
Примером таких гибридных конструкций, никоим образом их не ограничивающим, является вставка CDR-H1 (тяжелая цепь) антитела против CD4, а именно, 13В8.2, в одну из петель в PIN, при этом полученный таким образом новый связывающий белок сохраняет те же связующие свойства, что и исходное антитело (Bes et al., Biochem. Biophys. Res. Commun., 2006, 343(1), 334-344). Чисто для иллюстративной цели также можно упомянуть привитие CDR-H3 (тяжелая цепь) VHH антитела против лизоцима на одну из петель неокарциностатина (Nicaise et al., Protein Science, 2004, 13(7): 1882-1891).
И наконец, как описано выше, такие пептидные каркасы могут содержать по меньшей мере один из CDR, происходящих из исходного антитела. Предпочтительно, но это не является обязательным требованием, специалист в данной области выберет по меньшей мере один CDR из тяжелой цепи, причем известно, что последний в первую очередь отвечает за специфичность антитела. Выбор одного или более релевантных CDR очевиден специалисту в данной области, который затем будет выбирать известные подходящие методы (Bes et al., FEBS letters, 508, 2001, 67-74).
Конкретный аспект настоящего изобретения относится к способу отбора соединения, являющегося производным антитела по изобретению, причем указанное дериватизированное соединение способно ингибировать in vitro и/или in vivo проникновение ВИЧ в клетку и указанное дериватизированное соединение содержит пептидный каркас, на который привит по меньшей мере один CDR антитела, включающему следующие стадии:
a) приведение в контакт in vitro соединения, в состав которого входит пептидный каркас, на который привит по меньшей мере один CDR антитела, с биологическим образцом, содержащим ВИЧ 1 типа и РВМС; и
b) отбор указанного соединения, если указанное соединение способно ингибировать репликацию ВИЧ-1,
и где указанный по меньшей мере один привитый CDR выбран из следующих CDR с последовательностью SEQ ID No.1-6 и 30-33 или с последовательностью, идентичной по меньшей мере на 80%, предпочтительно на 85%, 90%, 95% и 98%, после оптимального выравнивания с последовательностью SEQ ID No.1-6 и 30-33.
Согласно предпочтительному воплощению данный способ может включать на стадии (а) приведение в контакт in vitro соединения, содержащего пептидный каркас, на который привиты по меньшей мере два или три CDR антитела.
Согласно еще одному более предпочтительному воплощению этого способа пептидный каркас выбран из каркасов или связывающих белков, структуры которых упомянуты выше.
Очевидно, что эти примеры никоим образом не являются ограничивающими, и любую другую структуру, известную или очевидную специалисту в данной области, следует рассматривать как защищенную настоящей заявкой.
Таким образом, настоящее изобретение относится к антителу или его дериватизированным соединениям либо функциональным фрагментам, где пептидный каркас выбран из белков, которые а) характеризуются хорошей филогенетической сохранностью, b) жесткой архитектурой, с) хорошо известной пространственной (3-D) молекулярной организацией, d) небольшим размером и/или е) содержат участки, которые могут быть модифицированы в результате делеции и/или вставки без изменения стабильности.
В соответствии с предпочтительным воплощением антитело по изобретению или его дериватизированные соединения либо функциональные фрагменты характеризуются тем, что указанный пептидный каркас выбран из 1) каркасов, происходящих из фибронектина, предпочтительно домена 10 фибронектина 3 типа, липокалина, антикалина, белка Z, происходящего из домена В белка А Staphylococcus aureus, тиоредоксина А, или 2) белков с повторяющимся мотивом, таким как "анкириновый повтор" (Kohl et al., PNAS, 2003, vol.100, No.4, 1700-1705), "повтор armadillo", "богатый лейцином повтор" и "тетратрикопептидный повтор", или 3) белковых ингибиторов нейронной синтазы NO (PIN).
Другой аспект изобретения относится к функциональным фрагментам антитела, описанного выше.
Более конкретно, изобретение касается антитела или его дериватизированных соединений либо функциональных фрагментов, где указанный функциональный фрагмент выбран из фрагментов Fv, Fab, F(ab')2, Fab', scFv, scFv-Fc и диател или любого фрагмента, период полувыведения которого увеличен, такого как пегилированные фрагменты.
Такие функциональные фрагменты антитела по изобретению состоят, например, из фрагментов Fv, scFv (sc = одноцепочечный), Fab, F(ab')2, Fab', scFv-Fc или диател или любого фрагмента, период полувыведения которого увеличен посредством химической модификации, например, присоединения полиалкиленгликоля, такого как полиэтиленгликоль (пегилирование) (пегилированные фрагменты обозначаются как Fv-ПЭГ, scFv-ПЭГ, Fab-ПЭГ, F(ab')2-ПЭГ и Fab'-ПЭГ), или путем инкорпорирования в липосому, микросферы или PLGA (сополимер молочной и гликолевой кислот), причем указанные фрагменты содержат по меньшей мере один из характерных CDR по изобретению, который обычно особенно способен к проявлению активности, хоть частичной, антитела, из которого он происходит.
Предпочтительно, указанные функциональные фрагменты будут содержать или включать частичную последовательность вариабельной области тяжелой или легкой цепи антитела, из которого они происходят, причем указанной частичной последовательности достаточно для сохранения той же специфичности связывания, что и у антитела, из которого она происходит, и достаточной аффинности, предпочтительно по меньшей мере равной 1/100, более предпочтительно по меньшей мере 1/10 от аффинности антитела, из которого она происходит.
Такой функциональный фрагмент будет включать по меньшей мере пять аминокислот, предпочтительно 6, 7, 8, 10, 15, 25, 50 или 100 следующих одна за другой аминокислот из последовательности антитела, из которого он происходит.
Предпочтительно, эти функциональные фрагменты будут представлять собой фрагменты типа Fv, scFv, Fab, F(ab')2, F(ab'), scFv-Fc или диатела, которые обычно имеют ту же специфичность связывания, что и антитело, из которого они происходят.В соответствии с настоящим изобретением фрагменты антитела по изобретению могут быть получены из описанных выше антител такими способами, как переваривание ферментами, такими как пепсин или папаин, и/или посредством расщепления дисульфидных мостиков в результате химического восстановления. Фрагменты антител также могут быть получены методами генетической рекомбинации, также известными специалисту в данной области, или даже посредством пептидного синтеза, например с применением автоматических пептидных синтезаторов, как например, которые выпускаются Applied Biosystems, и т.д.
Для большей ясности в приведенной ниже Таблице 2 ниже суммированы различные аминокислотные последовательности, соответствующие антителам по изобретению.
Особенно важный дополнительный аспект антител, являющихся объектом настоящего изобретения, заключается в том, что они не проявляют эффекторные функции, такие как антителозависимая клеточная цитотоксичность (ADCC) и/или комплементзависимая цитотоксичность (CDC).
Более конкретно, в качестве примера, антитела по изобретению или один из их функциональных фрагментов либо одно из их производных не обладают аффинностью к FcγR (I, II или III) или к C1q (1-й компонент системы стандартного комплемента), или к ним обоим.
Для специалиста в данной области это означает в структурном плане, что антитела по изобретению или один из их функциональных фрагментов либо одно из их производных лишены Fc-области или их Fc-область не является корректно гликозилированой для осуществления эффекторных функций.
Вследствие этого антитела по изобретению предпочтительно выбраны из изотипов IgG4 или IgG2, наиболее предпочтительно IgG4.
Аналогично, предпочтительными фрагментами являются фрагменты, лишенные ADCC, как например, фрагменты Fv, scFv (sc означает одноцепочечный), Fab, F(ab')2, Fab', scFv-Fc или диатела, или любой фрагмент, период полувыведения которого будет увеличен в результате химической модификации, например, присоединения поли(алкилен)гликоля, такого как поли(этилен)гликоль ("пегилирование") (пегилированные фрагменты обозначаются) Fv-ПЭГ, scFv-ПЭГ, Fab-ПЭГ, Р(ab')2-ПЭГ или Fab'-ПЭГ) ("ПЭГ" означает поли(этилен)гликоль), или путем инкорпорирования в липосому.
Более конкретно, предпочтительным функциональным фрагментом по изобретению, происходящим из антитела 515Н7, является scFv, далее обозначаемый как фрагмент scFv-Ck 515H7, содержащий аминокислотную последовательность SEQ ID No.54.
Нуклеотидная последовательность, соответствующая указанному scFv, содержит последовательность SEQ ID No.55.
Другой конкретный аспект настоящего изобретения относится к химерным антителам или их дериватизированным соединениям либо функциональным фрагментам, где указанные антитела также содержат константные области легкой цепи и тяжелой цепи, происходящие из антитела вида, гетерологичного мыши, а именно человеческого антитела.
Следующий другой конкретный аспект настоящего изобретения относится к гуманизированным антителам или их дериватизированным соединениям либо функциональным фрагментам, где константными областями легкой цепи и тяжелой цепи, происходящими из человеческого антитела, являются, соответственно, область лямбда или каппа и гамма-2 или предпочтительно область гамма-4.
Антитело по изобретению также содержит химерные или гуманизированные антитела.
Химерное антитело представляет собой антитело, содержащее природную вариабельную область (легкой цепи и тяжелой цепи), происходящую из антитела заданной разновидности, в комбинации с константными областями легкой цепи и тяжелой цепи антитела разновидности, гетерологичной указанной заданной разновидности.
Антитела или их химерные фрагменты могут быть получены путем использования методов генетической рекомбинации. Например, химерное антитело будет получено посредством клонирования рекомбинантной ДНК, содержащей промотор и последовательность, кодирующую вариабельную область нечеловеческого моноклонального антитела по изобретению, а именно мышиного, и последовательность, кодирующую константную область человеческого антитела. Химерное антитело по изобретению, кодируемое одним таким рекомбинантным геном, будет представлять собой, например, химерную конструкцию "мышь-человек", причем специфичность этого антитела будет определяться вариабельной областью, происходящей из мышиной ДНК, а его изотип - константной областью, происходящей из человеческой ДНК. В отношении способов получения химерных антител можно сослаться на Verhoeyn и соавт. (BioEssays, 8: 74, 1988).
В приведенной в данном описании ниже Таблице 3 суммированы аминокислотные последовательности различных тяжелых и легких цепей химерного антитела 515Н7 (обозначенного как с515Н7 или С515Н7) по изобретению.
Нуклеотидные последовательности, соответствующие указанным SEQ ID No.56-58 тяжелых цепей и SEQ ID No.59 легкой цепи антитела с515Н7, соответствуют последовательностям SEQ ID No.60-63 (тяжелые цепи) и SEQ ID No.64 (легкая цепь), соответственно.
В предпочтительном воплощении в последовательностях тяжелых цепей делегирован С-концевой остаток лизина (как имеется в оригинальной серии векторов pConPlus от Lonza: pConPlusγ4ΔK, pConPlusγ4PROΔK и pConPlusγ2ΔK).
Более того, тяжелая цепь G4PRO соответствует изотипу lgG4 человека, несущему мутацию в шарнирной области, чтобы не допустить образования половинок антител. Эта мутация имеется в родительской конструкции pConPlusγ4PROΔK от Lonza (Angal S, King DJ, Bodmer MW, Turner A, Lawson AD, Roberts G, Pedley B, Adair JR. A single amino acid substitution abolishes the heterogeneity of chimeric mouse/human (IgG4) antibody. Mol. Immunol. (1993), 30(1): 105-108).
Более конкретно, изобретение относится к тяжелой цепи химерного антитела, содержащей CDR, гомологичные соответствующим CDR антитела, происходящего из другого вида млекопитающих, причем указанные CDR согласно IMGT состоят из CDR-H1, CDR-H2 и CDR-H3, содержащих соответственно последовательности SEQ ID No.4, 5 и 6.
Более конкретно, изобретение относится к легкой цепи химерного антитела, содержащей CDR, гомологичные соответствующим CDR антитела, происходящего из другого вида млекопитающих, причем указанные CDR согласно IMGT состоят из CDR-L1, CDR-L2 и CDR-L3, содержащих соответственно последовательности SEQ ID No.1, 2 и 3.
Более конкретно, изобретение относится к химерному антителу или его дериватизированному соединению либо функциональному фрагменту, содержащему тяжелые и легкие цепи, каждая из которых имеет CDR, гомологичные соответствующим CDR антитела, происходящего из другого вида млекопитающих, причем указанные CDR согласно IMGT состоят из CDR-H1, CDR-H2 и CDR-H3 тяжелой цепи, содержащих соответственно последовательности SEQ ID No.4, 5 и 6, и CDR-L1, CDR-L2 и CDR-L3 легкой цепи, содержащих соответственно последовательности SEQ ID No.1, 2 и 3.
В другом воплощении изобретение относится к химерному антителу или его дериватизированному соединению либо функциональному фрагменту, содержащему вариабельную область тяжелой цепи с последовательностью состоящей из SEQ ID No.8, и вариабельную область легкой цепи с последовательностью SEQ ID No.7.
В следующем другом воплощении изобретение относится к химерному антителу или его дериватизированному соединению либо функциональному фрагменту, содержащему тяжелую цепь с последовательностью, выбранной из группы, состоящей из SEQ ID No.56, 57 или 58, и легкую цепь с последовательностью SEQ ID No.59.
В предпочтительном воплощении химерное антитело с515Н7 VH(G4wt)/VL-Ck или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит вариабельную область тяжелой цепи с последовательностью SEQ ID No.56, и вариабельную область легкой цепи с последовательностью SEQ ID No.59.
В предпочтительном воплощении химерное антитело с515Н7 VH(G4PRO)/VL-Ck или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит вариабельную область тяжелой цепи с последовательностью SEQ ID No.57 и вариабельную область легкой цепи с последовательностью SEQ ID No.59.
В предпочтительном воплощении химерное антитело с515Н7 VH(G2wt)/VL-Ck или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит вариабельную область тяжелой цепи с последовательностью SEQ ID No.58 и вариабельную область легкой цепи с последовательностью SEQ ID No.59.
Термин "гуманизированные антитела" означает антитело, которое содержит участки CDR, происходящие из антитела не-человеческого происхождения, причем другие части молекулы данного антитела происходят из одного (или более чем одного) человеческого антитела. К тому же, некоторые из остатков сегментов остова (называемых FR) могут быть модифицированы с целью сохранения аффинности связывания (Jones et al., Nature, 321: 522-525, 1986; Verhoeyen et al., Science, 239: 1534-1536, 1988; Riechmann et al., Nature, 332: 323-327, 1988).
Гуманизированные антитела по изобретению или их фрагменты могут быть получены с использованием методик, известных специалисту в данной области (таких как, например описанные в документах Singer et al., J. Immun., 150: 2844-2857, 1992; Mountain et al., Biotechnol. Genet. Eng. Rev., 10: 1-142, 1992; и Bebbington et al., Bio/Technology, 10: 169-175, 1992). Такие гуманизированные антитела предпочтительны для применения их в способах, включающих постановку диагнозов in vitro или превентивное и/или терапевтическое лечение in vivo. Специалисту в данной области также известны и другие методы гуманизации, такие как, например метод "CDR-привития" ("CDR Grafting"), описанный PDL (Public Documentation License) в патентах ЕР 0451261, ЕР 0682040, ЕР 0939127, ЕР 0566647 или US 5530101, US 6180370, US 5585089 и US 5693761. Также можно упомянуть патенты США 5639641 или 6054297, 5886152 и 5877293.
Помимо этого изобретение также относится к гуманизированным антителам, происходящим из мышиного антитела, описанного выше.
В предпочтительном способе получения константными областями легкой цепи и тяжелой цепи, происходящими из человеческого антитела, являются, соответственно, область лямбда или каппа и гамма-2 или предпочтительно гамма-4.
Более конкретно, изобретение относится к тяжелой цепи гуманизированного антитела, содержащей 1) каркасную область, гомологичную соответствующей каркасной области тяжелой цепи человеческого антитела, и 2) CDR, гомологичные соответствующим CDR антитела, происходящего из другого вида млекопитающих, причем указанные CDR согласно IMGT состоят из CDR-H1, CDR-H2 и CDR-H3, содержащих соответственно последовательности SEQ ID No.4, 5 и 6.
В другом воплощении изобретение относится к тяжелой цепи гуманизированного антитела, содержащей вариабельную область с последовательностью, состоящей из SEQ ID No.64.
В следующем другом воплощении изобретение относится к тяжелой цепи гуманизированного антитела, содержащей полную последовательность, выбранную из группы, состоящей из SEQ ID No.67, 68 и 69.
Более конкретно, изобретение относится к легкой цепи гуманизированного антитела, содержащей 1) каркасную область, гомологичную соответствующей каркасной области легкой цепи человеческого антитела, и 2) CDR, гомологичные соответствующим CDR антитела, происходящего из другого вида млекопитающих, причем указанные CDR согласно IMGT состоят из CDR-L1, CDR-L2 и CDR-L3, содержащих соответственно последовательности SEQ ID No.1, 2 и 3.
В другом воплощении изобретение относится к легкой цепи гуманизированного антитела, содержащей вариабельную область с последовательностью, выбранной из группы, состоящей из SEQ ID No.65, 66, 82 или 83.
В следующем другом воплощении изобретение относится к легкой цепи гуманизированного антитела, содержащей полную последовательность, выбранную из группы, состоящей из SEQ ID No.70, 71, 84 или 85.
Более конкретно, изобретение относится к гуманизированному антителу или его дериватизированному соединению либо функциональному фрагменту, содержащему тяжелые и легкие цепи, каждая из которых имеет 1) каркасные области, гомологичные соответствующим каркасным областям человеческого антитела, и 2) CDR, гомологичные соответствующим CDR антитела, происходящего из другого вида млекопитающих, причем указанные CDR согласно IMGT состоят из CDR-H1, CDR-H2 и CDR-H3 тяжелой цепи, содержащей соответственно последовательности SEQ ID No.4, 5 и 6, и CDR-L1, CDR-L2 и CDR-L3 легкой цепи, содержащей соответственно последовательности SEQ ID No.1, 2 и 3.
В другом воплощении изобретение относится к гуманизированному антителу или его дериватизированному соединению либо функциональному фрагменту, содержащему вариабельную область тяжелой цепи с последовательностью, состоящей из SEQ ID No.64, и вариабельную область легкой цепи с последовательностью, выбранной из группы, состоящей из SEQ ID No.65, 66, 82 или 83.
В следующем другом воплощении изобретение относится к гуманизированному антителу или его дериватизированному соединению либо функциональному фрагменту, содержащему тяжелую цепь с последовательностью, выбранной из группы, состоящей из SEQ ID No.67, 68 или 69, и легкую цепь с последовательностью, выбранной из группы, состоящей из SEQ ID No.70, 71, 84 или 85.
В предпочтительном воплощении гуманизированное антитело Hz515H7VH1 D76N (G4wt) / VL2-CK или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.67 и легкую цепь с последовательностью SEQ ID No.70.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7VH1 D76N (G4PRO)/VL2-Ck или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.68 и легкую цепь с последовательностью SEQ ID No.70.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7VH1 D76N (G2wt)/VL2-Ck или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.69 и легкую цепь с последовательностью SEQ ID No.70.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7 VH1 D76N (G4wt)/VL2.1-CK или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.67 и легкую цепь с последовательностью SEQ ID No.71.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7 VH1 D76N(G4PRO)/VL2.1-CK или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.68 и легкую цепь с последовательностью SEQ ID No.71.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7 VH1 D76N (G2wt)/VL2.1-Ck или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.69 и легкую цепь с последовательностью SEQ ID No.71.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7 VH1 D76N (G4wt)/VL2.2-CK или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.67 и легкую цепь с последовательностью SEQ ID No.84.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7 VH1 D76N(G4PRO)/VL2.2-CK или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.68 и легкую цепь с последовательностью SEQ ID No.84.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7 VH1 D76N (G2wt)/VL2.2-CK или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.69 и легкую цепь с последовательностью SEQ ID No.84.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7 VH1 D76N (G4wt)/VL2.3-Ck или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.67 и легкую цепь с последовательностью SEQ ID No.85.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7VH1 D76N(G4PRO)/VL2.3-Ck или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.68 и легкую цепь с последовательностью SEQ ID No.85.
В другом предпочтительном воплощении гуманизированное антитело Hz515H7 VH1 D76N (G2wt)/VL2.3-Ck или его дериватизированное соединение либо функциональный фрагмент по изобретению содержит тяжелую цепь с последовательностью SEQ ID No.69 и легкую цепь с последовательностью SEQ ID No.85.
В приведенной в данном описании ниже Таблице 4 суммированы аминокислотные последовательности различных вариабельных доменов тяжелых и легких цепей и полноразмерного (или полного), соответственно, гуманизированного антитела 515Н7 по изобретению.
В предпочтительном воплощении в последовательностях тяжелых цепей делегирован С-концевой остаток лизина (как имеется в оригинальной серии векторов pConPlus от Lonza: pConPlusy4AK, pConPlusy4PROAK и pConPlusy2AK).
Более того, тяжелая цепь G4PRO соответствует изотипу lgG4 человека, несущему мутацию в шарнирной области, чтобы не допустить образования половинок антител. Эта мутация имеется в родительской конструкции pConPlusy4PROAK от Lonza (Angal S, King DJ, Bodmer MW, Turner A, Lawson AD, Roberts G, Pedley B, Adair JR. A single amino acid substitution abolishes the heterogeneity of chimeric mouse/human (lgG4) antibody. Mol. Immunol. (1993), 30(1): 105-108).
В качестве примера, во избежание сомнений выражение "VH1" аналогично выражениям "Вариант 1 VH", "вариант 1 VH", "Вар.1 VH" или "вар.1 VH".
Необходимо понимать, что упомянутые выше в качестве примера комбинации VH/VL не являются ограничивающими. Несомненно, специалист в данной области может, без чрезмерных затрат и без приложения изобретательского таланта, перегруппировывать все VH и VL, изложенные в настоящем описании.
Новый аспект настоящего изобретения относится к выделенной нуклеиновой кислоте, которая выбрана из следующих нуклеиновых кислот (в том числе с учетом любой вырожденности генетического кода):
a) нуклеиновой кислоты, ДНК или РНК, кодирующих антитело или один из его функциональных фрагментов либо одно из его производных по изобретению;
b) нуклеиновой кислоты, содержащей последовательность ДНК, выбранную из группы последовательностей, состоящей из SEQ ID No.14-19 и 41-45;
c) нуклеиновой кислоты, содержащей последовательность ДНК, выбранную из группы последовательностей, состоящей из SEQ ID No.20, 21, 46 и 47;
d) соответствующих РНК нуклеиновых кислот, выбранных из нуклеиновых кислот, которые определены в b) или с);
e) нуклеиновых кислот, комплементарных нуклеиновым кислотам, определенным в а), b) и с); и
f) нуклеиновой кислоты, состоящей по меньшей мере из 18 нуклеотидов, способных гибридизоваться в условиях высокой жесткости по меньшей мере с одним из CDR с последовательностью SEQ ID No.14-19 и 41-45.
В приведенной ниже Таблице 5 суммированы различные нуклеотидные последовательности, относящиеся к антителам по изобретению.
Термины "нуклеиновая кислота", "последовательность нуклеиновой кислоты", "нуклеиновокислотная последовательность", "полинуклеотид", "олигонуклеотид", "полинуклеотидная последовательность" и "нуклеотидная последовательность", использованные взаимозаменяемо в настоящем описании, означают точную последовательность нуклеотидов, модифицированных или нет, определяющую фрагмент или область нуклеиновой кислоты, содержащую или не содержащую неприродные нуклеотиды и представляющую собой либо двухцепочечную ДНК, либо одноцепочечную ДНК, либо продукты транскрипции указанных ДНК.
Здесь также следует отметить, что настоящее изобретение не относится к нуклеотидным последовательностям в их природном хромосомном окружении, то есть в природном состоянии. Последовательности по настоящему изобретению выделены и/или очищены, то есть их отбирали напрямую или опосредованно, например, посредством копирования, после того, как их окружение по меньшей мере было частично изменено. Также здесь следует упомянуть выделенные нуклеиновые кислоты, полученные методами генетической рекомбинации с использованием возможностей, например, клеток хозяина, или полученные химическим синтезом.
Фраза "нуклеиновокислотные последовательности, демонстрирующие процент идентичности по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% после оптимального выравнивания с предпочтительной последовательностью" означает нуклеиновокислотные последовательности, демонстрирующие в сравнении с нуклеиновокислотной последовательностью сравнения некоторые модификации, такие как, в частности, делеция, укорочение, удлинение, слияние с образованием химерной конструкции и/или замена, в особенности точечные. Предпочтительно, чтобы они представляли собой последовательности, кодирующие точно те же аминокислотные последовательности, что и последовательность сравнения, причем это связано с вырожденностью генетического кода, или комплементарные последовательности, которые способны специфически гибридизоваться с последовательностями сравнения, предпочтительно в условиях высокой жесткости, а именно в условиях, определенных ниже.
Гибридизация в условиях высокой жесткости означает, что условия, относящиеся к температуре и ионной силе, выбраны такими, что позволяют поддерживать гибридизацию между двумя комплементарными фрагментами ДНК. С чисто иллюстративной целью предпочтительные условия высокой жесткости для стадии гибридизации с целью определения описанных выше полинуклеотидных фрагментов приведены ниже.
Гибридизацию ДНК-ДНК или ДНК-РНК проводят в две стадии: (1) предварительная гибридизация при 42°С в течение трех часов в фосфатном буфере (20 мМ, рН 7,5), содержащем 5×SSC (1×SSC соответствует раствору 0,15М NaCl+0,015 М цитрата натрия), 50% формамида, 7% додецилсульфата натрия (SDS), 10× раствор Денхардта, 5% декстрансульфата и 1% ДНК из молок лососевых; (2) первичная гибридизация в течение 20 часов при температуре, зависящей от длины зонда, (то есть: 42°С для зонда длиной более 100 нуклеотидов) с последующими двумя промывками в течение 20 минут при 20°С в 2×SSC+2% SDS, одной промывкой в течение 20 минут при 20°С в 0, 1×SSC+0,1% SDS. Последнюю промывку осуществляют в 0,1×SSC+0,1% SDS в течение 30 минут при 60°С для зонда длиной более 100 нуклеотидов. Условия гибридизации высокой жесткости, описанные выше для полинуклеотида определенного размера, могут быть адаптированы специалистом в данной области для олигонуклеотидов большей и меньшей длины в соответствии с методиками, описанными в Sambrook, et al. (Molecular cloning: a laboratory manual, Cold Spring Harbor Laboratory; 3rd edition, 2001).
Изобретение также охватывает молекулу выделенной нуклеиновой кислоты, которая выбрана из следующих нуклеиновых кислот:
a) нуклеиновой кислоты, ДНК или РНК, кодирующей тяжелую цепь гуманизированного антитела или его дериватизированного соединения либо функционального фрагмента по изобретению;
b) нуклеиновой кислоты, ДНК или РНК, кодирующей легкую цепь гуманизированного антитела или его дериватизированного соединения либо функционального фрагмента по изобретению;
c) нуклеиновой кислоты, ДНК или РНК, кодирующей гуманизированное антитело или его дериватизированное соединение либо функциональный фрагмент по изобретению;
d) нуклеиновой кислоты, комплементарной нуклеиновой кислоте, которая определена в а), b) или с);
e) нуклеиновой кислоты, состоящей по меньшей мере из 18 нуклеотидов, способных гибридизоваться в условиях высокой жесткости по меньшей мере с тяжелой цепью, содержащей нуклеиновокислотные последовательности SEQ ID No.72 или 75-77;
f) нуклеиновой кислоты, состоящей по меньшей мере из 18 нуклеотидов, способных гибридизоваться в условиях высокой жесткости по меньшей мере с легкой цепью, содержащей нуклеиновокислотные последовательности SEQ ID No.73, 74, 86, 87 или 78, 79, 88, 89.
В приведенной далее Таблице 6 суммированы нуклеотидные последовательности различных вариабельных доменов тяжелых и легких цепей и полноразмерного (или полного), соответственно, гуманизированного антитела 515Н7 по изобретению.
В приведенной ниже Таблице 7 суммированы нуклеотидные последовательности различных тяжелых и легких цепей химерного антитела 515Н7 по изобретению.
Другими словами, данное изобретение относится к выделенной нуклеиновой кислоте, которая выбрана из следующих нуклеиновых кислот:
a) нуклеиновой кислоты, ДНК или РНК, кодирующей антитело или один из его функциональных фрагментов либо одно из его производных по изобретению;
b) нуклеиновой кислоты, содержащей последовательность ДНК, выбранную из группы последовательностей CDR, состоящих из SEQ ID No.14-19 и 41-45;
c) нуклеиновой кислоты, содержащей последовательность ДНК, выбранную из группы последовательностей вариабельных доменов тяжелых и легких цепей, состоящей из SEQ ID No.20, 21, 46, 47, 72, 73, 74, 86 и 87;
d) нуклеиновой кислоты, содержащей последовательность ДНК, выбранную из группы последовательностей тяжелых и легких цепей, состоящей из SEQ ID No.60-63, 75-79, 88 и 89;
e) нуклеиновой кислоты, содержащей последовательность ДНК с SEQ ID No.55;
f) соответствующих РНК нуклеиновых кислот, выбранных из нуклеиновых кислот, которые определены в b), с), d) или е);
g) нуклеиновых кислот, комплементарных нуклеиновым кислотам, определенным в а), b), с), d) и е); и
h) нуклеиновой кислоты, состоящей по меньшей мере из 18 нукпеотидов, способных гибридизоваться в условиях высокой жесткости по меньшей мере с одним из CDR с последовательностью SEQ ID No.14-19 и 41-45.
Изобретение также относится к вектору, содержащему нуклеиновую кислоту, которая описана в данном изобретении.
Изобретение, в частности, относится к клонирующим и/или экспрессирующим векторам, которые содержат такую нуклеотидную последовательность.
Векторы по изобретению предпочтительно содержат элементы, которые позволяют осуществлять экспрессию и/или секрецию нуклеотидных последовательностей в заданной клетке хозяина. Таким образом, вектор должен содержать промотор, сигналы инициации и терминации трансляции, а также подходящие области регуляции транскрипции. Он должен стабильно поддерживаться в клетке хозяина и возможно может иметь специфические сигналы, обуславливающие секрецию транслируемого белка. Такие различные элементы отбираются и оптимизируются специалистом в данной области в соответствии с используемой клеткой хозяина. С этой целью нуклеотидные последовательности могут быть встроены в самореплицирующиеся в выбранном хозяине векторы или представлять собой интегративные векторы выбранного хозяина.
Такие векторы получают способами, обычно используемыми специалистом в данной области, и полученные клоны могут быть введены в подходящего хозяина стандартными методами, такими как липофекция, электропорация, тепловой шок или химические методы.
Векторами являются, например, векторы плазмидного или вирусного происхождения. Их используют для трансформации клеток хозяина, чтобы клонировать или экспрессировать нуклеотидные последовательности по изобретению.
Изобретение также включает клетки хозяина, трансформированные вектором или содержащие вектор, который описан в настоящем изобретении.
Клетка хозяина может быть выбрана среди прокариотических или эукариотических систем, таких как бактериальные клетки, например, но также дрожжевые клетки или клетки животных, а именно клетки млекопитающих. Также можно использовать клетки насекомых или растений.
Изобретение также относится к животным, отличающимся от человека, которые имеют трансформированную клетку по изобретению.
Другой аспект изобретения относится к способу получения антитела по изобретению или одного из его функциональных фрагментов, где указанный способ включает следующие стадии:
a) культивирование клетки хозяина по изобретению в среде и в подходящих условиях культивирования; и
b) извлечение указанного антитела или одного из его функциональных фрагментов, полученных таким образом, из культуральной среды или из указанных культивированных клеток.
Трансформированные клетки по изобретению применяются в способах получения рекомбинантных полипептидов по изобретению. Способы получения полипептида по изобретению в рекомбинантной форме, где в указанных способах используют вектор и/или клетку, трансформированную вектором по изобретению, также включены в настоящее изобретение. Предпочтительно, чтобы клетку, трансформированную вектором по изобретению, культивировали в условиях, позволяющих осуществлять экспрессию указанного выше полипептида и извлечение указанного рекомбинантного пептида.
Как уже упомянуто, клетка хозяина может быть выбрана среди прокариотических или эукариотических систем. В частности, возможна идентификация нуклеотидных последовательностей по изобретению, которые облегчают секрецию в такой прокариотической или эукариотической системе. Поэтому вектор по изобретению, несущий такую последовательность, может быть использован предпочтительно для получения подлежащих секреции рекомбинантных белков. Несомненно, очистка этих представляющих интерес рекомбинантных белков будет облегчена благодаря факту присутствия их в супернатанте клеточной культуры, а не внутри клеток хозяина.
Полипептиды по изобретению также могут быть получены химическим синтезом. Один из таких способов получения также представляет собой объект изобретения. Специалисту в данной области известны способы химического синтеза, такие как твердофазные методы (см., в частности Steward et al., 1984, Solid phase peptides synthesis, Pierce Chem. Company, Rockford, 111, 2nd ed.) или частично твердофазные методы, методы с использованием конденсации фрагментов или традиционного синтеза в растворе. Полипептиды, полученные химическим синтезом и способные содержать соответствующие неприродные аминокислоты, также включены в данное изобретение.
Антитела или их дериватизированные соединения либо функциональные фрагменты, которые могут быть получены способом по изобретению, также включены в настоящее изобретение.
Согласно еще одному аспекту настоящее изобретение относится к антителам, описанным выше, которые помимо всего прочего способны специфически связываться с представителем семейства хемокиновых рецепторов человека и/или способны специфически ингибировать репликацию Х4-тропного ВИЧ.
Согласно еще одному аспекту настоящее изобретение относится к антителам, описанным выше, которые помимо всего прочего способны специфически связываться с представителем семейства хемокиновых рецепторов человека и/или способны специфически ингибировать репликацию Х4/Р5-тропного ВИЧ.
Согласно новому воплощению изобретение относится к антителам или их дериватизированным соединениям либо функциональным фрагментам, состоящим из антител, которые являются биспецифическими в том смысле, что они содержат второй мотив, способный взаимодействовать с любым рецептором, вовлеченным в процесс проникновения ВИЧ в клетку, таким как, например, CCR5, CD4, CXCR4 (при этом данный мотив отличается от мотива антитела по настоящему изобретению, то есть нацелен на другой эпитоп) или CCR3, CCR2, CCR8, CXCR6, CXCR7, CX3CR1.
Биспецифические или бифункциональные антитела составляют второе поколение моноклональных антител, в которых две разные вариабельные области объединены в одной молекуле (Hollinger and Bohlen, 1999, Cancer and metastasis, rev. 18: 411-419). Их применимость была продемонстрирована как в терапевтической, так и в диагностической областях в связи с их способностью распознавать различные молекулы на поверхности клетки; такие антитела могут быть получены химическими методами (Glennie MJ. et al., 1987, J. Immunol. 139 2367-2375; Repp R. et al., 1995, J. Hemat., 377-382) или соматическими методами (Staerz U.D. and Bevan M.J., 1986, PNAS, 83, 1453-1457; Suresh M.R. et al., 1986, Method Enzymol., 121: 210-228), но также, предпочтительно, с применением методов генетической инженерии, которые делают возможным форсировать гетеродимеризацию и таким образом облегчать очистку желаемых антител (Merchand etal., 1998, Nature Biotech., 16: 677-681).
Эти биспецифические антитела могут быть сконструированы в виде целых IgG, биспецифических F(ab')2, Fab'-ПЭГ, диател или биспецифических scFv, а также в виде тетравалентного биспецифического антитела, в котором для каждого целевого антигена имеется два сайта связывания (Park et al., 2000, Mol. Immunol., 37(18): 1123-30), или сконструированы в виде фрагментов всего, что описано выше.
В дополнение к экономическому преимуществу, связанному с тем, что производство и введение биспецифического антитела дешевле, чем производство двух специфических антител, применение таких биспецифических антител обладает преимуществом, заключающемся в снижении токсичности лечения. Действительно, применение биспецифического антитела дает возможность уменьшить общее количество циркулирующих антител и вследствие этого возможную токсичность.
В предпочтительном воплощении изобретения биспецифические антитела представляют собой бивалентные или тетравалентные антитела.
И наконец, настоящее изобретение относится к антителам, описанным выше, или одному из их функциональных фрагментов или производных в качестве лекарственного средства.
Изобретение также относится к фармацевтической композиции, содержащей в качестве активного ингредиента соединение, состоящее из антитела по изобретению или одного из его функциональных фрагментов или производных. Предпочтительно, чтобы указанное антитело было дополнено эксципиентом и/или фармацевтически приемлемым носителем.
Изобретение также относится к композиции, которая описана выше, в качестве лекарственного средства.
В конкретном аспекте изобретения антитело или один из его функциональных фрагментов либо одно из его производных ингибирует репликацию первичного изолята KON ВИЧ-1 в РВМС с IC50 по меньшей мере 5 мкг/мл, предпочтительно по меньшей мере 10 мкг/мл.
Настоящее изобретение также включает применение антитела или композиции по изобретению для приготовления лекарства и/или лекарственного средства для предупреждения или лечения ВИЧ-инфекции.
Более конкретно, в качестве неограничивающего примера, указанная ВИЧ-инфекция представляет собой Х4-тропную ВИЧ-инфекцию.
В другом воплощении в качестве неограничивающего примера, указанная ВИЧ-инфекция представляет собой Х4/R5-тропную ВИЧ-инфекцию.
Настоящее изобретение также относится к применению антитела или его функционального фрагмента или производного, предпочтительно гуманизированного, и/или композиции по изобретению для получения лекарственного средства для ингибирования репликации ВИЧ. В общем случае настоящее изобретение относится к применению антитела или его функционального фрагмента или производного, предпочтительно гуманизированного, и/или композиции по изобретению для получения лекарственного средства для предупреждения или лечения вызываемого ВИЧ заболевания.
В настоящем описании "фармацевтический разбавитель" означает соединение или комбинацию соединений, входящее(ую) в фармацевтическую композицию, которое(ая) не вызывает побочной реакции и которое(ая), например, облегчает введение активного соединения, увеличивает его продолжительность жизни и/или эффективность в организме, увеличивает его растворимость в растворе или способствует его хранению. Такие фармацевтические носители хорошо известны и будут применяться специалистом в данной области в зависимости от природы и пути введения выбранных активных соединений.
Предпочтительно, такие соединения будут вводиться системным путем, а именно внутривенным, внутримышечным, интрадермальным, внутрибрюшинным, подкожным, интравагинальным или пероральным путем. Более предпочтительно, введение композиции, содержащей антитело по изобретению, будет осуществлено посредством введения нескольких доз, разделенных одинаковыми промежутками времени.
Пути их введения, режимы дозирования и оптимальные галеновые формы могут быть определены в соответствии с критериями, обычно учитываемыми при установлении лечения, подходящего пациенту, такие как, например, возраст или масса тела пациента, тяжесть его общего состояния, его толерантность к лечению и испытываемые побочные эффекты.
Изобретение также относится к композиции, содержащей помимо всего прочего, в виде комбинированного продукта для применения способом одновременного, раздельного или растянутого во времени введения, антитело против ВИЧ, или антитело против проникновения БИЧ в клетку, или антитело против репликации ВИЧ, отличающееся от антитела, направленного против CXCR4.
Согласно следующему другому воплощению настоящее изобретение также относится к описанной выше фармацевтической композиции, содержащей по меньшей мере второе соединение против ВИЧ, выбранное среди соединений, способных специфически ингибировать проникновение в клетку и/или репликацию ВИЧ, таких как анти-CCR5, анти-CD4 соединения и анти-CXCR4 соединения, отличные от описанных в данном изобретении, или любое другое соединение против ВИЧ, известное специалисту в данной области.
Другое воплощение, дополняющее данное изобретение, представляет собой описанную выше композицию, содержащую помимо всего прочего, в виде комбинированного или конъюгированного продукта для применения способом одновременного, раздельного или растянутого во времени введения, соединение против ВИЧ.
"Одновременное применение" означает введение обоих соединений композиции, содержащихся в разовой лекарственной форме.
"Раздельное применение" означает введение в один и тот же момент времени обоих соединений композиции, содержащихся в разных лекарственных формах.
"Растянутое во времени применение" означает последовательное введение обоих соединений композиции, каждое из которых содержится в отдельной лекарственной форме.
Обычно композиция по изобретению существенно повышает эффективность лечения ВИЧ. Другими словами, неожиданным образом терапевтический эффект антитела по изобретению оказался повышенным в результате введения средства против ВИЧ. Другое важное последующее преимущество, производимое композицией по изобретению, относится к возможности использования более низкой эффективной дозы активного ингредиента, что дает таким образом возможность избежать рисков или снизить риски появления побочных эффектов, в частности эффекта средства против ВИЧ. Более того, эта композиция предоставляет возможность достижения более быстрого ожидаемого терапевтического эффекта.
"Терапевтическое средство против ВИЧ" обозначает вещество, которое при введении пациенту "лечит или предупреждает" репликацию ВИЧ у пациента. Неограничивающие примеры таких средств включают "антиретровирусные лекарственные средства, такие как ингибиторы протеазы (PI) ВИЧ, нуклеозидные/нуклеотидные ингибиторы обратной транскриптазы (NRTI/NtRTI) ВИЧ, ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) ВИЧ, ингибиторы проникновения ВИЧ в клетку, ингибиторы интегразы ВИЧ".
Такие средства приведены, например, в справочнике ВИДАЛЬ, на страницах, отведенных соединениям, относящимся к "соединениям против ВИЧ"; при этом соединения против ВИЧ, упомянутые посредством ссылки к этому документу, приведены в данном описании в качестве неограничивающих предпочтительных средств против ВИЧ.
Термин "ингибитор протеазы ВИЧ" относится к любому веществу, которое может ингибировать активность протеазы ВИЧ. Примеры таких ингибиторов протеазы ВИЧ включают саквинавира мезилат или SQV (Invirase®), индинавир или IDV (Crixivan®), ритонавир или RTV (Norvir®), нелфинавир или NFV (Viracept®), ампренавир (Agenerase®, Prozei®), лопинавир/ритонавир или LPV/r (Kaletra®, Aluvia®), атазанавир или ATV (Reyataz®, Zrivada®), фосампренавир или FPV (Lexiva®, Telzir®), типранавир или TPV (Aptivus®), дарунавир или DRV (Prezista®), но этим не ограничиваются.
Термин "нуклеозидный или нуклеотидный ингибитор обратной транскриптазы (NRTI) ВИЧ" относится к веществу, которое представляет собой нуклеозидный или нуклеотидный аналог, блокирующий обратную транскрипцию РНК ВИЧ. Примеры NRTI включают зидовудин или AZT, ZDV (Retrovir/combivir/trixivir®), диданозин или ddi (Videx®), зальцитабин (HMD®), ставудин или d4T (Zerit®), ламивудин или 3ТС (Epivir/combivir/epzicom/trixivir®), абакавир или АВС (Ziagen/trixivir/epzicom®), тенофовира дизопроксила фумарат или TDF (Viread/atripla/truvada®), эмтрицитабин или FTC (Emtriva/atripla/truvada®), но этим не ограничиваются.
Термин "ненуклеозидный ингибитор обратной транскриптазы (NNRTI) ВИЧ" относится к веществу, которое представляет собой ненуклеозидный или ненуклеотидный аналог, блокирующий обратную транскрипцию РНК ВИЧ. Примеры NNRTI включают невирапин или NVP (Viramune®), эфавиренз или EFV (Sustiva/atripla®, Stocrin®), делавирдин или DLV (Rescriptor®) и этравирин или ETR (Intelence®), но этим не ограничиваются.
Термин "ингибитор проникновения ВИЧ в клетку" относится к веществу, которое блокирует проникновение ВИЧ в клетку. Примеры ингибиторов проникновения ВИЧ в клетку включают энфувиртид или Т20 (Fuzeon®), маравирок или MVC (Celsentri®, Celzentry®), но этим не ограничиваются.
Термин "ингибитор интегразы ВИЧ" относится к веществу, которое ингибирует активность интегразы ВИЧ. Пример ингибитора интегразы включает ралтегравир или RAL (Isentress®), но этим не ограничивается.
Такими агентами, например, также являются соединения, принадлежащие к тем же классам лекарственных средств, описанных в справочнике ВИДАЛЬ, которые в настоящее время проходят клинические испытания, такие как викривирок, PR0140, TNX-355, AMD070, рацивир, априцитабин, элвуцитабин, флосалвудин (flosalvudine), рилпивирин, элвитегравир, но этим не ограничиваются.
Такими агентами, например, также являются соединения, принадлежащие к другим возможным классам лекарственных средств, такие как ингибиторы созревания (бевиримат), гликозидные аналоги β-галактозилцерамида, агенты, связывающие углеводы, ингибиторы РНКазы Н, ингибиторы генной экспрессии ВИЧ, стимуляторы высвобождения ВИЧ из латентных Т-клеток (вальпроевая кислота…), но этим не ограничиваются.
В особенно предпочтительном воплощении в указанной композиции по изобретению, применяемой в качестве комбинированного продукта, указанное средство против ВИЧ химически связано с указанным антителом для одновременного применения.
Для облегчения связывания указанного средства против ВИЧ с антителом по изобретению между двумя этими соединениями могут быть введены молекулы спейсеров, таких как поли(алкилен)гликоль, полиэтиленгликоль или аминокислоты; или, в другом воплощении, могут быть использованы активные производные указанных средств против ВИЧ, в которые введены функциональные группы, способные взаимодействовать с указанным антителом. Эти методы связывания хорошо известны специалисту в данной области и не будут более подробно обсуждаться в настоящем описании.
Также предпочтительно, когда указанное антитело по изобретению, образующее указанный конъюгат, выбрано среди его функциональных фрагментов, а именно фрагментов, у которых отсутствует их Fc-компонент, таких как scFv-фрагменты.
Изобретение также относится к композиции, применяемой в качестве комбинированного продукта, или конъюгату Mab против CXCR4 и лекарственного средства против ВИЧ, соответствующих изобретению, которые используются в качестве лекарственного средства.
Предпочтительно, чтобы указанная композиция, применяемая в качестве комбинированного продукта, или указанный конъюгат были дополнены эксципиентом и/или фармацевтическим разбавителем.
Таким образом, данное изобретение относится к применению антитела или одного из его функциональных фрагментов либо производных для изготовления лекарственного средства для специфического мечения соединения, которое является биологически активным в отношении репликации ВИЧ.
Как продемонстрировано ранее, CXCR4-Mab 515H7 и 301аЕ5 обладают высокой активностью против репликации ВИЧ-1 в РВМС, поэтому такие антитела могут быть использованы в скрининг-анализах для идентификации антивирусных средств-антагонистов CXCR4 для лечения инфекции ВИЧ-1. На первой стадии этих анализов клетки, экспрессирующие CXCR4, инкубируют с Mab 515H7 и/или 301аЕ5, и затем молекулы можно оценить по их возможности ингибировать связывание с Mab 515H7 и/или 301аЕ5. Клетки, используемые в анализах этого типа, могут представлять собой трансфицированные клеточные линии, такие как СНО(яичников китайского хомячка)-CXCR4, NIH3T3-CXCR4 или CXCR4-трансфицированные человеческие клеточные линии, такие как U373-MAGI-CXCR4, человеческие клеточные линии, экспрессирующие CXCR4, такие как NALM6, или первичные клетки, такие как РВМС. Метод, используемый для скрининга антагонистов CXCR4, ингибирующих связывание Mab 515H7 и/или 301аЕ5 на CXCR4-экспрессирующих клетках, может представлять собой основанный на использовании клеток конкурентный твердофазный иммуноферментный анализ (ELISA), который описан Zhao Q. и соавт. (AIDS Research and Human Retroviruses, 2003, 19, pp.947-955), или изложен в протоколах с использованием метода сортировки флуоресцентно-активированных клеток (FACS), как например, описанных Juarez J. и соавт. (Leukemia, 2003, 17, pp.1294-1300).
Так, в конкретном аспекте изобретения рассматривается способ скрининга и/или идентификации молекул в качестве антивирусных средств-антагонистов CXCR4, включающий стадии:
a) отбора клеток, экспрессирующих CXCR4,
b) инкубации указанных клеток с антителом или одним из его функциональных фрагментов либо производных по изобретению, и
c) оценки тестируемых молекул по их способности ингибировать связывание антитела или одного из его функциональных фрагментов либо производных с CXCR4, и
d) отбора молекул, способных осуществлять указанное ингибирование.
В другом конкретном воплощении можно добавить следующую стадию (е):
e) тестирование этих молекул в анализе репликации ВИЧ-1.
Другие характеристики и преимущества данного изобретения станут ясными далее из описания примеров и графических материалов, подписи к которым представлены ниже.
ПОЯСНЕНИЯ К ГРАФИЧЕСКИМ МАТЕРИАЛАМ
На Фиг.1А и 1В показана стратегия отбора на предмет экспрессии CXCR4 на моноцитах и лимфоцитах.
Фиг.1А: окрашивание Т-клеток с использованием антитела CD3-PE (РЕ представляет собой фикоэритрин).
Фиг.1В: окрашивание моноцитов с использованием антитела CD14-PE.
На Фиг.2А и 2В показано связывание Mab против CXCR4 515Н7 и 301аЕ5 на моноцитах и Т-лимфоцитах.
На Фиг.3А и 3В показано модулирование димера рецептора CXCR4 под действием SDF-1 и под действием Mab против CXCR4 515Н7 и 301аЕ5, соответственно по данным подхода с применением резонансного переноса энергии биолюминесценции (BRET) в клетках HEK293.
На Фиг.4А и 4В и Фиг.5 показана способность Mab против CXCR4 515Н7 и 301аЕ5 ингибировать репликацию изолята KON ВИЧ-1 (Х4-тропного вируса) в РВМС человека.
На Фиг.6А, 6В и 6С показано ингибирование SDF-1-индуцированного высвобождения кальция в клетках CHO-CXCR4 под действием Mab 515Н7 (Фиг.6А), 301аЕ5 (Фиг.6В) и с515Н7 (Фиг.6С).
На Фиг.7 и 8 показана способность Mab против CXCR4 515Н7, с515Н7 и 301аЕ5 ингибировать репликацию первичных изолятов MN (Фиг.7) и 92UG024 (Фиг.8) Х4-тропного вируса ВИЧ-1 в РВМС человека.
На Фиг.9 показана способность Mab против CXCR4 515Н7, с515Н7 и 301аЕ5 ингибировать репликацию первичных изолятов KON, MN и 92UG024 Х4-тропного вируса ВИЧ-1 в РВМС человека.
На Фиг.10 и 11 показана способность Mab против CXCR4 515Н7, с515Н7 и 301аЕ5 ингибировать репликацию первичного изолята 89.6 вируса ВИЧ-1 с двойной Х4/R5-тропностью в РВМС человека.
На Фиг.12 показан благоприятный эффект комбинации Mab с515Н7 и маравирока в ингибировании репликации первичного изолята 89.6 ВИЧ-1 (вируса с двойной Х4/R5-тропностью) в РВМС человека.
На Фиг.13 показан благоприятный эффект комбинации Mab с515Н7 и маравирока в ингибировании репликации первичного изолята UG93067 ВИЧ-1 (вируса с двойной Х4/R5-тропностью) в РВМС человека.
На Фиг.14 показана способность Mab против CXCR4 515Н7, с515Н7 и 301аЕ5 ингибировать репликацию первичного изолята KON Х4-тропного вируса ВИЧ-1 в РВМС.
Фиг.15 иллюстрирует специфичность связывания Mab c515H7 посредством FACS-анализа.
Фиг.16 иллюстрирует влияние Mab c515H7 на гомодимер CXCR4 по данным подхода с применением резонансного переноса энергии биолюминесценции (BRET).
Фиг.17: выравнивание аминокислотных последовательностей вариабельного домена тяжелой цепи 515Н7 относительно IGHV3-49*04 и IGHJ4*01 зародышевой линии человека. Аминокислотную последовательность VH 515Н7 выравнивают относительно отобранных последовательностей акцепторного каркаса антитела человека. Последовательности Вар.1 VH (VH1) соответствуют гуманизированным вариантам VH-доменов 515Н7. Единственная обратная мутация в положении 76 выделена жирным шрифтом.
Фиг.18: выравнивание аминокислотных последовательностей легкой цепи 515Н7 относительно IGKV4-1*01 и IGKJ1*01 зародышевой линии антитела человека. Аминокислотную последовательность VL 515Н7 выравнивают относительно отобранных последовательностей акцепторного каркаса человека. Последовательности Вар.2.1, Вар.2.2 и Вар.2.3 VL соответствуют реализованным гуманизированным вариантам Вар.2 VL гуманизированного 515Н7, при этом подвергнутые мутации остатки выделены жирным шрифтом. Вар.2.1 и Вар.2.2 несут еще 4 гуманизированных остатка, тогда как Вар.2.3 содержит еще 5 остатков человеческого антитела.
Фиг.19: перекрестное блокирование биотинилированного мышиного антитела 515Н7 химерным 515Н7 и разными вариантами гуманизированного 515Н7. Активность гуманизированных вариантов 515Н7 (Hz515H7) в отношении перекрестного блокирования родительского мышиного антитела 515Н7 оценивали с использованием проточной цитометрии, применяя СХСК4-трансфицированные NIH3T3-клетки. Активность гуманизированных вариантов сравнивали с химерным 515Н7. Перекрестная блокирующая активность варианта VH1 в комбинации с химерной VL (cVL) была очень похожа на активность химерной конструкции (А). Что касается комбинации с вариантом 2 VL, то не было обнаружено никакого уменьшения активности для варианта 1 VH (VH1, варианта без каких-либо обратных мутаций)(В).
Фиг.20: ингибирование химерным 515Н7 и разными вариантами гуманизированного 515Н7 связывания биотинилированного SDF-1. Способность гуманизированного варианта 515Н7 (Hz515H7) ингибировать связывание SDF-1 оценивали с применением проточной цитометрии, используя клеточную линию RAMOS. Ингибирующую способность гуманизированных вариантов сравнивали с химерным 515Н7. Гуманизированный вариант Hz515H7 VH1 D76N VL2 обладал сходной способностью к ингибированию связывания SDF-1, как и химерное антитело. Фрагмент гуманизированного антитела Hz515 VH1 VL2 был полностью активным в ингибировании связывания SDF-1 с клетками RAMOS.
На Фиг.21 показано специфическое связывание гуманизированных Mab 515Н7 (Hz515H7 VH1 D76N VL2, Hz515H7 VH1 D76N VL2.1, Hz515H7 VH1 D76N VL2.2 и HzZ515H7 VH1 D76N VL2.3) с CXCR4 на клетках NIH3T3-CXCR4.
На Фиг.22 показано влияние гуманизированных Mab 515Н7 (Hz515H7 VH1 D76N VL2, Hz515H7 VH1 D76N VL2.1, Hz515H7 VH1 D76N VL2.2 и Hz515H7 VH1 D76N VL2.3) на гомодимер CXCR4 по данным подхода с применением резонансного переноса энергии биолюминесценции (BRET).
ПРИМЕРЫ
Пример 1. Получение моноклональных антител (Mab) против CXCR4 человека
Для получения моноклональных антител к CXCR4 мышей Balb/c иммунизировали, используя рекомбинантные клетки NIH3T3-CXCR4 и/или пептиды, соответствующие внеклеточным N-концу и петлям CXCR4. Мышей в возрасте 6-16 недель иммунизировали однократно антигеном в полном адъюванте Фрейнда подкожно (п/к), затем проводили 2-6 п/к иммунизации антигеном в неполном адъюванте Фрейнда. Иммунный ответ регистрировали, производя заборы крови из ретроорбитального синуса. Скрининг сыворотки крови проводили посредством ELISA (как описано ниже) и для слияния использовали мышей с более высокими титрами антител против CXCR4. Мышам проводили внутривенную бустер-иммунизацию антигеном за двое суток перед умерщвлением и извлекали селезенку.
- ELISA
Для отбора мышей, продуцирующих антитела против CXCR4, образцы сыворотки крови иммунизированных мышей тестировали посредством ELISA. Вкратце, микротитрационные планшеты покрывали очищенным N-концевым [1-41]-пептидом, конъюгированным с BSA (бычьим сывороточным альбумином) в концентрации 5 мкг-эквивалентов пептида/мл (100 мкл/лунка), инкубировали при 4°С в течение ночи, затем блокировали 0,5%-ым желатином в PBS (забуференном фосфатом физиологическом растворе) (250 мкл/лунка). В каждую лунку добавляли разведения плазмы крови CXCR4-иммунизированных мышей и инкубировали 2 часа при 37°С. Планшеты промывали PBS и затем инкубировали с антителом козы против мышиного IgG, конъюгированным с HRP (пероксидазой хрена) (Jackson Laboratories), в течение 1 часа при 37°С. После промывки планшеты обрабатывали субстратом ТМВ (тетраметилбензидином), реакцию останавливали через 5 мин, добавляя 1 M H2SO4(100 мкл/лунка). Мышей, у которых развились самые высокие титры антител против CXCR4, использовали для получения антител.
- Получение гибридом, продуцирующих Mab к CXCR4
Слияние мышиных спленоцитов, выделенных из мышей Balb/c, у которых развились самые высокие титры антител против CXCR4, с линией миеломных клеток мыши Sp2/O проводили, используя ПЭГ. Клетки рассевали в количестве приблизительно 1×105/лунка в микротитрационных планшетах, после чего инкубировали в течение двух недель в селективной среде, содержащей среду UltraCulture+2 мМ L-глутамин+1 мМ пируват натрия+1×НАТ (гипоксантин, аминоптерин, тимидин). Далее посредством ELISA проводили скрининг лунок на предмет моноклональных IgG антител против CXCR4. Затем гибридомы, секретирующие антитела, по меньшей мере дважды подвергали субклонированию, используя метод предельных разведении, культивировали in vitro для получения антитела для дальнейших анализов.
Пример 2. Характеристика специфичности связывания Mab против CXCR4 515Н7 и 301аЕ5 (трансфектанта NIH3T3-CXCR4) с использованием FACS-анализа
В этом эксперименте специфическое связывание Mab против CXCR4 515Н7 и 301аЕ5 с CXCR4 человека (hCXCR4) изучали, используя FACS-анализ.
Клетки NIH3T3 и NIH3T3-hCXCR4-трансфицированные клетки инкубировали с моноклональными антителами 515Н7 и 301аЕ5 в концентрации 10 мкг/мл. Затем клетки промывали смесью 1% BSA/PBS/0,01% NaN3. Далее к клеткам добавляли Alexa-меченные вторичные антитела и оставляли инкубироваться при 4°С в течение 20 мин. Затем клетки вновь дважды промывали. После второй промывки проводили FACS-анализ. Результаты этих исследований связывания представлены в следующей далее Таблице 8, в которой показано (согласно средней интенсивности флуоресценции (MFI), полученной с использованием FACS), что Mab против CXCR4 515Н7 и 301аЕ5 связываются специфически с клеточной линией NIH3T3, трансфицированной CXCR4 человека, тогда как никакого распознавания на родительских NIH3T3-клетках нет.
Пример 3. Характеристика связывания Mab против CXCR4 515Н7 и 301аЕ5 с мононуклеарными клетками периферической крови (РВМС) с использованием FACS-анализа
Кровь получали в виде светлого слоя кровяного сгустка от здорового донора. По 100 мкл цельной крови инкубировали с антителами против CXCR4 человека (клоны 515Н7 и 301аЕ5) в указанной концентрации в течение 20 минут при 4°С. Кровь трижды промывали в смеси PBS-BSA (1%)-NaN3 (0,01%) и инкубировали с меченными Alexa 488 антителами козы против IgG человека в разбавлении 1:500 (Invitrogen) в течение 20 минут при 4°С. Затем клетки промывали и инкубировали с CD14-PE (Caltag) или CD3-PE (Caltag) в течение 10 минут при 4°С и промывали три раза. Лизис эритроцитов осуществляли, используя раствор High-Yield lyse (Caltag), в течение 10 минут при комнатной температуре. Клетки незамедлительно анализировали, используя Facscalibur (проточный цитометр) (Becton-Dickinson). Экспрессию CXCR4 на моноцитах осуществляли, используя С014-положительные клетки, а экспрессию CXCR4 на Т-клетках осуществляли, используя CD3-положительные клетки (Фиг.1). Результаты выражены в виде антигенсвязывающей способности (АВС).
Как показано на Фиг.2А и 2 В, клоны 515Н7 и 301аЕ5 против CXCR4 человека окрашивали как Т-лимфоциты (Фиг.2А), так и моноциты (Фиг.2 В), указывая на то, что Mab 515Н7 и 301аЕ5 способны распознавать природную форму CXCR4, экспрессируемую на клеточной поверхности моноцитов и Т-лимфоцитов.
Пример 4. Влияние Mab 515Н7 и 301аЕ5 на гомодимер CXCR4 по данным подхода с применением резонансного переноса энергии биолюминесценции (BRET)
Этот функциональный анализ позволяет оценить влияние конформационных изменений, индуцируемых SDF-1 и/или связыванием Mab 515Н7 с рецептором CXCR4 на уровне гомодимера CXCR4.
Экспрессирующие векторы для исследуемых взаимодействующих партнеров конструировали в виде векторов, кодирующих белки, слитые с соответствующим "красителем" (люциферазой Renilla reniformis, Rluc, и желтым флуоресцентным белком, YFP), применяя традиционные методы молекулярной биологии. За двое суток до проведения экспериментов с применением BRET проводили временную трансфекцию клеток HEK293 экспрессирующими векторами, кодирующими соответствующие партнеры для BRET: [CXCR4/Rluc+CXCR4/YFP] с целью изучения гомодимеризации CXCR4. Спустя одни сутки клетки размещали в предварительно покрытых полилизином белых планшетах 96 MW (многолуночных на 96 лунок; от англ. multi-well plates) в полной культуральной среде (DMEM (модифицированной Дульбекко среде Игла), дополненной 10% FBS (фетальной телячьей сыворотки)). Сначала клетки культивировали при 37°С с 5% CO2, чтобы дать возможность клеткам прикрепиться к планшету. Затем клетки в течение ночи подвергали голоданию, используя по 200 мкл DMEM/лунка. Непосредственно перед проведением эксперимента с применением BRET DMEM удаляли и клетки быстро промывали PBS. Далее клетки инкубировали в PBS в присутствии или в отсутствие антитела в течение 10 мин при 37°С, после чего добавляли 5 мкМ коэлентеразин Н вместе с SDF-1 (300 нМ) или без него в конечном объеме 50 мкл. После инкубации в течение следующих 10 минут при 37°С начинали измерения эмиссии света при 485 нм и 530 нм, используя многомодальный ридер (multilabel reader) Mithras LB940 (Berthold) (1 с/длина волны/лунка, повтор 15 раз при комнатной температуре).
Расчет соотношения BRET проводили, как описано ранее (Angers и соавт., 2000):
[(эмиссия530 нм)-(эмиссия485 нм)×Cf]/(эмиссия485 нм),
где Cf=(эмиссия530 нм)/(эмиссия485 нм), для клеток, экспрессирующих в тех же экспериментальных условиях только слитый с Rluc белок. Упрощение этого выражения показывает, что соотношение BRET соответствует соотношению 530/485 нм, полученному, когда присутствуют два партнера по BRET, скорректированному с учетом соотношения 530/485 нм, полученного в тех же экспериментальных условиях, когда в данном анализе присутствует только один партнер, слитый с Rluc. Для удобочитаемости результаты выражают в единицах миллиВРЕТ (mBU); mBU соответствует соотношению BRET, умноженному на 1000.
SDF1 (300 нМ) увеличивал примерно на 20% сигнал BRET, обусловленный пространственной близостью адапторного и акцепторного белков, слитых с рецептором CXCR4, это по-видимому указывает на образование гомодимеров CXCR4/CXCR4 или на конформационные изменения в уже существующих димерах (Фиг.3А и В). Mab 515H7 и 301аЕ5 были способны модулировать SDF1-индуцированные конформационные изменения гомодимеров CXCR4 (ингибирование на 69% SDF1-индуцированного увеличения сигнала BRET для 515H7 и 301аЕ5, Фиг.3А и В). Сами Mab 515H7 и 301аЕ5 также были способны модулировать пространственную близость CXCR4/CXCR4, что указывает на влияние Mab 515H7 и 301аЕ5 на конформацию гомодимера CXCR4/CXCR4. (Фиг.3А и 3В).
Пример 5. Ингибирование репликации первичного изолята KON ВИЧ-1 (Х4-тропного вируса) в РВМС человека под действием Mab против CXCR4 515Н7 и 301аЕ5
РВМС от нормальных доноров, серонегативных в отношении ВИЧ-1, выделяли из светлых слоев кровяного сгустка или с использованием цитафереза посредством центрифугирования в градиенте фиколл-гипак. РВМС активировали в присутствии РНА (фитогемагглютинина) в клеточной культуральной среде RPMI 1640 (Roswell Park Memorial Institute), содержащей 25 мМ HEPES (N-2-гидроксиэтил-пиперазин-N-2-этансульфоновую кислоту), 5 мл пенициллина (10000 ед./мл)-стрептомицина (10000 мкг/мл), 2 мМ L-глутамин, дополненной 10% инактивированной нагреванием FCS, и использовали в качестве клеточных мишеней в анализе нейтрализации в течение одного цикла. Репликацию ВИЧ-1 в первичных РВМС человека осуществляли, оценивая внутриклеточное окрашивание вирусного антигена р24 посредством FACS-анализа. Вкратце, Mab 515H7, 301аЕ5 и 12G5 (R&D Systems) в различных разведениях или культуральную среду в качестве контроля (RPMI 1640, 10% FCS, 0,1% IL-2 (интерлейкина-2)) (по 25 мкл на одну лунку) инкубировали в течение 1 ч при 37°С вместе с разведением первичного изолята KON Х4-ВИЧ-1 (по 25 мкл на одну лунку) в двух повторах. К данной смеси Mab/вирус добавляли РНА-активированные РВМС человека (25 мкл/лунка; 20×106 клеток/мл) в 96-луночном планшете (с U-образным дном, Costar 3599) и культивировали в течение 24-36 часов при 37°С в RPMI 1640, 10% FCS и 0,1% IL-2. Вводили контроль, состоящий из неинфицированных РВМС в среде без Mab. Для детекции ВИЧ-инфицированных РВМС проводили внутриклеточное окрашивание вирусного антигена р24 и анализировали посредством проточной цитометрии. Клетки фиксировали и пермеабилизировали, используя набор Cytofix/Cytoperm (Becton Dickinson) в соответствии с протоколами производителя, окрашивали флуоресцентным Mab против р24 (клон KC57 - Coulter Beckman), используя разведение 1/160, инкубировали в течение 10 мин при 4°С в темноте. После промывки в среде PBS-3% FCS РВМС разбавляли в PBS, после чего проводили анализ посредством проточной цитометрии. Процентное содержание р24-положительных клеток в разных образцах определяли, пропуская 20000 событий на одну популяцию живых клеток. Субпопуляции живых клеток анализировали на предмет экспрессии р24 относительно фонового окрашивания неинфицированных клеток. Количество положительных в отношении антигена р24 клеток получали после вычитания фоновых событий для фиктивно инфицированных клеток. Процент нейтрализации определяли как уменьшение количества р24-положительных клеток по сравнению с контрольными инфицированными лунками, не содержащими Mab. Нейтрализующий титр определяли как разведение Mab, обеспечивающее снижение на 90% содержания инфицированных клеток. Mab против CXCR4 515Н7 и 301аЕ5 сравнивали с Mab 12G5, известным Mab против CXCR4 в качестве Mab сравнения для применения в исследовании ВИЧ. Как показано на Фиг.4А и В и 5, Mab против CXCR4 515Н7 и 301аЕ5 способны ингибировать репликацию первичного изолята KON ВИЧ-1 в РВМС с IC90, равной 10 мкг/мл (66 нМ) и 150 мкг/мл (1 мкМ), соответственно, тогда как Mab 12G5 не ингибировало репликацию первичного изолята KON ВИЧ-1 в РВМС (Фиг.4А).
Пример 6. Опосредованная рецептором CXCR4 мобилизация кальция из внутриклеточных депо
Этот функциональный анализ был разработан для регистрации передачи сигнала с участием рецептора CXCR4 посредством стимулирования пути фосфолипазы С, включая высвобождение кальция из внутриклеточных депо эндоплазматического ретикулума.
Клетки СНО-K1, стабильно и конститутивно экспрессирующие рецептор CXCR4 человека, получали после трансфекции ранее не подверженных экспериментам клеток СНО-K1 (№ в АТСС (Американской коллекции типовых культур) CCL-61) экспрессирующим вектором для млекопитающих, несущим полную кодирующую последовательность рецептора CXCR4 человека (№ в базе данных RefSeq (Reference Sequence standards) NM_003467). Клетки подращивали в полной культуральной среде (DMEM с питательной смесью Хэма F12, дополненной 5% фетальной телячьей сыворотки (FCS) и генетицином (500 мкг/мл)). Клетки рассевали в черные 96 MW-планшеты с плотностью 100000 клеток/лунка в соответствующей культуральной среде. Клетки подвергали голоданию в течение ночи перед проведением экспериментов. Клетки нагружают флуоресцентным красителем на кальций (Fluo-4 No Wash (NW, без промывки), Invitrogen US) в загрузочном буфере (HBSS (сбалансированный солевой раствор Хенкса) 1×; HEPES, 20 мМ; пробеницид (кислота), 25 мМ) в течение 30 мин при 37°С, затем в течение 30 мин при 25°С. Стимуляцию под действием SDF-1 осуществляли прямым введением в каждую лунку. В экспериментах по изучению антагонизма непосредственно в загрузочный буфер добавляют 10 мкл раствора Mab по меньшей мере за 10 мин до введения SDF-1. Измерения кинетики флуоресценции проводят на мультимодальном флуоресцентном микропланшетном ридере Mithras LB940 (Berthold), используя следующие настройки: для возбуждения - 485 нм, для эмиссии - 535 нм, для энергии возбуждения - 10000 условных единиц. Флуоресценцию в каждой лунке регистрируют каждую секунду в течение 0,1 секунды и в течение периода времени 20 с перед введением SDF-1 (базисный сигнал). Затем вводят 20 мкл раствора SDF-1 и производят регистрацию данных в течение периода времени 2 мин. Каждое из условий эксперимента выполняют в двух повторах. Величины для каждой лунки первоначально корректируют, вычитая базисную флуоресценцию и флуоресценцию, эмиттируемую контрольной лункой без клеток. Относительные данные выражают в виде процента от максимальной стимуляции, полученной под действием SDF-1 (100 нМ).
SDF-1 (100 нМ) индуцировал быстрое и значительное высвобождение внутриклеточного кальция в рекомбинантных CHO/CXCR4, тогда как для ранее не подверженных экспериментам клеток СНО-K1 никакого флуоресцентного сигнала не зарегистрировано. Максимальная интенсивность достигала более 140% от базисной флуоресценции и наблюдалась примерно через 40 с после стимуляции посредством SDF-1 (Фиг.6А, 6В и 6С). Mab 515Н7 (133 нМ) (Фиг.6А) и с515Н7 (133 нМ) (Фиг.6С) вызывали сильное ингибирование кальциевого сигнала, индуцируемого SDF-1 (100 нМ). Mab 301аЕ5 (133 нМ) (Фиг.6В) вызывало частичное ингибирование кальциевого сигнала, индуцируемого SDF-1 (100 нМ).
Пример 7. Ингибирование репликации первичных изолятов KON, MN и 92UG024 ВИЧ-1 (Х4-тропных вирусов) в РВМС человека под действием Mab против CXCR4 515Н7, с515Н7 и 301аЕ5
Анализ нейтрализации в течение одного цикла
Этот анализ проводят в течение 36 ч с использованием первичных изолятов KON, MN и 92UG024, концентрированных и соответственно разбавленных для возможности детекции 2% инфицированных CD4 Т-лимфоцитов через 2 суток инфекции.
По двадцать пять микролитров растворов Mab 515Н7, с515Н7 и 301аЕ5 в различных разведениях инкубировали в течение 1 ч при 37°С вместе с 25 мкл образцов вируса. РВМС человека (25 мкл, 20×106 клеток/мл) добавляли к смеси Мао/вирус в 96-луночном планшете (с U-образным дном, Costar 3599) и культивировали в течение 36 ч в RPMI 1640 с 10% FCS и 20 ед/мл IL-2 (R&D Systems, Minneapolis, MN).
Через 2 суток культивирования проводили детекцию ВИЧ-инфицированных лимфоцитов посредством внутриклеточного окрашивания вирусного Ag (антигена) р24. Клетки фиксировали и пермеабилизировали, используя как набор Cytofix/Cytoperm, так и набор Perm/Wash (BD Biosciences) в соответствии с инструкциями производителя, и окрашивали флуоресцентным анти-р24 Mab (ПТС(флуоресцеинизотиоцианат)- или РЕ-анти-р24, клон KC57; Beckman Coulter/lmmunotech, Hialeah, FL), используя разведение 1/160 в растворе Perm/Wash, добавленным на 15 мин при 4°С. После промывки в PBS, содержащем 3% FBS, РВМС разбавляли в 300 мкл PBS, после чего проводили анализ посредством проточной цитометрии (LSRII; BD Biosciences) с программным обеспечением DIVA (BD Biosciences). Процентное содержание р24-положительных клеток в разных образцах определяли, пропуская 20000 событий на одну популяцию живых клеток, идентифицированных по параметрам прямого и бокового светорассеяния. Субпопуляции живых клеток анализировали, используя набор растворов для окрашивания живых/мертвых клеток (live/dead solution kit, Invitrogen). Количество р24 Ag-положительных клеток получали после вычитания фоновых событий для фиктивно инфицированных клеток.
Процент нейтрализации определяли как уменьшение количества р24-положительных клеток по сравнению с контрольными инфицированными лунками, не содержащими Mab. Нейтрализующий титр определяли как концентрацию антитела (полученную интерполяцией в диапазоне последовательных разведении, проведенных в трех повторах), обеспечивающую снижение на 90% содержания инфицированных клеток.
Как показано на Фиг.7, 8 и 9, Mab против CXCR4 515Н7, с515Н7 и 301аЕ5 способны ингибировать репликацию первичных изолятов MN, KON и 92UG024 Х4-ВИЧ-1 в РВМС. Результаты для IC (в мкг/мл) суммированы в Таблице 9.
Пример 8. Ингибирование репликации первичного изолята 89.6 ВИЧ-1 (вируса с двойной Х4/R5-тропностью) в РВМС человека под действием Mab против CXCR4 515Н7, с515Н7 и 301аЕ5
Анализ нейтрализации в течение одного цикла
Этот анализ проводят в течение 36 ч с использованием первичного изолята 89.6, концентрированного и соответственно разбавленного для возможности детекции 2% инфицированных CD4 Т-лимфоцитов через 2 суток инфекции.
По двадцать пять микролитров растворов Mab 515H7, с515Н7 и 301аЕ5 в различных разведениях инкубировали в течение 1 ч при 37°С вместе с 25 мкл образцов вируса. РВМС человека (25 мкл, 20×106 клеток/мл) добавляли к смеси Mab/вирус в 96-луночном планшете (с U-образным дном, Costar 3599) и культивировали в течение 36 ч в RPMI 1640 с 10% FCS и 20 ед/мл IL-2 (R&D Systems, Minneapolis, MN).
Через 2 суток культивирования проводили детекцию ВИЧ-инфицированных лимфоцитов посредством внутриклеточного окрашивания вирусного Ag р24. Клетки фиксировали и пермеабилизировали, используя как набор Cytofix/Cytoperm, так и набор Perm/Wash (BD Biosciences) в соответствии с инструкциями производителя, и окрашивали флуоресцентным анти-р24 Mab (FITC- или РЕ-анти-р24, клон KC57; Beckman Coulter/lmmunotech, Hialeah, FL), используя разведение 1/160 в растворе Perm/Wash, добавленным на 15 мин при 4°С. После промывки в PBS, содержащем 3% FBS, РВМС разбавляли в 300 мкл PBS, после чего проводили анализ посредством проточной цитометрии (LSRII; BD Biosciences) с программным обеспечением DIVA (BD Biosciences). Процентное содержание р24-положительных клеток в разных образцах определяли, пропуская 20000 событий на одну популяцию живых клеток, идентифицированных по параметрам прямого и бокового светорассеяния. Субпопуляции живых клеток анализировали, используя набор растворов для окрашивания живых/мертвых клеток (Invitrogen). Количество р24 Ag-положительных клеток получали после вычитания фоновых событий для фиктивно инфицированных клеток.
Процент нейтрализации определяли как уменьшение количества р24-положительных клеток по сравнению с контрольными инфицированными лунками, не содержащими Mab. Нейтрализующий титр определяли как концентрацию антитела (полученную интерполяцией в диапазоне последовательных разведении, проведенных в трех повторах), обеспечивающую снижение на 90% содержания инфицированных клеток.
Как показано на Фиг.10 и 11, Mab против CXCR4 515H7, с515Н7 и 301аЕ5 способны ингибировать репликацию первичного изолята 89.6 ВИЧ-1 в РВМС. Результаты для IC (в мкг/мл) суммированы в Таблице 10.
Пример 9. Ингибирование репликации первичных изолятов 89.6 и UG93067 ВИЧ-1 (вирусов с двойной Х4/R5-тропностью) в РВМС человека под действием Mab против CXCR4 с515Н7 в комбинации с молекулой маравирока - антагониста CCR5
Анализ нейтрализации для исследования многократных раундов репликации первичного изолята ВИЧ в первичных РВМС
В этом анализе, в котором объединяют серийные разведения Mab с515Н7 или маравирока либо комбинации их обоих с серийными разведениями вируса, анализируют многократные раунды инфекции на РВМС (мононуклеарных клетках периферической крови). Вкратце, каждую из взятых в четырех повторах аликвот (25 мкл) серийных разведении (двукратных) Mab с515Н7 или маравирока либо комбинации их обоих инкубировали с 25 мкл серийных разведении вируса в предварительно увлажненных 96-луночных фильтровальных планшетах (размер пор 1,25 мкм; Durapor Dv; Millipore, Molsheim, France). Контрольное титрование вируса (с заменой разбавленных Mab с515Н7 или маравирока на 25 мкл RPMI) проводили в том же планшете, что и титрования в присутствии разведении Mab с515Н7 или маравирока либо комбинации их обоих. Через 1 ч при 37°С добавляли 25 мкл РНА-стимулированных РВМС в концентрации 4×106 клеток/мл (пул РНА-активированных РВМС от пяти здоровых доноров) с получением конечного объема (75 мкл) культуры, содержащей RPMI, 10% фетальной телячьей сыворотки (FCS) и 20 ME (международных единиц) интерлейкина-2 (IL-2) на один мл (R&D Systems). Через 24 ч при 37°С добавляли 100 мкп той же культуральной среды. На 4-е сутки для удаления Mab с515Н7 и маравирока делали две промывки (по 200 мкл RPMI каждая) посредством фильтрации и добавляли 200 мкл свежей культуральной среды. На 7-е сутки в культуральных супернатантах измеряли наличие р24, используя ELISA, и сравнивали с таковым в отрицательных контролях (в культурах, инфицированных разведениями вируса и поддерживаемых в присутствии 10-6 М зидовудина (AZT)) для определения "положительных" лунок. Для определения вирусного титра (средней цитопатогенной дозы (инфицирующей 50% клеток) (TCID50)) использовали лунки в четырех повторах в отсутствие (V0) и в присутствии (Vn) каждого из разведении Mab с515Н7 или маравирока либо комбинации их обоих. Нейтрализующий титр определяли как разведение Mab с515Н7 или маравирока либо комбинации их обоих, приводящее к уменьшению на 90% вирусного титра (Vn/V0=0,1).
Как показано на Фиг.12, репликация изолята 89.6 вируса с двойной X4/R5-тропностью ингибировалась Mab с515Н7 с IC90, равной 2 мкг/мл (Фиг.12). Маравирок в концентрации 50 мкг/мл не достигал данной величины (по IC90) ингибиторной активности (Фиг.12). Вместе с тем, добавление маравирока в концентрации 2 мкг/мл к антителу 515Н7 увеличивало ингибиторную активность Mab с515Н7 до IC90 0,2 мкг/мл (Фиг.12).
Благоприятный эффект комбинации Mab с515Н7 и маравирока оценивали, используя различные разведения этих двух соединений и другого изолята вируса с двойной тропностью - UG93067. Как показано на Фиг.13, ингибиторная активность Mab с515Н7 и маравирока была одинаковой. Эти результаты являются подтверждением того, что способность изолята UG93067 вируса к использованию либо рецептора CCR5, либо рецептора CXCR4 была сопоставимой. С использованием UG93067 вируса можно было подтвердить, что только комбинация этих ингибиторов, а именно, Х4-ингибитора (Mab с515Н7) и R5-ингибитора (маравирока) (10 мкг/мл каждого) позволили получить снижение титра вируса на 90% (Фиг.13).
Пример 10. Получение с515Н7 - химерного Mab против CXCR4
Была разработана химерная конструкция мышиного Mab 515Н7: она соответствует вариабельным доменам легких и тяжелых цепей представляющего интерес мышиного антитела, генетически слитым с константными доменами Скаппа и IgG1/IgG2/IgG4 человека. Такое рекомбинантное Mab получали после осуществления временной трансфекции посредством использования системы HEK293/EBNA (ядерный антиген вируса Эпштейна-Барр; от англ. Epstein Ban-Nuclear Antigen) вместе с экспрессирующим вектором рСЕР4 (InVitrogen, US).
Соответствующие аминокислотные и нуклеотидные последовательности были изложены выше в описании. Кроме того, наряду с приведенными выше в Таблице 3 последовательностями изотипов IgG2 и -4 (которые являются предпочтительными изотипами) здесь также можно упомянуть последовательность тяжелой цепи изотипа IgG1, то есть VH с515Н7 (G1wt), которой соответствует аминокислотная последовательность SEQ ID No.80 и нуклеотидная последовательность SEQ ID No.81.
Полные нуклеотидные последовательности, соответствующие вариабельным доменам легких и тяжелых цепей Mab 515H7, синтезировали с использованием глобального синтеза гена (global gene synthesis) (Genecust, Luxembourg). Их субклонировали в вектор рСЕР4 (InVitrogen, US), несущий полную кодирующую последовательность константного домена либо легкой (Скаппа), либо тяжелой (СН1-шарнирный участок-СН2-СН3) цепи человеческого иммуноглобулина IgG1/IgG2/IgG4. Все стадии клонирования проводили в соответствии с традиционными методами молекулярной биологии, как описано в Лабораторном руководстве (Sambrook и Russel, 2001) или в соответствии с инструкциями поставщика. Нуклеотидную последовательность каждой генетической конструкции полностью подтверждали путем секвенирования с использованием набора реагентов для циклического секвенирования Big Dye Terminator (Applied Biosystems, US) и анализировали с использованием генетического анализатора 3100 Genetic Analyzer (Applied Biosystems, US).
Клетки HEK293-EBNA (InVitrogen, US), адаптированные к суспензионному культивированию, выращивали стандартным образом на орбитальном шейкере (частота вращения 110 об./мин) в колбах емкостью 250 мл в 50 мл бессывороточной среды Excell 293 (SAFC Biosciences), дополненной 6 мМ глутамином. Временную трансфекцию проводили для 2·106 клеток/мл, используя линейный полиэтиленимин (PEI, 25 кДа) (Polysciences), приготовленный в воде в конечной концентрации 1 мг/мл и смешанный с плазмидной ДНК (конечная концентрация 1,25 мкг/мл для плазмид с тяжелой и легкой цепью в соотношении 1:1). После проведения трансфекции в течение 4 часов культуру разбавляли одним объемом свежей культуральной среды для достижения конечной плотности клеток 106 клеток/мл. Проводили мониторинг процесса культивирования, беря за основу жизнеспособность клеток и продуцирование Mab. Обычно культуры поддерживали в течение 4-5 суток. Mab очищали, используя традиционный хроматографический подход на носителе с белком A (GE Healthcare, US). Уровни продуцирования Mab были приемлемы для функциональных оценок. Уровни продуктивности для очищенного Mab обычно находятся в диапазоне от 6 до 15 мг/л.
Пример 11. Характеристика специфичности связывания с515Н7 - химерного Mab против CXCR4 - с использованием FACS-анализа
В этом эксперименте специфическое связывание химерного МаЬ против CXCR4 515Н7 и 301аЕ5 с CXCR4 человека изучали, используя FACS-анализ.
NIH3T3-hCXCR4-трансфицированные клетки инкубировали с моноклональным антителом с515Н7 в диапазоне доз от 0 мкг/мл до 10 мкг/мл. Затем клетки промывали смесью 1% BSA/PBS/0,01% NaN3. Далее к клеткам добавляли Alexa-меченные вторичные антитела и оставляли инкубироваться при 4°С в течение 20 мин. Затем клетки вновь дважды промывали. После второй промывки проводили FACS-анализ. Результаты этого исследования связывания представлены на Фиг.15, откуда видно, что химерное Mab против CXCR4 с515Н7 связывается специфически с клеточной линией NIH3T3, трансфицированной CXCR4 человека. Не было зарегистрировано никакого связывания с клетками NIH3T3 wt (данные не показаны).
Пример 12. Влияние МаЬ с515Н7 на гомодимер CXCR4 по данным подхода с применением резонансного переноса энергии биолюминесценции (ВРЕТ)
Этот функциональный анализ позволяет оценить влияние конформационных изменений, индуцируемых SDF-1 и/или связыванием Mab с515Н7 с рецептором CXCR4 на уровне гомодимера CXCR4.
Экспрессирующие векторы для исследуемых взаимодействующих партнеров конструировали в виде векторов, кодирующих белки, слитые с соответствующим "красителем" (люциферазой Renilla reniformis, Rluc, и желтым флуоресцентным белком, YFP), применяя традиционные методы молекулярной биологии. За двое суток до проведения экспериментов с применением BRET проводили временную трансфекцию клеток HEK293 экспрессирующими векторами, кодирующими соответствующие партнеры для BRET: [CXCR4/Rluc+CXCR4/YFP] с целью изучения гомодимеризации CXCR4. Спустя одни сутки клетки размещали в предварительно покрытых полилизином белых 96 MW-планшетах в полной культуральной среде (DMEM, дополненной 10% FBS). Сначала клетки культивировали при 37°С с 5% СО2, чтобы дать возможность клеткам прикрепиться к планшету. Затем клетки в течение ночи подвергали голоданию, используя по 200 мкл DMEM/лунка. Непосредственно перед проведением эксперимента с применением BRET DMEM удаляли и клетки быстро промывали PBS. Далее клетки инкубировали в PBS в присутствии или в отсутствие антитела в течение 10 мин при 37°С, после чего добавляли 5 мкМ коэлентеразин Н вместе с SDF-1 (100 нМ) или без него в конечном объеме 50 мкл. После инкубации в течение следующих 10 минут при 37°С начинали измерения эмиссии света при 485 нм и 530 нм, используя многомодальный ридер Mithras LB940 (Berthold) (1 с/длина волны/лунка, повтор 15 раз при комнатной температуре).
Расчет соотношения BRET проводили, как описано ранее (Angers и соавт., 2000):
[(эмиссия530 нм)-(эмиссия485 нм)×Cf]/(эмиссия485 нм),
где Cf=(эмиссия530 нм)/(эмиссия485 нм), для клеток, экспрессирующих в тех же экспериментальных условиях только слитый с Rluc белок. Упрощение этого выражения показывает, что соотношение BRET соответствует соотношению 530/485 нм, полученному, когда присутствуют два партнера по BRET, скорректированному с учетом соотношения 530/485 нм, полученного в тех же экспериментальных условиях, когда в данном анализе присутствует только один партнер, слитый с Rluc. Для удобочитаемости результаты выражают в единицах миллиВРЕТ (mBU); mBU соответствует соотношению BRET, умноженному на 1000.
SDF1 (100 нМ) увеличивал примерно на 10% сигнал BRET, обусловленный пространственной близостью донорного и акцепторного белков, слитых с рецептором CXCR4, это по-видимому указывает на образование гомодимеров CXCR4/CXCR4 или на конформационные изменения в уже существующих димерах (Фиг.16). Mab c515H7 было способно модулировать SDF1-индуцированные конформационные изменения гомодимеров CXCR4 (ингибирование на 96% SDF1-индуцированного увеличения сигнала BRET, Фиг.16). Само Mab c515H7 также было способно модулировать пространственную близость CXCR4/CXCR4, что указывает на влияние этого Mab на конформацию гомодимеров CXCR4/CXCR4. (Фиг.16В).
Пример 13. Оценка in vitro анти-ВИЧ-1 активности Mab 515H7 с использованием GFP-трансдуцированных клеток остеосаркомы человека (GHOST cells), экспрессирующих CD4 и CXCR4 или CCR5
С целью определения специфичности 515H7 - Mab против CXCR4, авторы изобретения провели оценку анти-ВИЧ-1 активности этого Mab, используя GHOST-клетки, экспрессирующие CD4 и CXCR4 или CCR5.
Этот анализ проводят в течение 48 ч, используя либо вирусный изолят LAI Х4-ВИЧ-1 (для Ghost-клеток, экспрессирующих CXCR4), либо вирусный изолят BaL R5-BH4-1 (для Ghost-клеток, экспрессирующих CCR5). 500 мкл Ghost-клеток (2,5·105 клеток/мл) помещали на 24 ч в культуральную среду Дульбекко, дополненную 10% FCS. Mab 515H7 в различных разведениях инкубировали в течение 1 ч при 37°С и затем к этим клеткам на 48 ч добавляли разбавленный (1/10) вирусный изолят LAI ВИЧ-1 или разбавленный (1/7) вирусный изолят BaL ВИЧ-1. Клетки подвергали обработке трипсином и промывали PBS 1×. К клеточному дебрису добавляли по 300 мкл 1,5%-го параформальдегида на 2 ч при +4°С в темноте для фиксации клеток и инактивации вирусов. GFP-положительные клетки анализировали посредством проточной цитометрии и вычисляли степень ингибирования инфекции ВИЧ-1.
Процент ингибирования инфицированных клеток определяли, сравнивая с контрольными инфицированными лунками, не содержащими Mab. Результаты для 1C (в мкг/мл) суммированы в Таблице 11; Mab против CXCR4 515Н7 было способно ингибировать инфекцию вирусным изолятом LAI Х4-ВИЧ-1 в CXCR4-экспрессирующих Ghost-клетках, но было полностью неактивным в отношении ингибирования инфекции вирусным изолятом BaL R5-BM4-1 в CCR5-экспрессирующих Ghost-клетках.
Пример 14. Гуманизация мышиного антитела против CXCR4 515Н7 и получение фрагмента указанного п515Н7
- Общая методика
Гуманизацию антитела против CXCR4 515Н7 проводили, применяя общие правила CDR-привития. Иммуногенетический анализ и определение CDR и каркасных областей (FR) проводили, применяя уникальную систему нумерации IMGT, а также библиотеки и средства IMGT (Lefranc, 1997 - www.imgt.org).
Связывание гуманизированных вариантов 515Н7 определяли на клеточной линии NIH3T3, стабильно трансфицированой CXCR4 человека. Активность в отношении связывания оценивали посредством конкурентного анализа с использованием биотинилированного мышиного антитела. Во втором опыте гуманизированные антитела оценивали по их способности ингибировать связывание биотинилированного SDF-1 с клетками RAMOS. Клетки RAMOS были выбраны ввиду высокой экспрессии ими CXCR4 и низкой экспрессии CXCR7 и SDF-1.
Эти анализы использовали для характеристики рекомбинантных гуманизированных версий антитела против CXCR4. Вариабельные домены переводили в формат константных доменов IgG1/κ человека и клонировали в экспрессирующий вектор для млекопитающих рСЕР. Временную экспрессию рекомбинантных антител, происходящих из IgG1/κ, проводили в клетках HEK293. Супернатанты культур после экспрессии фильтровали и антитела очищали, используя сефарозу с белком А. Очищенные антитела переводили в буфер (PBS) и концентрации антител определяли посредством ELISA.
Фрагменты рекомбинантных антител синтезировали с примененим ПЦР (полимеразной цепной реакции), используя олигонуклеотиды, специфичные к вариабельным доменам гуманизированного антитела, и субклонируя их в систему Е. coli. Очистку фрагментов антитела осуществляли аффинной хроматографией с использованием иммобилизованных ионов металлов (IMAC).
- Гуманизация вариабельных доменов 515Н7
Примеры различных выравниваний последовательностей вариабельных доменов тяжелых и легких цепей проиллюстрированы на Фиг.17 и 18.
В первой серии экспериментов анализировали активности в отношении связывания с CXCR4 первых трех гуманизированных вариантов. Вариант 1 VH (VH1) объединяли с мышиной VL, и эти конструкции оценивали по их способности ингибировать связывание биотинилированного мышиного родительского антитела 515Н7. Аминокислотная последовательность вариабельного домена VH1 содержит SEQ ID No.90, а нуклеотидная последовательность содержит SEQ ID No.91. Аминокислотная последовательность полноразмерного VH1 содержит SEQ ID No.92, а нуклеотидная последовательность содержит SEQ ID No.93. Эта конструкция показала способность конкурировать с мышиным антителом аналогично химерному антителу (Фиг.19А). Это указывает на то, что наиболее близкий к человеческому вариант VH обладает такой же способностью к связыванию, как и химерный. Ввиду этого, VH1 объединяли с вариантом 2 VL (Фиг.19В).
В дальнейших экспериментах определено, ингибируют гуманизированные варианты антитела 515Н7 связывание SDF-1 с CXCR4-экспрессирующими клетками или нет (Фиг.20). Ингибирующую способность гуманизированных вариантов hz515H7 оценивали путем детекции биотинилированного SDF-1 с использованием проточной цитометрии. Гуманизированное антитело hz515H7 VH1 D76N VL2 обладает такой же способностью ингибировать связывание SDF-1, как и химерное с515Н7.
Также протестирован фрагмент антитела гуманизированного варианта hz515H7 VH1 VL2 и обнаружено, что указанный фрагмент антитела способен полностью ингибировать связывание SDF-1 (Фиг.20).
Пример 15. Характеристика специфичности связывания гуманизированного Mab 515Н7 против CXCR4 с использованием FACS-анализа
В этом эксперименте специфическое связывание гуманизированного Mab против CXCR4 515Н7 с CXCR4 человека изучали, используя FACS-анализ.
Клетки NIH3T3 и NIH3T3-hCXCR4-трансфицированные клетки инкубировали с гуманизированными Mab 515Н7 (hz515H7 VH1 D76N VL2, hz515H7 VH1 D76N VL2.1, hz515H7 VH1 D76N VL2.2, hz515H7 VH1 D76N VL2.3) в концентрации от 0 до 10 мг/мл в течение 20 мин при 4°С в темноте в 100 мкл буфера для FACS-анализа. После 3 промывок в буфере для FACS-анализа, клетки инкубировали с вторичными антителами, Alexa 488-меченными антителами козы против IgG человека (разведение 1/500), в течение 20 минут при 4°С в темноте. После 3 промывок в буфере для FACS-анализа в каждую лунку добавляли пропидиум-иодид и, используя FACS, анализировали только жизнеспособные клетки. Для каждого из условий с целью оценки средней величины интенсивности флуоресценции анализировали по меньшей мере по 5000 жизнеспособных клеток.
Результаты этих исследований связывания представлены в следующей далее Таблице 8, в которой показано (согласно средней интенсивности флуоресценции (MFI), полученной с использованием FACS), что гуманизированные Mab против CXCR4 hz515H7 связываются специфически с клеточной линией NIH3T3, трансфицированной CXCR4 человека, (в случае родительских NIH3T3-клеток MFI=2,2).
Пример 16. Влияние Mab hz515H7 на гомодимер CXCR4 по данным подхода с применением резонансного переноса энергии биолюминесценции (ВРЕТ)
Этот функциональный анализ позволяет оценить влияние конформационных изменений, индуцируемых SDF-1 и/или связыванием hz515H7 VH1 D76N VL2, hz515H7 VH1 D76N VL2.1, hz515H7 VH1 D76N VL2.2, hz515H7 VH1 D76N VL2.3 с рецептором CXCR4 на уровне гомодимера CXCR4.
Экспрессирующие векторы для исследуемых взаимодействующих партнеров конструировали в виде векторов, кодирующих белки, слитые с соответствующим "красителем" (люциферазой Renilla reniformis, Rluc, и желтым флуоресцентным белком, YFP), применяя традиционные методы молекулярной биологии. За двое суток до проведения экспериментов с применением BRET проводили временную трансфекцию клеток НЕК293 экспрессирующими векторами, кодирующими соответствующие партнеры для BRET: [CXCR4/Rluc+CXCR4/YFP] с целью изучения гомодимеризации CXCR4. Спустя одни сутки клетки размещали в предварительно покрытых полилизином белых 96 MW-планшетах в полной культуральной среде (DMEM, дополненной 10% FBS). Сначала клетки культивировали при 37°С с 5% CO2, чтобы дать возможность клеткам прикрепиться к планшету. Затем клетки в течение ночи подвергали голоданию, используя по 200 мкл DMEM/лунка. Непосредственно перед проведением эксперимента с применением BRET DMEM удаляли и клетки быстро промывали PBS. Далее клетки инкубировали в PBS в присутствии или в отсутствие антитела в течение 10 мин при 37°С, после чего добавляли 5 мкМ коэлентеразин Н вместе с SDF-1 (100 нМ) или без него в конечном объеме 50 мкл. После инкубации в течение следующих 10 минут при 37°С начинали измерения эмиссии света при 485 нм и 530 нм, используя многомодальный ридер Mithras LB940 (Berthold) (1 с/длина волны/лунка, повтор 15 раз при комнатной температуре).
Расчет соотношения BRET проводили, как описано ранее (Angers и соавт., 2000):
[(эмиссия530 нм)-(эмиссия485 нм)×Cf]/(эмиссия485 нм),
где Cf=(эмиссия530 нм)/(эмиссия485 нм), для клеток, экспрессирующих в тех же экспериментальных условиях только слитый с Rluc белок. Упрощение этого выражения показывает, что соотношение BRET соответствует соотношению 530/485 нм, полученному, когда присутствуют два партнера по BRET, скорректированному с учетом соотношения 530/485 нм, полученного в тех же экспериментальных условиях, когда в данном анализе присутствует только один партнер, слитый с Rluc. Для удобочитаемости результаты выражают в единицах миллиВРЕТ (mBU); mBU соответствует соотношению BRET, умноженному на 1000.
SDF1 (100 нМ) увеличивал примерно на 12% сигнал BRET, обусловленный пространственной близостью донорного и акцепторного белков, слитых с рецептором CXCR4, это по-видимому указывает на образование гомодимеров CXCR4/CXCR4 или на конформационные изменения в уже существующих димерах (Фиг.22).
Гуманизированные Mab 515Н7 были способны модулировать SDF1-индуцированные конформационные изменения гомодимеров CXCR4, при этом процент ингибирования возрастания SDF-1-индуцированного сигнала BRET составляет примерно 88% для Mab hz515H7 VH1D76N-VL2, 65% для Mab hz515H7 VH1D76N-VL2.1, 33% для Mab hz515H7 VH1D76N-VL2.2 и 21% для Mab hz515H7 VH1D76N-VL2.3 (Фиг.22).
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CXCR4 ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2595394C2 |
| АНТИТЕЛА К CXCR4 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2009 |
|
RU2573897C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА I-3859 ДЛЯ ВЫЯВЛЕНИЯ И ДИАГНОСТИКИ РАКА | 2012 |
|
RU2636032C2 |
| НОВОЕ АНТИТЕЛО К CXCR4 И ЕГО ПРИМЕНЕНИЕ ДЛЯ ВЫЯВЛЕНИЯ И ДИАГНОСТИКИ РАКА | 2012 |
|
RU2636345C2 |
| АНТИТЕЛО ПРОТИВ c-Met | 2009 |
|
RU2560257C2 |
| НОВОЕ АНТИТЕЛО ПРОТИВ с-МЕТ | 2011 |
|
RU2607377C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА, СПЕЦИФИЧНЫЕ К АЛЬФА-ЭНОЛАЗЕ, И СПОСОБЫ ПРИМЕНЕНИЯ В ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ | 2014 |
|
RU2761662C2 |
| ANTI-CXCR4 АНТИТЕЛА И КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВО | 2014 |
|
RU2675516C2 |
| НОВЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ ДИМЕРИЗАЦИЮ С-МЕТ, И ИХ ПРИМЕНЕНИЯ | 2008 |
|
RU2552161C2 |
| Анти-LAG-3 антитела | 2016 |
|
RU2760582C2 |


































































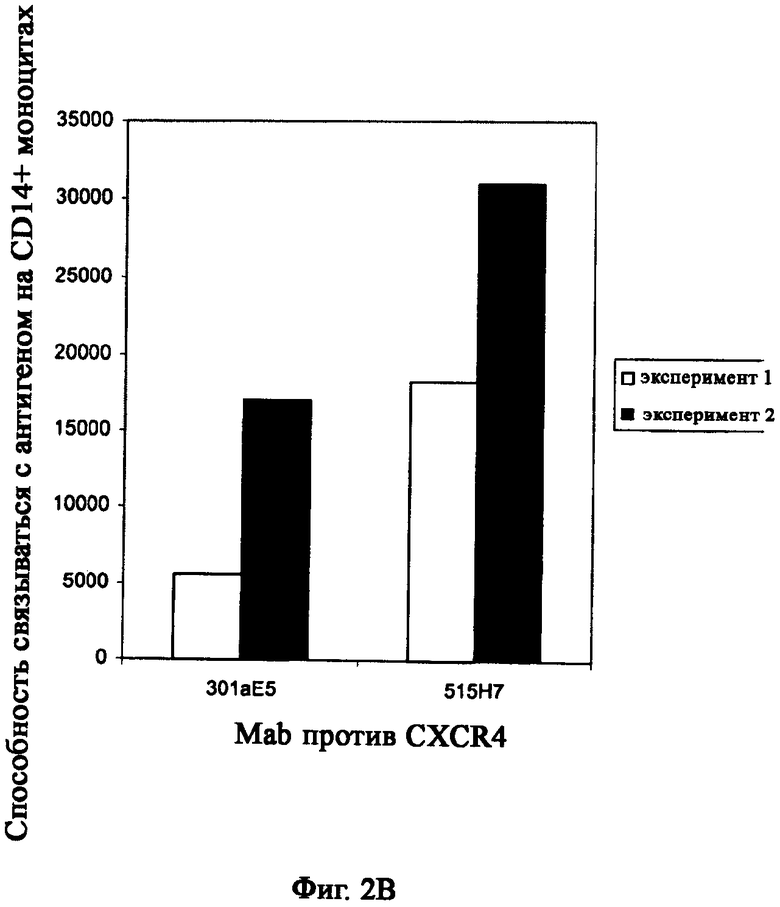

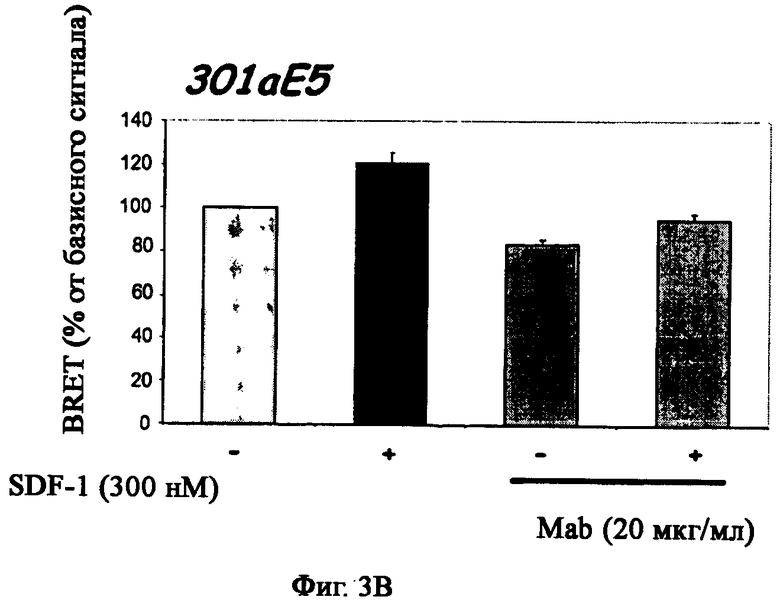
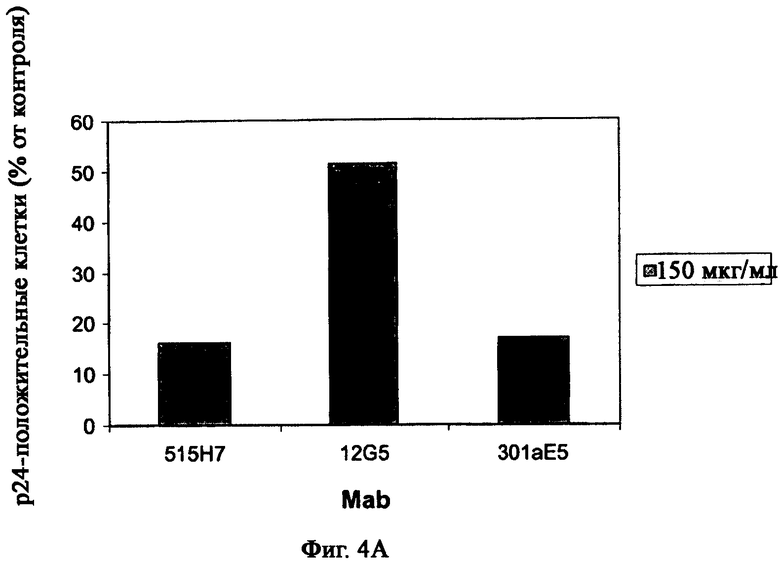
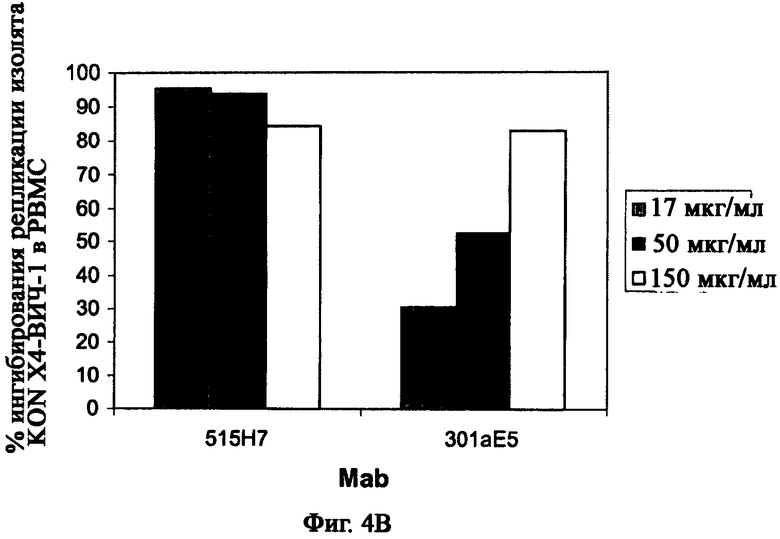







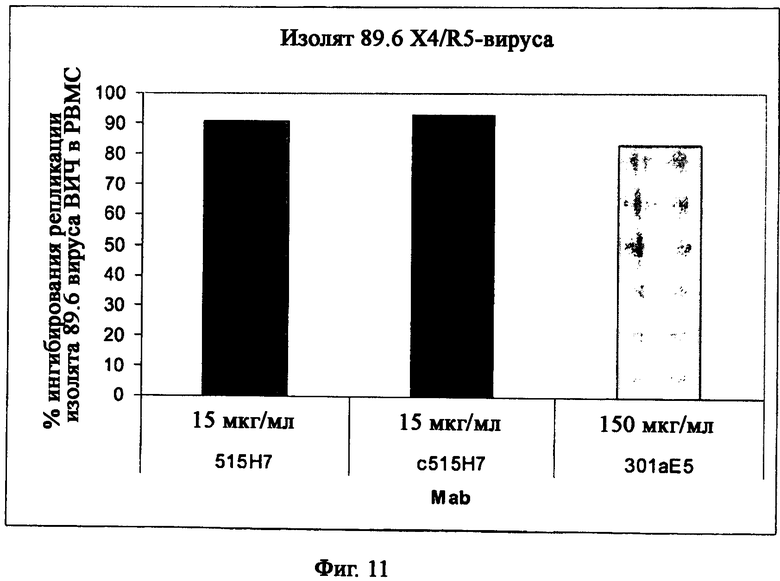
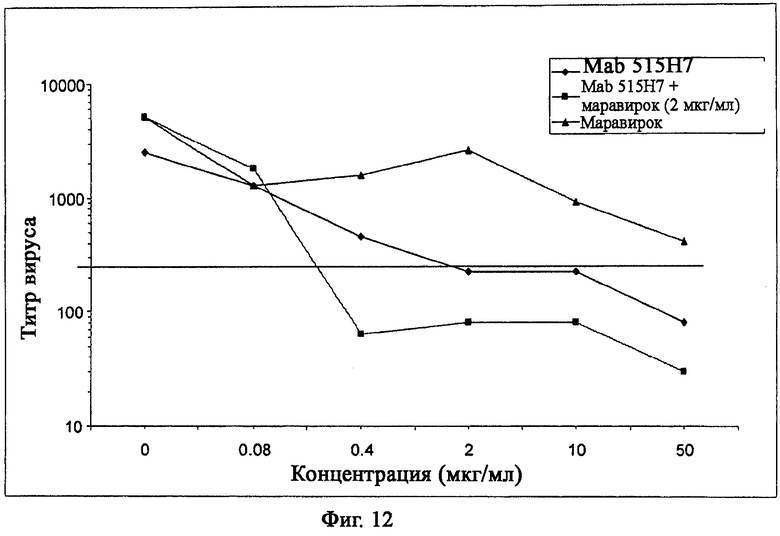



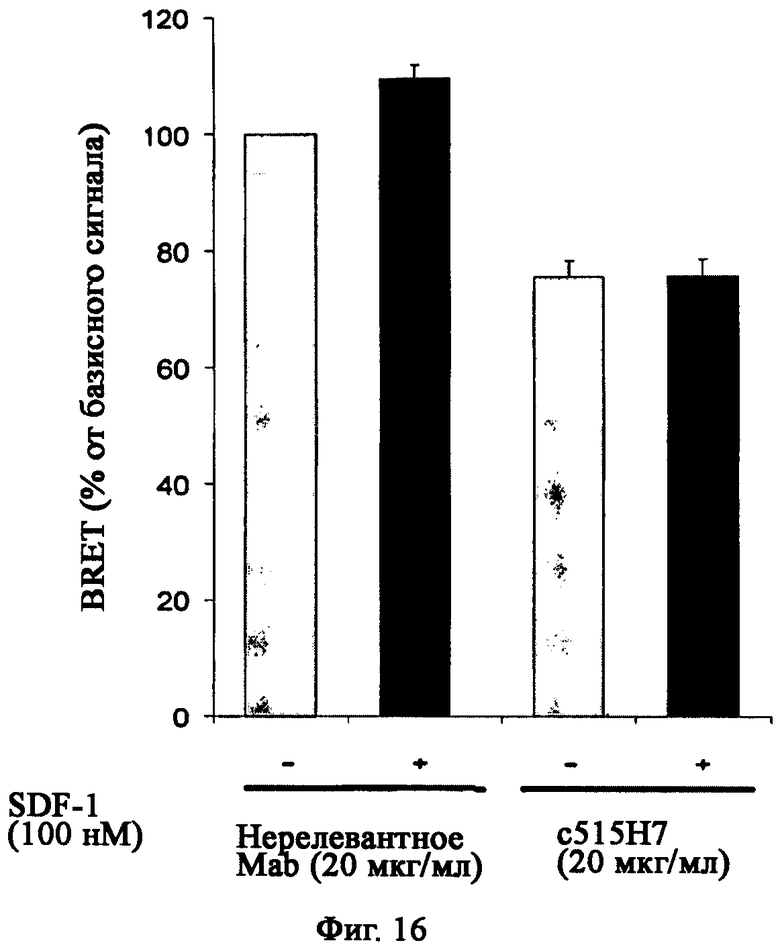

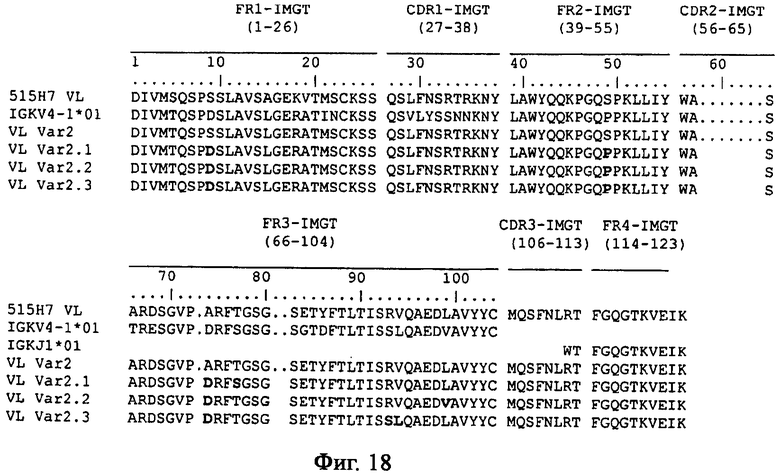

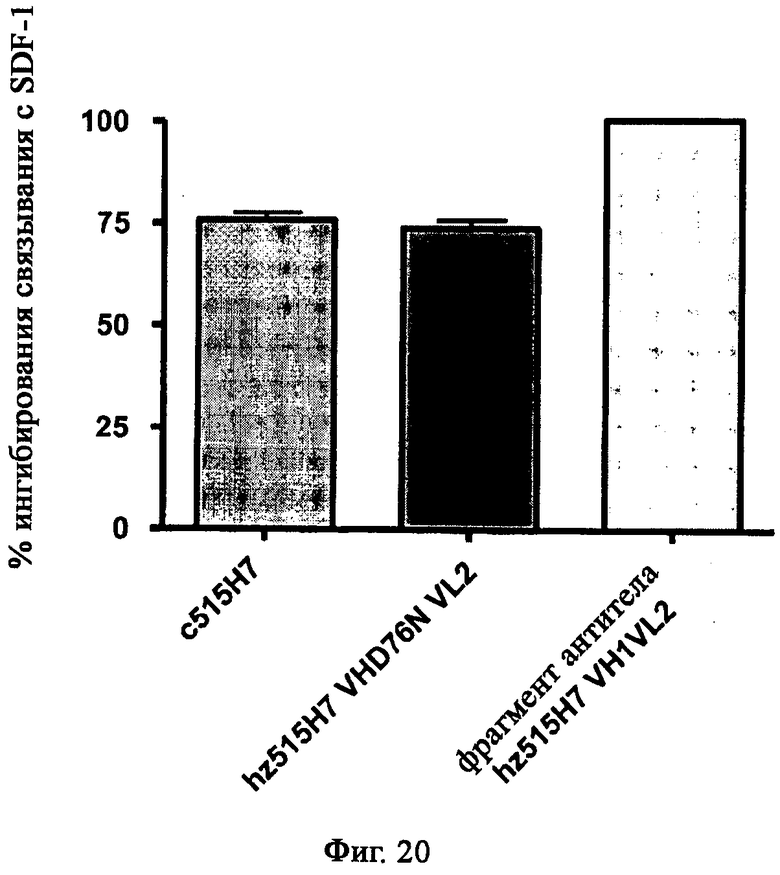
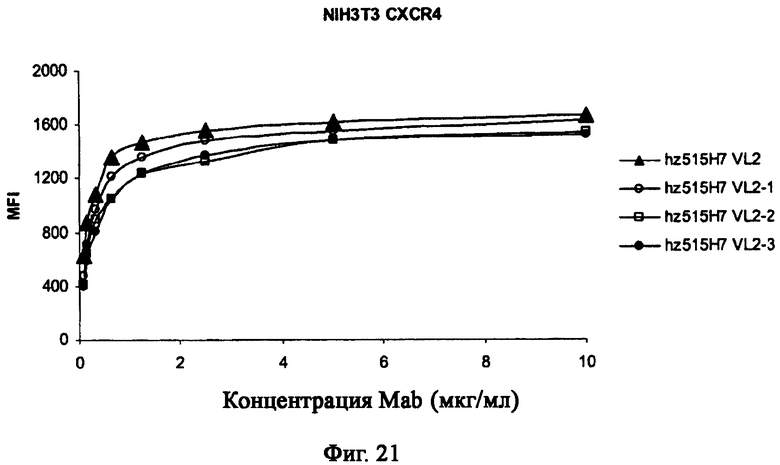

Предложенное изобретение относится к области иммунологии. Предложено антитело против CXCR4 человека или его функциональный фрагмент, которые характенизуются тем, что содержат легкую и тяжелую цепи, содержащие по 3 соответствующих CDR. Описаны варианты нуклеиновых кислот для экспрессии антитела; вектор для экспрессии антитела на основе указанной НК, клетка-хозяин для получения антитела, содержащая указанный вектор, и способ получения антитела, использующий культивирование клетки. Раскрыта фармацевтическая композиция, способная связывать CXCR4 человека на основе антитела. Описан способ скрининга и/или идентификации молекул в качестве антивирусных средств-антагонистов CXCR4. Использование изобретения обеспечивает антитела, которые могут найти применение в терапии ВИЧ-инфекции. 7 н. и 6 з.п. ф-лы, 22 ил., 11 табл., 16 пр.
1. Выделенное антитело, специфичное к CXCR4 человека, или один из его функциональных фрагментов, характеризующиеся тем, что они содержат легкую цепь, содержащую CDR-L1, CDR-L2 и CDR-L3, содержащие соответственно аминокислотную последовательность SEQ ID NO:1, 2 и 30; и тяжелую цепь, содержащую CDR-H1, CDR-H2 и CDR-H3, содержащие соответственно аминокислотную последовательность SEQ ID NO:31, 32 и 33.
2. Антитело или функциональный фрагмент по п. 1, содержащие легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:34, и тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:35.
3. Выделенная нуклеиновая кислота для экспрессии антитела по п. 1, специфичного к CXCR4 человека, выбранная из следующих нуклеиновых кислот:
a) нуклеиновой кислоты, кодирующей антитело по п. 1, или один из его функциональных фрагментов;
b) нуклеиновой кислоты, содержащей последовательность ДНК, кодирующей следующие последовательности CDR: SEQ ID NO:15 и 41-45; и
c) нуклеиновой кислоты, содержащей последовательность ДНК, выбранную из группы последовательностей вариабельных доменов тяжелых и легких цепей, состоящей из SEQ ID NO:46 и 47.
4. Вектор для экспрессии антитела по п. 1, специфичного к CXCR4 человека, содержащий нуклеиновую кислоту по п. 3.
5. Клетка-хозяин для получения антитела по п. 1, специфичного к CXCR4 человека, содержащая вектор по п. 4.
6. Способ получения антитела, специфичного к CXCR4 человека или одного из его функциональных фрагментов по п. 1, включающий следующие стадии:
a) культивирование клетки по п. 5 в среде и в соответствующих условиях культивирования; и
b) извлечение указанных антител или одного из их функциональных фрагментов, полученных таким образом, используя в качестве исходного материала культуральную среду или указанные культивированные клетки.
7. Антитело к CXCR4 человека или один из его функциональных фрагментов по п. 1, ингибирующие репликацию первичных изолятов KON ВИЧ-1 в РВМС с IC90 по меньшей мере 5 мкг/мл, предпочтительно по меньшей мере 10 мкг/мл.
8. Фармацевтическая композиция, способная связывать CXCR4 человека и содержащая антитело или один из его функциональных фрагментов по п. 1, а также эксципиент и/или фармацевтически приемлемый носитель.
9. Композиция по п.8 для предупреждения или для лечения ВИЧ-инфекции.
10. Композиция по п.8, где указанная ВИЧ-инфекция представляет собой инфекцию X4-тропным ВИЧ и(или) инфекцию X4/R5-тропным ВИЧ.
11. Композиция по п.8, содержащая по меньшей мере второе соединение против ВИЧ, выбранное из группы, состоящей из антиретровирусных лекарственных средств, таких как ингибиторы протеазы (PI) ВИЧ, нуклеозидные/нуклеотидные ингибиторы обратной транскриптазы (NRTI/NtRTI) ВИЧ, ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) ВИЧ, ингибиторы проникновения ВИЧ в клетку, ингибиторы интегразы ВИЧ.
12. Композиция по п. 8, где указанное по меньшей мере второе соединение против ВИЧ представляет собой маравирок.
13. Способ скрининга и/или идентификации молекул в качестве антивирусных средств-антагонистов CXCR4, включающий стадии:
a) отбора клеток, экспрессирующих CXCR4,
b) инкубации указанных клеток с антителом, специфичным к CXCR4 человека или одним из его функциональных фрагментов по п. 1, и
c) оценки тестируемых молекул по их способности ингибировать связывание антитела или одного из его функциональных фрагментов с CXCR4, и
d) отбора молекул, способных осуществлять указанное ингибирование.
| TANAKA et al., "Unique monoclonal antibody recognizing the third extracellular loop of CXCR4 induces lymphocyte agglutination and enhances human immunodeficiency virus type 1-mediated syncytium formation and productive infection", Journal of virology, 2001, pp.11534-11543, doi:10.1128/JVI.75.23.11534-11543.2001 | |||
| WO2001042308 A2, 14.06.2001 | |||
| RU 2006102570 A, 20.08.2007. |
Авторы
Даты
2016-01-27—Публикация
2010-04-29—Подача