Область, к которой относится изобретение
Аторвастатин кальций, вещество, химическое название полукальциевая соль [(R(R*,R*)]-2-(4-фторфенил)-b, d-дигидрокси-5-(1-метилэтил)-3-фенил-4-(фениламино) карбонил - 1H-пиррол-1- гептановой кислоты, известно как ингибитор HMG-CoA редуктазы и применяется как антигиперхолистеринемический агент. Способы получения аторвастатина и основные интермедиаты раскрываются в Патентах США: 5003080; 5097045; 5103024; 5123482; 5149837; 5155251; 5216174; 5245047; 5248793; 5280126; 5342952 и 5397792. Аторвастатин обычно получают в виде его кальциевой соли, так как из нее удобно готовить фармацевтические препараты, например, в виде таблеток, капсул, порошков и т.п. для перорального применения.
Аторвастатин кальций может существовать в аморфном виде или в одной из кристаллических форм (Форма I, Форма II, Форма III и Форма IV), которые включены в Международные патентные заявки РСТ WO-A-97/3598 и WO-A-97/3959. Известно, что аморфные формы ряда фармацевтических веществ имеют характер растворимости и биодоступности иной, нежели кристаллические формы (Konno Т., Chem. Pharm. Bull., 1990, 38: 2003-2007). Для некоторых терапевтических показаний биодоступность является одним из главных параметров, определяющих форму вещества, используемого в фармацевтическом препарате. Так как процессы кристаллизации и приготовления соответственно аморфного вещества иногда трудно осуществимы и так как продукт дает аморфно-кристаллические смеси, то есть кристаллическую форму вместо аморфной формы, существует постоянная потребность в способах, которые позволяют получать некристаллическую форму без одновременного образования кристаллических форм, то есть которые бы сделали возможным превращение кристаллической формы в некристаллическую форму.
Аторвастатин кальций представляет собой вещество, которое очень слабо растворимо в воде, и, как было обнаружено, его кристаллические формы менее растворимы, чем аморфная форма, что может вызвать проблемы с биодоступностью аторвастатина в организме. Найдено, что получение аморфного аторвастатина кальция ранее описанными методами не всегда воспроизводится, поэтому был создан процесс превращения кристаллических форм аторвастатина кальция (образующегося при синтезе аторвастатина) в аморфную форму. Этот процесс описан в патентной заявке РСТ WO-A-97/3960 и включает растворение кристаллической формы аторвастатина кальция в не содержащем гидроксильной группы растворителе, а затем удаление растворителя дает аморфный аторвастатин кальций. Предпочтительный негидроксильный растворитель выбирают из группы, состоящей из тетрагидрофурана и смеси тетрагидрофурана и толуола. Недостатком вышеприведенного процесса является, в первую очередь, применение "не дружественных" природным растворителей. Сходный процесс описан в патентной заявке РСТ WO-A-00/71116 и заключается в растворении кристаллической формы аторвастатина кальция в негидроксильном растворителе, таком, например, как тетрагидрофуран. К раствору аторвастатина кальция добавляют неполярный органический растворитель или раствор аторвастатина кальция добавляют к неполярному органическому растворителю, чтобы способствовать осаждению аторвастатина кальция. Образующийся осадок отфильтровывают.
Синтез аторвастатина кальция очень расходоемкий и, следовательно, стоимость конечного продукта высока. Поэтому целью было свести к минимуму число стадий синтеза в процессе получения аторвастатина кальция и таким образом повысить выход.
Данное изобретение включает превращение промежуточного соединения формулы (I), показанного ниже, в некристаллический, в частности аморфный, аторвастатин кальций, при этом нет необходимости в предварительном образовании аторвастатина лактона и аторвастатина кальция в форме кристаллов или смеси кристаллов аморфной и кристаллической формы аторвастатина кальция. В другом аспекте настоящее изобретение также включает превращение аторвастатина в форме лактона в некристаллический, в частности аморфный, аторвастатин кальций без промежуточного образования аторвастатина кальция в форме кристаллов или смеси кристаллов аморфной и кристаллической формы аторвастатина кальция. Еще в одном аспекте настоящее изобретение также охватывает способ приготовления фармацевтического препарата, содержащего аторвастатин кальций, который можно приготовить непосредственно в некристаллической, в частности в аморфной, форме.
Соответственно настоящее изобретение в первом аспекте включает новый способ прямого получения некристаллического аторвастатина кальция из следующего промежуточного соединения без предварительного превращения в аторвастатина лактона или аторвастатина кальция в кристаллическую форму, причем этот способ включает следующие стадии:
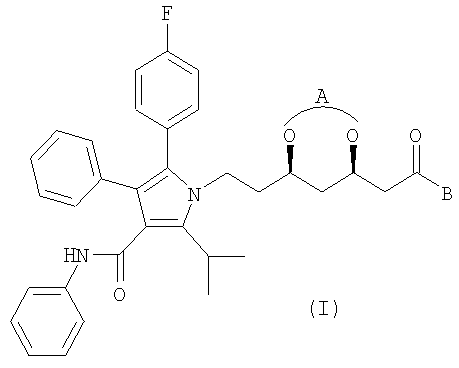
а) приготовление раствора, содержащего промежуточное соединение следующей формулы (I) в негидроксильном растворителе:
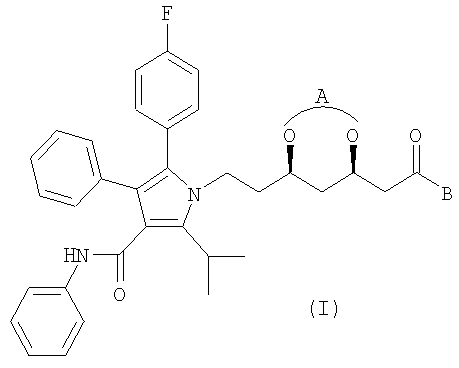
где А обозначает общую защитную группу или отдельные защитные группы для дигидроксигруппы, а В обозначает защитную группу для карбоксильной группы;
б) снятие защиты с дигидроксигруппы;
в) снятие защиты с карбоксильной группы;
где порядок стадий б) и в) может быть обратным;
г) концентрация раствора, примерно, до половины или менее первоначального объема;
д) прибавление объема воды, избыточного в сравнении с объемом концентрированного раствора;
е) прибавление растворителя, который плохо смешивается или не смешивается с водой и в котором аторвастатин кальций нерастворим или практически нерастворим, при этом объем этого растворителя примерно равен объему или больше объема воды, прибавленной на стадии д);
ж) необязательная операция смешения и разделение на две фазы;
з) нейтрализация водной фазы;
и) превращение аторвастатина в форме дигидроксикарбоновой кислоты в фармацевтически приемлемую форму соли; и
к) образование осадка аторвастатина, превращенного в указанную фармацевтически приемлемую форму соли.
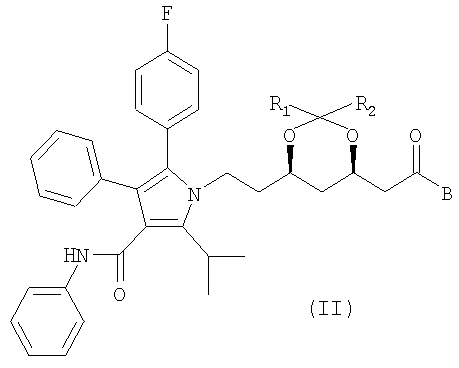
Получение промежуточного соединения формулы (I) раскрыто в Европейском патенте 0330172 и в Международной заявке WO 99/20492. Промежуточное соединение предпочтительно имеет следующую формулу (II):
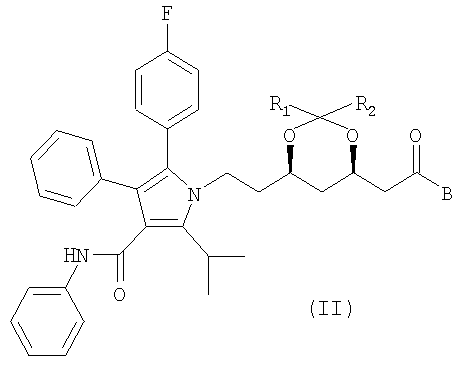
где R1 и R2 независимо обозначают водород, алкил, содержащий от одного до трех атомов углерода, или фенил, или R1 и R2 вместе обозначают (-СН2)n, где n обозначает 4 или 5, а В обозначает
а) О-R3, где R-з обозначает
- алкил с линейной или разветвленной цепью, содержащий от одного до восьми атомов углерода, предпочтительно, трет.-бутил, трет.-амил или α,α-диметилбензил, или
- трех- и шестичленную циклоалкильную группу,
б) группу формулы:
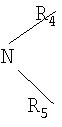
где R4 и R5 независимо обозначают алкил, содержащий от одного до десяти атомов углерода, циклоалкил, содержащий от трех до семи атомов углерода, такой как циклопропил, циклобутил, циклопентил и циклогексил, арил или аралкил, такой как бензил или фенил, или R4 и R5 вместе образуют четырех- и шестичленный углеводородный мостик, необязательно содержащий один или несколько гетероатомов, таких как О, и необязательно имеющий в качестве заместителя алкил, содержащий от одного до четырех атомов углерода, например, -(СН2)4-, -(СН2)5-, -СН(R6)-(СН2)3-, -СН(R6)-(СН2)4-, -СН(R6)-(СН2)2-СН(R6)-, -СН(R6)-(СН2)3-СН(R6)-, -СН2-СН2-O- СН2-СН2-, -СН(R6)-СН2-O-СН2-СН2- и -СН(R6)-СН2-O-СН2-СН(R6)-, где R6 обозначает алкил, содержащий от одного до четырех углеродных атомов.
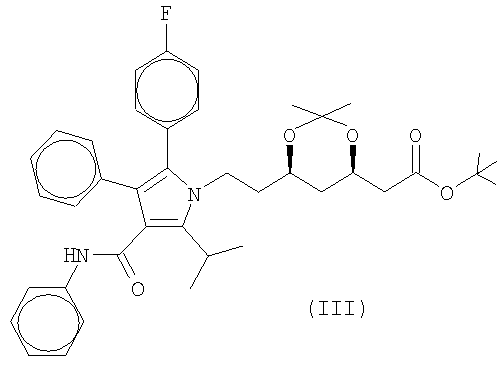
Конкретным примером промежуточного соединения, применяемого в качестве исходного, является соединение следующей формулы (III):
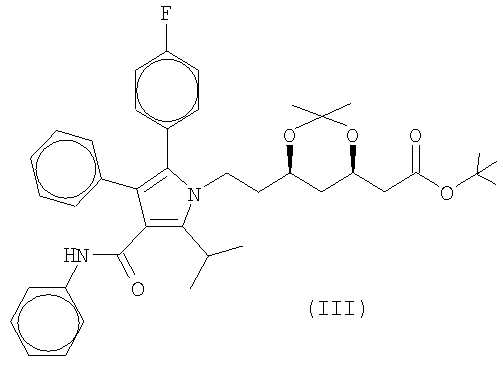
Во втором аспекте настоящее изобретение относится к способу превращения аторвастатина в лактонной форме в некристаллический аторвастатин кальций. В этом альтернативном процессе аторвастатин в лактонной форме находится в негидроксильном растворителе; осуществляют реакцию раскрытия лактонного цикла; а затем осуществляют стадии от г) до к), описанные выше в связи с первым аспектом изобретения.
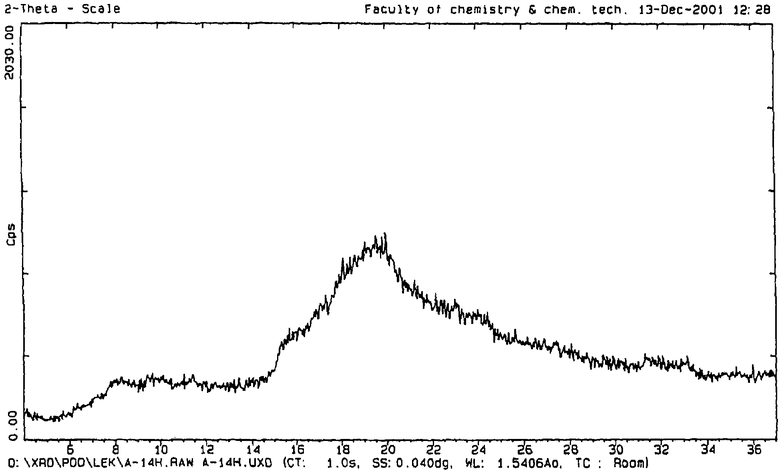
На чертеже показана порошковая рентгенограмма аторвастатина кальция, полученного способом по данному изобретению.
Данное изобретение более подробно представлено в виде следующих вариантов изобретения.
В соответствии с процессом промежуточное соединение формулы (I), особенно соединение формулы (II), и, в частности, соединение формулы (Ш), охарактеризованное производными с более специфическими защитными группами, предоставляется в растворе. Раствор может подаваться во время синтеза промежуточного соединения, или соединение может растворяться в соответствующем количестве, например, 100-300 мл (максимальная концентрация промежуточного соединения до 80 г/литр), негидроксильного растворителя, например, такого, как тетрагидрофуран, 1,4-диоксан, ацетон, этилацетат или смеси этих растворителей; или смеси упомянутых растворителей с толуолом, н-гептаном, н-гексаном, ацетонитрилом в объемном отношении от 1:0,01 до 1:1,0. Затем осуществляют снятие защиты с гидроксильных групп в боковой цепи (в положениях 3 и 5) промежуточного соединения, что удобно делать, добавляя кислоту, такую как минеральные кислоты, например, разбавленная соляная кислота или разбавленная серная кислота, трифторуксусная кислота, муравьиная кислота, пропионовая кислота, пара-толуолсульфокислота. Количество добавляемой к промежуточному соединению кислоты находится в пределах (дано молярное соотношение) от 1:0,05 до 1:0,2 (для одноосновных кислот), предпочтительно между 1:0,09 и 1:0,1. Полученный раствор выдерживают предпочтительно при перемешивании, взбалтывании или встряхивании, при температуре от 5°С до 40°С, предпочтительно при комнатной температуре, таким образом, чтобы промежуточное соединение (I), (II) или (III) соответственно не обнаруживалось с помощью тонкослойной хроматографии (ТСХ). Затем осуществляют депротекцию карбоксильной группы (удаление фрагмента В, такого как R3, например, трет.-бутил), которую удобно проводить, добавляя подходящее основание, такое как гидроксид щелочного металла или гидроксид щелочноземельного металла, например, гидроксид натрия, гидроксид калия, гидроксид лития, гидроксид бария и т.п., при этом предпочтительными являются гидроксид натрия или калия, к раствору, и доводя рН раствора до 8-13, предпочтительно до 9-12. Полученный раствор выдерживают предпочтительно при перемешивании, взбалтывании или встряхивании, при температуре от 5°С до 40°С, предпочтительно, при комнатной температуре, таким образом, чтобы промежуточное соединение со свободной гидроксильной группой, но с защищенной карбоксильной группой не обнаруживалось более с помощью тонкослойной хроматографии (ТСХ).
Затем раствор концентрируют, например, упаривая в вакууме, до половины первоначального объема или менее, предпочтительно, до 15-50% первоначального объема и, более предпочтительно, примерно, до 1/4 первоначального объема. Концентрированный раствор разбавляют объемом воды, избыточным по сравнению с объемом концентрированного раствора, предпочтительно объем воды равен 0,6 - 3-кратному объему концентрированного раствора. К этому раствору добавляют примерно такой же, как или больший, чем объем добавленной ранее воды, предпочтительно, 1-5-кратный, и, более предпочтительно, 2-3x-кратный по сравнению с объемом добавленной ранее воды объем растворителя, который плохо смешивается или совсем не смешивается с водой, в котором аторвастатин кальций нерастворим или практически нерастворим. Примеры подходящих растворителей включают гексан, гептан, циклогексан, эфир, диизопропиловый эфир или т.п. Предпочтительно, полученный раствор энергично перемешивают, взбалтывают или встряхивают и слои разделяют. Затем водную фазу, предпочтительно, быстро перемешивают, взбалтывают или встряхивают при осторожном прибавлении кислоты, например, минеральной кислоты, как сказано выше, такой как соляная кислота, для нейтрализации раствора, предпочтительно, доводя рН водного слоя до 6,5-8, более предпочтительно, до рН 6,8-7,5.
Затем полученный таким способом аторвастатин в форме дигидрокси карбоновой кислоты превращают в фармацевтически приемлемую форму соли. Наиболее предпочтительной солью является кальциевая соль. Эту операцию можно проводить, нагревая полученный нейтрализованный водный раствор до температуры 30-40°С, предпочтительно, примерно, до 35°С. К этому раствору, который быстро перемешивают, взбалтывают или встряхивают, добавляют 0,05-0,5 М, предпочтительно, 0,1-0,3 М водного раствора соответствующей соли, которую соответственно предварительно нагревают до 30-40°С, предпочтительно, примерно, до 35°С. Чтобы получить аторвастатин в форме предпочтительной кальциевой соли, применяют подходящую кальциевую соль, предпочтительно ацетат кальция, цитрат кальция, оксалат кальция, хлорид кальция или йодид кальция. По окончании прибавления смесь, предпочтительно, перемешивают, взбалтывают или встряхивают в течение определенного времени, например, в течение 0,5-3 часов и, предпочтительно, в течение, примерно, 1-2 часов, при температуре 10-30°С, предпочтительно, 20-25°С.
Затем образуется осадок аторвастатина в указанной фармацевтически приемлемой форме соли. В конце концов полученный раствор можно охладить до более низкой температуры, например, до температуры 2-15°С, предпочтительно, 4-10°С. Вместо охлаждения раствора аторвастатин кальций можно также осаждать, добавлять смешивающийся с водой растворитель, в котором аторвастатин кальций слабо растворим или практически нерастворим.
В качестве еще одной альтернативы аторвастатин кальций можно осаждать, концентрируя раствор, например, с помощью роторного испарителя.
Для того чтобы аторвастатин кальций был в требуемой некристаллической форме, образующийся осадок можно получать подходящим способом и соответственно его можно отфильтровать, промыть водой и высушить.
В случае, если исходное вещество представляет собой аторвастатин в форме лактона, лактон (который может быть получен по методикам, описанным в вышеприведенных ссылках), лактон соответственно берут в растворе. Аналогичным образом раствор можно получать во время проведения синтеза лактона или лактон можно растворять в соответствующем количестве, например, 100-300 мл негидроксильного растворителя, такого как, например, тетрагидрофуран.
Далее проводят реакцию раскрытия лактонного цикла, это удобно делать, добавляя основание, например, гидроксид щелочного или щелочноземельного металла, как указано выше, например NaOH. Количество добавляемого к лактону основания выражается молярным соотношением от 1:0,2 до 1:0,6, предпочтительно, от 1:0,29 до 1:0,57. Полученный раствор нагревают до соответствующей температуры, обычно до 40-60°С, предпочтительно, примерно, до 50°С, и выдерживают при этой температуре определенное время, пока лактон нельзя видеть по ТСХ.
Затем раствор концентрируют и обрабатывают далее, как описано выше, для получения некристаллического вещества из промежуточного соединения (I) (см. описанные выше стадии от г) до к)).
Согласно третьему аспекту настоящего изобретения способ приготовления фармацевтического препарата, содержащего аторвастатин кальций в некристаллической форме, включает получение аторвастатина кальция в некристаллическом виде либо из промежуточного соединения формулы (I) (более конкретно, формул (II и (III)) или из лактонной формы, и смешение полученного таким образом аторвастатина кальция с фармацевтически приемлемым носителем обычным способом. Предпочтительно, некристаллический аторвастатин получают в форме кальциевой соли. Фармацевтический препарат обычно находится в сухом виде в форме таблеток, капсул, порошков и т.п.для перорального применения.
Приготовленный таким образом фармацевтический препарат может включать, помимо этого непосредственно получаемого некристаллического аторвастатина кальция, в частности, полукальциевой соли, один или более наполнителей, таких как микрокристаллическая целлюлоза, лактоза, сахара, крахмалы, модифицированный крахмал, маннит, сорбит и другие полиолы, декстрин, декстран и мальтодекстрин, карбонат кальция, кальция фосфат и/или гидрофосфат, сульфат, одно или более связующих, таких как лактоза, крахмалы, модифицированный крахмал, декстрин, декстран и мальтодекстрин, микрокристаллическая целлюлоза, сахара, полиэтиленгликоли, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, метилцеллюлоза, карбоксиметилцеллюлоза, желатин, аравийская камедь, трагакант, поливинилпирролидон, силикат магния алюминия, один или более веществ, способствующих измельчению, таких как натрий кроскармеллоза, сшитый поливинилпирролидон, сшитый карбоксиметилкрахмал, крахмалы и микрокристаллическая целлюлоза, силикат магния алюминия, полиакрилинкалий, одно или более веществ, способствующих проглатыванию, таких как стеарат магния, стеарат цинка, бегенат кальция, стеарилфумарат натрия, тальк, трисиликат магния, стеариновая кислота, пальмитиновая кислота, воск карнаубы, диоксид кремния, один или более буферизующих агентов, таких как цитрат натрия или калия, фосфат натрия, дигидроортофосфат натрия, кальция карбонат, гидрофосфат, фосфат, сульфат, натрия или магния карбонат, натрия аскорбат, бензоат, натрия или калия гидрокарбонат, лаурилсульфат или смеси таких буферизующих агентов.
Если требуется, рецептура может также включать поверхностно-активные вещества и другие компоненты, обычные для сухих фармацевтических рецептур, таких как красители, лаки, ароматизаторы и адсорбенты. В качестве поверхностно-активных веществ могут применяться следующие вещества: ионные поверхностно-активные вещества, такие как лаурилсульфат натрия, или неионные поверхностно-активные вещества, такие как различные полоксамеры (сополимеры, такие как полиоксиэтилен или полиоксипропилен), природные или синтетические лецитины, сложные эфиры сорбитана и жирных кислот (например. Span®, выпускаемый Atlas Chemie), сложные эфиры полиоксиэтиленсорбитана и жирных кислот (например, Tween®, выпускаемый Atlas Chemie), полиоксиэтилированное гидрогенизированное касторовое масло (такое как Cremophor®, производимый BASF), полиоксиэтиленстеараты (такие как Brij®, производимый Atlas Chemie), диметилполисилоксан или любое сочетание вышеуказанных поверхностно-активных веществ.
Если фармацевтическая рецептура находится в виде таблеток, покрытых оболочкой, покрытие можно приготовить, по меньшей мере, из одного пленочного покрытия, такого как гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, по меньшей мере, из одного пластификатора, такого как полиэтиленгликоли, дибутилсебацинат, триэтилцитрат и другие фармацевтические добавки, обычно применяемые для пленочных покрытий, такие как пигменты, наполнители и т.п.
Фармацевтический препарат можно приготовить обычными методами, известными специалистам в данной области техники.
Настоящее изобретение иллюстрируется, но никоим образом не ограничивается нижеприведенными примерами.
ПРИМЕРЫ
Пример 1
4,37 г (0,0067 мол) соединения III растворяют в 200 мл тетрагидрофурана, добавляют 15 мл 10% HCl и перемешивают при комнатной температуре в течение 15 часов. К этому раствору прибавляют 3,6 г (0,090 мол) твердого NaOH и перемешивают еще в течение 30 часов. Раствор концентрируют (упаривают в вакууме) до 50 мл. Прибавляют 50 мл воды и 80 мл гексана. Слои разделяют и к быстро взбалтываемому (перемешиваемому) водному слою осторожно прибавляют 5 М НС1 до рН 7,0-7,5. Раствор нагревают до 35°С и к нему при перемешивании добавляют раствор 0,76 г (0,0043 мол) Са(ОАс)2×H2O в 20 мл воды, предварительно нагретой до 35°С. По окончании прибавления раствор перемешивают еще в течение 1 часа при комнатной температуре, а затем ставят в холодильник на 2 часа. Полученный осадок отфильтровывают, промывают водой (2×20 мл) и сушат при 40°С в течение 18 часов, получают 3,75 г некристаллического продукта.
Пример 2
3,00 г соединения III растворяют в 140 мл тетрагидрофурана, прибавляют 10 мл 10% HCl и раствор перемешивают при комнатной температуре. К этому раствору прибавляют 3,6 г твердого NaOH и раствор перемешивают в течение 30 часов. Раствор концентрируют (упаривают в вакууме) до 1/4-1/5 начального объема. Затем прибавляют такое же количество воды и 1,6-кратное количество гексана (по сравнению с остаточным объемом концентрированного раствора). Слои разделяют и к быстро перемешиваемому водному слою осторожно прибавляют 5 М HCl до рН 7,0. Раствор нагревают до 35°С и к нему при перемешивании добавляют предварительно нагретый до 35°С раствор 0,76 г (0,0043 мол) Ca(OAc)2×H2O в 20 мл воды. По окончании прибавления раствор перемешивают еще в течение 1 часа при комнатной температуре, а затем ставят в холодильник на 2 часа. Полученный осадок отфильтровывают, промывают водой и сушат при 40°С в течение 18 часов, получают 2,23 г некристаллического аторвастатина кальция.
Порошковая рентгенограмма полученного некристаллического аторвастатина кальция практически такова, как показанная на чертеже. Порошковую рентгенограмму получают на дифрактометре Philips PW1710 с использованием геометрии отражений. Прибор калибруют через определенные интервалы с применением кремния в качестве стандарта. Перед измерением образец не измельчают. Используют стандартный держатель для образцов Philips. Хранение образца, установку образца и сбор данных осуществляют при комнатной температуре.
Характеристики прибора: CuKα - излучение (30 мА, 40кВ, λ=1,5406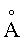 ), щель с изменяющейся дивергенцией (площадь излучения, примерно, 12×16 мм), принимающая щель 0,4 мм, графитовый монохроматор на второй стороне, сцинтилляционной счетчик.
), щель с изменяющейся дивергенцией (площадь излучения, примерно, 12×16 мм), принимающая щель 0,4 мм, графитовый монохроматор на второй стороне, сцинтилляционной счетчик.
Параметры эксперимента: 2θ в интервале от 4° до 37°; постадийное сканирование через 0,04°2θ, время накопления 1 сек на каждой стадии.
Изобретение относится к усовершенствованному способу получения аторвастатина в некристаллической форме, который включает:
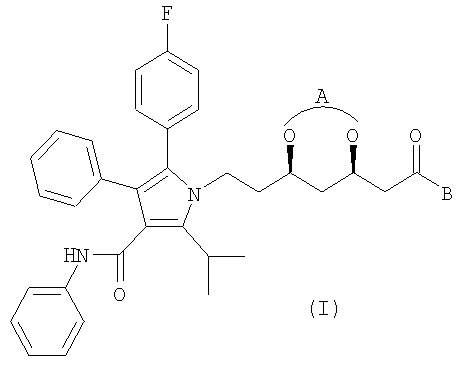
а) приготовление раствора, содержащего промежуточное соединение следующей формулы (I) в негидроксильном растворителе:
где А обозначает общую защитную группу или отдельные защитные группы для дигидроксигруппы, а В обозначает защитную группу для карбоксильной группы;
б) снятие защиты с дигидроксигруппы;
в) снятие защиты с карбоксильной группы;
при этом порядок стадий б) и в) может быть обратным;
г) концентрирование раствора, примерно, до половины или менее первоначального объема;
д) прибавление объема воды, избыточного в сравнении с объемом концентрированного раствора;
е) прибавление растворителя, который плохо смешивается или не смешивается с водой и в котором аторвастатин кальций нерастворим или практически нерастворим, причем объем этого растворителя примерно равен объему или больше объема воды, прибавленной на стадии д);
ж) необязательная операция смешения и разделение на две фазы;
з) нейтрализация водной фазы;
и) превращение аторвастатина в форме дигидроксикарбоновой кислоты в фармацевтически приемлемую форму соли; и
к) образование осадка аторвастатина кальция, полученного превращением в указанную фармацевтически приемлемую форму соли. Описаны стадии получения аторвастатина кальция из лактонной формы аторвастатина. 3 н. и 19 з.п. ф-лы, 1 ил.
а) приготовление раствора, содержащего промежуточное соединение следующей формулы (I) в негидроксильном растворителе
где А обозначает общую защитную группу или отдельные защитные группы для дигидроксигруппы, а В обозначает защитную группу для карбоксильной группы;
б) снятие защиты с дигидроксигруппы;
в) снятие защиты с карбоксильной группы;
при этом порядок стадий б) и в) может быть обратным;
г) концентрирование раствора примерно до половины или менее первоначального объема;
д) прибавление объема воды, избыточного в сравнении с объемом концентрированного раствора;
е) прибавление растворителя, который плохо смешивается или не смешивается с водой и в котором аторвастатин кальций нерастворим или практически нерастворим, причем объем этого растворителя примерно равен объему или больше объема воды, прибавленной на стадии д);
ж) необязательная операция смешения и разделение на две фазы;
з) нейтрализация водной фазы;
и) превращение аторвастатина в форме дигидроксикарбоновой кислоты в фармацевтически приемлемую форму соли; и
к) образование осадка аторвастатина кальция, полученного превращением в указанную фармацевтически приемлемую форму соли.
где R1 и R2 независимо обозначают водород, алкил, содержащий от одного до трех атомов углерода, или фенил, или R1 и R2 вместе обозначают (-СН2)n, где n обозначает 4 или 5,
В обозначает
а) O-R3, где R3 обозначает
алкил с линейной или разветвленной цепью, содержащий от одного до восьми атомов углерода, (R3 обозначает трет.-бутил, трет.-амил или α,α-диметилбензил), или
трех-, шестичленную циклоалкильную группу,
б) группу формулы
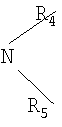
где R4 и R5 независимо обозначают алкил, содержащий от одного до десяти атомов углерода, циклоалкил, содержащий от трех до семи атомов углерода, арил или аралкил, или R4 и R5 вместе образуют четырех-, шестичленный углеводородный мостик, необязательно содержащий один или более гетероатомов и необязательно имеющий в качестве заместителя алкил, содержащий от одного до четырех атомов углерода.
приготовление раствора аторвастатина в лактонной форме в негидроксильном растворителе;
проведение реакции раскрытия лактонного цикла; и затем
концентрирование раствора, примерно, до половины или менее первоначального объема;
прибавление объема воды, избыточного в сравнении с объемом концентрированного раствора;
прибавление растворителя, который плохо смешивается или не смешивается с водой и в котором аторвастатин кальций нерастворим или практически нерастворим, причем объем этого растворителя примерно равен объему или больше объема воды, прибавленной на стадии д);
необязательная операция смешения и разделение на две фазы;
нейтрализация водной фазы;
превращение аторвастатина в форме дигидроксикарбоновой кислоты в фармацевтически приемлемую форму соли; и
образование осадка аторвастатина кальция, полученного превращением в указанную фармацевтически приемлемую форму соли.
| Tetrahedron Letters, v.33, n17, p.2283-2284 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| WO 00/7116 A1, 30.11.2000 | |||
| ЛЕЧЕНИЕ АРТЕРИОСКЛЕРОЗА И КСАНТОМЫ | 1996 |
|
RU2158607C2 |
Авторы
Даты
2008-05-20—Публикация
2002-01-22—Подача