ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к фармацевтическим композициям, содержащим аторвастатин и его фармацевтически приемлемые соли, к способу их получения, к наборам, содержащим такие композиции, а также к способам применения таких композиций для лечения субъектов, страдающих гиперхолестеринемией и/или гиперлипидемией, а также остеопорозом, доброкачественной гиперплазией простаты (ДГП) и болезнью Альцгеймера.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Превращение 3-гидрокси-3-метилглутарил-кофермента A (HMG-CoA) в мевалонат является ранней и лимитирующей скорость стадией пути биосинтеза холестерина. Эту стадию катализирует фермент HMG-CoA-редуктаза. Статины ингибируют HMG-CoA-редуктазу, не позволяя ей катализировать это превращение. Как таковые все статины представляют собой сильнодействующие агенты, снижающие уровень липидов.
Аторвастатин кальций, раскрытый в патенте Соединенных Штатов №5273995, который включен в данное описание посредством ссылки, в настоящее время продается как Lipitor®, имеющий химическое наименование тригидрат кальциевой соли (2:1) [R-(R*,R*)]-2-(4-фторфенил)-β,δ-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-гептановой кислоты и формулу
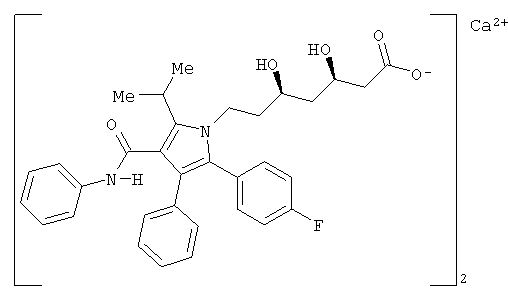
Аторвастатин и его фармацевтически приемлемые соли являются избирательными конкурентными ингибиторами HMG-CoA-редуктазы. Кальциевая соль аторвастатина как таковая представляет собой сильнодействующее соединение, снижающее уровень липидов, и является, таким образом, полезным в качестве гиполипидемического и/или гипохолестеринемического агента, а также в лечении остеопороза, доброкачественной гиперплазии простаты (ДГП) и болезни Альцгеймера.
Был выдан ряд патентов, раскрывающих аторвастатин, препараты аторвастатина, а также способы и ключевые промежуточные соединения для получения аторвастатина. Они включают патенты Соединенных Штатов №4681893; 5273995; 5003080; 5097045; 5103024; 5124482; 5149837; 5155251; 5216174; 5245047; 5248793; 5280126; 5397792; 5342952; 5298627; 5446054; 5470981; 5489690; 5489691; 5510488; 5686104; 5998633; 6087511; 6126971; 6433213 и 6476235, которые включены в данное описание посредством ссылки.
Аторвастатин может существовать в кристаллической, жидкокристаллической и некристаллической, а также аморфной формах.
Кристаллические формы кальциевой соли аторвастатина раскрыты в патентах Соединенных Штатов №5969156 и 6121461, которые включены в данное описание посредством ссылки. Кроме того, кристаллические формы аторвастатина раскрыты в патенте Соединенных Штатов №6605729, который включен в данное описание посредством ссылки.
Кроме того, в ряде опубликованных международных заявок на патент раскрыты кристаллические формы аторвастатина, а также способы получения аморфного аторвастатина. Они включают WO 00/71116; WO 01/28999; WO 01/36384; WO 01/42209; WO 02/41834; WO 02/43667; WO 02/43732; WO 02/051804; WO 02/057228; WO 02/057229; WO 02/057274; WO 02/059087; WO 02/083637; WO 02/083638; WO 03/011826; WO 03/050085; WO 03/070702 и WO 04/022053.
Раскрыто, что аморфные формы для ряда лекарственных средств проявляют иные характеристики растворимости и в некоторых случаях иную картину биодоступности по сравнению с кристаллической формой (Konno, Т., Chem. Pharm. Bull., 1990; 38: 2003-2007). Для некоторых терапевтических назначений одна картина биодоступности может быть предпочтительнее другой.
Различия в скоростях растворения могут сделать преимущественным получение препаратов аторвастатина или в кристаллической, или в аморфной формах. Например, при некоторых потенциальных применениях аторвастатина (например, для экстренного лечения пациентов с инсультами, как описано Takemoto, M.; Node, К.; Nakagami, H.; Liao, Y.; Grimm, M.; Takemoto, Y.; Kitakaze, M.; Liao, J.K., Journal of Clinical Investigation, 2001; 108(10): 1429-1437) быстрое начало действия может быть крайне полезным в улучшении эффективности лекарственного средства.
Получение твердых препаратов аторвастатина описано в патентах Соединенных Штатов с номерами 5686104 и 6126971. В описанном в них способе аторвастатин объединяют со стабилизирующей добавкой, такой как соль щелочного металла, и эксципиентами и подвергают влажному гранулированию, используя комбинацию воды и поверхностно-активного вещества (Tween™ 80). Поскольку добавки солей щелочных металлов могут влиять на биодоступность аторвастатина, остается необходимость в том, чтобы предложить аторвастатин в виде гранулированной влажным методом композиции, где указанная композиция по существу не содержит добавку соли щелочноземельного металла. Подобным образом, может быть желательной минимизация использования любых добавок подщелачивающих агентов в композиции аторвастатина для предотвращения потенциальных проблем с биодоступностью и для предотвращения взаимодействий, когда лекарство используют в комбинированных лекарственных формах с другими лекарствами.
В поданных одновременно заявках на патент США, принадлежащих тому же заявителю, в заявке под номером дела патентного поверенного РС25684, раскрыта стандартная лекарственная форма, содержащая аторвастатин или его фармацевтически приемлемую соль, получаемые в отсутствие стадии гранулирования, а в заявке под номером дела патентного поверенного РС25686 раскрыта гранулированная сухим методом фармацевтическая композиция, содержащая аторвастатин или его фармацевтически приемлемую соль.
Ближайшим аналогом настоящего изобретения является WO 02/072073, где решается проблема обеспечения терапевтической эквивалентности препаратов аторвастатина, содержащих аторвастатин кальций в аморфной, кристаллической форме или в виде их смеси. В отличие от данного изобретения в WO 02/072073 не раскрыты способы уменьшения количества продукта трансформации аторвастатина, лактона, при минимальных добавках солей щелочноземельных металлов.
При изготовлении и хранении лекарственных форм аторвастатина важно обеспечить активное лекарственное средство в чистом виде. Кроме того, желательно достигнуть этой высокой степени чистоты и стабильности с помощью как можно более простого препарата. Остается необходимость в получении простых препаратов и способах получения стандартных лекарственных форм аторвастатина, которые имеют низкие уровни примесей. Кроме того, сохраняется необходимость в получении препаратов аторвастатина, подходящих для стандартных лекарственных форм, в которых адекватная чистота лекарства, стабильность, требуемая скорость растворения и биодоступность обеспечиваются при минимальном добавлении подщелачивающих агентов.
Одной из предпочтительных стандартных лекарственных форм аторвастатина является таблетка. Для того чтобы активные лекарственыые средства в таблетках быстро всасывались после проглатывания, как правило, важно, чтобы таблетка быстро распадалась, после того как она будет подвергнута воздействию жидкостей в желудочно-кишечном тракте. В то же время важно, чтобы таблетки были достаточно твердыми, чтобы они не ломались или раскалывались во время производства, обращения с ними или хранения. Такие, по-видимому, противоречащие требования могут быть удовлетворены путем добавления разрыхлителей к композиции. В предшествующем уровне техники раскрыт ряд разрыхлителей для композиций аторвастатина, включая карбоксиметилцеллюлозу кальция, крахмал и кроскармеллозу натрия (смотри патенты США номер 5686014 и 6126971). При использовании аторвастатина с минимальными уровнями подщелачивающей добавки или добавки соли щелочноземельного металла, авторами изобретения неожиданно обнаружено, что при стандартном способе влажного гранулирования только определенные разрыхлители дают таблетки аторвастатина с приемлемой степенью чистоты. Это особенно неожиданно, так как было обнаружено, что разрыхлитель, используемый в коммерческих препаратах (кроскармеллоза натрия), оказался неприемлемым для влажного гранулирования аморфного аторвастатина с минимальными уровнями добавленных подщелачивающих добавок или добавок солей щелочноземельных металлов. Кроме того, такая стабильность неожиданно сохраняется, даже когда аторвастатин находится в аморфной форме. Помимо улучшений препарата, авторами изобретения разработан способ влажного гранулирования для включения разрыхлителей в препараты, который дает аторвастатин с высокой степенью чистоты, даже для разрыхлителей, которые обеспечивают плохую стабильность при использовании стандартного способа.
Кроме того, авторами изобретения обнаружено, что при использовании влажного гранулирования аторвастатина (особенно некристаллического аторвастатина) чистоту лекарства можно улучшить добавлением летучих оснований к растворителю для гранулирования. Эти летучие основания дают улучшенную чистоту лекарства в лекарственной форме, однако сами они не присутствуют в конечной лекарственной форме и как таковые не могут оказывать влияния на биодоступность.
Таким образом, задача настоящего изобретения заключается в том, чтобы предложить стабильную лекарственную форму аторвастатина, имеющую хорошую скорость распадаемости и биодоступность. Еще одна задача настоящего изобретения заключается в том, чтобы предложить стабильную и чистую композицию аторвастатина с минимальными уровнями добавок солей щелочноземельных металлов или других добавленных подщелачивающих агентов в композиции.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Соответственно, первым аспектом настоящего изобретения является гранулированная влажным методом фармацевтическая композиция аторвастатина с менее чем примерно 5% (масс.) добавки соли щелочноземельного металла, содержащая
(а) аторвастатин или его фармацевтически приемлемую соль и
(б) разрыхлитель или комбинацию разрыхлителей, где указанная гранулированная влажным методом фармацевтическая композиция содержит не более чем примерно 3% лактона аторвастатина на основании отношения площади пика лактона относительно объединенных площадей пиков, относящихся ко всему лекарственному средству, определенных путем ВЭЖХ.
Вторым аспектом настоящего изобретения является гранулированная влажным методом фармацевтическая композиция аторвастатина с менее чем примерно 5% (масс.) добавки соли щелочноземельного металла, содержащая
(а) аторвастатин или его фармацевтически приемлемую соль в комбинации с по меньшей мере одним активным лекарственным средством и
(б) разрыхлитель или комбинацию разрыхлителей, где указанная гранулированная влажным методом фармацевтическая композиция содержит не более чем примерно 3% лактона аторвастатина на основании отношения площади пика лактона относительно объединенных площадей пиков, относящихся ко всему лекарственному средству, определенных путем ВЭЖХ.
Третьим аспектом настоящего изобретения является способ получения композиции аторвастатина, гранулированной влажным методом, включающий:
(а) объединение аторвастатина или его фармацевтически приемлемой соли с крахмалгликолятом натрия, крахмалом, альгинатом натрия, порошковой целлюлозой, гидроксипропилцеллюлозой, алюмосиликатом магния или полакрилином калия или их комбинациями и, возможно, другими эксципиентами;
(б) добавление достаточного количества воды, изопропанола, этанола или их смеси к смеси аторвастатина со стадии (а) под действием усилия сдвига с образованием гранул;
(в) возможно, измельчение или просеивание указанных влажных гранул;
(г) сушку указанных гранул;
(д) возможно, измельчение, растирание или просеивание указанных гранул;
(е) возможно, смешивание в других эксципиентах;
(ж) возможно, изготовление стандартных лекарственных форм из данной композиции.
Четвертым аспектом настоящего изобретения является способ получения композиции аторвастатина, гранулированной влажным методом, включающий:
(а) объединение аторвастатина или его фармацевтически приемлемой соли с разбавителем с менее чем 2% (масс.) разрыхлителя;
(б) добавление достаточного количества воды, изопропанола, этанола или их смеси к смеси аторвастатина со стадии (а) под действием усилия сдвига с образованием гранул;
(в) возможно, измельчение, растирание или просеивание указанных влажных гранул;
(г) сушку указанных гранул;
(д) возможно, измельчение, растирание или просеивание указанных гранул;
(е) смешивание в разрыхлителе и, возможно, других эксципиентах;
(ж) возможно, изготовление стандартных лекарственных форм из данной композиции.
Пятым аспектом настоящего изобретения является способ получения композиции аторвастатина, гранулированной влажным методом, включающий:
(а) объединение аторвастатина или его фармацевтически приемлемой соли и одного или более чем одного эксципиента;
(б) добавление под действием усилия сдвига достаточного количества раствора летучего основания, растворенного в воде, изопропаноле или этаноле или в их смеси, с образованием гранул;
(в) возможно, измельчение, растирание или просеивание указанных влажных гранул;
(г) сушку указанных гранул;
(д) возможно, измельчение, растирание или просеивание указанных гранул;
(е) возможно, смешивание в других эксципиентах, как необходимо, с получением конечной композиции;
(ж) возможно, изготовление стандартных лекарственных форм из данной композиции.
Шестым аспектом настоящего изобретения является способ получения композиции аторвастатина, гранулированной влажным методом, включающий:
(а) объединение аторвастатина или его фармацевтически приемлемой соли в комбинации с по меньшей мере одним активным лекарственным средством с крахмалгликолятом натрия, крахмалом, альгинатом натрия, порошковой целлюлозой, гидроксипропилцеллюлозой, алюмосиликатом магния или полакрилином калия или их комбинациями и, возможно, другими эксципиентами;
(б) добавление достаточного количества воды, изопропанола, этанола или их смеси к смеси аторвастатина со стадии (а) под действием усилия сдвига с образованием гранул;
(в) возможно, измельчение или просеивание указанных влажных гранул;
(г) сушку указанных гранул;
(д) возможно, измельчение, растирание или просеивание указанных гранул;
(е) возможно, смешивание в других эксципиентах;
(ж) возможно, изготовление стандартных лекарственных форм из данной композиции.
Седьмым аспектом настоящего изобретения является способ получения композиции аторвастатина, гранулированной влажным методом, включающий:
(а) объединение аторвастатина или его фармацевтически приемлемой соли в комбинации с по меньшей мере одним активным лекарственным средством с разбавителем с менее чем 2% (масс.) разрыхлителя;
(б) добавление достаточного количества воды, изопропанола, этанола или их смеси к смеси аторвастатина со стадии (а) под действием усилия сдвига с образованием гранул;
(в) возможно, измельчение, растирание или просеивание указанных влажных гранул;
(г) сушку указанных гранул;
(д) возможно, измельчение, растирание или просеивание указанных гранул;
(е) смешивание в разрыхлителе и, возможно, других эксципиентах;
(ж) возможно, изготовление стандартных лекарственных форм из данной композиции.
Восьмым аспектом настоящего изобретения является способ получения композиции аторвастатина, гранулированной влажным методом, включающий:
(а) объединение аторвастатина или его фармацевтически приемлемой соли в комбинации с по меньшей мере одним активным лекарственным средством и одного или более чем одного эксципиента;
(б) добавление под действием усилия сдвига достаточного количества раствора летучего основания, растворенного в воде, изопропаноле или этаноле или в их смеси, с образованием гранул;
(в) возможно, измельчение, растирание или просеивание указанных влажных гранул;
(г) сушку указанных гранул;
(д) возможно, измельчение, растирание или просеивание указанных гранул;
(е) возможно, смешивание в других эксципиентах, как необходимо, с получением конечной композиции;
(ж) возможно, изготовление стандартных лекарственных форм из данной композиции.
Девятым аспектом настоящего изобретения является набор для достижения терапевтического эффекта у млекопитающего, включающий терапевтически эффективное количество таблеток или капсул, полученных из гранулированной влажным методом композиции аторвастатина, изготовленного в виде стандартных лекарственных форм из указанных композиций, и контейнер для содержания указанных лекарственных форм.
Десятым аспектом настоящего изобретения является способ применения этой фармацевтической композиции для лечения субъектов, страдающих гиперхолестеринемией и/или гиперлипидемией, остеопорозом, доброкачественной гиперплазией простаты (ДГП) и болезнью Альцгеймера.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Аторвастатин может быть легко получен, как описано в патентах США под номерами 4681893, 5273995 и 5969156, которые включены в данное описание посредством ссылки. Гемикальциевую соль аторвастатина в настоящее время продают как Lipitor®.
Аторвастатин существует в ряде морфологических форм в диапазоне от высококристаллических форм до форм с различными степенями неупорядоченности. Некоторые из этих неупорядоченных форм все же обладают некоторой структурой, о чем свидетельствуют картины дифракции рентгеновских лучей на порошке. Для цели настоящего изобретения все формы аторвастатина имеют пользу от данного изобретения и включены в объем настоящего изобретения. Менее упорядоченные формы аторвастатина, в особенности аморфные или преимущественно аморфные, имеют особенную пользу от настоящего изобретения. Такие формы могут быть получены, например, из кристаллического вещества с использованием методов, раскрытых в патенте Соединенных Штатов №6087511, который включен в данное описание посредством ссылки. Альтернативно аморфный аторвастатин может быть получен способами, раскрытыми в заявке на патент Соединенных Штатов, принадлежащей тому же заявителю, под номером дела патентного поверенного PC-25825. Для практического осуществления настоящего изобретения некристаллический и кристаллический аторвастатин может быть получен любым способом, известным в данной области техники. Предпочтительные формы аторвастатина описаны в следующем перечне патентов и опубликованных заявок на патент: патент Соединенных Штатов 5969156, патент Соединенных Штатов 6121461, патент Соединенных Штатов 6605729, международная заявка на патент WO 01/36384, международная заявка на патент WO 02/41834, международная заявка на патент WO 02/43732, международная заявка на патент WO 02/051804, международная заявка на патент WO 02/057229, международная заявка на патент WO 03/011826, международная заявка на патент WO 03/050085, международная заявка на патент WO 03/070702 и международная заявка на патент WO 04/022053. Все указанные выше патенты и заявки включены в данное описание посредством ссылки.
Аторвастатин может быть использован в форме, в которой он получен, или его можно обработать способом, изменяющим физические свойства частиц. Например, материал можно измельчать любым способом, известным в данной области техники. Неисключающие примеры таких способов включают механическое измельчение и струйное измельчение. Частицы, полученные либо непосредственно в процессе образования некристаллического аторвастатина, либо после операции измельчения, предпочтительно имеют средние диаметры частиц в интервале 1-200 мкм, более предпочтительно 5-150 мкм.
Фармацевтически приемлемые соли аторвастатина, полученные присоединением основания, образуются с металлами или аминами, такими как щелочные и щелочноземельные металлы или органические амины. Примерами металлов, используемых в качестве катионов, являются натрий, калий, магний, кальций и тому подобное. Примерами подходящих аминов являются N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, дициклогексиламин, этилендиамин, N-метилглюкамин и прокаин (смотри, например, Berge, S.M. et al., "Pharmaceutical salts", J. Pharm. Sci., 1977; 66:1).
Соли аторвастатина, полученные присоединением основания, готовят путем приведения во взаимодействие формы свободной кислоты с достаточным количеством желаемого основания с получением соли традиционным способом. Форму свободной кислоты можно регенерировать путем приведения во взаимодействие солевой формы с кислотой и выделения свободной кислоты традиционным способом. Формы свободной кислоты несколько отличаются от соответствующих солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях, но в других отношениях эти соли эквивалентны соответствующей свободной кислоте для целей настоящего изобретения.
Кроме того, аторвастатин может существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. В общем подразумевается, что сольватированные формы, включая гидратированные формы, входят в объем настоящего изобретения.
Те формы аторвастатина, которые являются по меньшей мере отчасти неупорядоченными, или смесь кристаллических и неупорядоченных форм аторвастатина имеют в значительной степени наибольшую пользу от настоящего изобретения. Под "отчасти неупорядоченными" подразумевается, что ширина линии (ширина пика на половине высоты пика) любого из пиков, измеренных с использованием дифракции рентгеновских лучей на порошке (PXRD), имеет значения 2-тета более чем примерно 2°. Аморфные или преимущественно аморфные формы аторвастатина, которые имеют особенную пользу от настоящего изобретения, характеризуются очень широкими нехарактеристическими пиками. Следует отметить, что у комбинации кристаллических и по меньшей мере отчасти неупорядоченных форм аторвастатина будут видны как острые (то есть значения 2-тета менее 2°), так и широкие пики (то есть более 2°), и такие комбинации форм имеют пользу от настоящего изобретения.
Было обнаружено, что аторвастатин является эффективным лекарственным средством даже при относительно низких дозах. Действительно, поддерживая низкую для данного пациента дозу, можно минимизировать побочные эффекты, сохраняя в то же время активность лекарственного средства. Следовательно, желательно получать аторвастатин в форме, способной обеспечить пациенту низкую дозу. Для целей настоящего изобретения доза, обеспечиваемая конечной лекарственной формой аторвастатина, предпочтительно находится между от 0,5 до 120 мг А (где мг А означает миллиграммы активного лекарственного средства, в расчете на свободную кислоту), более предпочтительно от 5 до 80 мг А.
Для удобства и легкости соблюдения пациентом режима лечения большинство лекарств доставляют в форме стандартных лекарственных форм. Для твердых лекарственных веществ эти стандартные лекарственные формы обычно имеют форму таблеток и капсул. В настоящем изобретении лекарственная форма предпочтительно представлена в форме капсулы или таблетки, наиболее предпочтительно в форме таблетки. Приготовление этих форм включает необходимую стадию заполнения пуансона или капсулы порошком. Для того чтобы эти стандартные лекарственные формы имели одинаковую эффективность в пределах допустимых границ (относительное стандартное отклонение (RSD) менее 6% для соответствия требованиям Стадии I и менее 7,8% для соответствия требованиям Стадии II Фармакопеи Соединенных Штатов (USP), руководства), не должно быть какой-либо значительной сегрегации компонентов препарата. По этой причине может быть желательным гранулирование аторвастатина, особенно когда лекарство используют в низких дозах. Влажное гранулирование способствует связыванию лекарства с эксципиентами и тем самым минимизирует какую-либо тенденцию к сегрегации.
В настоящем изобретении раскрыты способы влажного гранулирования и препараты, которые дают аторвастатин в чистой и стабильной форме. Термин "примеси" описывает вещества в лекарственной субстанции, присутствующие из процессов синтеза и очистки, а также любые вещества на основе лекарственного средства, образующиеся при приготовлении стандартной лекарственной формы. Термин "продукты разложения" относится к любым веществам на основе лекарственного средства, образующимся после получения стандартной лекарственной формы (на протяжении срока хранения данной лекарственной формы). Анализ примесей и продуктов разложения проводят, используя методики обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) на экстрагированных образцах, как это известно в данной области техники. Расчеты количества примесей и продуктов разложения выражают в виде процента суммарной площади всех пиков, отличных от пика лекарственного средства, поделенного на процент суммарной площади всех пиков, или, где это возможно, основываясь на факторе ответа для интегрирования пиков от образцов аутентичных веществ.
В препарате аторвастатина, полученном при использовании влажного гранулирования, используют комбинации разбавителей, связующих веществ, разрыхлителей, смазывающих веществ и других добавок, известных в данной области техники, для получения свойств, необходимых для стандартной лекарственной формы, как это известно в данной области техники. Например, при изготовлении таблеток эти комбинации обеспечивают адекватную прочность таблеток при прессовании, в то же время обеспечивая быструю распадаемость in vivo. Хотя имеется большая степень свободы при получении препаратов аторвастатина, удовлетворяющих этим условиям, обычно такие таблетированные препараты содержат примерно 1-40% масс.:масс. лекарственного средства, примерно 1-15% разрыхлителя, примерно 0-10% связующего вещества и примерно 0,5-2% смазывающего вещества, причем основная масса содержит разбавитель и/или другие компоненты. Предпочтительные связующие вещества включают карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, декстрин, желатин, гуаровую камедь, гидроксипропилметилцеллюлозу, мальтодекстрин, метилцеллюлозу, полиэтиленоксид, полиметакрилаты и альгинат натрия; особенно предпочтительным связующим веществом является гидроксипропилцеллюлоза. Предпочтительным смазывающим веществом является стеарат магния. Предпочтительные разбавители включают фосфат кальция, сульфат кальция, ацетат целлюлозы, декстраты, декстрин, декстрозу, фруктозу, каолин, лактит, лактозу, мальтит, мальтодекстрин, мальтозу, микрокристаллическую целлюлозу, полиметакрилаты, порошковую целлюлозу, силицированную микрокристаллическую целлюлозу, хлорид натрия, сорбит, сахарозу и тальк.
При применении настоящего изобретения уровень добавок солей щелочноземельных металлов в композиции предпочтительно составляет примерно 0-5% (масс.:масс.), более предпочтительно примерно 0-3%, наиболее предпочтительно примерно 0-2%. Также является предпочтительным, чтобы уровень добавок других подщелачивающих агентов в композиции составлял примерно 0-5% (масс.:масс.), более предпочтительно примерно 0-3%, наиболее предпочтительно примерно 0-2%. Также является предпочтительным, чтобы уровень аминных и амидных полимеров составлял менее чем примерно 0-5% (масс.:масс.); более предпочтительно примерно 0-3%, наиболее предпочтительно примерно 0-2% от массы препарата. Примеры таких полимеров раскрыты в международной заявке на патент WO 01/76566 A1.
Подщелачивающими агентами являются добавки или эксципиенты, которые обладают свойством повышения рН препарата, когда такие препараты добавляют в воду. Примеры подщелачивающих агентов включают неорганические и органические основания (буферы). Примеры неорганических подщелачивающих агентов включают цитрат натрия или калия, карбонат, бикарбонат, фосфат, сульфат, бензоат и аскорбат, а также карбонат кальция и карбонат магния. Последние два примера также представляют собой соли щелочноземельных металлов. Примеры органических подщелачивающих агентов включают амины. Конкретные примеры аминов включают N-метилглюкамин, гуанин и аргинин.
При получении композиций аторвастатина путем влажного гранулирования для целей настоящего изобретения может быть использована любая методика влажного гранулирования, известная в данной области техники. Важным элементом в отношении данных процессов является то, что раствор для гранулирования добавляют к композиции аторвастатина, пока порошковая смесь находится под действием усилия сдвига. Усилие сдвига служит для разрушения появляющихся комков и посредством этого обеспечивает более однородное гранулирование. Неограничивающие примеры способов гранулирования в грануляторах с усилием сдвига включают влажные гранулирования с большим усилием сдвига, гранулирования в псевдоожиженном слое, экструзионные гранулирования и влажные гранулирования с небольшим усилием сдвига (такие как с использованием мешалок, миксеров и блендеров, включая бункерные блендеры). Количество добавляемого растворителя для влажного гранулирования определяют на основании адекватного увлажнения для связывания большинства мелких частиц. Добавление растворителя для влажного гранулирования можно осуществить, используя любую методику, известную в данной области техники. Например, жидкость можно добавлять в виде одной или нескольких частых добавок, распылять на перемешиваемый слой порошка, закачивать непосредственно в порошок или вводить в псевдоожижающий газ. Время смешивания с жидкостью обычно оптимизируют таким образом, чтобы большинство мелких частиц связывалось в гранулы, но чтобы сами гранулы не становились слишком затвердевшими.
Как только образуются гранулы, иногда полезно размалывать, растирать или просеивать материал пока он влажный (размягченный), как это известно в данной области техники. Влажную композицию предпочтительно сушат перед применением в производстве стандартных лекарственных форм. Такую сушку можно выполнить, используя любой способ, известный в данной области техники. Неограничивающие примеры этих способов включают сушку на воздухе, сушку в псевдоожиженном слое, сушку в микроволновой печи, сушку в печи, радиочастотную сушку, сушку в вакуумной печи и сушку в конвекционной печи. Авторами изобретения обнаружено, что температура сушки важна для того, чтобы контролировать получение низких уровней примесей аторвастатина. Предпочтительно температура сушки не превышает примерно 60°С, более предпочтительно температура не превышает примерно 50°С, наиболее предпочтительно температура не превышает примерно 40°С. Как только гранулы становятся сухими, иногда желательно снизить размер частиц при помощи измельчения, растирания или просеивания, как известно в данной области техники. После этого момента обычно добавляют смазывающее вещество с последующим коротким (примерно 1-10 минут) периодом перемешивания, которое, как правило, проводят в блендере с небольшим усилием сдвига, таком как барабанный блендер. Примеры указанных барабанных блендеров включают бункерные блендеры, V-образные блендеры и блендеры Turbula™. Предпочтительным смазывающим веществом является стеарат магния. Как только смесь приготовлена, получают стандартные лекарственные формы при помощи методов, известных в данной области техники. Предпочтительные стандартные лекарственные формы включают таблетки или капсулы. Таблетки изготавливают путем заполнения пуансона композицией, содержащей аторвастатин, и затем прессования на соответствующем прессе. Капсулы изготавливают путем заполнения оболочки капсул заданной формы и затем запечатывания. Такие операции предпочтительно выполняют, используя ротационный таблеточный пресс или промышленную установку для заполнения капсул. Неисключающие примеры промышленных ротационных таблеточных прессов включают прессы, производимые Niro Pharma Systems (Columbia, MD), Kilian and Company (Horsham, PA), Korsch (Berline, Germany) и Elizabet-Hata International (North Huntingdon, PA). Неисключающие примеры промышленного оборудования для заполнения капсул включают оборудование, производимое Capsugel (Morris Plains, NJ) и CapPlus Technologies (Phoenix, AZ). Полученные таким образом таблетки затем возможно покрывают пленкой, предназначенной для того, чтобы обеспечить легкость проглатывания, проприетарный или распознаваемый внешний вид и/или защиту лекарственной формы. Конечную стандартную лекарственную форму затем упаковывают, используя методики, известные в данной области техники. Для настоящего изобретения упаковка предпочтительно имеет форму блистеров, полученных холодным способом фольга-фольга, пластиковых блистеров или запечатанных бутылочек, содержащих осушающие вещества. Возможно, упаковка может содержать вещества, поглощающие активный кислород, как раскрыто в ЕР 1243524 А2 или ЕР 1241110 А1, которые включены в данное описание изобретения посредством ссылки.
Аторвастатин подвергается двум основным путям разложения: лактонизации и окислению. Лактон образуется путем внутренней конденсации (потери воды) спирта и карбоновой кислоты с образованием шестичленного кольца. Он является основным продуктом разложения аторвастатина, обнаруживаемым при влажном гранулировании и получении таблетки, особенно в отсутствие солей щелочноземельных металлов. Авторами изобретения обнаружено, что уровень лактона в таблетках, полученных влажным гранулированием в присутствии менее 5% (масс.:масс.) добавки соли щелочноземельного металла, можно значительно снизить при помощи комбинации выбора эксципиентов и способа влажного гранулирования.
Когда аторвастатин получают в форме таблетки, разрыхлитель является желательным, чтобы обеспечить быструю распадаемость таблетки в желудочно-кишечном тракте и тем самым обеспечить, чтобы лекарство быстро становилось доступным для всасывания. Большое количество разрыхлителей раскрыто в предшествующем уровне техники для применения с аторвастатином. Например, следующий перечень разрыхлителей раскрыт в публикации международной заявки номер WO 03/011283 A1 в комбинации с подщелачивающим агентом и вторым активным фармацевтическим ингредиентом: карбоксиметилцеллюлоза кальция, карбоксиметилцеллюлоза натрия, диоксид кремния, кроскармеллоза натрия, кросповидон, гуаровая камедь, алюмосиликат магния, метилцеллюлоза, полакрилин калия, целлюлоза, предварительно желатинизированный крахмал, альгинат натрия, крахмалгликолят натрия и крахмал. В ряде патентов в примерах обращается внимание на применение кроскармеллозы натрия (смотри, например, патенты США номер 5686014, 6126971, 6531507 В1 и опубликованную заявку на европейский патент ЕР 1336405 А1). Этот разрыхлитель также используют в имеющемся в продаже продукте Lipitor®. В то время как многие из этих разрыхлителей обеспечивают адекватные свойства распадаемости в гранулятах аторвастатина, полученных влажным способом, содержащих менее 5% (масс.:масс.) добавок подщелачивающих агентов, авторами изобретения неожиданно установлено, что только некоторые из многих возможных разрыхлителей обеспечивают адекватную чистоту лекарства. Фактически было неожиданно обнаружено, что разрыхлитель, используемый в большинстве примеров (кроскармеллоза натрия), дает низкую чистоту лекарства.
Предпочтительные разрыхлители дают препараты аторвастатина с уровнем лактона аторвастатина менее чем примерно 3% (на основании процента площади пика лактона относительно всех пиков, относящихся к лекарственному средству, полученных путем интеграции ВЭЖХ-пиков) после влажного гранулирования и сушки; более предпочтительные разрыхлители дают уровни лактона менее чем примерно 1% и еще более предпочтительные разрыхлители дают уровни лактона менее чем примерно 0,5%.
Разрыхлители, подходящие для настоящего изобретения, также обеспечивают время распадаемости таблеток, полученных, как описано в данной заявке, предпочтительно менее 30 минут, еще более предпочтительно менее 15 минут и еще более предпочтительно менее 8 минут. Время распадаемости измеряют, используя растворы фосфатного буфера с рН 6,8, имеющимися в продаже устройствами для измерения распадаемости.
Предпочтительные разрыхлители для композиций, полезных для влажного гранулирования аторвастатина, содержащих менее чем примерно 5% (масс.) добавок подщелачивающего агента или солей щелочноземельных металлов, включают крахмалы, крахмалгликолят натрия, альгинат натрия, порошковую целлюлозу, гидроксипропилцеллюлозу, алюмосиликат магния и полакрилин калия. Особенно предпочтительные крахмалы включают кукурузный крахмал и предварительно желатинизированный крахмал. Эти разрыхлители предпочтительно используют в композициях аторвастатина при уровнях от примерно 1 до примерно 10% (масс.:масс.) от массы всего препарата; более предпочтительно от примерно 3 до примерно 8% (масс.:масс.).
Предпочтительные растворители для влажного гранулирования имеют свойство вызывать адгезию между частицами без значительного растворения аторвастатина, которое могло бы вызвать изменение морфологических форм лекарства. Кроме того, предпочтительно, чтобы такие растворители были летучими и имели низкую токсичность, так чтобы любые оставшиеся следовые количества не были бы вредными. Как таковые, вода и спирты являются предпочтительными растворителями для гранулирования аторвастатина. Особенно предпочтительными спиртами являются этанол и изопропанол. Во многих случаях могут быть полезными комбинации растворителей. Предпочтительно такие комбинации включают воду с этанолом или изопропанолом. Кроме того, может быть полезным добавление ингредиентов в растворитель для гранулирования, как это известно в данной области техники. Например, связующие вещества, увлажняющие агенты и стабилизаторы можно включать в виде части раствора для гранулирования, и они входят в объем настоящего изобретения.
Авторами изобретения обнаружено, что конкретная добавка к растворителю для гранулирования, представляющая собой увлажняющий агент Tween™ (полисорбат 80), пагубно влияет на стабильность аторвастатина. Это является неожиданным, так как эту добавку обычно используют в большинстве препаратов аторвастатина предшествующего уровня техники (смотри, например, патенты США номер 5686104 и 6126971). Следовательно, предпочтительно, чтобы уровень Tween 80, используемого в гранулированных влажным методом композициях аторвастатина, составлял менее чем 0,5% (масс.:масс.), более предпочтительно менее чем 0,2% и еще более предпочтительно менее чем 0,1%.
Предпочтительные способы приготовления гранулятов аторвастатина, полученных влажным методом, содержащих менее чем примерно 5% (масс.) добавок подщелачивающих агентов или солей щелочноземельных металлов и предпочтительные разрыхлители, включают следующие стадии:
(а) смешивание аторвастатина с предпочтительным разрыхлителем и возможно с некоторыми или всеми остальными эксципиентами, необходимыми для конечной композиции. Эти другие эксципиенты могут включать разбавители, связующие вещества и другие такие вещества, необходимые для обработки, текучести, стабильности или изготовления стандартных лекарственных форм;
(б) добавление растворителя для гранулирования, в то время как материал со стадии (а) находится под действием усилия сдвига.
Предпочтительные растворители для гранулирования включают воду, этанол, изопропанол и их комбинации. В растворитель для гранулирования можно добавить другие ингредиенты, как это известно в данной области техники. Примерами таких добавок являются связующие вещества, увлажняющие агенты, стабилизаторы и буферы. Растворитель можно вносить любым способом, известным в данной области техники. Предпочтительные способы внесения растворителя при одновременном действии усилия сдвига включают гранулирование с большим усилием сдвига, гранулирование с небольшим усилием сдвига, гранулирование в псевдоожиженном слое и зкструзионное гранулирование;
(в) возможно, материал со стадии (б) можно измельчать, растирать или просеивать. Этот влажный материал затем сушат, предпочтительно используя сушку на воздухе, сушку в псевдоожиженном слое, сушку в печи или микроволновую сушку. Сушку предпочтительно проводят так, чтобы температура сушки не превышала примерно 60°С, более предпочтительно, чтобы температура не превышала примерно 50°С, наиболее предпочтительно, чтобы температура не превышала примерно 40°С;
(г) возможно, этот материал затем измельчают или просеивают;
(д) материал затем смешивают с дополнительными эксципиентами и
(е) из данной композиции, возможно, изготавливают стандартную лекарственную форму, предпочтительно таблетку или капсулу.
Авторами изобретения также обнаружено, что даже при использовании разрыхлителей, которые индуцируют лактонизацию данного лекарственного средства (в отсутствие основания) во время влажного гранулирования, возможно включение таких эксципиентов путем изменения способа добавления этого разрыхлителя. Более конкретно, авторами обнаружено, что добавление разрыхлителей к композиции после стадии влажного гранулирования, то есть при внегранулятном добавлении, дает неожиданное улучшение стабильности лекарственного средства. Предпочтительные стадии в этом процессе включают:
(а) смешивание аторвастатина с по меньшей мере некоторыми зксципиентами, необходимыми для конечной композиции, но без значительного количества разрыхлителя. Значительным количеством разрыхлителя считают количество более чем примерно 2% (масс.:масс.) препарата. Другие эксципиенты могут включать разбавители, связующие вещества и другие такие вещества, необходимые для обработки, текучести, стабильности или получения стандартных лекарственных форм;
(б) добавление растворителя для гранулирования, в то время как материал со стадии (а) находится под действием усилия сдвига. Предпочтительные растворители для гранулирования включают воду, этанол, изопропанол и их комбинации. В растворитель для гранулирования можно добавить другие ингредиенты, как это известно в данной области техники. Примерами таких добавок являются связующие вещества, увлажняющие агенты, стабилизаторы и буферы. Жидкость можно вносить любым методом, известным в данной области техники. Предпочтительные способы внесения жидкости при одновременном действии усилия сдвига включают гранулирование с большим усилием сдвига, гранулирование с небольшим усилием сдвига, гранулирование в псевдоожиженном слое и экструзионное гранулирование;
(в) возможно, материал со стадии (б) можно измельчать, растирать или просеивать. Этот влажный материал затем сушат, предпочтительно используя сушку на воздухе, сушку в псевдоожиженном слое, сушку в печи или микроволновую сушку; такую сушку предпочтительно проводят так, чтобы температура сушки не превышала примерно 60°С, более предпочтительно, чтобы температура не превышала примерно 50°С, наиболее предпочтительно, чтобы температура не превышала примерно 40°С;
(г) возможно, этот материал затем измельчают, растирают или просеивают;
(д) эту композицию затем смешивают с одним или более чем одним разрыхлителем и возможно с дополнительными эксципиентами, предпочтительно включая смазывающее вещество, и
(е) из данной конечной композиции, возможно, изготавливают стандартную лекарственную форму, предпочтительно таблетку или капсулу.
Авторами изобретения также обнаружен еще один способ улучшения степени чистоты лекарства при влажном гранулировании аторвастатина, даже в присутствии разрыхлителей, способствующих проявлению низкой чистоты лекарственного средства. Более конкретно, авторами изобретения неожиданно обнаружено, что присутствие основания в композиции только лишь во время процессов влажного гранулирования и сушки обеспечивает стабилизацию аторвастатина против лактонизации, даже несмотря на то, что основание не присутствует в конечном продукте. В частности, было обнаружено, что летучие основания в отсутствие других добавленных оснований дают грануляты аторвастатина, полученные влажным способом, с более высоким уровнем чистоты, чем в отсутствие таких летучих оснований. Примеры таких предпочтительных летучих оснований включают гидроксид аммония, гидроксиды тетраалкиламмония, вторичные и третичные алкил- и ариламины, диэтаноламин и моноэтаноламин. Особенно предпочтительные летучие основания включают гидроксид аммония и гидроксид тетрабутиламмония. Эти основания могут быть добавлены вместе с растворителем для гранулирования (предпочтительно водой, изопропанолом, этанолом или их комбинацией) в количестве, выбранном так, чтобы быть эффективным в обеспечении хорошей чистоты и стабильности конечной лекарственной формы аторвастатина, не вызывая разложения ими лекарственного средства или обесцвечивание препарата. Авторами изобретения обнаружено, что концентрация летучего основания, используемого в грануляционной воде, предпочтительно варьирует от примерно 0,001 до примерно 50% (масс.:масс.), более предпочтительно от примерно 0,1 до примерно 40% (масс.:масс.). Количество грануляционного раствора основания, добавленного к грануляту, предпочтительно варьирует от примерно 40 до примерно 100% (масс.:масс.) от количества твердого вещества.
В настоящем изобретении предложены композиции аторвастатина, которые особенно хорошо подходят для комбинированных продуктов с другими лекарственными веществами благодаря большей стабильности аторвастатина, которую придают разрыхлители согласно настоящему изобретению. Это особенно верно, когда второе лекарственное средство (вместе с ассоциированными с ним эксципиентами) может дестабилизировать аторвастатин. Неограничивающие примеры лекарственных средств, которые могут давать пользу от комбинаций с композициями аторвастатина и способами по изобретению, включают торсетрапиб и амлодипин и их фармацевтически приемлемые соли.
Композиции аторвастатина по настоящему изобретению можно объединять с по меньшей мере одним другим активным лекарственным средством с получением стандартных лекарственных форм. Предпочтительные стандартные лекарственные формы включают таблетки и капсулы. В отношении комбинации композиции аторвастатина с по меньшей мере одним другим активным лекарственным средством для получения стандартной лекарственной формы следующий неограничивающий перечень описывает возможные варианты таких стандартных лекарственных форм: (а) смесь гранулированного влажным методом аторвастатина с другим активным лекарственным средством самим по себе (то есть внегранулятное добавление другого лекарственного средства к гранулированному влажным методом аторвастатину), в виде смеси с эксципиентами (то есть, внегранулятное добавление другого лекарственного средства с эксципиентами к гранулированному влажным методом аторвастатину) или в виде гранулята (то есть комбинация гранулята другого лекарственного средства с гранулированным влажным методом аторвастатином), формованная в таблетки или капсулы; (б) единый полученный влажным методом гранулят аторвастатина с другим лекарственным средством, формованный в таблетки или капсулы; (в) двухслойная таблетка, содержащая гранулированный влажным методом аторвастатин в одном слое и другое лекарственное средство и возможные эксципиенты в другом слое.
Настоящее изобретение относится к лечению у субъекта заболеваний и состояний, таких как гиперлипидемия и/или гиперхолестеринемия, остеопороз, доброкачественная гиперплазия простаты (ДГП) и болезнь Альцгеймера, аторвастатином или его фармацевтически приемлемой солью, как описано выше, который можно вводить в стандартной лекарственной форме, имеющей низкий уровень продуктов разложения и/или примесей, содержащихся в терапевтической упаковке или наборе. Набор включает стандартную лекарственную форму и контейнер. Обычно набор включает инструкции по введению лекарственной формы. Контейнер может быть любой традиционной формы или вида, известных в данной области техники, например бумажная упаковка, стеклянная или пластиковая бутылка, блистерная упаковка с отдельными лекарственными формами, выдавливаемыми через обратную поверхность блистера, согласно терапевтическому режиму.
Следующие неограничивающие примеры иллюстрируют предпочтительные способы авторов изобретения для получения и применения фармацевтичеких композиций по настоящему изобретению.
ПРИМЕР 1
ОБЩИЙ СПОСОБ ПОЛУЧЕНИЯ АМОРФНОГО АТОРВАСТАТИНА
Аморфный аторвастатин, пример неупорядоченного аторвастатина, описанный ранее и используемый в следующих примерах, был получен согласно способу, описанному в одновременно поданной заявке на патент США, принадлежащей тому же заявителю, номер дела поверенного PC-25825, путем первоначального растворения кальциевой соли аторвастатина (Патент США №5273995) в метаноле с получением 5%-ного (масс.) раствора. Этот раствор распыляли в распылительной сушилке Niro PSD-1 при скорости 170 г/мин, используя азот в качестве распыляющего газа. Температура на входе составляла 195°С и температура на выходе составляла 60°С. После сушки распылением порошок сушили на лотках в сушилке при 40°С в течение 12 часов с получением аморфного аторвастатина.
ПРИМЕР 2
ПОЛУЧЕНИЕ ТАБЛЕТОК АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ БЕЗ РАЗРЫХЛИТЕЛЯ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (1,3 г), 39,0 г микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 50,7 г лактозы водной (Foremost Farms USA, Rothschild, Wl) и 2,0 г гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 500-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Препарат затем гранулировали, используя Pro-C-epT Mi Mi Pro гранулятор для влажного гранулирования с большим усилием сдвига (Pro-C-epT n.v., B-9060 Zelzate, Belgium) с использованием 0,9-л резервуара. Препарат перемешивали в сухом виде в течение 2 мин при скорости рабочего колеса 400 об/мин и скорости измельчителя 1000 об/мин. Перемешивание во влажном состоянии производили при скорости рабочего колеса 600 об/мин и скорости измельчителя 1000 об/мин. Воду добавляли с приращениями по 10-30 г со скоростью 20-30 г/мин до общего количества 45 г, используя стандартный шприц на 60 см3. Материал перемешивали во влажном состоянии в целом на протяжении 2,5 мин. Гранулят просеивали во влажном состоянии через сито 10 меш вручную для достижения более однородного размера гранул перед сушкой. Гранулят сушили на лотках в течение ночи при 50°С в течение 16 ч в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Гранулят затем измельчали, используя мельницу Fitzpatrick L1A (Fitzpatrick Co., Elmhurst, IL) с растирающей пластиной 0,040'' Conidur со скоростью 500 об/мин. Вещество анализировали на уровень лактона аторвастатина (на основании отношения интегрирования пика лактона относительно общих интегрированных площадей пиков с использованием ВЭЖХ), добавляя 400 мг гранулята к 50 мл смеси 1:1 (об./об.) 0,05 М аммонийно-цитратного буфера (рН 7,4) : ацетонитрила и встряхивая в течение 20 мин. Материал затем фильтровали, используя политетрафторэтиленовую мембрану Gelman Acrodisc (размер пор 0,45 мкм), и анализировали с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) (Phenomenex, колонка Ultremex C18, размер частиц 5 мкм, 25,0 см × 4,6 мм, ВЭЖХ Waters 2690D, Waters Corp., Milford, MA, инъекционный объем 20 мкл, поток 1,5 мл/мин; подвижная фаза 53:27:20 (об./об./об.) 0,05 М цитрат аммония (рН 4,0) : ацетонитрил : тетрагидрофуран; детекция с использованием детектора Waters 2487 при 244 нм). Результаты изложены в Таблице 1. Таблетки изготавливали под действием физической силы с использованием однопозиционного пресса Manesty F-Press (Manesty, Liverpool, United Kingdom). Для получения таблеток с массой 450 мг каждая использовали 13/32'' стандартный круглый вогнутый (SRC) пуансон и матрицу. Целевая прочность таблеток составляла 12 кПа в диапазоне 10-14 кПа (прочность таблеток тестировали, используя Schleuniger Tablet Hardness Tester, Dr. Schleuniger Pharmatron AG, Solothurn, Switzerland).
ПРИМЕР 3
ПОЛУЧЕНИЕ АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С КРОСКАРМЕЛЛОЗОЙ НАТРИЯ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (1,3 г), 39,0 г микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 50,7 г лактозы водной (Foremost Farms USA, Rothschild, Wl), 3,0 г кроскармеллозы натрия (Ac-Di-Sol™, FMC Biopolymer, Philadelphia, PA) и 2,0 г гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 500-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Препарат затем гранулировали, используя Pro-C-epT Mi Mi Pro гранулятор для влажного гранулирования с большим усилием сдвига (Pro-C-epT n.v., B-9060 Zelzate, Belgium) с использованием 0,9-л резервуара. Препарат перемешивали в сухом виде в течение 2 мин при скорости рабочего колеса 400 об/мин и скорости измельчителя 1000 об/мин. Перемешивание во влажном состоянии осуществляли при скорости рабочего колеса 600 об/мин и скорости измельчителя 1000 об/мин. Воду добавляли с приращениями по 10-30 г со скоростью 20-30 г/мин до общего количества 60 г, используя стандартный шприц на 60 см3. Материал перемешивали во влажном состоянии в целом на протяжении 5,5 мин. Гранулят просеивали во влажном состоянии через сито 10 меш вручную для достижения более однородного размера гранул перед сушкой. Гранулят сушили на лотках в течение ночи при 50°С в течение 16 ч в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Гранулят затем измельчали, используя мельницу Fitzpatrick L1A с растирающей пластиной 0,040'' Conidur со скоростью 500 об/мин. Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 4
ПОЛУЧЕНИЕ АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С КРАХМАЛГЛИКОЛЯТОМ НАТРИЯ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (1,3 г), 39,0 г микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 50,7 г лактозы водной (Foremost Farms USA, Rothschild, Wl), 3,0 г крахмалгликолята натрия (Explotab™, Penwest Pharmaceuticals Co., Cedar Rapids, IA) и 2,0 г гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 500-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Препарат затем гранулировали, используя Pro-C-epT Mi Mi Pro гранулятор для влажного гранулирования с большим усилием сдвига (Pro-С-ерТ n.v., B-9060 Zelzate, Belgium) с использованием 0,9-л резервуара. Препарат перемешивали в сухом виде в течение 2 мин при скорости рабочего колеса 400 об/мин и скорости измельчителя 1000 об/мин. Перемешивание во влажном состоянии осуществляли при скорости рабочего колеса 600 об/мин и скорости измельчителя 1000 об/мин. Воду добавляли с приращениями по 10-30 г со скоростью 20-30 г/мин до общего количества 55 г, используя стандартный шприц на 60 см3. Материал перемешивали во влажном состоянии в целом на протяжении 5,5 мин. Гранулят просеивали во влажном состоянии через сито 10 меш вручную для достижения более однородного размера гранул перед сушкой. Гранулят сушили на лотках в течение ночи при 50°С в течение 16 ч в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Гранулят затем измельчали, используя мельницу Fitzpatrick L1A с растирающей пластиной 0,040'' Conidur со скоростью 500 об/мин. Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 5
ПОЛУЧЕНИЕ АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С КУКУРУЗНЫМ КРАХМАЛОМ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (1,3 г), 39,0 г микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 50,7 г лактозы водной (Foremost Farms USA, Rothschild, WI), 3,0 г кукурузного крахмала, чистота 21 (National Starch and Chemical Corp., Bridgewater, NJ) и 2,0 г гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 500-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Препарат затем гранулировали, используя Pro-C-epT Mi Mi Pro гранулятор для влажного гранулирования с большим усилием сдвига (Pro-C-epT n.v., B-9060 Zelzate, Belgium) с использованием 0,9-л резервуара. Препарат перемешивали в сухом виде в течение 2 мин при скорости рабочего колеса 400 об/мин и скорости измельчителя 1000 об/мин. Перемешивание во влажном состоянии осуществляли при скорости рабочего колеса 600 об/мин и скорости измельчителя 1000 об/мин. Воду добавляли с приращениями по 10-30 г со скоростью 20-30 г/мин до общего количества 45 г, используя стандартный шприц на 60 см3. Материал перемешивали во влажном состоянии в целом на протяжении 2,5 мин. Гранулят просеивали во влажном состоянии через сито 8 меш вручную для достижения более однородного размера гранул перед сушкой. Гранулят сушили на лотках в течение ночи при 50°С в течение 16 ч в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Гранулят затем измельчали, используя мельницу Fitzpatrick L1A с растирающей пластиной 0,040'' Conidur со скоростью 500 об/мин. Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 6
ПОЛУЧЕНИЕ АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С ПРЕДВАРИТЕЛЬНО ЖЕЛАТИНИЗИРОВАННЫМ КРАХМАЛОМ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (1,3 г), 39,0 г микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 50,7 г лактозы водной (Foremost Farms USA, Rothschild, Wl), 3,0 г предварительно желатинизированного крахмала (Starch 1500, Colorcon, West Point, PA) и 2,0 г гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 500-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Препарат затем гранулировали, используя Pro-C-epT Mi Mi Pro гранулятор для влажного гранулирования с большим усилием сдвига (Pro-C-epT n.v., B-9060 Zelzate, Belgium) с использованием 0,9-л резервуара. Препарат перемешивали в сухом виде в течение 2 мин при скорости рабочего колеса 400 об/мин и скорости измельчителя 1000 об/мин. Перемешивание во влажном состоянии осуществляли при скорости рабочего колеса 600 об/мин и скорости измельчителя 1000 об/мин. Воду добавляли с приращениями по 10-30 г со скоростью 20-30 г/мин до общего количества 40 г, используя стандартный шприц на 60 см3. Материал перемешивали во влажном состоянии в целом на протяжении 3 мин. Гранулят просеивали во влажном состоянии через сито 8 меш вручную для достижения более однородного размера гранул перед сушкой. Гранулят сушили на лотках в течение ночи при 50°С в течение 16 ч в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Гранулят затем измельчали, используя мельницу Fitzpatrick L1A с растирающей пластиной 0,040'' Conidur со скоростью 500 об/мин. Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 7
ПОЛУЧЕНИЕ АМОРФНОГО АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С АЛЬГИНАТОМ НАТРИЯ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (40,5 мг), 1,22 г микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 1,58 г лактозы водной (Foremost Farms USA, Rothschild, Wl), 93,9 мг альгината натрия (Protanal™, FMC BioPolymer, Philadelphia, PA) и 62,4 мг гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 30-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Смесь затем гранулировали в 30-см3 бутыли, используя импеллер с изогнутыми микролопаточками с 1/2'' лезвием на миниперфораторном прессе с переменной скоростью (Micro-Drill, модель 164С-7, Cameron Precision Engineering Co., Sonora, CA 95370). Перед применением лезвие изгибали до угла, достаточного для того, чтобы сметать гранулируемый материал и чтобы дать возможность части этого материала перетекать через верхнюю часть лезвия. Лезвие изгибали до угла примерно в 30° от вертикального положения. Гранулирующую жидкость вносили пипеткой с приращениями от 1,0 до 0,5 мл, перемешивая во влажном состоянии в течение 2,5 мин до образования подходящего гранулята, основываясь на визуальных наблюдениях (всего добавляли 1,5 мл). Гранулят сушили на лотках в течение 16 ч при 50°С в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 8
ПОЛУЧЕНИЕ АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С АЛЬГИНОВОЙ
КИСЛОТОЙ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (40,5 мг), 1,22 г микрокристаллической целлюлозы (Avicel РН102™, FMC Biopolymer, Philadelphia, PA), 1,58 г лактозы водной (Foremost Farms USA, Rothschild, WI), 93,9 мг альгиновой кислоты (Protacid™, FMC BioPolymer, Philadelphia, PA ) и 62,4 мг гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 30-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Смесь затем гранулировали в 30-см3 бутыли, используя импеллер с изогнутыми микролопаточками с 1/2'' лезвием на миниперфораторном прессе с переменной скоростью (Micro-Drill, модель 164С-7, Cameron Precision Engineering Co., Sonora, CA 95370). Перед применением лезвие изгибали до угла, достаточного для того, чтобы сметать гранулируемый материал и чтобы дать возможность части этого материала перетекать через верхнюю часть лезвия. Лезвие изгибали до угла примерно в 30° от вертикального положения. Гранулирующую жидкость вносили пипеткой с приращениями от 1,0 до 0,5 мл, перемешивая во влажном состоянии в течение 2,5 мин до образования подходящего гранулята, основываясь на визуальных наблюдениях (всего добавляли 1,5 мл). Гранулят сушили на лотках в течение 16 ч при 50°С в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 9
ПОЛУЧЕНИЕ АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С ПОРОШКОВОЙ ЦЕЛЛЮЛОЗОЙ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (40,5 мг), 1,22 г микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 1,58 г лактозы водной (Foremost Farms USA, Rothschild, Wl), 93,9 мг порошковой целлюлозы (Solka-Floc 40 NF™, International Fiber Corp., North Tonawanda, NY) и 62,4 мг гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 30 см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Смесь затем гранулировали в 30-см3 бутыли, используя импеллер с изогнутыми микролопаточками с 1/2'' лезвием на миниперфораторном прессе с переменной скоростью (Micro-Drill, модель 164С-7, Cameron Precision Engineering Co., Sonora, CA 95370). Перед применением лезвие изгибали до угла, достаточного для того, чтобы сметать гранулируемый материал и чтобы дать возможность части этого материала перетекать через верхнюю часть лезвия. Лезвие изгибали до угла примерно в 30° от вертикального положения. Гранулирующую жидкость вносили пипеткой с приращениями от 1,0 до 0,5 мл, перемешивая во влажном состоянии в течение 2,5 мин до образования подходящего гранулята, основываясь на визуальных наблюдениях (всего добавляли 1,5 мл). Гранулят сушили на лотках в течение 16 ч при 50°С в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 10
ПОЛУЧЕНИЕ АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С ГИДРОКСИПРОПИЛЦЕЛЛЮЛОЗОЙ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (40,5 мг), 1,22 г микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 1,58 г лактозы водной (Foremost Farms USA, Rothschild, Wl), 93,9 мг гидроксипропилцеллюлозы (с низкой степенью замещения, Shin-Etsu Chemical Co., Tokyo, Japan) и 62,4 мг гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 30-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Смесь затем гранулировали в 30-см3 бутыли, используя импеллер с изогнутыми микролопаточками с 1/2'' лезвием на миниперфораторном прессе с переменной скоростью (Micro-Drill, модель 164С-7, Cameron Precision Engineering Co., Sonora, CA 95370). Перед применением лезвие изгибали до угла, достаточного для того, чтобы сметать гранулируемый материал и чтобы дать возможность части этого материала перетекать через верхнюю часть лезвия. Лезвие изгибали до угла примерно в 30° от вертикального положения. Гранулирующую жидкость вносили пипеткой с приращениями от 1,0 до 0,5 мл, перемешивая во влажном состоянии в течение 2,5 мин до образования подходящего гранулята, основываясь на визуальных наблюдениях (всего добавляли 1,5 мл). Гранулят сушили на лотках в течение 16 ч при 50°С в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 11
ПОЛУЧЕНИЕ АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С АЛЮМОСИЛИКАТОМ МАГНИЯ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (40,5 мг), 1,22 г микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 1,58 г лактозы водной (Foremost Farms USA, Rothschild, Wl), 93,9 мг алюмосиликата магния (Veegum F™, R.T. Vanderbilt Co., Norwalk, CT) и 62,4 мг гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 30-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Смесь затем гранулировали в 30-см3 бутыли, используя импеллер с изогнутыми микролопаточками с 1/2'' лезвием на миниперфораторном прессе с переменной скоростью (Micro-Drill, модель 164С-7, Cameron Precision Engineering Co., Sonora, CA 95370). Перед применением лезвие изгибали до угла, достаточного для того, чтобы сметать гранулируемый материал и чтобы дать возможность части этого материала перетекать через верхнюю часть лезвия. Лезвие изгибали до угла примерно в 30° от вертикального положения. Гранулирующую жидкость вносили пипеткой с приращениями от 1,0 до 0,5 мл, перемешивая во влажном состоянии в течение 2,5 мин до образования подходящего гранулята, основываясь на визуальных наблюдениях (всего добавляли 1,5 мл). Гранулят сушили на лотках в течение 16 ч при 50°С в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 12
ПОЛУЧЕНИЕ АМОРФНОЙ КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА С ИСПОЛЬЗОВАНИЕМ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ С ПОЛАКРИЛИНОМ КАЛИЯ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (40,5 мг), 1,22 г микрокристаллической целлюлозы (Avicel РН102™, FMC Biopolymer, Philadelphia, PA), 1,58 г лактозы водной (Foremost Farms USA, Rothschild, WI), 93,9 мг полакрилина калия (Amberlite IRP88™, Rohm and Haas Co., Philadelphia, PA) и 62,4 мг гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) объединяли в 30-см3 бутыли и перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Masehinenfabrik, Basel, Switzerland). Смесь затем гранулировали в 30-см3 бутыли, используя импеллер с изогнутыми микролопаточками с 1/2'' лезвием на миниперфораторном прессе с переменной скоростью (Micro-Drill, модель 164С-7, Cameron Precision Engineering Co., Sonora, CA 95370). Перед применением лезвие изгибали до угла, достаточного для того, чтобы сметать гранулируемый материал и чтобы дать возможность части этого материала перетекать через верхнюю часть лезвия. Лезвие изгибали до угла примерно в 30° от вертикального положения. Гранулирующую жидкость вносили пипеткой с приращениями от 1,0 до 0,5 мл, перемешивая во влажном состоянии в течение 2,5 мин до образования подходящего гранулята, основываясь на визуальных наблюдениях (всего добавляли 1,5 мл). Гранулят сушили на лотках в течение 16 ч при 50°С в сушилке с подачей горячего воздуха (Gruenberg Forced Hot Air Oven, Gruenberg Oven Co., Williamsport, PA). Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 1.
ПРИМЕР 13
ПРИГОТОВЛЕНИЕ ГРАНУЛЯТОВ АТОРВАСТАТИНА, ПОЛУЧАЕМЫХ ВЛАЖНЫМ СПОСОБОМ, И ЕГО ТАБЛЕТОК ПРИ ПОМОЩИ СПОСОБА, ОБЕСПЕЧИВАЮЩЕГО ЧИСТЫЙ АТОРВАСТАТИН, С ИСПОЛЬЗОВАНИЕМ РЯДА РАЗРЫХЛИТЕЛЕЙ
К 13,30 г вещества, полученного в Примере 2, добавляли 0,858 г одного из следующих разрыхлителей: (а) крахмалгликолят натрия; (б) кроскармеллоза натрия; (в) кукурузный крахмал или (г) предварительно желатинизированный крахмал, в 60-см3 бутыли. Смеси перемешивали в течение 5 мин, используя Turbula Shaker Mixer. К этой смеси в каждом случае добавляли 0,143 г стеарата магния (Mallinckrodt Co., St. Louis, МО). Препараты затем перемешивали 3 мин, используя Turbula Shaker Mixer. Материал анализировали на уровень лактона, как описано в Примере 2, и результаты изложены в Таблице 2. Таблетки изготавливали под действием физической силы с использованием однопозиционного пресса Manesty F-Press (Manesty, Liverpool, United Kingdom). Для получения таблеток массой 450 мг каждая использовали 13/32'' SRC пуансон и матрицу. Целевая прочность таблеток составляла 12 кПа в диапазоне 10-14 кПа (прочность таблеток тестировали, используя Schleuniger Tablet Hardness Tester, Dr.Schleuniger Pharmatron AG, Solothurn, Switzerland). Вещество анализировали, как описано в Примере 2; результаты изложены в Таблице 2.
ПРИМЕР 14
КОНТРОЛЬ ВЛАЖНОГО ГРАНУЛИРОВАНИЯ АТОРВАСТАТИНА В ОТСУТСТВИЕ ЛЕТУЧЕГО ОСНОВАНИЯ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (62,1 мг), 1772,1 мг микрокристаллической целлюлозы (Avicel РН102™, FMC Biopolymer, Philadelphia, PA), 1010,4 мг лактозы водной (Foremost Farms USA, Rothschild, WI), 62,1 мг гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) и 93,3 мг кроскармеллозы натрия (Ac-Di-Sol™, FMC Biopolymer, Philadelphia, PA) помещали в 30-см3 стеклянную бутыль. Объединенные сухие компоненты перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Смесь затем гранулировали в 30-см3 бутыли, используя импеллер с изогнутыми микролопаточками с 1/2'' лезвием на миниперфораторном прессе с переменной скоростью (Micro-Drill, модель 164С-7, Cameron Precision Engineering Co., Sonora, CA 95370). Перед применением лезвие изгибали до угла, достаточного для того, чтобы сметать гранулируемый материал и чтобы дать возможность части этого материала перетекать через верхнюю часть лезвия. Лезвие изгибали до угла примерно в 30° от вертикального положения. Гранулирующую жидкость вносили пипеткой с приращениями от 0,5 до 1,0 мл, перемешивая во влажном состоянии в течение 4 мин до образования подходящего гранулята, основываясь на визуальных наблюдениях (всего добавляли 2,5 мл). Влажный гранулят сушили на протяжении ночи при 50°С в течение 16 ч в сушилке с подачей горячего воздуха. Вещество анализировали на уровень лактона, как описано а Примере 2, с тем изменением, что использовали 275 мг гранулята вместо 400 мг. Результаты изложены в Таблице 3.
ПРИМЕР 15
ПРИГОТОВЛЕНИЕ ГРАНУЛЯТОВ АМОРФНОГО АТОРВАСТАТИНА, ПОЛУЧАЕМЫХ ВЛАЖНЫМ СПОСОБОМ С ИСПОЛЬЗОВАНИЕМ ЛЕТУЧИХ ОСНОВАНИЙ
Аморфную кальциевую соль аторвастатина, полученную, как описано в Примере 1 (62,1 мг), 1772,1 мг микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 1010,4 мг лактозы, водной (Foremost Farms USA, Rothschild, WI), 62,1 мг гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) и 93,3 мг кроскармеллозы натрия (Ac-Di-Sol™, FMC Biopolymer, Philadelphia, PA) помещали в 30-см3 стеклянную бутыль. Объединенные сухие компоненты перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Смесь затем гранулировали, как описано в приведенном выше контроле, используя в тестах растворы летучих оснований: (а) 2,5 мл 30% гидроксида аммония (J.Т.Baker Co.), (б) 2,5 мл 3% гидроксида аммония, (в) 2,5 мл 0,00012% гидроксида аммония, (г) 2,0 мл 40% гидроксида тетрабутиламмония (Mallinckrodt Co.). Влажные грануляты сушили на протяжении ночи при 50°С в течение 16 ч в сушилке с подачей горячего воздуха. В каждой пробе вещество анализировали на уровень лактона, как описано в Примере 2, с тем изменением, что использовали 150 мг гранулята и экстракционный объем 30 мл. Результаты изложены в Таблице 3.
ПРИМЕР 16
ПРИГОТОВЛЕНИЕ ГРАНУЛЯТОВ АМОРФНОГО АТОРВАСТАТИНА, ПОЛУЧАЕМЫХ ВЛАЖНЫМ СПОСОБОМ С ИСПОЛЬЗОВАНИЕМ СУШКИ ПРИ РАЗНЫХ ТЕМПЕРАТУРАХ
Аморфную кальциевую соль аторвастатина, полученную, как в Примере 1 (40,5 мг), 1218,8 мг микрокристаллической целлюлозы (Avicel PH102™, FMC Biopolymer, Philadelphia, PA), 1572,1 мг лактозы водной (Foremost Farms USA, Rothschild, WI), 62,5 мг гидроксипропилцеллюлозы (Klucel EXF™, Hercules Incorporated, Aqualon Division, Wilmington, DE) и 93,8 мг крахмалгликолята натрия (Explotab™, Penwest Pharmaceuticals Co., Cedar Rapids, IA) помещали в 30-см3 стеклянную бутыль. Объединенные сухие компоненты перемешивали в течение 10 мин, используя Turbula Shaker Mixer (Willy A. Bachofen AG Maschinenfabrik, Basel, Switzerland). Гранулирующую жидкость, приготавливаемую с избытком, готовили путем объединения 99 г Н2O с 1 г полисорбата 80 (Tween 80™, Spectrum Chemicals & Lab Products, Gardena, CA) в 125 мл колбе и перемешивания. Смесь порошка затем гранулировали, как описано в Примере 1, используя 2,5 мл гранулирующей жидкости, перемешивая во влажном состоянии в течение 4 мин. Влажные грануляты затем делили на три приблизительно равные части. Каждую часть сушили в течение 16 часов при следующих условиях: (а) 30°С, вакуумная печь, (б) 50°С, конвекционная печь, (в) 70°С, вакуумная печь. В каждой пробе вещество анализировали на уровень лактона (на основании отношения интегрирования пика лактона относительно общих интегрированных площадей пиков, используя ВЭЖХ), путем добавления 300 мг материала к смеси 1:2:2 (об.,об.,об.) 0,05 М аммоний-ацетатный буфер (рН 7,4) : ацетонитрил : тетрагидрофуран и встряхивания в течение 20 минут. Эту смесь фильтровали, используя одноразовую 0,45 мкм политетрафторэтиленовую мембрану (Whatman), и анализировали с использованием ВЭЖХ (HP 1100, Zorbax SB-C8, размер частиц 5 мкм, колонка 25,0 см × 4,6 мм, термостатируемая при 35°С; инъецируемый объем 20 мкл; скорость потока 1,5 мл/мин; детекция при 244 нм). При элюции использовали линейный градиент, начиная с 67:21:12 (об./об./об.) и переходя на 54:34:12 (об./об./об.) смеси 0,05 М аммоний-ацетатный буфер (рН 7,4) : ацетонитрил : тетрагидрофуран через 40 минут (100% последней смеси через 55 минут). Результаты изложены в Таблице 4.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ АТОРВАСТАТИНА | 2004 |
|
RU2325903C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ АТОРВАСТАТИН, ИЗГОТОВЛЕННЫЙ БЕЗ ГРАНУЛИРОВАНИЯ | 2004 |
|
RU2314804C2 |
| КОМБИНИРОВАННАЯ КОМПОЗИЦИЯ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ, СОДЕРЖАЩАЯ ЭЗЕТИМИБ И РОЗУВАСТАТИН | 2014 |
|
RU2683937C2 |
| СТАБИЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ АМЛОДИПИНА БЕЗИЛАТ И АТЕНОЛОЛ | 1998 |
|
RU2188636C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИНГИБИТОР HMG РЕДУКТАЗЫ | 2000 |
|
RU2206324C1 |
| Комбинированная композиция, содержащая метформин замедленного высвобождения и ингибитор HMG-CoA-редуктазы немедленного высвобождения | 2014 |
|
RU2651460C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ, СОДЕРЖАЩИЕ АЦЕТАТ ЛИКАРБАЗЕПИНА | 2008 |
|
RU2546521C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ 5,8,14-ТРИАЗАТЕТРАЦИКЛО[10.3.1.0(2,11).0(4,9)]ГЕКСАДЕКА-2( 11),3,5,7,9-ПЕНТАЕНА | 2002 |
|
RU2272629C2 |
| СТАБИЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ВОДОРАСТВОРИМУЮ СОЛЬ ВИНФЛУНИНА | 2008 |
|
RU2462248C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ДИАБЕТА 2 ТИПА | 2010 |
|
RU2533560C2 |
Настоящее изобретение относится к медицине и описывает гранулированную влажным методом фармацевтическую композицию аторвастатина с менее чем примерно 5% (масс.) добавки соли щелочноземельного металла, содержащую (а) аторвастатин, где указанный аторвастатин представляет собой по меньшей мере отчасти неупорядоченную форму или смесь кристаллической и неупорядоченной форм аторвастатина, или его фармацевтически приемлемую соль, и (б) разрыхлитель или комбинацию разрыхлителей, выбранных из группы, состоящей из крахмалгликолята натрия, крахмала, кукурузного крахмала, предварительно желатинизированного крахмала, альгината натрия, порошковой целлюлозы, гидроксипропилцеллюлозы, алюмосиликата магния и полакрилина калия, где указанная гранулированная влажным методом фармацевтическая композиция содержит не более чем примерно 3% лактона аторвастатина, на основании отношения площади пика лактона относительно объединенных площадей пиков, относящихся ко всему лекарственному средству, определенных путем ВЭЖХ. Описаны также способы получения указанной композиции, наборы для содержания такой композиции. Заявленное изобретение дает возможность получения аторвастатина с высокой степенью чистоты, а также стабильность лекарственной формы аторвастатина, имеющей хорошую скорость распадаемости и биодоступности. 8 н. и 15 з.п. ф-лы, 4 табл.
(а) аторвастатин, где указанный аторвастатин представляет собой по меньшей мере отчасти неупорядоченную форму или смесь кристаллической и неупорядоченной форм аторвастатина, или его фармацевтически приемлемую соль; и
(б) разрыхлитель или комбинацию разрыхлителей, выбранных из группы, состоящей из крахмалгликолята натрия, крахмала, кукурузного крахмала, предварительно желатинизированного крахмала, альгината натрия, порошковой целлюлозы, гидроксипропилцеллюлозы, алюмосиликата магния и полакрилина калия,
где указанная гранулированная влажным методом фармацевтическая композиция содержит не более чем примерно 3% лактона аторвастатина, на основании отношения площади пика лактона относительно объединенных площадей пиков, относящихся ко всему лекарственному средству, определенных путем ВЭЖХ.
(а) объединение аторвастатина, где указанный аторвастатин представляет собой по меньшей мере отчасти неупорядоченную форму или смесь кристаллической и неупорядоченной форм аторвастатина, или его фармацевтически приемлемой соли с крахмалгликолятом натрия, крахмалом, альгинатом натрия, порошковой целлюлозой, гидроксипропилцеллюлозой, алюмосиликатом магния или полакрилином калия или их комбинациями и, возможно, другими эксципиентами;
(б) добавление достаточного количества воды, изопропанола, этанола или их смесей к смеси аторвастатина со стадии (а) под действием усилия сдвига с образованием гранул;
(в) сушку указанных гранул.
(а) объединение аторвастатина, где указанный аторвастатин представляет собой по меньшей мере отчасти неупорядоченную форму или смесь кристаллической и неупорядоченной форм аторвастатина, или его фармацевтически приемлемой соли с менее чем 2 мас.% разрыхлителя;
(б) добавление достаточного количества воды, изопропанола, этанола или их смесей к смеси аторвастатина со стадии (а) под действием усилия сдвига с образованием гранул;
(в) сушку указанных гранул;
(г) смешивание в разрыхлителе и, возможно, других эксципиентах.
(а) объединение аторвастатина, где указанный аторвастатин представляет собой по меньшей мере отчасти неупорядоченную форму или смесь кристаллической и неупорядоченной форм аторвастатина, или его фармацевтически приемлемой соли и одного или более чем одного эксципиента;
(б) добавление под действием усилия сдвига достаточного количества летучего основания, растворенного в воде, изопропаноле или этаноле или в их смеси, с образованием гранул;
(в) сушку указанных гранул.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US 6242003 B1, 05.06.2001 | |||
| EP 1291017 A2, 12.03.2003 | |||
| КУДРИН А.Н | |||
| Проблемы взаимодействия лекарственных средств | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2008-08-27—Публикация
2004-06-01—Подача