ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СВЯЗАННЫЕ ЗАЯВКИ
Настоящей заявкой заявляются притязания на приоритетные права, вытекающие из следующих первых заявок США: заявки №60/250.072, поданной 30 ноября 2000 года; заявки №60/267.897, поданной 09 февраля 2001 года; заявки №60/281.872, поданной 05 апреля 2001 года; заявки №60/312.144, поданной 13 августа 2001 года и заявки №60/326.529, поданной 01 октября 2001, которые все включены в настоящую заявку по ссылке.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ПРЕДЛАГАЕМОЕ ИЗОБРЕТЕНИЕ
Предлагаемое изобретение относится к новым кристаллическим полиморфным модификациям полукальциевой соли аторвастатина, к новым способам получения кристаллических полиморфных модификаций полукальциевой соли аторвастатина и к полукальциевой соли аторвастатина с малым разбросом размера частиц.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ПРЕДЛАГАЕМОГО ИЗОБРЕТЕНИЯ
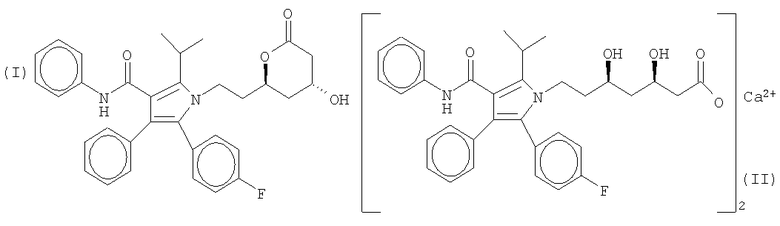
В данной отрасли хорошо известны аторвастатин ([R-(R*,R*)]-2-(4-фторфенил)-β,δ-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-энантовая кислота), который может быть представлен как циклический сложный эфир, и тригидрат кальциевой соли аторвастатина, структурные молекулярные формулы которых показаны ниже (формула (I) и формула (II) соответственно). Эти соединения описаны, помимо прочих источников, в патентах США №4.681.893 и №5.273.995, а также в одновременно рассматриваемой патентной заявке США №60/166.153, поданной 17 ноября 2000 года, при этом указанные патенты и заявка включены в настоящую заявку по ссылке.
Аторвастатин принадлежит к классу лекарственных веществ, именуемых статинами. Лекарственные вещества класса статинов являются наиболее терапевтически эффективными из известных в настоящее время лекарственных средств для понижения концентрации частиц липопротеинов низкой плотности в крови пациентов с риском сердечно-сосудистых заболеваний. Высокие концентрации липопротеинов низкой плотности в крови связывают с образованием поражений в коронарных сосудах, которые препятствуют кровотоку и могут привести к разрыву или развитию тромбоза (см. работу Goodman and Oilman "The Pharmacologcal Basis of Therapeutics" (Гудмэн и Гильман "Фармакологическая основа терапевтики"), 879. 9-е изд., 1996 год). Было доказано, что при снижении концентрации липопротеинов низкой плотности в плазме уменьшается риск возникновения клинических случаев у пациентов с сердечно-сосудистыми заболеваниями и у пациентов без сердечно-сосудистых заболеваний, но с гиперхолестеринемией (Scandinavian Simvastatin Study Group (Скандинавская группа по изучению симвастатина), 1994; Lipid Research Clinics Program (Клиническая программа исследований липидов), 1984а, 1984b).
В настоящее время выяснены некоторые детали механизма действия лекарственных веществ класса статинов. Они препятствуют синтезу холестерина и других стеринов в печени путем конкурентного ингибирования активности фермента - 3-гидрокси-3-метилглутарил коэнзим А (ГМГ-КоА) редуктазы. ГМГ-КоА редуктаза служит биокатализатором превращения 3-гидрокси-3-метил-глутарила (ГМГ) в мевалонат, что является определяющей стадией в биосинтезе холестерина, и, таким образом, ее подавление приводит к снижению концентрации холестерина в печени. Липопротеин очень низкой плотности служит средством транспортировки холестерина и триглицеридов от печени к периферическим клеткам. В результате катаболизма липопротеина очень низкой плотности в периферических клетках происходит образование жирных кислот, которые могут храниться в адопцитах или подвергаются окислению в мышцах. Липопротеин очень низкой плотности превращается в липопротеин промежуточной плотности, который или удаляется с помощью рецепторов липопротеина низкой плотности, или превращается в липопротеин низкой плотности. Снижение производства холестерина ведет к увеличению количества рецепторов липопротеина низкой плотности и соответственному снижению производства частиц липопротеина низкой плотности при метаболизме липопротеина промежуточной плотности.
Тригидрат полукальциевой соли аторвастатина поставляется на рынок компанией Уорнер-Ламберт Ко. (Warner-Lambert Co.) под товарным знаком LIPITOR. Информация об аторвастатине впервые стала достоянием гласности и предметом изобретения благодаря патенту США №4.681.893. Полукальциевая соль атовастатина (см. формулу (II), приведенную выше) раскрыт в патенте США №5.273.995. В патенте США №5.273.995 говорится, что полукальциевая соль атовастатина может быть получена путем кристаллизации из соляного раствора в результате перегруппировки натриевой соли с хлористым кальцием (CaCl2) с последующей очисткой путем повторной кристаллизации из смеси этилацетата и гексана, взятых в соотношении 5:3.
Настоящим изобретением предлагаются новые полиморфные модификации (кристаллические структуры) полукальциевой соли аторвастатина как в сольватированном, так и в гидратированном состояниях. Свойством некоторых молекул и молекулярных комплексов является способность к образованию разных кристаллических структур (полиморфизм). Из одних и тех же простых молекул, таких как аторвастатин (формула (I)), или солевых молекулярных комплексов, таких как тригидрат кальциевой соли аторвастатина (формула (II)), могут быть образованы различные твердые вещества, четко различающиеся по таким физическим свойствам, как температура плавления, рентгеновская дифракционная картина, картина инфракрасного поглощения и спектр ядерного магнитного резонанса. Различие физических свойств полиморфных модификаций вещества с одной и той же структурной молекулярной формулой обусловлено ориентацией и межмолекулярными взаимодействиями соседних молекул или молекулярных комплексов в массе твердого тела. Следовательно, мы имеем дело с составляющими семейство полиморфных модификаций разными твердыми веществами, имеющими одну и ту же структурную молекулярную формулу, но различающимися желательными или нежелательными для нас физическими свойствами. Одним из важнейших физических свойств полиморфных модификаций веществ, использующихся в качестве фармацевтических препаратов, является их растворимость в водных растворах, в особенности их растворимость в желудочном соке пациента. Так, например, в тех случаях, когда лекарственное вещество всасывается через желудочно-кишечный тракт, часто представляется желательным, чтобы лекарственное вещество, нестабильное в среде желудка или кишечника, растворялось медленно, с тем чтобы не происходило накопления продуктов его разложения, представляющих вред для организма. А в тех случаях, когда эффективность лекарственного вещества коррелирует с пиком концентрации этого лекарственного вещества в крови пациента, а этим свойством обладают лекарственные вещества класса статинов, и когда лекарственное вещество легко всасывается в желудочно-кишечном тракте, желательно, чтобы лекарственное вещество было в легкорастворимой полиморфной модификации, с тем чтобы была обеспечена более высокая эффективность по сравнению с таким же количеством этого вещества в малорастворимой полиморфной модификации.
Предметом патентов США №5.959.156 и №6.121.461, переданных компании Уорнер-Ламберт Ко. (Warner-Lambert Co.), являются полиморфные модификации Форма I, Форма II, Форма III и Форма IV полукальциевой соли аторвастатина, а полиморфная модификация Форма V полукальциевой соли аторвастатина раскрыта в являющейся общим достоянием патентной заявке №PCT/US00/31555. В патенте США №5.959.156 утверждается, что полиморфная модификация Форма I полукальциевой соли аторвастатина обладает более благоприятными, чем известная аморфная форма полукальциевой соли аторвастатина, характеристиками фильтрации и высушивания. Хотя полиморфная модификация Форма I свободна от некоторых недостатков аморфной полукальциевой соли аторвастатина с точки зрения технологичности, все же остается потребность в дальнейшем улучшении как этих, так и других свойств, таких как текучесть, паронепроницаемость и растворимость. Кроме того, открытие новых полиморфных модификаций лекарственного вещества дает занятым в этой отрасли ученым новые возможности для создания лекарственных форм с требуемым профилем высвобождения или другими желаемыми характеристиками.
КРАТКОЕ ОПИСАНИЕ ПРИЛАГАЕМЫХ ЧЕРТЕЖЕЙ
На фиг.1 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма VI, полученная при использовании обычного генератора рентгеновского излучения с медным анодом.
На фиг.2 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма VII, полученная при использовании обычного генератора рентгеновского излучения с медным анодом.
На фиг.3 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма VIII, полученная при использовании обычного генератора рентгеновского излучения с медным анодом.
На фиг.4 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма VIII, полученная при использовании синхротронного источника рентгеновского излучения.
На фиг.5 показан спектр ядерно-магнитного резонанса 13С полукальциевой соли аторвастатина полиморфной модификации Форма VIII.
На фиг.6 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма IX, полученная при использовании обычного генератора рентгеновского излучения с медным анодом.
На фиг.7 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма IX, полученная при использовании синхротронного источника рентгеновского излучения.
На фиг.8 показан спектр ядерно-магнитного резонанса 13С полукальциевой соли аторвастатина полиморфной модификации Форма IX.
На фиг.9 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма X, полученная при использовании обычного генератора рентгеновского излучения с медным анодом.
На фиг.10 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма X, полученная при использовании синхротронного источника рентгеновского излучения.
На фиг.11 показан спектр ядерно-магнитного резонанса 13С полукальциевой соли аторвастатина полиморфной модификации Форма X.
На фиг.12 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма XI, полученная при использовании обычного генератора рентгеновского излучения с медным анодом.
На фиг.13 приведена характеристическая диаграмма порошковой рентгеновской дифракции для полукальциевой соли аторвастатина полиморфной модификации Форма XII, полученная при использовании обычного генератора рентгеновского излучения с медным анодом.
На фиг.14 приведена термограмма цифровой сканирующей калориметрии заявляемой Формы IX.
На фиг.15 приведена термограмма цифровой сканирующей калориметрии известной Формы I.
На фиг.16 приведена термограмма цифровой сканирующей калориметрии известной Формы II.
На фиг.17 приведена термограмма цифровой сканирующей калориметрии известной Формы III.
На фиг.18 приведена термограмма цифровой сканирующей калориметрии известной Формы IV.
На фиг.19 приведена термограмма цифровой сканирующей калориметрии известной Формы VI.
На фиг.20 приведена термограмма цифровой сканирующей калориметрии известной Формы VI.
На фиг.21 приведено изображение частиц Формы XI, полученное с помощью оптического микроскопа.
На фиг.22-24 приведены изображения частиц Форм I-IV, полученные с помощью оптического микроскопа.
На фиг.25 приведено изображение частиц заявляемой Формы XII, полученное с помощью оптического микроскопа. Аторвастатин в легком масле.
КРАТКОЕ ОПИСАНИЕ ПРЕДЛАГАЕМОГО ИЗОБРЕТЕНИЯ
Предметом предлагаемого изобретения являются сольваты и гидраты полукальциевой соли аторвастатина.
Предметом предлагаемого изобретения является новая кристаллическая структура (полиморфная модификация) полукальциевой соли аторвастатина, обозначенная как Форма VI, и новые способы ее получения.
Еще одним предметом предлагаемого изобретения является новая кристаллическая структура (полиморфная модификация) полукальциевой соли аторвастатина, обозначенная как Форма VIII, и новые способы ее получения.
Еще одним предметом предлагаемого изобретения является новая кристаллическая структура (полиморфная модификация) полукальциевой соли аторвастатина, обозначенная как Форма IX, и новые способы ее получения.
Еще одним предметом предлагаемого изобретения является новая кристаллическая структура (полиморфная модификация) полукальциевой соли аторвастатина, обозначенная как Форма X, и новые способы ее получения.
Еще одним предметом предлагаемого изобретения является новая кристаллическая структура (полиморфная модификация) полукальциевой соли аторвастатина, обозначенная как Форма XI, и новые способы ее получения.
Еще одним предметом предлагаемого изобретения является новая кристаллическая структура (полиморфная модификация) полукальциевой соли аторвастатина, обозначенная как Форма XII, и новые способы ее получения.
Еще одним предметом предлагаемого изобретения являются новые способы получения полукальциевой соли аторвастатина полиморфной модификации Форма I.
Еще одним предметом предлагаемого изобретения являются новые способы получения полукальциевой соли аторвастатина полиморфной модификации Форма II.
Еще одним предметом предлагаемого изобретения являются новые способы получения полукальциевой соли аторвастатина полиморфной модификации Форма IV.
Еще одним предметом предлагаемого изобретения являются новые способы получения полукальциевой соли аторвастатина полиморфной модификации Форма V.
Еще одним предметом предлагаемого изобретения являются новые способы получения аморфной полукальциевой соли аторвастатина
Еще одним предметом предлагаемого изобретения являются фармацевтические композиции и лекарственные формы, содержащие полукальциевую соль аторвастатина в какой-либо из следующих полиморфных модификаций: Форма VI, Форма VII, Форма VIII, Форма IX, Форма Х, Форма XI, или смеси этих полиморфных модификаций.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДЛАГАЕМОГО ИЗОБРЕТЕНИЯ
Некоторые кристаллические структуры (полиморфные модификации) полукальциевой соли аторвастатина существуют в сольватированном состоянии и гидратированном состоянии. Гидраты полукальциевой соли аторвастатина исследовались с помощью анализа по методу Карла Фишера и термогравиметрического анализа.
Анализ по методу порошковой рентгеновской дифракции с использованием обычного CuKα-излучения осуществлялся с помощью известных в отрасли способов с использованием порошкового рентгеновского дифрактометра модели X'TRA производства SCINTAG (компании Scintag, inc.), снабженного твердотельным детектором. Использовалось излучение меди с длиной волны λ=1,5418Å. Диапазон измерений составлял от 2 до 40° угла 2θ ("два тэта"). Образец вводился с помощью круглого стандартного алюминиевого держателя, имеющего на дне новую (нулевой категории) круглую кварцевую пластинку. Истолченные в порошок образцы подвергались осторожному перемалыванию, и ими, с уплотнением с помощью стеклянной пластинки, заполнялась имеющая круглую форму полость в держателе образца.
Анализ по методу порошковой рентгеновской дифракции с использованием синхротронного источника рентгеновского излучения осуществлялся на установке "National Synchrotron Light Source" Бруклинской национальной лаборатории (дифрактометрическая станция Х3В1). Образцы были без прессования упакованы в тонкостенные стеклянные капилляры. Длина волны рентгеновского излучения составляла приблизительно 1,15Å. Поскольку длина волны падающего света соответствует длине волны, чаще всего используемой в анализе по методу порошковой рентгеновской дифракции, пиковые значения рентгеновского излучения в диаграмме дифракции, полученной от синхротронного источника, выражаются в терминах d-интервалов, которые при изменении длины волны для получения диаграммы рентгеновской дифракции являются инвариантными. Сканирование осуществлялось в диапазоне от 1 до 20° угла 2θ. Спектральное разрешение находится в диапазоне от 0,01 до 0,03° полной ширины на половине максимума. Положения пиков с хорошим разрешением определены с точностью от 0,003 до 0,01°.
Измерения спектров ядерно-магнитного резонанса 13С с CP/MAS (кросс-поляризация / вращение под магическим углом) проводились при частоте 125,76 МГц с помощью цифрового спектрометра ядерного магнитного резонанса в Фурье-модификации (FT NMR) марки "Bruker DMX-500", снабженного измерительной головкой марки BL-4 с кросс-поляризацией/вращением под магическим углом и предусилителем излучения 1H для твердых веществ: скорость вращения 5,0 кГц, последовательность импульсов SELTICS (сокращение от "Sideband Elimination by Temporary Interruption of Chemical Shift" - "Подавление боковой полосы путем временной приостановки химического сдвига"), держатель образца - циркониевый ротор диаметром 4 мм.
Полукальциевая соль аторвастатина полиморфной модификации Форма VI характеризуется диаграммой порошковой рентгеновской дифракции, показанной на фиг.1, которая имеет пиковые значения при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 3,5, 5,1, 7,7, 8,2, 8,7 10,0, 12,5, 13,8, 16,2, 17,2, 17,9, 18,3, 19,5, 20,4, 20,9, 21,7, 22,4, 23,2, 24,3, 25,5. Наиболее характеристический пик наблюдается при значении угла "два тэта" 19,5±0,2 градуса. Диаграмма порошковой рентгеновской дифракции полукальциевой соли аторвастатина полиморфной модификации Форма VI была получена с помощью дифрактометра марки "Phylips", подобного аппаратуре SCINTAG, которая упоминалась выше.
Полукальциевая соль аторвастатина полиморфной модификации Форма VI может быть получена путем растворения полукальциевой соли аторвастатина любой другой полиморфной модификации, предпочтительно полиморфной модификации Форма I, в ацетоне с последующим осаждением полукальциевой соли аторвастатина полиморфной модификации Форма VI при добавлении антирастворителя, предпочтительно воды.
Полукальциевая соль аторвастатина полиморфной модификации Форма VII характеризуется диаграммой порошковой рентгеновской дифракции, показанной на фиг.2, которая имеет два широких пика: один при значениях угла "два тэта" в диапазоне от 18,5 до 21,8°, другой при значениях угла "два тэта" в диапазоне от 21,8 до 25,0°, и дополнительные широкие пики при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 4,7, 7,8, 9,3, 12,0, 17,1, 18,2. Содержание воды в образцах полукальциевой соли аторвастатина полиморфной модификации Форма VII могут достигать 12%.
Полиморфная модификация Форма VII полукальциевой соли аторвастатина может быть легко отличена от других полиморфных модификаций этого вещества по двум широким пикам при значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса) 7,8 и 9,3. Например, согласно информации, содержащейся в патенте США №5.969.156, полукальциевая соль аторвастатина полиморфной модификации Форма I имеет следующие пиковые значения угла "два тэта" (в градусах): 9,2, 9,5, 10,3, 10,6, 11,0 и 12,2. В этом диапазоне полиморфная модификация Форма II имеет два острых пика при значениях угла "два тэта" (в градусах) 8,5 и 9,0, а полиморфная модификация Форма IV имеет один сильный пик при значениях угла "два тэта" 8,0 градусов. Другие широкие пики в диапазоне углов "два тэта" от 15 до 25° отличают полиморфную модификацию Форма VII от всех других полиморфных модификаций. Полиморфные модификации Форма I, Форма III и Форма IV все имеют в этом диапазоне углов "два тэта" острые пики.
Полукальциевая соль аторвастатина полиморфной модификации Форма VII может быть получена путем обработки полукальциевой соли аторвастатина полиморфной модификации Форма I с помощью этилового спирта, предпочтительно безводного этилового спирта, при температуре от комнатной до температуры дефлегмации в течение периода времени продолжительностью от приблизительно 1 часа до приблизительно 24 часов, предпочтительно от 2,5 до 16 часов. Если процесс осуществляется при дефлегмации этилового спирта, то превращение завершается в течение приблизительно 2,5 часов. Если же процесс осуществляется при комнатной температуре, то для его завершения требуется более длительное время.
Полукальциевая соль аторвастатина полиморфной модификации Форма VIII характеризуется диаграммой порошковой рентгеновской дифракции, показанной на фиг.3, которая получена с использованием обычного CuKα-излучения, при этом излучение имеет пиковые значения при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 4,8, 5,2, 5,9, 7,0, 8,0, 9,3, 9,6, 10,4, 11,9, 16,3, 17,1 (широкий пик), 17,9, 18,6, 19,2, 20,0, 20,8, 21,1, 21,6, 22,4, 22,8, 23,9, 24,7, 25,6, 26,5, 29,0. Наиболее характеристические пики наблюдаются при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 6,9, 9,3, 9,6, 16,3, 17,1, 19,2, 20,0, 21,6, 22,4, 23,9, 24,7, 25,6 и 26,5. С помощью анализа по методу Карла Фишера было установлено, что содержание воды в образцах полукальциевой соли аторвастатина полиморфной модификации Форма VIII достигает 7%. Полиморфная модификация Форма VII полукальциевой соли аторвастатина может быть легко отличена от полиморфных модификаций Форма I - Форма IV по характеристическим острым пикам при значениях угла "два тэта" 9,3 и 9,6°. Согласно информации, содержащейся в патенте США №5.969.156, полукальциевая соль аторвастатина полиморфной модификации Форма I имеет один средний пик при значении угла "два тэта" 6,9° и острые пики при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 9,2, 9,5, 10,3, 10,6, 11,0 и 12,2. Что касается полиморфной модификации Форма IV, то считается установленным, что она имеет два пиковых значения: при значениях угла "два тэта" 8,0 и 9,7°. В отношении полиморфной модификации Форма II считается установленным, что она имеет в этой области два острых пика: при значениях угла "два тэта" 8,5 и 9,0°. А в отношении полиморфной модификации Форма III в соответствии с информацией, содержащейся в патенте США №6.121.461, известно, что она имеет в этой области один сильный пик при значении угла "два тэта" 8,7. Эти характеристики не наблюдаются на диаграмме порошковой рентгеновской дифракции для полиморфной модификации Форма VIII. Кроме того, на диаграмме порошковой рентгеновской дифракции для полиморфной модификации Форма VIII наблюдается один острый пик средней интенсивности при значении угла "два тэта" 7,0°, который четко отличается от других пиков в этой области. Сравнение диаграммы порошковой рентгеновской дифракции для полиморфной модификации Форма VIII с диаграммами порошковой рентгеновской дифракции для полиморфных модификаций Форма I - Форма IV показывает, что эта характеристика полиморфной модификации Форма VIII является отличительной.
Другие пики на диаграмме порошковой рентгеновской дифракции для полиморфной модификации Форма VIII, которые являются уникальными для этой полиморфной модификации, наблюдаются при значениях угла "два тэта" 19,2 и 20,0° (сильные и острые пики). Согласно информации, содержащейся в патенте США №5.969.156, полиморфная модификация Форма I имеет в этой области следующие пиковые значения угла "два тэта" (в градусах): 21,6, 22,7, 23,3 и 23,7. Считается установленным, что в этой области полиморфная модификация Форма IV имеет пики при значениях угла "два тэта" 18,4 и 19,6°, в то время как полиморфная модификация Форма II имеет два главных пика при значениях угла "два тэта" 17,0 и 20,5°, а полиморфная модификация Форма III имеет пики при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 17,7, 18,2, 18,9, 20,0 и 20,3.
Для определения кристаллической системы и размеров элементарной ячейки кристалла полукальциевая соль аторвастатина полиморфной модификации Форма VIII была подвергнута анализу по методу синхротронной порошковой рентгеновской дифракции. В результате анализа было установлено, что полиморфная модификация Форма VIII имеет моноклинальную элементарную ячейку со следующими размерами кристаллической решетки: а=18,55-18,7Å, b=5,52-5,53Å, с=31,0-31,2Å, а угол β между осями "а" и "с" составляет 97,5-99,5°. Указанные параметры элементарной ячейки были определены с помощью метода Ле Бэля (Le Bail).
Дифрактограмма, приведенная на фиг.4, которая получена с помощью синхротронного источника рентгеновских лучей, имеет много острых пиков с высоким разрешением. В помещенной ниже таблице 1 приведены d-интервалы некоторых из более заметных пиков, а также значения угла 2θ ("два тэта"), при которых пики бы имели место в случае использования CuKα-излучения с длиной волны λ=1,5418Å.
По причине естественного различия в свойствах независимых образцов и погрешностей измерения пиковые значения могут отклоняться от указанных выше в таблице 1 на 0,5% значения d-интервала. Если материал подвергается измельчению, например микронизации, то возможны более значительные отклонения.
Полукальциевая соль аторвастатина полиморфной модификации Форма VIII дает спектр ядерно-магнитного резонанса 13С в твердой фазе, показанный на фиг.5. Полиморфная модификация Форма VIII характеризуется следующими значениями химических сдвигов при ядерно-магнитном резонансе 13С в твердой фазе (в миллионных долях): 17,8, 20,0, 24,8, 25,2, 26,1, 40,3, 40,8, 41,5, 43,4, 44,1, 46,1, 70,8, 73,3, 114,1, 116,0, 119,5, 120,1, 121,8, 122,8, 126,6, 128,8, 129,2, 134,2, 135,1, 137,0, 138,3, 139,8, 159,8, 166,4, 178,8, 186,5. Полиморфная модификация Форма VIII при исследовании по методу ядерно-магнитного резонанса 13С в твердой фазе характеризуется следующими разностями химических сдвигов между резонансом с самым низким (в миллионных долях) значением химического сдвига и другими резонансами (в миллионных долях): 2,2, 7,0, 7,4, 8,3, 22,5, 23,0, 23,7, 25,6, 26,3, 28,3, 53,0, 55,5, 96,3, 98,2, 101,7, 102,3, 104,0, 105,0, 108,8, 111,0, 111,4, 116,4, 117,3, 119,2, 120,5, 122,0, 142,0, 148,6, 161,0 и 168,7. Указанные выше для полиморфной модификации Форма VIII значения химических сдвигов получены путем усреднения значений, полученных от спектров четырех образцов полукальциевой соли аторвастатина полиморфной модификации Форма VIII. Характеристические части дифракционной диаграммы обнаруживаются при значениях химического сдвига в диапазоне от 24 миллионных долей до 26 миллионных долей (алифатический диапазон), в диапазоне от 119 миллионных долей до 140 миллионных долей (ароматический диапазон) и в других областях. Точность, с которой определены значения химического сдвига, составляет ±0,1 миллионной доли, за исключением карбонилового пика при значении химического сдвига 178,8 миллионной доли, у которого флуктуация составляет ±0,4 миллионной доли.
Полукальциевая соль аторвастатина полиморфной модификации Форма VIII может существовать в виде сольвата с этиловым спиртом, в котором содержание этилового спирта достигает приблизительно 3%.
Для получения полукальциевой соли аторвастатина полиморфной модификации Форма VIII были признаны подходящими способы, описываемые ниже. При этом следует заметить, что эта полиморфная модификация может быть получена также путем эмпирического развития и очевидной модификации этих способов.
Полукальциевая соль аторвастатина полиморфной модификации Форма VIII может быть получена путем суспендирования полукальциевой соли аторвастатина в среде смеси этилового спирта и воды при повышенной температуре, предпочтительно при температуре от 78 до 80°С. Процедура суспендирования может быть включена в последнюю стадию способа получения полукальциевой соли аторвастатина, который обычно состоит в получении полукальциевой соли аторвастатина из свободной аторвастатиновой кислоты или лактона путем обработки ее с помощью источника ионов кальция. При такой комбинированной процедуре получается полукальциевая соль аторвастатина в системе растворителя, состоящей из этилового спирта и воды. При этом удобный способ получения полукальциевой соли аторвастатина полиморфной модификации Форма VIII состоит в осаждении полукальциевой соли аторвастатина путем добавления некоторого дополнительного количества воды с последующим суспендированием этой соли в среде указанной реакционной смеси в течение нескольких часов, предпочтительно от 6 до 16 часов.
Полиморфная модификация Форма VIII может быть получена также из полиморфной модификации Форма V путем обработки полиморфной модификации Форма V с помощью смеси этилового спирта и воды (EtOH:Н2О), взятых предпочтительно в соотношении приблизительно 5:1, при повышенной температуре ниже температуры дефлегмации, предпочтительно при температуре от 78 до 80°С. Одна из особо предпочтительных смесей этилового спирта и воды (EtOH:Н2О) содержит приблизительно 4% (по объему) воды в этиловом спирте. В процессе нагревания постепенно происходит растворение полиморфной модификации Форма V, и при достижении температуры 78-80°С наблюдается помутнение с закипанием или без закипания. По достижении этого состояния суспензию немедленно начинают охлаждать до комнатной температуры.
Кроме того, полиморфная модификация Форма VIII может быть получена путем обработки полукальциевой соли аторвастатина с помощью этилового спирта (EtOH), предпочтительно безводного этилового спирта, при повышенной температуре, предпочтительно при температуре кипения этилового спирта. При этих условиях происходит растворение и повторное осаждение аторвастатина. При дефлегмации может быть добавлен метиловый спирт (МеОН). Добавленный метиловый спирт может оказать неблагоприятное воздействие на выход конечного продукта, но зато может повысить его химическую чистоту. В качестве исходного материала для получения полиморфной модификации Форма VIII по этому способу могут быть взяты другие полиморфные модификации полукальциевой соли аторвастатина, предпочтительно полиморфные модификации Форма I или Форма V, а также их смеси с аморфной полукальциевой солью аторвастатина.
В предпочтительных вариантах осуществления вышеописанных способов получения полукальциевой соли аторвастатина полиморфной модификации Форма VIII этиловый спирт или его смесь с водой используют в количестве от приблизительно 10 мл на грамм до приблизительно 100 мл на грамм, в еще более предпочтительных вариантах от приблизительно 20 мл на грамм до приблизительно 80 мл на грамм.
Авторами предлагаемого изобретения было обнаружено, что полукальциевая соль аторвастатина, содержащая более 0,1% дефторированной формы полукальциевой соли аторвастатина и/или более 1% транс-изомера полукальциевой соли аторвастатина, может быть очищена путем суспендирования в среде раствора, содержащего приблизительно 96% этилового спирта и приблизительно 4% воды, при повышенной температуре, предпочтительно при температуре дефлегмации. Обычно же извлечение полукальциевой соли возможно при загрязнении дефторированной формой полукальциевой соли аторвастатина менее 0,07% и загрязнении транс-изомером полукальциевой соли аторвастатина менее 0,6%.
Кроме того, полиморфная модификация Форма VIII может быть получена путем суспендирования полукальциевой соли аторвастатина в среде определенных смесей первичного бутилового спирта с водой и этилового спирта с водой в течение периода времени, достаточного для превращения полукальциевой соли аторвастатина в полиморфную модификацию Форма VIII. Используемые в этих способах смеси первичного бутилового спирта с водой должны содержать первичный бутиловый спирт в количестве приблизительно 20% по объему, при этом суспендирование осуществляется при повышенной температуре, предпочтительно при температуре дефлегмации.
Полукальциевая соль аторвастатина полиморфной модификации Форма IX характеризуется диаграммой порошковой рентгеновской дифракции, показанной на фиг.5, которая имеет пиковые значения при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 4,7, 5,2, 5,7, 7,0, 7,9, 9,4, 10,2, 12,0, 17,0, 17,4, 18,2, 19,1, 19,9, 21,4, 22,5, 23,5, 24,8 (широкий пик), 26,1, 28,7, 30,0. Наиболее характеристические пики полиморфной модификации Форма IX наблюдаются при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 6,9, 17,0, 17,4, 18,2, 18,6, 19,1, 19,9, 21,4, 22,5 и 23,5. Содержание воды в полукальциевой соли аторвастатина полиморфной модификации Форма IX может достигать 7%. Полиморфная модификация Форма IX может существовать также в форме сольвата с бутиловым спиртом, содержание бутилового спирта в котором достигает приблизительно 5%.
Полиморфная модификация Форма IX полукальциевой соли аторвастатина может быть легко отличена от других полиморфных модификаций этого вещества по характеристическим острым пикам при следующих значениях угла "два тэта" (в градусах): 18,6, 19,1, 19,9, 21,4, 22,5, 23,5. Для сравнения: согласно информации, содержащейся в патенте США №5.969.156, полиморфная модификация Форма I имеет острые пики при следующих значениях угла "два тэта" (в градусах): 21,6, 22,7, 23,3 и 23,7, полиморфная модификация Форма IV в этой области имеет острые пики при значениях угла "два тэта" 18,4° и 19,6°, а полиморфная модификация Форма II имеет два главных пика при значениях угла "два тэта" 17,0 и 20,5°. Полиморфная модификация Форма III имеет в этой области пики при следующих значениях угла "два тэта" (в градусах): 17,7, 18,3, 18,9, 20,0 и 20,3. Следует заметить также, что на диаграмме порошковой рентгеновской дифракции полиморфной модификации Форма IX, как и на диаграмме порошковой рентгеновской дифракции полиморфной модификации Форма VIII, наблюдается острый хорошо различимый пик средней интенсивности при значении угла "два тэта" 7,0°.
Для определения кристаллической системы и размеров элементарной ячейки кристалла полукальциевая соль аторвастатина полиморфной модификации Форма IX была подвергнута анализу по методу синхротронной порошковой рентгеновской дифракции. В результате анализа было установлено, что полиморфная модификация Форма IX имеет моноклинальную элементарную ячейку со следующими размерами кристаллической решетки: а=18,75-18,85Å, b=5,525-5,54Å, с=30,9-31,15Å, а угол β между осями "а" и "с" составляет 96,5-97,5°.
В помещенной ниже таблице 2 приведены d-интервалы некоторых из более заметных пиков дифрактограммы, приведенной на фиг.7, которая получена с помощью синхротронного источника рентгеновских лучей, а также значения угла 2θ ("два тэта"), при которых пики имели бы место в случае использования CuKα-излучения.
По причине естественного различия в свойствах независимых образцов и погрешностей измерения пиковые значения могут отклоняться от указанных выше в таблице 2 на 0,5% значения d-интервала. Если материал подвергается измельчению, например микронизации, то возможны более значительные отклонения.
Полукальциевая соль аторвастатина полиморфной модификации Форма IX дает спектр ядерно-магнитного резонанса 13С в твердой фазе, показанный на фиг.8. Полиморфная модификация Форма IX характеризуется следующими значениями химических сдвигов при ядерно-магнитном резонансе 13С в твердой фазе (в миллионных долях): 18,0, 20,4, 24,9, 26,1, 40,4, 46,4, 71,0, 73,4, 114,3, 116,0, 119,5, 120,2, 121,7, 122,8, 126,7, 128,6, 129,4, 134,3, 135,1, 136,8, 138,3, 139,4, 159,9, 166,3, 178,4, 186,6. Полиморфная модификация Форма IX при исследовании по методу ядерно-магнитного резонанса 13С в твердой фазе характеризуется следующими разностями химических сдвигов между резонансом с самым низким (в миллионных долях) значением химического сдвига и другими резонансами (в миллионных долях): 2,4, 6,9, 8,1, 22,4, 28,4, 53,0, 55,4, 96,3, 98,0, 101,5, 102,2, 103,7, 104,8, 108,7, 110,6, 111,4, 116,3, 117,1, 118,8, 120,3, 121,4, 141,9, 148,3, 160,4 и 168,6. Характеристические части дифракционной диаграммы обнаруживаются при значениях химического сдвига в диапазоне от 24 миллионных долей до 26 миллионных долей (алифатический диапазон), в диапазоне от 119 миллионных долей до 140 миллионных долей (ароматический диапазон) и в других областях. Указанные выше для полиморфной модификации Форма IX значения химических сдвигов получены путем усреднения значений, полученных от спектров двух образцов полукальциевой соли аторвастатина полиморфной модификации Форма IX. Погрешность, с которой определены значения химического сдвига, не превышает ±0,1 миллионной доли.
Для получения полукальциевой соли аторвастатина полиморфной модификации Форма IX могут быть применены способы, описываемые ниже. При этом следует заметить, что эта полиморфная модификация может быть получена также путем эмпирического развития и очевидной модификации этих способов.
Полукальциевая соль аторвастатина полиморфной модификации Форма IX может быть получена путем суспендирования полукальциевой соли аторвастатина в среде бутилового спирта и выделения полукальциевой соли аторвастатина полиморфной модификации Форма IX путем, например, фильтрования или сцеживания бутилового спирта, предпочтительно путем фильтрования. Предпочтительный температурный диапазон, в котором выполняется суспендирование, составляет от 78°С до температуры дефлегмации растворителя. Процент извлеченной из суспензии полукальциевой соли аторвастатина может быть увеличен при добавлении к суспензии перед выделением полукальциевой соли аторвастатина полиморфной модификации Форма IX антирастворителя. К предпочтительным антирастворителям, которые могут использованы для этой цели, относятся изопропиловый спирт и н-гексан. В качестве исходного материала для получения полиморфной модификации Форма IX по этому способу могут быть взяты аморфная полукальциевая соль аторвастатина или другие полиморфные модификации полукальциевой соли аторвастатина, предпочтительно полиморфные модификации Форма I или Форма V, а также их смеси.
Полиморфная модификация Форма IX может быть получена также путем суспендирования полиморфной модификации Форма VIII в среде этилового спирта, предпочтительно в среде безводного этилового спирта, при комнатной температуре в течение достаточного для превращения полиморфной модификации Форма VIII в полиморфную модификацию Форма IX периода времени, который может составлять от нескольких часов до 24 часов, обычно же составляет приблизительно 16 часов. После этого полиморфную модификацию Форма IX выделяют из суспензии. Кроме того, полиморфная модификация Форма IX может быть получена путем выдерживания полиморфной модификации Форма VIII в условиях влажной атмосферы.
Кроме того, полиморфная модификация Форма IX может быть получена путем суспендирования полукальциевой соли аторвастатина полиморфной модификации Форма V в среде смеси, одним компонентом которой является первичный бутиловый спирт, а другим - или этиловый спирт, или вода, при температуре дефлегмации в течение достаточного для превращения полиморфной модификации Форма V в полиморфную модификацию Форма IX периода времени и последующего извлечения полиморфной модификации Форма IX из суспензии. В предпочтительных вариантах осуществления рассматриваемого способа содержание каждого из компонентов смеси, в среде которой осуществляется суспендирование, составляет приблизительно 50% по объему.
Полукальциевая соль аторвастатина полиморфной модификации Форма Х характеризуется диаграммой порошковой рентгеновской дифракции, показанной на фиг.7, которая имеет пиковые значения при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 4,8, 5,3, 5,9, 9,6, 10,3, 11,5, 12,0, двойной пик при 16,1 и 16,3, 16,9, 17,4, 18,2, 19,2, 19,4, 20,0, 20,8, 21,6, 22,0, 22,8, 23,6, 24,6, 25,0, 25,5, 26,2, 26,8, 27,4, 28,0, 30,3. Наиболее характеристическими являются два пика, наблюдающиеся при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 20,0 и 20,8, и другие пики при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 19,1, 19,4, 22,8, 23,6, 25,0, 28,0 и 30,3. Содержание этилового спирта в полукальциевой соли аторвастатина полиморфной модификации Форма Х может достигать 2%, содержание воды может достигать 4%.
Полиморфная модификация Форма Х отличается от полиморфной модификации Форма IV наличием характеристических пиковых значений при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 7,0, 19,9, 20,7, 24,1, 25,0, 28,0 и 30,3. Эти характеристики легко отличимы от характеристик ранее описанных полиморфных модификаций Форма I-Форма IV в этой области диаграммы порошковой рентгеновской дифракции.
Для определения кристаллической системы и размеров элементарной ячейки кристалла полукальциевая соль аторвастатина полиморфной модификации Форма Х была подвергнута анализу по методу синхротронной порошковой рентгеновской дифракции. В результате анализа было установлено, что полиморфная модификация Форма Х имеет моноклинальную элементарную ячейку со следующими размерами кристаллической решетки: а=18,55-18,65Å, b=5,52-5,53Å, с=30,7-30,85Å, а угол β между осями "а" и "с" составляет 95,7-96,7°.
В помещенной ниже таблице 3 приведены d-интервалы некоторых из более заметных пиков дифрактограммы, приведенной на фиг.10, которая получена с помощью синхротронного источника рентгеновских лучей, а также значения угла 2θ ("два тэта"), при которых пики имели бы место в случае использования CuKα-излучения.
По причине естественного различия в свойствах независимых образцов и погрешностей измерения пиковые значения могут отклоняться от указанных выше в таблице 2 на 0,5% значения d-интервала. Если материал подвергается измельчению, например микронизации, то возможны более значительные отклонения.
Полукальциевая соль аторвастатина полиморфной модификации Форма Х дает спектр ядерно-магнитного резонанса 13С в твердой фазе, показанный на фиг.11. Полиморфная модификация Форма Х характеризуется следующими значениями химических сдвигов при ядерно-магнитном резонансе 13С в твердой фазе (в миллионных долях): 17,7, 18,7, 19,6, 20,6, 24,9, 43,4, 63,1, 66,2, 67,5, 71,1, 115,9, 119,5, 122,4, 126,7, 128,9, 134,5, 138,0, 159,4, 166,2, 179,3, 181,1, 184,3, 186,1. Полиморфная модификация Форма X при исследовании по методу ядерно-магнитного резонанса 13С в твердой фазе характеризуется следующими разностями химических сдвигов между резонансом с самым низким (в миллионных долях) значением химического сдвига и другими резонансами (в миллионных долях): 1,0, 1,9, 2,9, 7,2, 25,7, 45,4, 48,5, 49,8, 53,4, 98,2, 101,8, 104,7, 109,0, 111,2, 116,8, 120,3, 141,7, 148,5, 161,6, 163,4, 166,6, 168,4. Характеристические части дифракционной диаграммы обнаруживаются при значениях химического сдвига в диапазоне от 24 миллионных долей до 26 миллионных долей (алифатический диапазон), в диапазоне от 119 миллионных долей до 140 миллионных долей (ароматический диапазон) и в других областях. Указанные выше для полиморфной модификации Форма Х значения химических сдвигов получены путем усреднения значений, полученных от спектров трех образцов полукальциевой соли аторвастатина полиморфной модификации Форма X. Погрешность, с которой определены значения химического сдвига, не превышает ±0,1 миллионной доли, за исключением карбонилового пика при значении химического сдвига 179,3 миллионной доли, у которого флуктуация составляет ±0,4 миллионной доли.
Полукальциевая соль аторвастатина полиморфной модификации Форма Х может быть получена путем обработки других полиморфных модификаций полукальциевой соли аторвастатина, предпочтительно полиморфных модификаций Форма V или Форма I, или их смесей, или же аморфной полукальциевой соли аторвастатина с помощью смеси этилового спирта и воды предпочтительно в соотношении 5:1, при повышенной температуре, предпочтительно при температуре дефлегмации, в течение периода времени от получаса до нескольких часов, предпочтительно в течение приблизительно 1 часа. Исходный материал может добавляться к смеси этилового спирта и воды при комнатной температуре, после чего суспензию подвергают постепенному нагреванию до температуры дефлегмации. В альтернативном варианте осуществления рассматриваемого способа исходная форма полукальциевой соли аторвастатина может добавляться к смеси этилового спирта и воды при дефлегмации. В любом случае должно наблюдаться растворение полукальциевой соли аторвастатина в смеси этилового спирта и воды и затем ее повторное осаждение в виде полиморфной модификации Форма X. В предпочтительных вариантах осуществления рассматриваемого способа соотношение полукальциевой соли аторвастатина и смеси этилового спирта и воды составляет от 1 г соли на 16 мл смеси до 1 г соли на 25 мл смеси, в более предпочтительных вариантах от 1 г соли на 16 мл смеси до 1 г соли на 21 мл смеси, а в наиболее предпочтительном варианте 1 г соли на 16 мл смеси. Полученная полукальциевая соль аторвастатина полиморфной модификации Форма Х может быть отделена путем фильтрования сразу после охлаждения суспензии до комнатной температуры или же перед отделением полукальциевой соли аторвастатина полиморфной модификации Форма Х суспензия может быть подвергнута перемешиванию в течение периода времени от приблизительно 1 часа до приблизительно 20 часов, предпочтительно от приблизительно 3 часов до приблизительно 16 часов.
Полукальциевая соль аторвастатина полиморфной модификации Форма XI характеризуется диаграммой порошковой рентгеновской дифракции, показанной на фиг.9, которая имеет пиковые значения при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 3,2, 3,7, 5,1, 6,3, 7,8, 8,6, 9,8, 11,2, 11,8, 12,4, 15,4, 18,7, 19,9, 20,5, 24,0.
Полукальциевая соль аторвастатина полиморфной модификации Форма XI может быть получена путем суспендирования полукальциевой соли аторвастатина полиморфной модификации Форма V в среде метилэтилкетона при комнатной температуре в течение периода времени, достаточного для превращения полиморфной модификации Форма V в полиморфную модификацию Форма XI.
Кроме того, полукальциевая соль аторвастатина полиморфной модификации Форма XI может быть получена путем создания геля, содержащего полукальциевую соль аторвастатина в среде изопропилового спирта, и последующего высушивания этого геля. Наилучший способ приготовления такого геля состоит в насыщении изопропилового спирта полукальциевой солью аторвастатина при температуре дефлегмации и последующем охлаждении раствора до комнатной температуры. Для образования геля может понадобится интенсивное перемешивание раствора в течение 20 часов или более. По достижении гелеобразного состояния раствор оказывает явно возросшее сопротивление перемешиванию и не вытекает сплошной струей. Гель остается текучим в том смысле, что он поддается перемешиванию при приложении достаточной силы, а не разрывается под действием этой силы.
Полукальциевая соль аторвастатина полиморфной модификации Форма XII характеризуется диаграммой порошковой рентгеновской дифракции, которая имеет пиковые значения при следующих значениях угла "два тэта" (в градусах, с допуском ±0,2 градуса): 2,7, 8,0, 11,8, 18,2, 19,0, 19,8, 20,7, а также ореол, наличие которого указывает на присутствие аморфного материала. Типичные диаграммы порошковой рентгеновской дифракции полукальциевой соли аторвастатина полиморфной модификации Форма XII показаны на фиг.10.
Полукальциевая соль аторвастатина полиморфной модификации Форма XII может быть получена непосредственно из следующего соединения:
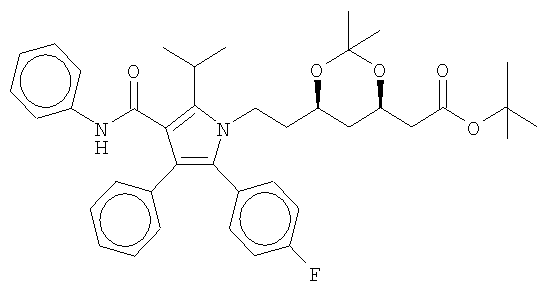
системное химическое наименование которого: сложный эфир [R-(R*,R*)]-2-(4-фторфенил)-β,δ-диоксан-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты. Далее это вещество будет для краткости называться "сложный эфир пирролацетонида". Процесс получения полукальциевой соли аторвастатина полиморфной модификации Форма XII начинается с того, что для сложного эфира пирролацетонида создаются условия, при которых обеспечивается отщепление ацетонидной и трет-бутиловой сложноэфирных групп. В предпочтительных вариантах осуществления рассматриваемого способа для создания таких условий используется водный раствор хлористоводородной кислоты, предпочтительно 1,5%-ный водный раствор хлористоводородной кислоты. Затем раствор аторвастатина, который может быть взят как в форме свободной кислоты, так и в форме лактона или же в виде смеси того и другого, подвергается обработке с помощью гидроокиси кальция, которую в предпочтительных вариантах осуществления рассматриваемого способа берут с некоторым избытком, предпочтительно в количестве приблизительно 1,5 эквивалента по отношению к сложному эфиру пирролацетонида. После связывания аторвастатина с растворенным кальцием добавленной гидроокиси избыток гидроокиси кальция может быть отделен с помощью фильтрования. Одним из важных признаков рассматриваемого способа является дальнейшее обращение с отфильтрованным материалом. К реакционной смеси при слегка повышенной температуре, предпочтительно при температуре 65°С, медленно добавляют воду до тех пор, пока не произойдет осаждение полукальциевой соли аторвастатина. По достижении этого состояния температуру повышают до возвращения раствора в светлое состояние. Затем смеси дают остынуть, в результате чего происходит осаждение полукальциевой соли аторвастатина. Выделенный осадок представляет собой полукальциевую соль аторвастатина полиморфной модификации Форма XII.
Настоящим изобретением предлагаются также новые способы получения известных полиморфных модификаций полукальциевой соли аторвастатина.
Полукальциевая соль аторвастатина полиморфной модификации Форма I может быть получена путем обработки полукальциевой соли аторвастатина водой при температуре от комнатной до 100°С в течение периода времени от нескольких часов до приблизительно 25 часов, предпочтительно в течение 16 часов. В предпочтительных вариантах осуществления рассматриваемого способа в качестве исходного материала берут полукальциевую соль аторвастатина полиморфных модификаций Форма V, Форма VII, Форма VIII, Форма IX или Форма X.
Кроме того, полукальциевая соль аторвастатина полиморфной модификации Форма I может быть получена путем обработки полукальциевой соли аторвастатина ультразвуком в среде этилового спирта, предпочтительно в среде безводного этилового спирта, или воды при температуре от комнатной до температуры дефлегмации растворителя в течение периода времени в несколько минут, предпочтительно от 1 до 3 минут. В предпочтительных вариантах осуществления рассматриваемого способа в качестве исходного материала берут полукальциевую соль аторвастатина полиморфной модификации Форма VII, хотя могут быть использованы и другие полиморфные модификации.
Полукальциевая соль аторвастатина полиморфной модификации Форма II может быть получена непосредственно из сложного эфира [R-(R*,R*)]-2-(4-фторфенил)-β,δ-диоксан-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты (сложного эфира пирролацетонида) по способу, который будет описан ниже в примере 31.
Полукальциевая соль аторвастатина полиморфной модификации Форма IV может быть получена путем суспендирования полукальциевой соли полиморфной модификации Форма I или Форма V в среде первичного бутилового спирта в течение периода времени, достаточного для завершения превращения полиморфной модификации Форма I или Форма V в полиморфную модификацию Форма IV, и последующего выделения полиморфной модификации Форма IV из смеси. Для завершения превращения может потребоваться длительное время, продолжительность которого зависит от температуры и других факторов. При комнатной температуре для завершения превращения обычно требуется от 24 до 72 часов.
Кроме того, полукальциевая соль аторвастатина полиморфной модификации Форма IV может быть получена путем суспендирования полукальциевой соли полиморфной модификации Форма V в среде смеси этилового спирта и воды (EtOH:Н2О) при температуре 50°С в течение периода времени, достаточного для превращения полиморфной модификации Форма V в полиморфную модификацию Форма IV, и последующего выделения полиморфной модификации Форма IV из суспензии. В предпочтительных вариантах осуществления рассматриваемого способа содержание воды в смеси этилового спирта и воды составляет приблизительно 15%.
Кроме того, полукальциевая соль аторвастатина полиморфной модификации Форма IV может быть получена путем суспендирования полукальциевой соли полиморфной модификации Форма V в среде метилового спирта в течение периода времени, достаточного для превращения полиморфной модификации Форма V в полиморфную модификацию Форма IV. Скорость превращения проявляет сильную зависимость от температуры, и при обычных лабораторных условиях для завершения превращения может потребоваться от приблизительно 1 часа до приблизительно 25 часов. При комнатной температуре для завершения превращения требуется приблизительно 16 часов. Превращение может осуществляться при повышенной температуре вплоть до температуры дефлегмации растворителя.
Полукальциевая соль аторвастатина полиморфной модификации Форма V может быть получена из сложного эфира пирролацетонида по способу, описанному выше для полиморфной модификации Форма XII. Полукальциевая соль аторвастатина полиморфной модификации Форма V может быть получена путем высушивания полукальциевой соли аторвастатина полиморфной модификации Форма XII при температуре приблизительно 65°С в течение приблизительно 24 часов. Полученная по такому способу полукальциевая соль аторвастатина полиморфной модификации Форма V имеет высокую степень чистоты. Но при этом она может быть подвергнута дополнительной очистке путем суспендирования в среде смеси, содержащей приблизительно 10% воды и приблизительно 90% этилового спирта.
Аморфная полукальциевая соль аторвастатина может быть получена путем обработки любой полиморфной модификации полукальциевой соли аторвастатина с помощью ацетона при температуре от комнатной до температуры дефлегмации в течение периода времени от нескольких часов до 25 часов, предпочтительно в течение 16 часов. В предпочтительных вариантах осуществления рассматриваемого способа в качестве исходного материала берут полукальциевую соль аторвастатина полиморфной модификации Форма V.
Кроме того, аморфная полукальциевая соль аторвастатина может быть получена путем обработки любой полиморфной модификации полукальциевой соли аторвастатина ультразвуком в среде ацетонитрила при температуре от комнатной до температуры дефлегмации ацетонитрила. Для превращения исходного материала в аморфную полукальциевую соль аторвастатина достаточно обработки ультразвуком в течение нескольких минут, предпочтительно от 1 до 3 минут. В предпочтительных вариантах осуществления рассматриваемого способа в качестве исходного материала берут полукальциевую соль аторвастатина полиморфных модификаций Форма VII или Форма I.
Кроме того, аморфная полукальциевая соль аторвастатина может быть получена путем перемалывания полукальциевой соли аторвастатина любой полиморфной модификации в шаровой мельнице.
Настоящим изобретением предлагаются также фармацевтические композиции и лекарственные формы, содержащие вышеописанные новооткрытые полиморфные модификации полукальциевой соли аторвастатина.
Фармацевтические композиции по предлагаемому изобретению включают порошки, гранулы, агрегации и другие твердые лекарственные формы, содержащие полукальциевую соль аторвастатина в новооткрытых полиморфных модификациях: Форма VI, Форма VII, Форма VIII, Форма IX, Форма Х, Форма XI и Форма XII. Кроме того, рассматриваемые как предметы предлагаемого изобретения твердые фармацевтические композиции, содержащие новооткрытые полиморфные модификации Форма VI, Форма VII, Форма VIII, Форма IX, Форма X, Форма XI и Форма XII, могут дополнительно содержать разбавляющие вещества, в качестве которых могут использоваться такие производные целлюлозы, как порошкообразная целлюлоза, микрокристаллическая целлюлоза, соли метилцеллюлозы, этилцеллюлозы, гидроксиэтилцеллюлозы, гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозы и другие замещенные и незамещенные целлюлозы, крахмал, предварительно желатинизированный крахмал, неорганические разбавляющие вещества, такие как углекислый кальций и пирофосфорнокислый кальций, а также другие разбавляющие вещества, известные в фармацевтической промышленности. Кроме того, для использования в фармацевтических композициях по предлагаемому изобретению в качестве разбавляющих веществ могут быть использованы воски, сахара и многоатомные спирты, такие как маннит и сорбит, а также полимеры и сополимеры акрилатов, пектин, декстрин и желатин.
Предлагаемым изобретением предусматривается также использование в фармацевтических композициях других инертных наполнителей, таких как связующие вещества, в качестве которых могут быть использованы аравийская камедь, предварительно желатинизированный крахмал, альгинат натрия, глюкоза и другие связующие вещества, используемые в процессах получения таблеток путем влажного и сухого гранулирования или непосредственного прессования. В число инертных наполнителей, которые могут присутствовать в твердых фармацевтических композициях, содержащих полукальциевую соль аторвастатина в новооткрытых полиморфных модификациях Форма VI, Форма VII, Форма VIII, Форма IX, Форма X, Форма XI и Форма XII, входят также разрыхлители, в качестве которых могут быть использованы такие вещества, как крахмалгликолевокислый натрий, кросповидон, низкозамещенная гидроксипропилцеллюлоза и другие. Кроме того, в число подходящих для использования в фармацевтических композициях по предлагаемому изобретению инертных наполнителей входят лубриканты для покрытия таблеток, в качестве которых могут быть использованы такие вещества, как стеарат магния и кальция и стеарилфумарат натрия, вкусовые и ароматизирующие вещества, подсластители, консерванты, фармацевтически приемлемые красители и глиданты, такие как двуокись кремния.
Лекарственные формы, в которых могут использоваться фармацевтические композиции по предлагаемому изобретению, включают лекарственные формы, которые могут вводиться в организм пациента перорально, трансбуккально, ректально, парентерально (включая чрескожное, внутримышечное и внутривенное введение), в виде ингаляций и в виде глазных капель. Хотя наиболее приемлемый способ приема лекарственного средства в каждом конкретном случае зависит от природы заболевания, подлежащего лечению, и его остроты, тем не менее предлагаемым изобретением предполагается, что наиболее предпочтительным является пероральный прием. Для удобства лекарственные формы могут быть представлены в виде единичных доз, и для их получения могут применяться способы, хорошо известные в фармацевтической промышленности.
Лекарственные формы, в которых могут использоваться фармацевтические композиции по предлагаемому изобретению, включают твердые лекарственные формы, такие как таблетки, порошки, капсулы, суппозитории, сашеты, лепешки и пастилки, а также жидкие лекарственные формы, такие как суспензии и эликсиры. Хотя настоящее описание по замыслу не является ограничивающим, следует заметить, что предлагаемое изобретение по замыслу не относится к истинным растворам полукальциевой соли, в которых свойства, отмеченные для твердых полиморфных модификаций полукальциевой соли аторвастатина, исчезают. Тем не менее использование новооткрытых полиморфных модификаций полукальциевой соли аторвастатина для приготовления истинных растворов (например, для доставки, в дополнение к аторвастатину, сольвата в такой раствор в определенной пропорции) рассматривается как находящееся в объеме предлагаемого изобретения.
Лекарственные формы в виде капсул содержат, разумеется, твердые фармацевтические композиции, заключенные в капсулы, которые могут быть выполнены из желатина или другого обычно используемого капсулирующего материала. Таблетки и частицы порошка могут иметь покрытие. Покрытие таблеток и частиц порошка может быть энтеросолюбильным. Для энтеросолюбильного покрытия порошковых лекарственных форм могут быть использованы такие вещества, как ацетат целлюлозы и фталевой кислоты, фталат гидроксипропилметилцеллюлозы, фталат поливинилового спирта, карбоксиметилэтилцеллюлоза, сополимер стирола и малеиновой кислоты, сополимер метакриловой кислоты и метилметакрилата и другие подобные материалы, а при желании они могут быть использованы вместе с подходящими пластификаторами и/или разрыхлителями. Таблетка, снабженная покрытием, может иметь покрытие снаружи или же таблетка может состоять из частиц порошка или гранул, покрытых энтеросолюбильным покрытием.
В предпочтительных вариантах осуществления предлагаемого изобретения единичные дозы фармацевтических композиции обычно содержат от 0,5 до 100 мг полукальциевой соли аторвастатина новооткрытых полиморфных модификаций Форма VI, Форма VII, Форма VIII, Форма IX, Форма X, Форма XI или Форма XII или их смесей друг с другом или с другими полиморфными модификациями полукальциевой соли аторвастатина. Чаще всего общая масса содержащихся в единичной дозе полиморфных модификаций полукальциевой соли аторвастатина находится в диапазоне от 2,5 до 80 мг.
Выше были описаны различные предметы предлагаемого изобретения, а далее, в иллюстративных целях, рассматриваются конкретные примеры осуществления предлагаемого изобретения. Рассматриваемые ниже примеры ни в коем случае не ограничивают объем предлагаемого изобретения.
ПРИМЕРЫ
Общая часть
Безводный этиловый спирт (содержание воды менее 0,2%) был приобретен у компании Биолаб (Biolab®). Прочие реагенты удовлетворяли требованиям, предъявляемым к лабораторным реагентам.
Перемалывание осуществлялось в центробежной шаровой мельнице марки S-100 производства компании Ретч (Retsch), снабженной камерой для перемалывания объемом 250 мл, выполненной из нержавеющей стали, и выполненными из нержавеющей стали использующимися в качестве перемалывающего средства 27 шариками диаметром 10 мм.
Получение полукальциевой соли аторвастатина полиморфной модификации Форма VI
Пример 1
Полукальциевая соль аторвастатина полиморфной модификации Форма I, взятая в количестве 1 г, была растворена в 9 мл ацетона при комнатной температуре и подвергалась перемешиванию в течение 2,5 часа. Затем, для обеспечения осаждения соли, к полученному раствору была добавлена вода в объеме 8,5 мл, и смесь подвергалась перемешиванию еще в течение 2,5 часа. После этого полученный твердый осадок белого цвета был отделен с помощью фильтрования и подвергался высушиванию при температуре 50°С в течение 5 часов, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма VI в количестве 0,88 г (выход продукта 88%).
Получение полукальциевой соли аторвастатина полиморфной модификации Форма VII
Пример 2
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 1,00 г, подвергалась перемешиванию в среде безводного этилового спирта (EtOH), взятого в объеме 400 мл, при комнатной температуре в течение 16 часов. Полученный твердый осадок был собран с помощью фильтрования и подвергался высушиванию при температуре 65°С в течение 24 часов, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма VII в количестве 400 мг (выход продукта 40%).
Пример 3
Полукальциевая соль аторвастатина полиморфной модификации Форма I, взятая в количестве 75 мг, подвергалась перемешиванию в среде безводного этилового спирта (EtOH), взятого в объеме 30 мл, при комнатной температуре в течение 16 часов. Полученный твердый осадок был собран с помощью фильтрования и подвергался высушиванию при температуре 65°С в течение 24 часов, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма VII в количестве 0,60 г (выход продукта 80%).
Получение полукальциевой соли аторвастатина полиморфной модификации Форма VIII
Пример 4
В колбу, снабженную магнитной мешалкой, был помещен сложный эфир [R-(R*,R*)]-2-(4-фторфенил)-(β,δ-диоксан-5-((1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты, взятый в количестве 1,0 г (1,59×10-3 моль), и подвергнут суспендированию в среде 90%-ного раствора уксусной кислоты, взятого в объеме 10 мл. Реакционная смесь была нагрета до температуры 50°С, при которой выдерживалась в течение 3 часов, после чего подвергалась перемешиванию при комнатной температуре до тех пор, пока с помощью жидкостной хроматографии высокого давления не было определено, что реакция завершена. После этого растворитель был выпарен, а микроскопические остатки уксусной кислоты были удалены с помощью азеотропной перегонки с толуолом (трижды по 100 мл толуола), в результате чего был получен маслянистый продукт с некоторым содержанием толуола. Полученный маслянистый продукт был растворен в смеси, содержащей 10 мл этилового спирта (EtOH) и 2 мл воды. Затем к реакционной смеси были добавлены гидроокись кальция (Ca(OH)2) в количестве 5,5 эквивалента (8,4×10-3 моль, что равно 622 мг) и тетрабутиламмонийбромид в количестве 5% (0,05 г). Полученная реакционная смесь была нагрета до температуры 50°С, при которой выдерживалась в течение 5 часов, пока с помощью жидкостной хроматографии высокого давления не было определено, что реакция завершена. Затем для удаления избыточной гидроокиси кальция (Са(ОН)2) было выполнено горячее фильтрование реакционной смеси под вакуумом. После этого реакционная смесь была охлаждена до комнатной температуры. Затем к этому раствору была добавлена вода в объеме 50 мл. Полученный осадок белого цвета подвергался перемешиванию при комнатной температуре до следующего утра, затем отделен с помощью фильтрования, после чего был подвергнут высушиванию при температуре 65°С в течение 18 часов, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма VIII в количестве 145 мг (выход продукта 16%).
Пример 5
Полукальциевая соль аторвастатина полиморфной модификации Форма I, взятая в количестве 1 г, подвергалась суспендированию в среде безводного этилового спирта (EtOH), взятого в объеме 80 мл, в течение 24 часов при дефлегмации растворителя. Полученный твердый осадок белого цвета был отделен с помощью фильтрования, после чего был подвергнут высушиванию при температуре 65°С в течение 24 часов, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма VIII в количестве 0,85 г (выход продукта 85%).
Пример 6
Полукальциевая соль аторвастатина полиморфной модификации Форма I, взятая в количестве 1 г, была помещена в среду кипящего безводного этилового спирта (EtOH), взятого в объеме 40 мл. Соль сначала перешла в раствор, а затем произошло ее возвращение в осадок. К полученной реакционной смеси был добавлен метиловый спирт (МеОН) в объеме 20 мл. Полученный твердый осадок белого цвета был отделен с помощью фильтрования, после чего был подвергнут высушиванию при температуре 50°С в течение 20 часов в вакуумной печи, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма VIII в количестве 188 мг (выход продукта 19%).
Пример 7
Суспензия полукальциевой соли аторвастатина полиморфной модификации Форма V, взятой в количестве 1,0 г, в среде смеси, состоящей из первичного бутилового спирта, взятого в объеме 4 мл, и воды, взятой в объеме 16 мл, была подвергнута нагреванию до температуры дефлегмации, при которой выдерживалась в течение 1 часа. Затем реакционная смесь была охлаждена до комнатной температуры и подвергалась перемешиванию при этой температуре в течение 16 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего был подвергнут высушиванию при температуре 50°С в течение 16 часов в вакуумной печи, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма VIII в количестве 0,9 г (выход продукта 91%).
Пример 8
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 5 г, была помещена в среду кипящего 96%-ного водного раствора этилового спирта, взятого в объеме 150 мл. После этого реакционная смесь подвергалась дефлегмации в течение 2,5 часа. Затем реакционная смесь в течение 1,5 часа была охлаждена до температуры 20°С, после чего подвергалась перемешиванию в течение 16 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего был промыт с помощью 96%-ного водного раствора этилового спирта (дважды по 25 мл спирта) и подвергнут высушиванию при температуре 65°С в течение 20 часов, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма VIII в количестве 4,4 г (выход продукта 88%). Следует заметить, что при таком способе имеет место химическая очистка, поэтому он пригоден также для очистки.
Пример 9
Полукальциевая соль аторвастатина полиморфной модификации Форма V, содержание дефторированного аторвастатина в которой составляло 0,12%, взятая в количестве 5 г, была помещена в среду кипящего 96%-ного водного раствора этилового спирта, взятого в объеме 150 мл. После этого реакционная смесь подвергалась дефлегмации в течение 2,5 часа. Затем реакционная смесь в течение 1,5 часа была охлаждена до температуры 20°С, после чего подвергалась перемешиванию в течение 16 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего был промыт с помощью 96%-ного водного раствора этилового спирта (дважды по 25 мл спирта) и подвергнут высушиванию при температуре 65°С в течение 20 часов, в результате чего была получена полукальциевая соль аторвастатина в количестве 4,4 г (выход продукта 88%), содержание дефторированного аторвастатина в которой составляло 0,06%. Полукальциевая соль аторвастатина, полученная по этому способу, принадлежала к полиморфной модификации Форма VIII.
Пример 10
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 5 г, была помещена в среду безводного этилового спирта (EtOH), взятого в объеме 35 мл, и полученная реакционная смесь подвергалась дефлегмации в течение 2,5 часа. Затем реакционная смесь была охлаждена до комнатной температуры, после чего подвергалась перемешиванию в течение 16 часов. Затем к реакционной смеси был добавлен безводный этиловый спирт в объеме 15 мл, полученная суспензия была профильтрована и полученный твердый отфильтрованный материал подвергнут высушиванию при температуре 65°С в течение 20 часов, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма VIII в количестве 4,7 г (выход продукта 94%).
Получение полукальциевой соли аторвастатина полиморфной модификации Форма IX
Пример 11
Полукальциевая соль аторвастатина полиморфной модификации Форма I, взятая в количестве 1 г, подвергалась суспендированию в среде первичного бутилового спирта, взятого в объеме 20 мл, при дефлегмации растворителя в течение 30 минут. Полученная реакционная смесь была охлаждена до комнатной температуры. Полученный твердый осадок белого цвета был отделен с помощью фильтрования, после чего повергался высушиванию под вакуумом в течение 20 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IX в количестве 0,94 г (выход продукта 94%). KF=0,9.
Пример 12
Полукальциевая соль аторвастатина полиморфной модификации Форма I, взятая в количестве 1 г, подвергалась суспендированию в среде первичного бутилового спирта, взятого в объеме 20 мл, при дефлегмации растворителя в течение 30 минут. Затем к полученной реакционной смеси для способствования дальнейшему осаждению был добавлен н-гексан в объеме 40 мл, после чего полученная реакционная смесь подвергалась перемешиванию в течение 2 часов при комнатной температуре. Полученный твердый осадок белого цвета был отделен с помощью фильтрования, после чего повергался высушиванию под вакуумом в течение 20 часов при температуре 50°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IX в количестве 0,96 г (выход продукта 96%).
Пример 13
Полукальциевая соль аторвастатина полиморфной модификации Форма I, взятая в количестве 1 г, подвергалась суспендированию в среде первичного бутилового спирта, взятого в объеме 20 мл, при дефлегмации растворителя в течение 30 минут. Затем к полученной реакционной смеси для способствования дальнейшему осаждению был добавлен изопропиловый спирт в объеме 40 мл, после чего полученная реакционная смесь подвергалась перемешиванию в течение 2 часов при комнатной температуре. Полученный твердый осадок белого цвета был отделен с помощью фильтрования, после чего повергался высушиванию под вакуумом в течение 20 часов при температуре 50°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IX в количестве 0,94 г (выход продукта 94%), содержание воды в которой, определенное с помощью анализа по методу Карла Фишера, составляло 0,9%.
Пример 14
Полукальциевая соль аторвастатина полиморфной модификации Форма VIII, взятая в количестве 800 мг, подвергалась перемешиванию в среде безводного этилового спирта (EtOH), взятого в количестве 320 мл, при комнатной температуре в течение 16 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IX в количестве 630 мг (выход продукта 79%).
Пример 15
Смесь полукальциевой соли аторвастатина полиморфной модификации Форма V, взятой в количестве 2,00 г, и первичного бутилового спирта, взятого в объеме 40 мл, подвергалась дефлегмации при температуре 118°С в течение получаса. Затем полученная реакционная смесь была охлаждена до комнатной температуры, после чего подвергалась перемешиванию в течение 3 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IX в количестве 1,83 г (выход продукта 92%).
Пример 16
Полукальциевая соль аторвастатина полиморфной модификации Форма VIII хранилась в условиях 100%-ной относительной влажности при комнатной температуре в течение девяти суток. С помощью анализа по методу порошковой рентгеновской дифракции полученный твердый продукт был идентифицирован как полукальциевая соль аторвастатина полиморфной модификации Форма IX.
Пример 17
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 1 г, была помещена в среду смеси первичного бутилового спирта (1-BuON), взятого в объеме 10 мл, и воды (Н2О), взятой в объеме 10 мл, и полученная реакционная смесь выдерживалась при температуре дефлегмации в течение 1 часа. Затем реакционная смесь была охлаждена до комнатной температуры, после чего подвергалась перемешиванию в течение 16 часов. После фильтрования реакционной смеси и высушивания полученного отфильтрованного материала в течение 24 часов при температуре 65°С была получена полукальциевая соль аторвастатина полиморфной модификации Форма IX в количестве 0,79 г (выход продукта 79%).
Пример 18
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 1 г, была помещена в среду смеси первичного бутилового спирта (1-BuON), взятого в объеме 10 мл, и этилового спирта (EtOH), взятого в объеме 10 мл, и полученная реакционная смесь выдерживалась при температуре дефлегмации в течение 1 часа. Затем реакционная смесь была охлаждена до комнатной температуры, после чего подвергалась перемешиванию в течение 16 часов. После фильтрования реакционной смеси и высушивания полученного отфильтрованного материала в течение 24 часов при температуре 65°С была получена полукальциевая соль аторвастатина полиморфной модификации Форма IX в количестве 0,98 г (выход продукта 98%).
Получение полукальциевой соли аторвастатина полиморфной модификации Форма Х
Пример 19
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 10,00 г, подвергалась суспендированию в среде смеси этилового спирта (EtOH), взятого в объеме 135 мл, и воды, взятой в объеме 24 мл, и полученная реакционная смесь выдерживалась при температуре дефлегмации в течение 1 часа. Затем реакционная смесь была охлаждена до комнатной температуры, после чего подвергалась перемешиванию в течение 16 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма Х в количестве 8,26 г (выход продукта 83%).
Пример 20
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 1,00 г, подвергалась суспендированию в среде смеси этилового спирта (EtOH), взятого в объеме 9 мл, и воды, взятой в объеме 1,6 мл, и полученная реакционная смесь выдерживалась при температуре дефлегмации в течение 1 часа. Затем реакционная смесь была охлаждена до комнатной температуры, после чего подвергалась перемешиванию в течение 3 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма Х в количестве 0,80 г (выход продукта 80%).
Получение полукальциевой соли аторвастатина полиморфной модификации Форма XI
Пример 21
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 1,00 г, подвергалась перемешиванию в среде метилэтилкетона, взятого в объеме 5 мл, при комнатной температуре в течение 24 часов. Полученный твердый осадок был отделен с помощью фильтрования, промыт метилэтилкетоном, взятым в объеме 2 мл, после чего повергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма XI в количестве 0,5 г (выход продукта 50%).
Пример 22
Суспензия полукальциевой соли аторвастатина полиморфной модификации Форма V, взятой в количестве 1,0 г, в среде изопропилового спирта, взятого в объеме 7 мл, выдерживалась при температуре дефлегмации в течение 1 часа. Затем реакционная смесь была охлаждена до комнатной температуры, после чего подвергалась перемешиванию в течение 20 часов. В результате был получен студенистый продукт. После добавления дополнительного количества изопропилового спирта (3 мл) полученный студенистый продукт был подвергнут фильтрованию, полученный отфильтрованный материал повергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма XI в количестве 0,8 г (выход продукта 80%).
Получение полукальциевой соли аторвастатина полиморфной модификации Форма XII
Пример 23
В реактор цилиндрической формы, снабженный дистиллятором (аппаратом для перегонки) и механической мешалкой, в среду смеси безводного этилового спирта, взятого в объеме 250 мл, и 1,5%-ного водного раствора хлористовородной кислоты, взятого в объеме 50 мл, для получения суспензии вводился сложный эфир [R-(R*,R*)]-2-(4-фторфенил)-β,δ-диоксан-5-((1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты (сложный эфир пирролацетонида), взятый в количестве 20 г (30,6 ммоль). Полученная реакционная смесь подвергалась нагреванию до температуры 40°С и выдерживалась при этой температуре в течение периода времени от 9 часов до 11 часов, при этом одновременно выполнялась непрерывная перегонка смеси этилового спирта, ацетона и воды в условиях пониженного давления (от 500 до 600 мбар). С периодичностью в 1 час осуществлялось добавление к реакционной смеси безводного этилового спирта в объеме от 35 до 40 мл. По истечении периода времени от 9 часов до 11 часов имело место уменьшение содержания сложного эфира пирролацетонида до уровня ниже 0,1% (определение содержания этого вещества осуществлялось с помощью жидкостной хроматографии высокого давления). Без дальнейшей обработки к реакционной смеси добавлялась гидроокись кальция (Са(ОН)2) в количестве 1,5 эквивалента (3,4 г). Затем реакционная смесь подвергалась нагреванию до температуры 70°С и выдерживалась при этой температуре в течение периода времени от 4 до 5 часов. После этого избыточная гидроокись кальция (Са(ОН)2) была удалена с помощью фильтрования. К горячему фильтрату (его температура составляла 65°С) в течение периода времени от s часа до 1 часа с помощью дозировочного насоса медленно добавлялась вода в количестве 350 мл, температура которой составляла 65°С. В процессе добавления воды происходило осаждение полукальциевой соли аторвастатина. По завершении добавления воды реакционная смесь подвергалась дефлегмации (при температуре 84°С) до получения прозрачного раствора. Затем реакционная смесь подвергалась охлаждению до температуры 20°С в течение 3 часов, после чего подвергалась перемешиванию при этой температуре в течение периода времени от 12 до 16 часов. После этого полученный твердый осадок отделялся с помощью фильтрования, в результате чего получалась, в виде влажного материала, полукальциевая соль аторвастатина полиморфной модификации Форма XII в количестве 45,0 г.
Получение полукальциевой соли аторвастатина известной полиморфной модификации Форма I
Пример 24
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 1,00 г, подвергалась перемешиванию в среде воды, взятой в объеме 400 мл, в течение 16 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма I в количестве 0,7 г (выход продукта 70%).
Пример 25
Смесь полукальциевой соли аторвастатина полиморфной модификации Форма VII, взятой в количестве 10,00 г, и воды, взятой в объеме 100 мл, подвергалась дефлегмации в течение 2 часов. Затем полученная реакционная смесь была охлаждена до комнатной температуры, после чего подвергалась перемешиванию в течение 1 часа. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма I в количестве 9,64 г (выход продукта 96%).
Пример 26
Полукальциевая соль аторвастатина полиморфной модификации Форма VIII, взятая в количестве 800 мг, подвергалась перемешиванию в среде воды, взятой в объеме 320 мл, при комнатной температуре в течение 16 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма I в количестве 350 мг (выход продукта 44%).
Пример 27
Полукальциевая соль аторвастатина полиморфной модификации Форма Х, взятая в количестве 1,0 г, подвергалась перемешиванию в среде воды, взятой в объеме 400 мл, при комнатной температуре в течение 24 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма I в количестве 720 мг (выход продукта 72%).
Пример 28
Полукальциевая соль аторвастатина полиморфной модификации Форма IX, взятая в количестве 750 мг, подвергалась перемешиванию в среде воды, взятой в объеме 300 мл, при комнатной температуре в течение 24 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего подвергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма I в количестве 420 мг (выход продукта 56%).
Пример 29
Полукальциевая соль аторвастатина полиморфной модификации Форма VII, взятая в количестве 1,00 г, подвергалась перемешиванию в среде безводного этилового спирта (EtOH), взятого в объеме 20 мл, при комнатной температуре. После этого полученная суспензия в течение периода времени 1,5 минуты была подвергнута ультразвуковой обработке (энергия = 235 кДж, амп. = 50%) для получения прозрачного раствора. Затем к реакционной системе была добавлена вода в объеме 14 мл, в результате чего произошло выпадение осадка, после чего суспензия была подвергнута повторной ультразвуковой обработке (энергия = 3,16 кДж, амп. = 50%), в результате которой произошло превращение суспензии в гель. Полученный гель повергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма I в количестве 0,50 г (выход продукта 50%).
Пример 30
Полукальциевая соль аторвастатина полиморфной модификации Форма VII, взятая в количестве 1,00 г, подвергалась перемешиванию в среде воды, взятой в объеме 200 мл, при комнатной температуре. После этого полученная суспензия в течение периода времени 2 минуты была подвергнута ультразвуковой обработке (энергия = 3,0 кДж, амп. = 50%), в результате которой произошло превращение суспензии в гель. Полученный гель повергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма I в количестве 0,92 г (выход продукта 92%).
Получение полукальциевой соли аторвастатина известной полиморфной модификации Форма II
Пример 31
В реактор цилиндрической формы, снабженный дистиллятором (аппаратом для перегонки) и механической мешалкой, в среду смеси метилового спирта, взятого в объеме 135 мл, и 10%-ного водного раствора хлористовородной кислоты, взятого в объеме 7,6 мл, для получения суспензии был введен сложный эфир [R-(R*,R*)]-2-(4-фторфенил)-β,δ-диоксан-5-((1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты (сложный эфир пирролацетонида), взятый в количестве 20 г (30,6 ммоль). Полученная реакционная смесь подвергалась нагреванию до температуры 35°С и выдерживалась при этой температуре в течение 3 часов, при этом одновременно выполнялась непрерывная перегонка смеси метилового спирта, ацетона и воды в условиях пониженного давления (820 мбар). С периодичностью в 1/2 часа осуществлялось добавление к реакционной смеси метилового спирта в объеме 35 мл. По истечении 3 часов имело место уменьшение содержания сложного эфира пирролацетонида до уровня ниже 0,1% (определение содержания этого вещества осуществлялось с помощью жидкостной хроматографии высокого давления). Без дальнейшей обработки к реакционной смеси были добавлены гидроокись кальция (Ca(OH)2) в количестве 1,5 эквивалента (3,4 г), вода в объеме 5 мл и метиловый спирт в объеме 45 мл. Затем реакционная смесь подвергалась нагреванию до температуры 70°С и выдерживалась при этой температуре в течение 2 часов. После этого избыточная гидроокись кальция (Са(ОН)2) была удалена с помощью фильтрования, и кек (осадок на фильтре) из гидроокиси кальция (Са(ОН)2) был промыт метиловым спиртом (дважды по 10 мл). К фильтрату в течение 3/4 часа с помощью дозировочного насоса медленно добавлялась вода в количестве 300 мл, температура которой составляла 65°С. В процессе добавления воды происходило осаждение полукальциевой соли аторвастатина. По завершении добавления воды реакционная смесь подвергалась дефлегмации (при температуре 78°С) в течение 1/2 часа. Затем реакционная смесь подвергалась охлаждению до температуры 20°С в течение 3 часов, после чего подвергалась перемешиванию при этой температуре в течение 20 часов. После этого полученный твердый осадок был отделен с помощью фильтрования и подвергнут высушиванию при температуре 65°С в течение 48 часов, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма II в количестве 16,9 г (выход продукта 96%). KF=3,2%.
Получение полукальциевой соли аторвастатина известной полиморфной модификации Форма IV
Пример 32
Полукальциевая соль аторвастатина полиморфной модификации Форма I, взятая в количестве 1,0 г, подвергалась перемешиванию в среде первичного бутилового спирта, взятого в объеме 9 мл, при комнатной температуре в течение 24 часов. Полученный твердый осадок белого цвета был отделен с помощью фильтрования, после чего повергался высушиванию в вакуумной печи в течение 16 часов при температуре 50°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IV в количестве 0,83 г (выход продукта 83%).
Пример 33
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 1,0 г, подвергалась перемешиванию в среде первичного бутилового спирта, взятого в объеме 20 мл, при комнатной температуре в течение 72 часов. Полученный твердый осадок белого цвета был отделен с помощью фильтрования, после чего повергался высушиванию в вакуумной печи в течение 20 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IV в количестве 0,82 г (выход продукта 82%).
Пример 34
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 2,0 г, подвергалась перемешиванию в среде смеси этилового спирта (EtOH), взятого в объеме 18 мл, и воды, взятой в объеме 3,2 мл, при температуре 50°С в течение 1 часа. Полученный осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IV в количестве 1,60 г (выход продукта 80%).
Пример 35
Смесь полукальциевой соли аторвастатина полиморфной модификации Форма V, взятой в количестве 2,00 г, и метилового спирта, взятого в объеме 20 мл, подвергалась дефлегмации в течение 1 часа. Затем реакционная смесь была охлаждена до комнатной температуры и подвергалась при этой температуре перемешиванию в течение 16 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IV в количестве 1,37 г (выход продукта 56%).
Пример 36
Смесь полукальциевой соли аторвастатина полиморфной модификации Форма V, взятой в количестве 1,00 г, и метилового спирта, взятого в объеме 10 мл, подвергалась перемешиванию при комнатной температуре в течение 20 часов. Полученный твердый осадок был отделен с помощью фильтрования, после чего повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма IV в количестве 0,25 г (выход продукта 25%).
Получение полукальциевой соли аторвастатина известной полиморфной модификации Форма V
Пример 37
В реактор цилиндрической формы, снабженный дистиллятором (аппаратом для перегонки) и механической мешалкой, в среду смеси безводного этилового спирта, взятого в объеме 250 мл, и 1,5%-ного водного раствора хлористовородной кислоты, взятого в объеме 50 мл, для получения суспензии вводился сложный эфир [R-(R*,R*)]-2-(4-фторфенил)-β,δ-диоксан-5-((1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты (сложный эфир пирролацетонида), взятый в количестве 20 г (30,6 ммоль). Полученная реакционная смесь подвергалась нагреванию до температуры 40°С и выдерживалась при этой температуре в течение периода времени от 9 до 11 часов, при этом одновременно выполнялась непрерывная перегонка смеси этилового спирта, ацетона и воды в условиях пониженного давления (от 500 до 600 мбар). С периодичностью в 1 час осуществлялось добавление к реакционной смеси безводного этилового спирта в объеме от 35 до 40 мл. По истечении периода времени от 9 до 11 часов имело место уменьшение содержания сложного эфира пирролацетонида до уровня ниже 0,1% (определение содержания этого вещества осуществлялось с помощью жидкостной хроматографии высокого давления). Без дальнейшей обработки к реакционной смеси добавлялась гидроокись кальция (Са(ОН)2) в количестве 1,5 эквивалента (3,4 г). Затем реакционная смесь подвергалась нагреванию до температуры 70°С и выдерживалась при этой температуре в течение периода времени от 4 до 5 часов. После этого избыточная гидроокись кальция (Са(ОН)2) была удалена с помощью фильтрования. К горячему фильтрату (его температура составляла 65°С) в течение периода времени от 3/4 часа до 1 часа с помощью дозировочного насоса медленно добавлялась вода в количестве 350 мл, температура которой составляла 65°С. В процессе добавления воды происходило осаждение полукальциевой соли аторвастатина. По завершении добавления воды реакционная смесь подвергалась дефлегмации (при температуре 84°С) до получения прозрачного раствора. Затем реакционная смесь подвергалась охлаждению до температуры 20°С в течение 3 часов, после чего подвергалась перемешиванию при этой температуре в течение 20 часов. После этого полученный твердый осадок отделялся с помощью фильтрования, в результате чего получалась, в виде влажного кека (осадка на фильтре), полукальциевая соль аторвастатина полиморфной модификации Форма XII в количестве 45,0 г. Этот твердый осадок повергался высушиванию в течение 24 часов при температуре 65°С, в результате чего получалась полукальциевая соль аторвастатина полиморфной модификации Форма V в количестве 16,7 г (выход продукта 95%). KF=2,8-6,6%.
Способ очистки полукальциевой соли аторвастатина полиморфной модификации Форма V
Пример 38
К кипящему 90%-ному водному раствору этилового спирта, взятому в объеме 150 мл, была добавлена полукальциевая соль аторвастатина полиморфной модификации Форма V в количестве 5,0 г. Полученная реакционная смесь подвергалась дефлегмации в течение 2,5 часа. Затем реакционная смесь в течение 1,5 часа подвергалась охлаждению до температуры 20°С, после чего подвергалась при этой температуре перемешиванию в течение 16 часов. Полученный твердый осадок был отделен с помощью фильтрования, затем был промыт 90%-ным [водным] раствором этилового спирта (дважды по 25 мл), после чего повергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена полукальциевая соль аторвастатина полиморфной модификации Форма V в количестве 3,4 г (выход продукта 68%).
Получение известной аморфной полукальциевой соли аторвастатина
Пример 39
Полукальциевая соль аторвастатина полиморфной модификации Форма V, взятая в количестве 2,00 г, подвергалась перемешиванию в закрытой колбе в среде ацетона, взятого в объеме 14 мл, при комнатной температуре в течение 16 часов. Через 2 часа реакционная смесь стала прозрачной. При продолжающемся перемешивании при комнатной температуре произошло выпадение твердого осадка. После этого ацетон был сцежен, а полученный твердый остаток был собран с помощью лопаточки и перенесен в сушильную печь, в которой подвергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена аморфная полукальциевая соль аторвастатина в количестве 1,85 г (выход продукта 93%).
Пример 40
Полукальциевая соль аторвастатина полиморфной модификации Форма VII, взятая в количестве 1,00 г, подвергалась перемешиванию в среде ацетонитрила, взятого в объеме 20 мл, при комнатной температуре. Затем полученная суспензия в течение 2 минут подвергалась ультразвуковой обработке (энергия = 2,5 кДж, амп. = 50%). После этого ацетонитрил был сцежен, а полученный твердый остаток подвергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена аморфная полукальциевая соль аторвастатина в количестве 0,71 г (выход продукта 71%).
Пример 41
Полукальциевая соль аторвастатина полиморфной модификации Форма I, взятая в количестве 1,00 г, подвергалась перемешиванию в среде ацетонитрила, взятого в объеме 20 мл, при комнатной температуре. Затем полученная суспензия в течение 2 минут подвергалась ультразвуковой обработке (энергия = 2,5 кДж, амп. = 50%). После этого ацетонитрил был сцежен, а полученный твердый остаток подвергался высушиванию в течение 20 часов при температуре 65°С, в результате чего была получена аморфная полукальциевая соль аторвастатина в количестве 0,71 г (выход продукта 71%).
Пример 42
В перемалывающую камеру шаровой мельницы были помещены 27 шариков диаметром 10 мм, выполненных из нержавеющей стали, и была загружена полукальциевая соль аторвастатина в количестве 108 г. Перемалывающая камера была взвешена, и шаровая мельница была сбалансирована в соответствии с ее весом. Шаровая мельница работала в течение 0,5 часа со скоростью 500 оборотов в минуту с включенной системой реверсирования. Затем налипший материал был соскоблен со стенок перемалывающей камеры вниз, после чего шаровая мельница работала еще в течение 4 часов при соскабливании со стенок перемалывающей камеры налипшего материала через каждые 15 минут. По завершении обработки перемалываемый материал был отделен от шариков путем просеивания через сито с ячейкой 300 мкм. Исследование перемолотого материала с помощью метода порошковой рентгеновской дифракции показало, что он является аморфным. Вышеописанный процесс повторялся для полукальциевой соли аторвастатина полиморфных модификаций Форма I, Форма V и Форма VIII, и во всех случаях была получена аморфная полукальциевая соль аторвастатина.
Преимущества заявленных кристаллических Форм аторвастатина с точки зрения понижения концентрации частиц липопротеинов низкой плотности.
Исследования заявленных кристаллических Форм аторвастатина показывают, что эти кристаллические Формы аторвастатина по физическим свойствам превосходят Формы, известные из предшествующего уровня техники. Под превосходством физических свойств новых кристаллических Форм аторвастатина понимается то, что они могут быть лучше приспособлены для включения в состав фармацевтических композиций для понижения концентрации частиц липопротеинов низкой плотности. Результаты проведенных исследований приводятся ниже.
Исследования растворимости
Растворимость заявленных кристаллических Форм аторвастатина в воде сравнивалась с растворимостью в воде аторвастатина кристаллических Форм I-IV, раскрытых в патентах США №5969156 и 6121461. Чаще всего бывает так, что чем быстрее лекарственная форма растворяется в воде, тем более эффективна эта форма по сравнению с формами, которые в воде растворяются медленнее.
Растворимость различных кристаллических Форм аторвастатина измерялась путем суспендирования избыточного количества порошка кристаллических Форм в воде. После фильтрования концентрация водного раствора определялась по ультрафиолетовому поглощению при длине волны 245 нм.
Заявляемая Форма VIII
Заявляемая Форма VIII показала более высокую растворимость по сравнению с Формами I-IV. Результаты сведены в таблицу 4.
Заявляемая Форма IX
Растворимость заявляемой Формы IX сравнивалась с растворимостью Формы I. Растворимость обеих сравниваемых Форм измерялась в воде при комнатной температуре путем добавления очень небольших порций порошка каждой из этих Форм до тех пор, пока не становилось видно, что порошок больше не растворяется. Результаты сведены в таблицу 5.
Цифровая сканирующая калориметрия
Точки плавления заявляемых кристаллических форм аторвастатина и форм, известных из предшествующего уровня техники, определялись с помощью цифровой сканирующей калориметрии.
Заявляемая Форма IX
Термограмма цифровой сканирующей калориметрии заявляемой Формы IX сравнивалась с термограммами цифровой сканирующей калориметрии Форм I-IV. Результаты представлены на фиг.14 - 18.
Термограмма цифровой сканирующей калориметрии заявляемой Формы IX показала очень высокий пик плавления при температуре приблизительно 196°С (см. фиг.14) по сравнению с Формами I-IV. Термограмма цифровой сканирующей калориметрии известной Формы I показала пик плавления при температуре приблизительно 164°С (см. фиг.15), известной Формы II - при температуре приблизительно 161°С (см. фиг.16), известной Формы III - при температуре приблизительно 177°С (см. фиг.17), известной Формы IV - в диапазоне температур приблизительно 96-172°С (см. фиг.18). Тот факт, что заявляемая Форма IX имеет более высокий пик плавления, чем известные Формы I-IV, свидетельствует о том, что заявляемая Форма IX более стабильна по сравнению с известными Формами I-IV. Производство стабильных кристаллических форм и использование этих стабильных кристаллических форм в фармацевтических лекарственных формах может иметь важное значение с точки зрения предупреждения деградации кристаллической формы в процессе производства или при хранении. Таким образом, из представляемых термограмм цифровой сканирующей калориметрии следует, что заявляемая Форма IX обеспечивает возможность получения фармацевтических композиций более высокого качества, обеспечивая тем самым лучший контроль над уровнем липопротеинов низкой плотности.
Заявляемая Форма VI
Термограмма цифровой сканирующей калориметрии заявляемой Формы VI (см. фиг.19) сравнивалась с термограммами цифровой сканирующей калориметрии Форм I-IV (см. фиг.15-18). Термограмма цифровой сканирующей калориметрии заявляемой Формы VI показала пик плавления при температуре приблизительно 194°С (см. фиг.19), в то время как термограмма цифровой сканирующей калориметрии известной Формы I показала пик плавления при температуре приблизительно 164°С (см. фиг.15), известной Формы II - при температуре приблизительно 161°С (см. фиг.16), известной Формы III - при температуре приблизительно 177°С (см. фиг.17), а известной Формы IV - в диапазоне температур приблизительно 96-172°С (см. фиг.18). Тот факт, что заявляемая Форма VI имеет более высокий пик плавления, чем известные Формы I-IV, свидетельствует о том, что заявляемая Форма VI более стабильна по сравнению с известными Формами I-IV. Производство стабильных кристаллических форм и использование этих стабильных кристаллических форм в фармацевтических лекарственных формах может иметь важное значение с точки зрения предупреждения деградации кристаллической формы в процессе производства или при хранении. Таким образом, из представляемых термограмм цифровой сканирующей калориметрии следует, что заявляемая Форма VI обеспечивает возможность получения фармацевтических композиций более высокого качества, обеспечивая тем самым лучший контроль над уровнем липопротеинов низкой плотности.
Кроме того, термограмма цифровой сканирующей калориметрии заявляемой Формы VI показывает пик плавления при температуре 194°С (см. фиг.19), в то время как для известной Формы IV - широкий пик плавления в диапазоне температур приблизительно 96-172°С (см. фиг.18). Этот широкий пик предполагает наличие некоторого другого процесса, например гидратации или десольватации, который начинается при температуре приблизительно 96°С. На физическую и химическую стабильность заявляемой Формы VI влияет то, что вода или сольвент не покидает кристалл при нагревании, в отличие от того, что имеет место для известной Формы IV. На стабильность известной Формы IV может влиять дегидратация или десольватация, в то время как в случае заявляемой Формы VI эти явления не имеют места.
Заявляемая Форма Х
Термограмма цифровой сканирующей калориметрии заявляемой Формы Х (см. фиг.20) сравнивалась с термограммами цифровой сканирующей калориметрии Форм I-IV (см. фиг.15-18). Термограмма цифровой сканирующей калориметрии заявляемой Формы Х показала пик плавления при температуре приблизительно 188°С (см. фиг.20), в то время как у известной Формы I пик плавления при температуре приблизительно 164°С (см. фиг.15), известной Формы II - при температуре приблизительно 161°С (см. фиг.16), а известной Формы III - при температуре приблизительно 177°С (см. фиг.17), известной Формы IV - в диапазоне температур приблизительно 96-172°С (см. фиг.18). Тот факт, что заявляемая Форма Х имеет более высокий пик плавления, чем известные Формы I-IV, свидетельствует о том, что заявляемая Форма VI более стабильна по сравнению с известными Формами I-IV. Производство стабильных кристаллических форм и использование этих стабильных кристаллических форм в фармацевтических лекарственных формах может иметь важное значение с точки зрения предупреждения деградации кристаллической формы в процессе производства или при хранении. Таким образом, из представляемых термограмм цифровой сканирующей калориметрии следует, что заявляемая Форма Х обеспечивает возможность получения фармацевтических композиций более высокого качества, обеспечивая тем самым лучший контроль над уровнем липопротеинов низкой плотности.
Морфология
Морфология порошков может иметь решающее значение для определения реологической характеристики порошка. Морфология порошков может быть обозначена как кубическая, иглообразная или округлая. Менее округлая форма частиц может приводить к уменьшению текучести. В общем случае, чем больше иглообразных частиц, тем хуже текучесть.
Заявляемая Форма XI
Заявитель сравнивал морфологию частиц заявляемой Формы XI с морфологией частиц известных Форм I-IV.
На изображении частиц заявляемой Формы XI, полученном с помощью оптического микроскопа (см. фиг.21), видны частицы неправильной формы, форма которых весьма отличается от иглообразных частиц известных Форм I-III (см. фиг.22-24). По сравнению с более округлыми частицами заявляемой Формы XI частицы известных Форм I-III являются продолговатыми и тонкими (плоскими или иглообразными).
Таким образом, заявляемая Форма XI имеет лучшую морфологию, чем сравниваемые известные Формы, потому что более или менее округлые частицы заявляемой Формы XI текли бы более свободно, чем пластинообразные или иглообразные частицы сравниваемых известных Форм.
Кроме того, заявляемая Форма XI содержит частицы более крупного размера, чем частицы известной Формы IV (как можно видеть на фиг.25, приблизительно 10-20 мкм). Материал, который содержит частицы крупного размера (а следовательно, имеет меньшую площадь поверхности), такой как заявляемая Форма XI, имеет лучшую текучесть, чем материал, содержащий частицы более мелкого размера, такой как известная Форма IV. Высокая текучесть является важным достоинством фармацевтического препарата, так как разные процессы приготовления лекарственного средства, включая смешивание, перенесение, хранение, загрузку, прессование и разжижение, связаны с работой с порошками. Поток порошка в процессе производства определяет качество продукта в понятиях массы и однородности содержания. Кроме того, эффективность производства для материала с низкой текучестью ниже.
Частицы известных Форм I-III по форме более продолговаты и тонки (пластинообразные или иглообразные), чем частицы заявляемой Формы XII, которые более округлы. Заявляемая Форма XII имеет более благоприятную морфологию частиц, чем другие Формы, так как более округлые частицы обеспечивают более высокую текучесть, чем частицы другой формы, например пластинообразной или иглообразной.
Кроме того, частицы заявляемой Формы XII имеют более крупный размер, чем намного более мелкие частицы известных Форм I-III (как можно видеть на фиг.25, приблизительно 10-20 мкм). Материал, который содержит частицы крупного размера (а следовательно, имеет меньшую площадь поверхности), такой как заявляемая Форма XII, имеет лучшую текучесть, чем материал, содержащий частицы более мелкого размера, такой как известная Форма IV. Высокая текучесть является важным достоинством фармацевтического препарата, так как разные процессы приготовления лекарственного средства, включая смешивание, перенесение, хранение, загрузку, прессование и разжижение, связаны с работой с порошками. Поток порошка в процессе производства определяет качество продукта в понятиях массы и однородности содержания. Кроме того, эффективность производства для материала с низкой текучестью ниже.
Изображение частиц заявляемой Формы XII, полученное с помощью оптического микроскопа (см. фиг.26), показало в основном большие частицы неправильной формы, отличающиеся по форме от иглообразных частиц известных Форм I-III (см. фиг.22, фиг.24).
Из приведенного выше описания, опирающегося на конкретные предпочтительные варианты осуществления предлагаемого изобретения и проиллюстрированного примерами его осуществления, среднему специалисту соответствующего профиля должно быть понятно, что предлагаемое изобретение допускает различные модификации относительно того, что было описано и проиллюстрировано, которые не отклоняются от духа предлагаемого изобретения и не выходят за пределы его объема, который определен приводимой ниже формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВАЯ ПОЛИМОРФНАЯ ФОРМА КРИСТАЛЛИЧЕСКОЙ ГЕМИКАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА | 2006 |
|
RU2409563C2 |
| ФОРМА VI АТОРВАСТАТИНА КАЛЬЦИЯ ИЛИ ЕЕ ГИДРАТЫ | 2002 |
|
RU2294924C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ VI И VII КАЛЬЦИЕВОЙ СОЛИ АТОРВАСТАТИНА | 2002 |
|
RU2304139C2 |
| СОЛИ И ПОЛИМОРФНЫЕ МОДИФИКАЦИИ ИНГИБИТОРА VEGF-R | 2006 |
|
RU2369607C1 |
| ПОЛИМОРФНАЯ МОДИФИКАЦИЯ А ИБАНДРОНАТА | 2006 |
|
RU2368617C2 |
| КРИСТАЛЛИЧЕСКИЕ МОДИФИКАЦИИ | 2005 |
|
RU2400479C2 |
| НОВЫЕ ПОЛИМОРФЫ И СОЛИ | 2011 |
|
RU2573384C2 |
| ПОЛИМОРФНАЯ МОДИФИКАЦИЯ В ИБАНДРОНАТА | 2006 |
|
RU2387661C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ ИКОТИНИБА И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2710013C2 |
| ПОЛИМОРФНЫЕ ФОРМЫ РИФАКСИМИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ПРЕПАРАТАХ | 2004 |
|
RU2270200C2 |
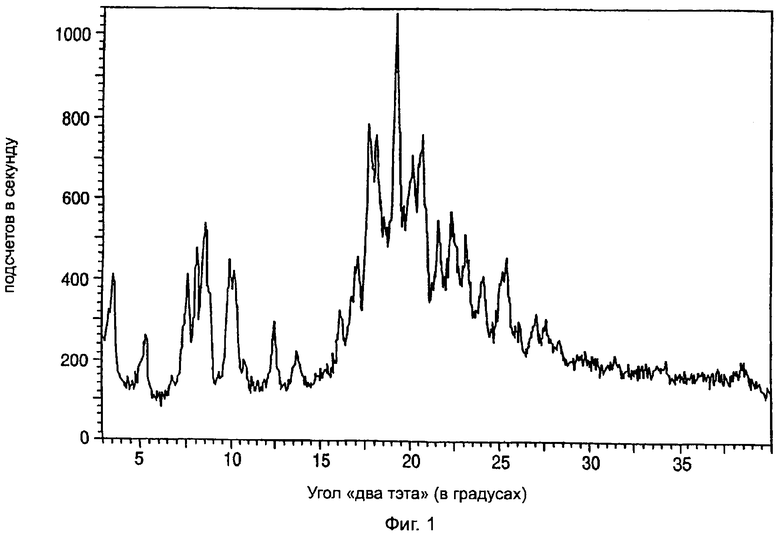
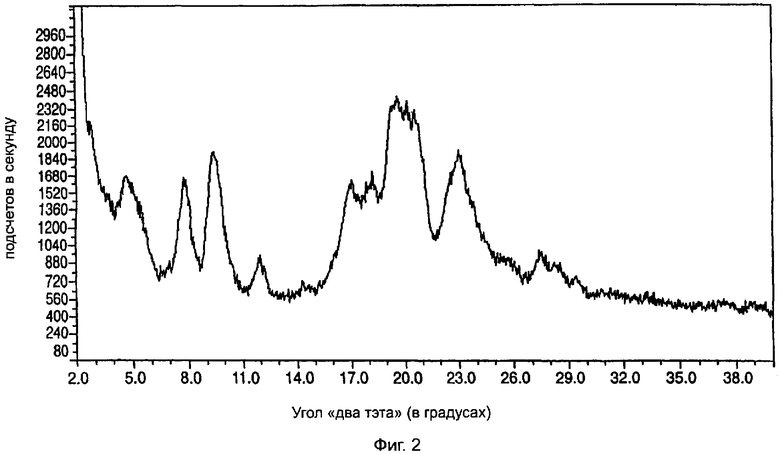
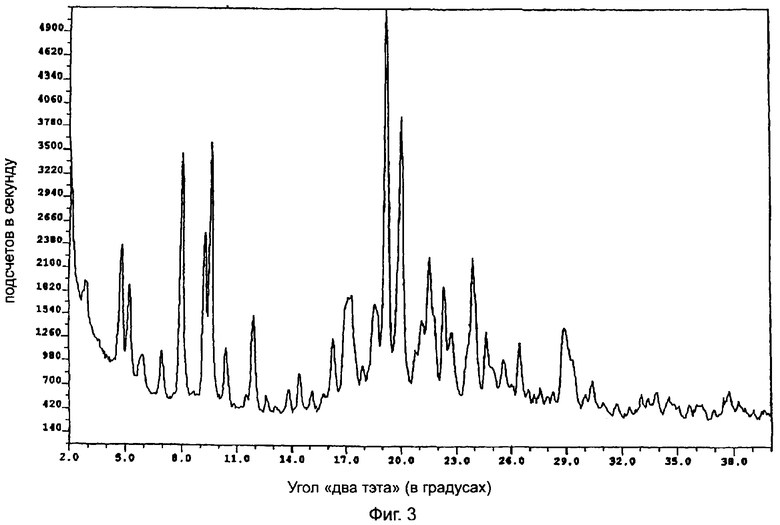
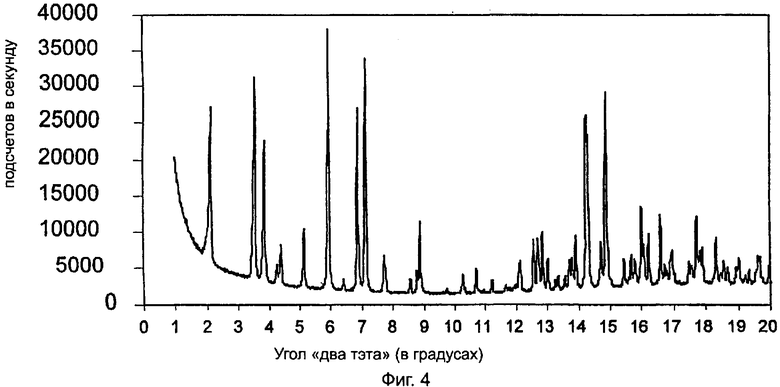
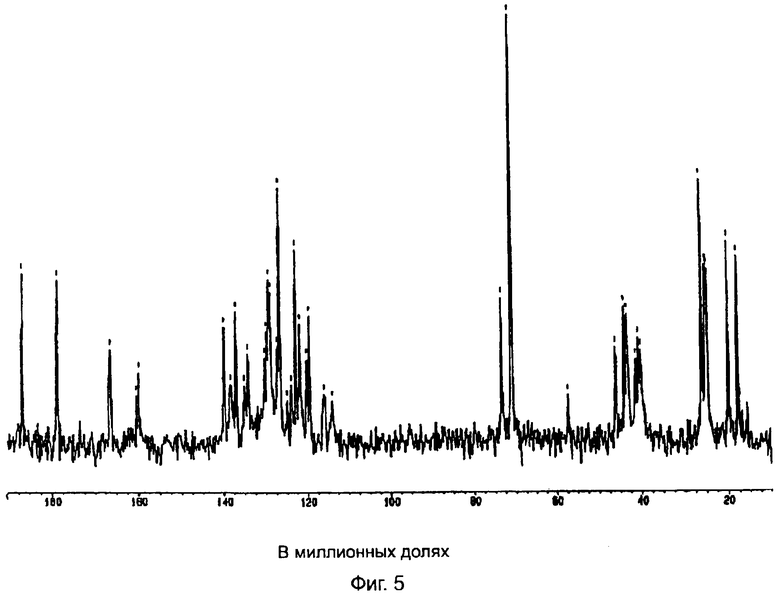
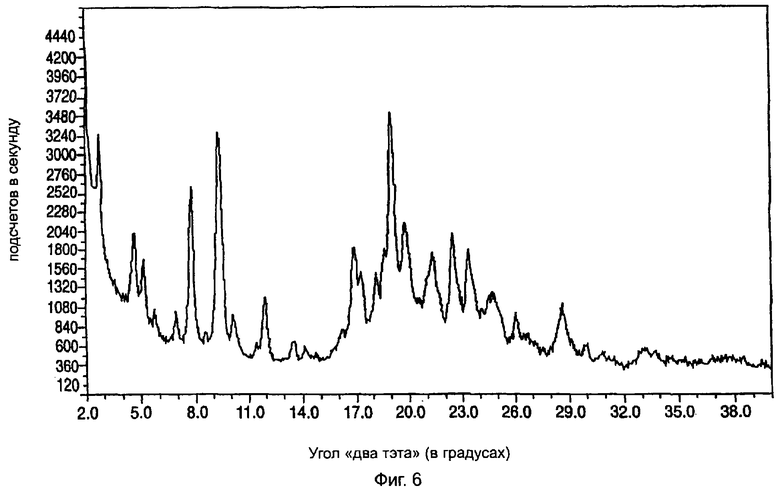
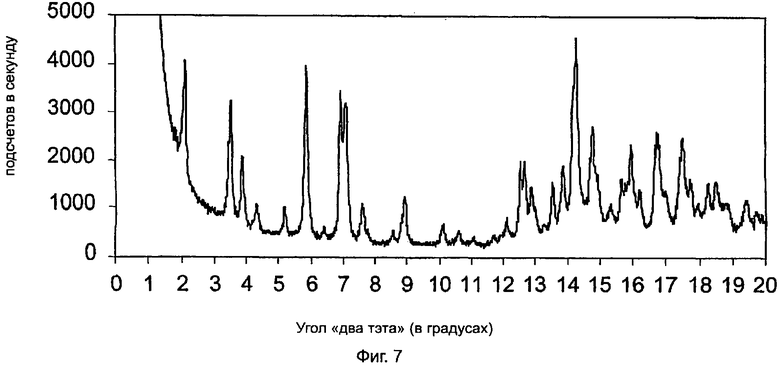
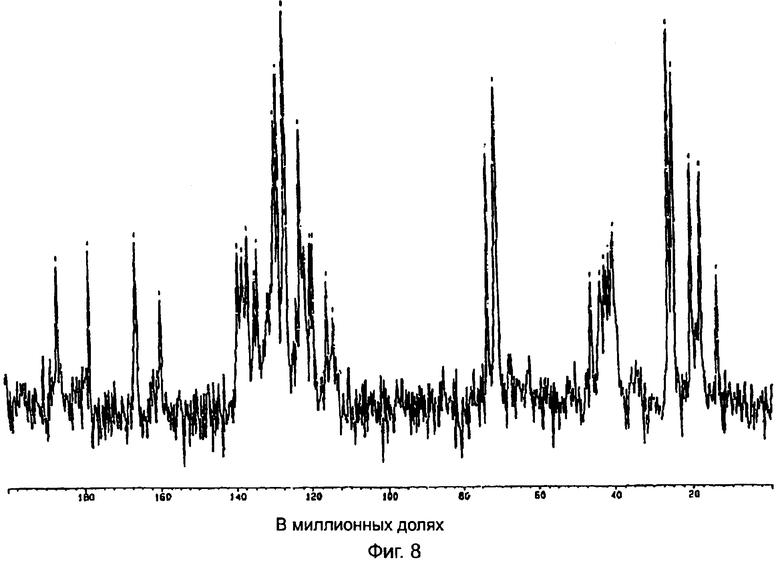
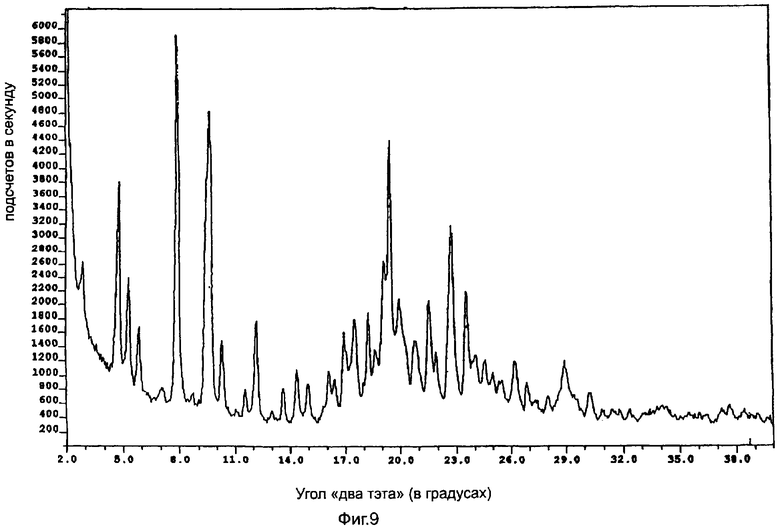
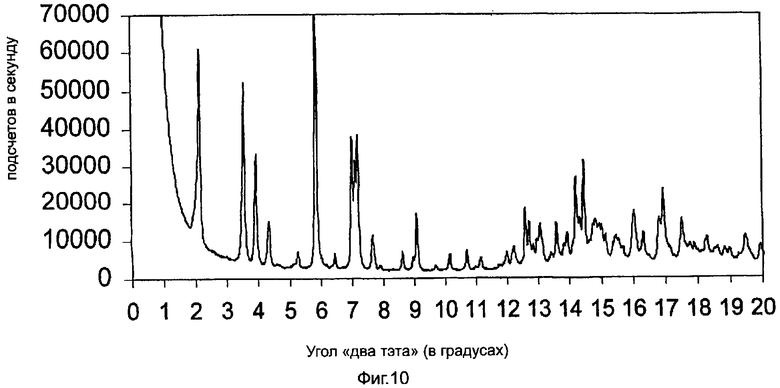
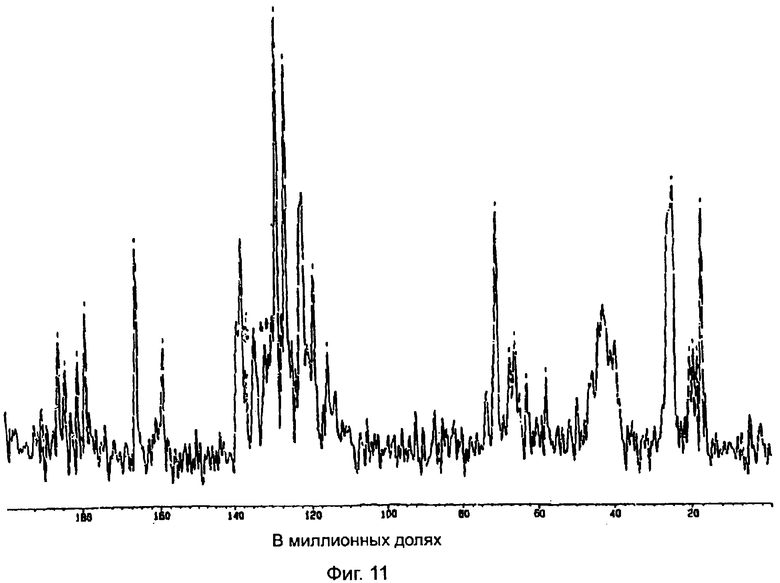
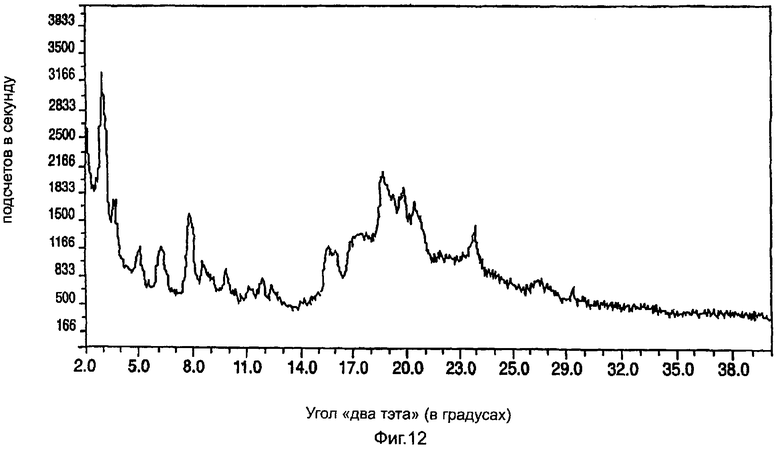
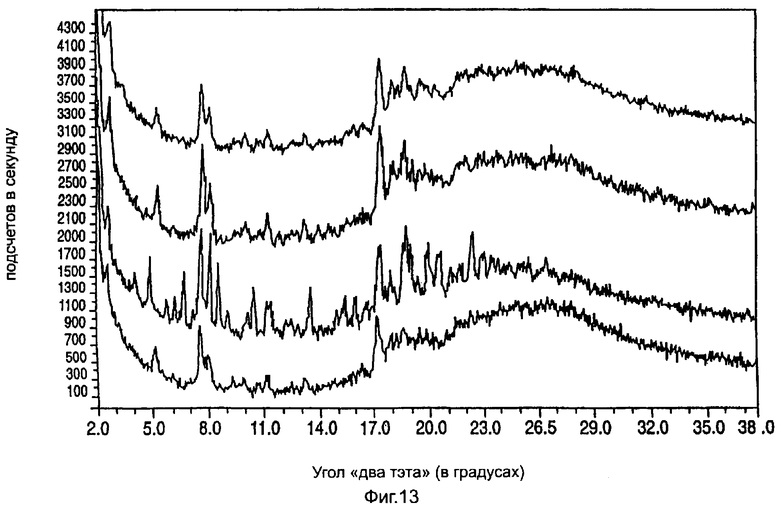
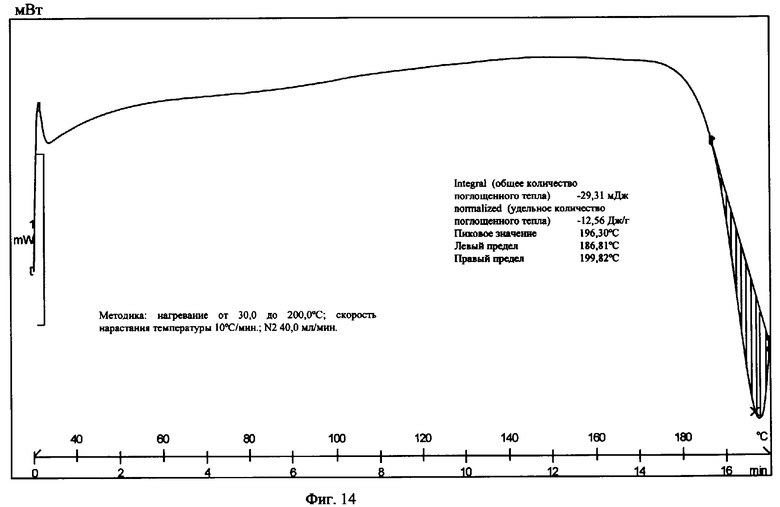
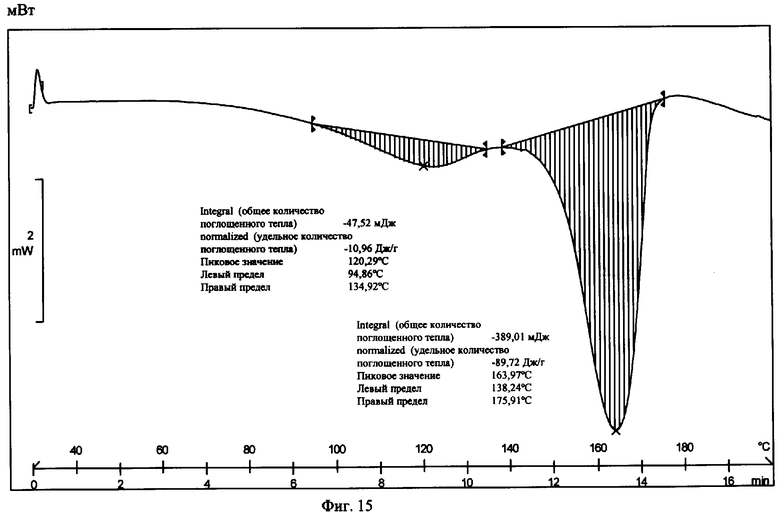
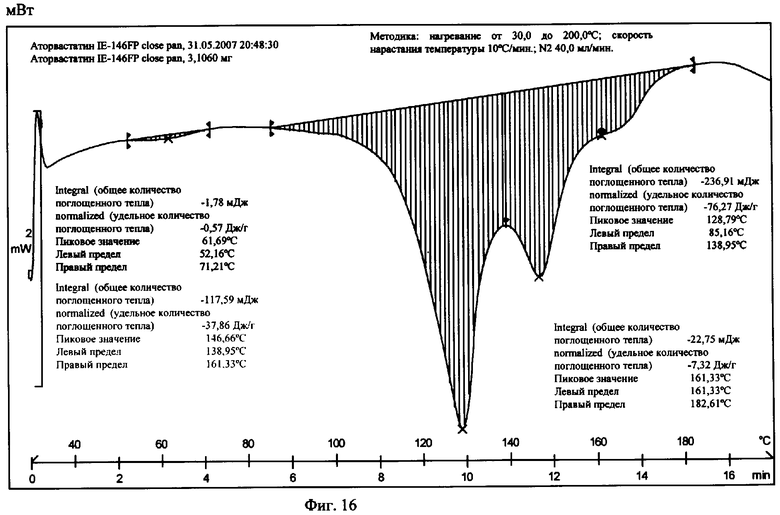
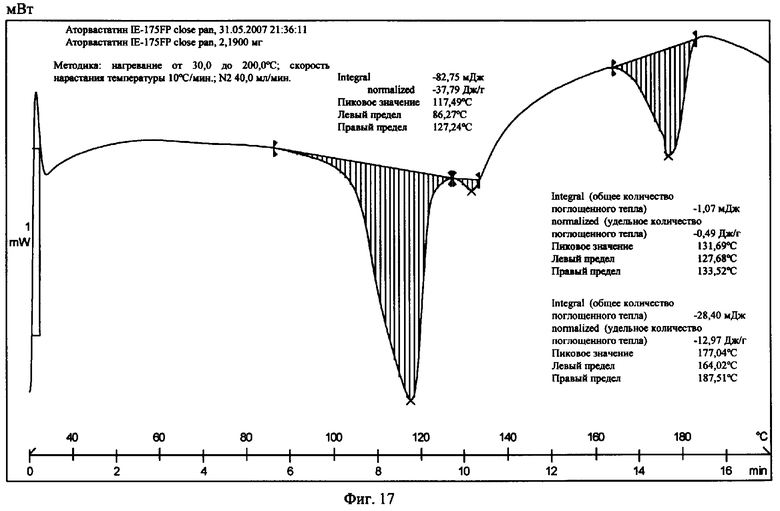
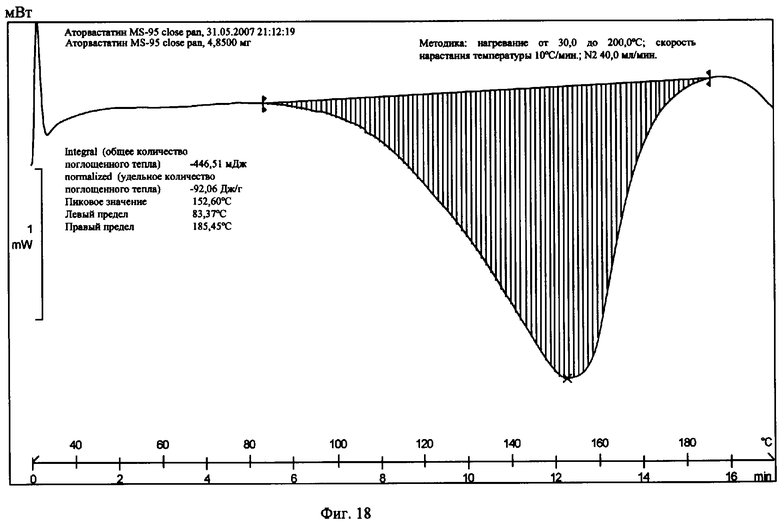
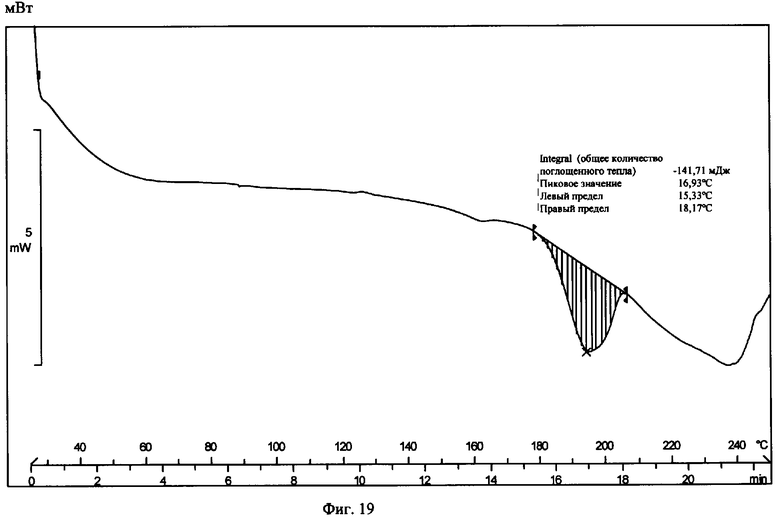
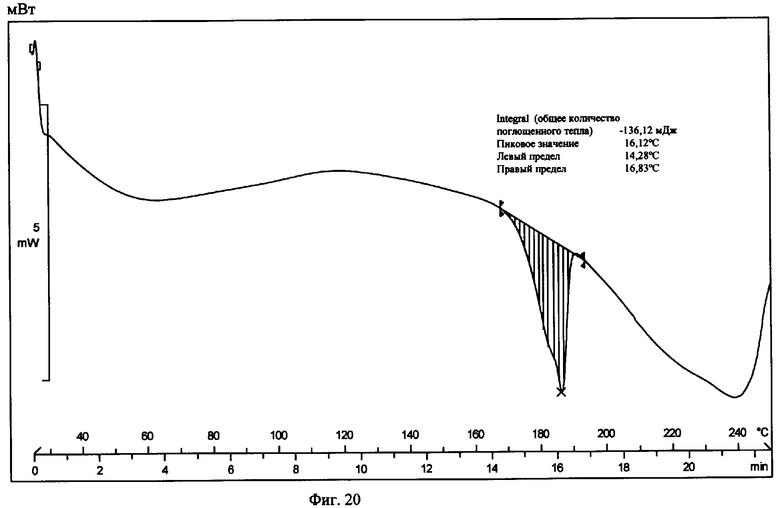




Изобретение относится к новым полиморфным модификациям полукальциевой соли аторвастатина, которым присвоены наименования Форма VI, Форма VIII, Форма IX, Форма X, Форма XI и Форма XII, и к способам их получения, а также способам получения полукальциевой соли аторвастатина полиморфных модификаций Форма I, Форма II, Форма IV и Форма V, а также аморфной полукальциевой соли аторвастатина. Использование новых форм в фармацевтических композициях повышает их качество и тем самым улучшает контроль над уровнем липопротеинов низкой плотности. 32 н. и 59 з.п. ф-лы, 26 ил., 5 табл.
а) растворение аморфной полукальциевой соли аторвастатина или кристаллической формы полукальциевой соли аторвастатина, которая не является Формой VI, в ацетоне,
б) осаждение полукальциевой соли аторвастатина Формы VI путем добавления воды, и
в) выделение твердой кристаллической Формы VI,
где Форма VI характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 7,7; 8,2; 8,7; 10,0; 12,5; 13,8; 17,9; 19,5; 20,4; 20,9; 22,4; 23,2; 25,5±0,2° угла 2θ.
а) суспендирование полукальциевой соли аторвастатина Формы V в смеси этилового спирта и воды в течение 6-16 ч для перехода Формы V в Форму VIII, и
б) извлечение Формы VIII из суспензии, при этом Форма VIII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 9,3; 9,6; 16,3; 17,1 (широкий пик); 19,2; 20,0; 21,6; 22,4; 23,9; 24,7; 25,6; 26,5±0,2° угла 2θ.
а) превращение аторвастатина в полукальциевую соль аторвастатина путем приведения аторвстатина в контакт с источником ионов кальция,
б) суспендирование полукальциевой соли аторвастатина в смеси этилового спирта и воды в течение 6-16 ч, чтобы превратить полукальциевую соль аторвастатина в Форму VIII, и
в) извлечение Формы VIII из суспензии, при этом Форма VIII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 9,3; 9,6; 16,3; 17,1 (широкий пик); 19,2; 20,0; 21,6; 22,4; 23,9; 24,7; 25,6; 26,5±0,2° угла 2θ.
а) суспендирование полукальциевой соли аторвастатина Формы V в смеси воды и низшего спирта, выбранного из следующего перечня: первичный бутиловый спирт и этиловый спирт, в течение 6-16 ч, чтобы вызвать превращение Формы V в Форму VIII, и
б) извлечение полукальциевой соли аторвастатина Формы VIII из смеси, при этом Форма VIII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 9,3; 9,6; 16,3; 17,1 (широкий пик); 19,2; 20,0; 21,6; 22,4; 23,9; 24,7; 25,6; 26,5±0,2° угла 2θ.
а) суспендирование полукальциевой соли аторвастатина Формы I или Формы V в этиловом спирте в течение 6-16 ч, чтобы превратить их в Форму VIII, и
б) извлечение Формы VIII из суспензии, причем Форма VIII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 9,3; 9,6; 16,3; 17,1 (широкий пик); 19,2; 20,0; 21,6; 22,4; 23,9; 24,7; 25,6; 26,5±0,2° угла 2θ.
а) суспендирование Формы I или Формы V полукальциевой соли аторвастатина в 1-бутаноле (первичном бутиловом спирте) в течение от 30 мин до 16 ч, чтобы превратить Форму I или Форму V в Форму IX, и
б) извлечение Формы IX из суспензии,
при этом Форма IX характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 6,9; 17,0; 17,4; 18,2; 18,6; 19,1; 19,9; 21,4; 22,5; 23,5±0,2° угла 2θ.
а) суспендирование полукальциевой соли аторвастатина Формы VIII в этиловом спирте в течение от 30 мин до 16 ч для превращения Формы VIII в Форму IX, и
б) извлечение Формы IX из суспензии, где Форма IX характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 6,9; 17,0; 17,4; 18,2; 18,6; 19,1; 19,9; 21,4; 22,5; 23,5±0,2° угла 2θ, при этом Форма VIII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 9,3; 9,6; 16,3; 17,1 (широкий пик); 19,2; 20,0; 21,6; 22,4; 23,9; 24,7; 25,6; 26,5±0,2° угла 2θ.
а) суспендирование полукальциевой соли аторвастатина Формы V в смеси этилового спирта и воды в течение 1-20 ч, чтобы превратить Форму V в Форму X, и
б) извлечение Формы Х из суспензии, причем Форма Х характеризуется характеристической диаграммой порошковой рентгеновской дифракции с резкими пиками при 19,1 и 19,4±0,2° угла 2θ и другими пиками при 20,0; 20,8; 22,8; 23,6 и 25,0±0,2° угла 2θ.
а) суспендирование полукальциевой соли аторвастатина Формы V в метилэтилкетоне при комнатной температуре в течение 24 ч, чтобы вызвать превращение Формы V в полукальциевую соль аторвастатина Формы XI, и
б) извлечение полукальциевой соли аторвастатина Формы XI из суспензии, причем Форма XI характеризуется характеристической диаграммой порошковой рентгеновской дифракции (PXRD) с пиками при: 3,2; 3,7; 5,1; 6,3; 7,8; 8,6; 9,8; 11,2; 11,8; 12,4; 15,4; 18,7; 19,9; 24,0±0,2° угла 2θ.
а) суспендирование сложного эфира [R-(R*,R*)]-2-(4-фторфенил)-β,δ-диоксан-5(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты в этиловом спирте,
б) снятие защиты в сложном эфире [R-(R*,R*)]-2-(4-фторфенил)-β,δ-диоксан-5(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты путем прибавления к суспензии соляной кислоты, тем самым получая раствор сложноэфирных производных аторвастатина в этиловом спирте,
в) прибавление к раствору гидроокиси кальция, тем самым получая раствор полукальциевой соли аторвастатина в этиловом спирте,
г) возможно удаление любого избытка гидроокиси кальция, и
д) осаждение полукальциевой соли аторвастатина из раствора в виде Формы XII,
при этом Форма XII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при: 8,0; 8,4; 11,8; 18,2; 19,0±0,2° угла 2θ.
а) суспендирование полукальциевой соли аторвастатина Формы V, Формы VII, Формы VIII, Формы IX или Формы Х в воде в течение от нескольких часов до 25 ч, чтобы превратить Форму V, Форму VII, Форму VIII, Форму IX или Форму Х в Форму I, и
б) извлечение Формы I из суспензии.
а) суспендирование полукальциевой соли аторвастатина Формы I или Формы VII в ацетонитриле,
б) обработка суспензии ультразвуком в течение 1-3 мин для превращения полукальциевой соли аторвастатина Формы I или Формы VII в аморфную полукальциевую соль аторвастатина,
в) извлечение аморфной полукальциевой соли аторвастатина из суспензии.
а) суспендирование полукальциевой соли аторвастатина Формы I в 1-бутаноле в течение 24-72 ч, чтобы превратить Форму I в Форму IV, и
б) извлечение Формы IV из суспензии.
а) суспендирование полукальциевой соли аторвастатина Формы V в смеси этилового спирта и воды в течение 1 ч, чтобы превратить Форму V в Форму IV, и
б) извлечение Форма IV из суспензии.
а) суспендирование полукальциевой соли аторвастатина Формы V в метиловом спирте в течение 1-25 ч для перехода Формы V в Форму IV, и
б) извлечение Формы IV из суспензии.
а) суспендирование сложного эфира [R-(R*,R*)]-2-(4-фторфенил)-β,δ-диоксан-5(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты в этиловом спирте,
б) снятие защиты в сложном эфире [R-(R*,R*)]-2-(4-фторфенил)-β,δ-диоксан-5(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты путем прибавления к суспензии соляной кислоты, тем самым получая раствор лактона аторвастатина и сложного эфира [R-(R*,R*)]-2-(4-фторфенил)-β,δ-дигидрокси-5(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1Н-пиррол-1-трет-бутилгептановой кислоты в этиловом спирте,
в) прибавление к раствору гидроокиси кальция, тем самым получая раствор полукальциевой соли аторвастатина в этиловом спирте,
г) осаждение полукальциевой соли аторвастатина из раствора, и
д) высушивание осажденной полукальциевой соли аторвастатина с получением полукальциевой соли аторвастатина в виде Формы V.
а) приведение полукальциевой соли аторвастатина Формы V в контакт с ацетоном в течение времени от нескольких часов до 25 ч, чтобы превратить полукальциевую соль аторвастатина Формы V в аморфную полукальциевую соль аторвастатина, и
б) отделение твердой аморфной полукальциевой соли аторвастатина от ацетона.
Форма VI характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 7,7; 8,2; 8,7; 10,0; 12,5; 13,8; 17,9; 19,5; 20,4; 20,9; 21,7; 22,4; 23,2; 25,5±0,2° угла 2θ,
Форма VIII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 9,3; 9,6; 16,3; 17,1 (широкий пик); 19,2; 20,0; 21,6; 22,4; 23,9; 24,7; 25,6; 26,5±0,2° угла 2θ,
Форма IX характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 6,9; 17,0; 17,4; 18,2; 18,6; 19,1; 19,9; 21,4; 22,5; 23,5±0,2° угла 2θ,
Форма Х характеризуется характеристической диаграммой порошковой рентгеновской дифракции с острыми пиками при 19,1 и 19,4±0,2° угла 2θ и другими пиками при 20,0; 20,8; 22,8; 23,6 и 25,0±0,2° угла 2θ, Форма XI характеризуется характеристической диаграммой порошковой рентгеновской дифракции (PXRD) с пиками при: 3,2; 3,7; 5,1; 6,3; 7,8; 8,6; 9,8; 11,2; 11,8; 12,4; 15,4; 18,7; 19,9; 24,0±0,2° угла 2θ, и Форма XII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при: 8,0; 8,4; 11,8; 18,2; 19,0±0,2° угла 2θ.
Форма VI характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 7,7; 8,2; 8,7; 10,0; 12,5; 13,8; 17,9; 19,5; 20,4; 20,9; 21,7; 22,4; 23,2; 25,5±0,2° угла 2θ,
Форма VIII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 9,3; 9,6; 16,3; 17,1 (широкий пик); 19,2; 20,0; 21,6; 22,4; 23,9; 24,7; 25,6; 26,5±0,2° угла 2θ, Форма IX характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 6,9; 17,0; 17,4; 18,2; 18,6; 19,1; 19,9; 21,4; 22,5; 23,5±0,2° угла 2θ,
Форма X характеризуется характеристической диаграммой порошковой рентгеновской дифракции с острыми пиками при 19,1 и 19,4±0,2° угла 2θ и другими пиками при 20,0; 20,8; 22,8; 23,6 и 25,0±0,2° угла 2θ, Форма XI характеризуется характеристической диаграммой порошковой рентгеновской дифракции (PXRD) с пиками при: 3,2; 3,7; 5,1; 6,3; 7,8; 8,6; 9,8; 11,2; 11,8; 12,4; 15,4; 18,7; 19,9; 24,0±0,2° угла 2θ, и Форма XII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при: 8,0; 8,4; 11,8; 18,2; 19,0±0,2° угла 2θ.
Форма VI характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 7,7; 8,2; 8,7; 10,0; 12,5; 13,8; 17,9; 19,5; 20,4; 20,9; 21,7; 22,4; 23,2; 25,5±0,2° угла 2θ,
Форма VIII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 9,3; 9,6; 16,3; 17,1 (широкий пик); 19,2; 20,0; 21,6; 22,4; 23,9; 24,7; 25,6; 26,5±0,2° угла 2θ, Форма IX характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 6,9; 17,0; 17,4; 18,2; 18,6; 19,1; 19,9; 21,4; 22,5; 23,5±0,2° угла 2θ,
Форма X характеризуется характеристической диаграммой порошковой рентгеновской дифракции с резкими пиками при 19,1 и 19,4±0,2° 2θ и другими пиками при 20,0; 20,8; 22,8; 23,6 и 25,0±0,2° угла 2θ, Форма XI характеризуется характеристической диаграммой порошковой рентгеновской дифракции (PXRD) с пиками при 3,2; 3,7; 5,1; 6,3; 7,8; 8,6; 9,8; 11,2; 11,8; 12,4; 15,4; 18,7; 19,9; 24,0±0,2° угла 2θ, и Форма XII характеризуется характеристической диаграммой порошковой рентгеновской дифракции с пиками при 8,0; 8,4; 11,8; 18,2; 19,0±0,2° угла 2θ.
Приоритет по пунктам:
| US 5969156, 19.10.1999 | |||
| US 6087511, 11.07.2000 | |||
| US 6121461, 19.09.2000 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| ЛЕЧЕНИЕ АРТЕРИОСКЛЕРОЗА И КСАНТОМЫ | 1996 |
|
RU2158607C2 |
Авторы
Даты
2009-01-20—Публикация
2001-11-29—Подача