Настоящее изобретение относится к 2-замещенным индолам и связанным с ними композициям, способам их использования в качестве терапевтических агентов и способам их получения.
Действия нейротрансмиттера 5-гидрокситриптамина (5-ГТ) как основного модулирующего нейротрансмиттера в мозге опосредованы рядом рецепторов из семейства 5-ГТ1, 5-ГТ2, 5-ГТЗ, 5-ГТ4, 5-ГТ5, 5-ГТ6 и 5-ГТ7. Основываясь на высоком уровне рецептора 5-ГТ6 мРНК в мозге, установлено, что рецептор 5-ГТ6 может играть роль в патологии и лечении заболеваний центральной нервной системы (ЦНС). В частности, найдено, что селективные лиганды 5-ГТ6 потенциально полезны для лечения некоторых заболеваний ЦНС, таких как болезнь Паркинсона, болезнь Хантингтона, тревожность, депрессия, маниакальная депрессия, психоз, эпилепсия, навязчивый невроз, мигрень, болезнь Альцгеймера (улучшение познавательной памяти), нарушения сна, нарушения обмена веществ (питания), такие как потеря аппетита (анорексия) и повышенное чувство голода (булемия), острые тревожные состояния с реакцией паники, синдром дефицита внимания с гиперактивностью (СДВГ), синдром дефицита внимания (СДВ), болезнь отмены приема наркотиков, таких как кокаин, этанол, никотин и бензодиазепины, шизофрения, а также заболевания, связанные с травмами позвоночника и/или травмами головы, такие как гидроцефалия. Вероятно также, что такие соединения будут полезны при лечении некоторых желудочно-кишечных (ЖК) заболеваний, таких как функциональные кишечные расстройства. В качестве примера можно привести следующие ссылки: B.L. Roth и соавт., J. Pharmacol. Exp.Ther., 1994, т.268, сс.1403-14120; D. R. Sibley и соавт., Mol. Pharmacol., 1993, т.43, сс.320-327; A.J. Sleight и соавт., Neurotransmission, 1995, т.11, сс.1-5 и А.J. Sleight и соавт., Serotonin ID Research Alert, 1997, т.2, №3, сс.115-8. Антагонисты 5-ГТ6 определены как потенциально полезные соединения для лечения ожирения. В качестве примера можно привести следующие ссылки: Bentley и соавт., Br. J. Pharmac. 1999, Suppi 126; Bently и соавт., J. PsychopharmacoL, 1997, Прилож. А64, с.255; Wooley и соавт., Newopharmacology, 2001, т.41, сс.210-129 и публикация международной патентной заявки WO 02/098878.
Несмотря на то что некоторые модуляторы 5-ГТ6 уже открыты, остается потребность в поисках соединений, полезных для модулирования 5-ГТ6.
Один объект настоящего изобретения представляет собой
(i) соединение общей формулы
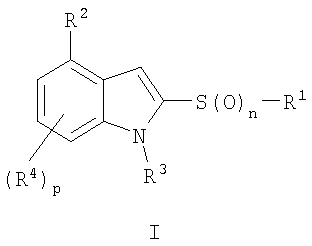
или его фармацевтически приемлемая соль, где
n обозначает 0, 1 или 2;
р обозначает 1 или 2;
R1 обозначает необязательно замещенный арил или необязательно замещенный гетероарил;
R2 обозначает необязательно замещенный гетероциклил;
R3 обозначает водород, алкил или -C(=O)-R5, где R5 обозначает алкил, алкоксигруппу, арил или арилоксигруппу и каждый R4 независимо выбран из водорода, гидроксигруппы, цианогруппы, алкила, алкоксигруппы, тиоалкила, алкилтиогруппы, галогена, галогеналкила, гидроксиалкила, нитрогруппы, алкоксикарбонила, алкилкарбонила, алкилсульфонила, арилсульфонила, галогеналкилсульфонила, аминогруппы, алкиламиногруппы, диалкиламиногруппы, алкил(арил)аминогруппы, алкиламинокарбонила, алкилкарбониламиногруппы, алкилкарбонил(алкиламино), алкиламиносульфонила, алкилсульфониламиногруппы или метилендиоксигруппы.
Другие объекты настоящего изобретения представляют собой:
(ii) Соединение (i), где
n обозначает 2;
R1 обозначает необязательно замещенный арил или необязательно замещенный гетероарил;
R2 обозначает необязательно замещенный гетероциклил;
R3 обозначает водород, алкил и
R4 обозначает водород.
(iii) Соединение (ii), где R2 обозначает необязательно замещенный пиперазин-1-ил или необязательно замещенный пиперидин-4-ил.
(iv) Соединение (iii), где R2 обозначает пиперазин-1-ил, 4-метилпиперазин-1-ил, 3,5-диметилпиперазин-1-ил, N-метилпиперидин-4-ил или пиперидин-4-ил.
(v) Соединение (iv), где R2 обозначает пиперазин-1-ил, 4-метилпиперазин-1-ил или пиперидин-4-ил.
(vi) Соединение (ii), где R1 обозначает необязательно замещенный фенил или необязательно замещенный тиенил.
(vii) Соединение (vi), где R1 обозначает тиен-2-ил или фенил, который необязательно замещен алкилом, галогеном или галогеналкилом.
(viii) Соединение (vii), где R1 обозначает фенил, 2,3-дихлорфенил, 2-фторфенил, 2-метилфенил, 2-трифторметилфенил, 3-бромфенил или тиен-2-ил.
(ix) Соединение (ii), где R3 обозначает водород или метил.
(х) Соединения (ii), которые представляют собой:
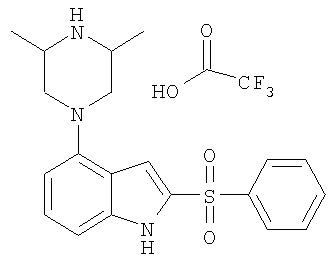
2-бензолсульфонил-4-пиперазин-1-ил-1Н-индол,
2-бензолсульфонил-4-(4-метилпиперазин-1-ил)-1Н-индол,
2-(2,3-дихлорбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(2,3-дихлорбензолсульфонил)-4-(4-метилпиперазин-1-ил)-1Н-индол,
2-бензолсульфонил-1-метил-4-пиперазин-1-ил)-1Н-индол,
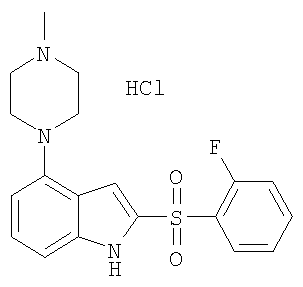
2-(2-фторбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(толуол-2-сульфонил)-4-пиперазин-1-ил-1H-индол,
2-(2-трифторметилбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
2-бензолсульфонил-4-(3,5-диметилпиперазин-1-ил)-1Н-индол,
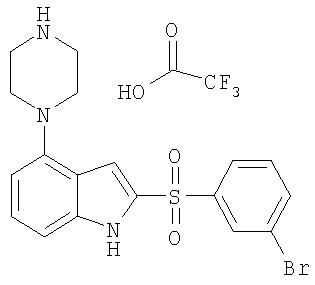
2-(3-бромбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
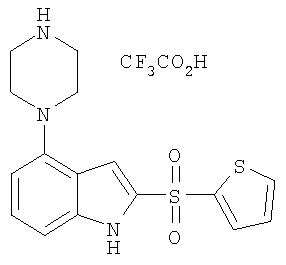
2-(тиофен-2-сульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(2-фторбензолсульфонил)-4-(4-метилпиперазин-1-ил)-1Н-индол,
2-(2-фторбензолсульфонил)-1-метил-4-пиперазин-1-ил-1Н-индол,
2-(3-бромбензолсульфонил)-1-метил-4-пиперазин-1-ил-1Н-индол,
2-бензолсульфонил-4-пиперидин-4-ил-1Н-индол,
(xi) Способ получения 2-замещенного индола формулы:

где n обозначает 0, 1 или 2;
р обозначает 1 или 2;
R1 обозначает необязательно замещенный арил или необязательно замещенный гетероарил;
R2 обозначает необязательно замещенный гетероциклил;
R3 обозначает водород, алкил или -C(=O)-R5, где R5 обозначает алкил, алкоксигруппу, арил или арилоксигруппу и
каждый R4 независимо выбран из группы, содержащей водород, гидроксигруппу, цианогруппу, алкил, алкоксигруппу, тиоалкил, алкилтио, галоген, галогеналкил, гидроксиалкил, нитрогруппу, алкоксикарбонил, алкилкарбонил, алкилсульфонил, арилсульфонил, галогеналкилсульфонил, аминогруппу, алкиламиногруппу, диалкиламиногруппу, алкил(арил)аминогруппу, алкиламинокарбонил, алкилкарбониламиногруппу, алкилкарбонил(алкиламино), алкиламиносульфонил, алкилсульфониламиногруппу или метилендиоксигруппу,
где способ включает взаимодействие замещенного индола формулы
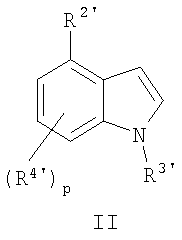
где R2' обозначает необязательно замещенный гетероциклил, необязательно защищенный защитной группой; R3' обозначает алкил или -C(=O)-R5; каждый R4' независимо друг от друга выбран из группы, содержащей водород, гидроксигруппу, цианогруппу, алкил, алкоксигруппу, тиоалкил, алкилтио, галоген, галогеналкил, гидроксиалкил, нитрогруппу, алкоксикарбонил, алкилкарбонил, алкилсульфонил, арилсульфонил, галогеналкилсульфонил, аминогруппу, алкиламиногруппу, диалкиламиногруппу, алкил(арил)аминогруппу, алкиламинокарбонил, алкилкарбониламиногруппу, алкилкарбонил(алкиламино), алкиламиносульфонил, алкилсульфониламиногруппу или метилендиоксигруппу, необязательно защищенный защитной группой,
(а) с основанием с получением депротонированного индола; и
(б) взаимодействие депротонированного индола с сульфонилирующим
агентом формулы Y-SO2-R1, где Y обозначает галогенид, или дисульфидным агентом формулы R1-S-S-R1 с получением 2-замещенного индола формулы
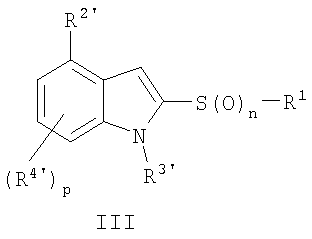
(в) необязательное окисление серы окисляющим агентом; и
(г) необязательное удаление защитной группы с получением 2-замещенного индола формулы I.
(xii) Способ (xi), где Y обозначает фтор.
(xiii) Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы I от (i) до (х) и фармацевтически приемлемый носитель.
(xiv) Применение одного или нескольких соединений от (i) до (х) для приготовления лекарственного средства для лечения или профилактики болезненного состояния, которое облегчается агонистами 5ГТ6.
(xv) Применение (xiv), когда болезненное состояние представляет собой заболевания ЦНС.
(xvi) Применение (xv), когда болезненное состояние представляет собой психозы, шизофрению, маниакальную депрессию, неврологические заболевания, болезни памяти, синдром дефицита внимания, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Альцгеймера и болезнь Хантингтона.
(xvii) Применение (xiv), когда болезненное состояние представляет собой заболевания желудочно-кишечного тракта.
(xviii) Применение (xiv), когда болезненное состояние представляет собой ожирение.
Настоящее изобретение представляет также способы получения соединений формулы I, композиции, их содержащие, и способы их использования.
Если не указано иное, определения следующих терминов, использованных в настоящей заявке, включая описание и формулу изобретения, приведены ниже. Необходимо заметить, что, как в описании, так и в формуле изобретения формы существительного единственного числа включают в себя и множественное число, если из контекста не следует обратное.
"Агонист" относится к соединению, которое повышает активность другого соединения или места связывания с рецептором.
"Алкил" обозначает моновалентный линейный или разветвленный насыщенный углеводородный остаток, состоящий исключительно из атомов углерода и водорода, имеющий от одного до двенадцати, предпочтительно от одного до четырех атомов углерода. Примеры алкильных групп включают, без ограничения перечисленным, метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил, н-гексил, октил, додецил и им подобные.
"Алкоксигруппа" относится к остатку формулы -ORa, где Ra обозначает алкил, как здесь определено.
"Антагонист" относится к соединению, которое снижает или предотвращает активность другого соединения или места связывания с рецептором.
"Арил" обозначает моновалентный циклический ароматический углеводородный остаток, состоящий из моно- или бициклического ароматического кольца. Арильная группа может быть необязательно замещена одним, двумя или тремя, предпочтительно одним или двумя заместителями, где каждый заместитель независимо друг от друга выбран из группы, содержащей гидроксигруппу, цианогруппу, алкил, алкоксигруппу, тиоалкил, алкилтиогруппу, галоген, галогеналкил, гидроксиалкил, нитрогруппу, алкоксикарбонил, алкилкарбонил, алкилсульфонил, арилсульфонил, галогеналкилсульфонил, аминогруппу, алкиламиногруппу, диалкиламиногруппу, алкил(арил)аминогруппу, алкиламинокарбонил, алкилкарбониламиногруппу, алкилкарбонил(алкиламино), алкиламиносульфонил, алкилсульфониламиногруппу или метилендиоксигруппу, если иное не обозначено специально. Примеры арильных остатков включают, без ограничения перечисленным, необязательно замещенный фенил и необязательно замещенный нафтил и им подобные.
"Арилоксигруппа" относится к остатку формулы -ORb, где Rb обозначает арил, как здесь определено.
"Циклоалкил" обозначает моновалентный насыщенный карбоциклический остаток, состоящий из моно- или бициклических колец. Циклоалкил может быть необязательно замещен одним или несколькими заместителями, где каждый заместитель независимо друг от друга выбран из группы, содержащей гидроксигруппу, алкил, алкоксигруппу, галоген, галогеналкил, аминогруппу, моноалкиламиногруппу или диалкиламиногруппу, если иное не обозначено специально. Примеры циклоалкильных остатков включают, без ограничения перечисленным, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и им подобные.
"Болезненное состояние" обозначает любую болезнь, состояние, симптом или признак.
Термины "гало", "галоид" и "галоген" применяются здесь взаимозаменяемо и относятся к заместителям фтор, хлор, бром или иод, предпочтительно фтор или бром.
"Галогеналкил" обозначает алкил, как определено здесь, в котором один или несколько атомов водорода заменены одинаковыми или разными атомами галогена. В качестве примеров галогеналкилов можно назвать -СН2Cl, -СН2CF3, -СН2CCl3, перфторалкил (например, -CF3) и им подобные.
"Гетероарил" обозначает моновалентный моно-, би- или трициклический ароматический остаток из 5-12 кольцевых атомов, содержащий один, два, три или четыре кольцевых гетероатома, выбранных из N, О или S, а остальные кольцевые атомы являются углеродом (С). Гетероарильное кольцо необязательно замещено независимо друг от друга одним или несколькими заместителями, преимущественно одним или двумя заместителями, выбранными из группы, содержащей гидроксигруппу, цианогруппу, алкил, алкоксигруппу, тиоалкил, алкилтиогруппу, галоген, галогеналкил, гидроксиалкил, нитрогруппу, алкоксикарбонил, алкилкарбонил, алкилсульфонил, арилсульфонил, галогеналкилсульфонил, аминогруппу, алкиламиногруппу, диалкиламиногруппу, алкил(арил)аминогруппу, алкиламинокарбонил, алкилкарбониламиногруппу, алкилкарбонил(алкиламино), алкиламиносульфонил, алкилсульфониламиногруппу или метилендиоксигруппу. Более конкретно термин гетероарил включает, без ограничения перечисленным, пиридил, фуранил, тиофенил, тиазолил, изотиазолил, триазолил, имидазолил, изоксазолил, пирролил, пиразолил, пиримидинил, бензофуранил, изобензофуранил, бензотиазолил, бензоизотиазолил, бензотриазолил, индолил, изоиндолил, бензоксазолил, хинолил, изохинолил, бензимидазолил, бензизоксазолил, бензотиофенил, дибензофуран и бензодиазепин-2-он-5-ил и им подобные.
"Гетероциклил" обозначает моновалентный насыщенный остаток, состоящий из одного до трех колец, содержащих один, два или три гетероатома (выбранных из азота, кислорода или серы). Гетероциклическое кольцо представляет собой необязательно замещенное независимо друг от друга одним или несколькими заместителями, преимущественно одним или двумя заместителями, выбранными из группы, содержащей гидроксигруппу, цианогруппу, алкил, алкоксигруппу, тиоалкил, алкилтиогруппу, галоген, галогеналкил, гидроксиалкил, нитрогруппу, алкоксикарбонил, алкилкарбонил, алкилсульфонил, арилсульфонил, галоалкилсульфонил, аминогруппу, алкиламиногруппу, диалкиламиногруппу, алкил(арил)аминогруппу, алкиламинокарбонил, алкилкарбониламиногруппу, алкилкарбонил(алкиламино), алкиламиносульфонил, алкилсульфониламиногруппу или метилендиоксигруппу. Более конкретно термин гетероциклил включает, без ограничения перечисленным, примеры гетероциклильных остатков, включающие, без ограничения перечисленным, морфолинил, пиперазинил, пиперидинил, пирролидинил, тетрагидропиранил, азитидинил и им подобные.
"Уходящая (удаляемая) группа" обозначает группу со значением, традиционно связанным с этим понятием в синтетической органической химии, т.е. атом или группу, замещаемую в условиях реакции замещения. Должно быть принято во внимание, что конкретная уходящая группа зависит от реакционных условий, включая атом, к которому уходящая группа присоединена. Например, удаляемыми группами для сульфонильных соединений являются, без ограничения перечисленным, галогены, сульфонаты и им подобные.
"Модулятор" обозначает молекулу, которая взаимодействует с целью (мишенью). Взаимодействия включают, без ограничения перечисленным, агонист, антагонист и им подобные, как здесь определено.
"Необязательный" или "необязательно" означает, что впоследствии описанное событие или условие может иметь место, но не обязательно выполняется и что описание включает примеры, где событие или условие происходит (выполняется) и примеры, в которых событие или условие не происходит (не выполняется).
"Инертный органический растворитель" или "инертный растворитель" означает, что растворитель является инертным (нейтральным) в описанных условиях реакции. Например: бензол, толуол, ацетонитрил, тетрагидрофуран (ТГФ), N,N-диметилформамид (ДМФА), хлороформ, метилен хлорид или дихлорметан, дихлорэтан, диэтиловый эфир, этилацетат, ацетон, метилэтилкетон, метанол, этанол, пропанол, изопропанол, трет-бутанол, диоксан, пиридин и им подобные. Если не указано обратное, растворители, используемые в настоящем изобретении, представляют собой инертные растворители.
"Фармацевтически приемлемый" означает применимый для приготовления фармацевтической композиции благодаря своей общей безопасности, нетоксичности и не являющийся ни биологически, ни как-либо иначе нежелательным и допустимым для ветеринарного и медицинского фармакологического использования.
"Фармацевтически приемлемые соли" соединения означает, что соли фармацевтически приемлемы, как определено здесь, и что они обладают требуемой фармакологической активностью исходного соединения. Такие соли включают: кислые соли присоединения образованы добавлением неорганических кислот, таких как хлористоводородная (соляная) кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и им подобные; или образованные добавлением органических кислот, таких как уксусная кислота, бензолсульфоновая кислота, бензойная, камфорсульфоновая кислота, лимонная кислота, этансульфоновая кислота, фумаровая кислота, глюкогептоновая кислота, глюконовая кислота, глутаминовая кислота, гликолевая кислота, гидроксинафтойная кислота, 2-гидроксиэтансульфоновая кислота, молочная кислота, малеиновая кислота, яблочная кислота, малоновая кислота, миндальная кислота (2-гидрокси-2-фенилуксусная кислота), метансульфоновая кислота, муконовая кислота, 2-нафталенсульфоновая кислота, пропионовая кислота, салициловая кислота, янтарная кислота, винная кислота, п-толуолсульфоновая кислота, трифторуксусная кислота, триметилуксусная кислота и им подобные; или соли, образующиеся, когда присутствующий в исходном соединении кислотный протон либо замещается на ион металла, например, ион щелочного металла, ион щелочноземельного металла или ион алюминия; либо координируется с органическим или неорганическим основанием. Приемлемые органические основания включают диэтаноламин, этаноламин, N-метилглюкамин, триэтаноламин, трометамин и им подобные. Приемлемые неорганические основания включают гидроокись алюминия, гидроокись кальция, гидроокись калия, карбонат натрия и гидроокись натрия.
Предпочтительными фармацевтически приемлемыми солями являются соли, образованные уксусной кислотой, хлористоводородной кислотой, серной кислотой, метансульфоновой кислотой, малеиновой кислотой, фосфорной кислотой, винной кислотой, лимонной кислотой, натрием, калием, кальцием, цинком и магнием.
Подразумевается, что все ссылки на фармацевтически приемлемые соли включают формы с добавленным растворителем (сольваты) или кристаллические формы (полиморфы), как здесь определено, тех же кислых солей, присоединения.
"Пролекарство" или "про-лекарство" означает фармакологически неактивную форму соединения, которая должна быть метаболизирована in vivo субъектом после введения, например, биологическими жидкостями или ферментами, в фармакологически активную форму соединения, для того чтобы получить желаемый фармакологический эффект. Пролекарство может быть метаболизировано перед всасыванием, в процессе всасывания, после всасывания или на определенном месте. Хотя для многих соединений метаболизм происходит главным образом в печени, почти все другие ткани и органы, особенно легкие, способны в той или иной степени осуществлять метаболизм. Пролекарственные формы соединений могут быть использованы, например, для улучшения биодоступности, улучшения переносимости путем маскировки или снижения неприятых свойств, таких как горький вкус или раздражение желудочно-кишечного тракта, изменения растворимости в случае внутривенного использования, для обеспечения пролонгированного или поддерживаемого замедленного высвобождения или доставки, упрощения лекарственной формы или обеспечения специфической-по-месту доставки соединения. Ссылка на соединение здесь включает Пролекарственные формы соединения.
"Защитная группа" или "защищающая группа" означает группу, которая выборочно блокирует одно реакционное положение в многофункциональном соединении, так что химическая реакция может проходить селективно по другому незащищенному реакционному положению, в значении, традиционно связанном с этим понятием в синтетической химии. Некоторые способы настоящего изобретения опираются на защитные группы для атомов азота и/или кислорода, присутствующих в реактантах. Например, термины "аминозащитная группа" и "азотзащищающая группа" используются здесь взаимозаменяемо и относятся к органическим группам, нуждающимся в защите атома азота от нежелательных реакций в процессе синтеза. Примеры азот защищающих групп включают в себя, без ограничения перечисленным, трифторацетил, ацетамидогруппу, бензил (Бн), бензилоксикарбонил (карбобензилокси, КБЗ), п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, трет-бутоксикарбонил (БОК) и им подобные. Аналогично термин "гидроксизащищающая группа" относится к органическим группам, нуждающимся в защите атома кислорода гидроксильной группы от нежелательных реакций в процессе синтеза. Примеры гидрокси защищающих группы включают в себя, без ограничения перечисленным, бензил, силильные группы, тетрагидропиранил, сложные эфиры и им подобные. Квалифицированный в данной области специалист знает, как выбрать группу, которую легко удалить, но которая способна выдержать последующие реакции.
"Сольваты" обозначают формы с добавленным растворителем, которые содержат либо стехиометрическое или нестехиометрическое количество растворителя. Некоторые соединения имеют тенденцию захватывать фиксированное молярное отношение молекул растворителя в кристаллическом твердом состоянии, образуя таким образом сольват. Если растворитель - вода, образующиеся сольваты являются гидратами, когда растворитель - спирт, образующиеся сольваты являются алкоголятами. Гидраты образуются комбинацией одной или нескольких молекул воды с одним из веществ, в которой вода сохраняет свое молекулярное состояние как Н2О, такая комбинация способна образовывать один или несколько гидратов.
"Субъект" означает млекопитающие и немлекопитающие. Млекопитающие означают любого представителя класса млекопитающих, включая, без ограничения перечисленным, людей, нечеловекообразных приматов, таких как шимпанзе и другие виды обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы и свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов типа крыс, мышей и морских свинок и т.п. Примеры немлекопитающих включают в себя, без ограничения перечисленным, птиц и т.п. Термин "субъект" не обозначает определенный возраст или пол.
"Терапевтически эффективное количество" обозначает такое количество вещества, которое при введении субъекту для лечения болезненного состояния является достаточным, чтобы оказать лечебный эффект на болезненное состояние. "Терапевтически эффективное количество" изменяется в зависимости от соединения, болезненного состояния, подлежащего лечению, серьезности заболевания, возраста и состояния здоровья субъекта, пути и способа введения, заключения лечащего медицинского или ветеринарного врача и других факторов.
Термины "определено выше" и "определено здесь", касающиеся переменной, сопровождаются рекомендацией широкого определения переменной, а также такими определениями, как предпочтительно, более предпочтительно и наиболее предпочтительно, если таковые имеются.
"Обработка" или "лечение" болезненного состояния включает в себя:
(i) предупреждение (профилактику) болезненного состояния, т.е. предотвращение развития клинических симптомов болезненного состояния у субъекта, который может подвергнуться или предрасположен к болезненному состоянию, но еще не испытывает или не проявляет симптомов болезненного состояния.
(ii) подавление болезненного состояния, т.е. остановку развития болезненного состояния или его клинических признаков, или
(iii) облегчение болезненного состояния, т.е. порождение временной или постоянной регрессии болезненного состояния или его клинических симптомов.
Термины "обработка", "взаимодействие" и "реагирование", относящиеся к химической реакции, означают добавление или смешивание двух или более реагентов при соответствующих условиях для получения указанного и/или требуемого продукта. Нужно понимать, что указанный и/или требуемый продукт реакции не обязательно образуется непосредственно при взаимодействии двух реагентов, которые были добавлены первоначально, то есть возможно образование одного или нескольких промежуточных в реакционной смеси, которые в конечном итоге приводят к образованию указанного и/или требуемого продукта.
В целом использованная в этой заявке терминология основана на AUTONOM™ v.4.0, компьютеризированная система Института Бельштейна для генерации систематической номенклатуры ИЮПАК.
В одном аспекте настоящее изобретение относится к соединению формулы
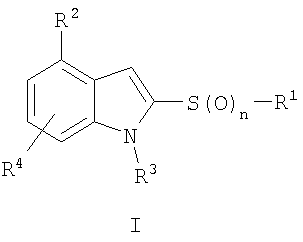
фармацевтически приемлемой его соли или пролекарству,
где
n обозначает 0, 1 или 2; предпочтительно n обозначает 2;
р обозначает 1 или 2, предпочтительно р обозначает 1;
R1 обозначает арил или гетероарил;
R2 обозначает гетероциклил;
R3 обозначает водород, алкил или -C(=O)-R5, где R5 обозначает алкил, алкоксигруппу, арил или арилоксигруппу; и
каждый R4 независимо друг от друга выбран из группы, содержащей водород, гидроксигруппу, цианогруппу, алкил, алкоксигруппу, тиоалкил, алкилтиогруппу, галоген, галогеналкил, гидроксиалкил, нитрогруппу, алкоксикарбонил, алкилкарбонил, алкилсульфонил, арилсульфонил, галогеналкилсульфонил, аминогруппу, алкиламиногруппу, диалкиламиногруппу, алкил(арил)аминогруппу, алкиламинокарбонил, алкилкарбониламиногруппу, алкилкарбонил(алкиламино), алкиламиносульфонил, алкилсульфониламиногруппу или метилендиоксигруппу; предпочтительно R4 обозначает водород, алкил, алкоксигруппу, галоген или галогеналкил.
Следует понимать, что объем притязаний данного изобретения охватывает не только различные изомеры, которые могут существовать, но и различные смеси изомеров, которые могут образовываться. Кроме того, объем притязаний настоящего изобретения охватывает сольваты и соли соединений формулы I.
Предпочтительно R1 обозначает тиенил или фенил, которые необязательно замещены одним или несколькими заместителями, выбранными из группы, содержащей алкил, алкоксигруппу, галоген, галогеналкил, -SO2-Ra, -NRaRb, -NRb-C(=O)-Ra, где Ra обозначает алкил или арил, а Rb обозначает водород или алкил и смесь их. Более предпочтительно R1 обозначает тиен-2-ил, фенил, 2,3-дихлорфенил, 2-фторфенил, 2-метилфенил, 2-трифторметилфенил или 3-бромфенил.
Предпочтительно R2 обозначает необязательно замещенный пиперазинил или пиперидинил. Более предпочтительно R обозначает необязательно замещенный пиперазин-1-ил или пиперидин-4-ил. Еще более предпочтительно R2 обозначает пиперазин-1-ил, 4-метилпиперазин-1-ил, 3,5-диетилпиперазин-1-ил, N-метил пиперидин-4-ил или пиперидин-4-ил. В одном частном случае, R2 обозначает 4-метилпиперазин-1-ил.
Предпочтительно R3 обозначает водород или метил.
Предпочтительно R4 обозначает водород.
Более того, комбинации описанных здесь предпочтительных групп образуют другие предпочтительные варианты. Например, в одном особенно предпочтительном варианте R1 обозначает фенил, n обозначает 2, R2 обозначает пиперазин-1-ил, R3 обозначает водород или метил и R4 обозначает водород. Таким образом, границы настоящего изобретения охватывают целый ряд предпочтительных соединений.
Некоторые характерные соединения формулы I показаны в таблице 1 ниже:
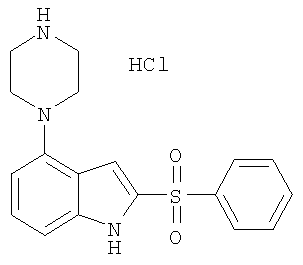
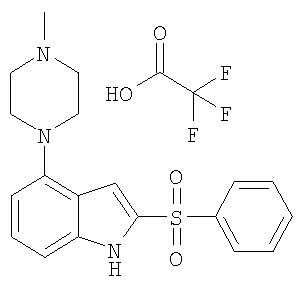
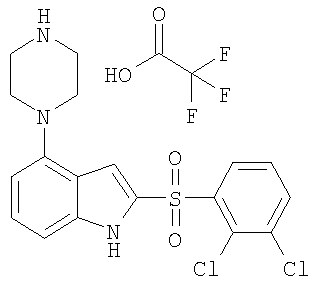
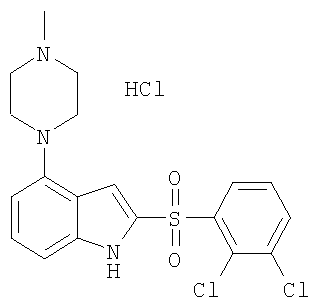
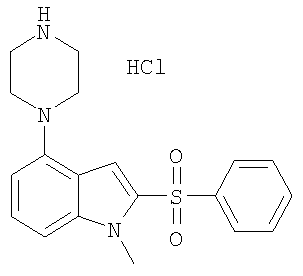
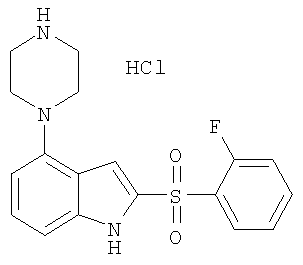
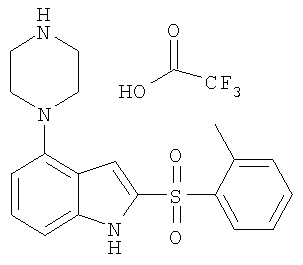
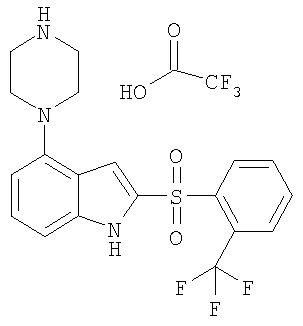
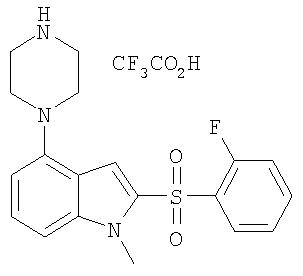
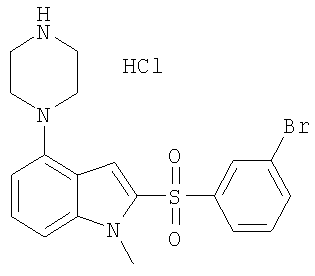
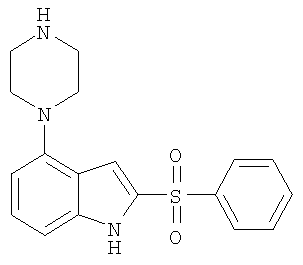
Другой объект настоящего изобретения относится к композиции, содержащей терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель.
Следующий объект настоящего изобретения представляет собой способ лечения болезненного состояния ЦНС субъекта, заключающийся во введении субъекту терапевтически эффективного количества соединения формулы I. Предпочтительно болезненное состояние включает психозы, шизофрению, маниакальную депрессию, неврологические заболевания, болезни памяти, синдром дефицита внимания, болезнь Паркинсона, амиотрофический боковой склероз, болезнь Альцгеймера и болезнь Хантингтона.
Еще один объект настоящего изобретения представляет собой способ лечения заболевания желудочно-кишечного тракта субъекта, заключающийся во введении субъекту терапевтически эффективного количества соединения формулы I.
Дополнительный объект настоящего изобретения представляет собой способ лечения ожирения субъекта, заключающийся во введении субъекту терапевтически эффективного количества соединения формулы I.
Другой объект настоящего изобретения представляет собой способ получения соединения формулы I.
Соединения настоящего изобретения могут быть получены различными способами, изображенными на иллюстративных схемах реакций синтеза, показанных и описанных ниже.
Исходные материалы и реагенты, используемые для получения этих соединений, в целом либо взяты у коммерческих поставщиков, таких как Aldrich Chemical Co., либо получены по известным методикам, описанным в таких источниках, как Л.Физер и М.Физер Реагенты для Органического Синтеза; (Wiley и Sons): Нью-Йорк, 1991, т.т.1-15; Родд Химия Углеродных Соединений, Elsevier Science Publishers, 1989, т.т.1-5 и Приложения; и Органические Реакции, Wiley & Sons, Нью-Йорк, 1991, т.т.1-40. Последующие схемы реакций синтеза просто иллюстрируют некоторые способы, которыми могут быть синтезированы соединения настоящего изобретения, могут быть сделаны различные модификации к этим схемам синтетических реакций и предложены специалистам-синтетикам со ссылкой на описание, содержащееся в этой Заявке.
Исходные материалы и интермедиаты реакций синтеза могут быть выделены и очищены согласно традиционным методикам, включающим, без ограничения перечисленным, фильтрацию, перегонку (дистилляцию), кристаллизацию, хроматографирование и им подобные. Такие материалы могут быть охарактеризованы традиционными способами, включая физические константы и спектральные данные.
Если не указано обратное, описанные здесь реакции предпочтительно проводятся в инертной среде при атмосферном давлении в температурном режиме реакции от приблизительно -78°С до приблизительно 150°С, более предпочтительно от приблизительно 0°С до приблизительно 125°С и наиболее предпочтительно и удобно при приблизительно комнатной (или окружающей) температуре, например приблизительно 20°С.
В одном варианте соединения формулы I получают депротонированием замещенного индола формулы
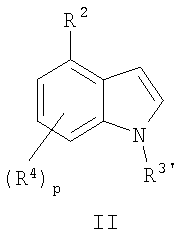
с помощью основания при добавлении сульфонилирующего агента формулы Y- SO2-R1, где R1, R2 и R4 определены здесь, R3' обозначает алкил или -C(=O)-R5, где R5 обозначает определенный здесь радикал, а Y обозначает удаляемую группу, предпочтительно галоген и более предпочтительно фтор. Следует отметить, что когда R2 и/или R4 имеют один или несколько кислотных протона (относительно используемого основания), они должны быть защищены соответствующей защитной группой. Подходящие защитные группы для таких кислотных протонов хорошо известны специалистам-синтетикам и зависят от природы кислотного протона, например, является ли протон амино протоном или гидрокси протоном, и т.д.
Основание должно быть достаточно сильным, чтобы депротонировать прежде всего 2-положение индольного кольца. Такие основания хорошо известны специалистам-синтетикам и включают металлоорганические соединения, такие как литий-органические соединения, например трет-бутиллитий, и реактивы Гриньяра, например галоид трет-бутилмагния. В целом реакция депротонирования проводится при температуре приблизительно 0°С или ниже, предпочтительно около -40°С или ниже и более предпочтительно около -70°С или ниже. Обычно депротонирование проводят при приблизительно -75°С.
Подходящий сульфонилирующий агент включает арилсульфонилгалиды, например арилсульфонилфториды. Арилсульфонилфториды легко могут быть получены из соответствующих арилсульфонилхлоридов обработкой с источником фтора, таким как фторид калия, или другими подходящими металлическими соединениями фтора. Превращение арилсульфонилхлорида в соответствующее производное фтора обычно представляет собой реакцию арилсульфонилхлорида с фторидом калия в инертном органическом растворителе, таком как 1,4-диоксан. Реакция в целом проходит в условиях кипячения в течение периода от приблизительно 1 до приблизительно 48 часов, обычно приблизительно 24 часа. Обычно в реакции используется избыток фторида калия, который может быть легко удален в процессе обработки промыванием водой. Полученный арилсульфонилфторид обычно используют без дальнейшей очистки.
Альтернативно соединение формулы I может быть также получено взаимодействием депротонированной индольной группы с дисульфидным реагентом формулы R1-S-S-R1 с получением тиоэфира формулы
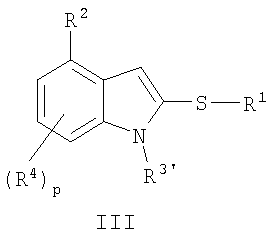
где R1, R2, R3' и R4 определены здесь. Обычно дисульфидный реагент добавляют к депротонированному индолу при той же температуре, при которой добавлено основание. Реакционную смесь затем перемешивают при этой же температуре от нескольких минут до нескольких часов, обычно приблизительно от 1 до 2 часов, и позволяют постепенно согреться до к.т.
Тиоэфирное соединение формулы III может быть окислено окисляющим агентом с получением соответствующего сульфоксида и/или сульфона. Подходящий окисляющий агент представляет собой мета-хлорпербензойную кислоту (МХПБК), периодаты, Оксон®, а также другие известные специалистам-синтетикам окисляющие серу агенты. Например, тиоэфир III может реагировать с МХПБК при смешивании двух реагентов при приблизительно 0°С в инертном растворителе, таком как дихлорметан, и перемешивании смеси при к.т. в течение нескольких часов. Избыток МХПБК обычно удаляют промыванием водным, предпочтительно основным водным раствором. Любое нежелательное окисление атома азота может быть подавлено гашением сырого продукта фосфиновым соединением, таким как трифенилфосфин.
Когда R1 или R2 группа содержит защитную группу или когда R3' обозначает защитную группу, такая защитная группа может быть удалена по окончании синтеза в реакционных условиях, традиционно известных специалистам-синтетикам. В качестве примера можно указать ссылку: Защитные Группы в Органическом Синтезе, 3-е издание, T.W.Greene и P.G.M.Wuts, John Wiley и Sons, Нью-Йорк, 1999, которая включена здесь полностью.
Более подробно детали получения соединений формулы I описаны в разделе примеры.
Удивительно и неожиданно авторы настоящего изобретения обнаружили, что соединения индола, имеющие заместитель -S(O)nR1 в положении 2, обладают фармакологической активностью в широких пределах, которая отсутствует у соответствующих индолов, не имеющих такого заместителя в положении 2. Например, соединения, представленные настоящим изобретением, обладают селективным сродством к рецептору 5-ГТ6 и применимы в лечении некоторых болезней ЦНС, таких как болезнь Паркинсона, болезнь Хантингтона, тревожность, депрессия, маниакальная депрессия, психоз, эпилепсия, навязчивый невроз, мигрень, болезнь Альцгеймера (улучшение познавательной памяти), нарушения сна, нарушения обмена веществ (питания), такие как потеря аппетита (анорексия) и повышенное чувство голода (булемия), острые тревожные состояния с реакцией паники, синдром дефицита внимания с гиперактивностью (СДВГ), синдром дефицита внимания (СДВ), болезнь отмены приема наркотиков, таких как кокаин, этанол, никотин и бензодиазепины, шизофрения, а также заболевания, связанные с травмами позвоночника и/или травмами головы, такие как гидроцефалия (водянка головного мозга). Кроме того, соединения настоящего изобретения полезны при лечении некоторых ЖК (желудочно-кишечных) заболеваний, таких как функциональные кишечные расстройства.
Фармакология соединений, представленных этим изобретением, была определена общепризнанными методами. In vitro методы определения в лабораторных условиях сродства тестируемых соединений к рецептору 5-ГТ6 в радиолигандном связывании и функциональные исследования описаны в Примерах 6-8.
Настоящее изобретение включает фармацевтические композиции, содержащие по крайней мере одно соединение настоящего изобретения, либо индивидуальный изомер, рацемическую или нерацемическую смесь изомеров, либо его фармацевтически приемлемую соль или его сольват, вместе с по крайней мере одним фармацевтически приемлемым носителем и необязательно другими терапевтическими и/или профилактическими составляющими.
В целом соединения, представленные настоящим изобретением, вводятся в терапевтически эффективных количествах любым общепринятым для агентов, которые служат подобным целям, способом введения. Соответствующие диапазоны доз составляют обычно 1-500 мг ежедневно, предпочтительно 1-100 мг ежедневно и наиболее предпочтительно 1-30 мг ежедневно в зависимости от ряда факторов, таких как тяжесть заболевания, возраст и состояние здоровья субъекта, эффективности используемого соединения, пути и способа введения, показаний, по которым назначено введение, а также от предпочтений и опыта медицинского работника. Для определения терапевтически эффективных количеств соединений настоящего изобретения для заданного заболевания достаточно обыкновенного опыта лечения подобных заболеваний без чрезмерного экспериментирования, полагаясь на персональные знания и описание данной заявки.
Обычно соединения, соответствующие настоящему изобретению, вводятся в виде фармацевтических составов, включая лекарственные формы, подходящие для орального (включая защечные и подъязычные формы), ректального, назального, местного, легочного, вагинального или парентерального (включая внутримышечный, внутриартериальный, интратекальный (подоболочечный), подкожный и внутривенный) способов введения или в форме, подходящей для введения ингаляцией или вдуванием (нагнетанием). Предпочтительный способ введения в целом оральный с использованием удобного режима суточных доз, которые могут быть подобраны соответственно степени заболевания.
Соединение или соединения настоящего изобретения вместе с одним или несколькими обычными вспомогательными средствами, носителями или разбавителями могут быть приготовлены в форме фармацевтических композиций и единичных лекарственных доз. Формы фармацевтических композиций и единичных (разовых) дозировок могут быть составлены из традиционных ингредиентов в обычных пропорциях с добавлением дополнительных активных соединений или компонентов или без них, и единичные лекарственные формы могут содержать любое соответствующее эффективное количество активного ингредиента, соразмерное с назначенным суточным диапазоном используемых доз. Фармацевтические композиции можно использовать в твердом виде, т.е. в форме таблеток или заполненных капсул, полутвердом виде, таком как порошки, лекарственные формы с замедленным высвобождением или в виде жидкостей, т.е. растворов, суспензий, эмульсий, эликсиров; или заполненных капсул для орального использования; или в виде суппозиториев для ректального или вагинального введения; или в виде стерильных инъекционных растворов для парентерального использования. Составы, содержащие около одного (1) миллиграмма активного ингредиента или, более широко, от около 0,01 до около ста (100) миллиграмм на таблетку, являются соответственно типичными образцами единичных лекарственных форм.
Соединения настоящего изобретения могут быть приготовлены в широком многообразии видов дозированных форм для перорального введения. Фармацевтические композиции и дозированные лекарственные формы могут содержать соединение или соединения настоящего изобретения или их фармацевтически приемлемые соли в качестве активных компонентов. Фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Твердые лекарственные формы препаратов включают порошки, таблетки, пилюли, капсулы, саше, суппозитории и дисперсные гранулы. Твердым носителем может быть одно или несколько веществ, которые могут также действовать как разбавители, вкусовые добавки, разжижающие агенты, смазочные агенты, суспендирующие компоненты, связующие вещества, консерванты, агенты для разрушения таблетки или инкапсулирующие материалы. В порошках носитель обычно представляет собой тонко размельченное твердое вещество, которое смешано с тонко измельченным активным компонентом. В таблетках активный компонент обычно смешан в соответствующих пропорциях с носителем, имеющим необходимую связующую способность, и уплотнен до требуемого размера и формы. Порошки и таблетки предпочтительно содержат от приблизительно одного (1) до приблизительно семидесяти (70) процентов активного вещества. Подходящие носители включают, без ограничения перечисленным, карбонат магния, стеарат магния, тальк, сахар, лактозу, пектин, декстрин, крахмал, желатин, трагант, метилцеллюлозу, карбоксиметилцеллюлозу натрия, низкоплавкий воск, масло какао и им подобные материалы. Термин "препарат" предназначен для включения композиции активного соединения с инкапсулирующим материалом в качестве носителя с образованием капсулы, в которой активный компонент, с наполнителем или без него, окружен носителем, который ассоциирован с ним. Подобно этому включены также саше и облатки (леденцы, пастилки). Таблетки, порошки, капсулы, пилюли, саше и облатки могут быть в виде твердых форм, подходящих для перорального приема.
Другие формы, подходящие для перорального введения, включают жидкие формы препаратов, такие как эмульсии, сиропы, эликсиры, водные растворы, водные суспензии, или твердые формы препаратов, предназначенные для быстрого превращения в жидкую форму непосредственно перед применением. Эмульсии могут быть приготовлены в растворах, например в водных пропиленгликолевых растворах, или могут содержать эмульгатор, например, такой как лецитин, моноолеат сорбита или гуммиарабик. Водные растворы могут быть приготовлены растворением активного компонента в воде с добавлением подходящих красителей, ароматизаторов, стабилизаторов и загустителей. Водные суспензии могут быть приготовлены распределением тонко измельченного активного компонента в воде с вязким материалом, таким как натуральные или синтетические смолы, камеди, метилцеллюлоза, карбоксиметилцеллюлоза натрия, и другими хорошо известными суспендирующими агентами. Твердые формы препаратов включают растворы, суспензии и эмульсии и могут содержать в дополнение к активному компоненту красители, ароматизаторы, стабилизаторы, буферы, искусственные и природные подсластители, дисперсанты, загустители, солюбилизирующие (растворяющие) компоненты и т.п.
Соединения настоящего изобретения могут быть приготовлены для парентерального введения (т.е. инъекций, например болюсное вливание или непрерывное вливание) и представлены в виде разовой дозы в ампулах, предварительно заполненных шприцах, инфузий (вливаний) небольшого объема или многодозовых контейнерах с добавлением консерванта. Композиции могут быть представлены в виде суспензий, растворов или эмульсий в масляном или водном связующем, например растворы в водном полиэтиленгликоле. Примеры масляных или неводных носителей, разбавителей или связующих материалов включают пропиленгликоль, полиэтиленгликоль, растительные масла (например, оливковое масло) и впрыскиваемые органические сложные эфиры (например, этилолеат) и могут содержать формирующие агенты, такие как консерванты, увлажнители, эмульгаторы или суспердирующие агенты, стабилизаторы и/или дисперсанты. Альтернативно активные ингредиенты могут быть в виде порошка, полученного асептическим выделением стерильного твердого вещества или лиофилизацией из раствора для подготовки перед использованием с подходящим разбавителем, например стерильной апирогенной водой.
Соединения настоящего изобретения могут быть приготовлены для местного применения на эпидермисе (коже) в виде мазей, кремов или лосьонов или в виде трансдермальных пластырей. Мази и кремы могут, например, быть приготовлены на водной или масляной основе с добавлением подходящих сгущающих и/или желирующих веществ. Лосьоны могут быть приготовлены на водной или масляной основе и, как правило, содержат также один или несколько эмульгаторов, стабилизаторов, диспергирующих агентов, суспендирующих агентов, загустителей или красителей. Лекарственные формы подходящие для местного применения во рту, представляют собой лепешки, содержащие активный компонент во вкусовой основе, обычно сахароза, гуммиарабик или трагакант; пастилки, содержащие активный компонент в инертной основе, такой как желатин и глицерин или сахароза и гуммиарабик, и жидкости для полоскания рта, содержащие активный компонент в подходящем жидком носителе.
Соединения настоящего изобретения могут быть приготовлены для введения в виде суппозиториев. Низкоплавкий воск, типа смеси глицеридов жирных кислот или масла какао, сначала растапливают и равномерно распределяют активный компонент, например, перемешиванием. Затем выливают растопленную гомогенную смесь в форму подходящих размеров, дают остыть и затвердеть.
Соединения настоящего изобретения могут быть приготовлены для вагинального введения. Маточные кольца, тампоны, кремы, гели, пасты, пены или спреи содержат помимо активного ингредиента общеизвестные соответствующие носители.
Соединения настоящего изобретения могут быть приготовлены для назального (носового) введения. Растворы или суспензии вводят непосредственно в носовую полость традиционным способом, например капельницей, пипеткой или спреем. Лекарственная форма может быть приготовлена в виде разовой дозы или мультидозы. В последнем случае при введении капельницей или пипеткой дозирование контролируется пациентом, вводящим соответствующий предопределенный объем раствора или суспензии. В случае спрея дозирование достигается, например, с помощью отмеряющего распыляемый спрей насоса.
Соединения настоящего изобретения могут быть приготовлены для аэрозольного введения, в частности, в дыхательный путь и включая внутриносовое введение. Как правило, соединение будет иметь маленький размер частиц, например порядка пяти (5) микрон или меньше. Такой размер частиц можно получить общеизвестным в данной области способом, например микронизацией. Активный ингредиент содержится в герметичной упаковке в аэрозольном баллончике с соответствующей сжатой жидкостью типа хлорфторуглерода (ХФУ), например дихлордифторметан, трихлорфторметан или дихлортетрафторэтан, или диоксид углерода, или другой подходящий газ. Аэрозоль может также содержать поверхностно-активное вещество (ПАВ) типа лецитина. Доза лекарства может контролироваться дозатором. Кроме того, активный компонент может быть представлен в виде сухого порошка, например смеси порошка соединения с соответствующим порошком-основой типа лактозы, крахмала, производных крахмала, таких как гидроксипропилметилцеллюлоза и поливинипирролидин (ПВП). Порошковый носитель образует гель в носовой полости. Порошковые композиции могут быть представлены в виде единичной лекарственной формы, например в капсулах или картриджах (ампулах, баллончиках) из, например, желатиновых или блистерных упаковок, из которых порошок вводится посредством ингаляции.
При необходимости составы могут быть приготовлены с кишечно-растворимой оболочкой, предназначенной для замедленного или контролируемого высвобождения активного ингредиента. Например, соединения настоящего изобретения могут быть приготовлены в виде трансдермальных или подкожных средств доставки лекарственного препарата. Эти системы доставки удобны, когда необходимо замедленное высвобождение соединения и когда решающим моментом является согласие пациента с режимом лечения. Соединения с трансдермальной системой доставки часто закреплены на прилипающей к коже твердой подложке. Активное соединение может быть скомбинировано с промотором проникновения, например Азоном (1-додецилазациклогептан-2-оном). Системы доставки с замедленным высвобождением вводятся подкожно в подкожный слой хирургически или инъекционно. Подкожные имплантаты содержат инкапсулированное соединение в жирорастворимой мембране, например силиконовом каучуке или биоразлагаемом полимере, например полимолочной кислоте.
Фармацевтические составы представлены преимущественно в единичных (разовых) лекарственных формах. В такой форме препарат подразделен на разовые дозы, содержащие соответствующие количества активного компонента. Единичная лекарственная форма может быть упакованным препаратом, где упаковка, содержит дискретные количества препарата типа упакованных таблеток, капсул и порошков в пробирках или ампулах. Кроме того, единичная лекарственная форма может быть капсулой, таблеткой, саше или лепешкой как таковой, либо это может быть подходящий ряд любых из этих упакованных форм.
Другие подходящие фармацевтические носители и их приготовление описаны в Remington: The Science and Practice of Pharmacy, 1995, под ред. E. W. Martin, Mack Publishing Company, 19-е издание, Easton, Pennsylvania. Представительные примеры фармацевтических составов, содержащих соединение по настоящему изобретению, описаны в примерах 6-12.
ПРИМЕРЫ
Следующие препараты и примеры приведены, чтобы дать возможность специалистам более ясно понять и опробовать на практике настоящее изобретение. Они не должны рассматриваться как ограничение объема притязаний изобретения, но просто иллюстрирующие и представляющие его.
Пример 1
Этот пример иллюстрирует способ получения соединений формулы I с использованием синтетической схемы, приведенной ниже:
2-(2-фторбензолсульфонил)-4-пиперазин-1-ил-1H-индол
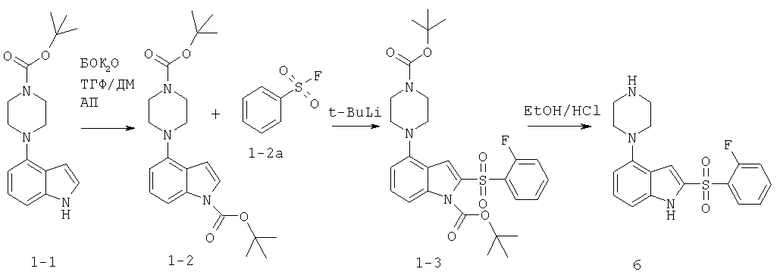
Стадия 1
К раствору индола 1-1 (1,38 г, 4,6 ммоль) в ТГФ (35 мл) при комнатной температуре (к.т.) добавляют ди-трет-бутилдикарбонат (1,0 г, 4,6 ммоль), а затем 4-диметиламинопиридин (ДМАП) (56 мг, 0,46 ммоль). Реакционную смесь перемешивают при к.т. в атмосфере азота в течение 1 часа, после чего реакционную смесь концентрируют в вакууме. Остаток распределяют между этилацетатом (50 мл) и насыщенным водным раствором бикарбоната натрия (50 мл). Органический слой промывают насыщенным раствором бикарбоната натрия (2×25 мл), затем солевым раствором (раствором хлорида натрия) (25 мл). Органический слой сушат (MgSO4), фильтруют и концентрируют с получением прозрачного масла. Масло кристаллизуют из гексана с получением 1,65 г (89%) трет-бутилоксикарбонилпиперазин-трет-бутилоксикарбонил-индола (бок-пиперазин-бок-индола) (1-2) в виде твердого вещества белого цвета.
(M+H)+=402,2.
Стадия 2а

Фторид калия (99%) (12 г, 216 ммоль) добавляют к раствору 2-фторбензолсульфонил хлорида (10 г, 51 ммоль) в 1,4-диоксане (35 мл). Реакционную смесь кипятят в течение 24 часов, затем охлаждают до комнатной температуры и выливают в ледяную воду (200 мл). Ледяную воду экстрагируют хлороформом (3×50 мл). Объединенные слои хлороформа сушат (MgSO4), фильтруют и концентрируют с получением 2-фторбензолсульфонилфторида (2а) в виде бесцветного масла 6,7 г (74%). (М+Н)+=177.
Стадия 2
К охлажденному до -75°С раствору бис-бок-индола 2 (500 мг, 1,25 ммоль) в ТГФ (25 мл) медленно добавляют трет-бутиллитий (1,47 мл, 2,5 ммоль). Реакционную смесь перемешивают в течение 30 минут с добавлением в это время 2-фторбензолсульфонил фторида 2а (222 мг, 1,5 ммоль). Реакционную смесь перемешивают 1,5 часа, в это время убирают ледяную баню и позволяют реакционной смеси согреться в течение более 45 минут. Реакционную смесь гасят насыщенным раствором хлорида аммония (55 мл). Затем смесь экстрагируют этилацетатом (3×20 мл). Объединенные слои этилацетата промывают солевым раствором (25 мл). Органический слой сушат (MgSO4), фильтруют и концентрируют с получением масла желтого цвета. Масло подвергают хроматографированию на силикагеле при элюировании гексаном/этилацетатом (17:3) с получением 300 мг (43%) 2-фенилсульфонил-4-пиперазин-1-ил-индола (1-3).
Стадия 3
2-Фенилсульфонил-4-пиперазин-1-ил индол (1-3) (300 мг, 0,54 ммоль) растворяют в 1М этанольном растворе HCl (30 мл) и нагревают до кипения. Через 2,5 часа реакционную смесь охлаждают до комнатной температуры и добавляют простой эфир (30 мл). Осадок серого цвета собирают с получением 150 мг (65%) дигидрохлорида продукта (6). (М+Н)+=360.
Соединения 1, 3, 7, 8, 9, 10 и 11 из таблицы 1, приведенной выше, синтезируют аналогично описанным выше способом:
2-бензолсульфонил-4-пиперазин-1-ил-1Н-индол,
2-(2,3-дихлорбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(толуол-2-сульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(2-трифторметилбензолсульфонил)-4-пиперазин-1-ил-1H-индол,
2-бензолсульфонил-4-(3,5-диметилпиперазин-1-ил)-1Н-индол,
2-(3-бромбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(тиофен-2-сульфонил)-4-пиперазин-1-ил-1Н-индол.
Пример 2
Этот пример иллюстрирует способ алкилирования пиперазинового остатка соединений формулы I.
2-бензолсульфонил-4-(4-метилпиперазин-1-ил)-1Н-индол
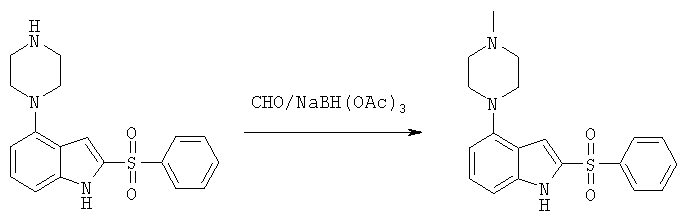
К раствору свободного основания соединения 1 из таблицы 1 (269 мг, 0,79 ммоль) и формальдегида (30%) (0,3 мл, 3,97 ммоль) в ТГФ (20 мл) в атмосфере инертного газа одной порцией добавляют триацетоксиборгидрид натрия (250 мг, 1,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 24 часов, затем концентрируют в вакууме. Остаток распределяют между 1М гидроокисью натрия (25 мл) и этилацетатом (25 мл). Водный слой экстрагируют этилацетатом (2×15 мл). Объединенные органические слои сушат (MgSO4), фильтруют и концентрируют. Оставшееся масло подвергают хроматографированию на силикагеле при элюировании дихлорметаном/метанолом (5:1) с получением продукта в виде прозрачного масла (140 мг, 0,39 ммоль). Трифторуксусную соль масла получают растворением масла в дихлорметане (10 мл) и добавлением трифторуксусной кислоты (ТФК) (90 мг, 0,79 ммоль). Дихлорметан упаривают и оставшееся масло кристаллизуют из этанола с получением 110 мг (39%) соединения 2 из таблицы 1. М+Н=356.
Соединения 4 и 12 из таблицы 1, приведенной выше, синтезируют аналогично описанным выше способом:
2-(2,3-Дихлорбензолсульфонил)-4-(4-метилпиперазин-1-ил)-1Н-индол,
2-(2-Фторбензолсульфонил)-4-(4-метилпиперазин-1-ил)-1Н-индол.
Пример 3
Этот пример иллюстрирует другой способ получения соединений формулы I.
2-бензолсульфонил-1-метил-4-пиперазин-1-ил-1Н-индол
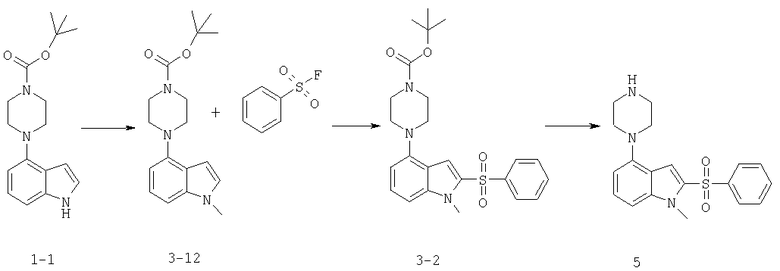
Стадия 1
К раствору индола 1-1 (500 мг, 1,7 ммоль) в ТГФ (20 мл) в атмосфере азота добавляют трет-бутоксид калия (223 мг, 2,0 ммоль). Реакционную смесь перемешивают в течение 30 минут, в это время добавляют иодометан (0,16 мл, 2,5 ммоль). Реакционную смесь перемешивают в течение 3 часов, затем гасят водой (20 мл) и экстрагируют этилацетатом (2×30 мл). Слой этилацетата промывают солевым раствором (25 мл), сушат (MgSO4), фильтруют и концентрируют с получением масла зеленого цвета (540 мг, 1,6 ммоль). Масло подвергают хроматографированию на силикагеле при элюировании этилацетатом/гексаном (1:6) с получением 420 мг (80%) соединения 3-1 в виде твердого вещества белого цвета. М+Н=316.
Стадия 2
К охлажденному до -75°С раствору N-метилиндольного соединения 3-1 (330 мг, 1,05 ммоль) в ТГФ (25 мл) медленно добавляют трет-бутиллитий (t-BuLi) (1,2 мл, 2,1 ммоль). Реакционную смесь перемешивают в течение 30 минут при -75°С, затем согревают на ледяной бане в течение 15 минут. Реакционную смесь повторно охлаждают до -75°С и добавляют бензолсульфонилфторид (0,2 мл, 1,6 ммоль). Реакционную смесь перемешивают холодной в течение 1,5 часов, в это время ледяную баню убирают и позволяют реакционной смеси нагреться до к.т.(45 мин). Реакцию гасят насыщенным раствором хлорида аммония (55 мл) и экстрагируют этилацетатом (3×20 мл). Объединенные слои этилацетата промывают солевым раствором (25 мл), сушат (MgSO4), фильтруют и концентрируют с получением масла желтого цвета. Масло подвергают хроматографированию на силикагеле при элюировании гексаном/этилацетатом (4:1) с получением 190 мг (40%) продукта (3-2).
Стадия 3
Индол 3-2 (190 мг, 0,54 ммоль) растворяют в 1М этанольном растворе HCl (30 мл) и нагревают до кипения. Через 2,5 часа реакционную смесь охлаждают до комнатной температуры и добавляют простой эфир (30 мл). Осадок белого цвета собирают с получением 130 мг (87%) дигидрохлорида соединения 5 из таблицы 1. М+Н=356.
Соединения 4 и 12 из таблицы 1, приведенной выше, синтезируют аналогично описанным выше способом:
2-(2-Фторбензолсульфонил)-1-метил-4-пиперазин-1-ил-1Н-индол,
2-(3-бромбензолсульфонил)-1-метил-4-пиперазин-1-ил-1Н-индол.
Пример 4
Этот пример иллюстрирует способ получения соединений формулы I, где R обозначает пиперидин-4-ил, с использованием схемы синтеза, приведенной ниже:
2-Бензолсульфонил-4-пиперидин-4-ил-1Н-индол
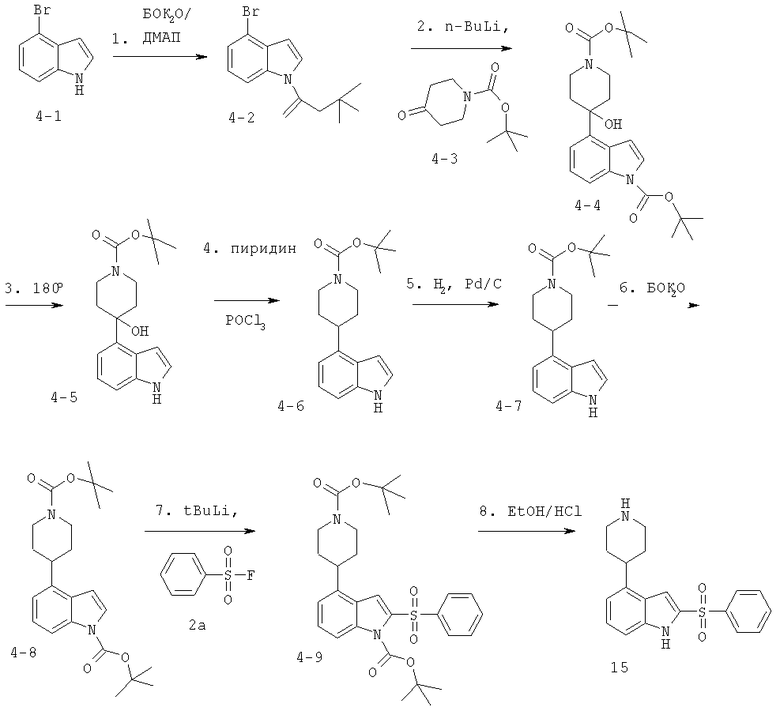
Стадия 1
Ди-трет-бутилдикарбонат (17 г, 76,5 ммоль) добавляют к раствору 4-броминдола 4-1 (10 г, 51 ммоль) и ДМАП (0,62 г, 0,51 ммоль) в ТГФ (120 мл). Реакционную смесь перемешивают в течение 15 минут и затем отгоняют. Оставшееся масло распределяют между простым эфиром и водой. Эфирный слой промывают 3×50 мл насыщенного раствора бикарбоната натрия и 1×75 мл солевого раствора. Эфирный слой сушат над сульфатом магния, фильтруют и отгоняют. Оставшееся масло коричневого цвета подвергают хроматографированию на силикагеле при элюировании смесью 1:100 этилацетат: гексан с получением 15 г (100% выход) трет-бутилового эфира 4-броминдол-1-карбоновой кислоты 4-2.
Стадия 2
Раствор трет-бутилового эфира 4-броминдол-1-карбоновой кислоты 4-2 (4,9 г, 16,5 ммоль) в ТГФ (150 мл) в атмосфере аргона охлаждают до -70°С и в течение более 20 минут добавляют н-бутиллитий (n-BuLi) (12,4 мл, 24,8 ммоль). Реакционную смесь нагревают до -5°С в ледяной бане и перемешивают при этой температуре в течение 30 минут. Смесь охлаждают до -70°С и в течение более 15 минут добавляют раствор N-Бок-пиперидона 4-3 (3,3 г, 16,5 ммоль) в ТГФ (10 мл). Реакционную смесь перемешивают в течение 45 минут при -70°С и затем нагревают до комнатной температуры. Реакцию гасят насыщенным раствором хлорида аммония (75 мл) и распределяют между водой (25 мл) и этилацетатом (75 мл). Органический слой промывают водой (50 мл) и солевым раствором (50 мл), затем сушат (MgSO4), фильтруют и концентрируют. Оставшееся масло коричневого цвета хроматографируют элюированием смесью этилацетат: гексан (1:9) с получением 1,32 г (19% выход) трет-бутилового эфира 4-(1-трет-бутоксикарбонил-4-гидроксипиперидин-4-ил)индол-1-карбоновой кислоты 4-4.
Стадия 3
трет-Бутиловый эфир 4-(1-трет-бутоксикарбонил-4-гидроксипиперидин-4-ил)индол-1-карбоновой кислоты 4-4 (1,32 г, 3,17 ммоль) нагревают до 180°С под вакуумом, пока не прекращается кипение. Реакционную смесь охлаждают до затвердевания с получением трет-бутилового эфира 4-гидрокси-4-(1Н-индол-4-ил)пиперидин-1-карбоновой кислоты (1,0 г, 100% выход) 4-5.
Стадия 4
трет-Бутиловый эфир 4-гидрокси-4-(1Н-индол-4-ил)пиперидин-1-карбоновой кислоты 4-5 (1,0 г, 3,17 ммоль) смешивают с пиридином (20 мл) и хлорокисью фосфора (0,7 мл, 7,4 ммоль) при комнатной температуре в атмосфере азота и перемешивают в течение ночи. Реакционную смесь распределяют между этилацетатом (55 мл) и водой (55 мл). Слой этилацетата промывают водой (2×30 мл) и солевым раствором (55 мл), затем сушат (MgSO4), фильтруют и концентрируют с получением (670 мг, 71%) трет-бутилового эфира 4-(1Н-индол-4-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты 4-6.
Стадия 5
Смесь трет-бутилового эфира 4-(1Н-индол-4-ил)-3,6-дигидро-2Н-пиридин-1-карбоновой кислоты 4-6 (670 мг, 2,24 ммоль) и 10% Pd/C (70 мг) в этаноле (75 мл) помещают в атмосфере Н2 на устройство для встряхивания (шейкер Парра) при 50 фунт/дюйм2 и встряхивают в течение ночи. Реакционную смесь фильтруют через насадку из целлита, покрытую стеклянным фильтром.
Фильтрат концентрируют с получением (650 мг, 96%) трет-бутилового эфира 4-(1Н-индол-4-ил)пиперидин-1-карбоновой кислоты 4-7.
Стадия 6
К раствору трет-бутилового эфира 4-(1Н-индол-4-ил)пиперидин-1-карбоновой кислоты 4-7 (650 мг, 2,16 ммоль) в ТГФ (75 мл) при комнатной температуре добавляют ди-трет-бутилдикарбонат (519 мг, 2,38 ммоль) с последующим добавлением каталитического количества ДМАП (5,6 мг, 0,046 ммоль). Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 24 часов, в это время реакционную смесь отгоняют. Остаток распределяют между этилацетатом (50 мл) и насыщенным раствором бикарбоната натрия (50 мл). Органический слой промывают насыщенным раствором бикарбоната натрия (2×25 мл) и солевым раствором (25 мл). Органический слой сушат (MgSO4), фильтруют и концентрируют с получением прозрачного масла. Масло хроматографируют при элюировании гексаном/этилацетатом (23:1) с получением 470 мг (54%) трет-бутилового эфира 4-(1-трет-бутоксикарбонилпиперидин-4-ил)индол-1-карбоновой кислоты 4-8.
Стадия 7
К охлажденному до -75°С раствору трет-бутилового эфира 4-(1-трет-бутоксикарбонилпиперидин-4-ил)индол-1-карбоновой кислоты 4-8 (470 мг, 1,2 ммоль) в ТГФ (20 мл) медленно добавляют трет-бутиллитий (t-BuLi) (1,6 мл, 2,25 ммоль). Реакционную смесь перемешивают в течение 45 минут при -75°С и добавляют бензолсульфонилфторид 2а (0,22 мл, 1,8 ммоль). Реакционную смесь перемешивают в течение 2,5 часов. В это время убирают ледяную баню и нагревают реакционную смесь до комнатной температуры, затем реакцию гасят насыщенным раствором хлорида аммония (25 мл). Смесь экстрагируют этилацетатом (3×20 мл). Объединенные слои этилацетата промывают солевым раствором (25 мл), сушат (MgSO4), фильтруют и отгоняют с получением масла желтого цвета. Масло подвергают хроматографированию на силикагеле при элюировании гексаном/этилацетатом (4:1) с получением (310 мг, 60%) продукта трет-бутилового эфира 2-бензолсульфонил-4-(1-трет-бутоксикарбонилпиперидин-4-ил)индол-1-карбоновой кислоты 4-9.
Стадия 8
трет-Бутиловый эфир 2-бензолсульфонил-4-(1-трет-бутоксикарбонилпиперидин-4-ил)индод-1-карбоновой кислоты 4-9 (310 мг, 0,57 ммоль) растворяют в 1М этанольном растворе HCl (30 мл) и нагревают до кипения. Через 2,5 часа реакционную смесь охлаждают до комнатной температуры и добавляют простой эфир (30 мл). Осадок белого цвета собирают с получением 138 мг (64%) продукта 2-бензолсульфонил-4-пиперидин-4-ил-1Н-индола 15.
Пример 5
Этот пример иллюстрирует изучение in vitro радиолигандного связывания соединения формулы I.
Активность связывания соединения настоящего изобретения in vitro определяют следующим образом. Повторные определения сродства лиганда проводят методом конкурирующего связывания [Н]ЛСД (диэтиламид лизергиновой кислоты) в клеточных мембранах, полученных из клеток НЕК293, стабильно экспрессирующих рекомбинантный человеческий рецептор 5-ГТ6.
Все определения проводят в буфере, содержащем 50 мМ Трис-HCl (трис(гидроксиметил)аминометан - HCl), 10 мМ MgSO4, 0,5 мМ этилендиаминтетрауксусной кислоты (ЭДТУ), 1 мМ аскорбиновой кислоты, рН 7,4 при 37°С в объеме реакции 250 микролитра. Исследуемые пробирки, содержащие [Н] ЛСД (диэтиламид лизергиновой кислоты) (5 нМ), конкурирующий лиганд и мембрану, инкубируют в качалке с водяным термостатом в течение 60 минут при 37°С, отфильтровывают на платах Packard GF-B (предварительно смоченных 0,3% ПЭИ (полиэтиленимин)) с использованием луночного устройства для сбора клеток Packard 96 и промывают 3 раза 50 мМ Трис-HCl, охлажденного льдом. Связанный [Н] ЛСД определяют подсчетом радиоактивности в минуту, используя счетчик Packard TopCount.
Замещение [3Н]ЛСД с места связывания рассчитывают подстановкой данных концентрация-связывание в логистическое уравнение с 4-параметрами:
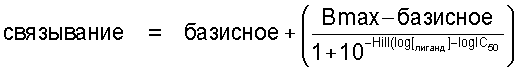
где Hill обозначает наклон кривой Hill, [лиганд] обозначает концентрацию конкурирующего радиолиганда и IC50 (50% ингибирующая концентрация) обозначает концентрацию радиолиганда, приводящую к половине максимального специфического связывания радиолиганда. Интервал специфического связывания представляет собой разницу между Bmax и базисным параметрами.
Пример 7
Соединения формулы I были протестированы с использованием процедуры Примера 4, и найдено, что они являются селективными антагонистами 5-ГТ6. Характерные активности ряда соединений показаны в Таблице 2.
Пример 6
Повышающие познавательные способности свойства соединений настоящего изобретения выявляют в модели познавания на животных: модель задания - распознавание субъекта. Используют четырехмесячных крыс-самцов породы Wistar rats (Charles River, Нидерланды). Соединения готовят ежедневно, растворяют в физиологическом растворе и тестируют в трех дозах. Введение всегда проводят внутрибрюшинно (в/бр) (объем инъекции 1 мл/кг) за 60 минут до Т1. Гидробромид скополамина вводят через 30 минут после инъекции соединения. Две равные тестируемые группы состоят из 24 крыс и тестируются двумя экспериментаторами. Порядок тестируемых доз определяют случайным образом. Эксперименты проводят с использованием двойного протокола вслепую. Все крысы получают каждую дозу один раз. Тест распознавание объекта проводят по методу, описанному Ennaceur A., Delacour J., 1988, Новый однопробный тест для нейробиологического изучения памяти у крыс.1: Поведенческие данные. Behav. Brain Res., т.31, сс.47-59.
Несмотря на то что изобретение представлено со ссылкой на специфические варианты его осуществления, следует понимать, что специалисты могут вносить различные изменения и делать эквивалентные замены без выхода за пределы сущности и объема притязаний изобретения. Кроме того, можно производить много модификаций с целью адаптации к конкретной ситуации, материалу, композиции веществ, стадии или стадиям способа, с целью обеспечения сущности и объема настоящего изобретения. Все подобные модификации предназначены для включения в объем притязаний, выраженный в прилагаемых пунктах формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| 2,7-ЗАМЕЩЕННЫЕ ИНДОЛЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОЯВЛЯЮЩАЯ АНТАГОНИСТИЧЕСКУЮ АКТИВНОСТЬ ПО ОТНОШЕНИЮ К 5-ГТ6 РЕЦЕПТОРУ | 2003 |
|
RU2327685C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ИНДОЛА СО СРОДСТВОМ К РЕЦЕПТОРУ 5-HT | 2002 |
|
RU2294932C2 |
| 4-ПИПЕРАЗИНИЛБЕНЗОЛСУЛЬФОНИЛИНДОЛЫ, ХАРАКТЕРИЗУЮЩИЕСЯ СРОДСТВОМ К РЕЦЕПТОРУ 5-НТ6 | 2003 |
|
RU2324693C2 |
| 2,5- ЗАМЕЩЕННЫЕ ТЕТРАГИДРОИЗОХИНОЛИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ МОДУЛЯЦИИ 5-НТ6 | 2004 |
|
RU2327689C2 |
| ПРОИЗВОДНЫЕ ИНДОЛЬНОГО РЯДА В КАЧЕСТВЕ ИНГИБИТОРОВ p38 КИНАЗЫ | 2000 |
|
RU2278115C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОКАРБАЗОЛОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ИХ | 2005 |
|
RU2382770C2 |
| СОЕДИНЕНИЯ 8-МЕТИЛ-1-ФЕНИЛИМИДАЗО[1, 5-а]ПИРАЗИНА | 2011 |
|
RU2560162C2 |
| ПРОИЗВОДНЫЕ АМИДОВ И МОЧЕВИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ВТОРИЧНОГО ПОГЛОЩЕНИЯ 5-HT И ЛИГАНДОВ 5-HT1B/1D | 1998 |
|
RU2211216C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ЦИКЛОПЕНТАНА | 2010 |
|
RU2572555C2 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 1999 |
|
RU2270833C2 |
Настоящее изобретение относится к новым 2,4-замещенным индолам формулы:
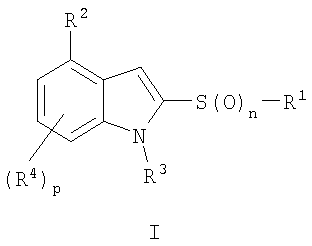
его фармацевтически приемлемой соли, где R1 означает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, включающей галоген, С1-12алкил, галоген С1-12алкил, или означает тиенил; R2 означает остаток насыщенного кольца, содержащий шесть кольцевых атомов, один или два из которых являются атомами азота, а другие - атомами углерода, необязательно замещенного одним или двумя С1-12алкилами; R3 означает Н, С1-12алкил; R4 означает Н; р означает 1 или 2; n означает 0, 1 или 2; Соединения обладают антагонистической активностью к 5-ГТ6 рецептору, что позволяет использовать их в фармацевтической композиции. 2 н. и 8 з.п. ф-лы., 2 табл.
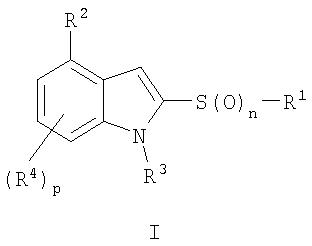
или его фармацевтически приемлемая соль,
где n обозначает 0, 1 или 2;
р обозначает 1 или 2;
R1 обозначает фенил, необязательно замещенный одним или двумя заместителями, выбранными из группы, включающей галоген, С1-C12алкил, галоген С1-С12алкил или означает тиенил,
R2 означает остаток насыщенного кольца, содержащего шесть кольцевых атомов, один или два из которых являются атомами азота, а другие - атомами углерода, необязательно замещенного одним или двумя С1-С12алкилами,
R3 обозначает водород или С1-С12алкил,
R4 обозначает водород.
2-бензолсульфонил-4-пиперазин-1-ил-1H-индол,
2-бензолсульфонил-4-(4-метилпиперазин-1-ил)-1Н-индол,
2-(2,3-дихлорбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(2,3-дихлорбензолсульфонил)-4-(4-метилпиперазин-1-ил)-1Н-индол,
2-бензолсульфонил-1-метил-4-пиперазин-1-ил-1Н-индол,
2-(2-фторбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(толуол-2-сульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(2-трифторметилбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
2-бензолсульфонил-4-(3,5-диметилпиперазин-1-ил)-1Н-индол,
2-(3-бромбензолсульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(тиофен-2-сульфонил)-4-пиперазин-1-ил-1Н-индол,
2-(2-фторбензолсульфонил)-4-(4-метилпиперазин-1-ил)-1Н-индол,
2-(2-фторбензолсульфонил)-1-метил-4-пиперазин-1-ил-1Н-индол,
2-(3-бромбензолсульфонил)-1-метил-4-пиперазин-1-ил-1Н-индол,
2-бензолсульфонил-4-пиперидин-4-ил-1Н-индол.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ИНДОЛИНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2104268C1 |
Авторы
Даты
2008-06-10—Публикация
2003-09-08—Подача