Перекрестная ссылка на родственную заявку
Настоящая патентная заявка, не являющаяся предварительной, основывается на полезных результатах, полученных ранее и описанных в предварительных патентных заявках Соединенных Штатов: заявка No. 60/416602, зарегистрированная 15 октября 2002, которая в настоящее время аннулирована, заявка No. 60/406807, зарегистрированная 29 августа 2002, которая в настоящее время аннулирована, и заявка No. 60/342156, зарегистрированная 19 декабря 2001, которая в настоящее время аннулирована.
Область техники
Данное изобретение относится к области фармакологии и лечению раковых заболеваний. Точнее, настоящее изобретение относится к доставке липосомальных препаратов на основе соединений витамина Е, как к эффективному способу лечения и профилактики рака.
Уровень техники
Контроль регуляции выживания (жизнеспособность) и гибели (апоптоз) представляет собой чрезвычайно сложный процесс, в котором участвует множество внутриклеточных путей передачи сигнала и множество взаимодействующих генных продуктов. Раковые клетки могут проявлять повышенную экспрессию генов и их продуктов, способствующих клеточной пролиферации, увеличению количества раковых клеток. Помимо повышения экспрессии генов, ответственных за выживание, раковые клетки осуществляют регуляцию по типу отрицательной связи генов и их продуктов, которые контролируют сигналы гибели, приводящие к аккумуляции и повышенному метастазированию угрожающих жизни раковых клеток. Сочетание нерегулируемой клеточной пролиферации и супрессии путей передачи сигналов, индуцирующих гибель клеток, приводят как к росту раковых клеток, так и к их выживанию.
Увеличение числа клеток или зависит, или не зависит от баланса экспрессии отрицательных и положительных регулирующих рост генных продуктов, и присутствия или отсутствия функциональных путей передачи сигнала к клеточной гибели. Отрицательные регулирующие рост гены вносят вклад в блокировку клеток в клеточном цикле. Положительные регулирующие рост гены стимулируют клетки к росту на протяжении клеточного цикла. Гены, участвующие в апоптозе, могут быть либо проапоптическими, либо антиапоптическими, и динамический баланс между ними определяет, клетка живет или умирает.
Существует широкий ряд патологических состояний, связанных с клеточной пролиферацией, для которых требуются новые стратегии и средства. Такие патологические состояния могут охватить почти все типы клеток, проявляющие способность к аномальной клеточной пролиферации или аномальному ответу на сигналы клеточной гибели. Среди типов клеток, которые проявляют признаки патологического или аномального роста, находятся фибробласты, эндотелиальные клетки и эпителиальные клетки сосудов. Таким образом, новые методы требуются для лечения локальных или распространяющихся патологических состояний во всех или почти во всех органах и тканях индивидуумов.
В большинстве случаев злокачественные опухоли, являются ли они специфическими для мужчин, такие как рак предстательной железы или яичка, или специфическими для женщин, такие как рак грудной железы, яичника или шейки матки, или они в равной степени поражают и мужчин и женщин, такие как рак печени, кожи или легких, со временем подвергаются генетическим изменениям и эпигенетическим изменениям, приводящим, в конечном счете, к образованию высоко метастатических и трудно излечиваемых опухолей. Хирургическое удаление локализованных опухолей может оказаться эффективным только в случае, когда опухоль не распространяется за пределы первичного поражения. Если опухоль распространяется на другие ткани и органы, хирургические процедуры должны сопровождаться другими более специфическими процедурами, способствующими удалению пораженных или злокачественных клеток. Большинство общепринятых дополнительных процедур для лечения пораженных или злокачественных клеток, таких как химиотерапия или облучение, не направлено только на опухолевые клетки и, хотя они оказывают соразмерно более высокое деструктивное действие на злокачественные клетки, часто воздействуют до некоторой степени на нормальные клетки.
Некоторые природные соединения витамина Е и некоторые производные витамина Е применяли в качестве проапоптических средств и ингибиторов синтеза ДНК и, тем самым, эффективных противораковых средств. Структурно витамин Е состоит из головной группы хроманола и алкильной боковой цепи. Имеется восемь основных природных форм витамина Е: альфа (α), бета (β), гамма (γ) и дельта (δ) токоферолы и α, β, γ и δ токотриенолы. Токоферолы отличаются от токотриенолов тем, что они имеют насыщенную фитильную боковую цепь, а не ненасыщенную изопренильную боковую цепь. Четыре формы токоферолов и токотриенолов отличаются количеством метильных групп в хроманольной головной группе (α имеет три, β имеет две и δ имеет одну), как показано в таблице 1.
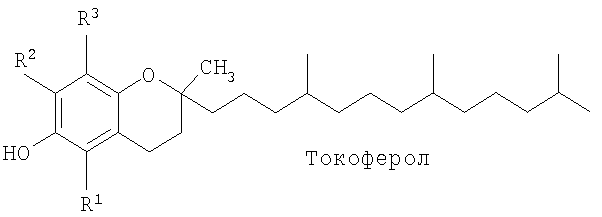
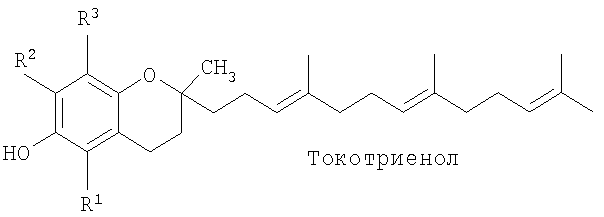
Некоторые исследования касаются высокой противоопухолевой активности RRR-α-токоферилсукцината (сукцинат витамина Е; VES), гидролизуемого сложноэфирного производного RRR-α-токоферола. Исследователи Prasad и Edwards-Prasad были первыми, описавшими способность сукцината витамина Е, а не других форм витамина Е, вызывать морфологические изменения и ингибирование роста клеток меланомы В-16 мыши, и предположили, что сукцинат витамина Е может быть благоприятным терапевтическим противоопухолевым средством (1). Дополнительные исследования показали, что сукцинат витамина Е является эффективным ингибитором роста широкого ряда типов эпителиальных раковых клеток, включая клетки грудной железы, простаты, легких и ободочной кишки, а также гемопоэтические, лейкозные и лимфоидные клетки in vitro (2-7).
Недавние исследования показали, что сукцинат витамина Е при внутрибрюшинном введении (i.p.) проявляет противоопухолевую активность на животных, являющихся моделями ксенотрансплантации и аллотрансплантации (8-11), что свидетельствует о возможной терапевтической активности данного препарата. Было показано, что при i.p. или пероральном (р.о.) введении сукцинат витамина Е проявляет ингибиторную активность по отношению к раку кардиального отдела желудка у мыши, индуцированному канцерогеном [бензо(а)пиреном], что свидетельствует о потенциале сукцината витамина Е как антиканцерогенного средства (12). Исследования показали, что сукцинат витамина Е вызывает зависимые от концентрации и времени ингибирование роста раковых клеток посредством блокировки синтеза ДНК индукцию клеточной дифференцировки и индукцию апоптоза (5, 6, 10, 13-15, неопубликованные данные).
Ингибирование клеточной пролиферации включает в себя блокировку GO/G1 клеточного цикла, опосредованную, отчасти, MAP киназами МЕК1 и ERK1, и активацию ключевого регуляторного белка клеточного цикла р21(waf1/cip1) (30). Индукция дифференцировки характеризуется морфологическими изменениями, повышенной передачей сигнала бета-казеина, экспрессией липидов молока, повышенным уровнем белка цитокератина 18 и регуляцией по типу обратной связи белка Her2/neu (13). Дифференцировка опосредуется, частично, путем активации MEK1, ERK1/2 и фосфорилирования белка c-Jun (13, 14). Из множества реакций передачи сигнала апоптоза, модулированных RRR-α-токоферолсукцинатом, особенно заслуживающей внимания является его способность превращать не чувствительные к Fas/Fas лиганду опухолевые клетки в Fas/Fas лигандчувствительные клетки, и его способность превращать опухолевые клетки, не отвечающие на трансформирующий фактор роста (TGF-α), в клетки, чувствительные к TGF-α, причем обе восстановленные реакции сходятся на JNK/c-Jun с последующей транслокацией белка Вах к митохондриям, индукцией перехода через проницаемую мембрану митохондрий, высвобождением цитохрома с в цитоплазму, активацией каспаз 9 и 3, расщеплением поли (ADP-рибоза)полимеразы (PARP) и апоптозом (15, 29, 31).
Сукцинат витамина Е заслуживает внимания не только в связи с его индукцией торможения роста опухолевых клеток, но также в связи с отсутствием токсичности по отношению к нормальным клеткам и тканям (2-7, 11). Применение негидролизуемого производного сукцината витамина Е показало, что оно является интактным соединением и ни один из его продуктов расщепления (а именно, RRR-α-токоферол или янтарная кислота) не являются ответственными за антипролиферативную активность (4). Таким образом, полагают, что антипролиферативное действие указанного производного витамина Е объясняется свойствами, отличными от антиоксидантных.
RRR-α-токоферилсукцинат (VES) является производным RRR-α-токоферола, структура которого была модифицирована путем образования сложноэфирной связи с сукцинильным фрагментом вместо гидроксильного фрагмента в положении 6 хромана. Указанный сукцинатный фрагмент, связанный сложноэфирной связью с RRR-α-токоферолом, оказался самой эффективной формой витамина Е, влияющей на биологическую способность запускать апоптоз и ингибировать синтез ДНК. Данная форма витамина Е вызывает апоптоз опухолевых клеток, в то же время не проявляет апоптотического действия по отношению к нормальным клеткам. Форма витамина Е с сукцинильным фрагментом является эффективным противораковым средством и в то же время интактным агентом; однако клеточные и тканевые эстеразы, которые могут отщеплять сукцинатный фрагмент, таким образом превращая сукцинатную форму RRR-α-токоферола в свободный RRR-α-токоферол, делают указанное соединение неэффективным как противораковое средство. RRR-α-токоферол не проявляет ни антипролиферативную, ни проапоптическую биологическую активность в клетках эпителиального или иммунного происхождения.
Конструирование соединений, основанных на RRR-альфа-токофероле или RRR-альфа-токотриеноле, модифицированных в С6 положении первого кольца головной группы хроманола альфа-токоферола или альфа-токотриенола посредством образования эфирной связи, поможет создать соединения с сильными противораковыми свойствами. Клеточные эстеразы не обнаружены в клетках; таким образом, такие соединения будут оставаться интактными в клеточной культуре, а также in vivo. В патенте США 6417223 использовали коммерчески доступный чистый RRR-α-токоферол в качестве исходного материала, из которого синтезировали аналоги витамина Е. Модификации были сделаны к трем частям молекулы RRR-α-токоферола: к 6-ому углероду фенольного кольца в хромане, к хроману, состоящему из фенольного и гетероциклического кольца или к фитильному остатку. В RRR-α-токофероле к 6-ому углероду фенольного кольца присоединен гидроксильный (-ОН) фрагмент, который является важным для проявления антиоксидантной активности.
Проверка аналогов витамина Е на их способность индуцировать апоптоз широкого ряда раковых клеток человека, а не нормальных клеток человека, а также анализ структуры и функции аналогов показывают, что основанные на токофероле аналоги, полная длина которых составляет 29 Å от донора Н-связи до конца фитильного остатка, которая имеет длину 17 Å, содержащие полностью метилированное замкнутое фенольное кольцо, насыщенное замкнутое гетероциклическое кольцо и негидролизуемый фрагмент уксусной кислоты, присоединенный к С6 фенольного кольца эфирной связью, проявляют самую мощную противораковую активность (фиг.1).
Способ доставки терапевтических средств, доставляются ли они пероральным путем, с пищей, через зонд, подкожным, внутрибрюшинным, местным, внутривенным, внутримышечным, респираторным путем и т.д., оказывает большое влияние на уровни и распределение в тканях лекарственных средств. Патент США No. 6090407 описывает противораковые препараты паклитаксел и камптотецин, которые могут быть включены в липосомы с целью доставки к дыхательным путям индивидуума посредством распыления. Введение указанных противораковых лекарственных препаратов посредством липосомальной ингаляции представляет собой более быстрое и более эффективное средство доставки, чем внутримышечная инъекция или пероральное введение.
Применение липосомального аэрозоля для доставки растительного алкалоида 9-нитрокамптотецина является наилучшим способом торможения роста раковых клеток молочной железы (28), ободочной кишки и легких человека, пересаженных иммунонекомпетентным голым мышам, по сравнению с доставкой 9-нитрокамптотецина посредством внутримышечной инъекции. Уровни 9-нитрокамптотецина при доставке в легкие, печень и головной мозг в виде липосомального аэрозоля в течение тридцати минут составили 310 нг/г, 192 нг/г и 61 нг/г соответственно, в то время как уровни 9-нитрокамптотецина при внутримышечной доставке в легкие, печень и головной мозг в течение тридцати минут составили 2-4 нг/г, 136 нг/г и 0 соответственно (16). Кроме того, указанный способ доставки, по-видимому, является высокоэффективным способом, направленным против метастазирования меланомы и остеосаркомы в легкие мышей (18). Аэрозольная доставка лекарственных средств имеет огромную важность, поскольку она является высокоэффективной и хорошо переносится человеком (19). Таким образом, способ доставки лекарственных средств посредством липосомального аэрозоля является эффективным способом достижения более высоких уровней и большего распределения в тканях лекарственных препаратов.
Кроме того, изобретатели признают необходимость в создании других эффективных способов липосомальной доставки противораковых препаратов, основанных на витамине Е, которые способствуют более продолжительному удерживанию, созданию более высокой концентрации лекарственного препарата, снижению системной токсичности и уменьшению требований к дозированию. Таким образом, предыдущий уровень техники отличается недостаточностью эффективных средств доставки индивидууму противораковых лекарственных средств, основанных на витамине Е, посредством липосом. Точнее, аэрозольная липосомальная доставка или введение через желудочный зонд липосомальных композиций противораковых лекарственных средств, основанных на витамине Е, является желательным. Настоящее изобретение осуществляет эту давнишнюю потребность и желание в данной области.
Краткое описание сущности изобретения
В одном аспекте настоящего изобретения представлен способ лечения заболевания, ассоциированного с пролиферацией клеток, заключающий в себе стадию доставки композиции, содержащей основанное на витамине Е противораковое соединение, которое содержится в везикуле, доставляемой индивидууму при необходимости такого лечения, где соединение имеет структурную формулу
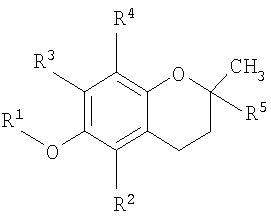
где R1 представляет собой водород или карбоновую кислоту; R2 и R3 представляют собой водород или R4; R4 является метилом и R5 является алкилом или алкенилом.
В другом аспекте настоящего изобретения разработана везикула для доставки основанного на витамине Е противоракового соединения, как описано в данном тексте.
Другие и добавочные аспекты, в особенности общий полезный результат и преимущества настоящего изобретения, будут очевидны из следующего описания представленных предпочтительных аспектов изобретения, данных с целью раскрытия изобретения.
Краткое описание чертежей
Для того чтобы суть изобретения, в котором вышеперечисленные особенности, преимущества и цели, а также другие характеристики, которые станут очевидными, была раскрыта и понята в деталях, более подробное описание изобретения кратко суммировано со ссылкой на определенные аспекты изобретения, которые иллюстрированы посредством прилагаемых чертежей. Указанные чертежи составляют часть описания. Однако следует заметить, что прилагаемые чертежи иллюстрируют предпочтительные аспекты изобретения и поэтому не рассматриваются как ограничивающие сферу изобретения.
На фиг.1 представлена модель аналогов R,R,R-α-токоферола, изображающая структурные элементы, которые требуются для проявления мощной противораковой активности. Группа R1 боковой цепи у С6 должна иметь такую длину, чтобы полная длина молекулы не превышала 29 Å.
На фиг.2 представлены результаты сравнения противоракового действия природных альфа- и гамма-токоферолов, природного альфа-токотриенола, фракции, обогащенной токотриенолом (TRF), синтетических токоферолов и синтетических производных токоферола по отношению к 66 cl.4 GFP опухолевым клеткам молочной железы.
На фиг.3А-3D представлены данные по апоптозу, индуцированному α-ТЕА. Фиг.3А: 66 cl.4-GFP клетки молочной железы мыши обрабатывали 10 мкг/мл α-ТЕА или сукцината витамина Е (положительный контроль) или не обрабатывали и культивировали в течение 3 дней. Клетки собирали, ядра метили флуоресцентным красителем DAPI, связывающимся с ДНК, и клетки проверяли, используя флуоресцентный микроскоп Zeiss ICM 405 (×400) с фильтром 487701. Ядра клеток с конденсированным хроматином или фрагментированные ядра подсчитывали как апоптические. Данные представлены из многочисленных экспериментов. Фиг.3В/3С: анализ клеток с окрашенными DAPI ядрами показывает, что α-ТЕА индуцирует апоптоз в зависимости от концентрации и времени. Данные представлены как средние величины ± стандартное отклонение трех экспериментов. Фиг.3D: дополнительное доказательство в пользу индукции апоптоза посредством α-ТЕА с помощью расщепления поли(ADP-рибоза)полимеразы (PARP). Клетки 66 cl.4-GFP обрабатывали 5, 10 или 20 мкг/мл α-ТЕА в течение 48 часов, клеточные лизаты анализировали на присутствие продукта расщепления PARP (р84) с помощью иммунного анализа вестерн-блоттинга. Данные представлены из 3 отдельных экспериментов.
На фиг.4А и 4В показано, что α-ТЕА индуцирует 66 cl. 4 клетки к апоптозу in vivo. Индукцию апоптоза посредством α-ТЕА определяли, используя 5 мкм опухолевые срезы, полученные от мышей после обработки липосомальным α-ТЕА/аэрозолем и от контрольной группы мышей (N=4), обработанных липосомальным аэрозолем. Апоптические клетки определяли, используя набор ApopTag In Situ Apoptosis Detection kit (Intergen, Purchase, NY). На фиг.4А представлены данные сравнения количества апоптических ядер после обработки липосомальным аэрозолем с α-ТЕА и после обработки контрольной группы аэрозолем. На фиг.4 В представлены положительно окрашенные апоптические клетки в опухолевых срезах у мышей, обработанных липосомальным аэрозолем с α-ТЕА и контрольных обработанных аэрозолем мышей.
На фиг.5 представлены результаты ингибирования клонального роста 66 cl.4-GFP посредством α-ТЕА. Обработка 66 cl.4-GFP клеток (помещали 600 клеток/культуральный планшет) посредством α-ТЕА при 1,25, 2,5 и 5 мкг/мл в течение 10 дней приводила к торможению образования колоний. Клетки окрашивали метиленовым голубым и количество колоний в обработанной и контрольной группах подсчитывали.
На фиг.6 графически представлен вес тела balb/c мышей, которым имплантировали 66 cl.4 GFP опухолевые клетки молочной железы мыши и которых обрабатывали липосомальной композицией с α-ТЕА, доставляемой посредством аэрозоля. Вес животного проверяли, начиная с девятого дня после имплантации опухолевых клеток.
На фиг.7 графически представлены уровни α-ТЕА в сыворотке и ткани balb/c мышей через 0, 2, 6 или 24 часа по окончании обработки липосомальным/α-ТЕА 1 аэрозолем.
На фиг.8 графически представлен вес опухолей у balb/c мышей, которым имплантировали 66 cl.4 GFP опухолевые клетки молочной железы мыши и которых обрабатывали липосомальной композицией с α-ТЕА, доставляемой посредством аэрозоля. Вес опухолей проверяли, начиная с девятого дня после имплантации опухолевых клеток.
На фиг.9А и 9В графически представлены результаты торможения роста опухолей и микрометастазов посредством липосомального аэрозоля с α-ТЕА. Фиг.9А: 66 cl.4-GFP клетки в количестве 2×105/мышь вводили в паховую область в точке, находящейся на одинаковом расстоянии между 4-м и 5-м сосками. Через девять дней после инокуляции опухоли мышей (10/группу) не обрабатывали или обрабатывали ежедневно липосомальным α-ТЕА/аэрозолем или аэрозолем только в течение 17 дней. Объем опухоли/мышь определяли при двухдневных интервалах. Объем опухоли (мм3) выражали как средние величины ± стандартная ошибка. Фиг.9В: при вскрытии трупа количество флуоресцирующих метастазов в левой доле легкого после обработки мышей липосомальным α-ТЕА/аэрозолем (8 мышей), аэрозолем только (10 мышей) и у необработанных мышей (10 мышей) определяли с помощью флуоресцентного микроскопа Nik-on (TE-200; 200X) и с использованием программы Image Pro-Plus S.E. для определения размера микрометастазов. Данные представлены как средние величины ± стандартная ошибка.
На фиг.10 графически представлены результаты ингибирования опухолевого роста 66 cl.4 GFP опухолевых клеток молочной железы посредством липосомального α-ТЕА и липосомального сукцината витамина Е (VES), доставляемых посредством распыления аэрозоля.
На фиг.11 графически представлен вес опухолей у balb/c мышей, которым имплантировали 66 cl.4 GFP опухолевые клетки молочной железы мыши и которых обрабатывали липосомальной композицией с α-ТЕА, доставляемой посредством желудочного зонда. Вес опухолей проверяли, начиная с девятого дня после имплантации опухолевых клеток. Фиг.11 отличается от фиг.8 только тем, что мышей обрабатывали ежедневно через желудочный зонд посредством 5 мг α-ТЕА в арахисовом масле или арахисового масла только и обрабатывали в течение только 13 дней.
На фиг.12А и 12В показано, что α-ТЕА, введенный через желудочный зонд, не ингибирует рост опухоли на участке инокуляции, но ингибирует микрометастазы легкого. Объем опухоли и размеры и количество микрометастазов были описаны в подписи к фиг.9А и 9В.
На фиг.13 графически представлены результаты ингибирования опухолевого роста 66 cl.4 GFP опухолевых клеток молочной железы посредством липосомального α-ТЕА и липосомального сукцината витамина Е (VES), доставляемых через желудочный зонд.
На фиг.14А и 14В графически представлены результаты ингибирования метастазов легкого (фиг.14А) и метастазов лимфатического узла (фиг.14В) опухолевых клеток 66 cl.4 GFP молочной железы посредством липосомального α-ТЕА и липосомального сукцината витамина Е (VES), доставляемых через желудочный зонд.
На фиг.15 графически представлены результаты ингибирования опухолевого роста MDA-MB-435 раковых клеток молочной железы посредством липосомального α-ТЕА, доставляемого через желудочный зонд.
На фиг.16А-16С показано апоптическое действие α-ТЕА или комбинации α-ТЕА/цисплатина на А2780 цисплатинчувствительную клеточную линию и на цисплатиннечувствительные ср-70 раковые клетки яичника человека. Фиг.16А: апоптическое действие in vitro α-ТЕА на А2780 линии клеток и ср-70 линии раковых клеток яичника человека. Фиг.16В: α-ТЕА восстанавливает чувствительность цисплатина к ср-70 in vitro. Фиг.16С: ингибирование роста опухоли посредством как α-ТЕА, так и комбинации α-ТЕА с цисплатином на А2780 и ср-70 in vivo. Данные in vivo показывают, что α-ТЕА превращает цисплатин-нечувствительные клетки ср-70 в цисплатинчувствительные и что комбинации α-ТЕА + цисплатин снижают рост ср-70 клеточных ксенотрансплантатов яичника у голых мышей.
На фиг.17 показано действие α-ТЕА, метилселеноцистеина и транс-ресвератрола на рост злокачественной опухоли MDA-MB-435 GFP FL молочной железы in vivo.
Подробное описание изобретения
В одном аспекте настоящего изобретения разработан способ лечения заболевания, связанного с клеточной пролиферацией, включающий стадию доставки композиции, содержащей основанное на витамине Е противораковое соединение, которое содержится в везикуле, доставляемой индивидууму при необходимости такого лечения, где соединение имеет структурную формулу

где R1 представляет собой водород или карбоновую кислоту; R2 и R3 представляют собой водород или R4; R4 является метилом и R5 является алкилом или алкенилом.
Во всех аспектах данного варианта осуществления изобретения противораковыми соединениями, основанными на витамине Е, могут быть токоферол, такой как β-токоферол, γ-токоферол, δ-токоферол или 2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусная кислота. Кроме того, противораковыми соединениями, основанными на витамине Е, могут быть токотриенол, такой как α-токотриенол, β-токотриенол, γ-токотриенол, δ-токотриенол, или фракция, обогащенная токотриенолом, или синтетическое соединение, основанное на витамине Е, такое как dl-α-токоферол, ацетат dl-α-токоферола, никотинат dl-α-токоферола или фосфат dl-α-токоферола.
В данном варианте осуществления изобретения везикула, как средство доставки, может представлять собой липосому, содержащую липид, наночастицу, микросферу или ниосому. Характерным примером подходящего липида в липосоме является 1,2-дилауроил-sn-глицеро-3-фосфохолин. Предпочтительным примером является липосома с конечной концентрацией противоракового соединения, основанного на витамине Е, в липосоме, то есть не выше чем 20,0 мг/мл. Основанное на витамине Е соединение/везикула для доставки может быть доставлено посредством аэрозольного распыления, аэрозольного ингалятора, желудочного зонда, перорального приема внутрь, перорально с помощью мягкой гелевой капсулы, чрескожного пластыря, подкожной инъекции, внутривенной инъекции, внутримышечной инъекции или внутрибрюшинной инъекции. Предпочтительным средством доставки является липосомальный аэрозоль, доставляемый посредством струйного распылителя.
В аспекте данного варианта осуществления изобретения способ также может заключать в себе стадию введения второй композиции противоракового средства, содержащегося в доставляемой везикуле. Вторая композиция может быть введена в комбинации с основанным на витамине Е соединением/доставляемой везикулярной композицией или последовательно за последней. Когда композиции вводят совместно, основанное на витамине Е соединение и противораковое лекарственное средство могут находиться в одной и той же доставочной везикуле. Характерными примерами противораковых лекарственных средств являются 9-нитрокамптотецин, цисплатен, паклитаксел, доксирубицин или целекоксиб.
Противораковые соединения, основанные на витамине Е, согласно настоящему изобретению оказывают антипролиферативное действие, выражающееся в апоптозе, ингибировании синтеза ДНК, ингибировании клеточного цикла или клеточной дифференцировки. В данном варианте осуществления изобретения количественный и/или качественный анализ антипролиферативного действия может быть осуществлен путем обнаружения биомаркера. Предпочтительным примером биомаркера является маркер KI-67 клеточной пролиферации. В качестве альтернативы может быть применен иммуногистохимический анализ.
Доставка соединений, основанных на витамине Е, или других противораковых соединений согласно настоящему изобретению может быть применена для лечения неопластических заболеваний и отличных от неопластических заболеваний. Характерными примерами неопластических заболеваний являются рак яичника, рак шейки матки, рак эндометрия, рак мочевого пузыря, рак легкого, рак молочной железы, рак простаты, рак яичка, глиома, фибросаркома, ретинобластома, меланома, саркома мягкой ткани, остеосаркома, рак ободочной кишки, карцинома почки, рак поджелудочной железы, базально-клеточная карцинома и плоскоклеточная карцинома. Характерными примерами заболеваний, отличных от неопластических заболеваний, являются заболевания, выбранные из группы, состоящей из псориаза, доброкачественных пролиферативных кожных заболеваний, ихтиоза, папилломы, повторного стеноза, склеродермии и гемангиомы и лейкоплакии.
Способы согласно настоящему изобретению могут быть применены для лечения заболеваний, отличных от неопластических заболеваний, которые развиваются вследствие неспособности выбранных клеток подвергаться нормальной запрограммированной клеточной гибели или апоптозу. Характерными примерами заболеваний и расстройств, которые имеют место вследствие неспособности клеток к гибели, являются аутоиммунные заболевания. Аутоиммунные заболевания отличаются деструкцией самих клеток иммунной системы, тканей и органов. Характерная группа аутоиммунных заболеваний включает в себя аутоиммунный тиреоидит, рассеянный склероз, тяжелую псевдопаралитическую миастению, системную красную волчанку, герпетиформный дерматит, глютеновую болезнь и ревматоидный артрит. Настоящее изобретение не ограничивается аутоиммунными заболеваниями, но включает в себя все расстройства с иммунным компонентом, таким как воспалительный процесс, участвующий в образовании бляшек в сердечно-сосудистой системе, или кожное поражение, вызванное ультрафиолетовым облучением.
Способы согласно настоящему изобретению могут быть применены для лечения расстройств и заболеваний, которые развиваются вследствие вирусных инфекций. Характерными примерами заболеваний и расстройств, которые происходят вследствие вирусных инфекций, являются болезни, обусловленные вирусом иммунодефицита человека (HIV). Поскольку соединения, основанные на витамине Е, действуют на внутреклеточных апоптических сетях передачи сигнала, доставочная везикула, такая как липосомальный аэрозоль, содержащий противораковые соединения, основанные на витамине Е, согласно настоящему изобретению, обладает способностью воздействовать на передачу сигнала любого типа внешнего клеточного сигнала, такого как цитокины, вирусы, бактерии, токсины, тяжелые металлы и т.д.
В другом варианте осуществления настоящего изобретения разработана везикула для доставки противоракового соединения, основанного на витамине Е, содержащегося в везикуле. В аспекте данного варианта осуществления изобретения везикула также может содержать противораковое лекарственное средство. В предпочтительном аспекте доставочная везикула представляет собой липосому, в которой отношение противоракового соединения, основанного на витамине Е, к липиду составляет приблизительно 1:3 (мас.:мас). Противораковые соединения, основанные на витамине Е, противораковые лекарственные средства, типы везикул и способы доставки могут быть такими, как описано выше.
Следующие определения даны с целью облегчения понимания изобретений, описанных в данном тексте. Любые термины, которые не четко определены, должны интерпретироваться соответственно значению термина в данной области.
Употребляемые в данном тексте термины "аэрозоль", "желудочный зонд", "липосома", "везикула для доставки" и "везикула" будут включать в себя различные химические композиции для приготовления препаратов везикула/липосома и различные методологии в отношении рассеивания аэрозоля или пероральной доставки указанных препаратов.
Употребляемый в данном тексте термин "индивидуум" будет относиться к животным и человеку.
Употребляемый в данном тексте термин "биологически ингибирующий" или "ингибирование" роста сингенных опухолевых трансплантатов будет включать в себя частичное или полное ингибирование роста и также подразумевает включение уменьшения скорости пролиферации или роста опухолевых клеток. Доза композиции согласно настоящему изобретению, оказывающая биологический ингибирующий эффект, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "ингибирование метастазов" будет включать в себя частичное или полное ингибирование миграции опухолевых клеток от первичного участка к другим органам, особенно к легким, как описано выше. Доза композиции согласно настоящему изобретению, оказывающая биологический ингибирующий метастазы эффект, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "ингибирование ангиогенеза" будет включать в себя частичное или полное ингибирование образования кровеносных сосудов в опухоли или снижение пропускной способности кровеносных сосудов, снабжающих кровью опухоли.
Употребляемый в тексте термин "индукция программированной гибели клеток или апоптоз" будет включать в себя частичную или полную гибель клеток в отношении тех клеток, которые обладают характерными для апоптоза морфологическими и биохимическими свойствами. Доза композиции согласно настоящему изобретению, которая вызывает апоптоз, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "индукция подавления синтеза ДНК" будет включать в себя подавление роста благодаря обработке клеток, блокированных в фазах клеточного цикла GO/G1, S или G2/M. Доза композиции согласно настоящему изобретению, которая вызывает угнетение синтеза ДНК, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "индукция клеточной дифференцировки" будет включать в себя угнетение роста клеток вследствие обработки клеток, претерпевающих клеточную дифференцировку согласно установленным морфологическим и биохимическим характеристикам дифференцировки, стадии, на которой пролиферации клеток не происходит. Доза композиции согласно настоящему изобретению, которая вызывает клеточную дифференцировку, может быть определена путем оценки действия тестируемого элемента на рост целевых злокачественных клеток или клеток с нарушенной пролиферацией в тканевой культуре, рост опухоли у животных и клеточной культуре или любым другим способом, известным квалифицированным специалистам в данной области.
Употребляемый в тексте термин "α-ТЕА" будет включать в себя аналог RRR-α-токоферола со связанной эфирной связью уксусной кислотой, который представляет собой негидролизуемый эфирный аналог RRR-α-токоферола, т.е. 2,5,7,8-тетраметил-2R-(4R,8R-12-триметилтридецил)хроман-6-илоксиуксусная кислота, которая может быть сокращенно написана как RRR-α-токоферилоксиуксусная кислота.
Изобретение представляет разработанный способ лечения заболеваний, связанных с пролиферацией клеток, посредством аэрозольной доставки липосомальной композиции или посредством доставки через желудочный зонд липосомальной композиции, содержащей природное или синтетическое противораковое лекарственное средство, основанное на витамине Е, и липид. Соединения согласно настоящему изобретению, основанные на витамине Е, проявляют антипролиферативное действие; характерными примерами таких антипролиферативных эффектов являются апоптоз, угнетение синтеза ДНК, подавление клеточного цикла или клеточной дифференцировки. Указанные соединения проявляют антиметастатический эффект и не проявляют токсичность по отношению к нормальным клеткам и тканям in vivo при введении клинически подходящим способом, таким как аэрозольная доставка или через желудочный зонд.
Возможно, противораковое лекарственное средство, основанное на витамине Е, и второе противораковое лекарственное средство, такое как 9-нитрокамптотецин (9NC), доксорубицин, пакситаксол, целекоксиб или цисплатин, но не ограниченное ими, в липосомальной композиции или введенные другим путем, таким как внутрибрюшинная инъекция, могут быть введены в комбинации друг с другом или последовательно друг за другом. Например, 9-нитрокамптотецин, в качестве ингибитора топоизомеразы-1, которая разрывает одну из двух цепей ДНК, что приводит к разрывам в двух цепях ДНК в процессе репликации, действует по механизму гибели клетки, отличному от механизма α-ТЕА. Кроме того, 9NC может активировать традиционный, зависимый от СD95/СD95-лиганда (FADD/каспаза 8) апоптический путь (29), который может совместно действовать с нетрадиционным путем, т.е. СD95/Daxx/JNK/митохондрия. Такое комбинированное действие способствует усилению гибели клеток.
Указанные соединения, основанные на витамине Е, согласно настоящему изобретению включают в себя природные или синтетические токоферолы или токотриенолы и их производные, проявляющие химическую функциональность у положения R1 хромана и положения R5 фитильной или изопренильной боковой цепи. Предпочтительно R1 представляет собой карбоновую кислоту, например уксусную кислоту. Обычно синтез указанных соединений сопровождается взаимодействием R,R,R-альфа-токоферола с соответствующей бромалкановой кислотой способами, принятыми в данной области.
Производные природных токоферолов и токотриенолов не гидролизуются клеточными эстеразами и, хотя не ограничиваются такими производными с боковой цепью в С6 положения, предпочтительно содержат фрагмент, уксусную кислоту, в данном положении. Предпочтительным соединением, которое удовлетворяет структурным элементам, требуемым для проявления сильного противоракового действия, является α-TEA, которое отличается от RRR-α-токоферола фрагментом уксусной кислотой, связанной простой эфирной связью с фенольным кислородом у углерода 6 головной группы хромана. VES отличается от α-TEA тем, что фрагмент, янтарная кислота, связывается сложной эфирной связью с фенолом у углерода 6 головной группы хромана. Поскольку антиоксидантные свойства исходного соединения, RRR-α-токоферола, принадлежат -ОН фрагменту у углерода 6, противоопухолевые свойства α-TEA не являются опосредованными антиоксидантом.
Настоящее изобретение может быть применимо в качестве терапевтического средства. Способы согласно настоящему изобретению могут быть применимы для лечения любого животного. Наиболее предпочтительно способы согласно настоящему изобретению применимы для человека. Обычно для того, чтобы достичь фармакологически эффективной гибели клеток и антипролиферативного эффекта, липосомальные композиции с противораковым соединением могут быть введены в любой терапевтически эффективной дозе. Вводимая дозировка зависит от возраста, клинической стадии и степени заболевания или генетической предрасположенности индивидуума, местоположения, веса, типа конкурентного лечения, если оно имеет место, и природы патологического или злокачественного состояния.
Предпочтительно дозировка составляет приблизительно от 0,1 до 100 мг/кг. Специалист, имеющий обычные навыки в данной области, сможет легко определить, без чрезмерного экспериментирования, соответствующие дозировки.
Исследования in vivo опухолевого роста и метастазирования опухолевых клеток человека, трансплантированных эктопически или ортотропно иммунонекомпетентным животным, таким как голые мыши, или исследования in vivo, в которых используют хорошо изученные модели животных, позволяют получить предварительные клинические результаты для клинических испытаний. Не ограничиваясь указанными моделями животных, такие исследования in vivo могут быть сфокусированы на других неопластических и отличных от неопластических моделях заболеваний, связанных с пролиферацией клеток. Например, в исследованиях могут быть использованы метастатические, не зависимые от эстрогена MDA-MB-435 раковые клетки молочной железы, 66 cl.4 GFP клетки или устойчивые к цисплатину ср-70 раковые клетки яичника человека.
В особенности исследователи рассматривают возможность использования новых производных токоферола, токотриенола и других производных хромана, содержащих или не содержащих насыщенные фитильные или ненасыщенные изопренильные боковые цепи, или их аналогов в липосомальной композиции, применяемой для доставки к индивидууму, такой как аэрозольная доставка к дыхательным путям или доставка через желудочный зонд. Такие молекулы содержат химически функциональные группы R1-R5 структуры хромана и химически функциональные фитильные и изопренильные боковые цепи, в частности, соединений, основанных на токоферолах и токотриенолах. Кроме того, рассматриваются соединения с замещениями кислорода хроманового кольца и кислорода 6-гидроксигруппы на гетероатом (N или S).
Используя методы алкилирования, большое количество соединений, содержащих различные R1 группы, можно синтезировать, особенно такие, у которых Х представляет собой кислород. После алкилирования дальнейшие химические модификации R1 групп позволяют синтезировать большое разнообразие новых соединений. Заместителями R1 могут быть алкил, алкенил, алкинил, арил, гетероарил, карбоновая кислота, карбоксилат, карбоксамид, сложный эфир, тиоамид, тиокислота, тиоэфир, сахарид, сахарид, связанный с алкоксигруппой, амин, сульфонат, сульфат, фосфат, спирт, простые эфиры и нитрилы.
Бромирование бензильных метильных групп хромана приводит к получению промежуточных соединений, с помощью которых можно получить соединения с различными R2, R3 и R4 группами. Заместителями для R2 и R3 могут быть водород или дополнительные заместители для R4, например, метил, бензилкарбоновая кислота, бензилкарбоксилат, бензилкарбоксамид, бензиловый эфир, сахарид и амин. Варианты группы R5, такие как алкил, алкенил, алкинил, арил, гетероарил, карбоксил, амид и сложный эфир, также возможны, особенно в случае, когда в качестве исходного соединения используют коммерчески доступную 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновую кислоту.
Когда происходит гетероатомное замещение азотом кислорода хроманового кольца, то затем азот может быть замещен группой R6, которая представляет собой водород или метил. Изменение Х на группы, отличные от кислорода, который является идентичным Х группе в токоферолах и токотриенолах, можно произвести посредством реакции с использованием палладия (для Х=СН2) и нуклеофильного ароматического замещения (для X=N или S). Другие возможные модификации структуры хромана включают в себя ненасыщение у 3-4 положений и уменьшение кольца до пятичленного фуранильного кольца.
Очевидно, что другие липиды можно использовать в липосомальной композиции. Любой липид, который может заключать в себе указанные противораковые соединения, основанные на витамине Е, или другие противораковые соединения и доставлять терапевтическую дозировку, будет подходящим. Различные способы доставки липосом используют, такие как аэрозольная доставка или доставка через желудочный зонд. Например, способы доставки липосом посредством аэрозоля и распыления или способы липосомального введения посредством желудочного зонда можно применять.
Очевидно, что α-ТЕА или другие производные токоферолов и токотриенолов могут быть использованы в препаратах ниосом, микросфер или наночастиц и доставлены в терапевтической дозе посредством аэрозольной ингаляции или аэрозольного распыления к дыхательным путям или введены через желудочный зонд, посредством местного нанесения, подкожно, внутрибрюшинно, внутривенно, внутримышечно или другими установленными способами введения. Например, липосомальная композиция α-ТЕА или композиция в виде наночастицы в мягкой гелевой капсуле для пероральной доставки может оказаться идеально подходящей для химиопрофилактики человека, однако не рассматривается как ограничивающая изобретение. Композиции в виде наночастиц, вводимые перорально в мягких гелевых капсулах, могут дольше удерживаться в пищеварительном тракте и, возможно, лучше всасываться. Кроме того, композиции в виде наночастиц могут быть пригодными для доставки ингаляцией. Липосомальные композиции или композиции в виде наночастиц могут быть пригодными в трансдермальной системе доставки, такой как пластырь.
Следующие примеры даны с целью иллюстрирования различных вариантов изобретения и не предназначены ограничить настоящее изобретение в любой форме.
ПРИМЕР 1
Синтез и характеристика 2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусной кислоты (α-ТЕА)
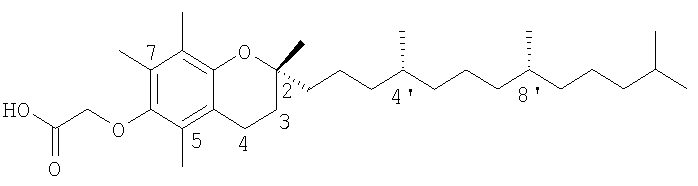
В большом масштабе α-ТЕА получали следующим образом. Суспендировали NaH (5,0 г, 124,9 ммоль) в сухом ТГФ (THF) (300 мл) и перемешивали в атмосфере аргона при 0°С в течение 10 мин до добавления через вспомогательное устройство α-токоферола (41,3 г, 96,1 ммоль), который растворяли в 100 мл сухого ТГФ. Полученную смесь перемешивали при 0°С в течение 15 мин в атмосфере аргона, затем с помощью шприца добавляли этилбромацетат (19,26 г, 115,3 ммоль). Ход реакции контролировали посредством ТСХ (гексан:этилацетат = 10:1, Rf=0,65), и реакцию завершали через 3,5 часа. Реакционную смесь разбавляли 150 мл CH2Cl2, промывали насыщенным раствором NaCl (150 мл×3) до тех пор, пока органическая фаза не становилась прозрачной, сушили над безводным Na2SO4, и растворитель удаляли при пониженном давлении. Сырой продукт все еще содержал небольшое количество свободного α-токоферола, который можно удалить колоночной хроматографией на силикагеле, используя смесь растворителей гексан:этилацетат (от 30:1 до 20:1), с получением чистого продукта этилового эфира α-ТЕА (41,6 г, 84%).
Этиловый эфир α-ТЕА (21,0 г, 40,7 ммоль) растворяли в 250 мл ТГФ, затем добавляли 75 мл 10% раствора КОН (122,1 ммоль) и смесь перемешивали при комнатной температуре в течение 6 часов. Ход реакции контролировали посредством ТСХ (CHCl3:МеОН:СН3СООН=97:2,5:0,5, Rf=0,18), и реакцию гасили добавлением 100 мл воды. рН раствора доводили до рН 3 с помощью 1 н. HCl и продукт экстрагировали посредством CH2Cl2 (100 мл×4), промывали насыщенным раствором NaCl, сушили над Na2SO4 и растворитель удаляли при пониженном давлении, получая конечный продукт α-ТЕА в виде воскообразного твердого вещества (18,5 г, 93%). Точка плавления 54-55°С; молекулярный вес 488,8.
ПРИМЕР 2
Линия опухолевых клеток молочной железы мыши
Клетки 66 cl.4-GFP представляют собой линию опухолевых клеток молочной железы мыши, произведенных из спонтанной опухоли молочной железы Balb/cfC3H мышей и позже изолированных как клон, устойчивый к 6-тиогуанину (20,21). Впоследствии данные клетки подвергали устойчивой трансфекции зеленым флуоресцирующим белком (GFP). Клетки 66 cl.4-GFP являются высоко метастатическими со 100% микрометастазов в легких. Перед использованием в данном исследовании клетки посылали в University of Missouri Research Animal Diagnostic and Investigative Laboratory (RADIL; Columbia, МО), где их проверяли на отсутствие патогенных микроорганизмов.
Клетки 66 cl.4-GFP поддерживали в виде монослойной культуры в среде для роста клеток: среда McCoy (Invitrogen Life Taechnologies, Carlsbad, CA.), дополненная 10% фетальной сывороткой крупного рогатого скота (FBS, Hyclone Lab, Logan, UT), 100 мкг/мл стрептомицина, 100 ME/мл пенициллина, 1X (об./об.) несущественными аминокислотами, 1X (об./об.) MEM витаминами, 1,5 мМ пирувата натрия и 50 мкг/мл гентамицина (Sigma Chemical Co., St. Louis, МО). Обработку проводили с использованием такой же дополненной средой McCoy за исключением того, что содержание FBS в среде было снижено до 5%. Культуры проверяли обычным методом, чтобы убедиться в отсутствии заражения микоплазмой.
ПРИМЕР 3
Определение апоптоза путем морфологической оценки DAPI-окрашенных ядер
Апоптоз определяли с помощью ранее опубликованных процедур (22). Кратко, 1×105 клетки/лунку в 12-луночном планшете культивировали в течение ночи, чтобы осуществить прикрепление клеток. Далее клетки обрабатывали посредством α-ТЕА, сукцината витамина Е (Sigma) или этанола в качестве контроля (0,1% этанол F.C. об./об.) в экспериментальной среде при различных концентрациях α-ТЕА и сукцината витамина Е в течение различных интервалов времени. После обработки всплывшие клетки и прилипшие клетки, освобожденные с помощью соскребания, осаждали центрифугированием в течение 5 мин при 350 × g, промывали один раз фосфатно-буферным раствором (PBS; 137 мМ NaCl, 2,7 мМ KCl, 10,4 мМ Na2HPO4, 10,5 мМ KH2PO4; рН 7,2) и окрашивали посредством 2 мкг/мл дигидрохлорида 4,6-диамидино-2-фенилиндола (DAPI, Boehringer Mannheim, Indianapolis, IN) в 100% метаноле в течение 15 мин при 37°С.
Клетки просматривали при 400Х увеличении с помощью флуоресцентного микроскопа Zeiss ICM 405 с фильтром 487701. Клетки, в которых ядра содержали конденсированный хроматин, или клетки с фрагментированными ядрами считали как апоптические. Данные представляют в виде процента апоптических клеток на клеточную популяцию, т.е. количество апоптических клеток/общее количество подсчитанных клеток. Три различных поля проверяли с помощью микроскопа и 200 клеток подсчитывали в каждом положении относительно минимума 600 клеток, подсчитанных на одно предметное стекло. Данные апотоза представляли как среднее ± стандартное отклонение для трех независимо проведенных экспериментов.
ПРИМЕР 4
Определение фрагментов расщепления поли(ADP-рибоза)полимеразы (PARP) посредством вестерн-блоттинга
Расщепление поли(ADP-рибоза)полимеразы анализировали как альтернативный способ определения апоптоза. Клетки 66 cl.4-GFP обрабатывали, как описано выше, для анализирования с помощью DAPI. После промывки посредством PBS клетки суспендировали в буфере для лизиса (IX PBS, 1% Nonidet P-40, 0,5% дезоксихолат натрия, 0,1% додецилсульфат натрия (SDS), 1 мкг/мл лейпептина, 1 мкг/мл апротинина, 1 мМ дитиотреитола (DTT), 2 мМ ортованадата натрия, 10 мкг/мл фенилметилсульфонилфторида (PMSF)) в течение 30 мин при 4°С, перемешивали и супернатанты собирали центрифугированием при 15000 × g в течение 20 минут. Концентрации белка определяли посредством Bio-Rad (Bradford) белкового анализа (Bio-Rad Laboratories, Hercules, CA) и образцы (100 мкг/дорожку) подвергали электрофорезу в 7,5% SDS-полиакриламидном геле при восстанавливающих условиях.
Белки подвергали переносу на нитроцеллюлозную мембрану Optitran нитроцеллюлозная ВА-S-подложка, поры 0,2 мкм, Schleicher and Schuell, Keene, NH) с помощью электрофореза. После переноса мембраны обрабатывали буфером для блокировки [25 мМ трис-HCl (рН 8,0), 125 мМ NaCl, 0,5% твин-20 и 5% обезжиренное сухое молоко] в течение 45 мин при комнатной температуре. Иммуноблоттинг осуществляли, используя 1 мкг первого кроличьего антитела против поли(ADP-рибоза)полимеразы человека [PARP (H-250), Santa Cruz Biotechnology, Santa Cruz, CA], и конъюгированные пероксидазой хрена козьи антитела против иммуноглобулина кролика использовали в качестве второго антитела (Jackson Immunoresearch Laboratory, West Grove, PA) при разведении 1:3000. Меченные пероксидазой хрена полоски после проведения иммуноблоттинга и промывания "иммуноблоттов" исследовали с помощью усиленной хемилюминесценции (Pierce, Rockford, IL) и ауторадиографии (Kodak BioMax film; Rochester, NY).
ПРИМЕР 5
Анализ образования колоний
Клетки 66 cl.4-GFP засевали при концентрации 600 клеток в 35х10 мм планшете для культуры ткани (Nunclon, Rochester, NY) и оставляли прикрепляться в течение ночи при 37°С. На следующий день среду для роста клеток удаляли и заменяли средой для обработки клеток, содержащей α-ТЕА при концентрации 1,25, 2,5, 5 и 10 мкг/мл, этанольный контроль (0,1% этанол F.C. об./об.), или только средой (необработанные клетки). Обработки проводили на клетках в течение 10 дней без смены среды. После 10 дней среду удаляли и планшеты промывали посредством PBS три раза. Клетки окрашивали в течение 30 мин 1% метиленовым голубым в PBS и колонии >0,5 мм "вручную" подсчитывали.
ПРИМЕР 6
Мыши линии balb/с
Мышей самок линии Balb/cJ в возрасте 6 недель (25 г веса тела) получали из Jackson Labs (Bar Harbor, ME) и оставляли акклиматизироваться, по крайней мере, в течение одной недели. Животных содержали в Animal Resource Center at the University of Texas at Austin при 74±2°F с влажностью 30-70% и 12-часовом перемежающемся цикле свет-темнота. Животных содержали по 5 на клетку и давали воду и стандартную лабораторную пищу ad libitum. Заявители следовали указаниям относительно гуманного обращения с животными, утвержденным University of Texas Institutional Animal Care and Use Committee.
ПРИМЕР 7
Инокуляция опухолевых клеток
Клетки 66 cl.4-GFP собирали посредством трипсинизации, центрифугирования, повторного суспендирования в среде МсСоу, не содержащей добавок, при плотности 2×105/100 мкл. Мышам вводили посредством инъекции клетки в паховую область у точки, находящейся на равном расстоянии между 4-м и 5-м сосками на правой стороне, с помощью иглы калибром 23.
50 мышей (10 мышей на группу) подвергали обработке аэрозолем, аэрозольным контролем, подвергали пероральной обработке, контрольный образец также давали перорально или не подвергали никакой обработке так, что средние объемы опухоли для всех групп близко соответствовали друг другу. В каждой группе размер опухоли составлял 2×2-4×4 мм в начале обработок, которые были начаты через девять дней после инокуляции опухолевых клеток. Десять дополнительных мышей, которых не инъецировали опухолевыми клетками, обрабатывали аэрозолем или перорально посредством α-ТЕА (5 каждая) в течение 17 дней, обработку заканчивали и наблюдали в течение дополнительных 11 месяцев, чтобы оценить безопасность применения препарата в течение длительного времени. Опухоли измеряли с помощью кронциркуля через день и объемы рассчитывали, используя формулу: объем (мм3) = [ширина (мм)2 × длину (мм)]/2. Вес тела определяли еженедельно.
ПРИМЕР 8
Приготовление и введение α-ТЕА, солюбилизированного в арахисовом масле для доставки через желудочный зонд
α-ТЕА растворяли в 100% этаноле (400 мг/мл) и затем смешивали с арахисовым маслом (100% арахисовое масло; nSpired Natural Foods, San Leandro, CA) при соотношении 1:8 (об./об.). Контрольная проба содержала эквивалентные количества этанола и арахисового масла, которые содержались в пробе с α-ТЕА. Смеси энергично перемешивали, затем хранили при 4°С до использования. Температуру смеси α-ТЕА/арахисовое масло доводили до комнатной температуры и вводили 100 мкл/мышь в день посредством желудочного зонда. Такое количество соответствует конечной концентрации 5 мг α-ТЕА/мышь/день.
ПРИМЕР 9
Приготовление липосомальной композиции, содержащей 2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусную кислоту (α-ТЕА)
Соотношение α-ТЕА/липосома, составляющее 1:3 (мас./мас.), было определено эмпирически как оптимальное способами, описанными ранее (17). Для того чтобы приготовить комбинацию α-ТЕА/липид, температуру компонентов вначале доводили до комнатной. Липид [1,2-дилауроил-sn-глицеро-3-фосфохолин (DLPC); Avanti Polar-Lipids, Inc., Alabaster, AL] при концентрации 120 мг/мл растворяли в третичном бутаноле (Fisher Scientific, Houston, TX), затем диспергировали с помощью ультразвука с получением прозрачного раствора. Также α-ТЕА растворяли при концентрации 40 мг/мл в третичном бутаноле и энергично перемешивали до тех пор, пока не растворялись все твердые частицы. Затем два раствора объединяли в равных количествах (об./об.) при энергичном перемешивании с получением желаемого соотношения α-ТЕА/липосома 1:3, замораживали при -80°С в течение 1-2 час и лиофилизировали в течение ночи до получения сухого порошка перед хранением при -20°С до тех пор, пока не потребуется. Каждый пузырек содержал 75 мг α-ТЕА.
ПРИМЕР 10
Приготовление аэрозоля и введение липосом, содержащих 2,5,7,8-тетраметил-(2R-(4R,8R,12-триметилтридецил)хроман-6-илокси)уксусную кислоту (α-ТЕА)
Аэрозоль вводили мышам, как описано ранее (17). Кратко, воздушный компрессор (Easy Air 15 Air Compressor (Precision Medical, Northampton, PA)), производящий поток воздуха 10 л/мин, использовали с распылителем типа AeroTech II (CIS-US, Inc. Bedford, MA), чтобы получить аэрозоль. Размер частиц содержащего α-ТЕА липосомального аэрозоля, выпущенного из распылителя типа AeroTech II, определяли с помощью каскадного импактора Anderson, и он составил 2,01 мкм среднего массового аэродинамического диаметра (NMAD) с геометрическим стандартным отклонением 2,04. Приблизительно 30% таких частиц при вдыхании будут откладываться в дыхательных путях мыши и оставшиеся 70% будут выдыхаться (17).
До распыления порошок α-ТЕА/липид доводили до комнатной температуры, затем восстанавливали путем добавления 3,75 мл дистиллированной воды с получением конечной желаемой концентрации α-ТЕА 20 мг/мл. Смесь оставляли набухать при комнатной температуре в течение 30 мин с периодическим перемешиванием и затем добавляли в распылитель. Полученная композиция с α-ТЕА может быть введена перорально с помощью желудочного зонда при уровнях 4 мг α-ТЕА/0,1 мл. Мышей помещали в пластиковые клетки (7×11×5 дюймов) с герметичной крышкой в защитный чехол. Аэрозоль впускали в клетку через 1-сантиметровую гофрированную трубку у одного конца и выпускали у противоположного конца, используя односторонний клапан для сброса давления. Животных подвергали обработке аэрозолем до тех пор, пока вся композиция α-ТЕА/липосома не была распылена, приблизительно 15 мин.
ПРИМЕР 11
Аэрозольные свойства α-ТЕА, включенной в липосомы
Анализы содержащих α-ТЕА липосом, полученных из аэрозоля в All Glass Impinger (Асе Glass Co., Vineland, NJ), проводили посредством ВЭЖХ. Доставленная дозировка = концентрация (мкг/л) × минутный объем мыши (1 мин/кг) × продолжительность доставки (мин) х предполагаемая отложившаяся фракция (30%; 17). На основании указанной формулы заявители установили, что приблизительно 36 мкг г α-ТЕА откладывалось в дыхательных путях каждой мыши каждый день (316,2 мкг г/л × 1 мин/кг × 15 мин × 0,30=1422,9 мкг г/кг/день).
ПРИМЕР 12
Анализы α-ТЕА в опухолях посредством ВЭЖХ
Опухоли удаляли при аутопсии и половину каждой опухоли быстро замораживали в жидком азоте, затем хранили при -70°С до тех пор, пока не начинали проводить ВЭЖХ анализы. Опухоли для анализа ВЭЖХ обрабатывали путем гомогенизирования и экстрагирования липидов гексаном. Кратко, взвешенные опухоли помещали в 5 мл одноразовые конические пробирки (Sarstedt, Newton, NC) наряду с 5-7 стеклянными шариками Kimble (4 мм), 1 мл 1% SDS в воде, 1-2 мл 100% этанола и 1 мл гексана. Затем образцы перемешивали, используя смеситель типа Crescent Wig-L-Bug (модель 3110В Densply International, Elgin, IL), дважды по 1 мин каждый раз. Затем образцы центрифугировали в течение 5 мин при 1000 об/мин, и органический слой собирали, водный слой вновь смешивали с гексаном, энергично перемешивали, центрифугировали и обрабатывали более двух раз до того, как органический слой высыхал в атмосфере азота. Образцы "прогоняли" немедленно. Анализы ВЭЖХ с обращенной фазой с флуорометрической регистрацией эфирного аналога токоферола проводили, как описано Tirmenstein, M.A., et al. (23).
ПРИМЕР 13
Метастазы в легком и лимфатическом узле
Поражения метастазами в пяти долях легкого подсчитывали визуально во время вскрытия. Флуоресцирующие зеленые микрометастатические колонии раковых клеток в доле левого легкого и лимфатических узлах подсчитывали с помощью флуоресцентного микроскопа Nikon (TE-200) с 20Х объективом (200Х увеличение) и программы Image-Pro Plus (версия 4.1; Media Cybernetics, Silver Spring, MD), объединенной с микроскопом. Флуоресцирующие поражения разделяли на три группы по размерам: <5 мкм, 5-10 мкм и >10 мкм.
ПРИМЕР 14
Анализ TUNEL определения апоптоза in vivo
Депарафинизированные срезы (5 мкм) опухолевой ткани использовали для оценки апоптоза с помощью реагентов, находящихся в наборе ApopTag in situ Apoptosis Detection kit (Intergen, Purchase, NY), соответственно инструкциям производителей. Ядра, окрашенные коричневым цветом, считали как положительные в отношении апоптоза и ядра, которые были окрашены голубым цветом, считали как отрицательные. По крайней мере, шестнадцать 400Х полей микроскопа использовали для подсчета на опухоль. Данные представлены как средние величины ± стандартная ошибка числа апоптических клеток, подсчитанных в трех отдельных опухолях от каждой группы. Картины опухолевой ткани рассматривали при 1000Х увеличении.
ПРИМЕР 15
Н&Е окрашивание опухолевой ткани
Опухоли фиксировали 10% нейтральным забуференным раствором формалина и включали в парафин согласно стандартным гистологическим процедурам. Н&Е окрашенные срезы толщиной 5 мкм использовали для морфологической проверки опухоли.
ПРИМЕР 16
Гистологическая оценка 66 cl.4-GFP клеток
Опухолевые клетки молочной железы мыши характеризовали как веретенообразные клетки карциномы, плохо дифференцированные, с высоким митотическим индексом.
ПРИМЕР 17
Статистический анализ
Статистический анализ проводили с помощью программы Prism версии 3,0 (Graphpad, San Diego, CA). Количество животных для экспериментов определяли с помощью расчета по степеням. Веса животных и объемы опухолей анализировали по t критерию Стьюдента.
ПРИМЕР 18
Оценка противораковых свойств природных и синтетических токоферолов, токотриенолов и их производных
Мышам balb/c с помощью инъекции вводили клетки 66 cl.4-GFP в количестве 200000 подкожно в скопление жировой ткани грудной области между 4-м и 5-м сосками на правой стороне тела. Через 9 дней после инъецирования животных разделяли на группы (10 животных на группу) со сравнимыми размерами опухолей, колеблющимися между 0,5×0,5 мм - 1×2 мм. Животных обрабатывали липосомальными композициями с природным альфа- и гамма-токоферолом, природным альфа-токотриенолом, фракцией, обогащенной токотриенолом (TRF; данная фракция содержит приблизительно 32% альфа-токоферола, 20% альфа-токотриенола, 31% гамма-токотриенола и 12% дельта-токотриенола; Gould, M.N. (30)), синтетическим dl-альфа-токоферолом и синтетическим производным ацетатом dl-альфа-токоферола путем аэрозольной доставки в течение 19 дней или 21 дня. Животным давали 75 мг каждого соединения посредством распыления в день, причем каждому животному было доставлено 36 мкг каждого соединения в день. Животных ощупывали через день и объемы рассчитывали как (w2×1) /2.
Данные представлены только для RRR-гамма-токоферола и dl-альфа-токоферола (фиг.2). Липосомальная композиция, содержащая dl-альфа-токоферол, доставленная посредством аэрозоля, ингибировала рост клеток 66 cl.4-GFP на 81 и 73% на 15-й и 17-й день обработки соответственно. Хотя и не настольно эффективно, как dl-альфа-токоферол, другие соединения, такие как ацетат dl-альфа-токоферола, RRR-дельта-токоферол, RRR-альфа-токотриенол, токотриенолом обогащенная фракция (TRF), ингибировали опухолевый рост на 15-й день обработки на 29, 25, 34, 25% соответственно, и на 17-й день обработки - на 57, 40, 27 и 40% соответственно.
Липосомальные препараты с RRR-α-токоферолом и RRR-γ-токоферолом, доставленные посредством аэрозоля, усиливали опухолевый рост. Усиление опухолевого роста, определенного по объему опухоли, при обработке препаратами с RRR-α-токоферолом было незначительно выше, чем рост опухоли в контролях; однако объем опухоли у мыши, получавшей RRR-γ-токоферол, был значительно выше, чем объем опухоли у контрольной мыши (фиг.2).
В таблице 2 представлены данные в процентах ингибирования видимых метастазов легкого при обработке липосомальными препаратами витамина Е или его производных. Данные показывают, что липосомальный препарат с dl-α-токоферолом, доставленный посредством аэрозоля, значительно снижал количество видимых метастатических поражений легкого по сравнению с контролем.
Иммуногистохимический анализ опухолевых срезов от мышей, обработанных липосомальным препаратом с dl-альфа-токоферолом, доставленным посредством аэрозоля, показал, что данная форма витамина Е ингибирует опухолевый рост путем снижения количества кровеносных сосудов в опухоли на 51%, индуцирования апоптоза на 44% и снижения клеточной пролиферации на 33%. В таблице 3 перечислены механизмы, посредством которых липосомальный препарат с dl-альфа-токоферолом, доставленный аэрозолем, тормозил рост 66 cl.4-GFP опухолей.
Кроме того, исследование механизмов действия α-TEA на модели сингенной мыши с трансплантируемой раковой опухолью молочной железы показало, что α-TEA снижает клеточную пролиферацию и индуцирует апоптоз. Точнее, средние величины уровня биомаркера KI-67 пролиферации, определенные иммунохимическими методами, были значительно снижены, на 56%, и средние величины уровня апоптоза, определенные TUNEL иммуногистохимическими методами, были в значительной степени повышены, на 30%, по сравнению с контролями (неопубликованные данные). Таким образом, полагают, что указанные псевдомаркеры могут быть важными как биомаркеры для качественного и/или количественного определения эффективности химиопрофилактики посредством α-TEA.
ПРИМЕР 19
VES и α-TEA индуцируют апоптоз в клетках 66 cl.4-GFP in vitro
Предыдущие исследования указывают на то, что сукцинат витамина Е является сильным апоптическим индуктором во многих линиях раковых клеток человека, включая рак молочной железы. Для сравнения заявители включили сукцинат витамина Е в исследования in vitro апоптоза, индуцированного α-TEA. Раковые клетки 66 cl.4-GFP молочной железы balb/с мыши обрабатывали сукцинатом витамина Е или α-TEA и уровень апоптоза оценивали посредством морфологического анализа клеток, окрашенных DAPI, относительно конденсированных ядер и фрагментированной ДНК.
Ядра из 66 cl.4-GFP клеток, обработанных посредством 10 мкг/мл α-ТЕА или сукцината витамина Е в течение трех дней, оказались конденсированными и с фрагментами ДНК, что является признаками апоптоза, в то время как ядра из необработанных клеток не проявляли указанных признаков (фиг.3А). Клетки 66 cl.4-GFP, обработанные посредством 2,5, 5, 10 и 20 мкг/мл α-ТЕА или сукцината витамина Е в течение трех дней, оказались апоптическими в зависимости от дозы на 5, 6, 34 и 50% при обработке α-ТЕА и на 3, 5, 16 и 34% при обработке сукцинатом витамина Е (фиг.2В). Необработанные, VEH и EtOH контроли обнаружили фоновый уровень апоптоза на 2, 2 и 3% соответственно (фиг.3В).
Было показано, что α-ТЕА индуцирует апоптоз в зависимости от времени. Клетки 66 cl.4-GFP, обработанные посредством 10 мкг/мл α-ТЕА в течение 2-5 дней, оказались апоптическими на 20, 35, 47 и 58% соответственно (фиг.3С). Индукция апоптоза была подтверждена наличием PARP расщепления после обработки 66 cl.4-GFP клеток посредством 5, 10 и 20 мкг/мл α-ТЕА в течение 48 часов (фиг.3D). Фрагмент расщепления PARP с молекулярной массой 84 кДа был обнаружен как при обработке посредством 10 мкг/мл, так и при обработке посредством 20 мкг/мл α-ТЕА, в то время как только интактный PARP белок определяли в клетках, обработанных посредством 5 мкг/мл α-ТЕА или в необработанных контрольных клетках (фиг.3D).
ПРИМЕР 20
Индукция апоптоза посредством α-TEA in vivo
Исходя из полученных in vitro данных, показывающих, что α-ТЕА тормозит рост 66 cl.4-GFP опухолевых клеток посредством индукции апоптоза, три опухоли от каждой обработки липосомальным аэрозолем, содержащим α-ТЕА, и контрольные группы, подвергаемые обработке только аэрозолем, проверяли относительно апоптоза, используя TUNEL окрашивание опухолевых срезов размером 5 микрон. Опухоли от мышей, обработанных посредством α-ТЕА, содержали в среднем ± стандартная ошибка 2,04±0,23 апоптических клеток/поле, в то время как опухоли от контрольных мышей, подвергаемых обработке только аэрозолем, содержали в среднем ± стандартная ошибка 0,67±0,15 апоптических клеток/поле (р<0,03; фиг.4А). Положительно окрашенные апоптические клетки в опухолевых срезах от мышей, обработанных липосомальным аэрозолем, содержащим α-ТЕА, и контрольным аэрозолем, можно увидеть на фиг.4В.
ПРИМЕР 21
α-ТЕА ингибирует рост 66 cl.4-GFP клеточного клона
α-ТЕА при концентрации 1,25, 2,5 и 5 мкг/мл уменьшала образование колоний на 30, 85 и 100% относительно контроля с EtOH (фиг.5). Необработанные клетки (данные не показаны) и EtOH контроли образовывали в среднем ± стандартное отклонение 146±11 и 140±22 колоний соответственно. Клетки, обработанные посредством α-ТЕА при концентрации 1,25 и 2,5 мкг/мл, образовывали в среднем ± стандартное отклонение 98±20 и 21±6 колоний соответственно. Никаких колоний не образовывалось, когда клетки обрабатывали α-ТЕА при концентрации 5 (фиг.5) или 10 мкг/мл.
ПРИМЕР 22
Действие обработки липосомальным аэрозолем с α-ТЕА на вес тела
Мышам balb/c, 10 мышей /группу (4 группы, всего 40 мышей), вносили клетки 66 cl.4-GFP в количестве 200000, как описано, на день 0. Через девять дней после инокуляции начинали обработку групп: обработка аэрозолем (ТХ) = аэрозольная доставка липосом с α-ТЕА (5 мг/мышь)/ежедневно по 23 день. Аэрозольный контроль = аэрозольная доставка липосомальной композиции только ежедневно по 23 день. Обработка посредством желудочного зонда = введение через зонд α-ТЕА при 5 мг/мышь в смеси этанол/арахисовое масло ежедневно по 23 день. Контроль посредством желудочного зонда = введение через зонд смеси этанол/арахисовое масло только по 23 день. Мышей взвешивали в начале обработки (день 9) и после обработки на дни 13, 16, 20 и 23 (фиг.6). Данные представлены как средние величины ± стандартное отклонение. Значительных различий в весе в четырех группах не обнаружили.
ПРИМЕР 23
Действие обработки липосомальным аэрозолем с α-ТЕА на уровни α-ТЕА в сыворотке и ткани
Восемь мышей обрабатывали аэрозолем посредством доставки в легкие 40 мг α-ТЕА (5 мг/мышь) в 6 мл липосом. Мыши вдыхали аэрозоль в течение периода 30 минут до окончания доставки. Мышей убивали через 0, 2, 6 или 24 часа после окончания обработки. Уровни α-ТЕА в сыворотке и ткани определяли посредством ВЭЖХ (фиг.7). При первом экспериментальном времени (время 0) α-ТЕА обнаруживали только в ткани желудка. α-ТЕА обнаруживали в сыворотке и желудке мышей, убитых через 2 часа после окончания обработки. α-ТЕА обнаруживали в печени и желудке мышей, убитых через 6 часов после окончания обработки. α-ТЕА обнаруживали в печени и желудке мышей, убитых через 24 часа после окончания обработки.
ПРИМЕР 24
Действие обработки липосомальным аэрозолем с α-ТЕА на вес опухоли
Мышам вводили посредством инъекции 66 cl.4-GFP опухолевые клетки молочной железы мыши в количестве 200000, как описано, на день 0. Обработки начинали на 9-й день, когда опухоли достигали размера 1-3 мм. Аэрозольные обработки липосомами с α-ТЕА (5 мг α-ТЕА/мышь) производили ежедневно в течение 16 дней (фиг.8). Данные представлены как средние величины ± стандартная ошибка (SE), N=10 мышей для контрольной группы и группы, подвергаемой обработке. Когда мышей убили на 25, 16 дни после начала обработки, размер опухоли в группе, подвергаемой обработке липосомальным аэрозолем с α-ТЕА, был на 61% меньше, чем размер опухоли в контрольной группе, подвергаемой обработке только аэрозолем.
ПРИМЕР 25
Обработка посредством липосомальной α-TEA/аэрозоля подавляла рост 66 cl.4-GFP опухоли у balb/c мышей и уменьшала микрометастазы легкого
Balb/c мышам посредством инъекции вводили s.c. 2×105 клеток 66 cl.4-GFP в паховую область между 4-м и 5-м соском на правой стороне тела. Когда опухоли достигали размера 2×2-4×4 мм (9 дней после инъекции опухоли), мышей делили на 5 групп ((группа 1: необработанный контроль, группа 2: контроль липосома/аэрозоль, группа 3: обработка липосомальным аэрозолем с α-ТЕА, группа 4: контроль арахисовое масло/желудочный зонд, группа 5: обработка посредством α-ТЕА в арахисовом масле/желудочный зонд) из 10 мышей на группу), так что средний объем опухоли в каждой группе соответствовал друг другу. Ежедневные обработки начинали осуществлять на 9-й день после инъекции опухоли.
Средний объем опухоли в группе, подвергаемой обработке липосомальным аэрозолем с α-ТЕА, в сравнении с аэрозольным контролем, снижался на 23, 41, 50, 67 и 61% в течение 9, 11, 13, 15 и 17 дней обработки соответственно (фиг.9А). После того как мышей убивали, у них удаляли легкие, проверяли визуально на наличие метастатических поражений и замораживали, чтобы проанализировать микрометастазы с помощью флуоресценции. В группе, подвергаемой обработке посредством α-ТЕА, никаких видимых опухолей не было обнаружено, в то время как необработанные группы и контрольные группы, обработанные аэрозолем только, имели видимые опухоли/животные объемом 3,25±1,7 и 4,25±0,5 соответственно, с метастазами в легких, как показано в таблице 4.
Применение флуоресцентного микроскопа Nikon и программы Image-Pro Plus позволило сгруппировать микрометастазы в три группы по размерам <5 мкм, 5-10 мкм и >10 мкм на основании определения зеленых флуоресцирующих микрометастазов. Данный анализ показал весьма значительное уменьшение количества метастазов всех трех размеров в группе, подвергаемой обработке посредством α-ТЕА, по сравнению с необработанными контрольными группами и группами, подвергаемыми обработке аэрозолем только (фиг.9В). Среднее число микрометастазов в группе, подвергаемой обработке посредством α-ТЕА (11,4±3,5 стандартная ошибка; N=8), по сравнению с контрольной группой, подвергаемой обработке аэрозолем только (60,0±15 стандартная ошибка; N=10), было снижено на 81% (р<0,2). Хотя среднее число микрометастазов в контрольной группе, обработанной аэрозолем, против необработанной контрольной группы (N=10) было снижено (60±15,2 стандартная ошибка против 101,7±17,0 стандартная ошибка; р<0,9), полагают, что разница была незначительной из-за большого диапазона в количестве микрометастазов среди мышей в пределах указанных двух групп (фиг.9В).
ПРИМЕР 26
Сравнение действия липосом, содержащих α-ТЕА и сукцинат витамина Е (VES), доставленных распылением, на рост опухолевых клеток 66 cl.4-GFP
Мышам balb/c посредством инъекции вводили клетки 66 cl.4-GFP в количестве 200000 подкожно в скопление жировой ткани грудной области между 4-м и 5-м соском на правой стороне тела. Через 9 дней после инъецирования животных разделяли на группы (10 животных на группу) со сравнимыми размерами опухолей, колеблющимися между 0,5×0,5 мм - 1×2 мм. Животных обрабатывали посредством α-ТЕА в липосоме, сукцината витамина Е в липосоме или контрольной липосомы только в виде аэрозоля 7 дней в неделю в течение 21 дня. Животным давали 75 мг соединения в день посредством распыления так, что каждое животное получало 36 мкг соединения в день. Животных пальпировали через день и объемы рассчитывали как (w2×1)/2. Липосомальный аэрозоль, содержащий α-ТЕА, снижал опухолевый рост на 64, 76, 69 и 67% на дни 15, 17, 19 и 21 соответственно (величины статистически значимо различались между α-ТЕА и контролем на дни 17, 19 и 21, р=0,03, 0,048 и 0,03 соответственно). Липосомальный аэрозоль, содержащий VES, снижал опухолевый рост на 76, 76, 69 и 68% на дни 15, 17, 19 и 21 соответственно (фиг.10). Величины статистически значимо различались между сукцинатом витамина Е и контролем на дни 17 и 21, р=0,029 и 0,029 соответственно.
ПРИМЕР 27
Действие доставки α-ТЕА через желудочный зонд на вес опухоли
Доставка α-ТЕА через желудочный зонд является неэффективной в предотвращении роста 66 cl.4-GFP опухолевых клеток молочной железы мыши на участке инокуляции (фиг.11). Заявители определяли размер опухолей через 9-21 день после инъецирования 66 cl.4-GFP клетками в количестве 200000 между 4-м и 5-м соском на правой стороне тела каждой мыши. Каждая группа состояла из n=10. Обработка через зонд = обработки 5 мг α-ТЕА в этаноле и арахисовом масле (объем 0,1 мл) осуществляли ежедневно, начиная с 9-го дня после инокуляции опухоли и продолжая в течение 21 дня. Контроль через зонд = мыши получали арахисовое масло и этанол только (объем 0,1 мл)/день, начиная с 9-го дня после инокуляции опухоли и продолжая в течение 21 дня. Данные (размер опухоли) выражали как среднее значение ± стандартная ошибка относительно дней 9, 11, 13, 15, 17, 19 и 21. Значительных различий в весе опухолей между контрольной группой и группой, подвергаемой обработке α-ТЕА через зонд, во всех временных точках не наблюдали.
ПРИМЕР 28
Доставка α-ТЕА через зонд не снижала рост опухоли на участке инокуляции, но снижала уровень микрометастазов легкого
В противоположность обработке липосомальным аэрозолем с α-ТЕА средние объемы опухолей у мышей, получавших 5 мг/день/мышь композиции α-ТЕА в EtOH/арахисовом масле, введенной через зонд, не отличались от среднего объема опухоли у мышей, получавших контроль через зонд (фиг.12А). Однако введение α-ТЕА через зонд снижало количество микрометастазов легкого на 68%. Количество микрометастазов, основанное на трех группировках по размерам (<5 мкм, 5-10 мкм, >10 мкм), было 6,8±1,5, 11,3±1,8 и 3,1±1,2 стандартная ошибка у мышей, которым α-ТЕА вводили через зонд, в то время как количество микрометастазов у контрольной группы мышей было 27,9±9,0, 29,2±6,3 и 8,4±1,5 стандартная ошибка соответственно (фиг.12В).
Никаких различий в среднем весе тела среди любой из контрольных групп или групп, подвергаемых обработке, не наблюдали (данные не показаны).
У мышей без опухоли, которых обрабатывали либо аэрозолем/α-ТЕА, либо через зонд в течение 17 дней и затем содержали в течение одиннадцати месяцев, чтобы оценить продолжительность действия препарата, не обнаружено вредное воздействие обработок посредством α-ТЕА.
Хотя введение α-ТЕА посредством аэрозоля было значительно лучше, чем введение через зонд тем, что введенный через зонд α-ТЕА не снижал размер опухоли на участке инокуляции по сравнению с размером опухоли контрольной мыши, интерес представляет тот факт, что количество микрометастазов легкого снижалось по сравнению с контролем, когда α-ТЕА вводили через зонд. Полагают, что α-ТЕА был биодоступным. Поскольку α-ТЕА не гидролизуется, и, кроме того, проверки показали, что при введении ее через зонд она должна представлять собой эффективное противоопухолевое средство, полагают, что введенная через зонд α-ТЕА при 5 мг/мл/день/мышь не снижала рост опухоли на участке опухолевой инокуляции вследствие низкого всасывания через пищеварительный тракт. Таким образом, предположили, что низкие уровни α-ТЕА могут быть эффективными в предотвращении образования очагов опухоли в легких.
ПРИМЕР 29
Сравнение степени ингибирования роста опухоли и метастазов легкого и лимфатического узла 66 cl.4 опухолей молочной железы при обработке посредством α-ТЕА/зонда, липосомального α-ТЕА/зонда и липосомального α-ТЕА/аэрозоля
Хотя композиция α-TEA/EtOH/арахисовое масло, введенная через зонд, была эффективной в отношении ингибирования микрометастазов легкого, она не ингибировала рост опухоли у сингенной модели животного с трансплантируемым раком молочной железы. Однако липосомальная композиция, содержащая α-ТЕА, вводимая перорально через зонд дважды в день при 6 мг α-ТЕА/день, представляет собой эффективное средство доставки для предотвращения роста опухоли, а также метастазов 66 cl.4 balb/c опухолевых клеток молочной железы у самок balb/c мышей. Липосомальная композиция α-ТЕА, доставленная через зонд, ингибировала опухолевый рост на 70% и ингибировала метастазы легких и лимфатического узла на 59% и 56%. Было подсчитано, что 36 мкг α-ТЕА откладывалось в легких мышей/день в случае, когда α-ТЕА/липосомальные препараты вводили посредством аэрозоля. Количество α-ТЕА, отложенное в тканях в случае, когда α-ТЕА/липосомальную композицию или композицию α-TEA/EtOH/арахисовое масло вводили через зонд, не известно. Сравнение противоопухолевой эффективности различных режимов обработки показано в таблице 5.
ПРИМЕР 30
Сравнение действия липосом, содержащих α-ТЕА и сукцинат витамина Е, доставленных через зонд, на рост 66 cl.4-GFP опухоли
Липосомальный препарат, содержащий α-TEA, доставленный перорально через зонд, ингибировал рост раковых клеток молочной железы мыши, трансплантированных в balb/c мышей. Липосомальный препарат, содержащий сукцинат витамина Е, доставленный перорально через зонд, не ингибировал рост раковых клеток молочной железы мыши, трансплантированных в balb/c мышей. Balb/c мышам посредством инъекции вводили 66 cl.4-GFP клетки в количестве 200000 подкожно в скопление жировой ткани грудной области между 4-м и 5-м соском на правой стороне тела. Через 9 дней после инъекции животных разделяли на группы (10 животных на группу) со сравнимыми размерами опухолей, колеблющимися между 0,5×0,5 мм - 1×2 мм. Животных обрабатывали посредством α-ТЕА в липосоме, сукцината витамина Е в липосоме или контрольной липосомы только через пероральный зонд 2 раза в день, 7 дней в неделю в течение 21 дня. Животным давали всего 6 мг соединения в день. Животных пальпировали через день, и объемы рассчитывали как (w2×1)/2. Обработка посредством α-ТЕА в липосоме через зонд снижала опухолевый рост на 85, 85, 80 и 70% на дни 15, 17, 19 и 21 соответственно (величины статистически значительно различались между α-ТЕА и контролем на дни 15, 17 и 19, р=0,03, 0,039 и 0,029 соответственно). Обработка посредством VES в липосоме не снижала опухолевый рост (фиг.13).
ПРИМЕР 31
Обработка липосомальным препаратом с α-ТЕА через зонд уменьшала микрометастазы 66 cl.4-GFP лимфатического узла и легкого
Balb/c мышам посредством инъекции вводили 66 cl.4-GFP клетки в количестве 200000 подкожно в скопление жировой ткани грудной области между 4-м и 5-м соском на правой стороне тела. Через 9 дней после инъекции животных разделяли на группы (10 животных на группу) со сравнимыми размерами опухолей, колеблющимися между 0,5×0,5 мм - 1×2 мм. Животных обрабатывали посредством α-ТЕА в липосоме, сукцината витамина Е в липосоме или контрольной липосомы только через пероральный зонд 2 раза в день, 7 дней в неделю в течение 21 дня. Животным давали всего 6 мг соединения в день. После забоя долю левого легкого каждой мыши мгновенно замораживали и использовали для определения микрометастатических поражений через экспрессию GFP с помощью флуоресцентного микроскопа.
У животных, которым давали липосомальный препарат α-ТЕА через зонд, обнаружили значительное уменьшение микрометастатических поражений легкого по сравнению с контролем (21,5/легкое против 52,7/легкое соответственно). Липосомальный препарат сукцината витамина Е, доставляемый через зонд, не воздействовал на метастазы легкого (фиг.14А). После забоя мышей лимфатические узлы собирали и осматривали на предмет микрометастатических поражений легкого. У животных, которым давали α-ТЕА через зонд, обнаружили в среднем 3,1±0,8 микрометастатических поражений в лимфатическом узле против 7,1±1,7 микрометастатических поражений в лимфатическом узле в контрольной группе животных (р=0,036). Препарат сукцината витамина Е, доставленный через зонд, не был эффективным в отношении уменьшения микрометастатических поражений легкого (фиг.14В).
ПРИМЕР 32
Обработка липосомальным препаратом α-TEA через зонд снижала опухолевый рост MDA-MB-435 клеток молочной железы in vivo
Бестимусным голым мышам Nu/Nu посредством инъекции вводили 1,0×106 клеток MDA-MB-435 GFP FL подкожно в скопление жировой ткани грудной области между 4-м и 5-м соском на правой стороне тела. Через 8 дней после инъекции животных разделяли на группы (10 животных на группу) со сравнимыми размерами опухолей, колеблющимися между 0,5×0,5 мм - 2×2 мм. Животных обрабатывали посредством альфа-ТЕА в липосоме или контрольной липосомой только через пероральный зонд 2 раза в день, 7 дней в неделю в течение 21 дня. Животным давали всего 8 мг соединения в день. Животных пальпировали через день и объемы рассчитывали как (w2×1)/2. Обработка посредством α-ТЕА в липосоме через зонд снижала опухолевый рост на 68, 75, 78 и 79% на дни 27, 29, 31 и 35 соответственно (фиг.15). Величины статистически значительно различались между α-ТЕА и контролем на дни 33 и 35 (р=0,045 и 0,033 соответственно).
ПРИМЕР 33
Ингибирование опухолевого роста и метастазирования 66 cl.4-GFP опухолей у balb/c мышей при обработке аэрозольной комбинацией липосомальной/α-ТЕА + 9NC
Самкам мышей balb/c в возрасте 6 недель посредством инъекции вводили подкожно 66 4-GFP клон опухолевых клеток молочной железы между 4-м и 5-м сосками на правой стороне. Когда опухоли достигали размера 1×1 миллиметр, начинали обработки аэрозолем. α-ТЕА, введенная отдельно и в комбинации с низким уровнем, 0,403 мкг/день, 9-нитрокамптотецина, является эффективным ингибитором опухолевого роста. Аэрозольная доставка α-ТЕА + 9-нитрокамптотецин ингибировала рост опухоли молочной железы мыши на 90%, в то время как α-TEA и 9-нитрокамптотецин только ингибировали опухолевый рост на 65% и 58% соответственно. Аэрозольная доставка α-ТЕА + 9-нитрокамптотецина ингибировала микрометастатические поражения подмышечного лимфатического узла и легкого на 87% и 71%, в то время как α-ТЕА и 9-нитрокамптотецин, введенные только посредством аэрозоля, ингибировали микрометастатические поражения лимфатического узла на 94% и 60% и микрометастатические поражения легкого на 71% и 55% соответственно. Таким образом, α-ТЕА + 9-нитрокамптотецин, введенные последовательно, ингибировали опухолевый рост лучше, чем при введении двух лекарственных средств раздельно. α-ТЕА является эффективным препаратом для ингибирования метастазирования легкого и лимфатического узла как введенный отдельно, так и в комбинации с 9-нитрокамптотецином. Сравнительные данные относительно действия α-ТЕА, введенной отдельно и в комбинации с 9-нитрокамптотецином, направленного на предотвращение опухолевого роста и метастазирования, представлены в таблице 6 ниже.
ПРИМЕР 34
α-ТЕА превращает устойчивые к цисплатину Ср-70 раковые клетки яичника человека в клетки, чувствительные к цисплатину
Комбинации α-ТЕА + цисплатин повышают гибель опухолевых клеток in vitro и in vivo. Клеточная линия ср-70, рак яичника человека, проявляет устойчивость к цисплатину, лекарственному препарату платины, который обычно применяют в первую очередь для обработки опухолей яичника. Субклон ср-70 был получен in vitro из А2780 цисплатинчувствительной линии клеток посредством периодического подвергания воздействию увеличивающихся уровней цисплатина, вплоть до 70 мМ. Когда обе клеточные линии, А2780 и ср-70, подвергали обработке в культуре посредством α-ТЕА, они претерпевали апоптоз (фиг.16А). Обработка ср-70 раковых клеток яичника человека субоптимальными уровнями цисплатина (0,625 и 1,25 мкг/мл) и α-ТЕА (10 мкг/мл) восстанавливала чувствительность цисплатина к ср-70 клеткам, повышала уровни апоптоза в А2780 клеточной линии и восстанавливала чувствительность цисплатина в ср-70 клеточной линии (фиг.16В). α-ТЕА в комбинации с цисплатином ингибировала рост ср-70 клеток in vivo. Ген зеленого флуоресцирующего белка (GFP) экспрессировался в ср-70 клетках посредством вирусного заражения так, что клетки должны были светиться и могли быть использованы для исследования эффектов совместной обработки в мышиной модели ксенотрансплантации. Обработку комбинацией цисплатина и α-ТЕА производили in vivo на модели голой мыши с ксенотрансплантацией. В данной модели самок голых мышей инокулировали 1×106 клетками подкожно между 4-м и 5-м сосками. Когда средний размер опухоли достигал 1,0 мм3, мышей отбирали для обработки либо только α-ТЕА, доставленной посредством аэрозоля в липосомах, только цисплатином (5 мг/кг), введенным с помощью инъекции I.P. один раз в неделю в течение 3 недель, цисплатина + α-ТЕА, либо контрольным аэрозолем (только липосома). Данные показали, что обработка посредством α-ТЕА + цисплатин представляет собой эффективный способ ингибирования роста устойчивых к цисплатину ср-70 раковых клеток яичника человека (фиг.16С).
ПРИМЕР 35
Действие альфа-ТЕА, метилселеноцистеина и транс-ресвератрола на раковые клетки MDA-MB-435-GFP-FL молочной железы
Самкам NU/NU гомозиготных мышей вводили посредством инъекции один миллион MDA-MB-435 GFP FL клеток подкожно в скопление жировой ткани грудной области между 4-м и 5-м сосками на правой стороне тела. Через девять дней после инъекции животных разделяли на пять групп по десять животных со сравнимыми размерами опухолей, колеблющимися от 0,5 мм × 0,5 мм до 2,0 мм × 2,0 мм. Животным через зонд давали 3 части на миллион метилселеноцистеина (MSC) в воде, α-ТЕА в липосоме посредством аэрозоля или через зонд давали 10 мг/кг веса тела транс-ресвератрола (t-RES) сначала в смеси 1:1, EtOH:физиологический раствор, и начиная с 24-го дня, в 6,5% EtOH и 93,5% масла ниобеи. Группу животных обрабатывали каждым из вышеуказанных трех соединений и контрольную группу обрабатывали липосомами в виде аэрозоля, 100 мкл воды и 50 мкл раствора t-Res. Животных обрабатывали семь дней в неделю в течение 35 дней. Опухоли пальпировали через день и объемы рассчитывали по формуле (w2×1) /2.
На 35-й день проверки было обнаружено, что в группе, подвергаемой обработке α-ТЕА, рост опухоли снижался на 47,8%, в группе, обрабатываемой MSC, рост опухоли снижался на 47,2%, в группе, обрабатываемой t-RES, рост опухоли увеличивался на 61,2% и в группе, подвергаемой комбинированной обработке, рост опухоли увеличивался на 19,8% от контроля (фиг.17). Группы статистически анализировали относительно контроля посредством t-теста, и р величины были р=0,0487, 0,0347, 0,2221 и 0,6255 для α-ТЕА, MSC, t-RES и комбинированной обработки соответственно. Таким образом, только в группах, обрабатываемых альфа-ТЕА и MSC, тестируемых отдельно, наблюдали снижение опухолевого роста, которое в значительной степени отличалось от контролей. Обработка транс-ресвератролом только и комбинацией трех соединений повышала опухолевый рост.
Следующие ссылки приводятся в тексте:
1. Prasad, et al., Effects of tocopherol (vitamin E) acid succinate on morphological alterations and growth inhibition in melanoma cells in culture. Cancer Res., 42: 550-554, 1982.
2. Prasad, et al., Vitamin E and cancer prevention: Recent advances and future potentials. J. Am. Coll. Nutr., 11: 487-500, 1992.
3. Schwartz, J., and Shklar, G. The selective cytotoxic effect of carotenoids and α-tocopherol on human cancer cell lines in vitro. J. Oral Maxillofac. Surg., 50: 367-373, 1992, conserved homolog, Bax, that accelerates programmed cell death. Cell, 74: 609-619, 1993.
4. Fariss, et al., The selective antiproliferative effects of α-tocopheryl hemisuccinate and cholesteryl hemisuccinate on murine leukemia cells result from the action of the intact compounds. Cancer Res., 54: 3346-3351, 1994.
5. Kline, К., Yu, W., and Sanders, B.G.Vitamin E Mechanisms of action as tumor cell growth inhibitors. In: K.N.Prasad and W.C.Cole (eds.). Proceeding of the International Conference on Nutrition and Cancer, pp 37-53. Amsterdam: IOS Press, 1998.
6. Kline, K., Yu, W, and Sanders, B.G.Vitamin E Mechanisms of action as tumor cell growth inhibitors. J.Nutr., 131: 161S-163S, 2001.
7. Neuzil, J., Weber, Т., Gellert, N., and Weber, C.Selective cancer cell killing by α-tocopheryl succinate. Br.J.Cancer, 84: 87-89, 2000.
8. Malafa, M.P., and Neitzel, L.Т.Vitamin E succinate promotes breast cancer tumor dormancy. J.Surg. Res., 93: 163-170, 2000.
9. Malafa, et al., Vitamin E inhibits melanoma growth in mice. Surgery, 131: 85-91, 2002.
10. Neuzil, et al., Induction of cancer cell apoptosis by α-tocopheryl succinate: molecular pathways and structural requirements. FASEB J., 15: 403-415, 2001.
11. Weber, et al., Vitamin E succinate is a potent novel antineoplastic agent with high selectivity and cooperativity with tumor necrosis factor-related apoptosis-inducing ligand (Apo2 ligand) in vivo. Clin. Cancer Res., 8: 863-869, 2002.
12. Wu, et al., Inhibitory effects of RRR-alpha-tocopheryl succinate on benzo(a)pyrene (B(a)P)-induced forestomach carcinogenesis in female mice. World J.Gastroenterol, 7: 60-65. 2001.
13. You, H., Yu, W., Sanders, B.G., and Kline. K. RRR-α-tocopheryl succinate induces MDA-MB-435 and MCF-7 human breast cancer cells to undergo differentiation. Cell Growth Differ., 12: 471-480, 2001.
14. You, H., Yu, W., Munoz-Medellin, D., Brown, P.H., Sanders, B.G., and Kline, K. Role of extracellular signal-regulated kinase pathway in RRR-α-tocopheryl succinate-induced differentiation of human MDA-MB-435 breast cancer cells. Mol. Carcinogenesis, 33: 228-236, 2002.
15. Yu, et al., Activation of extracellular signal-regulated kinase and c-Jun-NH2-terminal kinase but not p38 mitogen-activated protein kinases is required for RRR-α-tocopheryl succinate-induced apoptosis of human breast cancer cells. Cancer Res., 61: 6569-6576, 2001.
16. Koshkina, et al., Distribution of camptothecin after delivery as a liposome aerosol or following intramuscular injection in mice. Cancer Chemother. Pharmacol., 44: 187-192, 1999.
17. Knight, et al., Anticancer effect of 9-nitrocamptothecin liposome aerosol on human cancer xenografts in nude mice. Cancer Chemother. Pharmacol., 44: 177-186, 1999.
18. Koshkina, et al., 9-Nitrocamptothecin liposome aerosol treatment of melanoma and osteosarcoma lung metastasis in mice. Clin. Cancer Res,. 6: 2876-2880, 2000.
19. Walrep, et al., Pulmonary delivery of beclomethasone liposome aerosol in volunteers. Chest., 111: 316-23, 1997.
20. Dexter, et al., Heterogeneity of tumor cells from a single mouse mammary tumor. Cancer Res., 38: 3174-3181, 1978.
21. Miller, В.Е., Roi, L.D., Howard, L.M., and Miller, F.R.Quantitative selectivity of contact-mediated intercellular communication in a metastatic mouse mammary tumor line. Cancer Res., 43: 4102-4107, 1983.
22. Yu, et al., Vitamin E succinate (VES) induces Fas sensitivity in human breast cancer cells: role for Mr 43,000 Fas in VES-triggered apoptosis. Cancer Res., 59: 953-961, 1999.
23. Tirmenstein, et al. Sensitive method for measuring tissue alpha-tocopherol and alpha-tocopheryloxybutyric acid by high-performance liquid chromatography with fluorometric detection. J. Chromatogr. В Biomed. Sci. Appl, 707: 308-311, 1998.
24. Schwenke, D. С.Does lack of tocopherols and tocotrienols put women at increased risk of breast cancer? J.Nutr. Biochem. 13:2-20, 2002.
25. Kamal-Eldin. A. and Appelqvist, L.-A. The chemistry and antioxidant properties of tocopherols and tocotrienols. Lipids 37: 671-701, 1996.
26. Waldrep, et al., Operating characteristics of 18 different continuous-flow jet nebulizers with beclomethasone dipropionate liposome aerosol. Chest 105: 106-110, 1994.
27. Waldrep, et al., Nebulized glucocordcoids in liposomes: Aerosol characteristics and human dose estimates. J Aerosol Medicine 7: 135-145. 1994.
28. Pantazis, P. et al. Regression of human breast carcinoma tumors in immunodeficient mice treated with 9-nitrocamptothecin: differential response of nontumori genie and tumorigenic human breast cells in vitro. Cancer Research 53: 1577-82. 1993.
29. Chatterjee, D. et al. Induction of apoptosis in 9-nitrocamptothecin-treated DU145 human prostate carcinoma cells correlates with de novo synthesis of CD95 and CD95 ligand and down-regulation of cFLlP(short). Cancer Research 61: 7148-7154, 2001.
30. Yu, W. et al. RRR-α-tocopheryl succinate-induction of DNA synthesis arrest of human MDA-MB-435 cells involves TGF-α-independent activation of p21 (Wafl/Cipl). Nutrition and Cancer In Press.
31. Gould. N. et al. A comparison of tocopherol and tocotrienol for the chemoprevention of chemically induced rat mammary tumors. Am. J. Clin. Nutr. 53: 1068S-1070S. 1991.
Любые патенты и публикации, упомянутые в данном описании, отражают уровень знаний и профессионализма тех специалистов в данной области, к которым изобретение имеет отношение. Кроме того, упомянутые патенты и публикации включены в данный текст посредством ссылки в такой степени, как если бы каждая индивидуальная публикация была особенным образом и отдельно включена посредством ссылки.
Специалисты в данной области легко оценят, что настоящее изобретение в достаточной степени приспособлено к осуществлению целей и получению результатов и преимуществ, о которых упоминали в описании. Настоящие примеры наряду со способами, процедурами, обработками, молекулами и специфическими соединениями, описанными в данном тексте, представляют теперь предпочтительные аспекты, являются иллюстративными и не стремятся к ограничению сферы изобретения. Изменения и другие применения могут быть осуществлены теми специалистами в данной области, которые охватывают объем изобретения, определенного рамками формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТОКОФЕРОЛЫ, ТОКОТРИЕНОЛЫ И ДРУГИЕ ПРОИЗВОДНЫЕ ХРОМАНА И БОКОВЫХ ЦЕПЕЙ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ИСПОЛЬЗОВАНИЕМ | 1999 |
|
RU2232758C2 |
| ТОКОФЕРОЛЫ, ТОКОТРИЕНОЛЫ, ДРУГИЕ ХРОМАНЫ И ПРОИЗВОДНЫЕ ПО БОКОВЫМ ЦЕПЯМ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2263672C2 |
| СПОСОБ ИДЕНТИФИКАЦИИ СОЕДИНЕНИЙ ДЛЯ ЛЕЧЕНИЯ РАКА | 2010 |
|
RU2575828C2 |
| СОСТАВЫ, ОБЛАДАЮЩИЕ АНТИКАНЦЕРОГЕННЫМИ СВОЙСТВАМИ | 2006 |
|
RU2435580C2 |
| ПРИМЕНЕНИЕ ВИРУСА МИКСОМЫ ДЛЯ ТЕРАПЕВТИЧЕСКОГО ЛЕЧЕНИЯ РАКА И ХРОНИЧЕСКОЙ ВИРУСНОЙ ИНФЕКЦИИ | 2004 |
|
RU2362584C2 |
| СПОСОБ ЛЕЧЕНИЯ СУБЪЕКТА С РАКОМ ТОЛСТОГО КИШЕЧНИКА ИЛИ РАКОМ ЛЕГКИХ | 2014 |
|
RU2713555C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ АГОНИСТА TLR И КОМБИНИРОВАННАЯ ТЕРАПИЯ | 2011 |
|
RU2603467C2 |
| СПОСОБ ПРОФИЛАКТИКИ И/ИЛИ ЛЕЧЕНИЯ РАКОВЫХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2480201C2 |
| ИММУНОМОДИФИЦИРУЮЩИЕ ЧАСТИЦЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2794261C2 |
| ПРОТИВОРАКОВАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ РЕКОМБИНАНТНЫЙ АДЕНОВИРУС, ЭКСПРЕССИРУЮЩИЙ РАЗРУШАЮЩИЙ ФАКТОР ДЛЯ ВНЕКЛЕТОЧНОГО МАТРИКСА | 2017 |
|
RU2742726C2 |
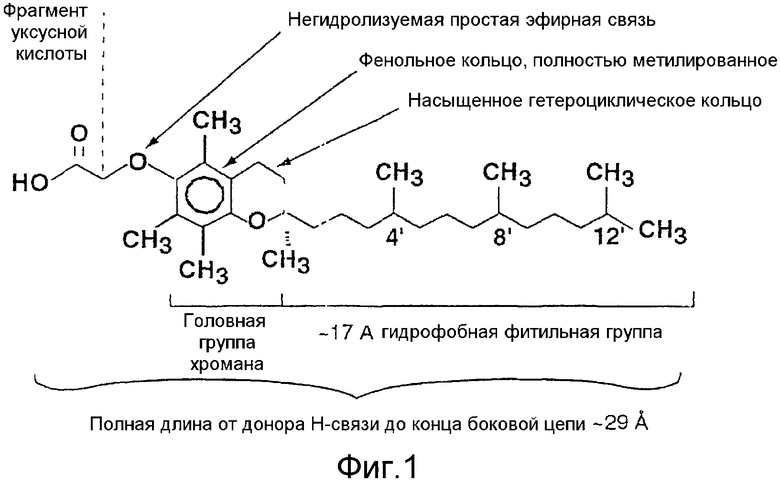
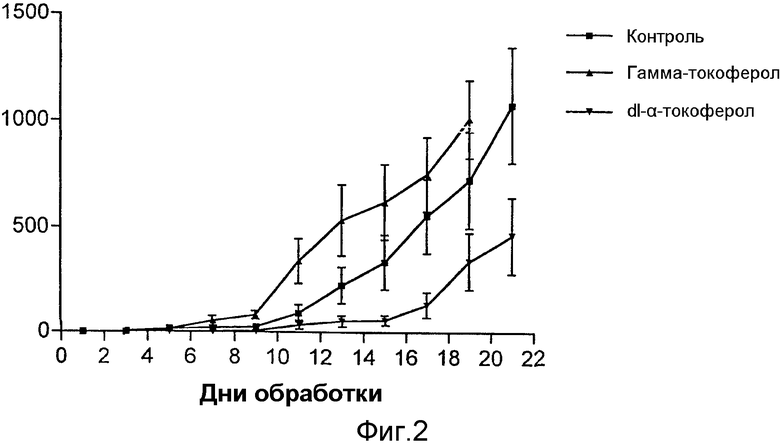
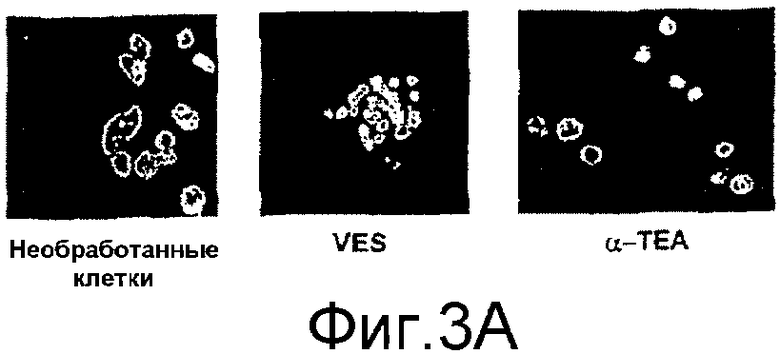
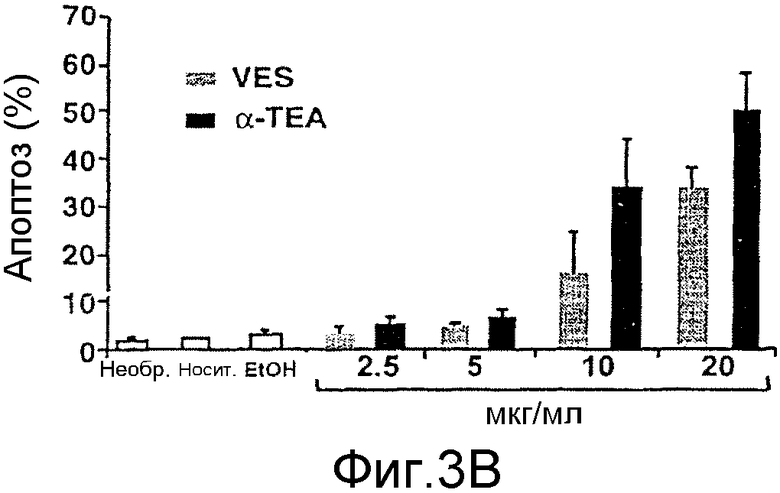
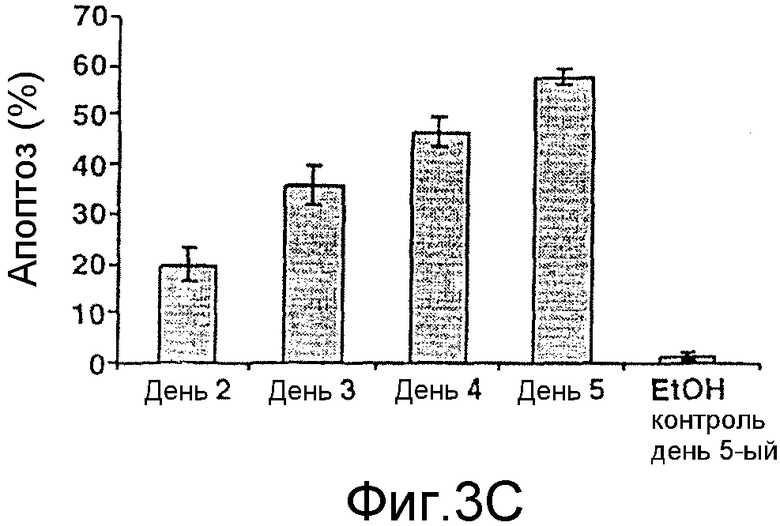
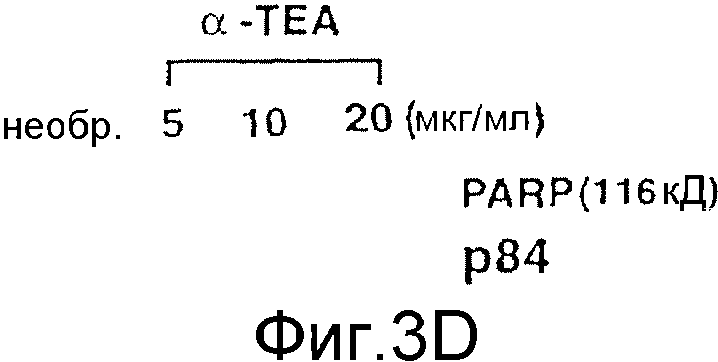


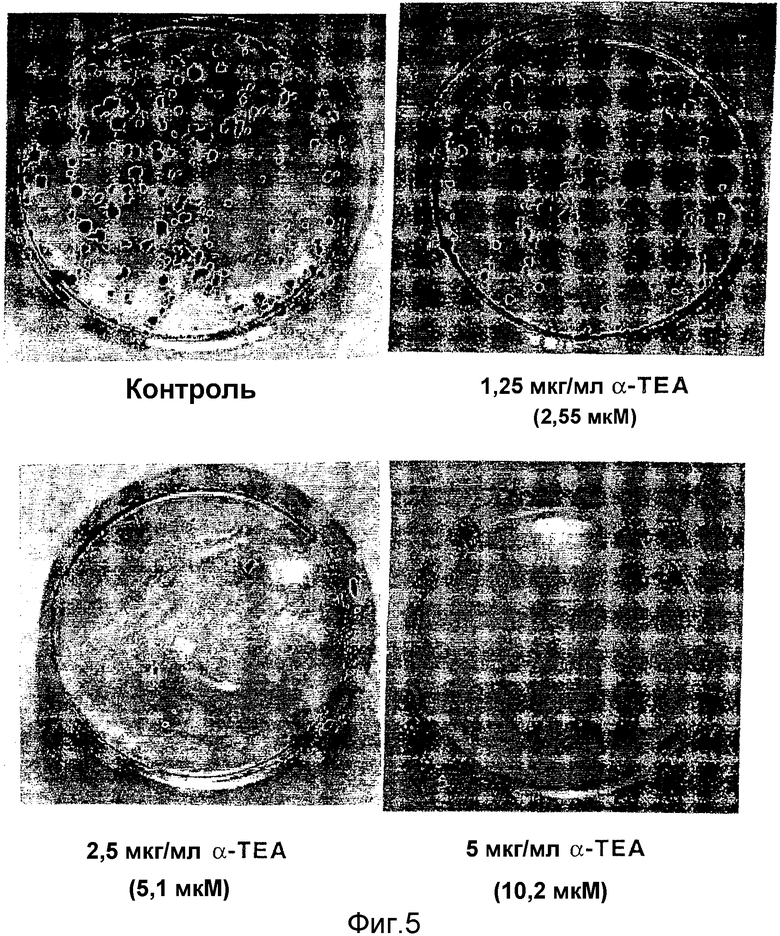
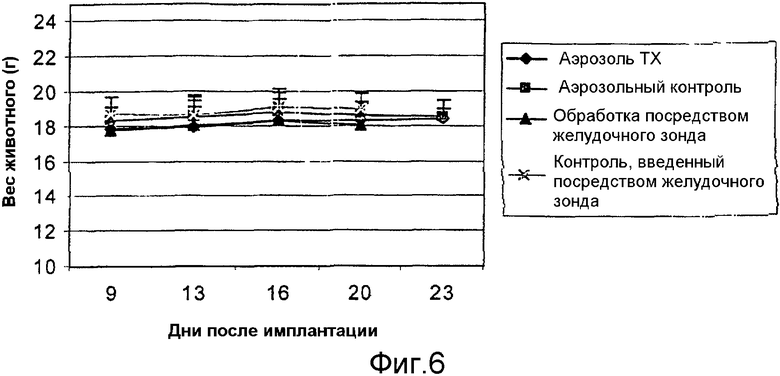
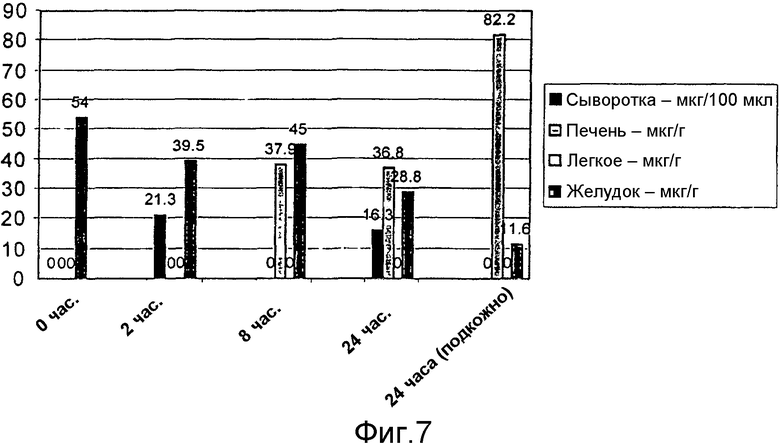
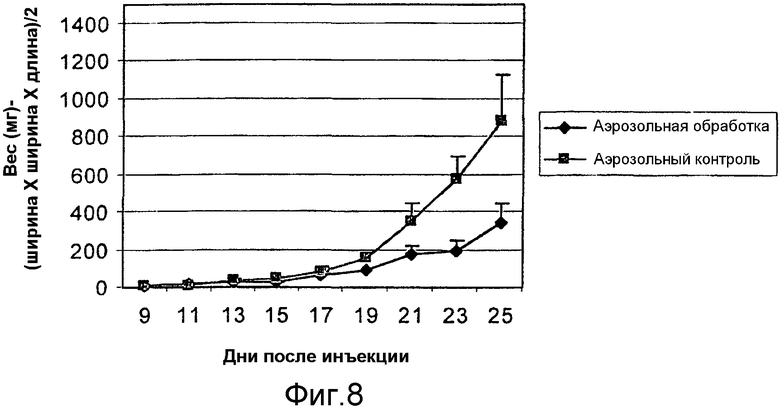
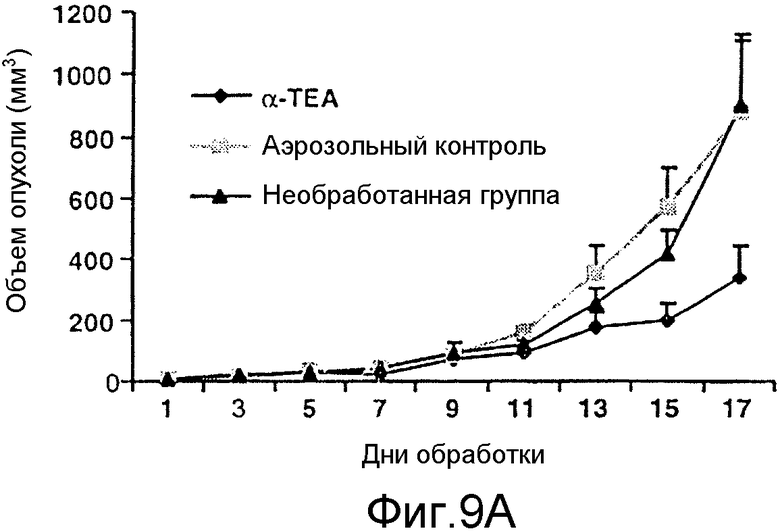
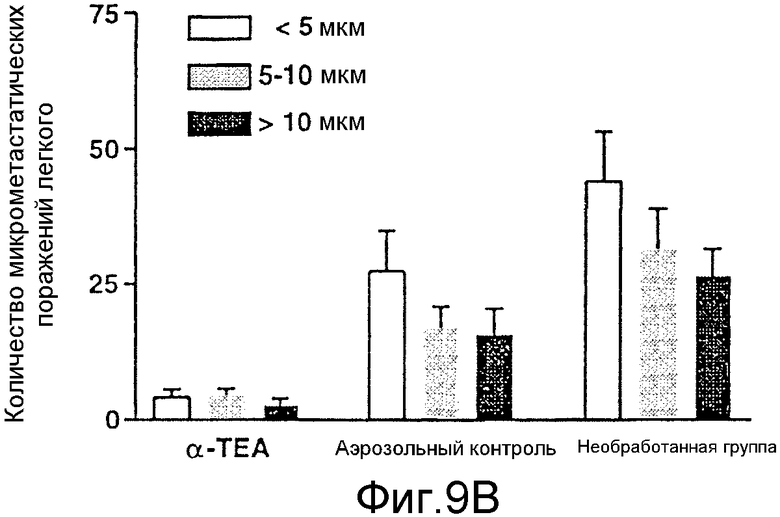
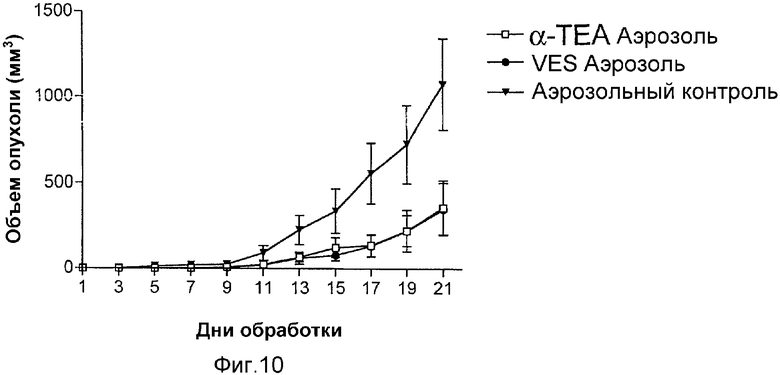
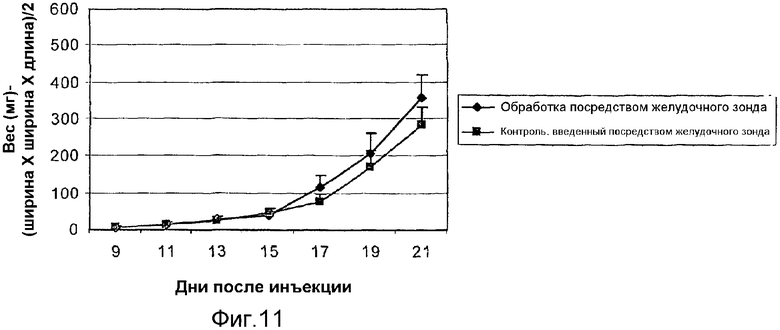
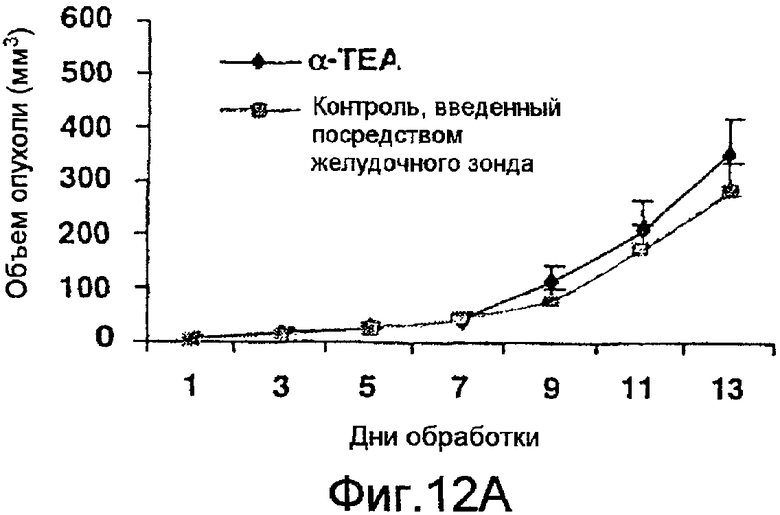
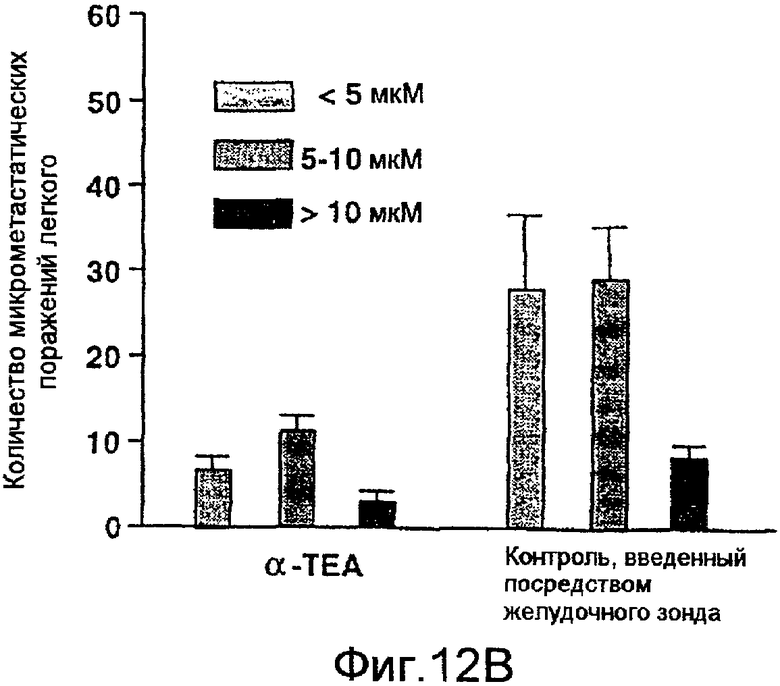
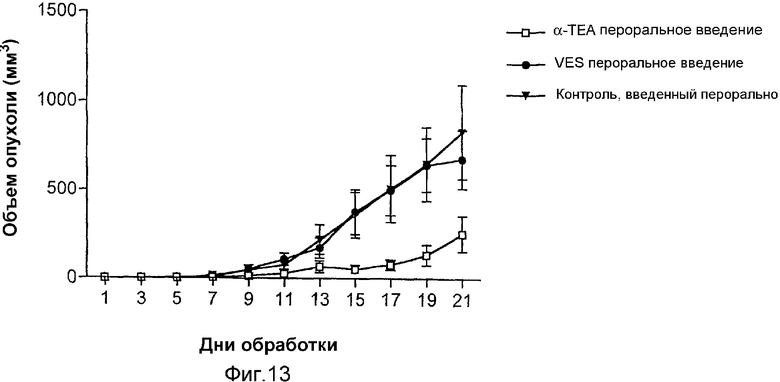
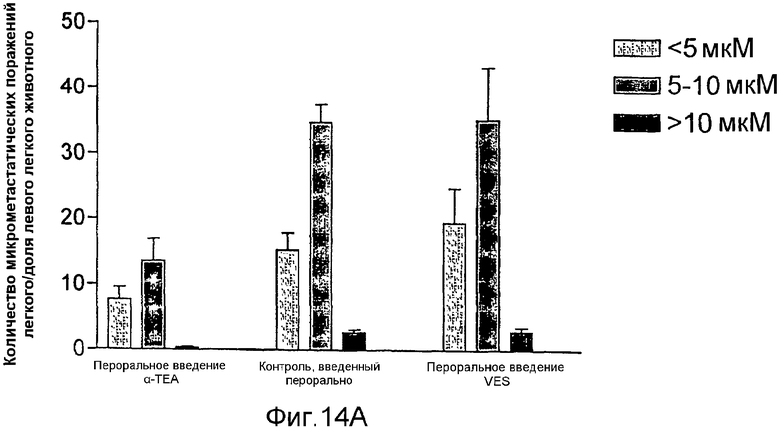
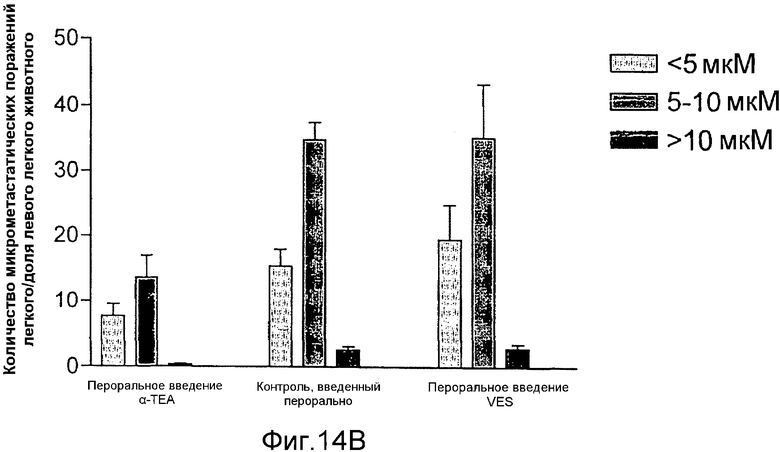
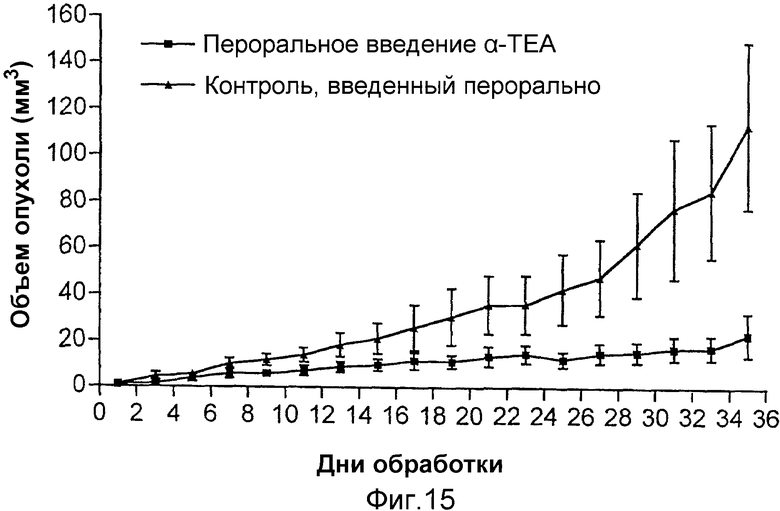
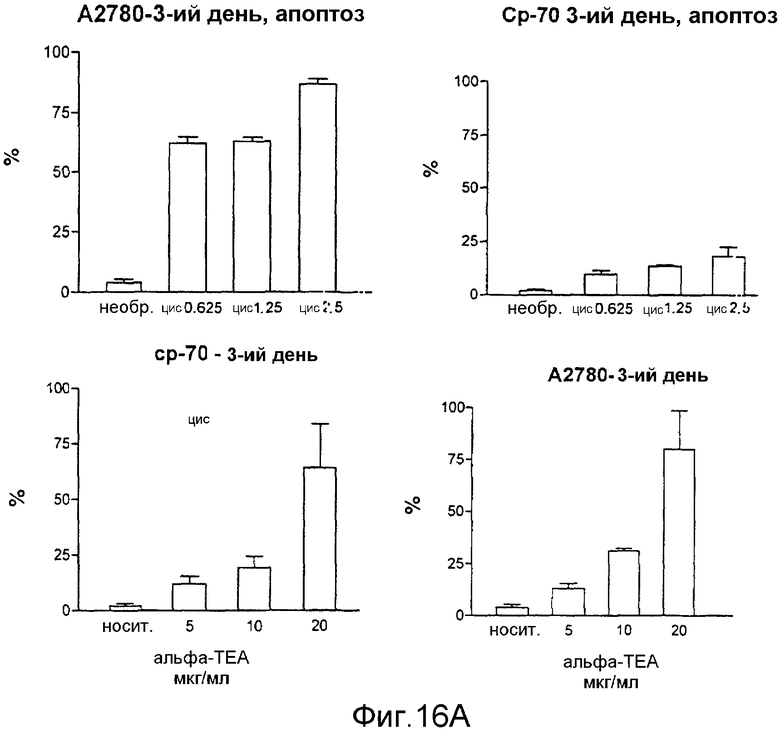
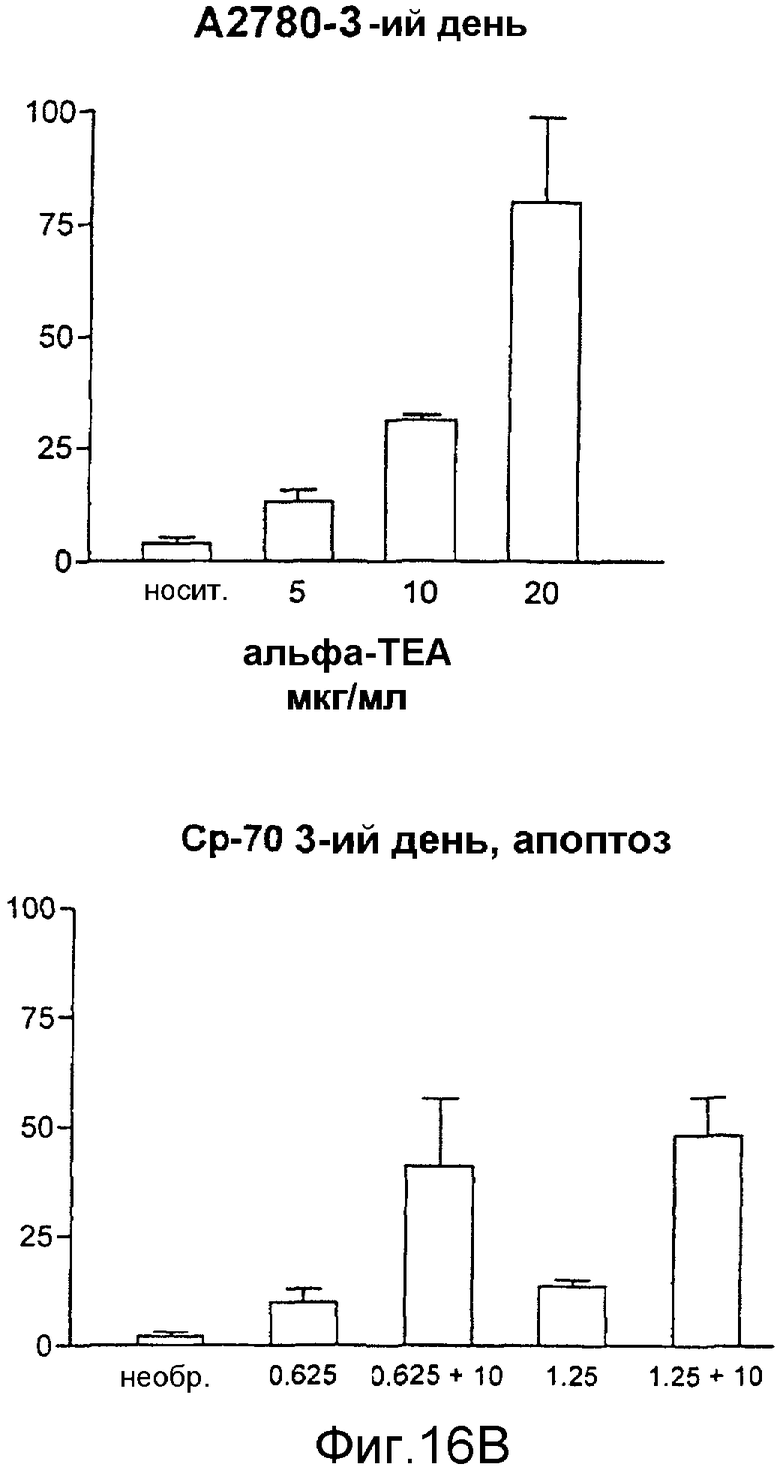
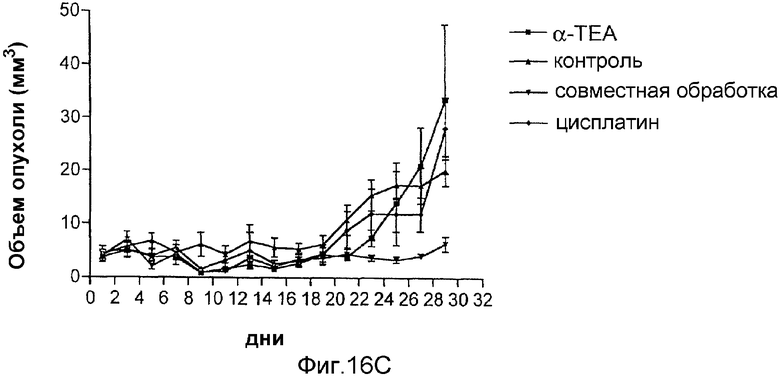
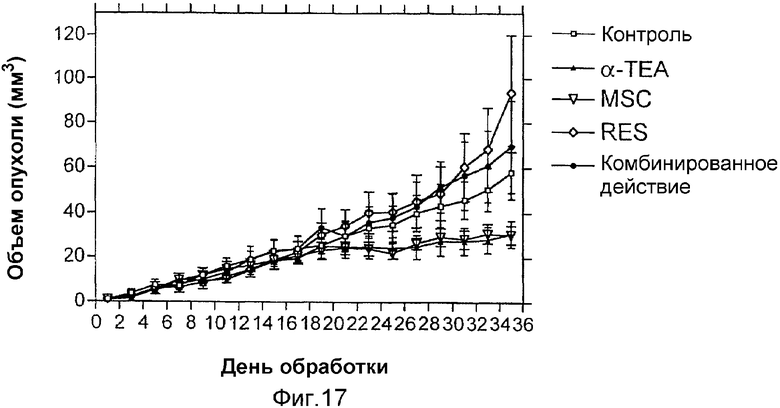
Изобретение относится к медицине, к созданию и применению аэрозольных распыляемых композиций для лечения заболеваний или расстройств, лечение которых требует снижения клеточной пролиферации и/или индукции клеточного апоптоза у пациента, таких как неопластические, аутоиммунные, вирусные заболевания. Композиция содержит в качестве действующего вещества основанное на витамине Е соединение, имеющее структурную формулу
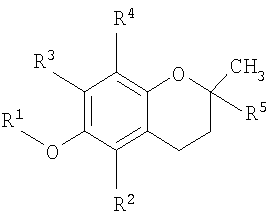
где R1 представляет собой карбоновую кислоту;
R2 и R3 представляют собой водород или R4;
R4 является метилом и R5 является алкилом или
где R1 представляет собой водород или карбоновую кислоту;
R2 и R3 представляют собой водород или R4;
R4 является метилом и R5 является алкенилом.
Изобретение обеспечивает улучшенную доставку указанного соединения ингаляционным путем с усилением его антипролиферативной активности. 3 н. и 56 з.п. ф-лы, 26 ил., 6 табл.
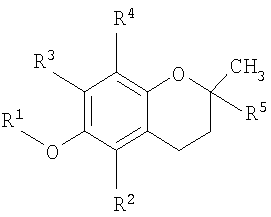
где R1 представляет собой карбоновую кислоту;
R2 и R3 представляют собой водород или R4;
R4 является метилом; и
R5 является алкилом; или
где R1 представляет собой водород или карбоновую кислоту;
R2 и R3 представляют собой водород или R4;
R4 является метилом; и
R3 является алкенилом,
в качестве действующего вещества лекарственного средства в распыляемой аэрозольной форме для лечения заболеваний или расстройств, лечение которых требует снижения клеточной пролиферации и/или индукции клеточного апоптоза у пациента.
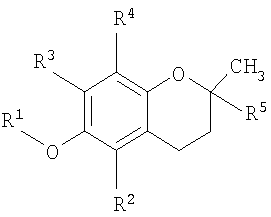
где R1 представляет собой карбоновую кислоту;
R2 и R3 представляют собой водород или R4;
R4 является метилом; и
R5 является алкилом; или
где R1 представляет собой водород или карбоновую кислоту;
R2 и R3 представляют собой водород или R4;
R4 является метилом; и
R5 является алкенилом,
в качестве действующего вещества для получения лекарственного средства в распыляемой аэрозольной форме для лечения заболеваний или расстройств, лечение которых требует снижения клеточной пролиферации и/или индукции клеточного апоптоза у пациента.
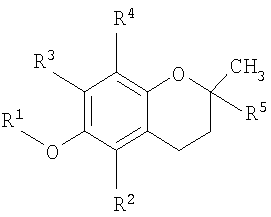
где R1 представляет собой карбоновую кислоту;
R2 и R3 представляют собой водород или R;
R4 является метилом; и
R5 является алкилом; или
где R1 представляет собой водород или карбоновую кислоту;
R2 и R3 представляют собой водород или R4;
R4 является метилом; и
R5 является алкенилом,
в качестве действующего вещества.
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| СЛОЖНЫЕ ЭФИРЫ НУКЛЕОЗИДОВ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2126417C1 |
| ГИГИЕНИЧЕСКИЕ И КОСМЕТИЧЕСКИЕ ПРЕПАРАТЫ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ КОЖИ | 1995 |
|
RU2139062C1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| YU W | |||
| et al | |||
| Induction of apoptosis in human breast cancer cells by tocopherols and tocotrienols | |||
| - Nutr Cancer. | |||
Авторы
Даты
2008-07-10—Публикация
2002-12-19—Подача