Область техники
Настоящее изобретение относится к соединениям тиено[2,3-d]пиримидина, проявляющим антагонистическую активность в отношении гонадотропин высвобождающего гормонов (GnRH), их получению и их применению.
Предшествующий уровень техники
Секреция гормонов передней доли гипофиза регулируется периферическими гормонами, выделяемыми из органов-мишеней соответствующих гормонов, и гормонами, регулирующими секрецию гипоталамуса, верхнего центрального органа передней доли гипофиза (здесь и далее указанные гормоны собирательно называют «гормонами гипоталамуса»). В настоящее время подтверждено существование девяти видов гормонов, являющихся гормонами гипоталамуса, включающих, например, тиреотропин высвобождающий гормон (TRH) и гонадотропин высвобождающий гормон [GnRH, иногда называемый LH-RH (лютеинизирующийгормон высвобождающий гормон)]. Считается, что действие указанных гормонов гипоталамуса проявляется через рецепторы, которые, как полагают, существуют в передней доле гипофиза; и предпринимались попытки обнаружить экспрессию генов-рецепторов, специфическую для указанных гормонов, включающих гормоны человека. Соответственно антагонисты или агонисты, специфично или селективно действующие на эти рецепторы, должны регулировать действие гормонов гипоталамуса и секрецию гормонов передней доли гипофиза. Предполагается, что в результате такие антагонисты или агонисты предотвращают гормонозависимые заболевания передней доли гипофиза или лечат их.
Известные соединения, обладающие GnRH-антагонистической активностью, включают GnRH производные линейныхпептидов (патенты США № 5140009 и № 5171835), циклическое производное гексапептида (JP-A-61-191698), бициклическое производное пептида (Journal of Medicinal Chemistry, Vo1. 36, pp. 3265-3273 (1993)) и т.п. Непептидные соединения, обладающие GnRH-антагонистической активностью, включают соединения, описанные в заявках JP-A-8-295693 (WO 95/28405), JP-A-9-169768 (WO 96/24597), JP-A-9-169735 (WO 97/14682), JP-A-9-169767 (WO 97/14697), JP-A-11-315079 (WO 99/33831), JP-A-2000-219691 (WO 00/00493), JP-A-2001-278884 (WO 00/56739) и JP-A-2002-30087.
При использовании пептидных соединений возникает множество проблем, требующих решения, которые относятся к всасываемости при пероральном введении, лекарственной форме, объемной дозе, к стабильности лекарственного средства, пролонгированному действию, метаболической стабильности и т.п. Существует большая потребность в пероральном антагонисте GnRH, особенно в антагонисте на основе непептидного соединения, который обладает превосходным лечебным действием на гормонозависимые виды рака, например, рак предстательной железы, эндометриоз, преждевременную половую зрелость и т.п., не оказывает транзиторного гипофизарно-гонадотропного действия (острого действия) и превосходно всасывается при пероральном введении.
Описание изобретения
Авторы настоящего изобретения провели различные исследования и в результате синтезировали следующее новое соединение, представленное формулой [которое далее в данном описании кратко называют соединение (I)]:

где
R1 означает C1-4алкил; R2 означает (1) C1-6алкил, который может содержать заместитель, выбранный из группы, состоящей из (1') гидроксигруппы, (2') C1-4алкокси, (3') С1-4алкоксикарбонила, (4') ди-С1-4алкилкарбамоила, (5') 5-7-членной азотсодержащей гетероциклической группы, (6') С1-4алкилкарбонила и (7') галогена, (2) C3-8циклоалкил, который может содержать (1') гидроксигруппу или (2') моно-С1-4алкилкарбониламино, (3) 5-7-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') гидроксигруппы, (3') C1-4алкила и (4') C1-4алкокси, (4) фенил, который может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') C1-4алкокси-C1-4алкила, (3') моно-С1-4алкилкарбамоил-C1-4алкила, (4') C1-4алкокси (5') моно-С1-4алкилкарбамоил-C1-4алкокси, или (5) C1-4алкокси; R3 означает C1-4алкил; R4 означает (1) атом водорода, (2) C1-4алкокси, (3) C6-10арил, (4) N-C1-4алкил-N-C1-4алкилсульфониламино, (5) гидроксигруппу или (6) 5-7-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') оксо, (2') C1-4алкила, (3') гидрокси-C1-4алкила, (4') С1-4алкоксикарбонила, (5') моно-С1-4алкилкарбамоила и (6') C1-4алкилсульфонила; n равно целому числу от 1 до 4; при условии, что, когда R2 означает фенил, который может содержать заместитель, R4 означает 5-7-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1) оксо, (2) гидрокси-C1-4алкила, (3) С1-4алкоксикарбонила, (4) моно-С1-4алкилкарбамоила и (5) C1-4алкилсульфонила; или его соль; которое отличается тем, что содержит 3-C1-4алкоксиуреидо в параположении фенильной группы в положении 6 тиено[2,3-d]пиримидинового скелета. Авторы также обнаружили, что соединение (I) обладает неожиданной превосходной GnRH-антагонистической активностью, в частности сильной антагонистической активностью на основе вышеуказанной конкретной химической структуры, и чрезвычайно низкой токсичностью и, следовательно, является удовлетворительным в качестве лекарственного средства, активного в качестве GnRH-антагониста, и создали настоящее изобретение на основе вышеуказанных данных.
Соответственно настоящее изобретение относится к
[1] Соединению формулы:
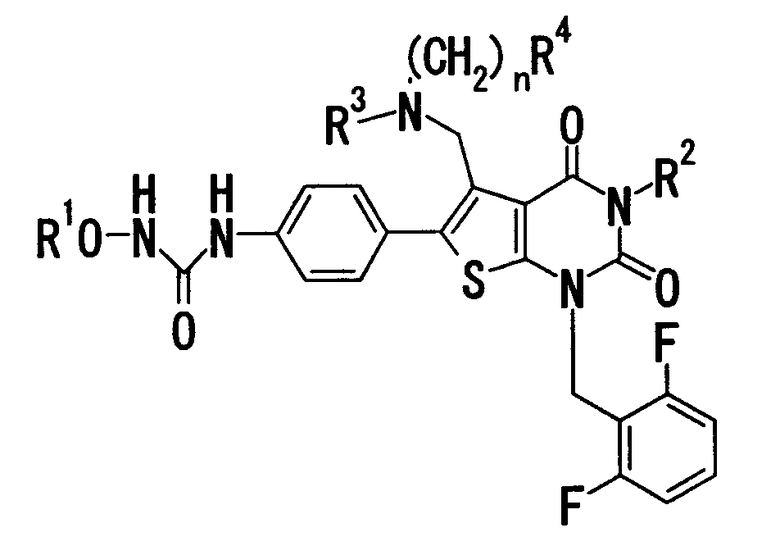
где
R1 означает C1-4алкил;
R2 означает
(1) C1-6алкил, который может содержать заместитель, выбранный из группы, состоящей из (1') гидроксигруппы, (2') C1-4алкокси, (3') С1-4алкоксикарбонила, (4') ди-С1-4алкилкарбамоила, (5') 5-7-членной азотсодержащей гетероциклической группы, (6') С1-4алкилкарбонила и (7') галогена,
(2) C3-8циклоалкил, который может содержать (1') гидроксигруппу или (2') моно-С1-4алкилкарбониламиногруппу,
(3) 5-7-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') гидроксигруппы, (3') C1-4алкила и (4') C1-4алкокси,
(4) фенил, который может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') C1-4алкокси-C1-4алкила, (3') моно-С1-4алкилкарбамоил-C1-4алкила, (4') C1-4алкокси, (5') моно-С1-4алкилкарбамоил-C1-4алкокси, или
(5) C1-4алкокси;
R3 означает C1-4алкил;
R4 означает
(1) атом водорода,
(2) C1-4алкокси,
(3) C6-10арил,
(4) N-C1-4алкил-N-C1-4алкилсульфониламино,
(5) гидроксигруппу или
(6) 5-7-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') оксо, (2') C1-4алкила, (3') гидрокси-C1-4алкила, (4') С1-4алкоксикарбонила, (5') моно-С1-4алкилкарбамоила и (6') C1-4алкилсульфонила;
n равно целому числу от 1 до 4;
при условии, что, когда R2 означает фенил, который может содержать заместитель, R4 означает 5-7-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1) оксо, (2) гидрокси-C1-4алкила, (3) С1-4алкоксикарбонила, (4) моно-С1-4алкилкарбамоила и (5) C1-4алкилсульфонила; или его солям;
[2] Соединению по вышеуказанному пункту [1], где
R2 означает
(1) C1-6алкил, который может содержать заместитель, выбранный из группы, состоящей из (1') гидроксигруппы, (2') C1-4алкокси, (3') С1-4алкоксикарбонила, (4') ди-С1-4алкилкарбамоила и (5') 5-7-членной азотсодержащей гетероциклической группы,
(2) C3-8циклоалкил, который может содержать (1') гидроксигруппу или (2') моно-С1-4алкилкарбониламиногруппу,
(3) 5-7-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') гидроксигруппы, (3')C1-4алкила и (4') C1-4алкокси,
(4) фенил, который может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') C1-4алкокси-C1-4алкила, (3') моно-С1-4алкилкарбамоил-C1-4алкила и (4') моно-С1-4алкилкарбамоил-C1-4алкокси, или
(5) C1-4алкокси;
R4 означает
(1) C1-4алкокси,
(2) C6-10арил,
(3) N-C1-4алкил-N-C1-4алкилсульфониламино или
(4) 5-7-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') оксо, (2') гидрокси-C1-4алкила, (3') С1-4алкоксикарбонила, (4') моно-С1-4алкилкарбамоила и (5') C1-4алкилсульфонила;
[3] Соединению по вышеуказанному пункту [1], где R1 означает метил;
[4] Соединению по вышеуказанному пункту [1], где R2 означает 5-7-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1) галогена, (2) гидроксигруппы, (3) C1-4алкила, (4) C1-4алкокси;
[5] Соединению по вышеуказанному пункту [1], где R3 означает метил;
[6] Соединению по вышеуказанному пункту [1], где R4 означает C1-4алкокси;
[7] Соединению по вышеуказанному пункту [1], где n означает 2;
[8] Соединению по вышеуказанному пункту [1], где R3 означает метил; R4 означает атом водорода и n означает 1;
[9] N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевине,
N-(4-(1-(2,6-дифторбензил)-5-(((2-этоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевине,
N-(4-(1-(2,6-дифторбензил)-5-((диметиламино)метил)-3-(6-метокси-3-пиридазинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевине или
N-(4-(1-(2,6-дифторбензил)-5-((диметиламино)метил)-3-(6-метоксипиридин-3-ил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевине или их солям;
[10] N-(4-(5-(((2-метоксиэтил)метиламино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(4-метоксифенил)тиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевине или
N-(4-(1-(2,6-дифторбензил)-5-((диметиламино)метил)-3-(4-метоксифенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'метоксимочевине или их солям;
[11] Пролекарству соединения по вышеуказанному пункту [1];
[12] Фармацевтическому препарату, который содержит соединение по вышеуказанному пункту [1] или его пролекарство;
[13] Фармацевтическому препарату по вышеуказанному пункту [12], который является антагонистом гонадолиберин высвобождающего гормона;
[14] Фармацевтическому препарату по вышеуказанному пункту [12] для профилактики и лечения заболеваний, зависимых от половых гормонов;
[15] Фармацевтическому препарату по вышеуказанному пункту [12] для профилактики и лечения раковых заболеваний, зависимых от половых гормонов; костных метастазов раковых заболеваний, зависимых от половых гормонов; гипертрофии предстательной железы,гистеромиомы, эндометриоза, метрофибромы, преждевременной половой зрелости, аменореи, предменструального синдрома, дисменореи, многокамерной (ячеистой) болезни яичников, синдрома поликистоза яичников, акне, алопеции, болезни Альцгеймера, бесплодия, синдрома раздраженной толстой кишки, доброкачественных или злокачественных опухолей, которые являются гормонозависимыми и LH-RH чувствительными, или приливов;в качестве регуляторов репродукции; контрацептивов; индукторов овуляции; или для профилактики послеоперационных рецидивов раковых заболеваний, зависимых от половых гормонов;
[16] Способу воздействия антагониста на гонадолиберин высвобождающий гормон, который включает введение эффективного количества соединения по вышеуказанному пункту 1 млекопитающим;
[17] Применению соединения по вышеуказанному пункту [1] для изготовления фармацевтической композиции длявоздействия антагониста на гонадолиберин высвобождающий гормон;
[18] Соединению формулы:
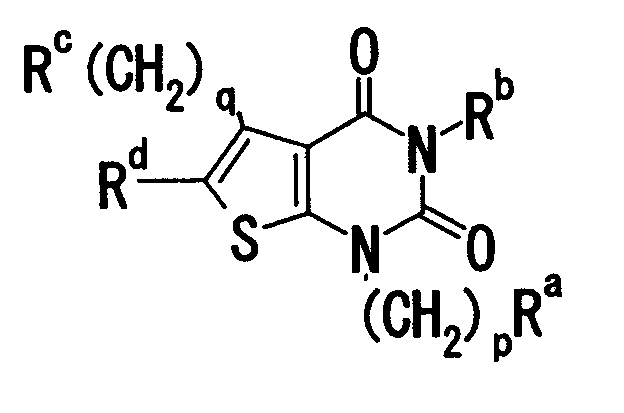
где
Ra означает (1) атом водорода, (2) арильную группу, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила, (3) циклоалкильную группу, которая может содержать заместитель, или (4) гетероциклическую группу, которая может содержать заместитель; Rb означает азотсодержащую гетероциклическую группу, которая может содержать заместитель; Rc означает аминогруппу, которая может содержать заместитель; Rd означает арильную группу, которая может содержать заместитель; p равно целому числу от 0 до 3; q равно целому числу от 0 до 3; или его солям; и т.п.
Определения всех терминов даны в следующих ниже абзацах.
Примеры "C1-4алкила" включают линейный C1-4алкил (например, метил, этил, пропил, бутил и т.п.), разветвленный C3-4алкил (например, изопропил, изобутил, втор-бутил, трет-бутил и т.п.), и т.п.
Примеры "C1-6алкила" включают линейный C1-6алкил (например, метил, этил, пропил, бутил, пентил, гексил и т.п.), разветвленный C1-6алкил (например, изопропил, изобутил, втор-бутил, трет-бутил, изопентил и т.п.) и т.п.
Примеры "C1-4алкокси" включают линейные C1-4алкокси (например, метокси, этокси, пропокси, бутокси и т.п.), разветвленные C1-4алкокси (например, изопропокси, изобутокси, втор-бутокси, трет-бутокси и т.п.) и подобные группы.
Примеры "C1-4алкоксикарбонила" включают метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил и т.п.
Примеры "ди-С1-4алкилкарбамоила" включают диметилкарбамоил, диэтилкарбамоил, дипропилкарбамоил, диизопропилкарбамоил, N-этил-N-метилкарбамоил и т.п.
Примеры «5-7-членной азотсодержащей гетероциклической группы» включают пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, оксазолидин-3-ил, тиазолидин-3-ил, изоксазолидин-2-ил, изотиазолидин-2-ил, имидазолидин-1-ил, имидазолидин-2-ил, имидазолидин-4-ил, пиразолидин-1-ил, пиразолидин-3-ил, пиразолидин-4-ил, пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, имидазол-1-ил, имидазол-2-ил, имидазол-4-ил, пиразол-1-ил, пиразол-3-ил, пиразол-4-ил, 1,2,3-триазол-1-ил, 1,2,5-триазол-1-ил, тетразол-1-ил, тетразол-2-ил, тетразол-5-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, пиперазин-1-ил, пиперазин-2-ил, морфолин-2-ил, морфолин-3-ил, морфолин-4-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиразин-2-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, пиридазин-3-ил, пиридазин-4-ил и т.п. Из них предпочтительными примерами являются пирролидин-1-ил, пирролидин-2-ил, имидазол-1-ил, имидазол-2-ил, 1,2,3-триазол-1-ил, 1,2,5-триазол-1-ил, тетразол-1-ил, тетразол-2-ил, пиридин-2-ил, пиридин-4-ил и т.п.
Примеры "(C1-4алкилкарбонила" включают метилкарбонил, этилкарбонил, пропилкарбонил, изопропилкарбонил, бутилкарбонил, изобутилкарбонил, втор-бутилкарбонил, трет-бутилкарбонил и т.п.
Термин "галоген" означает фтор, хлор, бром и иод.
Примеры "моно-С1-4алкилкарбониламино" групп включают
метилкарбониламино, этилкарбониламино, пропилкарбониламино,
изопропилкарбониламино, бутилкарбониламино,
изобутилкарбониламино, втор-бутилкарбониламино,
трет-бутилкарбониламино и т.п.
Примеры «C3-8циклоалкил» групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил и т.п.
Термин "C1-4алкокси-C1-4алкил" означает метоксиметил,
1-метоксиэтил, 2-метоксиэтил, 1-метоксипропил, 2-метоксипропил,
3-метоксипропил, 1-метоксибутил, 2-метоксибутил, 3-метоксибутил,
4-метоксибутил, 1-метокси-1-метилэтил, 2-метокси-1-метилэтил,
1-метокси-1-метилпропил, 2-метокси-1-метилпропил,
3-метокси-1-метилпропил, 1-(метоксиметил)пропил,
1-метокси-2-метилпропил, 2-метокси-2-метилпропил,
3-метокси-2-метилпропил, 2-метокси-1,1-диметилэтил, этоксиметил,
2-этоксиэтил, 3-этоксипропил, 4-этоксибутил и т.п.
Примеры "моно-C1-4алкилкарбамоил-C1-4алкила" включают
метиламинокарбонилметил, этиламинокарбонилметил,
2-метиламинокарбонилэтил, 2-этиламинокарбонилэтил и т.п.
Примеры "моно-C1-4алкилкарбамоил-C1-4алкокси" включают
метиламинокарбонилметокси, этиламинокарбонилметокси,
2-метиламинокарбонилэтокси, 2-этиламинокарбонилэтокси и т.п.
Примеры "C6-10арила" включают фенил, 1-нафтил, 2-нафтил и т.п.
Примеры "N-C1-4алкил-N-C1-4алкилсульфониламино" включают N-метил-N-метилсульфониламино, N-этил-N-метилсульфониламино, N-этилсульфонил-N-метиламино, N-этил-N-этилсульфониламино и т.п.
Примеры «гидрокси-C1-4алкила» включают гидроксиметил,
1-гидроксиэтил, 2-гидроксиэтил, 1-гидроксипропил,
2-гидроксипропил, 3-гидроксипропил, 1-гидроксибутил,
2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил,
1-гидрокси-1-метилэтил, 2-гидрокси-1-метилэтил,
1-гидрокси-1-метилпропил, 2-гидрокси-1-метилпропил,
3-гидрокси-1-метилпропил, 1-(гидроксиметил)пропил,
1-гидрокси-2-метилпропил, 2-гидрокси-2-метилпропил,
3-гидрокси-2-метилпропил, 2-гидрокси-1,1-диметилэтил и т.п.
Примеры «моно-C1-4алкилкарбамоила» включают метилкарбамоил, этилкарбамоил, пропилкарбамоил, изопропилкарбамоил, бутилкарбамоил, изобутилкарбамоил, втор-бутилкарбамоил, трет-бутилкарбамоил и т.п.
Примеры "C1-4алкилсульфонила" включают метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил, трет-бутилсульфонил и т.п.
В качестве R1 предпочтительны метил и этил, метил является особенно предпочтительным.
В качестве R2 предпочтительной является 5-7-членная азотсодержащая гетероциклическая группа, которая может содержать заместитель, выбранный из группы, состоящей из (1) галогена, (2) гидроксигруппы, (3) C1-4алкила и (4) C1-4алкокси. Из них более предпочтительна пиридильная группа (пиридин-2-ил, пиридин-3-ил, пиридин-4-ил), которая может содержать заместитель, выбранный из группы, состоящей из (1) галогена, (2) гидроксигруппы, (3) C1-4алкила и (4) C1-4алкокси. Особенно предпочтителен незамещенный пиридин-2-ил.
В качестве R3 предпочтительны метил и этил, метил является особенно предпочтительным.
В качестве R4 предпочтительным является C1-4алкокси. Метокси и этокси являются особенно предпочтительными.
В качестве n предпочтительны 1 или 2. Особенно предпочтительным является 2.
Предпочтительным примером комбинации R3, R4 и n является случай, когда R3 представляет собой метил, R4 представляет собой атом водорода и n равно 1.
Предпочтительные примеры соединения (I) включают
N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевину,
N-(4-(1-(2,6-дифторбензил)-5-(((2-этоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевину,
N-(4-(1-(2,6-дифторбензил)-5-((диметиламино)метил)-3-(6-метокси-3-пиридазинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевину или
N-(4-(1-(2,6-дифторбензил)-5-((диметиламино)метил)-3-(6-метоксипиридин-3-ил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевину.
Соли соединения (I) предпочтительно представляют собой физиологически приемлемые кислотно-аддитивные соли. Такие соли включают, например, соли, образованные с неорганическими кислотами (например, с хлористоводородной кислотой, бромистоводородной кислотой, азотной кислотой, серной кислотой, фосфорной кислотой и т.п.), соли, образованные с органическими кислотами (например, с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой и т.п.), и т.п. Когда в соединении (I) имеется кислотная группа, оно может образовывать физиологически приемлемую соль с неорганическим основанием (например, щелочными или щелочноземельными металлами, такими как натрий, калий, кальций, магний и т.п.; аммиаком и т.п.) или органическим основанием (например, триметиламином, триэтиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, дициклогексиламином, N,N'-дибензилэтилендиамином и т.п.).
Например, соединение (I) может быть получено нижеследующими способами. Соединения, которые показаны на представленных схемах, включают их соли. Примеры солей включают такие же соли, что и соли соединения (I), и т.п. Соединения (I)-(IV), показанные в следующих схемах реакций, могут образовывать приемлемые соли в зависимости от условий реакции.
(Способ получения 1)
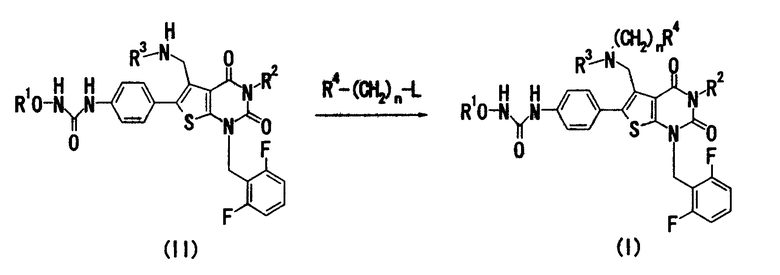
В показанной выше формуле L означает уходящую группу и другие символы имеют такие же значения, как определено выше.
Примерами «уходящей группы», обозначаемой L, являются атом галогена, C1-4алкилсульфонилоксигруппа, которая может содержать атом галогена, и т.п. Примерами «C1-4алкилсульфонилоксигруппы, которая может содержать атом галогена», являются метансульфонилокси, этансульфонилокси, трифторметансульфонилокси и т.п.
Соединение (II) может быть получено способами по существу известными, например способами, описанными в заявках JP-A-2001-278884, WO 00/56739, или аналогичными.
Например, соединение (I) можно получить взаимодействием соединения (II) и соединения, представленного формулой R4-(CH2)n-L. Данную реакцию предпочтительно проводить в присутствии основания.
Примерами "основания" являются неорганические основания, такие как карбонат натрия, гидрокарбонат натрия, карбонат калия, гидрокарбонат калия, гидроксид натрия, гидроксид калия, гидроксид таллия и т.п.; и органические основания, такие как триэтиламин, диизопропилэтиламин, пиридин и т.п.
Количество соединения, представленного формулой R4-(CH2)n-L, в реакции соединения (II) и соединения, представленного формулой R4-(CH2)n-L, составляет от около 1 до около 3 моль на моль соединения (II). Количество основания составляет от около 1 до около 3 моль на моль соединения (II).
Указанную реакцию обычно проводят в растворителе, инертном в условиях реакции. Примерами "растворителя" являются простые эфиры (например, диэтиловый эфир, диоксан, диметоксиэтан, тетрагидрофуран и т.п.), ароматические углеводороды (например, бензол, толуол и т.п.), амиды (например, диметилформамид, диметилацетамид и т.п.), галогенированные углеводороды (например, хлороформ, дихлорметан и т.п.) и т.п.
Температура реакции обычно составляет от около 0 до около 150°C, предпочтительно от около 50 до около 80°C. Время реакции обычно составляет от около 1 до около 24 часов.
(Способ получения 2)
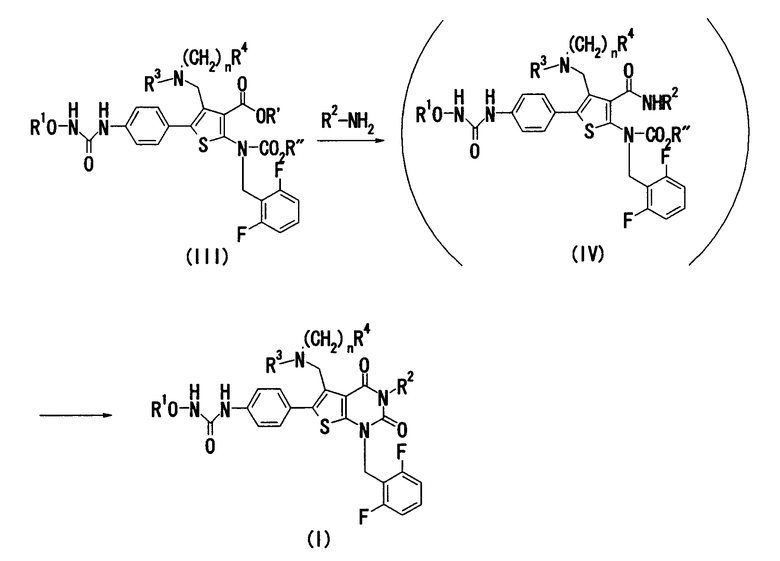
В представленной выше формуле R' означает атом водорода или C1-4алкил; R'' означает C1-4алкил и другие символы имеют значения, определенные выше.
Примерами C1-4алкилов, обозначаемых R' и R'', являются линейные C1-4алкилы (например, метил, этил, пропил, бутил и т.п.), разветвленные C3-4алкилы (например, изопропил, изобутил, втор-бутил, трет-бутил и т.п.) и т.п.
Соединение (III) может быть получено по любой по существу известной методике, например взаимодействием п-нитрофенилацетона со сложноэфирным соединением цианоуксусной кислоты и серой [например, Chem. Ber., 99, 94-100(1966)], с последующим преобразованием полученного 2-амино-4-метил-5-(4-нитрофенил)тиофена, используя способы, описанные в заявках JP-A-9-169768 и WO 96/24597, или аналогичные им способы.
1) Когда R' означает атом водорода, соединение (I) может быть получено взаимодействием соединения (III) с соединением, представленным формулой R2-NH2, или с его солью в присутствии конденсирующего агента с последующей циклизацией полученного таким образом соединения (IV).
Примерами "конденсирующего агента" являются WSC (гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида), DCC (дициклогексилкарбодиимид), диэтилцианофосфат, гексафторфосфат бензотриазол-1-илокситрипирролидинофосфония: PyBOP) и т.п.
Количество "конденсирующего агента" составляет от около 1 до около 3 моль на моль соединения (III).
Данную реакцию предпочтительно проводить в инертном для нее растворителе.
Примерами растворителей являются спирты (например, этанол, метанол и т.п.), ароматические углеводороды (например, бензол, толуол и т.п.), амиды (например, диметилформамид, диметилацетамид и т.п.), галогенированные углеводороды (например, хлороформ, дихлорметан и т.п.) и т.п.
Температура реакции обычно составляет от около 0 до около 150°C, предпочтительно от около 0 до 25°C. Время реакции обычно составляет от около 1 до около 36 часов.
Продукт, полученный приведенным выше способом, можно использовать в следующей реакции, хотя он еще не очищени находится в реакционной смеси, или его можно выделить из реакционной смеси обычным способом.
Соединение (IV) подвергают циклизации в присутствии основания.
Примерами "основания" являются неорганические основания, такие как метоксид натрия, карбонат натрия, гидрокарбонат натрия, карбонат калия, гидрокарбонат калия, гидроксид натрия, гидроксид калия, гидроксид таллия; и органические основания, такие как триэтиламин, пиридин и т.п.; и т.п.
Количество "основания" составляет от около 2 до около 20 моль, предпочтительно от около 5 до около 12 моль на 1 моль соединения (IV).
Данную реакцию обычно проводят в инертном для нее растворителе.
Примерами растворителя являются спирты (например, этанол, метанол и т.п.), ароматические углеводороды (например, бензол, толуол и т.п.), амиды (например, диметилформамид, диметилацетамид и т.п.), галогенированные углеводороды (например, хлороформ, дихлорметан и т.п.) и т.п.
Температура реакции обычно составляет от около 0 до около 150°C, предпочтительной является комнатная температура (примерно 15-25°С). Время реакции обычно составляет от около 1 до около 36 часов.
2) Когда R' означает алкильную группу, соединение (I) можно получить взаимодействием соединения (III) с активированным R2-NH2.
Активированный R2-NH2 можно получить любым известным по существу способом, например взаимодействием алюминийорганического реагента c R2-NH2 в растворителе, инертном для данной реакции.
Примерами "алюминийорганического реагента" являются триметилалюминий, диметилалюминийхлорид и т.п. и раствор, включающий указанные соединения и т.п.
Количество "алюминийорганического реагента" составляет от около 1 до около 5 моль, предпочтительно около 1 моль на 1 моль R2-NH2.
Примерами растворителя являются галогенированные углеводороды (например, хлороформ, дихлорметан и т.п.).
Температура реакции составляет обычно от около 0 до около 150°C, предпочтительно от около 0 до около 25°C. Время реакции обычно составляет от около 1 до около 6 часов.
Циклизацию можно осуществить взаимодействием соединения (III) с активированным R2-NH2 и получить соединение (I).
Количество "соединения (III)" составляет около 1/5 объема смеси R2-NH2 и алюминийорганического реагента.
Данную реакцию обычно проводят в инертном для нее растворителе.
Таким растворителем является растворитель, аналогичный используемому для реакции получения активированного R2-NH2.
Температура реакции обычно составляет от около 0 до около 150°C, предпочтительно от 0 до 25°С. Время реакции обычно составляет от около 1 до около 48 часов.
Соединение (I) можно также получать, используя известные реакции гидролиза, снятия защиты, ацилирования, алкилирования, окисления, циклизации, наращивания углеродной цепи (carbon bond expanding reaction), реакцию обмена заместителей или комбинации указанных реакций.
Соединение (I) можно выделять и очищать такими по существу известными методами разделения, как перекристаллизация, перегонка, хроматография и т.п.
Когда соединение (I) получают в несвязанной форме, его можно преобразовать в соль известными по существу методами или аналогичными им. Когда соединение (I) получают в виде соли, его можно преобразовать в несвязанную форму или в еще одну соль известными по существу методами или аналогичными им.
Соединение (I) может существовать в виде гидрата или в негидратированной форме. Примерами гидратов могут служить моногидрат, сесквигидрат и дигидрат.
Когда соединение (I) получают в виде смеси оптически активных конфигураций, смесь можно разделить на (R)- и (S)-формы обычными методами разделения оптических изомеров.
Соединение (I) можно использовать в качестве пролекарства. Пролекарство соединения (I) или его соли означает соединение, которое преобразуется в соединение (I) настоящего изобретения в физиологических условиях или в результате реакции, вызванной ферментом,кислотой желудочного сока и т.п. в живом организме, т.е. пролекарство - это соединение, которое преобразуется в соединение (I) настоящего изобретения в результате окисления, восстановления, гидролиза и подобных преобразований под действием ферментов; соединение, которое преобразуется в соединение (I) настоящего изобретения под действием кислоты желудочного сока и т.п. Пролекарством для соединения (I) может быть, например, соединение, полученное ацилированием, алкилированием или фосфорилированием аминогруппы в соединении (I) (например, соединение, полученное в результате эйкозаноилирования, аланилирования, пентиламинокарбонилирования, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонилирования, тетрагидрофуранилирования, пирролидинилметилирования, пивалоилоксиметилирования, трет-бутилирования и т.п. аминогруппы соединения (I)); соединение, полученное ацилированием, алкилированием, фосфорилированием или борированиемгидроксигруппы в соединении (I) (например, соединение, полученное ацетилированием, пальмитоилированием, пропаноилированием, пивалоилированием, сукцинилированием, фумарилированием, аланилированием, диметиламинометилкарбонилированием и т.п. гидроксигруппы в соединении (I)). Любое из указанных соединений можно получить из соединения (I) по существу известным способом.
Пролекарством соединения (I) может также быть соединение, которое преобразуется в соединение (I) в физиологических условиях, таких как условия, описанные в «IYAKUHIN no KAIHATSU (Development of Pharmaceuticals)», Vol.7, Design of Molecules, p. 163-198, Published by HIROKAWA SHOTEN (1990).
Соединение (I) может быть меченным изотопами (например, 3H, 14C, 35S) и т.п.
В вышеописанной реакции исходное соединение, содержащее аминогруппу, карбоксигруппу или гидроксигруппу в качестве заместителя, может находиться в виде соединения, в котором в такой заместитель введена защитная группа, обычно используемая в химии пептидов, и целевое соединение может быть получено снятием защиты после реакции, если необходимо.
Защитной группой для аминогруппы могут быть, например, необязательно замещенный C1-6алкилкарбонил(например, ацетил, пропионил и т.п.), формил, фенилкарбонил, C1-6алкилоксикарбонил (например, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил и т.п.), фенилоксикарбонил, C7-14аралкилоксикарбонил (например, бензилоксикарбонил, 9-флуоренилметоксикарбонил и т.п.), тритил, фталоил и подобные группы. Заместителем может быть, например, атом галогена (например, фтор, хлор, бром и иод), C1-6алкилкарбонил (например, ацетил, пропионил, бутирил и т.п.), нитрогруппа и т.п., и число заместителей может составлять от 1 до 3.
Защитной группой для карбоксигруппы может быть, например, необязательно замещенный C1-6алкил (например, метил, этил, пропил, изопропил, бутил, трет-бутил и т.п.), фенил, тритил, силил и т.п. Заместителем может быть, например, атом галогена (например, фтор, хлор, бром и иод), C1-6алкилкарбонил (например, ацетил, пропионил, бутирил и т.п.), формил, нитрогруппа и т.п., и число заместителей может составлять от 1 до 3.
Защитной группой для гидроксигруппы может быть, например, необязательно замещенный C1-6алкил (например, метил, этил, пропил, изопропил, бутил, трет-бутил и т.п.), фенил, C7-10аралкил (например, бензил и т.п.), C1-6алкилкарбонил (например, ацетил, пропионил и т.п.), формил, фенилоксикарбонил, C7-10аралкилоксикарбонил (например, бензилоксикарбонил и т.п.), тетрагидропиранил, тетрагидрофуранил, силил и т.п. Заместителем может быть, например, атом галогена (например, фтор, хлор, бром и иод), C1-6алкил, фенил, С7-11аралкил, нитрогруппа и т.п., и число заместителей может составлять от 1 до 4.
Способ введения и удаления защитных групп показан в соответствии с известным способом или аналогичным ему (например, способом описанным в Protective Groups in Organic Chemistry (J.F.W.McOmie et al, Plenum Press). Методом снятия защиты может быть обработка кислотой, основанием, восстановление, УФ, обработка гидразином, фенилгидразином, N-метилдитиокарбаматом натрия, фторидом тетрабутиламмония, ацетатом палладия и т.п.
Соединение (I) настоящего изобретения или его соль (здесь и далее называемое "соединение настоящего изобретения") обладает превосходной GnRH-антагонистической активностью и низкой токсичностью (например, острой токсичностью, хронической токсичностью, генетической токсичностью, репродукционной токсичностью, кардиотоксичностью, токсичностью в результате взаимодействия с лекарствами, канцерогенностью). Кроме того, оно характеризуется отличной всасываемостью при пероральном введении, пролонгированным действием, превосходной стабильностью и фармакокинетикой. Кроме того, оно практически не влияет на ингредиенты плазмы. Поэтому соединение настоящего изобретения можно без риска использовать для млекопитающих (например, людей, обезьян, быков, коров, лошадей, собак, кошек, кроликов, крыс, мышей и т.п.) для профилактики и/или лечения заболеваний, зависящих от мужских и женских гормонов, заболеваний, вызванных избытком упомянутых гормонов, и т.п. путем подавления секреции гонадотропина антагонистическим действием соединения в отношении GnRH рецепторов для регулирования концентрации половых гормонов в плазме.
Например, соединение настоящего изобретения можно применять для профилактики и/или лечения зависимых от половых гормонов видов рака (например, рака предстательной железы, рака матки, рака молочной железы, опухоли гипофиза и т.п.), костных метастазов зависимых от половых гормонов видов рака, гипертрофии предстательной железы,гистеромиомы, эндометриоза, метрофибромы, преждевременной половой зрелости, аменореи, предменструального синдрома, дисменореи, многокамерной (ячеистой) болезни яичников, синдрома поликистоза яичников, акне, алопеции, болезни Альцгеймера (болезни Альцгеймера, сенильной деменции типа Альцгеймера и смешанного типа) и подобных заболеваний. Соединение настоящего изобретения также полезно для регуляции мужской и женской репродукции (например, регуляторы наступления беременности, регуляторы менструального цикла, и т.п.). Соединение настоящего изобретения можно также использовать в качестве мужского и женского контрацептива или в качестве индуктора овуляции у женщин. Соединение настоящего изобретения можно применять для лечения бесплодия, если исходить из эффекта «рикошета»после его отмены. И соединение настоящего изобретения можно применять в качестве средства для профилактики и/или лечения доброкачественных или злокачественных опухолей, которые являются гормононезависимыми и чувствительными к LH-RH. Соединение настоящего изобретения можно применять в качестве средства для профилактики и/или лечения синдрома раздраженной толстой кишки и для профилактики послеоперационного рецидива рака, зависимого от половых гормонов (средства для профилактики послеоперационного рецидива рака предстательной железы; средства для профилактики послеоперационного рецидива рака груди или рака яичников в до- или постклимактерическом периоде; главным образом в качестве средства для профилактики послеоперационного рецидива рака груди или рака яичников в доклимактерическом периоде).
Кроме того, соединение настоящего изобретения полезно в области животноводства для регуляции эструса (течки) у животных, для улучшения качества мяса и стимуляции роста животных. Соединение настоящего изобретения также полезно в качестве стимулятора нереста у рыб.
Соединение настоящего изобретения можно также использовать для подавления кратковременного повышения концентрации тестостерона в плазме (явление обострения), которое наблюдается при введении суперагониста GnRH, такого как лейпрорелин ацетат. Соединение настоящего изобретения можно применять в сочетании с суперагонистом GnRH, таким как лейпрорелин ацетат, гонадорелин, бусерелин, трипторелин, госерелин, нафарелин, хистрелин, деслорелин, метерелин, лецирелин и т.п. Наиболее предпочтительным среди них является лейпрорелин ацетат.
Соединение настоящего изобретения предпочтительно также применять в комбинации с по меньшей мере одним средством, выбранным из следующих: стероидного или нестероидного антиандреногена или антиэстрогена, химиотерапевтического средства, пептида-антагониста GnRH, ингибитора α-редуктазы, ингибитора α-рецептора, ингибитора ароматазы, ингибитора 17β-гидроксистероидной дегидрогеназы, ингибитора продуцирования андрогена надпочечниками, ингибитора киназ, лекарственного средства для гормональной терапии и лекарственного средства, ингибирующего фактор роста клеток или их рецептор.
«Химиотерапевтическое средство», приведенное выше, включает ифосфамид, адриамицин, пепломицин, цисплатин, циклофосфамид, 5-FU, UFT, метотрексат, митомицин C, митоксантрон и т.п.
«Пептид-антагонист GnRH», приведенный выше, включает пептиды-антагонисты GnRH, не предназначенные для перорального введения, такие как цетрореликс, ганиреликс, абареликс и т.д.
«Ингибитор продуцирования андрогена надпочечниками», приведенный выше, включает ингибиторы лиаз (С17,20-лиазы) и т.п.
«Ингибитор киназы», приведенный выше, включает ингибитор тирозинкиназы и т.п.
«Лекарственное средство для гормональной терапии» включает, например, антиэстрогены, прогестероны (например, МРА, и т.п.), андрогены, эстрогены и антагонисты андрогенов.
«Фактор роста клеток» может быть любым веществом, которое стимулирует пролиферацию клеток, и обычно включает пептиды с молекулярной массой не выше 20000, которые экспрессируют действие при низких концентрациях посредством связывания с рецепторами. Конкретно, можно привести, например, (1) EGF (эпидермальный фактор роста) или вещества, обладающие по существу такой же активностью (например, EGF, херегулин (HER2 лиганд) и т.п.), (2) инсулин или вещества, обладающие по существу такой же активностью (например, инсулин, IGF (инсулиноподобный фактор роста)-1, IGF-2 и т.п.), (3) FGF (фактор роста фибробластов) или вещества, обладающие по существу такой же активностью (aFGF, bFGF, KGF (кератиноцитарный фактор роста), HGF (фактор роста гепатоцитов), FGF-10 и т.п.) и (4) другие факторы роста (например, CSF (фактор, стимулирующий колониеобразование), EPO (эритропоэтин), IL-2 (интерлейкин-2), NGF (фактор роста нервов), PDGF (тромбоцитарный фактор роста) и TGFβ (трансформирующий фактор роста β) и т.п.), среди прочих.
«Рецептором фактора роста клеток» может быть любой рецептор, способный связывать указанный фактор роста клеток, включая EGF рецептор, херегулиновый рецептор (HER2), инсулиновый рецептор-1, инсулиновый рецептор-2, IGF рецептор, FGF рецептор-1, FGF рецептор-2 и т.п.
Лекарственное средство, ингибирующее фактор роста клеток, приведенное выше, включает, например, херсептин (антитело для анти-HER2 рецептора).
Лекарственное средство, ингибирующее фактор роста клеток, приведенное выше, или его рецептор включает гербимицин, PD153035 [например, Science, 265 (5175) p. 1093, (1994)] и т.п.
Лекарственное средство, ингибирующие фактор роста клеток или его рецептор, включает ингибиторы HER2 как дополнительный класс. Ингибитор HER2 может представлять собой любое вещество, которое ингибирует активность HER2 (например, фосфорилирующую активность), включая таким образом антитело, низкомолекулярное соединение (синтетический или природный продукт), антисенс, HER2 лиганд, херегулин и любое из них вещество как частично модифицированное или видоизмененное по структуре. Кроме того, таким ингибитором может быть вещество, которое ингибирует активность рецептора HER2 (например, антитело рецептора HER2). Низкомолекулярные соединения, обладающие HER2 ингибирующей активностью, включают, например, соединения, описанные в WO 98/03505, то есть 1-[3-[4-[2-((E)-2-фенилэтенил)-4-оксазолилметокси]фенил]пропил]-1,2,4-триазол и т.п.
В случае гипертрофии предстательной железыиспользуют комбинации, содержащие соединение настоящего изобретения в сочетании, например, с суперагонистом GnRH, антагонистом андрогенов, антиэстрогеном, пептидом-антагонистом GnRH, ингибитором α-редуктазы, ингибитором α-рецептора, ингибитором ароматазы, ингибитором 17β-гидроксистероидной дегидрогеназы, ингибитором продуцирования андрогена надпочечниками, ингибитором киназы и т.п.
В случае рака предстательной железы используют комбинации, содержащие соединение настоящего изобретения в сочетании, например, с суперагонистом GnRH, антагонистом андрогена, антиэстрогеном, химиотерапевтическим средством (например, ифосфамидом, UFT, адриамицином, пепломицином, цисплатином и т.п.), пептидом-антагонистом GnRH, ингибитором ароматазы, ингибитором 17β-гидроксистероидной дегидрогеназы, ингибитором продуцирования андрогена надпочечниками, ингибитором киназы, лекарственным средством для гормональной терапии, таким как эстрогены (например, DSB, EMP и т.п.), антагонисты андрогенов (например, CMA и т.п.), лекарственным средством-антагонистом фактора роста или его рецептора, и т.п.
В случае рака груди используют комбинации, содержащие соединение настоящего изобретения в сочетании, например, с суперагонистом GnRH, антиэстрогеном, химиотерапевтическим средством (например, циклофосфамидом, 5-FU, UFT, метотрексатом, адриамицином, митомицином C, митоксантроном, и т.п.), пептидом-антагонистом GnRH, ингибитором ароматазы, ингибитором продуцирования андрогена надпочечниками, ингибитором киназы, лекарственным средством для гормональной терапии, таким как антиэстроген (например, тамоксифен и т.п.), прогестероны (например, MPA и т.п.), андрогены, эстрогены и т.п., и лекарственным средством-антагонистом фактора роста или его рецептора, и подобными.
Вариант введения соединения настоящего изобретения и сопутствующих лекарств конкретно не ограничен при условии, что соединение настоящего изобретения и сопутствующее лекарственный препарат объединяют при введении. Таким вариантом введения может быть, например, (1) введениеодного препарата, приготовленного из соединения настоящего изобретения и содержащего одновременно и сопутствующее лекарственное средство, (2) одновременное введение идентичным путем двух отдельных препаратов, приготовленного с соединением настоящего изобретения и приготовленного с сопутствующим лекарственным средством, (3) последовательное и периодическое введение идентичным путем двух отдельных препаратов, приготовленного с соединением настоящего изобретения и приготовленного с сопутствующим лекарственным средством, (4) одновременное введение различными путями двух отдельных препаратов, приготовленного с соединением настоящего изобретения и приготовленного с сопутствующим лекарственным средством, (5) последовательное и периодическое введение различными путями двух отдельных препаратов, приготовленного с соединением настоящего изобретения и приготовленного с сопутствующим лекарственным средством, (например, введение соединения настоящего изобретения, затем сопутствующего лекарственного средства или в обратном порядке) и т.п.
Когда соединение данного изобретения используют в качестве средства для профилактики и/или лечения указанных выше заболеваний или в области животноводства или рыбоводства, его можно вводить перорально или неперорально, в виде препаратов, приготовленных с фармацевтически приемлемым носителем, обычно в виде твердых препаратов, таких как таблетки, капсулы, гранулы и порошки для перорального введения, или в виде препаратов для внутривенных, подкожных, внутримышечных или иных инъекций, суппозиториев или сублингвальных таблеток для неперорального введения. Его также можно вводить сублингвально, подкожно, внутримышечно или же в виде препаратов с замедленным высвобождением - сублингвальных таблеток, микрокапсул и т.п. Дневная доза зависит от тяжести симптомов; возраста, пола, массы тела и чувствительности субъекта; продолжительности и интервалов введения; свойств, фасовки и вида фармацевтического препарата; типа активного ингредиента и т.п. и не может быть ограничена. Для применения в лечении вышеописанных гормонозависимых форм рака (например, рака предстательной железы, рака матки, рака груди, опухоли гипофиза и т.д.), гипертрофии предстательной железы,гистеромиомы, эндометриоза, метрофибромы, преждевременной половой зрелости и т.п. дневная доза обычно составляет около 0,01-30 мг, предпочтительно около 0,02-10 мг, и более предпочтительно 0,1-10 мг, особенно предпочтительно 0,1-5 мг на 1 кг массы млекопитающего, причем обычно дозу делят на 1-4 приема.
Вышеуказанные дозы активного ингредиента (соединения настоящего изобретения) для перорального введения применимы для использования в животноводстве и рыбоводстве. Дневная доза составляет около 0,01-30 мг, предпочтительно около 0,1-10 мг на 1 кг массы организма субъекта, обычно дозу делят на 1-3 приема.
В фармацевтической композиции настоящего изобретения количество соединения (I) составляет 0,01-100мас.% или около того от общей массы композиции.
Вышеуказанные фармацевтически приемлемые носители представляют собой различные органические или неорганические вещества-носители, широко применяемые в качестве фармацевтических материалов, включающие эксципиенты, вещества, способствующие скольжению, связующие и разрыхлители для твердых препаратов; растворители, вспомогательные вещества, способствующие растворению, суспендирующие агенты, агенты для изотоничности, буферы и болеутоляющие средства для жидких препаратов; и т.п. Если необходимо, можно использовать другие фармацевтические добавки, такие как консерванты, антиоксиданты, окрашивающие и подслащивающие вещества.
Предпочтительные примеры эксципиентов включают, например, лактозу, сахарозу, D-маннит, крахмал, кристаллическую целлюлозу, light ангидрид кремниевой кислоты и т.п. Предпочтительные примеры веществ, способствующих скольжению, включают, например, стеарат магния, стеарат кальция, тальк, коллоидный диоксид кремния и т.п. Предпочтительные примеры связующих включают, например, кристаллическую целлюлозу, сахарозу, D-маннит, декстрин, гидроксипропилцеллюлозу, поливинилпирролидон и т.п. Предпочтительные примеры разрыхлителей включают, например, крахмал, карбоксиметилцеллюлозу, кальциевую соль карбоксиметилцеллюлозы, натриевую соль кросс-кармелозы, натриевую соль карбоксиметилкрахмала и т.п. Предпочтительные примеры растворителей включают, например, воду для инъекций, спирт, пропиленгликоль, макрогол, кунжутное масло, кукурузное масло и т.п. Предпочтительные примеры вспомогательных веществ, способствующих растворению, включают, полиэтиленгликоль, пропиленгликоль, D-маннит, бензилбензоат, этанол, трисаминометан, холестерин, триэтаноламин, карбонат натрия, цитрат натрия и т.п. Предпочтительные примеры суспендирующих агентов включают поверхностно-активные вещества, такие как стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионовую кислоту, лецитин, бензалконийхлорид, бензэтонийхлорид, сложный моноэфир глицерина и стеариновой кислоты и т.п.; и гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и т.п. Предпочтительные примеры агентов для изотоничности включают, например, хлорид натрия, глицерин, D-маннит и т.п. Предпочтительные примеры буферов включают, буферные растворы фосфатов, ацетатов, карбонатов, цитратов и т.п. Предпочтительные примеры успокаивающих средств включают бензиловый спирт и ему подобные. Предпочтительные примеры консервантов включают сложные эфиры параоксибензойной кислоты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусную кислоту, сорбиновую кислоту и т.п. Предпочтительные примеры антиоксидантов включают, например, сульфиты, аскорбиновую кислоту и т.п.
Путем прибавления суспендирующих агентов, вспомогательных веществ, способствующих растворению, стабилизаторов, агентов для изотоничности, консервантов и т.п. из соединения настоящего изобретения обычными способами могут быть получены препараты для инъекций (внутривенных, подкожных или внутримышечных).
В таких случаях соединение настоящего изобретения может быть лиофилизировано общеизвестным методом, если необходимо. При введении человеку можно без риска вводить, например, соединение настоящего изобретения перорально или неперорально, в чистом виде или в виде фармацевтической композиции, полученной смешиванием соединения настоящего изобретения с фармацевтически приемлемыми носителем, эксципиентом и разбавителем, выбранными в качестве подходящих.
Такие фармацевтические композиции включают препараты для перорального введения (например, порошки, гранулы, капсулы, таблетки), препараты для парентерального введения [например, препараты для инъекций, капельного вливания, препараты для наружного применения (например, назальные препараты, трансдермальные препараты и т.п.), суппозитории (например, ректальные суппозитории, вагинальные суппозитории и т.п.) и тому подобное].
Указанные препараты можно получать обычными хорошо известными способами, которые широко применяются для изготовления фармацевтических препаратов.
Препараты для инъекций можно получать, например, приготавливанием соединения настоящего изобретения в виде водного раствора для инъекций, содержащего диспергирующий агент (например, твин-80 (Tween 80) (выпускаемый Atlas Powder Company, USA), HCO 60 (выпускаемый Nikko Chemicals Co., Ltd.), полиэтиленгликоль, карбоксиметилцеллюлозу, альгинат натрия и т.п.), консервант (например, метилпарабен, пропилпарабен, бензиловый спирт и т.п.), агент для изотоничности (например, хлорид натрия, маннит, сорбит, глюкозу и т.п.) и тому подобное, или в виде масляного препарата для инъекций в растворе, в виде суспензии или эмульсии в растительном масле, таком как оливковое масло, кунжутное масло, хлопковое масло или кукурузное масло; пропиленгликоле и т.п.
Препарат для перорального введения можно получать путем прессования композиции с соединением настоящего изобретения после прибавления эксципиента (например, лактозы, сахарозы, крахмала и т.п.), разрыхлителя (например, крахмала, карбоната кальция и т.п.), связующего (например, крахмала, аравийской камеди, карбоксиметилцеллюлозы, поливинилпирролидона, гидроксипропилцеллюлозы и т.п.), вещества, способствующего скольжению (например, талька, стеарата магния, полиэтиленгликоля 6000 и т.п.) и других добавок и, если требуется, наносят на готовый продукт покрытие обычным способом с целью корригирования вкуса, растворимости в кишечнике и замедленного высвобождения. Вещества для покрытий включают, например, гидроксипропилметилцеллюлозу, этилцеллюлозу, гидроксиметилцеллюлозу, гидроксипропилцеллюлозу, полиоксиэтиленгликоль, твин-80, Prulonic F68, ацетатфталат целлюлозы, фталат гидроксипропилметилцеллюлозы, ацетат сукцинат гидроксиметилцеллюлозы, Eudragit (выпускаемый Rohm Company, Германия); сополимер метакриловая кислота/акриловая кислота), красители (например, оксид железа, диоксид титана) и т.п. Для энтерального препарата между энтеральной фазой и фазой, содержащей лекарство, может быть введена промежуточная фаза для разделения двух фаз общеизвестным способом.
Препарат для наружного применения может быть получен превращением соединения настоящего изобретения в масляную или водную композицию, которая может быть в твердом, полужидком или жидком состоянии. Такую твердую композицию получают, например, измельчением в порошок соединения настоящего изобретения в чистом виде или в смеси с эксципиентом (например, гликолем, маннитом, крахмалом, микрокристаллической целлюлозой и т.п.), загустителем (например, натуральным каучуком, производным целлюлозы, полимером акриловой кислоты и т.п.) и другими добавками. Такую жидкую композицию получают, приготавливая масляную или водную суспензию соединения настоящего изобретения почти так же, как и в случае препарата для инъекций. Полужидкая композиция представляет собой предпочтительно водный или масляный гель или мазь. Все указанные композиции могут содержать регуляторы рН (например, карбоновые кислоты, фосфорную кислоту, лимонную кислоту, хлористоводородную кислоту, гидроксид натрия и т.п.), консерванты (например, сложные эфиры параоксибензойной кислоты, хлорбутанол, бензалконийхлорид и т.п.) и другие добавки.
Суппозиторий получают приготавливанием соединения настоящего изобретения в виде масляной или водной твердой, полужидкой и жидкой композиции общеизвестным способом. Основы, которые можно использовать для таких композиций, включают глицериды высших жирных кислот (например, масло какао, витепсолы (выпускаемые Dynamite Nobel Company, Германия) и т.п.; жирные кислоты со средней длиной углеродной цепи (например, MIGLIOL, выпускаемый Dynamite Nobel Company, Германия) и растительные масла (например, кунжутное масло, соевое масло, хлопковое масло и т.п.). Водные основы включают, например, полиэтиленгликоли и пропиленгликоль. Основы для водных гелей, например, включают натуральные каучуки, производные целлюлозы, виниловые полимеры и полимеры акриловой кислоты.
Соединение формулы
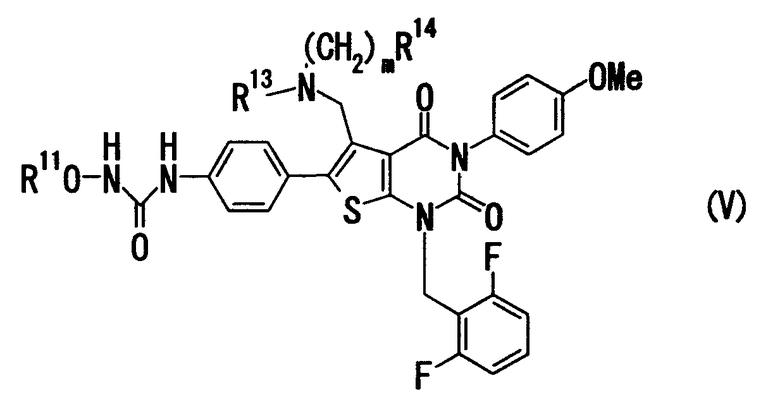
где и R11, и R13 означают C1-4алкил, R14 означает атом водорода или C1-4алкокси, и m равно целому числу от 1 до 4 (здесь и далее кратко называемое "соединение (V)") или его соль также обладают отличной антагонистической активностью в отношении GnRH, причем особенно сильной антагонистической активностью, несмотря на то что данное соединение находится вне объема соединения (I).
Примеры «С1-4алкила», обозначаемого R11 или R13, включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил и т.п.
Примеры «С1-4алкокси», обозначаемого R14 включают метокси этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси и т.п.
В качестве R11 предпочтительным является метил.
В качестве R13 предпочтительным является метил.
В качестве R14 предпочтительными являются атом водорода и метокси.
Предпочтительными примерами m являются 1 и 2.
Предпочтительными примерами соединения (V) являются N-(4-(5-(((2-метоксиэтил)метиламино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(4-метоксифенил)тиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина или N-(4-(1-(2,6-лифторбензил)-5-((диметиламино)метил)-3-(4-метоксифенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина и их соли.
Соли соединения (V) предпочтительно представляют собой физиологически приемлемые кислотно-аддитивные соли. Такие соли включают, например, соли, образованные с неорганическими кислотами (например, с хлористоводородной кислотой, бромистоводородной кислотой, азотной кислотой, серной кислотой, фосфорной кислотой), соли, образованные с органическими кислотами (например, муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой и т.п.) и т.п. Когда в соединении (V) имеется кислотная группа, оно может образовывать физиологически приемлемую соль с неорганическим основанием (например, щелочными или щелочноземельными металлами, такими как натрий, калий, кальций, магний и т.п.; аммиаком и т.п.) или с органическим основанием (например, с триметиламином, триэтиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, дициклогексиламином, N,N'-дибензилэтилендиамином и т.п.).
Соединение (V) может быть получено способом, описанным в заявках JP-A-9-169768 (WO 96/24597) и JP-A-2001-278884 (WO 00/56739), и аналогичным способом.
Соединение (V) может представлять собой гидрат или находиться в негидратированной форме. Примерами гидрата могут служить моногидрат, сесквигидрат и дигидрат.
Соединение (V) можно использовать в качестве пролекарства. Пролекарство означает соединение, которое преобразуется в соединение (V) в результате реакции, вызванной ферментом, кислотой желудочного сока или подобными факторами в физиологических условиях в живом организме, то есть соединение, которое преобразуется в соединение (V) в результате окисления, восстановления, гидролиза или подобных преобразований под действием ферментов; или соединение, которое преобразуется в соединение (V) под действием кислоты желудочного сока и т.п. Пролекарством для соединения (V) может, например, быть соединение, полученное ацилированием, алкилированием или фосфорилированием аминогруппы в соединении (I) (например, соединение, полученное в результате эйкозаноилирования, аланилирования, пентиламинокарбонилирования, (5-метил-2-оксо-1,3-диоксолен-4-илметоксикарбонилирования, тетрагидрофуранилирования, пирролидинилметилирования, пивалоилоксиметилирования, трет-бутилирования и т.п. аминогруппы соединения (I)). Указанные соединения могут быть получены из соединения настоящего изобретения.
Пролекарство соединения (V) может также быть соединением, которое преобразуется в соединение (V) в физиологических условиях, таких как условия, описанные в «IYAKUHIN no KAIHATSU (Development of Pharmaceuticals)», Vo1.7, Design of Molecules, p. 163-198, Published by HIROKAWA SHOTEN (1990).
Соединение (V) может быть меченным изотопами (например, 3H, 14C, 35S) и т.п.
И соединение, представленное формулой
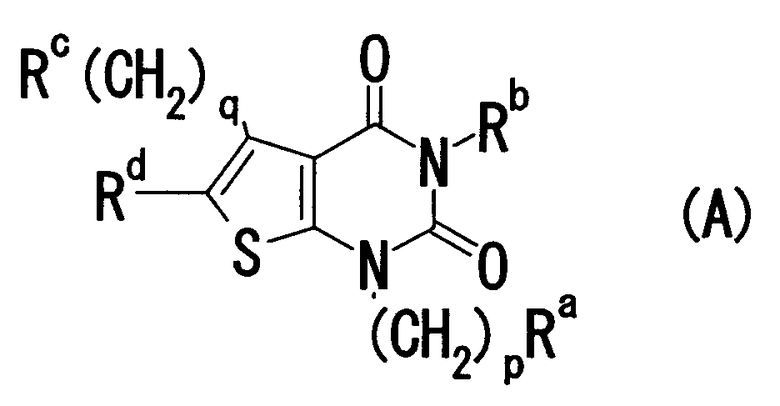
где Ra означает (1) атом водорода, (2) арильную группу, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила, (3) циклоалкильную группу, которая может содержать заместитель, или (4) гетероциклическую группу, которая может содержать заместитель; Rb означает азотсодержащую гетероциклическую группу, которая может содержать заместитель; Rc означает аминогруппу, которая может содержать заместитель; Rd означает арильную группу, которая может содержать заместитель; p равно целому числу от 0 до 3; и q равно целому числу от 0 до 3 (здесь и далее сокращенно называемое "соединение (А)") или его соль, которое содержит часть структуры соединения (I) настоящего изобретения, обладает превосходной антагонистическую активностью в отношении GnRH, особенно сильной антагонистическойактивностью, аналогичной активности соединения (I).
Определения для заместителей в соединении (A) показаны ниже.
Примерами «арильной группы, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила», обозначенной Ra, являются С6-14арильные группы, такие как фенил, 1-нафтил, 2-нафтил, антрил, фенантрил, аценафтиленил и т.п.
Примерами галогена в «арильной группе, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила», обозначенной Ra, являются фтор, хлор, бром и иод.
Примерами «карбоксигруппы, которая может быть этерифицирована или амидирована» в «арильной группе, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила», обозначенной Ra, являются карбоксил, C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил и т.п.), C3-6циклоалкилоксикарбонил (например, циклопропилоксикарбонил, циклобутилоксикарбонил, циклопентилоксикарбонил, циклогексилоксикарбонил и т.п.), C6-14арилоксикарбонил (например, феноксикарбонил, 1-нафтилоксикарбонил, 2-нафтилоксикарбонил, антрилоксикарбонил, фенантрилоксикарбонил, аценафтиленилоксикарбонил и т.п.), C7-10аралкилоксикарбонил (например, бензилоксикарбонил и т.п.), карбамоил, N-моно-С1-6алкилкарбамоил (например, метилкарбамоил, этилкарбамоил, пропилкарбамоил, изопропилкарбамоил, бутилкарбамоил, изобутилкарбамоил, втор-бутилкарбамоил, трет-бутилкарбамоил, пентилкарбамоил, гексилкарбамоил и т.п.), N-моно-С3-6циклоалкилкарбамоил (например, циклопропилкарбамоил, циклобутилкарбамоил, циклопентилкарбамоил, циклогексилкарбамоил и т.п.), N-моно-С6-14арил)карбамоил (например, фенилкарбамоил, 1-нафтилкарбамоил, 2-нафтилкарбамоил, антрилкарбамоил, фенантрилоксикарбамоил, аценафтиленилоксикарбамоил и т.п.), N-моно-С7-10аралкилкарбамоил (например, бензилкарбамоил и т.п.) и т.п.
Примерами алкилендиокси заместителей в «арильной группе, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила», обозначенной Ra, являются C1-6алкилендиокси (например, -OCH2O, -О(CH2)2O, -O(CH2)3O-, -O(CH2)4O-, -O(CH2)5O-, -O(CH2)6O-).
Примерами алкила в «арильной группе, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила», обозначенной Ra, являются C1-6алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.п.) и т.п.
Примерами алкокси заместителей в «арильной группе, которая может содержать 1-5 заместитель(ей), выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила», обозначенной Ra, являются C1-6алкокси (например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, гексилокси и т.п.) и т.п.
Примерами алкилтио заместителей в «арильной группе, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила», обозначенной Ra, являются C1-6алкилтио (например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио, гексилтио и т.п.) и т.п.
Примерами алкилсульфинила в «арильной группе, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила», обозначенной Ra, являются C1-6алкилсульфинил (например, метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, бутилсульфинил, изобутилсульфинил, втор-бутилсульфинил, трет-бутилсульфинил, пентилсульфинил, гексилсульфинил и т.п.) и т.п.
Примерами алкилсульфонила в «арильной группе, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила», обозначенной Ra, являются C1-6алкилсульфонил (например, метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил, трет-бутилсульфонил, пентилсульфонил, гексилсульфонил и т.п.) и т.п.
Примерами циклоалкильной группы в «циклоалкильной группе, которая может содержать заместитель», обозначенной Ra, являются C3-6циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил и т.п.) и т.п.
Примерами гетероциклической группы в «гетероциклической группе, которая может содержать заместитель», обозначенной Ra, являются (1) 5-членная циклическая группа, которая кроме атома углерода содержит 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и им подобных (например, 2-тиенил, 3-тиенил, 2-фурил, 3-фурил, 2-пирролил, 3-пирролил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, 3-(1,2,4-оксадиазолил), 5-(1,2,4-оксадиазолил), 1,3,4-оксадиазолил, 3-(1,2,4-тиадиазолил), 5-(1,2,4-тиадиазолил), 1,3,4-тиадиазолил, 4-(1,2,3-тиадиазолил), 5-(1,2,3-тиадиазолил), 1,2,5-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1H-тетразолил, 2H-тетразолил, оксоимидазинил, диоксотриазинил, пирролидинил и т.п.), (2) 6-членная циклическая группа, которая кроме атома углерода содержит 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и им подобных (например, 2-пиридил, 3-пиридил, 4-пиридил, N-оксидо-2-пиридил, N-оксидо-3-пиридил, N-оксидо-4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, N-оксидо-2-пиримидинил, N-оксидо-4-пиримидинил, N-оксидо-5-пиримидинил, 2-тиоморфолинил, 3-тиоморфолинил, 2-морфолинил, 3-морфолинил, пиперидинил, пиранил, тиопиранил, 1,4-оксазинил, 1,4-тиазинил, 1,3-тиазинил, 2-пиперазинил, 3-пиперазинил, триазинил, оксотриазинил, 3-пиридазинил, 4-пиридазинил, пиразинил, N-оксидо-3-пиридазинил, N-оксидо-4-пиридазинил и т.п.), и (3) бициклическая или трициклическая конденсированная циклическая группа, которая кроме атома углерода содержит 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и им подобных (например, бензофурил, бензотиазолил, бензоксазолил, тетразоло[1,5-b]пиридазинил, триазоло[4,5-b]пиридазинил, бензоимидазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, индолизинил, хинолизинил, 1,8-нафтилидинил, пуринил, птеридинил, дибензофуранил, карбазолил, акридинил, фенантридинил, хроманил, бензоксазинил, феназинил, фенотиазинил, феноксазинил и т.п.).
Примерами заместителя «циклоалкильной группы, которая может содержать заместитель» и «гетероциклической группы, которая может содержать заместитель», обозначенных Ra, являются (i) C1-6алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.п.), (ii) C2-6алкенил (например, винил, аллил, 1-бутенил, 2-бутенил и т.п.), (iii) C2-6алкинил (например, этинил, пропаргил, 2-бутинил, 5-гексинил и т.п.), (iv) C3-6циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил и т.п.), (v) C6-14арил (например, фенил, 1-нафтил, 2-нафтил и т.п.), (vi) C6-14аралкил (например, бензил, фенетил и т.п.), (vii) нитро, (viii) гидрокси, (ix) меркапто, (x) циано, (xi) карбамоил, (xii) карбоксил, (xiii) C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил и т.п.), (xiv) сульфо, (xv) галоген (например, фтор, хлор, бром и иод), (xvi) C1-6алкокси (например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, гексилокси и т.п.), который может содержать C1-6алкокси (например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, гексилокси и т.п.), (xvii) C6-10арилокси (например, фенокси, 1-нафтилокси, 2-нафтилокси и т.п.), (xviii) C1-6алкилтио (например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио, гексилтио и т.п.), (xix) C6-10арилтио (например, фенилтио, 1-нафтилтио, 2-нафтилтио и т.п.), (xx) C1-6алкилсульфинил (например, метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, бутилсульфинил, изобутилсульфинил, втор-бутилсульфинил, трет-бутилсульфинил, пентилсульфинил, гексилсульфинил и т.п.), (xxi) C6-10арилсульфинил (например, фенилсульфинил, 1-нафтилсульфинил, 2-нафтилсульфинил и т.п.), (xxii) C1-6алкилсульфонил (например, метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил, трет-бутилсульфонил, пентилсульфонил, гексилсульфонил и т.п.), (xxiii) C6-10арилсульфонил (например, фенилсульфонил, 1-нафтилсульфонил, 2-нафтилсульфонил и т.п.), (xxiv) амино, (xxv) C1-6ациламино, (например, формиламино, ацетиламино, пропиониламино, бутириламино, изобутириламино, валериламино и т.п.), (xxvi) моно-С1-6алкиламино (например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино и т.п.), (xxvii) ди-С1-6алкиламино (например, диметиламино, диэтиламино, дипропиламино, диизопропиламино, дибутиламино и т.п.), (xxviii) C3-6циклоалкиламино (например, циклопропиламино, циклобутиламино, циклопентиламино, циклогексиламино и т.п.), (xxix) C6-10ариламино (например, анилино, 1-нафтиламино, 2-нафтиламино и т.п.), (xxx) C1-6ацил (например, формил, ацетил, пропионил, бутирил, изобутирил, валерил и т.п.), (xxxi) C6-10арилкарбонил (например, бензоил, 1-нафтилкарбонил, 2-нафтилкарбонил и т.п.), (xxxii) C1-4алкилендиокси (например, -OCH2O, -O(CH2)2O-, -O(CH2)3O- и -О(СН2)4О-), (xxxiii) 5- или 6-членная гетероциклическая группа, которая, кроме атома углерода, содержит 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и им подобных (например, 2-тиенил, 3-тиенил, 2-фурил, 3-фурил, 2-пирролил, 3-пирролил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, 3-(1,2,4-оксадиазолил), 5-(1,2,4-оксадиазолил), 1,3,4-оксадиазолил, 3-(1,2,4-тиадиазолил), 5-(1,2,4-тиадиазолил), 1,3,4-тиадиазолил, 4-(1,2,3-тиадиазолил), 5-(1,2,3-тиадиазолил), 1,2,5-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1H-тетразолил, 2H-тетразолил, оксоимидазинил, диоксотриазинил, пирролидинил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 2-тиоморфолинил, 3-тиоморфолинил, 2-морфолинил, 3-морфолинил, пиперидинил, пиранил, тиопиранил, 1,4-оксазинил, 1,4-тиазинил, 1,3-тиазинил, 2-пиперазинил, 3-пиперазинил, триазинил, оксотриазинил, 3-пиридазинил, 4-пиридазинил, пиразинил и т.п.), (xxxiv) оксо, (xxxv) тиоксо и т.п. Количество заместителей составляет 1-6, предпочтительно 1-3, и заместитель может находиться в любом положении, в котором возможно замещение.
Примерами «азотсодержащей гетероциклическая группы, которая может содержать заместитель», обозначенной Rb, являются 5-7-членная азотсодержащая гетероциклическая группа (например, пирролидин-1-ил, пирролидин-2-ил, пирролидин-3-ил, оксазолидин-3-ил, тиазолидин-3-ил, изоксазолидин-2-ил, изотиазолидин-2-ил, имидазолидин-1-ил, имидазолидин-2-ил, имидазолидин-4-ил, пиразолидин-2-ил, пиразолидин-3-ил, пиразолидин-4-ил, пиррол-1-ил, пиррол-2-ил, пиррол-3-ил, имидазол-1-ил, имидазол-2-ил, имидазол-4-ил, пиразол-1-ил, пиразол-3-ил, пиразол-4-ил, 1,2,3-триазол-1-ил, 1,2,5-триазол-1-ил, тетразол-1-ил, тетразол-2-ил, тетразол-5-ил, оксазол-2-ил, оксазол-4-ил, оксазол-5-ил, изоксазол-3-ил, изоксазол-4-ил, изоксазол-5-ил, тиазол-2-ил, тиазол-4-ил, тиазол-5-ил, изотиазол-3-ил, изотиазол-4-ил, изотиазол-5-ил, пиперидин-1-ил, пиперидин-2-ил, пиперидин-3-ил, пиперидин-4-ил, пиперазин-1-ил, пиперазин-2-ил, морфолин-2-ил, морфолин-3-ил, морфолин-4-ил, пиридин-2-ил, пиридин-3-ил, пиридин-4-ил, пиразин-2-ил, пиримидин-2-ил, пиримидин-4-ил, пиримидин-5-ил, пиридазин-3-ил, пиридазин-4-ил, 1,2,3-триазин-4-ил, 1,2,3-триазин-5-ил, 1,2,4-триазин-3-ил, 1,2,4-триазин-5-ил, 1,2,4-триазин-6-ил, 1,3,5-триазин-2-ил, 1,2,3,4-тетразин-5-ил, 1,2,3,5-тетразин-4-ил, азепан-1-ил, азепан-2-ил, 1,2-диазепан-3-ил, 1,2-диазепан-4-ил, 1,2-диазепан-5-ил, 1,3-диазепан-2-ил, 1,3-диазепан-4-ил, 1,3-диазепан-5-ил, 1,4-диазепан-2-ил, 1,4-диазепан-3-ил, 1,4-диазепан-5-ил, 1,2,3-триазепан-4-ил, 1,2,3-триазепан-5-ил, 1,2,4-триазепан-3-ил, 1,2,4-триазепан-5-ил и т.п.) и т.п.
Примерами заместителя «азотсодержащей гетероциклической группы, которая может содержать заместитель», обозначенной Rb, являются заместители такого же типа и в таком же количестве, аналогично примерам заместителя «циклоалкильной группы, которая может содержать заместитель», и «гетероциклической группы, которая может содержать заместитель», обозначаемых Ra.
Примером «аминогруппы, которая может содержать заместитель», обозначенной Rc, является группа формулы -NReRf, в которой Re означает (1) атом водорода, (2) C1-6алкил, который может содержать заместитель, (3) C3-6циклоалкил, который может содержать заместитель, (4) C6-14арил, который может содержать заместитель, (5) C7-20аралкил, который может содержать заместитель, (6) карбамоил, который может содержать заместитель или (7) гетероциклическая группа; и Rf означает атом водорода или C1-6алкил, который может содержать заместитель.
Примерами C1-6алкила «C1-6алкила, который может содержать заместитель», обозначенного Re и Rf, являются метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.п.
Примерами заместителя «C1-6алкила, который может содержать заместитель», обозначенного Re и Rf, являются (1) C1-6алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил и т.п.), (2) C2-6алкенил (например, винил, 1-метилвинил, 1-пропенил, аллил и т.п.), (3) C2-6алкинил (например, этинил, 1-пропинил, пропаргил и т.п.), (4) C3-6циклоалкил(например, циклопропил, циклобутил, циклопентил, циклогексил и т.п.), (5) C5-7циклоалкенил (например, циклопентенил, циклогексенил и т.п.), (6) C7-11аралкил (например, бензил, α-метилбензил, фенетил и т.п.), (7) C6-14арил (например, фенил, нафтил и т.п.), (8) C1-6алкокси (например, метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси и т.п.), (9) C6-14арилокси (например, фенокси, 1-нафтокси, 2-нафтокси и т.п.), (10) C1-6алканоил (например, формил, ацетил, пропионил, бутирил, изобутирил и т.п.), (11) C6-14арилкарбонил (например, бензоил, 1-нафтилкарбонил, 2-нафтилкарбонил и т.п.), (12) C1-6алканоилокси (например, формилокси, ацетокси, пропионилокси, бутирилокси, изобутирилокси и т.п.), (13) C6-14арилкарбонилокси (например, бензоилокси, 1-нафтилкарбонилокси, 2-нафтилкарбонилокси и т.п.), (14) карбокси, (15) C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил и т.п.), (16) карбамоил, (17) N-моно-С1-4алкилкарбамоил (например, N-метилкарбамоил, N-этилкарбамоил, N-пропилкарбамоил, N-изопропилкарбамоил, N-бутилкарбамоил и т.п.), (18) N,N-ди-С1-4алкилкарбамоил (например, N,N-диметилкарбамоил, N,N-диэтилкарбамоил, N,N-дипропилкарбамоил, N,N-дибутилкарбамоил и т.п.), (19) циклический аминокарбонил (например, 1-азиридинилкарбонил, 1-азетидинилкарбонил, 1-пирролидинилкарбонил, 1-пиперидинилкарбонил, N-метилпиперазинилкарбонил, морфолинокарбонил и т.п.), (20) галоген (например, фтор, хлор, бром, иод), (21) C1-4алкил, замещенный 1-3 атомом(ами) галогена (например, хлорметил, дихлорметил, трифторметил, трифторэтил и т.п.), (22) оксо, (23) амидино, (24) имино, (25) амино, (26) моно- или ди-C1-4алкиламино (например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, втор-бутиламино, трет-бутиламино, пентиламино, гексиламино, диметиламино, диэтиламино, дипропиламино и т.п.), (27) 3-6-членная циклическая аминогруппа, которая кроме атома углерода может содержать 1-3 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и им подобных (например, азиридинил, азетидинил, пирролидинил, пирролинил, пирролил, имидазолил, пиразолил, имидазолидинил, пиперидино, морфолино, дигидропиридил, пиридил, N-метилпиперазинил, N-этилпиперазинил и т.п.), (28) C1-6алканоиламино (например, формиламино, ацетиламино, трифторацетиламино, пропиониламино, бутириламино, изобутириламино и т.п.), (29) бензамидо, (30) карбамоиламино, (31) (N-C1-4алкилкарбамоил)амино (например, (N-метилкарбамоил)амино, (N-этилкарбамоил)амино, (N-пропилкарбамоил)амино, (N-изопропилкарбамоил)амино, (N-бутилкарбамоил)амино и т.п.), (32) a (N,N-ди-C1-4алкилкарбамоил)амино (например, (N,N-диметилкарбамоил)амино, (N,N-диэтилкарбамоил)амино, (N,N-дипропилкарбамоил)амино, (N,N-дибутилкарбамоил)амино и т.п.), (33) C1-6алкилендиокси (например, -OCH2O, -O(CH2)2O-, -O(CH2)3О-, -O(CH2)4O-, -O(CH2)5O-, -O(CH2)6O-), (34) дигидроборил, (35) гидрокси, (36) эпокси, (37) нитро, (38) циано, (39) меркапто, (40) сульфо, (41) сульфино, (42) фосфоно, (43) сульфамоил, (44) N-C1-6алкилсульфамоил (например, N-метилсульфамоил, N-этилсульфамоил, N-пропилсульфамоил, N-изопропилсульфамоил, N-бутилсульфамоил и т.п.), (45) N,N-ди-С1-6алкилсульфамоил (например, N,N-диметилсульфамоил, N,N-диэтилсульфамоил, N,N-дипропилсульфамоил, N,N-дибутилсульфамоил и т.п.), (46) C1-6алкилтио (например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, втор-бутилтио, трет-бутилтио и т.п.), (47) фенилтио, (48) C1-6алкилсульфинил (например, метилсульфинил, этилсульфинил, пропилсульфинил, бутилсульфинил и т.п.), (49) фенилсульфинил, (50) C1-6алкилсульфонил (например, метилсульфонил, этилсульфонил, пропилсульфонил, бутилсульфонил и т.п.), (51) фенилсульфонил и т.п. Количество заместителей составляет 1-6, предпочтительно, 1-3, и заместитель может находиться в любом положении, в котором возможно замещение.
Примерами C3-6циклоалкила «C3-6циклоалкила, который может содержать заместитель», обозначенного Re, являются циклопропил, циклобутил, циклопентил, циклогексил и т.п.
Примеры заместителя «C3-6циклоалкила, который может содержать заместитель», обозначенного Rе, аналогичны примерам заместителя «C1-6алкила, который может содержать заместитель», обозначенного выше Rе и Rf. Количество заместителей составляет 1-6, предпочтительно 1-3, и заместитель может находиться в любом положении, в котором возможно замещение.
Примерами С6-14арила «С6-14арила, который может содержать заместитель», обозначенного Re, являются фенил, нафтил, антраценил и т.п.
Примеры заместителя «С6-14арила, который может содержать заместитель», обозначенного Re, аналогичны примерам заместителя «С1-6алкила, который может содержать заместитель», обозначенного выше Re и Rf, за исключением оксо и эпокси. Количество заместителей составляет 1-6, предпочтительно 1-3, и заместитель может находиться в любом положении, в котором возможно замещение.
Примерами C7-20аралкила «C7-20аралкила, который может содержать заместитель», обозначенного Re, являются бензил, фенетил, фенилпропил, бензгидрил, тритил и т.п.
Примеры заместителя «C7-20 аралкила, который может содержать заместитель», аналогичны примерам заместителя «С1-6алкила, который может содержать заместитель», обозначенного выше Re и Rf.Количество заместителей составляет 1-6, предпочтительно 1-3, и заместитель может находиться в любом положении, в котором возможно замещение.
Примерами заместителя «карбамоила, который может содержать заместитель», обозначенного Re, являются (1) С1-6алкил, который может содержать заместитель, (2) C3-6циклоалкил, который может содержать заместитель, (3) С6-14арил, который может содержать заместитель, (4) C7-20аралкил, который может содержать заместитель, (5) гидрокси, (6) С1-6алкокси, который может содержать заместитель, (7) С1-6алкоксикарбонил, который может содержать заместитель и т.п. Количество заместителей может составлять 1 или 2.
Примеры «С1-6алкила, который может содержать заместитель» в качестве заместителя «карбамоила, который может содержать заместитель», обозначенного Re, аналогичны примерам «С1-6алкила, который может содержать заместитель», обозначенного выше Re и Rf.
Примеры «C3-6 циклоалкила, который может содержать заместитель», «С6-14арила, который может содержать заместитель», и «C7-20аралкила, который может содержать заместитель», в качестве заместителя «карбамоила, который может содержать заместитель», обозначенного Re, аналогичны примерам «C3-6 циклоалкила, который может содержать заместитель», «С6-14арила, который может содержать заместитель» и «C7-20аралкила, который может содержать заместитель», обозначенные выше Re.
Примерами C1-6алкоксигруппы «C1-6алкоксигруппы, которая может содержать заместитель» в качестве заместителя «карбамоила, который может содержать заместитель», обозначенного Re, являются метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, гексилокси и т.п. Примеры заместителя «C1-6алкоксигруппы, которая может содержать заместитель» аналогичны примерам для"C1-6алкоксигруппы, которая может содержать заместитель", обозначенной выше Re. Количество заместителей составляет 1-6, предпочтительно 1-3, и заместитель может находиться в любом положении, в котором возможно замещение.
Примером «C1-6алкоксикарбонила, который может содержать заместитель» в качестве заместителя «карбамоила, который может содержать заместитель», обозначенного Re, является группа, содержащая «C1-6алкокси, который может содержать заместитель» в качестве заместителя «карбамоила, который может содержать заместитель», обозначенную выше Re, объединенная с карбонилом.
Примерами «гетероциклической группы», обозначенной Re, являются (1) 5-членная циклическая группа, содержащая кроме атомов углерода 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и т.п. (например, 2-тиенил, 3-тиенил, 2-фурил, 3-фурил, 2-пирролил, 3-пирролил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, 3-(1,2,4-оксадиазолил), 5-(1,2,4-оксадиазолил), 1,3,4-оксадиазолил, 3-(1,2,4-тиадиазолил), 5-(1,2,4-тиадиазолил), 1,3,4-тиадиазолил, 4-(1,2,3-тиадиазолил), 5-(1,2,3-тиадиазолил), 1,2,5-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1H-тетразолил, 2H-тетразолил, оксоимидазинил, диоксотриазинил, пирролидинил и т.п.), (2) 6-членная циклическая группа, содержащая кроме атомов углерода 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и т.п. (например, 2-пиридил, 3-пиридил, 4-пиридил, N-оксидо-2-пиридил, N-оксидо-3-пиридил, N-оксидо-4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, N-оксидо-2-пиримидинил, N-оксидо-4-пиримидинил, N-оксидо-5-пиримидинил, 2-тиоморфолинил, 3-тиоморфолинил, 2-морфолинил, 3-морфолинил, пиперидинил, пиранил, тиопиранил, 1,4-оксазинил, 1,4-тиазинил, 1,3-тиазинил, 2-пиперазинил, 3-пиперазинил, триазинил, оксотриазинил, 3-пиридазинил, 4-пиридазинил, пиразинил, N-оксидо-3-пиридазинил, N-оксидо-4-пиридазинил и т.п.), и (3) бициклическая или трициклическая конденсированная циклическая группа, которая содержит кроме атомов углерода 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и т.п. (например, бензофурил, бензотиазолил, бензоксазолил, тетразоло[1,5-b]пиридазинил, триазоло[4,5-b]пиридазинил, бензоимидазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, индолизинил, хинолизинил, 1,8-нафтилидинил, пуринил, птеридинил, дибензофуранил, карбазолил, акридинил, фенантридинил, хроманил, бензоксазинил, феназинил, фенотиазинил, феноксазинил и т.п.).
Примерами арила «арила, который может содержать заместитель», обозначенного Rd, являются фенил, нафтил, антраценил и т.п.
Примерами заместителя в «ариле, который может содержать заместитель», обозначенного Rd, являются (1) C6-14арил (например, фенил, нафтил и т.п.), который может содержать 1-4 заместителя, выбранных из группы, состоящей из (i) гидрокси, (ii) амино, (iii) моно- или ди-C1-6алкиламино (например, метиламино, этиламино, пропиламино, диметиламино, диэтиламино и т.п.), (iv) C1-6алкокси (например, метокси, этокси, пропокси, бутокси, пентилокси, гексилокси и т.п.), и (v) галоген (например, фтор, хлор, бром и иод), (2) гидрокси, (3) карбокси, (4) нитро, (5) C1-6алкокси (например, метокси, этокси, пропокси, изопропокси, бутокси, пентилокси, гексилокси и т.п.), (6) C1-6алкилкарбонилокси (например, ацетокси, пропионилокси, бутирилокси, изобутирилокси, валерилокси, изо валерилокси, пивалоилокси, пентилкарбонилокси, гексилкарбонилокси и т.п.), (7) C1-6алкилтио (например, метилтио, этилтио, пропилтио, изопропилтио, бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, пентилтио, гексилтио и т.п.), (8) C1-6алкилсульфинил (например, метилсульфинил, этилсульфинил, пропилсульфинил, изопропилсульфинил, бутилсульфинил, изобутилсульфинил, втор-бутилсульфинил, трет-бутилсульфинил, пентилсульфинил, гексилсульфинил и т.п.), (9) C1-6алкилсульфонил (например, метилсульфонил, этилсульфонил, пропилсульфонил, изопропилсульфонил, бутилсульфонил, изобутилсульфонил, втор-бутилсульфонил, трет-бутилсульфонил, пентилсульфонил, гексилсульфонил и т.п.), (10) галоген (например, фтор, хлор, бром и иод), (11) группа формулы -NRgRh, в которой Rg означает (a) атом водорода, (b) C1-6алкил, который может содержать заместитель, (c) C3-6циклоалкил, который может содержать заместитель,, (d) C6-14арил, который может содержать заместитель, (e) C7-20аралкил, который может содержать заместитель, (f) карбамоил, который может содержать 1 или 2 заместителя, выбранных из группы, состоящей из (i) C3-6циклоалкила, который может содержать заместитель, (ii) C6-14арила, который может содержать заместитель, (iii) C7-20аралкила, который может содержать заместитель, (iv) гидрокси, (v) C1-6алкоксигруппы, которая может содержать заместитель и (vi) C1-6алкоксикарбонила, который может содержать заместитель, (g) гетероциклическую группу; и Rh означает атом водорода или C1-6алкил, который может содержать заместитель, (12) 5-членная циклическая группа, содержащая кроме атомов углерода 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и т.п. (например, 2-тиенил, 3-тиенил, 2-фурил, 3-фурил, 2-пирролил, 3-пирролил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил, 3-(1,2,4-оксадиазолил), 5-(1,2,4-оксадиазолил), 1,3,4-оксадиазолил, 3-(1,2,4-тиадиазолил), 5-(1,2,4-тиадиазолил), 1,3,4-тиадиазолил, 4-(1,2,3-тиадиазолил), 5-(1,2,3-тиадиазолил), 1,2,5-тиадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1H-тетразолил, 2H-тетразолил, оксоимидазинил, диоксотриазинил, пирролидинил и т.п.), (13) 6-членная циклическая группа, содержащая кроме атомов углерода 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и т.п. (например, 2-пиридил, 3-пиридил, 4-пиридил, N-оксидо-2-пиридил, N-оксидо-3-пиридил, N-оксидо-4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, N-оксидо-2-пиримидинил, N-оксидо-4-пиримидинил, N-оксидо-5-пиримидинил, 2-тиоморфолинил, 3-тиоморфолинил, 2-морфолинил, 3-морфолинил, пиперидинил, пиранил, тиопиранил, 1,4-оксазинил, 1,4-тиазинил, 1,3-тиазинил, 2-пиперазинил, 3-пиперазинил, триазинил, оксотриазинил, 3-пиридазинил, 4-пиридазинил, пиразинил, N-оксидо-3-пиридазинил, N-оксидо-4-пиридазинил и т.п.), (14) бициклическая или трициклическая конденсированная циклическая группа, которая содержит кроме атомов углерода 1-4 гетероатом(а), выбранных из атома кислорода, атома серы, атома азота и т.п. (например, бензофурил, бензотиазолил, бензоксазолил, тетразоло[1,5-b]пиридазинил, триазоло[4,5-b]пиридазинил, бензоимидазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, индолизинил, хинолизинил, 1,8-нафтилидинил, пуринил, птеридинил, дибензофуранил, карбазолил, акридинил, фенантридинил, хроманил, бензоксазинил, феназинил, фенотиазинил, феноксазинил и т.п.), (15) C1-6алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, гексилоксикарбонил и т.п.), (16) карбамоил, (17) N-моно-C1-6алкилкарбамоил (например, N-метилкарбамоил, N-этилкарбамоил, N-пропилкарбамоил, N-изопропилкарбамоил и т.п.), (18) N,N-ди-С1-6алкилкарбамоил (например, N,N-диметилкарбамоил, N,N-диэтилкарбамоил, N,N-дипропилкарбамоил и т.п.) и т.п. Количество заместителей составляет 1-6, предпочтительно 1-3, и заместитель может находиться в любом положении, в котором возможно замещение.
Определения заместителей Rg и Rf, используемых в группе формулы NRgRh, в которой Rg и Rh имеют те же значения, что и определенный выше заместитель «арила, который может содержать заместитель», обозначенного Rd, представлены ниже.
Примеры «C1-6алкила, который может содержать заместитель», обозначенного Rg и Rh, аналогичны примерам «C1-6алкила, который может содержать заместитель», обозначенного Re и Rf, описанным выше.
Примеры «C3-6циклоалкила, который может содержать заместитель», «С6-14арила, который может содержать заместитель», «C7-20аралкила, который может содержать заместитель», и «гетероциклической группы», обозначенных Rg, аналогичны примерам «C3-6 циклоалкила, который может содержать заместитель», «С6-14арила, который может содержать заместитель», «C7-20аралкила, который может содержать заместитель», и «гетероциклической группы», обозначаемых Re, описанным выше.
Примеры «C3-6циклоалкила, который может содержать заместитель», «С6-14арила, который может содержать заместитель» и «C7-20аралкила, который может содержать заместитель» в «карбамоиле, который может содержать 1 или 2 заместителя, выбранных из группы, состоящей из (i) C3-6 циклоалкила, который может содержать заместитель, (ii) С6-14арила, который может содержать заместитель, (iii) C7-20аралкила, который может содержать заместитель, (iv) гидрокси, (v) C1-6алкоксигруппы, которая может содержать заместитель и (vi) C1-6алкоксикарбонила, который может содержать заместитель, обозначенных Rg, аналогичны примерам «C3-6 циклоалкила, который может содержать заместитель», «С6-14арила, который может содержать заместитель» и «C7-20аралкила, который может содержать заместитель», обозначаемых Re, описанным выше.
Примерами «C1-6алкоксигруппы, которая может содержать заместитель» в «карбамоиле, который может содержать 1 или 2 заместителя, выбранных из группы, состоящей из (i) C3-6циклоалкила, который может содержать заместитель, (ii) С6-14арила, который может содержать заместитель, (iii) C7-20аралкила, который может содержать заместитель, (iv) гидрокси, (v) C1-6алкоксигруппы, которая может содержать заместитель и (vi) C1-6алкоксикарбонила, который может содержать заместитель», обозначенного Rg, являются метокси, этокси, пропокси, изопропокси, бутокси, изобутокси. Примеры заместителя указанной «C1-6алкоксигруппы, которая может содержать заместитель», аналогичны примерам заместителя «C1-6алкила, который может содержать заместитель», обозначаемого Re, описанным выше. Количество заместителей составляет 1-6, предпочтительно 1-3, и заместитель может находиться в любом положении, в котором возможно замещение.
Примером «C1-6алкоксикарбонила, который может содержать заместитель» в «карбамоиле, который может содержать 1 или 2 заместителя, выбранных из группы, состоящей из (i) C3-6циклоалкила, который может содержать заместитель, (ii) С6-14арила, который может содержать заместитель, (iii) C7-20аралкила, который может содержать заместитель, (iv) гидрокси, (v) C1-6алкоксигруппы, которая может содержать заместитель и (vi) C1-6алкоксикарбонила, который может содержать заместитель», обозначаемого Rg, является группа, содержащая «C1-6алкоксигруппу, которая может содержать заместитель», в качестве заместителя «карбамоила, который может содержать заместитель», обозначенного выше Rg, объединенная с карбонилом.
Предпочтительные примеры Ra представляют собой арильную группу, которая может содержать 1-5 заместителей, выбранных из группы, состоящей из (i) галогена, (ii) нитро, (iii) циано, (iv) амино, (v) карбоксигруппы, которая может быть этерифицирована или амидирована, (vi) алкилендиокси, (vii) алкила, (viii) алкокси, (ix) алкилтио, (x) алкилсульфинила и (xi) алкилсульфонила. Предпочтительными среди них являются моно- или дигалогензамещенные фенилы, особенно предпочтительным является 2,6-дифторфенил.
Предпочтительными примерами Rb являются пирролидин-1-ил, пирролидин-2-ил, имидазол-1-ил, имидазол-2-ил, 1,2,3-триазол-1-ил, 1,2,5-триазол-1-ил, тетразол-1-ил, тетразол-2-ил, пиридин-2-ил, пиридин-4-ил. Из них пиридин-2-ил является предпочтительным.
Предпочтительным примером Rc является группа, представленная формулой NRe'Rf', в которой Re' означает (1) С1-6алкил, который может содержать заместитель, или (2) C7-20аралкил; Rf' означает C1-6алкил. Из них предпочтительной является группа формулы N(Me)Re'', в которой Re'' означает С1-6алкил, который замещен С1-6алкоксигруппой, или бензил.
Предпочтительным примером Rd является фенил, который может содержать заместитель. Из них предпочтительной является фенильная группа, замещенная в положении 4 группой, представленной формулой -NRgRh, в которой значения Rg и Rh определены выше, и особенно предпочтительна фенильная группа, замещенная в положении 4 группой, представленной формулой -NHRg', в которой Rg' означает карбамоил, который может содержать 1 или 2 заместителя, выбранных из группы, состоящей из (i) C3-6циклоалкила, который может содержать заместитель, (ii) C6-14арила, который может содержать заместитель, (iii) C7-20аралкила, который может содержать заместитель, (iv) гидрокси, (v) C1-6алкоксигруппы, которая может содержать заместитель, и (vi) C1-6 алкоксикарбониламиногруппы. Еще более предпочтительна фенильная группа, замещенная в положении 4 C1-6алкоксиаминокарбониламиногруппой (например, 4-метоксиаминокарбониламинофенилом, 4-этоксиаминокарбониламинофенилом и т.п.).
Предпочтительным значением p является 1, и предпочтительным значением q является 1.
Соли соединения (A) предпочтительно представляют собой физиологически приемлемые кислотно-аддитивные соли. Такие соли включают, например, соли, образованные с неорганическими кислотами (например, с хлористоводородной кислотой, бромистоводородной кислотой, азотной кислотой, серной кислотой, фосфорной кислотой и т.п.), соли, образованные с органическими кислотами (например, с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, паратолуолсульфоновой кислотой и т.п.), и т.п. Когда в соединении (I) имеется кислотная группа, оно может образовывать физиологически приемлемую соль с неорганическим основанием (например, щелочными или щелочноземельными металлами, такими как натрий, калий, кальций, магний и т.п.; аммиаком и т.п.) или органическим основанием (например, триметиламином, триэтиламином, пиридином, пиколином, этаноламином, диэтаноламином, триэтаноламином, дициклогексиламином, N,N'-дибензилэтилендиамином и т.п.).
Соединение (A) может быть получено способом, описанным в заявках JP-A-9-169768 (WO 96/24597) и JP-A-2001-278884 (WO 00/56739), и аналогичным способом.
Соединение (А) может находиться в гидратированной или негидратированной форме. Примерами гидрата могут служить моногидрат, сесквигидрат и дигидрат.
Когда соединение (A) получают в виде смеси оптически активных конфигураций, смесь можно разделить на (R)- и (S)-формы обычными методами разделения оптических изомеров.
Соединение (A) может быть использовано в качестве пролекарства. Пролекарство соединения (A) или его соли означает соединение, которое преобразуется в соединение (А) настоящего изобретения в физиологических условиях или в результате реакции, вызванной ферментом, кислотой желудочного сока и тому подобным, в живом организме, то есть соединение, которое преобразуется в соединение (А) настоящего изобретения в результате окисления, восстановления, гидролиза или подобных преобразований под действием ферментов; соединение, которое преобразуется в соединение (А) настоящего изобретения под действием кислоты желудочного сока и т.п. Пролекарством для соединения (А) может, например, быть соединение, полученное ацилированием, алкилированием или фосфорилированием аминогруппы в соединении (А) (например, соединение, полученное в результате эйкозаноилирования, аланилирования, пентиламинокарбонилирования, (5-метил-2-оксо-1,3-диоксолен-4-илметоксикарбонилирования, тетрагидрофуранилирования, пирролидинилметилирования, пивалоилоксиметилирования, трет-бутилирования и т.п. аминогруппы соединения (А)); соединение, полученное ацилированием, алкилированием, фосфорилированием или борированиемгидроксигруппы в соединении (А) (например, соединение, полученное ацетилированием, пальмитоилированием, пропаноилированием, пивалоилированием, сукцинилированием, фумарилированием, аланилированием, диметиламинометилкарбонилированием и т.п. гидроксигруппы в соединении (А)); соединение, полученное этерификацией или амидированием карбоксигруппы в соединении (А) (например, соединение, полученное этилэтерификацией, фенилэтерификацией, карбоксиметилэтерификацией, диметиламинометилэтерификацией, пивалоилоксиметилэтерификацией, этоксикарбонилоксиэтилэтерификацией, фталидилэтерификацией, (5-метил-2-оксо-1,3-диоксолен-4-)метилэтерификацией, циклогексилоксикарбонилэтилэтерификацией и метиламидированием и т.п. карбоксигруппы) и т.п. Любое из указанных соединений может быть получено из соединения настоящего изобретения способом, по существу известным.
Пролекарство соединения (A) может также быть соединением, которое преобразуется в соединение (A) в физиологических условиях, таких как описано в "IYAKUHIN no KAIHATSU (Development of Pharmaceuticals)", Vol.7, Design of Molecules, p.163-198, Published by HIROKAWA SHOTEN (1990).
Соединение(A) может быть меченным изотопами (например, 3H, 14C, 35S) и т.п.
Настоящее изобретение описано более подробно в следующих ссылочных примерах, примерах, примерах приготовления препаратов и экспериментальных примерах, но оно не ограничивается указанными примерами.
1H ЯМР спектры регистрируют с тетраметилсиланом в качестве внутреннего стандарта на спектрометрах Varian GEMINI 200 (200 МГц), JEOL LAMBDA 300 (300 МГц) или Bruker AM500 (500 МГц); все значения δ приводятся в м.д. Если конкретно не указано другое, «%» представляет собой «мас.%». Выход указывают в мол./мол.(%). Другие обозначения, используемые в данной заявке, обозначают следующее
c: синглет
д: дублет
т: триплет
дт: дублет триплетов
м: мультиплет
уш.: уширенный
AIBN: 2,2-азобисизобутиронитрил
ДМФА: N,N-диметилформамид
NBS: N-бромсукцинимид
TFA (ТФУ): трифторуксусная кислота
ТГФ: тетрагидрофуран
Me: метил
Et: этил
Ph:фенил
TBS: трет-бутилдиметилсилил
Ms: метансульфонил
Термин «комнатная температура» указывает на интервал температур примерно от 15 до 25°C, но подразумевается, что он строго не ограничен. Каждое из веществ, таких как лактоза, кукурузный крахмал, D-маннит, низкозамещенная гидроксипропилцеллюлоза, тальк, гидроксипропилцеллюлоза, гидроксипропилцеллюлоза 2910, оксид титана и light ангидрид кремневой кислоты, используемые в описанных ниже препаратах, соответствуют стандартам Фармакопеи, 14-го издания (Pharmacopoeia, Fourteenth Edition).
Примеры
Ссылочный пример 1
Получение этил-2-[(2,6-дифторбензил)(этоксикарбонил)амино]-5-(4-{[(метоксиамино)карбонил]амино}фенил)-4-[(метиламино)метил]тиофен-3-карбоксилата
К раствору этил-4-(N-бензилбензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоксилата (3,64 г, 5,47 ммоль) в этаноле (100 мл) добавляют 1N хлористоводородную кислоту (8 мл) и 10% палладий на угле (50% влажность, 1,82 г). Смесь энергично перемешивают в атмосфере водорода в течение 6 часов. Катализатор удаляют и фильтрат нейтрализуют 1N раствором гидроксида натрия. Растворитель отгоняют и остаток распределяют между этилацетатом и водой. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток подвергают хроматографии на NH-силикагеле (Fuji Silysia Chemical) и получают указанное в заголовке соединение (2,43 г, 77%) в виде желтого порошка.
1H-ЯМР (CDCl3) δ: 1,18 (3H, т, J=7,0 Гц), 1,33 (3H, т, J=7,2 Гц), 2,33 (3H, с), 3,65 (2H, с), 3,82 (5H, с), 4,16 (2H, кв, J=7,0 Гц), 4,24(2H, кв, J=7,2 Гц), 4,96 (2H, с), 6,84 (2H, т, J=7,8 Гц), 7,1-7,35 (3H, м), 7,44 (2H, д, J=8,6 Гц), 7,53 (2H, д, J=8,6 Гц), 7,63 (1Н, с).
Ссылочный пример 2
Получение этил-2-[(2,6-дифторбензил)(этоксикарбонил)амино]-5-(4-{[(метоксиамино)карбонил]амино}фенил)-4-{[метил(пиридин-2-илметил)амино]метил}тиофен-3-карбоксилата
Соединение, полученное в ссылочном примере 1 (2,43 г, 4,21 ммоль), растворяют в ДМФА (20 мл) и к раствору добавляют N,N-диизопропиламин (2,93 мл, 16,84 ммоль) и гидрохлорид 2-хлорметилпиридина (1,04 г, 6,32 ммоль). Смесь перемешивают при комнатной температуре в течение 24 часов, объединяют с насыщенным водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат) и получают указанное в заголовке соединение(2,34 г, 83%) в виде желтого порошка.
Ссылочный пример 3
Получение 2-[(2,6-дифторбензил)(этоксикарбонил)амино]-5-(4-{[(метоксиамино)карбонил]амино}фенил)-4-{[метил(пиридин-2-илметил)амино]метил}тиофен-3-карбоновой кислоты
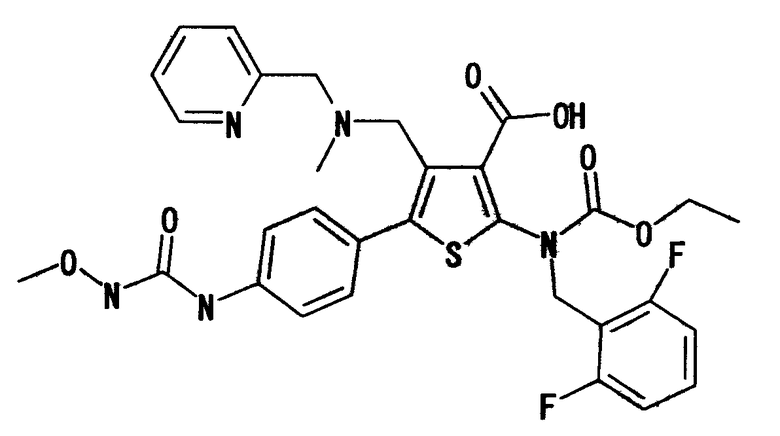
К раствору соединения, полученного в ссылочном примере 2 (2,34 г, 3,5 ммоль), в этаноле (40 мл) добавляют 2N раствор гидроксида натрия (8,75 мл) и смесь перемешивают при 50-60°C в течение 14 часов. Реакционную смесь охлаждают до комнатной температуры и нейтрализуют 1N хлористоводородной кислотой. Растворитель отгоняют и полученный остаток распределяют между этилацетатом и водой. Органический слой промывают насыщенным раствором соли и сушат над сульфатом магния. Растворитель отгоняют при пониженном давлении и получают указанное в заголовке соединение (2,06 г, 92%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ: 1,1-1,3 (3Н, м), 2,28 (3Н, с), 3,7-3,9 (2Н, уш.м), 3,84 (3Н, с), 3,91 (3Н, с), 4,1-4,3 (2Н, м), 5,07 (2Н, с), 6,7-6,85 (2Н, м), 7,15-7,8 (10Н, м), 8,5-8,6 (1Н, м).
Ссылочный пример 4
Получение метил-6-(бромметил)никотината
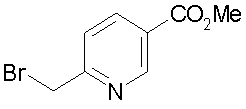
Метил-6-метилникотинат (1,05 г, 10 ммоль) растворяют в этилацетате (50 мл) и к раствору добавляют NBS (3,56 г, 20 ммоль) и AIBN (329 мг, 2 ммоль). Реакционную смесь перемешивают при 80°С в течение 3 ч, объединяют с водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат/гексан (1/4)) и получают указанное в заголовке соединение (682 мг, 28%) в виде оранжевого аморфного вещества.
1Н ЯМР (CDCl3) δ: 3,96 (3Н, с), 4,58 (2Н, с), 7,53 (1Н, д, J=8,2 Гц), 8,30 (2Н, дд, J=1,8, 8,2 Гц), 9,17 (1Н, д, J=1,8 Гц).
Ссылочный пример 5
Получение этил-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-4-[N-(2-метоксиэтил)-N-метиламинометил]-5-(4-аминофенил)тиофен-3-карбоксилата 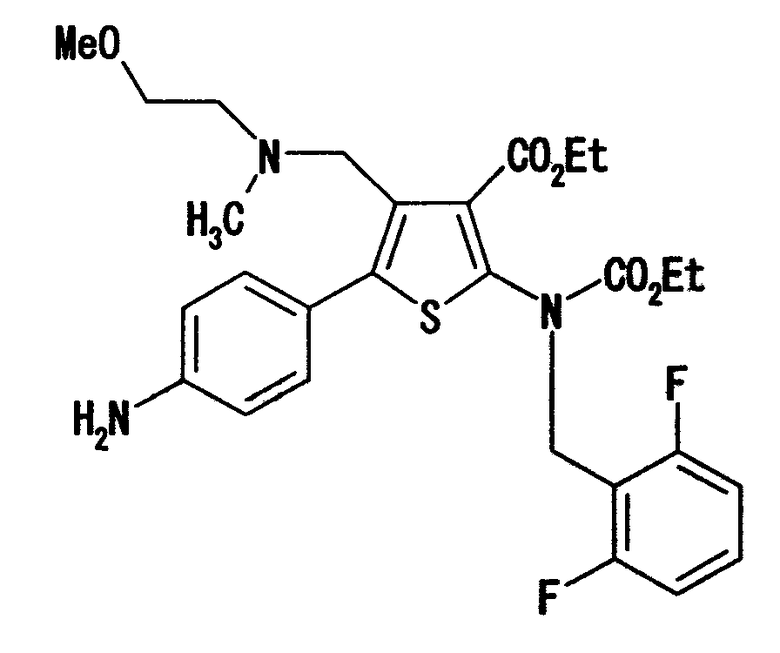
Раствор 2N гидрохлорида в диэтиловом эфире (21 мл) и 10% палладийна угле(50% влажность, 3,73 г) добавляют к раствору этил-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-4-[N-(2-метоксиэтил)-N-метиламинометил]-5-(4-нитрофенил)тиофен-3-карбоксилата (12,43 г) (JP-A-2001-278884, WO 00/56739) в этаноле (315 мл). Смесь энергично перемешивают в атмосфере водорода в течение 1 ч. Катализатор удаляют и фильтрат нейтрализуют раствором гидрокарбоната натрия. Растворитель отгоняют и остаток распределяют между этилацетатом и водой. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток подвергают хроматографии на NH-силикагеле (Fuji Silysia Chemical) и получают указанное в заголовке соединение (11,44 г) в виде масла.
1H-ЯМР (CDCl3) δ: 1,12-1,30 (3H, уш.), 2,05 (3H, с), 2,39 (2H, т, J=6,3Гц), 3,27 (3H, с), 3,32 (3H, т, J=6,3 Гц), 3,59 (2H, с), 3,78 (2H, с), 4,20 (2H, кв, J=7,1 Гц), 4,10-4,23 (2H, уш.), 5,00 (2H, с), 6,66 (2H, д, J=8,6 Гц), 6,84 (2H, т, J=8,2 Гц), 7,18 (2H, д, J=8,6 Гц), 7,15-7,30 (1Н, м).
ИК (KBr): 1717, 1626, 1609, 1472, 1406, 1300, 1246 см-1.
Ссылочный пример 6
Получение этил-2-[(2,6-дифторбензил)(этоксикарбонил)амино]-5-(4-{[(метоксиамино)карбонил]амино}фенил)-4-{[(2-метоксиэтил)(метил)амино]метил}-3-тиофенкарбоксилата
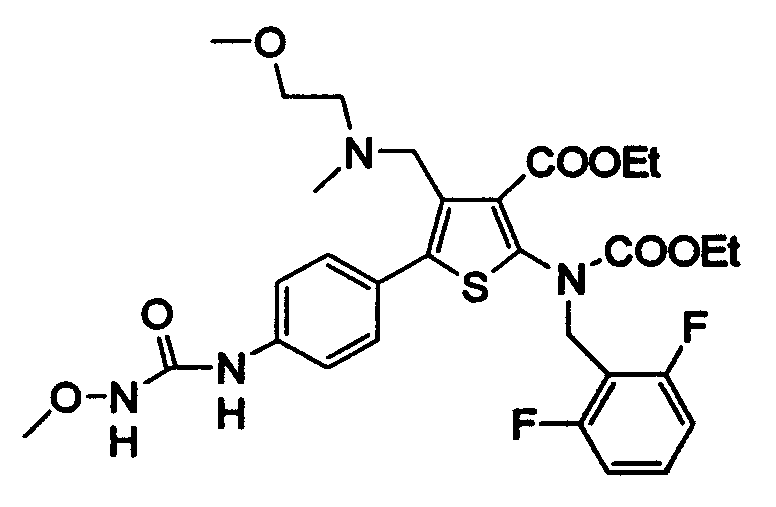
N-этилдиизопропиламин (3,06 мл) добавляют к раствору соединения, полученного в ссылочном примере 5 (4,89 г), в дихлорметане (113 мл) при охлаждении льдом и смесь перемешивают. N,N'-карбонилдиимидазол (2,82 г) добавляют к смеси при охлаждении льдом. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 67 часов. Реакционную смесь охлаждают при охлаждении льдом и добавляют гидрохлорид О-метилгидроксиамина (7,26 г) и N-этилдиизопропиламин (15,6 мл). Реакционную смесь нагревают до комнатной температуры и перемешивают при комнатной температуре в течение 19 часов. Реакционную смесь распределяют между хлороформом и насыщенным водным раствором гидрокарбоната натрия и экстрагируют хлороформом. Объединенный экстракт промывают насыщенным раствором соли и сушат над сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле и получают указанное в заголовке соединение(4,89 г) в виде светло-желтого карамелизованного продукта.
1H-ЯМР (CDCl3) δ: 1,19 (3H, уш.с), 1,30 (3H, т, J=6,9 Гц), 2,04 (3H, с), 2,40 (2H, т, J=6,0 Гц), 3,27 (3H, с), 3,33 (2H, т, J=6,0 Гц), 3,60 (2H, с), 3,81 (3H, с), 4,13-4,24 (4H, м), 5,00 (2H, с), 6,84 (2H, т, J=7,8 Гц), 7,19-7,29 (2H, м), 7,36 (2H, д, J=8,7 Гц), 7,50 (2H, д, J=8,7 Гц), 7,60 (1Н, с).
ИК (KBr): 1717, 1590, 1528, 1472, 1408, 1304 см-1.
Ссылочный пример 7
Получение 2-[(2,6-дифторбензил)(этоксикарбонил)амино]-5-(4-{[(метоксиамино)карбонил]амино}фенил)-4-{[(2-метоксиэтил)(метил)амино]метил}-3-тиофенкарбоновой кислоты
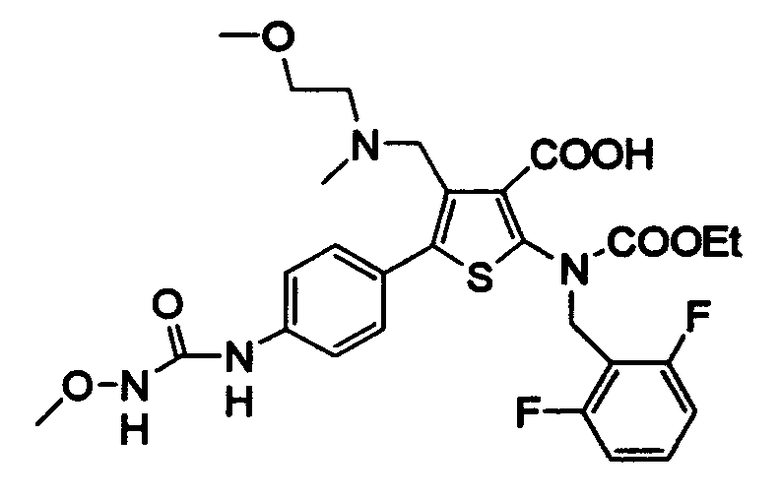
Водный раствор (2N)гидроксида натрия (18,9 мл) добавляют к раствору соединения, полученного в ссылочном примере 6 (4,81 г), в этаноле(114 мл), и смесь перемешивают при 60°C в течение 5 часов. Реакционную смесь нагревают до комнатной температуры и объединяют с 1N хлористоводородной кислотой (37,8 мл). Растворитель отгоняют. Остаток растворяют в этаноле и толуоле и растворитель отгоняют. Остаток объединяют с безводным этанолом (30 мл) и отфильтровывают неорганические продукты. Фильтрат упаривают досуха. Полученный остаток измельчают в безводном эфире, выделяют фильтрованием, сушат и получают указанное в заголовке соединение (4,43 г).
1H-ЯМР (CDCl3) δ: 1,17 (3H, уш.с), 2,45 (3H, с), 2,81 (2H, уш.с), 3,28 (3H, с), 3,55 (2H, т, J=4,8 Гц), 3,82 (3H, с), 3,92 (2H, с), 4,10-4,35 (2H, м), 5,06 (2H, с), 6,82 (2H, т, J=7,8 Гц), 7,16 (2H, д, J=8,4 Гц), 7,22-7,35 (1H, м), 7,60 (2H, д, J=8,4 Гц), 8,00-8,50 (2H, уш.).
ИК (KBr): 1713, 1605, 1528, 1472, 1408 см-1.
Ссылочный пример 8
Получение 4-(1-гидрокси-1-метилэтил)анилина (1) и 4-(1-метокси-1-метилэтил)анилина (2)
К раствору 2-метил-2-(4-нитрофенил)-2-пропанола (2,0 г) в метаноле (55 мл) добавляют 5% палладий на угле (0,3 г) и смесь перемешивают в атмосфере водорода в течение 4 часов. Катализатор отфильтровывают и фильтрат упаривают досуха. Полученный остаток очищают хроматографией на колонке с аминопропилсиликагелем (Fuji Silysia Chemical) (120 г; элюент гексан/этилацетат 9/1-1/4) и получают 4-(1-гидрокси-1-метилэтил)анилин (1) (1,0 г) и 4-(1-метокси-1-метилэтил)анилин (2) (0,35 г).
4-(1-гидрокси-1-метилэтил)анилин (1)
1H ЯМР (CDCl3) δ: 1,45 (1H, с), 1,55 (6H, с), 3,64 (2H, уш.с.), 6,66 (2H, д, J=8,8 Гц), 7,28 (2H, д, J=8,8 Гц).
ИК (KBr): 3335, 2975, 1613, 1516, 1256 см-1.
4-(1-метокси-1-метилэтил)анилин (2)
1H ЯМР (CDCl3) δ: 1,49 (6H, с), 3,03 (3H, с), 3,64 (2H, уш.с), 6,67 (2H, д, J=8,7 Гц), 7,20 (2H, д, J=8,7 Гц).
ИК (KBr): 2978, 1630, 1613, 1518, 1358, 1264 см-1.
Ссылочный пример 9
Получение 3-метокси-6-метил-2-нитропиридина
Карбонат калия (4,15 г) и метилиодид (2,80 мл) добавляют к раствору 6-метил-2-нитро-3-гидроксипиридина (4,63 г) в ДМФА (120 мл) и смесь перемешивают при комнатной температуре в течение 14 часов. Реакционную смесь распределяют между этилацетатом и водой. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия. Растворитель отгоняют при пониженном давлении, остаток перекристаллизовывают из смеси этилацетат/гексан и получают указанное в заголовке соединение (3,94 г) в виде игольчатых кристаллов.
1H ЯМР (CDCl3) δ: 2,54 (3H, с), 3,95 (3H, с), 7,37 (1H, д, J=8,8 Гц), 7,44 (1H, д, J=8,8 Гц).
ИК(KBr): 1541, 1489, 1381, 1308, 1289 см-1.
Ссылочный пример 10
Получение 2-амино-3-метокси-6-метилпиридина
К раствору 3-метокси-6-метил-2-нитропиридина (3,85 г) в этаноле (91,6 мл) добавляют 10% палладий на угле (50% влажность, 0,96 г) и смесь перемешивают в атмосфере водорода в течение 2 часов. Катализатор отфильтровывают и фильтрат упаривают досуха. Остаток перекристаллизовывают из смеси этилацетат/гексан и получают указанное в заголовке соединение (2,89 г).
1H ЯМР (CDCl3) δ: 2,32 (3H, с), 3,81 (3H, с), 4,61 (2H, с), 6,44 (1H, д, J=8,4 Гц), 6,81 (1H, д, J=8,4 Гц).
ИК (KBr): 1624, 1576, 1480, 1439, 1258 см-1.
Ссылочный пример 11
Получение 2-амино-3-гидрокси-6-метилпиридина
По реакции, аналогично описанной в ссылочном примере 10, используя 6-метил-2-нитро-3-гидроксипиридин (4,63 г), получают указанное в заголовке соединение (2,81 г) в виде кристаллического порошка.
1H ЯМР (CDCl3) δ: 2,14 (3H, с), 5,29 (2H, с), 6,20 (1H, д, J=7,5 Гц), 6,70 (1H, д, J=7,5 Гц), 9,09 (1H, с).
Ссылочный пример 12
Получение 3-метокси-2-нитропиридина
По реакции, аналогично описанной в ссылочном примере 9, используя 2-нитро-3-гидроксипиридин (7,0 г), карбонат калия (6,91 г) и метилиодид (4,67 мл), получают указанное в заголовке соединение (7,5 г) в виде кристаллического порошка.
1H ЯМР (CDCl3) δ: 3,99 (3H, с), 7,54-7,56 (2H, м), 8,09-8,12 (1H, м).
ИК (KBr): 1601, 1537, 1530, 1422, 1364, 1275 см-1.
Ссылочный пример 13
Получение 2-амино-3-метоксипиридина
По реакции, аналогично описанной в ссылочном примере 10, используя 3-метокси-2-нитропиридин (7,5 г), получают указанное в заголовке соединение (5,42 г) в виде кристаллического порошка.
1H ЯМР (CDCl3) δ: 3,84 (3H, с), 4,65 (2H, уш.с.), 6,62 (1H, д, J=5,0 Гц, 7,6 Гц), 6,90 (1H, дд, J=1,4 Гц, 7,6 Гц), 7,66 (1H, дд, J=1,4 Гц, 5,0 Гц).
ИК (KBr): 3443, 3142, 1634, 1601, 1570, 1483, 1460, 1441 см-1.
Пример 1
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
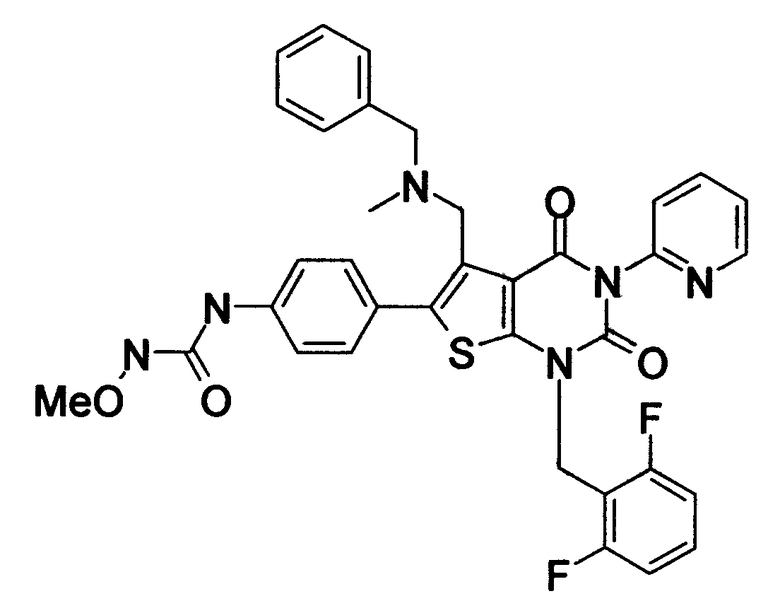
Этилдиизопропиламид (1,05 мл, 6,02 ммоль) и диэтилцианофосфат (0,86 мл, 5,64 ммоль) добавляют к раствору 4-(N-бензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоновой кислоты (2,40 г, 3,76 ммоль) и 2-аминопиридина (1,06 г, 11,28 ммоль) в ДМФА (20 мл) и смесь перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь объединяют с раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат) и получают амид. Полученный амид растворяют в метаноле (40 мл) и добавляют метоксид натрия (2,03 мг, 37,6 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 5 часов, концентрируют, нейтрализуют 1N хлористоводородной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на NH-силикагеле (Fuji Silysia Chemical) (элюент: этилацетат) и получают указанное в заголовке соединение (1,59 г, 63%) в виде светло-желтого аморфного вещества.
1H-ЯМР (CDCl3) δ: 2,05 (3H, с), 3,56 (2H, с), 3,82 (3H, с), 3,89 (2H, с), 5,34 (2H, уш.с), 6,91 (2H, т, J=8,0 Гц), 7,1-7,45 (9H, м), 7,56 (2H, д, J=8,8 Гц), 7,65 (1H, с), 7,75 (2H, д, J=8,8 Гц), 7,91 (1Н, дт, J=2,0, 7,7 Гц), 8,7-8,75 (1H, м).
Элементный анализ для C35H30F2N6O4S2:
Вычислено С, 62,86; H, 4,52; N, 12,57.
Найдено: С, 62,72; H, 4,31; N, 12,40.
Т.пл. 179-182°C.
Ссылочный пример 14
Получение N-(4-(1-(2,6-дифторбензил)-5-((метиламино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
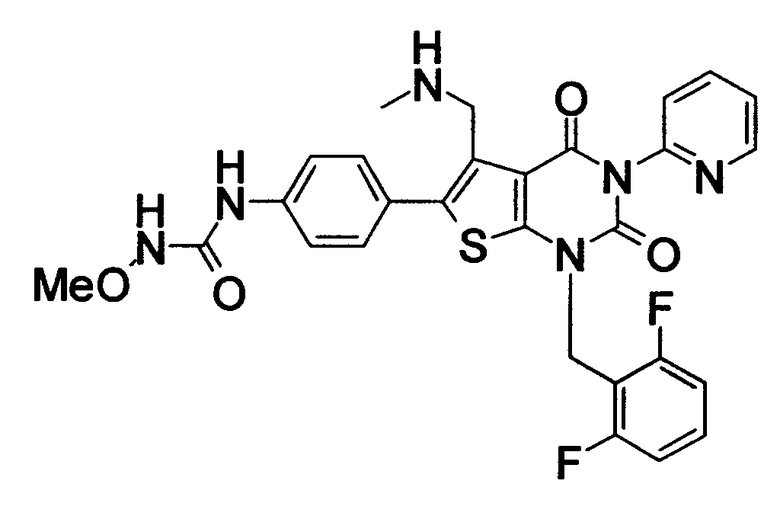
К раствору соединения, полученного в примере 1 (1,59 г, 2,38 ммоль), в этаноле (40 мл) добавляют 1N хлористоводородную кислоту (7 мл) и 10% палладий на угле (50% влажность, 0,63 г) и смесь энергично перемешивают в атмосфере водорода в течение 20 часов. Катализатор удаляют и фильтрат нейтрализуют 1N раствором гидроксида натрия. Растворитель отгоняют. Остаток распределяют между этилацетатом и водой, органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель отгоняют, полученный порошок промывают диэтиловым эфиром и получают указанное в заголовке соединение (980 мг, 71%) в виде желтого порошка.
1H-ЯМР (CDCl3) δ: 2,34 (3H, с), 3,78 (2H, с), 3,82 (2H, с), 5,38 (2H, уш.с), 6,92 (2H, т, J=8,2 Гц), 7,2-7,8 (9H, м), 7,92 (1H, дт, J=1,8 Гц, 7,6 Гц), 8,72 (1H, д, J=4,8 Гц).
Пример 2
Получение N-{2-[{[1-(2,6-дифторбензил)-6-(4-{[(метоксиамино)карбонил]амино}фенил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил]метил}(метил)амино]этил}-N-метилсульфонамида
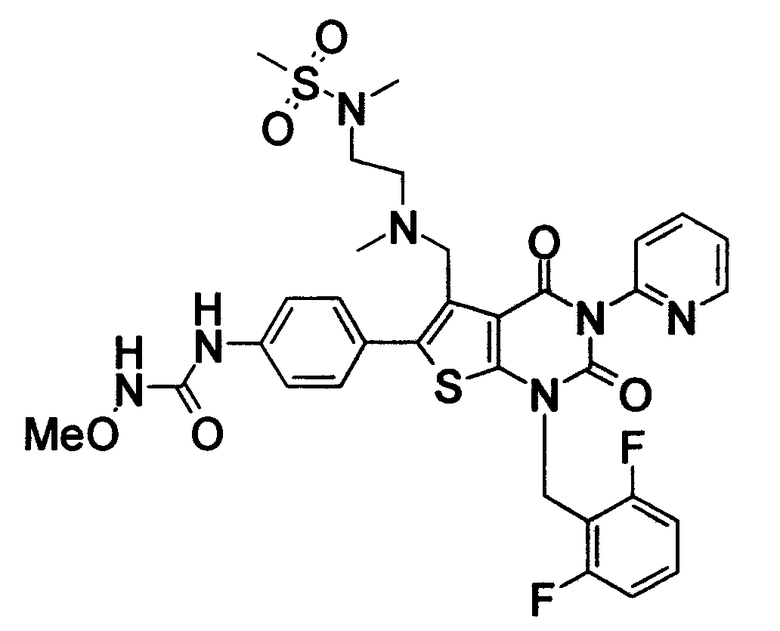
2-(Метиламино)этанол (0,14 г, 1,903 ммоль) растворяют в ТГФ (10 мл) и добавляют триэтиламин (0,58 мл, 4,15 ммоль) и метансульфонилхлорид (0,27 мл, 3,46 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь объединяют с водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Водный слой высаливают и экстрагируют этилацетатом. Объединенный органический слой сушат над сульфатом магния, упаривают при пониженном давлении и получают мезилат. Раствор полученного мезилата, соединение, полученное в ссылочном примере 14 (200 мг, 0,346 ммоль), N,N-диизопропилэтиламина (0,12 мл, 0,692 ммоль) и иодида калия (230 мг, 1,38 ммоль) в ДМФА (8 мл) перемешивают при 50-60°C в течение 16 часов. Реакционную смесь объединяют с водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат/метанол, 80/1) и перекристаллизовывают из смеси дихлорметан/метанол/диэтиловый эфир и получают указанное в заголовке соединение (115 мг, 47%) в виде светло-желтых кристаллов.
1H-ЯМР (CDCl3) δ: 2,11 (3H, с), 2,45-2,6 (2H, м), 2,70 (3H, с), 2,75 (3H, с), 3,1-3,25 (2H, м), 3,80 (2H, с), 3,83 (3H, с), 5,36 (2H, уш.с), 6,93 (2H, т, J=8,2 Гц), 7,14 (1H, с), 7,2-7,6 (7H, м), 7,65 (1Н, с), 7,85-7,95 (1Н, м), 8,65-8,75 (1Н, м).
ИК(KBr): 1715, 1669, 1530, 1462, 1333, 1146, 1032, 781 см-1.
Элементный анализ для C32H33F2N7O6S·0,3H2O:
Вычислено С, 53,44; H, 4,71; N, 13,63.
Найдено: C, 53,76; H, 4,75; N, 13,21.
Т.пл. 185-187°C.
Пример 3
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-(2-оксо-1-пирролидинил)этил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина
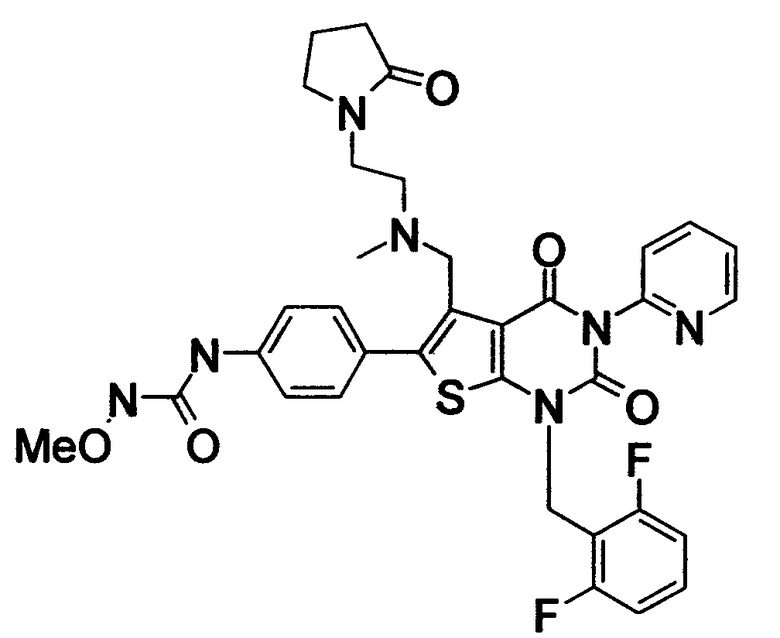
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 14 (200 мг, 0,346 ммоль), и 1-(2-гидроксиэтил)-2-пирролидон (0,25 г, 1,903 ммоль), получают указанное в заголовке соединение (97 мг, 41%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,7-1,85 (2H, м), 2,17 (3H, с), 2,15-2,3 (2H, м), 2,5-2,6 (2H, м), 3,15 (2H, т, J=7,0 Гц), 3,2-3,4 (2H, м), 3,76 (2H, с), 3,83 (3H, с), 5,36 (2H, уш.с), 6,93 (2H, т, J=8,4 Гц), 7,16 (1Н, с), 7,2-7,7 (8H, м), 7,85-7,95 (1H, м), 8,65-8,75 (1H, м).
ИК (KBr): 1715, 1672, 1526, 1464, 1329, 1032, 783 см-1. Элементный анализ для C34H33F2N7O5S·0,5H2O:
Вычислено С, 58,44; H, 4,90; N, 14,03.
Найдено: C, 58,75; H, 4,98; N, 13,71.
Т.пл. 199-201°C.
Пример 4
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-пиридинилметил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
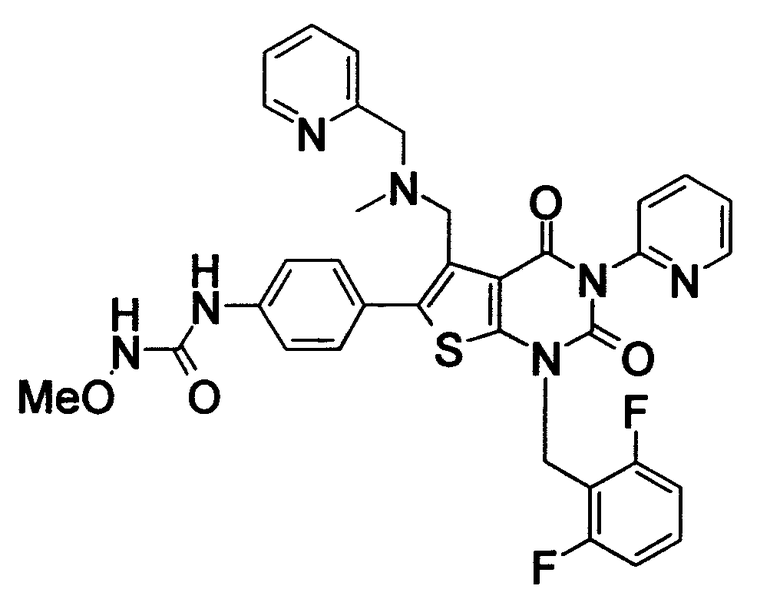
Соединение, полученное в ссылочном примере 14 (150 мг, 0,259 ммоль), растворяют в ДМФА (4 мл) и добавляют N,N-диизопропилэтиламин (0,20 мл, 1,14 ммоль) и гидрохлорид 2-хлорметилпиридина (85 мг, 0,518 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа, объединяют с водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат/метанол, 40/1), перекристаллизовывают из смеси дихлорметан/метанол/диэтиловый эфир и получают указанное в заголовке соединение(70 мг, 40%) в виде светло-желтых кристаллов.
1H-ЯМР (CDCl3) δ: 2,10 (3H, с), 3,70 (2H, с), 3,82 (3H, с), 3,96 (3H, с), 5,34 (2H, уш.с), 6,85-7,7 (14H, м), 7,85-7,95 (1Н, м), 8,4-8,5 (1H, м), 8,65-8,75 (1H, м).
ИК(KBr): 1717, 1672, 1526, 1464, 1331, 1236, 1036, 772 см-1.
Элементный анализ для C34H29F2N7O4S·0,3H2O:
Вычислено С, 62,36; H, 4,58; N, 12,47.
Найдено: C; 62,22; H, 4,32; N, 12,57.
Т.пл. 165-167°C.
Пример 5
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(2-гидроксиэтил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
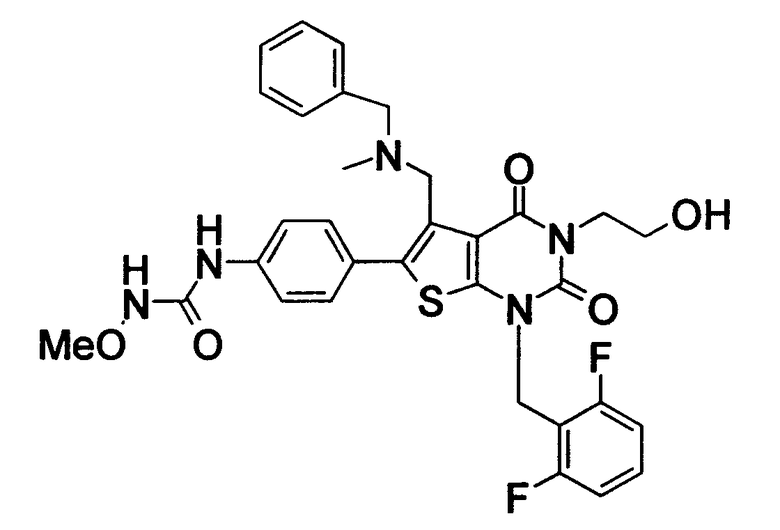
Этилдиизопропиламин (0,56 мл, 3,2 ммоль) и диэтилцианофосфат (0,46 мл, 3 ммоль) добавляют к раствору 4-(N-бензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоновой кислоты (1,28 г, 2 ммоль) и 2-аминоэтанола (183 мг, 3 ммоль) в ДМФА (12 мл) и смесь перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь объединяют с водным раствором гидрокарбоната натрия, экстрагируют этилацетатом, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на NH-силикагеле (Fuji Silysia Chemical) (элюент: этилацетат/метанол, 80/1) и получают амид. Полученный амид растворяют в метаноле (20 мл) и добавляют метоксид натрия (589 мг, 10,9 ммоль). Реакционную смесь перемешивают при 50-60°C в течение 3 часов, упаривают при пониженном давлении, нейтрализуют 1N хлористоводородной кислотой и экстрагируют этилацетатом. Экстракт промывают насыщенным раствором соли, сушат над сульфатом магния упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат), перекристаллизовывают из смеси дихлорметан/метанол/диэтиловый эфир и получают указанное в заголовке соединение (511 мг, 74%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,04 (3H, с), 2,5-2,65 (1Н, м), 3,58 (2H, с), 3,83 (3H, с), 3,91 (2H, с), 3,9-4,0 (2H, м), 4,37 (2H, т, J=5,0 Гц), 5,34 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,1-7,4 (7H, м), 7,54 (2H, д, J=8,6 Гц), 7,66 (2H, д, J=8,6 Гц), 7,6-7,7(1Н, м).
ИК (KBr): 1711, 1649, 1535, 1470, 1323, 1236, 1028, 785 см-1.
Элементный анализ для C32H31F2N5O5S·0,5H2O:
Вычислено С, 59,62; H, 5,00; N, 10,86.
Найдено: C, 59,75; H, 4,81; N, 10,93.
Пример 6
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-2,4-диоксо-3-(2-(2H-1,2,3-триазол-2-ил)этил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (1)
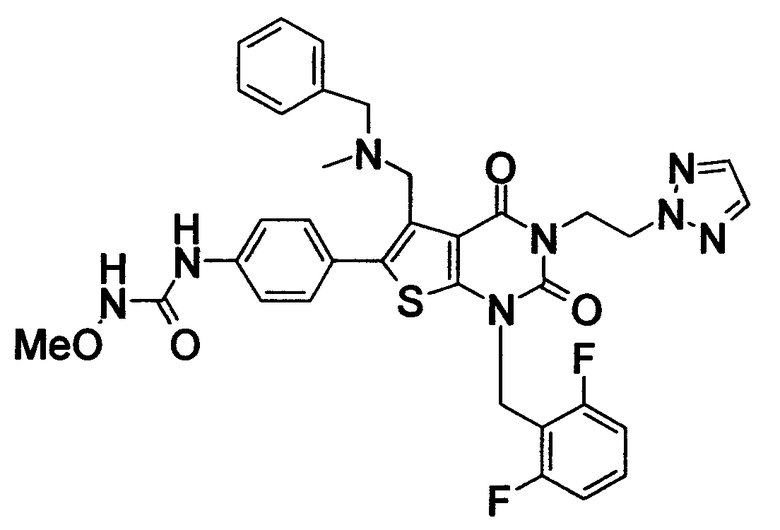
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-2,4-диоксо-3-(2-(1H-1,2,3-триазол-1-ил)этил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (2)
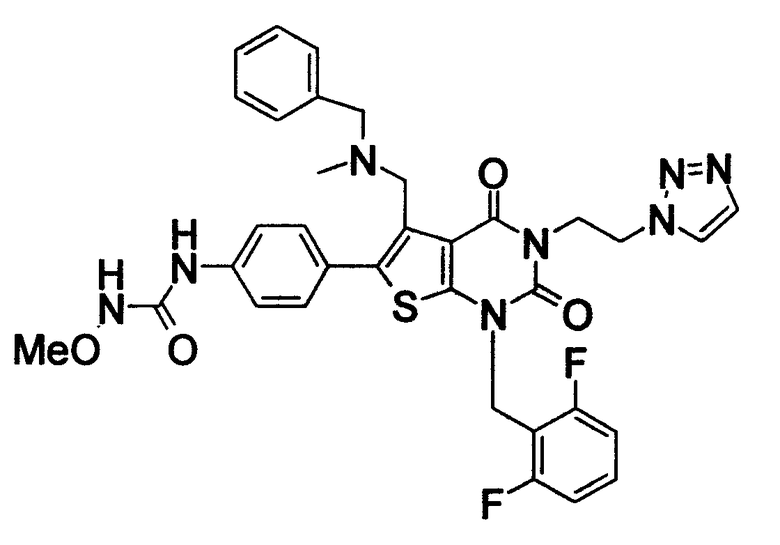
По реакции, аналогично описанной в примере 2, используя соединение, полученное в примере 5 (450 мг, 0,708 ммоль), получают мезилат. Раствор полученного мезилата, 1,2,3-триазола (148 мг, 2,12 ммоль) и карбоната калия (294 мг, 2,12 ммоль) в ДМФА (8 мл) перемешивают при комнатной температуре в течение 18 часов и при 50-60°C в течение 3 часов. Реакционную смесь объединяют с водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат) и получают указанное в заголовке соединение в 2-ил форме (243 мг, 50%) в виде белого аморфного вещества. С другой стороны, остаток перекристаллизовывают из смеси дихлорметан/метанол/диэтиловый эфир и получают указанное в заголовке соединение в 1-ил форме(177 мг, 36%) в виде бесцветных кристаллов.
2-ил форма(1)
1H-ЯМР (CDCl3) δ: 2,04 (3H, с), 3,51 (2H, с), 3,82 (3H, с), 3,86 (2H, с), 4,57 (2H, т, J=6,2 Гц), 4,81 (2H, т, J=6,2 Гц), 5,28 (2H, с), 6,91 (2H, т, J=8,4 Гц), 7,15-7,35 (6H, м), 7,46 (2H, с), 7,53 (2H, д, J=8,6 Гц), 7,62 (1H, с), 7,70 (2H, т, J=8,6 Гц), 7,75 (1Н, с).
ИК (KBr): 1705, 1663, 1530, 1472, 1323, 1034, 786 см-1.
1-ил форма(2)
1H-ЯМР (CDCl3) δ: 2,02 (3H, с), 3,52 (2H, с), 3,82 (3H, с), 3,85 (2H, с), 4,58 (2H, т, J=6,4 Гц), 4,78 (2H, т, J=6,4 Гц), 5,30 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,12 (1H, с), 7,15-7,4(7H, м), 7,54 (2H, д, J=8,8 Гц), 7,55-7,6J (2H, м), 7,67 (2H, д, J=8,8 Гц).
ИК (KBr): 1709, 1659, 1526, 1472, 1319, 1028, 799 см-1.
Элементный анализ для C34H32F2N8O4S·0,8H2O:
Вычислено С, 58,24; H, 4,83; N, 15,98.
Найдено: C, 58,48; H, 4,89; N, 15,65.
Пример 7
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-2,4-диоксо-3-(2-(2H-тетразол-2-ил)этил)-1,2,3,4-тетразолотиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (1)
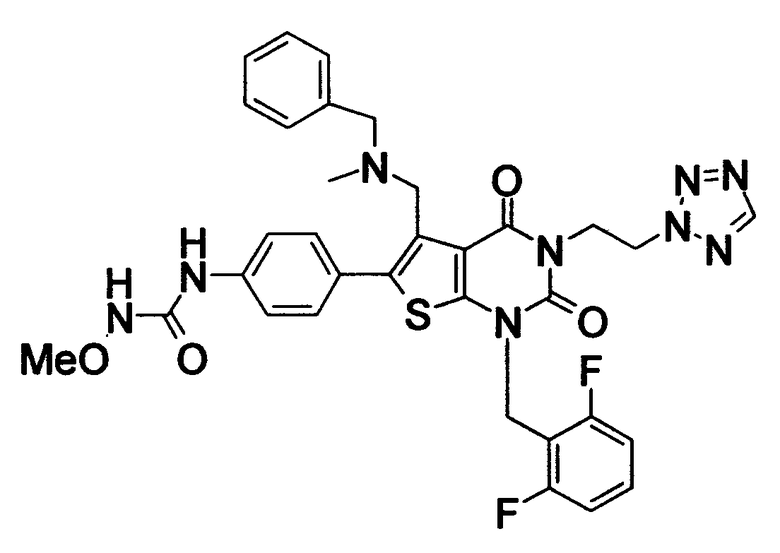
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-2,4-диоксо-3-(2-(1H-тетразол-1-ил)этил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (2)
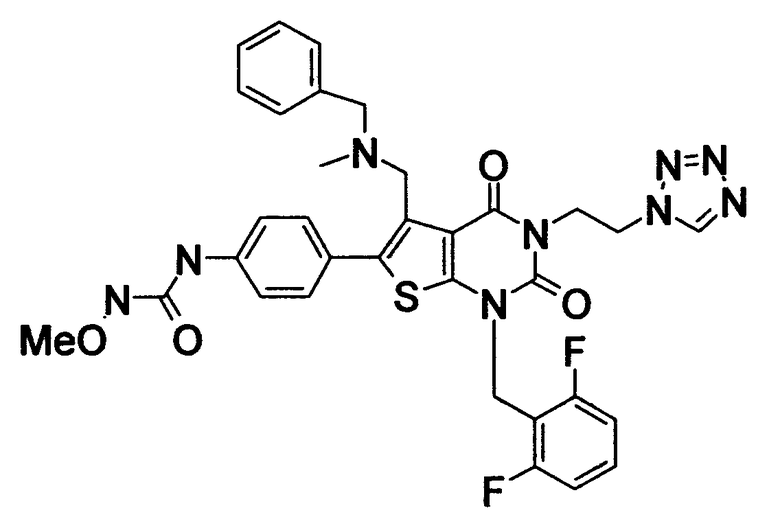
По реакции, аналогично описанной в примере 6, используя соединение, полученное в ссылочном примере 5 (636 мг, 1 ммоль), и тетразол (210 мг, 3 ммоль), получают указанное в заголовке соединение в 2-ил форме (234 мг, 34%) в виде белого аморфного соединения. С другой стороны, остаток растирают в простом диэтиловом эфире и получают указанное в заголовке соединение в 1-ил форме (34 мг, 5%) в виде светло-желтых кристаллов.
2-ил форма(1)
1H-ЯМР (CDCl3) δ: 2,02 (3H, с), 3,51 (2H, с), 3,83 (5H, с), 4,6-4,7 (2H, м), 5,0-5,1 (2H, м), 5,28 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,12 (1Н, с), 7,2-7,75 (l1Н, м), 8,38 (1H, с).
ИК (KBr): 1705, 1663, 1530, 1472, 1323, 1236, 1032, 777 см-1.
1-ил форма(2)
1H-ЯМР (CDCl3) δ: 2,01 (3H, с), 3,51 (2H, с), 3,83 (3H, с), 3,8-4,0 (2H, м), 4,6-4,7 (2H, м), 4,8-4,9 (2H, м), 5,30 (2H, с), 6,65-6,75 (1Н, м), 6,85-7,0 (2H, м), 7,1-7,7 (l1Н, м), 8,68 (1Н, с).
Пример 8
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-гидроксиэтил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
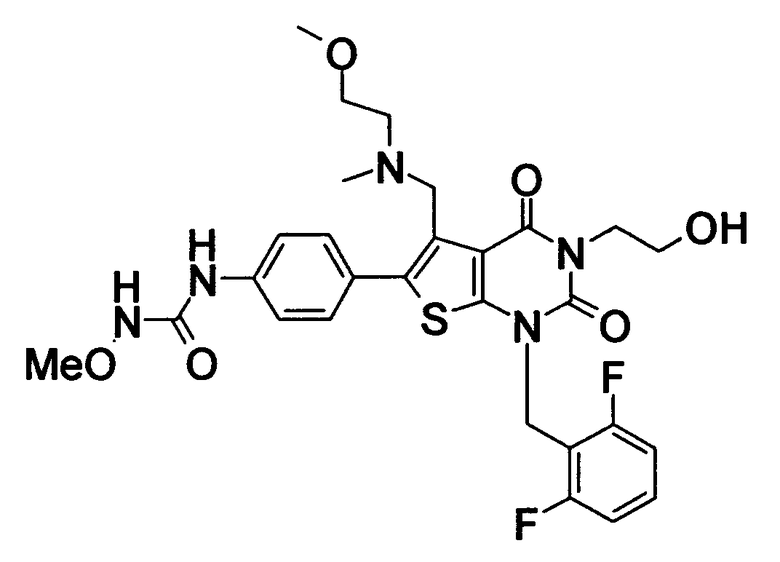
По реакции, аналогично описанной в примере 5, используя 4-(N-бензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоновую кислоту (1,21 г, 2 ммоль) и 2-аминоэтанол (0,18 мл, 3 ммоль), получают указанное в заголовке соединение (302 мг, 25%) в виде светло-желтого аморфного соединения.
1H-ЯМР (CDCl3) δ: 2,11 (3H, с), 2,65 (2H, т, J=5,8 Гц), 3,30 (3H, с), 3,46 (2H, т, J=5,8 Гц), 3,82 (5H, с), 3,9-4,0 (2H, м), 4,35 (2H, т, J=5,2 Гц), 5,34 (2H, с), 6,92 (2H, т, J=8,0 Гц), 7,14 (1Н, с), 7,2-7,35 (1H, м), 7,5-7,65 (5H, м).
Пример 9
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-(2H-тетразол-2-ил)этил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (1)
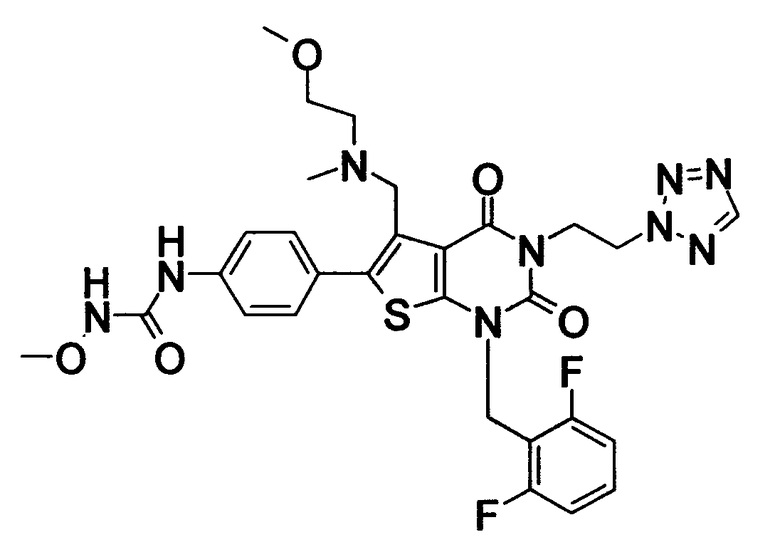
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-(1H-тетразол-1-ил)этил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (2)
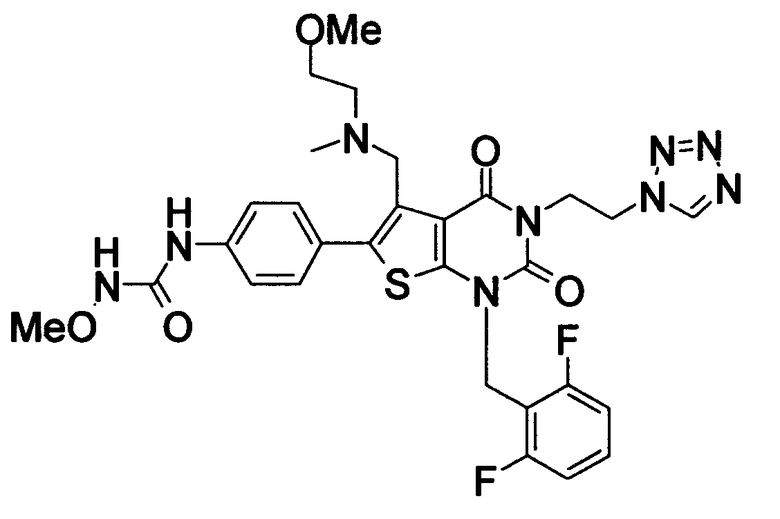
По реакции, аналогично описанной в примере 6, используя соединение, полученное в примере 8 (250 мг, 0,414 ммоль), и тетразол (145 мг, 2,07 ммоль), получают указанное в заголовке соединение в 2-ил форме (66 мг, 24%) и 1-ил форме (27 мг, 10%) в виде белых аморфных веществ.
2-ил форма (1)
1H-ЯМР (CDCl3) δ: 2,10 (3H, уш.с), 2,55-2,65 (2H, м), 3,31 (3H, с), 3,4-3,5 (2H, м), 3,76 (2H, с), 3,82 (3H, с), 4,62 (2H, т, J=5,8 Гц), 5,02 (2H, т, J=5,8 Гц), 5,27 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,13 (1Н, с), 7,25-7,4 (1H, м), 7,5-7,65 (5H, м), 8,43 (1Н, с).
1-ил форма (2)
1H-ЯМР (CDCl3) δ: 2,07 (3H, с), 2,55-2,65 (2H, м), 3,30 (3H, с), 3,4-3,5 (2H, м), 3,74 (2H, с), 3,82 (3H, с), 4,55-4,65 (2H, м), 4,8-4,9 (2H, м), 5,30 (2H, с), 6,93 (2H, т, J=7,8 Гц), 7,10 (1Н, с), 7,2-7,4 (1Н, м), 7,5-7,65 (5H, м), 8,69 (1H, с).
Пример 10
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-(2H-1,2,3-триазол-2-ил)этил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
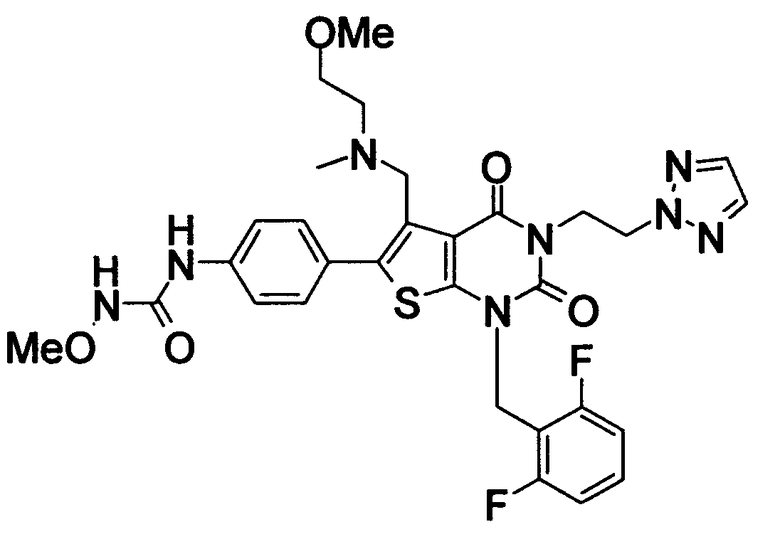
По реакции, аналогично описанной в ссылочном примере 14, используя соединение, полученное в примере 6 (1-ил формы) (200 мг, 0,291 ммоль), получают дебензилированное соединение (0,11 г, 63%) в виде бесцветного порошка. Из дебензилированного соединения (0,11 г, 0,184 ммоль) и 2-(хлорметил)метилового простого эфира (0,10 мл, 1,104 ммоль) по реакции, аналогичной описанной в примере 4, получают указанное в заголовке соединение (35 мг, 29%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,11 (3H, с), 2,62 (2H, т, J=5,8 Гц), 3,31 (3H, с), 3,44 (2H, т, J=5,8 Гц), 3,78 (2H, с), 3,82 (3H, с), 4,55 (2H, т, J=5,6 Гц), 4,79 (2H, т, J=5,6 Гц), 5,27 (2H, с), 6,91 (2H, т, J=8,2 Гц), 7,10 (1Н, с), 7,2-7,4 (2H, м), 7,51 (2H, с), 7,45-7,65 (4H, м).
Элементный анализ для C30H32F2N8O5S:
Вычислено С, 55,04; H, 4,93; N, 17,12.
Найдено: C, 55,02; H, 4,85; N, 16,83.
Ссылочный пример 15
Получение N-(4-(1-(2,6-дифторбензил)-5-((метиламино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
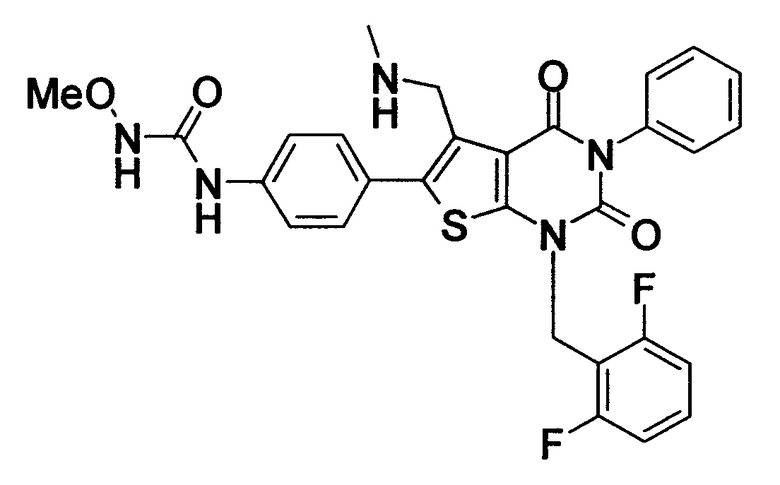
По реакции, аналогично описанной в ссылочном примере 14, используя 5-(N-бензил-N-метиламинометил)-1-(2,6-дифторбензил)-6-[4-(3-метоксиуреидо)фенил]-3-фенилтиено[2,3-d]пиримидин-2,4(1H,3H)-дион (6,68 г, 10 ммоль), получают указанное в заголовке соединение(5,52 г, 96%) в виде белого порошка.
1H ЯМР (CDCl3) δ: 2,35 (3H, с), 3,76 (2H, с), 3,82 (3H, с), 5,37 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,25-7,7 (12H, м).
Пример 11
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-(2H-1,2,3-триазол-2-ил)этил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (1)
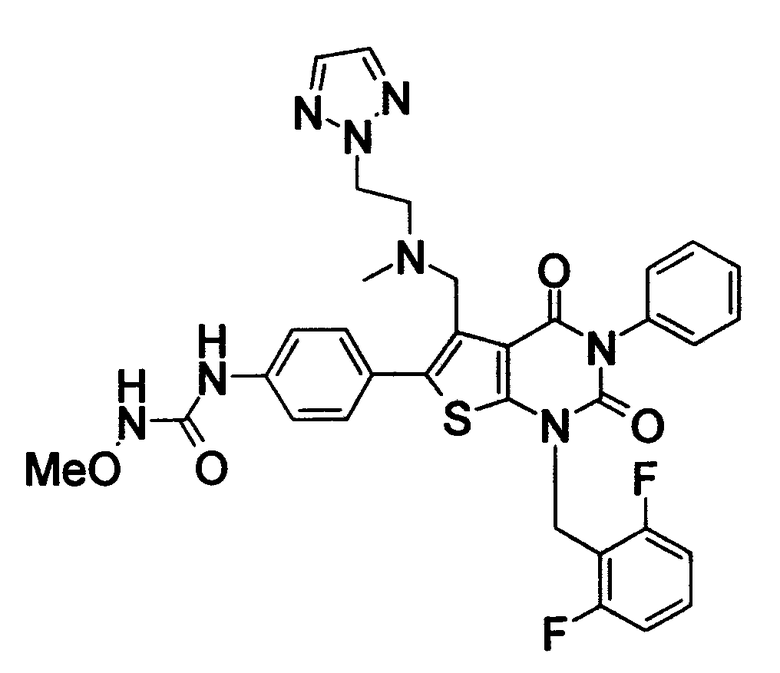
Получение N-(4-(1-(2,6-(дифторбензил)-5-((метил(2-(1H-1,2,3-триазол-1-ил)этил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (2)
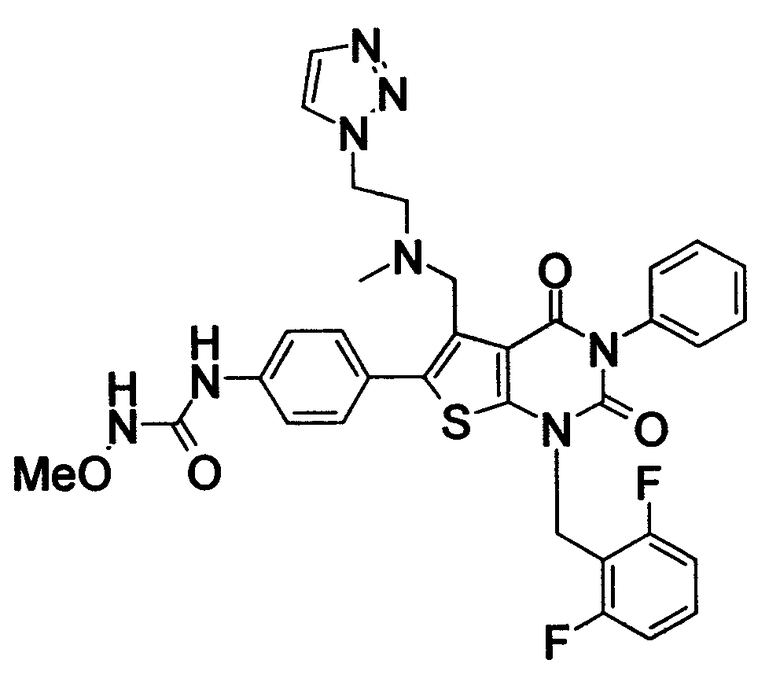
Карбонат калия (1,33 г, 10 ммоль) добавляют к раствору 1,2,3-триазола (0,46 г, 6,67 ммоль) и 1-бром-2-хлорэтана (0,83 мл, 10 ммоль) в ДМФА (5 мл) и смесь перемешивают при комнатной температуре в течение 1 часа и при 50-60°C в течение 3 часов. Реакционную смесь объединяют с насыщенным раствором соли и два раза экстрагируют этилацетатом. Объединенный органический слой сушат над сульфатом магния и упаривают, получая галогенид.
Соединение, полученное в ссылочном примере 15 (700 мг, 1,21 ммоль), растворяют в ДМФА (12 мл) и добавляют N,N-диизопропилэтиламин (1,16 мл, 6,67 ммоль) и полученный галогенид. Смесь перемешивают при 50-60°C в течение 16 часов, объединяют с водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на NH-силикагеле (элюент: этилацетат), перекристаллизовывают из смеси дихлорметан/метанол/диэтиловый эфир, получая указанное в заголовке соединение в 2-ил форме (140 мг, 17%) и 1-ил форме (332 мг, 41%) в виде бесцветных кристаллов.
2-ил форма(1)
1H-ЯМР (CDCl3) δ: 2,23 (3H, с), 3,00 (2H, т, J=6,3 Гц), 3,78 (2H, с), 3,82 (3H, с), 4,45 (2H, т, J=6,3 Гц), 5,37 (2H, с), 6,92 (2H, т, J=8,2 Гц), 6,85-6,95 (1H, м), 7,11 (1Н, с), 7,2-7,6 (12H, м).
ИК (KBr): 1715, 1671, 1530, 1470, 1331, 1236, 1032, 822, 735 см-1.
Элементный анализ для C33H30F2N8O4S·0,3H2O:
Вычислено С, 58,45; H, 4,55; N, 16,52.
Найдено: С, 58,75; H, 4,27; N, 16,20.
Т.пл. 166-168°C.
1-ил форма(2)
1H-ЯМР (CDCl3) δ: 2,14 (3H, с), 2,82 (2H, т, J=6,0 Гц), 3,80 (2H, с), 3,82 (3H, с), 4,39 (2H, т, J=6,0 Гц), 5,37 (2H, с), 6,92 (2H, т, J=8,2 Гц), 6,85-6,95 (1H, м), 7,14 (1Н, с), 7,2-7,55 (11H, м), 7,63 (1Н, с).
ИК (KBr): 1719, 1672, 1526, 1470, 1236, 1231, 1028, 824, 733 см-1.
Элементный анализ для C33H30F2N8O4S·0,4H2O:
Вычислено С, 58,30; H, 4,57; N, 16,48.
Найдено: C, 58,53; H, 4,50; N, 16,29.
Т.пл. 194-196°C.
Пример 12
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-(2-пиридинил)этил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
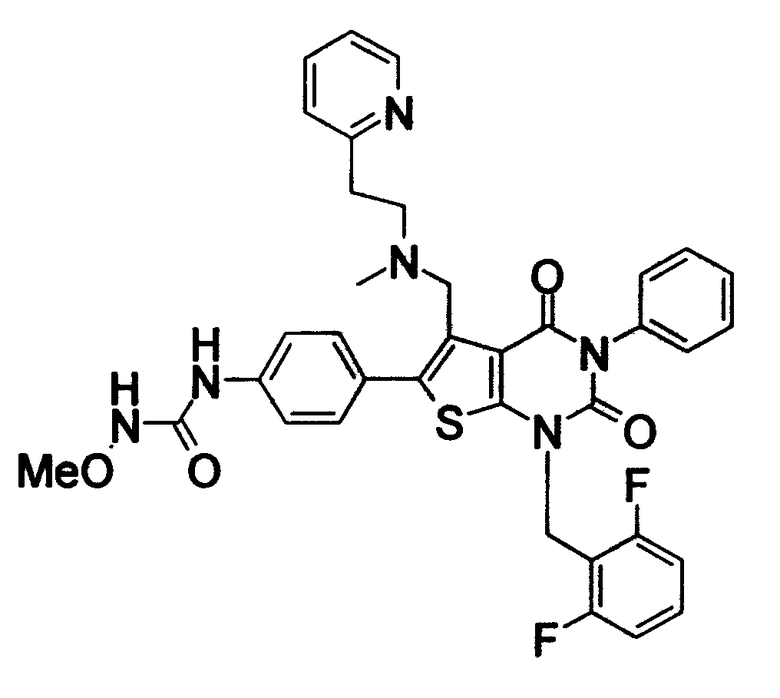
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 15 (350 мг, 0,606 ммоль), и 2-(2-гидроксиэтил)пиридин (0,45 г, 3,64 ммоль), получают указанное в заголовке соединение (233 мг, 56%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,20 (3H, с), 2,85 (4H, с), 3,82 (5H, с), 5,37 (2H, с), 6,93 (2H, т, J=8,2 Гц), 6,95-7,1 (2H, м), 7,14 (1Н, с), 7,2-7,55 (11Н, м), 7,60 (1H, с), 8,43 (1Н, д, J=4,0 Гц).
ИК (KBr): 1717, 1667, 1530, 1470, 1331, 1236, 1030, 735 см-1.
Элементный анализ для C36H32F2N6O4S:
Вычислено: С, 63,33; H, 4,72; N, 12,31.
Найдено: C, 63,17; H, 4,56; N, 12,31.
Т.пл. 159-160°C.
Пример 13
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-(4-пиридинил)этил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
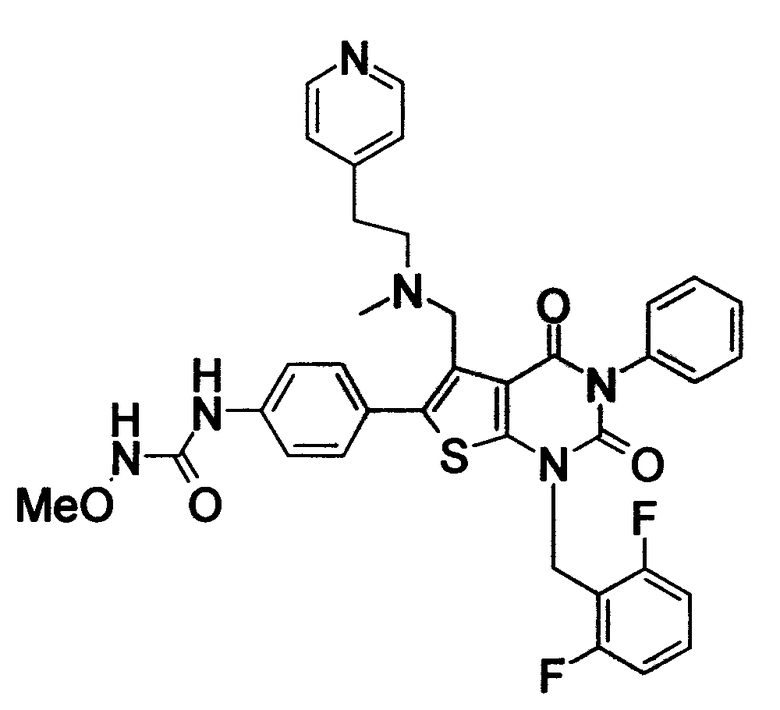
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 15 (350 мг, 0,606 ммоль), и гидрохлорид 4-(2-гидроксиэтил)пиридина (0,58 г, 3,64 ммоль), получают указанное в заголовке соединение (166 мг, 40%) в виде бесцветных кристаллов.
1H ЯМР (CDCl3) δ: 2,18 (3H, с), 2,68 (4H, с), 3,83 (5H, с), 5,37 (2H, с), 6,85-7,0 (5H, м), 7,16 (1H, с), 7,2-7,65 (10H, м), 8,35-8,4 (2H, м).
ИК (KBr): 1715, 1667, 1532, 1470, 735 см-1.
Элементный анализ для C36H32F2N6O4S·0,1H2O:
Вычислено С, 63,16; H, 4,74; N, 12,28.
Найдено: C, 62,91; H, 4,68; N, 12,26.
Т.пл. 194-196°C.
Пример 14
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-пиридинилметил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
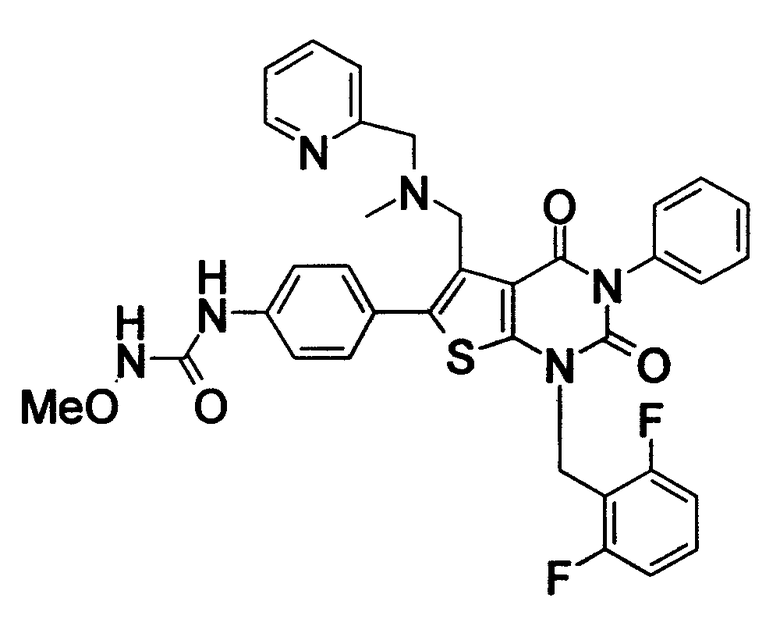
По реакции, аналогично описанной в примере 4, используя соединение, полученное в ссылочном примере 15 (350 мг, 0,606 ммоль), и гидрохлорид 2-хлорметилпиридина (149 мг, 0,908 ммоль), получают указанное в заголовке соединение (297 мг, 73%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,10 (3H, с), 3,71 (2H, с), 3,83 (3H, с), 3,99 (2H, с), 5,36 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,0-7,1 (1Н, м), 7,15 (1Н, с), 7,2-7,35 (4H, м), 7,4-7,65 (9H, м), 8,4-8,5 (1Н, м).
ИК (KBr): 1715, 1667, 1532, 1472, 735 см-1.
Элементный анализ для C35H30F2N6O4S·0,5H2O:
Вычислено С, 62,03; H, 4,61; N, 12,40.
Найдено: C, 62,13; H, 4,59; N, 12,47.
Т.пл. 181-182°C.
Ссылочный пример 16
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-2,4-диоксо-3-(4-фторфенил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
По реакции, аналогично описанной в примере 5, используя 4-(N-бензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоновую кислоту (2,87 г, 4,49 ммоль) и 4-фторанилин (0,64 мл, 6,735 ммоль), получают указанное в заголовке соединение (2,71 г, 88%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ: 2,05 (3H, с), 3,56 (2H, с), 3,83 (3H, с), 3,89 (2H, с), 5,36 (2H, с), 6,93 (2H, т, J=8,0 Гц), 7,1-7,35 (11H, м), 7,56 (2H, д, J=8,4 Гц), 7,63 (1H, с), 7,72 (2H, д, J=8,4 Гц).
Элементный анализ для C36H30F3N5O4S·0,5H2O:
Вычислено С, 62,24; H, 4,50; N, 10,08.
Найдено: C, 62,43; H, 4,21; N, 9,84.
Ссылочный пример 17
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-фторфенил)-5-((метиламино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
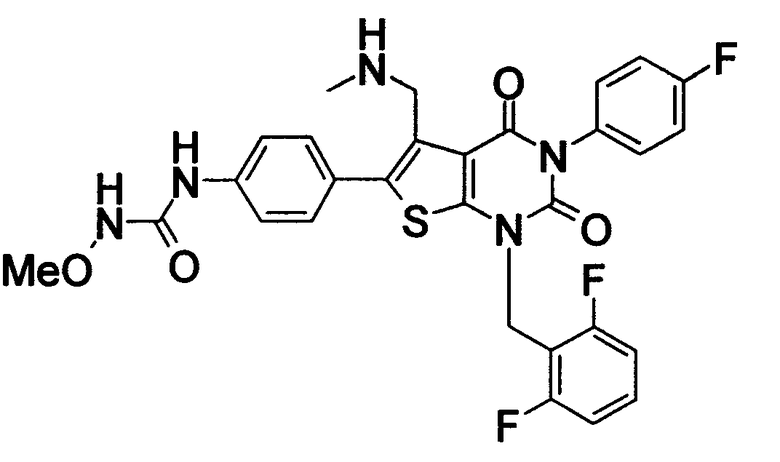
По реакции, аналогично описанной в ссылочном примере 14, используя соединение, полученное в ссылочном примере 16 (2,50 г, 3,65 ммоль), получают указанное в заголовке соединение (1,85 г, 85%) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 2,37 (3H, с), 3,76 (2H, с), 3,82 (3H, с), 5,37 (2H, с), 6,92 (2H, т, J=8,2 Гц), 6,85-7,0 (1H, уш.с), 7,15-7,35 (6H, м), 7,42 (2H, д, J=8,4 Гц), 7,57 (2H, д, J=8,4 Гц), 7,63 (1Н, с).
Пример 15
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-фторфенил)-5-((метил(2-пиридинилметил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
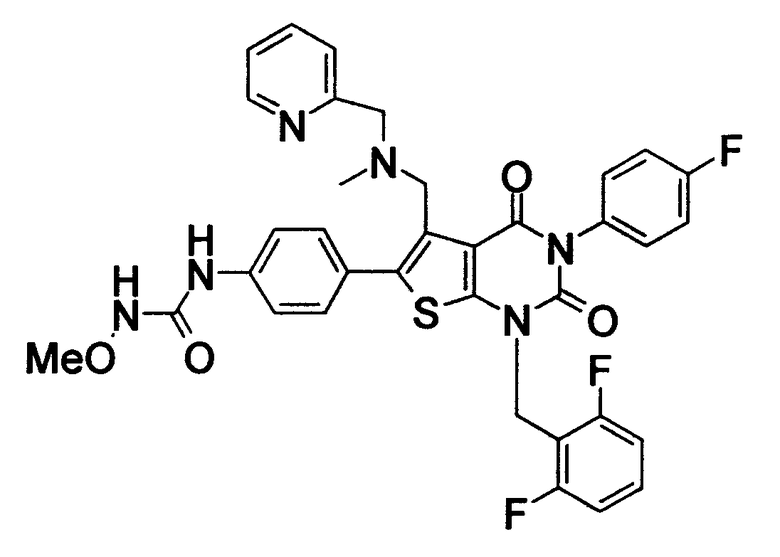
По реакции, аналогично описанной в примере 4, используя соединение, полученное в ссылочном примере 17 (150 мг, 0,25 ммоль), и гидрохлорид 2-хлорметилпиридина (85 мг, 0,52 ммоль), получают указанное в заголовке соединение (105 мг, 61%) в виде бесцветных кристаллов.
1H ЯМР (CDCl3) δ: 2,10 (3H, с), 3,71 (2H, с), 3,83 (3H, с), 3,97 (2H, с), 5,35 (2H, с), 6,93 (2H, т, J=8,2 Гц), 7,0-7,7 (14H, м), 8,4-8,5 (1H, м).
ИК (KBr): 1723, 1665, 1532, 1510, 1474, 1236, 1032, 761 см-1.
Элементный анализ для C35H29F3N6O4S·0,7H2O:
Вычислено С, 60,11; H, 4,38; N, 12,02.
Найдено: C, 59,76; H, 4,03; N, 11,71.
Т.пл. 183-185°C.
Пример 16
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-фторфенил)-5-((метил(2-(2-пиридинил)этил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
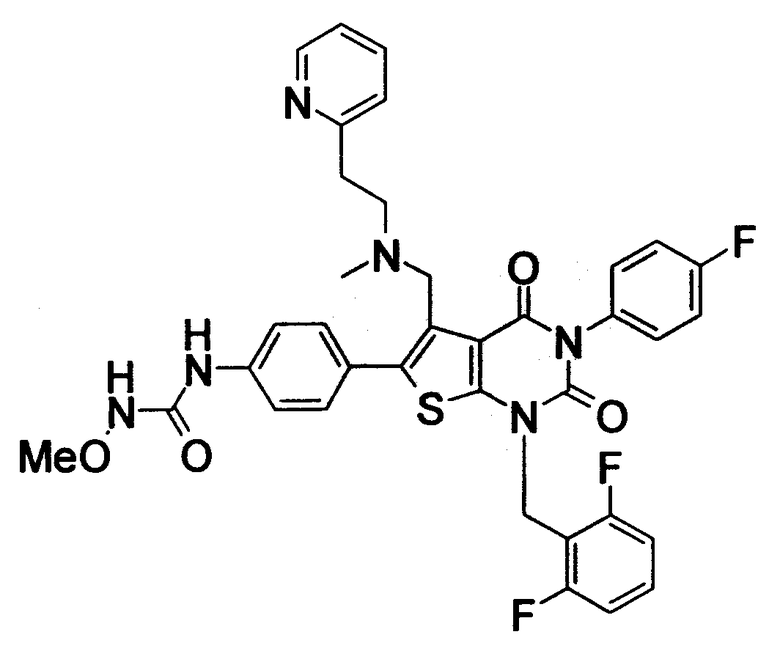
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 17 (150 мг, 0,25 ммоль), и 2-(2-гидроксиэтил)пиридин (0,19 г, 1,512 ммоль), получают указанное в заголовке соединение(100 мг, 57%) в виде бесцветных кристаллов.
1H ЯМР (CDCl3) δ: 2,19 (3H, с), 2,85 (4H, с), 3,82 (5H, с), 5,36 (2H, с), 6,9-7,55 (13H, м), 7,60 (1H, с), 8,4-8,45 (1H, м).
ИК (KBr): 1723, 1665, 1534, 1510, 1474, 1464, 1238, 1034, 762 см-1.
Элементный анализ для C36H31F3N6О4S·0,5H2O:
Вычислено С, 60,92; H, 4,54; N, 11,84.
Найдено: C, 61,12; H, 4,63; N, 11,78.
Т.пл. 185-187°C.
Пример 17
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-(2-пиридинил)этил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
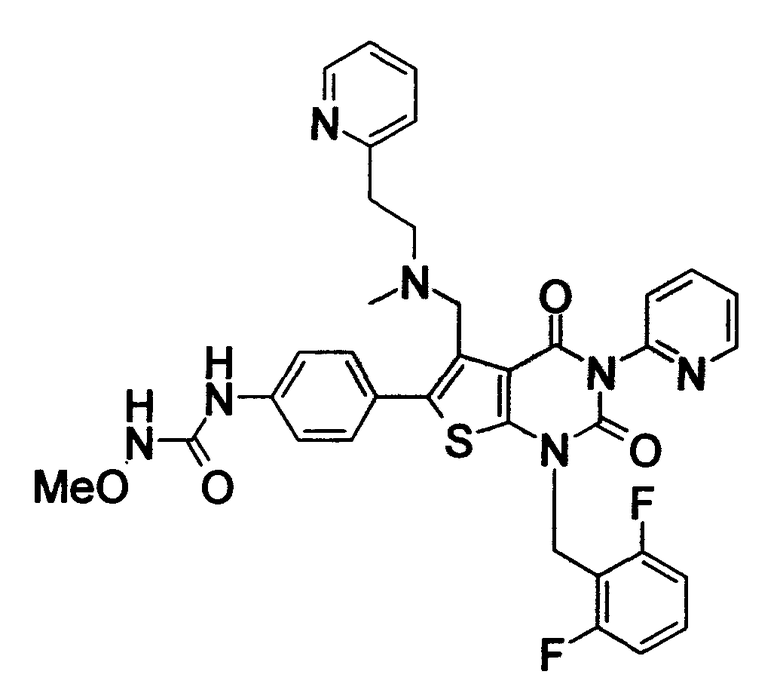
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 14 (150 мг, 0,259 ммоль) и 2-(2-гидроксиэтил)пиридин (0,18 г, 1,425 ммоль), получают указанное в заголовке соединение(83 мг, 47%) в виде светло-желтых кристаллов.
1H ЯМР (CDCl3) δ: 2,21 (3H, с), 2,8-2,9 (4H, м), 3,82 (5H, с), 5,34 (2H, уш.с), 6,85-7,75 (13H, м), 7,60 (1H, с), 7,85-7,95 (1H, м), 8,4-8,5 (1H, м), 8,65-8,75 (1H, м).
ИК (KBr): 1715, 1671, 1530, 1458, 1329, 1032, 781 см-1. Т.пл. 194-196 °C.
Пример 18
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(3-пиридинилметил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
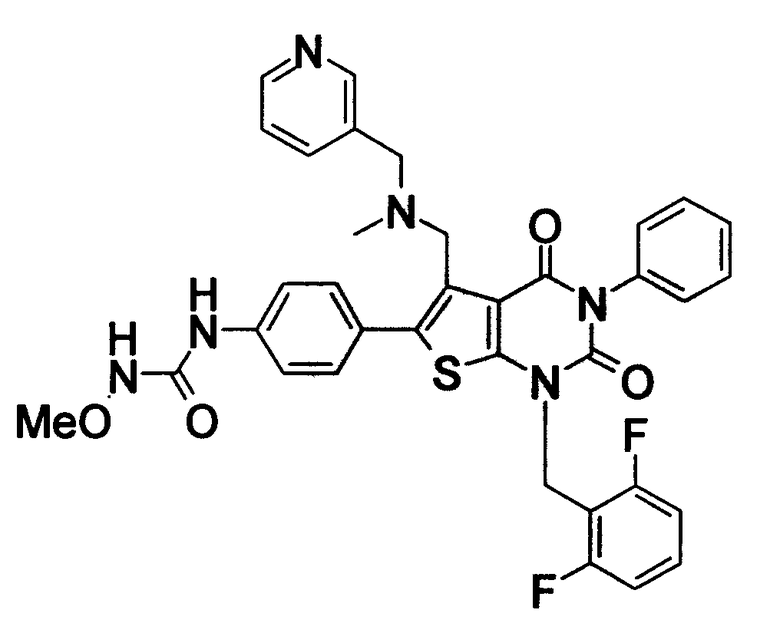
По реакции, аналогично описанной в примере 4, используя соединение, полученное в ссылочном примере 15 (150 мг, 0,26 ммоль), и гидрохлорид 3-хлорметилпиридина (85 мг, 0,52 ммоль), получают указанное в заголовке соединение(117 мг, 67%) в виде бесцветных кристаллов.
1H ЯМР (CDCl3) δ: 2,04 (3H, с), 3,58 (2H, с), 3,83 (3H, с), 3,92 (2H, с), 5,37 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,05-7,7 (14H, м), 8,35-8,45 (2H, м).
ИК (KBr): 1713, 1669, 1532, 1464, 1329, 1238, 1032, 787 см-1.
Элементный анализ для C35H30F2N6O4S·0,3H2O:
Вычислено С, 62,36; H, 4,58; N, 12,47.
Найдено: C, 62,22; H, 4,32; N, 12,57.
Т.пл. 184-185°C.
Пример 19
Получение N-(4-(1-(2,6-дифторбензил)-5-((((6-(гидроксиметил)-2-пиридинил)метил)(метил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
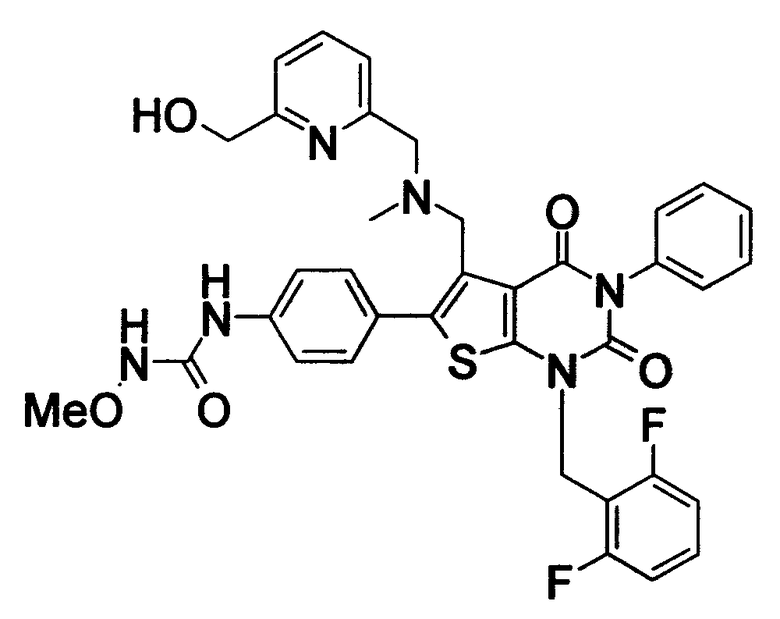
По реакции, аналогично описанной в примере 4, используя соединение, полученное в ссылочном примере 15 (150 мг, 0,26 ммоль) и 6-бромметил-2-пиридинметанол (105 мг, 0,52 ммоль), получают указанное в заголовке соединение (115 мг, 63%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,13 (3H, с), 3,72 (2H, с), 3,83 (3H, с), 3,97 (2H, с), 4,05-4,1 (1H, м), 4,65-4,75 (2H, м), 5,37 (2H, с), 6,93 (2H, т, J=8,2 Гц), 6,9-7,05 (1H, м), 7,1-7,2 (2H, м), 7,2-7,7 (12H, м).
ИК (KBr): 1713, 1669, 1534, 1472, 1032, 789, 735 см-1.Элементный анализ для C36H32F2N6O5S·1,1H2O:
Вычислено С, 60,17; H, 4,80; N, 11,70.
Найдено: C, 60,02; H, 4,70; N, 11,53.
Пример 20
Получение метил-6-((((1-(2,6-дифторбензил)-6-(4-(((метоксиамино)карбонил)амино)фенил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)метил)амино)метил)никотината
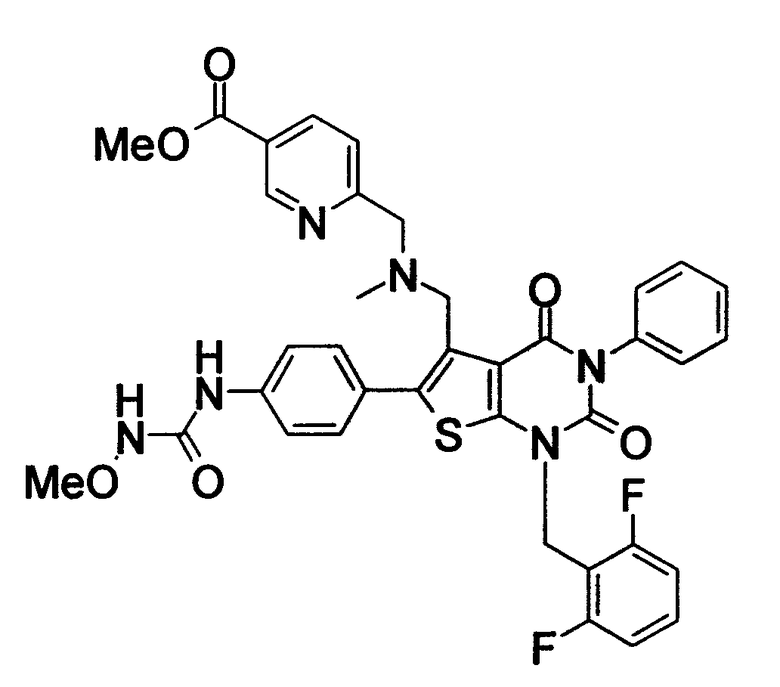
По реакции, аналогично описанной в примере 4, используя соединение, полученное в ссылочном примере 15 (280 мг, 0,485 ммоль), и метил-6-(бромметил)никотинат (0,19 г, 0,825 ммоль), получают указанное в заголовке соединение (267 мг, 76%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,09 (3H, с), 3,76 (2H, с), 3,83 (3H, с), 3,93 (3H, с), 3,99 (2H, с), 5,35 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,26 (1Н, с), 7,2-7,6 (11H, м), 7,64 (1H, с), 8,05-8,15 (1Н, м), 9,0-9,05 (1Н, с).
ИК (KBr): 1732, 1715, 1669, 1526, 1470, 1296, 1032, 789, 735 см-1.
Элементный анализ для C37H32F2N6О6S:
Вычислено С, 61,15; H, 4,44; N, 11,56.
Найдено: C, 60,96; H, 4,47; N, 11,52.
Пример 21
Получение 6-((((1-(2,6-дифторбензил)-6-(4-(((метоксиамино)карбонил)амино)фенил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)метил)(метил)амино)метил)-N-метилникотинамида
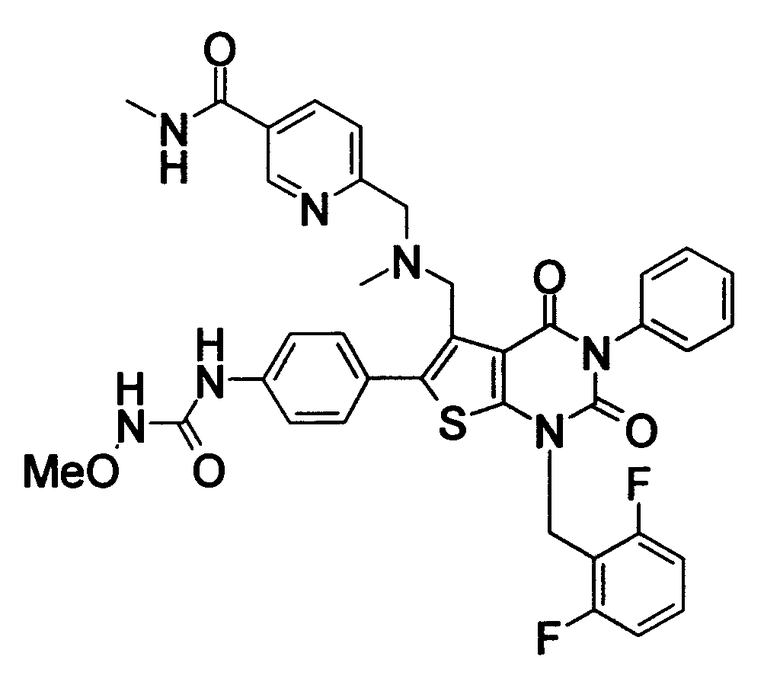
Этилдиизопропиламинамин (0,48 мл, 2,76 ммоль) и раствор диметилалюминийхлорида в гексане (0,98 M, 1,69 мл, 1,656 ммоль) добавляют по каплям к раствору метиламина (2M в ТГФ) (1,38 мл, 2,76 ммоль) в дихлорметане (4 мл) при охлаждении льдом и смесь перемешивают при комнатной температуре в течение 30 минут. К смеси добавляют раствор соединения, полученного в примере 20 (200 мг, 0,275 ммоль), в дихлорметане (14 мл) и смесь перемешивают при комнатной температуре в течение 2 дней. Реакционную смесь объединяют с водным раствором гидрокарбоната натрия и экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на NH-силикагеле (Fuji Silysia Chemical) (элюент: смесь этилацетат/метанол, 40/1) и перекристаллизовывают из смеси дихлорметан/метанол/диэтиловый эфир и получают указанное в заголовке соединение (68 мг, 34%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,2l (3H, с), 3,00 (3H, д, J=4,6 Гц), 3,74 (2H, с), 3,84 (3H, с), 3,92 (2H, с), 5,36 (2H, с), 6,5-6,65 (1Н, м), 6,92 (2H, т, J=8,0 Гц), 7,15-7,6 (12H, м), 7,71 (1Н, с), 7,9-8,0 (1Н, м), 8,80-8,85 (1Н, м).
ИК (KBr): 1713, 1665, 1534, 1470, 1327, 1032, 735 см-1.
Элементный анализ для C37H33F2N7O5S·1,6H2O:
Вычислено С, 58,89; H, 4,84; N, 12,99.
Найдено: C, 59,12; H, 5,06; N, 12,66.
Пример 22
Получение этил-6-((((1-(2,6-дифторбензил)-6-(4-(((метоксиамино)карбонил)амино)фенил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)метил)(метил) амино)метил)-2-пиридинкарбоксилата
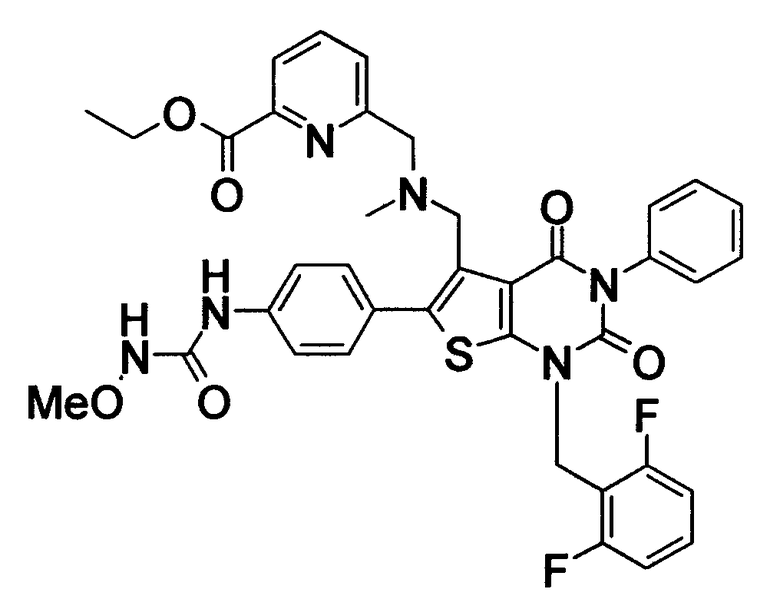
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 15 (578 мг, 1 ммоль), и этил-6-гидроксиметил-2-пиридинкарбоксилат (797 мг, 4,4 ммоль), получают указанное в заголовке соединение (590 мг, 80%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,40 (3H, т, J=7,2 Гц), 2,10 (3H, с), 3,79 (2H, с), 3,83 (3H, с), 4,0l (2H, с), 4,43 (2H, кв, J=7,2 Гц), 5,35 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,15 (1H, с), 7,2-7,7 (13H, м), 7,88 (1Н, д, J=7,4 Гц).
ИК (KBr): 1717, 1667, 1530, 1464, 1310, 1236, 1032, 747 см-1.
Элементный анализ для C38H34F2N6O6S:
Вычислено С, 61,61; H, 4,63; N, 11,34.
Найдено: C, 61,39; H, 4,65; N, 11,17.
Пример 23
Получение 6-((((1-(2,6-дифторбензил)-6-(4-(((метоксиамино)карбонил)амино)фенил-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)метил)(метил)амино)метил)-N-метил-2-пиридинкарбоксамида
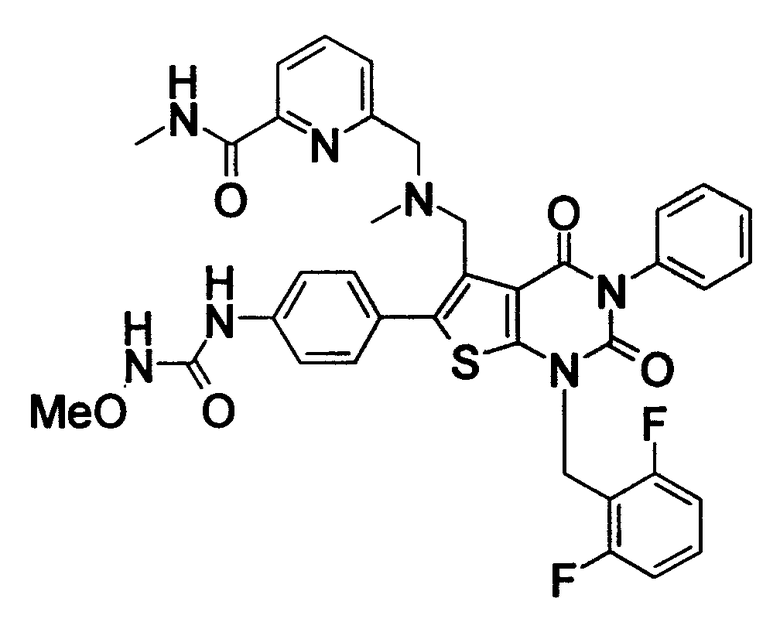
По реакции, аналогично описанной в примере 21, используя соединение, полученное в примере 22 (300 мг, 0,413 ммоль), и раствор метиламина в ТГФ (2M, 2,07 мл, 4,13 ммоль), получают указанное в заголовке соединение (158 мг, 53%) в виде бесцветных кристаллов.
1H ЯМР (CDCl3) δ: 2,13 (3H, с), 2,95 (3H, д, J=5,2 Гц), 3,74 (2H, с), 3,84 (3H, с), 3,99 (2H, с), 5,36 (2H, с), 6,93 (2H, т, J=8,2 Гц), 7,15-7,7 (13H, м), 7,9-8,1 (3H,м).
ИК (KBr): 1719, 1663, 1534, 1472, 1331, 1032, 737 см-1.
Элементный анализ для C37H33F2N7O5S·1,0H2O:
Вычислено С, 9,75; H, 4,74; N, 13,18.
Найдено: C, 59,60; H, 4,77; N, 13,12.
Пример 24
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-(1H-имидазол-1-ил)этил)(метил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
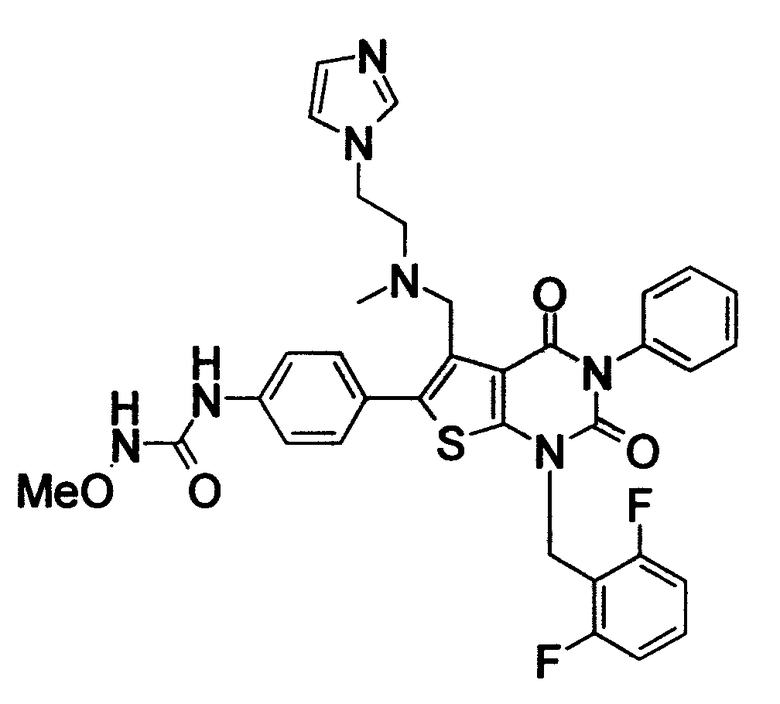
Соединение, полученное в ссылочном примере 15 (289 мг, 0,5 ммоль), растворяют в ДМФА (30 мл) и добавляют этилдиизопропиламин (0,44 мл, 2,5 ммоль) и 1-бром-2-хлорэтан (0,17 мл, 2,5 ммоль). Реакционную смесь перемешивают при 50-60°C в течение 1 часа, объединяют с водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Объединенный органический слой сушат над сульфатом магния и упаривают при пониженном давлении, получая галогенид. Раствор полученного галогенида, имидазола (177 мг, 2,6 ммоль) и карбоната калия (72 мг, 0,52 ммоль) в ДМФА (4 мл) перемешивают при комнатной температуре в течение 18 часов и при 50-60°C в течение 1 часа, разбавляют водой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на NH-силикагеле (Fuji Silysia Chemical) (элюент: смесь этилацетат/метанол, 80/1-20/1), перекристаллизовывают из смеси дихлорметан/метанол/диэтиловый эфир и получают указанное в заголовке соединение (40 мг, 23%) в виде бесцветных кристаллов.
1H ЯМР (CDCl3) δ: 2,17 (3H, с), 2,6-2,8 (2H, м), 3,80 (2H, с), 3,83 (3H, с), 3,9-4,0 (2H, м), 5,38 (2H, с), 6,78 (1H, с), 6,85-7,0 (3H, м), 7,2-7,6 (12H, м), 7,71 (1H, с).
Пример 25
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-(2-(2-гидроксиэтил)-1H-имидазол-1-ил)этил)(метил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
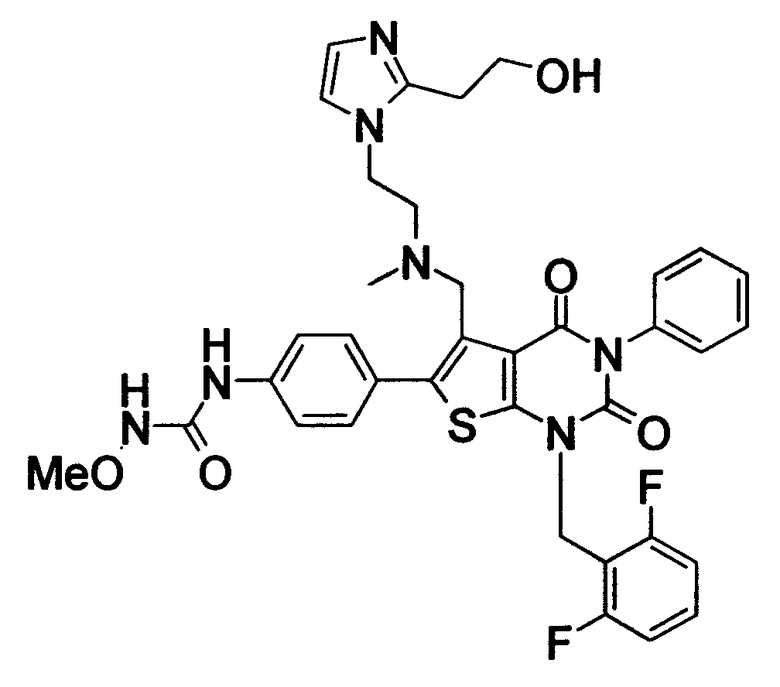
По реакции, аналогично описанной в примере 24, используя соединение, полученное в ссылочном примере 15 (289 мг, 0,5 ммоль), и 2-(2-гидроксиэтил)имидазол (292 мг, 2,6 ммоль), получают указанное в заголовке соединение (19 мг, 10%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,9-2,1 (2H, м), 2,16 (3H, с), 2,6-2,8 (4H, м), 3,78 (2H, с), 3,83 (2H, с), 3,9-4,0 (2H, м), 5,38 (2H, с), 6,70 (1Н, с), 6,80 (1Н, с), 6,94 (2H, т, J=8,0 Гц), 7,2-7,6 (11Н, м), 7,73 (1Н, с).
Пример 26
Получение 2-(4-(1-(2,6-дифторбензил)-6-(4-(((метоксиамино)карбонил)амино)фенил)-5-((метил(2-пиридинилметил)амино)метил)-2,4-диоксо-1,4-дигидротиено[2,3-d]пиримидин-3(2H)-ил)фенокси)-N-метилацетамида
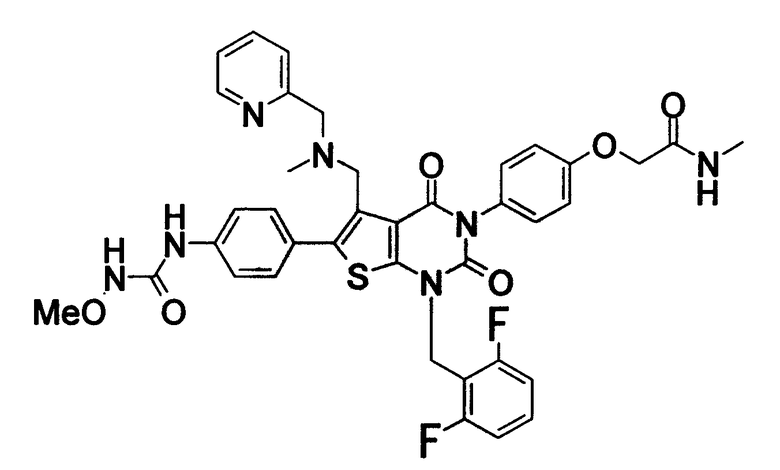
По реакции, аналогично описанной в примере 5, используя соединение, полученное в ссылочном примере 3 (320 мг, 0,5 ммоль), и 4-аминофенокси-N-метилацетамид (135 мг, 0,75 ммоль), получают указанное в заголовке соединение (192 мг, 51%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,09 (3H, с), 2,93 (3H, д, J=4,8 Гц), 3,72 (2H, с), 3,83 (3H, с), 3,97 (2H, с), 4,55 (2H, с), 5,35 (2H, с), 6,55-6,65 (1Н, м), 6,92 (2H, т, J=8,0 Гц), 7,0-7,65 (14H, м), 8,4 4 (1Н, д, J=6,0 Гц).
ИК (KBr): 1721, 1669, 1532, 1472, 1236, 1032, 764 см-1.
Элементный анализ для С38Н35F2N7О6·0,5Н2O:
Вычислено С, 59,68; Н, 4,74; N, 12,82.
Найдено: С, 59,51; Н, 4,66; N, 12,68.
Пример 27
Получение 2-(4-(1-(2,6-дифторбензил)-6-(4-(((метоксиамино)карбонил)амино)фенил)-5-((метил(2-пиридинилметил)амино)метил)-2,4-диоксо-1,4-дигидротиено[2,3-d]пиримидин-3(2Н)-ил)фенил-N-этилацетамида
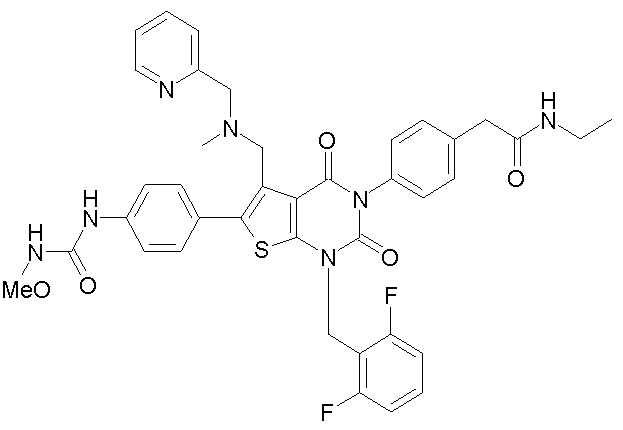
По реакции, аналогично описанной в примере 5, используя соединение, полученное в ссылочном примере 3 (320 мг, 0,5 ммоль), и 4-аминофенил-N-этилацетамид (134 мг, 0,75 ммоль), получают указанное в заголовке соединение (145 мг, 38%).в виде светло-желтых кристаллов.
1Н-ЯМР (CDCl3) δ: 1,10 (3Н, т, J=7,2 Гц), 2,10 (3Н, с), 3,2-3,4 (2Н, м), 3,64 (2Н, с), 3,72 (2Н, с), 3,83 (3Н, с), 3,98 (2Н, с), 5,36 (2Н, с), 5,45-5,55 (1Н, м), 6,93 (2Н, т, J=8,0 Гц), 7,0-7,1 (1Н, м), 7,16 (1Н, с), 7,25-7,7 (12Н, м), 8,44 (1Н, д, J=4,0 Гц).
ИК (KBr): 1721, 1672, 1534, 1470, 1032, 762 см-1.
Элементный анализ для C39H37F2N7O5S·0,5H2O:
Вычислено С, 61,41; H, 5,02; N, 12,85.
Найдено: C, 61,44; H, 4,90; N, 12,75.
Пример 28
Получение метил-3-(1-(2,6-дифторбензил)-6-(4-(((метоксиамино)карбонил)амино)фенил)-5-((метил(2-пиридинилметил)амино)метил)-2,4-диоксо-1,4-дигидротиено[2,3-d]пиримидин-3(2H)-ил)пропаната
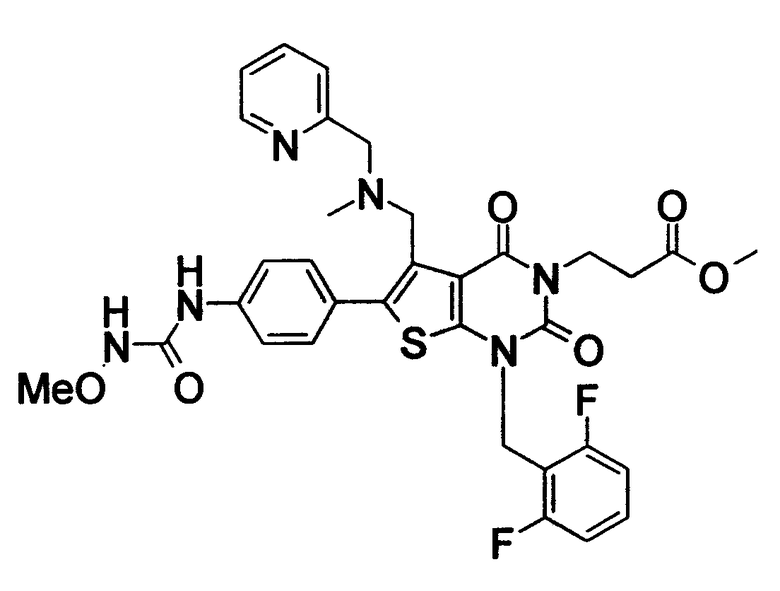
По реакции, аналогично описанной в примере 5, используя соединение, полученное в ссылочном примере 3 (320 мг, 0,5 ммоль), и метиловый сложный эфир β-аланина (115 мг, 0,75 ммоль), получают указанное в заголовке соединение (255 мг, 75%) в виде светло-желтого аморфного соединения.
1H-ЯМР (CDCl3) δ: 2,10 (3H, с), 2,65-2,8 (2H, м), 3,68 (3H, с), 3,72 (2H, с),3,83 (3H, с), 3,98 (2H, с), 4,3-4,5 (2H, м), 5,31 (2H, с), 6,91 (2H, т, J=7,6 Гц), 7,0-7,4 (5H, м), 7,45-7,65 (5H, м), 8,4-8,5 (1Н, м).
Пример 29
Получение 3-(1-(2,6-дифторбензил)-6-(4-(((метоксиамино)карбонил)амино)фенил)-5-((метил(2-пиридинилметил)амино)метил)-2,4-диоксо-1,4-дигидротиено[2,3-d]пиримидин-3(2H)-ил)-N,N-диметилпропанамида
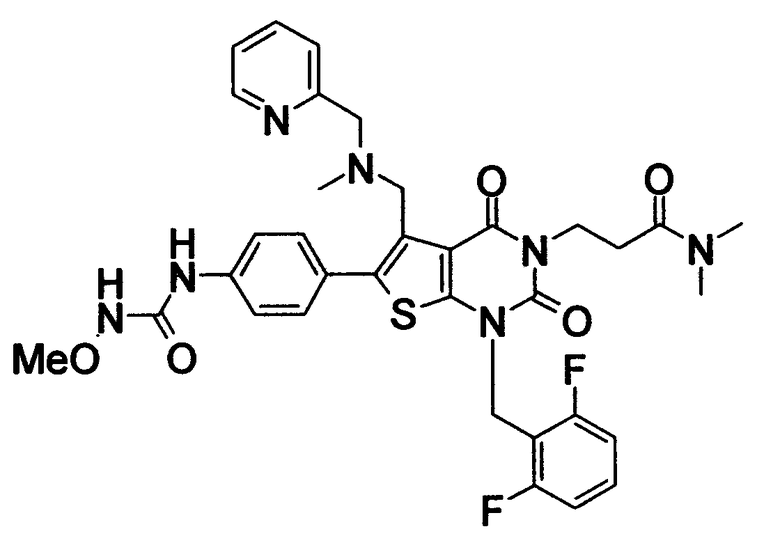
По реакции, аналогично описанной в примере 21, используя соединение, полученное в примере 28 (300 мг, 0,413 ммоль), и раствор диметиламина в ТГФ (2M) (1,63 мл, 3,26 ммоль), получают указанное в заголовке соединение(73 мг, 33%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ: 2,09 (3H, с), 2,75 (3H, д, J=7,8 Гц), 2,94 (3H, с), 3,02 (3H, с), 3,73 (2H, с), 3,83 (3H, с), 4,07 (2H, с), 4,40 (2H, т, J=7,8 Гц), 5,33 (2H, с), 6,91 (2H, т, J=8,2 Гц), 7,0-7,35 (5H, м), 7,5-7,65 (5H, м), 8,45 (1H, д, J=4,0 Гц).
ИК (KBr): 1703, 1659, 1530, 1472, 1321, 1034, 779 см-1.
Элементный анализ для C34H35F2N7O5S·1,0H2O:
Вычислено С, 57,54; H, 5,25; N, 13,81.
Найдено: C, 57,56; H, 5,05; N, 13,59.
Пример 30
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-гидроксициклогексил)-5-((метил(2-пиридинилметил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
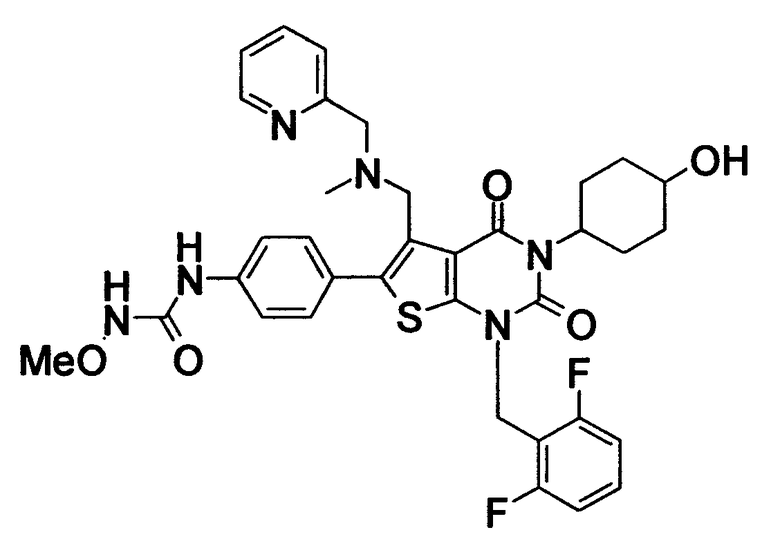
По реакции, аналогично описанной в примере 5, используя соединение, полученное в примере 28 (320 мг, 0,5 ммоль), и 4-аминогексанол (86 мг, 0,75 ммоль), получают указанное в заголовке соединение(154 мг, 45%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,4-1,8 (4H, м), 2,0-2,1 (2H, м), 2,12 (3H, с), 2,55-2,75 (2H, м), 3,73 (2H, с), 3,7-3,8 (1Н, м), 3,82 (3H, с), 3,98 (2H, с), 4,9-5,1 (1H, уш.м), 5,29 (2H, с), 6,91 (2H, т, J=8,2 Гц), 7,0-7,4 (7H, м), 7,45-7,65 (5H, м), 8,45 (1Н, д, J=4,8 Гц).
ИК (KBr): 1705, 1659, 1530, 1470, 1312, 1236, 1069, 1034,
783 см-1.
Элементный анализ для C35H36F2N6O5S·1,5H2O:
Вычислено С, 58,57; H, 5,48; N, 11,71.
Найдено: C, 58,65; H, 5,35; N, 11,64.
Пример 31
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-(2H-тетразол-2-ил)этил)аминометил))-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (1)
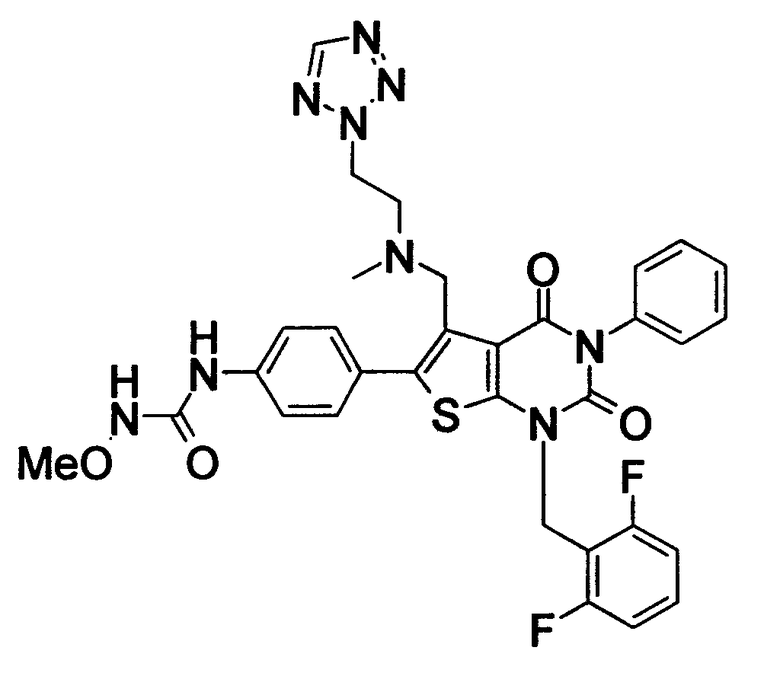
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-(1H-тетразол-1-ил)этил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (2)
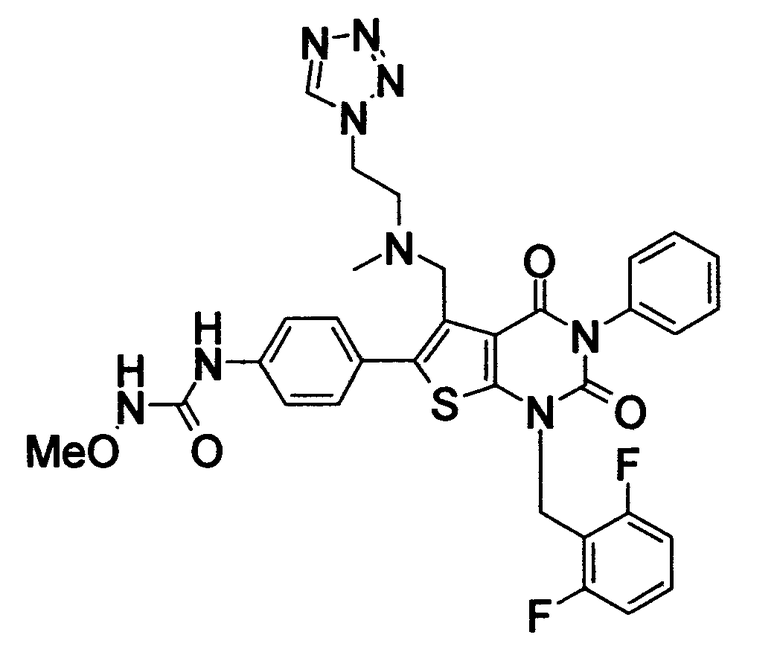
Карбонат калия (2,075 г, 15 ммоль) добавляют к раствору тетразола (0,70 г, 10 ммоль) и 1-бром-2-хлорэтана (1,25 мл, 15 ммоль) в ДМФА (5 мл) и смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь объединяют с насыщенным раствором соли и два раза экстрагируют этилацетатом. Объединенный экстракт сушат над сульфатом магния, упаривают при пониженном давлении и получают галогенид (4,23 г, включая ДМФА).
N,N-диизопропилэтиламин (1,16 мл, 6,67 ммоль) и галогенид, полученный выше, добавляют к раствору соединения, полученного в ссылочном примере 15 (578 мг, 1 ммоль) в ДМФА (10 мл), и смесь перемешивают при 60-70°C в течение 16 часов. Реакционную смесь объединяют с водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат/гексан, 9/1), перекристаллизовывают из смеси дихлорметан/метанол/диэтиловый эфир и получают 2-ил форму (80 мг, 12%) и 1-ил форму (38 мг, 57%) указанного в заголовке соединения в виде бесцветных кристаллов.
2-ил форма (1)
1H-ЯМР (CDCl3) δ: 2,25 (3H, с), 3,04 (2H, т, J=6,2 Гц), 3,78 (2H, с), 3,83 (3H, с), 4,66 (2H, т, J=6,2 Гц), 5,38 (2H, с), 6,94 (2H, т, J=8,0 Гц), 7,16 (1H, с), 7,2-7,6 (10H, м), 7,64 (1Н, с), 8,30 (1H, с).
ИК (KBr): 1713, 1669, 1530, 1470, 1325, 1032, 735 см-1.
Элементный анализ для C32H29F2N9O4S·0,5H2O:
Вычислено С, 56,30; H, 4,43; N, 18,46.
Найдено: C, 56,18; H, 4,42; N, 18,19.
1-ил форма (2)
1H-ЯМР (CDCl3) δ: 2,02 (3H, с), 2,7-2,8 (2H, м), 3,78 (2H, с), 3,83 (3H, с), 4,4-4,5 (2H, м), 5,38 (2H, с), 6,92 (2H, т, J=8,0 Гц), 7,17 (1Н, с), 7,25-7,65 (10H, м), 7,66 (1Н, с).
ИК (KBr): 1713, 1669, 1530, 1470, 1327, 1236, 1032, 735 см-1.
Элементный анализ для C32H29F2N9O4S·0,5H2O:
Вычислено С, 56,30; H, 4,43; N, 18,46.
Найдено: C, 56,54; H, 4,30; N, 18,27.
Пример 32
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-гидроксиэтил)-5-((метил(2-пиридинилметил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
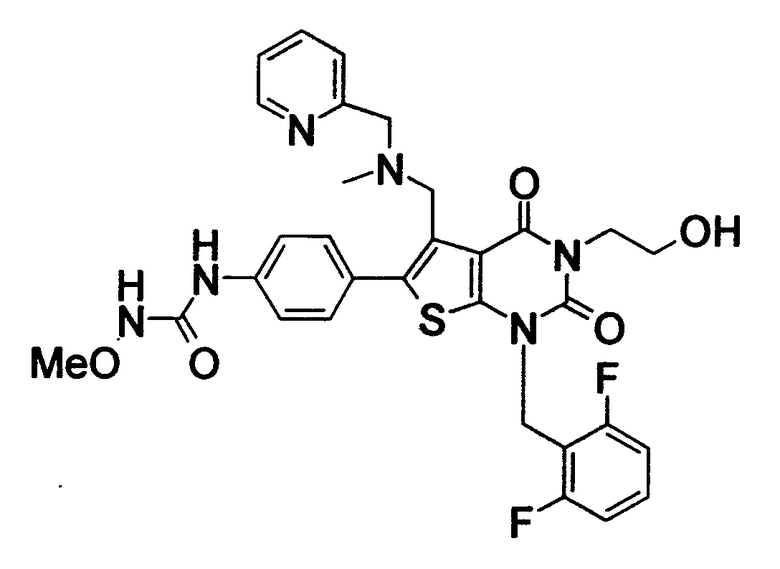
По реакции, аналогично описанной в примере 5, используя соединение, полученное в ссылочном примере 3 (410 мг, 0,64 ммоль), и 2-аминоэтанол (0,06 мл, 0,96 ммоль), получают указанное в заголовке соединение (76 мг, 19%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,22 (3H, с), 3,3-3,5 (1H, уш.), 3,78 (2H, с), 3,83 (3H, с), 3,9-4,05 (2H, м), 3,99 (2H, с), 4,35-4,4 (2H, м), 5,27 (2H, с), 6,91 (2H, т, J=8,0 Гц), 6,9-7,1 (1H, м), 7,15 (1H, с), 7,2-7,65 (8H, м), 8,35-8,4 (1H, м).
ИК (KBr): 1709, 1649, 1470, 1323, 1030, 787 см-1.
Элементный анализ для C31H30F2N6O5S·0,5H2O:
Вычислено С, 57,67; H, 4,84; N, 13,02.
Найдено: C, 57,77; H, 4,90; N, 12,82.
Пример 33
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(3-(2-оксо-1-пирродидинил)пропил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
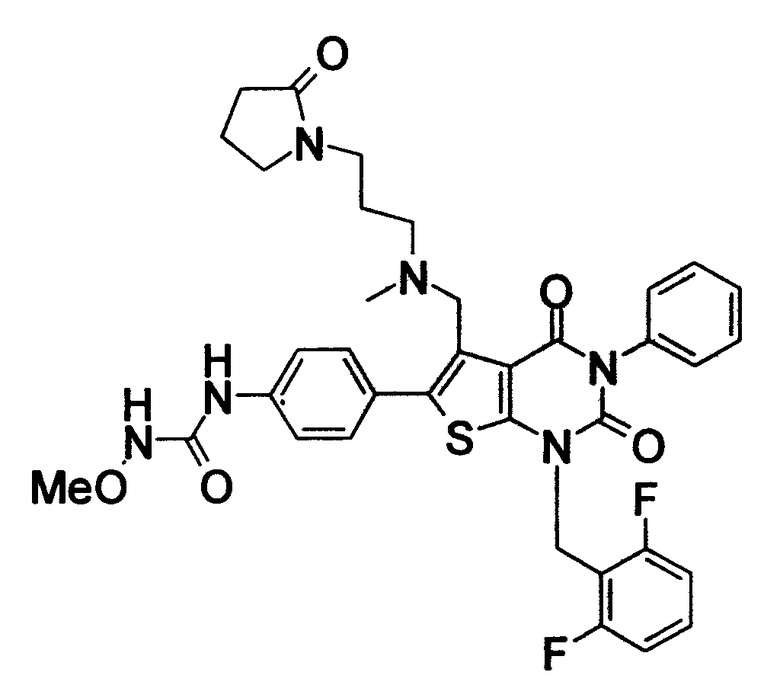
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 15 (404 мг, 0,7 ммоль), и 1-(3-гидроксипропил)-2-пирролидон (0,55 г, 3,85 ммоль), получают указанное в заголовке соединение (322 мг, 66%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,5-1,7 (2H, м), 1,8-2,0 (2H, м), 2,05 (3H, с), 2,25-2,45 (4H, м), 3,15 (2H, т, J=7,8 Гц), 3,23 (2H, т, J=7,2 Гц), 3,76 (2H, с), 3,83 (3H, с), 5,37 (2H, с), 6,93 (2H, т, J=8,0 Гц), 7,15 (1Н, с), 7,2-7,6 (10H, м), 7,67 (1H, с).
ИК (KBr): 1715, 1671, 1532, 1470, 1327, 1032, 735 см-1.
Элементный анализ для C36H36F2N6O5S·1,0H2O:
Вычислено С, 59,99; H, 5,31; N, 11,66.
Найдено: C, 60,21; H, 5,18; N, 11,74.
Т.пл. 128-129°C.
Пример 34
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(2-(2-оксо-1-пирролидинил)этил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
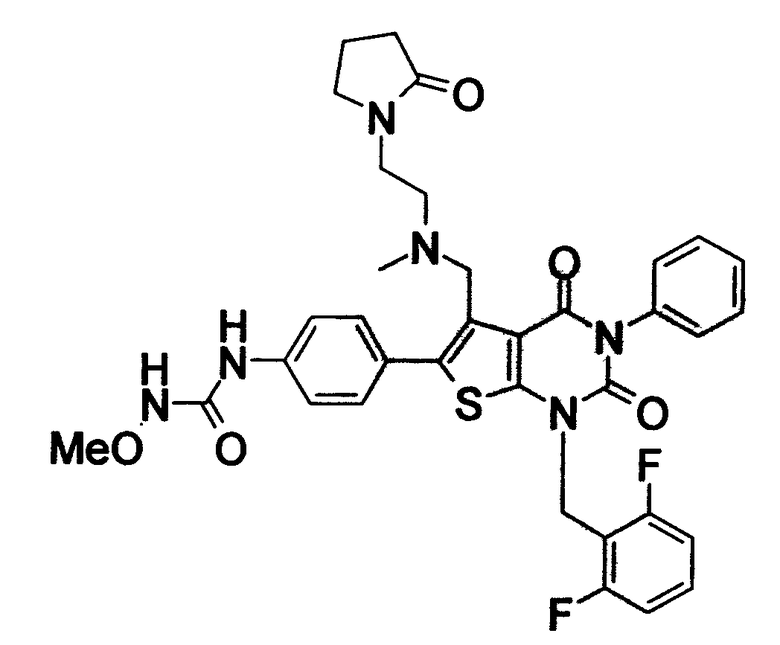
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 15 (404 мг, 0,7 ммоль), и 1-(3-гидроксиэтил)-2-пирролидон (0,50 г, 3,85 ммоль), получают указанное в заголовке соединение (290 мг, 60%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,7-1,85 (2H, м), 2,14 (3H, с), 2,21 (2H, т, J=8,1 Гц), 1,54 (2H, т, J=6,2 Гц), 3,19 (2H, т, J=7,0 Гц), 3,29 (2H, т, J=6,2 Гц), 1,77 (2H, с), 3,83 (3H, с), 5,38 (2H, с), 6,93 (2H, т, J=8,1 Гц), 7,18 (1H, с), 7,25-7,7 (11H, м).
ИК (KBr): 1715, 1672, 1530, 1470, 1323, 1238, 1032, 735 см-1.
Элементный анализ для C35H34F2N6O5S·0,5H2O:
Вычислено С, 60,25; H, 5,06; N, 12,04.
Найдено: C, 60,29; H, 5,04; N, 12,13.
Т.пл. 134-136°C.
Пример 35
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-фторфенил)-5-((метил-(2-(2-оксо-1-пирролидинил)этил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
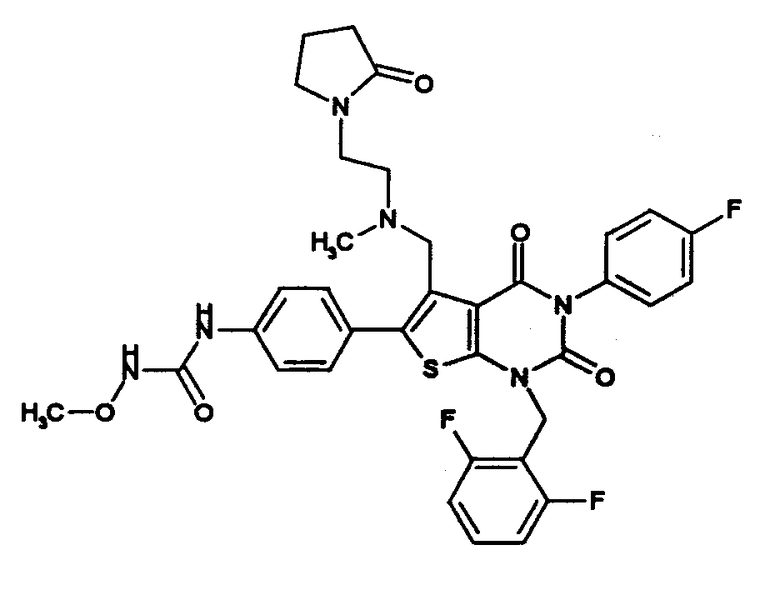
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 17 (350 мг, 0,588 ммоль), и 1-(3-гидроксиэтил)-2-пирролидон (0,50 г, 3,85 ммоль), получают указанное в заголовке соединение (283 мг, 68%) в виде светло-желтых кристаллов.
1H-ЯМР (CDCl3) δ: 1,7-1,9 (2H, м), 2,15 (3H, с), 2,15-2,3 (2H, м), 2,52 (2H, т, J=6,2 Гц), 3,20 (2H, т, J=6,8 Гц), 3,29 (2H, т, J=6,2 Гц), 3,77 (2H, с), 3,83 (3H, с), 5,37 (2H, с), 6,93 (2H, т, J=8,2 Гц), 7,1-7,35 (6H, м), 7,5-7,65 (4H, м), 7,64 (1Н, с).
ИК (KBr): 1723, 1667, 1532, 1472, 1236, 1034, 837, 762 см-1.
Элементный анализ для C35H33F3N6O5S·0,5H2O:
Вычислено С, 58,73; H, 4,79; N, 11,74.
Найдено: C, 58,99; H, 4,98; N, 11,92.
Т.пл. 198-200°C.
Пример 36
Получение N-(2-(((1-(2,6-дифторбензил)-3-(4-фторфенил)-6-(4-(((метоксиамино)карбонил)амино)фенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)метил)(метил)амино)этил)-N-метилметансульфонамид
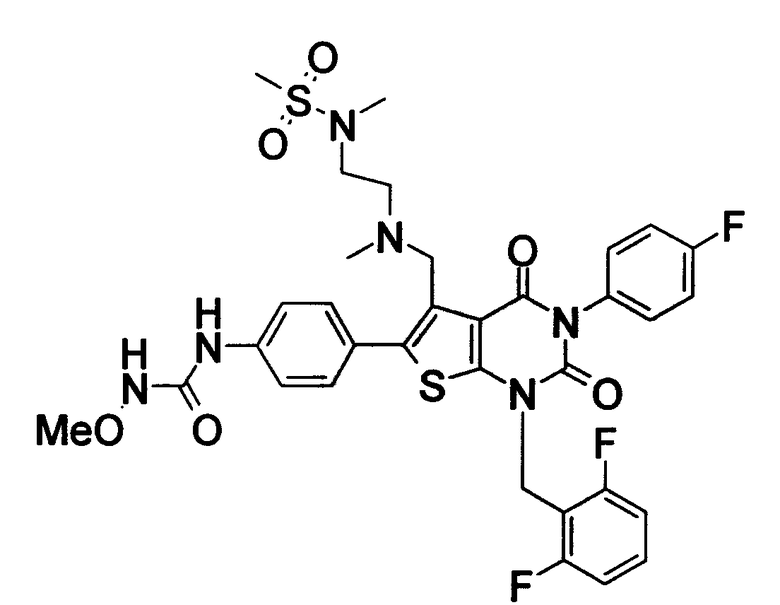
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 17 (350 мг, 0,588 ммоль), и 2-метиламиноэтанол (0,29 г, 3,85 ммоль), получают указанное в заголовке соединение (263 мг, 61%) в виде светло-желтых кристаллов.
1H-ЯМР (CDCl3) δ: 2,13 (3H, с), 2,55 (2H, т, J=6,4 Гц), 2,70 (3H, с), 2,71 (3H, с), 3,15 (2H, т, J=6,4 Гц), 3,81 (2H, с), 3,83 (3H, с), 5,37 (2H, с), 6,93 (2H, т, J=8,2 Гц), 7,1-7,7 (11Н, м).
ИК (KBr): 1725, 1663, 1534, 1474, 1331, 1236, 1142, 1034, 793 см-1.
Элементный анализ для C33H33F3N6O6S2:
Вычислено С, 54,24; H, 4,55; N, 11,50.
Найдено: C, 54,10; H, 4,45; N, 11,36.
Т.пл. 218-220°C.
Пример 37
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(((2S)-1-(метилсульфонил)-2-пирролидинил)метил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
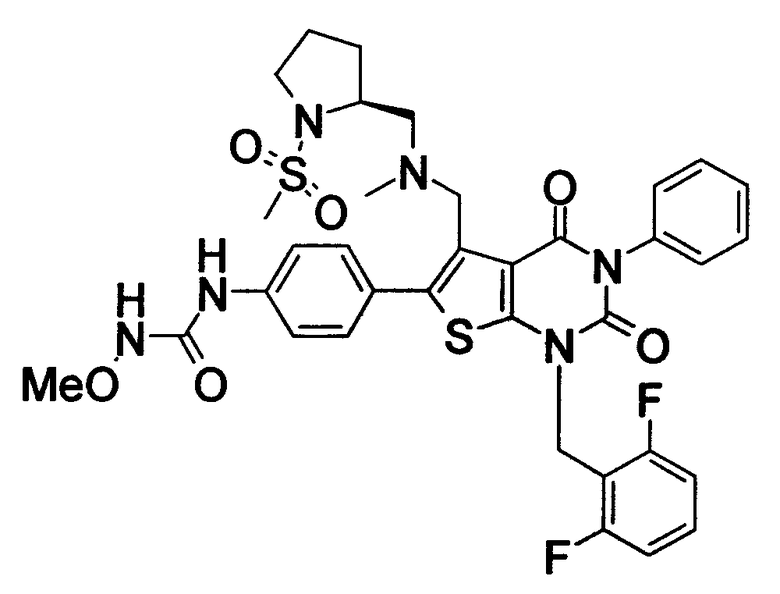
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 15 (404 мг, 0,7 ммоль), и (1)-2-гидроксиметилпирролидин (0,39 г, 3,85 ммоль), получают указанное в заголовке соединение (262 мг, 51%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,7-1,85 (4H, м), 2,08 (3H, с), 2,2-2,4 (1Н, м), 2,5-2,65 (1H, м), 2,72 (3H, с), 3,15-3,3 (2H, м), 3,7-3,9 (3H, м), 3,83 (3H, с), 5,37 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,13 (1Н, с), 7,2-7,7 (11Н, м).
ИК (KBr): 1713, 1667, 1528, 1470, 1333, 1148, 1030, 785 см-1.
Элементный анализ для C35H36F2N6O6S2:
Вычислено С, 56,90; H, 4,91; N, 11,37.
Найдено: C, 56,55; H, 4,87; N, 11,23.
Т.пл. 195-197°C.
Пример 38
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-фторфенил)-5-((метил(((2S)-1-(метилсульфонил)-2-пирролидинил)метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
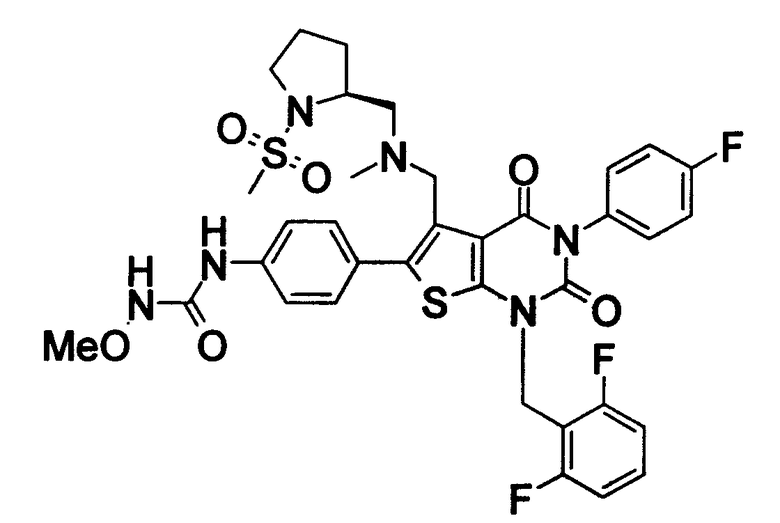
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 17 (400 мг, 0,672 ммоль), и (1)-2-гидроксиметилпирролидин (0,39 г, 3,85 ммоль), получают указанное в заголовке соединение (222 мг, 44%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,7-1,85 (4H, м), 2,09 (3H, с), 2,25-2,35 (1Н, м), 2,55-2,65 (1H, м), 2,71 (3H, с), 3,15-3,3 (2H, м), 3,65-3,7 (2H, м), 3,74 (1Н, д, J=12,0 Гц), 3,83 (3H, с), 3,87 (1Н, д, J=12,0 Гц), 5,36 (2H, с), 6,92 (2H, т, J=8,2 Гц), 6,85-6,95 (1Н, м), 7,1-7,35 (5H, м), 7,49 (2H, д, J=8,4 Гц), 7,55 (2H, д, J=8,4 Гц), 7,62 (1Н, с).
ИК (KBr): 1715, 1667, 1530, 1470, 1333, 1236, 1152, 1032, 795 см-1.
Элементный анализ для C35H35F3N6O6S2:
Вычислено С, 55,55; H, 4,66; N, 11,10.
Найдено: C, 55,42; H, 4,45; N, 11,01.
Т.пл. 202-204°C.
Пример 39
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(((2R)-1-(метилсульфонил)-2-пирролидинил)метил)амино)метил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
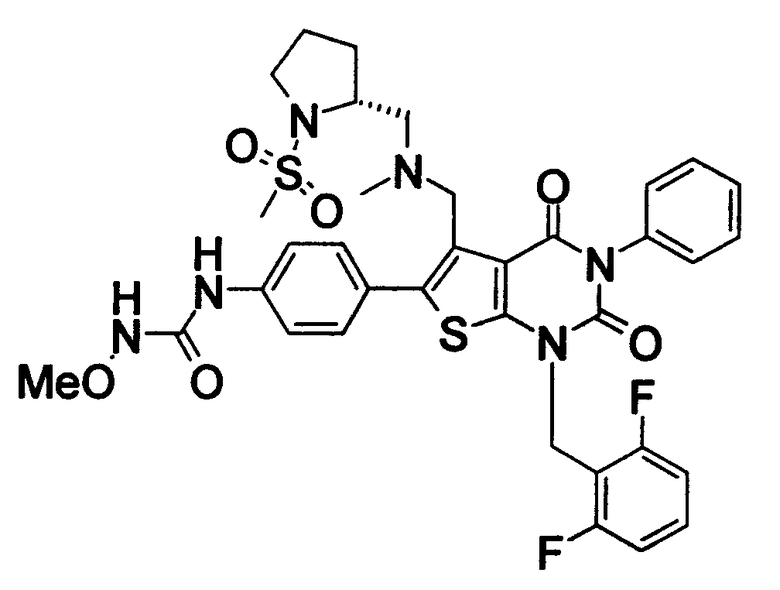
По реакции, аналогично описанной в примере 2, используя соединение, полученное в ссылочном примере 15 (188 мг, 0,325 ммоль), и (R)-2-гидроксиметилпирролидин (0,14 г, 1,38 ммоль), получают указанное в заголовке соединение (136 мг, 57%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,7-1,85 (4H, м), 2,08 (3H, с), 2,2-2,4 (1H, м), 2,5-2,65 (1H, м), 2,72 (3H, с), 3,15-3,3 (2H, м), 3,7-3,9 (3H, м), 3,83 (3H, с), 5,37 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,13 (1Н, с), 7,2-7,7 (11H, м).
ИК (KBr): 1713, 1665, 1530, 1470, 1333, 1148, 1030, 785 см-1.
Элементный анализ для C35H36F2N6O6S2·0,5H2O:
Вычислено С, 56,21; H, 4,99; N, 11,24.
Найдено: C, 56,29; H, 4,79; N, 11,11.
Т.пл. 208-210°C.
Пример 40
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
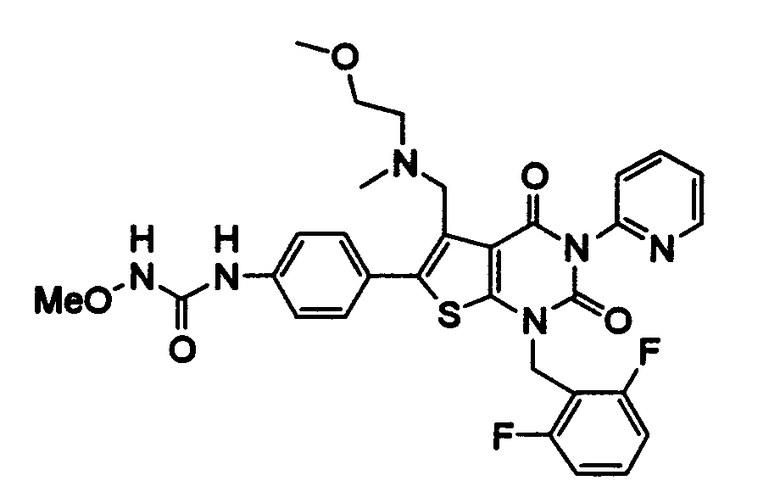
Диэтилцианофосфат (245 мг) и N-этилдиизопропиламин (284 мкл) добавляют к раствору соединения, полученного в ссылочном примере 7 (607 мг), и 2-аминопиридина (142 мг) в ДМФА (10 мл) при охлаждении льдом, реакционную смесь постепенно нагревают до комнатной температуры и перемешивают в течение 13 часов. Реакционную смесь распределяют между этилацетатом и водой. Органический слой промывают последовательно водой и насыщенным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Полученный остаток подвергают грубой очистке колоночной хроматографией на аминопропилсиликагеле (Fuji Silysia Chemical). Полученный неочищенный амид (350 мг) растворяют в этаноле (25,5 мл) и добавляют 28% раствор метоксида натрия в метаноле (196 мг). Смесь перемешивают при комнатной температуре в течение 15 часов. Реакционную смесь нейтрализуют 1N хлористоводородной кислотой (1 мл) и отгоняют растворитель. Остаток распределяют между этилацетатом и водой. Органический слой успешно промывают водой и насыщенным раствором соли и сушат над безводным сульфатом натрия. Полученный остаток очищают колоночной хроматографией на аминопропилсиликагеле (45 г, элюент: этилацетат/гексан(7/3)→этилацетат), перекристаллизовывают из смеси ТГФ-этанол и получают указанное в заголовке соединение(210 мг) в виде бесцветных кристаллов.
Элементный анализ для C31H30N6O5SF2:
Вычислено: С, 58,48; H, 4,75; N, 13,20.
Найдено: C, 58,46; H, 4,68; N, 12,93.
1H-ЯМР (CDCl3) δ: 2,15 (3H, с), 2,62 (2H, т, J=5,9 Гц), 3,26 (3H, с), 3,41 (2H, т, J=5,9 Гц), 3,80 (3H, с), 3,81 (2H, уш.с), 5,34 (2H, уш.с), 6,91 (2H, т, J=8,1 Гц), 7,24-7,40 (4H, м), 7,53 (2H, д, J=8,4 Гц), 7,62 (2H, д, J=8,4 Гц), 7,65 (1H, с), 7,88 (1H, дт, J=1,5 Гц, 7,8 Гц), 8,67-8,69 (1H, м).
ИК(KBr): 1717, 1674, 1591, 1530, 1460, 1329 см-1.
Пример 41
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-этоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
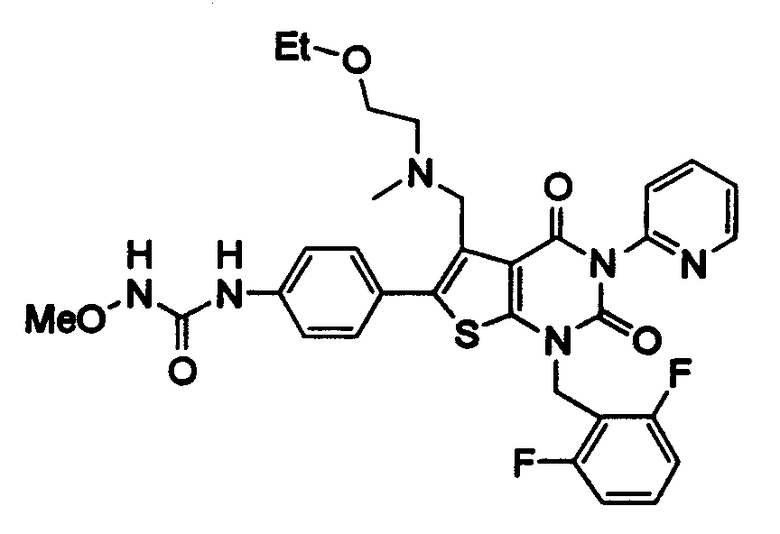
К раствору соединения, полученного в ссылочном примере 14 (251 мг), в ДМФА (4,3 мл) добавляют 2-этоксиэтилхлорид (141 мг), N-этилдиизопропиламин (245 мкл) и иодид калия (107 мг), смесь перемешивают при 60°C в течение 24 часов. Реакционную смесь распределяют между этилацетатом и водой.Органический слой промывают насыщенным раствором соли и сушат над сульфатом магния. Растворитель отгоняют, остаток очищают колоночной хроматографией на аминопропилсиликагеле (Fuji Silysia Chemical) (45 г, элюент: этилацетат/гексан, 3/2-4/1), перекристаллизовывают из этилацетата и получают указанное в заголовке соединение (62 мг) в виде бесцветных кристаллов.
Элементный анализ для C32H32N6O5SF2·0,1H2O:
Вычислено С, 59,01; H, 5,01; N, 12,74.
Найдено: C, 59,11; H, 5,13; N, 12,55.
1H-ЯМР (CDCl3) δ: 1,13 (3H, т, J=6,9 Гц), 2,15 (3H, с), 2,63 (2H, т, J=6,2 Гц), 3,39 (2H, кв, J=6,9 Гц), 3,44 (2H, т, J=6,2 Гц), 3,80 (2H, уш.с), 3,81 (3H, с), 5,34 (2H, уш.с), 6,91 (2H, т, J=8,1 Гц), 7,19 (1Н, с), 7,27-7,32 (1H, м), 7,35-7,41 (2H, м), 7,53 (2H, д, J=8,4 Гц), 7,63 (1Н, с), 7,64 (2H, д, J=8,4 Гц), 7,88 (1Н, дт, J=1,2 Гц, 7,5 Гц), 8,68 (1Н, дт, J=0,9 Гц, 4,8 Гц).
ИК: 1717, 1674, 1591, 1530, 1460, 1329 см-1.
Пример 42
Получение N-(4-(1-(2,6-дифторбензил)-3-(5-фтор-2-пиридинил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
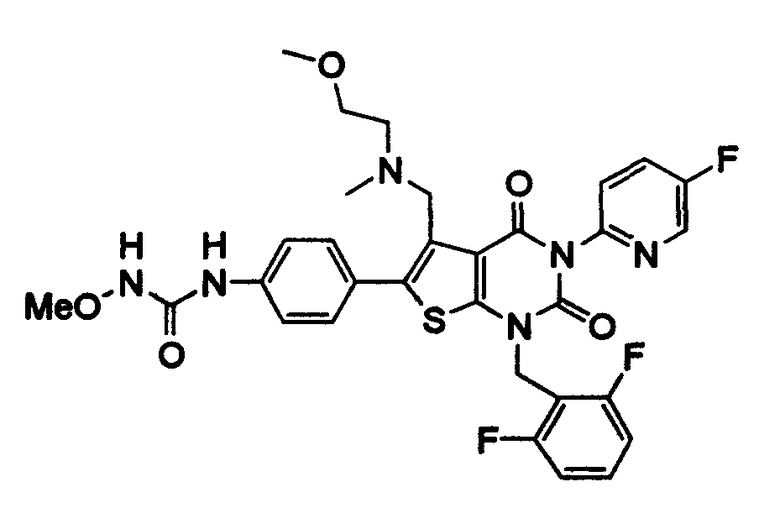
Неочищенный амид получают по методике, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (304 мг), диэтилцианофосфат (153 мкл), 2-амино-5-фторпиридин (113 мг) и N-этилдиизопропиламин (190 мкл), и указанное в заголовке соединение (113 мг) получают из неочищенного амида, используя метанол (19 мл) и 28% раствор метоксида натрия в метаноле (146 мг).
Элементный анализ для C31H29N6O5SF3:
Вычислено С, 56,87; H, 4,46; N, 12,84.
Найдено: C, 56,69; H, 4,57; N, 12,83.
1H-ЯМР (CDCl3) δ: 2,13 (3H, с), 2,62 (2H, т, J=5,9 Гц), 3,26 (3H, с), 3,41 (2H, т, J=5,9 Гц), 3,80 (2H, уш.с), 3,82 (3H, с), 5,33 (2H, уш.с), 6,92 (2H, т, J=8,3 Гц), 7,19 (1H, с), 7,28-7,38 (2H, м), 7,52-7,63 (6H, м), 8,51 (1H, д, J=3,0 Гц).
ИК (KBr): 1715, 1674, 1586, 1530, 1462 см-1.
Пример 43
Получение N-(4-(3-(5-бром-2-пиридинил)-1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
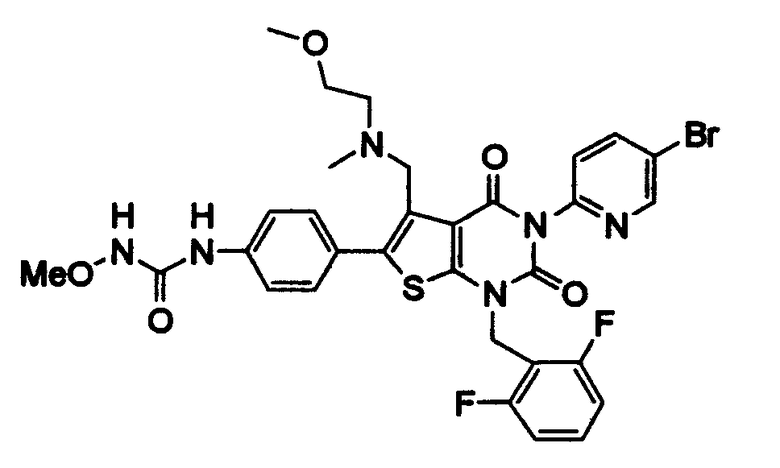
По реакции, аналогично описанной в примере 40, в которой используют соединение, полученное ссылочном примере 7 (304 мг), диэтилцианофосфат (153 мкл), 2-амино-5-бромпиридин (173 мг) и N-этилдиизопропиламин (190 мкл), получают неочищенный амид (228 мг). Кроме того, по аналогичной реакции, в которой используют метанол (14,5 мл) и 28% раствор метоксида натрия в метаноле (112 мг), получают указанное в заголовке соединение (113 мг).
Элементный анализ для C31Н29N6O5SBrF2·0,5H2O:
Вычислено С, 51,39; H, 4,17; N, 11,60.
Найдено: C, 51,68; H, 4,25; N, 11,53.
1H-ЯМР (CDCl3) δ: 2,13 (3H, с), 2,62 (2H, т, J=5,9 Гц), 3,26 (3H, с), 3,41 (2H, т, J=5,9 Гц), 3,78 (2H, уш.с), 3,80 (3H, с), 5,32 (2H, уш.с), 6,92 (2H, т, J=8,1 Гц), 7,27 (1H, д, J=8,4 Гц), 7,27-7,33 (1Н, м), 7,37 (1Н, с), 7,54 (2H, д, J=9,0 Гц), 7,60 (2H, д, J=9,0 Гц), 7,64 (1Н, с), 7,98 (1Н, дд, J=2,7 Гц, 8,4 Гц), 8,72 (1Н, д, J=2,7 Гц).
ИК (KBr): 2938, 1717, 1674, 1590, 1456 см-1.
Пример 44
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(5-метил-2-пиридинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
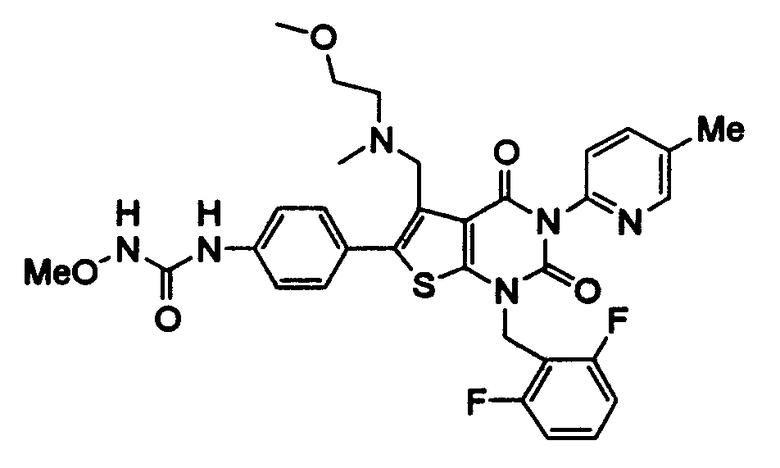
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере7 (304 мг), диэтилцианофосфат (153 мкл), 2-амино-5-метилпиридин (109 мг) и N-этилдиизопропиламин (190 мкл), получают неочищенный амид (188 мг). Кроме того, по аналогичной реакции, используя метанол (13,5 мл), 28% раствор метоксида натрия в метаноле (103 мг), получают указанное в заголовке соединение (122 мг).
Элементный анализ для C32H32N6O5SF2·0,5H2O:
Вычислено С, 58,26; H, 5,04; N, 12,74.
Найдено: C, 58,55; H, 5,14; N, 12,67.
1H-ЯМР (CDCl3) δ: 2,14 (3H, с), 2,39 (3H, с), 2,62 (2H, т, J=5,7 Гц), 3,26 (3H, с), 3,41 (2H, т, J=5,7 Гц), 3,77 (2H, уш.с), 3,80 (3H, с), 5,26 (1H, уш.с), 5,38 (1H, уш.с), 6,91 (2H, т, J=8,3 Гц), 7,23-7,34 (2H, м), 7,42 (1Н, с), 7,53 (2H, д, J=8,7 Гц), 7,62 (2H, д, J=8,7 Гц), 7,66 (1Н, с), 7,66-7,69 (1H, м), 8,48 (1H, д, J=2,4 Гц).
ИК (KBr): 2938, 1717, 1675, 1586, 1530, 1462 см-1.
Пример 45
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(6-метил-2-пиридинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
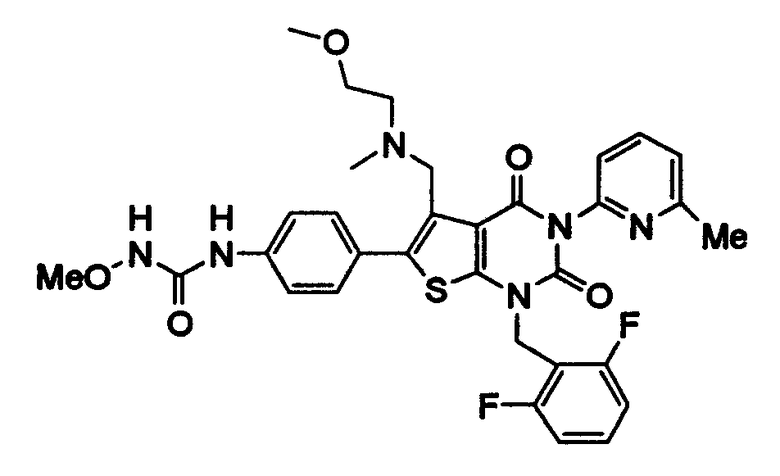
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере7 (423 мг), диэтилцианофосфат (212 мкл), 2-амино-6-метилпиридин (151 мг) и N-этилдиизопропиламин (265 мкл), получают неочищенный амид (242 мг). Кроме того, по аналогичной реакции, в которой используют метанол, (17 мл), 28% раствор метоксида натрия в метаноле (131 мг), получают указанное в заголовке соединение(145 мг).
Элементный анализ для C32H32N6O5SF2·0,5H2O:
Вычислено С, 58,26; H, 5,04; N, 12,74.
Найдено: C, 58,39; H, 4,86; N, 12,79.
1H-ЯМР (CDCl3) δ: 2,15 (3H, с), 2,60 (3H, с), 2,62 (2H, т, J=5,8 Гц), 3,27 (3H, с), 3,41 (2H, т, J=5,8 Гц), 3,66-3,94 (2H, м), 3,81 (3H, с), 5,15 (1H, д, J=15,3 Гц), 5,48 (1Н, д, J=15,3 Гц), 6,91 (2H, т, J=8,1 Гц), 7,16 (1H, д, J=7,8 Гц), 7,21 (1H, д, J=7,8 Гц), 7,25 (1Н, с), 7,26-7,35 (1Н, м), 7,53 (2H, д, J=8,7 Гц), 7,63 (1Н, с), 7,53 (2H, д, J=8,7 Гц), 7,64 (2H, д, J=8,7 Гц), 7,76 (1Н, т, J=7,8 Гц).
ИК (KBr): 2936, 1715, 1672, 1603, 1530, 1472 см-1.
Пример 46
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(3-метокси-6-метил-2-пиридинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
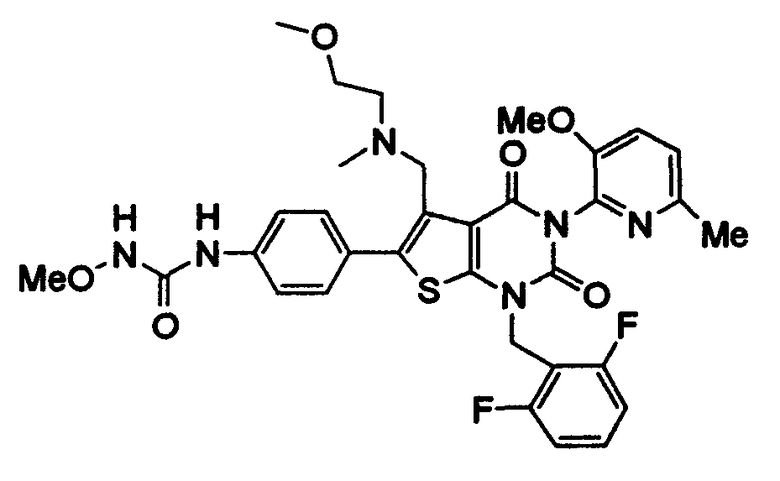
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (455 мг), диэтилцианофосфат (227 мкл), 2-амино-3-метокси-6-метилпиридин (208 мг) и N-этилдиизопропиламин (310 мкл), получают неочищенный амид (130 мг). Кроме того, по аналогичной реакции, используя метанол (8,5 мл), 28% раствор метоксида натрия в метаноле (666 мг), получают указанное в заголовке соединение(107 мг).
Элементный анализ для C33H34N6O6SF2·0,5H2O:
Вычислено: С, 57,47; H, 5,11; N, 12,18.
Найдено: C, 57,54; H, 5,03; N, 12,26.
1H-ЯМР (CDCl3) δ: 2,13 (3H, с), 2,51 (3H, с), 2,62 (2H, т, J=5,9 Гц), 3,26 (3H, с), 3,40 (2H, т, J=5,9 Гц), 3,77 (1Н, д, J=12,3 Гц), 3,77 (3H, с), 3,79 (3H, с), 3,86 (1Н, д, J=12,3 Гц), 5,24 (1Н, д, J=15,6 Гц), 5,40 (1Н, д, J=15,6 Гц), 6,90 (2H, т, J=8,1 Гц), 7,19 (1Н, д, J=8,4 Гц), 7,23-7,34 (1H, м), 7,27 (1H, д, J=8,4 Гц), 7,51 (2H, д, J=8,7 Гц), 7,58 (2H, д, J=8,7 Гц), 7,65 (1H, с), 7,69 (1H, с).
ИК (KBr): 2938, 1715, 1674, 1589, 1532, 1470 см-1.
Пример 47
Получение N-(4-(1-(2,6-дифторбензил)-3-(3-гидрокси-6-метил-2-пиридинил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
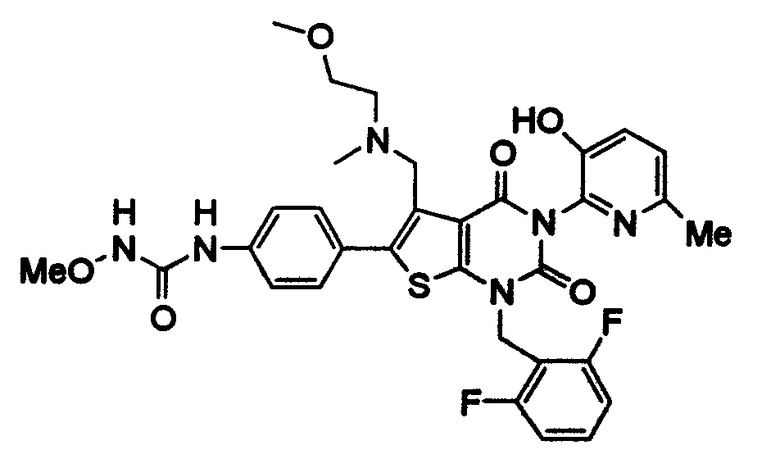
Неочищенный амид (163 мг) получают взаимодействием соединения, полученного в ссылочном примере 7 (455 мг), с гидрохлоридом 1-этил-3-(3-диметиламинопропил)карбодиимида (306 мг), 1-гидроксибензотриазолом (288 мг), 2-амино-3-гидрокси-6-метилпиридином (187 мг) и N-этилдиизопропиламином (517 мкл). Кроме того, из неочищенного амида получают указанное в заголовке соединение (127 мг), используя метанол и 28% раствор метоксида натрия в метаноле (85 мг).
Элементный анализ для C33H34N6O6SF2·H2O:
Вычислено С, 56,13; H, 5,01; N, 12,27.
Найдено: C, 56,03; H, 5,21; N, 12,05.
1H-ЯМР (CDCl3) δ: 2,11 (3H, с), 2,48 (3H, с), 2,51-2,59 (2H, м), 3,20 (3H, с), 3,30-3,46 (4H, м), 3,60 (1H, д, J=12,3 Гц), 3,79 (3H, с), 4,05 (1H, д, J=12,3 Гц), 5,21 (1H, д, J=15,6 Гц), 5,31 (1Н, д, J=15,6 Гц), 6,88 (2H, т, J=8,1 Гц), 7,07 (1H, д, J=8,1 Гц), 7,21-7,31 (2H, м), 7,43-7,51 (4H, м), 7,69(1H, с).
ИК (KBr): 2936, 1715, 1669, 1591, 1530, 1472 см-1.
Пример 48
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(3-метокси-2-пиридинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
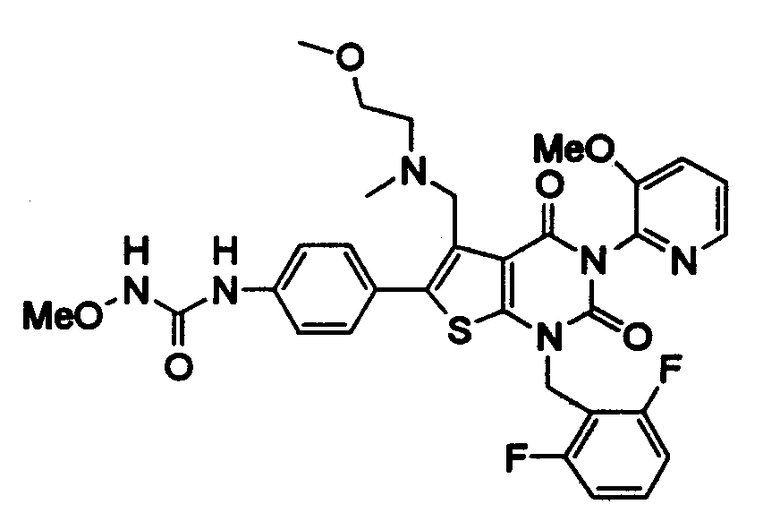
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (455 мг), диэтилцианофосфат (285 мкл), 2-амино-3-метоксипиридин (233 мг) и N-этилдиизопропиламин (388 мкл), получают неочищенный амид (226 мг). Кроме того, по аналогичной реакции, используя метанол (15,5 мл), 28% раствор метоксида натрия в метаноле (120 мг), получают указанное в заголовке соединение (115 мг).
Элементный анализ для C32H32N6O6SF2·0,5H2O:
Вычислено С, 56,88; H, 4,92; N, 12,44.
Найдено: C, 56,88; H, 4,96; N, 12,31.
1H-ЯМР (CDCl3) δ: 2,20 (3H, с), 2,63 (2H, т, J=6,2 Гц), 3,28 (3H, с), 3,41 (2H, т, J=6,2 Гц), 3,78 (1Н, д, J=12,3 Гц), 3,82 (3H, с), 3,84 (3H, с), 3,88 (1H, д, J=12,3 Гц), 5,35 (2H, с), 6,92 (2H, т, J=8,1 Гц), 7,17 (1Н, с), 7,23-7,39 (3H, м), 7,54 (2H, д, J=8,8 Гц), 7,57 (1Н, с), 7,69 (2H, д, J=8,8 Гц), 8,23-8,27 (1Н, м).
ИК(KBr): 1717, 1674, 1590, 1530, 1470 см-1.
Пример 49
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-(1-гидрокси-1-метилэтил)фенил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
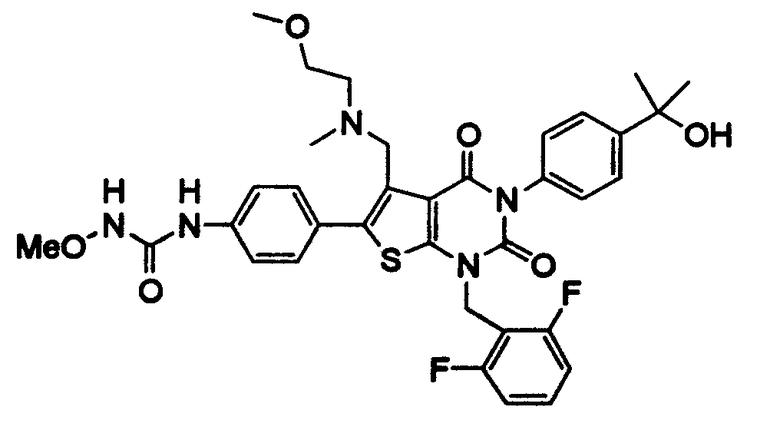
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (1,22 г), диэтилцианофосфат (456 мкл), 4-(1-гидрокси-1-метилэтил)анилин (454 мг) и N-этилдиизопропиламин (569 мкл), получают неочищенный амид (1,12 г). Кроме того, по аналогичной реакции, используя этанол (60 мл), 28% раствор метоксида натрия в метаноле (579 мг), получают указанное в заголовке соединение (849 мг).
Элементный анализ для C35H37N5O6SF2·0,5H2O:
Вычислено С, 59,82; H, 5,45; N, 9,97.
Найдено: C, 60,09; H, 5,40; N, 10,06.
1H-ЯМР (CDCl3) δ: 1,60 (6H, с), 1,79 (1H, с), 2,14 (3H, с), 2,63 (2H, т, J=5,9 Гц), 3,27 (3H, с), 3,41 (2H, т, J=5,9 Гц), 3,81 (3H, с), 3,82 (2H, с), 5,36 (2H, с), 6,92 (2H, т, J=8,3 Гц), 7,20-7,34 (4H, м), 7,53 (2H, д, J=8,7 Гц), 7,60-7,63 (5H, м).
ИК (KBr): 1713, 1669, 1590, 1532, 1470 см-1.
Пример 50
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(4-(1-гидрокси-1-метилэтил)фенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
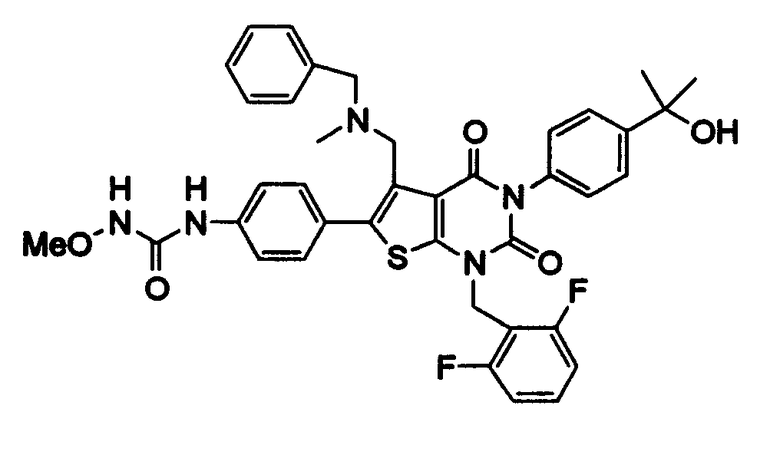
По реакции, аналогично описанной в примере 40, используя 4-(N-бензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоновую кислоту (470 мг), диэтилцианофосфат (167 мкл), 4-(1-гидрокси-1-метилэтил)анилин (166 мг) и N-этилдиизопропиламин (209 мкл), получают неочищенный амид (422 мг). Кроме того, по аналогичной реакции, используя этанол (25,5 мл) и этоксид натрия (70 мг), получают указанное в заголовке соединение (113 мг).
Элементный анализ для C39H37N5O5SF2:
Вычислено С, 64,54; H, 5,14; N, 9,65.
Найдено: C, 64,46; H, 5,05; N, 9,70.
1H-ЯМР (CDCl3) δ: 1,62 (6H, с), 1,77 (1H, с), 2,05 (3H, с), 3,56 (2H, с), 3,82 (3H, с), 3,90 (2H, с), 5,36 (2H, с), 6,91 (2H, т, J=8,1 Гц), 7,14-7,38 (9H, м), 7,55 (2H, д, J=9,0 Гц), 7,62 (1Н, с), 7,64 (2H, д, J=8,7 Гц), 7,72 (2H, д, J=8,4 Гц).
ИК(KBr): 1713, 1669, 1590, 1530, 1470 см-1.
Пример 51
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(4-(1-метокси-1-метилэтил)фенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
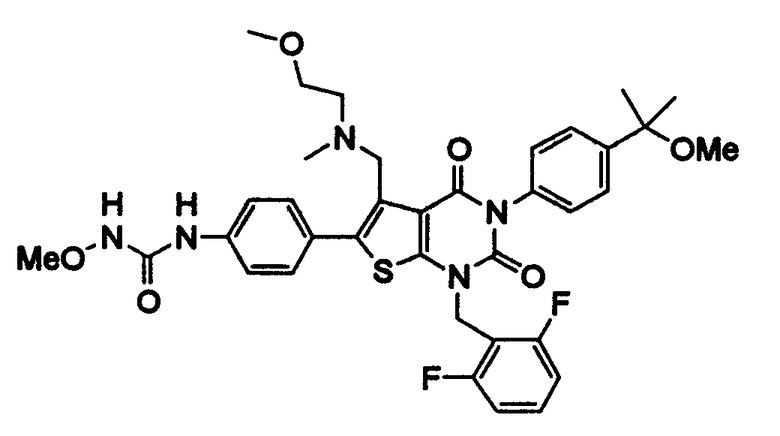
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (364 мг), диэтилцианофосфат (136 мкл), 4-(1-метокси-1-метилэтил)анилин (149 мг) и N-этилдиизопропиламин (171 мкл), получают неочищенный амид (292 мг). Кроме того, по аналогичной реакции, используя этанол (19 мл), и 28% раствор метоксида натрия (146 мг) в метаноле, получают указанное в заголовке соединение (146 мг).
Элементный анализ для C36H39N5O6SF2:
Вычислено С, 61,09; H, 5,55; N, 9,89.
Найдено: C, 60,97; H, 5,54; N, 9,92.
1H-ЯМР (CDCl3) δ: 1,55 (6H, с), 2,15 (3H, с), 2,64 (2H, т, J=5,9 Гц), 3,11 (3H, с), 3,27 (3H, с), 3,41 (2H, т, J=5,9 Гц), 3,82 (3H, с), 3,83 (2H, с), 5,36 (2H, с), 6,92 (2H, т, J=8,3 Гц), 7,16 (1H, с), 7,24-7,36 (4H, м), 7,51-7,63 (6H, м).
ИК (KBr): 1715, 1674, 1590, 1532, 1464, 1327 см-1.
Пример 52
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(1-метил-1H-имидазол-2-ил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
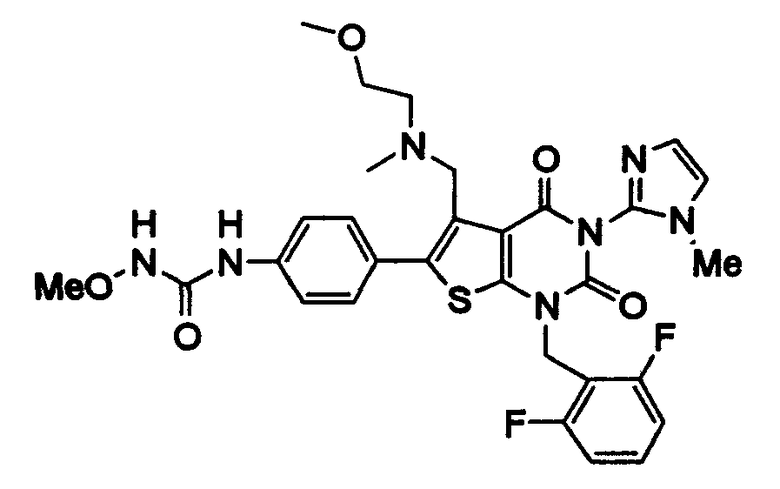
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (455 мг), диэтилцианофосфат (228 мкл), гидрохлорид 2-амино-1-метил-1H-имидазола (214 мг) и N-этилдиизопропиламин (586 мкл), получают неочищенный амид (48 мг). Кроме того, по аналогичной реакции, используя метанол (3,3 мл) и 28% раствор метоксида натрия в метаноле (25 мг), получают указанное в заголовке соединение (17 мг).
1H-ЯМР (CDCl3) δ: 2,15 (3H, с), 2,61 (2H, дт, J=1,8 Гц, 6,90 Гц), 3,27 (3H, с), 3,40 (2H, дт, J=1,8 Гц, 6,0 Гц), 3,53 (3H, с), 3,75 (1Н, д, J=12,3 Гц), 3,80 (3H, с), 3,81 (1H, д, J=12,3 Гц), 5,12 (1H, д, J=15,9 Гц), 5,57 (1H, д, J=15,9 Гц), 6,91 (2H, т, J=8,1 Гц), 6,99 (1H, д, J=1,5 Гц), 7,14 (1H, д, J=1,5 Гц), 7,28 (1H, с), 7,25-7,34 (1H, м), 7,53 (2H, д, J=9,0 Гц), 7,60 (2H, д, J=9,0 Гц), 7,70 (1Н, с).
ИК (KBr): 1725, 1682, 1590, 1530, 1470 см-1.
Пример 53
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(3-метилбутил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
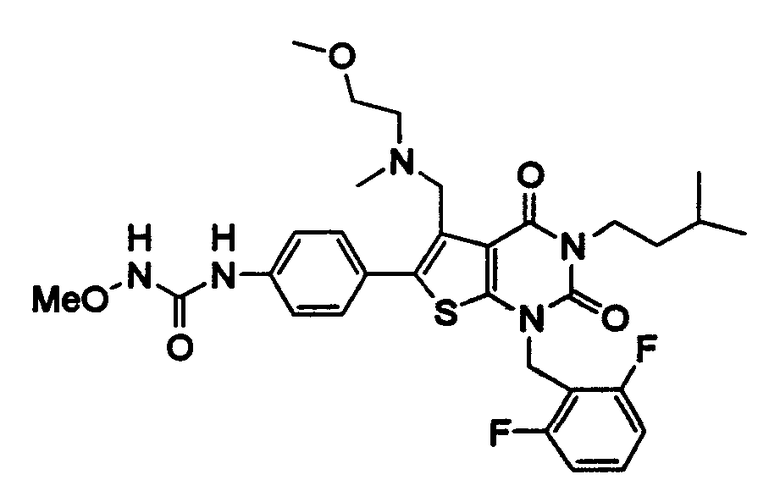
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере7 (455 мг), диэтилцианофосфат (228 мкл), изоамиламин (139 мг) и N-этилдиизопропиламин (310 мкл), получают неочищенный амид (102 мг). Кроме того, перемешиванием с метанолом (7 мл), 28% раствором метоксида натрия в метаноле (55 мг) при 55°C в течение 20 часов и аналогичной обработкой получают указанное в заголовке соединение (80 мг).
Элементный анализ для C31H37N5O5SF2:
Вычислено С, 59,13; H, 5,92; N, 11,12.
Найдено: C, 58,97; H, 5,99; N, 10,90.
1H-ЯМР (CDCl3) δ: 0,98 (6H, д, J=6,3 Гц), 1,52-1,58 (2H, м), 1,64-1,71 (1H, м), 2,14 (3H, с), 2,66 (2H, т, J=5,9 Гц), 3,30 (3H, с), 3,45 (2H, т, J=5,9 Гц), 3,81 (3H, с), 3,85 (2H, с), 4,04-4,09 (2H, м), 5,33 (2H, с), 6,90 (2H, т, J=8,3 Гц), 7,17 (1Н, с), 7,24-7,35 (1Н, м), 7,51 (2H, д, J=8,7 Гц), 7,57 (2H, д, J=8,7 Гц), 7,60 (1Н, с).
ИК (KBr): 2959, 1705, 1659, 1590, 1531, 1472 см-1.
Пример 54
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-метоксиэтил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
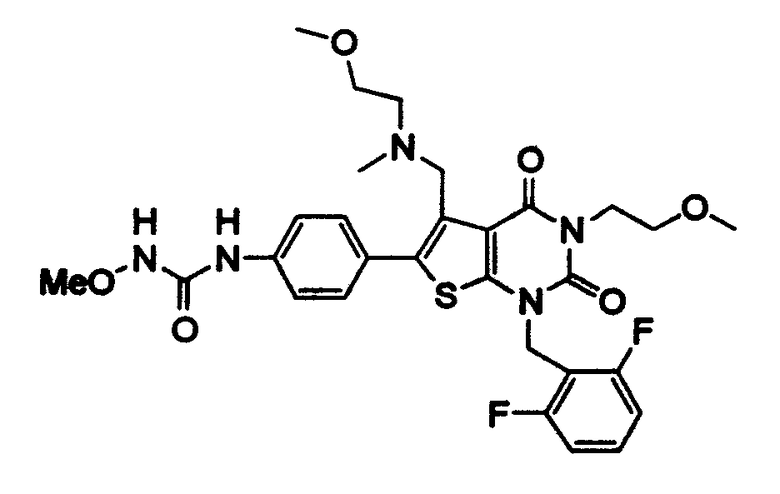
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (455 мг), диэтилцианофосфат (228 мкл), 2-метоксиэтиламин (120 мг) и N-этилдиизопропиламин (310 мкл), получают неочищенный амид (266 мг). Кроме того, по аналогичной реакции, используя метанол (19,6 мл), и 28% раствор метоксида натрия в метаноле (152 мг), получают указанное в заголовке соединение (140 мг).
Элементный анализ для C29H33N5O6SF2:
Вычислено С, 56,39; H, 5,39; N, 11,34.
Найдено: C, 56,40; H, 5,35; N, 11,15.
1H-ЯМР (CDCl3) δ: 2,14 (3H, с), 2,65 (2H, т, J=5,9 Гц), 3,30 (3H, с), 3,36 (3H, с), 3,45 (2H, т, J=5,9 Гц), 3,66 (2H, т, J=5,9 Гц), 3,81 (3H, с), 3,84 (2H, с), 4,30 (2H, т, J=5,9 Гц), 5,33 (2H, с), 6,90 (2H, т, J=8,3 Гц), 7,15 (1H, с), 7,24-7,34 (1H, м), 7,51 (2H, д, J=9,0 Гц), 7,56 (2H, д, J=9,0 Гц), 7,60 (1H, м).
ИК (KBr): 2936, 1705, 1663, 1590, 1532, 1472 см-1.
Пример 55
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-этоксиэтил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
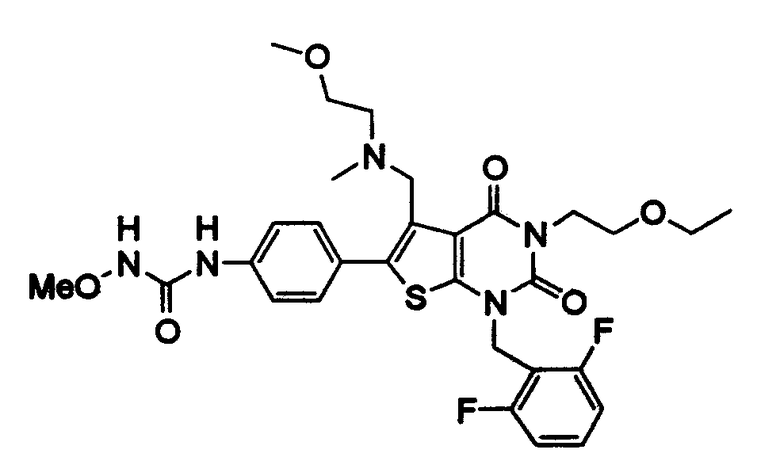
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (455 мг), диэтилцианофосфат (228 мкл), 2-этоксиэтиламин (143 мг) и N-этилдиизопропиламин (310 мкл), получают неочищенный амид (259 мг). Кроме того, по аналогичной реакции, используя метанол (18,7 мл) и 28% раствор метоксида натрия в метаноле (144 мг), получают указанное в заголовке соединение (193 мг).
Элементный анализ для C30H35N5O6SF2:
Вычислено С, 57,04; H, 5,58; N, 11,09.
Найдено: C, 57,01; H, 5,66; N, 10,93.
1H-ЯМР (CDCl3) δ: 1,15 (3H, т, J=6,9 Гц), 2,14 (3H, с), 2,66 (2H, т, J=6,0 Гц), 3,30 (3H, с), 3,45 (2H, т, J=6,0 Гц), 3,54 (2H, кв, J=6,9 Гц), 3,69 (2H, т, J=6,0 Гц), 3,81 (3H, с), 3,84 (2H, с), 4,29 (2H, т, J=6,0 Гц), 5,32 (2H, с), 6,89 (2H, т, J=8,1 Гц), 7,17 (1Н, с), 7,23-7,34 (1Н, м), 7,52 (2H, д, J=8,7 Гц), 7,57 (2H, д, J=8,7 Гц), 7,60 (1Н, м).
ИК (KBr): 2975, 1705, 1663, 1590, 1532, 1472 см-1.
Пример 56
Получение N-(4-(1-(2,6-дифторбензил)-3-изопропил-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
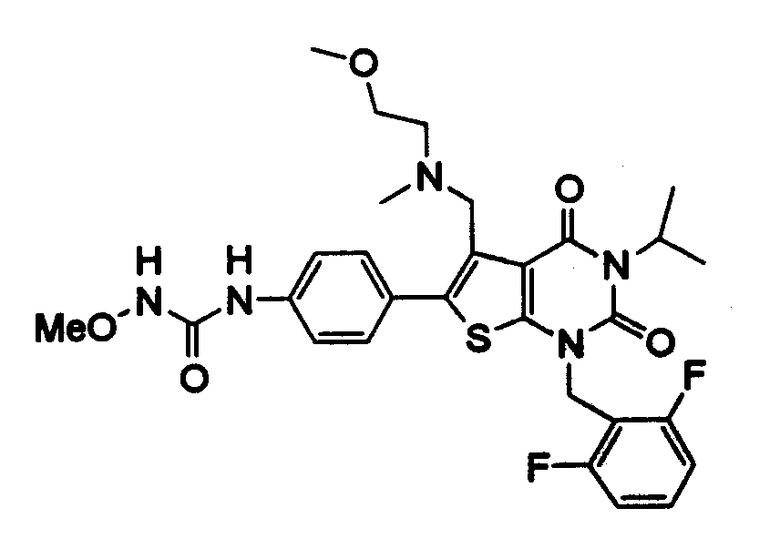
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (455 мг), диэтилцианофосфат (228 мкл), изопропиламин (95 мг) и N-этилдиизопропиламин (310 мкл), получают неочищенный амид (306 мг). Кроме того, перемешивание с метанолом (23,2 мл) и 28% раствором метоксида в метаноле (179 мг) при 60°C в течение 17 часов и аналогичная обработка дают указанное в заголовке соединение (192 мг).
Элементный анализ для C29H33N5O5SF2:
Вычислено С, 57,89; H, 5,53; N, 11,64.
Найдено: C, 57,98; H, 5,49; N, 11,72.
1H-ЯМР (CDCl3) δ: 1,52 (6H, д, J=6,9 Гц), 2,13 (3H, с), 2,66 (2H, т, J=5,9 Гц), 3,31 (3H, с), 3,46 (2H, т, J=5,9 Гц), 3,82 (3H, с), 3,84 (2H, с), 5,31 (2H, с), 5,34 (1Н, м), 6,90 (2H, т, J=8,1 Гц), 7,16 (1Н, с), 7,24-7,35 (1H, м), 7,52 (2H, д, J=8,4 Гц), 7,55 (2H, д, J=8,4 Гц), 7,60 (1Н, м).
ИК (KBr): 2973, 1703, 1659, 1590, 1534, 1472 см-1.
Пример 57
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(6-метокси-3-пиридазинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
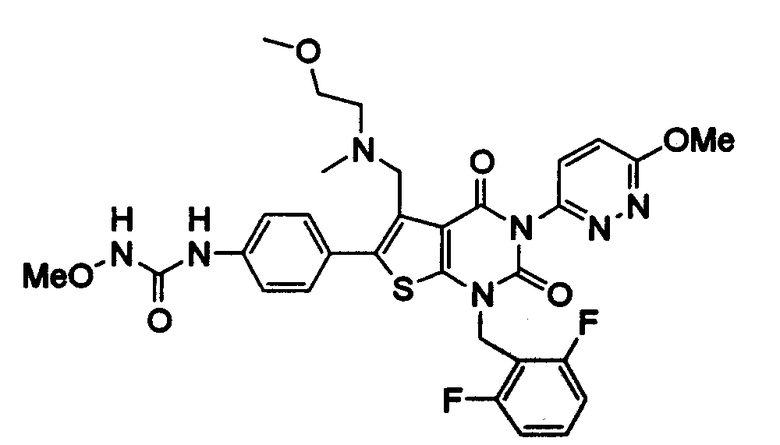
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (455 мг), диэтилцианофосфат (285 мкл), 3-амино-6-хлорпиридин (243 мг) и N-этилдиизопропиламин (388 мкл), получают неочищенный амид (207 мг). Кроме того, по аналогичной реакции, используя метанол (14,2 мл), и 28% раствор метоксида натрия в метаноле (109 мг), получают указанное в заголовке соединение (132 мг).
1Н-ЯМР (CDCl3) δ: 2,13 (3Н, с), 2,62 (2Н, т, J=5,7 Гц), 3,26 (3Н, с), 3,41 (2Н, т, J=5,7 Гц), 3,74 (2Н, уш.с), 3,82 (3Н, с), 4,18 (3Н, с), 5,32 (2Н, уш.с), 6,92 (2Н, т, J=8,3 Гц), 7,12 (1H, д, J=9,3 Гц), 7,24 (1Н, с), 7,29-7,35 (1Н, м), 7,41 (2Н, д, J=9,3 Гц), 7,54 (2Н, д, J=9,0 Гц), 7,59 (2Н, д, J=8,7 Гц), 7,66 (1Н, с).
ИК (KBr): 2936, 1717, 1674, 1591, 1530, 1460 см-1.
Пример 58
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(3-пиридазинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
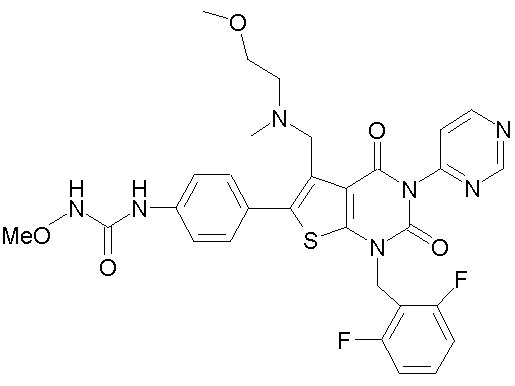
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (364 мг), диэтилцианофосфат (182 мкл), гидрохлорид 3-аминопиридазина (158 мг) и N-этилдиизопропиламин (414 мкл), получают неочищенный амид (55 мг). Кроме того, по аналогичной реакции, используя метанол (4 мл) и 28% раствор метоксида натрия в метаноле (30 мг), получают указанное в заголовке соединение (15 мг).
1H-ЯМР (CDCl3) δ: 2,12 (3H, с), 2,61 (2H, т, J=5,7 Гц), 3,26 (3H, с), 3,39 (2H, т, J=5,7 Гц), 3,78 (2H, уш.с), 3,82 (3H, с), 5,34 (2H, уш.с), 6,93 (2H, т, J=8,1 Гц), 7,26 (1H, с), 7,29-7,37 (1Н, м), 7,53-7,61 (5H, м), 7,67 (1Н, с), 7,69 (1H, дд, J=4,8 Гц, 8,4 Гц), 9,28 (1Н, дд, J=1,8 Гц, 4,8 Гц).
ИК (KBr): 2936, 1717, 1674, 1590, 1530, 1470 см-1.
Пример 59
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-метокси-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (607 мг), диэтилцианофосфат (304 мкл), гидрохлорид o-метилгидроксиламина (334 мг) и N-этилдиизопропиламин (1,04 мл), получают неочищенный продукт, который очищают колоночной хроматографией на аминопропилсиликагеле (Fuji Silysia Chemical), получая указанное в заголовке соединение (283 мг).
1H-ЯМР (CDCl3) δ: 2,14 (3H, с), 2,68 (2H, т, J=6,0 Гц), 3,31 (3H, с), 3,47 (2H, т, J=6,0 Гц), 3,82 (3H, с), 3,83 (2H, с), 4,06 (3H, с), 5,35 (2H, с), 6,92 (2H, т, J=8,3 Гц), 7,20 (1Н, с), 7,29-7,35 (1Н, м), 7,55 (4H, с), 7,63 (1H, с).
ИК (KBr): 1725, 1684, 1590, 1530, 1472 см-1.
Пример 60
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-метил-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
По реакции, аналогично описанной в примере 40, используя соединение, полученное в ссылочном примере 7 (607 мг), диэтилцианофосфат (304 мкл), гидрохлорид метиламина (270 мг) и N-этилдиизопропиламин (1,04 мл), получают неочищенный амид (133 мг). Кроме того, перемешивание с метанолом (9,1 мл) и 28% раствором метоксида натрия в метаноле (70 мг) при 60°C в течение 17 часов и аналогичная обработка дают указанное в заголовке соединение (83 мг).
1H-ЯМР (CDCl3) δ: 2,13 (3H, с), 2,66 (2H, т, J=5,9 Гц), 3,31 (3H, с), 3,45 (3H, с), 3,48 (2H, т, J=5,9 Гц), 3,82 (3H, с), 3,84 (2H, с), 5,33 (2H, с), 6,91 (2H, т, J=8,3 Гц), 7,17 (1Н, с), 7,25-7,35 (1Н, м), 7,55 (4H, с), 7,62 (1H, с).
ИК (KBr): 1705, 1661, 1590, 1532, 1472 см-1.
Ссылочный пример18
Получение N-(4-(5-хлорметил-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
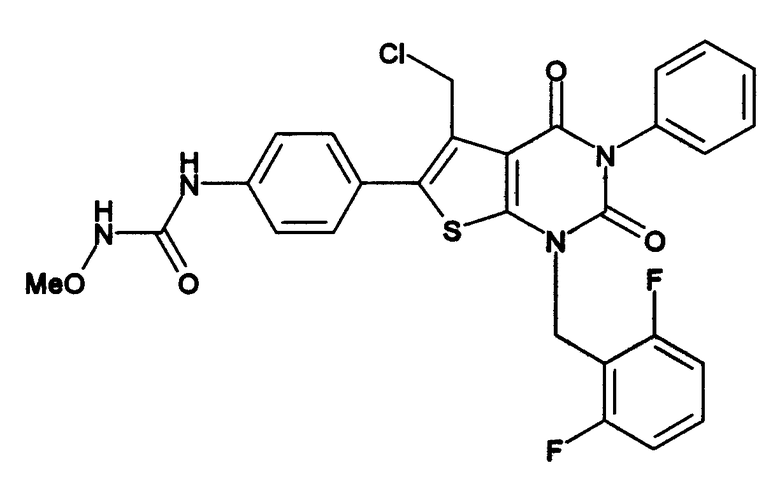
К раствору N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (7,7 г, 11,53 ммоль) в ТГФ (200 мл), который охлаждают на бане сухой лед - ацетон, добавляют α-хлорэтилхлорформиат (1,7 мл, 11,64 ммоль). Температуру смеси повышают до комнатной и смесь перемешивают в течение 2,5 часов. Реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия и экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюент: этилацетат/хлороформ, 1/4-1/3) и перекристаллизовывают из смеси хлороформ/диэтиловый эфир, получая указанное в заголовке соединение (5,66 г, 84%) в виде белых кристаллов.
1H ЯМР (CDCl3) δ: 3,83 (3H, с), 4,84 (2H, с), 5,27 (2H, с), 5,37 (2H, с), 6,92 (2H, т, J=7,8 Гц), 7,23-7,35 (4H, м), 7,41-7,66 (8Н, м).
Ссылочный пример 19
Получение N-(4-(5-хлорметил-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(4-метоксифенил)тиено[2,3-d]пиримидин-6-ил) фенил)-N'-метоксимочевины
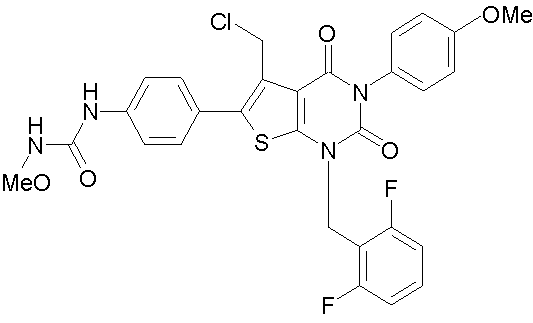
По реакции, аналогично описанной в примере 5, используя 4-(N-бензил-N-метиламинометил)-2-(N-(2,6-дифторбензил)-N-этоксикарбониламино)-5-(4-(3-метоксиуреидо)фенил)тиофен-3-карбоновую кислоту (5,0 г, 7,83 ммоль) и п-анизидин (1,93 г, 15,65 ммоль), получают N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(4-метоксифенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевину (3,39 г, 62%) в виде белого твердого вещества. Используя данное соединение (80 мг, 0,11 ммоль) по реакции, аналогично описанной в ссылочном примере 18, получают указанное в заголовке соединение(50 мг, 74%) в виде белых кристаллов.
1Н ЯМР (CDCl3) δ: 3,81 (3Н, с), 3,83 (3Н, с), 4,83 (2Н, с), 5,35 (2Н, с), 6,92 (2Н, т, J=8,1 Гц), 7,00 (2Н, д, J=10,2 Гц), 7,18-7,35 (3Н, м), 7,48-7,65 (5Н, м).
Ссылочный пример 20
Получение N-(4-(5-хлорметил-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(4-гидроксициклогексил)тиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
По реакции, аналогично описанной в примере 5, используя 4-(N-бензил-N-метиламинометил)-2-(N-(2,6-дифторбензил)-N-этоксикарбониламино)-5-(4-(3-метоксиуреидо)фенил)тиофен-3-карбоновую кислоту (10,0 г, 15,65 ммоль) и 4-аминоциклогексанол (3,61 г, 31,30 ммоль), получают N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(4-гидроксициклогексил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевину (5,20 г, 48%) в виде белых кристаллов. Используя данное соединение (500 мг, 0,72 ммоль) по реакции, аналогично описанной в ссылочном примере 18, получают указанное в заголовке соединение (180 мг, 41%) в виде белых кристаллов.
1Н-ЯМР (CDCl3) δ: 1,41-1,55 (2Н, м), 1,71 (2Н, д, J=11,7 Гц), 2,07 (2Н, д, J=12,4 Гц), 2,63 (2Н, кв, J=11,1 Гц), 3,70-3,82 (4Н, м), 4,84 (2Н, с), 4,90-5,06 (1Н, м), 5,29 (2Н, с), 6,91 (2Н, т, J=8,1 Гц), 7,13 (1Н, с), 7,25-7,33 (1Н, м), 7,47 ((2H, д, J=8,4 Гц), 7,58 (2Н, д, J=9,0 Гц), 7,63 (1Н, с).
Ссылочный пример 21
Получение N-(4-(5-хлорметил-1-(2,6-дифторбензил)-3-(5-фторпиридин-2-ил)-1,2,3,4-тетрагидро-2,4-диоксотиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
По реакции, аналогично описанной в примере 5, используя 4-(N-бензил-N-метиламинометил)-2-(N-(2,6-дифторбензил)-N-этоксикарбониламино)-5-(4-(3-метоксиуреидо)фенил)тиофен-3-карбоновую кислоту (10,0 г, 15,65 ммоль) и 2-амино-5-фторпиридин (3,51 г, 31,30 ммоль), получают N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(5-фторпиридин-2-ил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N' метоксимочевину (3,39 г, 32%) в виде белого твердого вещества. Используя данное соединение (1,0 г, 1,46 ммоль) по реакции, аналогично описанной в ссылочном примере 18, получают указанное в заголовке соединение (560 мг, 64%) в виде белого твердого вещества.
1H ЯМР (CDCl3) δ: 3,83 (1Н, с), 4,79 (2Н, уш.), 5,34 (2Н, уш.), 6,93 (2Н, т, J=8,0 Гц), 7,14 (1Н, с), 7,29-7,40 (2Н, м), 7,50-7,65 (5Н, м), 8,51 (1Н, д, J=3,0 Гц).
Ссылочный пример 22
Получение N-(4- (5-хлорметил-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(пиридин-2-ил)тиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
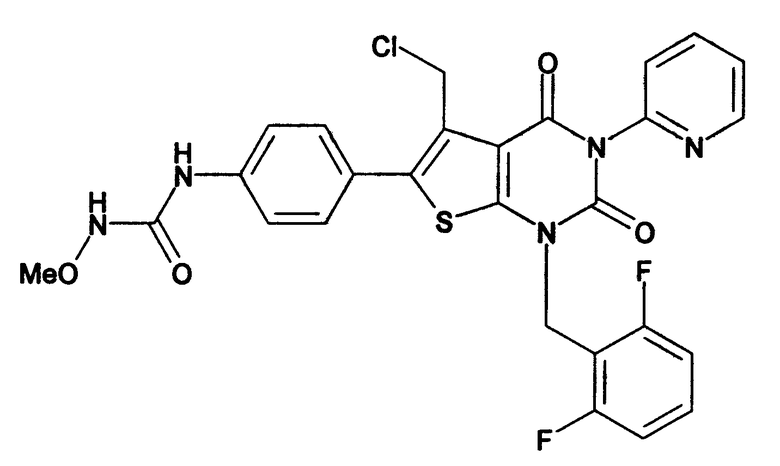
По реакции, аналогично описанной в ссылочном примере 18, используя соединение (500 мг, 0,75 ммоль), полученное в примере 1, получают указанное в заголовке соединение (270 мг, 62%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 3,63 (3H, с), 4,85 (2H, с), 5,10-5,24 (2H, уш.), 7,13 (2H, т, J=8,3 Гц), 7,41-7,54 (4H, м), 7,78 (2H, д, J=8,4 Гц), 8,01 (1Н, т, J=8,0 Гц), 8,30 (1H, с), 8,59-8,61 (1Н, м), 9,14 (1Н, с), 9,66 (1Н, с).
Ссылочный пример 23
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-гидроксициклогексил)-5-(метиламино)метил-1,2,3,4-тетрагидро-2,4-диоксотиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
По реакции, аналогично описанной в ссылочном примере 14, используя N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(4-гидроксициклогексил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевину (5,20 г, 48%), полученную в ссылочном примере 20, получают указанное в заголовке соединение (5,20 г, 48%) в виде белых кристаллов.
1Н-ЯМР (CDCl3) δ: 3,63 (3Н, с), 4,85 (2Н, с), 5,10-5,24 (2Н, уш.), 7,13 (2Н, т, J=8,3 Гц), 7,41-7,54 (4Н, м), 7,78 (2Н, д, J=8,4 Гц), 8,01 (1Н, т, J=8,0 Гц), 8,30 (1Н, с), 8,59-8,61 (1Н, м), 9,14 (1Н, с), 9,66 (1Н, с).
Ссылочный пример 24
Получение N-(2-метокси-1-метилэтил)-N-метиламина
Смесь раствора метоксиацетона (2,92 г, 33,14 ммоль) и метиламина в 2,0 М ТГФ (100 мл, 200,0 ммоль) и раствор уксусной кислоты (0,5 мл) в ТГФ (100 мл) перемешивают при охлаждении льдом в течение 30 минут. К смеси добавляют триацетоксинатрийборгидрид (14,05 г, 66,28 ммоль) и смесь перемешивают при комнатной температуре в течение 4 дней. К реакционной смеси добавляют последовательно насыщенный водный раствор бикарбоната натрия (100 мл), этилацетат (100 мл) и бензилоксикарбонилхлорид (8,48 г, 49,71 ммоль) и смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь распределяют между насыщенным водным раствором бикарбоната натрия и этилацетатом. Слой этилацетата промывают насыщенным водным раствором соли, сушат над сульфатом магния и отгоняют растворитель. Остаток очищают хроматографией на силикагеле (элюент: смесь этилацетат/гексан, 6/1-4/1) и получают бесцветную жидкость (4,24 г, 54%). Смесь бесцветной жидкости (0,94 г, 3,96 ммоль) и 10% палладия на угле (94 мг) в этаноле (10 мл) перемешивают при комнатной температуре в атмосфере водорода в течение 2 часов и фильтруют. Фильтрат упаривают при пониженном давлении и получают указанное в заголовке соединение (220 мг, 54%) в виде светло-желтой жидкости.
1H ЯМР (CDCl3) δ: 1,15 (3H, д, J=6,6 Гц), 2,50 (3H, с), 2,90-2,99 (1H, м), 3,29-3,44 (5H, м).
Ссылочный пример 25
Получение гидрохлорида N-(4-(5-метиламинометил-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(4-метоксифенил)тиено[2,3-d]-пиримидин-6-ил)фенил)-N'-метоксимочевины
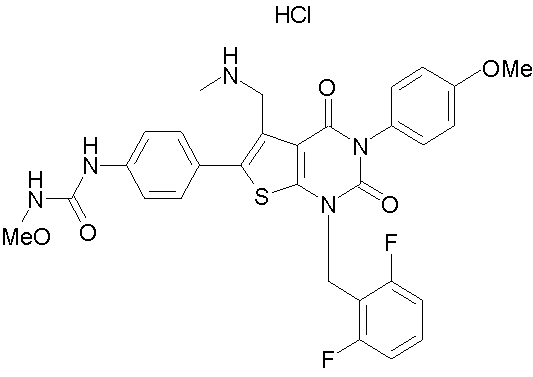
Смесь N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(4-метоксифенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины (2,0 г, 2,87 ммоль), синтезированной в ссылочном примере 19, 10% - палладия на угле (200 мг) и 1N хлористоводородной кислоты (3 мл) в этаноле (40 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 72 часов. Реакционную смесь фильтруют, фильтрат упаривают досуха и получают указанное в заголовке соединение (1,77 г, 96%) в виде белого порошка.
1Н-ЯМР (CDCl3) δ: 2,73 (3Н, с), 3,80 (3Н, с), 3,85 (3Н, с), 4,00-4,18 (2Н, уш.), 5,35 (2Н, с), 5,37 (2Н, с), 6,90-7,08 (4Н, м), 7,20-7,38 (5Н, м), 7,61 (4Н, с), 7,77 (1Н, с), 7,95 (1Н, с).
Ссылочный пример 26
Получение N-(4-(5-(((1R)-1-фенилэтил(метил)амино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
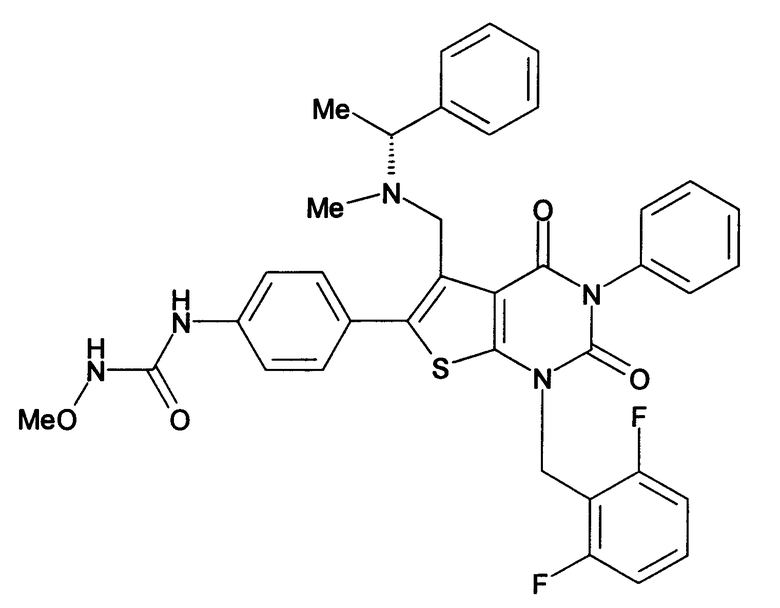
Раствор соединения, полученного в ссылочном примере 18 (100 мг, 0,17 ммоль), (R)-(+)-N-α-диметилбензиламина (28 мг, 0,21 ммоль) и N-этилдиизопропиламина (29 мг, 0,22 ммоль) в ДМФА (200 мл) перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором соли, сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюент: от этилацетат/хлороформ (2/3) до хлороформ/метанол (20/1)), перекристаллизовывают из смеси хлороформ/диэтиловый эфир и получают указанное в заголовке соединение (58 мг, 50%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 1,25 (3H, д, J=6,6 Гц), 1,89 (3H, с), 3,82 (3H, с), 3,82-3,87 (1H, м), 3,91 (2H, д, J=4,5 Гц), 5,35 (2H, с), 6,91 (2H, т, J=8,3 Гц), 7,14-7,30 (9H, м), 7,43-7,61 (8H, м).
Т.пл. 192-193°С.
Ссылочный пример 27
Получение N-(4-(5-((метил((1S)-1-фенилэтил)амино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
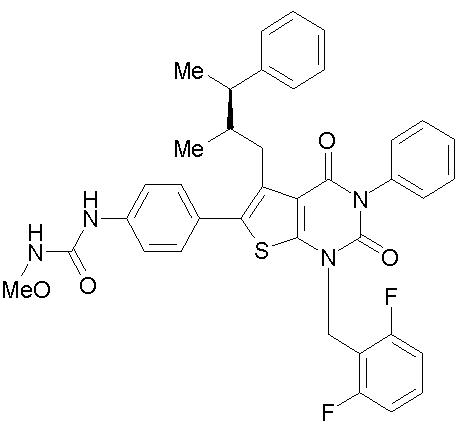
По реакции, аналогично описанной в ссылочном примере 26, используя соединение, полученное в ссылочном примере 18 (100 мг, 0,17 ммоль), и (S)-(-)-N-α-диметилбензиламин (2 8 мг, 0,21 ммоль), получают указанное в заголовке соединение (61 мг, 53%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 1,25 (3Н, д, J=6,6 Гц), 1,89 (3Н, с), 3,82 (3Н, с), 3,82-3,90 (1Н, м), 3,91 (2Н, д, J=4,5 Гц), 5,35 (2Н, с), 6,91 (2Н, т, J=8,0 Гц), 7,19-7,30 (9Н, м), 7,43-7,61 (8Н, м).
Т.пл. 191-192°С.
Ссылочный пример 28
Получение N-(4-(5-(((1R)-1-фенилэтиламино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
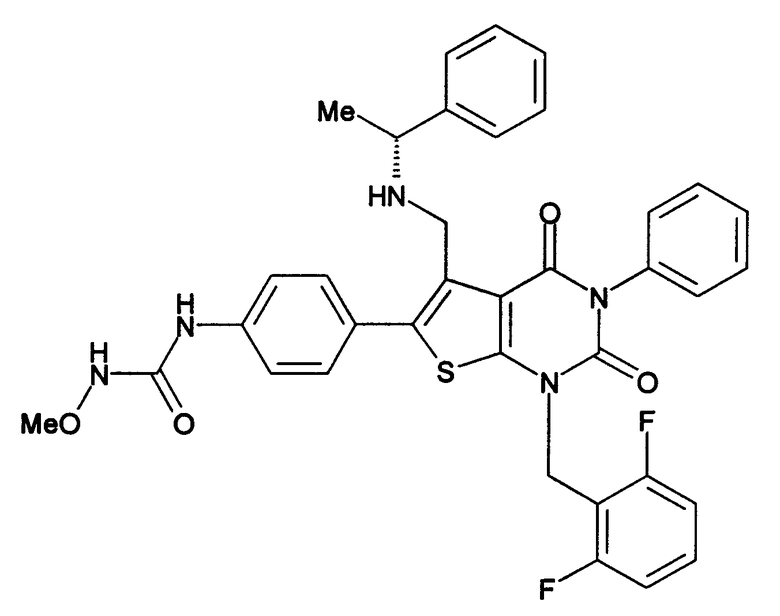
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (100 мг, 0,17 ммоль), полученное в Ссылочном примере 18, и (R)-(+)-1-фенилэтиламин (25 мг, 0,21 ммоль), получают указанное в заголовке соединение (56 мг, 49%) в виде белых кристаллов.
1H ЯМР (CDCl3) δ: 1,32 (3H, д, J=6,6 Гц), 3,59 (1H, д, J=12,0 Гц), 3,65-3,82 (5H, м), 5,25-5,46 (2H, AB), 6,90 (2H, т, J=8,1 Гц), 7,11-7,59 (13H, м).
Элементный анализ для C36H31F2N5O4S·0,2H2O:
Вычислено С, 64,41; H, 4,71; N, 10,43.
Найдено: C, 64,29; H, 4,64; N, 10,46.
Т.пл. 180-182°C.
Ссылочный пример 29
Получение N-(4-(5-(((1S)-1-фенилэтиламино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
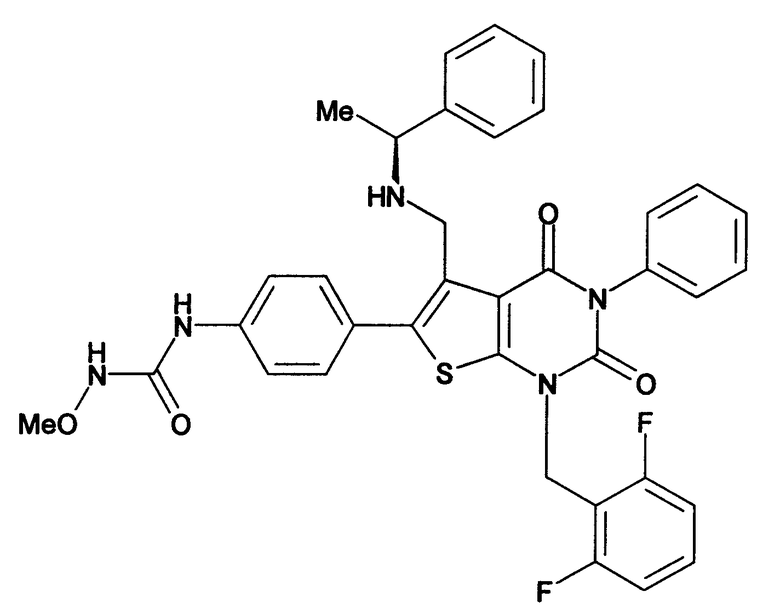
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (100 мг, 0,17 ммоль), полученное в ссылочном примере 18, и (S)-(-)-1-фенилэтиламин (25 мг, 0,21 ммоль), получают указанное в заголовке соединение (56 мг, 49%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 1,31 (3H, д, J=6,6 Гц), 3,58 (1H, д, J=12,3 Гц), 3,72-3,82 (5H, м), 5,24-5,46 (2H, AB), 6,90 (2H, т, J=8,1 Гц), 7,12 (1Н, с), 7,16-7,37 (8H, м), 7,43-7,56 (4H, м).
Элементный анализ для C36H31F2N5O4S:
Вычислено С, 64,76; H, 4,68; N, 10,49.
Найдено: C, 64,46; H, 4,57; N, 10,60.
Т.пл. 182-185°C.
Ссылочный пример 30
Получение N-(4-(5-((метил(1-фенилпропил)амино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
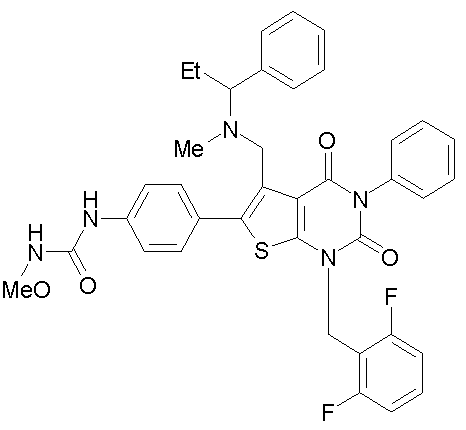
К раствору 1-фенил-1-пропанола (1,0 г, 7,34 ммоль) и N-этилдиизопропиламина (1,42 г, 11,01 ммоль) в дихлорметане (10 мл) при охлаждении льдом добавляют метансульфонилхлорид (690 мкл, 8,81 ммоль) и смесь перемешивают при комнатной температуре в течение 5 часов. Реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия и экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором соли, сушат над сульфатом магния и отгоняют растворитель при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюент: этилацетат/гексан, 5/1) и получают 1-хлор-1-фенилпропан (610 мг, 54%) в виде светло-желтой жидкости.
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (100 мг, 0,17 ммоль), полученное в ссылочном примере 15, и синтезированный 1-хлор-1-фенилпропан (32 мг, 0,21 ммоль), получают указанное в заголовке соединение (45 мг, 38%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 0,67 (3H, т, J=7,2 Гц), 1,63-1,91 (5H, м), 3,52-3,57 (1H, м), 3,73-3,93 (5H, м), 3,91 (2H, д, J=4,5 Гц), 5,35 (2H, с), 6,91 (2H, т, J=8,1 Гц), 7,08-7,34 (8H, м), 7,41-7,55 (8H, м), 7,64 (1Н, с).
Т.пл. 171-172°C.
Ссылочный пример 31
Получение метил(((1-(2,6-дифторбензил)-6-(4-(((метоксиамино)карбонил)амино)фенил)-2,4-диоксо-3-фенил-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-5-ил)метил)(метил)амино)(фенил)уксусной кислоты
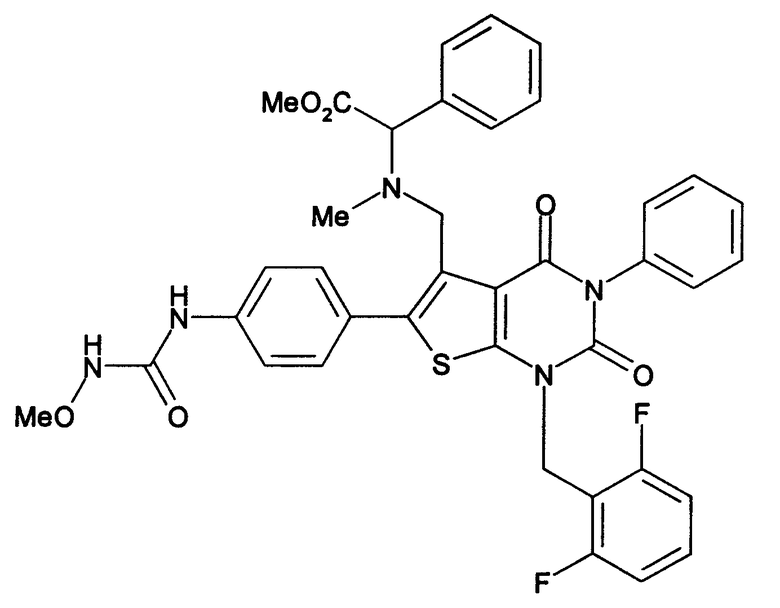
По реакции, аналогично описанной в примере 20, используя соединение(150 мг, 0,17 ммоль), полученное в ссылочном примере 15, и α-бромфенилметилацетат (71 мг, 0,31 ммоль), получают указанное в заголовке соединение(73 мг, 39%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 2,08 (3H, с), 3,54 (32H, с), 3,79 (3H, с), 3,89-4,20 (2H, AB), 4,67 (1H, с), 5,35 (2H, уш.с), 6,92 (2H, т, J=8,2 Гц), 7,22-7,37 (6H, м), 7,44-7,56 (7H, м), 7,71 (2H, д, J=8,0 Гц).
Элементный анализ для C38H33F2N5O6S:
Вычислено С, 62,89; H, 4,58; N, 9,65.
Найдено: C, 62,70; H, 4,61; N, 9,78.
Т.пл. 147-149°C.
Ссылочный пример 32
Получение N-(4-(1-(2,6-дифторбензил)-5-((2-метокси-1-фенилэтил(метил)амино)метил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
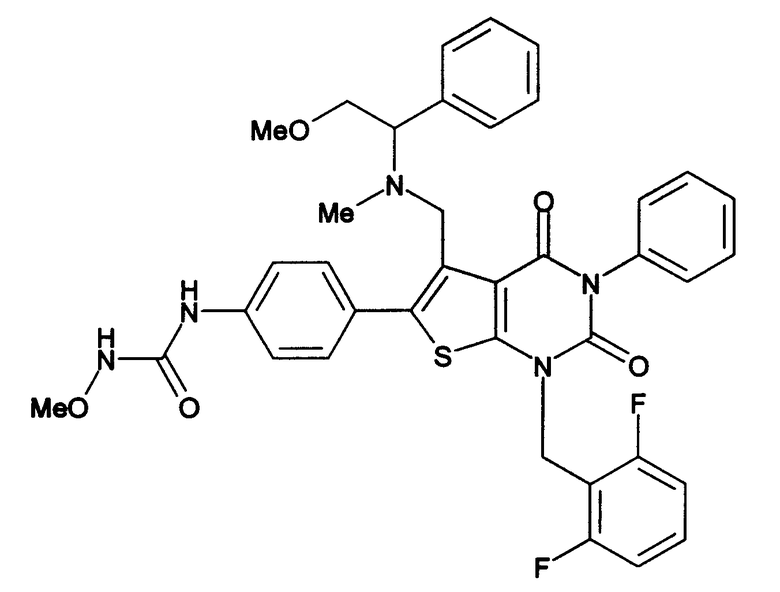
Раствор метилфенетилового простого эфира (1,0 г, 7,34 ммоль), NBS (1,96 г, 11,01 ммоль) и AIBN (240 мг, 1,47 ммоль) в тетрахлориде углерода (30 мл) нагревают с обратным холодильником в течение 2 часов. После охлаждения реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия и экстрагируют хлороформом. Экстракт промывают насыщенным водным раствором соли, сушат над сульфатом магния, упаривают при пониженном давлении и получают неочищенный2-метокси-1-фенилбромэтан (1,33 г, 84%) в виде коричневой жидкости.
По реакции, аналогично описанной в примере 14, используя соединение (200 мг, 0,34 ммоль), полученное в ссылочном примере 15, и синтезированный неочищенный бромид (50 мг), получают указанное в заголовке соединение (42 мг, 18%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 1,97 (3Н, с), 3,24 (3Н, с), 3,55-3,61 (1Н, м), 3,80 (3Н, с), 3,86-3,96 (3Н, м), 4,67 (1Н, с), 5,36 (2Н, с), 6,91 (2Н, т, J=8,1 Гц), 7,14-7,31 (8Н, м), 7,33-7,56 (8Н, м), 7,63 (1Н, с).
Элементный анализ для С38Н35F2N5О5S·0,2Н2O:
Вычислено С, 63,80; Н, 4,99; N, 9,79.
Найдено: С, 63,64; Н, 4,95; N, 9,89.
Т.пл. 169-172°С.
Ссылочный пример 33
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(1-пиридин-2-илэтил)амино)метил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
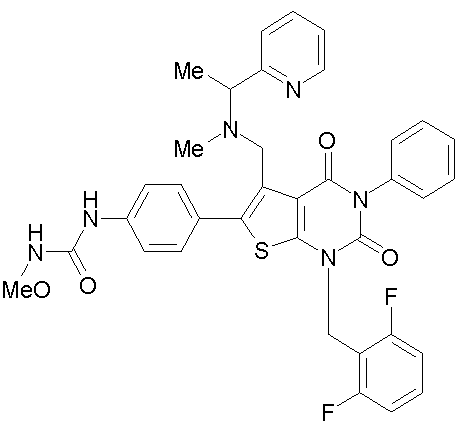
Раствор 2-этилпиридина (10,0 г, 93,34 ммоль), N-бромсукцинимида (17,44 г, 98,00 ммоль) и азобисизобутиронитрила (1,53 г, 9,33 ммоль) в тетрахлориде углерода (300 мл) перемешивают при 90°C в течение 1 часа. После охлаждения реакционную смесь фильтруют. Фильтрат промывают насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором соли, сушат над сульфатом магния и упаривают. Остаток очищают хроматографией на силикагеле и получают бромид (15,68 г, 90%) в виде светло-желтой жидкости.
По реакции, аналогично описанной в примере 14, используя соединение (160 мг, 0,26 ммоль), полученное в ссылочном примере 15, и полученный бромид (62 мг, 0,33 ммоль), получают указанное в заголовке соединение (133 мг, 75%) в виде желтых кристаллов.
1H-ЯМР (CDCl3) δ: 1,30 (3H, д, J=6,9 Гц), 1,92 (3H, с), 3,80 (3H, с), 4,00 (2H, с), 4,04 (1H, кв, J=6,6 Гц), 5,35 (2H, с), 6,91 (2H, т, J=8,0 Гц), 7,02-7,06 (1H, м), 7,24-7,30 (4H, м), 7,40-7,54 (8H, м), 7,65 (1Н, с), 8,44 (1Н, д, J=5,7 Гц).
Т.пл. 146-148°C.
Указанное в заголовке соединение (40 мг) разделяют на оптические изомеры препаративной ВЭЖХ, используя CHIRALPAK AD (50 мм (внутр. диаметр)×500 мм (длина)), где подвижная фаза представляет собой смесь гексан/2-пропанол (3/2), и получают 19 мг оптического изомера, время удерживания которого составляет 25 мин (э.и. 99,9%) и 19 мг еще одного изомера, время удерживания которого составляет 29 мин (э.и. 99,0%), при анализе на CHIRALPAK AD (4,6 мм (внутр. диаметр)×500 мм (длина)), оба изомера представляют собой белый порошок.
Ссылочный пример 34
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метокси-1-метилэтил)метиламино)метил)-1,2,3,4-тетрагидро-2,4-диоксо-3-фенилтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
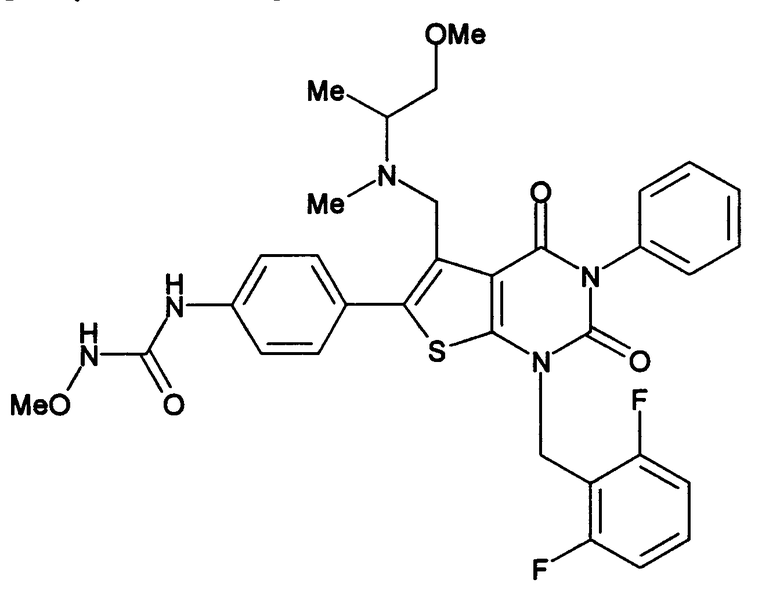
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (100 мг, 0,17 ммоль), полученное в ссылочном примере 18, и соединение (21 мг, 0,21 ммоль), полученное в ссылочном примере 24, получают указанное в заголовке соединение (24 мг, 21%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 0,90 (3H, д, J=6,3 Гц), 2,04 (3H, с), 3,06-3,16 (2H, м), 3,26 (3H, с), 3,40-3,46 (1H, м), 3,51-3,98 (4H, м), 5,35 (2H, с), 6,90 (2H, т, J=8,4 Гц), 7,09 (1H, с), 7,25-7,32 (5H, м), 7,39-7,60 (6H, м).
Элементный анализ для C33H33F2N5O5S·0,3H2O:
Вычислено С, 60,50; H, 5,17; N, 10,69.
Найдено: C, 60,28; H, 5,21; N, 10,53.
Т.пл. 154-155°C.
Указанное в заголовке соединение (48 мг) разделяют на оптические изомеры препаративной ВЭЖХ, используя CHIRALPAK AD (50 мм (внутр. диаметр)×500 мм (длина)), где подвижная фаза представляет собой смесь гексан/2-пропанол (65/35), и получают 22 мг оптического изомера, время удерживания которого составляет 49 мин (э.и. 99,0%) и 21 мг другого изомера, время удерживания которого составляет 54 мин (э.и. 99,0%), при анализе на CHIRALPAK OD (4,6 мм (внутр. диаметр)×250 мм (длина)), оба изомера представляют собой белый порошок.
Ссылочный пример 35
Получение N-(4-(1-(2,6-дифторбензил)-5-((метил(1-пиридин-2-илэтил)амино)метил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(пиридин-2-ил)тиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
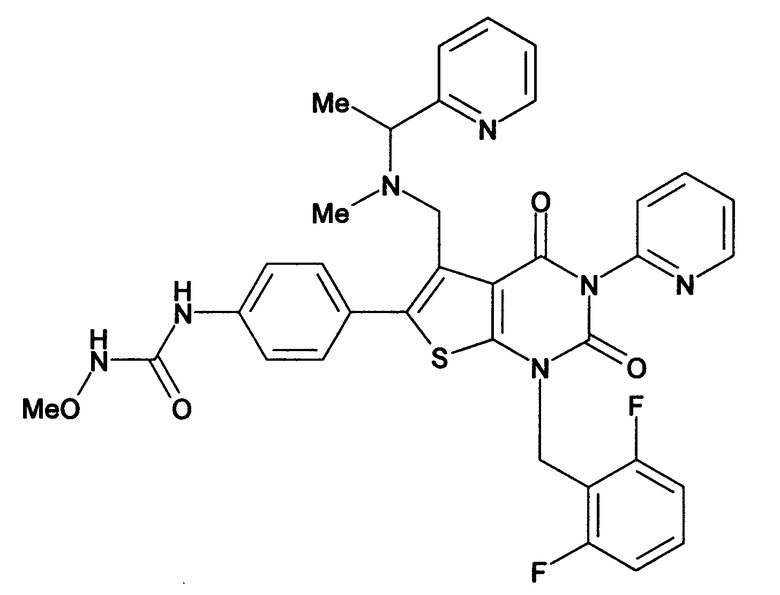
По реакции, аналогично описанной в ссылочном примере 33, используя соединение (100 мг, 0,17 ммоль), полученное в ссылочном примере 14, получают указанное в заголовке соединение (31 мг, 27%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 1,30 (3H, д, J=6,9 Гц), 1,92 (3H, с), 3,80 (3H, с), 3,98-4,10 (3H, м), 5,33 (2H, уш.с), 6,90 (2H, т, J=8,1 Гц), 7,01-7,06 (1Н, м), 7,23-7,42 (5Н, м), 7,49-7,56 (4Н, м) 7,65 (1Н, с), 7,90 (1Н, т, J=7,8 Гц), 8,44 (1Н, д, J=3,9 Гц), 8,68 (1Н, д, J=5,7 Гц).
Т.пл. 143-144°С.
Указанное в заголовке соединение (20 мг) разделяют на оптические изомеры препаративной ВЭЖХ, используя CHIRALPAK AD (50 мм (внутр. диаметр)×500 мм (длина)), где подвижная фаза представляет собой смесь гексан/2-пропанол (1/1), и получают 10 мг оптического изомера, время удерживания которого составляет 23 мин (э.и. 99,9%), и 11 мг другого изомера, время удерживания которого составляет 28 мин (э.и. 99,2%), при анализе на CHIRALPAK AD (4,6 мм (внутр. диаметр)×250 мм (длина)), оба изомера представляют собой бесцветное маслянистое вещество.
Ссылочный пример 36
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-гидроксициклогексил)-5-((метил(1-пиридин-2-илэтил)амино)метил)-1,2,3,4-тетрагидро-2,4-диоксотиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
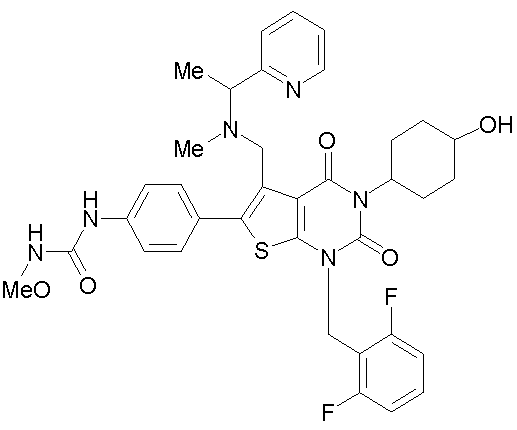
По реакции, аналогично описанной в ссылочном примере 33, используя соединение (100 мг, 0,17 ммоль), полученное в ссылочном примере 23, получают указанное в заголовке соединение (17 мг, 14%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 1,35 (3H, д, J=6,9 Гц), 1,43-1,54 (2H, м), 1,91 (3H, с), 2,09 (2H, д, J=12,3 Гц), 2,65 (2H, кв, J=12,8 Гц), 3,73-3,81 (4H, м), 3,98-4,13 (3H, м), 4,60 (1Н, т, J=12,0 Гц), 5,28 (2H, уш.с), 6,88 (2H, т, J=8,1 Гц), 6,89-7,08 (1Н, м), 7,22-7,31 (3H, м), 7,40-7,54 (4H, м) 7,62 (1Н, с), 8,45 (1H, д, J=4,89 Гц).
Т.пл. 144-145°C.
Ссылочный пример 37
Получение N-(4-(5-(((1R)-1-фенилэтиламино)метил)-1-(2,6-дифторбензил)-3-(4-гидроксициклогексил)-1,2,3,4-тетрагидро-2,4-диоксотиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
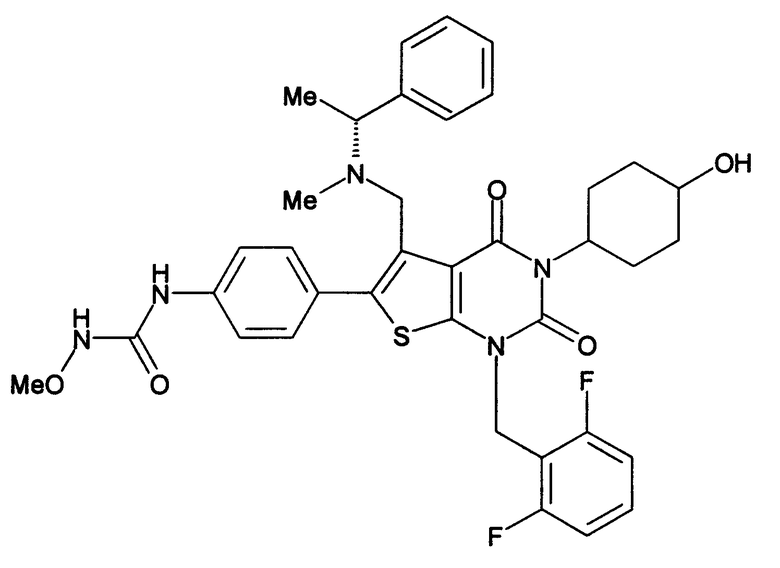
По реакции, аналогично описанной вссылочном примере 26,используя соединение (180 мг, 0,30 ммоль), полученное в ссылочном примере 20,получают указанное в заголовке соединение (77 мг, 37%) в виде белых кристаллов.
1Н-ЯМР (CDCl3) δ: 1,30 (3Н, д, J=6, 6 Гц), 1,43-1,57 (2Н, м), 1,71 (2Н, д, J=9,9 Гц), 1,88 (3Н, с), 2,04-2,15 (2Н, м), 2,62-2,71 (2Н, м), 3,70-3,93 (7Н, м), 4,90-5,10 (1Н, м), 5,28 (2Н, с), 6,89 (2Н, т, J=8,1 Гц), 7,11-7,30 (8Н, м), 7,51 (3Н, с), 7, 60 (1Н, с).
Элементный анализ для C37H39F2N2O5·1, 5H2O:
Вычислено С, 60,81; Н, 5,79; N, 9,58.
Найдено: С, 60,77; Н, 5,72; N, 9,41.
Т.пл. 137-138°С.
Ссылочный пример 38
Получение N-(4-(5-((метил((1R)-1-фенилэтил)амино)метил)-1-(2,6-дифторбензил)-1,2,3,3,4-тетрагидро-2,4-диоксо-3-пиридин-2-илтиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
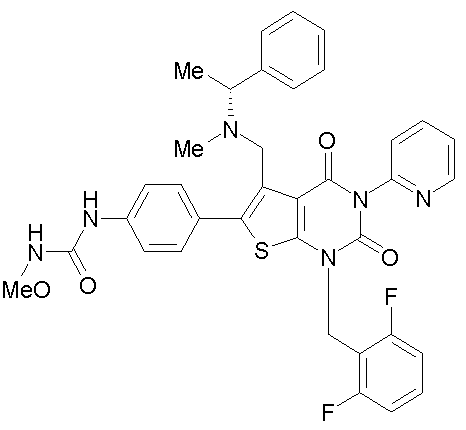
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (270 мг, 0,46 ммоль), полученное в ссылочном примере 22, получают указанное в заголовке соединение (178 мг, 57%), в виде белых кристаллов.
1Н-ЯМР (CDCl3) δ: 1,27 (3Н, д, J=6, 8 Гц), 1,91 (3Н, с), 2,04-2,15 (2Н, м), 2,62-2,71 (2Н, м), 3,75-4,00 (4Н, м), 5,30 (2Н, уш.с), 6,91 (2Н, т, J=8,1 Гц), 7,13-7,42 (10Н, м), 7,54 (211, д, J=8,6 Гц), 7,61 (2Н, д, J=8,5 Гц), 7,91 (1Н, т, J=7,7 Гц), 8,70 (1Н, д, J=4,8 Гц).
Элементный анализ для C36H32F2N6O4S·0,5Н2O:
Вычислено С, 62,51; Н, 4,81; N, 12,15.
Найдено: С, 62,34; Н, 4,71; N, 12,12.
Т.пл. 168-170°С.
Ссылочный пример 39
Получение N-(4-(5-((метил((1R)-1-фенилэтил)амино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(5-фторпиридин-2-ил)тиено[2,3-d]пиримидин-6-ил)-N'-метоксимочевины
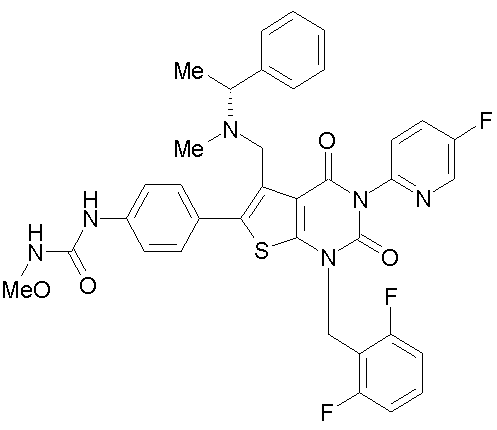
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (280 мг, 0,46 ммоль), полученное в ссылочном примере 21, получают указанное в заголовке соединение (187 мг, 58%) в виде белых кристаллов.
1H-ЯМР (CDCl3) δ: 1,27 (3Н, д, J=6, 6 Гц), 1,90 (3Н, с), 3,78-3,99 (5Н, м), 5,33 (2Н, уш.с), 6,91 (2Н, т, J=8,1 Гц), 7,12-7,38 (9Н, м), 7,51-7,63 (5Н, м), 8,52 (1Н, д, J=3,0 Гц).
Элементный анализ для C36H31F3N6O4S·0,2H2O:
Вычислено С, 61,39; Н, 4,49; N, 11,93.
Найдено: С, 61,22; Н, 4,56; N, 11,96.
Т.пл. 128-130°С.
Ссылочный пример 40
Получение N-(4-(5-(((2-метоксиэтил)метиламино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(4-метоксифенил)тиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
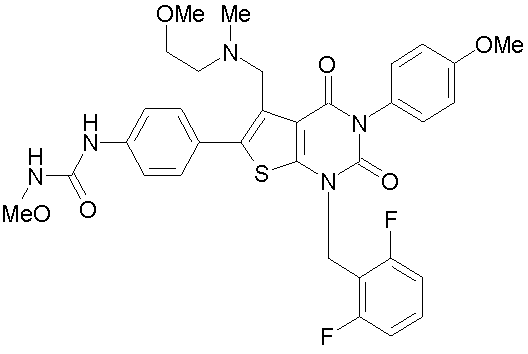
По реакции, аналогично описанной в примере 4, используя соединение (800 мг, 1,24 ммоль), полученное в ссылочном примере 25, и 2-бромэтилэтиловый простой эфир (207 мг, 1,49 ммоль), получают указанное в заголовке соединение (407 мг, 58%) в виде белого твердого вещества.
1Н-ЯМР (CDCl3) δ: 2,13 (3Н, с), 2,64 (2Н, т, J=5,7 Гц), 3,27 (3Н, с), 3,41 (2Н, т, J=5,6 Гц), 3,82 (3Н, с), 3,84 (3Н, с), 5,36 (2Н, с), 6,92 (2Н, т, J=8,1 Гц), 7,01 (2Н, д, J=8,7 Гц),7,11 (1H, с), 7,19 (2H, д, J=8,7 Гц), 7,26-7,33 (3H, м), 7,53-7,70 (5H, м).
Т.пл. 181-184°C.
Ссылочный пример 41
Получение 1-амино-2-метил-2-пропанола
К суспензии литийалюминийгидрида (2,85 г, 75 ммоль) в диэтиловом эфире (120 мл) добавляют по каплям раствор циангидрина ацетона (4,73 г, 50 ммоль) в диэтиловом эфире (30 мл) при охлаждении льдом. Жидкую реакционную смесь перемешивают при комнатной температуре в течение 4 часов и по каплям добавляют последовательно воду (2,85 мл), 1N гидроксид натрия (2,85 мл) и воду (8,55 мл). Нерастворимые вещества отфильтровывают, фильтрат упаривают и получают указанное в заголовке соединение (1,32 г, 30%) в виде бесцветного маслянистого вещества.
1H ЯМР (CDCl3) δ: 1,17 (6H, с), 2,60 (2H, с).
Ссылочный пример 42
Получение трет-бутил(3-этокси-2,2-диметилпропокси)диметилсилана
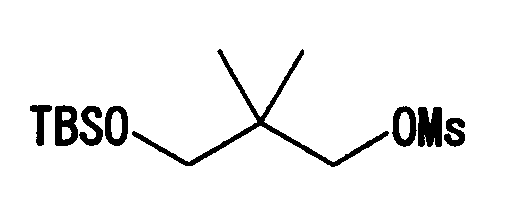
К раствору 3-{[трет-бутил(диметил)силил]окси}-2,2-диметилпропан-1-ола (регистрационный номер 117932-70-4) (2,18 г, 10 ммоль) в ТГФ (30 мл) добавляют триэтиламин (1,67 мл, 12 ммоль) и метансульфонилхлорид (0,85 мл, 11 ммоль) при охлаждении льдом. Реакционную жидкость перемешивают при комнатной температуре в течение 30 мин и добавляют водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором соли, сушат над безводным сульфатом магния, упаривают при пониженном давлении и получают указанное в заголовке соединение (2,98 г, выход количественный) в виде бесцветного маслянистого вещества.
1H ЯМР (CDCl3) δ: 0,04 (6H, с), 0,89 (9H, с), 0,93 (6H, с), 2,98 (3H, с), 3,34 (9H, с), 4,00 (2H, с).
Ссылочный пример 43
Получение 2-(3-{[трет-бутил(диметил)силил]окси}-2,2-диметилпропил)-1H-изоиндол-1,3(2H)-диона
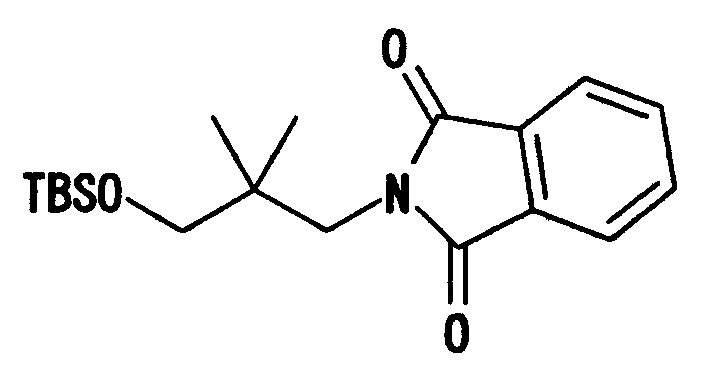
К раствору соединения (2,96 г, 10 ммоль), полученному в ссылочном примере 42, в ДМФА (10 мл) добавляют фталимид калия (1,85 г, 10 ммоль). Реакционную жидкость перемешивают при 140°C в течение 30 часов и добавляют воду. Органический слой промывают насыщенным водным раствором соли, сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат/гексан, 1/10), получая указанное в заголовке соединение (2,79 г, 80%) в виде светло-желтого маслянистого вещества.
1H ЯМР (CDCl3) δ: 0,01 (6H, с), 0,87 (9H, с), 0,93 (6H, с), 3,39 (2H, с), 3,61 (2H, с), 7,65-7,75 (2H, м), 7,8-7,9 (2H, м).
Ссылочный пример 44
Получение гидрохлорида 3-амино-2,2-диметилпропан-1-ола
Смесь соединения (1,395 г, 4,0 ммоль), полученного в ссылочном примере 43, концентрированной хлористоводородной кислоты (10 мл), уксусной кислоты (7 мл) и воды (10 мл) кипятят с обратным холодильником в течение 24 часов. Реакционную жидкость концентрируют и добавляют воду. Выпавшую в осадок фталевую кислоту отфильтровывают и фильтрат упаривают. Остаток перекристаллизовывают из этилацетата и получают указанное в заголовке соединение (257,2 мг, 46%) в виде светло-пурпурных кристаллов.
1H ЯМР (CDCl3+CD3OD) δ: 2,91 (2H, уш.с), 3,38 (6H, уш.с), 3,52 (2H, уш.с).
Ссылочный пример 45
Получение [1-({[трет-бутил(диметил)силил]окси}метил)циклопропил]метанола
К раствору литийалюминийгидрида (9,34 г, 246 ммоль) в ТГФ (150 мл) добавляют по каплям раствор диметилциклопропан-1,1-дикарбоксилат (25,95 г, 164,1 ммоль) в ТГФ (150 мл) при охлаждении льдом. Раствор перемешивают при 0°C в течение 2 часов и к раствору медленно добавляют последовательно воду (9,5 мл), 15% водный раствор NaOH (9,5 мл) и воду (30 мл). Нерастворимые вещества отфильтровывают, фильтрат упаривают, получая циклопропан-1,1-диметилметанол в виде бесцветного маслянистого вещества.
К раствору вышеуказанного маслянистого вещества в 1,2-диметоксиэтане (150 мл) добавляют гидрид натрия (60% в масле, 6,56 г, 164 ммоль) и смесь перемешивают при комнатной температуре в течение 1 часа. К реакционной жидкости по каплям добавляют раствор трет-бутилдиметилхлорсилана (24,7 г, 164 ммоль) в 1,2-диметоксиэтане (100 мл) и смесь перемешивают при комнатной температуре в течение ночи. Реакционную жидкость выливают в воду и два раза экстрагируют этилацетатом. Органический слой сушат над сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (элюент: этилацетат/гексан, 1/15-1/9) и получают указанное в заголовке соединение (28,19 г, 79%) в виде бесцветного маслянистого вещества.
1H ЯМР (CDCl3) δ: 0,07 (6H, с), 0,45-0,54 (4H, м), 0,91 (9H, с), 2,35 (1H, уш.с), 3,56 (2H, с), 3,61 (2H, с).
ИК (чистый) 3361, 2953, 2856, 1466, 1254, 1088, 1030, 837, 777 см-1.
Ссылочный пример 46
Получение трет-бутил{[1-(этоксиметил)циклопропил]метокси}диметилсилана
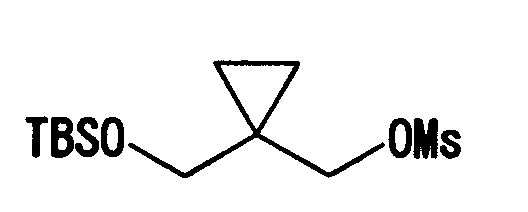
По реакции, аналогично описанной в ссылочном примере 42, используя соединение (4,33 г, 20 ммоль), полученное в ссылочном примере 45, получают указанное в заголовке соединение (5,71 г, 97%) в виде бесцветного маслянистого вещества.
1H ЯМР (CDCl3) δ: 0,05 (6H, с), 0,55-0,65 (4H, м), 0,89 (9H, с), 3,01 (3H, с), 3,52 (2H, с), 4,17 (2H, с).
Ссылочный пример 47
Получение 2-{[1-({[трет-бутил(диметил)силил]окси}метил)циклопропил]метил}-1H-изоиндол-1,3(2H)-диона
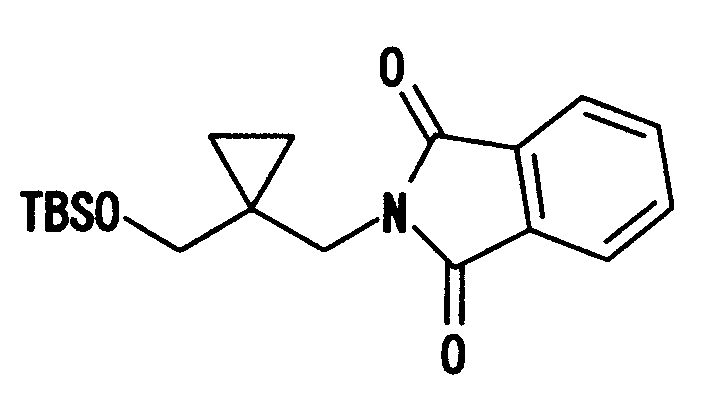
По реакции, аналогично описанной в ссылочном примере 43, используя соединение (5,71 г, 19,39 ммоль), полученное в ссылочном примере 46, получают указанное в заголовке соединение (5,02 г, 75%) в виде бесцветного маслянистого вещества.
1H-ЯМР (CDCl3) δ: -0,07 (6H, с), 0,45-0,55 (2H, м), 0,65-0,75 (2H, м), 0,79 (9H, с), 3,53 (2H, с), 3,74 (2H, с), 7,65-7,75 (2H, м), 7,80-7,90 (2H, м).
Ссылочный пример 48
Получение 1-[1-({[трет-бутил(диметил)силил]окси}метил)циклопропил]метанамина

К раствору соединения (2,0 г, 5,79 ммоль), полученного в ссылочном примере 47, в этаноле (20 мл) добавляют моногидрат гидразина (0,42 мл, 8,68 ммоль) и смесь кипятят с обратным холодильником в течение 2 часов. Нерастворимые вещества отфильтровывают и фильтрат упаривают. Остаток распределяют между этилацетатом и водным 1N раствором гидроксида натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором соли, сушат над сульфатом магния, упаривают и получают указанное в заголовке соединение (1,15 г, 92%) в виде светло-желтого маслянистого вещества.
1H ЯМР (CDCl3) δ: 0,0-0,1 (6H, м), 0,3-0,4 (4H, м), 0,85 (9H, с), 2,61 (2H, с), 3,49 (2H, с).
Ссылочный пример 49
Получение N-(4-(5-хлорметил-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(6-метокси-3-пиридинил)тиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
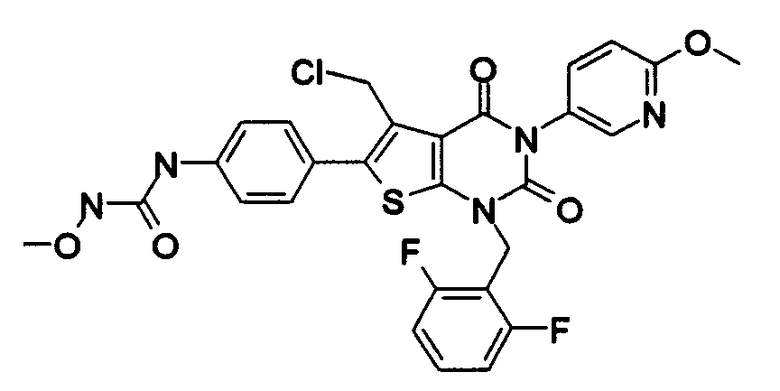
По реакции, аналогично описанной в ссылочном примере 18, используя N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(6-метокси-3-пиридинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевину (49,3 мг, 0,074 ммоль), получают указанное в заголовке соединение (44,1 мг, выход количественный) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 3,83 (3H, с), 3,97 (3H, с), 4,83 (2H, с), 5,37 (2H, с), 6,87 (1H, д, J=9,0 Гц), 6,94 (2H, т, J=8,4 Гц), 7,13 (1H, с), 7,25-7,35 (1H, м), 7,5-7,6 (3H, м), 7,52 (2H, д, J=9,0 Гц), 7,66 (1H, с), 8,1-8,15 (1H, м).
Ссылочный пример 50
Получение N-(4-(5-хлорметил-1-(2,6-дифторбензил-1,2,3,4-тетрагидро-2,4-диоксо-3-(6-метокси-3-пиридазинил)тиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
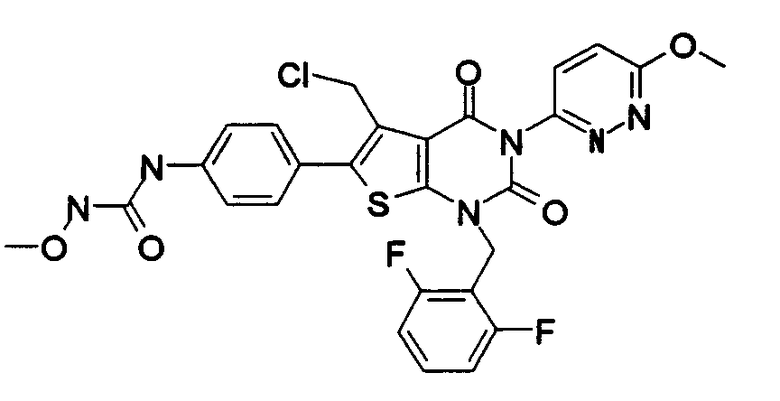
По реакции, аналогично описанной в ссылочном примере 18, используя N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-3-(6-метокси-3-пиридазинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевину (1,34 г, 2 ммоль), получают указанное в заголовке соединение (888,5 мг, 71%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ: 3,83 (3H, с), 4,19 (3H, с), 4,7-4,9 (2H, уш.м), 5,3-5,45 (2H, м), 6,93 (2H, т, J=8,0 Гц), 7,14 (1Н, д, J=9,0 Гц), 7,16 (1Н, с), 7,2-7,4 (1H, м), 7,42 (1H, д, J=9,0 Гц), 7,52 (2H, д, J=8,6 Гц), 7,62 (2H, д, J=8,6 Гц), 7,69 (1H, с).
Ссылочный пример 51
Получение N-(4-(1-(2,6-дифторбензил)-3-(4-гидроксициклогексил)-5-((метиламино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
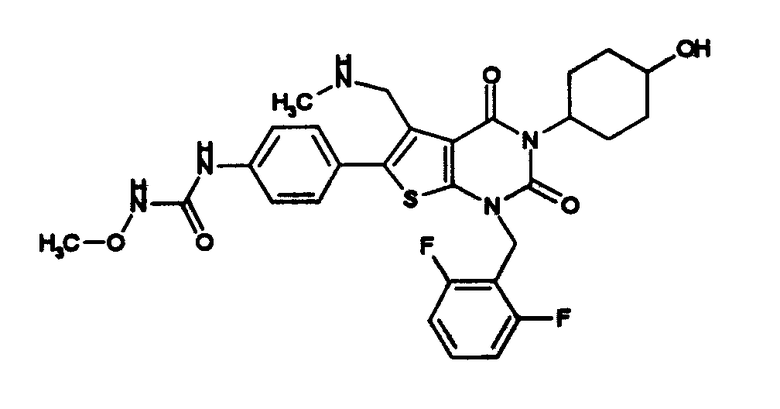
По реакции, аналогично описанной в ссылочном примере 14, используя соединение (1,75 г, 2,54 ммоль), полученное в примере 69, описанном ниже, получают указанное в заголовке соединение (1,60 г, выход количественный) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,4-1,9 (3H, м), 2,0-2,2 (2H, м), 2,40 (3H, с), 2,5-2,75 (2H, м), 3,77 (2H, с), 3,7-3,85 (1H, м), 3,82 (3H, с), 4,9-5,1 (1Н, м), 5,30 (2H, с), 6,90 (2H, т, J=8,0 Гц), 7,2-7,35 (2H, м), 7,38 (2H, д, J=8,4 Гц), 7,54 (2H, д, J=8,4 Гц), 7,61 (1Н, с).
Ссылочный пример 52
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-гидроксипропил)-5-((метиламино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
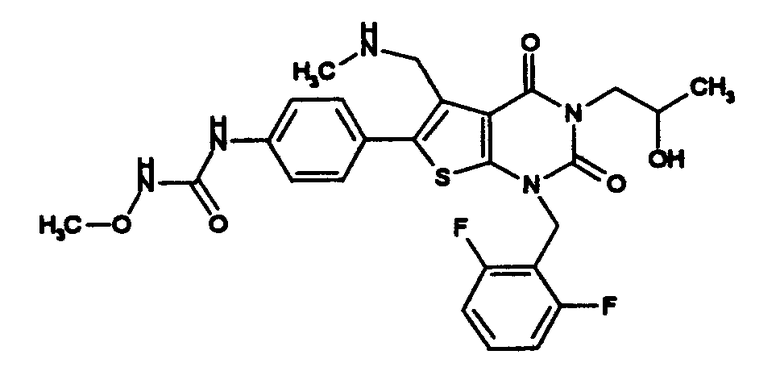
По реакции, аналогично описанной в ссылочном примере 14, используя соединение (360 мг, 0,554 ммоль), полученное в примере 72, описанном ниже, получают указанное в заголовке соединение (281 мг, 91%) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 1,29 (3H, д, J=6,0 Гц), 2,39 (3H, с), 3,80 (2H, с), 3,82 (3H, с), 4,1-4,25 (3H, м), 5,34 (2H, с), 6,91 (2H, т, J=8,2 Гц), 7,25-7,35 (2H, м), 7,40 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,63 (1Н, с).
Ссылочный пример 53
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-гидрокси-2-метилпропил)-5-((метиламино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
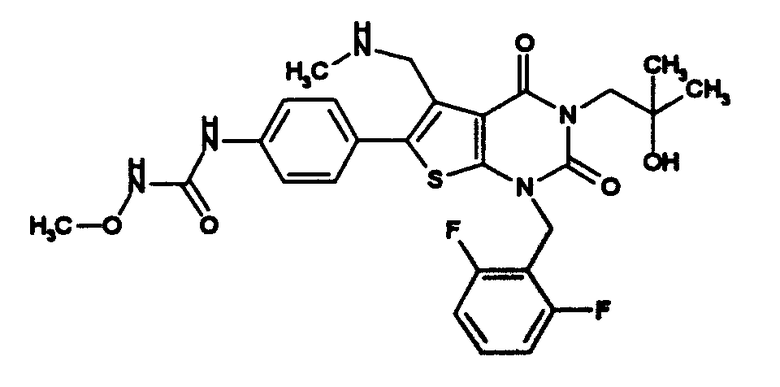
По реакции, аналогично описанной в ссылочном примере 14, используя соединение (310 мг, 0,467 ммоль), полученное в примере 73, описанном ниже, получают указанное в заголовке соединение (241 мг, 90%) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 1,28 (6H, с), 2,38 (3H, с), 3,80 (2H, с), 3,82 (3H, с), 3,88 (1H, уш.с), 4,26 (2H, с), 5,37 (2H, с), 6,91 (2H, т, J=8,1 Гц), 7,25-7,35 (2H, м), 7,40 (2H, д, J=8,6 Гц), 7,56 (2H, д, J=8,6 Гц), 7,63 (1H, с).
Ссылочный пример 54
Получение N-(4-(1-(2,6-дифторбензил)-3-(6-метокси-3-пиридазинил)-5-((метиламино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
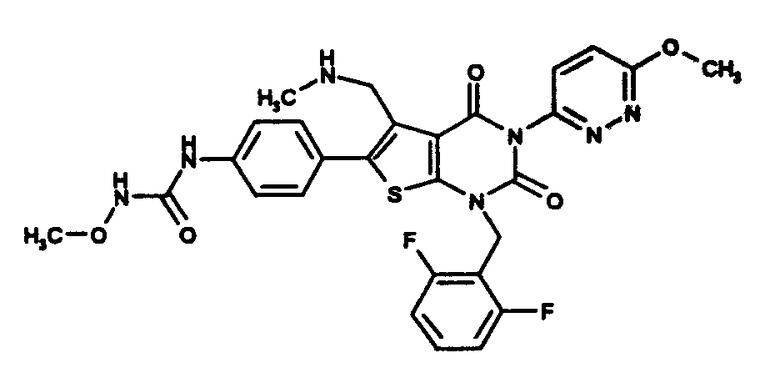
По реакции, аналогично описанной в Ссылочном примере 14, используя соединение (320 мг, 0,457 ммоль), полученное в примере 77, описанном ниже, получают указанное в заголовке соединение (138 мг, 50%) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 2,34 (3H, с), 3,77 (2H, с), 3,82 (3H, с), 4,19 (3H, с), 5,35 (2H, с), 6,92 (2H, т, J=8,0 Гц), 7,14 (1H, т, J=9,2 Гц), 7,25-7,5 (5H, м), 7,57 (2H, д, J=8,6 Гц), 7,64 (1H, с).
Ссылочный пример 55
Получение N-{4-[1-(2,6-дифторбензил)-5-[(диметиламино)метил]-3-(4-метоксифенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил]фенил}-N'-метоксимочевины
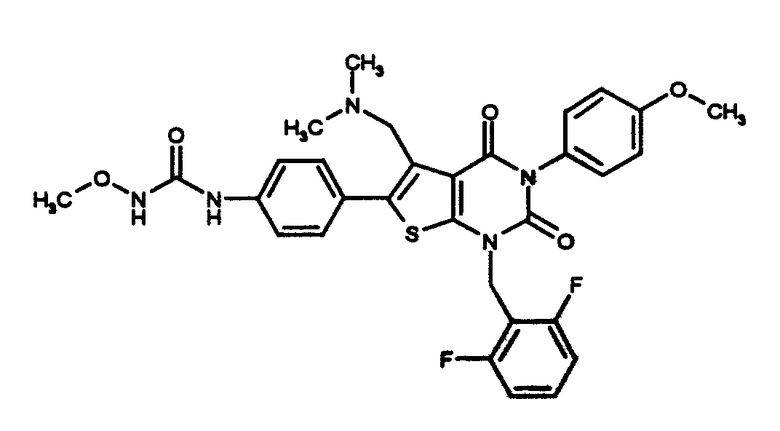
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (130 мг, 0,192 ммоль), полученное в ссылочном примере 19, описанном ниже, и раствор диметиламина в ТГФ (0,96 мл, 1,92 ммоль), получают указанное в заголовке соединение (43,4 мг, 36%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,14 (6H, с), 3,70 (2H, с), 3,82 (3H, с), 3,83 (3H, с), 5,36 (2H, с), 6,92 (2H, т, J=7,8 Гц), 7,01 (1Н, д, J=8,7 Гц), 7,1-7,35 (4H, м), 7,51 (2H, д, J=8,7 Гц), 7,56 (2H, д, J=8,7 Гц), 7,63 (1Н, с).
Ссылочный пример 56
Получение N-{4-[1-(2,6-дифторбензил)-3-(6-метоксипиридазин-3-ил)-2,4-диоксо-5-(пирролидин-1-илметил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил]фенил}-N'-метоксимочевины

По реакции, аналогично описанной в ссылочном примере 26, используя соединение (110 мг, 0,175 ммоль), полученное в ссылочном примере 50, и пирролидин (124 мг, 1,75 ммоль), получают указанное в заголовке соединение (68,1 мг, 60%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,5-1,7 (4H, м), 2,35-2,5 (4H, м), 3,82 (3H, с), 3,89 (2H, уш.с), 4,18 (3H, с), 5,34 (2H, уш.с), 6,92 (2H, т, J=8,8 Гц), 7,12 (2H, д, J=9,2 Гц), 7,2-7,35 (2H, м), 7,41 (1Н, д, J=9,2 Гц), 7,5-7,6 (3H, м), 7,64 (1H, с).
Ссылочный пример 57
Получение N-{4-[1-(2,6-дифторбензил)-3-(6-метоксипиридазин-3-ил)-5-(морфолин-4-илметил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил]фенил}-N'-метоксимочевины
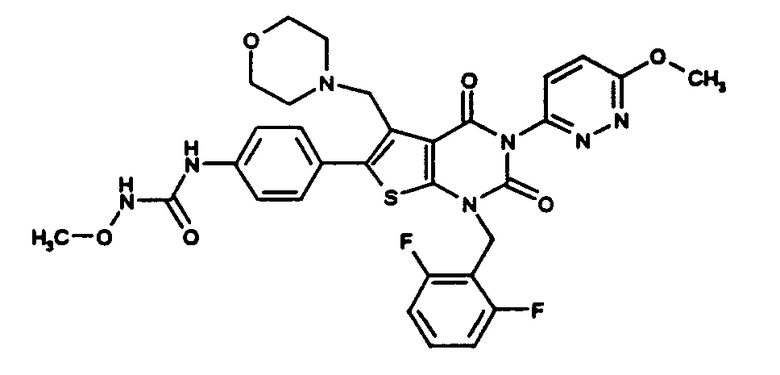
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (110 мг, 0,175 ммоль), полученное в ссылочном примере 50, и морфолин (152 мг, 1,75 ммоль), получают указанное в заголовке соединение (78,0 мг, 67%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,35-2,5 (4H, м), 3,5-3,65 (4H, м), 3,76 (2H, с), 3,83 (3H, с), 4,19 (3H, с), 5,35 (2H, с), 6,93 (2H, т, J=8,0 Гц), 7,1-7,2 (2H, м), 7,2-7,3 (1H, м), 7,40 (1Н, д, J=9,0 Гц), 7,5-7,7 (5H, м).
Ссылочный пример 58
Получение N-(4-(5-((бензил(2-метоксиэтил)амино)метил)-1-(2,6-дифторбензил)-3-(6-метокси-3-пиридазинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
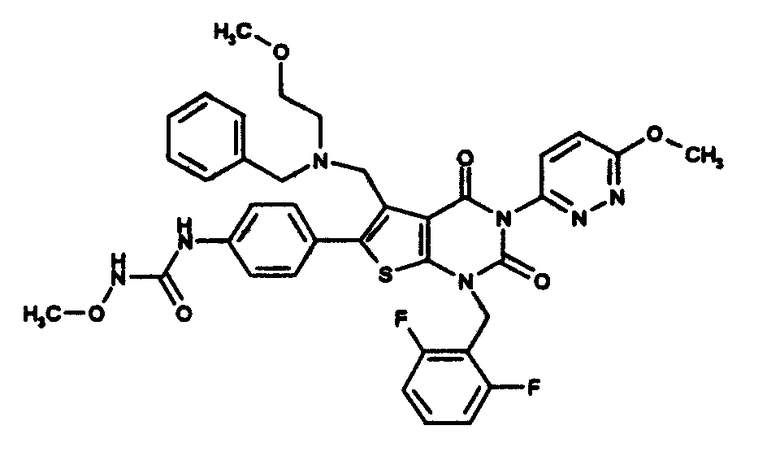
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (120 мг, 0,191 ммоль), полученное в ссылочном примере 50, и N-бензил-N-(2-метоксиэтил)амин (316 мг, 1,91 ммоль), получают указанное в заголовке соединение (105,1 мг, 74%) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 2,67 (2H, т, J=6,2 Гц), 3,18 (3H, с), 3,34 (2H, т, J=6,2 Гц), 3,65 (2H, с), 3,83 (3H, с), 4,03 (2H, с), 4,20 (3H, с), 5,32 (2H, уш.с), 6,92 (2H, т, J=8,2 Гц), 7,1-7,25 (6H, м), 7,25-7,35 (2H, м), 7,40 (1H, д, J=9,0 Гц), 7,55 (2H, д, J=8,7 Гц), 7,64 (1Н, с), 7,75 (2H, д, J=8,7 Гц).
Элементный анализ для C37H35F2N7O6S·1,0H2О:
Вычислено С, 58,34; H, 4,90; N, 12,87.
Найдено: C, 58,51; H, 4,58; N, 12,56.
Ссылочный пример 59
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)амино)метил)-3-(6-метокси-3-пиридазинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
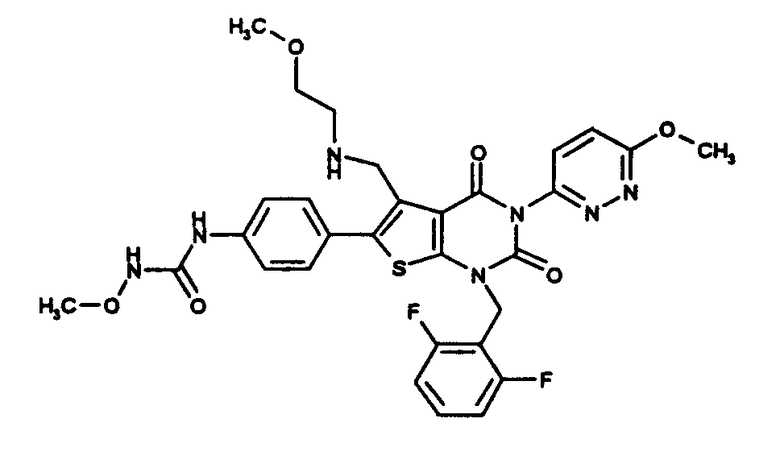
По реакции, аналогично описанной в ссылочном примере 14, используя соединение (400 мг, 0,538 ммоль), полученное в ссылочном примере 58, получают указанное в заголовке соединение (215,9 мг, 61%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,72 (2H, т, J=5,6 Гц), 3,28 (3H, с), 3,40 (2H, т, J=5,6 Гц), 3,82 (3H, с), 3,86 (2H, с), 4,19 (3H, с), 5,35 (2H, уш.с), 6,92 (2H, т, J=8,4 Гц), 7,14 (2H, д, J=9,0 Гц), 7,25-7,35 (1Н, м), 7,39 (2H, д, J=9,0 Гц), 7,43 (2H, д, J=8,8 Гц), 7,56 (2H, д, J=8,8 Гц), 7,64 (1Н, с).
Элементный анализ для C30H29F2N7O6S·0,5H2O:
Вычислено С, 54,38; H, 4,56; N, 14,80.
Найдено: C, 54,62; H, 4,39; N, 14,62.
Пример 61
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-гидроксипропил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
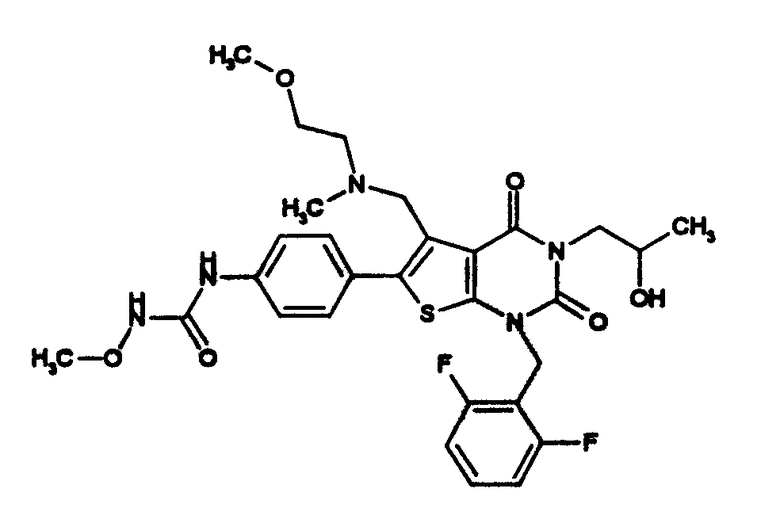
По реакции, аналогично описанной в примере 5, используя соединение (1,82 г, 3 ммоль), полученное в ссылочном примере 7, и 1-амино-2-пропанол (0,45 г, 6 ммоль), получают указанное в заголовке соединение (1,11 г, 60%) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 1,27 (3H, д, J=5,6 Гц), 2,12 (3H, с), 2,64 (2H, т, J=5,8 Гц), 2,9-3,05 (1H, м), 3,30 (3H, с), 3,45 (2H, д, J=5,8 Гц), 3,82 (5H, с), 4,05-4,25 (1H, м), 4,18 (2H, с), 5,34 (2H, с), 6,91 (2H, т, J=8,2 Гц), 7,2-7,4 (1H, м), 7,5-7,6 (3H, м), 7,63 (1H, с).
Элементный анализ для C29H33F2N5O6S·0,7H2O:
Вычислено С, 55,26; H, 5,50; N, 11,11.
Найдено: C, 55,42; H, 5,52; N, 10,75.
Пример 62
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил-2,4-диоксо-3-(2-оксопропил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
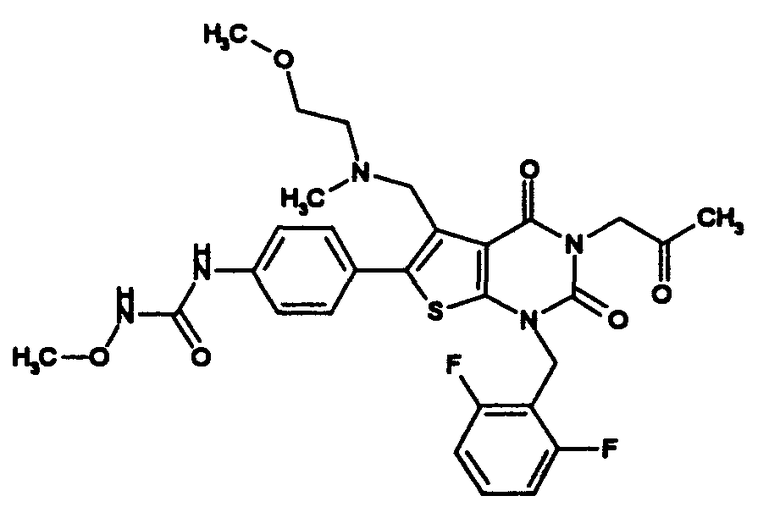
К раствору оксалилхлорида (0,20 г, 1,58 ммоль) в дихлорметане (2 мл) добавляют по каплям раствор диметилсульфоксида (163 мг, 2,09 ммоль) в дихлорметане (2 мл) при охлаждении (-78°C). После перемешивания в течение 10 мин добавляют по каплям раствор соединения (308 мг, 0,5 ммоль), полученного в примере 61, в дихлорметане (2 мл). После перемешивания в течение 30 мин дополнительно добавляют по каплям триэтиламин (0,40 мл, 2,88 ммоль) и смесь перемешивают при 0°C в течение 2 часов. К смеси при 0°C добавляют водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором соли, сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на NH-силикагеле (выпускаемом Fuji Silysia Chemical Ltd.) (элюент: этилацетат), полученный порошок промывают диизопропиловым эфиром и гексаном, получая указанное в заголовке соединение (40,7 мг, 13%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ: 2,13 (3H, с), 2,27 (3H, с), 2,55-2,65 (2H, м), 3,29 (3H, с), 3,4-3,5 (2H, м), 3,82 (5H, с), 4,88 (2H, с), 5,33 (2H, с), 6,91 (2H, т, J=8,0 Гц), 7,2-7,35 (1Н, м), 7,5-7,65 (4H, м).
Пример 63
Получение N-(4-(1-(2,6-дифторбензил)-3-(3,3-диметил-2-оксобутил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
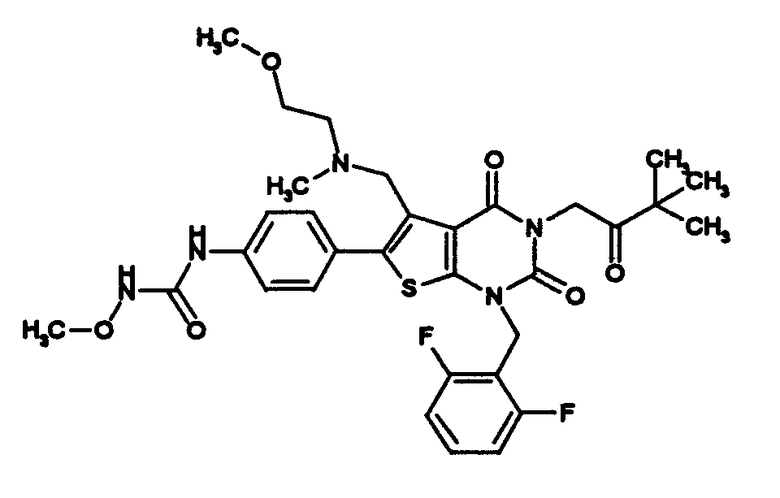
По реакции, аналогично описанной в примере 5, используя соединение (303 мг, 0,5 ммоль), полученное в ссылочном примере 7, и гидрохлорид 3,3-диметил-2-оксобутиламина (патент США № 6096688) (152 мг, 1 ммоль), получают указанное в заголовке соединение (195,7 мг, 60%) в виде светло-желтых кристаллов.
1H-ЯМР (CDCl3) δ: 1,30 (9H, с), 2,12 (3H, с), 2,62 (2H, т, J=5,8 Гц), 3,29 (3H, с), 3,44 (2H, д, J=5,8 Гц), 3,80 (2H, с), 3,82 (3H, с), 5,04 (2H, с), 5,33 (2H, с), 6,91 (2H, т, J=8,2 Гц), 7,14 (1Н, с), 7,2-7,3 (1Н, м), 7,5-7,6 (4H, м), 7,61 (1Н, с).
Элементный анализ для C32H37F2N5O6S:
Вычислено С, 58,43; H, 5,67; N, 10,65.
Найдено: C, 58,15; H, 5,71; N, 10,42.
Пример 64
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2,2,2-трифторэтил)-1,2,3,4-тетрагидротиено[2,3-d]пиридин-6-ил)фенил)-N'-метоксимочевины
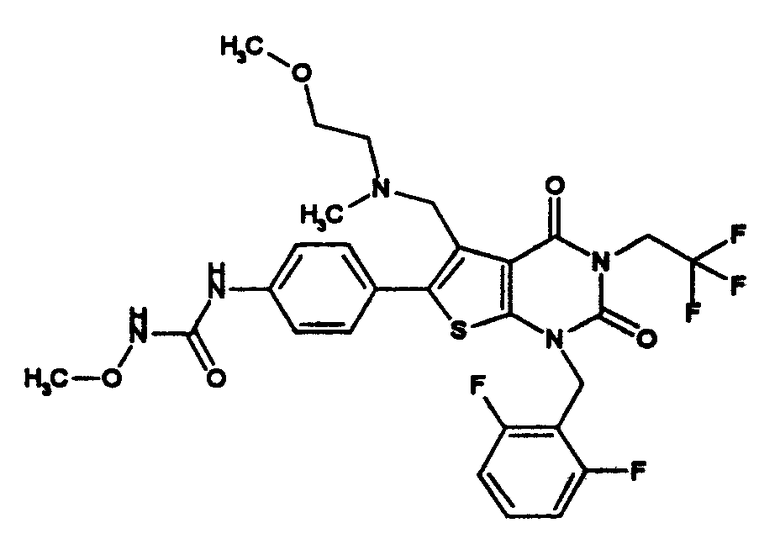
По реакции, аналогично описанной в примере 5, используя соединение (303 мг, 0,5 ммоль), полученное в ссылочном примере 7, и 2,2,2-трифторэтиламин (99 мг, 1 ммоль), получают указанное в заголовке соединение(52,9 мг, 16%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,12 (3H, с), 2,65 (2H, т, J=6,0 Гц), 3,31 (3H, с), 3,45 (2H, д, J=6,0 Гц), 3,82 (5H, с), 4,75-4,85 (2H, м), 5,36 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,13 (1Н, с), 7,2-7,35 (1Н, м), 7,55-7,6 (4H, м), 7,62 (1Н, с).
Элементный анализ для C28H28F5N5O5S·1,0H2O:
Вычислено С, 50,98; H, 4,58; N, 10,62.
Найдено: C, 51,14; H, 4,44; N, 10,34.
Пример 65
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-гидрокси-3,3-диметилбутил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
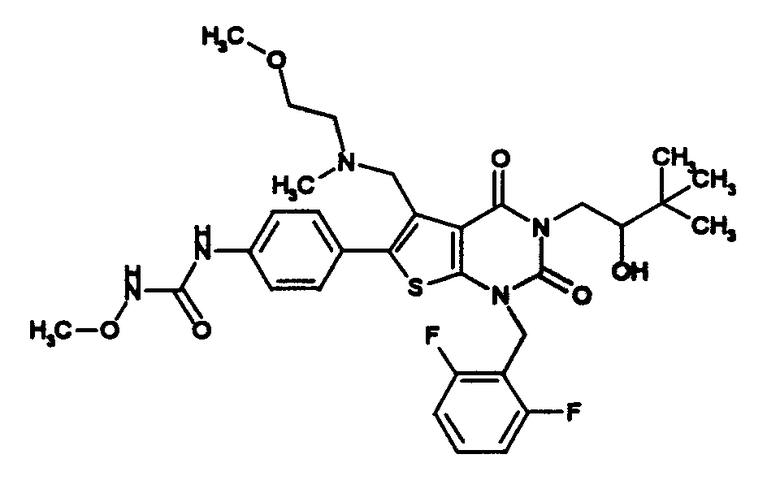
К раствору соединения (120 мг, 0,182 ммоль), полученному в примере 63, в смеси метанола (6 мл) и ТГФ (4 мл) добавляют натрийборгидрид (6,9 мг, 0,182 ммоль) при охлаждении льдом. Реакционную жидкость перемешивают при комнатной температуре в течение 1,5 часов и упаривают при пониженном давлении. Остаток распределяют между водой и этилацетатом и извлекают органический слой. Экстракт промывают насыщенным водным раствором соли, сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на NH-силикагеле (Fuji Silysia Chemical Ltd.) (элюент: этилацетат), перекристаллизовывают из этилацетата и диэтилового эфира и получают указанное в заголовке соединение(81,1 мг, 68%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,04 (9H, с), 2,12 (3H, с), 2,64 (2H, т, J=6,0 Гц), 2,96 (1H, д, J=6,0 Гц), 3,31 (3H, с), 3,46 (2H, д, J=6,0 Гц), 3,5-3,6 (1H, м), 3,82 (3H, с), 3,75-3,9 (2H, м), 4,05-4,2 (1Н, м), 4,3-4,45 (1Н, м), 5,25-5,45 (2H, м), 6,91 (2H, т, J=8,2 Гц), 7,14 (1Н, с), 7,2-7,35 (1Н, м), 7,5-7,6 (4H, м), 7,61 (1H, с).
Элементный анализ для C32H39F2N5O6S·0,2H2O:
Вычислено С, 57,94; H, 5,99; N, 10,56.
Найдено: C, 57,89; H, 5,91; N, 10,43.
Пример 66
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-гидрокси-2-метилпропил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
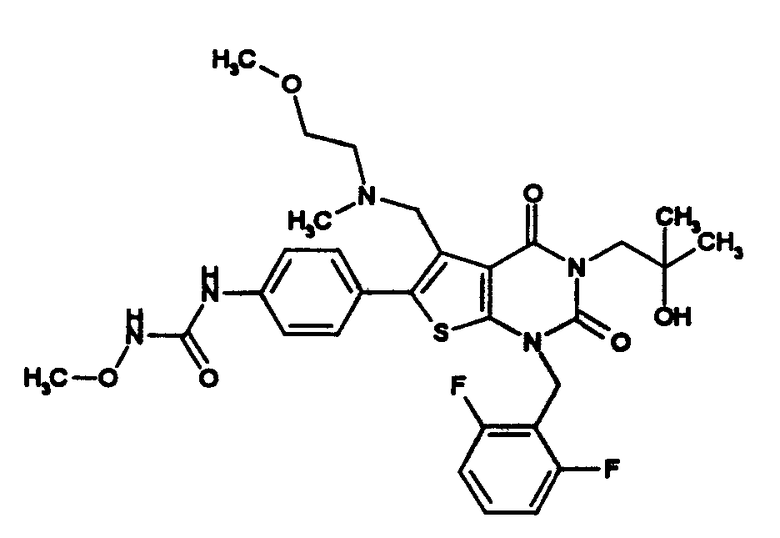
По реакции, аналогично описанной в примере 5, используя соединение (303 мг, 0,5 ммоль), полученное в ссылочном примере 7, и соединение(89 мг, 1 ммоль), полученное в ссылочном примере 41, получают указанное в заголовке соединение (133,9 мг, 42%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,28 (6H, с), 2,3 (3H, с), 2,64 (2H, т, J=5,8 Гц), 3,30 (3H, с), 3,45 (2H, т, J=5,8 Гц), 3,82 (5H, с), 3,99 (1Н, с), 4,25 (2H, с), 5,36 (2H, с), 6,91 (2H, т, J=8,2 Гц), 7,12 (1Н, с), 7,2-7,4 (1Н, м), 7,5-7,6 (4H, м), 7,61 (1H, с).
Элементный анализ для C30H35F2N5O6S·0,1H2O:
Вычислено С, 56,88; H, 5,60; N, 11,06.
Найдено: C, 56,65; H, 5,54; N, 10,85.
Пример 67
Получение N-[4-(1-(2,6-дифторбензил)-3-(3-гидрокси-2,2-диметилпропил)-5-{[(2-метоксиэтил)(метил)амино]метил}-2,4- диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил]-N'-метоксимочевины
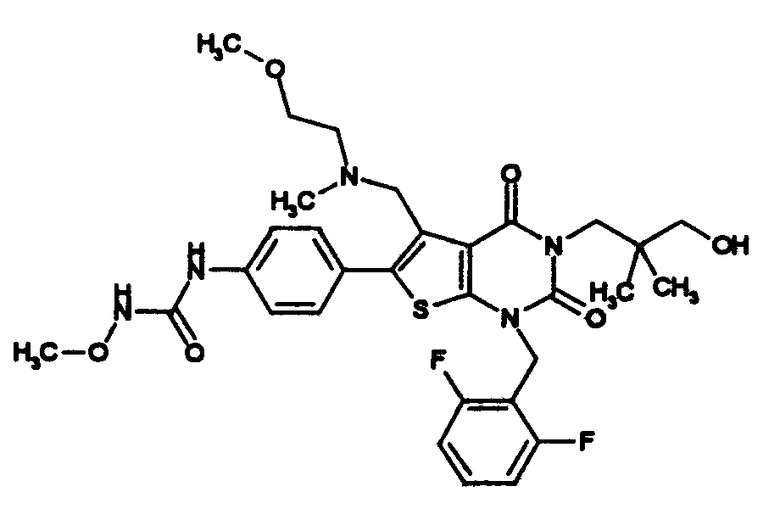
По реакции, аналогично описанной в примере 5, используя соединение (303 мг, 0,5 ммоль), полученное в ссылочном примере 7, и соединение (140 мг, 1 ммоль), полученное в ссылочном примере 44, получают указанное в заголовке соединение (36,8 мг, 11%) в виде светло-желтых кристаллов.
1H-ЯМР (CDCl3) δ: 0,96 (6H, с), 2,13 (3H, с), 2,64 (2H, т, J=6,2 Гц), 3,13 (2H, с), 3,30 (3H, с), 3,45 (2H, т, J=6,2 Гц), 3,82 (5H, с), 3,95-4,15 (2H, уш.м), 5,1-5,5 (2H, уш.), 6,91 (2H, т, J=8,2 Гц), 7,14 (1Н, с), 7,2-7,4 (1H, м), 7,5-7,6 (4H, м), 7,61 (1Н, с).
ВЭЖХ (220 нм), чистота 90% (время удерживания 1,83 мин).
MC (ESI+, m/e) 646 (M+1).
Пример 68
Получение N-(4-(1-(2,6-дифторбензил)-3-((1-(гидроксиметил)циклопропил)метил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
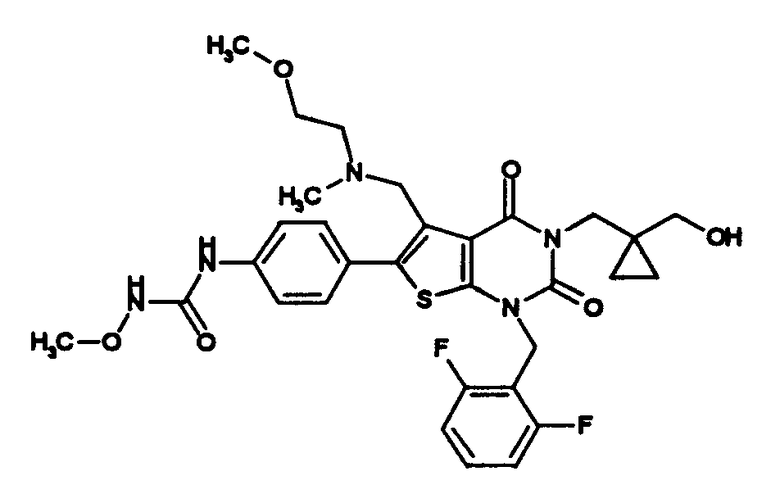
По реакции, аналогично описанной в примере 5, используя соединение (606 мг, 1 ммоль), полученное в ссылочном примере 7, и соединение (431 мг, 2 ммоль), полученное в ссылочном примере 47, получают циклическую форму тиенопиримидина (549,3 мг, 72%). Вышеуказанную циклическую форму растворяют в ТГФ (10 мл) и добавляют 1М раствор тетрабутиламмонийфторида в ТГФ (1,7 мл, 1,7 ммоль). Смесь перемешивают при комнатной температуре в течение 20 часов. Реакционную жидкость распределяют между водой и этилацетатом и органический слой отделяют. Органический слой промывают насыщенным водным раствором соли, сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на NH-силикагеле (Fuji Silysia Chemical Ltd.) (элюент: этилацетат) и перекристаллизовывают из этилацетата и диэтилового эфира, получая указанное в заголовке соединение (196,1 мг, 43%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 0,46 (2H, т, J=5,4 Гц), 0,85 (2H, т, J=5,4 Гц), 2,11 (3H, с), 2,64 (2H, т, J=6,0 Гц), 3,25 (2H, с), 3,3l (3H, с), 3,46 (2H, т, J=6,0 Гц), 3,82 (5H, с), 3,95-4,15 (1Н, уш.), 4,14 (2H, с), 5,37 (2H, с), 6,91 (2H, т, J=8,0 Гц), 7,12 (1Н, с), 7,2-7,4 (1H, м), 7,54 (4H, с), 7,61 (1H, с).
Элементный анализ для C31H35F2N5О6S:
Вычислено С, 57,84; H, 5,48; N, 10,88.
Найдено: C, 57,63; H, 5,46; N, 10,86.
Пример 69
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(4-гидроксициклогексил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
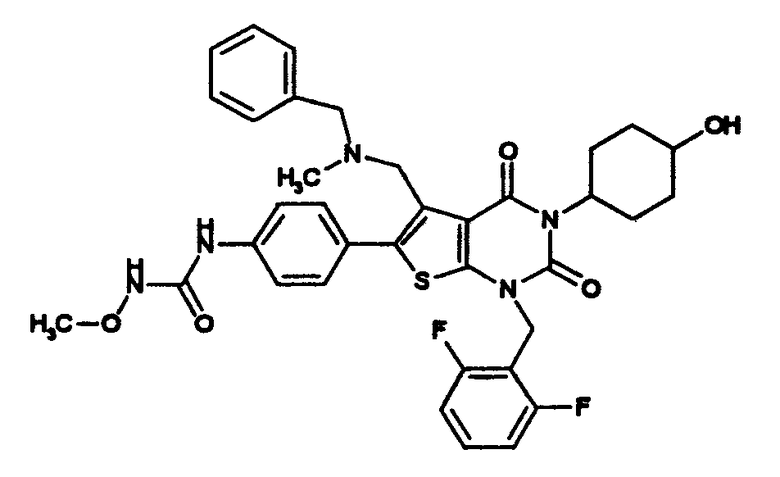
По реакции, аналогично описанной в примере 5, используя 4-(N-бензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоновую кислоту (3,19 г, 5 ммоль) и транс-4-аминоциклогексанол (1,44 г, 12,5 ммоль), получают указанное в заголовке соединение (1,80 г, 52%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,35-1,65 (3H, м), 1,65-1,8 (2H, м), 2,07 (3H, с), 2,5-2,8 (2H, м), 3,58 (2H, с), 3,7-3,9 (1Н, м), 3,82 (3H, с), 3,9l (2H, с), 4,9-5,1 (1H, м), 5,29 (2H, с), 6,90 (2H, т, J=7,8 Гц), 7,13 (1Н, с), 7,15-7,35 (6H, м), 7,53 (2H, д, J=8,6 Гц), 7,61 (1H, с), 7,66 (2H, д, J=8,6 Гц).
Элементный анализ для C36H37F2N5O6S·0,5H2O:
Вычислено С, 61,09; H, 5,55; N, 9,89.
Найдено: C, 61,41; H, 5,65; N, 9,56.
Пример 70
Получение N-[4-(1-(2,6-дифторбензил)-3-(4-гидроксициклогексил)-5-{[(2-метоксиэтил)(метил)амино]метил}-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил]-N'-метоксимочевины
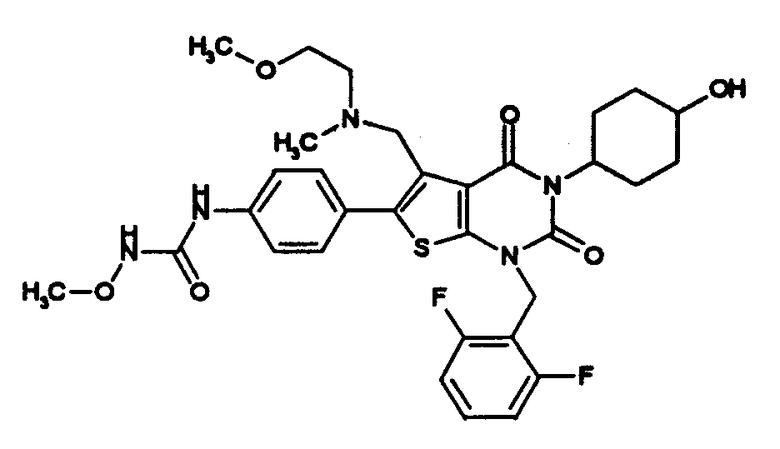
По реакции, аналогично описанной в примере 4, используя соединение (300 мг, 0,5 ммоль), полученное в ссылочном примере 51, и 2-бромэтилметиловый простой эфир (0,69 г, 5 ммоль), получают указанное в заголовке соединение (75,1 мг, 23%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,2-1,6 (3H, м), 1,6-1,8 (2H, м), 2,0-2,1 (2H, м), 2,14 (3H, с), 2,5-2,75 (4H, м), 3,31 (3H, с), 3,45 (2H, т, J=5,8 Гц), 3,65-3,85 (3H, м), 3,82 (3H, с), 4,9-5,05 (1Н, уш.), 5,30 (2H, с), 6,90 (2H, т, J=8,0 Гц), 7,12 (1H, с), 7,25-7,4 (1Н, м), 7,5-7,6 (4H, м), 7,60 (1Н, с).
Элементный анализ для C32H37F2N5O6S·0,5H2O:
Вычислено С, 57,65; H, 5,74; N, 10,50.
Найдено: C, 57,54; H, 5,75; N, 10,64.
Пример 71
Получение N-{4-[1-(2,6-дифторбензил)-5-{[(2-метоксиэтил)(метил)амино]метил}-3-(6-метилпиридазин-3-ил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил]фенил}-N'-метоксимочевины
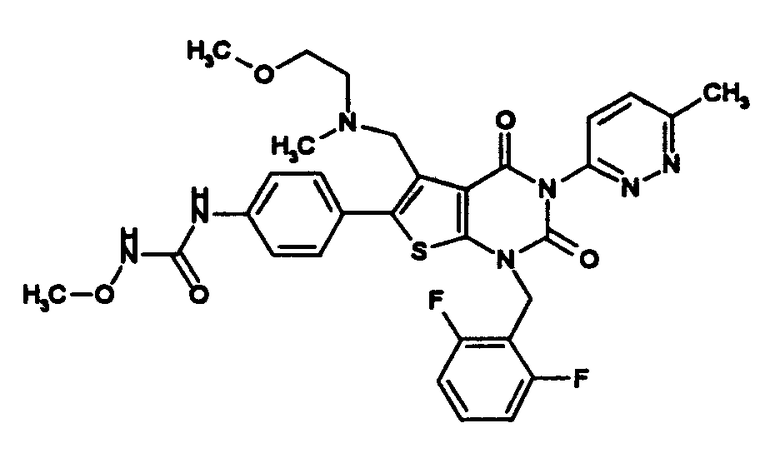
По реакции, аналогично описанной в примере 5, используя соединение (303 мг, 0,5 ммоль), полученное в ссылочном примере 7, и 3-амино-6-метилпиридазин (136 мг, 1,25 ммоль), получают указанное в заголовке соединение (48,3 мг, 15%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,13 (3H, с), 2,61 (2H, т, J=5,8 Гц), 2,79 (3H, с), 3,26 (3H, с), 3,41 (2H, т, J=5,8 Гц), 3,75-3,85 (2H, м), 3,82 (3H, с), 5,25-5,45 (2H, уш.м), 6,92 (2H, т, J=8,2 Гц), 7,18 (1H, с), 7,2-7,7 (8H, м).
Пример 72
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(2-гидроксипропил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-илфенил)-N'-метоксимочевины
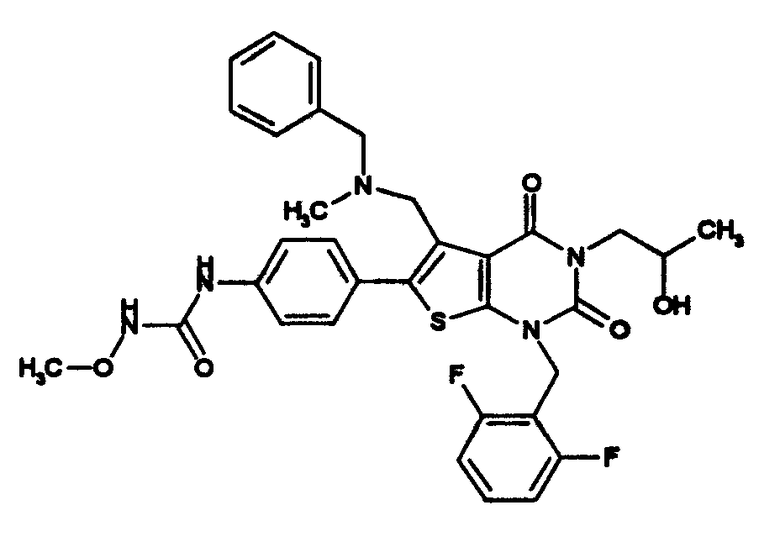
По реакции, аналогично описанной в примере 5, используя 4-(N-бензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоновую кислоту (639 мг, 1 ммоль) и 1-амино-2-пропанол (0,19 г, 2,5 ммоль), получают указанное в заголовке соединение(409,7 мг, 63%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,30 (3H, д, J=6,0 Гц), 2,06 (3H, с), 2,90 (1H, д, J=5,2 Гц), 3,57 (2H, с), 3,82 (3H, с), 3,91 (2H, с), 4,1-4,25 (1Н, м), 4,20 (2H, с), 5,34 (2H, с), 6,91 (2H, т, J=8,0 Гц), 7,16 (1H, с), 7,2-7,4 (6H, м), 7,54 (2H, д, J=8,8 Гц), 7,62 (1Н, с), 7,67 (2H, д, J=8,8 Гц).
Элементный анализ для C33H33F2N5O5S:
Вычислено С, 61,00; H, 5,12; N, 10,78.
Найдено: C, 60,82; H, 5,21; N, 10,68.
Пример 73
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(2-гидрокси-2-метилпропил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
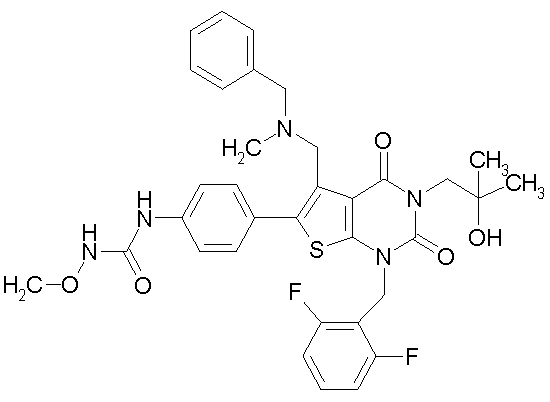
По реакции, аналогично описанной в примере 5, используя 4-(N-бензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоновую кислоту (639 мг, 1 ммоль) и соединение (0,22 г, 2,5 ммоль), полученное в ссылочном примере 41, получают указанное в заголовке соединение (360,9 мг, 54%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,29 (6Н, с), 2,06 (3Н, с), 3,56 (2Н, с), 3,83 (3Н, с), 3,91 (2Н, с), 3,96 (1Н, с), 4,28 (2Н, с), 5,36 (2Н, с), 6,91 (2Н, т, J=8,2 Гц), 7,13 (1Н, с), 7,2-7,35 (6Н, м), 7,54 (2Н, д, J=8,8 Гц), 7,62 (1Н, с), 7,67 (2Н, д, J=8,8 Гц).
Элементный анализ для C34H35F2N5O6S:
Вычислено С, 61,53; Н, 5,32; N, 10,55.
Найдено: С, 61,30; Н, 5,32; N, 10,32.
Пример 74 Получение N-(4-(1-(2,6-дифторбензил)-3-(2-гидроксипропил)-5-((метил(2-(2-пиридинил)этил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
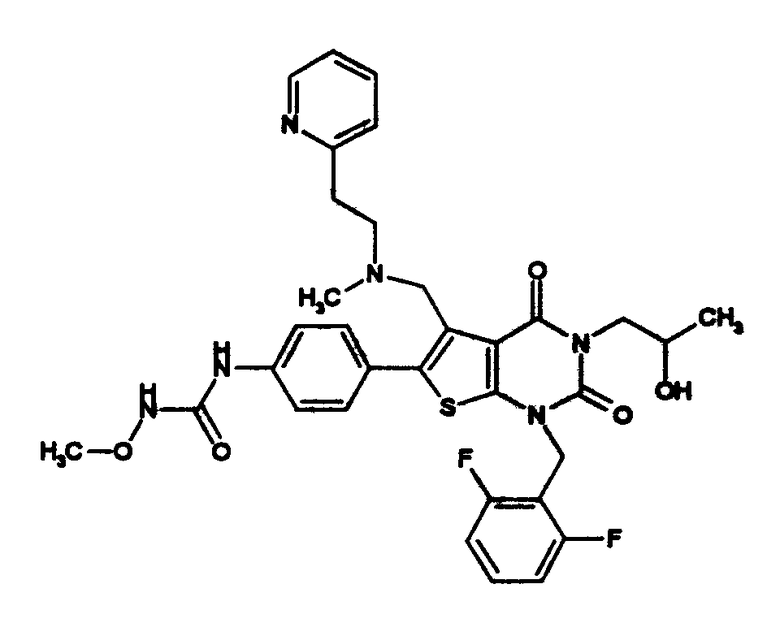
По реакции, аналогично описанной в примере 2, используя соединение (260 мг, 0,465 ммоль), полученное в ссылочном примере 52, и 2-(2-гидроксиэтил)пиридин (400 мг, 1,63 ммоль), получают указанное в заголовке соединение (195,9 мг, 63%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,28 (3H, д, J=5,8 Гц), 2,21 (3H, с), 2,75-2,95 (4H, м), 3,0-3,1 (1H, м), 3,82 (5H, с), 4,1-4,2 (1Н, м), 4,17 (2H, с), 5,34 (2H, с), 6,91 (2H, т, J=8,2 Гц), 6,95-7,1 (2H, м), 7,14 (1Н, с), 7,2-7,4 (1Н, м), 7,4-7,55 (5H, м), 7,59 (1Н, с), 8,43 (1Н, д, J=5,0 Гц).
Элементный анализ для C33H34F2N6O5S·0,2H2O:
Вычислено С, 59,31; H, 5,19; N, 12,57.
Найдено: C, 59,24; H, 5,29; N, 12,32.
Пример 75
Получение N-(4-(1-(2,6-дифторбензил)-3-(2-гидрокси-2-метилпропил)-5-((метил(2-(2-пиридинил)этил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
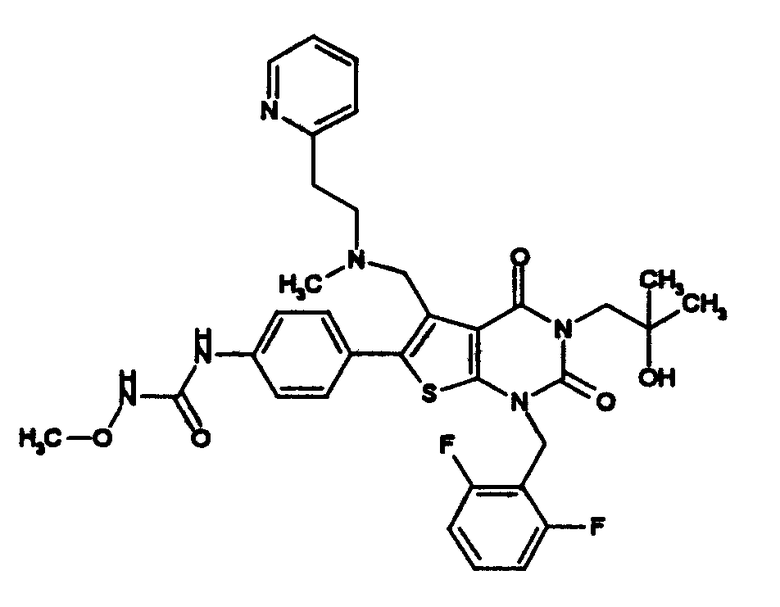
По реакции, аналогично описанной в примере 2, используя соединение (220 мг, 0,384 ммоль), полученное в ссылочном примере 53 и 2-(2-гидроксиэтил)пиридин (800 мг, 3,25 ммоль), получают указанное в заголовке соединение (138,2 мг, 53%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,26 (6H, с), 2,21 (3H, с), 2,75-2,95 (4H, м), 3,82 (5H, с), 3,99 (1H, с), 4,24 (2H, с), 5,36 (2H, с), 6,91 (2H, т, J=8,2 Гц), 7,0-7,1 (2H, м), 7,13 (1H, с), 7,2-7,35 (1H, м), 7,45-7,55 (5H, м), 7,59 (1H, с), 8,43 (1H, д, J=4,0 Гц).
Элементный анализ для C34H36F2N6O5S·0,1H2O:
Вычислено С, 59,85; H, 5,38; N, 12,32.
Найдено: C, 59,81; H, 5,45; N, 12,03.
Пример 76
Получение N-(4-(1-(2,6-дифторбензил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-пиразинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
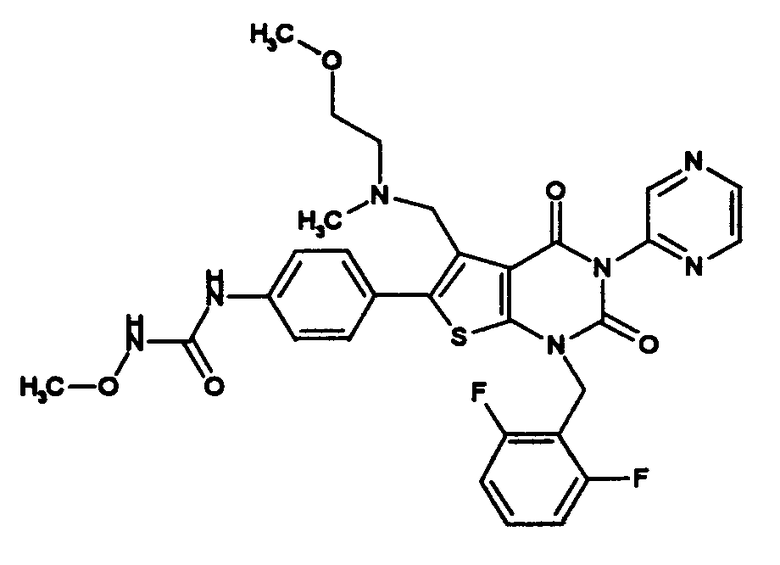
По реакции, аналогично описанной в примере 5, используя соединение (303 мг, 0,5 ммоль), полученное в ссылочном примере 7, и аминопиразин (119 мг, 1,25 ммоль), получают указанное в заголовке соединение(35,2 мг, 11%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,13 (3H, с), 2,62 (2H, т, J=6,0 Гц), 3,26 (3H, с), 3,41 (2H, т, J=6,0 Гц), 3,79 (2H, с), 3,83 (1Н, с), 5,36 (2H, с), 6,94 (2H, т, J=8,0 Гц), 7,12 (1H, с), 7,2-7,4 (1H, м), 7,5-7,65 (5H, м), 8,65-8,7 (3H, м).
Элементный анализ для C30H29F2N7O6S·0,1H2O:
Вычислено С, 56,35; H, 4,60; N, 15,33.
Найдено: C, 56,20; H, 4,52; N, 15,16.
Пример 77
Получение N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(6-метокси-3-пиридазинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины

По реакции, аналогично описанной в примере 5, используя 4-(N-бензил-N-метиламинометил)-2-[N-(2,6-дифторбензил)-N-этоксикарбониламино]-5-[4-(3-метоксиуреидо)фенил]тиофен-3-карбоновую кислоту (1,28 г, 2 ммоль) и 6-хлор-3-аминопиридазин (648 мг, 5 ммоль), получают указанное в заголовке соединение (0,36 г, 26%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,06 (3Н, с), 3,55 (2H, с), 3,83 (3Н, с), 3,87 (2H, с), 4,19 (3Н, с), 5,35 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,1-7,45 (9H, м), 7,55 (2H, д, J=8,4 Гц), 7,63 (1H, с), 7,72 (2H, д, J=8,4 Гц).
Пример 78
Получение N-(4-(1-(2,6-дифторбензил)-3-(6-метокси-3-пиридазинил)-5-((метил(2-(2-пиридинил)этил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
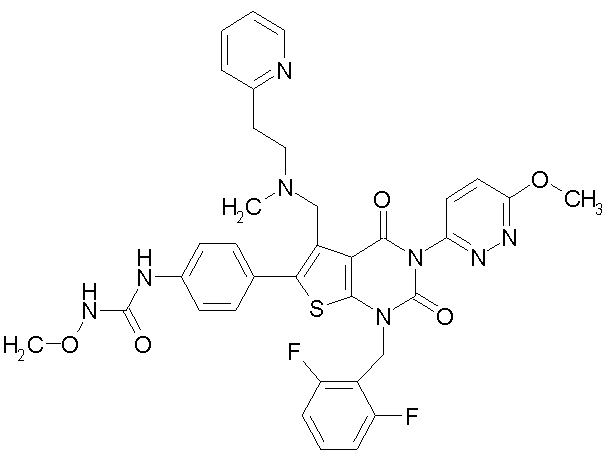
По реакции, аналогично описанной в примере 2, используя соединение (135 мг, 0,221 ммоль), полученное в Ссылочном примере 54, и 2-(2-гидроксиэтил)пиридин (272 мг, 2,21 ммоль), получают указанное в заголовке соединение (79,6 мг, 50%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,20 (3Н, с), 2,7-2,9 (4Н, м), 3,78 (2Н, с), 3,82 (3Н, с), 4,19 (3Н, с), 5,34 (2Н, с), 6,85-7,2 (5Н, м), 7,25-7,45 (2Н, м), 7,45-7,7 (7Н, м), 8,42 (1Н, д, J=4,0 Гц).
Элементный анализ для C35H32F2N8O5S·1, 0Н2О:
Вычислено С, 57,37; Н, 4,68; N, 115,29.
Найдено: С, 57,29; Н, 4,60; N, 15,15.
Пример 79
Получение N-(4-(5-((метил(2-пиридин-2-илэтил)амино)метил)-1-(2,6-дифторбензил)-1,2,3,4-тетрагидро-2,4-диоксо-3-(4-метоксифенил)тиено[2, 3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
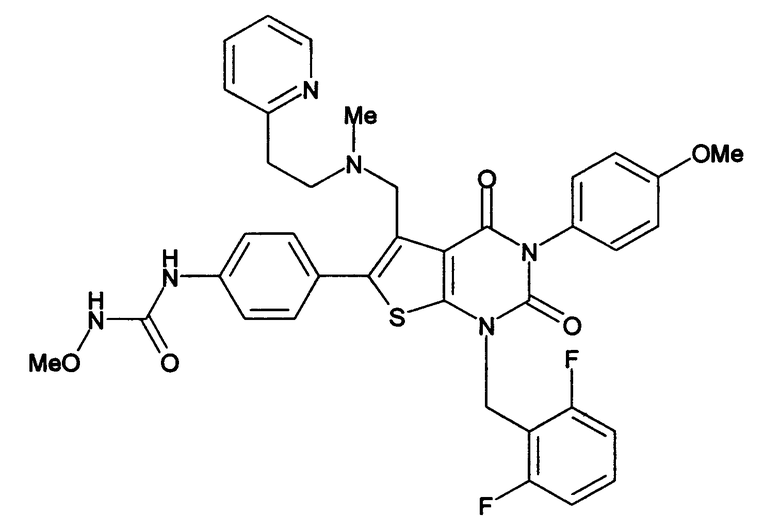
По реакции, аналогично описанной в примере 2, используя соединение (800 мг, 1,24 ммоль), полученное в ссылочном примере 25, и 2-(2-гидроксиэтил)пиридин (300 мг, 1,49 ммоль), получают указанное в заголовке соединение (407 мг, 58%) в виде белого твердого вещества.
1H-ЯМР (CDCl3) δ: 2,20 (3H, с), 2,86 (4H, м), 3,82-3,84 (8H, м), 5,36 (2H, с), 6,92 (2H, т, J= 8,3 Гц), 7,00-7,06 (4H, м), 7,14-7,33 (4H, м), 7,46-7,51 (5H, м), 7,61 (1H, с), 8,42 (1H, д, J= 5,7 Гц).
Элементный анализ для C37H34F2N6O5S·0,7H2O:
Вычислено С, 61,26; H, 4,92; N, 11,59.
Найдено: C, 61,06; H, 4,86; N, 11,52.
Пример 80
Получение N-[4-(1-(2,6-дифторбензил)-3-(6-гидроксипиридазин-3-ил)-5-{[(2-метоксиэтил)(метил)амино]метил}-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил]-N'-метоксимочевины
К раствору соединения (1,34 г, 2 ммоль), полученного в примере 57, в ТГФ (30 мл) добавляют 4N раствор HCl в уксусной кислоте (2 мл, 8 ммоль) и смесь перемешивают при комнатной температуре в течение 20 часов, при 50°C в течение 10 часов и далее при 60°C в течение 3 часов. Реакционную жидкость распределяют между водным раствором бикарбоната натрия и этилацетатом, органический слой отделяют. Водный слой подвергают высаливанию и экстрагируют этилацетатом. Органические слои собирают и объединяют, объединенный органический слой сушат над безводным сульфатом магния и упаривают при пониженном давлении. Остаток очищают колоночной хроматографией на NH-силикагеле (Fuji Silysia Chemical Ltd.) (элюент: смесь этилацетат/метанол, 8/1). К элюату добавляют диизопропиловый эфир и получают порошок, который отфильтровывают, промывают диизопропиловым эфиром, получая указанное в заголовке соединение (539 мг, 41%) в виде светло-желтого порошка.
1H-ЯМР (CDCl3) δ: 2,12 (3H, с), 2,63 (2H, т, J=5,8 Гц), 3,28 (3H, с), 3,43 (2H, т, J=5,8 Гц), 3,79 (2H, с), 3,83 (3H, с), 5,35 (2H, с), 6,94 (2H, т, J=8,2 Гц), 7,0-7,1 (1H, м), 7,2-7,4 (3H, м), 7,5-7,65 (4H, м), 7,63 (1H, с), 10,5-10,6 (1Н, уш.с).
Элементный анализ для C30H29F2N7O6S·2,0H2О:
Вычислено С, 52,24; H, 4,82; N, 14,22.
Найдено: C, 52,24; H, 4,57; N, 14,06.
Пример 81
Получение N-{4-[1-(2,6-дифторбензил)-5-{[(2-гидроксиэтил)(метил)амино]метил}-3-(6-метоксипиридазин-3-ил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил]фенил}-N'-метоксимочевины
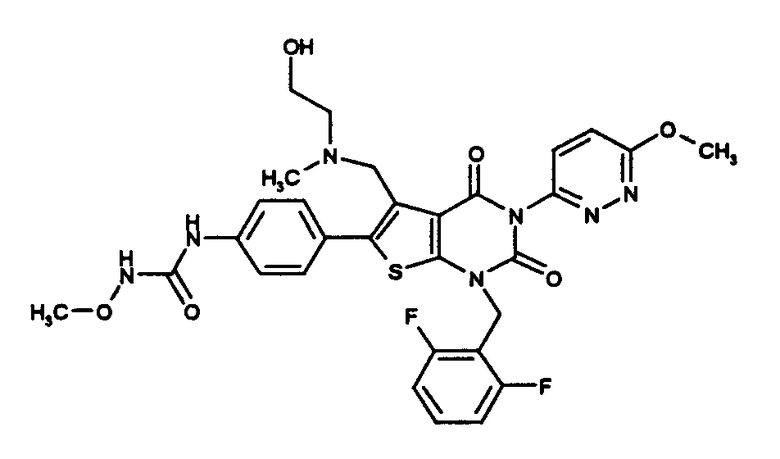
По реакции, аналогично описанной в примере 4, используя соединение (305 мг, 0,5 ммоль), полученное в ссылочном примере 54, и 2-бромэтанол (0,62 г, 5 ммоль), получают указанное в заголовке соединение (145,7 мг, 45%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,98 (3Н, с), 2,45-2,5 (2H, м), 2,9-3,2 (1H, м), 3,5-3,55 (2H, м), 3,65-3,85 (2H, уш.м), 3,82 (3H, с), 4,18 (3H, с), 5,34 (2H, с), 6,93 (2H, т, J=8,0 Гц), 7,11 (1H, д, J=9,0 Гц), 7,18 (1H, с), 7,25-7,35 (1H, м), 7,35-7,45 (3H, м), 7,57 (2H, д, J=8,7 Гц), 7,66 (1H, с).
Элементный анализ для C30H29F2N7O6S·0,6H2O:
Вычислено С, 54,23; H, 4,58; N, 14,76.
Найдено: C, 53,98; H, 4,61; N, 14,72.
Пример 82
Получение N-{4-[1-(2,6-дифторбензил)-5-{[(2-гидроксиэтил) (метил)амино]метил}-3-(4-метоксифенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил]фенил}-N'-метоксимочевины
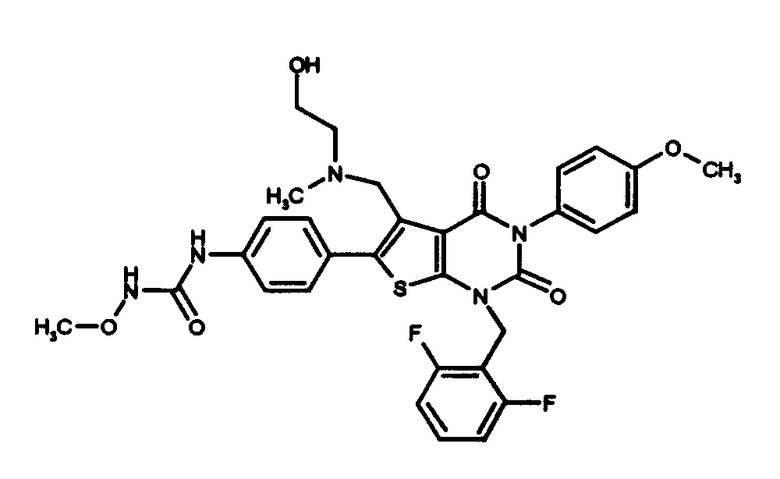
По реакции, аналогично описанной в примере 4, используя соединение (123 мг, 0,191 ммоль), полученное в ссылочном примере 25, и 2-бромэтанол (239 мг, 1,91 ммоль), получают указанное в заголовке соединение (47,1 мг, 39%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 1,99 (3H, с), 2,45-2,55 (2Н, м), 3,5-3,6 (2Н, м), 3,79 (2Н, с), 3,82 (3Н, с), 3,83 (3Н, с), 5,36 (2Н, с), 6,92 (2Н, т, J=8,0 Гц), 6,99 (2H, д, J=8,8 Гц), 7,1-7,3 (4H, м), 7,39 (2H, д, J=8,8 Гц), 7,56 (2H, д, J=8,8 Гц), 7,64 (1H, с).
Пример 83
Получение N-(4-(1-(2,6-дифторбензил)-5-((диметиламино)метил)-3-(6-метокси-3-пиридазинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевины
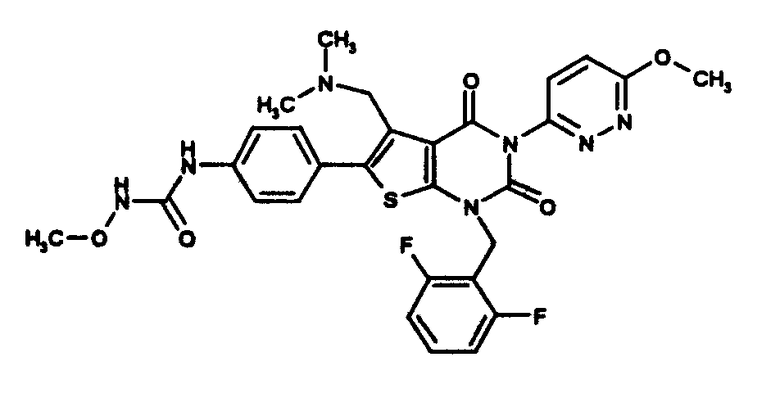
По реакции, аналогично описанной в примере 4, используя соединение (100 мг, 0,164 ммоль), полученное в ссылочном примере 54, и метилиодид (0,010 мл, 0,164 ммоль), получают указанное в заголовке соединение (17,3 мг, 17%) в виде бесцветных кристаллов.
1H-ЯМР (CDCl3) δ: 2,15 (6H, с), 3,6-3,8 (2H, м), 3,82 (3H, с), 4,18 (3H, с), 5,35 (2H, с), 6,92 (2H, т, J=8,2 Гц), 7,12 (1H, д, J=8,8 Гц), 7,2-7,65 (7H, м), 7,69 (1H, с).
Пример 84
Получение N-{4-[1-(2,6-дифторбензил)-5-[(диметиламино)метил]-3-(6-метоксипиридин-3-ил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил]фенил}-N'-метоксимочевины
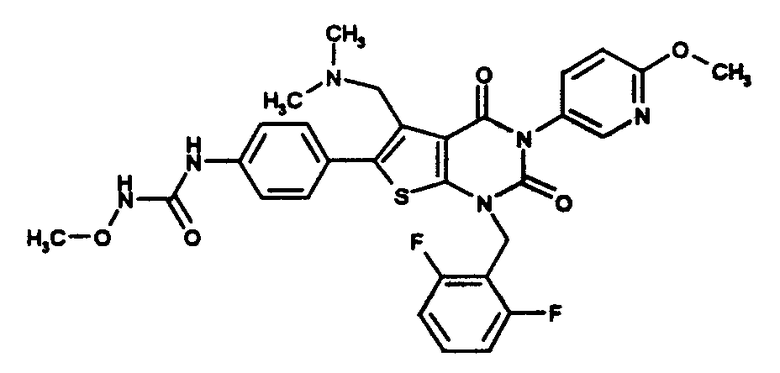
По реакции, аналогично описанной в ссылочном примере 26, используя соединение (41,1 мг, 0,067 ммоль), полученное в ссылочном примере 49, и раствор диметиламина в ТГФ (0,67 мл, 1,34 ммоль), получают указанное в заголовке соединение (18,4 мг, 44%) в виде белого порошка.
1H-ЯМР (CDCl3) δ: 2,13 (6H, с), 3,68 (2H, с), 3,83 (3H, с), 3,96 (3H, с), 5,36 (2H, с), 6,8-7,0 (3H, м), 7,13 (1H, с), 7,2-7,4 (1H, м), 7,45-7,65 (6H, м),8,10 (1Н, д, J=2,6 Гц).
Препарат 1
Таблетку получают обычным способом, используя соединение, полученное в примере 40 (100 мг), лактозу (165 мг), кукурузный крахмал (25 мг), поливиниловый спирт (4 мг) и стеарат магния (1 мг).
Препарат 2
Соединение, полученное в примере 40 (5 г), растворяют в дистиллированной воде для инъекций и доводят общий объем раствора до 100 мл. Раствор подвергают стерильной фильтрации на мембранном фильтре диаметром 0,22 мкм (Sumitomo Electric Industries, Ltd. или Sartorius K.K.), каждые 2 мл раствора заливают в стерилизованный флакон, лиофилизируют общепринятым способом, получая лиофилизированный препарат для инъекций.
Препарат 3
Таблетку получают обычным способом, используя соединение, полученное в примере 41 (100 мг), лактозу (165 мг), кукурузный крахмал (25 мг), поливиниловый спирт (4 мг) и стеарат магния (1 мг).
Препарат 4
Полученное в примере 41 соединение, (5 г), растворяют в дистиллированной воде для инъекций и доводят общий объем раствора до 100 мл. Раствор подвергают стерильной фильтрации на мембранном фильтре диаметром 0,22 мкм (Sumitomo Electric Industries, Ltd. или Sartorius K.K.), каждые 2 мл раствора заливают в стерилизованный флакон, лиофилизируют общепринятым способом, получая лиофилизированный препарат для инъекций.
Препарат 5
Вышеуказанные компоненты (1), (3), (4), (5), (6), (7) и (8) суспендируют или растворяют в очищенной воде, частицы для образования ядра препарата (2) покрывают раствором для получения твердых мелких гранул. На твердые мелкие гранулы наносят компоненты (9)-(11) и получают мелкие гранулы с покрытием. Их смешивают с компонентом (12) для получения мелких гранул, содержащих 1% KM05283 (500 г). Каждые 500 мг мелких гранул упаковывают отдельно.
Экспериментальный пример 1
(1) Препарат 125I-лейпрорелина
В пробирку, содержащую 10 мкл водного 3×10-4M раствора лейпрорелина и 10 мкл лактопероксидазы (0,01 мг/мл), добавляют (37 МБк) раствора Na125I. После перемешивания добавляют 10 мкл 0,001% H2O2 и проводят реакцию при комнатной температуре в течение 20 мин. Реакцию прекращают добавлением 700 мкл 0,05% раствора TFA с последующей очисткой методом ВЭЖХ с обращенной фазой. Ниже указаны используемые условия ВЭЖХ. 125I-лейпрорелин элюируют при времени удерживания 26-27 минут.
Колонка: TSKge1 ODS-80™ (обозначение TM указывает на зарегистрированную торговую марку в данном случае и в случаях, указанных ниже) CTR (4,6 мм×10 см). Элюенты:
Растворитель A (0,05% TFA)
Растворитель B (40% CH3CN-0,05% TFA)
- 0 минут (100% растворитель A)
- 3 минуты (100% растворитель A)
- 7 минут (50% растворитель A+50% растворитель B)
- 40 минут (100% растворитель B)
Температура элюирования: комнатная температура
Скорость элюирования: 1 мл/мин.
(2) Препарат фракции клеточных мембран CHO (яичников китайского хомячка), содержащий GnRH рецептор обезьяны
Клетки CHO (109 клеток), экспрессирующие GnRH рецептор обезьяны, суспендируют в физиологическом растворе, забуференном фосфатом и содержащим 5 мМ EDTA (PBS-EDTA), и центрифугируют при 100×g в течение 5 минут. К дебрису добавляют 10 мл буфера клеточного гомогената (10 мМ NaHCO3, 5 мМ EDTA, pH 7,5) с последующей гомогенизацией с помощью гомогенизатора Polytron. После центрифугирования при 400×g в течение 15 минут супернатант переносят в пробирку для ультрацентрифугирования, центрифугируют при 100000×g в течение 1 часа и получают осадок фракции мембран. Осадок суспендируют в 2 мл буфера для анализа и центрифугируют при 100000×g в течение 1 часа. Фракцию мембран, возвращенную в виде осадка, вновь суспендируют в 20 мл буфера для анализа, разливают и хранят при -80°C, размораживая перед применением.
(3) Препарат фракции клеточных мембран CHO (яичников китайского хомячка), содержащий GnRH рецептор человека.
Клетки CHO (109 клеток), экспрессирующие GnRH рецептор человека,суспендируют в физиологическом растворе, забуференном фосфатом и содержащим 5 мМ EDTA (PBS-EDTA), и центрифугируют при 100×g в течение 5 минут. К дебрису добавляют 10 мл буфера клеточного гомогената (10 мМ NaHCO3, 5 мМ EDTA, pH 7,5) с последующей гомогенизацией с помощью гомогенизатора Polytron. После центрифугирования при 400×g в течение 15 минут супернатант переносят в пробирку для ультрацентрифугирования и центрифугируют при 100000×g в течение 1 часа, получая осадок фракции мембран. Осадок суспендируют в 2 мл буфера для анализа и центрифугируют при 100000×g в течение 1 часа. Фракцию мембран, возвращенную в виде осадка, вновь суспендируют в 20 мл буфера для анализа, разливают и хранят при -80°C, размораживая перед применением.
(4) Определение скорости ингибирования связывания 125I-лейпрорелином
Фракции мембран обезьяны и человека, полученные выше (2) и (3), разводят буфером для анализа, получая разведение 200 мкг/мл, каждую из которых затем разливают в пробирки (по 188 мкл). В пробирку, содержащую фракцию клеточных мембран CHO с экспрессируемыми GnRH рецепторами обезьяны, добавляют 2 мкл раствора 20 мМ соединения в 60% ДМСО и 10 мкл 38нМ 125I-лейпрорелин. В пробирку, содержащую фракцию клеточных мембран CHO с экспрессируемыми GnRH рецепторами человека, добавляют 2 мкл раствора 20 мМ соединения в 60% ДМСО и 10 мкл 38 нМ 125I-лейпрорелина. Чтобы определить максимальное количество для связывания, приготавливают реакционную смесь, содержащую 20 мМ соединения в 60% ДМСО и 10 мкл 38нМ 125I-лейпрорелина. Чтобы определить количество для неспецифического связывания, приготавливают реакционную смесь, содержащую 2 мкл раствора 100 мкМ лейпрорелина в 60% ДМСО и 10 мкл 38 нМ 125I-лейпрорелина.
В тех случаях, когда используют фракцию мембран CHO с экспрессируемыми GnRH рецепторами обезьяны и человека, реакцию проводят при 25°C в течение 60 минут. После каждой реакции реакционную смесь аспирируют и фильтруют через Whatman стеклянный фильтр, обработанный полиэтиленимином (GF-F). После фильтрования γ-счетчиком измеряют радиоактивность 125I-лейпрорелина, остающегося на фильтровальной бумаге. Рассчитывают экспрессию (TB-SB)/(TB-NSB)×100 (где SB=радиоактивность с прибавленным соединением, TB=радиоактивность при максимальном связывании, NSB=радиоактивность при неспецифическом связывании), чтобы определить скорость ингибирования связывания для каждого из испытуемых соединений. Кроме того, скорость ингибирования определяют путем варьирования концентрации испытуемого вещества и концентрацию ингибирования 50% (величину IC50) соединения рассчитывают по графику Хилла. Результаты приведены ниже.
Применимость
Соединение настоящего изобретения обладает превосходной антагонистической активностью в отношении гонадотропин высвобождающего гормона. Оно также обладает хорошей всасываемостью при пероральном введении, высокой стабильностью и отличной фармакокинетикой. Из-за низкой токсичности указанное соединение является превосходным с точки зрения безопасности. Следовательно, соединение настоящего изобретения можно применять, например, в качестве средства для профилактики и лечения гормонозависимых заболеваний. Конкретно, данное соединение эффективно, например, в качестве средства для профилактики и лечения видов рака, зависимых от половых гормонов (например, рака предстательной железы, рака матки, рака груди, опухолей гипофиза и т.п.), гипертрофии предстательной железы,гистеромиомы, эндометриоза, метрофибромы, преждевременной половой зрелости, аменореи, предменструального синдрома, синдрома поликистоза яичника, акне, алопеции, болезни Альцгеймера и т.п.; в качестве регулятора наступления беременности (например, контрацептива), лекарства от бесплодия или регулятора менструации, в качестве средства для профилактики и лечения синдрома раздраженной толстой кишки; или в качестве средства профилактики послеоперационных рецидивов раковых заболеваний, зависимых от половых гормонов, и в качестве лекарственного средства. Указанное соединение также эффективно в области животноводства в качестве регулятора эструса у животных, средства для повышения качества мясопродуктов или регулятора роста животных, и в качестве стимулятора нереста рыб в области рыбоводства.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕДОТВРАЩАЮЩИЙ ПРЕЖДЕВРЕМЕННУЮ ОВУЛЯЦИЮ АГЕНТ | 2006 |
|
RU2419435C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИМИДОНА ИЛИ ПИРРОЛОТРИАЗОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2014 |
|
RU2674977C2 |
| СУЛЬФОНАМИДНОЕ ПРОИЗВОДНОЕ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2607081C2 |
| ТИЕНОПИРИМИДИНДИОНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2002 |
|
RU2294937C9 |
| СОЕДИНЕНИЯ ТИЕНОПИРИМИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2158739C2 |
| ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2571662C2 |
| ПИРИМИДИНАМИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2006 |
|
RU2420519C2 |
| КОНДЕНСИРОВАННОЕ 4-ОКСОПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ | 2005 |
|
RU2358969C2 |
| ХИМИЧЕСКИЕ СОЕДИНЕНИЯ 637: ПИРИДОПИРИМИДИНДИОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2008 |
|
RU2479584C2 |
| ПРОИЗВОДНОЕ СУЛЬФОНАМИДА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2014 |
|
RU2667520C9 |
Настоящее изобретение относится к производным тиенопиримидина общей формулы I
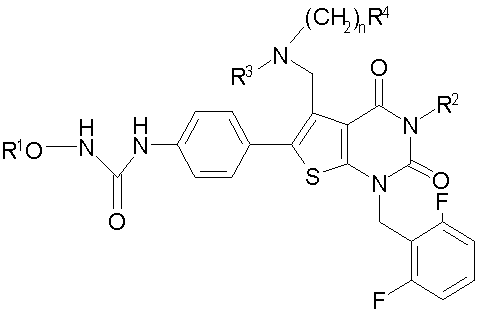
где
R1 означает С1-4алкил;
R2 означает
С1-6алкил, возможно замещенный (1') гидроксигруппой, (2') С1-4алкокси, (3') С1-4алкоксикарбонилом, (4') ди-С1-4алкилкарбамоилом, (5') 5-6-членной азотсодержащей гетероциклической группой, (6') С1-С4алкилкарбонилом и (7') галогеном,
5-6-членная азотсодержащая гетероциклическая группа,
фенил, который может содержать заместитель,
R3 - С1-4алкил, R4 - С1-4алкокси.
Соединения проявляют антагонистическую активность в отношении гонадотропин высвобождающего гормонов (GnRH). Описано также лекарственное средство на основе соединений I, применение соединений для изготовления фармацевтической композиции и способ воздействия антагониста на гонадотропин высвобождающий гормон. 8 н. и 9 з.п. ф-лы, 1 табл.
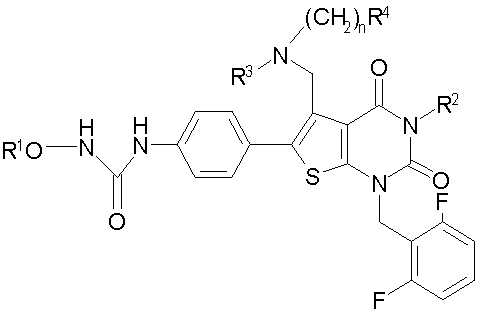
где R1 означает С1-4алкил;
R2 означает
(1) С1-6алкил, который может содержать заместитель, выбранный из группы, состоящей из (1') гидроксигруппы, (2') С1-4алкокси, (3') С1-4алкоксикарбонила, (4') ди-С1-4алкилкарбамоила, (5') 5-6-членной азотсодержащей гетероциклической группы, (6') С1-4алкилкарбонила и (7') галогена,
(2) С3-8циклоалкил, который может содержать гидроксигруппу,
(3) 5-6-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') гидроксигруппы, (3') С1-4алкила и (4') С1-4алкокси,
(4) фенил, который может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') С1-4алкокси-С1-4алкила, (3') моно-С1-4алкилкарбамоил-С1-4алкила, (4') С1-4алкокси, (5') моно-С1-4алкилкарбамоил-С1-4алкокси, или
(5) С1-4алкокси;
R3 означает С1-4алкил;
R4 означает
(1) атом водорода,
(2) С1-4алкокси,
(3) фенил,
(4) N-C1-4алкил-N-C1-4алкилсульфониламино,
(5) гидроксигруппу или
(6) 5-6-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') оксо, (2') С1-4алкила, (3') гидрокси-С1-4алкила, (4') С1-4алкоксикарбонила, (5') моно-С1-4алкилкарбамоила и (6') С1-4алкилсульфонила;
n равно целому числу от 1 до 4;
при условии, что, когда R2 означает фенил, который может содержать заместитель, R4 означает 5-6-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1) оксо, (2) гидрокси-С1-4алкила, (3) С1-4алкоксикарбонила, (4) моно-С1-4алкилкарбамоила и (5) С1-4алкилсульфонила;
или его соль.
где R2 означает
(1) С1-4алкил, который может содержать заместитель, выбранный из группы, состоящей из (1') гидроксигруппы, (2') С1-4алкокси, (3') С1-4алкоксикарбонила, (4') ди-С1-4алкилкарбамоила и (5') 5-6-членной азотсодержащей гетероциклической группы,
(2) С3-8циклоалкил, который может содержать гидроксигруппу,
(3) 5-6-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') гидроксигруппы, (3') С1-4алкила и (4') С1-4алкокси,
(4) фенил, который может содержать заместитель, выбранный из группы, состоящей из (1') галогена, (2') С1-4алкокси-С1-4алкила, (3') моно-С1-4алкилкарбамоил-(С1-4)алкила и (4') моно-С1-4алкилкарбамоил (С1-4)алкокси, или
(5) С1-4алкокси;
R4 означает
(1) С1-4алкокси,
(2) фенил,
(3) N-С1-4алкил-N-C1-4алкилсульфониламино или
(4) 5-6-членную азотсодержащую гетероциклическую группу, которая может содержать заместитель, выбранный из группы, состоящей из (1') оксо, (2') гидрокси-С1-4алкила, (3') С1-4алкоксикарбонила, (4') моно-С1-4алкилкарбамоила и (5') С1-4алкилсульфонила.
N-(4-(1-(2,6-дифторбензил)-5-(((2-этоксиэтил)(метил)амино)метил)-2,4-диоксо-3-(2-пиридинил)-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина,
N-(4-(1-(2,6-дифторбензил)-5-((диметиламино)метил)-3-(6-метокси-3-пиридазинил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина или
N-(4-(1-(2,6-дифторбензил)-5-((диметиламино)метил)-3-(6-метоксипиридин-3-ил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина или их соли.
N-(4-(1-(2,6-дифторбензил)-5-((диметиламино)метил)-3-(4-метоксифенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина или их соли.
N-(4-(5-((бензил(метил)амино)метил)-1-(2,6-дифторбензил)-3-(4-(1-гидрокси-1-метилэтил)фенил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина;
или N-(4-(1-(2,6-дифторбензил)-3-((1-(гидроксиметил)циклопропил)метил)-5-(((2-метоксиэтил)(метил)амино)метил)-2,4-диоксо-1,2,3,4-тетрагидротиено[2,3-d]пиримидин-6-ил)фенил)-N'-метоксимочевина; или их соли.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2008-08-20—Публикация
2004-01-28—Подача