ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение посвящено пиримидинамидным соединениям, их получению, содержащим эти соединения фармацевтическим композициям и их фармацевтическому применению в лечении патологических состояний, которые можно модулировать ингибированием рецептора простагландина D-синтазы.
УРОВЕНЬ ТЕХНИКИ
Аллергическим ринитом, наиболее распространенным атопическим заболеванием, по оценкам страдает от примерно 5 до примерно 22 процентов всего населения, и его характерными симптомами являются чихание, носовые выделения и заложенность носа. Предполагается, что такие симптомы вызываются различными медиаторами, выделяемыми мастоцитами и другими воспалительными клетками. Существующие методы лечения, например антигистаминные препараты, эффективно устраняют чихание и носовые выделения, но оказывают слабое воздействие на заложенность, которая является ключевым симптомом, влияющим на качество жизни пациентов.
Показано, что локальная стимуляция аллергеном пациентов с аллергическим ринитом, бронхиальной астмой, аллергическим конъюнктивитом и атопическим дерматитом приводит к быстрому росту уровня простагландина D2 (PGD2) в назальной и бронхиальной смывной жидкости, слезах и кожной полостной жидкости. PGD2 может оказывать разное воспалительное действие, например повышать проницаемость сосудов в конъюнктиве и коже, повышать сопротивление дыхательных путей носа, сужение дыхательных путей и проникновение эозинофилов в конъюнктиву и трахеи. PGD2 - основной циклооксигеназный продукт арахидоновой кислоты, производимый мастоцитами при иммунологическом стимулировании [Lewis R.A., Soter N.A., Diamond P.T., Austen K.F., Oates J.A., Roberts L.J. II, Prostaglandin D2 generation after activation of rat and human mast cells with anti-IgE, J. Immunol. 129, 1627-1631, 1982]. Активированные мастоциты, один из главных источников PGD2, играют одну из ключевых ролей в возникновении аллергической реакции при таких заболеваниях, как астма, аллергический ринит, аллергический конъюнктивит, аллергический дерматит и другие заболевания [Brightling C.E., Bradding P., Pavord I.D., Wardlaw A.J., New Insights into the role of the mast cell in asthma, Clin. Exp. Allergy. 33, 550-556, 2003].
В присутствии сульфгидрильных соединений PGD2 образуется при изомеризации PGH2, распространенного предшественника простаноидов, при каталитическом воздействии простагландин D синтазы «(PGDS)». Существует две изоформы фермента PGDS: L-PGDS и H-PGDS. H-PGDS является цитозольным ферментом, который распределяется в периферических тканях и который локализован в антиген-представляющих клетках, мастоцитах, мегакариоцитах и Th2 лимфоцитах. Действие продукта PGD2 опосредовано рецепторами, связанными с G-белком: D простагландином «(DP)» и crTH2. См. (1) Prostaglandin D Synthase: Structure and Function. T. Urade and O. Hayaishi, Vitamin and Hormones, 2000, 58, 89-120, (2) J. J. Murray, N. Engl. J. Med., 1986 Sept. 25; 315(13):800, и (3) Urade et al., J. Immunology 168: 443-449, 2002.
Авторы полагают, что ингибирование образования PGD2 должно оказывать воздействие на заложенность носа, а потому проявлять терапевтический эффект при аллергическом рините. Кроме того, авторы полагают, что ингибитор PGDS должен обладать терапевтическим эффектом для некоторых других показаний, например бронхиальной астмы.
Имеются данные об ингибиторах PGDS. Известно, что соединение HQL-79 является слабым ингибитором PGDS и проявляет антиастматическое действие в исследованиях на морских свинках и крысах (Matsusshita, et al., Jpn. J. Pharamcol. 78: 11, 1998). Соединение Tranilast проявляет свойства ингибитора PGDS (Inhibitory Effect of Tranilast on Prostaglandin D Synthetase. K. Ikai, M. Jihara, K. Fujii, and Y. Urade. Biochemical Pharmacology, 1989, 28, 2773-2676).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение посвящено соединению формулы (I)
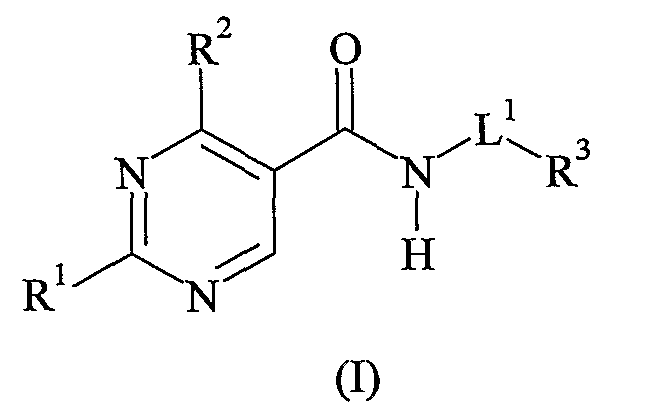
где
R1 представляет собой арил, гетероарил или (C5-C6)-циклоалкил, каждый из которых необязательно имеет в качестве заместителя галоген, (C1-C6)-алкил, гидрокси, (C1-C6)-алкокси, (C1-C4)-галогеналкил или (C1-C4)-галогеналкокси;
R2 представляет собой водород или (C1-C4)-алкил;
R3 представляет собой -P(=O)-(алкокси)2 или Y1Y2N-SO2-,
циклоалкил, циклоалкенил, арил, гетероарил, гетероциклил, гетероцикленил или полициклический алкарил, каждый из которых необязательно имеет в качестве заместителя
ацил, циано, нитро, галоген, гидрокси, карбокси, амидино,
R5O-C(=O)-C(=N-OR4)-, Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-C(=O)-O-, Y1Y2N-SO2-,
R7-SO2-NR6-, R7-C(=O)-NR6-, Y1Y2N-(C1-C4)-алкилен-SO2-(C1-C4)-алкилен-, или
алкил, алкенил, алкинил, алкокси, алкоксикарбонил, алкилтио, алкилсульфинил, или алкилсульфонил, каждый из которых необязательно имеет в качестве заместителя
галоген, алкокси, галогеналкокси, гидрокси, карбокси, алкоксикарбонил, -P(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-,
арил или гетероарил, каждый из которых необязательно имеет в качестве заместителя алкил, галоген, галогеналкил, алкокси, галогеналкокси, гидрокси, амино, алкиламино, диалкиламино, карбокси, или алкоксикарбонил, или
гетероциклил или арилгетероциклил, каждый из которых необязательно имеет в качестве заместителя оксо или алкил, или
арил, гетероарил, ароил, гетероароил, арилокси, гетероарилокси, или гетероциклил, каждый из которых необязательно имеет в качестве заместителя алкил, галогеналкил, галоген, алкокси, галогеналкокси, гидрокси, карбокси, алкоксикарбонил, -P(=O)-(алкокси)2, Y1Y2N-, или Y1Y2N-SO2-, и
когда R3 является циклоалкилом, циклоалкенилом, гетероциклилом, гетероцикленилом или полициклическим алкарилом, он также необязательно замещен оксо;
L1 представляет собой связь или (C1-C6)-алкилен, который необязательно замещен гидрокси, или когда R3 необязательно имеет в качестве заместителя циклоалкил, циклоалкенил, арил, гетероарил, гетероциклил, гетероцикленил или полициклический алкарил, тогда (C1-C6)-алкилен также может быть замещен -P(=O)-(алкокси)2;
R4, R5 и R6, каждый независимо, является водородом или алкилом,
R7 представляет собой алкил, который необязательно имеет в качестве заместителя гидрокси, галоген или алкокси, или
арил, гетероарил, арилалкил или гетероарилалкил, причем арил, гетероарил или арильная или гетероарильная группа арилалкила или гетероарилалкила необязательно имеет в качестве заместителя алкил, галогеналкил, гидрокси, карбокси, алкоксикарбонил, амино, алкиламино, диалкиламино, галоген, алкокси или галогеналкокси; и
Y1 и Y2, каждый независимо, является
водородом,
алкилом, который необязательно имеет в качестве заместителя
гидрокси, карбокси, галоген, амино, алкиламино, диалкиламино, циклоалкиламино, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, циклоалкиламинокарбонил,
алкокси, необязательно замещенный гидрокси,
циклоалкил, гетероциклил, арил или гетероарил, каждый из которых необязательно имеет в качестве заместителя алкил, галоген или галогеналкил, или
циклоалкилом, который может быть замещен карбокси, или
Y1 и Y2 вместе с атомом азота, с которым они связаны, образуют гетероциклил, который необязательно содержит еще один гетероатом, выбираемый из кислорода, азота или серы, где гетероциклил необязательно имеет в качестве заместителя алкил или оксо;
или гидрат, сольват или его N-оксид, или его фармацевтически приемлемая соль.
Другим аспектом настоящего изобретения является фармацевтическая композиция, включающая фармацевтически эффективное количество соединения формулы (I), или гидрат, сольват или его N-оксид, или его фармацевтически приемлемая соль, в смеси с фармацевтически приемлемым носителем.
Еще один аспект настоящего изобретения направлен на способ лечения аллергических и/или воспалительных расстройств, в частности таких расстройств, как аллергический ринит, астма и/или хроническое обструктивное заболевание легких (ХОЗЛ) у пациента, нуждающегося в таком лечении, посредством введения пациенту соединения формулы (I), или гидрата, сольвата или его N-оксида, или его фармацевтически приемлемой соли.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определение терминов
Используемые выше и во всем тексте описания изобретения следующие термины, если не указано иначе, имеют следующие принятые значения:
«Ацил» означает H-CO- или (алифатический или циклический)-CO-. К конкретным примерам ацилов относятся низшие алканоилы, содержащие низшие алкилы. Примерами ацилов являются формил, ацетил, пропаноил, 2-метилпропаноил, бутаноил, пальмитоил, акрилоил, пропиноил и циклогексилкарбонил.
«Алкенил» означает линейную или разветвленную алифатическую углеводородную группу с двойной углерод-углеродной связью, имеющую от 2 до примерно 15 атомов углерода. В конкретном примере алкенил включает от 2 до примерно 12 атомов углерода. В более конкретном примере алкенил включает от 2 до примерно 4 атомов углерода. "Разветвленный" означает, что к линейной алкенильной цепи присоединена одна или несколько низших алкильных групп, таких как метил, этил или пропил. «Низший алкенил» означает от примерно 2 до 4 атомов углерода в цепи, которая может быть линейной или разветвленной. Примерами алкенилов являются этенил, пропенил, н-бутенил, изобутенил, 3-метилбут-2-енил, н-пентенил, гептенил, октенил, циклогексилбутенил и деценил.
"Алкокси" означает алкил-O-. Примерами алкокси являются метокси, этокси, н-пропокси, изопропокси, н-бутокси и гептокси.
"Алкоксикарбонил" означает алкил-O-CO-. Примерами алкоксикарбонила являются метоксикарбонил, этоксикарбонил и трет-бутилоксикарбонил.
«Алкил» означает линейную или разветвленную алифатическую углеводородную группу, имеющую от 1 до примерно 20 атомов углерода. В конкретном примере алкил включает от 1 до примерно 12 атомов углерода. В более конкретном примере алкил является низшим алкилом. "Разветвленный" означает, что к линейной алкильной цепи присоединена одна или несколько низших алкильных групп, таких как метил, этил или пропил. «Низший алкил» означает от 1 до примерно 4 атомов углерода в линейной алькильной цепи, которая может быть прямой или разветвленной.
"Алкиламино" означает алкил-NH-. В конкретном примере алкиламино является (C1-C6)-алкиламино. Примерами алкиламино являются метиламино и этиламино.
«Алкилен» означает линейный или разветвленный бивалентный углеводород, имеющий от 1 до примерно 15 атомов углерода. В конкретном примере алкиленом является низший алкилен с количеством атомов углерода от 1 до примерно 6. Примерами алкиленов являются метилен, этилен, пропилен и бутилены.
"Алкилсульфонил" означает алкил-SO2-. В конкретном примере алкилсульфонилом является (C1-C6)-алкилсульфонил. Примерами алкилсульфонила являются CH3-SO2- и CH3CH2-SO2-.
"Алкилтио" означает алкил-S-. Примером алкилтио является CH3-S-.
«Алкинил» означает линейный или разветвленный алифатический углеводород с тройной углерод-углеродной связью, имеющий от 2 до примерно 15 атомов углерода. В конкретном примере алкинил включает от 2 до примерно 12 атомов углерода. В более конкретном примере алкинил включает от 2 до примерно 6 атомов углерода. Разветвленный означает, что к линейной алкинильной цепи присоединена одна или несколько низших алкильных групп, таких как метил, этил или пропил. «Низший алкинил» означает от 2 до примерно 4 атомов углерода в прямой алкинильной цепи, которая может быть линейной или разветвленной. Примерами алкинилов являются этинил, пропинил, н-бутинил, 2-бутинил, 3-метилбутинил, н-пентинил, гептинил, октинил и децинил.
"Ароил" означает арил-CO-. Примерами ароила являются бензоил и 1- и 2-нафтоил.
«Арил» означает ароматическую моноциклическую или полициклическую кольцевую систему, имеющую от 6 до примерно 14 атомов углерода. В конкретном примере арил имеет от примерно 6 до примерно 10 атомов углерода. Примерами арилов являются фенил и нафтил.
"Арилалкокси" означает арилалкил-O-. Примерами арилалкокси являются бензилокси и 1- или 2-нафтиленметокси.
"Арилалкоксикарбонил" означает арилалкил-O-CO-. Примерами арилалкоксикарбонила являются феноксикарбонил и нафтоксикарбонил.
"Арилалкил" означает арил-алкил-. В конкретном примере арилалкил содержит (C1-C6)-алкильную группу. Примерами арилалкила являются бензил, 2-фенетил и нафтиленметил.
"Арилалкилсульфонил" означает арил-алкил-SO2-. В конкретном примере арилалкилсульфонил содержит (C1-C6)-алкильную группу. Примером арилалкилсульфонила является бензилсульфонил.
«Арилциклоалкенил» означает конденсированные арил и циклоалкенил. В конкретном примере арилциклоалкенилом является такой, в котором арилом является фенил, а циклоалкенильное кольцо имеет от примерно 5 до примерно 7 атомов. Арилциклоалкенил связан через любой из атомов циклоалкенильной группы, допускающий такую связь. Примерами арилциклоалкенилов являются 1,2-дигидронафтилен и инден.
«Арилциклоалкил» означает конденсированные арил и циклоалкил. В конкретном примере арилциклоалкилом является такой, в котором арилом является фенил, а циклоалкильное кольцо имеет от примерно 5 до примерно 6 атомов. Арилциклоалкил связан через любой из атомов циклоалкильной группы, допускающий такую связь. Примером арилциклоалкилов является 1,2,3,4-тетрагидронафтилен.
«Арилгетероцикленил» означает конденсированные арил и гетероцикленил. В конкретном примере арилгетероцикленилом является такой, в котором арилом является фенил, а гетероцикленильное кольцо имеет от примерно 5 до примерно 6 атомов. Арилгетероцикленил связан через любой из атомов гетероцикленильной группы, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероцикленильной части арилгетероцикленила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота арилгетероцикленила может быть основным атомом азота. Атом азота или серы гетероцикленильной части арилгетероцикленила также может быть окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примерами арилгетероцикленилов являются 3H-индолинил, 1H-2-оксохинолил, 2H-l-оксоизохинолил, 1,2-дигидрохинолинил, 3,4-дигидрохинолинил, 1,2-дигидроизохинолинил и 3,4-дигидроизохинолинил.
«Арилгетероциклил» означает конденсированные арил и гетероциклил. В конкретном примере арилгетероциклилом является такой, в котором арилом является фенил, а гетероциклическое кольцо имеет от примерно 5 до примерно 6 атомов. Арилгетероциклил связан через любой из атомов гетероциклической группы, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероциклической части арилгетероциклила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота арилгетероциклила может быть основным атомом азота. Атом азота или серы гетероциклической части арилгетероциклила также может быть окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примерами арилгетероциклилов являются индолинил, 1,2,3,4-тетрагидроизохинолин, 1,2,3,4-тетрагидрохинолин, 1H-2,3-дигидроизоиндол-2-ил, 2,3-дигидробенз[f]изоиндол-2-ил и 1,2,3,4-тетрагидробенз[g]-изохинолин-2-ил.
"Арилокси" означает арил-O-. Примерами арилокси являются фенокси и нафтокси.
"Арилоксикарбонил" означает арил-O-CO-. Примерами арилоксикарбонила являются феноксикарбонил и нафтоксикарбонил.
«Соединения, составляющие предмет настоящего изобретения» и аналогичные выражения призваны охватить описанные ранее в настоящем описании соединения формулы (I), их гидраты, сольваты и N-оксиды, а также их фармацевтически приемлемые соли, где это допускается контекстом. Аналогичным образом ссылка на промежуточные соединения, независимо от того, включены ли они сами в формулу изобретения, призваны охватить их соли, N-оксиды и сольваты в случаях, где это допускается контекстом.
«Циклоалкенил» означает неароматическую моно- или полициклическую кольцевую систему, имеющую от примерно 3 до примерно 10 атомов углерода, в частности от примерно 5 до примерно 10 атомов углерода, в которой есть хотя бы одна двойная углерод-углеродная связь. В конкретном примере кольца кольцевых систем содержат от примерно 5 до примерно 6 атомов в кольце; такие частные примеры размера кольца также называют «низшими». Примерами моноциклических циклоалкенилов являются циклопентенил, циклогексенил и циклогептенил. Примером полициклического циклоалкенила является норборниленил.
«Циклоалкениларил» означает конденсированные арил и циклоалкенил. В конкретном примере циклоалкениларилом является такой, в котором арилом является фенил, а циклоалкенил состоит из от примерно 5 до примерно 6 атомов. Циклоалкениларил связан через любой из атомов арильной группы, допускающий такую связь. Примерами циклоалкениларилов являются 1,2-дигидронафтилен и инден.
«Циклоалкенилгетероарил» означает конденсированные гетероарил и циклоалкенил. В конкретном примере циклоалкенилгетероарилом является такой, в котором гетероарильное кольцо имеет от примерно 5 до примерно 6 атомов, а циклоалкенильное кольцо имеет от примерно 5 до примерно 6 атомов. Циклоалкенилгетероарил связан через любой из атомов гетероарила, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероарильной части циклоалкенилгетероарила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота циклоалкенилгетероарила может быть основным атомом азота. Атом азота гетероарильной части циклоалкенилгетероарила также может быть окислен до соответствующего N-оксида. Примерами циклоалкенилгетероарилов являются 5,6-дигидрохинолил, 5,6-дигидроизохинолил, 5,6-дигидрохиноксалинил, 5,6-дигидрохиназолинил, 4,5-дигидро-1H-бензимидазолил и 4,5-дигидробензоксазолил.
«Циклоалкил» означает неароматическую моно- или полициклическую насыщенную кольцевую систему, имеющую от примерно 3 до примерно 10 атомов углерода, в частности от примерно 5 до примерно 10 атомов углерода. В конкретном примере кольца кольцевых систем содержат от примерно 5 до примерно 7 атомов в кольце; такие частные примеры размера кольца также называют «низшими». Примерами моноциклических циклоалкилов являются циклопентил, циклогексил и циклогептил. Примерами полициклического циклоалкила являются 1-декалин, норборнил и адамант-(1- или 2-)ил.
«Циклоалкиларил» означает конденсированные арил и циклоалкил. В конкретном примере циклоалкиларилом является такой, в котором арилом является фенил, а циклоалкильное кольцо имеет от примерно 5 до 6 атомов. Циклоалкиларил связан через любой из атомов циклоалкильной группы, допускающий такую связь. Примером циклоалкиларила является 1,2,3,4-тетрагидронафтилен.
«Циклоалкилен» означает бивалентную циклоалкильную группу, имеющую от примерно 4 до примерно 8 атомов углерода. В конкретном примере циклоалкилен содержит от примерно 5 до примерно 7 атомов в кольце; такие кольца предпочтительного размера также называют «низшими». Характер связывания циклоалкиленовой группы предусматривает образование 1,1-, 1,2-, 1,3- или 1,4-структур, причем, когда это применимо, стереохимическая конфигурация точек образования связей может быть цис или транс. Примерами моноциклических циклоалкиленов являются (1,1-, 1,2- или 1,3-)циклогексилен и (1,1- или 1,2)циклопентилен.
«Циклоалкилгетероарил» означает конденсированные гетероарил и циклоалкил. В конкретном примере циклоалкилгетероарилом является такой, в котором гетероарильное кольцо имеет от примерно 5 до примерно 6 атомов, а циклоалкильное кольцо имеет от примерно 5 до примерно 6 атомов. Циклоалкилгетероарил связан через любой из атомов гетероарила, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероарильной части конденсированного циклоалкилгетероарила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота циклоалкилгетероарила может быть основным атомом азота. Атом азота гетероарильной части циклоалкилгетероарила также может быть окислен до соответствующего N-оксида. Примерами циклоалкилгетероарилов являются 5,6,7,8-тетрагидрохинолинил, 5,6,7,8-тетрагидроизохинолил, 5,6,7,8-тетрагидрохиноксалинил, 5,6,7,8-тетрагидрохиназолил, 4,5,6,7-тетрагидро-1H-бензимидазолил и 4,5,6,7-тетрагидробензоксазолил.
"Циклил" означает циклоалкил, циклоалкенил, гетероциклил или гетероцикленил.
«Диалкиламино» означает (алкил)2-N-. В конкретном примере диалкиламиногруппой является (C1-C6алкил)2-N-. Примерами диалкиламиногрупп являются диметиламино-, диэтиламино- и метилэтиламиногруппы.
«Галоген» означает фтор, хлор, бром или йод. В конкретном примере галогенами являются фтор или хлор.
«Галогеналкокси» означает алкоксильную группу, имеющую от одной до трех галогеновых групп в качестве заместителей. Предпочтительными являются низшие алкоксильные группы, имеющие от одного до трех галогенов в качестве заместителей. Наиболее предпочтительными являются низшие алкоксильные группы, замещенные одним галогеном.
«Галогеналкил» означает алкильную группу, имеющую от одной до трех галогеновых групп в качестве заместителей. Предпочтительными являются низшие алкильные группы, имеющие от одного до трех галогенов в качестве заместителей. Наиболее предпочтительными являются низшие алкильные группы, замещенные одним галогеном.
"Гетероароил" означает гетероарил-CO-. Примерами гетероароила являются тиофеноил, никотиноил, пиррол-2-илкарбонил и пиридиноил.
«Гетероарил» означает ароматическую моноциклическую или полициклическую кольцевую систему, имеющую от примерно 5 до примерно 14 атомов углерода, в которой один или несколько атомов углерода кольцевой системы являются гетероатомами, отличными от углерода, например азотом, кислородом или серой. Предпочтительные ароматические кольцевые системы имеют от примерно 5 до примерно 10 атомов углерода и от 1 до 3 гетероатомов. Наиболее предпочтительны кольцевые системы размером от примерно 5 до 6 атомов. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероарила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота гетероарила может быть основным атомом азота, а также может быть окисленным до соответствующего N-оксида. Если гетероарил замещен гидроксильной группой, он также включает соответствующий таутомер. Примерами гетероарила являются пиразинил, тиенил, изотиазолил, оксазолил, пиразолил, фуранил, пирролил, 1,2,4-тиадиазолил, пиридазинил, хиноксалинил, фталазинил, имидазо[1,2-а]пиридин, имидазо[2,1-b]тиазолил, бензофуранил, азаиндолил, бензимидазолил, бензотиенил, тиенопиридил, тиенопиримидил, пирролопиридил, имидазопиридил, бензоазаиндолил, 1,2,4-триазинил, бензотиазолил, имидазолил, индолил, индолизинил, изоксазолил, изохинолинил, изотиазолил, оксадиазолил, пиразинил, пиридазинил, пиразолил, пиридил, пиримидинил, пирролил, хиназолинил, хинолинил, 1,3,4-тиадиазолил, тиазолил, тиенил и триазолил.
"Гетероарилалкил" означает гетероарил-алкил-. В более конкретном случае гетероарилалкил содержит (C1-C4)-алкильную группу. Пример гетероарилалкила включает тетразол-5-илметил.
«Гетероарилциклоалкенил» означает конденсированные гетероарил и циклоалкенил. В конкретном примере гетероарилциклоалкенилом является такой, в котором гетероарильное кольцо имеет от примерно 5 до 6 атомов, а циклоалкенильное кольцо имеет от примерно 5 до 6 атомов. Гетероарилциклоалкенил связан через любой из атомов циклоалкенильной группы, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероарильной части гетероарилциклоалкенила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота гетероарилциклоалкенила может быть основным атомом азота. Атом азота гетероарильной части гетероарилциклоалкенила также может быть окислен до соответствующего N-оксида. Примерами гетероарилциклоалкенилов являются 5,6-дигидрохинолил, 5,6-дигидроизохинолил, 5,6-дигидрохиноксалинил, 5,6-дигидрохиназолинил, 4,5-дигидро-1H-бензимидазолил и 4,5-дигидробензоксазолил.
«Гетероарилциклоалкил» означает конденсированные гетероарил и циклоалкил. В конкретном примере гетероарилциклоалкилом является такой, в котором гетероарильное кольцо имеет от примерно 5 до примерно 6 атомов, а циклоалкильное кольцо имеет от примерно 5 до примерно 6 атомов. Гетероарилциклоалкил связан через любой из атомов циклоалкильной группы, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероарильной части насыщенного гетероарилциклоалкила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота гетероарилциклоалкила может быть основным атомом азота. Атом азота гетероарильной части гетероарилциклоалкила также может быть окислен до соответствующего N-оксида. Примерами гетероарилциклоалкилов являются 5,6,7,8-тетрагидрохинолинил, 5,6,7,8-тетрагидроизохинолил, 5,6,7,8-тетрагидрохиноксилинил, 5,6,7,8-тетрагидрохиназолил, 4,5,6,7-тетрагидро-1H-бензимидазолил и 4,5,6,7-тетрагидробензоксазолил.
«Гетероарилгетероцикленил» означает конденсированные гетероарил и гетероцикленил. В конкретном примере гетероарилгетероцикленилом является такой, в котором гетероарильное кольцо имеет от примерно 5 до 6 атомов, а гетероцикленильное кольцо имеет от примерно 5 до 6 атомов. Гетероарилгетероцикленил связан через любой из атомов гетероцикленильной группы, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероарильной или гетероцикленильной части гетероарилгетероцикленила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота гетероарилазагетероциклила может быть основным атомом азота. Атом азота или серы гетероарильной или гетероцикленильной части гетероарилгетероцикленила также может быть окислен до соответствующего N-оксида. Атом азота или серы гетероарильной части или гетероциклической части гетероарилгетероциклила может быть окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примерами гетероарилгетероцикленилов являются 7,8-дигидро[1,7]нафтиридинил, 1,2-дигидро[2,7]-нафтиридинил, 6,7-дигидро-3H-имидазо [4,5-c]пиридил, 1,2-дигидро-1,5-нафтиридинил, 1,2-дигидро-1,6-нафтиридинил, 1,2-дигидро-1,7-нафтиридинил, 1,2-дигидро-1,8-нафтиридинил и 1,2-дигидро-2,6-нафтиридинил.
«Гетероарилгетероциклил» означает конденсированные гетероарил и гетероциклил. В конкретном примере гетероарилгетероциклилом является такой, в котором гетероарильное кольцо имеет от примерно 5 до 6 атомов, а гетероциклическое кольцо имеет от примерно 5 до 6 атомов. Гетероарилгетероциклил связан через любой из атомов гетероциклической группы, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероарильной или гетероциклической части конденсированного гетероарилгетероциклила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота конденсированного гетероарилгетероциклила может быть основным атомом азота. Атом азота или серы гетероарильной группы гетероарилгетероциклила может также быть необязательно окислен соответствующим N-оксидом. Атом азота или серы гетероарильной или гетероциклической части гетероарилгетероциклила также может быть окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примерами гетероарилгетероциклилов являются 2,3-дигидро-lH-пиррол[3,4-b]хинолин-2-ил, 1,2,3,4-тетрагидробенз[b][1,7]нафтиридин-2-ил, 1,2,3,4-тетрагидробенз[b][1,6]нафтиридин-2-ил, 1,2,3,4-тетрагидро-9H-пиридо[3,4-b]индол-2-ил, 1,2,3,4-тетрагидро-9H-пиридо[4,3-b]индол-2-ил, 2,3-дигидро-1H-пирроло[3,4-b]индол-2-ил, 1H-2,3,4,5-тетрагидроазепино[3,4-b]индол-2-ил, 1H-2,3,4,5-тетрагидроазепино[4,3-b]индол-3-ил, 1H-2,3,4,5-тетрагидроазепино[4,5-b]индол-2-ил, 5,6,7,8-тетрагидро[1,7]нафтиридил, 1,2,3,4-тетрагидро[2,7]нафтиридил, 2,3-дигидро[1,4]диоксино[2,3-b]пиридил, 2,3-дигидро[1,4]диоксино[2,3-b]пиридил, 3,4-дигидро-2H-l-окса[4,6]диазанафталинил, 4,5,6,7-тетрагидро-3H-имидазо[4,5-c]пиридил, 6,7-дигидро[5,8]диазанафталинил, 1,2,3,4-тетрагидро[1,5]нафтиридинил, 1,2,3,4-тетрагидро[1,6]нафтиридинил, 1,2,3,4-тетрагидро[1,7]нафтиридинил, 1,2,3,4-тетрагидро[1,8]нафтиридинил и 1,2,3,4-тетрагидро[2,6]нафтиридинил.
"Гетероарилокси" означает гетероарил-O-. Пример гетероарилокси включает пиридилокси.
«Гетероцикленил» означает неароматическую моноциклическую или полициклическую углеводородную кольцевую систему, имеющую от примерно 3 до примерно 10 атомов углерода, в которой один или несколько атомов углерода кольцевой системы являются гетероатомами, отличными от углерода, например азотом, кислородом или серой, и которая содержит по меньшей мере одну двойную углерод-углеродную связь или двойную углерод-азотную связь. Предпочтительные неароматические кольцевые системы имеют от примерно 5 до примерно 10 атомов углерода и от 1 до 3 гетероатомов. Наиболее предпочтительны кольцевые системы размером от примерно 5 до 6 атомов; причем кольцевые системы данного конкретного размера также обозначаются как «низшие». Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероцикленила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота гетероцикленила может быть основным атомом азота. Атом азота или серы гетероцикленила также может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-оксида. Примерами моноциклического азагетероцикленила являются 1,2,3,4-тетрагидрогидропиридил, 1,2-дигидропиридил, 1,4-дигидропиридил, 1,2,3,6-тетрагидропиридил, 1,4,5,6-тетрагидропиримидин, 2-пирролинил, 3-пирролинил, 2-имидазолинил и 2-пиразолинил. Примерами оксагетероцикленила являются 3,4-дигидро-2H-пиран, дигидрофуранил и фтордигидрофуранил. Примером полициклического оксагетероцикленила является 7-оксабицикло[2,2,1]гептенил. Примерами моноциклического тиогетероцикленила являются дигидротиофенил и дигидротиопиранил.
«Гетероциклениларил» означает конденсированные арил и гетероцикленил. В конкретном примере гетероциклениларилом является такой, в котором арил является фенилом, а гетероцикленильное кольцо имеет от примерно 5 до 6 атомов. Гетероциклениларил связан через любой из атомов арила, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероцикленильной части конденсированного гетероциклениларила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота гетероциклениларила может быть основным атомом азота. Атом азота или серы гетероцикленильной части гетероциклениларила также может быть окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примерами гетероциклениларилов являются 3H-индолинил, 1H-2-оксохинолил, 2H-l-оксоизохинолил, 1,2-дигидрохинолинил, 3,4-дигидрохинолинил, 1,2-дигидроизохинолинил и 3,4-дигидроизохинолинил.
«Гетероцикленилгетероарил» означает конденсированные гетероарил и гетероцикленил. В конкретном примере гетероцикленилгетероарилом является такой, в котором гетероарильное кольцо имеет от примерно 5 до 6 атомов, а гетероцикленильное кольцо имеет от примерно 5 до 6 атомов. Гетероцикленилгетероарил связан через любой из атомов гетероарила, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероарильной или гетероцикленильной части гетероцикленилгетероарила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота азагетероцикленилгетероарила может быть основным атомом азота. Атом азота или серы гетероарильной или гетероцикленильной части гетероцикленилгетероарила также может быть окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примерами гетероцикленилгетероарилов являются 7,8-дигидро[1,7]нафтиридинил, 1,2-дигидро[2,7]нафтиридинил, 6,7-дигидро-3H-имидазо[4,5-c]пиридил, 1,2-дигидро-1,5-нафтиридинил, 1,2-дигидро-1,6-нафтиридинил, 1,2-дигидро-1,7-нафтиридинил, 1,2-дигидро-1,8-нафтиридинил и 1,2-дигидро-2,6-нафтиридинил.
«Гетероциклил» означает неароматическую насыщенную моноциклическую или полициклическую кольцевую систему, имеющую от примерно 3 до примерно 10 атомов углерода, в которой один или несколько атомов углерода кольцевой системы являются гетероатомами, отличными от углерода, например азотом, кислородом или серой. Предпочтительные кольцевые системы имеют от примерно 5 до примерно 10 атомов углерода и от 1 до 3 гетероатомов. Конкретные размеры колец в кольцевой системе включат от примерно 5 до 6 атомов, причем кольцевые системы данного конкретного размера также обозначаются как «низшие». Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероциклила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота гетероциклила может быть основным атомом азота. Атом азота или серы гетероциклила также может быть окисленным до соответствующего N-оксида, S-оксида или S,S-диоксида. Примерами моноциклического гетероциклила являются пиперидил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,3-диоксоланил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил и тетрагидротиопиранил.
«Гетероциклиларил» означает конденсированные арил и гетероциклил. В конкретном примере гетероциклиларилом является такой, в котором арилом является фенил, а гетероциклическое кольцо имеет от примерно 5 до 6 атомов. Гетероциклиларил связан через любой из атомов арильной группы, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероциклической части гетероциклиларила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота гетероциклиларила может быть основным атомом азота. Атом азота или серы гетероциклической части гетероциклиларила также может быть окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примерами гетероциклиларилов являются индолинил, 1,2,3,4-тетрагидроизохинолин, 1,2,3,4-тетрагидрохинолин, 1H-2,3-дигидроизоиндол-2-ил, 2,3-дигидробенз[f]изоиндол-2-ил и 1,2,3,4-тетрагидробенз[g]-изохинолин-2-ил.
«Гетероциклилгетероарил» означает конденсированные гетероарил и гетероциклил. В конкретном примере гетероциклилгетероарилом является такой, в котором гетероарильное кольцо имеет от примерно 5 до 6 атомов, а гетероциклическое кольцо имеет от примерно 5 до 6 атомов. Гетероциклилгетероарил связан через любой из атомов гетероарильной группы, допускающий такую связь. Обозначения «аза», «окса» или «тио» в качестве приставки в названии гетероарильной или гетероциклической части гетероциклилгетероарила означают, что по меньшей мере в качестве одного из атомов кольца присутствует атом азота, кислорода или серы соответственно. Атом азота гетероциклилгетероарила может быть основным атомом азота. Атом азота или серы гетероарильной части гетероциклилгетероарила также может быть окислен до соответствующего N-оксида. Атом азота или серы гетероарильной или гетероциклической части гетероциклилгетероарила может быть необязательно окислен до соответствующего N-оксида, S-оксида или S,S-диоксида. Примерами гетероциклилгетероарилов являются 2,3-дигидро-lH-пиррол[3,4-b]хинолин-2-ил, 1,2,3,4-тетрагидробенз[b][1,7]нафтиридин-2-ил, 1,2,3,4-тетрагидробенз[b][1,6]нафтиридин-2-ил, 1,2,3,4-тетрагидро-9H-пиридо[3,4-b]индол-2-ил, 1,2,3,4-тетрагидро-9H-пиридо[4,3-b]индол-2-ил, 2,3-дигидро-1H-пирроло[3,4-b]индол-2-ил, 1H-2,3,4,5-тетрагидроазепино[3,4-b]индол-2-ил, 1H-2,3,4,5-тетра-гидроазепино[4,3-b]индол-3-ил, 1H-2,3,4,5-тетрагидроазепино[4,5-b]индол-2-ил, 5,6,7,8-тетрагидро[1,7]нафтиридил, 1,2,3,4-тетрагидро[2,7]нафтиридил, 2,3-дигидро[1,4]диоксино[2,3-b]пиридил, 2,3-дигидро[1,4]диоксино[2,3-b]пиридил, 3,4-дигидро-2H-1-окса[4,6]диазанафталинил, 4,5,6,7-тетрагидро-3H-имидазо[4,5-c]пиридил, 6,7-дигидро[5,8]диазанафталинил, 1,2,3,4-тетрагидро[1,5]нафтиридинил, 1,2,3,4-тетрагидро[1,6]нафтиридинил, 1,2,3,4-тетрагидро[1,7]нафтиридинил, 1,2,3,4- тетрагидро[1,8]нафтиридинил и 1,2,3,4-тетрагидро[2,6]нафтиридинил.
«Полициклический алкарил» означает полициклическую кольцевую систему, имеющую по меньшей мере одно ароматическое кольцо, конденсированное с по меньшей мере одним неароматическим кольцом, которое может быть насыщенным или ненасыщенным и может также содержать в кольцевой системе один или несколько гетероатомов, таких как азот, кислород или сера. Примерами полициклического алкарила являются арилциклоалкенил, арилциклоалкил, арилгетероцикленил, арилгетероциклил, циклоалкениларил, циклоалкиларил, циклоалкенилгетероарил, циклоалкилгетероарил, гетероарилциклоалкенил, гетероарилциклоалкил, гетероарилгетероцикленил, гетероарилгетероциклил, гетероциклениларил, гетероцикленилгетероарил, гетероциклиларил и гетероциклилгетероарил. В конкретном примере полициклическими алкарильными группами являются бициклические системы, состоящие из одного ароматического кольца, слитого с одним неароматическим кольцом, которые могут содержать в кольцевой системе один или несколько гетероатомов, таких как азот, кислород или сера.
«Пациент» означает человека и других млекопитающих.
«Фармацевтически приемлемые соли» означает нетоксичные, неорганические и органические соли соединений, составляющих предмет настоящего изобретения, образованные при присоединении кислоты и основания. Эти соли могут быть получены in situ на конечной стадии выделения и очистки соединений или при помощи отдельной реакции очищенного соединения в форме свободного основания с подходящей органической или неорганической кислотой и выделением полученной таким образом соли. В некоторых случаях сами соединения способны иметь самопротонирующиеся основные сайты в молекуле и образовывать внутренние амфотерные соли.
Примерами солей присоединения кислоты являются гидробромиды, гидрохлориды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валераты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, фосфаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, нафтилаты, мезилаты, глюкогептонаты, лактиобионаты, сульфаматы, малонаты, салицилаты, пропионаты, метилен-бис-β-гидроксинафтоаты, гентисаты, изэтионаты, ди-пара-толуоилтартраты, метансульфонаты, этансульфонаты, бензолсульфонаты, пара-толуолсульфонаты, циклогексилсульфаматы и лаурилсульфонаты. См., например, S.M. Berge, et al., "Pharmaceutical Salts," J. Pharm. Sci., 66, 1-19 (1977), включенную в настоящее описание в качестве ссылки. Соли, образованные при присоединении основания, можно также получить независимым образом в результате реакции очищенного соединения в его кислой форме с подходящим органическим или неорганическим основанием и выделением полученной таким образом соли. К солям, образующимся при присоединении основания, относятся фармацевтически приемлемые соли металлов и аминов. К подходящим солям металлов относятся соли натрия, калия, кальция, бария, цинка, магния и алюминия. Конкретными примерами соли, образованной при присоединении основания, являются соль натрия или соль калия. Подходящие неорганические соли, образующиеся при присоединении основания, получают из оснований металлов, к которым относятся гидрид натрия, гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид алюминия, гидроксид лития, гидроксид магния и гидроксид цинка. Подходящие аминные соли, образующиеся при присоединении основания, получают из аминов, основность которых достаточна для образования стабильной соли, и, в частности, из аминов, часто используемых в медицинской химии по причине их низкой токсичности и пригодности для использования в медицинских целях. Некоторыми примерами аминов являются аммиак, этилендиамин, N-метилглюкамин, лизин, аргинин, орнитин, холин, N,N'-дибензилэтилендиамин, хлорпрокаин, диэтаноламин, прокаин, N-бензилфенетиламин, диэтиламин, пиперазин, трис(гидроксиметил)аминометан, гидроксид тетраметиламмония, триэтиламин, дибензиламин, эфенамин, дегидроабиэтиламин, N-этилпиперидин, бензиламин, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, этиламин, основные аминокислоты, например лизин и аргинин, и дициклогексиламин.
«Сольват» означает соединение, составляющее предмет настоящего изобретения, физически связанное с одной или несколькими молекулами растворителя. К физическому связыванию относится, в частности, образование водородной связи. В определенных случаях сольват можно будет выделить, например, когда одна или более молекул растворителя включены в кристаллическую решетку твердого кристаллического вещества. Термин «сольват» распространяется как на фазу раствора, так и на изолируемые сольваты. Типичными сольватами являются гидраты, этаноляты и метаноляты.
Конкретные осуществления настоящего изобретения
Одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой фенил, пяти- или шестичленный гетероарил или (C5-C6)-циклоалкил, каждый из которых необязательно имеет в качестве заместителя галоген, (C1-C6)-алкил, гидрокси, (C1-C6)-алкокси, (C1-C4)-галогеналкил или (C1-C4)-галогеналкокси или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой фенил или пяти- или шестичленный гетероарил, каждый из которых необязательно имеет в качестве заместителя галоген, (C1-C6)-алкил, гидрокси, (C1-C6)-алкокси, (C1-C4)-галогеналкил или (C1-C4)-галогеналкокси или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой фенил или пяти- или шестичленный гетероарил, каждый из которых необязательно имеет в качестве заместителя галоген, (C1-C6)-алкил, гидрокси, (C1-C6)-алкокси, (C1-C4)-галогеналкил или (C1-C4)-галогеналкокси или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль, при условии, что если R1 представляет собой фенил или шестичленный гетероарил, тогда его можно замещать только в орто- или мета-положении.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой фенил, пиридил, тиазолил, имидазолил или оксодиазолил, каждый из которых необязательно имеет в качестве заместителя галоген, (C1-C6)-алкил, гидрокси, (C1-C6)-алкокси, (C1-C4)-галогеналкил или (C1-C4)-галогеналкокси, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой фенил или пиридил, каждый из которых необязательно имеет в качестве заместителя в орто- или мета-положении галоген, (C1-C6)-алкил, гидрокси, (C1-C6)-алкокси, (C1-C4)-галогеналкил или (C1-C4)-галогеналкокси, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой фенил, который необязательно имеет в качестве заместителя галоген, (C1-C6)-алкил, гидрокси, (C1-C6)-алкокси, (C1-C4)-галогеналкил или (C1-C4)-галогеналкокси, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой фенил, который необязательно имеет в качестве заместителя в орто- или мета-положении галоген, (C1-C6)-алкил, гидрокси, (C1-C6)-алкокси, (C1-C4)-галогеналкил или (C1-C4)-галогеналкокси, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой фенил, который необязательно имеет в качестве заместителя галоген, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой фенил, который необязательно имеет в качестве заместителя в орто- или мета-положении галоген, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R1 представляет собой 2-фторфенил или 3-фторфенил, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R2 представляет собой водород, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R2 представляет собой метил, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где L1 представляет собой связь, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где L1 представляет собой (C1-C3)-алкилен, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где L1 представляет собой -CH2-, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где
R3 представляет собой циклоалкил, циклоалкенил, арил, гетероарил, гетероциклил, гетероцикленил или полициклический алкарил, каждый из которых необязательно имеет в качестве заместителя
ацил, циано, нитро, галоген, гидрокси, карбокси, амидино,
R5O-C(=O)-C(=N-OR4)-, Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-C(=O)-O-, Y1Y2N-SO2-,
R7-SO2-NR6-, R7-C(=O)-NR6-, Y1Y2N-(C1-C4)-алкилен-SO2-(C1-C4)-алкилен-, или
алкил, алкенил, алкинил, алкокси, алкоксикарбонил, алкилтио, алкилсульфинил или алкилсульфонил, каждый из которых необязательно имеет в качестве заместителя
галоген, алкокси, галогеналкокси, гидрокси, карбокси, алкоксикарбонил, -P(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-,
арил или гетероарил, каждый из которых необязательно имеет в качестве заместителя алкил, галоген, галогеналкил, алкокси, галогеналкокси, гидрокси, амино, алкиламино, диалкиламино, карбокси, или алкоксикарбонил, или
гетероциклил или арилгетероциклил, каждый из которых необязательно имеет в качестве заместителя оксо или алкил, или
арил, гетероарил, ароил, гетероароил, арилокси, гетероарилокси или гетероциклил, каждый из которых необязательно имеет в качестве заместителя алкил, галогеналкил, галоген, алкокси, галогеналкокси, гидрокси, карбокси, алкоксикарбонил, -P(=O)-(алкокси)2, Y1Y2N-, или Y1Y2N-SO2-, и
когда R3 представляет собой циклоалкил, циклоалкенил, гетероциклил, гетероцикленил или полициклический алкарил, он также может быть замещен на оксо,
или его гидрат, сольват или N-оксид, или его фармацевтически приемлемую соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R3 представляет собой фенил, пиридил, тиазолил, имидазолил, оксодиазолил, имидазолил, пиримидинил, тиофенил, оксазолил, циклоалкил, бензооксазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, тетрагидропиранил, пиперидинил, фуранил, бензо[1,3]диоксолил, бензотиазолил, имидазолидинил, индазолил, бензоимидазолил, индолил, бензофуранил или 1,3-дигидро-бензо[c]изотиазолил, каждый из которых необязательно имеет в качестве заместителя
ацил, циано, нитро, галоген, гидрокси, карбокси, амидино,
R5O-C(=O)-C(=N-OR4)-, Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-C(=O)-O-, Y1Y2N-SO2-,
R7-SO2-NR6-, R7-C(=O)-NR6-, Y1Y2N-(C1-C4)-алкилен-SO2-(C1-C4)-алкилен-, или
алкил, алкенил, алкинил, алкокси, алкоксикарбонил, алкилтио, алкилсульфинил, или алкилсульфонил, каждый из которых необязательно имеет в качестве заместителя
галоген, алкокси, галогеналкокси, гидрокси, карбокси, алкоксикарбонил, -P(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-,
арил или гетероарил, каждый из которых необязательно имеет в качестве заместителя алкил, галоген, галогеналкил, алкокси, галогеналкокси, гидрокси, амино, алкиламино, диалкиламино, карбокси, или алкоксикарбонил, или
гетероциклил или арилгетероциклил, каждый из которых необязательно имеет в качестве заместителя оксо или алкил, или
арил, гетероарил, ароил, гетероароил, арилокси, гетероарилокси или гетероциклил, каждый из которых необязательно имеет в качестве заместителя алкил, галогеналкил, галоген, алкокси, галогеналкокси, гидрокси, карбокси, алкоксикарбонил, -P(=O)-(алкокси)2, Y1Y2N-, или Y1Y2N-SO2-, и
когда R3 представляет собой циклоалкил, тетрагидропиранил, пиперидинил, имидазолидинил или 1,3-дигидро-бензо[c]изотиазолил, он также может быть замещен на оксо,
или гидрат, сольват или его N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где
R3 представляет собой фенил, пиридил, тиазолил, имидазолил, оксодиазолил, имидазолил, пиримидинил, тиофенил, оксазолил, циклоалкил, бензооксазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, тетрагидропиранил, пиперидинил, фуранил, бензо[1,3]диоксолил, бензотиазолил, имидазолидинил, индазолил, бензоимидазолил, индолил, бензофуранил или 1,3-дигидробензо[c]изотиазолил, каждый из которых необязательно имеет в качестве заместителя
нитро, галоген, гидрокси, карбокси, амидино, R5O-C(=O)-C(=N-OR4)-, Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-SO2-, R7-SO2-NR6-, R7-C(=O)-NR6-, алкокси, алкоксикарбонил, алкилтио, алкилсульфонил, арил, гетероарил, или
алкил, который необязательно имеет в качестве заместителя
галоген, карбокси, алкоксикарбонил, арил или гетероарил, -P(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-, или
гетероциклил или арилгетероциклил, каждый из которых необязательно имеет в качестве заместителя оксо, или
гетероциклил, который необязательно имеет в качестве заместителя Y1Y2N-, и
когда R3 представляет собой циклоалкил, тетрагидропиранил, пиперидинил, имидазолидинил, или 1,3-дигидро-бензо[c]изотиазолил, он также может быть замещен на оксо; и
Y1 и Y2, каждый независимо, представляют собой водород, циклоалкил или алкил, который необязательно имеет в качестве заместителя гидрокси, алкокси, амино, алкиламино, диалкиламино, гетероарил или гетероциклил, который необязательно имеет в качестве заместителя алкил, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R3 представляет собой фенил, который необязательно имеет в качестве заместителя
ацил, циано, нитро, галоген, гидрокси, карбокси, амидино,
R5O-C(=O)-C(=N-OR4)-, Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-C(=O)-O-, Y1Y2N-SO2-,
R7-SO2-NR6-, R7-C(=O)-NR6-, Y1Y2N-(C1-C4)-алкилен-SO2-(C1-C4)-алкилен-, или
алкил, алкенил, алкинил, алкокси, алкоксикарбонил, алкилтио, алкилсульфинил или алкилсульфонил, каждый из которых необязательно имеет в качестве заместителя
галоген, алкокси, галогеналкокси, гидрокси, карбокси, алкоксикарбонил, -P(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-,
арил или гетероарил, каждый из которых необязательно имеет в качестве заместителя алкил, галоген, галогеналкил, алкокси, галогеналкокси, гидрокси, амино, алкиламино, диалкиламино, карбокси или алкоксикарбонил, или
гетероциклил или арилгетероциклил, каждый из которых необязательно имеет в качестве заместителя оксо или алкил, или
арил, гетероарил, ароил, гетероароил, арилокси, гетероарилокси или гетероциклил, каждый из которых необязательно имеет в качестве заместителя алкил, галогеналкил, галоген, алкокси, галогеналкокси, гидрокси, карбокси, алкоксикарбонил, -P(=O)-(алкокси)2, Y1Y2N- или Y1Y2N-SO2-,
или гидрат, сольват или его N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где
R3 представляет собой фенил, который необязательно имеет в качестве заместителя
нитро, галоген, гидрокси, карбокси, амидино, R5O-C(=O)-C(=N-OR4)-, Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-SO2-, R7-SO2-NR6-, R7-C(=O)-NR6-, алкокси, алкоксикарбонил, алкилтио, алкилсульфонил, арил, гетероарил, или
алкил, который необязательно имеет в качестве заместителя
галоген, карбокси, алкоксикарбонил, арил или гетероарил, -P(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-, или
гетероциклил или арилгетероциклил, каждый из которых необязательно имеет в качестве заместителя оксо, или
гетероциклил, который необязательно имеет в качестве заместителя Y1Y2N-, и
Y1 и Y2, каждый независимо, представляют собой водород, циклоалкил или алкил, который необязательно имеет в качестве заместителя гидрокси, алкокси, амино, алкиламино, диалкиламино, гетероарил или гетероциклил, который необязательно имеет в качестве заместителя алкил, или гидрат, сольват или его N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где R3 представляет собой фенил, который необязательно имеет в качестве заместителя:
Y1Y2N-SO2-, R7-SO2-NR6-, алкилсульфонил, или
алкил, замещенный Y1Y2N-SO2-, R7-SO2-NR6-,
или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), где
R3 представляет собой фенил, который необязательно имеет в качестве заместителя
Y1Y2N-SO2-, R7-SO2-NR6-, алкилсульфонил, или
алкил, замещенный Y1Y2N-SO2-, R7-SO2-NR6-; и
Y1 и Y2, каждый независимо, представляют собой водород, циклоалкил или алкил, который необязательно имеет в качестве заместителя гидрокси, алкокси, амино, алкиламино, диалкиламино, гетероарил или гетероциклил, который необязательно имеет в качестве заместителя алкил, или его гидрат, сольват или N-оксид, или его фармацевтически приемлемая соль.
Еще одним частным осуществлением настоящего изобретения является соединение формулы (I), представляющее собой
бензиламид 2-фенилпиримидин-5-карбоновой кислоты
фениламид 2-пиридин-4-илпиримидин-5-карбоновой кислоты,
фениламид 2-пиридин-3-илпиримидин-5-карбоновой кислоты,
фениламид 2-пиридин-2-илпиримидин-5-карбоновой кислоты,
фениламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
фениламид 2-(4-фторфенил)пиримидин-5-карбоновой кислоты,
фениламид 2-(2-фторфенил)пиримидин-5-карбоновой кислоты,
(2,2-диоксо-2,3-дигидро-1H-2-лямбда*6*-бензо[c]изотиазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
[1-(1H-имидазол-2-илметилпиперидин-4-ил]амид 2-фенилпиримидин-5-карбоновой кислоты,
(6-диметиламинопиридин-3-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(2-пирролидин-1-илэтил)бензооксазол-6-ил]амид 2-фенилпиримидин-5-карбоновой кислоты,
4-сульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(4-сульфамоилфенил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты,
[4-(2-оксооксазолидин-4-илметил)фенил]амид (R)-2-фенилпиримидин-5-карбоновой кислоты,
(6-ацетиламинопиридин-3-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-карбамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-метилкарбамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(4-гидроксициклогексил)амид 2-фенилпиримидин-5-карбоновой кислоты,
этиловый эфир 4-метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновой кислоты,
этиловый эфир {2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусной кислоты,
4-метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновая кислота,
{2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусная кислота,
4-метилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
4-диметилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
(3,5-дифторфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
пиридин-2-иламид 2-фенилпиримидин-5-карбоновой кислоты,
тиазол-2-иламид 2-фенилпиримидин-5-карбоновой кислоты,
(3-сульфамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(2-оксо-1,2-дигидропиримидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(4-сульфамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
пиримидин-4-иламид 2-фенилпиримидин-5-карбоновой кислоты,
(1-пиридин-3-илметилпиперидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(2-оксоимидазолидин-1-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(1H-имидазол-4-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты,
(тетрагидропиран-4-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-трифторметилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(2H-пиразол-3-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(1-метилпиперидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
пиримидин-2-иламид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3,5-дифторфенил)пиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(2,5-дифторфенил)пиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(4-дифторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(2-пиридил)пиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3-пиридил)-4-метилпиримидин-5-карбоновой кислоты,
3-этилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-этоксиэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-гидроксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-циклопропилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-гидроксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-метоксиэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-метоксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(4-метоксибутилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-циклогексилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-гидрокси-1,1-диметилэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-сульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-морфолин-4-илэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-пиперидин-1-илэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[2-(1-метилпирролидин-2-ил)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[(1-этилпирролидин-2-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[2-(1H-имидазол-4-ил)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[3-(2-метилпиперидин-1-ил)пропилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-пирролидин-1-илпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-диметиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-диэтиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-диметиламино-2,2-диметилпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(5-диметиламинопентилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-диизопропиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(метансульфониламинометил)бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-[(пропан-2-сульфониламино)метил]бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилметилбензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-(изопропилсульфамоилметил)бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-(метансульфониламинометил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[(пропан-2-сульфониламино)метил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-метилсульфамоилметилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(изопропилсульфамоилметил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(2-метансульфониламинопиридин-4-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(тетрагидропиран-4-ил)амид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты,
4-сульфамоилбензоламид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты,
(3-фенил-[1,2,4]тиадиазол-5-ил)амид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты,
3-(морфолин-4-сульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3,4-диметоксилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
(2-бензо[1,3]диоксол-5-илэтил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(1H-индазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
4-[1,2,3]тиадиазол-5-ил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 4-метил-2-пиридин-2-илпиримидин-5-карбоновой кислоты,
4-морфолин-4-илбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
метиловый эфир 6-[(2-фенилпиримидин-5-карбонил)амино]-1H-бензоимидазол-2-карбоновой кислоты,
6-[(2-фенилпиримидин-5-карбонил)амино]-1H-бензоимидазол-2-карбоновая кислота,
(бензофуран-5-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
4-метансульфониламинобензиламид 2-фенилпиримидин-5-карбоновой кислоты,
4-карбамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
3-(2-гидроксиэтилсульфамоил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты,
4-(морфолин-4-сульфонил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(2-амино-4-метилтиазол-5-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
диэтиловый эфир {4-{[(2-фенилпиримидин-5-карбонил)амино]бензил}фосфоновой кислоты,
диэтиловый эфир {4-[(2-фенилпиримидин-5-карбонил)амино]бутил}фосфоновой кислоты,
диэтиловый эфир {4-[(2-фенилпиримидин-5-карбонил)амино]этил}фосфоновой кислоты,
диэтиловый эфир {фенил-[(2-фенилпиримидин-5-карбонил)амино]метил}фосфоновой кислоты,
3-метансульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(1-метансульфонилпиперидин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(1-диметансульфамоилпиперидин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-метансульфониламинобензиламид 2-(фенил)пиримидин-5-карбоновой кислоты,
3-ацетилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-оксопипериазин-1-сульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(2-сульфамоилэтил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(2-диметилсульфамоилэтил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-фенил-[1,2,4]тиадиазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-фенил-[1,2,4]тиадиазол-5-ил)амид 4-метил-2-фенилпиримидин-5-карбоновой кислоты,
(3-фенил-[1,2,4]тиадиазол-5-ил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(тетрагидропиран-4-ил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
фениламид 2-циклогексилпиримидин-5-карбоновой кислоты,
3-аминобензиламид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3-пиридил)пиримидин-5-карбоновой кислоты,
4-сульфамоилбензиламид 2-пиразол-1-илпиримидин-5-карбоновой кислоты,
(тетрагидропиран-4-ил)амид 2-(2-метилтиазол-4-ил)пиримидин-5-карбоновой кислоты,
(тиофен-2-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(4-метилоксазол-2-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
этиловый эфир метоксиимино-{2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусной кислоты,
(5-метилсульфанил-[1,3,4]тиадиазол-2-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
этиловый эфир 2-[(2-фенилпиримидин-5-карбонил)амино]бензотиазол-5-карбоновой кислоты,
(1-фенилэтил)амид (R)-2-фенилпиримидин-5-карбоновой кислоты,
[3-(1H-тетразол-5-ил)фенил]амид 2-фенилпиримидин-5-карбоновой кислоты,
(1-карбамимидоилпиперидин-4-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
амид 5-[(2-фенилпиримидин-5-карбонил)амино]-1H-индол-3-карбоновой кислоты,
[3-(2-аминотиазол-4-ил)фенил]амид 2-фенилпиримидин-5-карбоновой кислоты,
{4-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)этил]тиазол-2-ил}амид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(пирролидин-1-сульфонил)этил]амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
трет-бутиловый эфир [3-({[2-(3-фторфенил)-4-метилпиримидин-5-карбонил]амино}метил)бензил]карбаминовой кислоты,
3-[(пиридин-2-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-гидрокси-2,2-диметилпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-гидрокси-2-метилпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[(тетрагидропиран-4-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(4-гидроксибутилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[2-(2-гидроксиэтокси)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[(тетрагидрофуран-2-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-изобутилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(5-изопропилсульфамоилпиридин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(5-метилсульфамоилпиридин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(2-метилсульфамоилпиридин-4-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(2-метилсульфамоилпиридин-4-илметил)амид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты или
(5-изопропилсульфамоилпиридин-3-илметил)амид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
или гидрат, сольват или его N-оксид, или его фармацевтически приемлемая соль.
В сферу настоящего изобретения также входит фармацевтическая композиция, содержащая фармацевтически эффективное количество соединения, составляющего предмет настоящего изобретения, в смеси с фармацевтически приемлемым носителем.
Соединения настоящего изобретения являются ингибиторами PGDS и, таким образом, полезны для лечения аллергических и/или воспалительных расстройств, в частности таких расстройств, как аллергический ринит, астма и/или хроническое обструктивное заболевание легких (ХОЗЛ).
Следовательно, еще один аспект изобретения, описываемый здесь, направлен на способ лечения пациента, страдающего аллергическим ринитом и/или астмой, посредством введения пациенту фармацевтически эффективного количества соединения формулы (I).
Подразумевается, что термин "лечение" распространяется как на профилактическую терапию для ингибирования PGDS, так и на лечение известных острых или хронических или физиологических заболеваний, связанных с PGDS, с тем чтобы излечить пациента, страдающего указанными заболеваниями, или улучшить физиологическое состояние, связанное с ними. Обсуждаемые здесь физиологические состояния включают некоторые, но не все, возможные клинические ситуации, в которых уместно лечение аллергического ринита и/или астмы. Специалистам, практикующим в данной области, хорошо известны обстоятельства, требующие лечения.
На практике соединения, составляющие предмет настоящего изобретения, могут вводиться в виде фармацевтически приемлемых лекарственных форм человеку и другим млекопитающим посредством местного или системного применения, в том числе перорального, ингаляционного, ректального, назального, буккального, сублингвального, вагинального, кишечного, парентерального (в том числе подкожного, внутримышечного, внутривенного, внутрикожного, интратекального и эпидурального), интрацистернального и внутрибрюшинного. Следует принимать во внимание, что конкретный способ введения можно варьировать, например, в зависимости от физиологического состояния пациента.
«Фармацевтически приемлемыми лекарственными формами» называются лекарственные формы соединения, составляющего предмет настоящего изобретения, которые включают, например, таблетки, драже, порошки, эликсиры, сиропы, жидкие составы, в том числе суспензии, спреи, ингалянты, таблетки, лепешки, эмульсии, растворы, гранулы, капсулы и суппозитории, также жидкие составы для инъекций, в том числе липосомные препараты. Общее описание методов и составов можно найти в последнем издании Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA.
Особым аспектом настоящего изобретения является соединение, составляющее предмет настоящего изобретения, которое должно вводиться в форме фармацевтической композиции.
Фармацевтически приемлемые носители имеют в своем составе по меньшей мере один из компонентов, которыми могут быть фармацевтически приемлемые носители, разбавители, оболочки, адъюванты, эксципиенты или среды, такие как консерванты, наполнители, разрыхлители, смачивающие вещества, эмульгаторы, стабилизаторы эмульсии, суспендирующие вещества, изотонические вещества, подсластители, вкусовые добавки, ароматизаторы, красители, бактерицидные средства, противогрибковые средства, другие терапевтические вещества, скользящие вещества, вещества, замедляющие или ускоряющие всасывание, и дозирующие вещества, в зависимости от особенностей способа введения и лекарственной формы.
Примерами суспендирующих веществ являются этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сложные эфиры сорбитана, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант или смеси этих веществ.
Примерами бактерицидных и противогрибковых веществ, предотвращающих действие микроорганизмов, являются парабены, хлорбутанол, фенол, сорбиновая кислота и подобные им вещества.
Примерами изотонических веществ являются сахара, хлорид натрия и подобные им вещества.
Примерами веществ, замедляющих и продлевающих всасывание, являются моностеарат алюминия и желатин.
Примерами веществ, ускоряющих и стимулирующих абсорбцию, являются диметилсульфоксид и его аналоги.
Примерами разбавителей, растворителей, носителей, солюбилизирующих добавок, эмульгаторов и стабилизаторов эмульсии являются вода, хлороформ, сахароза, этанол, изопропиловый спирт, этиловый эфир угольной кислоты, этилацетат, бензиловый спирт, тетрагидрофурфуриловый спирт, бензилбензоат, полиолы, пропиленгликоль, 1,3-бутиленгликоль, глицерин, полиэтиленгликоли, диметилформамид, Tween® 60, Span® 60, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат и лаурилсульфат натрия, сложные эфиры сорбитана и жирных кислот, растительные масла (такие как хлопковое масло, арахисовое масло, оливковое масло, касторовое масло и кунжутное масло) и инъецируемые органические эфиры, такие как этилолеат и ему подобные, или подходящие смеси этих соединений.
Примерами формообразующих наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция и дикальцийфосфат.
Примерами разрыхлителей являются крахмал, альгиновые кислоты и некоторые сложные силикаты.
Примерами скользящих веществ являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоли с высоким молекулярным весом.
Выбор фармацевтически приемлемого носителя, в целом, определяется в соответствии с химическими свойствами активного соединения, такими как растворимость, метод применения и меры предосторожности, которые необходимо соблюдать в фармацевтической практике.
Фармацевтические композиции, составляющие предмет настоящего изобретения, пригодные для перорального применения, могут представлять собой отдельные единицы, такие как твердые лекарственные формы, такие как капсулы, облатки или таблетки, каждая из которых содержит определенное количество активного ингредиента, либо такие как порошки или гранулы, или жидкие лекарственные формы, такие как растворы или суспензии в водной или неводной жидкой среде, или жидкие эмульсии масла-в-воде или воды-в-масле. Активный ингредиент также необязательно имеет форму болюса, электуария или пасты.
«Твердая лекарственная форма» означает лекарственную форму соединения, составляющего предмет настоящего изобретения, в виде твердого вещества, например капсулы, таблетки, пилюли, порошки, драже или гранулы. В таких твердых лекарственных формах соединение, составляющее предмет настоящего изобретения, добавлено в по меньшей мере один традиционно используемый инертный наполнитель (или носитель), например цитрат натрия или дикальцийфосфат или (a) наполнители или среды, такие как, например, крахмал, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, (b) связующие вещества, например карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, (c) увлажняющие вещества, такие как, например, глицерин, (d) разрыхлители, такие как, например, агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, определенные сложные силикаты и карбонат натрия, (e) растворы-замедлители, такие как, например, парафин, (f) ускорители абсорбции, такие как, например, четвертичные аммониевые соединения, (g) увлажняющие вещества, такие как, например, цетиловый спирт и глицеринмоностеарат, (h) адсорбенты, такие как, например, каолин или бентонит, (i) скользящие вещества, такие как, например, тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия, (j) замутняющие компоненты, (k) буферные вещества и агенты, высвобождающие соединение, составляющее предмет настоящего изобретения, с отсрочкой, в определенной части кишечного тракта.
Таблетка может быть приготовлена прессованием или формовкой и необязательно имеет один или несколько вспомогательных компонентов. Прессованные таблетки можно получать прессованием в подходящем аппарате активного ингредиента в сыпучей форме, такой как порошок или гранулы, которая необязательно смешана со связующим веществом, скользящим веществом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим веществом. Могут использоваться такие эксципиенты, как лактоза, цитрат натрия, карбонат кальция, дикальцийфосфат и разрыхлители, такие как крахмал, альгиновые кислоты и определенные сложные силикаты, смешанные со смазывающими веществами, такими как стеарат магния, лаурилсульфат натрия и тальк. Смесь порошкообразных соединений, смоченную инертным жидким разбавителем, можно формовать на подходящей установке для получения формованных таблеток. Таблетки необязательно могут иметь покрытия или насечки, а также могут иметь состав, обеспечивающий медленное или контролируемое выделение содержащегося в них активного ингредиента.
Твердые композиции также могут использоваться в качестве наполнителей в желатиновых капсулах с мягким или твердым наполнением с использованием таких инертных наполнителей, как лактоза или молочный сахар, а также полиэтиленгликолей с большим молекулярным весом и подобных им веществ.
В случае необходимости, а также для более эффективного распределения соединение может быть микроинкапсулированным в системах медленного или направленного высвобождения, таких как биосовместимые, биоразложимые полимерные матрицы (например сополимер d,l-лактида с гликолидом), липосомы и микросферы для подкожного или внутримышечного инъецирования методом, называемым подкожной или внутримышечной инъекцией замедленного всасывания, обеспечивающей медленное высвобождение соединения(ий) в течение 2 недель или дольше. Соединения могут быть стерилизованы, например, фильтрацией через задерживающий бактерии фильтр или добавлением стерилизующих веществ в форме стерильных твердых композиций, которые могут быть растворены в стерильной воде или другой стерильной инъецируемой среде непосредственно перед применением.
«Жидкая лекарственная форма» означает форму активного соединения, которая вводится пациенту в жидкой форме, например в виде фармацевтически приемлемых эмульсий, растворов, суспензий, сиропов или эликсиров. Помимо активного соединения жидкие лекарственные формы могут содержать обычно применяемые в данной области инертные разбавители, такие как растворители, солюбилизирующие вещества и эмульгаторы.
Водные суспензии могут содержать эмульгаторы или вещества, способствующие образованию суспензии.
Фармацевтические композиции, пригодные для местного применения, - это составы в форме, допускающей местное введение пациенту. Составы могут иметь форму мазей местного применения, бальзамов, порошков, спреев и ингалянтов, гелей (на водной или спиртовой основе), кремов, обычно используемых в данной области, или быть включенными в матричную основу для применения в качестве пластыря, обеспечивающего контролируемое высвобождение соединения через кожный барьер. В форме мази активные ингредиенты могут использоваться с парафиновыми или водорастворимыми основами. В альтернативном варианте активные ингредиенты могут иметь форму крема на масляно-водной основе. Составы, предназначенные для местного применения через глаза, представляют собой глазные капли, в которых активный ингредиент растворен или суспендирован в подходящем носителе, как правило, водном растворителе. Составы, предназначенные для местного применения через слизистую рта, включают таблетки, имеющие в своем составе активный ингредиент во вкусовой добавке, как правило, сахарозе и аравийской камеди или трагаканте; пастилки, имеющие в своем составе активный ингредиент на инертной основе, такой как желатин и глицерин, или сахароза и аравийская камедь; и составы для полоскания рта, имеющие в своем составе активный ингредиент в подходящем жидком носителе.
Масляная фаза эмульсионных фармацевтических композиций может быть получена обычным способом из известных ингредиентов. Эта фаза необязательно имеет в своем составе только эмульгатор (также называемый эмульгирующим веществом), однако желательно, чтобы в нее также входила смесь по меньшей мере одного эмульгатора с жиром или маслом, или эмульгатора с жиром и маслом. В конкретном осуществлении изобретения в состав включен гидрофильный эмульгатор наряду с липофильным эмульгатором, который действует как стабилизатор. Эмульгатор(ы) вместе со стабилизатором(ами) или без него образуют эмульгирующийся воск, а вместе с маслом или жиром образуют эмульгирующуюся основу мази, которая является масляной диспергированной фазой кремовых составов.
При необходимости водная фаза кремовой основы может включать, например, не менее 30% вес./вес. многоатомного спирта, то есть спирта с двумя или более гидроксильными группами, например пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин или полиэтиленгликоль (в том числе PEG 400) и их смеси. Составы для местного применения могут, если нужно, иметь в своем составе соединение, стимулирующее всасывание или проникновение активного ингредиента через кожу или другие поврежденные зоны.
Выбор подходящих масел или жиров для использования в составе зависит от свойств, которые необходимо получить. Желательно, чтобы крем был в особенности нежирным, не оставляющим пятен и смываемым продуктом подходящей консистенции, не допускающей утечки из тюбиков или других емкостей. Могут использоваться линейные и разветвленные одно- и двухосновные алкиловые эфиры, такие как диизопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известная как Crodamol CAP. Они могут использоваться отдельно или в смесях, в зависимости от желаемых свойств. В качестве альтернативы могут использоваться липиды с высокой температурой плавления, такие как белый мягкий парафин, и/или жидкий парафин, или другие минеральные масла.
Фармацевтическими композициями для ректального или вагинального введения называются составы, форма которых допускает ректальное или вагинальное введение пациенту и которые содержат по меньшей мере одно соединение, составляющее предмет настоящего изобретения. Суппозитории представляют собой одну из форм таких составов, которую можно получить смешиванием соединений, составляющих предмет настоящего изобретения, с подходящими нераздражающими средами или носителями, например масло какао, полиэтиленгликоль или восковая основа суппозитория, которые находятся в твердом состоянии при обычных температурах, но становятся жидкими при температуре тела и поэтому плавятся при ректальном или вагинальном введении и высвобождают активный ингредиент.
Фармацевтические составы, вводимые посредством инъекции, могут вводиться внутримышечно, внутривенно, внутрибрюшинно и/или подкожно. Составы, составляющие предмет настоящего изобретения, готовят в жидких растворах, в частности в физиологически совместимых буферах, таких как раствор Ханка или раствор Рингера. Кроме того, составы могут быть приготовлены в твердой форме и повторно растворены или суспендированы непосредственно перед применением. Возможны также лиофилизированные формы. Составы являются стерильными и включают эмульсии, суспензии, водные и неводные растворы для инъекций, которые могут содержать суспендирующие вещества, загустители и антиоксиданты, буферы, бактериостаты и добавки, делающие состав изотоническим, и иметь правильно подобранный уровень pH, соответствующий показателю крови пациента, которому будет вводиться препарат.
Фармацевтическими композициями, составляющими предмет настоящего изобретения, пригодными для назального или ингаляционного введения, называются составы, форма которых пригодна для введения пациенту назально или ингаляционно. Состав может содержать носитель в форме порошка с размером частиц, например, в диапазоне от 1 до 500 микрон (в том числе с размерами частиц в диапазоне от 20 до 500 микрон с шагом 5 микрон, то есть с размерами 30 микрон, 35 микрон и т.д.). К подходящим составам с жидким носителем для применения, например, в качестве спрея или капель для носа относятся водные или масляные растворы активного ингредиента. Составы, пригодные для аэрозольного введения, могут быть получены в соответствии с традиционными методами и вводиться с другими терапевтическими веществами. Для проведения ингаляционной терапии могут использоваться дозирующие ингаляторы или любые сухие порошковые ингаляторы, такие как Eclipse, Spinhaler® или Ultrahaler®, согласно описанию в патентной заявке WO 2004/026380 и в патенте США № 5176132.
Действительную дозировку активного ингредиента(ов) в составах, составляющих предмет настоящего изобретения, можно варьировать с целью получения количества активного ингредиента(ов), эффективного для получения желаемого терапевтического эффекта для определенного состава и метода его введения пациенту. Поэтому дозировка, выбираемая для каждого пациента, зависит от множества факторов, таких как желаемый терапевтический эффект, способ введения, желаемая длительность лечения, этиология и тяжесть заболевания, состояние пациента, вес, пол, диета и возраст, тип и активность каждого активного ингредиента, скорости абсорбции, метаболизм и/или выделение и других факторов.
Полная дневная доза соединения, составляющего предмет настоящего изобретения, вводимая пациенту в виде одной или нескольких доз, может составлять, например, от примерно 0,001 до примерно 100 мг/кг веса тела в день, в частности от 0,01 до 10 мг/кг/день. Например, для взрослого дозы, как правило, составляют от примерно 0,01 до примерно 100, в частности от примерно 0,01 до примерно 10, мг/кг веса тела в день при ингаляции, от примерно 0,01 до примерно 100, в частности от 0,1 до 70, желательно от 0,5 до 10, мг/кг веса тела в день при пероральном введении и от примерно 0,01 до примерно 50, в частности от 0,01 до 10, мг/кг веса тела в день при внутривенном введении. Процентное содержание активного ингредиента может быть разным, но оно должно обеспечивать получение оптимальной дозировки. Лекарственные формы необязательно содержат количества или дольные единицы дозы, позволяющие получить желаемую дневную дозу. Очевидно, что возможно почти одновременное введение нескольких стандартных доз. Введение доз может быть настолько частым, насколько необходимо для достижения желаемого терапевтического эффекта. Некоторые пациенты могут быстро реагировать на большие или меньшие дозы, и для них может оказаться адекватной более низкая поддерживающая доза. Для других пациентов может потребоваться длительное лечение с интенсивностью от 1 до 4 доз в день в соответствии с физиологическими потребностями каждого пациента. Само собой разумеется, для других пациентов может потребоваться не более одной или двух доз в день.
Стандартные дозы составов могут быть получены любым из традиционно используемых в фармацевтике методов. Такие методы включают стадию связывания фармацевтически активного ингредиента с носителем, состоящим из одного или нескольких вспомогательных ингредиентов. Как правило, составы получают однородным и необратимым связыванием активного ингредиента с жидкими носителями, или мелкозернистыми твердыми носителями, или обоими, с последующим формованием продукта, если это необходимо.
Составы могут быть в упаковках по одной дозе или по несколько доз, например в запаянных ампулах и пузырьках с эластичными пробками, и могут храниться в лиофилизированном состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед применением. Индивидуальные растворы для инъекций и суспензии могут быть приготовлены из стерильных порошков, гранул или таблеток описанных выше типов.
Соединения, составляющие предмет настоящего изобретения, могут быть получены посредством применения или адаптации известных методов, под которыми подразумеваются методы, использовавшиеся прежде либо описанные в литературе, например описанные R.C. Larock in Comprehensive Organic Transformations, VCH publishers, 1989.
В описанных ниже реакциях может возникать необходимость защитить реакционные функциональные группы, например гидроксильные, амино-, имино-, тио- или карбоксильные группы, чтобы избежать их нежелательного участия в реакциях в случаях, когда они должны остаться в конечном продукте. Обычные защитные группы могут использоваться в соответствии с общепринятой практикой, например см. T.W. Greene and P.G.M. Wuts, Protecting Groups in Organic Synthesis, 3rd edition, John Wiley & Sons, Inc., 1999.
Соединение формулы (I), где R2 представляет собой водород, может быть получено, как показано на схеме I ниже, в результате реакции амидинового соединения, в котором R1 соответствует приведенному здесь определению, с реагентом формулы (А) с образованием соединения формулы (B), которое непосредственным образом или через продукт гидролиза формулы (C) присоединяется к амину формулы (D), где L1 и R3 соответствуют приведенному здесь определению.
Схема I

R2 = водород
Соединение формулы (I), где R2 представляет собой (C1-C4)-алкил, может быть получено, как показано на схеме II ниже, в результате реакции амидинового соединения, в котором R1 соответствует приведенному здесь определению, с реагентом формулы (Е), с образованием соединения формулы (F), которое непосредственным образом или через продукт гидролиза формулы (G) присоединяется к амину формулы (D), где L1 и R3 соответствуют приведенному здесь определению.
Схема II

R2 = (С1-С4)-алкил
Соединения, составляющие предмет настоящего изобретения, также могут быть получены превращением одних соединений, составляющих предмет настоящего изобретения, в другие.
Следует отметить, что соединения, составляющие предмет настоящего изобретения, могут содержать асимметричные центры. Эти асимметричные центры могут независимо быть или в R- или в S-конфигурации. Для специалиста в области очевидно, что определенные соединения, составляющие предмет настоящего изобретения, могут также проявлять геометрическую изомерию. Следует понимать, что настоящее изобретение распространяется на отдельные геометрические изомеры и стереоизомеры и их смеси, в том числе рацемические смеси соединений с приведенной выше формулой (I). Такие изомеры можно выделить из их смесей при помощи известных методов или их модификаций, например хроматографических методов или методов перекристаллизации, либо получить отдельно из соответствующих изомеров промежуточных соединений.
Соединения изобретения, методы их получения, а также их биологическая активность будут более очевидны из анализа следующих примеров, которые приводятся исключительно в качестве иллюстрации и не должны рассматриваться как ограничивающие объем изобретения. Соединения настоящего изобретения идентифицируются, например, с помощью следующих аналитических методов.
Масс-спектры (МС) записывали на масс-спектрометре Micromass LCT. Метод основан на положительной ионизации электрораспылением и сканировании массы m/z от 100 до 1000.
Спектры ядерного магнитного резонанса (1H ЯМР) 300 МГц 1H записывают при комнатной температуре на спектрометре Varian Mercury (300 МГц) с 5 мм датчиком ASW. В 1H ЯМР химические сдвиги (δ) указаны в миллионных долях (м.д.) относительно тетраметилсилана (TMS) в качестве внутреннего стандарта.
В приведенных далее примерах и описаниях синтеза, а также в остальной части заявки, используемые термины имеют следующие значения: «кг» - килограммы, «г» - граммы, «мг» - миллиграммы, «мкг » - микрограммы, «моль» - моли, «ммоль» - миллимоли, «М» - моли на литр, «мМ» - миллимоли на литр, «мкМ» - микромоли на литр, «нМ» - наномоли на литр, «л» - литры, «мл» - миллилитры, «мкл» - микролитры, «°C» - градусы Цельсия, «т. пл.» - точка плавления, «т. кип.» - точка кипения, «мм рт. ст.» - давление в миллиметрах ртутного столба, «см» - сантиметры, «нм» - нанометры, «абс.» - абсолютный, «конц.» - концентрированный, «c» - концентрация в г/мл, «к.т.» - комнатная температура, «ТСХ» - тонкослойная хроматография, «ВЭЖХ» - высокоэффективная жидкостная хроматография, «в/б» - внутрибрюшинно, «в/в» - внутривенно, «с» - синглет, «д» - дублет; «т» - триплет; «кв» - квартет; «м» - мультиплет, «дд» - дублет дублетов; «уш.» - уширенный, «ЖХ» - жидкостной хроматограф, «МС» - масс-спектрометрия, «ESI/MS» - ионизация в электроспрее/масс-спектрометрия, «RT» - время удерживания, «М» - молекулярный ион, «фунтов на кв. дюйм» - фунтов на квадратный дюйм, «ДМСО» - диметилсульфоксид, «ДМФ» - N,N-диметилформамид, «ДХМ» - дихлорметан, «HCl» - соляная кислота, «SPA» - SPA-анализ (сцинтилляционный анализ с использованием молекулярно импринтированных полимеров), «EtOAc» - этилацетат, «PBS» - фосфатный буферный физиологический раствор, «ИЮПАК» - Международный союз теоретической и прикладной химии, «МГц» - мегагерц, «MeOH» - метанол, «N» - нормальность, «ТГФ» - тетрагидрофуран, «мин» - минута(ы), «N2» - газообразный азот, «MeCN» или «CH3CN» - ацетонитрил, «Et2O» - этиловый эфир, «ТФУ» - трифторуксусная кислота, «~» - приблизительно, «MgSO4» - сульфат магния, «Na2SO4» - сульфат натрия, «NaHCO3» - бикарбонат натрия, «Na2CO3» - карбонат натрия, «MCPBA» - 3-хлоропероксибензойная кислота, «NMP» - N-метилпирролидон, «PS-DCC» - дициклогексилкарбодиимид на полимерном носителе, «LiOH» - гидроокись лития, «PS-трисамин» - трисамин на полимерном носителе, «PGH2» -простагландин H2, «PGD2» - простагландин D2; «PGE2» - простагландин E2, «hPGDS» -гематопоэтическая PGD2 синтаза, «GSH» - глутатион (восстановленный), «ИФА» - иммуноферментный анализ, «KH2PO4» - дигидрофосфат калия, «K2HPO4» - гидрофосфат калия, «FeCl2» - хлорид железа (II), «MOX» - метоксиламин; «EtOH» - этанол.
ПРИМЕРЫ
Пример 1
Бензиламид 2-фенилпиримидин-5-карбоновой кислоты
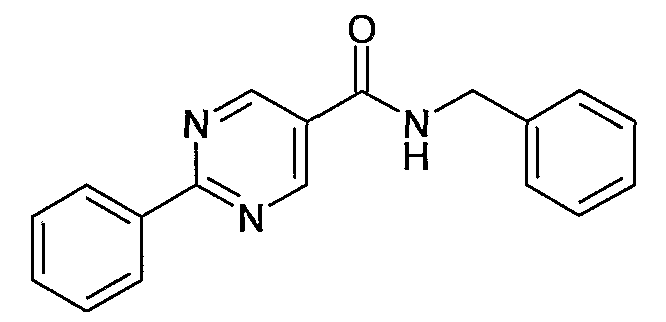
Стадия 1: Трехгорлую круглодонную колбу с магнитной мешалкой и обратным холодильником объемом 250 мл продувают N2. В колбу последовательно добавляют метил-3,3-диметоксипропионат (5,22 г, 35,3 ммоль), безводный 1,2-диметоксиэтан (25 мл), безводный метилформиат (5 мл), 60% гидрид натрия (1,7 г, 42,5 ммоль) и смесь нагревают до 40-50°C до прекращения выделения газообразного водорода. Реакционную смесь охлаждают на водяной бане со льдом и медленно дают нагреться до комнатной температуры в течение ночи при перемешивании. Добавляют безводный эфир (25 мл) и полученную суспензию фильтруют под N2, промывают безводным эфиром (10 мл) и сушат под вакуумом в течение 2 часов, чтобы получить натриевую соль метилового эфира 2-диметоксиметил-3-гидроксиакриловой кислоты (3,51 г, 50%) в виде порошка. 1H ЯМР (CD3OD): δ 3,33 (с, 6H), 3,60 (с, 3H), 5,31 (с, 1H), 8,89 (с, 1H). (См.: P. Zhichkin, D.J. Fairfax, S.A. Eisenbeis, Synthesis, 2002, 720-722.)
Стадия 2: К раствору гидрата бензамидингидрохлорида (2 ммоль) в безводном ДМФ (4 мл) добавляют натриевую соль метилового эфира 2-диметоксиметил-3-гидроксиакриловой кислоты (0,46 г, 2,32 ммоль) и реакционную смесь нагревают при 100°C под N2 в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры и добавляют воду (15 мл). После добавления воды сразу наблюдают осаждение продукта. Твердую фазу собирают фильтрованием, промывают водой (2,5 мл) и сушат под вакуумом, чтобы получить метиловый эфир 2-фенилпиримидин-5-карбоновой кислоты (0,32 г, 74%). (См.: P. Zhichkin, D.J. Fairfax, S.A. Eisenbeis, Synthesis, 2002, 720-722.)
Стадия 3: Раствор метилового эфира 2-фенилпиримидин-5-карбоновой кислоты (3,15 г) и LiOH (0,71 г) в смеси MeOH, ТГФ и воды (1:1:1 по объему, 120 мл) перемешивают в течение ночи при комнатной температуре. MeOH и ТГФ отгоняют, чтобы получить водный раствор. Водный раствор подкисляют 5% соляной кислотой, чтобы скорректировать рН в пределах между 2,5 и 3. Осадок фильтруют и промывают водой, сушат под вакуумом, чтобы получить 2,94 г (~100%) 2-фенилпиримидин-5-карбоновой кислоты в виде порошка. МС: 201 (M+H).
Стадия 4: Смесь 2-фенилпиримидин-5-карбоновой кислоты, (80 мг), 1-гидроксибензотриазола (92 мг) и карбодиимида на полимерном носителе (640 мг, 1,25 ммоль/г) в 8 мл ДХМ перемешивают при комнатной температуре в течение 30 минут и добавляют бензиламин (43 мг). После встряхивания при комнатной температуре в течение 1,5 дней добавляют PS-трисамин (295 мг, 4,08 ммоль/г). Смесь постоянно встряхивают при комнатной температуре в течение 16 часов. Осадок фильтруют и промывают ДХМ. Фильтрат концентрируют, чтобы получить бензиламид 2-фенилпиримидин-5-карбоновой кислоты (98 мг, 85%) в виде твердого вещества. МС: 290 (M+H); 1H ЯМР (CDCl3): 9,17 (с, 2H), 8,50 (д, 2H), 7,52-7,55 (м, 3H), 7,36-7,40 (м, 5H), 6,54 (уширенный, H), 4,69-4,71 (д, 2H); IC50 = 10 нМ.
Пример 2
Фениламид 2-пиридин-4-илпиримидин-5-карбоновой кислоты
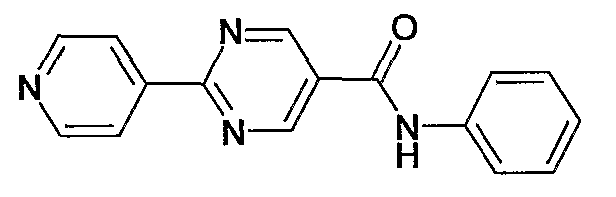
Стадия 1. К раствору изоникотинамидингидрохлорида (1 г, 6,35 ммоль) в безводном ДМФ (12 мл) добавляют натриевую соль метилового эфира 2-диметоксиметил-3-гидроксиакриловой кислоты (1,46 г, 7,36 ммоль) и реакционную смесь нагревают при 100°C в атмосфере азота в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры и добавляют воду (48 мл). Осадок собирают фильтрованием, промывают водой и сушат под вакуумом, чтобы получить метиловый эфир 2-пиридин-4-илпиримидин-5-карбоновой кислоты (1,2 г, 88%). МС: 216 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 4,00 (с, 3H), 8,44 (д, 2H), 8,73 (д, 2H), 9,38 (с, 2H).
Стадия 2. Раствор метилового эфира 2-пиридин-4-илпиримидин-5-карбоновой кислоты (1,11 г, 5,18 ммоль) и водного LiOH (1M, 5,18 мл) в MeOH (7,25 мл) перемешивают при комнатной температуре в течение ночи. МеОН удаляют под вакуумом и водный раствор обрабатывают 3н HCl, чтобы скорректировать рН в пределах между 2 и 3. Осадок фильтруют и промывают водой, сушат под вакуумом, чтобы получить 2-пиридин-4-илпиримидин-5-карбоновую кислоту (1 г, 96%) в виде твердого вещества. МС: 202 (M+H).
Стадия 3. Смесь 2-пиридин-4-илпиримидин-5-карбоновой кислоты (100 мг, 0,5 ммоль), 1-гидроксибензотриазола (76,1 мг, 0,56 ммоль) и PS-DCC (539 мг, 1,25 ммоль/г, 0,66 ммоль) в ДМФ (8 мл) встряхивают при комнатной температуре в течение 15 мин и добавляют анилин (31 мг, 0,33 ммоль). После встряхивания при комнатной температуре в течение 18 часов добавляют PS-трисамин (398 мг, 3,75 ммоль/г, 1,49 ммоль) и смесь постоянно встряхивают при комнатной температуре в течение 18 часов. Осадок фильтруют и промывают ДХМ. Фильтрат концентрируют, чтобы получить фениламид 2-пиридин-4-илпиримидин-5-карбоновой кислоты (15 мг, 16%) в виде твердого вещества. МС: 277 (M+H).
Пример 3
Фениламид 2-пиридин-3-илпиримидин-5-карбоновой кислоты
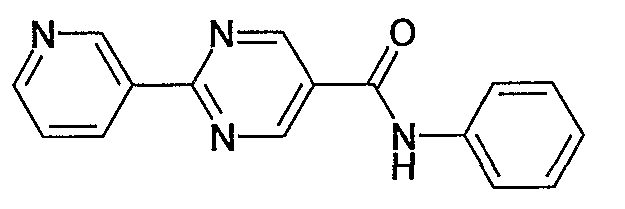
Стадия 1. К раствору никотинамидингидрохлорида (1 г, 6,35 ммоль) в безводном ДМФ (12 мл) добавляют натриевую соль метилового эфира 2-диметоксиметил-3-гидроксиакриловой кислоты (1,46 г, 7,36 ммоль) и реакционную смесь нагревают при 100°C в атмосфере азота в течение 3 часов. После этого реакционную смесь охлаждают до комнатной температуры и добавляют воду (48 мл). Осадок собирают фильтрованием, промывают водой и сушат под вакуумом, чтобы получить метиловый эфир 2-пиридин-3-илпиримидин-5-карбоновой кислоты (0,7 г, 51%). МС: 216 (M+H).
Стадия 2. Раствор метилового эфира 2-пиридин-3-илпиримидин-5-карбоновой кислоты (0,73 г, 3,32 ммоль) и 1М водного LiOH (3,32 мл) в MeOH (5 мл) перемешивают при комнатной температуре в течение ночи. МеОН удаляют под вакуумом и водный раствор обрабатывают 3н HCl, чтобы скорректировать рН в пределах между 2 и 3. Осадок фильтруют и промывают водой, сушат под вакуумом, чтобы получить 2-пиридин-3-илпиримидин-5-карбоновую кислоту (0,2 г, 30%) в виде твердого вещества. МС: 202 (M+H).
Стадия 3. Смесь 2-пиридин-3-илпиримидин-5-карбоновой кислоты (110 мг, 0,55 ммоль), 1-гидроксибензотриазола (83,5 мг, 0,62 ммоль) и PS-DCC (568 мг, 1,28 ммоль/г, 0,73 ммоль) в ДМФ (8 мл) встряхивают при комнатной температуре в течение 15 мин и добавляют анилин (34 мг, 0,36 ммоль). После встряхивания при комнатной температуре в течение 18 часов добавляют PS-трисамин (436 мг, 3,75 ммоль/г, 1,64 ммоль) и смесь постоянно встряхивают при комнатной температуре в течение 18 часов. Осадок фильтруют и промывают ДХМ. Фильтрат концентрируют, чтобы получить фениламид 2-пиридин-3-илпиримидин-5-карбоновой кислоты (41,2 мг, 41%) в виде твердого вещества. МС: 277 (M+H).
Пример 4
Фениламид 2-пиридин-2-илпиримидин-5-карбоновой кислоты
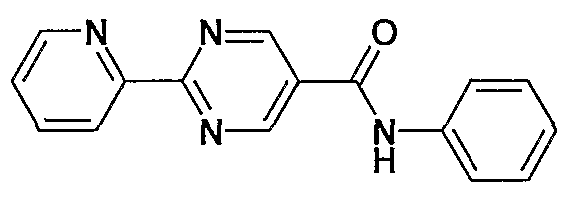
Смесь 2-пиридин-2-илпиримидин-5-карбоновой кислоты (100 мг, 0,5 ммоль, получена общим методом, описанным в примере 2, стадии 1 и 2), 1-гидроксибензотриазол (76,1 мг, 0,56 ммоль) и PS-DCC (518 мг, 1,28 ммоль/г, 0,66 ммоль) в 8 мл ДМФ встряхивают при комнатной температуре в течение 15 мин и добавляют анилин (31 мг, 0,33 ммоль). После встряхивания при комнатной температуре в течение 18 часов добавляют PS-трисамин (400 мг, 3,75 ммоль/г, 1,5 ммоль) и смесь постоянно встряхивают при комнатной температуре в течение 18 часов. Осадок фильтруют и промывают ДХМ. Фильтрат концентрируют, чтобы получить фениламид 2-пиридин-2-илпиримидин-5-карбоновой кислоты (21 мг, 23%) в виде твердого вещества. МС: 277 (M+H).
Пример 5
Фениламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
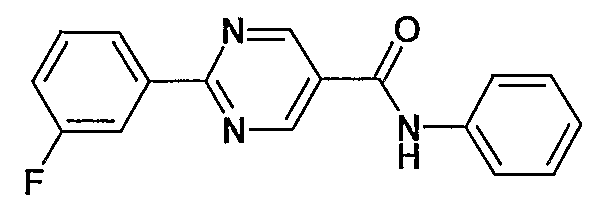
Смесь 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (107 мг, 0,49 ммоль, получена общим методом, описанным в примере 2, стадии 1 и 2), 1-гидроксибензотриазол (75 мг, 0,56 ммоль) и PS-DCC (511 мг, 1,28 ммоль/г, 0,65 ммоль) в ДМФ (8 мл) встряхивают при комнатной температуре в течение 15 мин. Добавляют анилин (30,4 мг, 0,33 ммоль). Смесь встряхивают при комнатной температуре в течение 18 часов. Добавляют PS-трисамин (392 мг, 3,75 ммоль/г, 1,47 ммоль) и смесь постоянно встряхивают при комнатной температуре в течение 18 часов. Осадок фильтруют и промывают EtOAc. Фильтрат концентрируют, чтобы получить фениламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты в виде твердого вещества с количественным выходом. МС: 294 (M+H).
Пример 6
Фениламид 2-(4-фторфенил)пиримидин-5-карбоновой кислоты
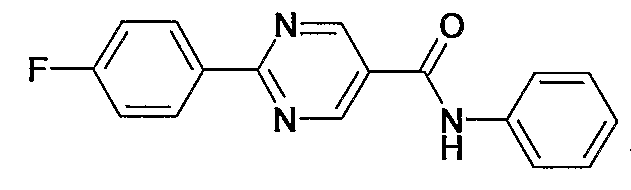
Смесь 2-(4-фторфенил)пиримидин-5-карбоновой кислоты (107 мг, 0,49 ммоль, получена общим методом, описанным в примере 2, стадии 1 и 2), 1-гидроксибензотриазол (75 мг, 0,56 ммоль) и PS-DCC (511 мг, 1,28 ммоль/г, 0,65 ммоль) в ДМФ (8 мл) встряхивают при комнатной температуре в течение 15 мин. Добавляют анилин (30,4 мг, 0,33 ммоль). Смесь встряхивают при комнатной температуре в течение 18 часов. Добавляют PS-трисамин (392 мг, 3,75 ммоль/г, 1,47 ммоль) и смесь постоянно встряхивают при комнатной температуре в течение 18 часов. Осадок фильтруют и промывают EtOAc. Фильтрат концентрируют, чтобы получить фениламид 2-(4-фторфенил)пиримидин-5-карбоновой кислоты (83,4 мг, 86%) в виде твердого вещества. МС: 294 (M+H).
Пример 7
Фениламид 2-(2-фторфенил)пиримидин-5-карбоновой кислоты

Смесь 2-(2-фторфенил)пиримидин-5-карбоновой кислоты (105 мг, 0,48 ммоль, получена общим методом, описанным в примере 2, стадии 1 и 2), 1-гидроксибензотриазол (74 мг, 0,54 ммоль) и PS-DCC (501 мг, 1,28 ммоль/г, 0,64 ммоль) в ДМФ (8 мл) встряхивают при комнатной температуре в течение 15 мин. Добавляют анилин (29,9 мг, 0,32 ммоль). Смесь встряхивают при комнатной температуре в течение 18 часов. Добавляют PS-трисамин (385 мг, 3,75 ммоль/г, 1,44 ммоль) и смесь постоянно встряхивают при комнатной температуре в течение 18 часов. Осадок фильтруют и промывают EtOAc. Фильтрат концентрируют, чтобы получить фениламид 2-(2-фторфенил)пиримидин-5-карбоновой кислоты (60 мг, 63%) в виде твердого вещества. МС: 294 (M+H).
Пример 8
(2,2-Диоксо-2,3-дигидро-1H-2-лямбда*6*-бензо[c]изотиазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты

Смесь 2-фенилпиримидин-5-карбоновой кислоты (60 мг, 0,3 ммоль), 1-гидроксибензотриазола (69 мг, 0,51 ммоль) и PS-DCC (469 мг, 1,21 ммоль/г, 0,6 ммоль) в ДМФ (8 мл) встряхивают при комнатной температуре в течение 60 мин. Добавляют 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин (55 мг, 0,3 ммоль). Смесь встряхивают при комнатной температуре в течение 2 дней. Добавляют PS-трисамин (221 мг, 4,08 ммоль/г, 0,9 ммоль) и смесь постоянно встряхивают при комнатной температуре в течение 18 часов. Осадок фильтруют и промывают МеОН. Фильтрат концентрируют, чтобы получить (2,2-диоксо-2,3-дигидро-1H-2-лямбда*6*-бензо[c]изотиазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты (57 мг) в виде твердого вещества. МС: 367 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 4,58 (с, 2H), 6,86 (д, H), 7,53-7,65 (м, 4H), 7,76 (с, H), 8,46 (т, 2H), 9,33 (д, 2H), 10,41 (уширенный, H), 10,54 (м, H); IC50=2,5 нМ.
Пример 9
[1-(1H-Имидазол-2-илметилпиперидин-4-ил]амид 2-фенилпиримидин-5-карбоновой кислоты
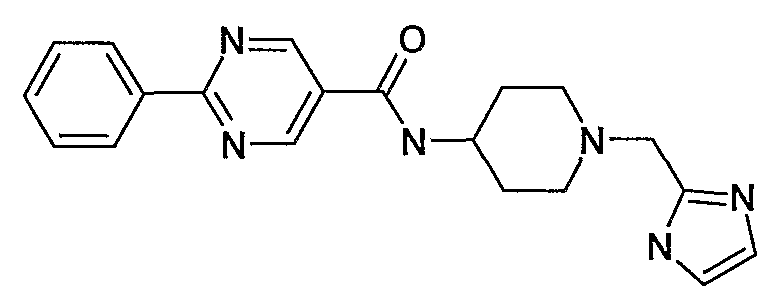
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 1-(1H-имидазол-2-илметил)пиперидин-4-иламин, получают [1-(1H-имидазол-2-илметилпиперидин-4-ил]амид 2-фенилпиримидин-5-карбоновой кислоты (74 мг) в виде твердого вещества. МС: 363 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 1,80-1,89 (м, 2H), 2,05-2,16 (м, 2H), 3,21-3,37 (м, 2H), 3,50-3,60 (м, 2H), 4,14 (м, H), 4,66 (с, 2H), 7,49-7,58 (м, 3H), 7,80 (с, 2H), 8,44 (м, 2H), 8,69 (д, H), 9,23 (с, 2H); IC50=2 нМ.
Пример 10
(6-Диметиламинопиридин-3-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты
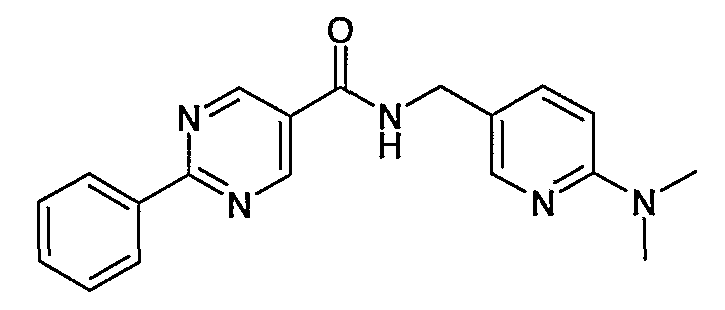
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 6-диметиламинопиридин-3-илметиламин (0,3 ммоль), получают (6-диметиламинопиридин-3-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 334 (M+H).
Пример 11
[2-(2-Пирролидин-1-илэтил)бензооксазол-6-ил]амид 2-фенилпиримидин-5-карбоновой кислоты
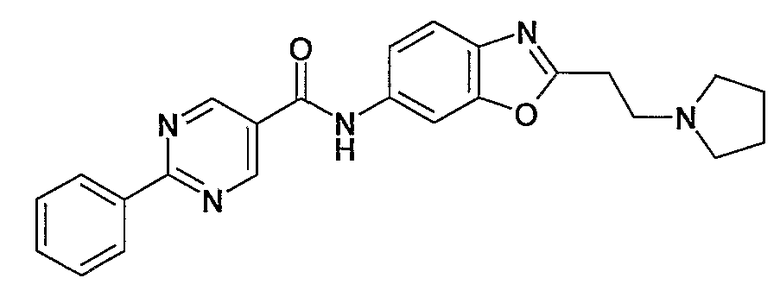
Стадия 1: Раствор 2-метил-6-нитробензоксазола (30 ммоль), диметилацеталя диметилформамида (60 ммоль) и пирролидина (60 ммоль) в ДМФ (45 мл) перемешивают при 100oC в течение 16 часов. Реакционную смесь концентрируют под вакуумом. Остаток растворяют в EtOAc, промывают водой и солевым раствором, сушат (Na2SO4) и фильтруют. Фильтрат концентрируют. Остаток промывают охлажденным EtOAc, чтобы получить 6-нитро-2-(2-пирролидин-1-илвинил)бензоксазол в виде твердого остатка. 1Н ЯМР (300 МГц, CDCl3): δ 1,80-2,25 (уширенный, 4H), 3,10-3,80 (уширенный, 4H), 5,06 (д, H), 7,44 (д, H), 7,96 (д, H), 8,21 (м, 2H).
Стадия 2: Раствор 6-нитро-2-(2-пирролидин-1-илвинил)бензоксазола (8,5 ммоль) и палладий-на-углероде (10%) (0,85 ммоль) в этаноле (100 мл) гидрируют под давлением 50 фунтов на кв. дюйм при комнатной температуре в течение 18 часов. Смесь фильтруют и фильтрат концентрируют под вакуумом, чтобы получить 2-(2-пирролидин-1-илвинил)бензоксазол-6-иламин в форме твердого остатка. 1Н ЯМР (300 МГц, CDCl3): δ 1,82 (м, 4H), 3,2 (уширенный, 4H), 3,65 (уширенный, 2H), 4,92 (д, H), 6,49 (д, H), 6,64 (д, H), 7,19 (д, H), 7,60 (д, H).
Стадия 3: К раствору 2-(2-пирролидин-1-илвинил)бензоксазол-6-иламина (3,2 ммоль) в MeOH (40 мл) добавляют цианоборогидрид натрия (6,4 ммоль) при комнатной температуре. Реакционную смесь нагревают с обратным холодильником в течение 18 часов. Реакционную смесь концентрируют и остаток растворяют в ДХМ. Раствор промывают водой и солевым раствором и сушат (MgSO4). К раствору добавляют небольшое количество активированного угля и смесь фильтруют. Фильтрат концентрируют, чтобы получить 2-(2-пирролидин-1-илэтил)бензоксазол-6-иламин в виде твердого остатка. 1Н ЯМР (300 МГц, CDCl3): δ 1,79 (м, 4H), 2,61 (м, 4H), 3,00-3,18 (м, 4H), 4,78 (уширенный, 2N-H), 6,68 (кв, H), 6,80 (д, H), 7,43 (д, H).
Стадия 4: Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 2-(2-пирролидин-1-илэтил)бензоксазол-6-иламин (0,3 ммоль), получают [2-(2-пирролидин-1-илэтил)бензооксазол-6-ил]амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 414 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 1,70 (уширенный, 4H), 2,44-2,78 (м, 2H), 2,95-3,30 (м, 6H), 7,55-7,75 (м, 5H), 8,27 (с, H), 8,5 (кв, 2H), 8,38 (с, 2H), 10,8 (с, H); IC50=18 нМ.
Пример 12
4-Сульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты
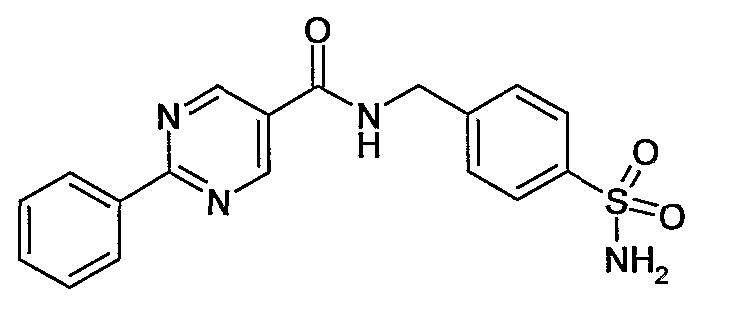
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 4-аминометилбензолсульфонамид (0,3 ммоль), получают 4-сульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 369 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 4,60 (д, 2H), 7,34 (с, 2H), 7,54-7,64 (м, 5H), 7,78 (д, 2H), 8,45 (м, 2H), 9,30 (с, 2H), 9,46 (т, H).
Пример 13
[2-(4-Сульфамоилфенил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 4-(2-аминоэтил)бензолсульфонамид (0,3 ммоль), получают [2-(4-сульфамоилфенил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 383 (M+H).
Пример 14
[4-(2-Оксо-оксазолидин-4-илметил}фенил]амид (R)-2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 4-(4-аминобензил)оксазолидин-2-он (0,3 ммоль), получают [4-(2-оксо-оксазолидин-4-илметил}фенил]амид (R)-2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 375 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 2,85-2,94 (м, 2H), 4,13-4,24 (м, 2H), 4,36 (м, H), 7,30 (д, 2H), 7,46-7,60 (м, 3H), 7,70 (д, 2H), 8,44-8,56 (м, 2H), 9,23 (д, 2H).
Пример 15
(6-Ацетиламинопиридин-3-ил)амид 2-фенилпиримидин-5-карбоновой кислоты
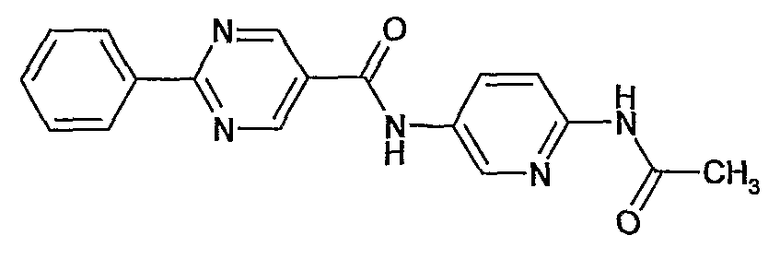
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на N-(5-аминопиридин-2-ил)ацетамид (0,3 ммоль), получают (6-ацетиламинопиридин-3-ил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 334 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,09 (с, 3H), 7,47-7,66 (м, 3H), 8,09 (с, 2H), 8,40-8,53 (м, 2H), 8,72 (с, H), 9,36 (с, 2H), 10,29 (с, N-H), 10,70 (с, N-H).
Пример 16
(3-Карбамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 3-аминобензамид (0,3 ммоль), получают (3-карбамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 319 (M+H).
Пример 17
(3-Метилкарбамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 3-амино-N-метилбензамид (0,3 ммоль), получают (3-метилкарбамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 333 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,79 (д, 3H), 7,47 (т, H), 7,54-7,65 (м, 3H), 7,96 (д, 2H), 8,23 (с, H), 8,37-8,54 (м, 3H), 9,37 (с, 2H), 10,70 (с, 1H).
Пример 18
(4-Гидроксициклогексил)амид 2-фенилпиримидин-5-карбоновой кислоты
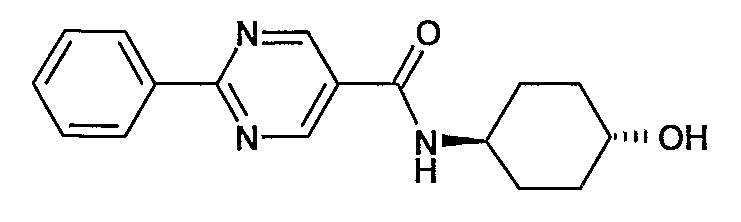
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 4-аминоциклогексанол (0,3 ммоль), получают (4-гидроксициклогексил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 298 (M+H).
Пример 19
Этиловый эфир 4-метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на этиловый эфир 2-амино-4-метилтиазол-5-карбоновой кислоты (0,3 ммоль), получают этиловый эфир 4-метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновой кислоты в виде твердого вещества. МС: 369 (M+H).
Пример 20
Этиловый эфир {2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусной кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на этиловый эфир (2-аминотиазол-4-ил)уксусной кислоты (0,3 ммоль), получают этиловый эфир {2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусной кислоты в виде твердого вещества. МС: 369 (M+H).
Пример 21
4-Метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновая кислота
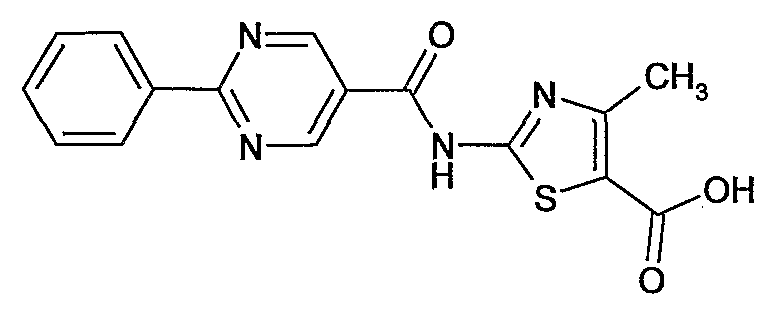
Смесь этилового эфира 4-метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновой кислоты (0,15 ммоль) и 10% водного раствора NaOH (4 мл) в ТГФ (10 мл) перемешивают при 60oC в течение 18 часов. ТГФ упаривают и остаток подкисляют 5% соляной кислотой до pH ~2,0-2,5. Осадок фильтруют и сушат, чтобы получить 4-метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновую кислоту в виде твердого вещества. МС: 341 (M+H).
Пример 22
{2-[(2-Фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусная кислота

Методами, аналогичными описанным в примере 21, но заменяя этиловый эфир 4-метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновой кислоты на этиловый эфир {2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусной кислоты, получают {2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусную кислоту в виде твердого вещества. МС: 341 (M+H).
Пример 23
4-Метилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты
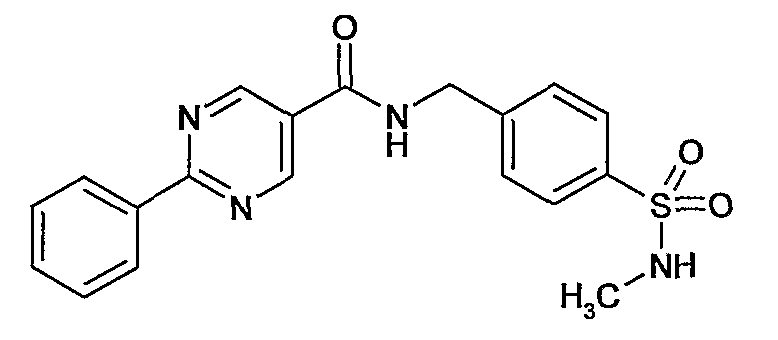
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на гидрохлорид 3-аминометил-N-метилбензолсульфонамида (1,5 ммоль), получают 4-метилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 383 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 3,36 (с, 3H), 4,51 (с, 2H), 7,48-7,57 (м, 3H), 7,59 (д, 2H), 7,84 (д, 2H), 8,50 (м, 2H), 9,25 (с, 2H).
Пример 24
4-Диметилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты

Смесь сульфамоилбензамида 2-фенилпиримидин-5-карбоновой кислоты (пример 12, 0,3 ммоль), иодметана (0,3 ммоль) и карбоната калия (0,9 ммоль) в ДМФ (8 мл) перемешивают при комнатной температуре в течение 18 часов. Смесь концентрируют под вакуумом и остаток растворяют в EtOAc (30 мл). Полученный раствор промывают водой, солевым раствором, сушат (Na2SO4), фильтруют и концентрируют. Остаток очищают колоночной хроматографией, элюируя 5-10% EtOAc в ДХМ, чтобы получить 4-диметилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 397 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 2,70 (с, 6H), 4,74 (с, 2H), 7,46-7,57 (м, 3H), 7,65 (д, 2H), 7,77 (д, 2H), 8,43-8,56 (м, 2H), 9,25 (с, 2H).
Пример 25
(3,5-Дифторфенил)амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 3,5-дифторанилин (0,3 ммоль), получают (3,5-дифторфенил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 312 (M+H).
Пример 26
Пиридин-2-иламид 2-фенилпиримидин-5-карбоновой кислоты
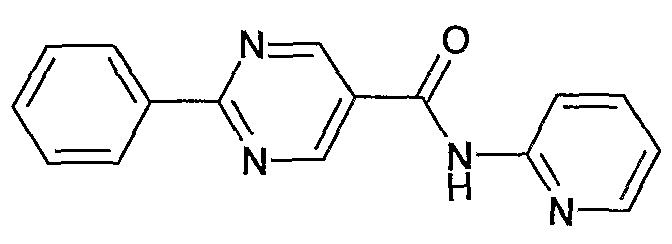
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 2-аминопиридин (0,3 ммоль), получают пиридин-2-иламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 277 (M+H).
Пример 27
Тиазол-2-иламид 2-фенилпиримидин-5-карбоновой кислоты
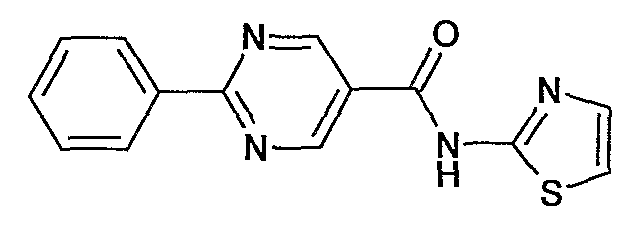
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 2-аминотиазол (0,3 ммоль), получают тиазол-2-иламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 283 (M+H).
Пример 28
(3-Сульфамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты
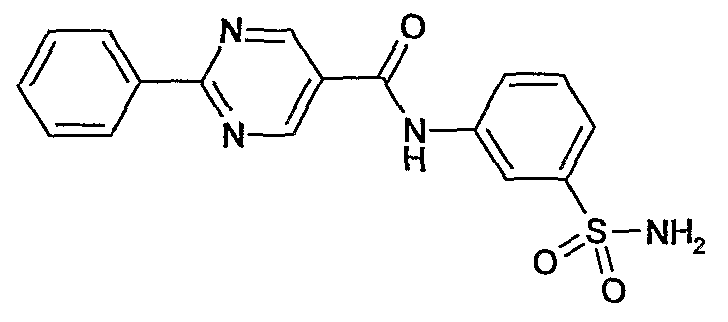
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 3-аминобензолсульфонамид (0,3 ммоль), получают (3-сульфамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 355 (M+H).
Пример 29
(2-Оксо-1,2-дигидропиримидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты
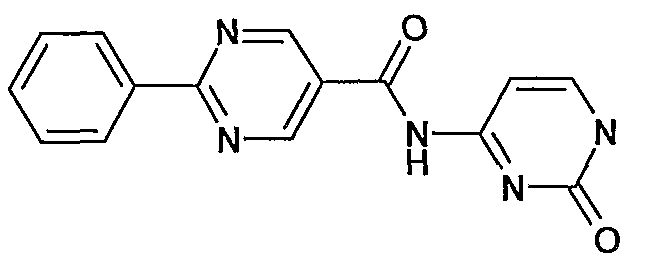
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 4-амино-1Н-пиридмин-2-он (0,3 ммоль), получают (2-оксо-1,2-дигидропиримидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 294 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 7,17 (ушир.с, N-H), 7,47-7,68 (м, 4H), 7,90 (д, H), 8,46 (д, 2H), 9,35 (с, 2H), 11,65 (ушир.с, N-H); IC50=15 нМ.
Пример 30
(4-Сульфамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты
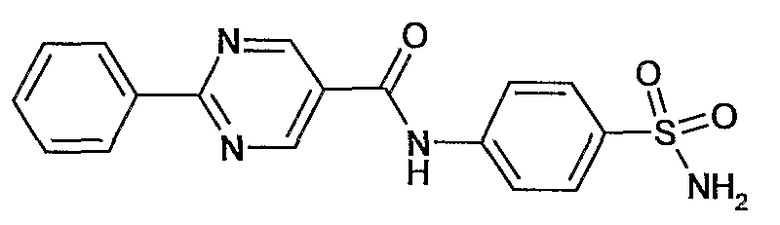
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 4-аминобензолсульфонамид (0,3 ммоль), получают (4-сульфамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 355 (M+H). IC50=5 нМ.
Пример 31
Пиримидин-4-иламид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 4-аминопиридин (0,3 ммоль), получают пиридин-4-иламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 278 (M+H);
Пример 32
(1-Пиридин-3-илметилпиперидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты
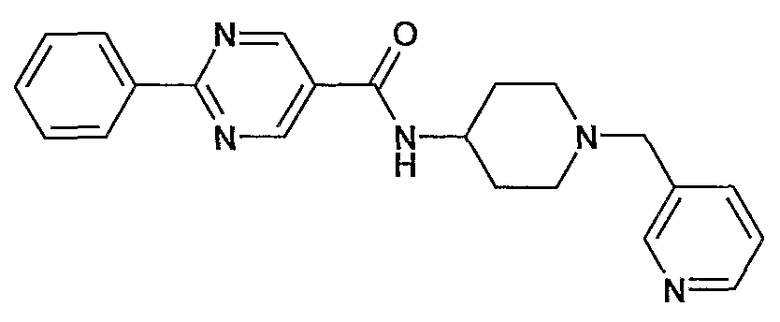
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 1-пиридин-3-илметилпиперидин-4-иламин (0,3 ммоль), получают (1-пиридин-3-илметилпиперидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 374 (M+H).
Пример 33
[2-(2-Оксоимидазолидин-1-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 1-(2-аминоэтил)имидазолидин-2-он (0,3 ммоль), получают [2-(2-оксоимидазолидин-1-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 312 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 3,47-3,58 (м, 4H), 4,60-4,73 (м, 4H), 4,52 (с, N-H), 7,46-7,57 (м, 3H), 8,02 (ушир.с, N-H), 8,53 (м, 2H), 9,24 (с, 2H); IC50=32 нМ.
Пример 34
[2-(1H-Имидазол-4-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 2-(1H-имидазол-4-ил)этиламин (0,3 ммоль), получают [2-(1H-имидазол-4-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества; МС: 294 (M+H); IC50=35 нМ.
Пример 35
(Тетрагидропиран-4-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты
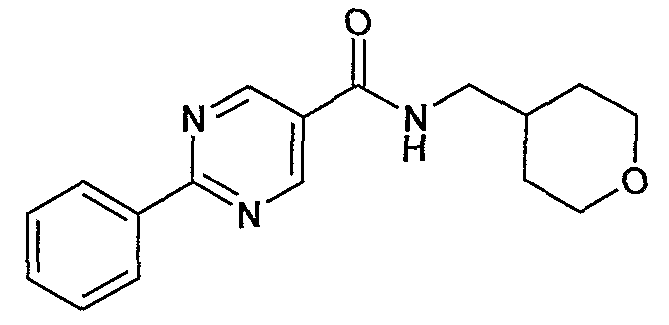
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на (тетрагидропиран-4-ил)метиламин (0,3 ммоль), получают (тетрагидропиран-4-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 298 (M+H).
Пример 36
(3-Трифторметилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 3-трифторметиланилин (0,3 ммоль), получают (3-трифторметилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 344 (M+H).
Пример 37
(2H-Пиразол-3-ил)амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 2Н-пиразол-3-иламин (0,3 ммоль), получают (2H-пиразол-3-ил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 266 (M+H).
Пример 38
(1-Метилпиперидин-4-ил)амид 2-фенилпиримидин-5-карбоновой
кислоты
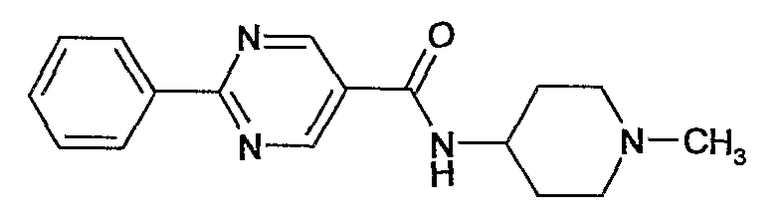
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 1-метилпиперидин-4-иламин (0,3 ммоль), получают (1-метилпиперидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 297 (M+H); IC50=96 нМ.
Пример 39
Пиримидин-2-иламид 2-фенилпиримидин-5-карбоновой кислоты
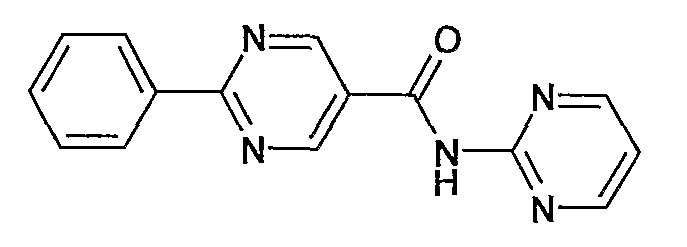
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 2-аминопиримидин (0,3 ммоль), получают пиримидин-2-иламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 278 (M+H).
Пример 40
3-Метилсульфамоилбензиламид 2-(3,5-дифторфенил)пиримидин-5-карбоновой кислоты
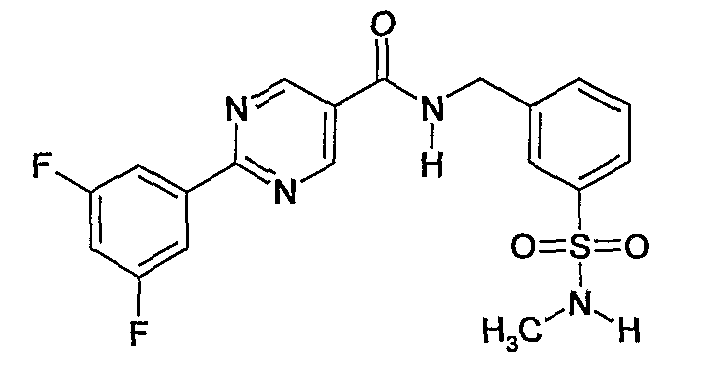
Смесь 2-(3,5-дифторфенил)пиримидин-5-карбоновой кислоты (118 мг, 0,5 ммоль, получена общим методом, описанным в примере 2, стадии 1 и 2), O-(7-азабензотриазол-1-ил)-N,N,N,N-тетраметилуроний гексафторфосфата (190 мг, 0,5 ммоль) в сухом ДМФ (5 мл) обрабатывают диизопропилэтиламином (0,09 мл) и перемешивают при комнатной температуре в течение 30 мин. Добавляют раствор 3-метилсульфамоилбензиламина (150 мг, 0,75 ммоль) в сухом ДМФ (1 мл) и смесь перемешивают при комнатной температуре в течение 24 часов. Растворитель удаляют и остаток встряхивают с EtOAc и водой. Органическую фазу отделяют и промывают насыщенным NaHCO3, водой и солевым раствором, сушат (MgSO4), фильтруют и концентрируют под вакуумом. Остаток очищают колоночной хроматографией, элюируя 30% EtOAc в ДХМ, чтобы получить 3-метилсульфамоилбензиламид 2-(3,5-дифторфенил)пиримидин-5-карбоновой кислоты (125 мг, 62%) в виде твердого вещества. МС: 419 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,41 (д, 3H), 4,64 (д, 2H), 7,43-7,75 (м, 5H), 7,80 (с, 1H), 8,05 (д, 2H), 9,37 (с, 2H), 9,60 (т, 1H); IC50=49 нМ.
Пример 41
3-Метилсульфамоилбензиламид 2-(2,5-дифторфенил)пиримидин-5-карбоновой кислоты
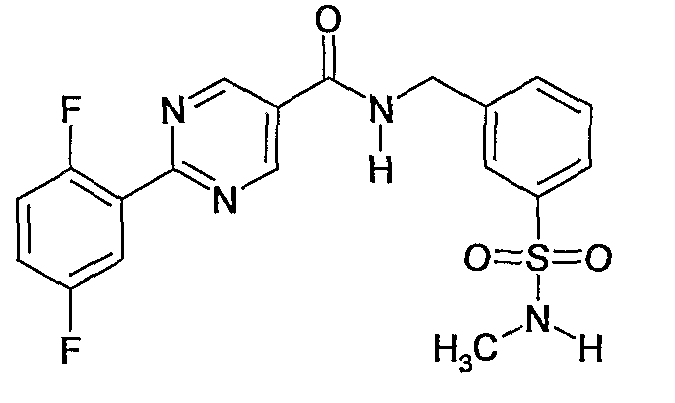
Смесь 2-(2,5-дифторфенил)пиримидин-5-карбоновой кислоты (118 мг, 0,5 ммоль, получена общим методом, описанным в примере 2, стадии 1 и 2), O-(7-азабензотриазол-1-ил)-N,N,N,N-тетраметилуроний гексафторфосфата (190 мг, 0,5 ммоль) в сухом ДМФ (5 мл) обрабатывают 0,09 мл диизопропилэтиламином и перемешивают при комнатной температуре в течение 30 минут. Добавляют раствор 3-метилсульфамоилбензиламина (150 мг, 0,75 ммоль) в сухом ДМФ (1 мл) и смесь перемешивают при комнатной температуре в течение 24 часов. Растворитель удаляют и остаток встряхивают с EtOAc и насыщенным NaHCO3. Органическую фазу отделяют и промывают водой и солевым раствором, сушат (MgSO4), фильтруют и концентрируют под вакуумом. Остаток очищают колоночной хроматографией, элюируя 20% EtOAc в ДХМ, чтобы получить 3-метилсульфамоилбензиламид 2-(2,5-дифторфенил)пиримидин-5-карбоновой кислоты (135 мг, 65%) в виде твердого вещества. МС: 419 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,41 (д, 3H), 4,64 (д, 2H), 7,43-7,78 (м, 5H), 7,89 (с, 1H), 7,90 (т, 1H), 9,37 (с, 2H), 9,60 (т, 1H).
Пример 42
3-Метилсульфамоилбензиламид 2-(4-фторфенил)-4-метилпиримидин-5-карбоновой кислоты
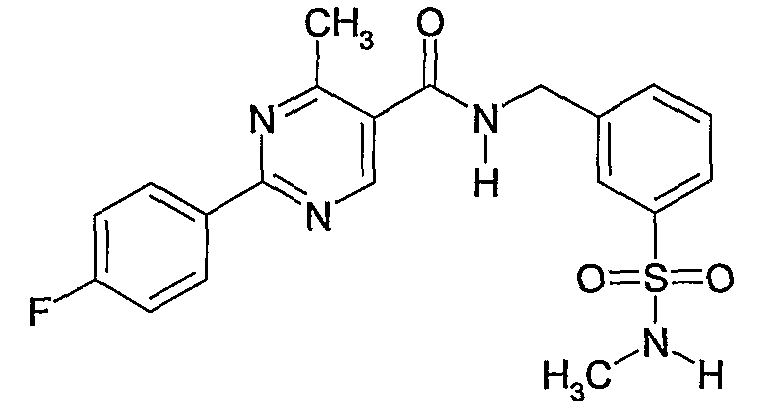
Стадия 1: 4-Фторбензамидин гидрохлорид (1,25 г, 7,16 ммоль) добавляют к раствору металлического натрия (0,17 г, 7,39 ммоль) в сухом этаноле (25 мл) и перемешивают при комнатной температуре в течение 20 мин. Добавляют этил-2-ацетил-3-(диметиламино)акрилат (1,35 г, 7,16 ммоль). Реакционную смесь нагревают с обратным холодильником в течение 3 часов. Растворитель удаляют под вакуумом. Остаток растворяют в EtOAc, промывают водой и солевым раствором, сушат (MgSO4), фильтруют и концентрируют под вакуумом, чтобы получить этил-2-(4-фторфенил)-4-метилпиримидин-5-карбоксилат (1,65 г, 87%) в виде твердого вещества. МС: 261 (M+H) 261.
Стадия 2: Раствор этил-2-(4-фторфенил)-4-метилпиримидин-5-карбоксилата (1,65 г, 6,35 ммоль) в MeOH (75 мл) обрабатывают 2н водным гидроксидом натрия (10 мл) и нагревают с обратным холодильником в течение 30 мин. MeOH удаляют под вакуумом и остаток растворяют в воде (50 мл). Раствор подкисляют до pH ~2, добавляя 2M соляную кислоту. Осадок собирают фильтрованием, промывают водой и сушат под вакуумом, чтобы получить 2-(4-фторфенил)-4-метилпиримидин-5-карбоновую кислоту (1,3 г, 88%) в виде твердого вещества. МС: 233 (M+H).
Стадия 3: Смесь 2-(4-фторфенил)-4-метилпиримидин-5-карбоновой кислоты (232 мг, 1 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N,N-тетраметилуроний гексафторфосфата (380 мг, 1 ммоль) в сухом ДМФ (12 мл) обрабатывают диизопропилэтиламином (0,18 мл) и перемешивают при комнатной температуре в течение 30 мин. Добавляют раствор 3-метилсульфамоилбензиламина (300 мг, 1,5 ммоль) в сухом ДМФ (1,5 мл) и смесь перемешивают при комнатной температуре в течение 24 часов. Растворитель удаляют и остаток встряхивают с EtOAc и водой. Органическую фазу отделяют, промывают насыщенным NaHCO3, водой и солевым раствором, сушат (MgSO4), фильтруют и концентрируют под вакуумом. Остаток очищают колоночной хроматографией, элюируя 60% EtOAc в гептане, чтобы получить 3-метилсульфамоилбензиламид 2-(4-фторфенил)-4-метилпиримидин-5-карбоновой кислоты (210 мг, 52%) в виде твердого вещества. МС: 415 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,42 (с, 3H), 2,63 (с, 3H), 4,60 (д, 2H), 7,37-7,40 (т, 2H), 7,50 (с, 1H), 7,60-7,75 (м, 3H), 7,80 (с, 1H), 8,45-8,50 (дд, 2H), 8,88 (с, 1H), 9,30 (т, 1H).
Пример 43
3-Метилсульфамоилбензиламид 2-(2-пиридил)пиримидин-5-карбоновой кислоты

Методами, аналогичными, описанным в примере 40, но заменяя 2-(3,5-дифторфенил)пиримидин-5-карбоновую кислоту гидрохлоридом 2-(2-пиридил)пиримидин-5-карбоновой кислоты, получают 3-метилсульфамоилбензиламид 2-(2-пиридил)пиримидин-5-карбоновой кислоты (183 мг, 48%) в форме твердого вещества. МС: 384 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,42 (д, 3H), 4,64 (д, 2H), 7,46-7,54 (м, 1H), 7,51-7,70 (м, 4H), 7,80 (с, 1H), 8,00-8,07 (т, 1H), 8,44-8,50 (д, 1H), 8,80 (д, 1H), 9,37 (с, 2H), 9,55 (т, 1H).
Пример 44
3-Метилсульфамоилбензиламид 2-(3-пиридил)-4-метилпиримидин-5-карбоновой кислоты

Смесь 2-(3-пиридил)-4-метилпиримидин-5-карбоновой кислоты (215 мг, 1 ммоль, получена общим методом, описанным в примере 42, стадии 1 и 2), O-(7-азабензотриазол-1-ил)-N,N,N,N-тетраметилуроний гексафторфосфата (380 мг, 1 ммоль) в сухом ДМФ (12 мл) обрабатывают диизопропилэтиламином (0,18 мл) и перемешивают при комнатной температуре в течение 30 мин. Добавляют 3-метилсульфамоилбензиламин гидрохлорид (355 мг, 1,5 ммоль) и смесь перемешивают при комнатной температуре в течение 24 часов. Растворитель удаляют и остаток встряхивают с EtOAc и насыщенным NaHCO3. Органическую фазу отделяют, промывают водой и солевым раствором, сушат (MgSO4), фильтруют и концентрируют под вакуумом. Остаток очищают колоночной хроматографией, элюируя 2% МеОН в EtOAc, чтобы получить 3-метилсульфамоилбензиламид 2-(3-пиридил)-4-метилпиримидин-5-карбоновой кислоты (180 мг, 45%) в виде твердого вещества. МС: 398 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,43 (с, 3H), 2,65 (с, 3H), 4,60 (д, 2H), 7,57-7,71 (м, 4H), 7,79 (с, 1H), 8,68-8,72 (д, 1H), 8,72-8,78 (д, 1H), 8,93 (с, 1H), 9,34 (т, 1H), 9,53 (с, 1H).
Общие методы для примеров 45-67
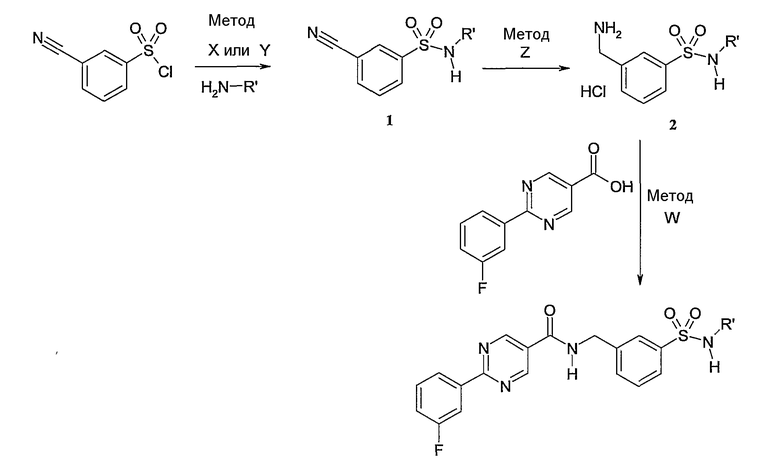
Общий метод Х: Образование сульфонамида
В ампулу помещают амин H2N-R' (1 ммоль), затем п-диоксан (5 мл) и пиперидинометил полистирол (375 мг, 1,5 ммоль, 4 ммоль/г смолы). Ампулу встряхивают на ротационном шейкере в течение 20 мин. Добавляют 3-цианобензолсульфонилхлорид (181 мг, 0,9 ммоль) и реакционную ампулу помещают в орбитальный шейкер на 18 часов. Ампулу извлекают из шейкера и добавляют МеОН (5 мл), затем 4-бензилоксибензальдегид-полистирольную смолу (100 мг, 0,3 ммоль, 3 ммоль/г смолы). Встряхивание продолжают в орбитальном шейкере в течение 5 часов. Образец фильтруют, смолу промывают МеОН и объединенные органические фракции концентрируют, чтобы получить сульфонамидное соединение 1.
Общий метод Y: Образование сульфонамида
В ампулу помещают амин H2N-R' (1 ммоль), затем п-диоксан (5 мл) и триэтиламин (202 мг, 2 ммоль). Добавляют 3-цианобензолсульфонилхлорид (181 мг, 0,9 ммоль) и реакционную ампулу помещают в орбитальный шейкер на 18 часов. Растворители удаляют под вакуумом. Остаток встряхивают в 1н. HCl в воде (5 мл) и EtOAc (10 мл). Органическую фазу отделяют, сушат (Na2SO4), фильтруют и концентрируют под вакуумом, чтобы получить сульфонамидное соединение 1.
Общий метод Z: Гидрогенизация
К раствору сульфонамидного соединения (0,9 ммоль) в MeOH (9 мл) добавляют палладий-на-угле (200 мг, 10% вес. на угле, 50% вес. воды, ACROS), а затем концентрированную HCl в воде (1 мл). В альтернативном варианте реакцию проводят под вакуумом и в атмосфере водорода (1 атм) в течение 3 циклов, а затем смесь оставляют в атмосфере водорода при перемешивании на магнитной мешалке в течение 24 часов. Реакционную смесь фильтруют через целитовый цилиндр и фильтрат концентрируют под вакуумом, чтобы получить амингидрохлоридное соединение 2.
Общий метод W: Параллельное ацилирование
К раствору 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (196 мг, 0,9 ммоль) в ДХМ (5 мл) добавляют оксалилхлорид (229 мг, 1,8 ммоль), а затем ДМФ (2 мкл). Реакционную смесь перемешивают в течение 3 часов. Добавляют безводный толуол (0,5 мл) и концентрируют смесь под вакуумом. Остаток растворяют в EtOAc (7 мл) и полученный раствор добавляют к смеси аминогидрохлоридного соединения 2 (1 ммоль), Na2CO3 (212 мг) в воде (5 мл) в ампуле при быстром перемешивании. Реакционную смесь перемешивают 18 часов, органическую фазу отделяют и концентрируют в вакууме. Остаток суспендируют в ДМСО (3 мл), фильтруют, очищают обращенно-фазовой ВЭЖХ (подвижная фаза вода и ацетонитрил в буфере 0,1% ТФУ), чтобы получить искомый продукт.
Пример 45
3-Этилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

Раствор этиламина (2M в MeOH, 6 ммоль) в ДХМ (40 мл) охлаждают в водяной бане со льдом и добавляют 3-цианобензолсульфонилхлорид (402 мг, 2 ммоль). Реакционную смесь быстро перемешивают в течение 2 часов. Добавляют воду (40 мл) и реакционную смесь подкисляют примерно до рН 4 при осторожном добавлении концентрированной HCl. ДХМ удаляют под вакуумом. Осадок отделяют фильтрованием. Гидрогенизацию осадка проводят с использованием общей методики Z, чтобы получить аминогидрохлоридное соединение. Аминогидрохлоридное соединение ацилируют в соответствии с методом ацилирования W, чтобы получить 3-этилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (449 мг) в форме твердого вещества. МС: 415 (M+H); 1H ЯМР (300 МГц, CDCl3): δ = 0,95 (т, 3H), 2,75-2,9 (м, 2H), 4,65 (д, 2H), 7,47 (т, 1H), 7,55-7,75 (м, 4H), 7,81 (с, 1H), 8,17 (д, 1H), 8,32 (д, 1H), 9,27 (ушир.с, 1H), 9,35 (с, 2H), 9,58 (т, 1H); IC50=58 нМ.
Пример 46
3-(2-Этоксиэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
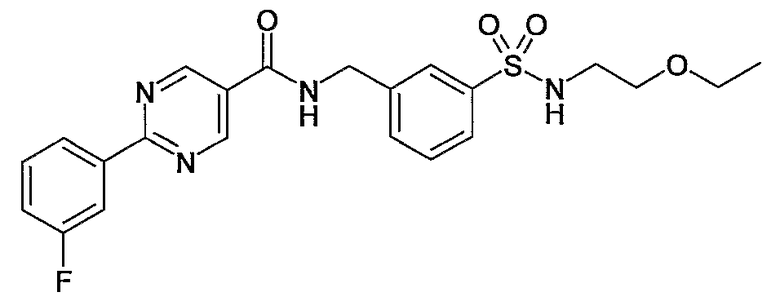
На основе общих методов Y, Z и W, но используя 2-этоксиэтиламин в качестве амина в методе Y, получают 3-(2-этоксиэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (210 мг) в виде порошка. МС: 457 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 1,0 (т, 3H), 2,9 (т, 2H), 4,6 (с, 2H), 7,45 (т, 1H), 7,5-7,7 (м, 4H), 7,8 (с, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,3 (с, 1H).
Пример 47
3-(2-Гидроксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Y, Z и W, но используя 1-аминопропан-2-ол в качестве амина в методе Y, получают 3-(2-гидроксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (265 мг) в виде твердого вещества. МС: 443 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 0,97 (д, 3H), 2,57-2,71 (м, 2H), 3,55-3,61 (кв, 1H), 4,6 (с, 2H), 7,45 (т, 1H), 7,54-7,77 (м, 4H), 7,8 (с, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,34 (с, 2H).
Пример 48
3-Циклопропилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Y, Z и W, но используя циклопропиламин в качестве амина в методе Y, получают 3-циклопропилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (265 мг) в виде твердого вещества. МС: 425 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 0,35-0,49 (м, 4H), 2,07-2,14 (м, 1H), 4,65 (д, 2H), 7,46 (дт, 1H), 7,57-7,73 (м, 4H), 7,81 (с, 1H), 7,94 (д, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,33 (с, 2H), 9,55 (т, 1H); IC50=132 нМ.
Пример 49
3-(3-Гидроксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Y, Z и W, но используя 3-аминопропанол в качестве амина в методе Y, получают 3-(3-гидроксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (175 мг) в виде порошка. МС: 443 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 1,51 (п, 2H), 2,79 (т, 2H), CH2 скрыта пиком воды, 4,64 (с, 2H), 7,45 (дт, 1H), 7,55-7,70 (м, 4H), 7,79 (с, 1H), 8,135 (д, 1H), 8,31 (д, 1H), 9,29 (с, N-H), 9,33 (с, 1H); IC50=22 нМ.
Пример 50
3-(2-Метоксиэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
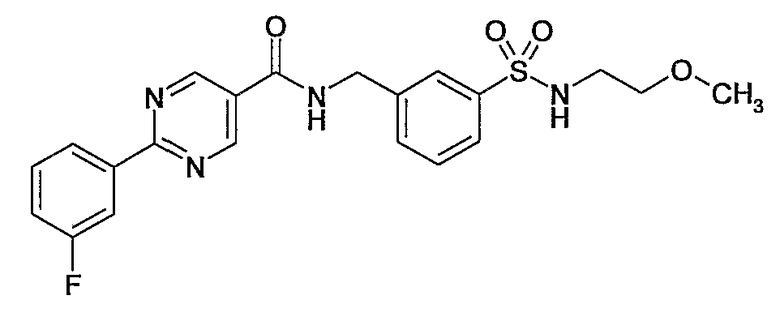
На основе общих методов Y, Z и W, но используя 2-метоксиэтиламин в качестве амина в методе Y, получают 3-(2-метоксиэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (190 мг) в виде порошка. МС: 443 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 2,90 (т, 2H), 3,14 (с, 3H), CH2 скрыта пиком воды, 4,63 (с, 2H), 7,45 (дт, 1H), 7,54-7,71 (м, 4H), 7,80 (с, 1H), 8,15 (д, 1H), 8,31 (д, 1H), 9,33 (с, 2H), 9,57 (ушир.с, N-H).
Пример 51
3-(3-Метоксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
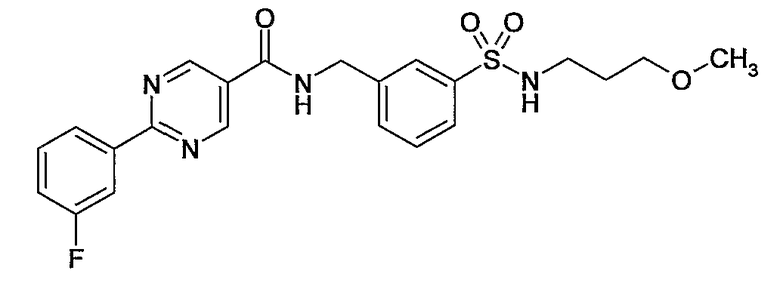
На основе общих методов Y, Z и W, но используя 3-метоксипропиламин в качестве амина в методе Y, получают 3-(3-метоксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (201 мг) в виде порошка. МС: 457 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 1,57 (п, 2H), 2,77 (т, 2H), 3,13 (с, 3H), 3,24 (т, 2H), 4,63 (с, 2H), 7,45 (дт, 1H), 7,55-7,70 (м, 4H), 7,79 (с, 1H), 8,15 (д, 1H), 8,31 (д, 1H), 9,33 (с, 2H), 9,58 (ушир.с, N-H); IC50=37 нМ.
Пример 52
3-(4-Метоксибутилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
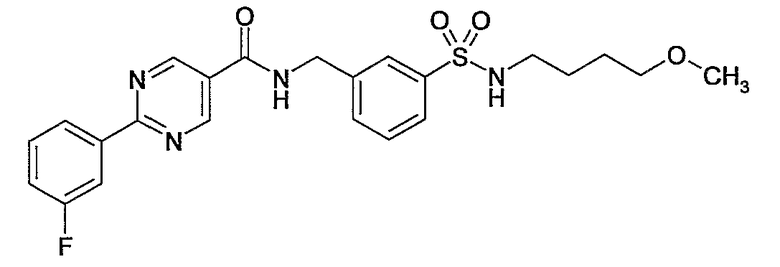
На основе общих методов Y, Z и W, но используя 4-метоксибутиламин в качестве амина в методе Y, получают 3-(4-метоксибутилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (220 мг) в виде порошка. МС: 471 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 1,01 (т, 2H), 1,57 (п, 2H), 2,78 (т, 2H), CH2 и CH3 скрыты пиком воды, 4,63 (с, 2H), 7,45 (дт, 1H), 7,55-7,70 (м, 4H), 7,79 (с, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,33 (с, 2H), 9,59 (ушир.с, N-H).
Пример 53
3-Циклогексилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Y, Z и W, но используя циклогексиламин в качестве амина в методе Y, получают 3-циклогексилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (240 мг) в виде порошка. МС: 467 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 1,07 (т, 6H), 1,41 (ушир.с, 1H), 1,53-1,55 (м, 4H), 2,90 (ушир.с, 1H), 4,63 (д, 2H), 7,45 (дт, 1H), 7,53-7,72 (м, 4H), 7,80 (с, 1H), 8,15 (дд, 1H), 8,30 (д, 1H), 9,33 (с, 2H), 9,55 (т, 1H).
Пример 54
3-(2-Гидрокси-1,1-диметилэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Y, Z и W, но используя 2-амино-2-метилпропан-1-ол в качестве амина в методе Y, получают 3-(2-гидрокси-1,1-диметилэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (90 мг) в виде твердого вещества. МС: 457 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 1,00 (с, 6H), 3,19 (д, 2H), 4,63 (д, 2H), 4,75 (т, 1H), 7,35 (с, 1H), 7,45 (дт, 1H), 7,52-7,67 (м, 3H), 7,75 (д, 1H), 7,84 (с, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,33 (с, 2H), 9,54 (т, 1H); IC50=60 нМ.
Пример 55
3-Сульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Y, Z и W, но используя трет-бутиламин в качестве амина в методе Y, получают 3-сульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (25 мг) в виде порошка. МС: 385 (M-H); 1H ЯМР (300 МГц, CDCl3): δ 4,62 (д, 2H), 7,38 (с, 1H), 7,45 (т, 1H), 7,53-7,75 (м, 5H), 7,83 (с, 1H), 8,16 (д, 1H), 8,32 (д, 1H), 8,34 (с, 1H), 9,32 (с, 2H), 9,55 (т, 1H); IC50=31 нМ.
Пример 56
3-(2-Морфолин-4-илэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
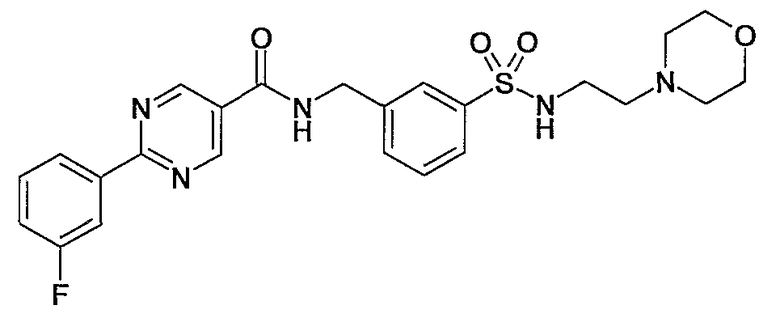
На основе общих методов Х, Z и W, но используя 2-морфолин-4-илэтиламин в качестве амина в методе Х, получают 3-(2-морфолин-4-илэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (150 мг), содержащий небольшое количество ТФУ. МС: 500 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 3,0-3,4 (м, 8H), 3,5-3,75 (м, 2H), 3,85-4,1 (м, 2H), 4,64 (д, 2H), 7,45 (дт, 1H), 7,60-7,75 (м, 4H), 7,82 (с, 1H), 8,01 (с, 1H), 8,16 (д, 1H), 8,30 (д, 1H), 9,33 (с, 2H), 9,56 (т, 1H), 9,69 (м, 1H); IC50=37 нМ.
Пример 57
3-(2-Пиперидин-1-илэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
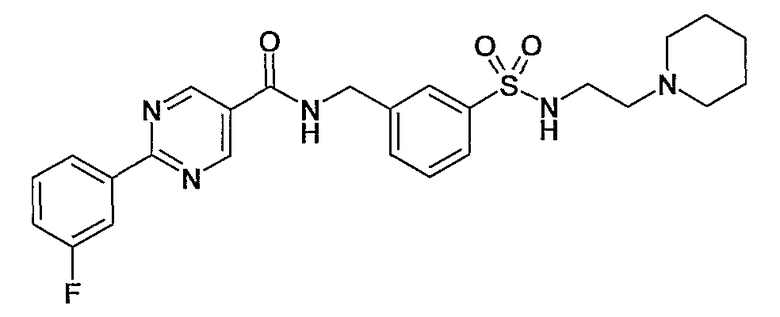
На основе общих методов Х, Z и W, но используя 2-пиперидин-1-илэтиламин в качестве амина в методе Х, получают 3-(2-пиперидин-1-илэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (125 мг), содержащий небольшое количество ТФУ. МС: 498 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,2-1,8 (м, 6H), 2,8-2,95 (м, 2H), 3,11 (ушир.с, 4H), 3,3-3,5 (м, 2H), 4,64 (д, 2H), 7,46 (дт, 1H), 7,60-7,75 (м, 4H), 7,82 (с, 1H), 8,00 (ушир.с, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,08 (м, 1H), 9,33 (с, 2H), 9,56 (т, 1H).
Пример 58
3-[2-(1-Метилпирролидин-2-ил)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
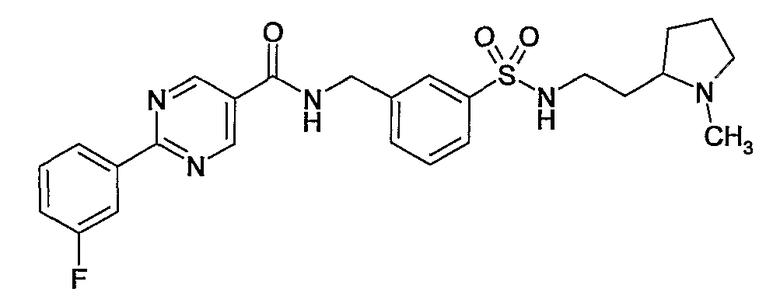
На основе общих методов Х, Z и W, но используя 2-(1-метилпирролидин-2-ил)этиламин в качестве амина в методе Х, получают 3-[2-(1-метилпирролидин-2-ил)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (110 мг). МС: 498 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,4-1,7 (м, 2H), 1,7-2,2 (м, 4H), 2,7-2,9 (м, 5H), 3,0-3,1 (м, 1H), 3,1-3,3 (м, 1H), 3,4-3,6 (м, 1H), 4,64 (д, 2H), 7,46 (дт, 1H), 7,58-7,72 (м, 4H), 7,79 (с, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,33 (с, 2H), 9,56 (т, 1H).
Пример 59
3-[(1-Этилпирролидин-2-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Х, Z и W, но используя С-(1-этилпирролидин-2-ил)метиламин в качестве амина в методе Х, получают 3-[(1-этилпирролидин-2-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (85 мг), содержащий небольшое количество ТФУ. МС: 498 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,20 (т, 3H), 1,6-2,2 (м, 4H), 2,95-3,2 (м, 4H), 3,25-3,45 (м, 2H), 3,45-3,6 (м, 1H), 4,65 (д, 2H), 7,46 (дт, 1H), 7,60-7,76 (м, 4H), 7,83 (с, 1H), 8,09-8,17 (м, 2H), 8,31 (д, 1H), 9,13 (ушир.с, 1H), 9,34 (с, 2H), 9,57 (т, 1H).
Пример 60
3-[2-(1H-Имидазол-4-ил)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
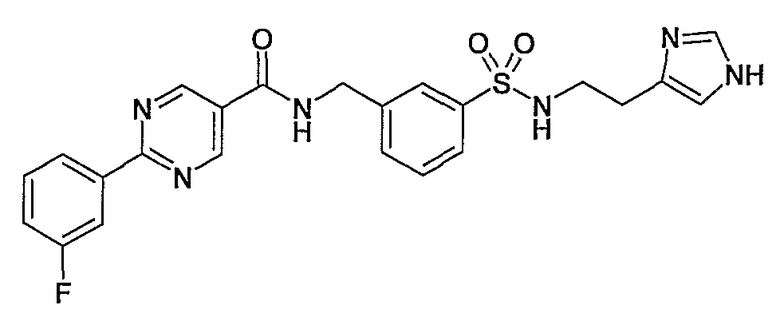
На основе общих методов Х, Z и W, но используя 2-(1H-имидазол-4-ил)этиламин в качестве амина в методе Х, получают 3-[2-(1H-имидазол-4-ил)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (30 мг) в форме твердого вещества. МС: 481 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 2,77 (т, 2H), 3,06 (т, 2H), 4,63 (д, 2H), 7,40 (с, 1H), 7,46 (т, 1H), 7,56-7,96 (м, 4H), 7,77 (с, 1H), 7,86 (т, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,32 (с, 2H), 9,55 (т, 1H); IC50=61 нМ.
Пример 61
3-[3-(2-Метилпиперидин-1-ил)пропилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Х, Z и W, но используя 3-(2-метилпиперидин-1-ил)пропиламин в качестве амина в методе Х, получают 3-[3-(2-метилпиперидин-1-ил)пропилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (155 мг), содержащий небольшое количество ТФУ. МС: 526 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,19 (дд, 3H), 1,3-1,9 (м, 8H), 2,75-3,25 (м, 6H), 3,3-3,6 (м, 1H), 4,64 (д, 2H), 7,46 (дт, 1H), 7,58-7,72 (м, 4H), 7,79-7,85 (м, 2H), 8,16 (д, 1H), 8,31 (д, 1H), 8,9-9,2 (м, 1H), 9,34 (с, 2H), 9,57 (т, 1H).
Пример 62
3-(3-Пирролидин-1-илпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
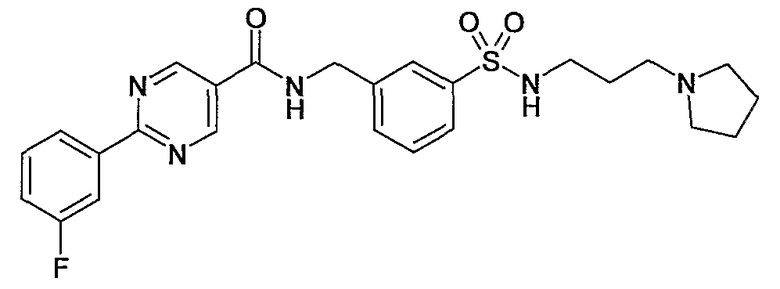
На основе общих методов Х, Z и W, но используя 3-пирролидин-1-илпропиламин в качестве амина в методе Х, получают 3-(3-пирролидин-1-илпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (105 мг). МС: 498 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,7-1,9 (м, 4H), 1,9-2,1 (м, 2H), 2,8-3,0 (м, 4H), 3,05-3,15 (м, 2H), 3,2-3,35 (м, 2H), 4,64 (д, 2H), 7,46 (дт, 1H), 7,58-7,77 (м, 4H), 7,79 (м, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,34 (с, 2H), 9,41 (ушир.с, 1H), 9,56 (т, 1H).
Пример 63
3-(2-Диметиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Х, Z и W, но используя N1,N1-диметилэтан-1,2-диамин в качестве амина в методе Х, получают 3-(2-диметиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (38 мг) в виде твердого вещества. МС: 458 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 2,78 (с, 6H), 3,0-3,2 (м, 4H), 4,65 (д, 2H), 7,46 (дт, 1H), 7,60-7,76 (м, 4H), 8,01 (т, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,33 (ушир.с, 3H), 9,56 (т, 1H); IC50=45 нМ.
Пример 64
3-(2-Диэтиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
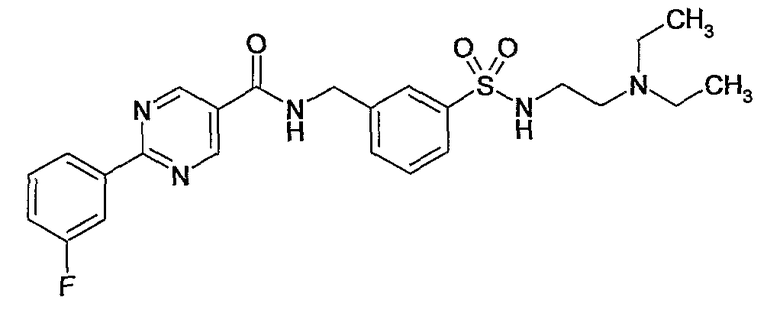
На основе общих методов Х, Z и W, но используя N1,N1-диэтилэтан-1,2-диамин в качестве амина в методе Х, получают 3-(2-диэтиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (128 мг), содержащий небольшое количество ТФУ. МС: 486 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,16 (т, 6H), 3,0-3,2 (м, 8H), 4,65 (д, 2H), 7,46 (дт, 1H), 7,60-7,76 (м, 4H), 7,83 (с, 1H), 8,02 (т, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,17 (ушир.с, 1H), 9,33 (с, 2H), 9,57 (т, 1H).
Пример 65
3-(3-Диметиламино-2,2-диметилпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
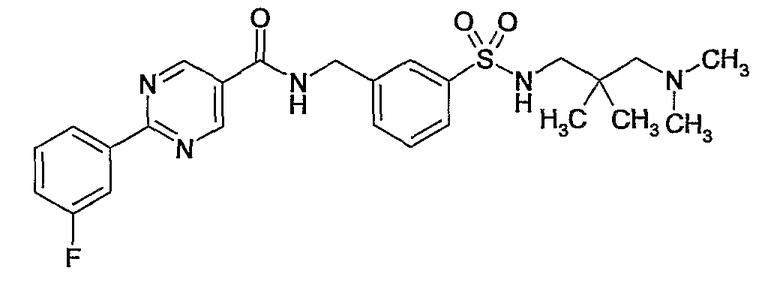
На основе общих методов Х, Z и W, но используя 2,2,N1,N1-тетраметилпропан-1,3-диамин в качестве амина в методе Х, получают 3-(3-диметиламино-2,2-диметилпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (190 мг), содержащий небольшое количество ТФУ. МС: 500 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 0,95 (с, 6H), 2,68 (д, 2H), 2,84 (д, 6H), 3,03 (д, 2H), 4,64 (д, 2H), 7,46 (дт, 1H), 7,58-7,74 (м, 4H), 7,80 (с, 1H), 7,85 (т, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 8,85 (ушир.с, 1H), 9,34 (с, 2H), 9,57 (т, 1H); IC50=35 нМ.
Пример 66
3-(5-Диметиламинопентилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Х, Z и W, но используя N1,N1-диметилпентан-1,5-диамин в качестве амина в методе Х, получают 3-(5-диметиламинопентилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (175 мг). МС: 500 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,22-1,27 (м, 2H), 1,34-1,44 (м, 2H), 1,44-1,57 (м, 2H), 2,70-2,74 (м, 8H), 2,92-2,99 (м, 2H), 4,63 (д, 2H), 7,46 (дд, 1H), 7,56-7,70 (м, 4H), 7,78 (с, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,33 (с, 2H), 9,56 (т, 1H).
Пример 67
3-(2-Диизопропиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

На основе общих методов Х, Z и W, но используя N1,N1-диизопропилэтан-1,2-диамин в качестве амина в методе Х, получают 3-(2-диизопропиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (150 мг). МС: 514 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,21 (т, 12H), 3,06-3,08 (м, 4H), 3,58-3,65 (м, 2H), 4,64 (д, 2H), 7,46 (дд, 1H), 7,60-7,75 (м, 4H), 7,82 (с, 1H), 8,07 (т, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,34 (с, 2H), 9,59 (т, 1H).
Пример 68
3-(Метансульфониламинометил)бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты
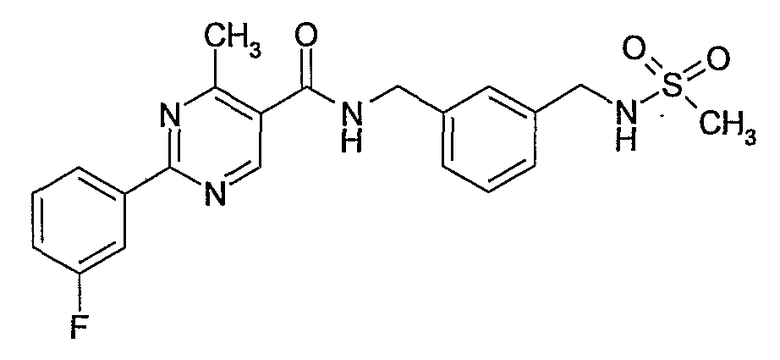
Стадия 1. Na0 (0,66 г, 28,6 ммоль) добавляют к безводному EtOH (100 мл) и перемешивают при комнатной температуре в течение 15 мин. Добавляют 3-фторбензамидин гидрохлорид (4,87 г, 27,8 ммоль) и раствор перемешивают 15 мин. Добавляют этиловый эфир 2-диметиламинометилен-3-оксомасляной кислоты (5,3 г, 28,6 ммоль) и реакционную смесь нагревают с обратным холодильником под N2 в течение 1 часа. Реакционную смесь охлаждают до комнатной температуры и концентрируют в вакууме. Остаток растворяют в EtOAc (300 мл), промывают солевым раствором (2×100 мл), сушат (NaSO4), фильтруют и концентрируют, чтобы получить этиловый эфир 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты (6,8 г, 99%). МС: 261 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,43 (т, J=7,0 Гц, 3H), 2,92 (с, 3H), 4,42 (кв, J=7,0 Гц, 2H), 7,24 (м, 1H), 7,45 (м, 1H), 8,27 (м, 1H), 8,37 (м, 1H), 9,21 (с, 1H).
Стадия 2. Раствор этилового эфира 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты (6,7 г, 27,2 ммоль) и NaOH (2,1 г, 54,4 ммоль) в растворе 1:1:1 ТГФ, MeOH и воды (300 мл) нагревают с обратным холодильником в течение 45 мин. ТГФ/MeOH отгоняют и водный раствор обрабатывают 3н HCl, чтобы скорректировать pH в пределах от 2 до 3. Твердую фазу фильтруют, промывают водой и сушат под вакуумом, чтобы получить 2-(3-фторфенил)-4-метилпиримидин-5-карбоновую кислоту (5,4 г, 91%) в виде твердого вещества. МС: 233 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 2,85 (с, 3H), 7,24 (м, 1H), 7,50 (м, 1H), 8,17 (м, 1H), 8,32 (м, 1H), 9,20 (с, 1H).
Стадия 3. К раствору 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты (0,195 г, 0,89 ммоль) в ТГФ (5 мл) добавляют карбонил диимидазол (0,18 г, 1,1 ммоль) и нагревают при 60°С в течение 2 часов. Смесь охлаждают до комнатной температуры. Добавляют трет-бутиловый эфир (3-аминометилбензил)карбаминовой кислоты (0,25 мл, 1,1 ммоль) и смесь перемешивают в течение 12 часов. Смесь разбавляют EtOAc (100 мл), промывают солевым раствором (2×50 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией, элюируя 20-80% EtOAc/гептан, чтобы получить трет-бутиловый эфир [3-({[2-(3-фторфенил)-4-метилпиримидин-5-карбонил]амино}метил)бензил]карбаминовой кислоты (0,32 г, 80%) в форме твердого вещества. МС: 451 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 1,38 (с, 9H), 2,65 (с, 3H), 4,14 (д, J=6,1 Гц, 2H), 4,50 (д, J=5,6 Гц, 2H), 7,15 (м, 1H), 7,24 (м, 1H), 7,31 (м, 1H), 7,43 (м, 1H), 7,62 (м, 1H), 8,13 (м, 1H), 8,28 (м, 1H), 8,89 (с, 1H), 9,23 (м, 1H).
Стадия 4. К раствору трет-бутилового эфира [3-({[2-(3-фторфенил)-4-метилпиримидина-5-карбонил]амино}метил)бензил]карбаминовой кислоты (0,05 г, 0,111 ммоль) в ДХМ (2 мл) при 0°C добавляют ТФУ (0,013 мл, 0,111 ммоль) и смесь перемешивают в течение 2,5 часа. Смесь концентрируют под вакуумом. Остаток растворяют в ТГФ (2 мл). Добавляют Et3N (0,05 мл, 0,333 ммоль) и метансульфонилхлорид (0,010 мл, 0,133 ммоль) и смесь перемешивают в течение 12 часов. Смесь разбавляют EtOAc (100 мл), промывают насыщенным водным NH4Cl (2×50 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией, элюируя 20-80% EtOAc/гептан, чтобы получить 3-(метансульфониламинометил)бензиламид 2-(3-фторфенил)-4-метил-пиримидин-5-карбоновой кислоты (0,03 г, 64%) в форме порошка. МС: 429 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,65 (с, 3H), 2,86 (с, 3H), 4,18 (д, J=6,3 Гц, 2H), 4,50 (д, J=5,9 Гц, 2H), 7,27-7,45 (м, 3H), 7,62 (м, 2H), 8,13 (м, 1H), 8,28 (м, 1H), 8,90 (с, 1H), 9,25 (м, 1H); IC50=48,5 нМ.
Пример 69
3-[(Пропан-2-сульфониламино)метил]бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты
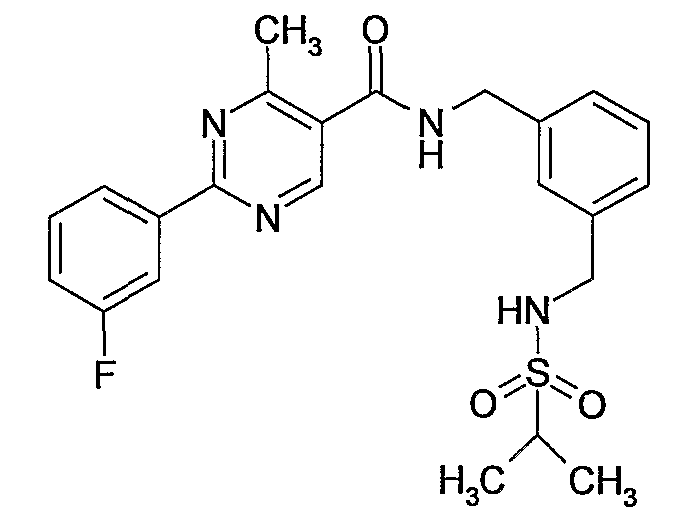
Методами, аналогичными описанным в примере 68 (стадия 3), но заменяя трет-бутиловый эфир (3-аминометилбензил)карбаминовой кислоты на изопропансульфонилхлорид (0,57 ммоль), получают 3-[(пропан-2-сульфониламино)метил]бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты (100 мг) в виде твердого вещества. МС: 456 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 1,22 (д, J=6,8 Гц, 6H), 2,65 (с, 3H), 3,10 (м, 1H), 4,18 (д, J=6,2 Гц, 2H), 4,51 (с, 2H), 7,27-7,45 (м, 3H), 7,62 (м, 2H), 8,14 (м, 1H), 8,26 (м, 1H), 8,90 (с, 1H), 9,25 (м, 1H).
Пример 70
3-Метилсульфамоилметилбензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты
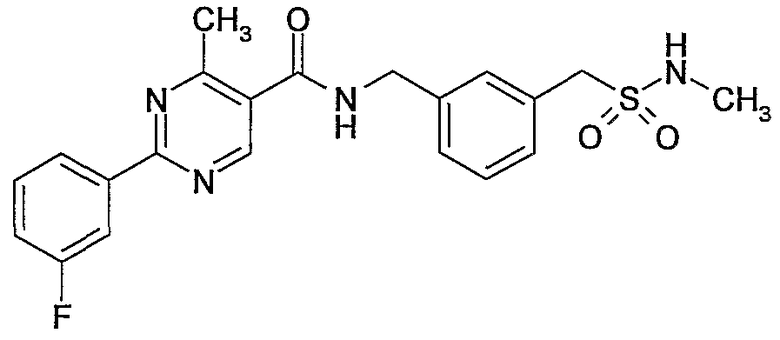
Стадия 1: Раствор 3-бромметилбензонитрила (2 г, 10,2 ммоль) в EtOH (50 мл) обрабатывают раствором Na2SO3 (1,3 г, 10,3 ммоль) в H2O (50 мл) и нагревают с обратным холодильником в течение 4 часов. Смесь концентрируют под вакуумом. Остаток суспендируют в ДХМ (100 мл) и ДМФ (1 мл), охлаждают до 0°C и обрабатывают оксалилхлоридом (8 мл, 43,4 ммоль). Смесь нагревают до комнатной температуры и перемешивают в течение 3 часов. Смесь разбавляют солевым раствором, экстрагируют ДХМ (2×100 мл), сушат Na2SO4, фильтруют и концентрируют в вакууме. Остаток растворяют в ТГФ (25 мл), добавляют метиламин (2М, 12,5 мл, 25 ммоль) и смесь перемешивают в течение 12 часов. Смесь разбавляют EtOAc (100 мл), промывают насыщенным водным NH4Cl (2×100 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией, элюируя 20-80% EtOAc/гептан, чтобы получить C-(3-цианофенил)-N-метилметансульфонамид (1,5 г, 69%) в форме порошка. МС: 209 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,60 (д, J=4,8 Гц, 3H), 4,44 (с, 2H), 7,02 (м, 1H), 7,61 (м, 1H), 7,74 (м, 1H), 7,85 (м, 2H).
Стадия 2: К раствору C-(3-цианофенил)-N-метилметансульфонамида (42 мг, 0,2 ммоль) в ТГФ (4 мл) добавляют раствор BH3 .ТГФ в ТГФ (1M, 1 мл). Смесь помещают в герметичный сосуд и нагревают в микроволновом реакторе при 100°C в течение 120 секунд. Смесь выливают в 1M HCl (20 мл), подщелачивают 3M NaOH до pH ~10, экстрагируют ДХМ (2×50 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме, чтобы получить C-(3-аминометилфенил)-N-метилметансульфонамид, который используется непосредственно на следующей стадии без дальнейшей очистки.
Стадия 3: Методами, аналогичными описанным в примере 68 (стадия 3), но заменяя трет-бутиловый эфир (3-аминометилбензил)карбаминовой кислоты на C-(3-аминометилфенил)-N-метилметансульфонамид (2,3 ммоль), получают 3-метилсульфамоилметилбензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты (30 мг) в виде твердого вещества. МС: 429 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,58 (д, J=4,8 Гц, 3H), 2,65 (с, 3H), 4,34 (с, 2H), 4,53 (д, J=5,7 Гц, 2H), 6,92 (м, 1H), 7,27-7,45 (м, 3H), 7,62 (м, 2H), 8,14 (м, 1H), 8,28 (м, 1H), 8,90 (с, 1H), 9,23 (м, 1H).
Пример 71
3-(Изопропилсульфамоилметил)бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты
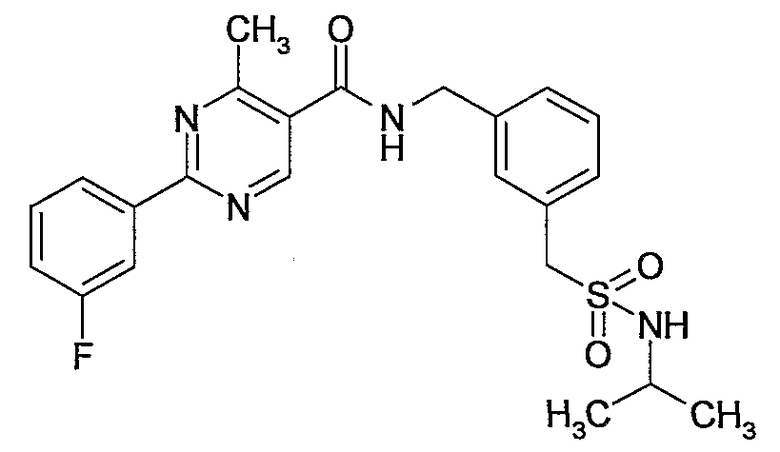
Стадия 1: К раствору 3-бромметилбензонитрила (2 г, 10,2 ммоль) в EtOH (50 мл) добавляют раствор Na2SO3 (1,3 г, 10,3 ммоль) в H2O (50 мл) и смесь нагревают с обратным холодильником в течение 4 часов. Смесь концентрируют под вакуумом. Остаток суспендируют в ДХМ (100 мл) и ДМФ (1 мл), охлаждают до 0°C и обрабатывают оксалилхлоридом (4,5 мл, 24,4 ммоль). Смесь нагревают до комнатной температуры в течение 3 часов. Смесь разбавляют солевым раствором (100 мл), экстрагируют ДХМ (2×100 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток растворяют в THF (100 мл) и обрабатывают изопропиламином (3,5 мл, 40,8 ммоль). Смесь перемешивают в течение 12 ч, разбавляют EtOAc (200 мл), промывают насыщенным водным NH4Cl (2×100 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией, элюируя 20-80% EtOAc/гептан, чтобы получить C-(3-цианофенил)-N-изопропилметансульфонамид в форме порошка. МС: 237 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 1,10 (д, J=6,6 Гц, 6H), 3,36 (м, 1H), 4,42 (с, 2H), 7,09 (м, 1H), 7,57 (м, 1H), 7,74 (м, 1H), 7,85 (м, 2H).
Стадия 2: К раствору C-(3-цианофенил)-N-изопропилметансульфонамида (0,5 г, 2,06 ммоль) в ТГФ (10 мл) добавляют раствор BH3 .ТГФ в ТГФ (1 M, 10,3 мл). Смесь помещают в герметичный сосуд и нагревают в микроволновом реакторе при 100°C в течение 120 секунд. Смесь выливают в 1M HCl (50 мл), подщелачивают 3M NaOH до pH ~10, экстрагируют ДХМ (2×50 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме, чтобы получить C-(3-аминометилфенил)-N-изопропилметансульфонамид, который используется непосредственно на следующей стадии без дальнейшей очистки.
Стадия 3: Методами, аналогичными описанным в примере 68 (стадия 3), но заменяя трет-бутиловый эфир (3-аминометилбензил)карбаминовой кислоты на C-(3-аминометилфенил)-N-изопропилметансульфонамид (2 ммоль), получают 3-(пропан-2-сульфониламино)метил]бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты (160 мг) в виде твердого вещества. МС: 457 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 1,09 (д, J=6,4 Гц, 6H), 2,65 (с, 3H), 3,37 (м, 1H), 4,31 (с, 2H), 4,53 (д, J=5,8 Гц, 2H), 6,99 (д, J=7,1 Гц, 1H), 7,27-7,45 (м, 3H), 7,62 (м, 1H), 8,13 (м, 1H), 8,28 (м, 1H), 8,90 (с, 1H), 9,24 (м, 1H); IC50=34 нМ.
Пример 72
3-(Метансульфониламинометил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
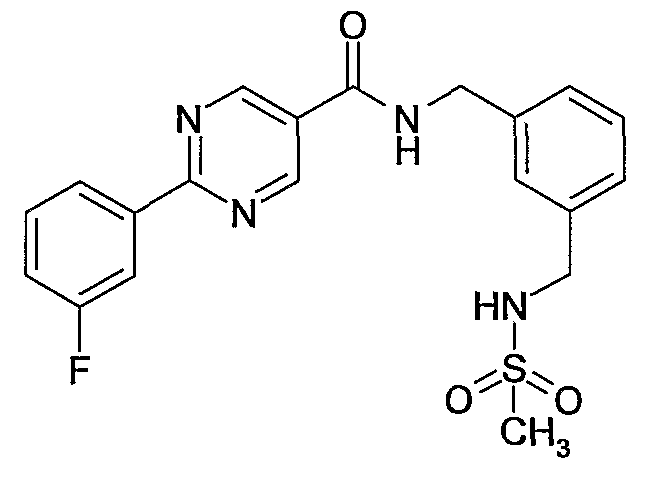
Стадия 1. К раствору 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (0,5 г, 2,25 ммоль) в ТГФ (25 мл) добавляют карбонил диимидазол (0,5 г, 2,7 ммоль) и нагревают при 60°С в течение 2 часов. Смесь охлаждают до комнатной температуры и добавляют трет-бутиловый эфир (3-аминометилбензил)карбаминовой кислоты (0,67 мл, 2,7 ммоль). Смесь перемешивают в течение 12 часов, разбавляют EtOAc (100 мл), промывают солевым раствором (2×50 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией, элюируя 20-80% EtOAc/гептан, чтобы получить трет-бутиловый эфир [3-({[2-(3-фторфенил)пиримидин-5-карбонил]амино}метил)бензил]карбаминовой кислоты (0,8 г, 80%) в форме твердого вещества. МС: 437 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 1,35 (с, 9H), 4,13 (д, J=6,1 Гц, 2H), 4,54 (д, J=5,9 Гц, 2H), 7,27-7,48 (м, 4H), 7,62 (м, 1H), 8,16 (м, 1H), 8,31 (м, 1H), 9,32 (с, 2H), 9,43 (м, 1H).
Стадия 2. К раствору трет-бутилового эфира [3-({[2-(3-фторфенил)пиримидин-5-карбонил]амино}метил)бензил]карбаминовой кислоты (0,28 г, 0,64 ммоль) при 0°C добавляют HCl в диоксане (6,5 мл, 4н.) и смесь перемешивают в течение 2,5 часов. Смесь концентрируют под вакуумом. Остаток растворяют в ДХМ (3 мл), добавляют Et3N (0,21 мл, 0,1,5 ммоль) и метансульфонилхлорид (0,105 мл, 0,1,3 ммоль). Смесь перемешивают в течение 12 ч, разбавляют EtOAc (100 мл), промывают насыщенным водным NH4Cl (2×50 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают флэш-хроматографией, элюируя 20-80% EtOAc/гептан, чтобы получить 3-(метансульфониламинометил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (0,25 г, 94%) в форме порошка. МС: 459 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,85 (c, 3H), 4,17 (д, J=6,2 Гц, 2H), 4,56 (д, J=5,9 Гц, 2H), 7,27-7,62 (м, 5H), 8,17 (м, 1H), 8,32 (м, 1H), 9,32 (с, 2H), 9,45 (м, 1H).
Пример 73
3-[(Пропан-2-сульфониламино)метил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 72 (стадия 2), но заменяя метансульфонилхлорид на изопропансульфонилхлорид (1,3 ммоль), получают 3-[(пропан-2-сульфониламино)метил]бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты (7 мг) в виде твердого вещества. МС: 443 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 1,20 (д, J=6,8 Гц, 6H), 3,05 (м, 1H), 4,17 (д, J=6,4 Гц, 2H), 4,55 (д, J=5,9 Гц, 2H), 7,27-7,62 (м, 5H), 8,17 (м, 1H), 8,32 (м, 1H), 9,32 (с, 2H), 9,45 (м, 1H).
Пример 74
3-Метилсульфамоилметилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 72 (стадия 1), но заменяя трет-бутиловый эфир (3-аминометилбензил)карбаминовой кислоты на C-(3-аминометилфенил)-N-метилметансульфонамид (1,17 ммоль), получают 3-метилсульфамоилметилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (105 мг) в виде твердого вещества. МС: 415 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,57 (д, J=4,8 Гц, 3H), 4,32 (с, 2H), 4,57 (д, J=5,9 Гц, 2H), 6,92 (м, 1H), 7,28-7,67 (м, 5H), 8,17 (м, 1H), 8,32 (м, 1H), 9,32 (с, 2H), 9,46 (м, 1H).
Пример 75
3-(Изопропилсульфамоилметил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
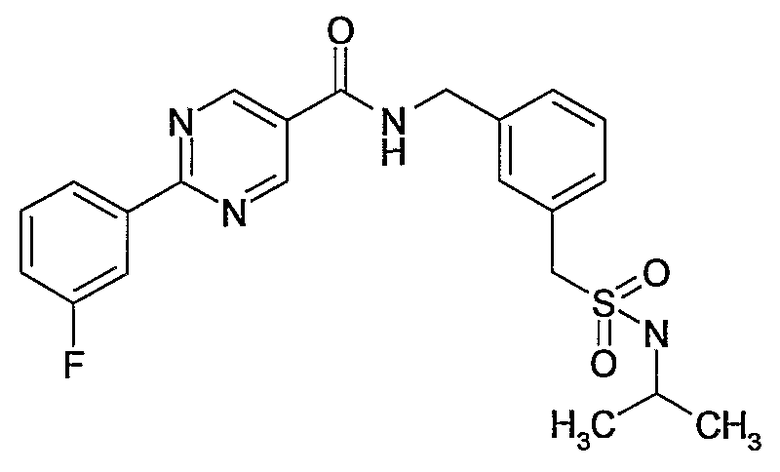
Методами, аналогичными описанным в примере 72 (стадия 1), но заменяя трет-бутиловый эфир (3-аминометилбензил)карбаминовой кислоты на C-(3-аминометилфенил)-N-изопропил-метансульфонамид (1,45 ммоль), получают 3-(изопропилсульфамоилметил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (140 мг) в виде твердого вещества. МС: 443 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 1,07 (д, J=6,4 Гц, 6H), 3,39 (м, 1H), 4,29 (с, 2H), 4,56 (д, J=5,9 Гц, 2H), 6,99 (д, J=7,1 Гц, 1H), 7,28-7,45 (м, 3H), 7,62 (м, 1H), 8,17 (м, 1H), 8,32 (м, 1H), 9,32 (с, 2H), 9,45 (м, 1H).
Пример 76
(2-Метансульфониламинопиридин-4-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

Стадия 1: Раствор 2-аминоизоникотинонитрила (1 г, 8,4 ммоль) и метансульфонилхлорида (0,716 мл, 9,2 ммоль) в пиридине (10 мл) перемешивают при комнатной температуре в течение 12 часов. Смесь выливают на лед и перемешивают 20 мин. Смесь фильтруют и промывают водой (100 мл), а затем диэтиловым эфиром (100 мл). Твердое вещество сушат под вакуумом, чтобы получить N-(4-цианопиридин-2-ил)метансульфонамид (1,1 г, 66%). МС: 198 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 3,32 (с, 3H), 7,27 (с, 1H), 7,48 (д, J=5,1 Гц, 1H), 8,53 (д, J=5,3 Гц, 1H).
Стадия 2: N-(4-Цианопиридин-2-ил)метансульфонамид (0,15 г, 0,76 ммоль) растворяют в MeOH (4 мл) и концентрированной HCl (2 мл) и обрабатывают Pd/C (10%, 150 мг). Смесь перемешивают под Н2 в течение 12 часов, фильтруют и концентрируют под вакуумом, чтобы получить N-(4-аминометилпиридин-2-ил)метансульфонамид (0,15 г, 97%), который используется на следующей стадии без дополнительной очистки.
Стадия 3: Методами, аналогичными описанным в примере 72 (стадия 1), но заменяя трет-бутиловый эфир (3-аминометилбензил)карбаминовой кислоты на N-(4-аминометилпиридин-2-ил)метансульфонамид (0,75 ммоль), получают (2-метансульфониламинопиридин-4-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (320 мг) в виде твердого вещества. МС: 402 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 3,24 (с, 3H), 4,53 (д, J=5,7 Гц, 2H), 6,97 (ушир.с, 2H), 7,43 (м, 1H), 7,63 (м, 1H), 8,18 (м, 2H), 8,33 (м, 1H), 9,33 (с, 2H), 9,52 (м, 1H).
Пример 77
(Тетрагидропиран-4-ил)амид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты
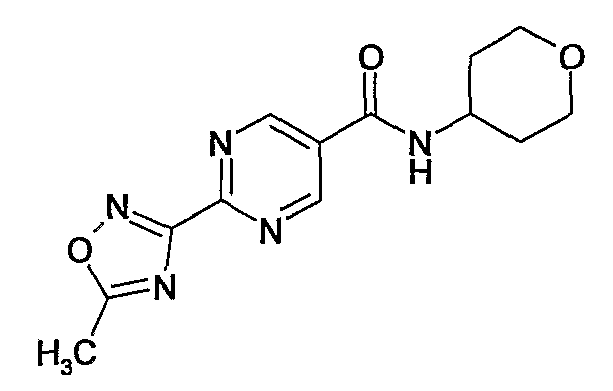
Стадия 1. К раствору метилового эфира 2-метилсульфанилпиримидин-5-карбоновой кислоты 1 (1 г, 5,43 ммоль) в ДХМ (60 мл) добавляют MCPBA (2,81 г, 16,29 ммоль) порциями при комнатной температуре. Полученный раствор перемешивают в течение ночи при комнатной температуре. Добавляют раствор Na2S2O3 (1,6 г) в воде (60 мл). Смесь перемешивают при комнатной температуре в течение 20 мин. Слой отделяют, водный слой экстрагируют ДХМ (2×20 мл). Объединенный слой ДХМ промывают насыщенным NaHCO3 (3×20 мл), сушат (NaSO4), фильтруют и концентрируют под вакуумом, чтобы получить метиловый эфир 2-метансульфонилпиримидин-5-карбоновой кислоты в виде твердого вещества (1,05 г, 90%). МС: 217 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 3,41 (с, 3H), 4,06 (с, 3H), 9,44 (с, 2H).
Стадия 2. К раствору метилового эфира 2-метансульфонилпиримидин-5-карбоновой кислоты 2 (2,5 г, 11,56 ммоль) в ДХМ (30 мл) добавляют раствор цианида тетрабутиламмония (3,1 г, 11,56 ммоль) в воде (30 мл) медленно, при комнатной температуре. Смесь перемешивают в течение 80 мин. Смесь промывают водой (2×20 мл), сушат (Na2SO4), фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией, элюируя 5-60% EtOAc в гептане, чтобы получить метиловый эфир 2-цианопиримидин-5-карбоновой кислоты (1,16 г, 61%) в виде твердого вещества. МС: 164 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 4,05 (с, 3H), 9,37 (с, 2H).
Стадия 3. К раствору метилового эфира 2-цианопиримидин-5-карбоновой кислоты 3 (1 г, 6,13 ммоль) в MeOH (20 мл) при комнатной температуре добавляют гидроксиламин гидрохлорид (0,64 г, 9,2 ммоль) и ацетат натрия (0,76 г, 9,2 ммоль). Полученную смесь нагревают с обратным холодильником в течение 2 часов. Смесь охлаждают до комнатной температуры и концентрируют в вакууме. К остатку добавляют воду (30 мл) и осадок фильтруют и дважды промывают водой. Твердое вещество сушат в вакуумной печи в течение ночи, чтобы получить метиловый эфир 2-(N-гидроксикарбамимидоил)пиримидин-5-карбоновой кислоты (1,09 г, 91%) в виде твердого вещества. МС: 197 (M+H).
Стадия 4. К раствору метилового эфира 2-(N-гидроксикарбамимидоил)пиримидин-5-карбоновой кислоты (900 мг, 4,59 ммоль) в пиридине (15 мл) по каплям добавляют ацетилхлорид (432 мг, 5,5 ммоль). Полученный раствор перемешивают при комнатной температуре в течение 1 часа и нагревают с обратным холодильником в течение 3 часов. Раствор охлаждают до комнатной температуры и концентрируют в вакууме. К остатку добавляют воду (30 мл) и смесь экстрагируют EtOAc (3×20 мл). Объединенный органический слой промывают насыщенным NaHCO3, сушат (NaSO4), фильтруют и концентрируют под вакуумом, чтобы получить метиловый эфир 2-(5-метил-[1,2,3]оксадиазо-3-ил)пиримидин-5-карбоновой кислоты в виде твердого вещества (900 мг, 89%). МС: 221 (M+H).
Стадия 5. К раствору метилового эфира 2-(5-метил-[1,2,3]оксадиазо-3-ил)пиримидин-5-карбоновой кислоты (900 мг) в MeOH (20 мл) добавляют раствор LiOH (100 мг) в воде (20 мл) при 0°C. Убирают ледяную баню и смесь перемешивают еще 10 мин. Растворитель упаривают и добавляют воду (20 мл). Водный раствор промывают эфиром (2×20 мл) и подкисляют 2н HCl до pH ~3. Полученный осадок фильтруют, промывают водой и сушат в вакуумной печи в течение ночи, чтобы получить 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновую кислоту (350 мг, 37%) в виде твердого вещества. МС: 207 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,73 (с, 3H), 9,39 (с, 2H).
Стадия 6. К раствору 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты (50 мг, 0,24 ммоль) в ДХМ (10 мл) добавляют 1-[3-(диметиламино)пропил-3-этилкарбодиимид (50 мг, 0,26 ммоль) и N-гидроксибензотриазол (35 мг, 0,26 ммоль) при комнатной температуре. Смесь перемешивают в течение 10 минут и добавляют тетрагидропиран-4-иламин (27 мг, 0,26 ммоль). Смесь перемешивают в течение ночи, промывают 2н HCl (1×5 мл), насыщенным NaHCO3 (1×5 мл), водой (1×5 мл), сушат (Na2SO4), фильтруют и концентрируют под вакуумом. Остаток очищают колоночной хроматографией, элюируя 5% МеОН в ДХМ, чтобы получить (тетрагидропиран-4-ил)амид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты (33 мг) в виде твердого вещества. МС: 290 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,70 (м, 2H), 2,04 (м, 2H), 2,76 (с, 3H), 3,59 (м, 2H), 4,06 (м, 2H), 4,28 (м, 1H), 9,26 (с, 2H); IC50=513,5 нМ.
Пример 78
4-Сульфамоилбензоламид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 77 (стадия 6), но заменяя тетрагидропиран-4-иламин на 4-аминометилбензолсульфонамид, получают 4-сульфамоилбензоламид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 375 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,72 (с, 3H), 4,61 (д, 2H), 7,33 (с, 2H), 7,56 (д, 2H), 7,80 (д, 2H), 9,39 (с, 2H).
Пример 79
(3-Фенил-[1,2,4]тиадиазол-5-ил)амид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 77 (стадия 6), но заменяя тетрагидропиран-4-иламин на 3-фенил-[1,2,4]тиадиазол-5-иламин, получают (3-фенил-[1,2,4]тиадиазол-5-ил)амид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 366 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,74 (с, 3H), 7,56 (м, 3H), 8,24 (м, 2H), 9,63 (с, 2H).
Пример 80
3-(Морфолин-4-сульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
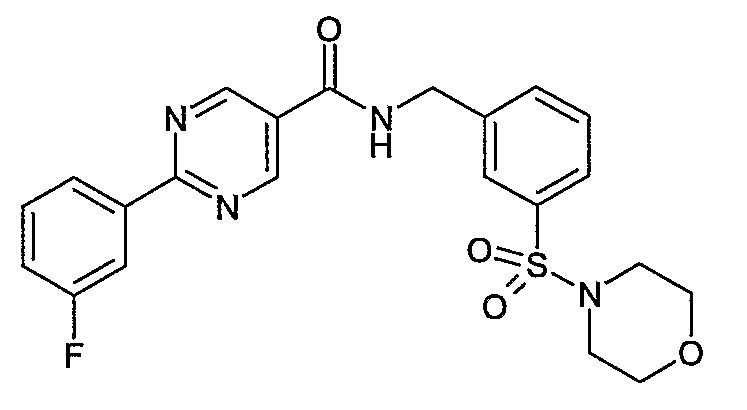
Методами, аналогичными описанным в примере 5, но заменяя анилин на 3-(морфолинсульфонил)бензиламин, получают 3-(морфолин-4-сульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 457 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 2,88-3,10 (м, 4H), 3,65-3,85 (м, 4H), 4,78 (д, 2H), 6,88-7,05 (ушир.с, N-H), 7,18-7,35 (м, H), 7,40-7,60 (м, 2H), 7,60-7,80 (м, 3H), 8,10-8,35 (кв, 4H), 9,21 (с, 2H).
Пример 81
3,4-Диметоксилбензиламид 2-фенилпиримидин-5-карбоновой кислоты
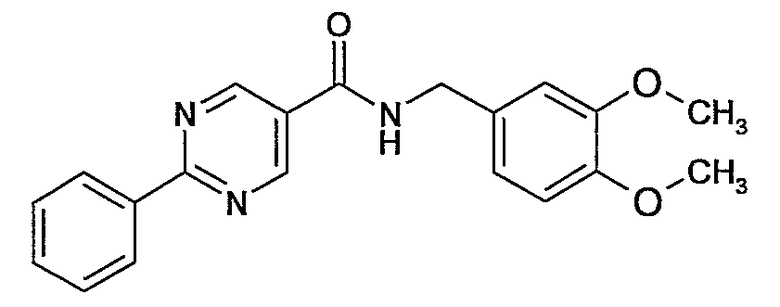
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 3,4-диметоксилбензиламин (0,3 ммоль), получают 3,4-диметоксилбензиламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 350 (M+H).
Пример 82
(2-Бензо[1,3]диоксол-5-илэтил)амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 2-бензо[1,3]диоксол-5-илэтиламин гидрохлорид (0,3 ммоль), получают (2-бензо[1,3]диоксол-5-илэтил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 348 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 2,91 (т, 2H), 3,74 (м, 2H), 5,98 (с, 2H), 6,20 (ушир.с, N-H), 6,65-6,83 (м, 3H), 7,54 (м, 3H), 8,49 (м, 2H), 9,08 (с, 2H); IC50=2 нМ.
Пример 83
(1H-Индазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 1Н-индазол-5-амин (0,3 ммоль), получают (1H-индазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 316 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 6,99 (д, H), 7,06 (кв, H), 7,52-7,63 (м, 4H), 8,10 (с, H), 8,38 (д, H), 8,57 (м, 3H), 9,53 (с, H); IC50=23 нМ.
Пример 84
4-[1,2,3]Тиадиазол-5-ил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты
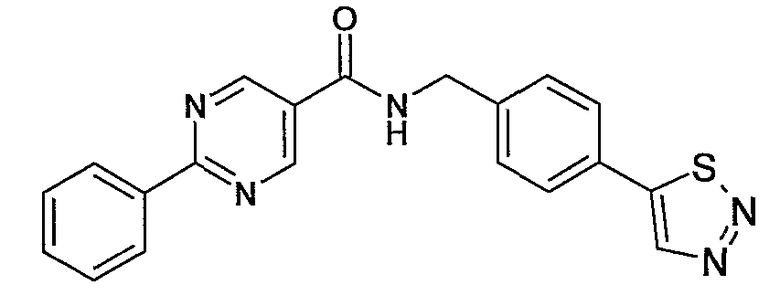
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 4-[1,2,3]тиадиазол-5-илбензиламин (0,3 ммоль), получают 4-[1,2,3]тиадиазол-5-ил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 374 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 4,25 (д, 2H), 7,52-7,60 (м, 5H), 8,12 (д, 2H), 8,45 (м, 2H), 9,31 (с, 2H), 9,46 (ушир.с, N-H), 9,59 (с, H); IC50=6,5 нМ.
Пример 85
3-Метилсульфамоилбензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты
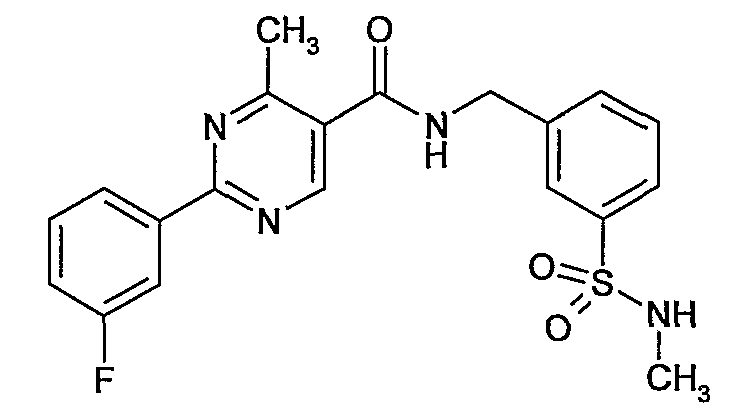
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислотой и заменяя анилин 3-аминометил-N-метилбензолсульфонамидгидрохлоридом, получают 3-метилсульфамоилбензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты в форме твердого вещества. МС: 415 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 2,73 (с, 3H), 4,72 (д, 2H), 6,70 (ушир.с, N-H), 7,15-7,26 (м, H), 7,41-7,65 (м, 3H), 7,77 (д, H), 7,85 (с, N-H), 8,15 (д, H), 8,24 (д, H), 9,76 (с, H). IC50=106 нМ.
Пример 86
3-Метилсульфамоилбензиламид 4-метил-2-пиридин-2-илпиримидин-5-карбоновой кислоты

Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 4-метил-2-пиридин-2-илпиримидин-5-карбоновой кислотой и заменяя анилин на 3-аминометил-N-метилбензолсульфонамид, получают 3-метилсульфамоилбензиламид 4-метил-2-пиридин-2-илпиримидин-5-карбоновой кислоты в форме твердого вещества. МС: 398 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 2,54 (с, 3H), 2,59 (с, 3H), 4,62 (д, 2H), 7,23-7,42 (м, 3H), 7,48-7,60 (м, H), 7,61-7,68 (д, H), 7,78-7,93 (м, 2H), 8,37-8,44 (д, H), 8,51-8,62 (м, H), 8,67 (с, H).
Пример 87
4-Морфолин-4-илбензиламид 2-фенилпиримидин-5-карбоновой кислоты
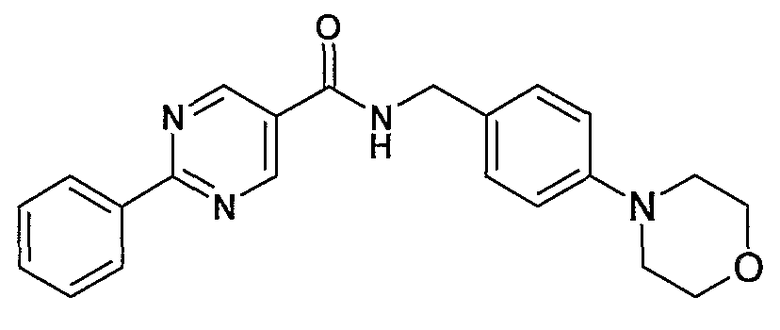
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 4-морфолин-4-илбензиламин, получают 4-морфолин-4-илбензиламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 375 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 3,18 (т, 4H), 3,88 (т, 4H), 4,62 (д, 2H), 6,48 (ушир.с, N-H), 6,92 (м, 2H), 7,29 (м, 2H), 7,47-7,58 (м, 3H), 8,50 (м, 2H), 9,16 (с, 2H); IC50=12 нМ.
Пример 88
Метиловый эфир 6-[(2-фенилпиримидин-5-карбонил)амино]-1H-бензоимидазол-2-карбоновой кислоты
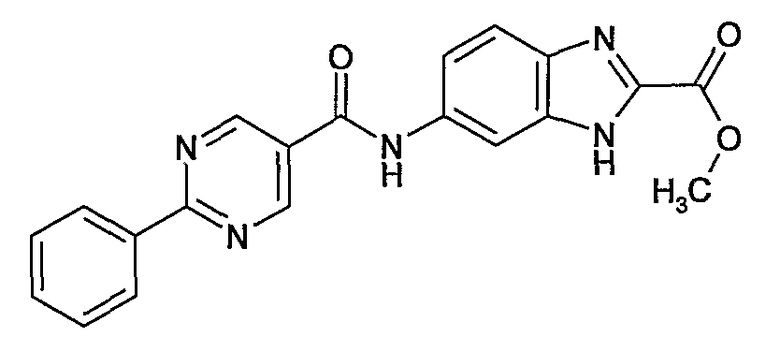
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на метиловый эфир 6-амино-1Н-бензоимидазол-2-карбоновой кислоты, получают метиловый эфир 6-[(2-фенилпиримидин-5-карбонил)амино]-1H-бензоимидазол-2-карбоновой кислоты в виде твердого вещества. МС: 374 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 3,95 (с, 3H), 7,52-7,63 (м, 5H), 7,70-7,82 (м, H), 8,29 (с, H), 9,38 (с, 2H), 10,68 (д, H).
Пример 89
6-[(2-Фенилпиримидин-5-карбонил)амино]-1H-бензоимидазол-2-карбоновая кислота

Раствор метилового эфира 6-[(2-фенилпиримидин-5-карбонил)амино]-1H-бензоимидазол-2-карбоновой кислоты (0,44 ммоль) и LiOH (4,40 ммоль) в MeOH/вода/тетрагидрофуран (1:1:1, 60 мл) перемешивают при комнатной температуре в течение ночи. MeOH и ТГФ упаривают в вакууме и водную смесь подкисляют 5% HCl до pH ~2. Полученный осадок фильтруют, промывают водой (10 мл) и сушат, чтобы получить 6-[(2-фенилпиримидин-5-карбонил)амино]-1H-бензоимидазол-2-карбоновую кислоту в виде твердого вещества (115 мг). МС: 360 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 7,52-7,70 (м, 5H), 8,30 (с, H), 8,48 (м, 3H), 9,28 (с, H), 9,38 (с, 2H), 10,73 (с, N-H).
Пример 90
(Бензофуран-5-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты
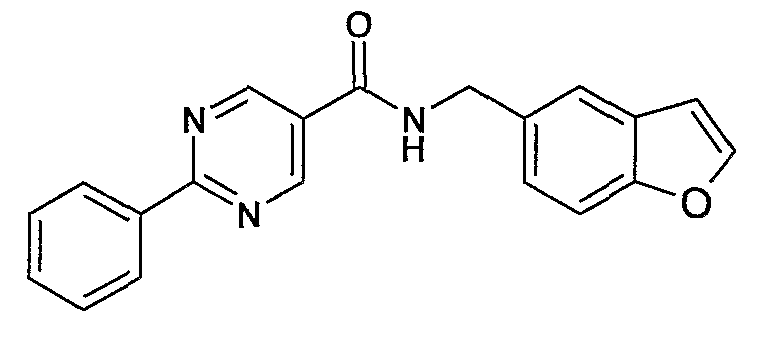
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой и заменяя анилин C-бензофуран-5-илметиламином, получают (бензофуран-5-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты в форме твердого вещества. МС: 330 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 4,79 (д, 2H), 6,58 (ушир.с, N-H), 6,78 (м, H), 7,32 (кв, H), 7,49-7,56 (м, 4H), 7,64 (с, H), 7,66 (д, 2H), 8,48 (м, 2H), 9,18 (с, 2H); IC50=7 нМ.
Пример 91
4-Метансульфониламинобензиламид 2-фенилпиримидин-5-карбоновой кислоты
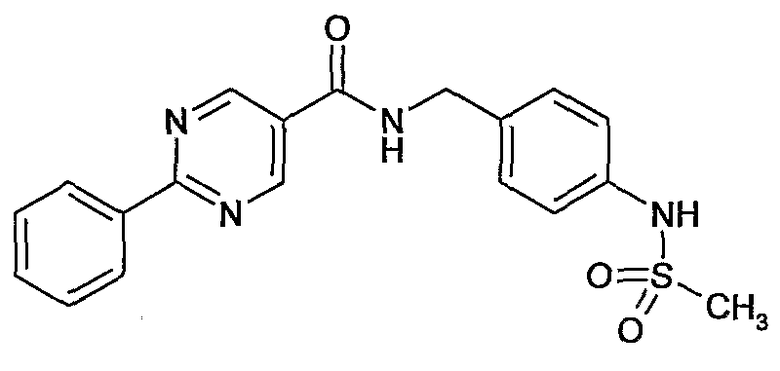
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой и заменяя анилин N-(4-аминометилфенил)метансульфонамидом, получают 4-метансульфониламинобензиламид 2-фенилпиримидин-5-карбоновой кислоты в форме твердого вещества. МС: 383 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,96 (с, 3H), 4,89 (д, 2H), 7,18 (д, 2H), 7,33 (д, 2H), 7,51-7,63 (м, 3H), 78,43 (м, 2H), 8,27 (с, 2H), 9,36 (ушир.с, N-H).
Пример 92
4-Карбамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты
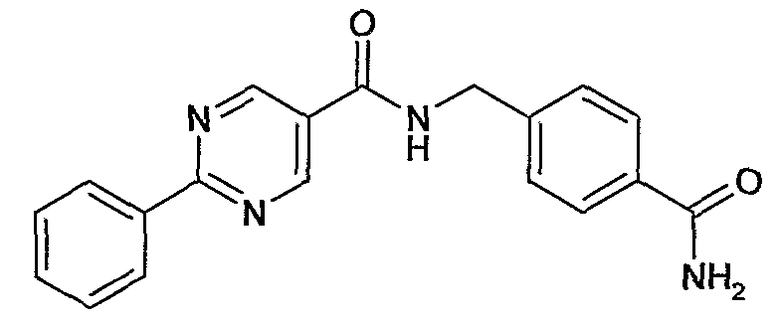
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой и заменяя анилин 4-аминометилбензамидом, получают 4-карбамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты в форме твердого вещества. МС: 333 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 4,59 (д, 2H), 7,32 (с, N-H), 7,43 (д, 2H), 7,50-7,63 (м, 4H), 7,85 (д, 2H), 7,94 (с, H), 8,47 (м, 2H), 9,37 (с, 2H), 9,43 (т, N-H); IC50=16 нМ.
Пример 93
3-(2-Гидроксиэтилсульфамоил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты
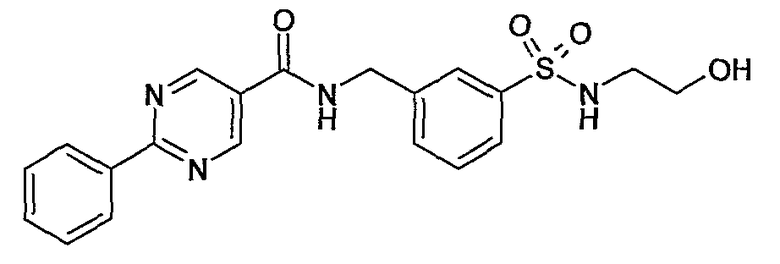
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой и заменяя анилин 3-аминометил-N-(2-гидроксиэтил)бензолсульфонамидгидрохлоридом, получают 3-(2-гидроксиэтилсульфамоил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты в форме твердого вещества. МС: 413 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 2,96 (т, 2H), 3,53 (т, 2H), 4,78 (д, 2H), 7,42-7,91 (м, 9H), 8,46 (м, 2H), 9,22 (с, 2H), 9,40 (ушир.с, N-H).
Пример 94
4-(Морфолин-4-сульфонил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты
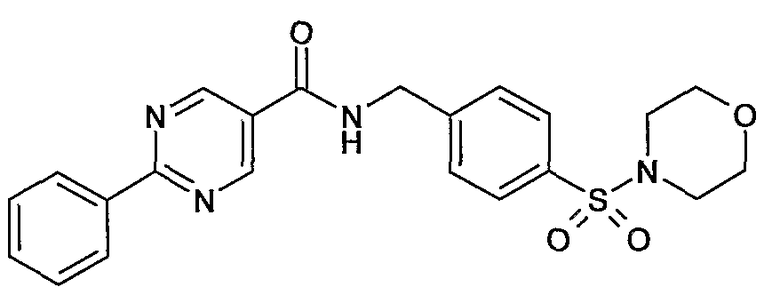
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой (0,35 ммоль) и заменяя анилин 4-(морфолин-4-сульфонил)бензиламингидрохлоридом, получают 4-(морфолин-4-сульфонил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты в форме твердого вещества. МС: 439 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 2,96 (т, 4H), 3,70 (т, 4H), 4,73 (с, 2H), 7,53 (м, 3H), 7,65 (д, 2H), 7,77 (д, 2H), 8,49 (д, 2H), 9,26 (с, 2H).
Пример 95
3-Метилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты
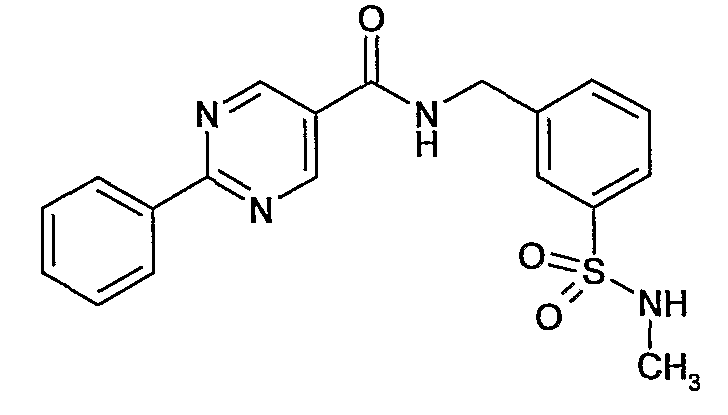
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой и заменяя анилин 3-аминометил-N-метилбензолсульфонамидгидрохлоридом, получают 3-метилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты в форме твердого вещества. МС: 383 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 2,53 (с, 3H), 4,71 (с, 2H), 7,26 (м, H), 7,46-7,80 (м, 7H), 7,87 (с, H), 8,49 (м, 2H), 9,24 (с, 2H).
Пример 96
[2-(2-Амино-4-метилтиазол-5-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты
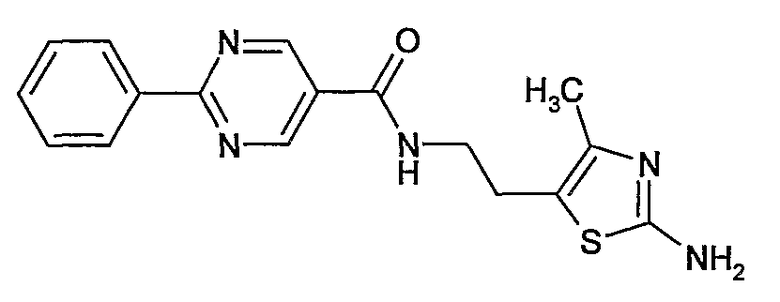
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой (0,12 ммоль) и заменяя анилин дигидробромидом 5-(2-аминоэтилтиазол-2-иламина, получают [2-(2-амино-4-метилтиазол-5-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты в форме твердого вещества. МС: 340 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 2,11 (с, 3H), 2,92 (т, 2H), 3,61 (кв, 2H), 6,70 (ушир.с, N-H), 7,40-7,58 (м, 3H), 8,37-8,54 (м, 2H), 9,12 (с, 2H).
Пример 97
3-Метилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

Стадия 1: Сосуд, содержащий ДХМ (90 мл) и метиламин в воде (40% вес., 7,5 ммоль), охлаждают в водяной бане со льдом при перемешивании на магнитной мешалке. Добавляют 3-цианобензолсульфонилхлорид (5 г, 2,49 ммоль) вместе с ДХМ (10 мл), чтобы смыть остатки со стенок сосуда. Через 30 мин добавляют концентрированную HCl в воде при 0°C, до тех пор пока реакция не будет кислой (pH <4). Добавляют воду (50 мл) и удаляют ДХМ под вакуумом. Остаток фильтруют, чтобы получить 3-циано-N-метилбензолсульфонамид в виде твердого вещества (99%). МС: 195 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 2,76 (д, 3H), 4,48 (ушир.с, N-H), 7,7 (т, 1H), 7,9 (д, 1H), 8,13 (д, 1H), 8,19 (с, 1H).
Стадия 2: К раствору 3-циано-N-метилбензолсульфонамида (4,88 г, 2,49 ммоль) в MeOH (160 мл) добавляют концентрированную HCl в воде (16 мл), а затем палладий-на-угле (10% вес., 50% вес. воды, 1,6 г). В альтернативном варианте при перемешивании магнитной мешалкой реакционную смесь вакуумируют и в течение трех циклов подают 1 атмосферу водорода (из надувного шара). Затем реакционную смесь оставляют под 1 атмосферой водорода при перемешивании в течение 2 дней. Реакционную смесь фильтруют через целит и добавляют свежий палладий-на-угле (10% вес., 50% вес. воды, 1,6 г). Реакционную смесь перемешивают в течение 24 часов под 1 атмосферой водорода. Реакционную смесь фильтруют через целит и фильтрат концентрируют под вакуумом, чтобы получить 3-аминометил-N-метилбензолсульфонамидгидрохлорид в виде твердого вещества (99%). МС: 201 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,41 (д, 3H), 4,12 (д, 2H), 7,23-7,57 (м, 2H), 7,70 (д, 1H), 7,81 (д, 1H), 8,49 (ушир.с, 3H).
Стадия 3: К смеси 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (545 мг, 2,5 ммоль) в ДХМ (35 мл) добавляют оксалилхлорид (635 мг, 5 ммоль), а затем ДМФ (20 мкл). Реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Добавляют безводный толуол (10 мл) и концентрируют реакционную смесь под вакуумом. Остаток растворяют в EtOAc (30 мл). Полученный раствор добавляют к смеси 3-аминометил-N-метилбензолсульфонамидгидрохлорида (590 мг, 2,5 ммоль), карбоната натрия (530 мг, 5 ммоль) и воды (10 мл) при 0°C. Полученную реакционную смесь нагревают до комнатной температуры и перемешивают в течение ночи. Примерно 80% EtOAc удаляют под вакуумом и добавляют гептан, чтобы осадить продукт. Осадок собирают фильтрованием и дважды перекристаллизовывают из EtOAc, чтобы получить 3-метилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (400 мг). Маточные растворы концентрируют и осадок очищают флэш-хроматографией, чтобы получить дополнительное количество 3-метилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (130 мг) в виде порошка. МС: 401 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,41 (д, 3H), 4,64 (д, 2H), 7,42-7,50 (м, 2H), 7,57-7,70 (м, 4H), 7,78 (с, 1H), 8,16 (д, 1H), 8,31 (д, 1H), 9,33 (с, 2H), 9,53 (т, 1H). IC50=9,5 нМ.
Пример 98
Диэтиловый эфир {4-{[(2-фенилпиримидин-5-карбонил)амино]бензил}фосфоновой кислоты

Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой и заменяя анилин диэтиловым эфиром 4-(аминобензил)фосфоновой кислоты, получают диэтиловый эфир {4-{[(2-фенилпиримидин-5-карбонил)амино]бензил}фосфоновой кислоты в форме твердого вещества. МС: 426 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,13 (т, 3H), 1,32 (т, 3H), 3,79 (кв, H), 3,99 (кв, H), 4,20 (м, 2H), 5,91 (кв, 4,62 (д, H), 7,27 (д, 3H), 7,48 (с, 3H), 7,67 (д, 2H), 8,42 (д, 2H), 9,28 (с, H), 9,53 (с, H); IC50=38 нМ.
Пример 99
Диэтиловый эфир {4-[(2-фенилпиримидин-5-карбонил)амино]бутил)фосфоновой кислоты

Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой и заменяя анилин оксалатом диэтилового эфира 4-(аминобутил)фосфоновой кислоты, получают диэтиловый эфир {4-[(2-фенилпиримидин-5-карбонил)амино]бутил)фосфоновой кислоты в форме твердого вещества. МС: 392 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,31 (т, 6H), 1,77 (м, 6H), 3,48 (кв, 2H), 3,97-4,19 (м, 4H), 7,40-7,58 (м, 3H), 7,84 (ушир.с, N-H), 8,40-8,57 (м, 2H), 9,23 (с, 2H); IC50=23,5 нМ.
Пример 100
Диэтиловый эфир {4-[(2-фенилпиримидин-5-карбонил)амино]бутил)фосфоновой кислоты
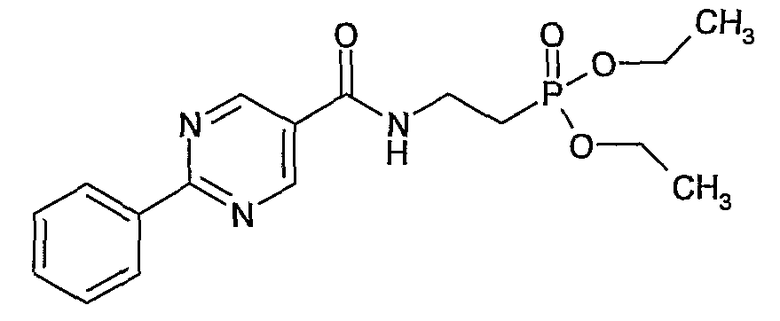
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой и заменяя анилин оксалатом диэтилового эфира 4-(аминоэтил)фосфоновой кислоты, получают диэтиловый эфир {4-[(2-фенилпиримидин-5-карбонил)амино]бутил)фосфоновой кислоты в форме твердого вещества. МС: 364 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,38 (т, 6H), 2,16 (м, 2H), 3,78 (м, 2H), 4,03-4,22 (м, 4H), 7,50 (м, 3H), 8,09 (ушир.с, N-H), 8,48 (м, 2H), 9,24 (с, 2H).
Пример 101
Диэтиловый эфир {фенил-[(2-фенилпиримидин-5-карбонил)амино]метил)фосфоновой кислоты
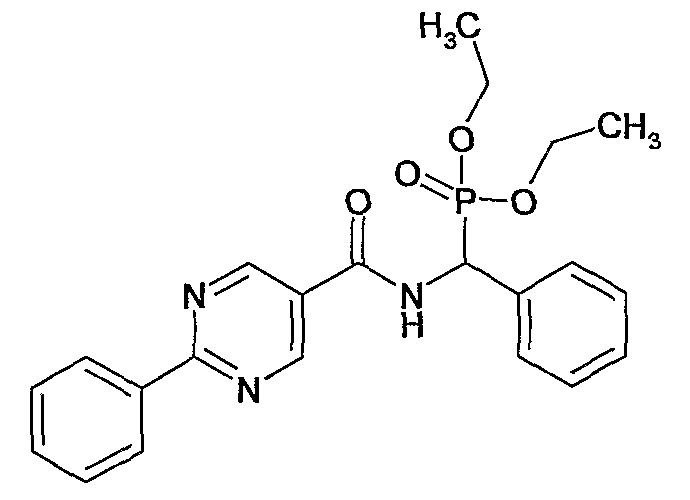
Методами, описанными в примере 5, но заменяя 2-(3-фторфенил)пиримидин-5-карбоновую кислоту 2-фенилпиримидин-5-карбоновой кислотой и заменяя анилин гидрохлоридом диэтилового эфира (аминофенилметил)фосфоновой кислоты, получают диэтиловый эфир {фенил-[(2-фенилпиримидин-5-карбонил)амино]метил)фосфоновой кислоты в форме твердого вещества. МС: 426 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,13 (т, 3H), 1,32 (т, 3H), 3,70-3,90 (м, H), 3,90-4,08 (м, H), 4,09-4,31 (м, 2H), 5,88 (кв, H), 7,27 (м, 3H), 7,47 (м, 3H), 7,65 (д, H), 8,43 (м, 2H), 9,27 (с, 2H), 9,35 (д, N-H); IC50=48 нМ.
Пример 102
3-Метансульфонилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 5, но заменяя анилин на 3-метансульфонилбензиламин, получают 3-метансульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 386 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 3,12 (с, 3H), 4,93 (д, 2H), 7,24-7,37 (м, H), 7,48-7,70 (м, 2H), 7,77 (д, H), 7,88 (д, H), 7,98 (с, H), 8,20 (д, H), 8,34 (д, H), 9,25 (с, 2H).
Пример 103
(1-Метансульфонилпиперидин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
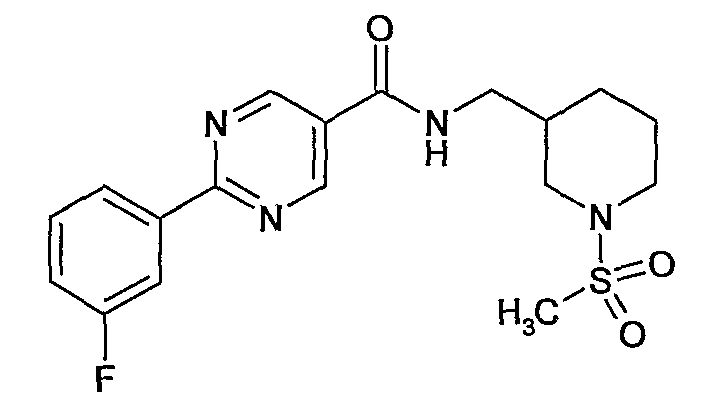
Стадия 1: К раствору карбоната калия (13,94 ммоль) и трет-бутилового эфира 3-аминометилпиперидин-1-карбоновой кислоты (4,65 ммоль) в этилацетате (30 мл) и воде (20 мл) добавляют раствор хлорида 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (4,65 ммоль) в этилацетате (20 мл). Полученную смесь перемешивают в течение ночи при комнатной температуре. Реакционную смесь экстрагируют этилацетатом, промывают водой, сушат (Na2SO4) и концентрируют под вакуумом, чтобы получить трет-бутиловый эфир 3-({[2-(3-фторфенил)пиримидин-5-карбонил]амино}метил)пиперидин-1-карбоновой кислоты в форме твердого вещества. MC 415 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,47 (с, 9H), 1,55-2,22 (м, 5H), 2,90-4,90 (м, 6H), 7,15-7,25 (м, H), 7,41-7,53 (м, H), 7,56 (ушир.с, NH), 8,18 (д, H), 8,29 (д, H), 9,21 (с, 2H).
Стадия 2: Газообразный хлористый водород барботируют в раствор трет-бутилового эфира 3-({[2-(3-фторфенил)пиримидин-5-карбонил]амино}метил)пиперидин-1-карбоновой кислоты (3,76 м) в ДХМ (20 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Смесь концентрируют под вакуумом, чтобы получить гидрохлорид (пиперидин-3-илметил)амида 2-(3-фторфенил)пиримидин-5-карбоновой кислоты в виде твердого вещества. MC 415 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 1,22-1,50 (м, 2H), 1,68-1,90 (м, H), 1,90-2,06 (ушир.с, 2H), 2,06-2,17 (ушир.с, 6H), 2,73-3,04 (м, 2H), 3,24-3,50 (м, H), 7,24-7,35 (м, H), 7,48-7,60 (м, H), 8,19 (д, H), 8,34 (д, H), 9,23 (с, 2H).
Стадия 3: Метансульфонилхлорид (0,523 ммоль) добавляют к перемешиваемому раствору гидрохлорида (пиперидин-3-илметил)амида 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (0,523 ммоль) и триэтиламина (2,62 ммоль) в ДХМ (20 мл) при 0°C. Смесь перемешивают при 0°C в течение часа, а затем при комнатной температуре в течение ночи. Реакционную смесь промывают водой (20 мл). Органический слой отделяют, сушат (MgSO4), фильтруют и концентрируют под вакуумом. Остаток очищают колоночной хроматографией на силикагеле, элюируя EtOAc, чтобы получить (1-метансульфонилпиперидин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 393 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 1,43-1,95 (м, 4H), 2,10-2,23 шир.с, H), 3,04-3,50 (м, 5H), 3,60-3,78 (м, H), 6,71-6,90 (ушир.с, N-H), 7,18-7,23 (м, H), 7,42-7,57 (м, H), 8,18-8,37 (кв, 2H), 9,20 (с, 2H).
Пример 104
(1-Диметансульфамоилпиперидин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты
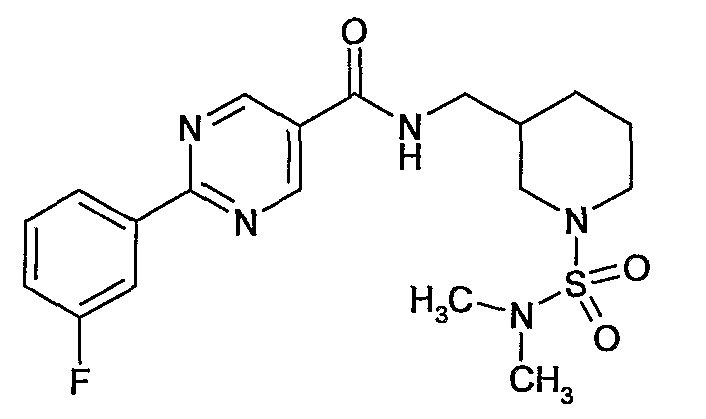
Диметансульфонилхлорид (0,632 ммоль) добавляют к перемешиваемому раствору (пиперидин-3-илметил)амид тригидрохлорида 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (0,632 ммоль) и триэтиламина (3,16 ммоль) в ДХМ (20 мл) при 0°C. Смесь перемешивают при 0°C в течение часа, а затем при комнатной температуре в течение ночи. Реакционную смесь разбавляют ДХМ (10 мл) и промывают водой (30 мл). Органический слой отделяют, сушат (Na2SO4), фильтруют и концентрируют под вакуумом. Остаток растирают с EtOAc, чтобы получить (1-диметансульфамоилпиперидин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (245 мг) в виде твердого вещества. МС: 422 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 1,37-1,69 (м, 2H), 1,74-1,92 (м, 2H), 2,03-2,17 (ушир.с, H), 2,81 (с, 6H), 3,09-3,20 (м, H), 3,21-3,50 (м, 4H), 3,60-3,75 (м, H), 6,83-6,98 (ушир.с, N-H), 7,16-7,28 (м, H), 7,42-7,55 (м, H), 8,16-8,33 (кв, 2H), 9,20 (с, 2H).
Пример 105
3-Метансульфониламинобензиламид 2-(фенил)пиримидин-5-карбоновой кислоты
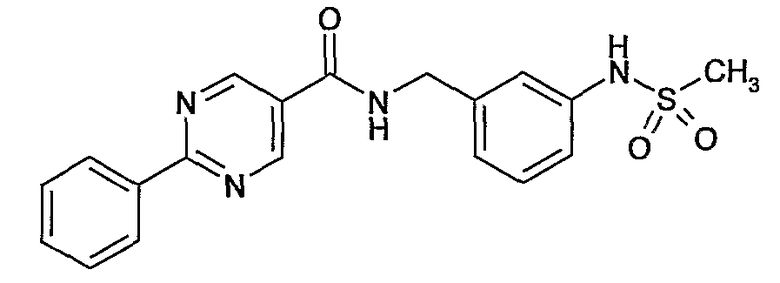
Метансульфонилхлорид (0,553 ммоль) добавляют к перемешиваемому раствору 3-аминобензиламида 2-фенилпиримидин-5-карбоновой кислоты (пример 115, 0,526 ммоль) и триэтиламина (1,05 ммоль) в ДХМ (20 мл) при 0°C. Смесь перемешивают при комнатной температуре в течение часа. Реакционную смесь гасят 5% HCl и экстрагируют ДХМ (20 мл). Органическую фазу отделяют, промывают водой (20 мл) и солевым раствором (20 мл), сушат (Na2SO4), фильтруют и концентрируют под вакуумом. Остаток очищают колоночной хроматографией на силикагеле, элюируя 0-5% МеОН в ДХМ, чтобы получить 3-метансульфониламинобензиламид 2-(фенил)пиримидин-5-карбоновой кислоты (200 мг) в виде твердого вещества. МС: 383 (M+H); 1H ЯМР (300 МГц, CDCl3): δ 3,41 (с, 3H), 4,76-4,72 (м, 2H), 7,00 (ушир.с, N-H), 7,05-7,23 (м, 2H), 7,27-7,60 (м, 5H), 8,40-8,53 (м, 2H), 9,16 (с, 2H).
Пример 106
3-Ацетилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

К раствору карбоната калия (1,22 ммоль) и N-ацетил-3-аминометилбензолсульфонамида (1,22 ммоль) в EtOAc (10 мл) и воде (10 мл) добавляют раствор хлорида 2-(3-фторфенил)пиримидин-5-карбоновой кислоты (1,22 ммоль) в ацетате (10 мл) при 0°C и смесь перемешивают при комнатной температуре в течение ночи. Смесь подкисляют 5% HCl до pH 2-3 и экстрагируют EtOAc. Органический слой отделяют, промывают водой и солевым раствором, сушат (MgSO4), фильтруют и концентрируют под вакуумом. Остаток очищают колоночной хроматографией на силикагеле, элюируя EtOAc, чтобы получить 3-ацетилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 429 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 3,95-4,00 (д, 3H), 4,85 (с, 3H), 7,22-7,34 (м, H), 7,41-7,62 (м, H), 7,66-7,83 (д, 2H), 7,88-7,95 (д, H), 8,04 (с, H), 8,12-8,23 (м, H), 8,26-8,37 (д, H), 9,26-9,34 (м, 2H).
Пример 107
3-(3-Оксопипериазин-1-сульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 106, но заменяя N-ацетил-3-аминометилбензолсульфонамид на 4-(3-аминометилбензолсульфонил)пиперазин-2-он, получают 3-(3-оксопипериазин-1-сульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 470 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 3,16 (с, 4H), 3,57 (с, 2H), 4,63 (д, 2H), 7,34-7,47 (м, H), 7,56-7,77 (м, 4H), 7,80 (с, N-H), 8,01-8,18 (м, 2H), 8,28 (д, H), 9,29 (с, 2H), 9,45 (т, N-H).
Пример 108
(2-Сульфамоилэтил)амид 2-фенилпиримидин-5-карбоновой кислоты
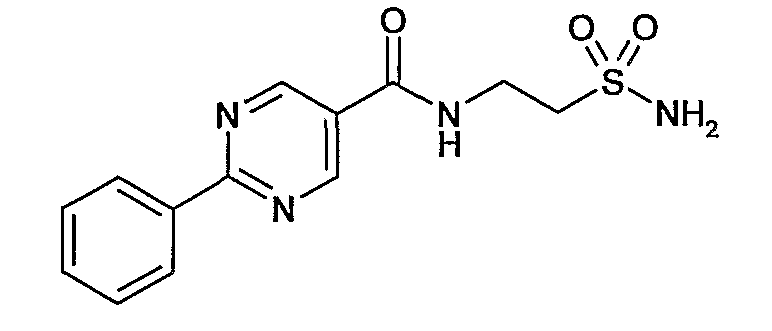
К раствору хлорида 2-фенилпиримидин-5-карбоновой кислоты (1,51 ммоль) и амида 2-аминоэтансульфоновой кислоты (1,51 ммоль) в ДХМ (15 мл) добавляют диизопропилэтиламин (4,53 ммоль). Полученную смесь перемешивают в течение ночи при комнатной температуре. Смесь концентрируют под вакуумом. Остаток промывают водой и ДХМ, чтобы получить (2-сульфамоилэтил)амида 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 307 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 3,25 (кв, 2H), 3,67 (м, 2H), 6,93 (с, N-H), 7,47-7,60 (м, 3H), 8,36-8,48 (м, 2H), 8,92-9,15 (м, N-H), 9,16-9,36 (м, 2H); IC50=55 нМ.
Пример 109
(2-Диметилсульфамоилэтил)амид 2-фенилпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 108, но заменяя амид 2-аминоэтансульфоновой кислоты амидом 2-диметиламиноэтансульфоновой кислоты, получают (2-диметилсульфамоилэтил)амид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 334 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,76 (с, 6H), 3,29 (т, 2H), 3,62-3,73 (м, 2H), 7,45-7,60 (м, 3H), 8,42 (м, 2H), 9,06 (ушир.с, N-H), 9,20 (с, 2H); IC50=82 нМ.
Пример 110
(3-Фенил-[1,2,4]тиадиазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты
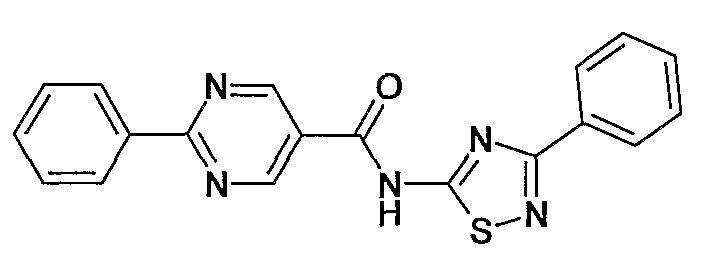
К суспензии 2-фенилпиримидин-5-карбоновой кислоты (400 мг, 2 ммоль) в ДХМ (10 мл) добавляют оксалилхлорид (0,2 мл, 2,3 ммоль) при 0oC, а затем ДМФ (0,23 мл, 3 ммоль). Смесь перемешивают при 0°C в течение 20 минут, нагревают до комнатной температуры и перемешивают еще 20 мин. Смесь концентрируют в вакууме. Остаток растворяют в ДХМ и добавляют 3-фенил-[1,2,4]тиадиазол-5-иламин (248 мг, 1,4 ммоль), а затем NMP (0,5 мл). Смесь перемешивают при комнатной температуре в течение двух часов и концентрируют в вакууме. Остаток растирают с ДХМ, чтобы получить (2-диметилсульфамоилэтил)амид 2-фенилпиримидин-5-карбоновой кислоты (300 мг) в виде твердого вещества. МС: 360 (M+H); IC50=30 нМ.
Пример 111
(3-Фенил-[1,2,4]тиадиазол-5-ил)амид 4-метил-2-фенилпиримидин-5-карбоновой кислоты
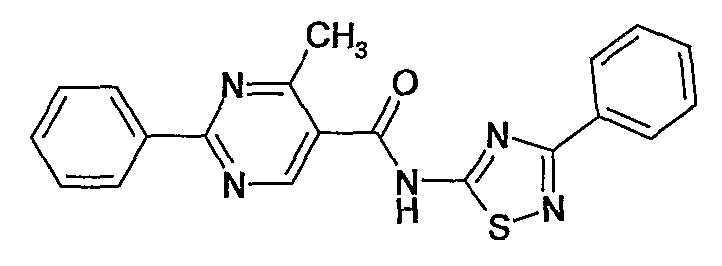
Методами, аналогичными описанным в примере 110, но заменяя 2-фенилпиримидин-5-карбоновую кислоту на 4-метил-2-фенилпиримидин-5-карбоновую кислоту, получают (3-фенил-[1,2,4]тиадиазол-5-ил)амид 4-метил-2-фенилпиримидин-5-карбоновой кислоты
МС: 374 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,77 (с, 3H), 7,54-7,60 (м, 6H), 8,23 (д, 2H), 8,48 (д, 2H), 9,22 (с, 1H), 13,88 (с, 1H).
Пример 112
(3-Фенил-[1,2,4]тиадиазол-5-ил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 110, но заменяя 2-фенилпиримидин-5-карбоновую кислоту на 2-(3-фторфенил)пиримидин-5-карбоновую кислоту, получают (3-фенил-[1,2,4]тиадиазол-5-ил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты. МС: 378 (M+H).
Пример 113
(Тетрагидропиран-4-ил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 110, но заменяя 2-фенилпиримидин-5-карбоновую кислоту на 2-(3-фторфенил)пиримидин-5-карбоновую кислоту и заменяя 3-фенил-[1,2,4]тиадиазол-5-иламин на тетрагидропиран-4-иламин, получают (тетрагидропиран-4-ил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты. МС: 302 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 1,60-1,64 (м, 2H), 1,81-1,84 (д, 2H), 3,33 (с, 2H), 3,38-3,45 (т, 2H), 3,88-3,92 (д, 2H), 4,02-4,06 (м, 1H), 7,46 (т, 1H), 7,62 (кв, 1H), 8,14 (д, 1H), 8,29 (д, 1H), 8,70 (д, 1H), 9,27 (с, 2H).
Пример 114
Фениламид 2-циклогексилпиримидин-5-карбоновой кислоты
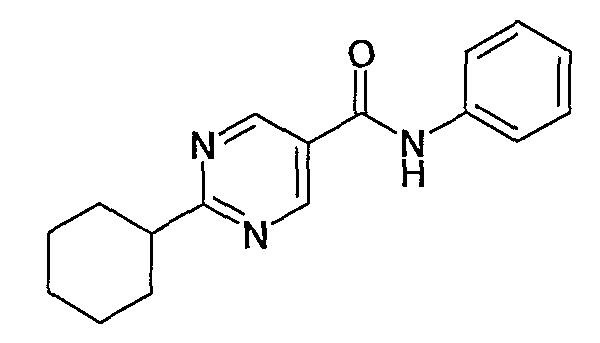
Стадия 1. К раствору циклогексанкарбоксиамидин гидрохлорида (1 г, 7,9 ммоль) в безводном ДМФ (15 мл) добавляют натриевую соль 3,3-диметокси-2-карбометоксипроп-1-ен-1-оксида (1,82 г, 9,2 ммоль) и реакционную смесь нагревают при 100°C под N2 в течение 3 часов. Реакционную смесь охлаждают до комнатной температуры и добавляют воду (59 мл). Смесь экстрагируют EtOAc. Органический слой промывают насыщенным водным солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме, чтобы получить метиловый эфир 2-циклогексилпиримидин-5-карбоновой кислоты (0,5 г, 29%) в виде твердого вещества. МС: 221 (M+H).
Стадия 2. Раствор метилового эфира 2-циклогексилпиримидин-5-карбоновой кислоты (0,97 г, 4,39 ммоль) и водного LiOH (1M, 4,39 мл) в MeOH (6 мл) перемешивают при комнатной температуре в течение ночи. МеОН удаляют под вакуумом и водный раствор обрабатывают 3н HCl, чтобы скорректировать рН в пределах между 2 и 3. Полученный осадок фильтруют, промывают водой и сушат под вакуумом, чтобы получить 2-циклогексилпиримидин-5-карбоновую кислоту (0,2 г, 22%) в виде порошка. МС: 207 (M+H).
Стадия 3. Смесь 2-циклогексилпиримидин-5-карбоновой кислоты (100 мг, 0,48 ммоль), 1-гидроксибензотриазола (74,2 мг, 0,55 ммоль) и PS-DCC (505 мг, 1,28 ммоль/г, 0,65 ммоль) в ДМФ (8 мл) встряхивают при комнатной температуре в течение 15 минут и добавляют анилин (30 мг, 0,32 ммоль). Смесь встряхивают при комнатной температуре в течение 18 часов, добавляют PS-трисамин (388 мг, 3,75 ммоль/г, 1,45 ммоль) и смесь постоянно встряхивают при комнатной температуре в течение 18 часов. Осадок фильтруют и промывают ДХМ. Фильтрат концентрируют под вакуумом, чтобы получить фениламид 2-циклогексилпиримидин-5-карбоновой кислоты (45,6 мг, 51%) в виде твердого вещества. МС: 282 (M+H); IC50=4960 нМ.
Пример 115
3-Аминобензиламид 2-фенилпиримидин-5-карбоновой кислоты
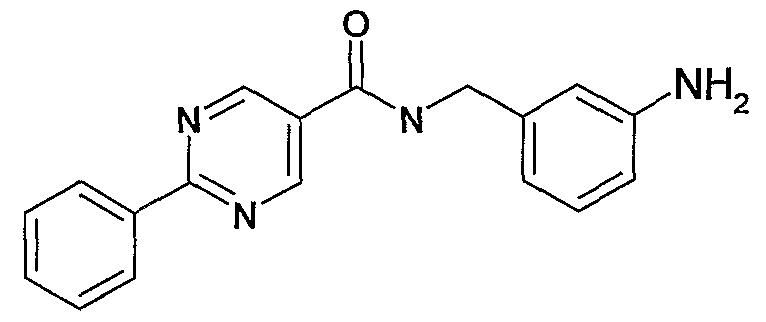
Методами, аналогичными описанным в примере 8, но заменяя 2,2-диоксо-2,3-дигидро-1Н-2-лямбда*6*-бензо[с]изотиазол-5-иламин на 3-аминобензиламин, получают 3-аминобензиламид 2-фенилпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 305 (M+H); 1H ЯМР (300 МГц, CD3OD): δ 4,52 (с, 2H), 6,60-6,75 (м, 2H), 6,77 (ушир.с, N-H), 7,07 (т, H), 7,47-7,59 (м, 3H), 8,44-8,53 (м, 2H), 9,23 (с, 2H).
Пример 116
3-Метилсульфамоилбензиламид 2-(3-пиридил)пиримидин-5-карбоновой кислоты
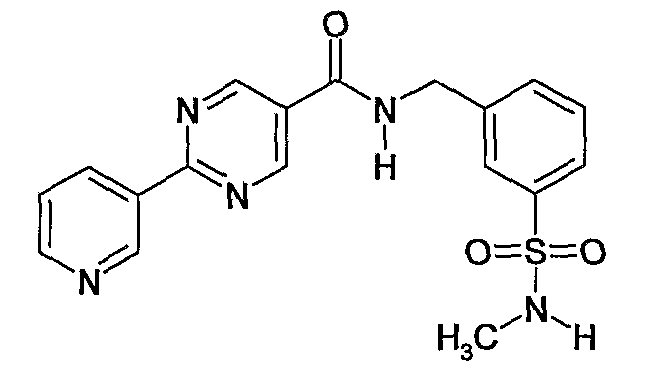
Смесь гидрохлорида 2-(3-пиридил)пиримидин-5-карбоновой кислоты (237 мг, 1 ммоль) и O-(7-азабензотриазол-1-ил)-N,N,N,N-тетраметилуроний гексафторфосфата (380 мг, 1 ммоль) в сухом ДМФ (15 мл) обрабатывают диизопропилэтиламином (0,36 мл) и перемешивают при комнатной температуре в течение 30 мин. Добавляют раствор гидрохлорида 3-метилсульфамоилбензиламина (355 мг, 1,5 ммоль) и смесь перемешивают при комнатной температуре в течение 24 часов. Растворитель удаляют и остаток распределяют между EtOAc и насыщенным водным NaHCO3. Органическую фазу отделяют, промывают водой и солевым раствором, сушат (MgSO4), фильтруют и концентрируют под вакуумом. Смесь растирают с EtOAc. Полученное твердое вещество фильтруют, промывают эфиром, чтобы получить 3-метилсульфамоилбензиламид 2-(3-пиридил)пиримидин-5-карбоновой кислоты (185 мг, 48%). МС: 384 (M+H); 1H ЯМР (300 МГц, ДМСО-d6): δ 2,43 (д, 3H), 4,65 (д, 2H), 7,45-7,55 (кв, 1H), 7,60-7,75 (м, 3H), 7,80 (с, 1H), 8,72-8,80 (м, 2H), 9,35 (с, 2H), 9,55 (м, 2H).
Пример 117
4-Сульфамоилбензиламид 2-пиразол-1-илпиримидин-5-карбоновой кислоты

Методами, аналогичными описанным в примере 116, но заменяя гидрохлорид 2-(3-пиридил)пиримидин-5-карбоновой кислоты на 2-пиразол-1-илпиримидин-5-карбоновую кислоту и заменяя 3-метилсульфамоилбензиламингидрохлорид на 4-аминометилбензолсульфонамидгидрохлорид, получают 4-сульфамоилбензиламид 2-пиразол-1-илпиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 359 (M+H); IC50=266 нМ.
Пример 118
(Тетрагидропиран-4-ил)амид 2-(2-метилтиазол-4-ил)пиримидин-5-карбоновой кислоты
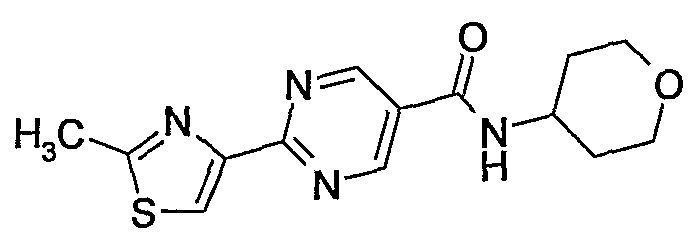
Методами, аналогичными описанным в примере 116, но заменяя гидрохлорид 2-(3-пиридил)пиримидин-5-карбоновой кислоты на 2-(2-метилтиазол-4-ил)пиримидин-5-карбоновую кислоту и заменяя 3-метилсульфамоилбензиламингидрохлорид на тетрагидропиран-4-иламин, получают (тетрагидропиран-4-ил)амид 2-(2-метилтиазол-4-ил)пиримидин-5-карбоновой кислоты в виде твердого вещества. МС: 305 (M+H); IC50=82 нМ.
Следуя общим методам, описанным в приведенных выше примерах, можно приготовить следующие соединения:
(тиофен-2-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(4-метилоксазол-2-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
этиловый эфир метоксиимино-{2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусной кислоты,
(5-метилсульфанил-[1,3,4]тиадиазол-2-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
этиловый эфир 2-[(2-фенилпиримидин-5-карбонил)амино]бензотиазол-5-карбоновой кислоты,
(1-фенилэтил)амид (R)-2-фенилпиримидин-5-карбоновой кислоты,
[3-(1H-тетразол-5-ил)фенил]амид 2-фенилпиримидин-5-карбоновой кислоты,
(1-карбамимидоилпиперидин-4-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
амид 5-[(2-фенилпиримидин-5-карбонил)амино]-1H-индол-3-карбоновой кислоты,
[3-(2-аминотиазол-4-ил)фенил]амид 2-фенилпиримидин-5-карбоновой кислоты,
{4-[2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)этил]тиазол-2-ил}амид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(пирролидин-1-сульфонил)этил]амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
трет-бутиловый эфир [3-({[2-(3-фторфенил)-4-метилпиримидин-5-карбонил]амино}метил)бензил]карбаминовой кислоты,
3-[(пиридин-2-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-гидрокси-2,2-диметилпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-гидрокси-2-метилпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[(тетрагидропиран-4-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(4-гидроксибутилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[2-(2-гидроксиэтокси)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[(тетрагидрофуран-2-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-изобутилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(5-изопропилсульфамоилпиридин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(5-метилсульфамоилпиридин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(2-метилсульфамоилпиридин-4-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(2-метилсульфамоилпиридин-4-илметил)амид 2-(3-фторфенил)-4-метил-пиримидин-5-карбоновой кислоты и
(5-изопропилсульфамоилпиридин-3-илметил)амид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты.
ПРОТОКОЛЫ АНАЛИЗА «IN VITRO» ДЛЯ ИДЕНТИФИКАЦИИ ИНГИБИТОРОВ ГЕМОПОЭТИЧЕСКОЙ PGD2 СИНТАЗЫ
Соединения настоящего изобретения могут быть протестированы на активность ферментативного ингибирования PGD2 синтазы в соответствии с одним из приведенных ниже методов анализа.
Метод анализа 1: Анализ поляризации флуоресценции
Как описано в публикации PCT WO 2004/016223, пример II.
Метод анализа 2: Метод иммуноферментного анализа (ИФА)
I. Аналитические растворы
a. Приготовление буфера 0,1M K2HPO4/KH2PO4 (pH 7,4)
Приготовить 0,1M KH2PO4 из 1M KH2PO4 (Sigma, № кат. P-8709)
Приготовить 0,1M K2HPO4 из порошка K2HPO4 (Fisher, BP363-500)
Смешать 0,1M K2HPO4 с 0,1M KH2PO4, чтобы скорректировать pH до 7,4.
b. Приготовление 0,5% γ-глобулина
Добавить 0,1 г γ-глобулин (Sigma, № кат. G-5009) к 20 мл буфера 0,1M K2HPO4/KH2PO4 (pH 7,4) и приготовить аликвоты в 1-мл/пробирках и хранить их при -80°C.
c. Приготовление 100 мМ GSH
Добавить 307 мг GSH (Sigma, № кат. G-6529) к 10 мл буфера 0,1M K2HPO4/ KH2PO4 (pH 7,4) и хранить при -80°C.
d. Приготовление реакционного буфера:
198 мл буфера 0,1M K2HPO4/KH2PO4 (pH 7,4)
2 мМ GSH - Готовят из 100 мМ GSH
0,4 г глицерина
2 мл 0,5% γ-глобулина
Добавить 0,4 г глицерина и 2 мл 0,5% γ-глобулина к 198 мл буфера 0,1M K2HPO4/KH2PO4 (pH 7,4).
Добавить 0,4 мл 100 мМ GSH к 19,6 мл реакционного буфера перед анализом (достаточно для двух 96-луночных планшет).
e. Приготовление стоп-раствора FeCl2/лимонная кислота: (8 мг/мл FeCl2, 0,1M лимонной кислоты)
Добавить 40 мг свежеприготовленного FeCl2 (IGN, № кат. 158046) к 5 мл 0,1M лимонной кислоты (Sigma, № кат. C0759).
f. Приготовление реагента MOX:
10% EtOH - Добавить 1 мл EtOH к 9 мл сверхчистой H2O
Растворить 0,1 г метоксиламина (Cayman, № кат. 400036/) в 10% EtOH (10 мл).
Добавить 0,82 г ацетата натрия (Cayman, № кат. 400037) к раствору MOX и растворить.
II. Материалы и методы
Диметилсульфоксид (ДМСО; Sigma; № кат. D2650)
Набор для экспресс-ИФА простагландин D2-MOX (Caymen Chemical, № кат. 500151)
Перед анализом охладить на льду 10 мл ацетона в полипропиленовых пробирках и чистые 96-луночные планшеты. Все процедуры, кроме растворения соединений, выполняются на льду.
III. Разведение соединения
1. Разведение соединения в ДМСО
2. Добавляют 2 мкл каждой из указанных выше концентраций соединения к 38 мкл реакционного буфера в 96-луночных планшетах и перемешивают.
IV. Приготовление растворов фермента и субстрата
1. Приготовление 0,39 нг/мкл раствора фермента (0,35 нг/мкл на конечном этапе после добавления соединения).
Смешать 4 мкл 4 мг/мл человеческой h-PGDS с 396 мкл реакционного буфера (чтобы получить концентрацию фермента 40 мкг/мл). Добавить 46,8 мкл 40 мкг/мл h-PGDS к 4,753 мл реакционного буфера, чтобы получить суммарный объем 4,8 мл.
2. Приготовление раствора субстрата (PGH2): Добавить 0,375 мл 0,1 мг/мл PGH2 к 1,625 мл ацетона.
V. Ферментативная реакция:
1. Добавить 60 мкл раствора фермента к лунке соединения и положительного контроля (без соединения) в полипропиленовую планшету с U-образным дном на льду.
2. Добавить 60 мкл реакционного буфера и 6,6 мкл 5% ДМСО в реакционном буфере в лунки с отрицательным контролем в планшете.
3. Добавить 6,6 мкл разбавленного соединения в реакционном буфере к лункам соединения и перемешать.
4. Добавить 6,6 мкл 5% ДМСО в реакционном буфере к лунке положительного контроля.
5. Инкубировать планшету на льду по меньшей мере 30 мин.
6. Добавить 20 мкл раствора субстрата (PGH2) к лункам соединения, положительного и отрицательного контроля в 96-луночном планшете с U-образным дном на льду.
7. Высушить планшету в холодной комнате примерно 25-28 мин.
8. Добавить пипеткой 45 мкл раствора фермента (выше) в 96-луночные планшеты с высушенной PGH2 и перемешать 3 раза. Инкубировать на льду 1 мин.
9. Добавить 45 мкл раствора FeCl2 в каждую лунку и перемешать.
10. Добавить 90 мкл раствора MOX и перемешать.
11. Инкубировать 30 мин при 60°C.
12. Разбавить образцы 2500X буфером ИФА.
VI. Анализ ИФА
Провести анализ в соответствии с методом для набора ИФА, предоставленного Cayman. Общий уровень PGD2 (пкг/мл) определяли в образцах с помощью набора ИФА (Caymen Chemical, № кат. 500151)
Рассчитать количество PGD2, как показано ниже.
Расчетный % положительного контроля в соответствии с приведенным ниже уравнением;
%Положительного контроля= (значение соединения - отрицательный контроль)/(положительное значение-значение отрицательного контроля)×100.
%Положительного контроля = (значение соединения - отрицательный контроль)×100
(положительное значение-значение отрицательного контроля)
Значение соединения = уровням PGD2 (пкг/мл), полученныем из стандартной кривой в анализе ИФА для образцов с соединением
Значение отрицательного контроля = уровням PGD2 (пкг/мл), полученным из стандартной кривой в анализе ИФА для образцов без фермента
Значение положительного контроля = уровням PGD2 (пкг/мл), полученным из стандартной кривой в анализе ИФА для образцов с ферментом, но без соединения
IC50 определяются подгонкой в программе Excel, чтобы получить значение x при y=1/2Ymax с использованием логистической 4-параметрической модели для кривых IC50.
Результаты
Соединения, составляющие предмет настоящего изобретения, обеспечивают 50% ингибирование при анализе поляризации флуоресценции или анализе ИФА при концентрациях в диапазоне от примерно 1 нмоль/л до примерно 30 мкмоль/л. IC50 для примеров 8, 9, 33, 34, 82, 83, 84 и 114, полученные при анализе поляризации флуоресценции, и IC50 для примеров 1, 30, 38, 40, 45, 48, 49, 51, 54, 55, 56, 63, 65, 68, 71, 85, 93, 97, 108, 109, 110, 117 и 118, полученные при анализе ИФА, приводятся в разделе «ПРИМЕРЫ» настоящего документа.
Настоящее изобретение может быть реализовано в других конкретных формах, не искажая сущности изобретения или его основных характеристик.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРИМИДИНГИДРАЗИДНЫЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ PGDS | 2008 |
|
RU2464262C2 |
| 2,6-ЗАМЕЩЕННЫЕ-4-МОНОЗАМЕЩЕННЫЙ АМИНО-ПИРИМИДИНЫ КАК АНТАГОНИСТЫ РЕЦЕПТОРА ПРОСТАГЛАНДИНА D2 | 2005 |
|
RU2417990C2 |
| СОЕДИНЕНИЯ ГЕТЕРОАРИЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ТКБ И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2742122C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ СОСТОЯНИЙ, ОПОСРЕДОВАННЫХ СХСR4 И CCR5 | 2001 |
|
RU2277092C2 |
| ИНГИБИТОРЫ РЕПЛИКАЦИИ ВИРУСА ГРИППА, СПОСОБЫ ИХ ПРИМЕНЕНИЯ И ИСПОЛЬЗОВАНИЕ | 2016 |
|
RU2737190C2 |
| АРИЛКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2003 |
|
RU2340605C2 |
| КОМПОЗИЦИИ, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С KIT | 2014 |
|
RU2706235C2 |
| НОВЫЕ ПИРИДИНОВОЕ ПРОИЗВОДНОЕ И ПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ (1) | 2005 |
|
RU2330021C2 |
| ПИРИДИЛДИМЕТИЛСУЛЬФОНОВОЕ ПРОИЗВОДНОЕ | 2006 |
|
RU2404968C2 |
| СОЕДИНЕНИЯ ГЕТЕРОАРИЛА В КАЧЕСТВЕ ИНГИБИТОРОВ BTK И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2703301C2 |
Данное изобретение относится к соединению формулы (I):
 где R1 представляет собой арил, гетероарил или (C5-С6)-циклоалкил, каждый из которых необязательно имеет в качестве заместителя галоген или (С1-С6)-алкил; R2 представляет собой водород или (C1-C4)-алкил; R3 представляет собой -Р(=O)-(алкокси)2 или Y1Y2N-SO2-, циклоалкил, арил, гетероарил, гетероциклил, циклоалкенил, каждый из которых необязательно имеет в качестве заместителя: галоген, гидрокси, карбокси, Y1Y2N-, Y1Y2NC(=O)-, Y1Y2N-SO2-, R7-SO2-NR6-, R7-C(=O)-NR6-, или алкил, алкокси, алкоксикарбонил, каждый из которых необязательно имеет в качестве заместителя галоген, -Р(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-, арил или гетероарил, и когда R3 является циклоалкилом, циклоалкенилом, гетероциклилом, он также необязательно замещен оксо; L1 представляет собой связь или (С1-С6)-алкилен, который необязательно замещен -Р(=O)-(алкокси)2; R4, R5 и R6 являются водородом, R7 представляет собой алкил; и Y1 и Y2, каждый независимо, является водородом, алкилом, который необязательно имеет в качестве заместителя: гидрокси, амино, алкиламино, диалкиламино, алкокси, циклоалкил, или Y1 и Y2 вместе с атомом азота, с которым они связаны, образуют гетероциклил, который необязательно содержит еще один гетероатом, выбираемый из кислорода, азота или серы, где гетероциклил необязательно имеет в качестве заместителя алкил или оксо; при условии, что, когда L1 представляет собой связь, R3 не является необязательно замещенным фенилом, необязательно замещенным нафтилом, необязательно замещенным бензоимидазолилом, необязательно замещенным бензотиазолилом или необязательно замещенным тетразолилом; или к его фармацевтически приемлемой соли, а также к фармацевтической композиции, включающей соединение формулы I. Технический результат: получены и описаны новые соединения, которые могут быть полезны в лечении аллергических и/или воспалительных расстройств, в частности таких расстройств, как аллергический ринит, астма и/или хроническое обструктивное заболевание легких (ХОЗЛ). 2 н. и 23 з.п. ф-лы.
где R1 представляет собой арил, гетероарил или (C5-С6)-циклоалкил, каждый из которых необязательно имеет в качестве заместителя галоген или (С1-С6)-алкил; R2 представляет собой водород или (C1-C4)-алкил; R3 представляет собой -Р(=O)-(алкокси)2 или Y1Y2N-SO2-, циклоалкил, арил, гетероарил, гетероциклил, циклоалкенил, каждый из которых необязательно имеет в качестве заместителя: галоген, гидрокси, карбокси, Y1Y2N-, Y1Y2NC(=O)-, Y1Y2N-SO2-, R7-SO2-NR6-, R7-C(=O)-NR6-, или алкил, алкокси, алкоксикарбонил, каждый из которых необязательно имеет в качестве заместителя галоген, -Р(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-, арил или гетероарил, и когда R3 является циклоалкилом, циклоалкенилом, гетероциклилом, он также необязательно замещен оксо; L1 представляет собой связь или (С1-С6)-алкилен, который необязательно замещен -Р(=O)-(алкокси)2; R4, R5 и R6 являются водородом, R7 представляет собой алкил; и Y1 и Y2, каждый независимо, является водородом, алкилом, который необязательно имеет в качестве заместителя: гидрокси, амино, алкиламино, диалкиламино, алкокси, циклоалкил, или Y1 и Y2 вместе с атомом азота, с которым они связаны, образуют гетероциклил, который необязательно содержит еще один гетероатом, выбираемый из кислорода, азота или серы, где гетероциклил необязательно имеет в качестве заместителя алкил или оксо; при условии, что, когда L1 представляет собой связь, R3 не является необязательно замещенным фенилом, необязательно замещенным нафтилом, необязательно замещенным бензоимидазолилом, необязательно замещенным бензотиазолилом или необязательно замещенным тетразолилом; или к его фармацевтически приемлемой соли, а также к фармацевтической композиции, включающей соединение формулы I. Технический результат: получены и описаны новые соединения, которые могут быть полезны в лечении аллергических и/или воспалительных расстройств, в частности таких расстройств, как аллергический ринит, астма и/или хроническое обструктивное заболевание легких (ХОЗЛ). 2 н. и 23 з.п. ф-лы.
1. Соединение формулы (I):

где R1 представляет собой арил, гетероарил или (С5-С6)-циклоалкил, каждый из которых необязательно имеет в качестве заместителя галоген или (С1-С6)-алкил;
R2 представляет собой водород или (С1-С4)-алкил;
R3 представляет собой -Р(=O)-(алкокси)2 или Y1Y2N-SO2-,
циклоалкил, арил, гетероарил, гетероциклил, циклоалкенил, каждый из которых необязательно имеет в качестве заместителя:
галоген, гидрокси, карбокси,
Y1Y2N-, Y1Y2NC(=O)-, Y1Y2N-SO2-,
R7-SO2-NR6-, R7-C(=O)-NR6-, или
алкил, алкокси, алкоксикарбонил, каждый из которых необязательно имеет в качестве заместителя
галоген, -Р(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-, арил или гетероарил, и
когда R3 является циклоалкилом, циклоалкенилом, гетероциклилом, он также необязательно замещен оксо;
L1 представляет собой связь или (С1-С6)-алкилен, который необязательно замещен -Р(=O)-(алкокси)2;
R4, R5 и R6 являются водородом,
R7 представляет собой алкил; и
Y1 и Y2, каждый независимо, является
водородом,
алкилом, который необязательно имеет в качестве заместителя:
гидрокси, амино, алкиламино, диалкиламино,
алкокси,
циклоалкил, или
Y1 и Y2 вместе с атомом азота, с которым они связаны, образуют гетероциклил, который необязательно содержит еще один гетероатом, выбираемый из кислорода, азота или серы, где гетероциклил необязательно имеет в качестве заместителя алкил или оксо;
при условии, что, когда L1 представляет собой связь, R3 не является необязательно замещенным фенилом, необязательно замещенным нафтилом, необязательно замещенным бензоимидазолилом, необязательно замещенным бензотиазолилом или необязательно замещенным тетразолилом;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой фенил, пяти- или шестичленный гетероарил или (С5-С6)-циклоалкил, каждый из которых необязательно имеет в качестве заместителя галоген или (С1-С6)-алкил, или его фармацевтически приемлемая соль.
3. Соединение по п.1, где R1 представляет собой фенил, или пяти- или шестичленный гетероарил, каждый из которых необязательно имеет в качестве заместителя галоген или (С1-С6)-алкил, или его фармацевтически приемлемая соль.
4. Соединение по п.1, где R1 представляет собой фенил, или пяти- или шестичленный гетероарил, каждый из которых необязательно имеет в качестве заместителя галоген или (С1-С6)-алкил, или его фармацевтически приемлемая соль, при условии, что если R1 представляет собой фенил или шестичленный гетероарил, тогда он может быть замещен только в орто- или мета-положении.
5. Соединение по п.1, где R1 представляет собой фенил, пиридил, тиазолил, имидазолил или оксодиазолил, каждый из которых необязательно имеет в качестве заместителя галоген или (С1-С6)-алкил, или его фармацевтически приемлемая соль.
6. Соединение по п.1, где R1 представляет собой фенил или пиридил, каждый из которых необязательно имеет в качестве заместителя в орто- или мета-положении галоген или (С1-С6)-алкил, или его фармацевтически приемлемая соль.
7. Соединение по п.1, где R1 представляет собой фенил, который необязательно имеет в качестве заместителя галоген или (С1-С6)-алкил, или его фармацевтически приемлемая соль.
8. Соединение по п.1, где R1 представляет собой фенил, который необязательно имеет в качестве заместителя в орто- или мета-положении галоген или (С1-С6)-алкил, или его фармацевтически приемлемая соль.
9. Соединение по п.1, где R1 представляет собой фенил, который необязательно имеет в качестве заместителя галоген, или его фармацевтически приемлемая соль.
10. Соединение по п.1, где R1 представляет собой фенил, который необязательно имеет в качестве заместителя в орто- или мета-положении галоген, или его фармацевтически приемлемая соль.
11. Соединение по п.1, где R1 представляет собой 2-фторфенил или 3-фторфенил, или его фармацевтически приемлемая соль.
12. Соединение по п.1, где R2 представляет собой водород, или его фармацевтически приемлемая соль.
13. Соединение по п.1, где R2 представляет собой метил, или его фармацевтически приемлемая соль.
14. Соединение по п.1, где L1 представляет собой связь, или его фармацевтически приемлемая соль.
15. Соединение по п.1, где L1 представляет собой (С1-С3)-алкилен, или его фармацевтически приемлемая соль.
16. Соединение по п.1, где L1 представляет собой -СН2-, или его фармацевтически приемлемая соль.
17. Соединение по п.1, где
R3 представляет собой циклоалкил, циклоалкенил, арил, гетероарил, гетероциклил, каждый из которых необязательно имеет в качестве заместителя
галоген, гидрокси, карбокси,
Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-SO2-,
R7-SO2-NR6-, R7-C(=O)-NR6-, или
алкил, алкокси, алкоксикарбонил, каждый из которых необязательно имеет в качестве заместителя
галоген, -P(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2, R7-SO2-NR6-,
арил или гетероарил, и
когда R3 представляет собой циклоалкил, циклоалкенил, гетероциклил, он также может быть замещен оксо,
или его фармацевтически приемлемая соль.
18. Соединение по п.1, где R3 представляет собой фенил, пиридил, тиазолил, имидазолил, оксодиазолил, имидазолил, пиримидинил, тиофенил, оксазолил, циклоалкил, бензооксазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, тетрагидропиранил, пиперидинил, фуранил, бензо[1,3]диоксолил, бензотиазолил, имидазолидинил, индазолил, бензоимидазолил, индолил, бензофуранил, или 1,3-дигидробензо[с]изотиазолил, каждый из которых необязательно имеет в качестве заместителя
галоген, гидрокси, карбокси,
Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-SO2-,
R7-SO2-NR6-, R7-C(=O)-NR6-, или
алкил, алкокси, алкоксикарбонил, каждый из которых необязательно имеет в качестве заместителя:
галоген, -Р(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-,
арил или гетероарил, и
когда R3 представляет собой циклоалкил, тетрагидропиранил, пиперидинил, имидазолидинил или 1,3-дигидробензо[с]изотиазолил, он также может быть замещен оксо, или его фармацевтически приемлемая соль.
19. Соединение по п.1, где
R3 представляет собой фенил, пиридил, тиазолил, имидазолил, оксодиазолил, имидазолил, пиримидинил, тиофенил, оксазолил, циклоалкил, бензооксазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, тетрагидропиранил, пиперидинил, фуранил, бензо[1,3]диоксолил, бензотиазолил, имидазолидинил, индазолил, бензоимидазолил, индолил, бензофуранил, или 1,3-дигидробензо[с]изотиазолил, каждый из которых необязательно имеет в качестве заместителя:
галоген, гидрокси, карбокси, Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-SO2-, R7-SO2-NR6-, R7-C(=O)-NR6-, алкокси, алкоксикарбонил, или алкил, который необязательно имеет в качестве заместителя
галоген, -Р(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-, и
когда R3 представляет собой циклоалкил, тетрагидропиранил, пиперидинил, имидазолидинил, или 1,3-дигидробензо[с]изотиазолил, он также может быть замещен оксо; и
Y1 и Y2, каждый независимо, представляют собой водород или алкил, который необязательно имеет в качестве заместителя гидрокси, алкокси, амино, алкиламино, диалкиламино,
или его фармацевтически приемлемая соль.
20. Соединение по п.1, где R3 представляет собой фенил, который необязательно имеет в качестве заместителя
галоген, гидрокси, карбокси,
Y1Y2N-, Y1Y2N-C(=O)-, Y1Y2N-SO2-,
R7-SO2-NR6-, R7-C(=O)-NR6-, или
алкил, алкокси, алкоксикарбонил, каждый из которых необязательно имеет в качестве заместителя
галоген, -Р(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2-, R7-SO2-NR6-,
арил или гетероарил,
или его фармацевтически приемлемая соль.
21. Соединение по п.1, где
R3 представляет собой фенил, который необязательно имеет в качестве заместителя
галоген, гидрокси, карбокси, Y1Y2N-, Y1Y2N-C(=O)-,
Y1Y2N-SO2-, R7-SO2-NR6-, R7-C(=O)-NR6-, алкокси, алкоксикарбонил, или алкил, который необязательно имеет в качестве заместителя
галоген, -Р(=O)-(алкокси)2, Y1Y2N-, Y1Y2N-SO2, R7-SO2-NR6-, и
Y1 и Y2 независимо представляют собой водород или алкил, который необязательно имеет в качестве заместителя гидрокси, алкокси, амино, алкиламино, диалкиламино,
или его фармацевтически приемлемая соль.
22. Соединение по п.1, где R3 представляет собой фенил, который необязательно имеет в качестве заместителя Y1Y2N-SO2, R7-SO2-NR6-, или алкил, замещенный Y1Y2N-SO2-, R7-SO2-NR6-, или его фармацевтически приемлемая соль.
23. Соединение по п.1, где
R3 представляет собой фенил, который необязательно имеет в качестве заместителя
Y1Y2N-SO2-, R7-SO2-NR6-, или
алкил, замещенный Y1Y2N-SO2, R7-SO2-NR6-; и
Y1 и Y2, каждый независимо, представляют собой водород или алкил, который необязательно имеет в качестве заместителя гидрокси, алкокси, амино, алкиламино, диалкиламино,
или его фармацевтически приемлемая соль.
24. Соединение по п.1, представляющее собой
бензиламид 2-фенилпиримидин-5-карбоновой кислоты
фениламид 2-пиридин-4-илпиримидин-5-карбоновой кислоты,
фениламид 2-пиридин-3-илпиримидин-5-карбоновой кислоты,
фениламид 2-пиридин-2-илпиримидин-5-карбоновой кислоты,
фениламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
фениламид 2-(4-фторфенил)пиримидин-5-карбоновой кислоты,
фениламид 2-(2-фторфенил)пиримидин-5-карбоновой кислоты,
(2,2-диоксо-2,3-дигидро-1Н-2лямбда*6*-бензо[с]изотиазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
[1-(1Н-имидазол-2-ил)метилпиперидин-4-ил]амид 2-фенилпиримидин-5-карбоновой кислоты,
(6-диметиламинопиридин-3-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(2-пирролидин-1-илэтил)бензооксазол-6-ил]амид 2-фенилпиримидин-5-карбоновой кислоты,
4-сульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(4-сульфамоилфенил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты,
[4-(2-оксооксазолидин-4-илметил)фенил]амид (R)-2-фенилпиримидин-5-карбоновой кислоты,
(6-ацетиламинопиридин-3-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-карбамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-метилкарбамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(4-гидроксициклогексил)амид 2-фенилпиримидин-5-карбоновой кислоты,
этиловый эфир 4-метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновой кислоты,
этиловый эфир {2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусной кислоты,
4-метил-2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-5-карбоновая кислота,
{2-[(2-фенилпиримидин-5-карбонил)амино]тиазол-4-ил}уксусная кислота,
4-метилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
4-диметилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
(3,5-дифторфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
пиридин-2-иламид 2-фенилпиримидин-5-карбоновой кислоты,
тиазол-2-иламид 2-фенилпиримидин-5-карбоновой кислоты,
(3-сульфамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(2-оксо-1,2-дигидропиримидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(4-сульфамоилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
пиримидин-4-иламид 2-фенилпиримидин-5-карбоновой кислоты,
(1-пиридин-3-илметилпиперидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(2-оксоимидазолидин-1-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(1Н-имидазол-4-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты,
(тетрагидропиран-4-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-трифторметилфенил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(2Н-пиразол-3-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(1-метилпиперидин-4-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
пиримидин-2-иламид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3,5-дифторфенил)пиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(2,5-дифторфенил)пиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(4-дифторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(2-пиридил)пиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3-пиридил)-4-метилпиримидин-5-карбоновой кислоты,
3-этилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-этоксиэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-гидроксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-циклопропилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-гидроксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-метоксиэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-метоксипропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(4-метоксибутилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-циклогексилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-гидрокси-1,1-диметилэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-сульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-морфолин-4-илэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-пиперидин-1-илэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[2-(1-метилпирролидин-2-ил)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[(1-этилпирролидин-2-илметил)сульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[2-(1Н-имидазол-4-ил)этилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[3-(2-метилпиперидин-1-ил)пропилсульфамоил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-пирролидин-1-илпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-диметиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-диэтиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-диметиламино-2,2-диметилпропилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(5-диметиламинопентилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(2-диизопропиламиноэтилсульфамоил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(метансульфониламинометил)бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-[(пропан-2-сульфониламино)метил]бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилметилбензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-(изопропилсульфамоилметил)бензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-(метансульфониламинометил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-[(пропан-2-сульфониламино)метил]бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-метилсульфамоилметилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(изопропилсульфамоилметил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(2-метансульфониламинопиридин-4-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(тетрагидропиран-4-ил)амид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты,
4-сульфамоилбензоламид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты,
(3-фенил-[1,2,4]тиадиазол-5-ил)амид 2-(5-метил-[1,2,4]оксадиазол-3-ил)пиримидин-5-карбоновой кислоты,
3-(морфолин-4-сульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3,4-диметоксилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
(2-бензо[1,3]диоксол-5-илэтил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(1Н-индазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(4-[1,2,3]тиадиазол-5-ил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3-фторфенил)-4-метилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 4-метил-2-пиридин-2-илпиримидин-5-карбоновой кислоты,
4-морфолин-4-илбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
метиловый эфир 6-[(2-фенилпиримидин-5-карбонил)амино]-1Н-бензоимидазол-2-карбоновой кислоты,
6-[(2-фенилпиримидин-5-карбонил)амино]-1Н-бензоимидазол-2-карбоновую кислоту,
(бензофуран-5-илметил)амид 2-фенилпиримидин-5-карбоновой кислоты,
4-метансульфониламинобензиламид 2-фенилпиримидин-5-карбоновой кислоты,
4-карбамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
3-(2-гидроксиэтилсульфамоил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты,
4-(морфолин-4-сульфонил)бензиламид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-фенилпиримидин-5-карбоновой кислоты,
[2-(2-амино-4-метилтиазол-5-ил)этил]амид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
диэтиловый эфир 4-{[(2-фенилпиримидин-5-карбонил)амино]бензил}фосфоновой кислоты,
диэтиловый эфир (4-[(2-фенилпиримидин-5-карбонил)амино]бутил)фосфоновой кислоты,
диэтиловый эфир (4-[(2-фенилпиримидин-5-карбонил)амино]этил)фосфоновой кислоты,
диэтиловый эфир {фенил-[(2-фенилпиримидин-5-карбонил)амино]метил}фосфоновой кислоты,
3-метансульфонилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(1-метансульфонилпиперидин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(1-диметансульфамоилпиперидин-3-илметил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-метансульфониламинобензиламид 2-(фенил)пиримидин-5-карбоновой кислоты,
3-ацетилсульфамоилбензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
3-(3-оксопипериазин-1-сульфонил)бензиламид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(2-сульфамоилэтил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(2-диметилсульфамоилэтил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-фенил-[1,2,4]тиадиазол-5-ил)амид 2-фенилпиримидин-5-карбоновой кислоты,
(3-фенил-[1,2,4]тиадиазол-5-ил)амид 4-метил-2-фенилпиримидин-5-карбоновой кислоты,
(3-фенил-[1,2,4]тиадиазол-5-ил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
(тетрагидропиран-4-ил)амид 2-(3-фторфенил)пиримидин-5-карбоновой кислоты,
фениламид 2-циклогексилпиримидин-5-карбоновой кислоты,
3-аминобензиламид 2-фенилпиримидин-5-карбоновой кислоты,
3-метилсульфамоилбензиламид 2-(3-пиридил)пиримидин-5-карбоновой кислоты,
4-сульфамоилбензиламид 2-пиразол-1-илпиримидин-5-карбоновой кислоты или
(тетрагидропиран-4-ил)амид 2-(2-метилтиазол-4-ил)пиримидин-5-карбоновой кислоты,
или его фармацевтически приемлемая соль.
25. Фармацевтическая композиция, ингибирующая PGD2 синтазу, включающая соединение по п.1 или 24, или его фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Электрохирургический инструмент | 1988 |
|
SU1553089A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| JP 03112985 А, 14.05.1991 | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2011-06-10—Публикация
2006-10-04—Подача