Изобретение относится к молекулярной биологии и медицине.
Фибриноген, гликопротеин плазмы, синтезируемый в печени, является главным компонентом системы гемостаза человека и животных. Молекула фибриногена человека состоит из шести полипептидных цепей: две Аα-цепи, две Вβ-цепи и две γ-цепи (Аα2Вβ2γ2). Три вида полипептидных цепей кодируются тремя отдельными генами, которые расположены на одной хромосоме 4q23-q32. Последовательность генов расшифрована, поэтому на практике геномную ДНК используют для определения мутаций и таким образом аминокислотных патологий в вариантах фибриногена. Так, наиболее изученная аномалия в молекуле фибриногена связана с Аα-цепью. В ее гене известен однонуклеотидный полиморфизм, обусловленный заменой А на G в 6534-й позиции кодирующей части, приводящей к замена треонина (Thr) на аланин (Ala) в 312-й позиции полипептида (обозначаемый как FGA T312A). Популяционная частота более редкого аллеля FGA А достаточно велика и составляет 35% (http://www.ncbi.nlm.nih.gov/entrez/viewcr.fcsi?db=nucleotide&val=14278704). Анализ генетической ассоциации показал, что у больных, несущих аллель FGA А нарушается образование стабильного фибринового сгустка, что повышает вероятность развития заболеваний, связанных со свертывающейся способностью крови. Имеются работы по корреляции этого аллеля с легочной эмболией (K.F.Standeven et al. Circulation, 2003, v.107, p.2326-2330), ишемической болезнью сердца (A.M.Carter et al. Circulation 1999, v.99, p.2423-2426) и сахарным диабетом (Е.J.Dunn, R.A.S.Ariens. Herz, 2004 v.29, p.470-479).
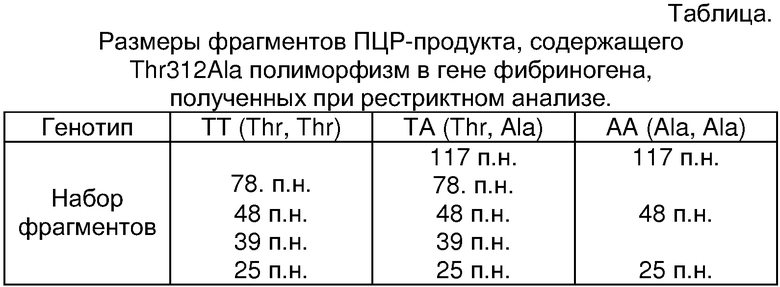
Известен способ идентификации аллелей гена FGA, основанный на двухэтапной процедуре - амплификации ДНК с последующим расщеплением амплифицированного фрагмента рестриктазой Rsa I (далее именуемый прототип) (A.M.Carter et al., Circulation 1999, v.99, p.2423-2426). Для идентификации Thr312Ala генотипов в прототипе использовали следующие олигонуклеотиды, которые в ходе полимеразной цепной реакции (ПЦР) позволяли получать продукт размером 190 п.н.: прямой, 5'-CCT-AGC-AGT-GCT-GGA-AGC-TG-3' и обратный, 5'-CTC-CCA-GGG-TTT-TGG-TTT-CCA-Т-3'. Данный фрагмент был амплифицирован при помощи стандартной процедуры ПЦР при температуре отжига праймеров 54°С. Состав реакционной смеси помимо стандартных компонент включал 25 пмоль/л каждого праймера, 2,0 ммоль/л хлорида магния. Полученный ПЦР-продукт инкубировали с 5 ед. рестриктазы Rsa I. При добавлении указанной рестриктазы к ПЦР-продукту в случае аллеля FGA Т происходит расщепление ДНК с образованием четырех фрагментов различной длины: 78, 48, 39 и 25 п.н. (Таблица). В случае редкого аллеля FGA А обнаруживается только три фрагмента: 117, 48 и 25 п.н. (Таблица ). Таким образом, в результате электрофоретического анализа в 2% агарозном геле от генотипов, гомозиготных по распространенному аллелю идентифицируется четыре полосы, от гомозигот по редкому аллелю - три полосы, а от гетсрозигот пять полос - 117, 78, 48, 39 и 25 п.н. (Таблица).
Примечание: «п.н.» - пар нуклеотидов.
К недостаткам метода следует отнести: высокую трудоемкость анализа и необходимость использования коммерческого препарата рестриктазы Rsa I, что составляет значимую часть стоимости выполнения данного анализа (www.biotst.net/search.php?criteria=Rsa&submit=%CF%EE%E8%FI1%EA).
Технической задачей предлагаемого изобретения является упрощение известного способа (уменьшение числа процедур) и ускорение выявления аллельных вариантов и генотипов FGA, без снижения точности.
Определяющим существенным отличием заявляемого способа по сравнению с описанным выше методом (прототипом) является то, что в прототипе проводят стандартную амплификацию ДНК с использованием пары праймеров, фланкирующих интересующий фрагмент. В заявляемом способе использовали другой подход - аллельспецифическую амплификацию. При таком анализе амплификацию проводят в двух параллельных пробах: в одной - в качестве обратного праймера использовали олигонуклеотид с концевым нуклеотидом (Т), комплиментарным аденину (А) в 6534 позиции частого аллеля (FGA Т), а в другой - праймер с концевой дезоксицитидиловой кислотой (С) комплиментарной гуанину (G) в 6534 позиции редкого аллеля (FGA А). Благодаря этому, в заявляемом способе отсутствует этап обработки рестриктазой амплифицированного фрагмента ДНК.
Заявляемый способ расширяет область применения идентификации аллелей гена α-фибриногена (FGA) и позволит использовать этот метод в клинико-диагностических лабораториях медицинских учреждений. Т.о., внедрение данной технологии будет способствовать повышению качества диагностики наследственных нарушений системы гомеостаза.
Заявляемый способ выполняли следующим образом.
Геномную ДНК выделяли из 5-10 мл периферической крови по стандартной методике с использованием протеиназы К с последующей экстракцией фенол/хлороформом (Смит К., Клко С., Кантор Ч. В сб. Анализ генома. Под ред. К.Дейвиса, М.: Мир, 1990, с.58-94). Для идентификации распространенного аллеля FGA Т применяли обратный праймер 5'-ТСС-CAG-AGT-TCC-AGC-TTC-CAG-T-3' с треонином на 3'-конце. Для амплификации более редкого аллеля FGA А применяли обратный праймер 5'-CCC-AGA-GTT-CCA-GCT-TCC-AGC-3' с цитозином на 3'-конце. В качестве прямого праймера в обоих случаях служила последовательность 5'-TGT-CGA-GGG-TCA-TGC-AGT-AGG-G-3'.
Разработанный режим амплификации включал следующие стадии: начальную денатурацию при 95°С в течение 180 с, затем 30 циклов - с денатурацией в течение 20 с при 94°С; отжигом в течение 30 с при 58,5°С и синтезом в течение 35 с при 72°С. Продукты ПЦР анализировали с помощью электрофореза в 2% агарозном геле с последующим окрашиванием бромистым этидием.
Определение аллелей гена FGA проводили по наличию или отсутствию в геле фрагмента размером 475 п.н. В случае, если фрагмент выявлялся при амплификации ДНК с обеими парами праймеров, это свидетельствовало о присутствии обоих аллелей в генотипе индивида. Следовательно, носитель образца ДНК - гетерозигота. Амплификация фрагмента только с одной парой праймеров и отсутствие амплификата при использовании другой пары свидетельствовало о гомозиготном состоянии по соответствующему аллелю.
Изобретение иллюстрируется следующим примером конкретного выполнения.
Геномную ДНК трех индивидуумов выделяли из крови с использованием протеиназы К с последующей экстракцией фенол/хлороформом. Одновременную идентификацию аллелей в исследуемых образцах проводили при помощи прототипа и заявляемого способа.
В первом случае - в случае прототипа - смесь для амплификации объемом 50 мкл содержала 25 пмоль/л прямого и обратного праймера (ОАО "СибЭнзим", Новосибирск); 2,0 ммоль/л хлорида натрия; 1,25 ед Taq-полимеразы с 10-кратным буфером, приготовленным фирмой производителем (ОАО "СибЭнзим", Новосибирск); 0,2 ммоль/л смеси дезоксирибонуклеотидов (ОАО "СибЭнзим", Новосибирск) и 0,5 мкг тотальной ДНК. Амплификацию проводили на оборудовании РСТ-200 DNA-EngineTM MJ Research. Режим амплификации: начальная денатурация при 95°С в течение 180 с, затем 30 циклов - с денатурацией в течение 20 с при 94°С; отжигом в течение 30 с при 54°С и синтезом в течение 35 с при 72°С.После амплификации полученные ПЦР-продукты инкубировали с 5 ед. рестриктазы Rsa I.
Во втором случае состав реакционной смеси, также объемом 50 мкл, помимо стандартных компонент включал 0,1 мкмоль/л каждого праймера (ОАО "СибЭнзим", Новосибирск) 2,0 ммоль/л хлорид магния и 4 ммоль/л DMSO и 0,5 мкг тотальной ДНК. Режим амплификации был аналогичен прототипу с единственным отличием в температуре отжига праймеров, которая составила 58,5°С.
Все полученные продукты анализировали с помощью электрофореза в 2% агарозном геле с последующим окрашиванием бромистым этидием. На гель наносили 10 мкл продукта. Электрофорез проводили в течение 60 мин при напряжении 100 В.
Электроферограмма, приведенная на Фиг.1, демонстрирует результаты идентификации аллелей гена фибриногена при помощи прототипа. При добавлении рестриктазы к ПЦР-продукта в образце 1 (Фиг.1 дорожка 1) образовалось четыре фрагмента разной длины. Это свидетельствует о том, что исследуемый генотип гомозиготен по аллелю FGA Т (генотип ТТ). Три фрагмента в образце 3 (Фиг.1 дорожка 3) соответствуют гомозиготе по аллелю FGA А (генотип АА), а пять (Фиг.1 дорожка 2) - гетерозиготе (генотип ТА).
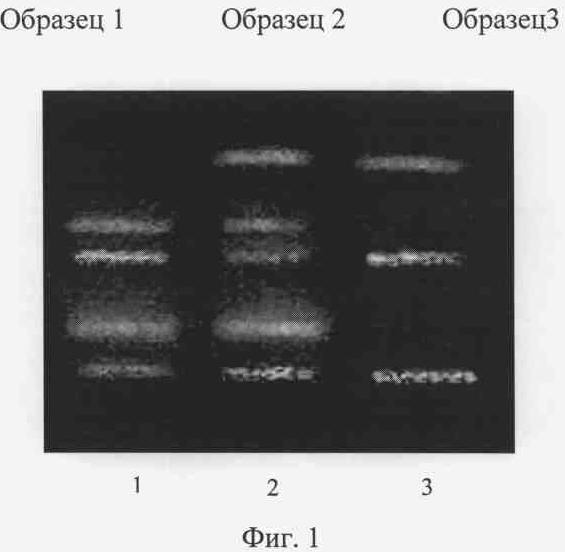
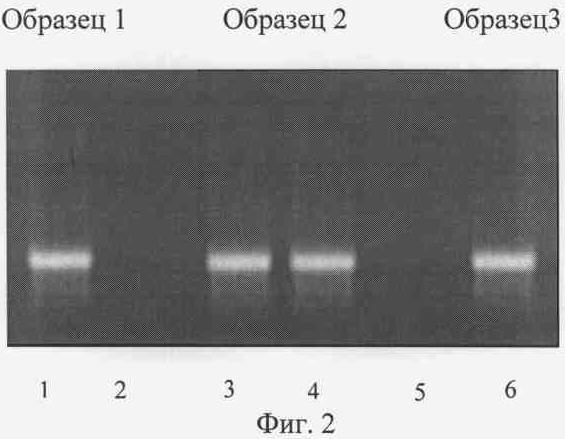
Аналогичные результаты были получены при идентификации аллелей при помощи заявляемого способа. Электроферограмма приведена на Фиг.2. Образец 1 взят от индивидуума, гомозиготного по аллелю FGA Т (генотип ТТ). На это указывает наличие фрагмента ДНК размером 475 п.н. только на одной из пары дорожек в случае амплификации фрагмента ДНК FGA с парой праймеров, один из которых имеет 3'-концевой нуклеотид комплементарный аденину в позиции 6534 распространенного аллеля (FGA Т) (Фиг.2. дорожки 1 и 2). Образец 2 принадлежит индивидууму с гетерозиготым генотипом ТА (фрагмент размером 475 п.н. выявляется при амплификации с обоими парами праймеров - Фиг.2 дорожки 3 и 4 соответственно). Образец 3 получен от индивидуума, гомозиготного по аллелю FGA А (генотип АА). На это указывает наличие фрагмента только при амплификации с той парой праймеров, где обратный имеет 3'-концевой нуклеотид, комплементарный гуанину в позиции 6534 редкого аллеля (FGA А) (Фиг.2 дорожки 5 и 6).
С помощью предлагаемого способа обследованы 100 пациентов больных метаболическим синдромом и 50 практически здоровых лиц. Правильность определения генотипов заявляемым способом подтверждена независимо с помощью полимеразной цепной реакции и гидролиза продукта ПЦР рестриктазой Rsa I (СибЭнзим, Новосибирск) по способу, взятому в качестве прототипа (A.M.Carter et al., Circulation 1999, v.99, p.2423-2426).
Изобретение относится к области генной инженерии и может быть использовано в медицине при диагностике ряда заболеваний, связанных с метаболическим синдромом. Для определения Thr312Ala полиморфизма гена α-фибриногена (FGA) из исследуемого образца выделяют ДНК, которую затем подвергают амплификации методом полимеразной цепной реакции с использованием аллельспецифических праймеров. Для идентификации распространенного аллеля FGA Т используют обратный праймер 5'-ТСС-CAG-AGT-TCC-AGC-TTC-CAG-T-3'; для идентификации редкого аллеля FGA А применяют обратный праймер 5'-CCC-AGA-GTT-CCA-GCT-TCC-AGC-3'; прямым праймером в обоих случаях служит последовательность 5'-TGT-CGA-GGG-TCA-TGC-AGT-AGG-G-3'. Изобретение обеспечивает возможность проведения высокоточного, простого и дешевого анализа указанного полиморфизма фибриногена, пригодного для использования в клинико-диагностических лабораториях. 2 ил., 1 табл.
Способ определения аллелей гена α-фибриногена (FGA) по полиморфному сайту Thr312Ala, включающий забор материала от пациента, амплификацию фрагмента гена FGA с использованием пары праймеров, отличающийся тем, что амплификацию осуществляют методом аллельспецифической полимеразной цепной реакции с использованием двух пар праймеров, при этом для идентификации распространенного аллеля FGA Т используют обратный праймер 5'-TCC-CAG-AGT-TCC-AGC-TTC-CAG-T-3'; для идентификации редкого аллеля FGA А применяют обратный праймер 5'-CCC-AGA-GTT-CCA-GCT-TCC-AGC-3'; прямым праймером в обоих случаях служит последовательность 5'-TGT-CGA-GGG-TCA-TGC-AGT-AGG-G-3'.
| CARTER A.M | |||
| et al | |||
| Способ обработки шкур | 1921 |
|
SU312A1 |
| Circulation | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АЛЛЕЛЕЙ ГЕНА ХЕМОКИНОВОГО РЕЦЕПТОРА CCR2 ПО ПОЛИМОРФНОМУ САЙТУ V64I | 2001 |
|
RU2180922C1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2008-08-20—Публикация
2006-06-02—Подача