Область техники
Изобретение относится к областям молекулярных биотехнологии и медицины и касается генетической конструкции, несущей открытую рамку считывания гена SMN1 человека, под управлением нейроспецифичного промотора гена синапсина I (SYN1). Изобретение может служить основой для создания генотерапевтического препарата для борьбы со спинальной мышечной атрофией I типа (СМА1).
Работа выполнена при финансовой поддержке Федерального государственного бюджетного учреждения «Фонд содействия развитию малых форм предприятий в научно-технической сфере» (Фонд содействия инновациям) в рамках Договора (Соглашения) №№4174ГС1/68618 от 23.07.2021.
Уровень техники
Спинальная мышечная атрофия (СМА) является тяжелым аутосомно-рецессивным нейродегенеративным заболеванием, характеризующимся прогрессирующей слабостью и атрофией проксимальных мышц, возникающих в результате дегенерации альфа-нейронов в передних рогах спинного мозга. Несмотря на то, что глобальная оценочная заболеваемость СМА не превышает 1 случая на 10000 живорождений (Verhaart, I.Е.С. Prevalence, incidence and carrier frequency of 5q linked spinal muscular atrophy a literature review /I.E.C. Verhaart, A. Robertson, I.J. Wilson, A. Aartsma-Rus, S. Cameron, С.C. Jones et al. // Orphanet J Rare Dis. - 2017. - v. 12. - P. 15), данное заболевание является вторым по распространенности аутосомно-рецессивным наследственным заболеванием в мире и, более того, является наиболее распространенным моногенным заболеванием, приводящим к младенческой смертности. Частота встречаемости мутантного аллеля СМА варьирует от 1 на 38 до 1 на 72 случая, что в среднем в популяции составляет 1 на 54 (Chen, Т. New and Developing Therapies in Spinal Muscular Atrophy: From Genotype to Phenotype to Treatment and Where Do We Stand? / T. Chen // Int J Mol Sci. - 2020. - v. 21. - P. 3297.).
Причиной развития СМА более чем в 95% случаев является снижение уровня экспрессии белка выживания моторных нейронов SMN (Survival of Motor Neuron), возникающее в результате гомозиготной делеции или конверсии гена SMN1. В геноме находится практически идентичный аналог этого гена - SMN2, однако он обеспечивает только 10-15% синтеза функционального белка (Blasco-Pérez, L. Beyond copy number: A new, rapid, and versatile method for sequencing the entire SMN2 gene in SMA patients / L. Blasco-Pérez, I. Paramonov, J. Leno, S. Bernal, L. Alias, P. Fuentes-Prior et al. // Hum Mutat. - 2021. - v. 42. - P. 787-795.).
Именно гены SMN1 и SMN2 являются главными мишенями для разработки современных методов терапии спинальной мышечной атрофии. В настоящее время три препарата - Нусинерсен ("Спинраза"; Biogen), Рисдиплам ("Эврисди"; Roche) и Онасемноген абепарвовек ("Золгенема"; Novartis) - одобрены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) и Европейским агентством по лекарственным средствам (ЕМА). Нусинерсен и Рисдиплам оказывают влияние на сплайсинг мРНК гена CMN2. Синонимичная замена нуклеотидов цитозина на тимин в последовательности гена SMN2 формирует энхансер сплайсинга и приводит к синтезу усеченного варианта белка - SMN-Δ7 (Schorling, D.С. Advances in Treatment of Spinal Muscular Atrophy - New Phenotypes, New Challenges, New Implications for Care / D.C. Schorling, A. Pechmann, J. Kirschner // J Neuromuscul Dis. - 2020. - v. 7. - P. 1-13.). Ингибируя процессы сплайсинга, данные препараты позволяют повысить уровень функционального белка SMN, однако они обладают только временным эффектом и требуют ежегодного введения (Blasco-Pérez, L. Beyond copy number: A new, rapid, and versatile method for sequencing the entire SMN2 gene in SMA patients / L. Blasco-Pérez, I. Paramonov, J. Leno, S. Bernal, L. Alias, P. Fuentes-Prior et al. // Hum Mutat. - 2021. - v. 42. - P. 787-795.). Онасемноген абепарвовек представляет собой рекомбинантный аденоассоциированный вирус, несущий нормальную копию кДНК гена SMN1 под контролем гибридного промотора, состоящего из энхансера цитомегаловируса и интрона гена куриного β-актина. Данный препарат обеспечивает восстановление экспрессии белка SMN после однократного введения, однако он вызывает тяжелые побочные эффекты в виде печеночной недостаточности (Chaytow, Н. Spinal muscular atrophy: From approved therapies to future therapeutic targets for personalized medicine / H. Chaytow, K. M. E. Faller, Y. Huang, Т.H. Gillingwater // Cell Rep Med. - 2021. - v. 2. P. 19.). Оптимизация генно-инженерных конструкций, содержащих гены аденоассоциированного вируса и последовательность кДНК гена SMN1 путем добавления нейроспецифичного промотора гена SYN1 позволит снизить гепатотоксичность препарата, достичь ремиссии у пациентов, страдающих спинальной мышечной атрофией и избежать развития тяжелых побочных эффектов, особенно у детей младенческого возраста.
Раскрытие сущности изобретение
В данном изобретении тканеспецифичная экспрессия гена SMN1 обеспечивается использованием вектора pAAVITR. Открытая рамка считывания гена SMN1 в векторе располагается после промотора гена синапсина I SYN1. Ген синапсина I в организме человека ассоциирован с синаптическими везикулами и экспрессируется только в нейронах, что обеспечивается его нейроспецифичным промотором. При этом промотор гена синапсина I один из самых коротких среди промоторов генов человека, что делает его удобным для использования в генетических конструкциях. После гена SMN1 в генетической конструкции располагается сигнал полиаденилирования гормона роста крупного рогатого скота bGH, который обеспечивает полиаденилирование мРНК, что продляет время ее жизни путем защиты 3`-конца от нуклеаз. Все перечисленные последовательности располагаются между инвертированными концевыми повторами (ITR) аденоассоциированного вируса 2 серотипа. Наличие повторов обеспечивает репликацию и упаковку функциональной части конструкции в белки капсида и сборку вирионов, несущих терапевтический агент.
Наличие в векторе гена β-лактамазы (AmpR) позволяет проводить его наработку в бактериальных клетках Escherichia coli при селективном отборе с использованием антибиотика - ампициллина. Экспрессия этого гена происходит только в бактериальных клетках за счет регуляции с помощью промотора гена β-лактамазы. Репликация вектора в прокариотических клетках обеспечивается наличием ориджина репликации ColEI.
Задачей заявляемого изобретения является создание генотерапевтического препарата на основе рекомбинантного аденоассоциированного вируса 2 серотипа, несущего в своем геноме нормальную открытую рамку считывания гена SMN1 под управлением нейроспецифичного промотора гена синапсина SYN1 в составе вектора pAAVTTR.
Задача решается тем, что получена новая генетическая конструкция prSYN1_SMN1_AAVITR, для чего:
1. С помощью полимеразной цепной реакции с перекрывающимися праймерами после обратной транскрипции был выполнен синтез открытой рамки считывания функционального варианта гена SMN1 размером 889 пар нуклеотидов, несущей на своих концах сайты рестрикции для эндонуклеаз рестрикции HindIII и XbaI. В качестве матрицы была использована тотальная РНК, выделенная из линии клеток человека IMR-32, представляющей собой смесь двух типов клеток: нейробластов и фибробластов. Правильность последовательности синтезированной открытой рамки считывания была подтверждена с помощью секвенирования по методу Сэнгера.
2. С помощью полимеразной цепной реакции со вложенными праймерами в условиях амплификации ГЦ-богатых матриц был синтезирован промотор гена синапсина (SYN1) с использованием в качестве матрицы геномной ДНК линии клеток человека MRC-5, которые представляют собой эмбриональные фибробласты. Был получен продукт размером 448 пар нуклеотидов, несущий на своих концах сайты узнавания эндонуклеаз рестрикции KpnI и HindIII.
3. Сборка вектора prSYN1_SMN1_AAVITR характеризуется следующими стадиями:
а) Обработка плазмиды, полученной ранее на основе конструкции pSpCas9(BB)-2A-GFP (РХ458) (Addgene #48138) эндонуклеазами рестрикции KpnI и XbaI, выделение фрагмента, несущего инвертированные концевые повторы аденоассоциированного вируса, бактериальный ориджин ColE1 и ген β-лактамазыразмером 3143 пары нуклеотидов из агарозного геля и его очистка
б) Гидролиз эндонуклеазами рестрикции HindIII и XbaI ранее синтезированной открытой рамки считывания гена SMN1
в) Гидролиз эндонуклеазами рестрикции KpnI и HindIII ранее синтезированного промотора гена синапсина SYN1.
г) Лигирование всех трех полученных фрагментов с помощью ДНК-лигазы фага Т-4 и последующее клонирование в бактериальных клетках Escherichia coli штамма NEB Stable.
д) Подтверждение правильности сборки вектора prSYN1_SMN1_AAVITR с помощью секвенирования по методу Сенгера.
Технический результат изобретения: получена генетическая конструкция, несущая функциональный вариант гена SMN1 под регуляцией нейроспецифичного промотора гена синапсина SYN1 между инвертированными концевыми повторами аденоассоциированного вируса 2 серотипа, обеспечивающая получение рекомбинантных аденоассоциированных вирусов для доставки функциональной части вектора к клеткам in vivo.
Изобретение иллюстрируется фигурой и перечнем использованных последовательностей.
Краткое описание чертежей
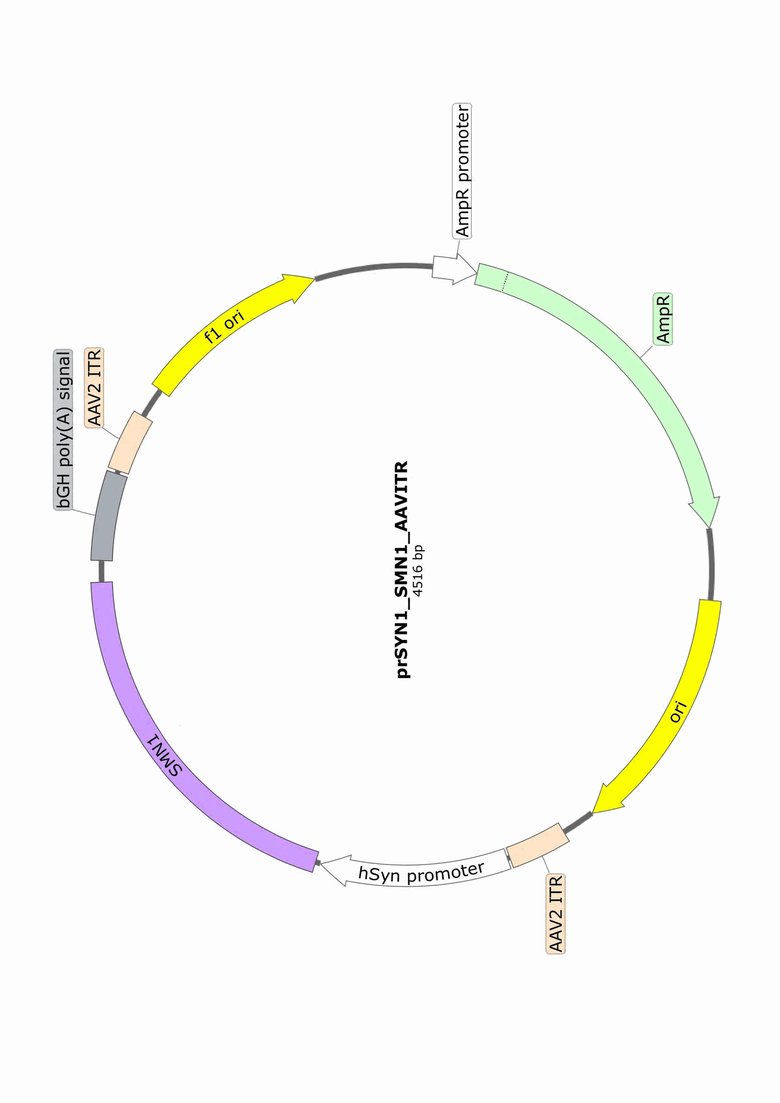
На фигуре представлена схема вектора prSYN1_SMN1_AAVITR. Между инвертированными концевыми повторами аденоассоциированного вируса ITR располагается функциональная открытая рамка считывания гена SMN1 под управлением нейроспецифичного промотора гена синапсина SYN1.
Осуществление изобретения
Способ осуществляется следующим образом:
Получение генетических конструкций. кДНК гена SMN1 (SEQ ID NO: 1) получали на основе суммарной мРНК, полученной из тотальной РНК клеток IMR-32, выделенной с помощью фенол-хлороформной экстракции. Обратную транскрипцию осуществляли с использованием обратной транскриптазы M-MuLV-RH (Биолабмикс) и трех вариантов праймера SMN1_1-R (SEQ ID NO: 3), SMN1_2-R (SEQ ID NO: 4), SMN1_3-R (SEQ ID NO: 5). Амплификацию кодирующей последовательности SMN7 осуществляли с использованием системы вложенной ПЦР и праймеров SMN1_Kozak_KpnI-F (SEQ ID NO: 6), SMN1_dell-F (SEQ ID NO: 7), SMN1_dell-R (SEQ ID NO: 8), SMN1_del2-F (SEQ ID NO: 9), SMN1_del2-R (SEQ ID NO: 10), SMN1_XbaI-R (SEQ ID NO: 11) ДНК полимеразой Q5 (NEB). Синтезированный фрагмент фрагмент подвергали разрезанию эндонуклеазами рестрикции HindIII и XbaI (SybEnzyme).
Синтез промотора Syn1 (SEQ ID NO: 2) осуществляли на основе материала ДНК, выделенного из культуры клеток MRC-5 с помощью фенол-хлороформной экстракции и спиртовым осаждением. В синтезе использовали с праймеры Syn1_KpnI-F (SEQ ID NO: 12) и Syn1_HindIII-R (SEQ ID NO: 13) и ДНК полимеразой Q5 (NEB) с добавлением диметилсульфоксида. Синтезированный фрагмент подвергали разрезанию эндонуклеазами рестрикции HindIII и KpnI (SybEnzyme).
Вектор pAAVITR, полученный ранее на основе конструкции pSpCas9(BB)-2A-GFP (РХ458) (Addgene #48138), подвергали разрезанию эндонуклеазами рестрикции XbaI и KpnI (SybEnzyme) и очищали с помощью экстракции из агарозного геля с помощью набора QIAquick Gel Extraction Kit (Qiagen)
Лигирование трех полученных фрагментов проводили с помощью ДНК-лигазы фага Т4 (Thermo Fisher Scientific). Расчет необходимого количества фрагментов для проведения реакции лигирования производился с помощью онлайн калькулятора NEBioCalculator (NEB). Для успешного прохождения реакции было выбрано соотношение копий ДНК вставок относительно копий ДНК вектора 7 к 1, при этом на реакцию было взято 100 нг фрагмента. Лигазную смесь трансформировали в компетентные клетки NEB Stable (NEB), колонии скринировали, наращивали в ночной культуре, плазмидную ДНК из них выделяли и проверяли с помощью рестриктного анализа. Один образец секвенировали и проверяли, полностью ли последовательность соответствует предсказанным (SEQ ID NO: 1 и SEQ ID NO: 2).
--->
Перечень последовательностей
<110> ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ ТРАНСГЕН (OBSCHESTVO S
OGRANICHENNOI OTVETSTVENNOSTYU TRANSGEN)
<120> Генетическая конструкция, адаптированная для доставки гена SMN1
человека с помощью аденоассоциированного вируса серотипа 2 для
обеспечения нейроспецифичной экспрессии
<160> 13
<210> 1
<211> 889
<212> последовательность открытой рамки считывания гена SMN1 ДНК
<213> H.sapiens
<400> 1 atg gcg atg agc agc ggc ggc agt ggt ggc ggc gtc ccg gag cag
gag gat tcc gtg ctg 60
ttc cgg cgc ggc aca ggc cag agc gat gat tct gac att tgg gat gat aca
gca ctg ata 120
aaa gca tat gat aaa gct gtg gct tca ttt aag cat gct cta aag aat ggt
gac att tgt 180
gaa act tcg ggt aaa cca aaa acc aca cct aaa aga aaa cct gct aag aag
aat aaa agc 240
caa aag aag aat act gca gct tcc tta caa cag tgg aaa gtt ggg gac aaa
tgt tct gcc 300
att tgg tca gaa gac ggt tgc att tac cca gct acc att gct tca att gat
ttt aag aga 360
gaa acc tgt gtt gtg gtt tac act gga tat gga aat aga gag gag caa aat
ctg tcc gat 420
cta ctt tcc cca atc tgt gaa gta gct aat aat ata gaa caa aat gct caa
gag aat gaa 480
aat gaa agc caa gtt tca aca gat gaa agt gag aac tcc agg tct cct gga
aat aaa tca 540
gat aac atc aag ccc aaa tct gct cca tgg aac tct ttt ctc cct cca cca
ccc ccc atg 600
cca ggg cca aga ctg gga cca gga aag cca ggt cta aaa ttc aat ggc cca
cca ccg cca 660
ccg cca cca cca cca ccc cac tta cta tca tgc tgg ctg cct cca ttt cct
tct gga cca 720
cca ata att ccc cca cca cct ccc ata tgt cca gat tct ctt gat gat gct
gat gct ttg 780
gga agt atg tta att tca tgg tac atg agt ggc tat cat act ggc tat tat
atg ggt ttc 840
aga caa aat caa aaa gaa gga agg tgc tca cat tcc tta aat taa
<210> 2
<211> 448
<212> последовательность промотора SYN1 ДНК
<213> H.sapiens
<400> 1 agt gca agt ggg ttt tag gac cag gat gag gcg ggg tgg ggg tgc
cta cct gac gac cga 60
ccc cga ccc act gga caa gca ccc aac ccc cat tcc cca aat tgc gca tcc
cct atc aga 120
gag ggg gag ggg aaa cag gat gcg gcg agg cgc gtg cgc act gcc agc ttc
agc acc gcg 180
gac agt gcc ttc gcc ccc gcc tgg cgg cgc gcg cca ccg ccg cct cag cac
tga agg cgc 240
gct gac gtc act cgc cgg tcc ccc gca aac tcc cct tcc cgg cca cct tgg
tcg cgt ccg 300
cgc cgc cgc cgg ccc agc cgg acc gca cca cgc gag gcg cga gat ag g ggg
gca cgg gcg 360
cga cca tct gcg ctg cgg cgc cgg cga ctc agc gct gcc tca gtc tgc ggt
ggg cag cgg 420
agg agt cgt gtc gtg cct gag agc gca g
<210> 3
<211> 20
<212> ДНК
<213> artifficial sequence
<220> обратный праймер
<223> SMN1_1-R
<400> 1 gcc aca tac gcc tca cat ac
<210> 4
<211> 25
<212> ДНК
<213> artifficial sequence
<220> обратный праймер
<223> SMN1_2-R
<400> 1 gat tct gta aca ttt tgc cac ata c
<210> 5
<211> 21
<212> ДНК
<213> artifficial sequence
<220> обратный праймер
<223> SMN1_3-R
<400> 1 aca atg aac agc cat gtc cac
<210> 6
<211> 35
<212> ДНК
<213> artifficial sequence
<220> прямой праймер
<223> SMN1_Kozak_KpnI-F
<400> 1 taa gca ggt acc ttt gct atg gcg atg agc agc gg
<210> 7
<211> 22
<212> ДНК
<213> artifficial sequence
<220> прямой праймер
<223> SMN1_del1-F
<400> 1 gtc taa aat tca atg gcc cac c
<210> 8
<211> 22
<212> ДНК
<213> artifficial sequence
<220> обратный праймер
<223> SMN1_del1-R
<400> 1 ggt ggg cca ttg aat ttt aga c
<210> 9
<211> 26
<212> ДНК
<213> artifficial sequence
<220> прямой праймер
<223> SMN1_del2-F
<400> 1 cta tta tat ggg ttt cag aca aaa tc
<210> 10
<211> 27
<212> ДНК
<213> artifficial sequence
<220> обратный праймер
<223> SMN1_del2-R
<400> 1 gat ttt gtc tga aac cca tat aat agc
<210> 11
<211> 30
<212> ДНК
<213> artifficial sequence
<220> обратный праймер
<223> SMN1_XbaI-R
<400> 1 taa gca tct aga gtg ctg ctc tat gcc agc
<210> 12
<211> 33
<212> ДНК
<213> artifficial sequence
<220> прямой праймер
<223> Syn1_KpnI-F
<400> 1 taa gca ggt acc agt gca agt ggg ttt tag gac
<210> 13
<211> 29
<212> ДНК
<213> artifficial sequence
<220> обратный праймер
<223> Syn1_HindIII-R
<400> 1 taa gca aag ctt ctg cgc tct cag gca cg
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения линии гуманизированных мышей, содержащих инсерцию 3974insT в гене mGrin2a (mice glutamate [NMDA] receptor subunit epsilon-1), приводящую к преждевременному прекращению трансляции белка grin2a | 2021 |
|
RU2764650C1 |
| Способ получения линии гуманизированных мышей, трансгенных по hACE2 | 2020 |
|
RU2757114C1 |
| КОНСТРУКЦИИ НУКЛЕИНОВОЙ КИСЛОТЫ И ВЕКТОРЫ ДЛЯ ГЕНОТЕРАПИИ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ВИЛЬСОНА И ДРУГИХ СОСТОЯНИЙ | 2015 |
|
RU2745567C2 |
| АТТЕНУИРОВАННЫЙ ШТАММ ВИРУСА СЕНДАЙ | 2013 |
|
RU2552487C2 |
| МАТЕРИАЛЫ И МЕТОДЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ У СОБАК | 2020 |
|
RU2811752C2 |
| ИММУНОИНДУЦИРУЮЩЕЕ СРЕДСТВО | 2016 |
|
RU2744843C2 |
| Вакцина против герпеса | 2019 |
|
RU2731073C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ И/ИЛИ ПРЕДОТВРАЩЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2016 |
|
RU2714205C2 |
| ПАРВОВИРУС СВИНЕЙ | 2015 |
|
RU2817872C2 |
| ВИРУС ГРИППА, СПОСОБНЫЙ ИНФИЦИРОВАТЬ СОБАЧЬИХ, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2802222C2 |
Настоящее изобретение относится к области биотехнологии и касается генетической конструкции, несущей открытую рамку считывания гена SMN1 человека, под управлением нейроспецифичного промотора гена синапсина I (SYN1), и может быть использовано в медицине. Благодаря содержащемуся в векторе промотору SYN1, экспрессия трансгена будет обеспечена только в нейрональных клетках, а наличие инвертированных концевых повторов AAV-ITR обеспечивает упаковку в вирионы рекомбинантного аденоассоциированного вируса. Изобретение может быть использовано при получении генотерапевтического препарата для борьбы со спинальной мышечной атрофией 1 (СМА1) типа путем доставки конструкции с помощью рекомбинантного аденоассоциированного вируса 2 серотипа. 1 ил.
Рекомбинантная плазмида prSYN1_SMN1_AAVITR, предназначенная для упаковки последовательности функциональной открытой рамки считывания гена SMN1 под управлением промотора гена синапсина I SYN1 в вирионы рекомбинантного аденоассоциированного вируса 2 серотипа для обеспечения экспрессии гена SMN1 в нейрональных клетках человека, которая
имеет размер 4516 пар нуклеотидов,
содержит целевой ген, представляющий собой открытую рамку считывания гена SMN1, имеющий нуклеотидную последовательность SEQ ID NO: 1 длиной 885 пар нуклеотидов, под управлением промотора SYN1, имеющего нуклеотидную последовательность SEQ ID NO: 2 длиной 448 пар нуклеотидов, и
состоит из следующих элементов:
ген β-лактамазы, имеющий координаты с 1298 по 2158 пару нуклеотидов, под управлением промотора с координатами с 1193 по 1297 пару нуклеотидов для обеспечения селективного отбора бактерий Escherichia coli с помощью антибиотика – ампициллина;
точка начала репликации – ori, имеющая координаты с 3605 по 4489 пару нуклеотидов, для обеспечения репликации вектора в бактериальных клетках Escherichia coli;
инвертированные концевые повторы аденоассоциированного вируса 2 серотипа с координатами с 2998 по 3138 пару нуклеотидов и с 241 по 381 пару нуклеотидов, обеспечивающие упаковку целевого гена SMN1 по управлением промотора SYN1 в вирионы аденоассоциированного вируса; и
сигнал полиаденилирования bGH poly(A) signal, имеющий координаты с 25 по 232 пару нуклеотидов, обеспечивающий полиаденилирование мРНК.
| WO 2017106354 A1, 22.06.2017 | |||
| Рекомбинантная плазмидная ДНК pQE-30_P36GP12_GP57, обеспечивающая синтез рекомбинантного белка P36GP12 в клетках Escherichia coli, штамм бактерий Escherichia coli - продуцент рекомбинантного белка P36GP12, рекомбинантный белок P36GP12, обладающий способностью связывать липополисахариды Escherichia coli | 2019 |
|
RU2707922C1 |
| US 20220001028 A1, 06.01.2022 | |||
| CHAYTOW H | |||
| et al.: "Spinal muscular atrophy: From approved therapies to future therapeutic targets for personalized medicine", Cell Reports Medicine, 2021 | |||
| v | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| GABER ALI H | |||
| et al.: "Gene therapy for spinal muscular atrophy: the Qatari | |||
Авторы
Даты
2023-08-16—Публикация
2022-06-10—Подача