Область техники
Изобретение относится к пищевой промышленности и, в частности, к инкапсулированному продукту, полученному на основе сложной коацервации и состоящему из липофильного содержимого и гидрофильной оболочки, в котором оболочка полностью покрывает внутреннее содержимое (далее по тексту - сложный инкапсулят-коацерват). Сложный инкапсулят-коацерват может не содержать желатина, однако не требуется, чтобы он полностью не содержал желатина. Изобретение относится также к способу производства сложных инкапсулятов-коацерватов и к пищевым композициям, содержащим указанные сложные инкапсуляты-коацерваты.
Предшествующий уровень техники
Капсулирование жирорастворимых материалов, таких как жиры или масла с неприятным вкусом или чувствительные к кислороду витамины или бета-каротин, хорошо известно. Предложен ряд методов получения инкапсулята с липофильным содержимьм, необходимых для капсулирования жирорастворимых материалов.
Например, ЕР 982038 описывает получение инкапсулята путем распыления смеси водного раствора белка с поперечными связями, трансглютаминазы и гидрофобного материала, такого как бета-каротин. В качестве белка с поперечными связями используется желатин, казеин, соевый белок, кукурузный белок и коллаген. В примерах в качестве указанного белка применяется желатин.
Применение желатинсодержащих капсул в качестве объемных носителей хорошо известно во многих областях техники: примерами могут служить желатиновые шарики с органическим красителем, фармацевтические желатиновые капсулы, капсулы с витаминами/лечебными составами, инкапсулированные продукты для парфюмерных/косметических целей, а также инкапсулированные средства и гели для ванны и душа. Указанные капсулы эластичны и легко растворяются. Они могут быть получены на основе сложной коацервации.
Сложная коацервация является хорошо известным в коллоидной химии явлением; обзор базирующихся на коацервации методов капсулирования дается, например, P.L.Madan с сотр. в "Drug Development and Industrial Pharmacy", 4(1), 95-116 (1978) и Р.В.Deary в "Microencapsulation and Drug Processes", 1988, глава 3. В большинстве случаев коацервация описывается как явление высаливания или фазоразделения лиофильных коллоидов скорее на капли жидкости, чем на твердые агрегаты. Коацервация полимерного ингредиента может вызываться целым рядом различных факторов, например изменением температуры, изменением рН, добавлением низкомолекулярного вещества или добавлением второго макромолекулярного вещества. Существуют два вида коацервации: простая коацервация и сложная коацервация. В большинстве случаев простая коацервация обычно происходит в системах, содержащих только один полимерный ингредиент, в то время как сложная коацервация имеет место в системах, содержащих более одного полимерного ингредиента.
В большинстве выпускаемых промышленностью инкапсулятах используется животный желатин для обеспечения требуемой комбинации таких свойств, как способность к плавлению, эластичность и прочность. Однако в некоторых случаях использование животного желатина может быть нежелательным с точки зрения возможной передачи болезни, такой, например, как бешенство коров в Европе.
Основными источниками желатина служат отходы переработки туш крупного рогатого скота и свиней, хотя в литературе в качестве альтернативных, малых по объемам источников желатина названы также отходы от переработки рыбы и птицы. Источник желатина может стать проблемой в некоторых областях его потенциального применения или для некоторых групп потребителей. Большие группы населения земного шара не употребляют в пищу никаких продуктов из свинины (например, вегетарианцы, евреи и мусульмане) или говядины (индусы и вегетарианцы). В случае лечебных средств и/или пищевых добавок в желатиновых капсулах источник желатина не указывается, поэтому в регионах, где религиозные убеждения требуют знания происхождения желатина, введено ограничение на употребление капсул. В дополнение к этому в этих регионах отмечается некоторый спад потребительского спроса на субпродукты без контролируемого указания вида скота. Отсюда вытекает, что существует потребность в композициях, способных заменить желатин и не имеющих животного происхождения.
Предложен ряд методов капсулирования, которые не предусматривают использования желатина, получаемого из отходов производства говядины или свинины.
WO 96/20612 описывает инкапсулят на основе рыбьего желатина. Хотя рыбий желатин позволяет избежать применения желатина из отходов производства говядины или свинины, однако источник рыбьего желатина все же имеет животное происхождение. Рыбий желатин может вызывать аллергические реакции у некоторых людей, употребляющих его в пищу, что осложняет его массовое использование в пищевых продуктах.
С.Schmitt, С.Sanchez, F.Thaoma и J.Hardy в "Food Hydrocolloids", 13 (1999), с.483-496, описывают сложную коацервацию между бета-лактоглобулином и камедью акации в водной среде. В этой публикации описывается получение коацерватов указанных ингредиентов, но ничего не говорится о производстве капсул с липофильным содержимым.
WO 96/38055 описывает инкапсулированную композицию на основе сухой матрицы, содержащую аромат или активный ингредиент в матрице, включающей изолят белка молочной сыворотки. Изолят белка молочной сыворотки обычно содержит большое количество лактозы и солей.
WO 97/48288 описывает инкапсулят, состоящий из внутреннего содержимого и покрывающего его слоя, который содержит белок, обладающий комбинацией гидрофобных и гидрофильных свойств и выбираемый из группы, состоящей из изолята соевого белка, изолята белка молочной сыворотки, казеината и их смесей. Инкапсуляты производятся способом, который предусматривает денатурацию белка.
Краткое описание изобретения
Целью изобретения является обеспечение стабильного инкапсулирования липофильных соединений. Другой целью изобретения является получение инкапсулятов, которые обеспечивают повышенную биодоступность соединений, заключаемых в капсулу, по сравнению с известными инкапсулятами. Следующей целью является обеспечение инкапсулятов, которые позволяют отказаться от использования желатина в качестве ингредиента. Еще одной целью изобретения является обеспечение инкапсулятов меньшего диаметра.
Одна или более указанных целей достигаются согласно изобретению, которое обеспечивает сложный инкапсулят-коацерват, состоящий из липофильного содержимого и гидрофильной оболочки, при этом оболочка полностью покрывает внутреннее содержимое, характеризующийся тем, что оболочка состоит в основном из бета-лактоглобулина и одного или более полимеров, изоэлектрическая точка которых ниже изоэлектрической точки бета-лактоглобулина.
Инкапсулирование согласно изобретению предпочтительно предусматривает применение β-лактоглобулина, его партнера по коацервации, такого как казеинат, и предпочтительно агента поперечной сшивки, такого как трансглютаминаза.
Подробное описание изобретения
Для получения сложного инкапсулята-коацервата согласно изобретению используются β-лактоглобулин и один или более полимеров, изоэлектрическая точка которых ниже изоэлектрической точки β-лактоглобулина.
Используемый в изобретении β-лактоглобулин может представлять собой выпускаемый промышленностью β-лактоглобулин, например, от фирмы Sigma, Нидерланды. Альтернативно β-лактоглобулин может быть получен из молочных продуктов, например из белка молочной сыворотки, в частности из изолята белка молочной сыворотки.
Полимер, имеющий изоэлектрическую точку (IEP) ниже изоэлектрической точки β-лактоглобулина, может представлять собой любой полимер с требуемой IEP. В контексте описания этот полимер обозначается как анионный полимер. Бета-лактоглобулин и анионные полимеры в контексте описания обозначаются в совокупности как оболочечные полимеры.
Предпочтительно анионный полимер должен хорошо усваиваться в человеческом организме.
Примерами пригодных для данной цели усвояемых анионных полимеров (в скобках указана IEP) являются казенны и казеинаты (4,1-4,5), альфа-лактоглобулин (4,2-4,5), сывороточный альбумин (4,7), соевый глиценин (4,9), соевый бета-конглиценин (4,6), гуммиарабик, каррагинан и пектин (3-4).
IEP бета-лактоглобулина составляет 5,1-5,2.
Соотношение и общая концентрация биополимеров подбираются таким образом, чтобы можно было получить коацерваты, способные формировать достаточно гомогенную и толстую гидрофильную оболочку.
Предпочтительно отношение (мас./мас.) бета-лактоглобулина к общей массе анионных полимеров составляет 1-5, более предпочтительно - 1,5-3, наиболее предпочтительно - 2-2,4.
Предпочтительно отношение (мас./мас.) оболочечного материала/материалов (бета-лактоглобулин и анионный полимер(ы)) к общей массе липофильного материала содержимого должно быть порядка 0,15 или выше, более предпочтительно - выше 0,2, наиболее предпочтительно - от 0,25 до 0,5.
Предпочтительно бета-лактоглобулин и анионные полимеры в основном не содержат солей (<0,1 (мас./мас.) в пересчете на общую массу сухих оболочечных полимеров).
Предпочтительно анионный полимер состоит из казеината или производного казеина. Инкапсуляты согласно изобретению, содержащие бета-лактоглобулин и казеинат, высоко чувствительны к протеолитической активности в желудке человека. Поэтому их разрушение и высвобождение из них внутреннего содержимого происходит значительно раньше, чем из инкапсулированных продуктов на основе модифицированного желатина (сшитого). Известно, что желатин более устойчив к протеолитической активности желудочного пепсина, но не дуоденальных протеаз. Эта временная разница в высвобождении между желатинсодержащими и не содержащими желатина инкапсулятами обусловливает более быстрое растворение заключенных в не содержащую желатина капсулу агентов в содержимом желудка, что проявляется в улучшении биодоступности соединений, для которых растворение всегда было стадией, лимитирующей степень биодоступности.
С другой стороны, коацерваты согласно изобретению могут с успехом использоваться в целях замедленного переваривания липофильного содержимого или его компонентов по сравнению с перевариванием этих компонентов при свободном диспергировании их в пищевом продукте.
Липофильное содержимое представляет собой преимущественно масло или масло, включающее маслорастворимые или диспергированные в масле соединения.
Предпочтительно в состав коацервата входят материалы пищевого качества и допущенные к применению в пищевых продуктах.
Предпочтительно сложный инкапсулят-коацерват является стабильным в ходе производства, обработки и хранения пищевой композиции.
Оболочка коацервата преимущественно поперечно сшивается, предпочтительно с помощью трансглютаминазы.
Средний размер частиц инкапсулята составляет предпочтительно 50 мкм или менее, более предпочтительно - 10 мкм или менее.
Изобретение относится также к способу получения сложного инкапсулята-коацервата, согласно которому рН эмульсии масляной фазы в водном растворе или дисперсии бета-лактоглобулина и одного или более полимеров, изоэлектрическая точка которых ниже изоэлектрической точки бета-лактоглобулина, изменяется таким образом, чтобы образовался сложный коацерват бета-лактоглобулина и полимера.
Изобретение относится также к пищевым композициям, содержащим сложные инкапсуляты-коацерваты, полученные как описано выше. В указанных пищевых композициях коацерваты присутствуют предпочтительно в форме агрегатов. Средний размер частиц агрегатов составляет преимущественно от 10 до 100 мкм.
Согласно предпочтительному варианту осуществления изобретения липофильное содержимое удерживается внутри гидрофильной оболочки в ходе обработки и/или хранения, но высвобождается в процессе пищеварения в желудочно-кишечном тракте млекопитающих.
Под «стабильным» в контексте описания понимается стабильность липофильных соединений к вытеканию из оболочки. Стабильность к вытеканию или «ретенция» может дать ряд преимуществ в рамках качества в процессе обработки и хранения, например, пищевых продуктов, содержащих эти капсулы. Преимущества могут заключаться в том, что содержимое становится менее чувствительным к химическим реакциям, таким как окисление, а при употреблении композиции в пищу вкус содержимого не будет ощущаться потребителем и показатели композиции останутся без изменений в процессе хранения.
Для достижения сложной коацервации (при определенном рН) один из видов (био)полимеров должен нести положительный заряд, а другой - отрицательный заряд. В процессе сложной коацервации значение рН лежит в диапазоне между соответствующими IEP биополимеров. Это означает, что IEP предпочтительно далеко отстоят друг от друга. Требуемый рН сложной коацервации зависит от концентраций полимеров.
Большинство биополимеров имеют низкую IEP, однако существует несколько биополимеров с высокой IEP. Бета-лактоглобулин имеет высокую IEP, она составляет 5,1-5,2.
β-лактоглобулин предпочтительно должен быть чистым, т.е. не содержать примесей, насколько это возможно. Образцы выпускаемых промышленностью изолятов белка молочной сыворотки имеют как правило высокое содержание α-лактальбумина, соли и лактозы, поэтому такие биополимеры менее пригодны для сложной коацервации.
Другим преимуществом β-лактоглобулина является то, что он не животного происхождения (т.е. его получают не из кожи или костей) в отличие от желатина. Следует упомянуть еще одно преимущество β-лактоглобулина: способ получения сложных инкапсулятов-коацерватов включает образование эмульсии типа «масло в воде». β-лактоглобулин облегчает образование такой эмульсии по сравнению с желатином.
Сведения, подтверждающие возможность осуществления изобретения
Примеры
Примеры 1-4
А. Получение сложных инкапсулятов-коацерватов
Сложные инкапсуляты-коацерваты с использованием β-лактоглобулина (производства фирмы Sigma, Нидерланды) и гуммиарабика (фирмы MERCK, Нидерланды) или казеината натрия (фирмы DMV, Нидерланды) с синтезированным β-каротином в качестве функционального ингредиента получали следующим образом:
10,5 г β-лактоглобулина и 4,9 г казеината натрия добавляли к 705 г деминерализованной воды. Смесь нагревали при перемешивании до 55°С.
1,5 г β-каротина (30% дисперсия в подсолнечном масле; от фирмы Roche, Швейцария) помещали в стеклянный стакан на 3 л, добавляли 43,5 г подсолнечного масла и полученную смесь подвергали тепловой обработке при 60°С в течение 2 часов в условиях перемешивания.
К вышеупомянутым растворам β-лактоглобулина добавляли смесь масла с каротином. Общую смесь перемешивали с помощью мешалки ultraturrax (во избежание пенообразования) при 55°С до получения однородной эмульсии.
Добавляли 0,1 N HCl до рН 5,1 (при одновременном перемешивании с помощью рифленой мешалки при 55°С), вокруг капель масла формировались коацерваты. При низком рН происходила фактическая коацервация, которую можно было визуально наблюдать под микроскопом. При указанном рН выход был максимальным (он варьировал от эмульсии к эмульсии). Время, необходимое для добавления кислоты, оптимизировали, с целью получения мелких инкапсулятов-коацерватов, примерно до 60 минут.
В. Поперечная сшивка инкапсулятов
B1. Поперечная сшивка с помощью глутарового диальдегида
Смесь инкапсулятов-коацерватов, полученную на стадии А, охлаждали до 20°С в течение 2 часов и смешивали с 1,3 г глутарового диальдегида (50% раствор); полученную смесь перемешивали в течение 18 часов при 20°С. Воду удаляли фильтрацией через складчатый бумажный фильтр.
B2. Поперечная сшивка с помощью трансглютаминазы
Смесь коацерватов, полученную на стадии А, охлаждали до 50°С, добавляли 6,00 г трансглютаминазы (1% на носителе) и полученную смесь перемешивали в течение 17 часов при 50°С. Фермент инактивировали путем тепловой обработки смеси при 65°С в течение 30 минут. Затем смесь охлаждали до 20°С в течение 2 часов, воду удаляли фильтрацией через складчатый бумажный фильтр.
С. Промывка инкапсулятов
Инкапсуляты, полученные на стадии В, промывали водой для удаления остатков глутарового диальдегида или трансглютаминазы. Стадию промывки повторяли несколько раз с целью удаления всего количества сшивающего агента до тех пор, пока в промывной воде не было обнаружено следов указанного агента.
Инкапсуляты суспендировали в воде и смесь вымешивали в течение 30 минут. Воду удаляли фильтрацией через складчатый бумажный фильтр. В промывную воду добавляли 0,1% сорбата калия.
D. Производство пищевого продукта (спреда), содержащего инкапсуляты
Производство спреда осуществляли в лабораторном масштабе в микровотаторе (аппарат для охлаждения в непрерывном режиме). Параметры спреда:
- концентрация β-каротина - 100 мг/кг;
- перед объединением обеих фаз для приготовления предварительной смеси к водной фазе спреда добавляли влажные коацерваты;
- содержание жира в спреде составляло 40% (мас./мас.).
Жировую смесь готовили из следующих ингредиентов, взятых в следующих количествах в пересчете на общее количество жировой смеси:
73% соевого масла,
17% переэтерифицированной жировой композиции
отвержденного пальмоядрового масла,
10% пальмового масла.
Полученную жировую смесь использовали для приготовления жировой фазы следующим образом (количество указано в пересчете на общий готовый продукт):
39,78% вышеуказанной жировой смеси,
0,05% лецитина,
0,16% эмульгатора (диглицериды отвержденного пальмового масла),
0,012% 15% мас.-ной дисперсии бета-каротина в растительном масле.
Ингредиенты водной фазы:
1,1% желатина,
0,48% NaCl,
0,27% кислой сыворотки,
0,12% сорбата калия,
вода - до 100%,
рН устанавливали на уровне примерно рН 5,0 добавлением лимонной кислоты.
Жировую фазу и водную фазу смешивали с получением предварительной смеси, которую пропускали через линию обработки А-А-А-С в следующих условиях.
Предварительную смесь нагревали примерно до 60°С и пропускали через линию обработки, в которой применяли следующие режимы:
Устройство А: 1000 об/мин, при 20°С,
Устройство А: 1000 об/мин, при 14°С,
Устройство А: 1000 об/мин, при 9°С,
Устройство С: 900 об/мин.
Производительность составила 150 кг/ч.
Е. Тест на вытекаемость внутреннего содержимого
Определение концентраций свободно диспергированного и инкапсулированного β-каротина в спреде
К 1,3-1,9 г спреда в колбе добавляли гексан (или петролейный эфир) (10-100 мл гексана в зависимости от содержания β-каротина). Смесь осторожно встряхивали до растворения жировой фазы. Инкапсуляты оставались без изменений (цельными) и гексан не экстрагировал β-каротин. Затем отделяли гексан от инкапсулятов декантацией и переносили их в другую колбу. Эту колбу постепенно наполняли гексаном. Измерение β-каротина в гексане позволяет определить содержание "свободно диспергированного" β-каротина в спреде. К оставшимся инкапсулятам добавляли ацетон. Смесь интенсивно перемешивали до полной экстракции всего β-каротина из инкапсулятов ацетоном, что можно было визуально наблюдать по обесцвечиванию инкапсулятов. Измерение β-каротина в ацетоне позволяет определить содержание "инкапсулированного" β-каротина в спреде.
УФ-измерения
Для измерения содержания инкапсулированного β-каротина образцы фильтровали через фильтр с диаметром отверстий 0,22 мкм для удаления тонких частиц. Для измерения содержания свободного β-каротина образцы направляли непосредственно на измерения без фильтрации. Измерения проводили в 1-см стеклянной кювете. Максимальное значение абсорбции при длине волны примерно 460 нм использовали для расчете содержания β-каротина по следующей эмпирической формуле:
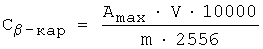
где Сβ-кар - концентрация β-каротина [мг/кг],
Amax - максимальное значение абсорбции при 460 нм [-],
V - объем образца [мл],
m - масса образца [г].
Вытекаемость β-каротина из инкапсулятов в матрицу спреда определяли по содержанию β-каротина в инкапсулятах в спреде и свободно диспергированного β-каротина в спреде. Расчет проводили по следующей формуле:
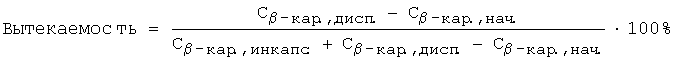
где Сβ-кар.,дисп - концентрация β-каротина, свободно диспергированного в спреде [мг/кг],
Сβ-кар.,инкапс - концентрация инкапсулированного β-каротина в спреде [мг/кг],
Сβ-кар.,нач - концентрация β-каротина, свободно диспергированного в спреде, добавленного в качестве красителя [мг/кг].
Примеры 5-6
Процедуру приготовления в примерах 1-4 повторяли с внесением следующих модификаций: на стадии А в настоящих примерах 10,3 г β-лактоглобулина и 4,6 г гуммиарабика добавляли к 678 г деминерализованной воды. Смесь нагревали в условиях перемешивания до 55°С.
Сравнительные эксперименты А-В
Процедуру приготовления в примерах 1-4 повторяли с внесением следующих модификаций: на стадии А-В 20,5 г Hyprol 8100 (изолят белка молочной сыворотки, содержащий ≈ 9,8 г β-лактоглобулина) и 4,9 г гуммиарабика добавляли к 720 г деминерализованной воды. Смесь нагревали в условиях перемешивания до 55°С.
В примерах 1-6 получали коацерваты, имеющие средний диаметр примерно 10 мкм.
Результаты примеров 1-6 и сравнительных А-В представлены в таблице 1.
Из результатов, представленных в таблице 1, видно, что когда инкапсуляты, приготовленные из β-лактоглобулина и гуммиарабика или казеината, сшивались глутаровым диальдегидом или трансглютаминазой, то вытекаемость β-каротина значительно снижалась по сравнению с несшитыми инкапсулятами. Кроме того, замена гуммиарабика казеинатом не влияла на вытекаемость β-каротина из сшитого инкапсулята.
Инкапсуляты, приготовленные из Hyprol (сравнительные эксперименты А и В), показали высокую степень вытекаемости β-каротина даже после сшивки глутаровым диальдегидом.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОАЦЕРВАТНЫЕ КОМПЛЕКСЫ, СПОСОБЫ И ПИЩЕВЫЕ ПРОДУКТЫ | 2012 |
|
RU2564241C2 |
| КАПСУЛЫ СО СТРУКТУРОЙ ЯДРО-ОБОЛОЧКА | 2012 |
|
RU2665380C2 |
| КОМПОЗИЦИЯ КОРМА ДЛЯ ЖИВОТНЫХ, СОДЕРЖАЩАЯ ИНКАПСУЛИРОВАННЫЙ ГЛЮКОНО-ДЕЛЬТА-ЛАКТОН | 2013 |
|
RU2650570C2 |
| КАПСУЛЫ-КОАЦЕРВАТЫ С ТВЕРДЫМ ЯДРОМ | 2011 |
|
RU2636510C2 |
| СПОСОБ ОБРАБОТКИ ВОЛОКОН И/ИЛИ ТЕКСТИЛЬНЫХ МАТЕРИАЛОВ | 2011 |
|
RU2556670C2 |
| ПРИРОДНЫЕ ИНКАПСУЛИРОВАННЫЕ АРОМАТИЗИРУЮЩИЕ ПРОДУКТЫ | 2017 |
|
RU2747237C2 |
| ПРОЦЕСС ОДНОВРЕМЕННОЙ МНОЖЕСТВЕННОЙ АЦЕРВАЦИИ | 2009 |
|
RU2577968C2 |
| ТВЕРДЫЕ ЧАСТИЦЫ СИМЕТИКОНА И ИХ ДОЗИРОВАННАЯ ФОРМА | 2018 |
|
RU2790260C2 |
| Способ коацервации дигидрокверцетина | 2023 |
|
RU2805649C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИКРОКАПСУЛ | 1972 |
|
SU331563A1 |
Изобретение относится к пищевой промышленности. Сложный инкапсулят-коацерват, состоит из липофильного содержимого и гидрофильной оболочки. При этом оболочка полностью покрывает внутреннее содержимое и состоит в основном из бета-лактоглобулина и одного или более полимеров, изоэлектрическая точка которых ниже изоэлектрической точки бета-лактоглобулина. Пищевая композиция содержит сложные инкапсуляты-коацерваты. Эмульсия масляной фазы в водном растворе или дисперсии бета-лактоглобулина и одного или более полимеров, изоэлектрическая точка которых ниже изоэлектрической точки бета-лактоглобулина, подвергается изменению рН так, что образуется сложный инкапсулят-коацерват. Изобретение позволяет получить стабильные инкапсуляты липофильных соединений. 3 н. и 15 з.п. ф-лы, 1 табл.
| WO 0241711 A, 30.05.2002 | |||
| СПОСОБ ПОЛУЧЕНИЯ КАПСУЛ АРОМАТИЧЕСКОГО МАСЛА И СПОСОБ АРОМАТИЗАЦИИ ПИЩЕВЫХ ПРОДУКТОВ | 1993 |
|
RU2089076C1 |
| Способ получения микрокапсул | 1973 |
|
SU482187A1 |
Авторы
Даты
2008-08-27—Публикация
2003-11-17—Подача