Изобретение относится к фармакологии, а именно к пищевым добавкам и лекарственным препаратам противоишемического и гиполипидемического действия, и может быть использовано в качестве нового средства для коррекции нарушений липидного обмена с целью профилактики и лечения дислипидемий, ишемической болезни сердца (ИБС), а также в качестве реабилитационного средства при послеинфарктных состояниях.
Известны несколько групп липидемических препаратов: статины (ингибиторы синтеза холестерина), фибраты, никотиновая кислота, секвестранты желчных кислот, полиненасыщенные жирные кислоты, антиоксиданты (Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. Разработаны Комитетом экспертов Всероссийского научного общества кардиологов. Секция атеросклероза ВНОК. Москва, 2004. 36 С.).
Секвестранты (сорбенты) жирных кислот (СЖК) - холестирамин и колестипол - представляют собой анионообменные смолы, не растворимые в воде и не всасывающиеся в кишечнике. СЖК обладают в основном холестеринпонижающим эффектом. Основной механизм действия СЖК заключается в связывании холестерина (ХС) и желчных кислот, которые синтезируются из ХС в печени. СЖК вызывают дополнительное образование желчных кислот и обеднение печени ХС. При терапии СЖК уровень общего ХС понижается на 10-15%, а липопротеидов низкой плотности (ЛПНП) - на 15-20%. Одновредменно наблюдается небольшое (на 3-5%) повышение уровня липопротеидов высокой плотности (ЛПВП). Недостатком и ограничением применения СЖК является их способность повышать уровень триглицеридов (ТГ). Поэтому препараты этой группы холестирамин и колестипол с осторожностью назначают больным с сопутствующей гипертриглицеридемией (Джанашия П.Х., Назаренко В.А., Николенко С.А. Дислипопротеидемии: клиника, диагностика, лечение. Москва, 2000).
В группу фибратов входят ряд препаратов: клофибрат (в настоящее время вытеснен другими препаратами этого ряда), гемфиброзил, безафибрат, ципрофибрат и фенофибрат. Эти препараты усиливают катаболизм липропротеидов очень низкой плотности (ЛПОНП), а также угнетают синтез ЛПНП и усиливают выведение ХС с желчью. Действуя на метаболизм ЛПОНП, основным эффектом этих препаратов является понижение уровня ТГ (на 20-50%). Уровень ХС и ЛПНП снижается на 10-15%, а содержание ЛПВП несколько увеличивается. Одним из факторов, сдерживающих применение фибратов в целях профилактики ИБС, является отсутствие данных, которые позволили бы утверждать, что длительная терапия фибратами приводит к увеличению выживаемости больных ИБС (Джанашия П.Х., Назаренко В.А., Николенко С.А. Дислипопротеидемии: клиника, диагностика, лечение. Москва, 2000).
Известно, что в повышенных дозах (3-5 г в день) гиполипидемическим действием обладает никотиновая кислота, которая в равной степени уменьшает содержание ХС и ТГ. Известная пролонгированная форма никотиновой кислоты - эндурацин. Имеются данные, что в группе больных, принимавших никотиновую кислоту, в отдаленном периоде смертность от всех причин была на 11% ниже по сравнению с группой плацебо. В то же время никотиновая кислота противопоказана у больных сахарным диабетом и подагрой (Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. Разработаны Комитетом экспертов Всероссийского научного общества кардиологов. Секция атеросклероза ВНОК. Москва, 2004. 36 С.).
Для лечения нарушений липидного обмена испытывался и целый ряд других средств, в числе которых были природные и синтетические антиоксиданты (витамины А, Е, С, пробукол), препараты, содержащие полиненасыщенные жирные кислоты (максепа, эйконол), гормонально-заместительные препараты (эстрогены); ряд пищевых добавок (чеснок). Однако по результатам обширных клинических исследований впечатляющих результатов от большинства перечисленных препаратов не получено (Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. Разработаны Комитетом экспертов Всероссийского научного общества кардиологов. Секция атеросклероза ВНОК. Москва, 2004. 36 С.).
В арсенале современных гиполипидемических средств наиболее эффективными препаратами являются статины, получаемых как из продуктов жизнедеятельности грибковой флоры, так и синтетическим путем. В настоящее время в России используются ряд препаратов данной группы: ловастатин (Mevacor®), симвастатин (Zocor®), правастатин (Lipostat®), аторвастатин (Liprimar®), флувастатин (Lescol®). Статины отличаются друг от друга физико-химическими (гидрофильно-гидрофобным балансом молекул) и фармакологическими свойствами. Эти свойства обеспечивают различную проходимость препаратов через клеточные мембраны клеток. Ловастатин и симвастатин поступают в печень в виде пролекарства и затем превращаются в активную форму, которая действует как ингибитор ГМГ-КоА-редуктазы, одного из ключевых ферментов синтеза ХС. Все другие препараты этого ряда поступают в организм в активной форме. Наиболее выраженным влиянием на уровень липидов плазмы крови, чем другие статины, обладает новый ингибитор ГМГ-КоА-редуктазы аторвастатин (Пфайзер, Германия), который выбран нами за прототип. Доказано, что статины хорошо переносятся, однако их прием может сопровождаться побочными реакциями в виде болей в животе, метеоризма и запоров. Наиболее опасным осложнением терапии статинами является рабдомиолиз или распад мышечной ткани с возможным повреждением почечных канальцев. В этих случаях терапия статинами должна быть немедленно прекращена (Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации. Разработаны Комитетом экспертов Всероссийского научного общества кардиологов. Секция атеросклероза ВНОК. Москва, 2004. 36 С.). Другим фактором, сдерживающим применение статинов в отечественной медицинской практике, является дороговизна этих препаратов.
Задачей настоящего изобретения является расширение арсенала средств гиполипидемического и противоишемического действия, получение препарата низкой себестоимости из доступного растительного сырья за счет высокого содержания действующего вещества и воспроизводимости сырьевой базы.
В этом состоит технический результат.
Технический результат достигается тем, что в качестве гиполипидемического и противоишемического средства применяют экдистероидсодержащую субстанцию Серпистен, выделенную из надземной части растений серпухи венценосной Serratula coronata L. (Asteraceae), представляющую собой смесь 20-гидоксиэкдизона в количестве не менее 75% и 25S-инокостерона в количестве не менее 10%.
Известна смесь экдистероидов, выделенных по способу, описанному в патенте РФ №2153346, содержащая 20-гидроксиэкдизона - не менее 75% и 25S-инокостерона - не менее 10% со структурными формулами, указанными ниже, являющихся действующими веществами, проявляющими физиологическую активность, сходную по величине с препаратом-аналогом.
Предлагаемое средство, названное нами Серпистен, представляет собой белый кристаллический порошок, не имещий запаха, мало растворимый в воде, хорошо растворимый в метаноле и 70%-ном этаноле.
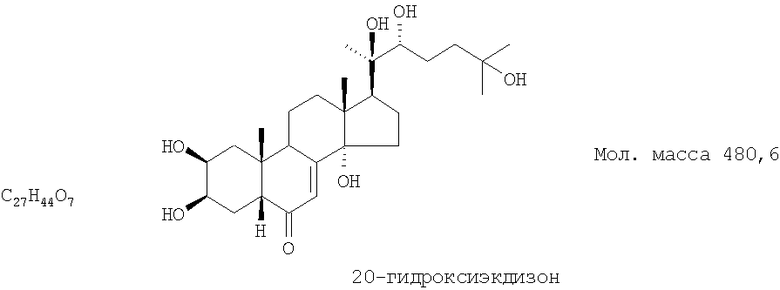
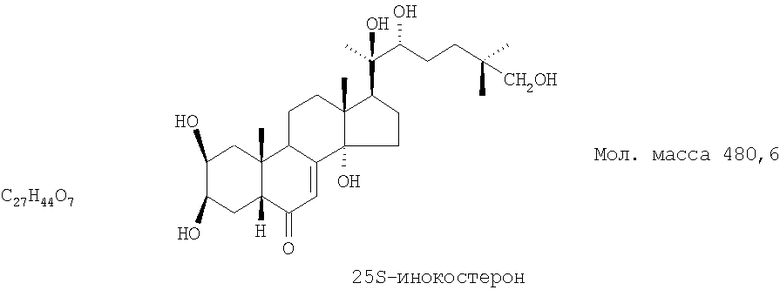
Смесь фитоэкдистероидов получают известным способом (по патенту 2153346) следующим образом.
Заготовку сырья, предпочтительно листьев, осуществляют в фазу вегетации, массовой бутонизации или начала цветения. Экспериментально установлено, что в эти фазы развития содержание действующих экдистероидов максимально. Исследование распределения экдистероидов в растениях серпухи венценосной проводили у средневозрастных генеративных особей. По содержанию экдистероидов серпуха венценосная намного превосходит рапонтик сафлоровидный. Использование надземной части растения в отличие от корневищ рапонтика значительно облегчает заготовку и переработку экдистероидсодержащего растительного сырья.
Измельченное растительное сырье (надземная часть растения рода Serratula семейства Asteraceae) неоднократно экстрагируют водой при температуре не выше 100°С не более 1 ч при постоянном перемешивании и соотношении сырье:экстрагент - 1:10 соответственно. Густой водный экстракт упаривают при пониженном давлении, обрабатывают смесью этилацетат-метанол, взятой при соотношении 4:1, или хлороформ-метанол при соотношении 6:1. Процедуру повторяют до полного извлечения экдистероидов из густого экстракта. Органические извлечения упаривают досуха, затем экдистероиды очищают путем хроматографии на оксиде алюминия в системе хлороформ-метанол или этилацетат-метанол возрастающей полярности и перекристаллизацией в системе этилацетат-метанол или этилацетат-этанол при соотношении 9:1.
Пример осуществления способа.
6 кг измельченных листьев растения рода Serratula семейства Asteraceae заливают 60 л воды и экстрагируют в течение 1 часа при температуре 50°С при постоянном перемешивании, затем экстракт сливают, а растительное сырье подвергают повторной экстракции. Объединенный экстракт упаривают в вакуумном роторно-пленочном испарителе при пониженном давлении до 2 л. 2 л густого экстракта обрабатывают трижды 8 л смеси этилацетат-метанол при соотношении 4:1 при постоянном перемешивании и фильтруют. Фильтрат упаривают досуха, остатки объединяют и переносят на колонку с оксидом алюминия и элюируют смесью хлороформ-метанол возрастающей полярности. Элюат собирают в колбы по 1 л и определяют в них содержание экдистероидов методом тонкослойной хроматографии (ТСХ). Целевые фракции, содержащие экдистероиды, упаривают досуха и перекристаллизовывают в смеси этилацетат-метанол (9:1).
Таким образом, способ позволяет получать субстанцию Серпистен, представляющую собой смесь фитоэкдистероидов, содержащую не менее 75% 20-гидроксиэкдизона и не менее 10% инокостерона (Белый кристаллический порошок, не имеет запаха, мало растворим в воде (1,9 г/л), хорошо растворим в 70%-ном этаноле (61 г/л) и метаноле (75 (г/л)).
Выход - 42 г или 0,7% к массе сырья, что составляет 70% к теоретически рассчитанному выходу.
Известен способ выделения 20-гидроксиэкдизона и 258-инокостерона (патент РФ 2155599), позволяющий получить индивидуальные соединения из смеси фитоэкдистероидов и смешивать их в эффективном количестве.
Проверка гиполипидемической и противоишемической активности субстанции Серпистен осуществлялась в ЗАО «Адаптоген» (г.Санкт-Петербург) на модели экспериментальной дислипопротеидемии и инфаркта миокарда в профилактическом и лечебном режиме. Эксперименты выполнялись на нелинейных белых крысах-самцах массой 180-230 г, возрастом 3,5-4 месяца.
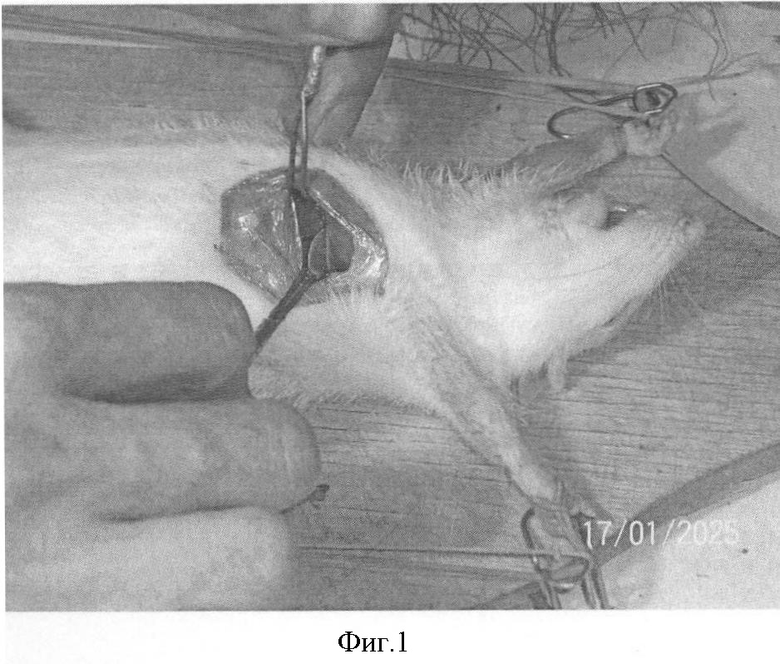
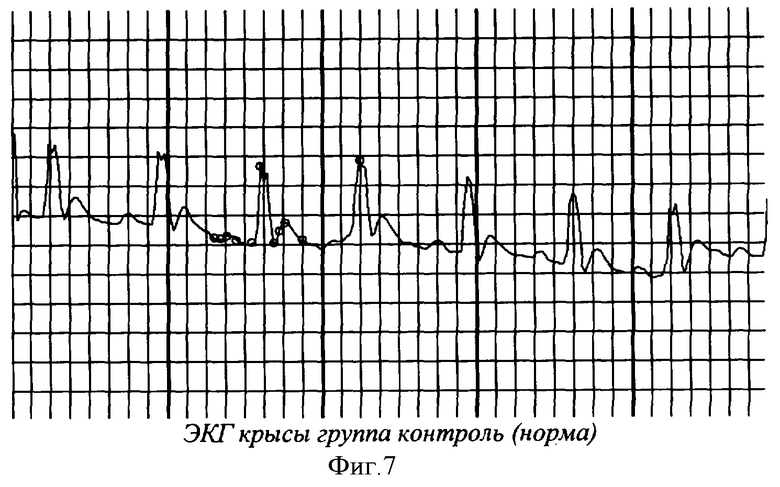
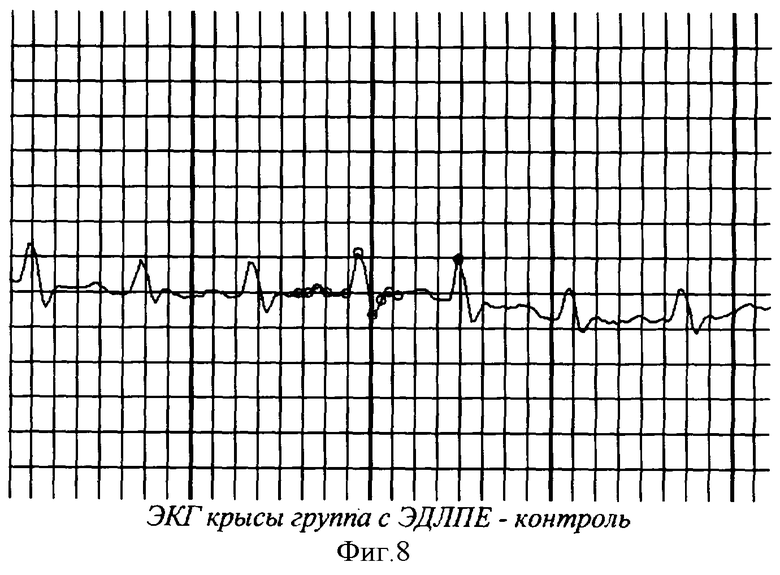
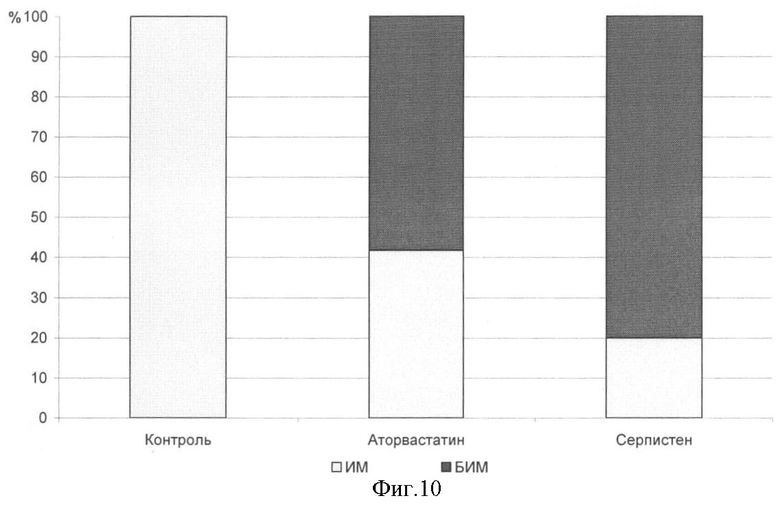
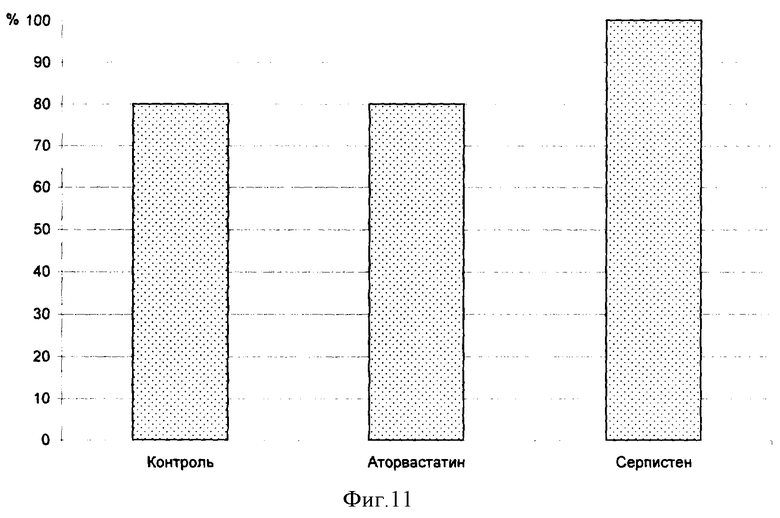
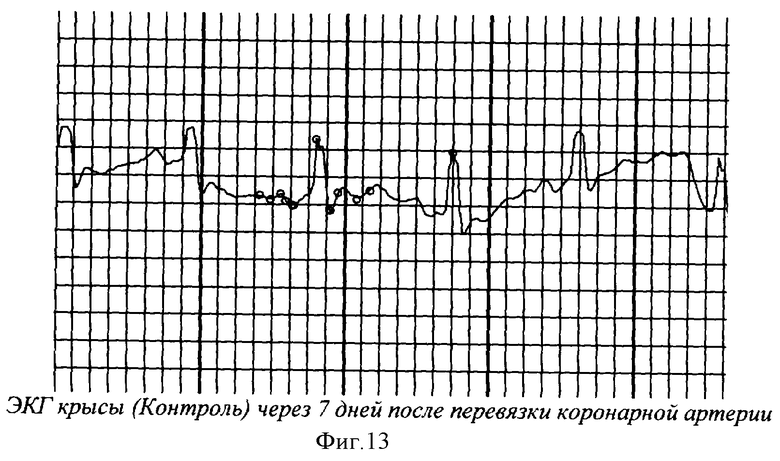
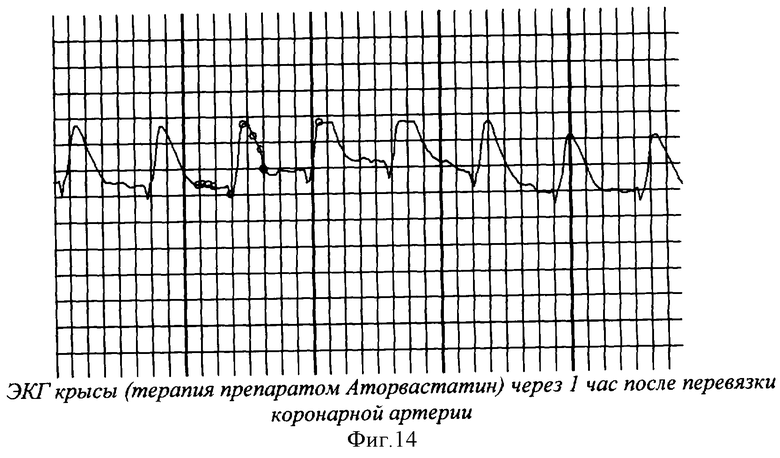
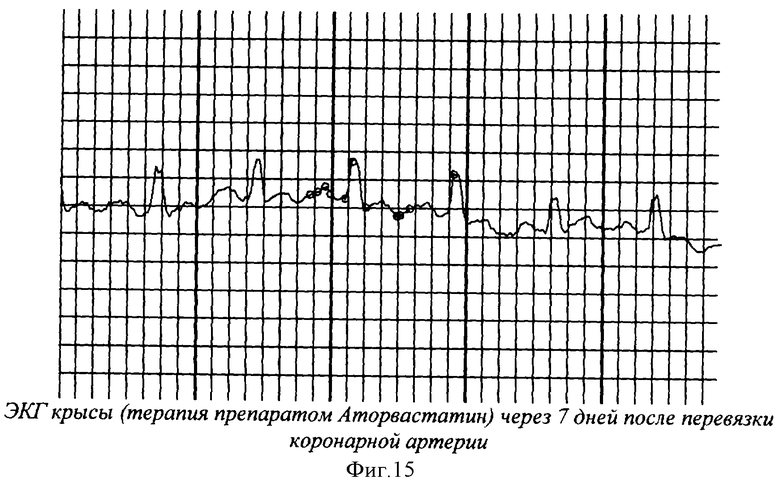
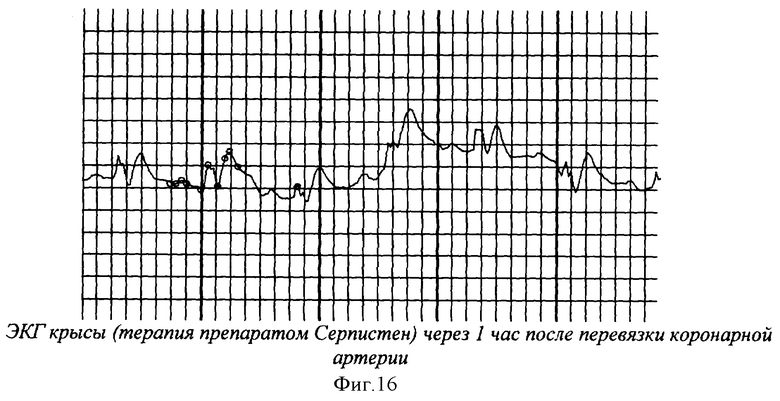
На фиг.1 показана перевязка левой коронарной артерии (экспериментальный инфаркт миокарда) у наркотизированной белой крысы - первый этап - вскрытие грудной клетки. На фиг.2 показан второй этап - лигирование левой коронарной артерии. На фиг.3 - третий этап - ушивание грудной клетки. На фиг.4 заключительный этап - наложение швов на кожу. На фиг.5 представлено снятие ЭКГ у белой крысы через 1 час после перевязки левой коронарной артерии. На фиг.6 - электронная регистрация ЭКГ у белой крысы через 1 час после перевязки левой коронарной артерии. На фиг.7 - ЭКГ крысы, группа - контроль (норма). На фиг.8 - ЭКГ крысы, группа с ЭДЛПЕ - контроль. На фиг.9 - ЭКГ крысы, группа с ЭДЛПЕ + Серпистен. На фиг.10 - частота возникновения экспериментального инфаркта миокарда в экспериментальных группах. На фиг.11 представлена выживаемость экспериментальных животных при ЭИМ на фоне предварительной терапии исследуемыми препаратами. На фиг.12 - ЭКГ крысы группы - контроль через 1 час после перевязки коронарной артерии. На фиг.13 - ЭКГ крысы (контроль), через 7 дней после перевязки коронарной артерии. На фиг.14 - ЭКГ крысы (терапия препаратом Аторвастатин) через 1 час после перевязки коронарной артерии. На фиг.15 - ЭКГ крысы (терапия препаратом Аторвастатин) через 7 дней после перевязки коронарной артерии. На фиг.16 - ЭКГ крысы (терапия препаратом Серпистен) через 1 час после перевязки коронарной артерии. На фиг.17 - ЭКГ крысы (терапия препаратом Серпистен) через 7 дней после перевязки коронарной артерии.
На фиг.18 представлена интактная крыса. Миокард левого желудочка сердца. Отчетливая поперечная исчерченность миофибрилл и четкие ядра кардиомицитов. Окраска по Ван Гизону. Ув. 40×70.
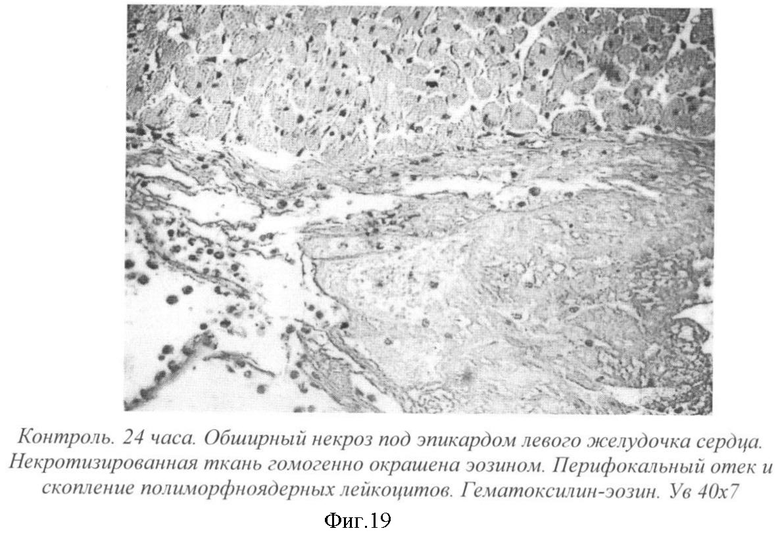
На фиг.19 - контроль. 24 часа. Обширный некроз под эпикардом левого желудочка сердца. Некротизированная ткань гомогенно окрашена эозином. Перифокальный отек и скопление полиморфноядерных лейкоцитов. Гематоксилин-эозин. Ув. 40×7.
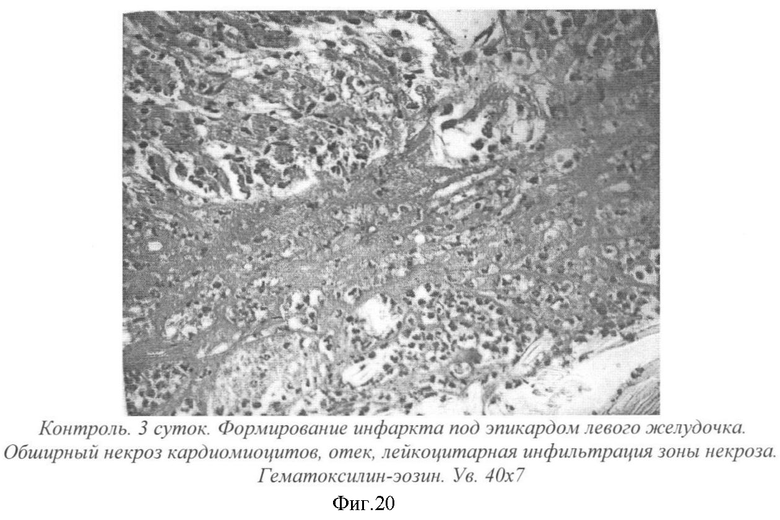
На фиг.20 - контроль. 3 суток. Формирование инфаркта под эпикардом левого желудочка. Обширный некроз кардиомиоцитов, отек, лейкоцитарная инфильтрация зоны некроза. Гематоксилин-эозин. Ув. 40×7.
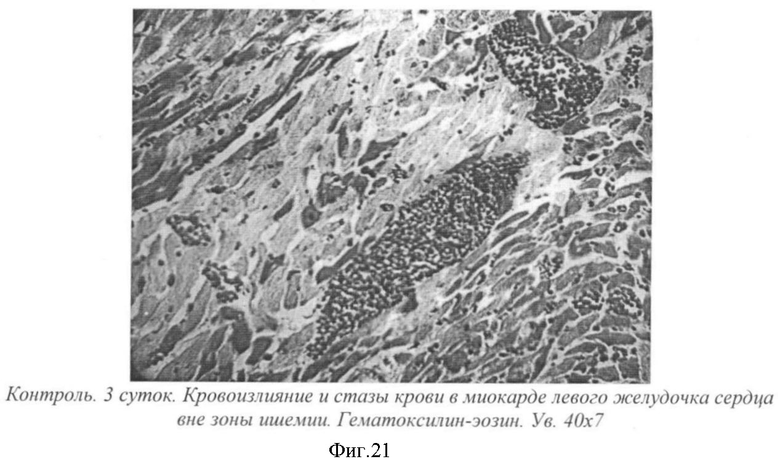
На фиг.21- контроль. 3 суток. Кровоизлияние и стазы крови в миокарде левого желудочка сердца вне зоны ишемии. Гематоксилин-эозин. Ув. 40×7.
На фиг.22 - лечение препаратом Серпистен. 3 суток. Очаг некроза кардиомиоцитов, умеренный отек и лейкоцитарная инфильтрация под эпикардом левого желудочка сердца. Гематоксилин-эозин. Ув. 40×7.
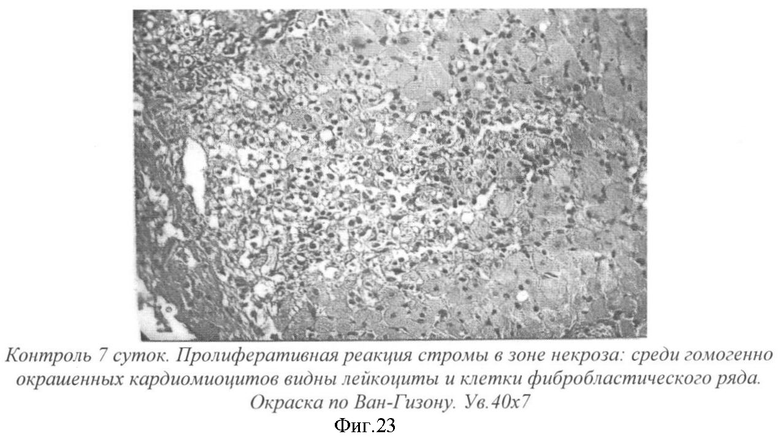
На фиг.23 - контроль. 7 суток. Пролиферативная реакция стромы в зоне некроза: среди гомогенно окрашенных кардиомиоцитов видны лейкоциты и клетки фибробластического ряда. Окраска по Ван-Гизону. Ув. 40×7.
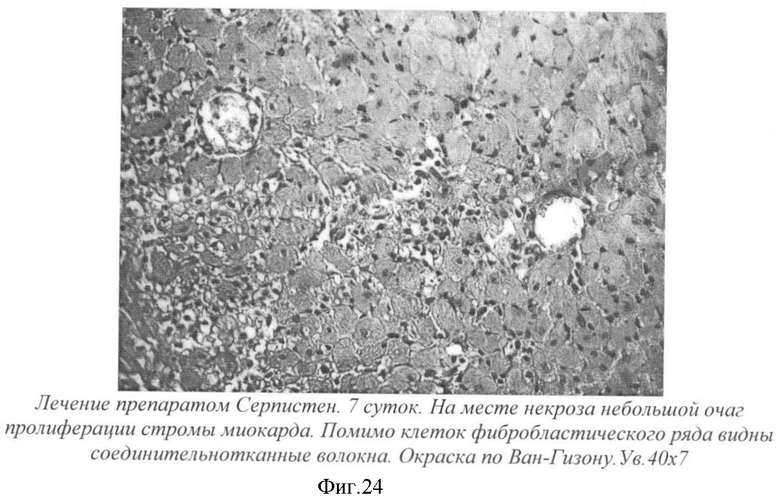
На фиг.24 - лечение препаратом Серпистен. 7 суток. На месте некроза небольшой очаг пролиферации стромы миокарда. Помимо клеток фибробластического ряда видны соединительно-тканные волокна. Окраска по Ван-Гизону. Ув. 40×7.
Карантин. Длительность карантина (акклиматизационного периода) для всех животных составляла 14 дней. В течение карантина проводили ежедневный осмотр каждого животного. Перед началом исследования животные, отвечающие критериям включения в эксперимент, были распределены на группы с помощью метода рандомизации.
Содержание животных. Клетки с животными были помещены в отдельные комнаты. Световой режим: 12 час - свет, 12 час - темнота. Температура воздуха поддерживалась в пределах 19-25°С, относительная влажность - 50-70%. Температура и влажность воздуха регистрировались ежедневно. При изменении погодных условий контролировался воздухообмен в помещении с помощью анемометра и путем измерения содержания в воздухе углекислого газа и аммиака. Был установлен режим проветривания, обеспечивающий около 15 объемов помещения в час, концентрацию СО2 не более 0.15 объемных %, аммиака - не более 0.001 мг/л.
Ежедневный осмотр. В течение исследования каждое животное осматривалось ежедневно. Осмотр включал в себя оценку поведения и общего состояния животных и проводился примерно через 1 час после введения исследуемых веществ.
Моделирование экспериментальной дислипопротеидемии (ЭДЛПЕ).
Для моделирования дислипопротеидемии была использована диета, содержащая в стандартном корме 5% холестерина и 30% насыщенных жиров в виде бараньего жира. Диету применяли в небольших количествах утром, натощак с докармливанием в течение дня. Кроме этого, крысам дополнительно внутрижелудочно вводили 10% масляный раствор холестерина в дозе 100 мг/кг. Холестерин растворяли в переокисленном подсолнечном масле. Длительность диеты составила 24 дня. Интактная группа крыс получала обычную виварную диету. Для верификации полученных изменений в конце этого срока у животных осуществляли забор крови через 6 часов после отнятия корма. Все лабораторные тесты проводились по стандартным методикам [Мед. лаб. технол.]. α-холестерин (α - ХЛ) - унифицированным методом, β-липопротеиды (β-ЛП) (или липопротеиды низкой плотности - ЛПНП) сыворотки крови определяли турбодиметрическим методом; фосфолипиды (ФЛ) - по содержанию общего фосфора.
Экспериментальный инфаркт миокарда (ЭИМ). Моделирование инфаркта миокарда проводили перевязкой левой коронарной артерии по способу [Дьячук Г.И., Лапкина Г.Я., 1992]. Под эфирным рауш-наркозом рассекали кожу и подкожную жировую клетчатку, ткани отделяли по фасции, грудные и межреберные мышцы разъединяли вдоль хода волокон. После вскрытия грудной клетки сердце выводили в операционную рану, левую коронарную артерию прошивали и перевязывали лигатурой. Контроль наступления ишемии миокарда проводили электрокардиографически. После операции рану послойно ушивали (фиг.1-4).
Регистрация электрокардиограмм (ЭКГ). Регистрацию ЭКГ проводили на ненаркотизированных животных с помощью полиграфа RM-6000 (Япония). Крыс помещали в специальные клетки-пеналы из прозрачной пластмассы. В качестве электродов использовали тонкие стальные иглы, введенные подкожно. ЭКГ записывали в I стандартном отведении (фиг.5, 6).
Динамику веса тела крыс определяли на весах ВЛР-500. Сердца животных взвешивали на электронных весах 1602 МР немецкой фирмы «Sartorius».
Содержание восстановленного глутатиона в печени определяли иодометрически [Ellouk-Achard S. et al., 1995], сульфгидрильных групп сыворотки крови - амперометрическим титрованием по [Тимер М., Гедрих И., 1969], содержание гликогена - методом [Кигель Г.Б. Харабаджахьян А.В., 1978].
Кровь для биохимических исследований получали пункцией хвостовой вены крыс.
Активность АлТ, АсТ, КК, ЛДГ сыворотки крови определяли с помощью наборов Био-Ла-Тест Чешской фирмы «Лахема» [Кудрин А.Н., 1953]. Уровень глюкозы в крови и гомогенатах органов определяли ортотолуидиновым методом.
Интенсивность тканевого дыхания в гомогенатах органов определяли манометрическим методом Варбурга [Клиническая..., 1986, Умбрейт В.В., Буррис Р.Х., 1957]. Содержание молочной кислоты определяли по методу Баркера [Подильчак М.Д., 1967], АТФ - хроматографически [Лабораторные методы], а сукцинатдегидрогеназы - по Кигелю [Кигель Г.Б. Харабаджахьян А.В., 1978].
Забитые декапитацией животные подвергались патолого-анатомическому вскрытию и гистологическому исследованию ткани сердца. Сердце фиксировали в 10-15% формалине и заливали в парафин. Парафиновые срезы окрашивали гематоксилин-эозином и по Ван-Гизону.
Состояние антиоксидантной системы животных оценивалось по концентрации диеновых конъюгатов, продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-РП) в плазме крови, активности каталазы и супероксиддисмутазы в эритроцитах.
Оценку концентрации диеновых конъюгатов осуществляли в гептан-изопропанольных экстрактах по методу [Гаврилов В.Г. и др., 1988], концентрацию ТБК-РП в бутанольной фракции проводили по методу [Медицинские..., 2002].
Активность каталазы и суперокисиддисмутазы оценивали в гемолизате эритроцитов по методу [Медицинские..., 2002].
Концентрацию восстановленного глутатиона и активность глутатион-зависимых ферментов (глутатионпероксидаза (ГПО), глутатионредуктаза (ГР), глутатион-S-трансфераза (Г-S-T)) определяли по методикам, описанным в [Медицинские..., 2002].
Статистическую обработку результатов экспериментов проводили по Стьюденту-Фишеру.
Ход эксперимента. Всего было сформировано 4 экспериментальных группы (каждая экспериментальная группа включала по 15 животных):
1. Интактные животные (ложнооперированные)+плацебо.
2. Контрольная группа ЭДЛПЕ + ЭИМ + плацебо;
3. Опытная группа 1 - ЭДЛПЕ + ЭИМ + Аторвастатин (2.0 мг/кг);
4. Опытная группа 2 - ЭДЛПЕ + ЭИМ + Серпистен (5.0 мг/кг);
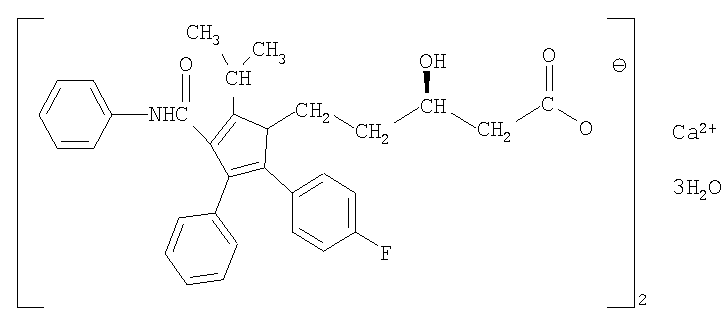
Исследуемые препараты начинали вводить на фоне формирования экспериментальной дислипопротеидемии в течение 24 дней интрагастрально в легкой крахмальной взвеси один раз в сутки до ЭИМ и один раз в сутки курсом 7 дней после ЭИМ. Интактным и контрольным животным (ЭДЛПЕ+ЭИМ) вводили крахмальную взвесь. Сравнительный анализ показателей проводили с препаратом Аторвастатин со структорной формулой.
Распределение экспериментальных животных по группам и исследуемым показателям представлено в таблице 1.
Пример 1. Динамика электрокардиограмм (ЭКГ) в условиях ЭДЛПЕ на фоне терапии субстанцией Серпистен.
Результаты исследования динамики ЭКГ не выявили практически никаких различий между исследуемыми группами до начала моделирования экспериментальной дислипопротеидемии (таблица 2, фиг.7).
Аритмии в экспериментальных группах не зарегистрировано.
После формирования экспериментальной дислипопротеидемии на фоне терапии исследуемыми препаратами во всех группах (кроме интактных животных) наблюдалось достоверное увеличение амплитуды зубца R в 2 раза, что, вероятно, свидетельствует о компенсаторном повышении сократительной силы миокарда с развитием гипертрофии в условиях повышенной нагрузки за счет ЭДЛПЕ и, как следствие, нарушении коронарного кровотока. Достоверных изменений вольтажа зубцов Р и S не зарегистрировано. Изменений проводимости не отмечено (таблица 3). Аритмии в экспериментальных группах не зарегистрировано.
Следует отметить изменение во всех экспериментальных группах зубца Т и сегмента ST по сравнению с интактными животными. Во всех экспериментальных группах с ЭДЛПЕ наблюдалась инверсия зубца Т, депрессия сегмента ST (фиг.8,9). В контрольной группе величина инверсии Т составила 0.34±0.06 мм, которая наблюдалась у 40%. Данные изменения свидетельствуют о развитии коронарной недостаточности средней степени на фоне ЭДЛПЕ.
На фоне терапии препаратом Аторвастатин процент животных с депрессией ST был достоверно ниже в 2 раза, а величина инверсии Т достоверно в 3 раза меньше по сравнению с контролем.
На фоне терапии препаратом Серпистен процент животных с депрессией ST был достоверно ниже в 3 раза, а величина инверсии Т достоверно в 6 раз меньше по сравнению с контролем.
Как свидетельствуют представленные данные, терапия исследуемыми препаратами улучшает коронарный кровоток в условиях экспериментальной дислипопротеидемии.
Обозначение (**) - р<0.05 по сравнению с контрольной группой.
Пример 2. Влияние субстанции Серпистен на частоту возникновения экспериментального инфаркта миокарда.
Анализ ЭКГ выявил распределение животных в опытных группах в зависимости от регистрации подъема сегмента ST, что характеризует наличие экспериментального инфаркта миокарда у животных, с выделением в каждой опытной группе подгрупп с зарегистрированным инфарктом миокарда (ИМ) и без электрокардиографических признаков инфаркта миокарда (БИМ) на сроке 1 час (табл.4, фиг.10). В группе ложнооперированных животных подъема сегмента ST не зарегистрировано.
На фоне профилактической терапии Серпистеном наблюдается достоверное снижение частоты возникновения ЭИМ в 5 раз. При применении препарата сравнения Аторвастатина также наблюдалось снижение частоты возникновения ЭИМ, однако менее выраженное (в 2,5 раза).
Об этом косвенно также свидетельствует показатель выживаемости экспериментальных животных при моделировании ИМ (табл.2 и фиг.11).
Выживаемость на фоне терапии препаратом Серпистен была примерно в 1.3 раза выше по сравнению с выживаемостью в контрольной группе.
Величина подъема ST во всех опытных группах достоверно отличается от контроля, причем в группе животных, получавших Серпистен, величина подъема сегмента ST была ниже в 2,6 раза по сравнению с контролем, а в группе Аторвастатина ниже в 1.7 раза.
Уменьшение величины подъема сегмента ST свидетельствует о меньшей площади очага некроза и позволяет зарегистрировать достоверный противоишемический эффект для исследуемого вещества (табл.5, фиг.12)
Снижение ST ниже изолинии (депрессия) характеризует постинфарктные ишемические изменения и свидетельствует о недостаточности кровоснабжения, гипоксии миокарда. Как видно из таблицы 6, выраженность депрессии сегмента ST через 7 дней после ЭИМ достоверно отличается от контроля во всех опытных группах.
В группах животных, получавших терапию исследуемьм веществом, депрессия сегмента ST была менее выражена примерно в 1.5 раза (р<0.05) по сравнению с контролем, а на фоне применения препарата сравнения в 2.6 раза.
Полученные результаты свидетельствуют о наличии противоишемического эффекта у Серпистена и повышении устойчивости миокарда к гипоксии на фоне терапии.
Пример 3. Динамика ЭКГ при терапии субстанцией Серпистен на фоне экспериментального инфаркта миокарда.
При дальнейшем анализе для объективного суждения о влиянии исследуемых препаратов на характер ЭКГ-изменений сравнительный анализ электрокардиографических параметров проводился в выделенных подгруппах: с зарегистрированным ИМ и БИМ.
ЭКГ-характеристика группы (контроль)
Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ в контрольной группе ИМ (без лечения) представлена в таблице 7.
Аритмии не зарегистрировано.
В контрольной группе с ИМ наблюдалась тенденция к отрицательному хронотропному эффекту (снижение ЧСС на 14%) с последующим небольшим повышением в постинфарктный период - 7 дней, как компенсаторное уменьшение кислородного запроса миокарда; увеличение амплитуды зубца R и достоверное увеличение амплитуды зубца Т (в 1.3-2.5 раза, р<0.05) по сравнению со сроком наблюдения до ЭИМ (1 час после ЭИМ), выраженное уменьшение амплитуды зубцов R, S и Т на сроке наблюдения 7 дней (в 2-1.5-2 раза соответственно) по сравнению со сроком наблюдения 1 час, что характеризует угнетение сократительной активности миокарда в постинфарктный период; стойкие прогрессирующие нарушения атриовентрикулярной и внутрижелудочковой проводимости (удлинение PQ и QT на в 1.5-2 раза по сравнению со сроком наблюдения до ЭИМ) (фиг.12, 13).
ЭКГ-характеристика на фоне терапии препаратом Аторвастатин
Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Аторвастатин ИМ представлена в таблице 8.
Аритмия не зарегистрирована.
На фоне терапии препаратом Аторвастатин в группе с ИМ через 1 час наблюдалось достоверное повышение амплитуды зубца R в 1.7 раза, Т - в 2.6 раза и тенденция к повышению амплитуды зубца S (в 2 раза) и достоверное стойкое урежение ЧСС. В постинфарктный период на сроке наблюдения 7 дней наблюдалась нормализация амплитуды зубцов R, S и Т (угнетение сократимости миокарда). Отсутствие регистрируемых нарушений атриовентрикулярной проводимости (PQ). Также наблюдалась тенденция к удлинению внутрижелудочковой проводимости (QT) к 7 дню в 1.3 раза по сравнению со сроком наблюдения до ЭИМ (фиг.14, фиг.15).
Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Аторвастатин БИМ представлена в таблице 9.
Аритмия не зарегистрирована.
В группе БИМ на фоне терапии препаратом Аторвастатин через 1 час после перевязки наблюдались схожие изменения ЭКГ. Через 7 дней - также сохранение высокой амплитуды R, отсутствие снижения Т, что свидетельствует о предотвращении развития некротических изменений, нарушений сократимости миокарда и, наоборот, повышению таковой. Зарегистровано достоверное удлинение атриовентрикулярной проводимости по сравнению с группой ЭИМ и удлинение внутрижелудочковой проводимости в виде тенденции по сравнению со сроком наблюдения до ЭИМ, с нормализацией к 7 дню.
ЭКГ-характеристика на фоне терапии препаратом Серпистен
Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Серпистен ИМ представлена в таблице 10.
Аритмия не наблюдалась.
На фоне терапии препаратом Серпистен через 1 час после ЭИМ наблюдалось достоверное урежение ЧСС в 1.3 раза, снижение амплитуды зубца R в 2 раза, достоверное увеличение амплитуды зубца Т в 3.3 раза по сравнению со сроком наблюдения до ЭИМ. Через 7 дней - наблюдалось достоверное увеличение ЧСС (нормализация) в 1.2 раза по сравнению со сроком наблюдения 1 час, достоверное увеличение амплитуды зубца R в 2.5 раза (нормализация) по сравнению со сроком наблюдения 1 час; стойкое достоверное увеличение амплитуды зубца Т в 3.5 раза по сравнению со сроком наблюдения до ЭИМ, что свидетельствует от повышении сократительной активности миокарда на фоне терапии препаратом Серпистен; достоверное удлинение атриовентрикулярной проводимости в 1.6 раз по сравнению со сроком наблюдения 1 час и по сравнению со сроком наблюдения до ЭИМ (фиг.16-17). Динамика ЧСС и показателей ЭКГ крыс с ЭДЛПЕ на фоне терапии препаратом Серпистен БИМ представлена в таблице 11.
Аритмия не зарегистрирована.
В группе БИМ на фоне терапии препаратом Серпистен через 1 час и через 7 дней после перевязки коронарной артерии наблюдалось достоверное увеличение амплитуды зубца R в 1.5-1.4 раза, стойкое увеличение амплитуды Т в 2-3 раза. Отсутствие изменений атриовентрикулярной и внутрижелудочковой проводимости.
Пример 4. Показатели липидного обмена экспериментальных животных после применения субстанции Серпистен на фоне формирования ЭДЛПЕ и после ЭИМ и недельной терапии.
Полученные результаты подтверждают адекватность использованной модели атеросклероза: в контрольной группе (без лечения) значительно возросло содержание в крови общих липидов, липопротеидов низкой плотности, триглицеридов, холестерина, а содержание фосфолипидов в сыворотке и α-ХЛ, наоборот, снизилось; увеличился коэффициент атерогенности (таблица 12).
Как видно из таблицы 12, применение Серпистена на фоне ЭДЛПЕ приводило к значительному снижению содержания общих липидов и холестерина, β-ЛП, что хорошо согласуется с данными Lupien et al. [1969] о подавлении синтеза холестерина при применении Серпистена.
Вместе с тем достоверно увеличивалось содержание α-холестерина, практически до уровня интактных животных, и фосфолипидов. Стоит отметить также тот факт, что снижение уровня триглицеридов при применении Серпистена было более выражено, чем при применении Атровастатина, что в целом отражает липолитические свойства исследуемого соединения.
Пример 5. Результаты морфометрических и биохимических исследований на фоне экспериментальной дислипопротеидемии и после ЭИМ и недельной терапии субстанцией Серпистен. Данные представлены в таблицах 13-16.
Оказалось, что ЭИМ характеризуется некоторым снижением массы тела и достоверным увеличением относительной массы сердца. Кроме этого, наблюдались достоверные признаки цитолиза в миокарде: увеличение АЛТ, ACT, KK и ЛДГ в плазме крови (таблица 14).
экспериментальных животных после применения Серпистена на фоне
формирования ЭДЛПЕ и после ЭИМ и недельной терапии, М±m
На фоне формирования ЭДЛПЕ и ЭИМ наблюдалось достоверное увеличение активности индикаторных ферментов в крови, что свидетельствует о поражении кардиомиоцитов, их цитолизе в имшемизированной ткани и хорошо согласуется с данными ЭКГ. На фоне применения Серпистена наблюдалось снижение активности этих ферментов практически до уровня интактных животных.
Также при развитии ЭИМ фиксировались нарушения процессов тканевого дыхания и метаболизма в миокарде: снижались запасы АТФ, гликогена; повышалось содержание недоокисленных продуктов обмена - молочной кислоты; наблюдалась активация свободно-радикальных реакций (увеличение МДА) и снижение уровня антиоксидантной защиты (каталазы, восстановленного глутатиона). Предварительное введение Серпистена и Аторвастатина оказывало кардипротективное действие, причем по ряду показателей эффект Серпистена был несколько более выражен, чем Аторвастатина.
Пример 6. Результаты гистологических исследований на фоне экспериментальной дислипопротеидемии и после ЭИМ и недельной терапии субстанцией Серпистен.
Через 24 часа после операции в миокарде левого желудочка крыс контрольной группы наблюдались общие расстройства кровообращения в виде полнокровия, небольших кровоизлияний, стазов крови в капиллярах, отека. Преимущественно под эпикардом были видны мышечные волокна, интенсивно окрашенные эозином (фиг.19).
На 3-и сутки после операции (у крыс без лечения) в зоне ишемии наблюдалось формирование инфаркта (фиг.20). Под эпикардом левого желудочка сердца наблюдался обширный некроз кардиомиоцитов с отеком и воспалительной инфильтрацией. Некротизированная ткань была гомогенно окрашена эозином в розоватый цвет. Ядра и поперечная исчерченность не выявлялись. В отечной жидкости были видны многочисленные полиморфноядерные лейкоциты. Вне зоны ишемии наблюдались нарушения микроциркуляции в миокарде левого желудочка - стазы крови в капиллярах, кровоизлияния (фиг.21).
У крыс группы Серпистен на 3-и сутки повреждение миокарда носило менее выраженный и распространенный характер. Очаг некроза был небольшим, полиморфноядерные лейкоциты в отечной жидкости были немногочисленными (фиг.22). Нарушения микроциркуляции вне зоны ишемии были выражены слабее.
На 7-й день у крыс без лечения в зоне некроза миокарда, помимо полиморфноядерных лейкоцитов, были видны многочисленные клетки фибробластичекого ряда - гистиоциты, фибробласты, перициты, плазматические клетки, т.е. наблюдалась организация инфаркта, рассасывание некротизированных волокон и замещение участков некроза молодой соединительной тканью, богатой клеточными элементами преимущественно фибробластического ряда. На месте этих очагов пролиферации клеток фибробластического ряда образовывался фиброзный рубец (фиг.23).
У крыс, леченных Серпистеном, на месте некроза миокарда наблюдалась пролиферативная реакция стромы: помимо фибробластов были видны тонкие соединительно-тканные волокна. Очаг пролиферации по сравнению с контролем имел значительно меньшие размеры (фиг.24).
Пример 7. Результаты исследований антиоксидантной системы при ЭДЛПЕ И ЭИМ на фоне терапии субстанцией Серпистен.
О состоянии оксидативного баланса судят по изменению содержания таких первичных и вторичных продуктов перекисного окисления в эритроцитах и плазме крови, как диеновые конъюгаты, шиффовы основания, ТБК-реагирующие продукты. Изменение концентрации продуктов перекисного окисления липидов в плазме крови у крыс с экспериментальной дислипопротеинемией и инфарктом миокарда и на фоне применения Серпистена приведены в таблице 17.
Как видно из представленных в таблице 17 данных, развитие экспериментального инфаркта миокарда сопровождалось значительным усилением перекисного окисления липидов (ПОЛ), по показателям увеличения концентрации диеновых конъюгатов (на 64%) и ТБК-РП (на 231%) в плазме крови.
Под влиянием Аторвастатина концентрация ДК была ниже уровня интактных животных, но концентрация ТБК-РП оставалась выше уровня интактных животных, хотя достоверно отличалась от нелеченных животных.
Применение Серпистена вызывало значительное снижение ТБК-РП, даже более выраженное, чем под влиянием Аторвастатина, однако уровень интактных животных также достигнут не был. В отношении ДК Серпистен имел только тенденцию к снижению, однако достоверных отличий от контрольной группы не выявлено.
Выделяют три главных звена АОС:
1) антирадикальные и антиперекисные ферменты (супероксиддисмутаза, каталаза и некоторые пероксидазы);
2) система глутатиона и связанных с ним биоантиоксидантов: глутатион и ферменты его метаболизма (глутатионпероксидаза, глутатион-S-трансферазы, глутатионредуктаза, глутатиондегидроаскорбатредуктаза, глутатионтокоферилрадикалредуктаза), а также мочевая кислота, аскорбиновая кислота и ее формы, токоферолы, полифенолы, каротиноиды, ретинол и др.;
3) структурные биоантиоксиданты, антиокислительное действие которых обусловлено изменением структуры мембран.
Изменение активности супероксиддисмутазы (СОД) и каталазы у крыс с экспериментальной дислипопротеинемией и инфарктом миокарда и на фоне применения Серпистена приведены в таблице 18.
Развитие экспериментального инфаркта миокарда сопровождалось снижением активности супероксиддисмутазы на 35% и активности каталазы на 10%, что свидетельствует о снижении защитных функций этого звена АОС.
Под влиянием Аторвастатина и Серпистена наблюдалось достоверное восстановление активности СОД, однако уровень интактных животных ни в одной группе достигнут не был. Активность каталазы при использовании Серпистена и Аторвастатина практически не изменялась (таблица 18).
Свободные радикалы и перекиси, которые не разрушаются в процессе функционирования супероксиддисмутазы и каталазы, весьма эффективно обезвреживаются в системе глутатиона и связанных с ним биоантиоксидантов.
Система глутатиона является одной из важнейших защитных систем организма, выполняющей антиоксидантную, детоксицирующую, коферментную и др. функции. Компоненты этой системы ингибируют многие свободнорадикальные реакции, обеспечивают безрадикальное восстановление липогидроперекисей, являются комплексообразователями, инактивируют токсины [Пасечников В.Д. и др., 1988; Коломоец М.Ю. и др., 1991; Santra A. et al, 2000].
Глутатион, присутствуя в клетках в высоких концентрациях, является акцептором гидроксильного иона и синглетного кислорода. Кроме того, он же является кофактором глутатионпероксидазы и глутатионредуктазы [Тиунов Л.А., Иванова В.А., 1988].
Активность глутатионпероксидазы (ГПО) зависит от содержания ГSН в клетке, что, в свою очередь, определяется активностью глутатионредуктазы и концентрацией НАДФН, который образуется в пентозофосфатном метаболическом цикле [Владимиров Ю.А., 2000; Зайцев В.Г., Закревский В.И., 1998]. Активность глутатионпероксидазы зависит также от поступления селена, витамина Е, аскорбиновой кислоты [Hill K.E., Burk R.F, 1982].
Кроме ГПО в клетках выявлено семейство мультифункциональных белков - глутатионтрансфераз [КФ 2.5.18], использующих ГSH для конъюгации с гидрофобными соединениями и восстановления органических перекисей и являющихся фактически Se-независимыми ГПО-ами.
В регенерации восстановленного глутатиона определяющую роль играет глутатионредуктаза (ГР) [КФ 1.6.4.2], которая катализирует реакцию восстановления глутатиона с участием НАДФН в качестве восстановительного эквивалента. В клетке ГР преимущественно находится в цитозоле [Зборовская И.А., Банникова М.В., 1995].
Изменения в состоянии системы глутатиона в эритроцитах и связанных с ним ферментов у крыс с экспериментальной дислипопротеинемией и инфарктом миокарда и на фоне применения Серпистена приведены в таблице 19.
При оценке системы глутатиона и связанных с ним ферментов обращает на себя внимание, что при развитии экспериментального инфаркта миокарда концентрация восстановленного глутатиона в эритроцитах снижается почти вдвое и одновременно наблюдается снижение активности ГР и небольшое увеличение активности ГПО. Изменения активности ГSТ при инфаркте миокарда не наблюдалось.
Выявленные изменения могут быть связаны с развитием окислительного повреждения и повышением расхода эндогенных антиоксидантов, в частности ГSН, снижение концентрации ГSН, вначале развития окислительного стресса приводит к увеличению активности ГР, а при длительном сроке может сопровождаться истощением фермента, что вероятно и имело место в нашем эксперименте при заборе крови на 7 сутки после инфаркта.
Увеличение активности ГПО при развитии инфаркта миокарда, вероятно, также является ответной реакцией на развитие окислительного повреждения и носит компенсаторный характер, однако при течение окислительного стресса на протяжении 31 дня (срок дислипопротеинемии) можно было бы ожидать значительно более выраженное увеличение активности. Можно предположить, что забор крови для исследования проведен в начальной фазе декомпенсации и истощения пула этого фермента.
При лечении животных Аторвастатином наблюдалось увеличение концентрации ГSН в эритроцитах даже выше уровня интактных животных (на 45%), что хорошо коррелировало с активностью ГР, которая возрастала практически до уровня интактных животных. Также позитивные изменения наблюдались в активности ГПО, которая также возвращалась к уровню интактных животных. В то же время активность ГSТ при применении Аторвастатина снижалась и была на 7% ниже, чем у нелеченных животных.
При применении Серпистена концентрация восстановленного глутатиона и активность ГР не имели позитивной динамики, концентрация ГSН оставалась ниже уровня интактных животных на 24%, а активность ГР не отличалась от нелеченных животных. Активность ГПО и ГST при лечении Серпистеном не имела достоверных отличий (таблица 19).
Таким образом. Полученные экспериментальные данные позволяют констатировать следующие выводы:
1. Экспериментальная дислипопротеидемия характеризуется увеличением в крови общих липидов, ЛПНП, ТГ, холестерина, при этом содержание ФЛ и α-ХЛ снижалось. Использование в диете переокисленных липидов и холестерина сопровождалось развитием окислительного стресса, в крови повышался уровень продуктов ПОЛ, кроме того, наблюдалось гиперферментемия вследствие цитолиза клеток. Развитие ИБС сопровождалось повышением амплитуды зубца R (компенсаторное повышение сократительной силы миокарда). Кроме того, у 40% животных наблюдались признаки коронарной недостаточности (инверсия зубца Т).
2. Экспериментальный инфаркт миокарда на фоне экспериментальной дислипопротеидемии характеризуется 100% формированием очага некроза, недостаточностью коронарного кровотока в острый и подострый периоды, угнетением сократительной активности миокарда и нарушением атриовентрикулярной и внутрижелудочковой проводимости. Следует отметить, что частота развития экспериментального инфаркта миокарда на фоне дислипопротеидемии достоверно выше, чем без таковой. По данным биохимических исследований ЭИМ на фоне ЭДЛПЭ сопровождался значительным усилением ПОЛ в миокарде и сыворотке крови, усилением цитолиза, нарушением процессов энергообеспечения, дислипопротеидемией и нарушением функционирования эндогенной АОС.
3. Препарат Аторвастатин обладает профилактическим противоишемическим действием: на фоне ЭДЛПЕ улучшает коронарный кровоток в 2-2,6 раза по сравнению с контролем (частота и степень инверсии зубца Т); достоверно снижает частоту возникновения ЭИМ в 2,5 раза по сравнению с контролем (частота увеличения сегмента ST выше изолинии); способствует уменьшению площади очага некроза миокарда на фоне ЭИМ в 1,7 раз по сравнению с контролем (величина подъема сегмента ST выше изолинии), улучшает коронарный кровоток в 2,6 раза в постинфарктный период по сравнению с контролем (степень уменьшения инверсии зубца Т в ходе лечения). Препарат не увеличивает сократительную активность миокарда в постинфарктный период, способствует нормализации нарушенной атриовентрикулярной и внутрижелудочковой проводимости, аритмии не вызывает.
Препарат обладал выраженной антиоксидантной активностью, по показателям концентрации восстановленного глутатиона и активности глутатионредуктазы в эритроцитах, но не оказывал влияния на ферменты детоксикации - глутатионпероксидазу и глутатион-S-трансферазу.
4. По сравнению с препаратом Аторвастатин субстанция Серпистен обладает более выраженным противоишемическим действием: на фоне ЭДЛПЕ улучшает коронарный кровоток в 3 раза по сравнению с контролем; достоверно снижает частоту возникновения ЭИМ в 5 раз по сравнению с контролем; способствует уменьшению площади очага некроза миокарда на фоне ЭИМ в 2,6 раз по сравнению с контролем, улучшает коронарный кровоток в 1,5 раза в постинфарктный период по сравнению с контролем. Препарат Серпистен способствует повышению сократительной активности миокарда в постинфарктный период, нормализации внутрижелудочковой проводимости и не способствует нормализации нарушений атриовентрикулярной проводимости.
Исследуемая субстанция Серпистен на фоне ЭДЛПЕ и ЭИМ обладала выраженным гиполипидемическим действием, значительно снижая содержание общих липидов и холестерина, β-ЛП и триглицеридов. Вместе с тем достоверно увеличивалось содержание антиатерогенного α-холестерина, практически до уровня интактных животных, и фосфолипидов.
Препарат уменьшал выраженность ПОЛ в миокарде, но не влиял на состояние АОС крови и эритроцитов. Однако позитивное влияние препарата на отдельные показатели АОС может быть дополнительным критерием эффективности терапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ВИДЕ ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2445091C1 |
| КОРОНАРОАКТИВНОЕ АНТИИШЕМИЧЕСКОЕ И АНТИАРИТМИЧЕСКОЕ СРЕДСТВО | 2005 |
|
RU2290927C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИИШЕМИЧЕСКОЙ И АНТИГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2356573C1 |
| БРОМИД 1-(β-ФЕНИЛЭТИЛ)-4-АМИНО-1,2,4-ТРИАЗОЛИЯ (МТ), ОБЛАДАЮЩИЙ КАРДИОПРОТЕКТИВНЫМ, ПРОТИВОИШЕМИЧЕСКИМ, АНТИГИПЕРТЕНЗИВНЫМ, АНТИОКСИДАНТНЫМ, ПРОТЕИНСИНТЕТИЧЕСКИМ И ЭНЕРГОТРОПНЫМ ДЕЙСТВИЕМ | 2008 |
|
RU2404974C2 |
| Фармацевтическая композиция из личинок Galleria mellonella и способ её получения | 2019 |
|
RU2741801C2 |
| СПОСОБ КОРРЕКЦИИ ПРОЦЕССОВ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ У БОЛЬНЫХ ОСТРЫМ ИНФАРКТОМ МИОКАРДА | 2016 |
|
RU2627458C1 |
| ГАММА-ГИДРОКСИПРОПИЛАМИНИЙ-5-ГИДРОКСИНИКОТИНАТ, ОБЛАДАЮЩИЙ ПРОТИВОИШЕМИЧЕСКОЙ, АНТИАРИТМИЧЕСКОЙ И ГИПОЛИПИДЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2003 |
|
RU2245329C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА | 1998 |
|
RU2155036C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНО-СОСУДИСТЫХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2555335C9 |
| СПОСОБ ДИАГНОСТИКИ КОРОНАРНОЙ РЕПЕРФУЗИИ У БОЛЬНЫХ ИНФАРКТОМ МИОКАРДА | 2000 |
|
RU2190847C2 |




Изобретение относится к фармакологии, а именно к лекарственным препаратам противоишемического и гиполипидемического действия, и может быть использовано в качестве нового средства для коррекции нарушений липидного обмена с целью профилактики и лечения дислипидемий, ишемической болезни сердца (ИБС), а также в качестве реабилитационного средства при послеинфарктных состояниях. Средство гиполипидемического и противоишемического действия представляет собой экдистероидсодержащую субстанцию, выделенную из надземной части растений серпухи венценосной Serratula coronata L. (Asteraceae), содержащую смесь 20-гидоксиэкдизона в количестве не менее 75% и 25S-инокостерона в количестве не менее 10%. Данная субстанция обладает выраженным гиполипидемическим действием, значительно снижает содержание общих липидов и холестерина, β-ЛП и триглицеридов. 19 табл., 24 ил.
Гиполипидемическое и противоишемическое средство, представляющее собой экдистероидсодержащую субстанцию смеси 20-гидоксиэкдизона в количестве не менее 75% и 25S-инокостерона в количестве не менее 10%, выделенную из надземной части растения серпухи венценосной Serratula coronata L. (Asteraceae).
| Турищев С.Н | |||
| Фитотерапия | |||
| - М., 2003, с.131, 134-135 Телятьев В.В | |||
| Целебные клады | |||
| - Иркутск, 1991, с.250 | |||
| ТОНИЗИРУЮЩЕЕ И АКТОПРОТЕКТОРНОЕ СРЕДСТВО "СЕРПИСТЕН" | 2005 |
|
RU2276991C1 |
| ОНКОЛОГИЧЕСКИЙ РАСТИТЕЛЬНЫЙ СБОР ДЛЯ ЛЕЧЕНИЯ РАКА | 2003 |
|
RU2246963C1 |
| Полный справочник лекарственных растений | |||
| - М., 2001, с.851 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЭКДИСТЕРОИДОВ | 1999 |
|
RU2153346C1 |
Авторы
Даты
2008-11-10—Публикация
2007-02-06—Подача