Область техники, к которой относится изобретение
Изобретение относится к биохимии, медицине и фармакологии, в частности к фармацевтической композиции, получаемой из личинок восковой моли, включающей биологически активные пептиды, органические кислоты, аминокислоты и антиоксиданты, обладающей кардиозащитным, противотуберкулезным, противострессорным действием, а также к способу ее получения.
Уровень техники
Большая восковая моль Gallerla mellonella L. (Lepldoptera. Pyralldae), далее восковая моль (ВМ), является повсеместно распространенным паразитом пчелиной семьи. Восковая моль получила название за чрезвычайно редкую для животных способность переваривать и усваивать пчелиный воск. Гусениц (личинок) ВМ разводят и используют для различных целей: в качестве лабораторного хозяина при выращивании насекомых - энтомофагов, применяемых для биологической защиты растений в сельском хозяйстве; в качестве тест-объекта для оценки активности и качества бактериальных препаратов; а также в качестве объекта биохимических и физиологических исследований в энтомологии. Эмпирические работы по изучению биологической активности гусениц ВМ и применению экстракта из них можно рассматривать как аналоги нашего изобретения.
1. Применение спиртового экстракта из гусениц ВМ в народной медицине.
Спиртовый экстракт гусениц ВМ применялся в качестве народного лечебного средства при туберкулезе в соседствующих с Россией европейских странах, особенно, в Германии, Польше, а также в России, в частности, на Украине с XV-XVII веков. Условия получения препаратов кустарными способами не строго оговорены, произвольно варьируют, не содержат критериев качества препаратов. Как показали наши выборочные анализы встречающихся в продаже препаратов, содержание в них отдельных компонентов гораздо меньше, чем в заявляемой ФК. Могут также встречаться образцы, в которых полностью отсутствуют выявленные нами биологически активные вещества (фиг. 9, 16).
Таким образом, используемые «кустарными» производителями способы непригодны для производства продуктов с гарантированной активностью.
2. Научные исследования биологической активности препаратов из гусениц ВМ.
2.1. Изучение роли липаз.
Первоначальные и современные исследования биологической активности препаратов из гусениц ВМ в основном направлены на понимание механизма их противотуберкулезного действия и не затрагивают основное направление нашего изобретения - экспериментальное воспроизведение и понимание механизма более широкого лечебного действия на организм человека при других патологических состояниях, внешне отличных от туберкулеза.
Направление исследования иммунной активности гусениц ВМ было открыто работами выдающегося русского ученого И.И. Мечникова и его последователя С.И. Метальникова [1]. Основной идеей этих работ было предположение, что суть лечебного действия препаратов ВМ при туберкулезе состоит в повреждении туберкулезных микробов путем переваривания их устойчивых оболочек, содержащих воскоподобные вещества группы липидов.
Антимикробное действие экстрактов гусениц ВМ по отношению к Mycobacterium tuberculosis было подтверждено рядом других авторов [2-5]. Было показано, что личинки ВМ обладают чрезвычайно высоким иммунитетом по отношению к ряду микроорганизмов, патогенных для человека: возбудители туберкулеза, дифтерии, столбняка, чумы, и некоторые другие, также содержащие воскоподобные липиды в составе мембран.
Были сделаны попытки исследования биохимического механизма такого действия путем выделения фермента, расщепляющего липиды. Ранее в качестве такового рассматривались пищеварительные эстеразы. Позже процесс переваривания липидов стал пониматься как процесс липолиза - окислительного распада липидов. В гемолимфе личинок была найдена и очищена высокоактивная липаза, которая инициировала в современном понимании процесс перекисного окисления липидов [6]. Она, действительно, была способна уничтожать микобактерии в организме морских свинок, что выявлялось следующими за заражением посевами из тканей [7]. Было проведено выделение липазы для лечебного использования. Недостатком способа получения липазы является трудоемкость многоступенчатого процесса очистки, спектра биологической активности препарата и необходимость применения в виде инъекций, выявившая его высокую токсичность. Препарат обладает высокой пирогенностью, которая в некоторых случаях может приводить к гибели животных. Кроме того, препарат не обладает широким спектром действия биологической активности на организм человека, который по нашему мнению существенен и для реализации лечебного действия при туберкулезе. Описан и другой способ выделения из гусениц ВМ препарата липаз, являющихся пищеварительными ферментами насекомого, которые обладают антимикробным действием по отношению к Mycobacterium tuberculosis. Этот способ также трудоемкий, включает получение порошка ткани и его экстракцию эмульгирующей смесью, содержащей 50% глицерина и 1,5% карбокселя, затем липазы осаждают ацетоном и подвергают лиофилизации [8]. Недостатком данного способа также является ограниченность спектра биологической активности получаемого препарата.
2.2 Изучение роли пептидов
Другим, более поздним и современным направлением исследований возможного антимикробного действия явилось обнаружение антимикробных пептидов в гемолимфе гусениц ВМ после иммунизации разными бактериями. Цекропиноподобные пептиды обнаружены и в Galleria [9-11]. В последние годы из личинок восковой моли выделены и охарактеризованы более десяти новых пептидов с антибактериальной и противогрибковой активностью [11-13]. Методика, описанная в работе [11] включала следующие этапы: иммунизацию личинок бактериями, получение гемолимфы, метанольно-уксусную экстракцию, лиофилизацию, делипидизацию, лиофилизацию, разделение на колонке Supelcosil LC-18-DB, гель-электрофорез, определение антибактериальной активности фракций, хроматографическую очистку на колонках Superose 12 HR 10/30 и Supelcosil LC-18-DB.
Недостатком способа является высокая стоимость и трудоемкость получения пептидных препаратов, низкий выход активного продукта и ограниченность спектра биологической активности.
Таким образом, все рассмотренные способы не приводят к получению препаратов с более широкой биологической активностью, чем только антимикробное действие. Полученные в процессе изучения препараты не рассматриваются как форма лекарственных продуктов, поскольку процедура их получения трудоемка. Поэтому современным направлением в области медицинского применения пептидов является их синтез, а не выделение из живых объектов. Кроме того, как отмечено выше, целью рассмотренных работ было обоснование механизма только антимикробного действия гусениц ВМ. При этом не затрагивалось их более широкое биологическое действие на организм человека.
2.3 Изучение лечебного действия спиртового экстракта из гусениц ВМ
Внимание к более широкому лечебному действию кустарных препаратов из ВМ привлек С.А. Мухин. Им было показано лечебное действие препарата ВМ после инфаркта миокарда [14].
Предметом изучения авторов настоящего изобретения являются именно новые аспекты биологического действия препаратов ВМ, которые значительно расширяют их влияние на организм человека и высших животных: в первую очередь повышение защитных сил больного человека, которое можно назвать общеукрепляющим, адаптагенным или восстановительным.
В качестве аналога препарата следует рассматривать недавно опубликованный патент, на получение из личинок Большой Восковой моли, а также и других видов насекомых комплекса веществ в пропиленгликоле с кератолитическим действием для наружного применения [32].
Препарат сильно отличается от Восковита - фармацевтической композиции по данному изобретению. Он получен при выращивании личинок на искусственном корме. Для получения использован резко отличный по экстрагирующим свойствам растворитель. В его составе не показано присутствие веществ, обнаруженных авторами данного изобретения. Он предназначен для использования в других целях в косметологии. Он является аналогом только по способу получения.
3. Характеристика ближайшего аналога
В сотрудничестве с С.А. Мухиным в нашей лаборатории было предпринято первое экспериментальное исследование общеукрепляющего действия спиртового экстракта из гусениц ВМ на организм теплокровных животных в норме и на экспериментальных моделях патологии. Начальные этапы этой работы отражены в патенте, совместном с С.А. Мухиным [16] - ближайший аналог.
В отличие от работ - аналогов, рассмотренных выше, где исследовали компоненты, содержащиеся в ткани гусениц, в этом аналоге изучали препарат, полученный из ВМ, который используется при лечении. В какой мере попадают в экстракт вещества, обнаруженные в тканях гусениц, не было известно.
В первую очередь в аналоге исследуется, казалось бы, очевидное обстоятельство, роль качества корма для биологической активности препаратов из гусениц. Этот вопрос также не ставился ранее. Пищевой рацион личинок, развивающихся в пчелином улье, уникален, это - перга, мед, а также воск, из отработанных сот - темная восковая сушь, содержащая прополис - компоненты, богатые биологически активными веществами. Однако при производственном разведении личинки прекрасно растут на упрощенном корме - в основном - чистом воске с добавлением сахара. Ввиду удобства этого способа он применяется для производства личинок в больших количествах. Пчеловоды обычно используют для выращивания личинок в небольших количествах отработанные соты -темную восковую сушь. До нашего аналога не было данных о влиянии корма на биологическую активность экстракта, получаемого из личинок. В работе были проведены экспериментальные исследования зависимости биологической активности от качества корма. Сравнивали активность препарата из гусениц, выращенных на стандартном искусственном корме, выращенных на темной восковой суши и экстракта самой восковой суши. Продукт, полученный предлагаемым способом, содержал несколько биологически активных компонентов. Его химический состав отличался от состава экстракта, получаемого аналогичным способом из гусениц ВМ, выращенных на искусственном корме, а также от состава экстракта темной восковой суши.
Исследования, проведенные на биологических моделях, показали, что экстракт гусениц ВМ, полученный предложенным способом, не обладал достаточно высокой физиологической активностью: адаптогенным, кардиозащитным и рост стимулирующим действием, а также не активировал в достаточной степени окислительный метаболизм сердечной и сосудистой тканей.
Был описан стандартный регламент выращивания личинок и получения спиртового экстракта. Для получения отбирали личинок, последнего перед окукливанием возраста, массой 150 мг и более, выращенных вне улья на темной восковой суши при температуре 20-25 градусов. Экстракцию проводили при комнатной температуре. По данной методике получали стабильный, контролируемый по активности продукт, что отличало его от кустарных спиртовых экстрактов. Полученный продукт представляет собой прозрачную жидкость красновато-желтого цвета, содержащую около 1% сухого вещества. Экстракт хранили в темноте при 4°С, при этом физиологическая активность сохранялась в течение года. В составе продукта обнаружены в значительном количестве в процентах от сухого веса только свободные аминокислоты: 50-60%. Остальные органические компоненты содержатся в минорных количествах, преимущественно 1-2% и не идентифицированы до индивидуальных веществ.
Однако следует отметить следующие недостатки этого аналога.
1. Оставался неясным механизм широкого восстановительного общеукрепляющего действия, который не объяснялся обнаруженным составом.
2. Выявленная физиологическая активность обнаружена на моделях, недостаточных для демонстрации лечебного действия:
- исследования адаптагенного действия проведены на здоровых животных при плавании, что показывает скорее устойчивость к физической нагрузке.
- кардиозащитное действие выявлено на устаревшей модели токсичности строфантина для сердца холоднокровного - лягушки.
3. Отсутствует экспресс-стандартизация получаемого продукта.
В аналоге продукт стандартизировали по характеристике его химического состава, включая минорные компоненты без понимания их роли в физиологическом действии. Стандартизация включала применение нескольких трудоемких и дорогостоящих методов исследования: фракционирование на колонках, использование тонкослойной и газовой хроматографии, электрофореза, аминокислотного и элементного анализа, ЯМР, УФ- и люминесцентной спектроскопии.
4. Способ аналог неудобен для промышленного производства ввиду необходимости постоянного поддержания личинок в культуре и ежедневной обработки малых порций без возможности хранения сырья и создания запасов.
Раскрытие изобретения
Цель изобретения - получение из личинок Большой Восковой моли в производственных количествах стандартизованного физиологически активного продукта (фармацевтической композиции (ФК)), обладающего лечебным действием при патологических состояниях, обусловленных перенапряжением рабочих функций организма вследствие гиперактивации симпатической регуляции, приводящей к ослаблению восстановительных процессов, поддерживающих биологическую устойчивость организма. Такие состояния характерны для постоянной напряженной деятельности без соответствующего объема восстановления и лежат в основе ряда социально значимых заболеваний современности - острый стресс, сердечно-сосудистые заболевания, острые воспалительные заболевания, включая туберкулез, ухудшение качества жизни лиц пожилого возраста, количество которых в России и мире возрастает.
Задачей заявляемого изобретения является получение пригодным для промышленного воспроизведения способом стандартизированной фармацевтической композиции (ФК) из личинок восковой моли и препаратов на ее основе с уникальным набором физиологически активных соединений, обуславливающим лечебное действие, выявляемое на моделях ряда патологических состояний.
Техническими результатами, обеспечиваемыми заявляемым изобретением, являются:
а) получение из гусениц восковой моли стандартизованной ФК и препаратов на ее основе более высокого качества по сравнению с прототипом (и кустарными образцами) с повышенным содержанием компонентов, в частности биологически активных пептидов и антиоксидантов;
б) получение ФК с физиологическим действием, включающим нормализацию энергетических процессов в митохондриях: предупреждение гиперактивации сукцинатдегидрогеназы и поддержание активности альфа-кето-глутарат дегидрогеназы;
в) получение ФК с лечебным действием при патологических состояниях таких как инфаркт миокарда, туберкулез, психо-эмоциональный стресс, гнойные раны;
г) получение ФК с высокой безопасностью в широком диапазоне доз.
Способ получения заявленной ФК, обеспечивающий указанные технические результаты, включает стадии:
1) выращивание личинок вне улья в специально оборудованных термостатируемых помещениях;
2) выращивание личинок на определенном искусственном корме, обеспечивающем повышенное содержание биологически активных ингредиентов в заявленной ФК;
3) дополнительные подкормки личинок раствором сахара;
4) предобработку личинок перед экстракцией;
5) экстракцию компонентов ФК органическим растворителем с дополнительной процедурой повторной экстракции частью экстрагирующего раствора;
6) добавление к экстрагирующему раствору антиоксиданта дигидрокверцетина; и
7) получение сухого бесспиртового препарата ФК путем высушивания с использованием сорбита.
Предобработка личинок перед экстракцией заключается в предварительном замораживании или лиофилизации. Эти процедуры позволяют использовать заявленный способ для промышленного получения ФК, т.к. не требует немедленного проведения экстракции собранных личинок, а позволяет накапливать, хранить и транспортировать сырье (замороженные или лиофилизированные личинки). Кроме того, процедура предобработки ускоряет выход экстрагируемых веществ. Для получения ФК экстракцию проводят преимущественно раствором этилового спирта. К оставшимся после первой экстракции личинкам добавляют часть первоначального раствора экстрагента и проводят вторичную экстракцию. Это позволяет значительно увеличить антиоксидантную активность ФК.
Механизм широкого биологического действия ФК не сводится к наличию в ней антимикробной активности, а объясняется синергетическим влиянием нескольких групп веществ, которые уменьшают состояние симпатической гиперактивности организма человека, лежащее в основе ряда внешне различных заболеваний, социально значимых в настоящее время. К ним относятся - постоянное перенапряжение (стресс), сердечнососудистые заболевания, гипертоническая болезнь, ишемия миокарда, бронхо-легочные патологии, включая туберкулез.
В представленном эксперименте по заживлению инфицированной раны воспроизведено восстанавливающее регенераторное действие препарата ВМ на сердце и легкие при инфаркте и туберкулезе, а также ростстимулирующее действие, описанное в другой работе нашей лаборатории [17].
Усиление восстановительных процессов важно само по себе и уменьшает гиперактивцию работы клеток адренэргической стимуляцией.
Отличия от ближайшего аналога
В отличие от ближайшего аналога в настоящем изобретении получены следующие результаты.
1. Достигнуто увеличение выхода экстрагируемых веществ. Явным указанием на повышение выхода является увеличение сухого веса в единице объема экстракта. В Прототипе он составлял около 1%, а при заявляемом способе больше: 1,5% и до 2,%. Эти данные приведены в примере 2 при описании содержания аминокислот.
2. Осуществлена разработка удобного экспресс-метода контроля физиологической активности препаратов по показателям его антиоксидантной активности (АОА). АОА активность является химическим показателем, отражающим биологическую активность препаратов, а также удобна для измерения. С помощью этого метода удобно подбирать усовершенствования способа получения активных препаратов. Подробное описание этого метода приведено в примере 3.
3. Достигнуто воспроизводимое получение препаратов с высокой активностью способами, пригодными для производственного использования, благодаря улучшению состава корма, усовершенствованию процедур обработки гусениц ВМ и созданию сухих препаратов, помимо известного спиртового экстракта. Эти результаты представлены в примерах 11, 12.
4. В состав заявляемой ФК входят новые важные вещества, с регуляторной физиологической активностью, что позволяет рассматривать получаемый продукт как фармацевтическую композицию, которая может быть использована в качестве фармацевтического средства.
ФК включает три группы высокоактивных физиологических регуляторов
1) Пептиды, включая тимоген, пептид тимуса высших животных, который впервые обнаружен нами у насекомых, тимозин, низкомолекулярные белки: супероксиддисмутаза (СОД) - самый активный антиоксидант организма, а также лизоцим - белок животных тканей и аполипофорин - белок ВМ, обладающие лизирующим действием на мембраны, в том числе, бактерий и митохондрий. Присутствует и несколько других пептидов насекомых с лизирующим действием на мембраны.
Содержание биологически активных пептидов в заявленной ФК составляет:
- тимоген - преимущественно 4-5 мкг/мл, но диапазон может варьировать от 0,5 до 6 мкг/мл;
- тимозин-бета 4 - преимущественно 2 мкг/мл, но диапазон может варьировать от 0,5 до 3 мкг/мл;
- лизоцим - преимущественно 1 мкг/мл, но диапазон может варьировать от 0,1 до 2 мкг/мл;
- супероксиддисмутаза - преимущественно 8 мкг/мл, но диапазон может варьировать от 1 до 15 мкг/мл.
2) Вторую группу веществ ФК составляют аминокислоты, соответствующие таковым в ближайшем аналоге, однако выход их больше. Данные представлены в примере 2.
В настоящем изобретении среди аминокислот выделена группа из 4-х аминокислот-участников процесса переаминирования и двух веществ, тесно связанных взаимопревращениями, апарагиновая, гутаминовая {глутамин, пролин}, глицин, аланин, (АСП, ГЛУ {ГЛН, ПРО}, ГЛИ, АЛА), которые содержатся в большем количестве. Они отличаются от других аминокислот тем, что оказывают сильное регуляторное действие на окислительные процессы энергообеспечения в митохондриях, чем обеспечивают устойчивость разных тканей к гипоксии и успокоительное, седативное, антистрессорное действие, особенно выраженное на мозге.
Несмотря на значительные отличия исследований по аналогу, проведенных на других образцах корма и гусениц, и на препаратах по данному изобретению, обнаружено при повышении выхода то же соотношение кислот - участников переаминирования и ПРО (пример 2). Они нарастают в последовательности АСП, ГЛУ, ГЛИ, АЛА, и к ним по содержанию примыкает ПРО.
аминокислоты:
аспарагиновая - преимущественно 500 мкг/мл, но диапазон может варьировать от 100 до 800 мкг/мл;
глутаминовая - преимущественно 700 мкг/мл, но диапазон может варьировать от 200 до 1000 мкг/мл;
глицин - преимущественно 300 мкг/мл, но диапазон может варьировать от 50 до 500 мкг/мл;
аланин - преимущественно 1000 мкг/мл, но диапазон может варьировать от 300 до 1500 мкг/мл;
3) Третью группу представляют карбоновые кислоты: лимонная (ЛИМ), изолимонная (ИЗЛ), α-кетоглутаровая (КГЛ), связанные взаимопревращениями. Они известны как субстраты окисления в митохондриях. Ранее нами показана еще и выраженная регуляторная роль ИЗЛ и КГЛ, которые снижают гиперактивацию окисления янтарной кислоты (ЯНТ) в митохондриях, повышая устойчивость тканей к стрессорным воздействиям и гипоксии, что рассмотрено далее. Описание этих данных см.в примере 2. Входящие в состав ФК карбоновые кислоты содержатся в количествах:
лимонная - преимущественно 1000 мкг/мл, изолимонная - преимущественно 250 мкг/мл, α-кетоглутаровая - преимущественно 60 мкг/мл, но диапазон может варьировать от 10 до 100 мкг/мл.
5. Заявленная ФК обладает высокой антиоксидантной/антирадикальной активностью.
Ее антиоксидантная активность, измеренная методом ингибирования аутоокисления адреналина, составляет не менее 20 усл. ед/мл, а при измерении методом ингибирования люминесценции, сопровождающей термическое разложение α,α'-азодиизобутироамидин дигидрохлорида, составляет не менее 100 усл. ед/мл. Данные представлены в примере 3.
6. В заявляемом изобретении предложено использовать величину антиоксидантной активности для тестирования качества и стандартизации получаемых препаратов ФК (как жидких экстрактов, так и сухих препаратов), т.к. показано, что ее величина согласуется с содержанием других активных компонентов ФК, в частности пептидов (примеры 1, 3, 11, 12).
7. На экспериментальных моделях патологических состояний высших животных впервые показано лечебное действие ФК при остром психоэмоциональном стрессе, близком к жизни, экспериментальном туберкулезе и инфаркте миокарда, а также ускорение заживления инфицированных ран. Описание см. в примерах 4-6, 8.
8. Показано отсутствие токсичности ФК (пример 7)
9. Фармакологическая композиция может повышать порог чувствительности к туберкулезному возбудителю. Экспериментально показано увеличение противотуберкулезной активности крови при приеме ФК, что позволяет использовать ее в целях профилактики (пример 5).
При современном угрожающем распространении туберкулезной инфекции, обусловленном как ускорением возникновения устойчивых к антимикробным препаратам штаммов микобактерий, так и ослаблением сопротивляемости организма человека к возбудителям, остро актуален поиск и создание средств, повышающих защитные силы организма.
Согласно существующим представлениям активность нейтрофилов в значительной мере определяет врожденную устойчивость к туберкулезной инфекции. Эта устойчивость обеспечивается выработкой антибактериальных пептидов с антитуберкулезной активностью [18], Показано, что риск туберкулезной инфекции находится в обратной зависимости от количества нейтрофилов в периферической крови. Пептиды 1-3 нейтрофилов человека убивают М. tuberculosis, а такие нейтрофильные пептиды как cathelicidin LL-37 и lipocalin 2 ограничивают рост микроорганизмов.
Количество антимикробных пептидов в крови зависит не только от числа циркулирующих нейтрофилов, но и от их активности. Одним из таких регуляторов выработки пептидов является витамин Д [19]. Известно, что люди с темным цветом кожи обладают низким содержанием витамина Д в сыворотке крови и низким содержанием антибактериальных пептидов [20]. Для них характерна повышенная восприимчивость к туберкулезной инфекции и более тяжелое ее протекание [21]. Заявляемая ФК способствует активации нейтрофилов (пример 9, фиг. 40), а также значительно повышает бактериостатическую активность крови в отношении М. tuberculosis (пример 5, таблица 10). Таким образом, ФК может быть использована не только для лечения, но и в качестве средства предупреждения заражения туберкулезом лиц, контактирующих с больными. Использование ФК в качестве средства профилактики заболевания не менее важно для борьбы с туберкулезом, чем его лечебное применение. Возможность профилактического применения определяется также отсутствием токсичности ФК (пример 7).
7. Выяснение механизмов биологического действия на основе влияния выявленных новых компонентов.
На основании полученных результатов предполагается новый механизм широкого биологического действия препаратов ВМ, которое не сводится к его известной антимикробной активности, а объясняется синергичным влиянием нескольких групп веществ, которые уменьшают состояние симпатической гиперактивности организма человека, лежащее в основе ряда внешне различных заболеваний, социально значимых в настоящее время. К ним относятся - постоянное перенапряжение (стресс), сердечнососудистые заболевания, гипертоническая болезнь, ишемия миокарда, бронхо-легочные патологии, включая туберкулез, а также ослабление лиц пожилого возраста.
Кроме того, предложено новое объяснение роли веществ с антимикробной активностью во влиянии на физиологическое состояние организма человека. Оно обусловлено способностью преимущественно пептидов с антимикробной активностью повышать проницаемость биологических мембран. Это убивает микробы, но может иметь важное защитное действие на клетки и митохондрии макроорганизма, сбрасывая избыточный потенциал, что прекращает образование АФК, то есть проявляет антиоксидантнную активность (АОА) и нормализует важные физиологические функции, в частности, инсулинорезистентность.
Использованная модель симпатической гиперактивности.
В данной работе экспериментально моделировали состояние симпатической гиперактивности современной моделью стресса, близкой к условиям жизни, состоящей в создании только эмоционального напряжения крыс помещением в коробочку, ограничивающую движения без болевых воздействий. Однако, эта процедура приводит к сильному волнению - психо-эмоциональному стрессу. Ранее нами было показано, что при этом происходит гиперактивация пусковым гормоном стресса адреналином (АДР) самого мощного фермента окисления в митохондриях СДГ. Такая высокая активность может привести к сильному ингибированию работы фермента. Показано, что в реализации влияния АДР на митохондрии взаимодействуют и гормон, и субстрат окисления - ЯНТ. Поэтому эти взаимодействия были нами обозначены как субстратно-гормональная система [22-24], (Фиг. 1). Эта пара АДР и ЯНТ представляют симпатическую половину регуляции деятельности тканей, усиливая энергообеспечение и поддерживая внешнюю работу клеток. Вторую половину представляет пара ацетилхолин (АЦХ) - КГЛ, которая поддерживает противоположное состояние - усиление восстановительных процессов нарушений, вызванных работой, что будет рассмотрено далее.
В проведенном исследовании определяли антистрессорное действие количественно по влиянию ФК на гиперактивность СДГ. Это явилось чувствительным показателем. Как показано в примере 4, ФК обладает антистрессорной активностью по этому показателю, согласующемуся с ответами иммунной системы.
Состояние начальной фазы (острого) стресса всегда связано с возрастанием уровня активных форм кислорода (АФК), в первую очередь супероксида. Поэтому антиоксиданты являются защитными веществами при стрессе. Выявление и измерение антиоксидантной активности ФК и ее компонентов является и показателем ее качества, и показателем антистрессорного действия.
Острая фаза возбуждения связана также с гипоксией, поэтому антигипоксическая активность может также рассматриваться, как защитная при стрессорной симпатической гиперактивации.
Отмеченные неблагоприятные метаболические изменения обусловливают характерное развитие повреждающего стресса, представленное левой кривой на фиг 2. Ответ характеризуется большой амплитудой со спадом к реакции адаптации, которая завершается истощением. По активности СДГ это проявляется сильным ингибированием.
Кинетика развития ответа на нефизиологическую нагрузку резко отличается от действия физиологической нагрузки, которая повышает рабочие возможности ткани, является тренирующей. При нагрузках в физиологическом диапазоне ответ меньше по амплитуде, но сменяется устойчивой фазой адаптации и главное стимулирует восстановительные процессы, которые обеспечивают усиление работоспособности ткани, сопряженной даже с делением клеток - правая кривая на фиг. 2.
Снижение остроты первой фазы стресса очень важно для предотвращения патологических нарушений в ткани, вызываемых перенапряжением. Применение веществ, защищающих от неблагоприятных метаболических сдвигов, позволяет ослабить вредное воздействие сильной нагрузки. Как отмечено выше, в такой регуляции участвуют и гормоны - АДР и АЦХ, и некоторые субстраты - метаболиты митохондрий, как ЯНТ, КГЛ, ИЗЛ кислоты, пролин во взаимодействии с КГЛ.
По физиологическим проявлениям антистрессорное действие проявляется в успокоительном, седативном эффекте на нервную систему, что известно для ГЛИ в составе ФК и по нашим данным вероятно для ИЗЛ и КГЛ.
Таким образом, в составе ФК обнаружено несколько компонентов с синергичным антистрессорным действием, однако, отличающимся по механизмам.
Механизмы действия компонентов ФК на симпатическую гиперактивность
ФК в целом обладает по рассмотренным показателям антистрессорным действием (снижение гиперактивности СДГ в сочетнии с нормализацей иммунных реакций лимфоцитов и нейтрофилов). Она также проявляет выраженную антиоксидантную активность, что обычно связано и с антигипоксическим действием. Обнаружение новых компонентов в составе ФК позволяет понять, какими веществами обусловлено действие композиции, и каковы механизмы этих эффектов.
Анитиоксидантная активность (АОА) Компоненты ФК обладают АОА активностью двух типов. Более широко известен первый тип, который можно назвать устранение АФК после их образования в форме супероксида. Самым мощным биологическим антиоксидантом такого типа является фермент супероксиддисмутаза (СОД), присутствие которого в ФК выявляется электрофорезом (пример 1). К антиоксидантам этого типа относятся некоторые аминокислоты, например, глутаминовая, многие пептиды (примеры 1, 2).
Не менее важную роль могут играть антиоксиданты второго типа, предупреждающие образование супероксида, что особенно важно при гиперактивации энергетических процессов. В таком состоянии мембранный потенциал митохондрий возрастает до максимума, не достигаемого в норме. Гиперполяризация мембран приводит к резкому возрастанию образования супероксида. Такие состояния чреваты критическими патогенными сдвигами - развитием инфаркта миокарда или эпилептического приступа. Очень быстрым способом предотвращения патологического нарастания супероксида является даже небольшой сброс потенциала мембраны митохондрий. Это ярко проявляется при действии разобщителей - веществ, образующих поры в липидных участках мембран [25]. При этом образование супероксида падает очень сильно. Веществ с подобным действием много в ФК. Все они повреждают микроорганизмы, так как повышают проницаемость их мембран. Мембраны митохондрий животных и микробов имеют сходство, и вещества такого типа оказывают сходное действие на мембраны митохондрий. Действие разобщителей на мембраны митохондрий рассматривается в норме как повреждающее. Но в состояниях гиперактивности энергетических процессов избыточный потенциал приводит к ряду нарушений. Помимо упомянутых выше, к ним относится такой бич современности как инсулинорезистентность, влекущая диабет 2 типа, а также другие метаболические болезни. Метаболические болезни - новый класс заболеваний, вызванных дисбалансом использования пищевых веществ, особенно жиров и глюкозы в условиях недостатка физической активности. Оказывается, при этом и избытке питания, что характерно для современной жизни, развивается рассмотренная выше гиперполяризация мембран митохондрий, что индуцирует всплеск образования супероксида, который непосредственно индуцирует потерю чувствительности к инсулину и неспособность клетками использовать глюкозу - то есть диабет 2 типа [26]. Показано, что разобщители, вредные для ткани в норме, быстро прекращают образование супероксида и восстанавливают чувствительность к инсулину.
Веществ типа разобщителей много в ФК. Среди них, прежде всего - лизоцим, липофорин, целая группа пептидов, повышающих проницаемость мембран (пример 1). Мы выявляли такую активность ФК по ее влиянию на мембранный потенциал митохондрий, измеренный по накоплению ионов Са (пример 4).
Антигипоксическое действие в составе ФК. Такое действие осуществляют аминокислоты- участники переаминирования АСП, ГЛУ, ГЛИ, АЛА, поскольку они переключаю окисление на путь, менее зависящий от НАДН.
Ресопрягающее действие ИЗЛ-КГЛ-ГТФ Важным регулятором гиперактивности СДГ при стрессе является способность ИЗЛ уменьшать ее, приближая к уровню нормы [23]. Это основано на образовании КГЛ, приводящем к синтезу ГТФ - вещества, препятствующего разобщению дыхания митохондрий при стрессе и снижающего гиперактивацию дыхания.
Седативное действие. По физиологическим проявлениям антистресорное действие проявляется в успокоительном, седативном действии, что известно для ГЛИ в составе ФК и вероятно по нашим данным для ИЗЛ и КГЛ.
Множественное дублирование регуляторного действия в надежной системе
Как указано выше, в составе ФК обнаружено несколько компонентов с синергичным антистрессорным действием, однако, отличающимся по конкретным механизмам.
Это показывает, что получаемая ФК представляет не случайную смесь, а биологически активное сочетание веществ с разным механизмом действия, но синергичных во влиянии на патогенную симпатическую гиперактивность, а именно, сбрасывающих это опасное состояние энергетичекого избытка.
По-видимому, не случайны и соотношения количеств веществ. Так оказалось, что отношение количеств выделенных аминокислот - участников переаминирования сохраняет одинаковую последовательность и в данных по прототипу, образцы которого были получены из личинок, выращенных на другом корме, и в наших современных препаратах (пример 2).
В живых системах, как и в хороших технических устройствах механизмы регуляции осуществляются системой параллельных предохранителей. Это обеспечивает необходимую надежность регулирования. Поэтому множественность механизмов не является избыточной, а необходимой. И работа композиции не может быть заменена действием одной пары регуляторов. Есть и вторая причина множественности регуляции активности клеток - неодинаковость и даже противоположность знака регуляции в разных состояниях. Это положение иллюстрируется фиг. 3. На этой схеме разное состояние клеток представлено по активности СДГ. Два левых столбика представляют активацию СДГ в пределах нормы. В состоянии нормы, согласно микроскопическим исследованиям, состояние клеток в органе или митохондрий в клетке в основном одинаково. Это показано пунктирным столбиком, высота которого равна общему количеству микроскопических объектов. Та средняя величина активности, которая измеряется, характерна для всех них. Однако, при гиперактивности, которая является основой многих патологий, состояние объектов распадается на две группы, представленные пунктирными столбиками. Начальные изменения выражаются в гиперактивации части клеток или митохондрий, которая по мере продолжения воздействия постепенно сменяется ингибированием некоторой доли из них. Таким образом, несмотря на одну среднюю суммарную гиперактивность ткани, в ней присутствуют две разные популяции клеток или митохондрий в клетке - гиперактивные и сильно ингибированные. Для их нормализации нужны противоположные сдвиги их состояния: чтобы вернуть к норме гиперактивные клетки, нужно снизить их активность, и повысить ее для ингибированных, что показано стрелками Несомненно, более гибкая регуляция будет осуществляться более богатой композицией веществ.
Следует отметить, что использованный метод определения активности СДГ в лимфоцитах крови человека и животных позволяет измерить активность митохондрий в организме [23]. Это недоступно принятыми биохимическими методами, в которых это важное состояние утрачивается из за грубой процедуры выделения, а наблюдаются только трудно регулируемое ингибирование СДГ, показанное последней парой столбиков на фиг. 3. Оно однако, не отражает активность в организме а является результатом повреждения митохондрий при исследовании [27]. Повреждение маскирует реальное значение состояния гиперактивного энергетического избытка, являющегося угрозой многих заболеваний и закрывает возможность исследования его регуляции.
Влияние ФК на восстановительные процессы
Усиление холинэргической регуляции. Свойство ФК - влиять на показатели гиперактивности тканей. Согласно физиологическим представлениям о регуляции жизнедеятельности клеток, работа и восстановление, включая размножение, деление клеток не могут происходить одновременно, как не может физическая работа производиться во сне [28].
Для включения второй стороны регуляции - усиления восстановительных процессов необходимо отключить симпатическую активацию и открыть путь регуляции АЦХ, показанный на фиг 1. Следует отметить, что наличие КГЛ и ее предшественников - ИЗЛ, и ЛИМ, показанное нами в ФК (пример 2), которые являются участниками и стимуляторами регуляции АЦХ, согласуется с представлением, что ФК подавляет адренэргическую симпатическую ветвь регуляции, стимулирующую работу и активирует холинэргическую, парасимпатическую, стимулирующую восстановление и размножение клеток. Такие противоположные эффекты АДР и АЦХ показаны по регуляции синтеза инсулина в поджелудочной железе [29].
Таким образом, ЛИМ-ИЗЛ-КГЛ в ФК способствуют активации холинэргической регуляции и через нее восстановительных процессов.
Холинэргическое влияние препарата ВМ по прототипу сильно выражено. Проведенные исследования ФК показывают, что холинэргический эффект обусловлен влиянием комплекса веществ с миотропным действием. В первую очередь, это аминокислоты и карбоновые кислоты - стимуляторы энергетических процессов в митохондриях. Холинэргическое действие может проявляться и по активации иммунных функций нейтрофилов и повышению их количества в крови. Такой эффект наблюдали как защиту от стресса (пример 4). Как отмечено выше, активация иммунной защиты нейтрофилов обусловливает и противотуберкулезное действие. Однако, при анализе действия препаратов из ВМ противотуберкулезное действие обычно не связывают с усилением холинэргической регуляции. Оказывается, что это две стороны одного механизма.
Пептидная регуляция - центральное звено биологической активности ФК
Мощным фактором, поддерживающим восстановительное действие ФК, по-видимому, является обнаруженный в ее составе пептид тимуса - тимоген, а, возможно, и другие близкие по эффектам пептиды (см. далее), основная функция которых и состоит в активации восстановления и регенерации тканей в норме и при повреждении. Важно открытие среди пептидов тимуса - тимозина-бета4, которому присуща способность активировать стволовые клетки, способные развиваться в кардиомиоциты. Эта способность была показана и для других тканей [30]. В связи с нашей работой следует отметить, что и этот пептид обладает высокой антиоксидантной активностью.
Выявление пептидов, как основного звена биологической активности ФК проясняет и некоторые, не имевшие научного обоснования особенности действия препаратов ВМ. Например, его эффективность в дозах, низких по масштабам аллопатической фармакологии. В механизме действия пептидов выявлено замечательное явление, показывающее усилении их активности при очень сильных разведениях вплоть до ультра-низких [31]. Это объясняется существованием единого пептидно-водного континуума в тканях. Благодаря этому начальное действие проявляется в «бесконечно» (инфинитезмално) низких концентрациях.
Рассмотренное ростстимулирующее действие ВМ, обусловленное содержанием пептидов, ранее не привлекались для понимания биологической активности гусениц ВМ и их антимикробного действия.
Важно отметить, что для полноты реализации ростстимулирующей активности важно сочетание пептидов с пролином. Было отмечено, что его содержание также высоко в ФК. Пролин играет ключевую роль в обеспечении структурной, морфологической устойчивости тканей. Он незаменим для создания соединительнотканного каркаса устойчивости растущих клеток - коллагена. В создании коллагена участвует взаимодействие пролина и КГЛ, которая, как отмечалось выше, также присутствует в ФК. На основании проведенного исследования механизма биологического действия ФК авторы пришли к заключению, что его основой является усиление восстановительных процессов в тканях организма, а не собственно антибактериальное действие на возбудителей туберкулеза.
Проведенные исследования привели к новому пониманию механизма биологического действия препаратов ВМ как стимулятора восстановительных процессов в ткани, включая деление клеток. Этот вывод привлекает внимание к группе публикаций, не имеющих отношения к ВМ и противотуберкулезному действию. Тем не менее, она очень близка по составу и механизму действия.
Это - группа препаратов, основным свойством которых является именно стимуляция восстановительных процессов в тканях, включая усиление деления клеток для замены поврежденных. В эту группу входят экстракты тканей высших животных, преимущественно телят. Среди них тималин - суммарный экстракт тимуса, его отдельный пептид, тимоген выделенный и синтетический - бетагистин, тимозин-бета 4.
Высокой восстановительной биологической активностью обладают экстракты и из других эндокринных желез - особенно, эпифиза и других тканей. Рекомендуется использовать для лечения именно экстракты из органов, которые затронуты патологическим процессом, так как экстракт содержит и регуляторы, специфические для отдельных тканей. Для них важным является именно сочетание - композиция многих синергично действующих веществ [31].
Широко известны препараты такого типа с широким действием на разные ткани - актовегин, церебролизин. Основными действующими компонентами являются пептиды, аминокислоты и низкомолекулярные белки. По этим показателям группа веществ - стимуляторов восстановления клеток близка к выявленному нами механизму действия ФК. В описании актовегина, также отмечается высокое содержание аминокислот - участников переаминирования, выявленное нами и для ФК. Несмотря на несомненную близость основного действия веществ этой группы к ФК, они не рассматриваются как аналоги, поскольку они отличаются источниками и способами получения. Кроме того, для них вообще не характерно антимикробное действие, которое считается основным свойством препаратов из ВМ.
Следует отметить, что в качестве участников субстратно- гормональной системы обычные метаболиты, как субстраты биохимических превращений, участвуют в гораздо более низких концентрациях, чем известно для субстратов - порядка миллимолей, а действуют в концентрациях сигнальных, ближе к действию гормонов - микромолярных и ниже. Это описано на примере взаимодействия ЯНТ с регуляцией АДР, которое было обозначено как сигнальное действие [33-37]. Позже были обнаружены рецепторы к субстратам ЯНТ и КГЛ, что позволило понять механизм физиологического действия низких доз субстратов, как опосредуемых рецепторами [38-43].
В настоящее время широко используются лекарства, действие которых направлено на различные рецепторы, преимущественно адренорецепторы, или гистаминовые, что характерно для гипотензивных, диуретических и неврологических средств. Эти средства используются также в гораздо более низких концентрациях, чем лекарства с иным механизмом действия. Поэтому эффективность низких доз ФК не представляется столь необычной, как ранее.
Проведенные исследования позволяют считать, что бактериолитическое действие ВМ на микробы и стимуляция восстановителных процессов макроорганизма - две стороны одного механизма.
На протяжении исследования биологического действия препаратов из личинок ВМ в качестве основного механизма рассматривали преимущественно - антимикробную активность в отношении возбудителей туберкулеза. Ее объясняли расщеплением воскоподобных и других липидов мембран микробов. В первоначальный период исследований это действие связывали с липазами. С конца прошлого века и, особенно с начала нового, антимикробное и бактериолитическое действие связывают с группой пептидов и белками аполипофорином III, лизоцимом. Таким образом, предлагаемые объяснения сосредоточивались на уничтожении микрооргнизмов и не включали влияние на макроорганизм хозяина - больного человека.
В настоящее время сначала в тимусе, а потом и в других тканях, обнаружены пептиды, тимуса тимоген и тимозин - бета 4, которые являются стимуляторами деления клеток сердца, а также и других органов. На основании собственных исследований о защите ткани тимуса от повреждения при стрессе авторы предположили и обнаружили наличие этих пептидов, присущих эндокринной железе высших животных, в составе ФК из гусениц восковой моли. Это объясняет восстановительное действие препаратов ВМ на ткани сердца и легких при патологии. Кроме того, на модели - ускорение заживления инфицированной раны, авторы показали наличие рост-стимулирующего действия ФК. Эти данные заставили обратить более серьезное внимание на лечебное действие ФК на организм самого больного человека.
Для выяснения механизмов такого действия было проведено исследование влияния ФК на основную систему нервной регуляции тканей органов - вегетативную. Она управляет переключением между двумя основными состояниями живых тканей - работой и покоем, в котором происходят восстановительные процессы трат на работу. Соответственно система состоит из двух частей - симпатической, стимулирующей работу, и парасимпатической, стимулирующей процессы восстановления. На уровне гормонов это осуществляется действием АДР или АЦХ соответственно. Ранее авторы показали, что их действие включает влияние на процессы в митохондриях с участием известных ранее только как субстраты кислот - ЯНТ и КГЛ в качестве сигнальных молекул - синергистов АДР и КГЛ. Действие направлено на ферменты, окисляющие эти субстраты - СДГ и КДГ. Они известны только как рядовые равноправные участники процессов энергообеспечения. Однако СДГ играет ведущую роль в энергообеспечении активной деятельности, а КДГ - в обеспечении восстановительных процессов.
Максимальная активность СДГ осуществляется при высоком уровне энергизации митохондрий и высоком мембранном потенциале. Эти условия тормозят и подавляют активность КДГ. Она, однако, активируется при наступающем «утомлении» митохондрий, которое связано с падением энергизации и потенциала.
Такой подход к анализу механизма действия ФК позволил предположить, что хорошо известное - «убийственное» действие СДГ на одноклеточного микроба может оказывать лечебное влияние на состояние многоклеточного организма.
Было показано, что на состояние митохондрий высших животных ФК оказывает такое же сильное мембранолитическое действие, как на микробы. Оно развивается за секунды при добавлении к митохондриям, (пример 10). Обычно такое действие рассматривается также как «убийственное» для митохондрий.
Однако, в современных условиях жизни выявляется вредоносность избытка накопления энергии митохондриями. Она обусловлена избытком пищи и недостатком физической активности человека. Это состояние рассматривается как бич цивилизации и основа болезней, которые увеличиваются по количеству и омолаживаются по возрасту. К ним относится: потеря чувствительности к инсулину (диабет), гипертония, онкологические заболевания. Основой обмена веществ этих патологий является расстройство подвижного переключения окисления жиров и углеводов - метаболический синдром. Он представляет собой - застой энергетического обмена. Для клеток, попавших в гиперэргическое состояние, сброс потенциала является лечебным воздействием. Он помогает преодолеть механизмы, удерживающие это состояние, и перейти к низкоэнергетическому состоянию, которое запускает процессы восстановления.
Это подобно проблеме «похудения», когда трудно вырваться из плена жировых накоплений в организме без дополнительного стимула.
Такое понимание действия ФК позволило авторам предложить свое объяснение, ее восстановительного действия, которое является обратной стороной давно обсуждающегося антибактериального действия ФК.
Мощная группа мембранолитических пептидно-белковых веществ, присутствующих в ФК, повышая проницаемость мембран, убивает организм микроба, состоящий из одной клетки. Однако, снижение проницаемости мембран в некоторых регуляторных клетках макро-клеточного организма может играть эффективную регуляторную роль при патологиях, обусловленных постоянным стрессом.
Таким образом, ФК оказывает лечебное действие не благодаря «подстегиванию» функций, которое невозможно при ослаблении, а усилением восстановления, которое требует ослабления - отключения импульсов, стимулирующих работу и энергообеспечение.
На уровне гормонов это означает хорошо известное реципрокное подавление импульса адреналина действием ацетилхолина. По существу это отражает двойственность ответа на стресс. Он воспринимается больше, как внешняя реакция на раздражитель: сокращение мышцы, зрительное возбуждение и др. Известно, но более скрыто от наблюдения, что ответ на стресс несет одновременно и адаптационную, приспособительную реакцию, по сути, анти-стрессорную. Она не так очевидна для наблюдения. На уровне митохондрий ее количественное измерение оценивают по соотношению активности СДГ и КДГ (пример 4).
Резюмируем вышесказанное следующим образом: мембранолитическое действие ФК позволяет уменьшить интенсивность работы - стрессорной составляющей ответа на воздействие, и тем самым включить восстановление, то есть антистрессорную часть реакции ткани, при этом рабочий выход «ослабевает» в смысле произведенной работы. Однако он становится более полноценным для жизни в смысле поддержания биологической устойчивости ткани.
Таким образом, ФК (ВОСКОВИТ) действительно поддерживает основу жизни - процесс самовоспроизведения живых структур, их восстановление.
Краткое описание чертежей
На фиг. 1 схематически иллюстрировано представление о системе физиологической регуляции, объединяющей действие двух противоположно влияющих на деятельность тканей симпатической (адренэргической) и парасимпатической (холинэргической) ветвей вегетативной регуляции с процессами окисления субстратов в митохондриях. Система включает действие гормонов адреналина (АДР) и ацетилхолина (АЦХ) на дегидрогеназы, окисляющие только два субстрата - янтарную (ЯНТ) и α-кетоглутаровую (КГЛ) кислоты - сукцинатдегидрогеназу (СДГ) и α-кетоглутаратдегидрогеназу (КДГ) соответственно. Это воздействие на митохондрии синергично с новым сигнальным действием только этих двух субстратов на митохондрии через рецепторы, специфические для ЯНТ и КГЛ.
На фиг. 2 схематически представлено соотношение работы и восстановления при патогенном и физиологическом напряжении (стрессе, деятельности, активности)
Повреждающая нагрузка - слева
Развивающая (тренирующая) нагрузка - справа
Ответ развивается по терминологии Селье от начальной, острой стадии - реакция тревоги, через стадию адаптации к заключительной фазе, которая резко различна при разной нагрузке.
По вертикальной оси показана амплитуда и характер ответной реакции. При повреждающей нагрузке размах активности больше, но значительная часть реакции вызывает повреждения в ткани, которые отмечены серой зоной между кривыми. Стадия адаптации в этом случае сменяется стадией истощения, требующей длительного восстановления, или частично необратимой. Нижние кривые показывают уровень ответа, не повреждающий ткань. При реакциях в физиологическом диапазоне компенсаторных возможностей амплитуда ответа, рабочая активность меньше, но при такой деятельности зона повреждения очень мала или отсутствует, зато вместо повреждения в ткани гораздо больше усиливаются восстановительные процессы, светлая зона, которые перекрывают исходный уровень. Такая физиологическая тренировка нагрузкой лежит в основе прогрессивного развития.
На фиг. 3 представлена средняя активность СДГ в митохондриях лимфоцитов и доля клеток в популяции с разной активностью (сплошной и пунктирный контур столбиков - соответственно) при разных состояниях организма - норма, симпатическая гиперактивность - стресс, нефизиологическое ингибирование.
На фиг. 4 представлено тонкое разделение низкомолекулярных пептидов и белков с использованием разработанной нами системы электрофореза.
В качестве метчиков молекулярной массы использован природный препарат тималин (крайняя левая дорожка) и синтетические метчики (крайняя правая дорожка). Их масса указана в KDa. Под номерами 1-5 представлено 5 разных образцов ФК с высокой антиоксидантной активностью по хемилюминесцентному методу (верхняя надпись над дорожками) и по адреналиновому методу (нижняя надпись над дорожками).
На фиг. 5 представлено разделение белково-пептидной фракции ФК с помощью электрофореза в трис-трициновой буферной системе (рН 8.45). 16,5% акриламидный гель. Дорожки: 1 - маркеры молекулярного веса (Fermentas, Литва), 2-3 - ФК, полученная из живых личинок, 4-6 - экстракты, хранившиеся в холодильнике 3 месяца, 4 - из живых личинок, 5 и 6 - из лиофилизированных. 7 - коммерческий препарат тималина, 8-10 - образцы, аналогичные 4-6, но хранившиеся при комнатной температуре.
На фиг. 6 представлена идентификация полосы тимогена в ФК сравнением с природными препаратами - тималином, тимогеном (Т) и его синтетическим аналогом бестимом (Б), а также оценка влияния различных способов экстракции на белково-пептидный состав ФК с использованием стандартных маркеров (М). №1 - экстракт для ФК получен из живых личинок; №2-А - из лиофилизированных личинок: №2 - из свежеполученных, №3 и 4 - из хранящихся в морозильнике 1 и 3 года, соответственно.
На фиг. 7 представлена идентификация полосы тимозина в ФК в сравнении с синтетическим аналогом тимозина бета-4 (44 аминокислоты, М.в. 4,8). 1-3 - разные препараты ФК, М - маркер.
На фиг. 8 представлено влияние хранения в различных условиях (12 месяцев) на белково-пептиный состав ФК и ее антиоксидантную активность. Вверху приведены значения АОА по хемилюминесцентному методу. Каждый вариант ФК хранили в холодильнике или при комнатной температуре, что указано над дорожками.
На фиг. 9 представлена оценка влияния потенциальных протекторов на сохранение свойств ФК при длительном хранении. Препараты хранили в тепле или холодильнике в течение 21 месяца. В качестве возможных протекторов был использован углекислый газ и дигидрокверцетин (ДГКВ) в концентрациях 0,1 и 1 г/л. На последнюю дорожку нанесен коммерческий препарат из личинок восковой моли.
На фиг. 10 представлены белково-пептидные компоненты, выявляемые методом электрофореза в полиакриламидном геле, в препаратах ФК, полученных разными способами.
1, 2 - препараты ФК, полученные из предобработанных гусениц
3, 4 - препараты из живых гусениц
5, 6 - препараты из замороженных гусениц.
1, 3, 5 - препараты из гусениц, выращенных на восковой суши
2, 4, 6 - препараты из гусениц выращеных на смеси мерва-сушь.
Каждый из шести представленных на рисунке препаратов является смесью равных количеств 4-х отдельно полученных данным способом препаратов.
Цифрами над номерами препаратов обозначены:
нижний ряд - АОА, усл.ед./мл;
верхний ряд - содержание аминокислот, мг/л.
Тим - тималин, аптечный препарат, пептидная фракция тимуса телят, М - маркеры.
На фиг. 11 представлены графики дозозависимого нгибирующего действия пяти отдельно полученных образцов фармкомпозиции на аутоокисление адреналина.
На фиг. 12 показано дозозависимое ингибирующее действие ФК на скорость восстановления нитросинего тетразолия супероксидными анион-радикалами, образующимися при окислении ксантина ксантиноксидазой.
На фиг. 13 представлено ингибирующее действие ФК на интенсивность люминолзависимой хемилюминесценции активированных нейтрофилов крови человека.
Сверху вниз: без добавления ФК; 0,22%; 0,9%; 2,3% ФК (V/V). Приведены средние значения 8 экспериментов, в которых использовали кровь четырех доноров. В каждом эксперименте измерения хемилюминесценции проводились в 2-3 повторах.
На фиг. 14 представлена АОА в двух разных препаратах ФК при хранении на холоду (вверху) или при комнатной температуре (внизу). Определение по аутоокислению адреналина (слева) или хемилюминесцентным методом в системе АДБА-люминол (справа). По оси абсцисс - время хранения в сутках. По оси ординат - АОА в усл.ед./мл ФК. За единицу АОА на рисунках слева принято такое количество препарата в мкл, которое ингибирует реакцию аутоокисления адреналина на 50%. За единицу АОА на рисунках справа принято такое количество препарата в мкл, которое приводит к такому же изменению латентного периода хемилюминесценции в модельной системе, как и тролокс в концентрации 1 мкМ.
На фиг. 15 представлено влияние условий хранения на АОА ФК, измеряемую по ингибированию аутоокисления адреналина.
На фиг. 16 представлена антиоксидантная активность препаратов ФК, полученных разными способами (3-5), препарата ФК при длительном хранении в тепле (6), а также экстрактов из личинок восковой моли, полученных кустарным способом (1, 2, 7) * За единицу АОА принято количество мкл препарата, необходимое для 50% ингибирования аутоокисления адреналина. За единицу прооксидантной активности принято количество мкл препарата, необходимое для 50% активации аутоокисления адреналина.
На фиг. 17 представлены результаты разделения методом гельэлектрофореза белков и пептидов, содержащихся в разных образцах ФК
1 дорожка (Т): препарат тимоген (дипептид глутамилтриптофан); 2-5 дорожки - препараты ФК:
2 (-4%) - ФК из живых личинок после 8 мес.хранения;
3 (11%) - ФК, 5 лет хранения, из живых личинок;
4 (70%) - ФК из сырья, хранившегося 4 года;
5 (86%) - ФК из свежего сырья; 6 дорожка (М) - маркеры.
Над дорожками указана степень ингибирования аутоокисления адреналина при внесении 50 мкл исследуемого экстракта в стандартную инкубационную смесь.
На фиг. 18 представлено анти-стрессорное действие ФК на активность СДГ и КДГ у животных умеренно возбужденных и более спокойных.
А: Изменение активности ферментов (измеряемых по общей площади гранул формазана в 30 клетках, мкм2) в лимфоцитах контрольных и получавших ФК (1 мл по схеме: 5 дней кормления - 2 дня перерыв - 1 день кормление) крыс при введении адреналина (50 мкг/100 г веса). В представленном опыте группа животных имела немного повышенную активность СДГ в покое.
Б: Идентичный по постановке опыт на животных с низкой активностью СДГ в покое.
На фиг. 19 представлено анти-стрессорное действие ФК на активность СДГ и КДГ у крыс на разных моделях стресса - введение адреналина и 24 часовой психоэмоциональный стресс.
Изменение активности ферментов (измеряемых по средней площади гранул формазана в клетке, мкм2 в лимфоцитах контрольных и получавших ФК (1 мл по схеме: 5 дней кормления - 2 дня перерыв - 1 день кормление).
На фиг. 20 представлено антистрессорное действие ФК по показателю накопления ионов кальция в митохондриях при введении АДР (вверху) или при 30 -мин психоэмоциональном стрессе (внизу).
На фиг. 21 представлено анти-стрессорное действие ФК по предотвращению увеличения веса селезенки при введении адреналина.
На фиг. 22 представлена интенсивность индуцированной 200 мкг/мл зимозаном хемилюминесценции крови у интактных или у принимавших ФК животных после введения адреналина (вверху) или после 30 минутного ПЭС.
На фиг. 23 представлена интенсивность индуцированной зимозаном (200 мкг/мл) хемилюминесценции в расчете на 10 тысяч нейтрофилов в крови у интактных или получавших ФК крыс после введения адреналина (вверху) и после 30 минутного ПЭС (внизу). Приведены расчетные значения (отношение хемилюминесценции 20 мкл крови на число нейтрофилов в этом объеме) *р<0.05; по сравнению с ПЭС.
На фиг. 24 представлено количество нейтрофилов в крови интактных или получавших ФК крыс после введения адреналина (вверху) и 30 минутного ПЭС (внизу). На каждом графике представлены средние значения трех независимых экспериментов. *р<0,005 по сравнению с адреналином или ПЭС.
На фиг. 25 представлены лейкоцитарные индексы интактных и получавших ФК крыс после введения адреналина (вверху) и 30 минутного ПЭС (внизу). На каждом графике - средние значения трех независимых экспериментов.
На фиг. 26 представлена интенсивность спонтанной хемилюминесценции крови крыс при внутрибрюшинном введении адреналина (вверху) и при 30-минутном ПЭС. Данные представлены в % к контролю.
На фиг. 27 представлены микрофотографии окрашенных срезов легочной ткани мышей, зараженных МБТ. Группа №4 (без лечения). Увеличение × 100.
Видны рассеянные крупные и средние лимфо - макрофагальные гранулемы в: А - межальвеолярных септах; В - перибронхиальной области; С - периваскулярной области. В ткани легких по ходу межальвеолярных септ, в перибронхиальной и в периваскульярной ткани обнаруживаются массивные, диффузно-очаговые, преимущественно лимфоцитарные, клеточные скопления и лимфоцитарные гранулемы. Выражено полнокровие сосудов. Встречаются очажки ацинарного типа эмфиземы.
На фиг. 28 представлены микрофотографии окрашенных срезов печеночной ткани мышей, зараженных МБТ. Группа №4 (без лечения).
Видны множественные лимфо - макрофагальные инфильтраты: А - крупные; В - средние. По ходу вен, триад и желчных протоков располагаются массивные клеточные скопления с преобладанием в них лимфоцитов. В паренхиме печени обилие лимфоцитарных гранулем с «рассыпным» распределением. Выражена дискомплексация печеночных балок с гибелью ряда групп гепотацитов.
На фиг. 29 представлены микрофотографии окрашенных срезов легочной ткани мышей, зараженных МБТ. Группа №3 (Лечение ФК 150 мкл/мышь/день). Увеличение × 100. Видны разреженные, субмикроскопические лимфо - макрофагальные скопления в: А - межальвеолярных септах; В - перибронхиальной области; С - периваскулярной области; D - нормальная ткань легкого.
В легочной ткани встречаются единичные гранулемы, инфильтративные проявления, включая интерстициальные, расценены как скудные. Выражено снижение активности специфического для туберкулеза воспалительного процесса и наличие обширных участков нормальной легочной ткани присущей для интактных мышей.
На фиг. 30 представлены микрофотографии окрашенных срезов печеночной ткани мышей, зараженных МБТ. Группа №3 (Лечение ФК 150 мкл/мышь/день).
Видны: А - субмикроскопические эпителиоидно - макрофагальные гранулемы; В - лимфоцитарная инфильтрация.
В печени встречаются участки с высоким содержанием субмикроскопических эпителиоидно- макрофагальных гранулем; по ходу септ лишь кое-где обнаруживаются минимальные проявления лимфоцитарной инфильтрации.
На фиг. 31 представлена ЭКГ крысы из группы I (норма)
На фиг. 32 представлена ЭКГ крысы группы II (ЭИМ без лечения) через 1 час после операции.
Снижение сегмента ST ниже изолинии (депрессия) характеризует постинфарктные ишемические изменения и свидетельствует о недостаточности кровоснабжения и гипоксии миокарда.
На фиг. 33 представлена ЭКГ крысы из группы II (ЭИМ без лечения) через 3 дня после операции.
На фиг. 34 представлена ЭКГ крысы из группы V (терапия ФК в дозе 500 мкл/крыса) через 3 дня после операции.
Величина депрессии сегмента ST ниже, чем в группе II (без лечения, фиг. 32).
На фиг. 35 представлена ЭКГ крысы из группы II (ЭИМ без лечения) через 7 дней после операции. Величина депрессии сегмента ST в группе II увеличилась по сравнению со сроком 3 суток.
На фиг. 36 представлена ЭКГ крысы из группы V (терапия ФК в дозе 500 мкл/крыса) через 7 дней после операции.
Величина депрессии сегмента ST в группе V (терапия ФК в дозе 500 мкл/крыса) значительно менее выражена, чем в группе без лечения (группа II, фиг. 35).
На фиг. 37 представлены микрофотографии окрашенных срезов миокарда левого желудочка сердца крыс: интактной (а) и группы II через 24 ч (б), через 3 (в) и 7 (г) суток после ЭИМ. Окраска по Ван Гизону, увеличение 40×7.
На фиг. 38 представлены микрофотографии окрашенных срезов миокарда левого желудочка сердца крыс из групп III (а), IV (б), V (в) через 3 суток и в группе V (г) через 7 суток после ЭИМ. Окраска по Ван Гизону, увеличение 40×7.
На фиг. 39 представлена динамика заживления раны на коже собаки.
Вверху: лечение с применением ФК.
Внизу: лечение без ФК (контроль).
На фиг. 40 представлено праймирующее действие препарата ФК, полученного путем холодной экстракции буферно-солевым раствором из предобработанных личинок: влияние на интенсивность хемилюминесценции нейтрофилов цельной крови, активированных зимозаном.
На фиг. 41 представлено влияние ФК на накопление ионов кальция в митохондриях (А) и мембранный потенциал митохондрий (Б).
А - изменения мембранного потенциала митохондрий в гомогенатах печени крыс (50 мкл) в ответ на последовательные добавки CaCl2 в конечной концентрации 50 мкМ каждая в присутствии 20 мкл ФК (кривая 1) и в контроле (кривая 2).
Б - влияние пептидной фракции ФК (кривая 1) и тималина (кривая 2) на мембранный потенциал выделенных митохондрий печени. Пептидная фракция получена из 25 мкл экстракта; тималин - аптечный препарат в виде лиофилизированного порошка, 10 мг в ампуле, добавки по 100 мкг каждая.
Гомогенаты или выделенные митохондрии инкубировали в среде 125 мМ KCl, 10 мМ Hepes, 1,5 мМ фосфата, рН 7,2 в присутствии 4 мМ янтарной кислоты. Изменения мембранного потенциала определяли ТФФ+ - селективным электродом.
На фиг. 42 представлен общий вид препаратов ФК, полученных с использованием живых (1) или предобработанных личинок (2). На панели слева, время экстракции сокращено вдвое.
На фиг. 43 представлены фотографии гелей после разделения пептидов в препаратах ФК в ПААГ и окраски азотнокислым серебром. Дорожки 1 и 2 - ФК - из живых и предобработанных личинок, соответственно, (те же препараты, что и представленные на фиг. 42 и в таблице 22). 3 - препарат ФК получен из предобработанных личинок, хранящиеся в течение года при -20°С; 4 - Препарат ФК из предобработанных личинок, хранящиеся в течение 4-х лет при -20°С.
На панели слева - время экстракции сокращено в два раза.
Цифрами сверху указана АОА, определяемая по ингибированию аутоокисления адреналина (усл. ед./мл экстракта).
На фиг. 44 приведены результаты исследования АОА препаратов ФК, полученных в результате 4-дневной холодной экстракции компонентов из предобработанных личинок или из лиофилизированного гомогената личинок в сравнении с 20 дневным экстрактом из нативных личинок.
На фиг. 45 представлена антиоксидантная активность жидкого препарата ФК (ЖФК) (а) и сорбита (б). Антиоксидантная активность оценивалась по степени ингибирования аутоокисления адреналина.
На фиг. 46 представлено ингибирующее действие ЖФК на аутоокисление адреналина в присутствии разных количеств сорбита. Для построения представленных графиков в кювету спектрофотометра вносили указанные объемы раствора сорбита и при каждой концентрации сорбита определяли скорость аутоокисления адреналина в присутствии разного количества добавленной ЖФК. За 100% принимали скорость реакции окисления адреналина без добавок (ингибирование равно 0%).
На фиг. 47 представлена АОА ЖФК в присутствии сорбита. Определение АОА проводили измерение степени ингибирования окисления адреналина фармкомпозицией в присутствии разных концентраций сорбита. За 100% принимали скорость аутоокисления адреналина в присутствии соответствующего количества сорбита. Процент ингибирования добавленным экстрактом определяли по отношению к этой скорости. Верхняя кривая - 200 мкл сорбита (169 мг сухого вещества), пунктирная - 50 мкл (42 мг), средняя - 100 мкл (84 мг).
На фиг. 48 представлена АОА сухого препарата ФК.
В измерительную кювету вносили определенный объем растворенного образца, содержащего от 42 до 169 мг сухого препарата ФК. Добавляли карбонатный буфер, затем раствор адреналина и определяли скорость окисления адреналина по изменению оптической плотности. За 100% принимали скорость окисления адреналина в присутствии соответствующей добавки контрольного образца. Каждая точка - среднее значение измерения 3-х образцов.
На фиг. 49 представлена антиоксидантная активность сухого препарата ФК при 24 дневном хранении в различных условиях.
На фиг. 50 представлена антиоксидантная активность жидкого препарата ФК при 24 дневном хранении в различных условиях.
Осуществление изобретения
Пример 1
Выявление в ФК пептидов и низкомолекулярных белков методом электрофореза в полиакриламидном геле
Целью этого этапа работы было исследование пептидного и (частично) белкового состава ФК для выявления основных действующих веществ и стандартизации качества препарата. Качественный и количественный состав пептидов и белков определяли с помощью электрофореза в полиакриламидном геле различной процентности и буферного состава.
Для оптимального разделения пептидных полос опробовали несколько систем электрофореза, включая нативный электрофорез и стандартный электрофорез по Лэммли в гелях различной процентности (15-20% SDS-ПААГ в буферной системе трис-глицин (рН 6,8-8,8)). Наилучший результат был получен в 15-20% SDS-ПААГ в буферной системе трис-трицин (рН 8,25-8,9) [44]. Данная система анализа позволяет получить хорошо воспроизводимые результаты и, следовательно, может быть использована для стандартизации качества препарата.
Для проведения электрофоретических исследований нами были использованы следующие буферы и реагенты:
Буферы:
катодный: 0.1 M Tris-HCl (ОСЧ, Amresco, Испания, рН 8,25); 0.1М трицин (Ultra pure grade, Amresco, Испания); 0.1% SDS (ОСЧ, Диа-М, Россия)
анодный: 02 M Tris-HCl (ОСЧ, Amresco, Испания, рН 8,9);
солюбилизирующий: 0,063 М Tris-HCl (рН 6.8); 5% 2-меркаптоэтанол (ОСЧ, Диа-М, Россия); 2% SDS; 0.004% бромфеноловый синий; 10% глицерин (USP grade, Panreac, Испания).
Реактивы:
Акриламид (Ultra pure grade, Amresco, Испания);
N,N'-метиленбисакриламид (Ultra pure grade, Amresco, Испания);
персульфат аммония (ОСЧ, Fisher Scientific, США);
TEMED (ОСЧ, Хеликон, Россия);
Для окрашивания гелей было использовано два различных подхода - стандартное окрашивание раствором Кумасси R-250 и более чувствительное окрашивание раствором нитрата серебра. Такое сравнительное окрашивание на первых этапах было необходимо для уверенности в белковом происхождении полос, поскольку нитрат серебра способен окрашивать и полосы ДНК.
В случае использования кумасси, гель после проведения электрофореза окрашивали в течение 10 часов в 0, 25% растворе Кумасси Brilliant Blue R-250 (Sigma, США) (с добавлением 45% этанола и 10% уксусной кислоты (ОСЧ, Химмед, Россия)). Гель отмывали в растворе, содержащем 40% этанол и 7% уксусную кислоту (ОСЧ, Химмед, Россия). Нитратом серебра гели окрашивали по стандартной методике [45].
РЕЗУЛЬТАТЫ
На фиг. 4 показан пример качества разделения фракции низкомолекулярных пептидов и более высокомолекулярных белков с использованием высокопроцентного полиакриламидного геля и буферной системы трис-трицин. Видно, что в такой системе четко разделяются как низкомолекулярная фракция пептидов с весом до 10 кДа, так и более высокомолекулярные белки, обеспечивается качественное разрешение пептидов и белков с молекулярной массой от нескольких сот Дальтон до 50 кДа, что позволяет идентифицировать предполагаемые активные компоненты ФК.
Прежде всего, было выяснено, попадают ли в экстракт и сохраняются ли в нем пептиды и белки, выявленные в тканях гусениц, по литературным данным и присутствует ли в ФК пептид, близкий к тимогену высших животных. Последнее предположение основано на том, что для получения активных препаратов из ВМ принято использовать гусениц перед стадией окукливания. Эта стадия состоит в превращении (метаморфозе) насекомого в новую форму жизни - гусеницы в бабочку. Это аналогично рождению высших животных. На этапе новорожденности и раннего интенсивного развития очень важную роль играет тимус. Известно, что тимус является носителем молодых свойств организма. Снижение его функций происходит при созревании организма, а во взрослом состоянии он сильно уменьшается. Препараты из тимуса используют как повышающие устойчивость при старении или ослаблении организма.
Тимоген - высокоактивный иммуностимулирующий пептид, который оказывает регулирующее влияние на реакции клеточного, гуморального иммунитета и неспецифическую резистентность организма, стимулирует процессы регенерации. Тимоген усиливает процессы дифференцировки лимфоидных клеток, индуцируя экспрессию генов в лимфоцитах, нормализует количество Т-хелперных клеток, Т-супрессоров и их соотношение у больных с различными иммунодефицитными состояниями. Его обнаружение в ФК позволяет объяснить высокую биологическую активность препарата.
Для проверки этого предположения кроме стандартных синтетических маркеров молекулярной массы при электорофорезе были использованы три метчика, содержащие сам тимоген - дипептид глутамил-триптофан (м.в - 0,31 кДа). В первую очередь это препарат из тимуса - тималин. Тималин - аптечный препарат, представляет собой суммарную вытяжку пептидов и белков из тимуса теленка. Тималин производится как источник лечебного тимогена, содержание которого в нем очень высоко и преобладает над другими компонентами. Мы сравнивали положение полосы тимогена в тималине с полосой чистого тимогена или его синтетического аналога - бестима, которые были одинаковыми.
Метчики с тимогеном или бестимом наносили по 20 мкл в концентрации 10 мкг/мл. На остальные дорожки наносили по 20 мкл ФК. В качестве метчиков молекулярной массы использован природный препарат тималин (фиг. 4, крайняя левая дорожка) и синтетические метчики (фиг. 4, крайняя правая дорожка). Их масса указана в кБа. На фиг. 4 под номерами 1-5 представлено 5 разных образцов ФК с высокой антиоксидантной активностью по хемилюминесцентному методу (верхняя надпись над дорожками) и по адреналиновому методу (надпись под верхней).
Рассмотрим электрофореграмму с переднего фронта движения от самых мелких пептидов. Этот фронт приносит главное открытие, подтверждающее наше предположение о наличии тимогена в препарате ВМ. Тимоген в тималине представлен огромной жирной полосой на самом переднем фронте движения раствора по дорожке. Его положение и большое количество в тималине известно по литературе и подтверждено в наших определениях сравнением с полосой добавленного тимогена или его аналога бестима, приведенных на других фигурах (5 и 6). На фиг. 4 видно, что точно на этом уровне во всех исследованных активных препаратах ФК находится четкая полоска в форме срезанного ногтя. Количество этого пептида в ФК велико, поскольку полоска по плотности одного порядка с полосой тимогена. Проведенное определение показывает, что концентрация тимогена в ФК составляет около 5 мкг/мл. Эта полоска воспроизводится во всех препаратах с высокой антиоксидантной активностью (АОА) по адреналину (фиг. 5 и 6), но ее интенсивность снижается или она исчезает в препаратах с низкой АОА (фиг. 7, 8, 9). Таким образом, наличие тимогена не вызывает сомнений, так как подтверждено тремя естественными метчиками, высоким содержанием, присутствием в образцах ФК с высокой антиоксидантной активностью и исчезновением при потере этой активности.
Оказалось, что содержание в ФК пептидов с массой между 4 и 8 кДа, которые известны для гусениц ВМ, ниже, чем тимогена: от 0,5 до 5 мкг/мл. Однако, их присутствие наблюдается во всех препаратах. Минимально оно в последнем образце с минимальной антиоксидантной активностью. Пептиды этой группы обладают очень высокой литической активностью и поэтому могут вносить существенный вклад в биологическую активность ФК. По данным литературы в этой группе могут находиться перечисленные ниже пептиды:
1. Цекропин-D-подобный пептид, Mw=4,256 кДа, 39 аминокислот.
2. Лебоцин-подобный антимикробный пептид 1, Mw=4,819 кДа, 42 аминокислоты.
3. Дефензин-подобный пептид, Mw=4,949 кДа, 44 аминокислоты.
4. Анионный антимикробный пептид 2, Mw 6,980 кДа, 60 аминокислот.
5. Дефензин (Галиомицин), Mw=7,823 кДа, 72 аминокислоты.
Все эти компоненты обладают высокой литической и антибактериальной активностью в отношении ряда грам-положительных (Micrococcus luteus, hysteria monocytogenes, Sternbergia luted) и грам-отрицательных (E.coli) бактерий. Кроме того, они способны проявлять фунгицидное действие в отношении Aspergillus niger, Candida albicans, Candida fructus, Candida wickerhamii, Pichia pastoris, Pichia tannophilus, Trichoderma harzianum и Zygosaccharomyces marxianus. [46, 47]
Далее на уровне полосы метчика 18 кДА и немного ниже отмечается одна мажорная полоса (выше) несколько более слабых (ниже). Они почти отсутствуют в последнем образце с более низкой антиоксидантной активностью.
Относительные концентрации данных веществ в препарате составили: от 0,5 до 5 мкг/мл активных пептидов, от 1 до 10 мкг на мл СОД и от 0,1 до 1 мкг/мл лизоцима.
Рассматривая данную группу в том же порядке снизу вверх, по данным литературы [46-49] можно предполагать выявление в ФК следующих веществ, найденных в гусеницах ВМ;
1. 14,027 кДа. Лизоцим, 121 аминокислота. В первую очередь, обладает бактериолитической активностью. Кроме того, он связан с системой макрофагов и усиливает активность иммунных клеток. 0,1-1 мкг/мл.
2. 16,3-17 кДа. Мономер Cu-SOD супероксиддисмутазы насекомых, которая обладает ярко выраженной антиоксидантной активностью. 1-10 мкг/мл.
3. ~17,5 кДа - Аполипофорин III. Специфический белок восковой моли, который связывается с липополисахаридами клеточной стенки бактерий и усиливает литическое действие лизоцима [49]. До 100 мкг/мл.
Особенно вероятно присутствие аполипофорина III в виде наиболее интенсивной полосы на уровне метчика 18 кДА, соответствующего массе этого пептида. Ввиду большой литической активности и высокого содержания аполипофорин может играть ведущую роль в регуляции состояния организма человека, рассмотренную далее в примере 10.
Проведенные исследования показали, что получаемый способом по изобретению препарат из ВМ содержит большое разнообразие и в достаточных количествах биологически активных пептидов и белков в основном с антиоксидантной и литической активностью.
Отдельно контролировали зависимость состава ФК от способа получения и хранения препарата. Эти результаты приведены на фиг. 5 при окрашивании двумя способами.
На фиг. 6 показан результаты электрофореза образцов после 20 дней экстракции, полученных из живых личинок (1), из лиофилизированных свежих личинок (2), лиофилизированных личинок, хранившихся 1 год при -20°С (3) и из лиофилизированных личинок после трех лет хранения при -20°С (4). На фиг. 6 видно, что оптимальное качество получено в третьем варианте приготовления ФК, что было подтверждено и максимальной АОА данной ФК (400 у.е./мл по адреналину против 286 в варианте 2 и 47 в варианте 4). Также проводился электрофорез образцов после 10-дневной экстракции, где интенсивность полос была гораздо меньшей, как и АОА ФК. Поэтому в дальнейшем экстракция препарата проводилась именно по третьему способу.
На фиг. 7 приведена идентификация полосы тимозина бета-4 в ФК при сравнении с синтетическим аналогом (44 аминокислоты, молекулярный вес 4,8).
На фиг. 6 приведена идентификация полосы тимогена в ФК при сравнении с природными метчиками - тималином, тимогеном и его аналогом - бестимом.
Фиг. 6, как и другие, также показывает, что самая подвижная полоса фракции низкомолекулярных пептидов соответствует полосе коммерческого тимогена, тимогена в тималине и бестима. Как и в других определениях, содержание тимогена составляет около 5 мкг/мл.
В этом определении, как и на фиг 4, присутствуют несколько белков с молекулярной массой между 14-18 кДа, что соответствует описанному в ВМ лизоциму, СОД насекомых и аполипофорину III.
Эти и другие данные показывают, что АОА препарата хорошо коррелирует с концентрацией пептидов в нем, а длительное хранение при комнатной температуре снижает оба показателя. Был проведен дополнительный эксперимент с несколькими параллельными образцами, которые хранились при комнатной температуре или в холодильнике в течение 12 месяцев. Параллельно с электрофоретическими исследованиями белково-пептидного состава проводили и измерение антиоксидантной активности двумя различными способами - по адреналину и по хемилюминесценции. Результат данного исследования приведен на фиг 8. В качестве метчика использован природный препарат «Тималин» стандартные маркеры.
Фиг. 8 показывает, что АОА активность ФК коррелирует с содержанием низкомолекулярной фракции пептидов - чем она ярче, тем выше АОА активность - а также с содержанием в препарате супероксиддисмутазы Cu-СОД: на всех гелях - полоса с молекулярной массой 17 кДа - вторая полоса маркеров снизу. В то же время следует отметить, что при хранении в тепле АОА по адреналиновому методу исчезает, а при хранении в холоде медленно снижается (фиг. 14, 15, 17).
Приведенные данные показывают, что продолжительное хранение ФК нужно проводить в холодильнике. Кроме такого способа сохранения активных веществ мы исследовали возможность их защиты с помощью разрешенных для употреблении протекторов.
На фиг. 9 показан результат подобного эксперимента - препараты хранили в тепле или холодильнике в течение 21 месяца. В качестве возможных протекторов был использован углекислый газ и специальный протектор - дигидрокверцетин в концентрациях 0,1 и 1 г/л.
На фиг. 8 и 9 четко видно, что продолжительное хранение в тепле приводит к снижению белково-пептидного состава ФК.
Добавка углекислого газа даже дополнительно разрушает компоненты ФК. Добавка дигидрокверцетина в меньшей концентрации мало эффективна. Но в концентрации 1 г/л существенно повышает сохранность белков и пептидов.
Важность контроля условий хранения и получения препарата для обеспечения его высокого качества следует из анализа последнего образца, приведенного на фиг. 9. На данный электрофорез был нанесен продающийся на рынке без должной документации кустарный препарат, обозначенный как «чужой». В этом препарате не наблюдается даже следовых количеств возможных активных белково-пептидных компонентов.
Пример 2
Содержание аминокислот, пептидов, АОА активности и карбоновых кислот в ФК в зависимости от способа получения
Общие условия выращивания гусениц
Для получения фармкомпозиции использовали гусеницы Восковой моли, культивируемые в лабораторно-производственных условиях Питомника восковой моли ИТЭБ РАН, с соблюдением круглогодичного температурного, светового и влажностного режима помещений. Гусеницы выращивали в открытых контейнерах. В качестве корма использовали темную восковую сушь и мерву в соотношении 1:1. В некоторых случаях гусеницы выращивали только на темной восковой суши без подкормок. Периодически контейнеры с личинками опрыскивали 20% раствором сахарного сиропа. Для приготовления ФК собирали гусеницы, находящиеся на последней стадии развития, перед окукливанием. Далее экстракцию компонентов ФК проводили или непосредственно из живых гусениц или из гусениц, подвергнутых предварительному замораживанию или лиофилизации. В первом случае отобранных гусениц, после удаления паутины и остатков восковой суши, помещали в стеклянные сосуды и добавляли раствор этилового спирта-ректификата (из расчета 450 мл раствора экстрагента на 100 г гусениц). Экстракцию проводили при 20-25°С в темноте, при периодическом перемешивании в течении 21 суток. Экстракт фильтровали. Затем проводили вторичную экстракцию, добавляя экстрагент из расчета 20% от первоначального объема. Экстракцию проводили в течение 2-3 дней с последующей фильтрацией. Таким же способом проводили экстракцию из предобработанных гусениц: замороженных при -20°С или лиофилизированных гусениц. Лиофилизацию проводили на установке ЛС-500 (Россия). Было приготовлено шесть вариантов ФК как указано в таблицах 1 и 2, отличающихся по способам выращивания гусениц и приготовления экстрактов. Для каждого варианта ФК, указанного в таблицах 1 и 2, а также на фиг. 10, получали по 4 отдельных препарата, которые затем смешивали в равных пропорциях и в полученных экстрактах определяли содержание сухого вещества (по ГОСТ Р 51437-99).
Определение аминокислот
Содержание аминокислот определяли в ООО ИЛ Тест-Пущино с использованием метода ВЖКХ на аминокислотном анализаторе YL-9100-Pinnacle PCX (по протоколу Comission Regulation (EC) №152/2009). Содержание аминокислот в указанных выше препаратах ФК представлено в таблице 1.
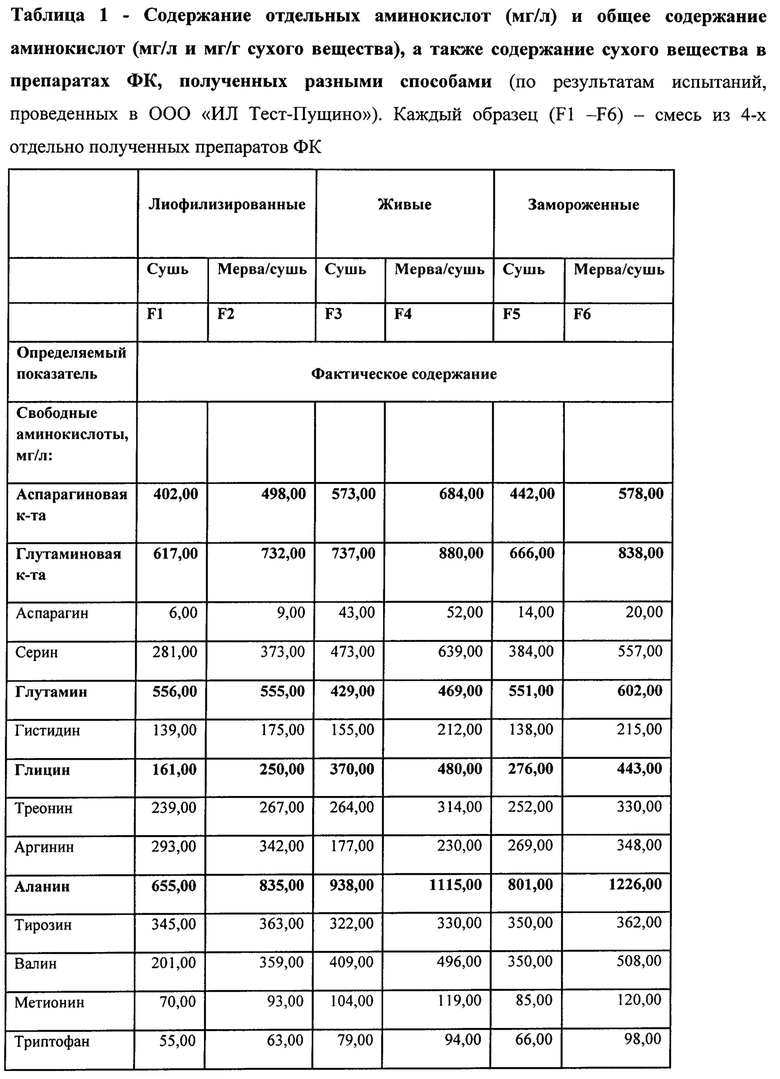
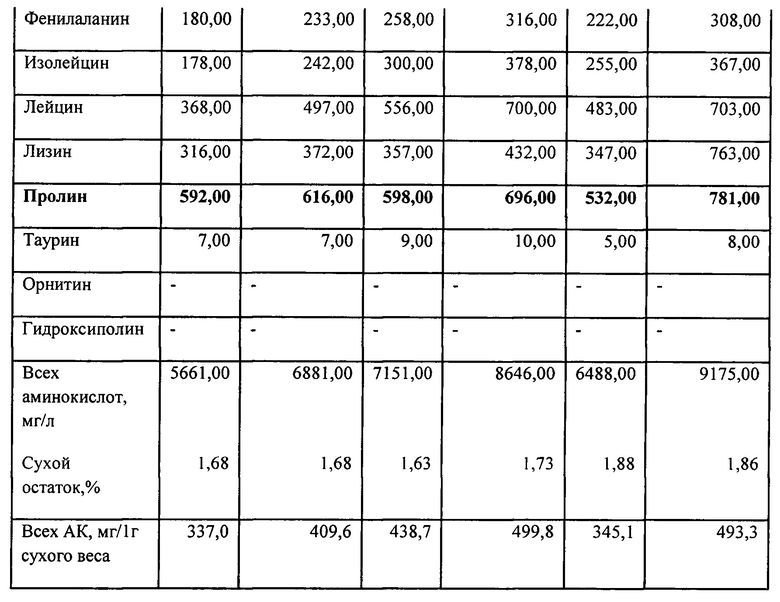
Как следует из таблицы 1, ФК содержит широкий спектр различных аминокислот. Обращает внимание, что в наибольших концентрациях представлены аминокислоты, - участники процесса переаминировния: АСП, ГЛУ-Глутамин, ГЛИ, АЛА. Активация переаминирования приводит к защите от гипоксии, так как обходит в митохондриях этапы, требующие участия окисленного НАД. С регуляцией тканевой гипоксии связан и ПРО (во взаимодействии с КГЛ), содержание которого также повышено. ГЛИ обладает седативным эффектом в организме, что важно для антистрессорного действия ФК.
Как следует из таблицы 2, при любом способе получения ФК общее содержание аминокислот выше при выращивании гусениц на комбинированном корме. Общее содержание аминокислот несколько выше (в 1,2 раза) в препаратах ФК, полученных из живых гусениц, в то время как АОА в них значительно ниже (до 2 раз) ниже, чем в препаратах ФК из предобработанных гусениц. Это может указывать на распад пептидов в препаратах из живых гусениц, так как показано, что величина АОА соответствует уровню пептидов (фиг. 10, а также пример 1). В сопоставлении с прототипом содержание аминокислот при предложенных модификациях получения увеличивается, так как сухой остаток повышается - около 1% в прототипе и в среднем 1,7% в заявленной ФК.
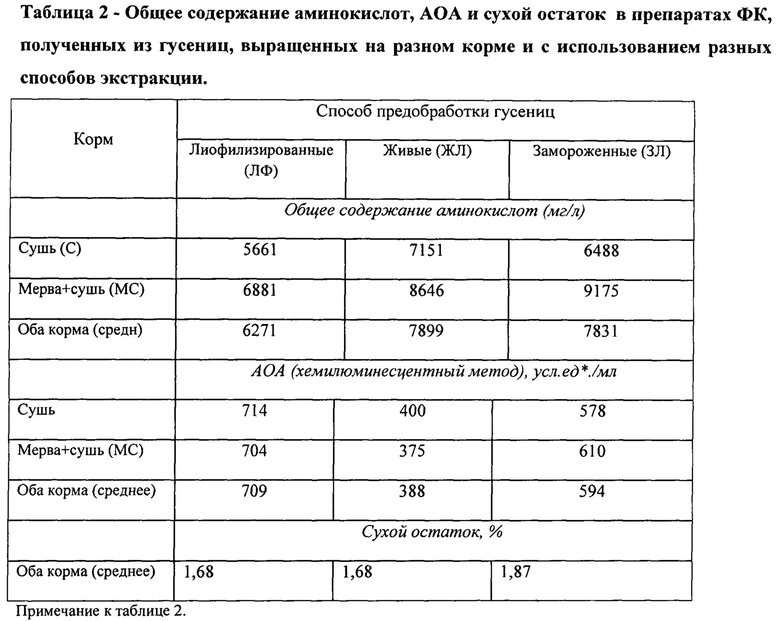
Для определения сухого остатка и содержания спирта объединяли экстракты, полученные на разных типах корма. *За 1 усл. Ед. принят такой объем экстракта, который при добавлении в модельную систему, приводит к таким же изменениям латентного периода ХЛ как и добавление тролокса в концентрации 1 мкМ.
Содержание сухого вещества в получаемых препаратах ФК составляет в среднем 1,7%, что превышает содержание сухого вещества (около 1%) в экстракте восковой моли, описанном в аналоге [16].
Определение пептидов и АОА
Кроме аминокислот в полученных экстрактах проводили определение содержания пептидов методом электрофореза в ПААГ как указано в примере 1, а также антиоксидантной активности (АОА). АОА определяли по ингибированию люминесценции, сопровождающей термическое разложение α,α'-азодиизобутироамидин дигидрохлорида (АДБА) как описано в примере 3.
За единицу антиоксидантной активности исследуемого препарата принимали такой его объем (в мкл) который при добавлении в модельную систему, который приводит к таким же изменениям латентного периода ХЛ как и добавление тролокса в концентрации 1 мкМ. АОА выражали в условных единицах в 1 мл ФК. Результаты представлены на фиг. 10. Как следует из фиг. 10, содержание пептидов выше при использовании для получения ФК предобработанных гусениц по сравнению с живыми. Максимальное содержание пептидов наблюдается при включении в процедуру получения ФК стадии лиофильной сушки. В препаратах ФК, полученных этим способом, наблюдается также максимальная АОА. Это еще раз показывает связь содержания пептидов и АОА активности, которая отмечалась в ряде сопоставлений.
Определение карбоновых кислот
Для выявления органических кислот в экстракте его анализировали с помощью высокоэффективной жидкостной хроматографии на колонках Aminex НРХ-87Н для отделения органических кислот (300×7.8 mm; Bio-Rad, United States). Элюировали 4 мМ H2S04 со скоростью 0,5 мл/мин при температуре 35°С. Кислоты детектировали спектрофотометрически при длине волны 210 нм. Колонку калибровали стандартными растворами ожидаемых кислот: изолимонной, лимонной, альфа-кетоглутаровой, (Boehringer; Mannheim, Germany). Для количественного определения содержания органических кислот в экстракте использовали энзиматические методы. Для определения α-кетоглутаровой кислоты использовали реакцию, катализируемую глутаматдегидрогеназой [50]. Под действием фермента в присутствии ионов аммония α-кетоглутаровая кислота превращается в глутамат. NAD+ восстанавливается до NADH в количестве, эквивалентном количеству присутствующей в среде α-кетоглутаровой кислоты. Для определения изолимонной кислоты измеряли NADPH, образующийся при в результате превращения изолимонной кислоты в α-кетоглутаровую под действием фермента NADP+ - зависимой изоцитратдегидрогеназы [51].
Окисление изолимонной кислоты сопровождается образованием восстановленного NADPH2, количество которого измеряли на спектрофотометре Spekol при длине волны 340 нм. Точность измерения изолимонной кислоты этим методом составляет 90-95%. В таблице 3 представлены данные по содержанию карбоновых кислот в ФК. В таблице представлены результаты определения в пяти параллельно полученных образцах ФК (приготовленных с использованием предобработанных гусениц).

Как следует из таблицы 3, Содержание альфа-кетоглутаровой кислоты, (которая ввиду присутствия кето- группы известна как нестабильное вещество), снижается при хранении ФК. Хранение на холоду замедляет снижение содержания альфа-кетоглутаровой кислоты. Содержание изолимонной кислоты остается постоянным даже при длительном хранении при комнатной температуре.
Пример 3
Антиоксидантная активность (АОА) фармкомпозиции
Принято считать, что для полной характеристики антиоксидантных свойств в препаратах, представляющих собой смесь различных соединений, необходимо использовать разные методы определения АОА, т.к. это позволяет выявить в смеси компоненты с разной по механизму действия антиоксидантной активностью [52]. Поэтому в данной работе проводили исследования АОА несколькими методами, описанными ниже, а для экспресс-контроля качества ФК выбрали два наиболее информативных и удобных.
Антиоксидантная активность фармкомпозиции (ФК) была протестирована в различных модельных системах.
Для характеристики антиоксидантной активности ФК использовали следующие методики:
1. Определение антиоксидантной активности (АОА) по ингибированию аутоокисления адреналина;
2. Определение АОА по ингибированию восстановления нитросинего тетразолия в ксантинокидазной реакции;
3. Определение АОА по ингибированию люминесценции, сопровождающей термическое разложение α,α'-азодиизобутироамидин дигидрохлорида (АДБА) с использованием антиоксиданта тролокса в качестве стандарта;
4. Определение АОА по ингибированию люминолзависимой хемилюминесценции активированных нейтрофилов.
1. Определение АОА по аутоокислению адреналина
Для определения АОА по аутоокислению адреналина использовали метод Т.В. Сироты [53], являющийся модификацией метода Misra Н.Р., Fridovich I. [54]. Антиоксидантную активность АОА измеряли по степени ингибирования аутоокисления адреналина в стандартных условиях при внесении в реакционную смесь разных объемов (5-200 мкл) препарата. К 2 мл 0,1 М карбонатного буфера рН 10,6 добавляли нужный объем образца; 100 мкл 0.1% раствора адреналина и измеряли скорость окисления адреналина при длине волны 347 нм при комнатной температуре (20°С). Скорость окисления адреналина без добавленного образца ФК принимали за 100%. Строили график зависимости ингибирования скорости окисления адреналина от количества добавленного образца и определяли количество образца, необходимое для 50% ингибирования скорости аутоокисления адреналина (фиг. 11). Это количество (в мкл) принимали за условную единицу АОА.
На представленных на фиг. 11 графиках - кривые ингибирования аутоокисления адреналина разными дозами образцов ФК. Из этих кривых находится количество ФК, необходимого для ингибирования скорости реакции аутоокисления адреналина на 50%, что принимается за 1 единицу АОА. На фиг. 11 представлены пять отдельно полученных одинаковым способом, но из разных партий сырья образцов ФК. В таблице 4 представлены вычисленные значения АОА данных образцов в условных единицах.
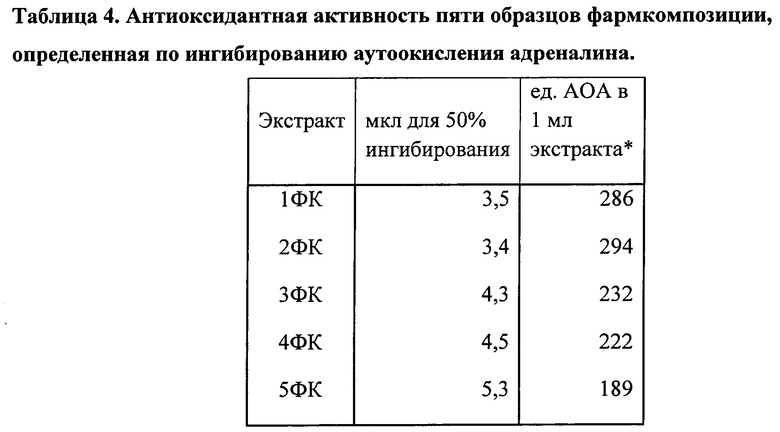
Как следует из фиг. 11 и таблицы 4, АОА в полученных образцах очень близка. При аутоокислении адреналина в щелочной среде образуется большое количество супероксидных анион-радикалов, поэтому данная реакция используется для определения активности супероксиддисмутазы.
2. Определение АОА в ксантиноксидазной реакции.
Для подтверждения наличия супероксиддисмутазной активности в ФК использовали тест с ксантиноксидазной реакцией, используемой для генерации супероксидных радикалов, которые могут быть обнаружены по образованию окрашенного продукта их взаимодействия с нитросиним тетразолием. Определение проводили по методу, описанному [55]. В этой реакции ФК также оказывала дозозависимое подавление образования окрашенного продукта, т.е. проявляло способность инактивировать супероксидные анион-радикалы (фиг. 12).
Таким образом, в ФК двумя методами была обнаружена способность инактивировать супероксидные анион-радикалы. Полученные результаты указывают на наличие супероксиддисмутазы в ФК, что согласуется с данными электрофореза (пример 1)
3. Определение АОА по ингибированию люминесценции АДБА.
Способность ФК инактивировать органические радикалы была протестирована в по ингибированию люминесценции, сопровождающей термическое разложение α,α'-азодиизобутироамидин дигидрохлорида (АДБА). При нагревании молекулы АДБА претерпевают термическую деградацию, разлагаясь на два радикала, при взаимодействии которых с кислородом образуются пероксильные радикалы [56]. Взаимодействие этих радикалов с люминолом приводит к его окислению, сопровождающееся хемилюминесценцией (ХЛ). При введении в систему перехватчика радикалов в системе создается конкуренция за радикал между люминолом и перехватчиком, что сопровождается тушением ХЛ и появлением так называемого латентного периода. Длительность латентного периода определяется временем, за которое антиоксидант полностью расходуется. Иными словами, до тех пор, пока в модельной системе присутствует перехватчики пероксильньгх радикалов АДБА, до тех пор не будет развиваться свечение, а длительность латентного периода определяет антиокислительную активность ингибитора.
Для тестирования или количественного определения антиоксидантной активности исследуемых веществ модельные системы окисления калибруют с использованием стандартного антиоксиданта [57]. Такой подход был применен в данном исследовании. В качестве стандартного антиоксиданта был выбран тролокс, водорастворимый аналог витамина Е, который является хорошим перехватчиком пероксильньгх радикалов [58].
Учитывая тот факт, что зависимости изменения латентного периода ХЛ от объема исследуемых препаратов и концентрации тролокса носили линейный характер, активность препаратов выражали через эквивалентную концентрацию тролокса. Так если уравнение зависимости изменения латентного периода ХЛ от объема исследуемого препарата имеет следующий вид:

где t/to - изменение латентного периода ХЛ; 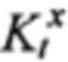 - константа изменения латентного периода ХЛ для исследуемого вещества; V - объем исследуемого раствора, который добавляется к модельной системе;
- константа изменения латентного периода ХЛ для исследуемого вещества; V - объем исследуемого раствора, который добавляется к модельной системе;
а аналогичная зависимость для тролокса:
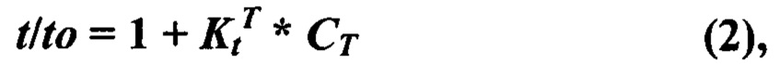
где t/to - изменение латентного периода ХЛ; 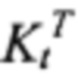 - константа изменения латентного периода ХЛ для тролокса; CT - концентрация тролокса в модельной системе; то можно записать:
- константа изменения латентного периода ХЛ для тролокса; CT - концентрация тролокса в модельной системе; то можно записать:
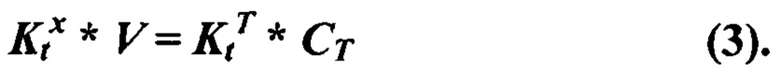
Следовательно, за меру антиоксидантной активности исследуемого препарата можно принять такой его добавляемый объем в модельную систему, который приводит к таким же изменениям латентного периода ХЛ как и добавление тролокса в концентрации 1 мкМ:
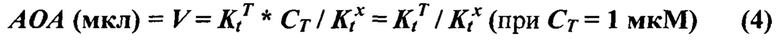
В работе использовали следующие реактивы: люминол, тролокс ("Serva", Германия), α,α'-азодиизобутироамидин дигидрохлорид ("Fluka", Германия).
ХЛ в модельной системе окисления люминола, индуцированного пероксильными радикалами, образующимися при термическом разложении азосоединения АДБА {система люминол-АДБА), регистрировали следующим образом [59]. В реакционную среду, содержащую буферный раствор с люминолом, добавлялся определенный объем исследуемых препаратов или раствора тролокса (конечная концентрация 1 мкМ). Затем добавлялся раствор АДБА до конечной концентрации 10 мМ и регистрировалась кинетика ХЛ в течении 10-60 минут. Измерения проводили с помощью хемилюминометра SmartLum-5773 и програмного обеспечения «PowerGraph». В качестве измеряемого параметра использовали латентный период ХЛ (t), представляющий собой время от момента введения АДБА до начала развития свечения. Латентный период хемилюминесценции находили для каждого препарата(tX) и тролокса(tT).
С помощью этого подхода была оценена антиоксидантная активность нескольких отдельно полученных образцов ФК. Использовались те же образцы ФК, которые представлены в таблице 4. Для жидких образцов ФК, содержащих пищевой растворитель, ставились контрольные пробы с соответствующими объемами растворителя. Результаты представлены в таблице 5.

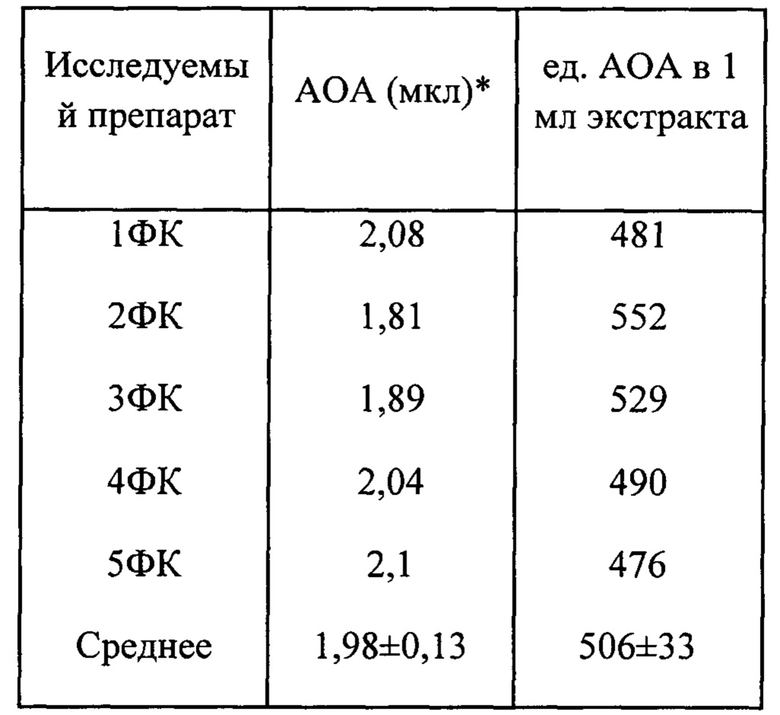
* добавляемый объем в модельную систему, который приводит к таким же изменениям латентного периода ХЛ как и добавление тролокса в концентрации 1 мкМ.
Из таблицы 5 видно, что объемы образцов, который необходимо добавить к модельной системе, чтобы получить антиоксидантную активность эквивалентную 1 мкМ тролокса, составили в среднем 1,98±0,13. В правой колонке представлена вычисленная АОА образцов, выраженная в условных единицах на 1 мл образца. За 1 условную единицу антиоксидантной активности исследуемого препарата принят такой его добавляемый объем в модельную систему, который приводит к таким же изменениям латентного периода ХЛ как и добавление тролокса в концентрации 1 мкМ.
Из таблицы 5 следует, что средняя АОА исследованных образцов ФК составляет 506±33 усл. ед./мл.
Таким образом, как следует из таблицы 4 и таблицы 5, способ получения заявленной ФК позволяет получать препараты с высокими и воспроизводимыми значениями АОА.
Оценка АОА с помощью данного метода близка к определению АОА с помощью известного метода ORAC, т.к. также использует азосоединение ААРН (2,2'-азобис(2-амидино-пропан)дигидрохлорид) в качестве источника радикалов и тролокс в качестве антиоксидантного стандарта, хотя получаемые значения АОА не могут быть напрямую переведены в единицы, используемые в методике ORAC.
4. Определение антиоксидантной активности ex vivo
Антиоксидантная активность определялась также в системе ex vivo по ингибированию люминолзависимой хемилюминесценции, сопровождающей респираторный взрыв нейтрофилов при их активации зимозаном. Стабилизированную гепарином капиллярную кровь человека добавляли в ячейку хемилюминометра, содержащую раствор Хенкса с люминолом. В ячейку также вносили определенный объем Фармкомпозиции или соответствующего растворителя. Добавляли опсонизированный зимозан и регистрировали хемилюминесценцию. Одновременно в другой ячейке хемилюминометра регистрировали спонтанную хемилюминесценцию. Интегральную интенсивность хемилюминесценции выражали в условных единицах и определяли, измеряя площадь под кривой хемилюминесценции (фиг. 13).
Как следует из фиг. 13, при внесении в реакционную смесь 0,22%; 0,9%; 2,3% ФК (V/V), интенсивность свечения снижалась на 25%, 37%, 52% соответственно. Установлено, что ФК дозозависимо снижает хемилюминесценцию люминола при респираторном взрыве нейтрофилов.
Преимущества метода определения АОА с адреналином
Как указано выше, АОА фармкомпозиции подтверждена различными методами. Для экспресс-оценки качества получаемых образцов ФК наиболее удобным оказался метод по определению аутоокисления адреналина, т.к. он информативен, наиболее простой и не требует дорогих реактивов. Кроме того, этот метод лучше, чем хемилюминесцентный метод в системе АДБА-люминол, выявляет различия в АОА в разных препаратах ФК, а также изменения АОА, возникающие при хранении препаратов (фиг. 14).
Как следует из фиг. 14, при хранении на холоду АОА препаратов не изменяется, в то время как при хранении при комнатной температуре происходит снижение способности ингибировать реакцию аутоокисления адреналина, но способность ингибировать хемилюминесценцию, сопровождающую реакцию термического разложения АДБА не снижается в процессе хранения при комнатной температуре.
Применение обоих методов для определения АОА в ФК позволяет дифференцировать два компонента АОА: термолабильный с супероксиддисмутазной активностью и термостабильный с антирадикальной активностью.
Методом с адреналином было установлено, что при хранении на свету происходит еще более быстрое снижение АОА. (фиг. 15).
Определение АОА с адреналином позволило выявить различия в препаратах, получаемых разными способами (фиг. 16).
Определение АОА с адреналином выявляет различия между препаратами, полученными разными способами, из разного сырья, а также позволяет выявить изменения в составе ФК, возникающие при ненадлежащем хранении (не только ФК (фиг. 8, 16, 50), но и сырья (фиг. 17)). При этом для экспресс-анализа качества получаемых образцов можно обходиться без построения зависимости степени ингибирования аутоокисления адреналина от количества вносимого препарата, а проводить измерение при одной вносимой дозе, например, 50 мкл. Степень ингибирования в качественных препаратах при этом должна быть не ниже 60% (как правило 70-85%).
Выявленные различия коррелируют с различиями, выявляемыми методом электрофореза (фиг. 17, а также пример 1).
Пример 4
Антистрессорное действие ФК на модели введения адреналина и психоэмоционального стресса у крыс
В этом примере представлены результаты исследования антистрессорного действия ФК. Исследовали влияние стресса на энергетические функции митохондрий, а также иммунные функции крови. Исследования проводили на модели физиологического стресса на животных перед достижением зрелости при внутрибрюшинном введении адреналина (АДР) а также на современной модели безболевого психоэмоционального стресса (ПЭС) крыс при помещении на короткий срок (30 мин) в пластиковую вентилируемую коробочку, ограничивающую движения. Действие стресса исследовали по реакциям митохондрий (активности сукцинатдегидрогеназы (СДГ) и α-кетоглутаратдегидрогеназы (КДГ), а также накоплению ионов кальция митохондриями, и ответам системы крови (по изменению клеточного состава крови, индуцированной зимозаном и спонтанной хемилюминесценции). Ниже описаны методы, которые представлены в ссылках раздела «Раскрытие изобретения» и в публикации [23].
Протокол модели.
Эксперименты проводили на крысах линии Вистар разведения вивария ИТЭБ возраста 6-ти недель, весом до 200 г. веса. Группа животных (6-8) для одной серии подбиралась из пометов одной даты рождения и отсадки. При отсадке животные одной серии содержались в одной клетке и привыкали друг к другу. Во всех других отношениях проводили максимальную стандартизацию условий для сохранения состояния покоя животных. Исследование воздействия стресса и влияние на него изучаемого препарата проводили одновременно на всей группе животных, которых готовили к опыту в течение одного календарного срока и осуществляли эвтаназию в один день, в сжатый период времени 10-12 часов. Это сводит к минимуму разброс состояний животных в разные дни и время суток. Согласно предшествующим собственным и литературным наблюдениям состояние группы однородных животных сходно в один день, но меняется в разные дни, причем изменения отдельных животных группы близки. Опытные животные получали 0, 25 или 1 мл ФК, нанесенные на хлеб по нескольким схемам: 5 дней кормления - 2 дня перерыв - 1 день кормление, либо в течение 10 дней без перерыва (см. подписи к рисункам). Скармливание препарата проводили после высушивания на воздухе для удаления спирта.
Стресс имитировали также введением животным умеренно-высокой дозы АДР 50 мкг/100 г веса внутрибрюшинно за 30 мин до забоя. Либо животных подвергали 30 минутному ПЭС, помещая отсаживая в камеру, ограничивающую движение, но без болевых воздействий. Эта модель соответствует физиологическому эмоциональному стрессу.
Животных усыпляли в герметичной камере, предварительно заполненной углекислым газом, что обеспечивало сохранение спокойного состояния у животных - эвтаназию без возбуждения. Через 15-25 с. у животных происходила остановка дыхания, однако работа сердца продолжалась, тогда крысу быстро извлекали из камеры, декапитировали, и, слив первые капли крови, забирали кровь для исследований.
Методы исследования
Взвешивание органов. Сразу после декапитации проводили взвешивание тимуса, надпочечников и селезенки, не допуская подсыхания взятых органов.
Исследование энергетических функций митохондрий
1. Цитобиохимическое определение активности дегидрогеназ.
Проводили определение активности двух дегидрогеназ - сукцинатдегирогеназы (СДГ) и α-кетоглутаратдегидрогеназы (КДГ), отражающих регуляцию симпатической (адреналин) и парасимпатической (ацетилхолин) нервной системы. Измерения проводили в лимфоцитах крови на мазке по разработанному ранее цитобиохимический методу, высокочувствительному к изменениям в организме благодаря сочетанию преимуществ цитохимического и биохимического методов. Измерение активности дегидрогеназ по восстановлению нитросинего тетразолия (НСТ) проводили в свежеприготовленном мазке крови после инкубации в течение 1 часа при 37°С в цитобиохимической среде, содержащей 125 мМ KCl, 10 мМ HEPES, 1.22 мМ NBT, рН 7,2±0,05, а также субстраты. Для всех процедур использовалась бидистиллированная вода. После инкубации мазки ополаскивали бидистилированной водой, и проводили докрашивание ядер 0,5% нейтральным красным в течение 8 мин. Мазки исследовали под масляной иммерсией на микроскопе Микмед-2 («Ломо», Россия), при увеличении 6,3×100/1,30, оснащенном видеокамерой MINTRON CCD MTV-1 802 СВ («Кандела», Россия). С мазков крови выбирали 30 лимфоцитов, их видеофотографии, сделанные через красный фильтр, помещали на один планшет в компьютере и всю картину подвергали количественному морфометрическому анализу с помощью программы Image Tool, версия 2 (The University of Texas Health Science Center in San Antonio, США).
Достоинством метода, проводимого путем компьютерного видеомикроскопирования множества окрашенных объектов в 30 лимфоцитах является высокая статистическая достоверность каждой отдельной величины. Значение активности фермента определяется автоматически путем сканирования площадей множества окрашенных продуктов реакции - гранул формазана, содержащихся в 30 клетках и вычисления средней из них. Число окрашенных объектов n составляет 250-350 для проб со средней активностью до 600-700 для проб с высокой активностью и порядка 100 для проб с низкой активностью. Результаты представлены для каждой особи в виде средних значений площади окрашенных объектов (М) в каждой пробе. Для всех полученных значений средней вычисляется стандартное отклонение (σ), ошибка средней (±m), а также по t-критерию Стьюдента оценивается достоверность найденных средних величин (р) с использованием программы Microsoft Office Excel 2003. Вследствие большого объема выборки, во всех представленных случаях средние величины являются статистически достоверными 99,9% (p<0,001). Таким образом, данные, полученные по каждому отдельному животному статистически репрезентативны. Благодаря этому имеется возможность сравнивать индивидуальные данные отдельных особей между собой.
2. Поглощению ионов кальция
Эти исследования проводили на гомогенате печени путем измерения поглощения ионов кальция митохондриями - емкости митохондрий - которое определяли по изменению мембранного потенциала в ответ на последовательные добавки ионов кальция в концентрациях 50 мкМ. Мембранный потенциал митохондрий измеряли ТФФ+-селективным электродом с компьютерной регистрацией. Митохондрии инкубировали в среде 120 мМ KCl, 10 мМ HEPES, и 1.5 мМ фосфат, рН 7.25 при концентрации ТФФ+1 мкМ.
3. Исследование клеточного состава крови и иммунной функции нейтрофилов. Кроме обработки мазков крови крыс цитобиохимическим методом, кровь этих же крыс была взята для проведения измерения клеточного состава крови общепринятым методом и иммунной активности нейтрофилов (НФ) путем регистрации хемилюминесценции, индуцированной добавлением зимозана [60]. Полученную при декапитации кровь смешивали в пропорции 1:1 с средой Хенкса, не содержащей кальция, рН 7,45 и содержащей гепарин 40 ед./мл среды. Кровь хранили при 4°С. Измерение хемилюминесценции начинали через 1 час после взятия крови. В ячейки хемилюминометра (ИБК РАН), содержащие по 200 мкл среды Хенкса с кальцием (CaCl2 1 мМ) и 50 мкМ люминола, рН 7,45 добавляли по 20 мкл крови, через 10 минут добавляли опсонизированный зимозан (конечная концентрация в ячейке 217 мкг/мл) и регистрировали активированную хемилюминесценцию при 37°С. Одновременно в отдельной ячейке регистрировали спонтанную хемилюминесценцию. Интегральную интенсивность хемилюминесценции, выраженную в условных единицах, определяли, вычисляя площадь под кривой хемилюминесценции.
Статистический анализ проводили по критерию Стьюдента, представлены средние значения ± S.E.M.
Всего было проведено 6 экспериментов, в которых было исследовано 24 животных, из них 10 получали ФК.
Были получены следующие результаты.
Влияние ФК на активность дегидрогеназ митохондрий
В этом разделе представлены данные исследования влияния ФК на активность СДГ и КДГ в митохондриях лимфоцитов крови. Известно, что эти ферменты являются участниками субстратно-гормональной системы регуляции, связывающей митохондрии и вегетативную нервную систему через сигнальное взаимодействие субстратов ЯНТ и КГЛ и медиаторов - адреналина (АДР) и ацетилхолина (АЦХ) [Подробнее см. в разделе - «Раскрытие изобретения»]. Активность СДГ отражает расход энергии на функции клетки, а также активность симпатической регуляции, активность КДГ - обеспечение восстановительных процессов и активность парасимпатической регуляции.
Для контрольных животных в состоянии покоя характерна низкая активность СДГ. При действии адреналина или стрессе наблюдается ее сильное повышение - в 2-3 раза и более. Однако, и без контролируемых возбуждающих воздействий у контрольных животных встречается умеренное повышение СДГ. Таких животных можно рассматривать как более возбужденных.
В примере, представленном на фиг. 18, приведено действие ФК на двух выявленных группах с умеренно высокой и низкой активностью СДГ в контроле.
На панели А. фиг. 18 приведены данные для группы, которая, судя по показателям контроля, находится в состоянии менее полного покоя с немного повышенной активностью ферментов. На этой группе наблюдается классическое проявление острого стресса введением пускового гормона стресса АДР. Оно выражается в сильной активации функций, в данном случае, активности СДГ, обеспечивающей работу. Используемая доза АДР высока в масштабе его содержания в организме. Кроме того, в отличие от возбуждения в организме, когда АДР выделяется в сопровождении АЦХ, в опыте создается искусственное преобладание АДР, не уравновешенного АЦХ. Видна резкая активация СДГ. Она, однако, превышает адаптивные возможности ткани, на что указывает катастрофическое снижение КДГ.
Это свидетельствует о нарушении нормального восстановления и повышению риска возникновения патологии.
Чрезвычайно ярко проявляется защитное действие предварительного потребления ФК. Оно приводит к защите от стресса, восстанавливая активность КДГ. Как показано нами ранее, этот механизм лежит и в нормализации активности СДГ, проявляющейся в уменьшении ее гиперактивации. Надо подчеркнуть, что умеренная активность СДГ после скармливания ФК наблюдается на фоне добавления АДР. Таким образом, ФК помогает противостоять сильному стрессорному воздействию, то есть, проявляет анти-стрессорное действие и является указанием на холиномиметическое (подобное АЦХ) действие ФК.
На панели Б фиг. 18 действие ФК испытано на противоположном фоне - группы с исходно низкой активностью СДГ. Эта группа является примером организма в более спокойном, уравновешенном состоянии. Он не отвечает на введение АДР бурной реакцией, как в первой группе. Зато КДГ, хотя и снижается, но все-таки сохраняет активность, несмотря на резкое нарушение регуляции АЦХ введением АДР. Укрепляющее действие ФК на уравновешенных животных проявляется в обеспечении полноценного ответа на АДР, который даже превышает ответ у мене спокойных животных. Это очень сильно выражено и по активности СДГ, и по активности КДГ. Такое действие также является анти-стрессорным, так как восстанавливает активный ответ на стресс, причем без нарушения восстановительных процессов, поддерживаемых активностью КДГ.
На фиг 19 приведено защитное действие предварительного потребления ФК на функции митохондрий при более мягкой, близкой к жизни модели стресса - нервного напряжения, вызванного помещением крысы в коробочку. При таком воздействии ответ организма регулируется сочетанным влиянием выделения АДР и АЦХ. Ответ представлен сравнительно с влиянием на фоне введенного АДР. Видно, что анти-стрессорное действие ФК проявляется в обоих случаях.
В приведенном опыте применяли длительное выдерживание в коробочке - в течение 24 часов. За это время по данным других экспериментов, активация СДГ проходила максимум и переходила в фазу ингибирования. КДГ была полностью неактивна, как и при действии АДР. Однако потребление ФК приводило к усилению активности этого важного для восстановления фермента. Его активация, как отмечено выше, приводит к уменьшению гиперактивации СДГ.
Таким образом, исследование влияния ФК на фоне разных стресссорных воздействий показывает уменьшение неблагоприятных реакций в организме, то есть, анти-стрессорное действие.
Влияние ФК на поглощение ионов кальция
Влияние на энергетические функции митохондрий измеряли и по потреблению ими ионов кальция, которое требует больших затрат энергии. Такое измерение показано на фиг. 20.
В этом исследовании (в отличие от измерения активности ферментов без рабочей нагрузки (Фиг. 18 и Фиг. 19) ферменты исследуются при сильной нагрузке по транспорту ионов кальция. Поэтому при введении АДР в сочетании с большой нагрузкой кальцием наблюдается не активация энергообеспечения, как на фиг. 18 и 19, а его снижение. Относительно контроля работа митохондрий уменьшается при введении АДР, что видно по уменьшению числа порций накапливающегося кальция. Потребление ФК оказывает сильно выраженное защитное действие, обеспечивая при введении АДР: накопление 9-ти порций кальция вместо 3-х. Это значительно выше, чем в контроле - 5.
На нижней панели показано действие ФК, исследованное на фоне еще более мягкого ПЭС, чем рассмотрено выше - помещение в коробочку на 30 мин. Более мягкий стресс и при нагрузке кальцием сохраняет активирующее действие на митохондрии, что проявляется повышением накопления ионов по сравнению с контролем. ФК снимает активацию, вызываемую стрессом. Это указывает на сохранение покоя при возбуждении, то есть, анти-стрессорное действие. Это действие направлено на гиперактивацию, вызванную стрессом, так как на работу в контроле, в состоянии покоя ФК не влияет. Показанное действие ФК можно рассматривать как сохранение покоя при возбуждении - успокоительное или анти-стрессорное.
Таким образом, по реакциям митохондрий при скармливании ФК на группах с активацией АДР или ПЭС выявлено выраженное анти-стрессорное действие препарата: его введение уменьшает гиперактивацию СДГ (абсолютную и относительно КДГ), которая соответствует симпатической гиперактивации в организме. В основе сдерживающего действия ФК на активность СДГ лежит сохранение активности КДГ при нагрузке, которая поддерживает процессы восстановления. По значению для организма это соответствует регуляции АЦХ. Такое действие должно способствовать снижению риска развития патологий симпатической гиперактивности (в частности, хронического стресса, гипертонии).
Анти-стрессорное действие ФК по влиянию на вес селезенки
Наглядным, быстрым и удобным показателем для оценки острого стресса является быстрое изменение веса селезенки, зависящее, от заметного увеличения кровенаполнения, но также и от включения стрессорных реакций, в частности, образования разобщающего белка [23]. В данной работе измеряли вес селезенки параллельно с принятыми показателями стресса - изменениями веса тимуса и надпочечников. Однако изменения веса этих желез проявляются при более сильных и менее естественных воздействиях, чем использованные модели. Изменения веса селезенки были наиболее выраженными. Во всех группах наблюдалась одинаковая тенденция (фиг. 21). У животного в состоянии стресса, вызванного введением адреналина 50 мкг/100 г веса, наблюдалось значительное увеличение веса селезенки, а прием ФК во всех случаях предотвращал это увеличение. Обнаруженное повышение кровенаполнения селезенки, возможно, перекликается с геморрагией желудочно-кишечного тракта, развивающейся при стрессе и ведущей к появлению язв желудка и 12-перстной кишки.
Влияние приема ФК на клеточный состав и параметры хемилюминесценции крови при психоэмоциональном стрессе (ПЭС) и введении адреналина
Известно, что стресс изменяет клеточный состав крови и состояние кроветворных органов [61-63]. Поэтому было исследовано влияние ФК на клеточный состав и функциональную активность лейкоцитов в цельной крови при стрессе, вызванном введением АДР и при 30-мин ПЭС. Функциональную активность нейтрофилов оценивали по величине хемилюминесценции, возникающий в ответ на стимулятор иммунного ответа фагоцитов - зимозан.
Влияние стресса и ФК на индуцированную хемилюминесценцию крови
Индуцированная зимозаном хемилюминесценция отражает величину иммунного ответа клеток крови, преимущественно нейтрофилов (респираторный взрыв). Введение АДР и 30 минутный ПЭС приводили к ослаблению иммунного ответа, о чем свидетельствует снижение индуцированной хемилюминесценции. ФК также как и ПЭС снижала хемилюминесценцентный ответ у контрольных животных. Однако, при этом у животных, получавших ФК, не только не происходило снижение хемилюминесценции в ответ на стресс (нижняя панель фиг. 22), но напротив, она восстанавливалась почти до уровня контроля. Такое действие аналогично примеру Б на фиг. 18, когда ответ СДГ на стресс у животных с исходно низкой активностью СДГ усиливался приемом ФК. Снижение хемилюминесценции, вызванное введением АДР (нижняя часть фиг. 22), не ослаблялось, а усиливалось у животных, получавших ФК. Это может быть объяснено более резким, нефизиологичным действием АДР, отмеченным выше, по сравнению с моделью психоэмоционального стресса, когда стресс в организме поддерживается совместным влиянием АДР и АЦХ. Приведенные данные показывают, что активность НФ выше при участии регуляции АЦХ.
Поскольку величина хемилюминесцентного ответа крови определяется как количеством нейтрофилов, так и их функциональной активностью, исследовали влияние стресса на количество нейтрофилов и оценивали их функциональную активность по интенсивности хемилюминесценции в расчете на 10 тысяч клеток.
Влияние стресса и ФК на индуцированную хемилюминесценцию нейтрофилов
Как следует из фиг. 23, введение АДР снижало функциональную активность НФ, оцениваемую по величине хемилюминесцентного ответа на высокую дозу зимозана в расчете на 10 тыс. НФ, в то время как 30 минутный ПЭС ее активировал, т.е., АДР подавляет активность НФ, а АЦХ ее активирует. Прием ФК не восстанавливал активность на фоне введения АДР, но предотвращал повышение, вызванное ПЭС. Это, может быть также объяснено боле грубым стрессорным действием введенного АДР по сравнению с естественной реакцией, регулируемой сбалансированным влиянием физиологических концентраций АДР и АЦХ.
Наблюдаемое при ПЭС снижение хемилюминесценции крови (фиг. 22) определяется снижением количества НФ крови (см. ниже). Сниженная введением АДР функциональная активность НФ не компенсируется даже повышением их количества в крови (фиг. 24).
Влияние стресса и ФК на количество и соотношение лейкоцитов
Прием ФК приводит к снижению количества НФ у контрольных животных. Это указывает на усиление состояния покоя.
Внутрибрюшинное введение АДР через 30 минут приводит к повышению количества НФ в крови крыс. Прием ФК, снимает стрессорный ответ на АДР: количество НФ не повышается, а даже снижается до уровня контроля при введении ФК. Введение адреналина не приводит к повышению количества нейтрофилов.
Короткий ПЭС приводит к снижению количества НФ, до уровня более низкого, чем прием ФК. Прием ФК предотвращает вызванное ПЭС снижение количества НФ в крови, которое остается на уровне контроля. Таким образом, курсовой прием ФК предотвращает вызываемые введением АДР и ПЭС изменения количества НФ в крови.
Разнонаправленные изменения НФ в крови при различных моделях стресса описаны в литературе. Повышение количества НФ при стрессовых воздействиях считается классической реакцией на стресс, в том числе иммобилизационный [61]. При этом в работах использовался, как правило, длительный иммобилизационный стресс (3 часа и более) с фиксацией за конечности. В наших экспериментах при мягкой модели ПЭС наблюдается снижение количества НФ в крови при измерении сразу после окончания 30 минутного стресса. Такое снижение наблюдалось и другими авторами, которые использовали ПЭС в тесной камере без фиксации за конечности [64]. По современным представлениям направление ответа на стресс (увеличение или уменьшение клеток) зависит от многих факторов (длительности, силы и характера стрессорного воздействия) [64-66], поскольку является результатом перераспределения иммунных клеток между тканями в процессе стрессорного ответа. Кроме того, направление ответа носит бифазный характер. Это связано с включением разных регуляторных систем: сначала катехоламины (гормональные и нейротрансмиттерные) вызывают выброс лейкоцитов из депо (маргинального пула, селезенки, легких и др. в кровь и лимфу. Затем, если стресс продолжается, активируется гипоталамо-гипофизо-адреналовая система, выбрасываются глюкокортикоиды, которые приводят к выходу лейкоцитов из крови в возможные места повреждения: легкие, кожу, ЖКТ [5 63]. Таким образом, знак изменения количества НФ в ответ на стресс определяется интенсивностью воздействия. Важно, что прием ФК снимает стрессорный ответ НФ по их количеству при исследованных нами двух формах стресса.
Изменение количества лейкоцитов в целом и ЛФ слабо выражены (данные не приводим), поскольку по содержанию у крыс они сильно преобладают над НФ. Как показано выше, изменения ответа при стрессе в основном определяются активностью и количеством НФ. Это видно при определении показателей для самих НФ или по соотношению процентного содержания количества ЛФ к количеству НФ - лимфоцитарному индексу (ЛИ).
Как следует из фиг. 25, через 30 минут после введения АДР и после окончания ПЭС изменялось соотношение различных типов иммунных клеток, в частности, отношение количества ЛФ к количеству НФ-ЛИ. Как следует из фиг. 25, ЛИ снижается при введении АДР и увеличивается при ПЭС. По-видимому, как показано выше, изменение ЛИ связано с изменением количества НФ. У животных, принимавших ФК, в ответ на действие стресса не происходит соответствующего изменения лимфоцитарного индекса. Считается, что изменение ЛИ является неспецифическим ответом на различные воздействия. Таким образом, прием ФК предотвращает изменения ЛИ в обеих моделях стресса.
Спонтанная хемилюминесценция
Как показано на фиг. 26 АДР и ПЭС повышали спонтанную хемилюминесценцию крови.
Введение адреналина и 30 минутный ПЭС вызывали повышение спонтанной хемилюминесценции крови. Это увеличение может быть связано с повышением количества свободных радикалов в результате окислительного стресса. У животных, получавших ФК, спонтанная хемилюминесценция не повышалась в ответ на стресс. При этом прием ФК не изменяла спонтанную хемилюминесценцию в контроле. Спонтанная хемилюминесценция в цельной крови определяется многими факторами, в том числе и свободнорадикальными процессами, протекающими как внутри, так и вне клеток и не связанными с иммунными функциями. Эти процессы, например такие, как перекисное окисление липидов или окисление гемоглобина могут усиливаться при стрессе. Предотвращение приемом ФК спонтанной хемилюминесценции крови, по-видимому, связано с ее антиоксидантным действием.
Таким образом, при 30-минутном ПЭС и при стрессе, вызванном введением адреналина, предварительный прием ФК в течение 5-6 или 10 дней предотвращал изменения, вызванные стрессом, нормализуя активность ферментов СДГ и КДГ и накопление ионов кальция в митохондриях, а также клеточный состав и иммунную функцию крови. Проведенные исследования показали, что ФК при курсовом приеме оказывает анти-стрессорное действие, предотвращая или ослабляя действие стресса на митохондрии и на клетки крови.
Пример 5
Действие фармакологической композиции на туберкулезную инфекцию при заражении на мышах и вне организма
1. Противотуберкулезное действие Фармакологической композиции в эксперименте in vivo.
Исследование проведено на 60 нелинейных половозрелых мышах массой 36-40 г. Модель генерализованного туберкулеза мышей воспроизводили путем внутривенного (в венозный синус глаза) введения взвеси микобактерий туберкулеза лабораторного штамма H37Rv в дозе 0,05 мг в 0,2 мл физиологического раствора. Указанная доза МБТ для заражения использована для получения модели генерализованного не остро текущего туберкулеза, исключающая гибель животных в течение 1 мес. Такая модель позволяет определить оптимальную дозу препарата, у которого не известны его минимальные бактериостатические и бактерицидные характеристики.
Через 2 недели после заражения животных разделили на 4 группы по 15 мышей в каждой (таблица. 6).
* - на каждые 20 грамм массы. Мыши 4-й группы (контрольной) лечения не получали.
В процессе эксперимента наблюдали за общим состоянием мышей, получавших лечение, их активностью и изменением веса и сравнивали с аналогичными показателями в контрольной группе.
Через 2 дня после окончания лечения животных всех групп эвтаназировали путем дислокации шейных позвонков. На вскрытии определяли макроскопические изменения легких (количество и размеры туберкулезных очажков), взвешивали легкие, печень, почки, селезенку для вычисления весовых индексов и забирали материал (легкие, печень, селезенка) для микробиологических и гистологических исследований.
В условиях соблюдения строгой стерильности, кусочки легких, селезенки и печени взвешивали, затем гомогенизировали и взвесь засевали на плотную питательную среду Левенштейна-Йенсена. За ростом микобактерий следили в течение 3 месяцев, подсчитывали количество выросших колоний в пробирках и вычисляли затем число колониеобразующих единиц МБТ (КОЕ) на грамм ткани органа.
Для гистологических исследований кусочки легких, селезенки, печени фиксировали в 10% формалине. После фиксации и проводки материал заливали в парафин и из парафиновых блоков изготовляли ступенчатые гистологические срезы. Использовали окраски гематоксилином и эозином.
Проводили статистическую обработку полученных результатов; вычисляли (М±m). Достоверность различий между группами наблюдений оценивали по критерию Стьюдента.
Результаты
В конце эксперимента гибель не наблюдали ни в одной из групп. К моменту окончания эксперимента прирост массы тела отмечался у мышей 2 и 3 опытных групп. Однако он был достоверно выше по сравнению с контролем только в 3 группе животных (таблица 7).

Примечание: * - различия с контрольной (4) группой статистически достоверны (p<0,05).
Результаты макроскопических патоморфологических исследований представлены в таблице 8.
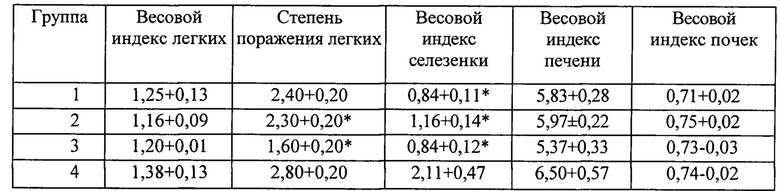
Примечание: * - различия с контрольной (4) группой статистически достоверны (р<0,05).
Как следует из таблицы 8, определены достоверные различия показателей степени поражения легких и весового индекса селезенки между контрольной группой и опытными группами. Среди опытных групп выявлены существенные различия по показателю степени поражения легких между 1 и 3 и 2 и 3 группами мышей (р<0.05). Наименьшая степень поражения легких была у мышей 3 опытной группы.
Результаты гистологического исследования.
В 4, контрольной, группе наблюдений: в легких были рассеянные множественные мелкие лимфо-макрофагальные гранулемы и очажки, располагавшиеся как в межальвеолярных септах, так и в перибронхиальной и периваскулярной ткани. Отмечалось наличие участков интерстициального типа пневмоний в субплевральных участках (фиг. 27). В печени выявлялись множественные, мелкие гранулемы. Лимфо-макрофагальные инфильтраты обнаруживались в центральных отделах печеночных долек и по ходу септ (фиг. 28). В селезенке отмечено наличие разновеликих фолликулов без четких границ, формирование гранулем и интенсивная гистиоцитарная пролиферация в синусах.
В 1 группе наблюдений: в легких находили ограниченные участки интерстициальной пневмонии, субплеврально, перибронхиально и периваскулярно встречались лимфоцитарные инфильтраты. Лимфо - макрофагальные гранулемы в умеренном количестве находили чаще субплеврально и в плевре. В ткани печени были рассеянные множественные, мелкие лимфо- макрофагальные гранулемы. Клеточных скоплений по ходу септ почти не встречалось. Проявления гепатоза были незначительными. В селезенке имела место реактивная гиперплазия фолликулов. Макрофагальная инфильтрация была интенсивнее выражена в краевых синусах. Обнаруживались единичные гранулемы.
Во 2 группе наблюдений: в ткани легких интерстициальный компонент воспаления сохранялся не у всех животных. Лимфо- макрофагальные инфильтраты по ходу сосудов и бронхов были умеренные. Гранулематозные проявления были скудными. В печени гранулемы в умеренном количестве локализовались преимущественно субкапсулярно. По ходу триад встречались скудные лимфоцитарные инфильтраты. Проявления белковой дистрофии гепатоцитов было слабым. В ткани селезенки фолликулы были разновеликими, макрофагальная реакция в синусах носила активный характер.
В 3 группе наблюдений: в легочной ткани встречались единичные гранулемы, инфильтративные проявления, включая интерстициальные, расценены как скудные (фиг. 29). В печени встречались участки с высоким содержанием субмикроскопических эпителиоидно-макрофагальных гранулем; по ходу септ лишь кое-где обнаруживались минимальные проявления лимфоцитарной инфильтрации (фиг. 30). В селезенке имела место умеренная гиперплазия фолликулов. Макрофагальная пролиферация в синусах была сохранена.
Таким образом, интенсивность проявлений специфического воспаления падала от 1 группы к 3, что было особенно значимым по изменению «показателя гранулематоза» и лимфо- макрофагальной инфильтрации в ткани легких. В 3 группе наблюдений снижение активности специфического процесса в печени реализовалось субмикроскопической величиной гранулем, минимальностью выраженности лимфоцитарной инфильтрации в пределах септ, в селезенке снизилась выраженность реактивной гиперплазии. Между 2 и 3 группами принципиальных различий не отмечено.
Результаты микробиологических исследований тканей
В таблице 9 представлены результаты микробиологических исследований тканей мышей.
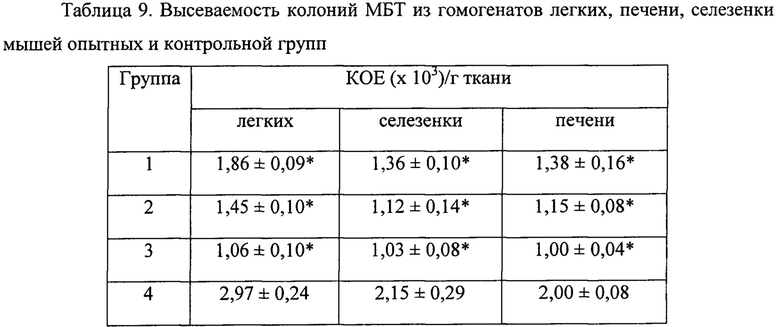
Примечания: * - различия с контрольной (4) группой статистически достоверны (р<0,05).
Как следует из таблицы 9, высеваемость МБТ из органов мышей опытных групп значительно меньше, чем в контрольной. Наименьшие показатели высеваемости колоний среди мышей опытных групп были у мышей 3 группы. Существенных различий по микробиологической эффективности у мышей 3 и 2 групп не отмечено.
Таким образом, в модели генерализованного не остро текущего туберкулеза наблюдали выраженные проявления лечебного действия ФК.
По данным клинических, микробиологических и патоморфологических исследований установлено, что введение мышам, зараженным микобактериями туберкулеза, в течение 1 месяца фармакологической композиции в дозе 150 мкл/мышь было более эффективным, чем в дозах 75 и 15 мкл/мышь. Существенных различий по микробиологическим и гистологическим критериям у мышей 3 и 2 групп не определено.
Сравнительная характеристика степени морфологических проявлений активности туберкулезного воспаления по группам 3 и 4 экспериментальных животных свидетельствует о наличии выраженной редукции тканевых специфических изменений в 3-й группе, которые по степени выраженности приближаются к уровню вакцинного процесса. Специфические изменения наиболее четко прослеживались в легких и в печени, где сохранялись разреженные, субмикроскопические лимфо-макрофагальные скопления, которые не носили выраженного и постоянного характера.
В 4-ой контрольной, группе наблюдений в легких были выявлены множественные средние и крупные лимфо-макрофагальные гранулемы. Отмечалось наличие участков интерстициального типа пневмоний. В печени выявлялись множественные гранулемы, а лимфо-макрофагальные инфильтраты обнаруживались в центральных отделах печеночных долек и по ходу септ.
Представленные данные являются экспериментальными доказательствами in vivo противотуберкулезного действия разработанной Фармакологической композиции.
2. Повышение порога чувствительности к туберкулезному возбудителю
Полученная фармакологическая композиция (ФК) может повышать порог чувствительности к туберкулезному возбудителю, что продемонстрировано в эксперименте по повышению батериостатической активности крови (БАК).
Для определения БАК использовали образцы крови мышей после введения им ФК в дозе 150 мкл на мышь массой 20 грамм. Препарат водили однократно внутрижелудочно с помощью специального зонда. Использовали цельную кровь, которую забирали из сонных артерий животных сразу же после дислокации шейных позвонков через 30 минут или через 1 час после введения ФК. Бактериостатическую активность крови (БАК) определяли в соответствии с методическими рекомендациями «Модификация определения бактериостатической активности крови больных туберкулезом на плотной питательной среде методом серийных разведений», 1983 г. Из образцов крови готовили серийные разведения от 1: до 1:64 и засевали на плотную питательную среду Левенштейна-Йенсена вместе с МБТ. В качестве тест-культуры использовали лабораторный штамм H37Rv. Величину бактериостатической активности крови определяли по разведению крови, где отсутствовал рост МБТ. Задержкой роста МБТ признается полное отсутствие колоний или наличие единичных (до 20) мелких колоний на плотной питательной среде. К каждому ряду разведений крови ставился контроль роста МБТ. Для сравнения был поставлен аналогичный ряд разведений крови от интактных мышей.
Результаты
В таблице 10 представлены данные учета роста культуры микобактерий, который проводили через 3 недели после засева.

Как следует из таблицы 10, БАК интактных мышей была низкой уже при разведении крови 1:2. Отсутствие роста МБТ в пробирках с кровью мышей, получивших ФК, отмечалось при разведениях крови 1:8 (через 30 мин после введения ФК) и 1:16 (через 1 час). Таким образом БАК у мышей, получивших ФК в дозе 150 мкл на мышь, повысилась в 4-8 раз по сравнению с естественной БАК у интактных животных.
3. Усиление лечебного действия при совместном применении с противотуберкулезными препаратами.
Изучение эффективности сочетанного применения ФК и противотуберкулезных препаратов проводили на модели туберкулеза мышей, зараженных лекарственно-устойчивыми микобактериями (по клиническим, микробиологическим и патоморфологическим критериям)
Материал и методы исследования:
Исследование проведено на 70 нелинейных половозрелых мышах массой 30-34 г. Модель генерализованного туберкулеза мышей воспроизводили путем внутривенного (в венозный синус глаза) введения взвеси микобактерий туберкулеза (МБТ) в дозе 0,1 мг в 0,2 мл физиологического раствора. Штамм МБТ был выделен от больного пациента и был устойчив к 10,0 мкг/мл изониазида и 40,0 мкг/ мл рифампицина.
Животные в данном эксперименте были разделены на 7 групп по 10 мышей в каждой (таблица 11) в зависимости от лечебной схемы.
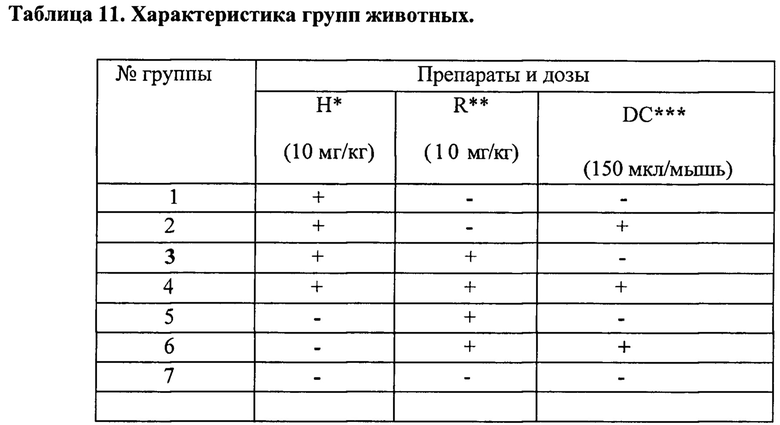
* Примечание: Н* - изониазид; R** - рифампицин; DC*** (drug composition) - фармакологическая композиция (ФК)
Таким образом, мыши 2, 4 и 6 групп получали противотуберкулезные препараты в сочетании с ФК. Группы 1, 3 и 5 были группами сравнения (только ПТП). Мыши 7 группы препаратов не получали (контрольная группа). Лечение мышей начинали через 2-недели после заражения. Препараты вводили внутрижелудочно 5 раз в неделю в течение I месяца. В процессе эксперимента наблюдали за общим состоянием мышей, получавших лечение, их активностью и изменением веса, гибелью и сравнивали с аналогичными показателями в контрольной группе.
Через 2 дня после окончания лечения животных всех групп эвтаназировали путем дислокации шейных позвонков. На вскрытии определяли макроскопические изменения легких (количество и размеры туберкулезных очажков), взвешивали легкие, печень, почки, селезенку для вычисления весовых индексов. Весовые индексы внутренних органов высчитывали путем деления массы органа на массу мыши и выражали в относительных единицах. Производили забор материала (легкие, селезенку) для микробиологических и гистологических (легкие, печень, селезенку) исследований.
В условиях соблюдения строгой стерильности кусочки легких и селезенки взвешивали, затем гомогенизировали и взвесь засевали на плотную питательную среду Левенштейна-Иенсена. За ростом микобактерий следили в течение 3 месяцев, подсчитывали количество выросших колоний в пробирках и вычисляли затем число колониеобразующих единиц микобактерий на грамм ткани органа (КОЕ/г).
Для гистологических исследований кусочки легких, селезенки, печени фиксировали в 10% формалине. После фиксации и проводки материал заливали в парафин и из парафиновых блоков изготовляли ступенчатые гистологические срезы. Использовали окраски гематоксилином и эозином.
Проводили статистическую обработку полученных результатов; вычисляли (M+m). Достоверность различий между группами наблюдений оценивали по критерию Стьюдента.
Результаты исследования.
Гибель единичных животных в контрольной и опытных группах наблюдали на последней неделе химиотерапии (таблица 12). К моменту окончания эксперимента наиболее значимый прирост массы тела у оставшихся животных отмечался у мышей 2, 3 и 4 опытных групп.
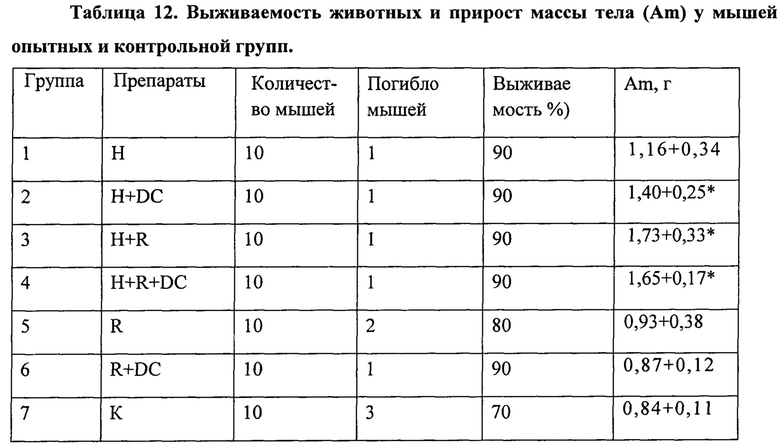
Примечание: * - различия с контрольной (7) группой статистически достоверны (р<0,05).
Оставшихся животных эвтаназировали. При вскрытии провели визуальную оценку внутренних органов и сделали забор материала для гистологических и микробиологических исследований.
Результаты макроскопических патоморфологических исследований представлены в таблице 13.

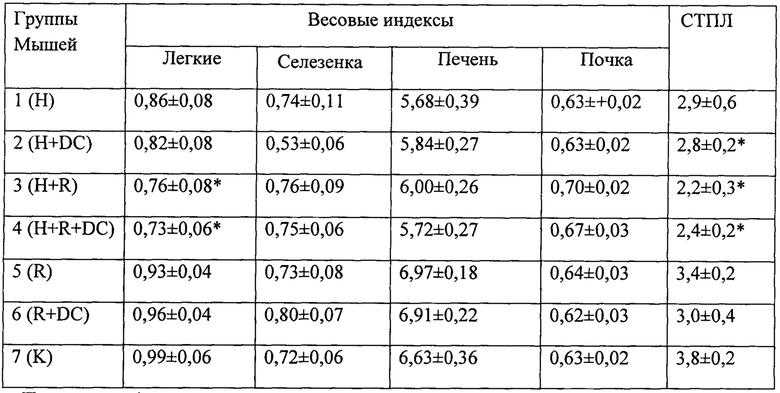
Примечание: * - различия с контрольной (7) группой статистически достоверны (р<0,05).
Как следует из таблицы 13, определены достоверные различия показателей степени поражения легких и весового индекса легких между контрольной группой (7) и некоторыми опытными группами: 2, 3 и 4. Однако существенных различий по показателю степени поражения легких между этими опытными группами не выявлено.
Гистологические исследования
При гистологическом исследовании легких, селезенки и печени мышей были получены следующие результаты.
В контрольной группе (7):
В легких выражены очагово-инфильтративные изменения но типу интерстициальной пневмонии и выраженной интенсивностью лимфо- макрофагальных скоплений в перибронхиальной ткани, очажки по типу крупноочаговой диссеминации и бляшечного типа клеточными скоплениями в плевре.
В ткани печени: выраженная гидропическая дистрофия гепатоцитов с дискомплексацией печеночных балок. Отмечается наличие милиарного типа лимфо-макрофагальных гранулем, в том числе и в септах.
В селезенке: фолликулы разновеликие с различной степенью очерченности. В ткани - значительное количество мегакариоцитов.
В 1-й группе (Н):
В ткани легких отмечалось наличие неравномерно расположенных инфильтративно-пневмонических очагов. Встречались ограниченные перибронхиальные лимфо-макрофагальные инфильтраты, а также единичные крупные лимфо-макрофагальные очаги.
В ткани печени на фоне скудных проявлений гидропической дистрофии гепатоцитов и незначительной десквамации печеночных балок отмечалось наличие мелких диссеминированных лимфо- макрофагальных гранулем. По ходу септ кое-где присутствовали ограниченные лимфоидные скопления.
В селезенке выражены проявления гиперплазии лимфоидной ткани по фолликулярному типу.
Во 2-й группе (H+DC):
В ткани легких выявлено наличие участков инфильтративно-пневмонического типа на фоне полнокровия и участков эмфиземы В перибронхиальной ткани скудные лимфо-макрофагальные скопления. Гранулематозных изменений нет.
В печени выражены незначительные проявления гидропической дистрофии гепатоцитов. Гранулемы мелкие, немногочисленные.
В селезенке отмечается наличие крупных и средних гиперплазированных фолликулов с размытыми контурами. В субкапсулярной зоне в значительном количестве содержались мегакариоциты.
В 3 группе (H+R):
В легких проявления специфического воспаления были слабее: встречались ограниченные участки типа интерстициальной пневмонии. Перибронхиально встречались единичные лимфо- макрофагальные узелковые скопления, в том числе субплеврально в виде «полосок».
В печени дистрофические изменения гепатоцитов были слабыми и лимфо-макрофагальные гранулемы единичными.
В селезенке: фолликулы разновеликие с расширенной, нечеткой краевой зоной.
В 4-й группе (Н+R+DC):
В легких обнаруживались ограниченные интерстициально-пневмонические изменения. Перибронхиальные и периваскулярные лимфо-макрофагальные клеточные скопления были минимальными по объему. Выявлялись единичные бляшкоподобные гранулематозные очажки.
В печени проявления гидропической дистрофии гепатоцитов и десквамации печеночных балок незначительны. Лимфо-макрофагальные гранулемы единичные, точечные по величине. Клеточная инфильтрация по ходу септ отсутствовала.
Селезенка: фолликулы крупные, с незначительным расширением краевой зоны; субкапсулярно-умеренное количество мегакариоцитов.
В 5-й группе (R):
В ткани легких отмечалось наличие участков инфильтративных изменений. Выражены перибронхиальные и периваскулярные лимфо-макрофагальные скопления, иногда сливающиеся с паренхиматозными очажками. Очаговоподобные клеточные скопления встречались и в субплевральной зоне.
В печени были резко выражены гидропическая дистрофия гепатоцитов с очажками некробиоза и десквамацией печеночных балок. В ткани печени в умеренном количестве рассеяны мелкие лимфо-макрофагальные гранулемы. По ходу сосудов в септах имелись ограниченные лимфоидные скопления.
В селезенке: фолликулы разновеликие с преобладанием крупных с размытостью границ. Количество мегакариоцитов в субкапсулярной зоне умеренное.
В 6-й группе (R+DC):
В легких наблюдали участки инфильтративно-пневмонических изменений и лимфо-макрофагальные перибронхиальные инфильтраты небольшие (выраженные в отдельных участках). Лимфо-макрофагальные очаги крупные, неправильной формы, преимущественно с субплевральной локализацией. Выражено полнокровие ткани.
В печени выявлялись резкие дистрофические изменения гепатоцитов с участками некробиоза и некроза, выражена десквамация печеночных балок. По ходу септ скудные лимфоидные скопления. Лимфо-макрофагальные гранулемы мелкие в умеренном количестве.
В селезенке выражено полнокровие красной пульпы. Имелись крупные фолликулы с размытостью границ.
Таким образом, инволютивные изменения компонентов специфического воспаления отслеживались как по объему, так и по характеру. Так, в гистологических препаратах из органов мышей контрольной (7) группы имели место распространенные очагово- инфильтративные изменения, сходные с интерстициальной пневмонией, и массивные лимфо-макрофагальные инфильтраты в перибронхиальной ткани, находили также очаговые и субплевральные бляшечные клеточные скопления.
В препаратах мышей опытных групп, получавших различное лечение, отмечали снижение остроты процесса: сходили на нет инфильтративно-пневмонические изменения, падал объем перибронхиальных клеточных скоплений, исчезали очаги - диссеминанты. В печени гранулемы становились точечными, падала интенсивность гидропической дистрофии гепатоцитов. Однако инволюция специфического воспаления в опытных группах различалась по «результативности». По эффективности уменьшения проявлений туберкулезного процесса группы расположились следующим образом: 4, 2, 3 и 1. У мышей в группах №5 и 6 проявления специфического воспаления сохранились в большем объеме, а дистрофические изменения гепатоцитов сопровождались развитием некробиоза и некроза.
Таким образом, по данным гистологических исследований, при сочетанном применении с противотуберкулезным препаратом изониазидом, а также совместно с изониазидом и рифампицином ФК усиливала лечебное действие при лечении лекарственно устойчивой формы туберкулеза. При применении ФК с рифампицином без изониазида такого усиления не наблюдалось.
Заключение.
По данным клинических, микробиологических и патоморфологических исследований установлено:
1. При инфицировании мышей культурой МБТ, устойчивых к изониазиду и рифампицину, развивался специфический процесс, характеризовавшийся распространенными очагово-инфильтративными изменениями легочной и перибронхиальной тканей и массивной высеваемостью колоний МБТ из легких и селезенки;
2. При введении мышам в течение 1 месяца ФК в комплексе с изониазидом наблюдалось достоверное снижение степени пораженности легких, высеваемости МБТ из легких и селезенки по сравнению с контрольной группой. По сравнению с применением одного изониазида наблюдалось значительное уменьшение лимфо-макрофагальных гранулем в легочной ткани.
3. При введении мышам в течение 1 месяца ФК в комплексе с изониазидом и рифампицином наблюдалось значительное снижение степени пораженности легких, весового индекса легких, высеваемости МБТ из легких и селезенки по сравнению с контрольной группой. В легочной ткани отмечалось более выраженное уменьшение инфильтративно-пневмонических изменений по сравнению с контрольной группой и остальными опытными.
Пример 6
Изучение фармакологической активности фармкомпозиции при экспериментальном инфаркте миокарда
В настоящем исследовании представлены материалы по изучению специфической фармакологической активности фармкомпозиции (ФК) при экспериментальном инфаркте миокарда (ЭИМ) в сравнении со стандартным препаратом-антигипоксантом Рибоксином.
1. Экспериментальная часть
Животные. В работе были использованы половозрелые крысы-самцы линии SD весом 180-200 г, полученные из питомника ФИБХ РАН.
Карантин. Длительность карантина (акклиматизационного периода) составляла 14 дней. В течение карантина проводили ежедневный осмотр каждого животного. Перед началом исследования животные, отвечающие критериям включения в эксперимент, были распределены на группы с помощью метода рандомизации.
Содержание животных. Клетки с животными помещали в отдельные комнаты со световым режимом 12 ч - свет, 12 ч - темнота, температурой воздуха в пределах 19-25°С и относительной влажностью - 50-70%. Температуру и влажность воздуха регистрировали ежедневно. Был установлен режим проветривания, обеспечивающий около 15 объемов помещения в час, концентрацию СО2 не более 0.15 объемных %, аммиака - не более 0.001 мг/л.
Ежедневный осмотр. В течение исследования каждое животное осматривалось ежедневно. Осмотр включал в себя оценку поведения и общего состояния животных. Осмотр проводился примерно через 1 час после введения препаратов.
Экспериментальный инфаркт миокарда. Моделирование инфаркта миокарда проводили перевязкой левой коронарной артерии. Под эфирным рауш-наркозом рассекали кожу и подкожную жировую клетчатку, ткани отделяли по фасции, грудные и межреберные мышцы разъединяли вдоль хода волокон. После вскрытия грудной клетки сердце выводили в операционную рану, левую коронарную артерию прошивали и перевязывали лигатурой. Контроль наступления ишемии миокарда проводили электрокардиографически. После операции рану послойно ушивали. Экспериментальный инфаркт миокарда (ЭИМ) характеризуется формированием очага некроза, недостаточностью коронарного кровотока, угнетением сократительной активности миокарда, нарушением атриовентрикулярной и внутрижелудочковой проводимости, тканевого дыхания и метаболизма, активацией перекисного окисления липидов и снижением антиоксидантной защиты.
Регистрация ЭКГ. Регистрацию ЭКГ проводили на ненаркотизированньгх животных с помощью полиграфа RM-6000 (Япония). Крыс помещали в специальные клетки-пеналы из прозрачной пластмассы. В качестве электродов использовали тонкие стальные иглы, введенные подкожно. ЭКГ записывали в отведении I. Электрокардиографическим признаком ЭИМ у крыс является регистрации подъема сегмента ST через 1 час после операции.
Динамику веса тела крыс определяли на весах ВЛР-500. Сердца животных взвешивали на электронных весах 1602 MP немецкой фирмы "Sartorius".
Исследуемые препараты.
Рибоксин (9-β-D-рибофуранозилгипоксантин, ООО "Нижфарм", Россия, №001382/01-2002, 06.05.2002), широко применяемый в комплексной терапии ишемической болезни сердца, перенесенного инфаркта миокарда, миокардиодистрофии (снижение функциональной способности сердечной мышцы), нарушениях ритма, связанных с применением сердечных гликозидов, вводили интрагастрально в дозе 10 мг/кг один раз в сутки курсом 7 дней после ЭИМ. Препарат ФК в дозах 200 и 500 мкл/крыса вводили по той же схеме, что и Рибоксин. Крысам контрольных групп вводили растворитель - дистиллированную воду. Сравнительная эффективность препаратов оценивалась по нескольким показателям: летальности и клинической картине; функциональным - ЭКГ (1 ч, 3 дня и 7 дней), биохимическим (исследование крови и ткани сердца через 24 ч после ЭИМ), гистологическим (24 ч, 3 дня и 7 дней).
Экспериментальные группы. Было сформировано пять экспериментальных групп по 15 животных в каждой: группа I - ложнооперированные животные (отрицательный контроль), группа II - животные с ЭИМ без лечения (положительный контроль), группа III - животные с ЭИМ, терапия препаратом Рибоксин (10 мг/кг), группа IV - животные с ЭИМ, терапия препаратом ФК (200 мкл/крыса), группа V - животные с ЭИМ, терапия препаратом ФК (500 мкл/крыса).
Кровь для биохимических исследований получали пункцией хвостовой вены. Забитых декапитацией животных подвергали патологоанатомическому вскрытию и гистологическому исследованию ткани сердца. Сердце фиксировали в 10-15% формалине и заливали в парафин. Парафиновые срезы окрашивали гематоксилин-эозином и по Ван-Гизону.
Содержание восстановленного глутатиона в печени определяли йодометрически [67], содержание гликогена в печени - методом Самодьи [68], уровень глюкозы в крови и гомогенатах органов измеряли ортотолуидиновым методом [69]. Активность АЛТ, ACT, ЩФ, КФ, ЛДГ сыворотки крови определяли с помощью наборов Био-Лат-Тест (Лахема, Чехия).
Интенсивность тканевого дыхания в гомогенатах органов определяли манометрическим методом Варбурга [70]. Содержание молочной кислоты в крови определяли по методу Баркера [71], активность сукцинатдегидрогеназы - по методу Вогельса [72].
Статистическую обработку результатов проводили с помощью t-критерия Стьюдента.
2. Инфаркт-характеристика экспериментальных групп
Экспериментальное моделирование инфаркта миокарда сопровождалось примерно 20-26% смертностью; таким образом, в исследовании наблюдались 11-12 животных из каждой группы (табл. 14). Результаты исследования динамики ЭКГ не выявили практически никаких различий между исследуемыми группами до начала моделирования ЭИМ (табл. 15, фиг. 31).
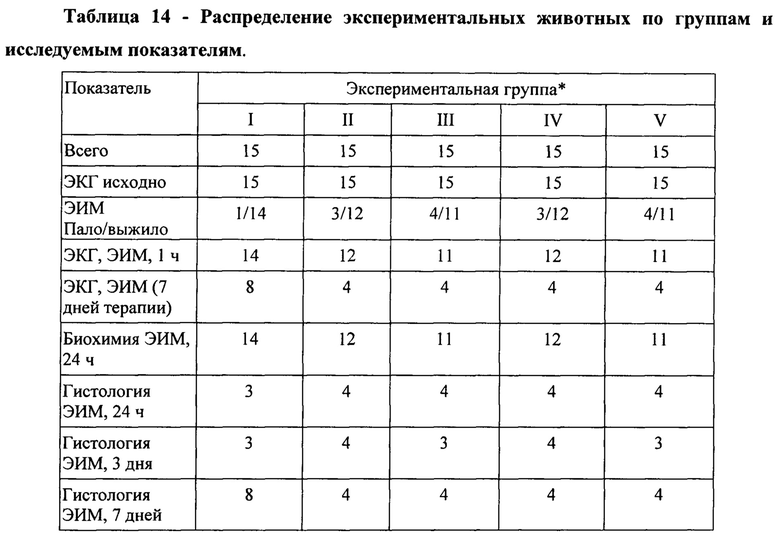
*I - отрицательный контроль; II - положительный контроль - ЭИМ без терапии; III - ЭИМ + Рибоксин; IV - ЭИМ + ФК (200 мкл/крыса); V - ЭИМ + ФК (500 мкл/крыса).
Анализ ЭКГ выявил распределение животных в опытных группах в зависимости от регистрации подъема сегмента ST, характеризующего наличие инфаркта миокарда, с выделением в каждой опытной группе подгрупп с зарегистрированным инфарктом миокарда (ИМ) и без электрокардиографических признаков инфаркта миокарда (БИМ) через 1 ч после операции. Согласно полученным данным, после моделирования ЭИМ не наблюдалось достоверных различий в частоте возникновения ИМ в экспериментальных группах: частота ИМ составляла в среднем 83.2%, БИМ - 16.8%.

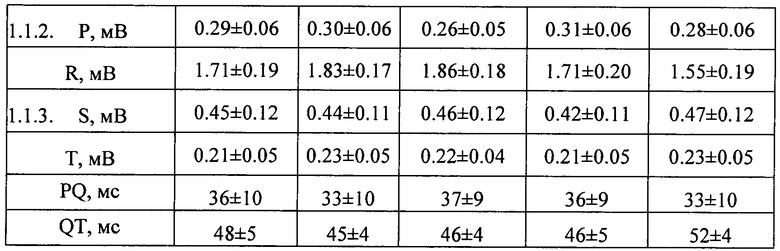
n - количество животных в группе; p<0.05 по сравнению с группой I. Аритмия в экспериментальных группах не зарегистрирована.
Через 1 час после моделирования ЭИМ величина подъема сегмента ST достоверно не отличалась между группами (табл. 16, фиг. 32). В группе I (отрицательный контроль) подъема сегмента ST не наблюдалось. Как свидетельствуют полученные данные, после экспериментального инфаркта миокарда не наблюдалось достоверных различий в частоте возникновения ИМ в экспериментальных группах. Частота ИИ составила в среднем 83.2%, БИМ - 16.8%.
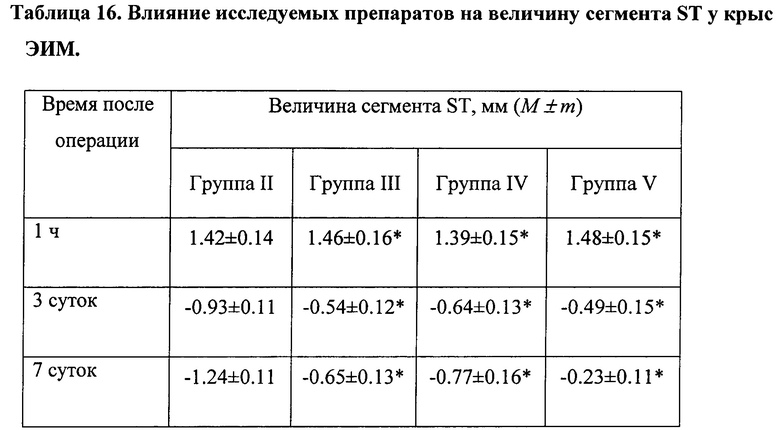
* p<0.05 по сравнению с группой II.
Снижение сегмента ST ниже изолинии (депрессия) характеризует постинфарктные ишемические изменения и свидетельствует о недостаточности кровоснабжения и гипоксии миокарда. Результаты, приведенные в таблице 16, показывают, что величина депрессии сегмента ST через 3 суток после ЭИМ в группах III (терапия Рибоксином) и IV (терапия ФК в дозе 200 мкл/крыса) была в 1.5, а в группе V (терапия ФК в дозе 500 мкл/крыса) в 2 раза меньше, чем в группе II (ЭИМ без терапии). На фигурах 33 и 34 приведены ЭКГ крыс групп II и V.
Через 7 суток после ЭИМ величина депрессии сегмента ST в группе II достоверно увеличилась в 1.2. раза по сравнению со сроком 3 суток (табл. 16, фиг. 35; 36). На фоне терапии Рибоксином и ФК в дозе 200 мкл/крыса (группы III и IV) величина депрессии сегмента ST не изменялась, а в группе V (терапия ФК в дозе 500 мкл/крыса) достоверно снижалась в 2 раза и была в 4 раза менее выражена, чем в контроле (группа II). Полученные результаты свидетельствуют о способности ФК повышать устойчивость миокарда к ишемии. Следует отметить, что противоишемическое действие ФК было дозозависимым (табл. 16).
3. ЭКГ характеристика экспериментальных групп
В табл. 17 приведены данные о влиянии Рибоксина и ФК на динамику частоты сердечных сокращений (ЧСС) и показателей ЭКГ у крыс после ЭИМ. Видно, что в группе II (ЭИМ без лечения) наблюдался выраженный стойкий отрицательный хронотропный эффект (достоверное снижение ЧСС на 30-40% через 1 час и 7 суток по сравнению с группой I). Кроме того, у крыс этой группы наблюдались следующие достоверные изменения ЭКГ через 7 суток: уменьшение в 2 раза амплитуды зубца R по сравнению со сроком наблюдения 1 ч и группой I, что характеризует угнетение сократительной активности миокарда в постинфарктный период; а также удлинение PQ и QT в 2.4 и 2 раза по сравнению со сроком наблюдения до ЭИМ, что свидетельствующее о стойком прогрессирующем нарушении атриовентрикулярной (PQ) и внутрижелудочковой (QT) проводимости.
На фоне терапии препаратом Рибоксин (табл. 17, группа III) сохранялось достоверное снижение ЧСС, уменьшение амплитуды зубца R и удлинение QT через 7 суток по сравнению с нормой (группа I) и со сроком наблюдения 1 час. В то же время, достоверного удлинения PQ не происходило, что свидетельствует о нормализации атриовентрикулярной проводимости.
 p<0.05 по сравнению со сроком наблюдения 1 ч
p<0.05 по сравнению со сроком наблюдения 1 ч
 •p<0.05 по сравнению с нормой - до ЭИМ
•p<0.05 по сравнению с нормой - до ЭИМ
ФК (группы IV и V) также не влияла на ЧСС - брадикардия была на том же уровне, что и в группах II и III (табл. 17). В то же время, через 7 суток не происходило достоверного снижения амплитуды зубца R и наблюдалось достоверное (в 2 раза) повышение амплитуды зубца Т, что свидетельствует о повышении сократительной активности миокарда на фоне терапии ФК в дозах 200-500 мкл/крыса. Как и в случае терапии Рибоксином, в группах IV и V наблюдались достоверные нарушения внутрижелудочковой проводимости (удлинение QT в 1.3 и 1.5 раза через 1 ч и 7 суток по сравнению со сроком наблюдения до ЭИМ) и нормализация атриовентрикулярной проводимости.
4. Влияние исследуемых препаратов на морфометрические и биохимические показатели экспериментальных животных.
Результаты морфометрических и биохимических исследований на фоне экспериментального инфаркта миокарда представлены в табл. 18.
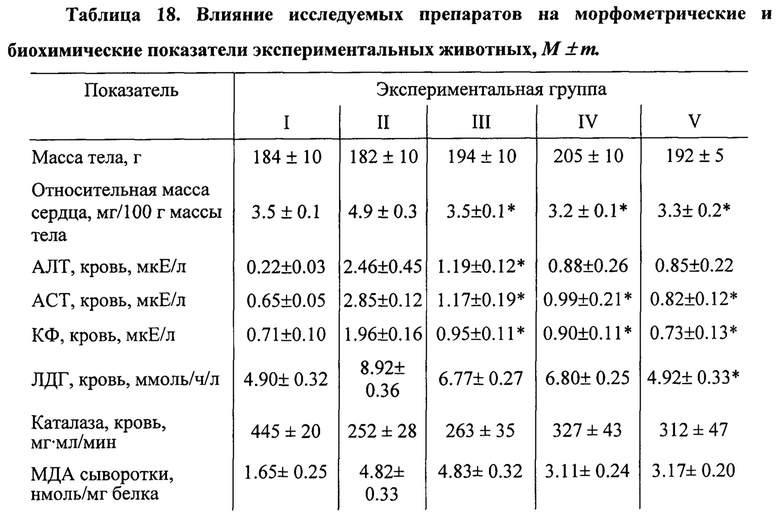
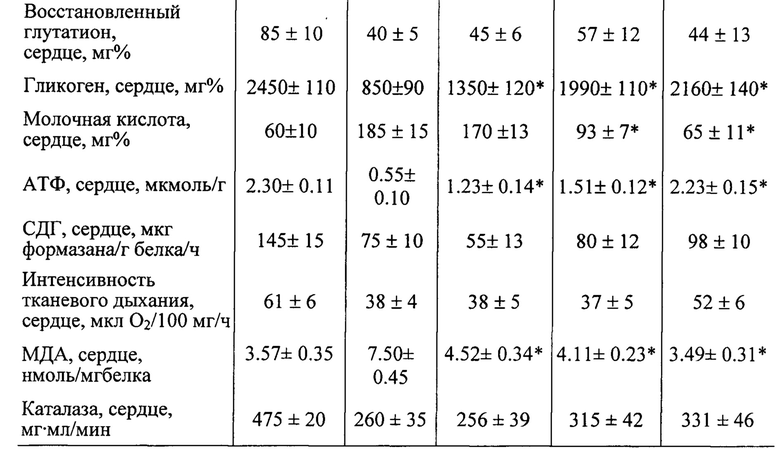
* - различия достоверны по сравнению с группой II (p<0.05).
Оказалось, что ЭИМ характеризуется достоверным увеличением относительной массы сердца. Кроме того, наблюдались достоверные признаки цитолиза в миокарде: увеличение активности АЛТ, ACT, КФ и ЛДГ в плазме крови. Фиксировались нарушения процессов тканевого дыхания и метаболизма в миокарде: снижались запасы АТФ, гликогена; повышалось содержание недоокисленных продуктов обмена - молочной кислоты; наблюдалась активация свободно-радикальных реакций (увеличение концентрации МДА - конечного продукта перекисного окисления липидов) и снижение уровня антиоксидантной защиты (каталазы, СДГ, ВГ). ФК (группы IV и V) достоверно снижала активность ACT, КФ и ЛДГ крови; нормализовала относительную массу сердца, а также содержание молочной кислоты и МДА и увеличивала содержание гликогена и АТФ в миокарде (табл. 18). Во всех случаях ФК была активнее Рибоксина (группа III).
5. Гистологические исследования
Результаты гистологических исследований представлены на фиг. 37 и 38. На фиг. 37-а приведена типичная гистологическая картина миокарда левого желудочка сердца интактной крысы. Отчетливо видны поперечная исчерченность миофибрилл и ядра кардиомиоцитов. Через 24 ч после операции в миокарде левого желудочка крыс группы II (контроль) наблюдались общие расстройства кровообращения в виде полнокровия, небольших кровоизлияний, стазов крови в капиллярах, отека. Преимущественно под эпикардом видны мышечные волокна, интенсивно окрашенные эозином или пикриновой кислотой (фиг. 37-б). Через трое суток (фиг. 37-в) расстройство кровообращения носило уже не общий, а местный характер. На фиг. 37-в видно, что кардиомиоциты гомогенно окрашены эозином, т.е. лишены поперечной исчерченности и ядер. Большая часть некротизированных волокон находится в состоянии лизиса и окрашена очень бледно. В зоне некроза видны гемолизированные эритроциты и полиморфоядерные лейкоциты. Строма миокарда вне зоны некроза была отечной. На 7-е сутки (фиг. 37-г) наблюдалось рассасывание некротизированных волокон и замещение участков некроза молодой соединительной тканью, богатой клеточными элементами преимущественно фибробластического ряда. В более поздние сроки на месте этих очагов пролиферации формировался фиброзный рубец.
У крыс опытных групп (III-V) через 24 ч после ЭИМ общее расстройство кровообращения миокарда левого желудочка сердца было менее выражено по сравнению с группой И. В участке ишемии наблюдалась эозинофилия мышечных волокон и небольшой отек. Через трое суток (фиг. 38-а, б, в) наблюдалось формирование инфаркта миокарда, преимущественно под эпикардом передней стенки левого желудочка. Размеры очага некроза были значительно меньше, чем у контрольных крыс. На фиг. 38-в (группа V) различима поперечная исчерченность миофибрилл. Лейкоцитарная инфильтрация вокруг очага некроза слабо выражена. Интерстициальный отек вне зоны ишемии отсутствует.
На 7-е сутки на месте некротизированных волокон наблюдалась пролиферативная реакция стромы с большим количеством клеток фибробластического ряда. Размеры участка пролиферации были меньше по сравнению с контролем. На фиг. 38-г в зоне инфаркта видна молодая соединительная ткань с большим количеством фибробластов (группа V).
Суммируя полученные результаты можно сделать следующие выводы: 1) ФК обладает выраженным противоишемическим действием: улучшает коронарный кровоток в постинфарктный период (в дозе 200 мкл/крыса - в 1,5 в дозе 500 мкл/крыса - в 4 раза); 2) ФК увеличивает сократительную активность миокарда в постинфарктный период в 2 раза, способствует нормализации нарушений атриовентрикулярной проводимости миокарда, причем данный эффект достигается уже на дозе 200 мкл/крыса; 3) ФК обладает выраженным кардиопротективным действием, снижает интенсивность цитолиза миокарда, интенсивность перекисного окисления липидов, способствует повышению уровня антиоксидантной защиты, причем более эффективно, чем препарат сравнения Рибоксин.
Пример 7
Исследование токсического действия ФК
Для выявления возможного токсического, раздражающего и аллергенного действия ФК были проведены экспериментальные исследования общей токсичности (острой, подострой и хронической) и аллергенности при внутрижелудочном введении ФК.
Объем доклинических испытаний определялся: «Правилами доклинической оценки безопасности фармакологических средств (GLP)» (РД 64-126-91. М., 1992) и «Методическими указаниями по доклиническому изучению новых препаратов, разрабатываемых из природного сырья» (в кн. «Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ», М., 2000, с. 346-348). Кроме этого использовались «Методические указания о порядке доклинического и клинического изучения препаратов природного происхождения и гомеопатических лекарственных средств» (М., 1994, 64 с.). В соответствии с требованиями этих нормативных документов, касающихся изучения безопасности препарата (субстанции) из известного природного сырья, были исследованы следующие виды токсичности:
- острая токсичность;
- подострая и хроническая токсичность;
- местно-раздражающее действие;
- аллергизирующее действие.
Кроме этого, использовали нормативные документы МЗСР РФ:
- «Методические указания по изучению общетоксического действия фармакологических веществ» (в книге «Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ», М., ОАО «Издательство «Медицина», 2005, с. 41-53);
- «Методические указания по оценке аллергизирующих свойств фармакологических веществ» (там же, с. 54-69). Основные результаты этих исследований кратко суммированы в таблице 19.

* V класс - класс практически нетоксичных лекарственных веществ [73, 74]
Эксперименты показали, что даже эта незначительная острая токсичность ФК определяется только присутствием экстрагента в конечном продукте. Было показано, что заявляемая фармкомпозиция практически нетоксична и в условиях длительного (90 суток) непрерывного применения не вызывает нарушений биохимических показателей крови крыс и собак, не оказывает негативного воздействия на основные физиологические системы и внутренние органы. ФК при внутрижелудочном введении не вызывает раздражающего эффекта и не обладает аллергенными свойствами.
Пример 8
Ранозаживляющее действие ФК на модели острой инфицированной раны у собак
Опыт проводился на 10 собаках, которые были разделены на 2 группы (по 5 животных в группе) по принципу аналогов, опытную и контрольную. Животным обеих групп наносили ожоговую рану. Гнойную рану получали при инфицировании ожоговой раны навозом (стафилококковая и стрептококковая инфекция).
В опытной группе лечение инфицированных ран производили ФК в дозе 0,1 мл на 1 кг живого веса, параллельно проводили влажную тампонаду раны с наложением повязки после соответствующего туалета. Для влажной тампонады ФК разбавляли водой 1:1.
В контрольной группе лечение проводили по общепринятой методике с использованием линимента бальзамического по Вишневскому. В ходе экспериментов проводились клинические, микробиологические, гематологические и гистологические исследования а также целлофанограмма и фотографирование ран. В опытной группе, процесс заживления инфицированных ран был ускорен, а выделение гнойного экссудата прекратилось на 5-ые сутки. Наряду с этим нормализовались гематологические показатели. Полное заживление инфицированных ран наступило на 13-ые сутки, в то время как в контрольной группе заживление инфицированных ран не происходило даже на 15-ые сутки. Результаты представлены на фиг. 39.
Результаты целлофанографических исследований заживления раневого процесса представлены в таблице 20.
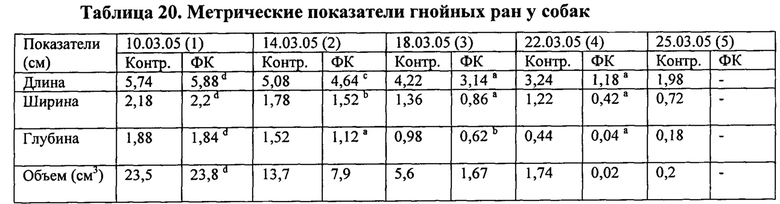
Примечания: а/Р≤0.001; b/Р≤0.01; с/Р≤0.05; d/Р≤1.0
Пример 9
Иммуномодулирующее действие фармкомпозиции
Праймирующую активность препаратов оценивали по влиянию препарата ФК, полученного путем экстракции буферным солевым раствором предобработанных личинок или лиофилизованного гомогената личинок восковой моли на респираторный взрыв нейтрофилов.
Как следует из фиг. 40 прединкубация крови с неспиртовыми экстрактами вызывает увеличение хемилюминесценции, сопровождающей ответ нейтрофилов цельной крови на зимозан. Увеличение концентрации неспиртового экстракта лиофилизованных личинок в среде инкубации, приводит к дозозависимой активации респираторного взрыва нейтрофилов в ответ на зимозан (эффект праймирования), достигая своего максимума ХЛ (на 62% по отношению к контролю) при концентрации 0,006 мг сырого вещества. При дальнейшем увеличении концентрации, ХЛ снижается. Неспиртовой экстракт лиофилизованного гомогената, также приводит к увеличению ХЛ ответа нейтрофилов на зимозан, однако, в меньшей степени - на 20% при концентрации 0,005 мг.
Пример 10
Мембранолитическое действие ФК на митохондриях
Выявление присутствия в ФК комплекса пептидов и белков с высокой бактериолитической активностью указывало на то, что препарат может оказывать и мембранолитическое действие на митохондрии высших животных и человека.
Известна общность физико-химической организации различных биологических мембран. Особенно близки мембраны микробов и митохондрий, поскольку считается, что митохондрии у животных произошли в результате симбиоза с микроорганизмами.
Повышение проницаемости бактериальных мембран веществами, активирующими перенос через мембрану митохондрий, как показано в работе [75].
Предполагаемое мембранолитическое действие ФК было проверено нами путем измерения величины мембранного потенциала по поглощению катиона ТФФ+ ион-селективным электродом. Измерения проводили или при добавках ионов кальция, увеличивающих нагрузку на митохондрии (панель А), или без нагрузки при добавлении ФК сравнительно со стандартным пептидным препаратом тималином (панель Б).
Полученные данные представлены на фиг. 41 и в табл. 21
Фиг. 41 показывают, что за 5-100 сек контакта с ФК проницаемость мембран митохондрий сильно повышается, поскольку они накапливают примерно вдвое меньшее количество ионов кальция.
Повышение проницаемости мембраны митохондрий связано с уменьшением мембранного потенциала. Это показано на панели Б в сравнении с действием препарата тималина, содержащего больше пептидов в добавляемых количествах. Также довольно быстро, за время взаимодействия ФК с мембранами митохондрий 100-300 сек наблюдается снижение мембранного потенциала примерно вдвое.

В табл. 21 приведены средние результаты влияния исследуемых образцов, содержащих пептиды по начальным эффектам влияния при кратком взаимодействии с митохондриями, 100 сек. Видно, что действие развивается быстро.
Проведенные исследования показывают, что хорошо известное бактериолитическое действие комплекса высокоактивных пептидно-белковых компонентов ФК может проявлять совершенно неучитываемое ранее влияние на мембранный потенциал митохондрий макроорганизма человека. Это действие состоит в снижении мембранного потенциала митохондрий, которое может иметь важное регуляторное значение при некоторых распространенных патологиях (подробнее в разделе «Раскрытие изобретения»).
Пример 11
Увеличение скорости и степени экстракции активных компонентов композиции
Способ получения ФК значительно сокращает сроки экстракции активных компонентов из сырья, а также увеличивает концентрацию пептидов, аминокислот и антиоксидантов в ФК. На фиг. 42 представлены фотографии вариантов ФК, полученных разными способами. Из фиг. 42 следует, что при использовании предобработанных личинок сокращается время экстракции компонентов композиции. При половинном сроке инкубации уже наблюдается значительный выход в раствор из предобработанных личинок, в то время как при получении ФК из живых личинок, выхода компонентов практически не происходит. В таблице 22 показан выход некоторых компонентов ФК в экстракт при укороченном и заявленном способе экстрагирования с использованием живых или предобработанных личинок.


На фиг. 43 представлены результаты разделения белков и пептидов в препаратах ФК, полученных из живых и предобработанных личинок, а также из предобработанных личинок с разным сроком хранения. Как следует из таблицы 22 и фиг. 43, предобработка личинок позволяет быстрее экстрагировать компоненты ФК из сырья, а также увеличивает содержание компонентов ФК в конечном продукте. Содержание аминокислот в ФК в большей степени зависит от способа выращивания и кормления личинок (Пример 2). Предлагаемый способ получения позволяет увеличить содержание антиоксидантных компонентов и стимулирующих активность фагоцитов компонентов в ФК и может быть осуществлен с использованием разных экстрагентов.
На фиг. 44 приведены результаты исследования АОА препаратов ФК, полученных в результате 4-дневной холодной экстракции компонентов из предобработанных личинок или из лиофилизированного гомогената личинок.
Препараты ФК были получены с использованием лиофильной сушки целых или предварительно гомогенизированных в стеклянном гомогенизаторе Поттера-Эльвегейма личинок (36 часов, в камере -80°, система в колбах). Для оценки АОА и праймирующей активности препаратов проводили экстракцию лиофилизированных личинок двумя способами: раствором этанола (30 мг/1 мл) или бескальциевым раствором Хенкса (30 мг/мл) в течение 4 суток при температуре 4°С в темноте. После экстракции измеряли АОА каждого образца. Как видно из рисунка 2 для 50% ингибирования необходимо 0,45 мг (в расчете на сырой вес личинок) экстракта, полученного из лиофилизата целых или гомогенизированных личинок (кривые совпадают) и 4,5 мг (в расчете на сырой вес личинок) спиртового 20 дневного экстракта из живых личинок. Таким образом, АОА спиртовых экстрактов, полученных из лиофилизованных личинок, значительно превышает АОА ФК. При этом Как следует из фиг. 44 предварительная лиофилизация существенно сокращает время экстракции (4 суток вместо 21 суток), необходимое для выхода в экстракт антиоксидантных компонентов ФК.
Пример 12
Получение сухого препарата на основе фармкомпозиции
Для получения сухого препарата в качестве загустителя может быть использован сорбит. Для получения сухой бесспиртовой формы ФК разное количество предварительно растертого в порошок сорбита смешивали в ступке с 0,45 мл ФК.
Доза 0,45 мл соответствует 15 каплям (1 капля около 0,03 мл) - средняя рекомендуемая разовая доза на одного человека, при расчете по 2 капли ФК на 10 кг веса (максимальная рекомендуемая доза при тяжелых состояниях - 1 капля на 1 кг веса).
Для оценки активности полученных препаратов определяли их антиоксидантную активность (АОА) по ингибированию аутоокисления адреналина. Измеряли АОА исходной жидкой ФК (ЖФК), АОА раствора загустителя, а также исследовали влияние добавки раствора загустителя на АОА ЖФК. Определение АОА проводили, как описано в примере 3. Результаты представлены на фиг. 45, 46. Как видно из фиг. 45-б, 46, сорбит ингибирует реакцию окисления адреналина, но в значительно меньшей степени, чем ФК (фиг. 45-а). На фиг. 46 показано ингибирующее действия ЖФК на окисление адреналина в присутствии различных количеств сорбита в реакционной среде. Для определения ингибирующего действия ЖФК на скорость окисления адреналина в присутствии сорбита в кювету спектрофотометра вносили указанные на фиг. 46 справа объемы раствора сорбита (2 г/мл воды) и при каждой концентрации сорбита определяли скорость аутоокисления адреналина в присутствии разного количества добавленной ЖФК. За 100% принимали скорость реакции окисления адреналина без добавок (ингибирование равно 0%). Для определения АОА ЖФК в присутствии сорбита измеряли степень ингибирования аутоокисления адреналина препаратом ЖФК в присутствии разных концентраций сорбита в инкубационной смеси как указано выше, но за 100% принимали скорость аутоокисления адреналина в присутствии соответствующего количества сорбита. Процент ингибирования добавленным препаратом ЖФК определяли по отношению к этой скорости (фиг. 48).
Как следует из фиг. 46, 47, сорбит увеличивает максимальную степень ингибирования фармкомпозицией реакции аутоокисления адреналина. В присутствии сорбита возможно достижение полного ингибирования окисления адреналина.
Для определения АОА в сухих препаратах ФК получали опытные образцы из ЖФК с известной АОА. Для приготовления образцов растирали сорбит в ступке до порошкообразного состояния, к этому порошку добавляли ЖФК. Смешивали до однородной массы, и когда образовывались гранулы, помещали их в чашки Петри.
Образцы сушили в течение суток, затем переносили в закрытые флаконы. В контрольном образце вместо ЖФК использовался растворитель в соответствующей концентрации, который смешивали с сорбитом в такой же пропорции, как ЖФК и высушивали до состояния гранул.
Определение антиоксидантной активности.
Непосредственно перед определением активности опытный и контрольный образцы растворяли в бидистиллированной воде. АОА сухого препарата на основе ФК представлена на фиг. 48.
Как следует из фиг. 47, 48, при смешивании жидкой ФК с загустителем и высушивании АОА получающегося сухого препарата ФК сохраняется.
Для определения условий хранения, при которых сохраняется их АОА образцы сухого препарата ФК с одинаковой АОА в течение 24 дней хранили в закрытых стеклянных флаконах в следующих условиях:
1) в холодильнике
2) при комнатной температуре, в темноте,
3) при комнатной температуре на свету.
Затем образцы растворяли в воде и определяли АОА по отношению к контрольному образцу (приготовленному с использованием растворителя вместо ФК) как указано выше. Результаты представлены на фиг. 49. На фиг. 50 показано влияние тех же условий хранение на АОА той жидкой ФК, которая была использована для приготовления сухих форм.
Как видно из фиг. 49, 50 АОА снижается при хранении в тепле и на свету. Следует заметить, что препарат ЖФК до начала эксперимента уже хранился в холодильнике в течение 3 месяцев со дня изготовления без снижения своей активности, но при помещении в комнатную температуру начал быстро терять активность. Активность сухих препаратов при хранении мало отличается от жидких препаратов. Таким образом, для сухих препаратов, полученных с использованием сорбита, необходимым условием сохранения в них АОА является их хранение на холоду, в темноте. Использование сорбита позволяет получить сухой препарат, не содержащий спирта с сохраненной АОА. Оптимальное для получения твердых гранул соотношение ФК и сорбита соответствует по экстракту количеству, равному дозе препарата для одного приема и по количеству сорбита - дозе, оптимальной для приготовления таблетки.
Пример 13
Экстракция в присутствии дигидрокверцетина
Для увеличения антиоксидантной активности, содержания пептидов в фармкомпозиции и повышения устойчивости при хранении в экстрагирующий раствор добавляли пищевой антиоксидант дигидрокверцетин и проводили обработку углекислым газом.
Условия получения экстрактов
Для получения экстрактов использовали свежезамороженные личинки. Личинки замораживались сразу после сбора, небольшими партиями и хранились в морозильной камере холодильника до начала экстракции. Перед началом экстракции все партии замороженных личинок объединяли и тщательно перемешивали. Для приготовления каждого экстракта личинки заливали раствором этанола с добавками или без. рН экстрактов, содержащих дигидрокверцетин доводили до значения 4,6. Для получения экстракта №4 экстрагирующий раствор продували углекислым газом в течение 10 минут, помещали в него личинки, перед закрытием емкости заполняли пространство под крышкой углекислым газом.
Экстракцию проводили при комнатной температуре, в темноте в течение 20 дней. Полученные экстракты хранили в 50 мл темных флаконах при +4°С или при +20°С в течение 21 месяца.

За 1 условную единицу АОА принято:
по адреналиновому методу: количество (мкл) экстракта, необходимое для 50% ингибирования реакции аутоокисления адреналина в стандартных условиях [54];
по хемилюминесцентному методу: такой добавляемый в модельную систему объем препарата, который приводит к таким же изменениям латентного периода ХЛ как и добавление тролокса в концентрации 1 мкМ [59].
Как следует из таблицы 23, добавка ДГКВ к экстрагирующему раствору увеличивает АОА получаемой ФК 1,5-2 раза.
На фиг. 9 показаны результаты электорофореза в ПААГ ФК, полученной с использованием ДГКВ. Четко видно, что продолжительное хранение в тепле приводит к снижению белково-пептидного состава ФК. Добавка углекислого газа даже дополнительно разрушает компоненты ФК. Добавка дигидрокверцетина в меньшей концентрации мало эффективна. Но в концентрации 1 г/л существенно повышает сохранность белков и пептидов. Таким образом, использование ДГКВ при получении ФК препятствует разрушению пептидов в процессе хранения, особенно при хранении на холоду.
Список использованных источников
1. Metalnikoff S.J. Contribution a rimmunite de la mite des ruches d'abeilles (Galeria melonela) 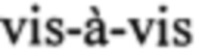 de I'infection tuberculeuse// Archives des sciences biologiques publiees par l'Institut Imperial de medicine experimentale a St.-Petersburg - 1906 - Vol. 12, N 1 - P. 300-317.
de I'infection tuberculeuse// Archives des sciences biologiques publiees par l'Institut Imperial de medicine experimentale a St.-Petersburg - 1906 - Vol. 12, N 1 - P. 300-317.
2. Oliver H.R. Antibiotic action of an extract of Galleria mellonella// 1947 - Nature - V. 159. - N 4046. - P. 685-687.
3. Kuzniecow A. & Wojciechowski E. Wpliw  z larw Galleria mellonella na wzrost
z larw Galleria mellonella na wzrost  Medicina, Doswiadczalna I Microbiologia// 1950. - Vol. 2 - N 2 - P. 246-249.
Medicina, Doswiadczalna I Microbiologia// 1950. - Vol. 2 - N 2 - P. 246-249.
4. Paszevski A. Influence of an enzyme extract from larvae of Galleria mellonella together with penicillin or sulphatiazole on the Growth of Micobacterium tuberculosis 607//Annales Universitatis Mariae  Lublin - Polonia, sectio C. - 1959. - V. 14 - N 20. - P. 435-438.
Lublin - Polonia, sectio C. - 1959. - V. 14 - N 20. - P. 435-438.
5. Muftic M.K. Progress in pharmacological study of cerase, a new preparation against tuberculosis// 1958. - Brit J. of Tuberc - V. 52. - N. 4. - P. 308-312.
6. Muftic M.K Isolation properties of the cerase// 1957. - Enzimologia Acta Biocatalytica. - V. 18. - N 1. - P. 7-21.
7. Mankiewicz E. The lipidilytic enzymes of larvae of galleria mellonella// 1949 - Canadial Journal of Research. - V. 27. - sec E. - P. 195-201.
8. Powning, R.F., Davidson, W.J. Studies on insect bacteriolytic enzymes - 1. Lysozyme in haemolymph of Galleria mellonella and Bombex mory // Comp. Biochem. Phisiol. - 1972. - Vol. 45 В. - P. 669-686.
9. Jarosz, J. Simultaneous induction of protective immunity and selective Synthesis of hemolymph lysozyme protein in larvae of Galleria mellonella// Biol. Zbl. - 1979. - Vol. 98. - P. 459-471.
10. 10 Hoffmann, D., Hultmark, D., Boman, H.G. Insect immunity: Galleria mellonella and other lepidoptera have cecropiaP9-like Factors active against Gram negative bacteria// Insect Biochem. - 1981. - Vol. 11. - P. 537-548.
11. Cytrynska M., Mak P., Zdybika-Barabas A., Suder P., Jakubowicz T. purification and characterization of eight peptides from galleria mellonella immune hemolymph // Peptides. - 2007. - Vol. 28. - P. 533-546.
12. Bergin D., Murphy L., Keenan J., Clynes M., Kavanagh K. Pre-exposure to yeast protects larvae of Galleria mellonella from a subsequent lethal infection by Candida albicans and is mediated by the increased expression of antimicrobial peptides// Microbes and Infection - 2006. - Vol. 8. - P. 2105-2112.
13. Мак P.T., Chmiel G.J., Gacek J.W. Antibacterial peptides of moth Galleria mellonella//2001. - Acta Biochim. Polon. - Vol. 4. - P. 1191-1195.
14. Мухин С.A. (1961) О некоторых вопросах гомеопатического лечения болезней сердца// Е. Величко/ В поисках истины. - М. - 2005. - С. 225-264.
15. Студитский А.Н. Восстановление мышц у высших млекопитающих. Москва, АН СССР, 1961 г.
16. Патент RU 2038086. Способ получения биологически активного продукта из личинок большой восковой моли/Спиридонов Н.А., Рачков А.К., Мухин С.А., Кондрашова М.Н.// Бюллетень №18 от 27.06.1995.
17. Spiridonov N.A., Arkhipov V.V., Narimanov A.A., Kondrashova M.N. Effect of Galleria mellonella larvae preparation on cell cultures//1992. - Comp. Biochem. Physiol. - Vol. 102 C. - P. 205.
18. Martineau A.R, Newton S.M., Wilkinson K.A., Kampmann В., Hall B.M., Niga Nawroly N., Packe G.E., Davidson R.N., Griffiths C.J., Wilkinson R.J. Neutrophil-mediated innate immune resistance to mycobacteria// J. Clin. Invest. 2007, 117:1988-1994.
19. Adams J.S., Martin Hewison M. Unexpected actions of vitamin D: new perspectives on the regulation of innate and adaptive immunity// Nat Clin Pract Endocrinol Metab. 2008 February; 4(2): 80-90.
20. Matsuoka L.Y., Wortsman J., Haddad J.G., Kolm P., Hollis B.W. Racial pigmentation and the cutaneous synthesis of vitamin D//, Arch. Dermatol. 1991, 127, 536-538.
21. Stead W.W., Senner J.W., Reddick W.T., Lofgren J.P. Racial differences in susceptibility to infection by Mycobacterium tuberculosis// N Engl J Med. 1990 Feb 15; 322(7):422-427.
22. Кондрашова М.Н. Взаимодействие процессов переаминирования и окисления. Биохимия 56, 388-406, 1991.
23. Zakharchenko MV, Zakharchenko AV, Khunderyakova NV, Tutukina MN, Simonova MA, Vasilieva AA, Romanova OI, Fedotcheva NI, Litvinova EG, Maevsky EI, Zinchenko VP, Berezhnov AV, Morgunov IG, Gulyaev AA, Kondrashova MN. Burst of succinate dehydrogenase and α-ketoglutarate dehydrogenase activity in concert with the expression of genes coding for respiratory chain proteins underlies short-term beneficial physiological stress in mitochondria. Int J Biochem Cell Biol. 2013, 45, 190-200.
24. Kondrashova MN, Zakharchenko MV, Zakharchenko AV, Khunderyakova NV. Study of Succinate Dehydrogenase and α-Ketoglutarate Dehydrogenase in Mitochondria inside Glass-Adhered Lymphocytes under Physiological Conditions. The Two Dehydrogenases as Counterparts of Adrenaline and Acetylcholine Regulation. In: Dehydrogenases. Janeza Trdine, Croatia, 2012. 354 p. ISBN 978-953-307-019-3. Rosa Angela Canuto Ed. p. 235-265. http://www.intechopen.com/articles/show/title/study-of-succinate-dehvdrogenase-and-ketoglutarate-dehydrogenase-in-mitochondria-inside-glass-adhere
25. Korshunov SS, Skulachev VP, Starkov AA. High protonic potential actuates a mechanism of production of reactive oxygen species in mitochondria. FEBS Lett. 1997 Oct 13; 416(1):15-18.
26. K.L. Hoehna, A.B. Salmonb, C. Hohnen-Behrensa, N.Turnera, A.J. Hoya, G.J. Maghzalc, R. Stockerc, H. Van Remmenb, E.W. Kraegena, G.J. Cooneya, A.R. Richardsonb, D.E. Jamesa. Insulin resistance is a cellular antioxidant defense mechanism. PNAS, October 20, 2009 vol. 106 no. 42, 17787-17792.
27. Кондрашова MH, Захарченко MB, Хундерякова HB, Федотчева НИ, Литвинова ЕГ, Романова ОИ, Гуляев АА. Состояние сукцинатдегидрогеназы в организме - «выведенное из равновесия» или гиперактивное. Биофизика. 2013, Т. 58, вып. 1, 108-116.
28. Резник Н.Л. Занятия спящего мозга. Химия и Жизнь 2014, 3, 36-40.
29. Begg D.P., Woods S.C. Interactions between the central nervous system and pancreatic islet secretions: a historical perspective. Adv Physiol Educ, 2013, 37, 53-60.
30. Tian-Jiao Xu, Qi Wang, Xiao-Wen Ma, Zhen Zhang, Wei Zhang, Xiao-Chang Xue, Cun Zhang, Qiang Hao, Wei-Na Li, Ying-Qi Zhang, Meng Li. A novel dimeric thymosin beta 4 with enhanced activities accelerates the rate of wound healing. Drug Des Devel Ther. 2013; 7: 1075-1088.
31. Хавинсон B.X., Анисимов B.H. Пептидные биорегуляторы и старение. Санкт-Петербург, Наука, 2003, 223 стр.
32. MD 4198 В1 2013.02.18. Complex of entomological origin in propylene glycol with keratolytic action, process for its preparation, pharmaceutical and cosmetic products based on it (embodiments)/ Ciuhrii Veaceslav// BOPI nr. 2/2013.
33. В.М. Дильман, В.Н. Анисимов, М.Н. Кондрашова. Влияние янтарной и глутаминовой кислот на чувствительность гипоталамо-гонадотропной системы к ингибирующему действию эстрогенов у старых крыс. Фармакология и токсикология 3, 540, 1976.
34. M.N. Kondrashova, N.M. Doliba Polarographic observation of substrate-level phosphorylation and its stimulation by acetylcholine. FEBS Lett. 243, 153-155б 1989.
35. M.N. Kondrashova, G.D. Kuznetzova. Succinic acid as a physiological signal molecule. In; Signal molecules and behaviour. Eds: W. Winslow, O.S. Vinogradova. Manchester University Press, Manchester& New York. 1991, 295-301.
36. M.N. Kondrashova. Mechanisms of physiological activity and cure effect of a small doses of succinic (amber) acid. Eur. Journ. Med. Res. 5, 10, 58, 2000.
37. М.Н. Кондрашова. Гормоноподобное действие янтарной кислоты. Вопр. Биол. Мед. Фармац. Химии 1, 2002, 7-12.
38. Не W, Mlao F, Lin D, Schwandner RT, Wang Z, Gao J, et al. Citric acid cycle intermediates as ligands for orphan G-protein-coupled receptors. Nature 2004; 429: 188-193.
39. Gonzalez NS, Communi D, Hannedouche S, Boeynaems JM. The fate of P2Y-related orphan receptors: GPR80/99 and GPR91 are receptors of dicarboxylic acids. Purinergic Signal. 2004 Dec; 1(1): 17-20.
40. Sadagopan N, Li W, Roberds SL, Major T, Preston GM, Yu Y, Tones MA. Circulating succinate is elevated in rodent models of hypertension and metabolic disease. Am J Hypertens. 2007 Nov; 20(11): 1209-15.
41. Correa PR, Kruglov EA, Thompson M, Leite MF, Dranoff JA, Nathanson MH. Succinate is a paracrine signal for liver damage. J Hepatol. 2007 Aug; 47(2):262-9.
42. Regard JB, Sato IT, Coughlin SR. Anatomical profiling of G protein-coupled receptor expression. Cell. 2008 Oct 31; 135(3):561-71.
43. Toma I, Kang JJ, Sipos A, Vargas S, Bansal E, Hanner F, Meer E, Peti-Peterdi J. Succinate receptor GPR91 provides a direct link between high glucose levels and renin release in murine and rabbit kidney. J Clin Invest. 2008 Jul; 118(7):2526-34.
44.  H., Von Jagow G. Tricine-sodium dodecil sulfate - polyacrylamide gel electrophoresis for the separation of proteins in the range from1 to 100 kDa// Anal. Biochem. - 1987. - Vol. 166. - P. 368-379.
H., Von Jagow G. Tricine-sodium dodecil sulfate - polyacrylamide gel electrophoresis for the separation of proteins in the range from1 to 100 kDa// Anal. Biochem. - 1987. - Vol. 166. - P. 368-379.
45. Покусаева B.O., Антипов C.C., Швырева У.С., Тутукина М.Н., Озолинь О.Н. (2012) Суперпродукция, выделение и очистка функционально активного бактериоферритина DPS E.coli // Сорбционные и хроматографические процессы, Т. 12, №6, Стр. 1011-1017.
46. Cytrynska М., Мак P., Zdybicka-Barabas A., Suder P., Jakubowicz Т. Purification and characterization of eight peptides from Galleria mellonella immune hemolymph. // Peptides. - 2007. - Vol. 28. - P. 533-546 [PubMed: 17194500].
47. Мак P., Chmiel D., Gacek G.J. Antibacterial peptides of the moth Galleria mellonella.// Acta Biochim. Pol. - 2001. - Vol. 48. - P. 1191-1195 [PubMed: 11995991].
48. База данных UniProt (http://www.uniprot.org/).
49. Halwani A.E. and Dunphy G.B. Apolipophorin-III in Galleria mellonella potentiates hemolymph lytic activity// Developmental & Comparative Immunology. - 1999. - Vol. 23. - Issues 7-8. - P. 563-570.
50. Korff von RW (1969) In: Methods in Enzymology Lowenstain L.M. (Ed.), N.-Y., Academ. Press, 13, pp. 519-523.
51. Stern JR (1957) In: Methods in Enzymology Colowick S.P., Kaplan N.O. (Eds.), N.-Y., Academ. Press, 3,; Biochem. Catalog Boehringer, 1995, pp. 425-443.
52. Хасанов B.B., Рыжова Г.Л., Мальцева E.B. Методы исследования антиоксидантов// Химия растительного сырья, 2004, №3, С. 63-75.
53. Сирота Т.В., RU 2144674, "Способ определения антиоксидантной активности супероксиддисмутазы и химических соединений", приоритет от 24.02.1999).
54. Misra Н.Р., Fridovich I. The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase. J. Biol. Chem. 1972, v. 247, 3170-3175.
55. Beauchamp C., Fridovich I. Superoxide dismutase: improved assay and assay applicable to acrylamide gels. Anal. Biochem., 1971, v. 44, 276-287.
56. Lissi A., Salim-Hanna M., Pascual C., Castillo M.D./Evaluation of total antioxidant potential (TRAP) and total antioxidant reactivity (TAR) from luminol-enhanced chemiluminescence measuriment // Free Rad. Biol. Med. (1995), V. 18, №2, P. 153-158.
57. Клебанов Г.И., Теселкин Ю.О., Бабенкова И.В., Любицкий О.Б., Владимиров Ю.А./ Антиоксидантная активность сыворотки крови// Вестник Росс. акад. мед. наук (1999), №2, С. 15-22.
58. Wayner D.D.M., Burton G.W., Ingold K.U., Locke S. Quantitative measurement of the total, peroxyl radical-trapping antioxidant capability of human blood plasma by controlled peroxidation. The important contribution made by plasma proteins. //FEBS Letters (1985), V. 187, №1, P. 33-37.
59. Клебанов Г.И., Любицкий О.Б., Васильева O.B., Климов Ю.В., Пензулаева О.Б., Тепляшин А.С., Толстых М.П., Проморенко В.К., Владимиров Ю.А. Антиоксидантные свойства производных 3-оксипиридина: мексидола, эмоксипина и проксипина // Вопросы медицинской химии (2001), Т. 47, С. 288-300.
60. Сафронова В.Б., Матвеева Н.О., Авхачева Н.В., Сидельникова М.М., Ванько Л.В., Сухих Г.Г. Изменение в регуляции оксидазной активностигранулоцитов переферической крови у женщин с привычным невынашиванием беременности // Бюлл. эксперим. биол. и мед. - 2003. - Т. 136, №9. - 295-98.
61. Горизонтов П.Д., Белоусова О.И., Федотова М.И. Стресс и система крови - М., 1983.
62. Schedlowski M., Jacobs R., Stratman G., Richter S., Hadike A., Tewes U., Wagner T.O.F., Schmidt R.E. Changes of natural killer cells during acute psychological stress// J Clin Immunol - 1993 -Vol. 13. - P. 119-126.
63. Dhabhar F.S. Enhancing versus suppressive effects of stress on immune function: implications for immunoprotection and immunopathology// Neuroimmunomodulation. - 2009. - Vol. 16 - P. 300-317.
64. Bovers S.L., Bilbo S.D., Dhabhar F.S., Nelson R.J. Stressor-Specific alterations in corticosterone and immune responses in mice// Brain Behav Immun. - 2008 - Vol. 22 - P. 105-113.
65. Schwab C.L., Fan R., Zheng Q., Myers L.P., Hebert P., Pruett S.B. Modeling and predicting stress-induced immunosuppression in Mice using Blood Parameters// Toxicological Sciences. - 2005. - Vol. 83. - P. 101-113.
66. Rinner I., Schauenstein K., Mangge H., Porta S., Kvetnansky R. Opposite effects of mild and severe stress on in vitro activation of rat peripheral blood lymphocytes// Brain Behav Immun - 1992 - Vol. 6. - P. 130-140.
67. Ellouk-Achard S., Levresse V., Martin C, Pham-Huy C, Dutertre-Catella H., Thevenin M., Warnet J.M., Claude J.R. Ex vivo and in vitro models in acetaminophen hepatotoxicity studies. Relationship between glutathione depletion, oxidative stress and disturbances in calcium homeostasis and energy metabolism. Arch. Toxicol. Suppl. 1995. V. 17. P. 209-214.
68. Тиц Н.У. // Клиническая оценка лабораторных тестов. М.: Медицина, 1986.
69. Меньшиков В.В. // Лабораторные методы исследования в клинике. М.: Медицина, 1987.
70. Warburg О. New manometric 2-vessel method. Hoppe Seylers Z. Physiol. Chem. 1967. V. 348. P. 1677-1682.
71. Pryce J.D. A modification of the Barker-Summerson method for the determination of lactic acid. Analyst. 1969. V. 94. P. 151-152.
72. Van Noorden C.J., Vogels I.M. Cytophotometric analysis of reaction rates of succinate and lactate dehydrogenase activity in rat liver, heart muscle and tracheal epithelium. Histochem. J. 1989. V. 21. P. 575-583.
73. H. Hodge et al. Clinical Toxicology of Commercial Products. Acute Poisoning. Ed. IV, Baltimore, 1975, 427 p.
74. Сидоров К.К. О классификации токсичности ядов при парентеральных способах введения. Токсикология новых промышленных химических веществ. М. 1973, Вып. 13, 47-51.
75. Belosludtsev K.N. Belosludtseva N.V. Kondratyev M.S., Agafonov A.V., Purtov Yu.A. Interaction of phospholipase A of the E.coli outer membrane with the inhibitors of eukaryotic phospholipases A2 and their Effect on the Ca2+-induced permeabilization of the bacterial membrane. J Membrane Biol (2014) 247:281-288.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, ОБУСЛОВЛЕННОГО НАРУШЕНИЕМ ОКИСЛИТЕЛЬНОГО СТРЕССА | 2018 |
|
RU2674286C1 |
| СПОСОБ КОРРЕКЦИИ СТРУКТУРНЫХ ПЕРЕСТРОЕК СОСУДОВ В ЭКСПЕРИМЕНТЕ | 2007 |
|
RU2349320C2 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИИШЕМИЧЕСКОЙ И АНТИГИПОКСИЧЕСКОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2356573C1 |
| ПЕПТИДЫ, ОБЛАДАЮЩИЕ АНТИСТРЕССОРНЫМ, ПРОТИВОСУДОРОЖНЫМ И НЕЙРОПРОТЕКТОРНЫМ ДЕЙСТВИЕМ | 1997 |
|
RU2115660C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИШЕМИИ МИОКАРДА ПРИ КОРОНАРОИНВАЗИВНЫХ ВМЕШАТЕЛЬСТВАХ | 1999 |
|
RU2146933C1 |
| СБОР, ОБЛАДАЮЩИЙ ГИПОГЛИКЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2666398C1 |
| Средство, обладающее способностью увеличивать продолжительность жизни, улучшать когнитивные свойства, моторный контроль и координацию движений животных | 2022 |
|
RU2801871C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКОГО СИНДРОМА И ДИАБЕТИЧЕСКОЙ НЕФРОПАТИИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2519744C2 |
| Способ получения препарата митохондрий головного мозга | 1990 |
|
SU1745258A1 |
| СРЕДСТВО НА ОСНОВЕ ПРИРОДНЫХ ФОСФОЛИПИДОВ | 2008 |
|
RU2367443C1 |
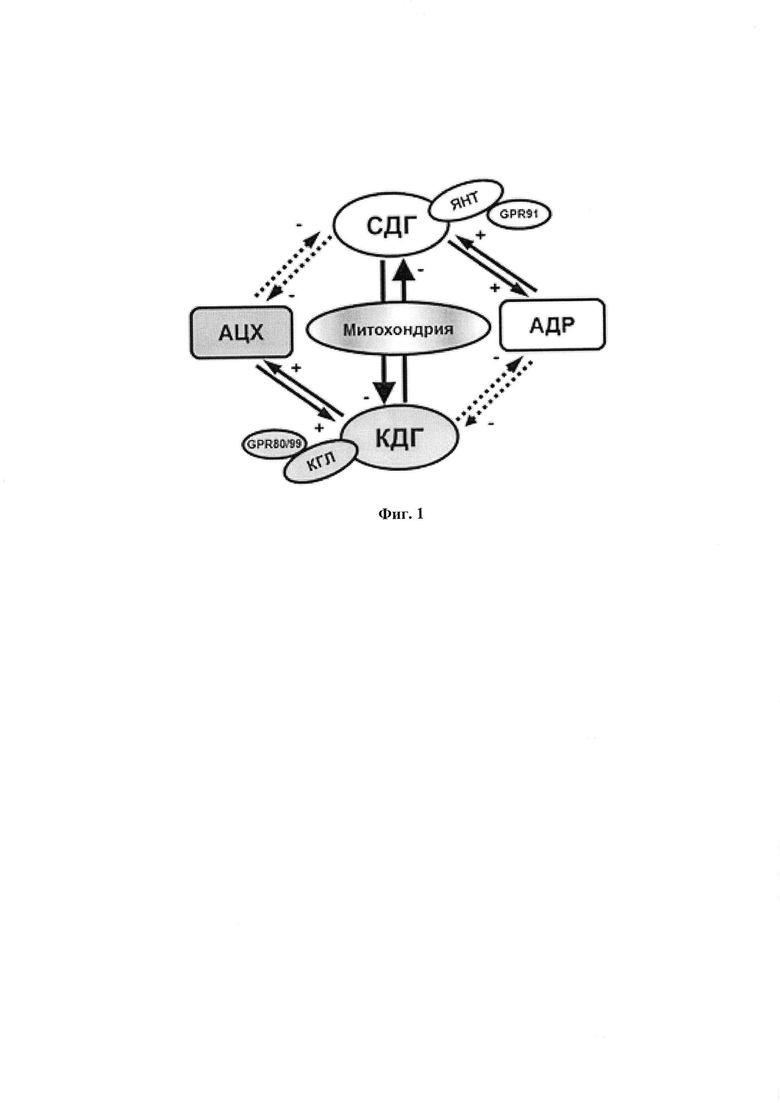
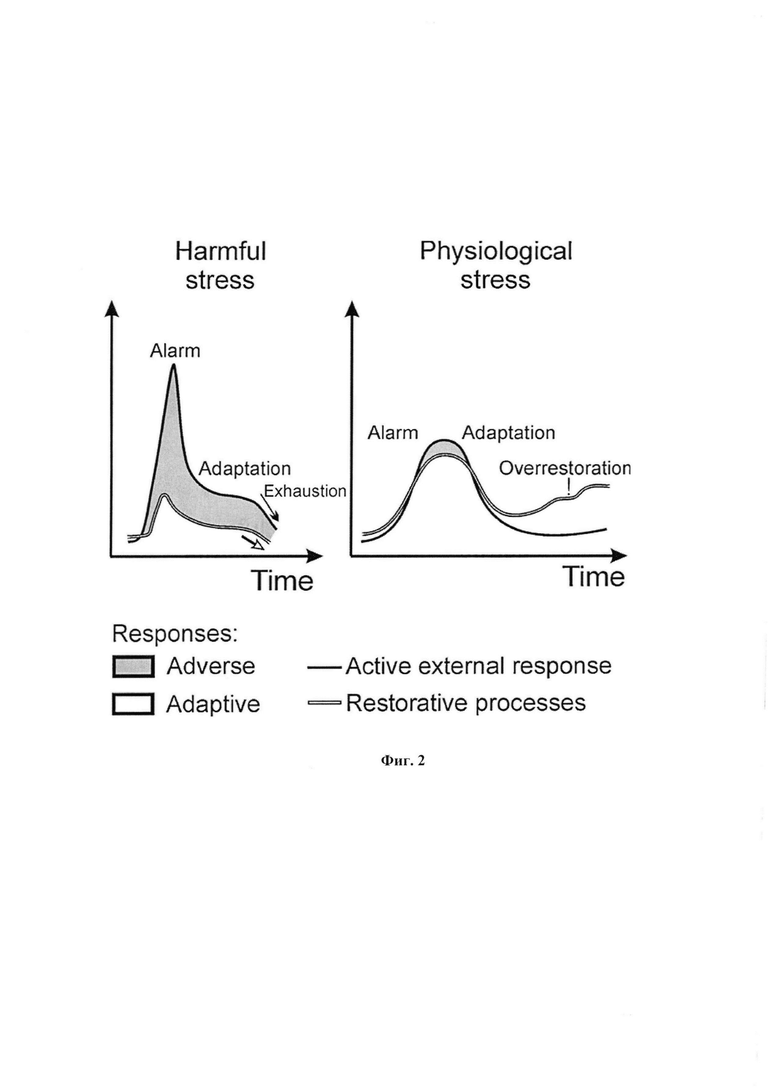
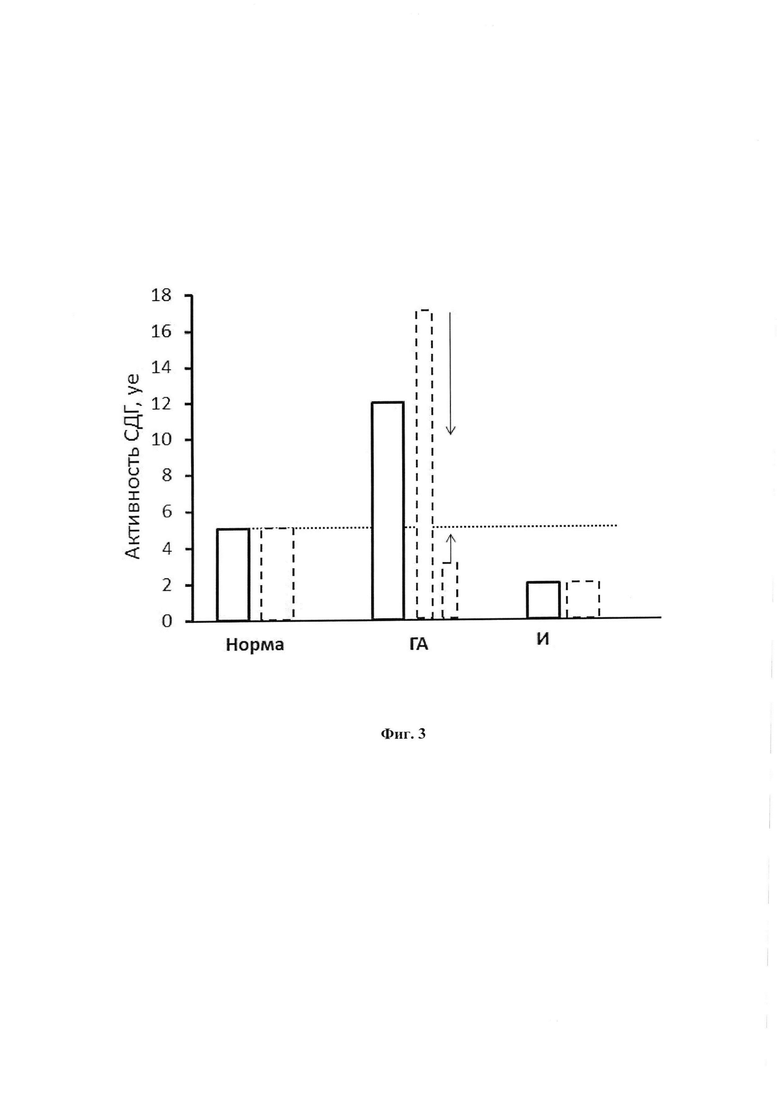
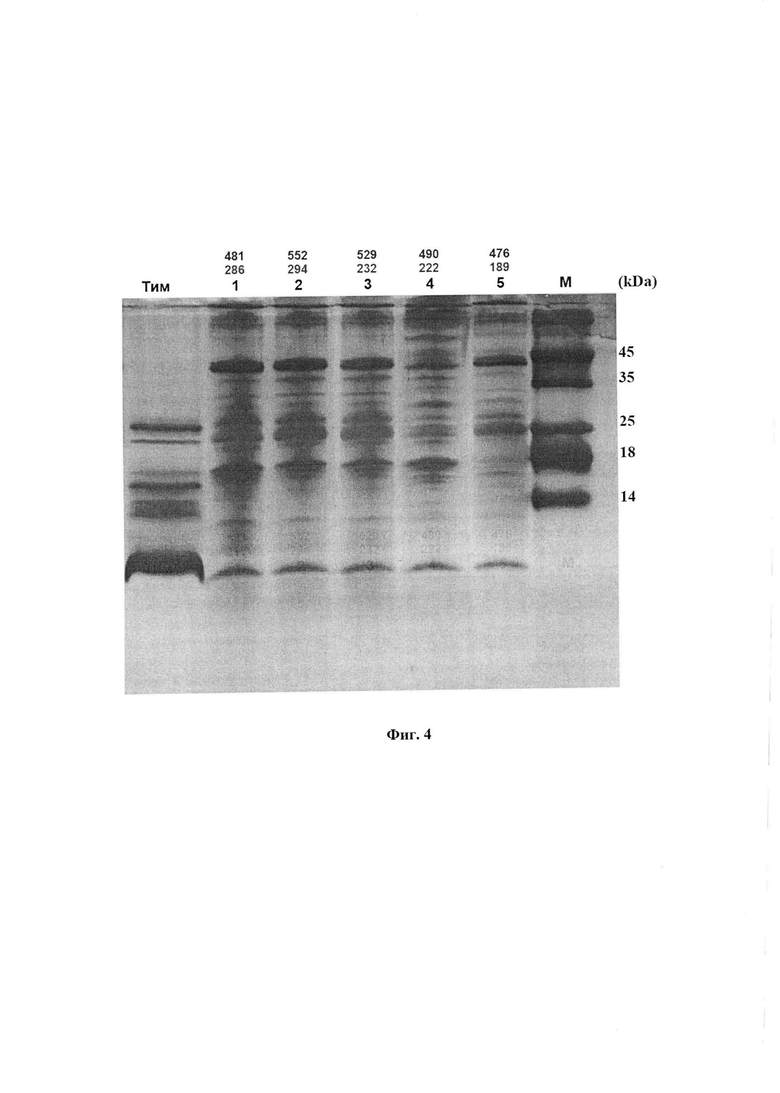
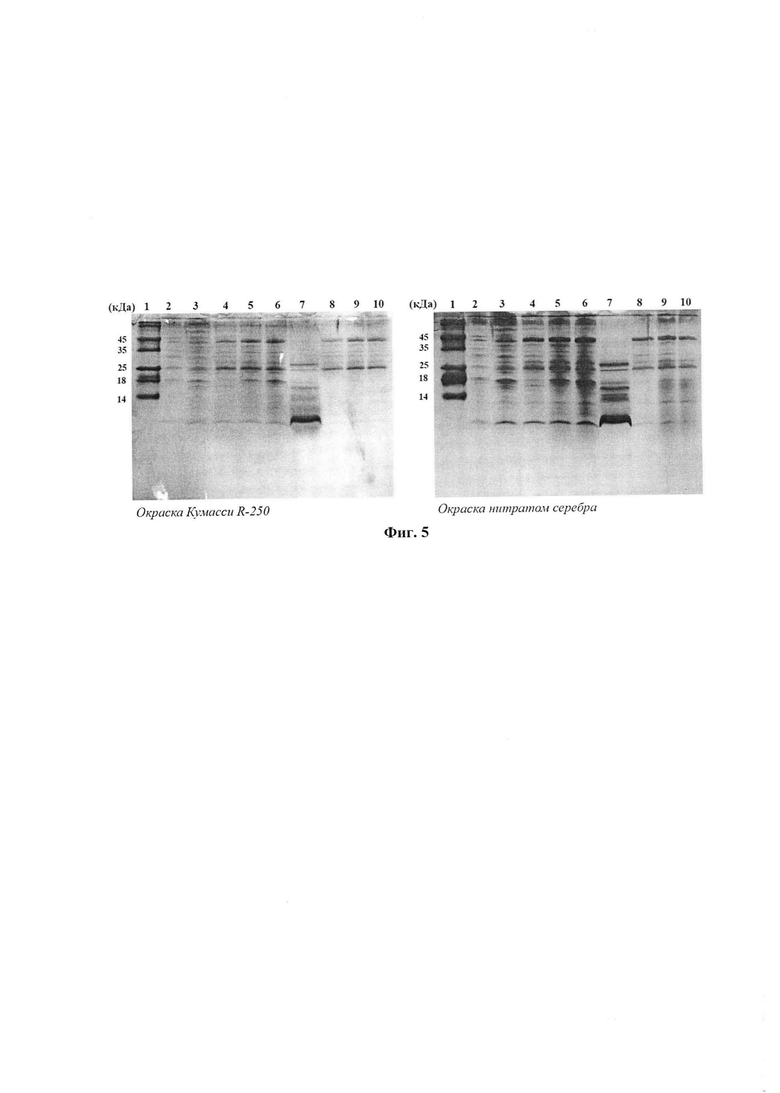
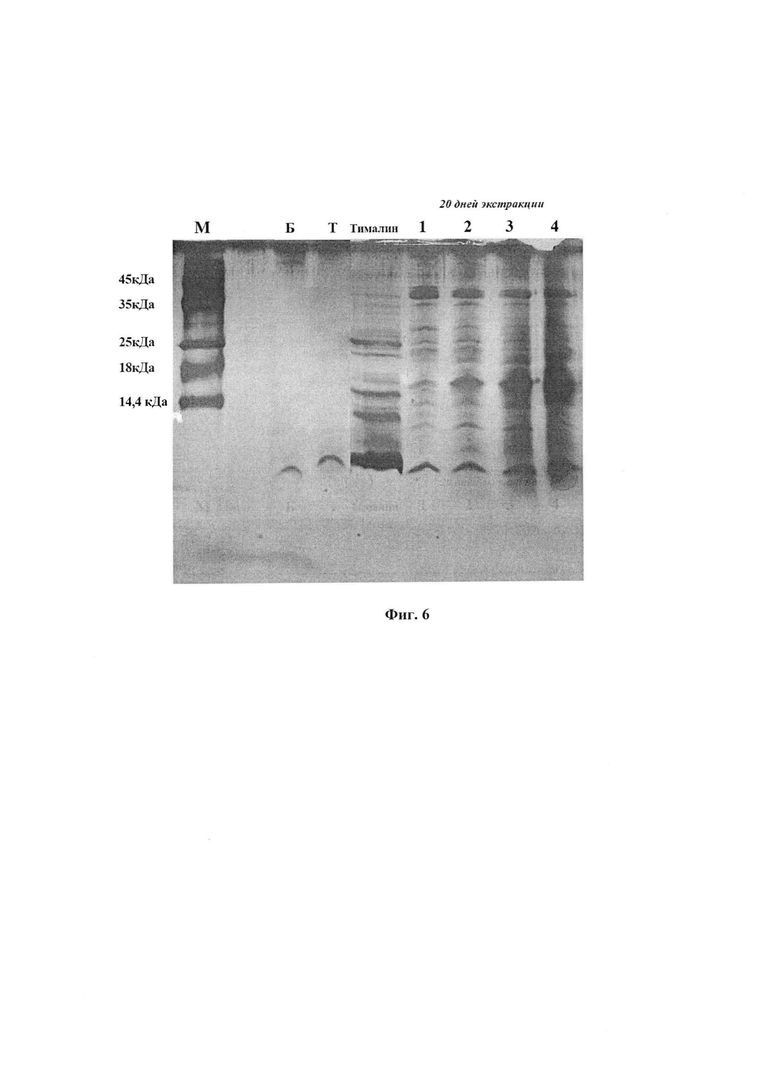
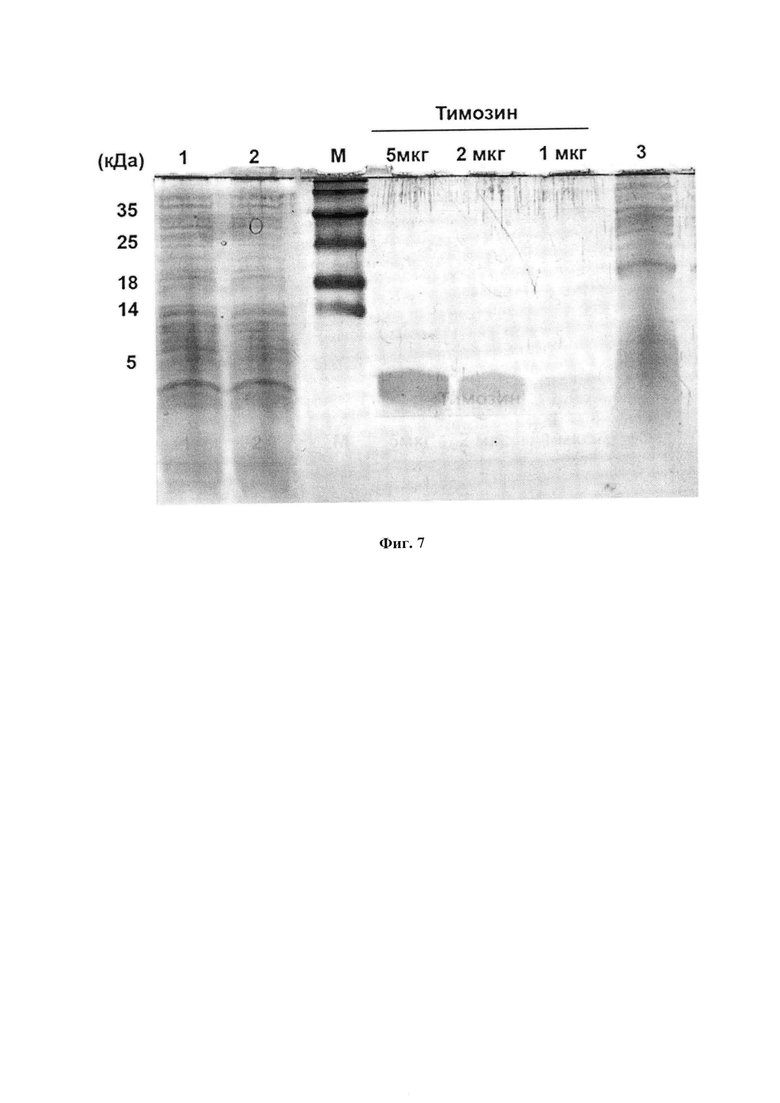
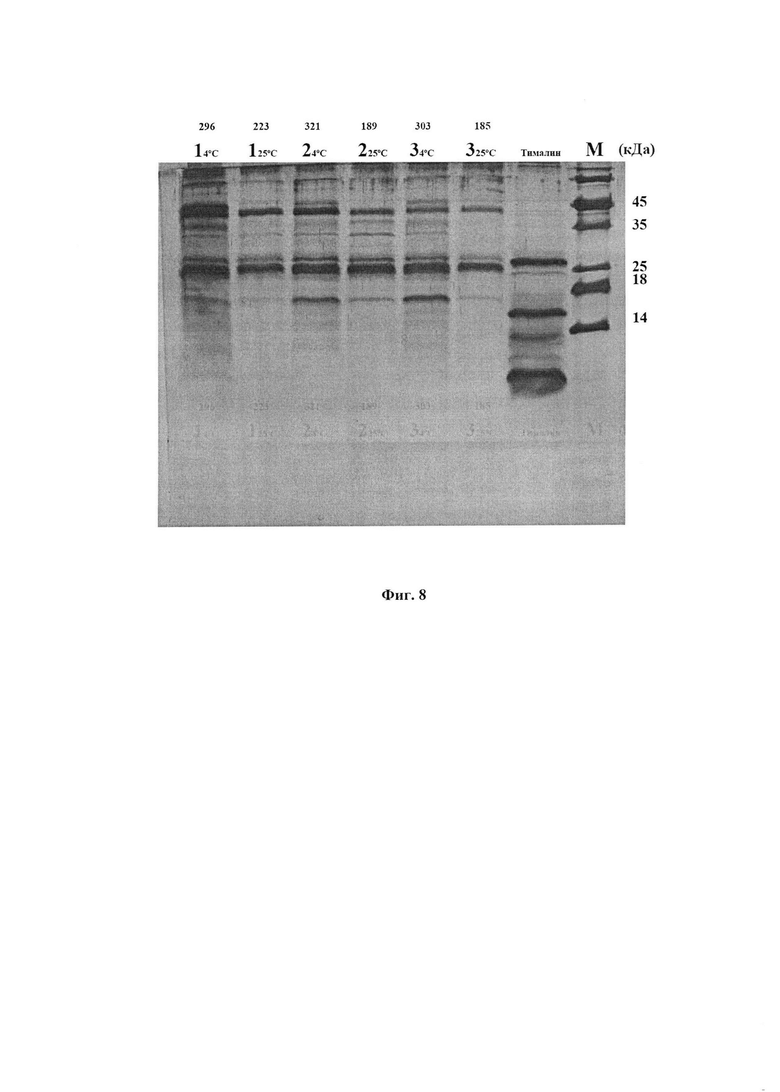
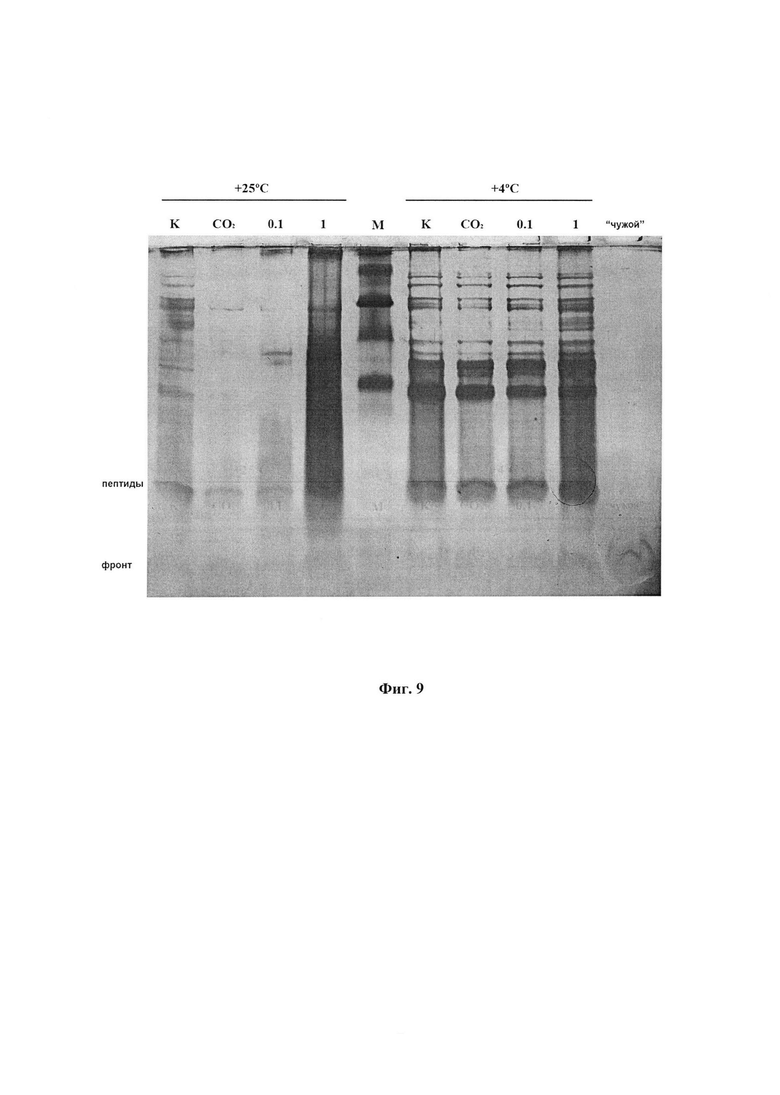
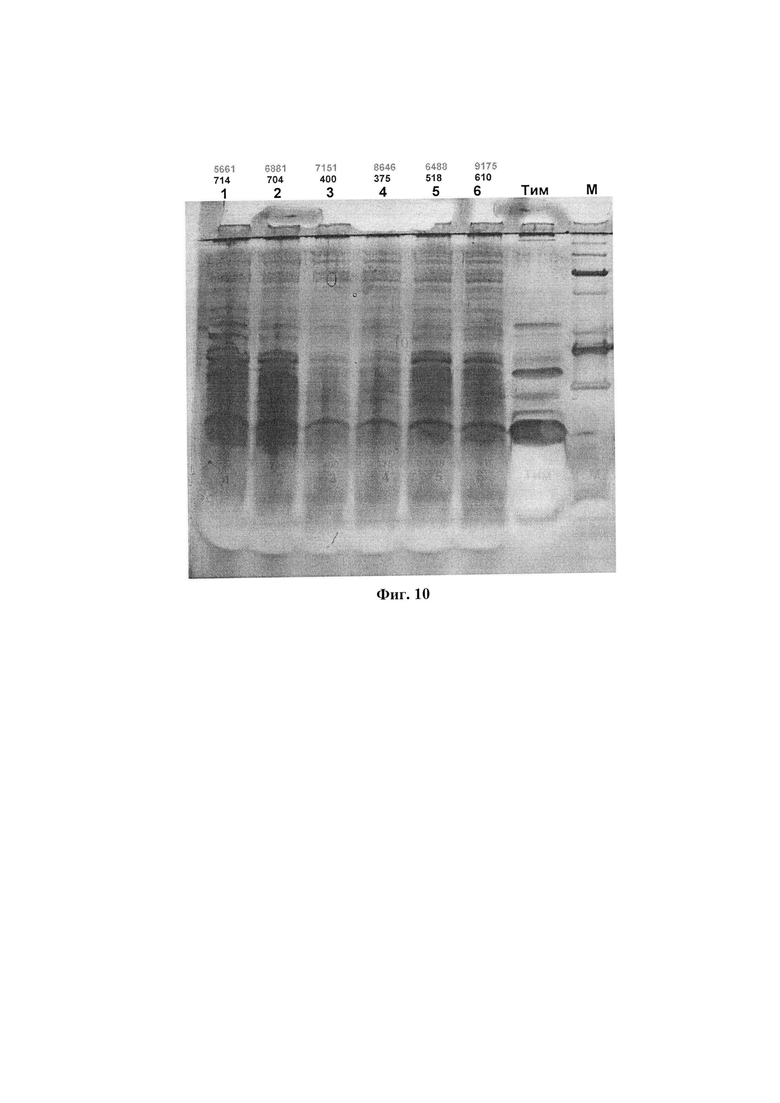
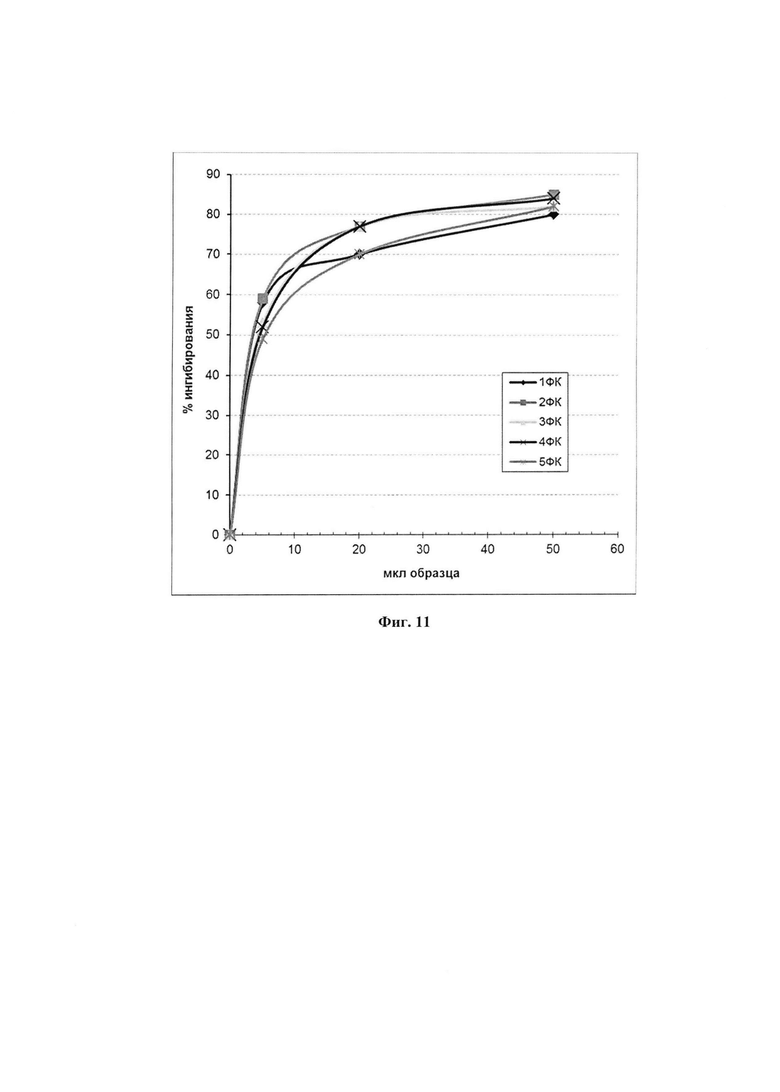
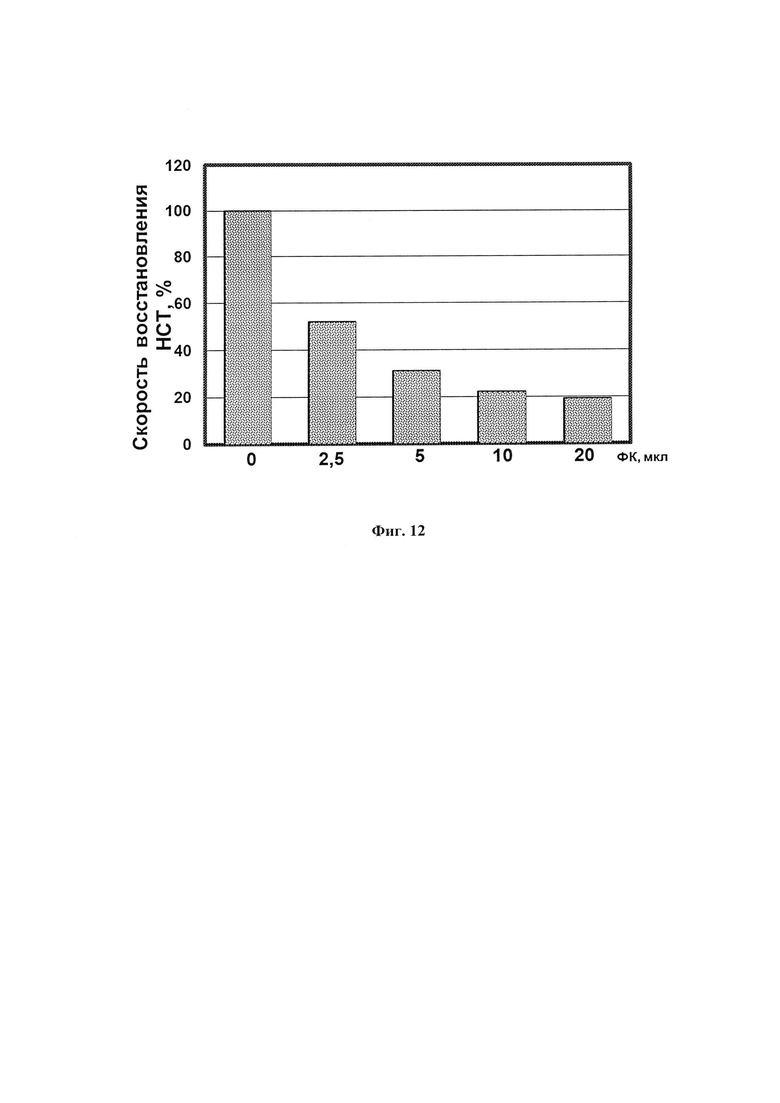
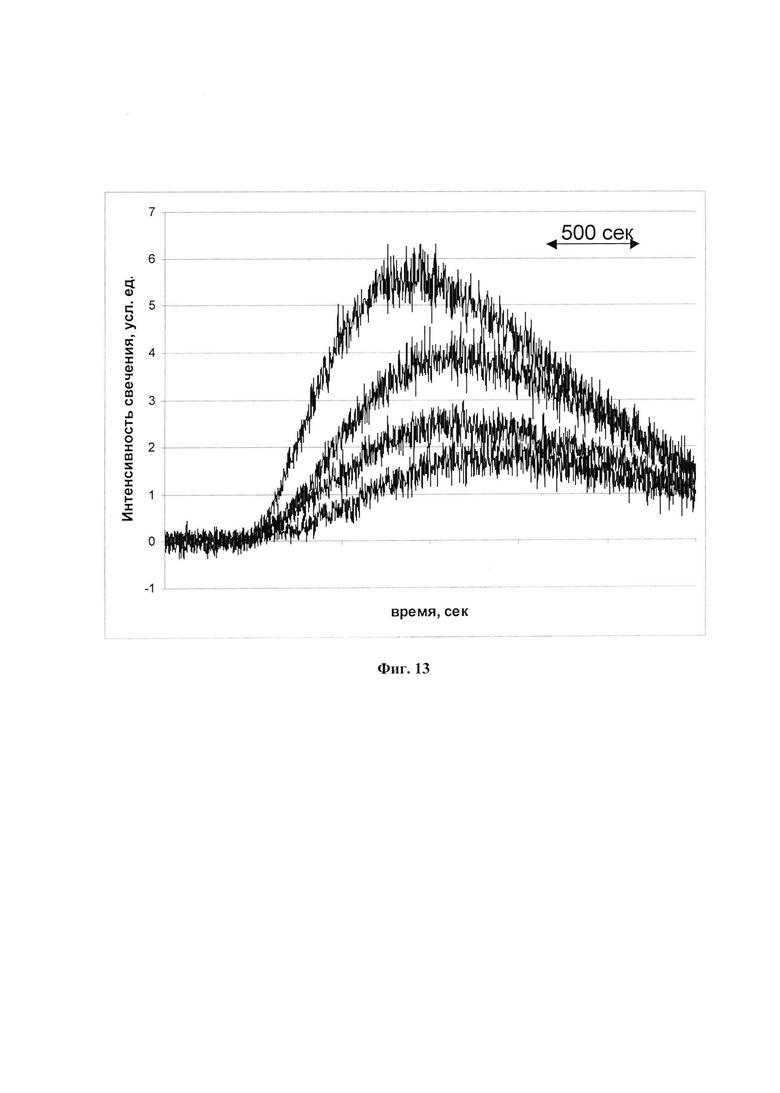
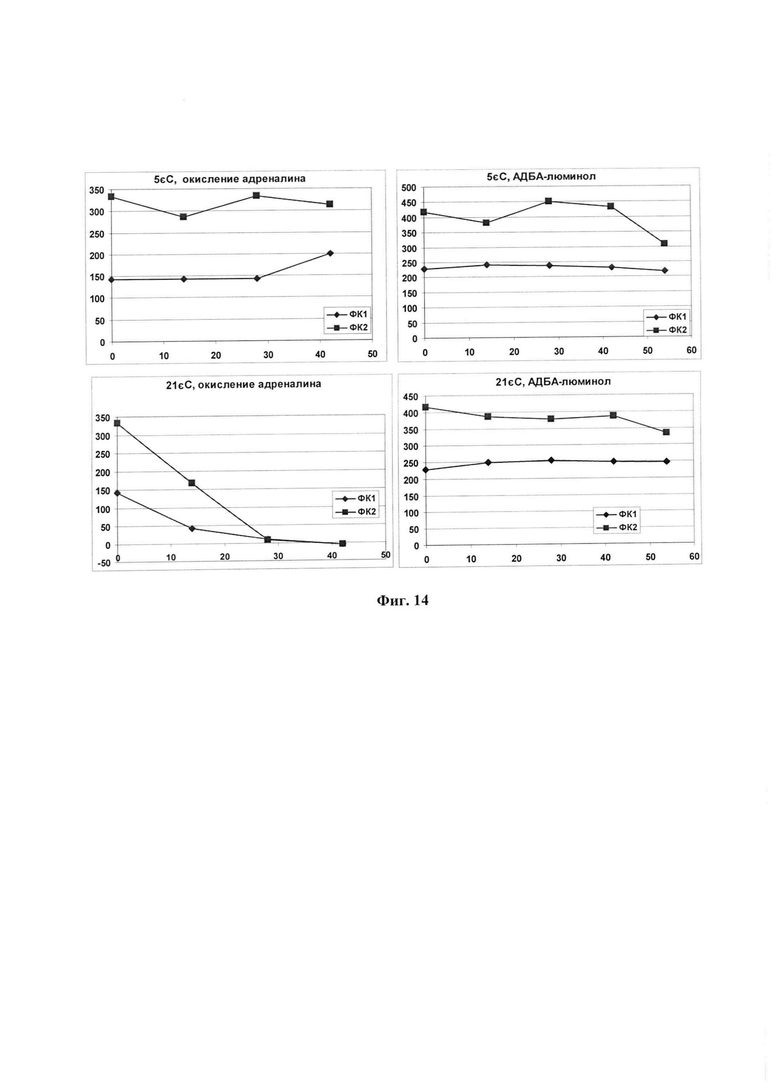
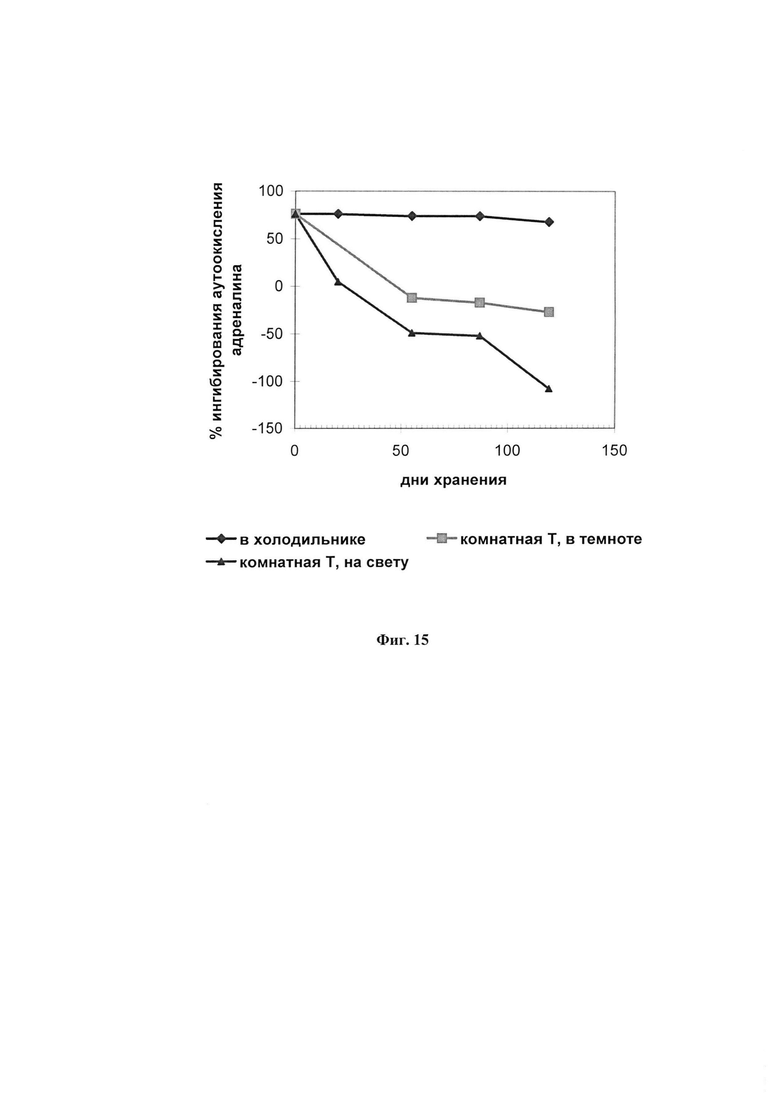
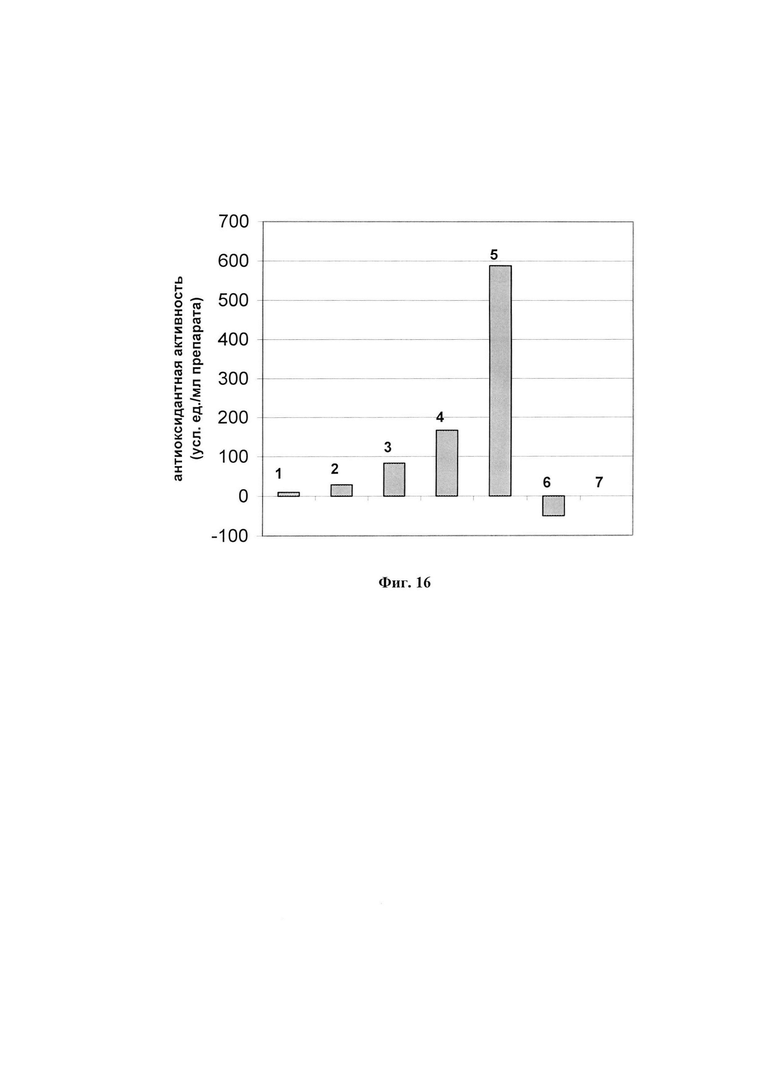
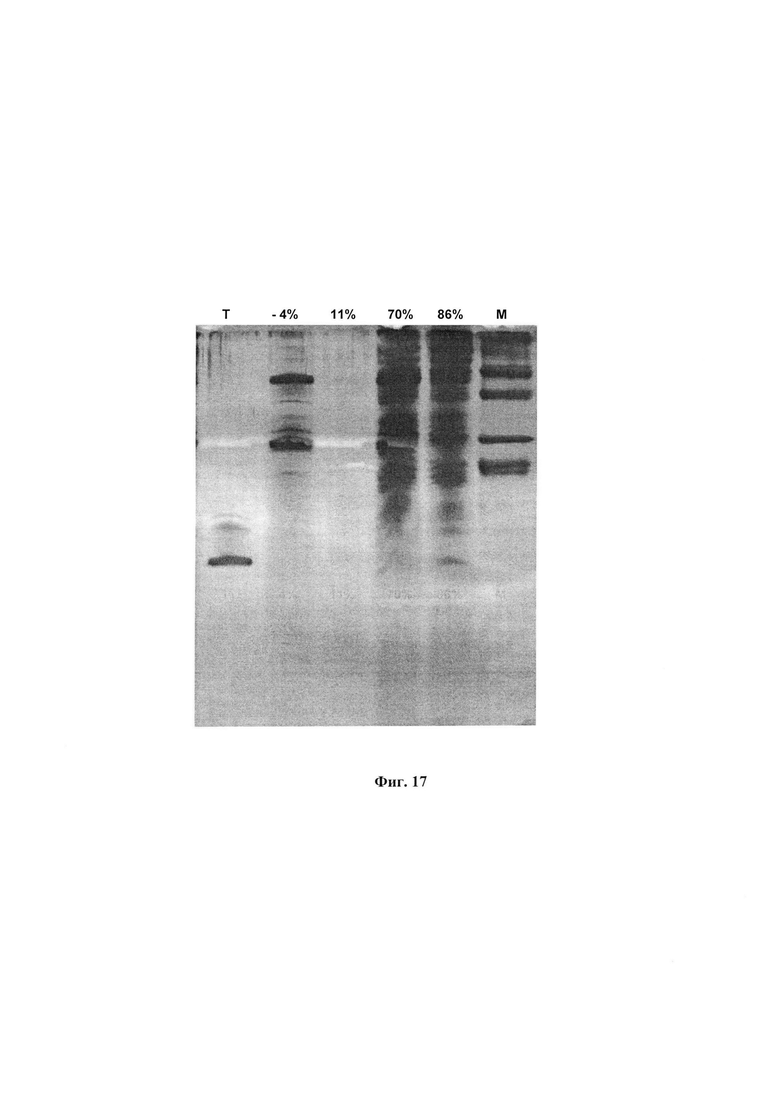
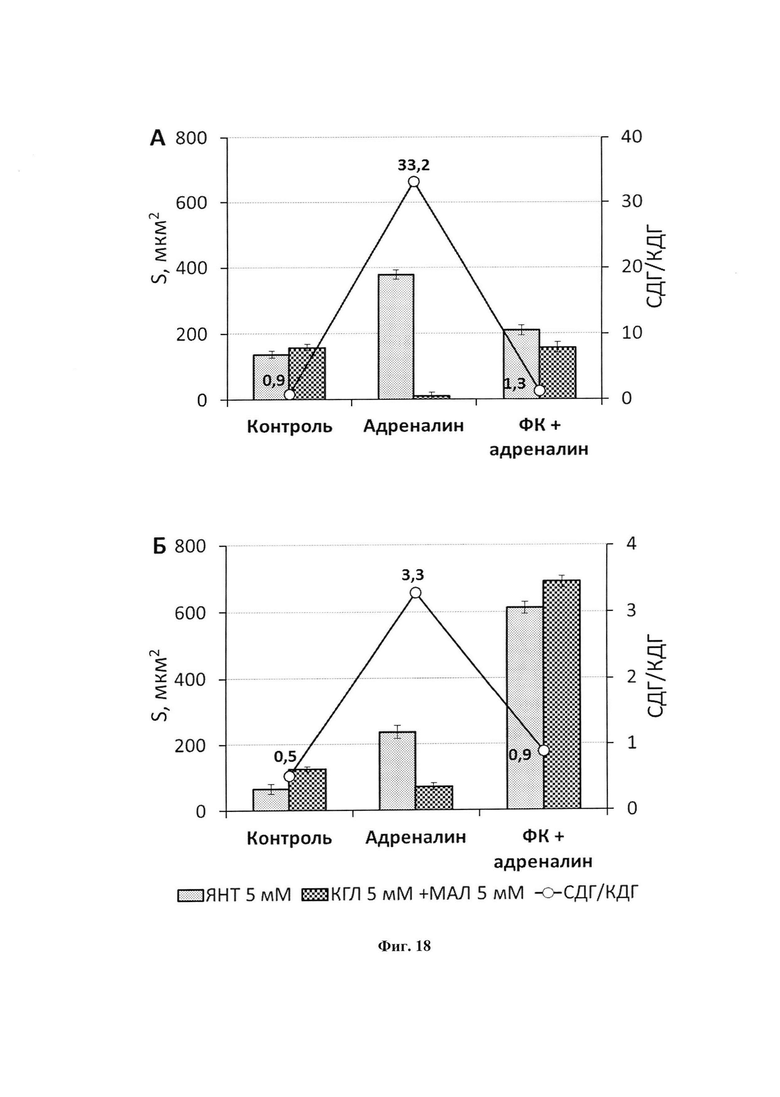
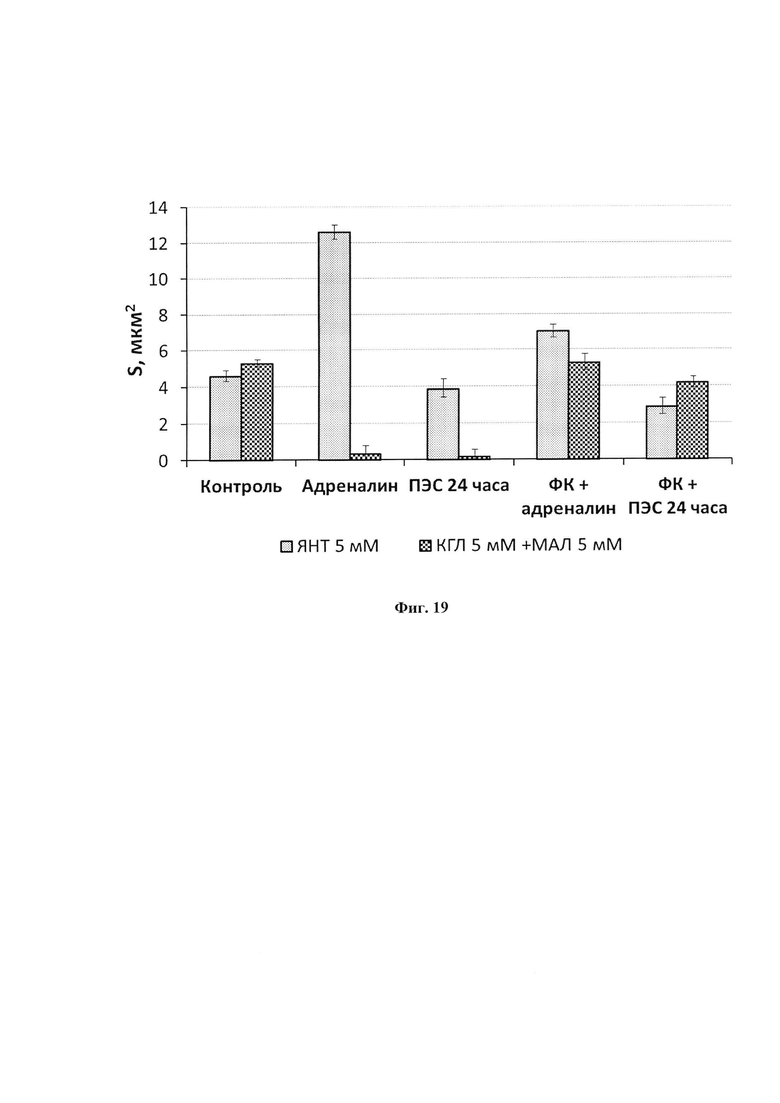
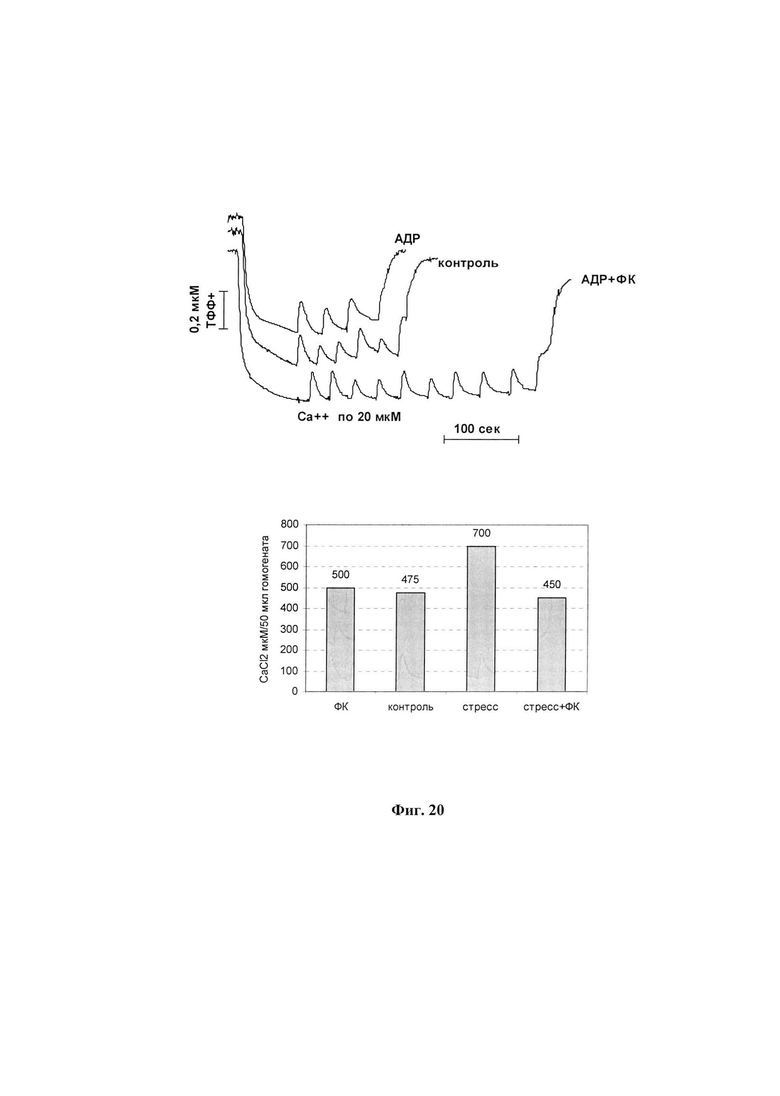
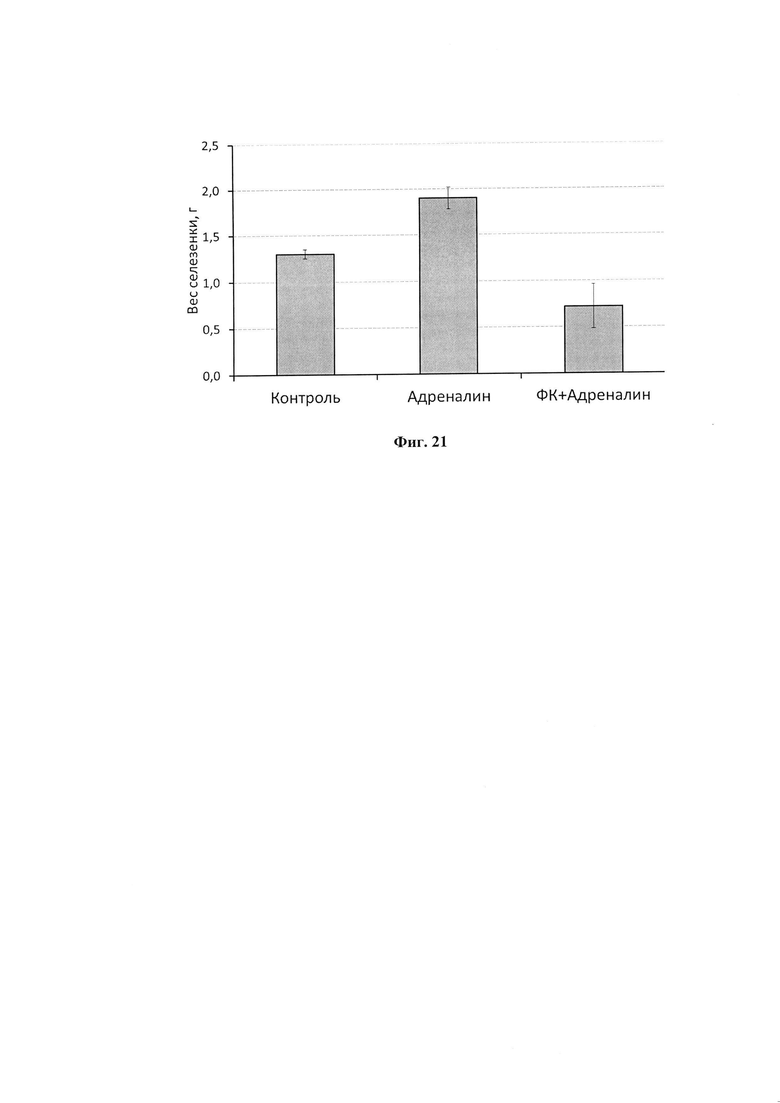
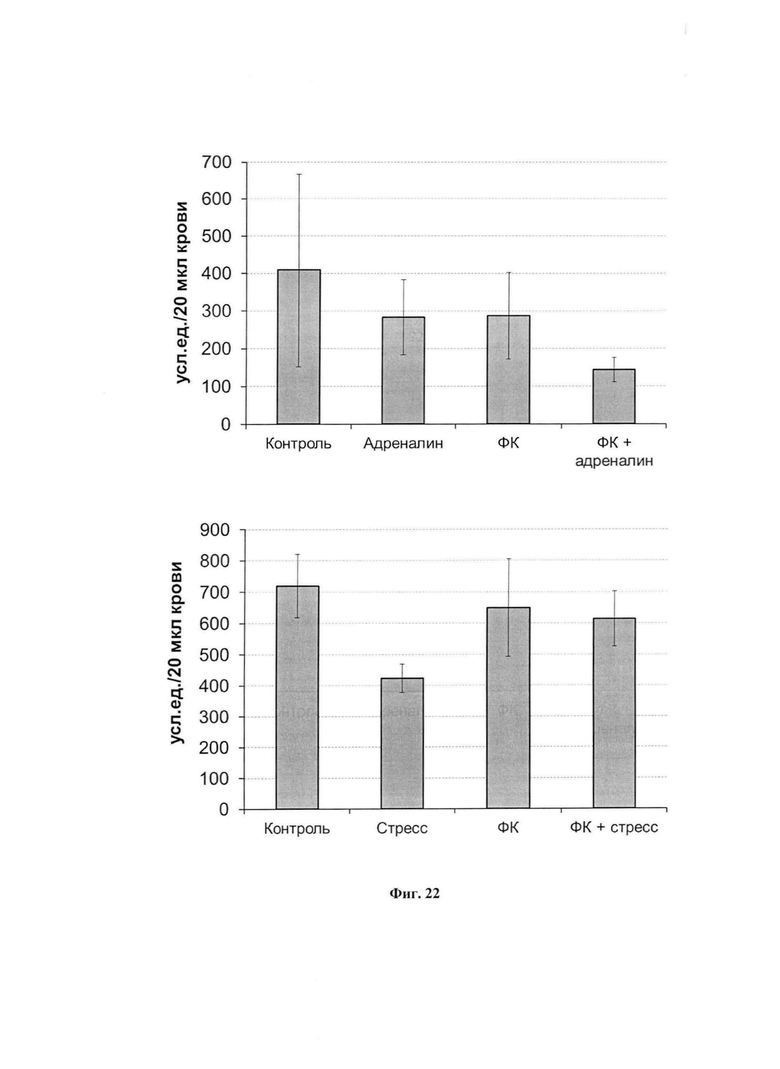
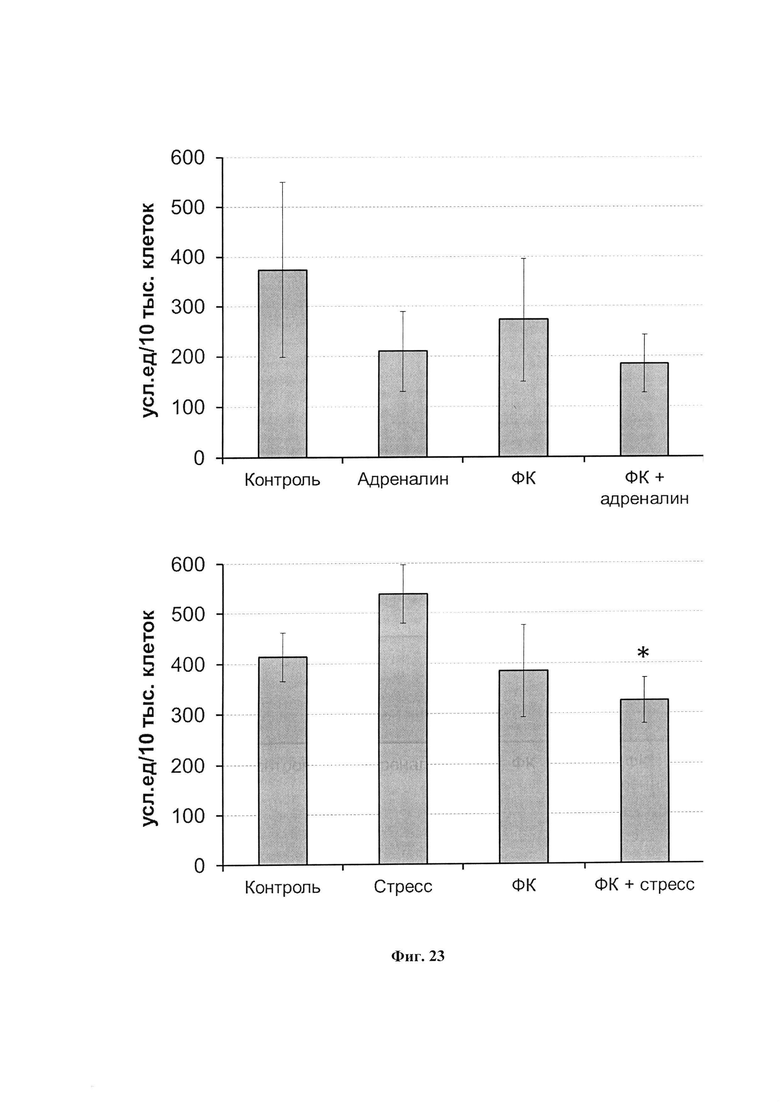
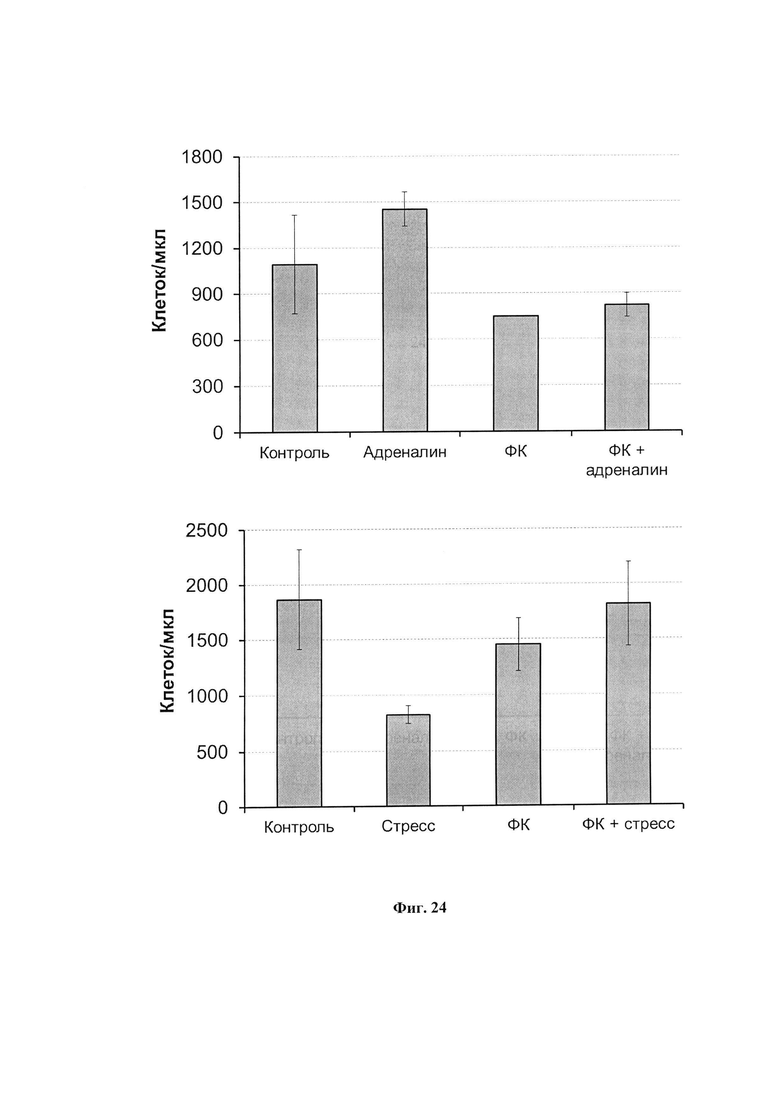
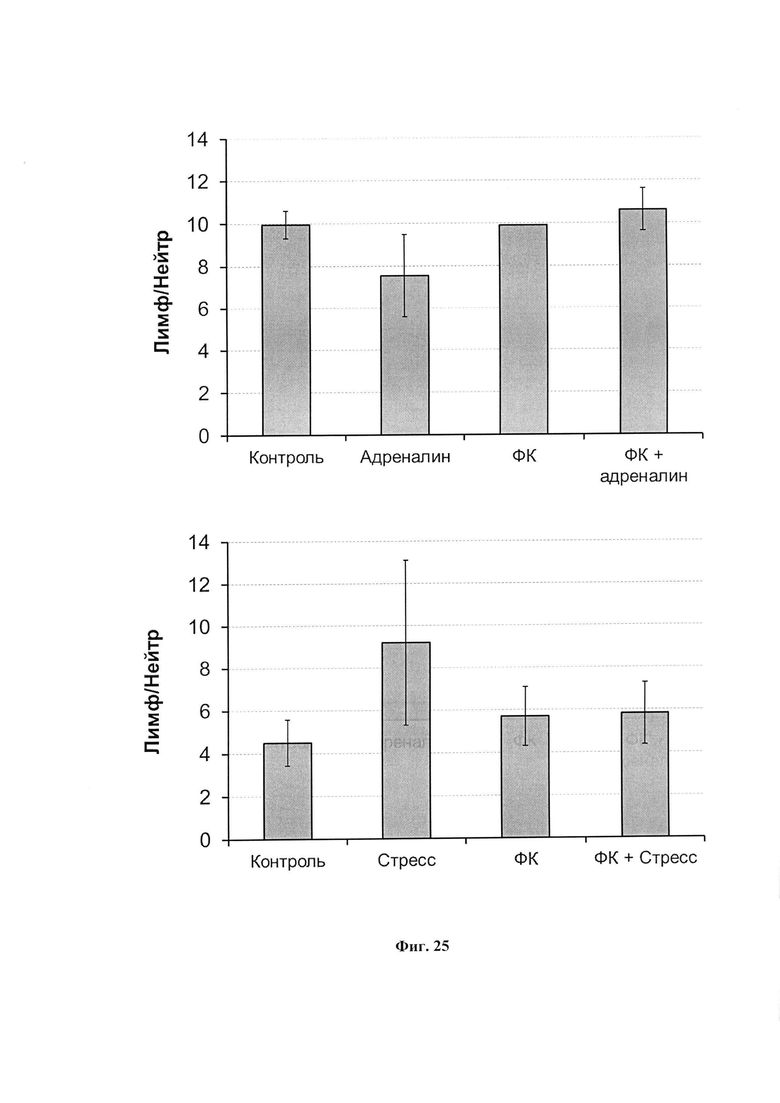
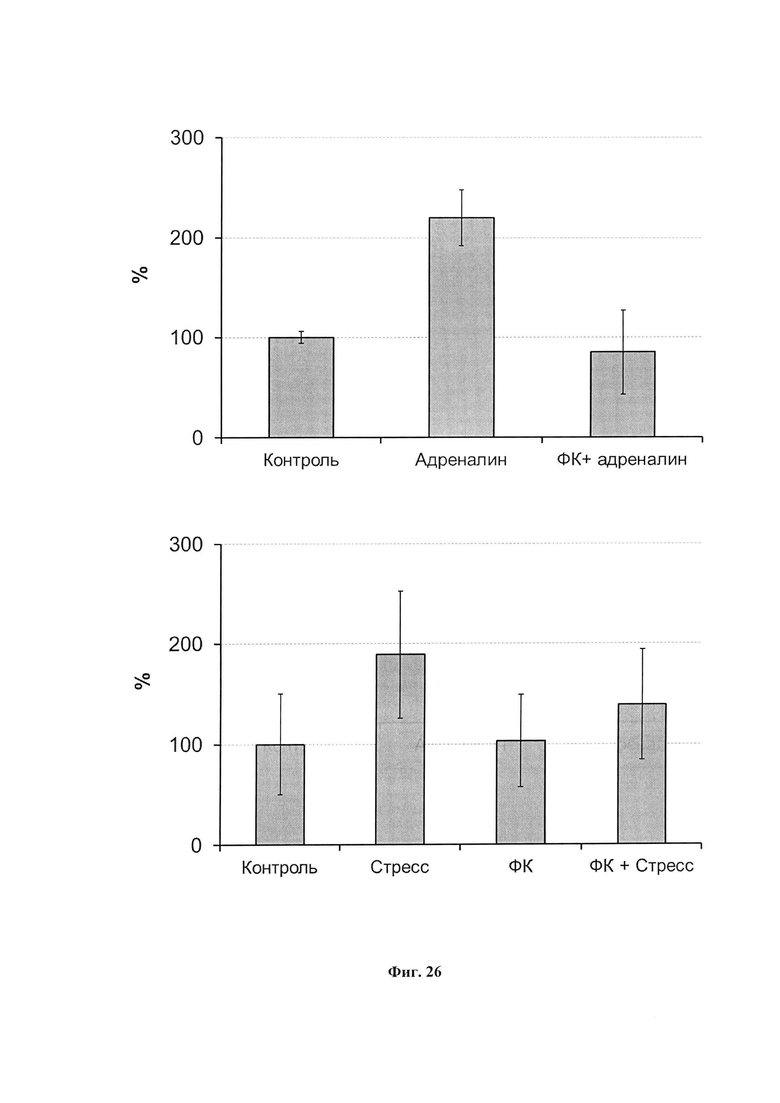

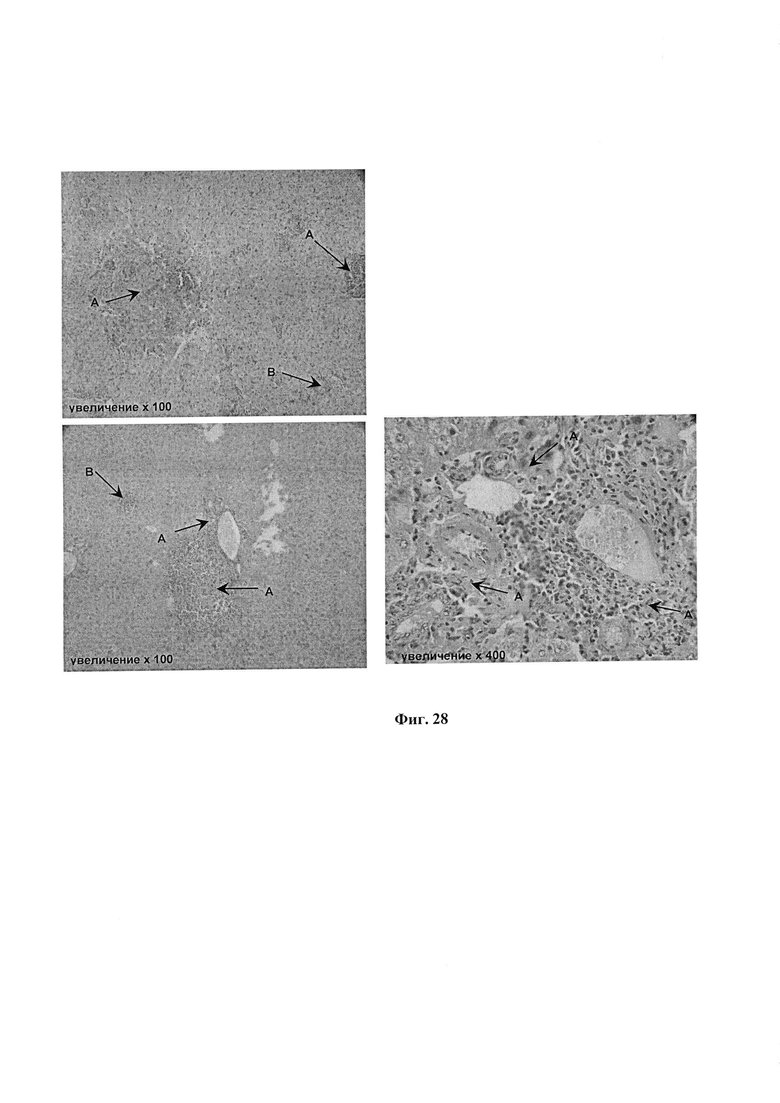

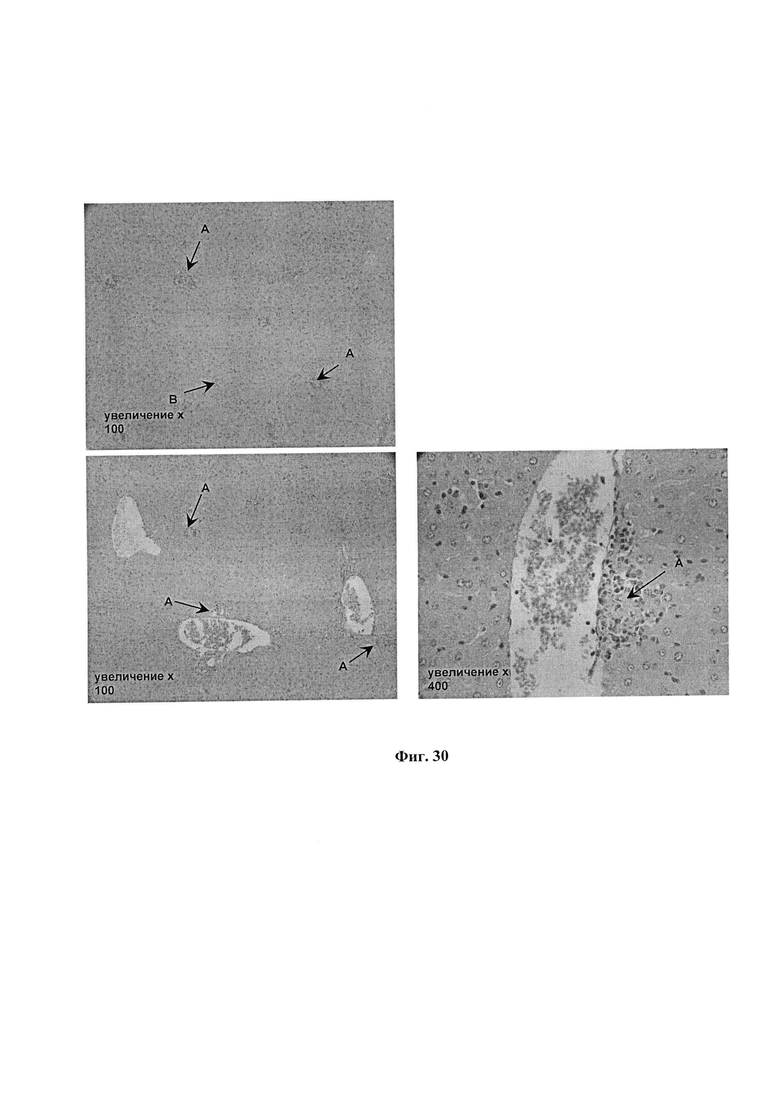
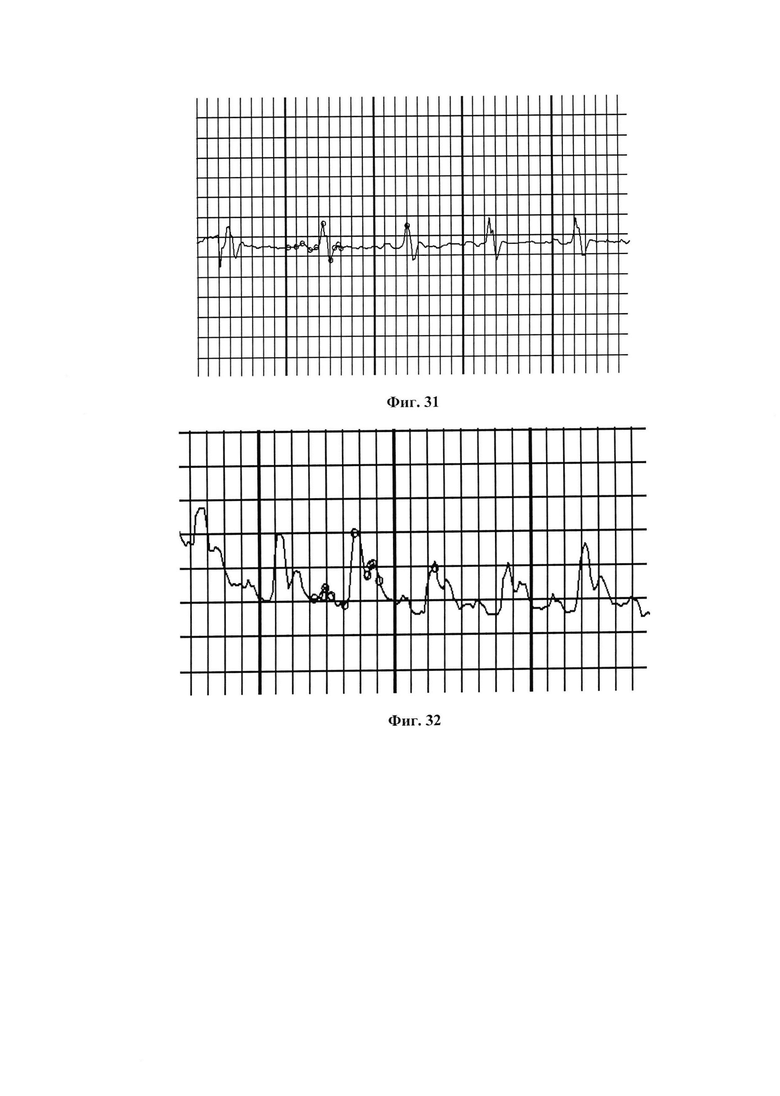
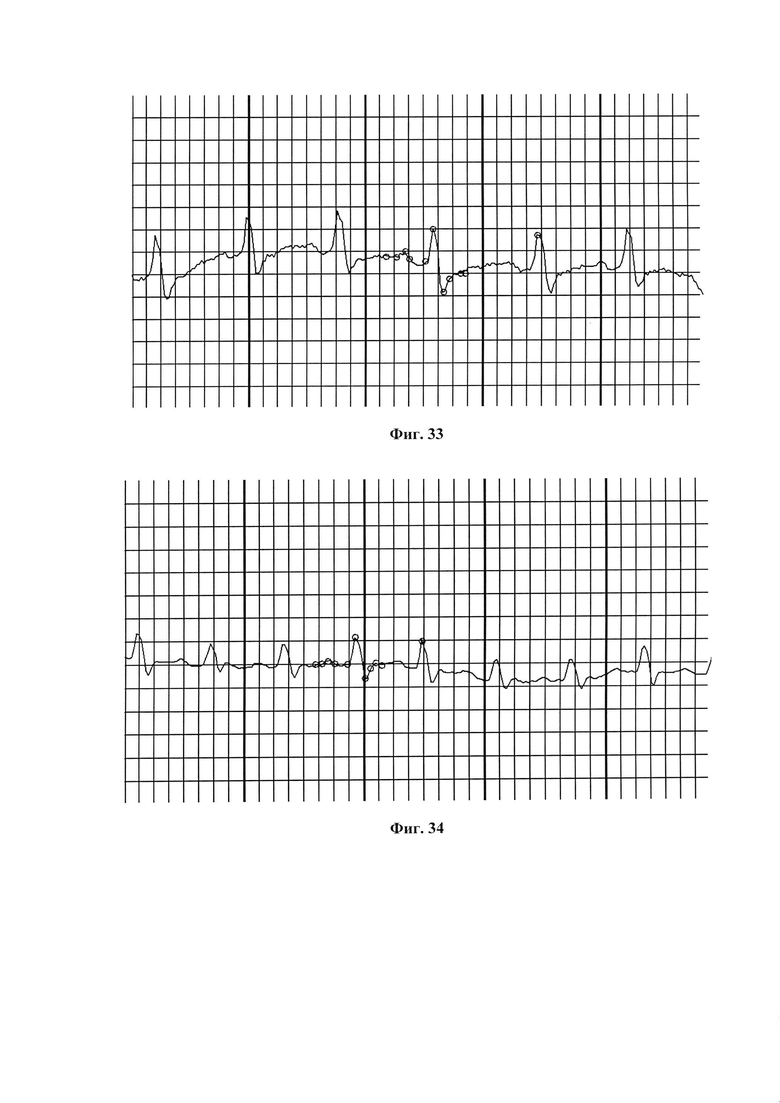
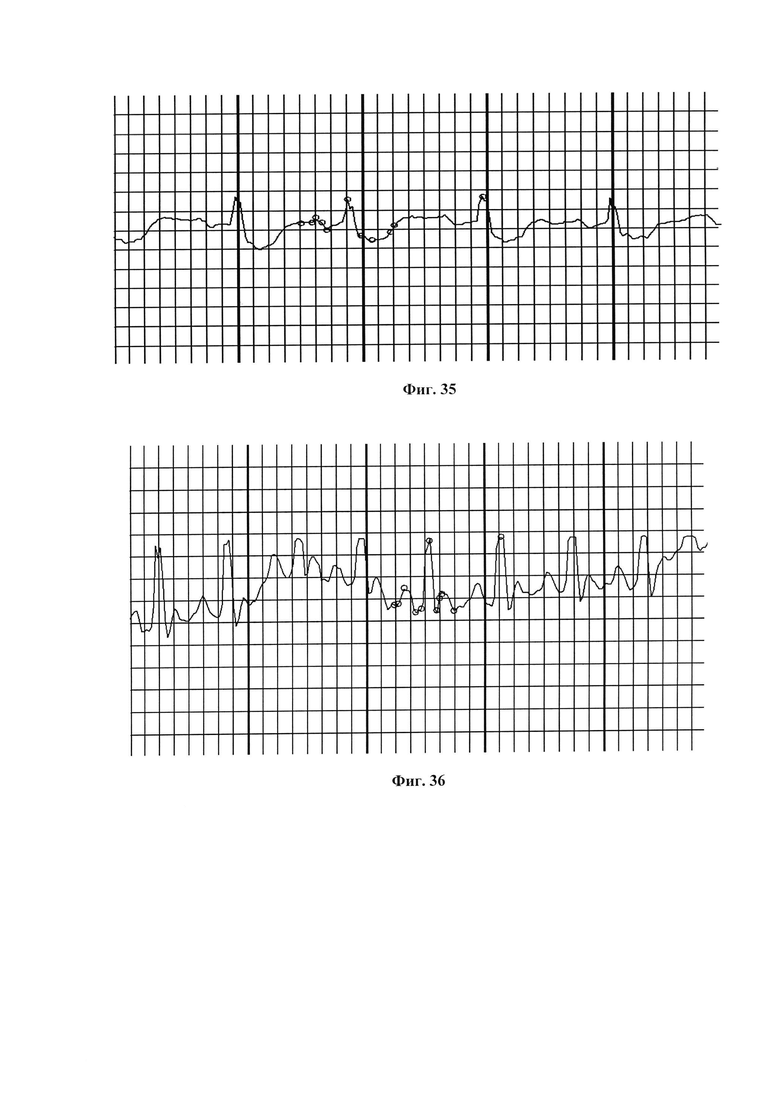
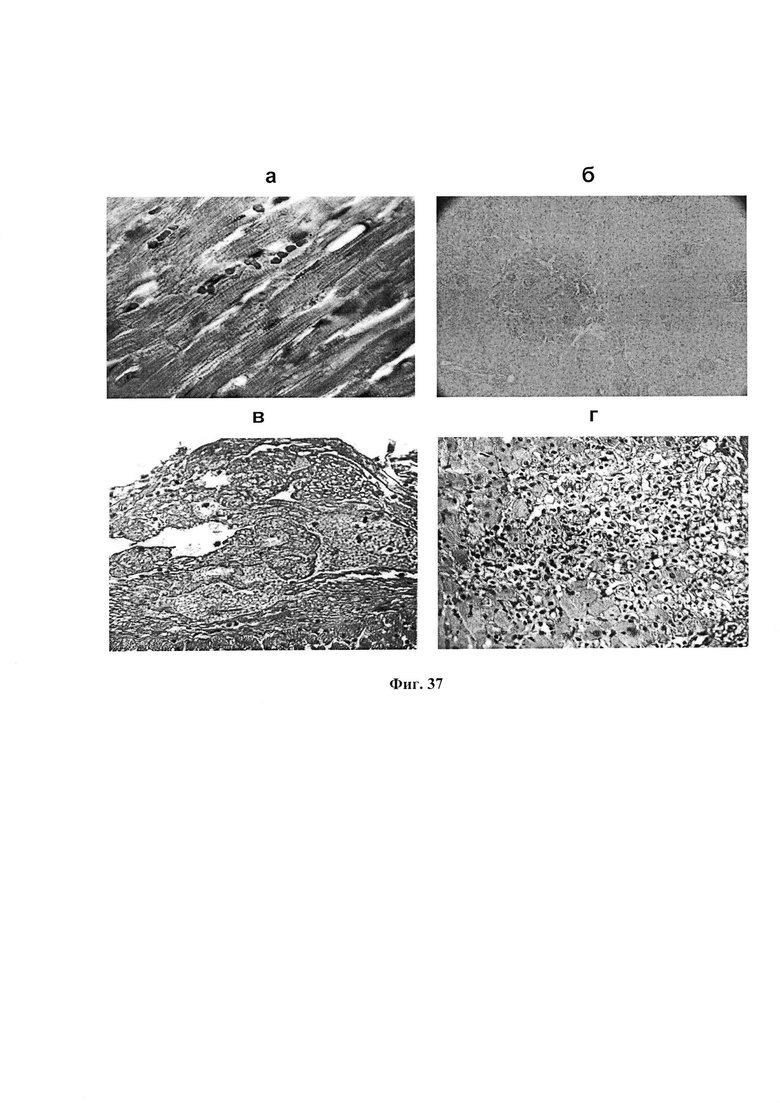
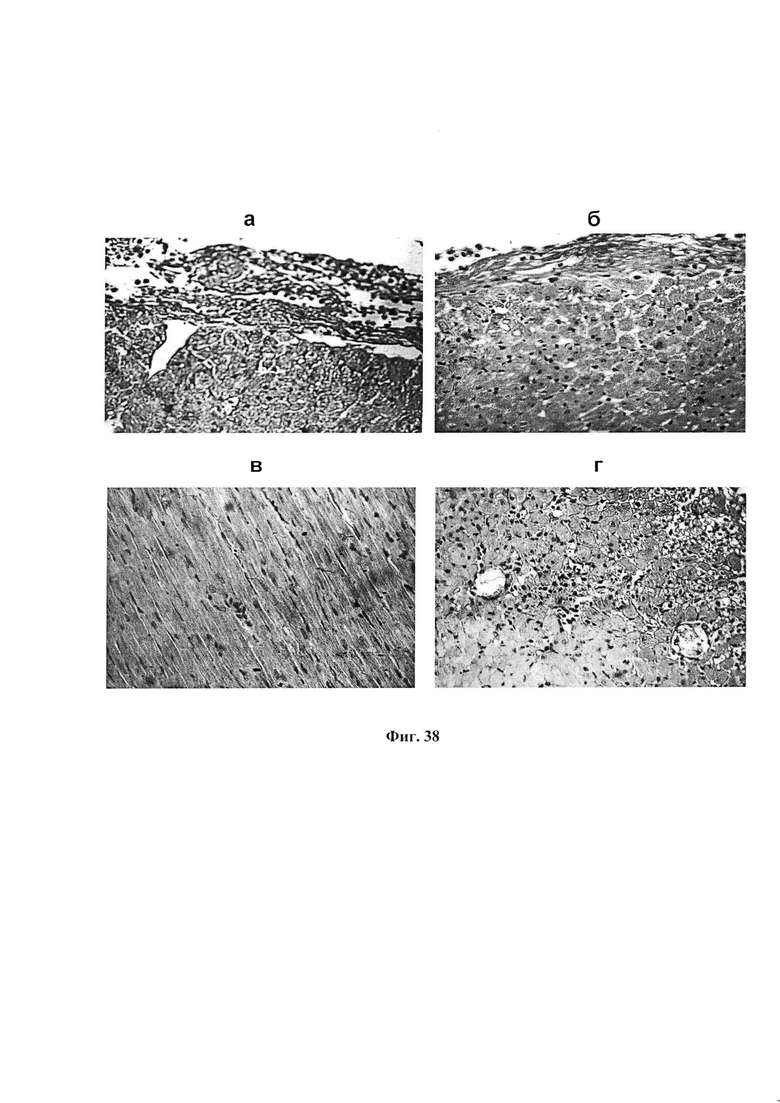
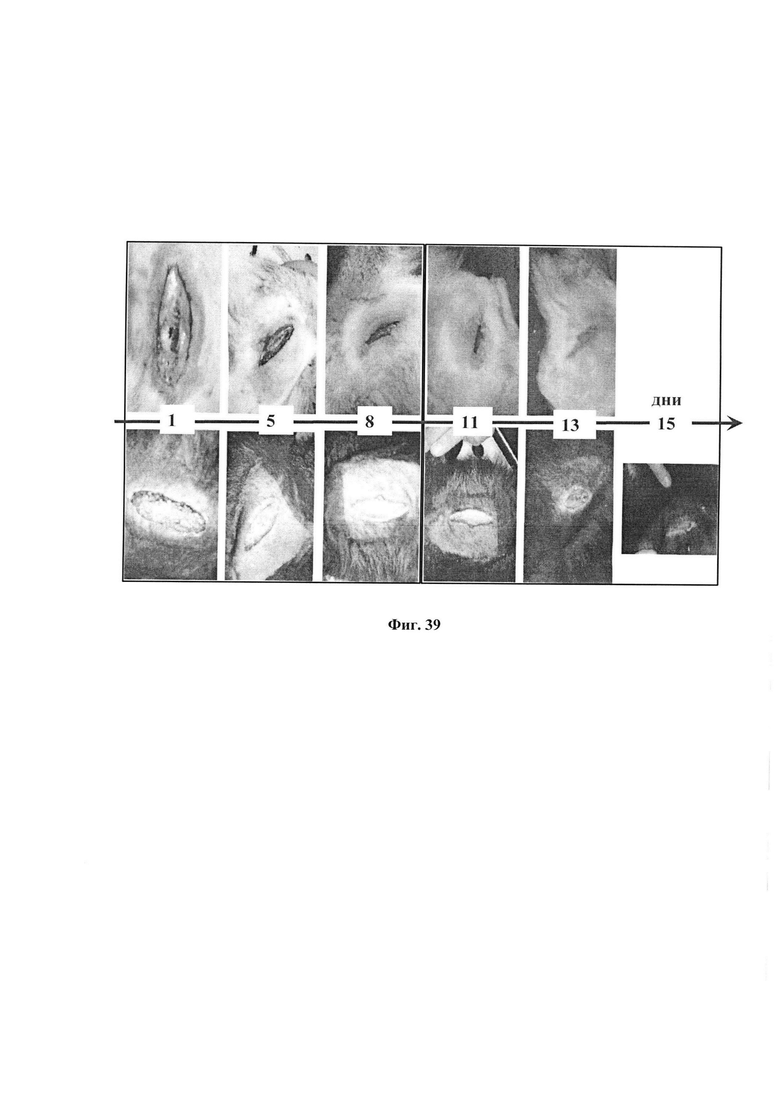
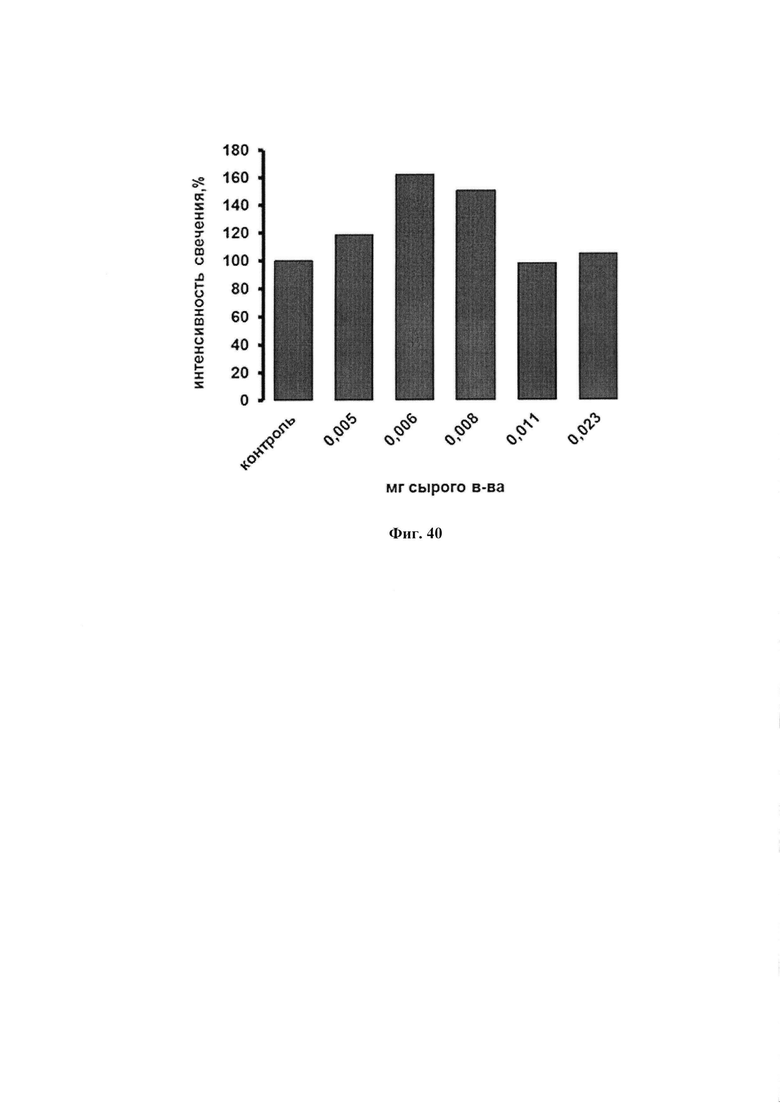
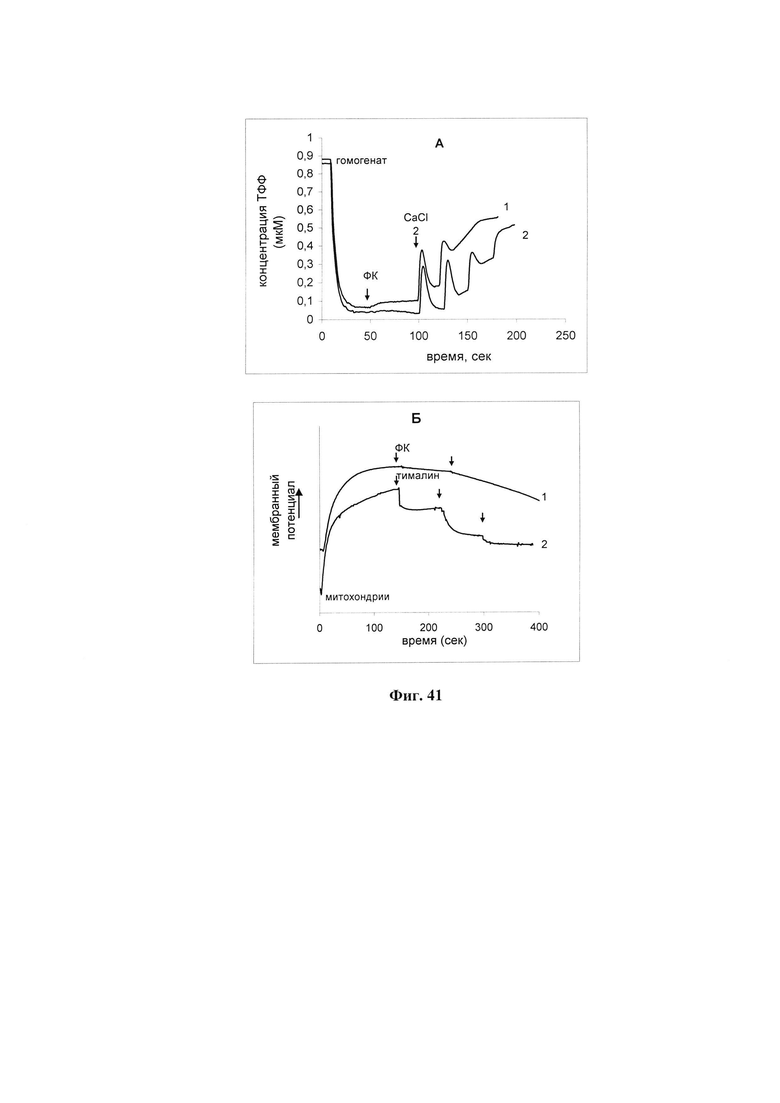

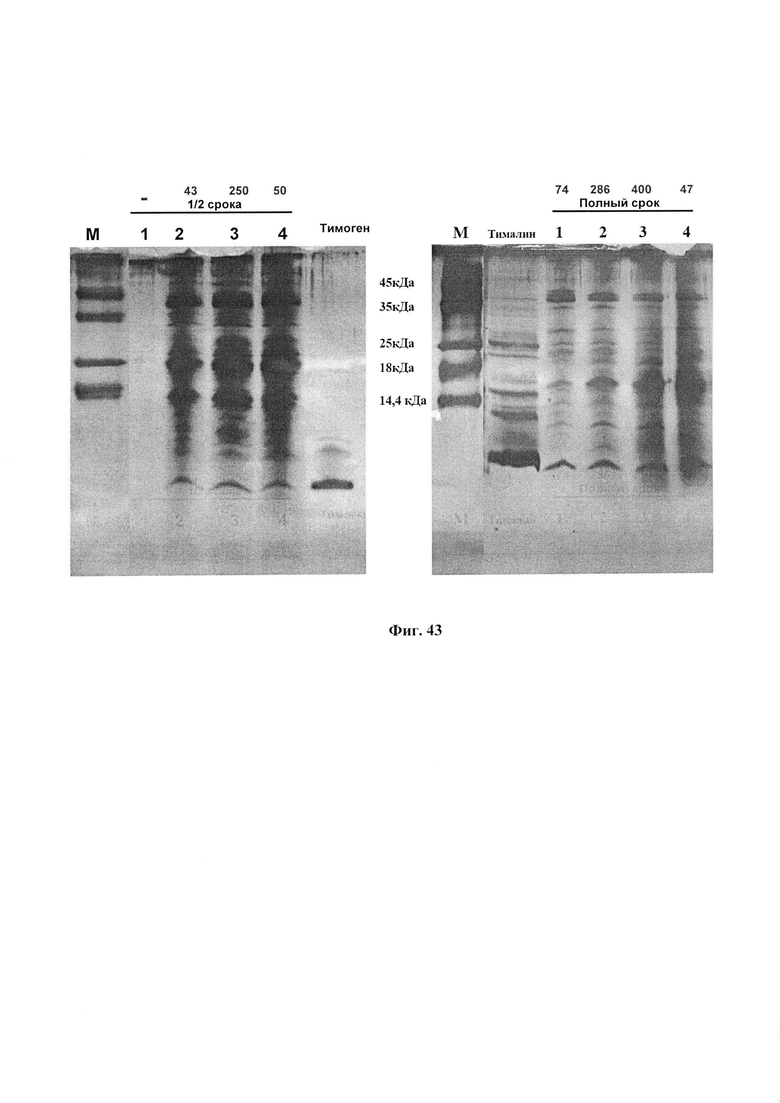
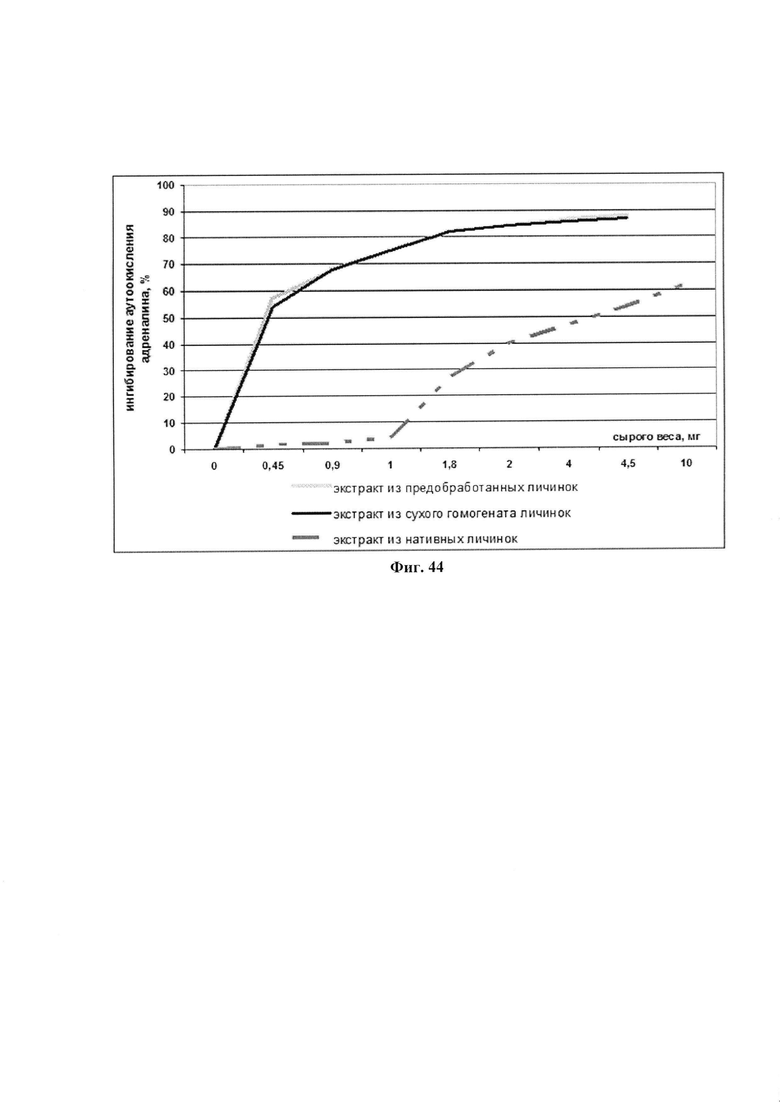
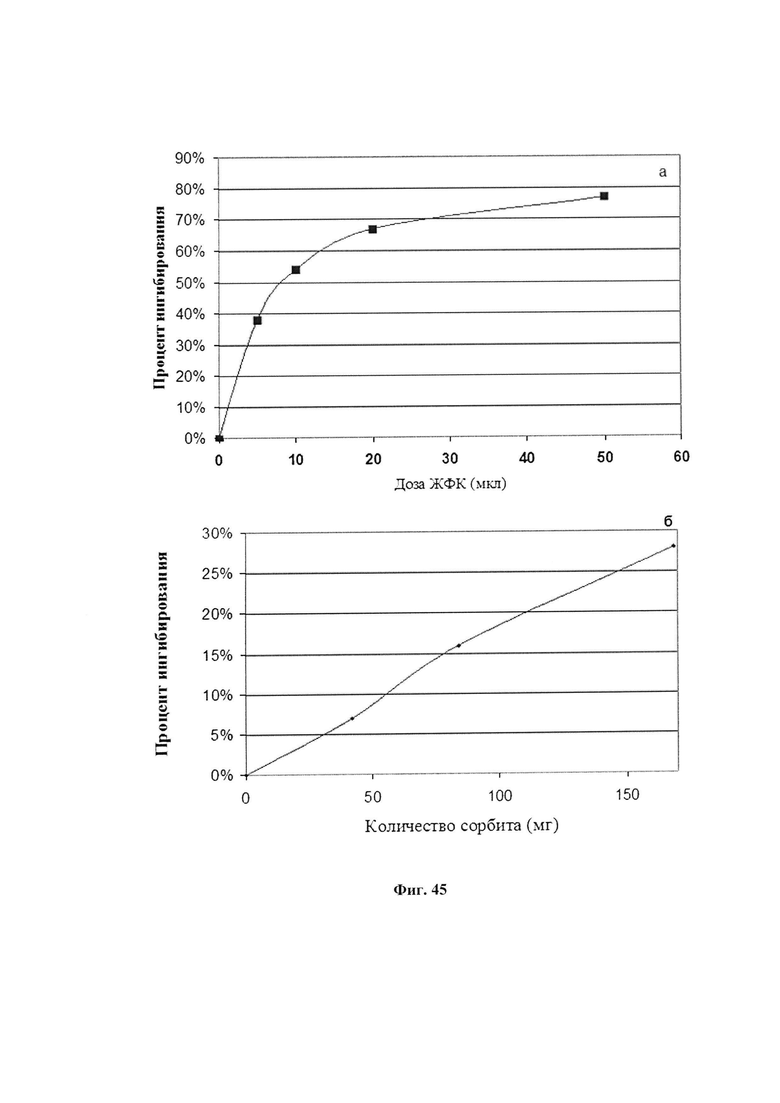
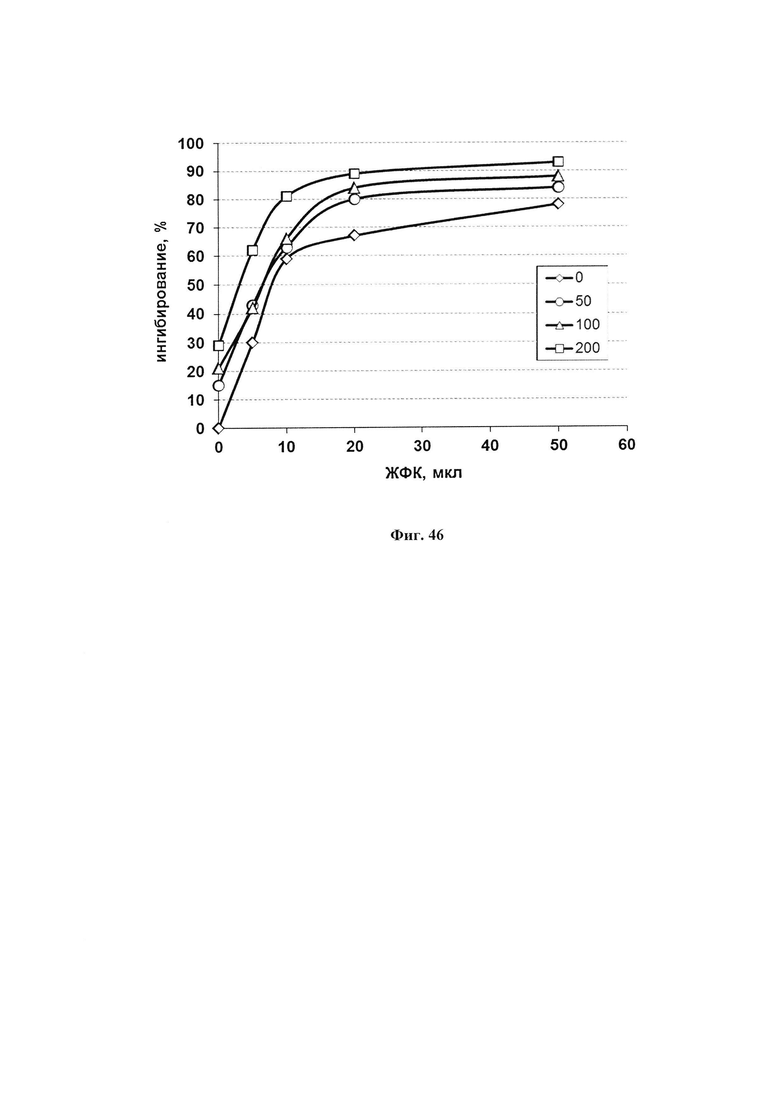
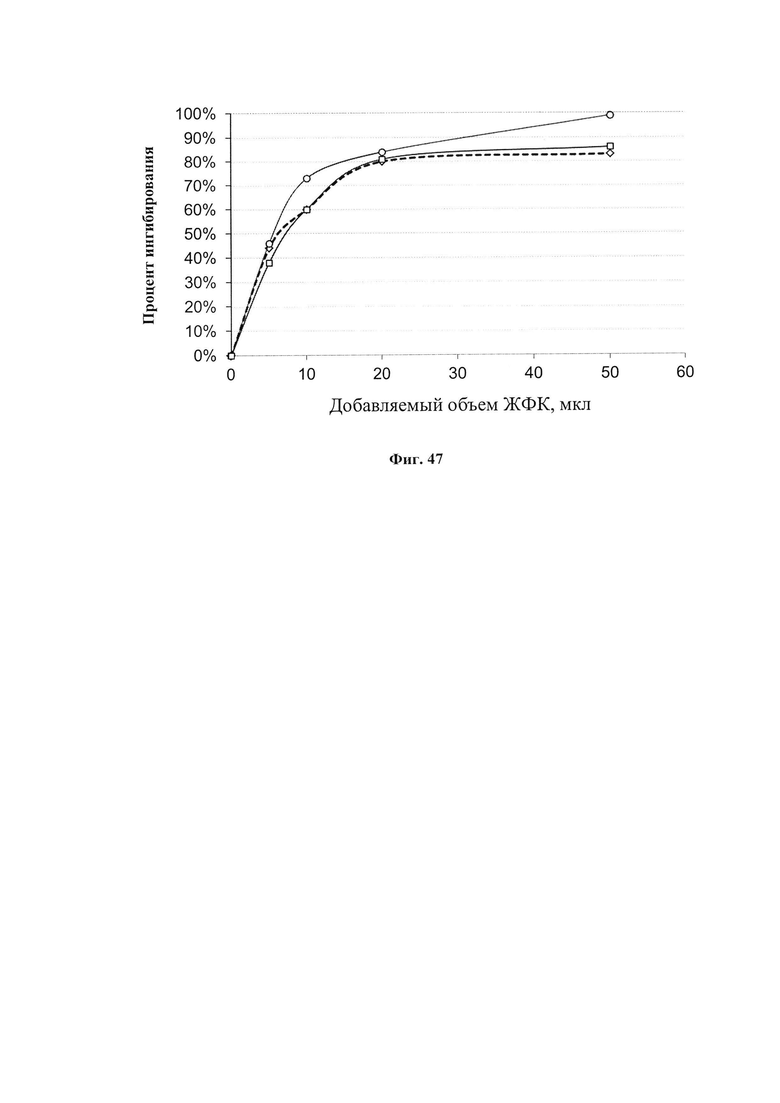
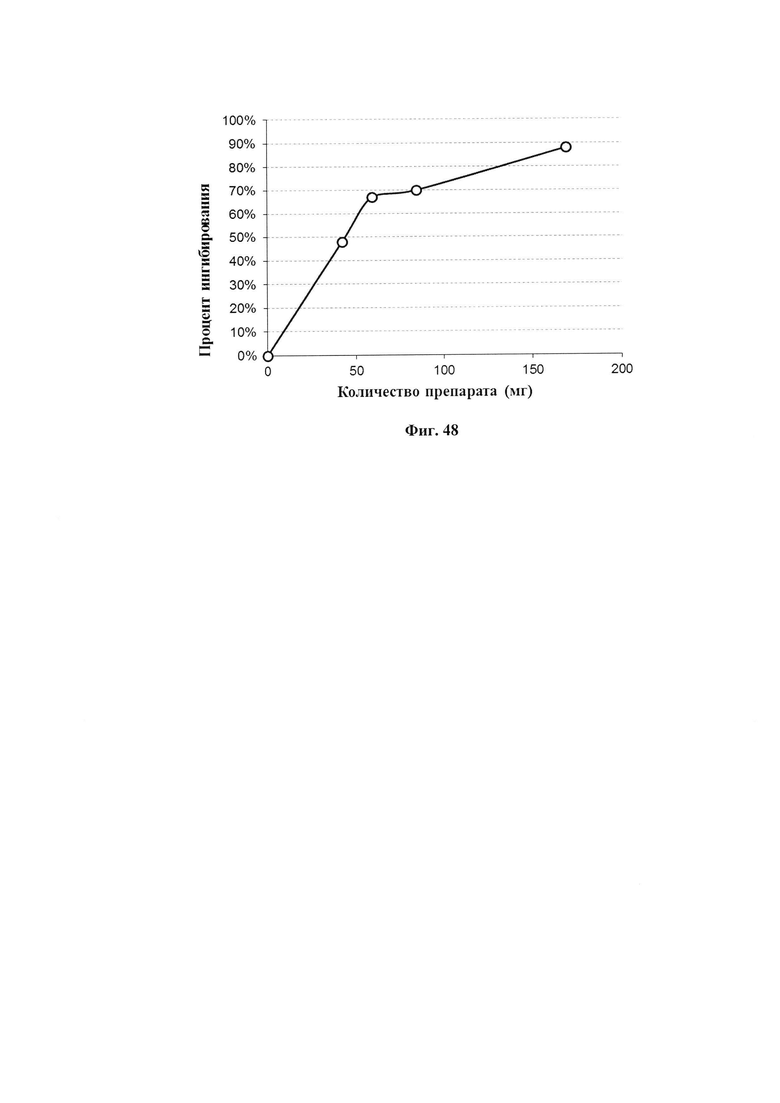
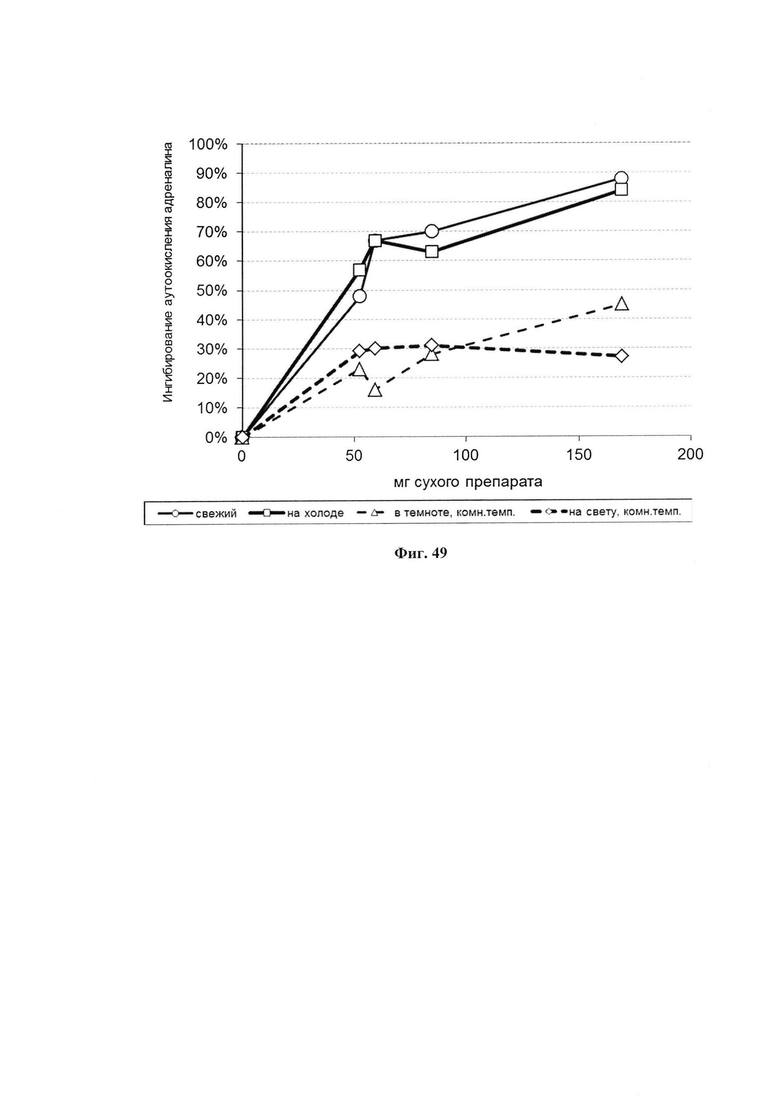
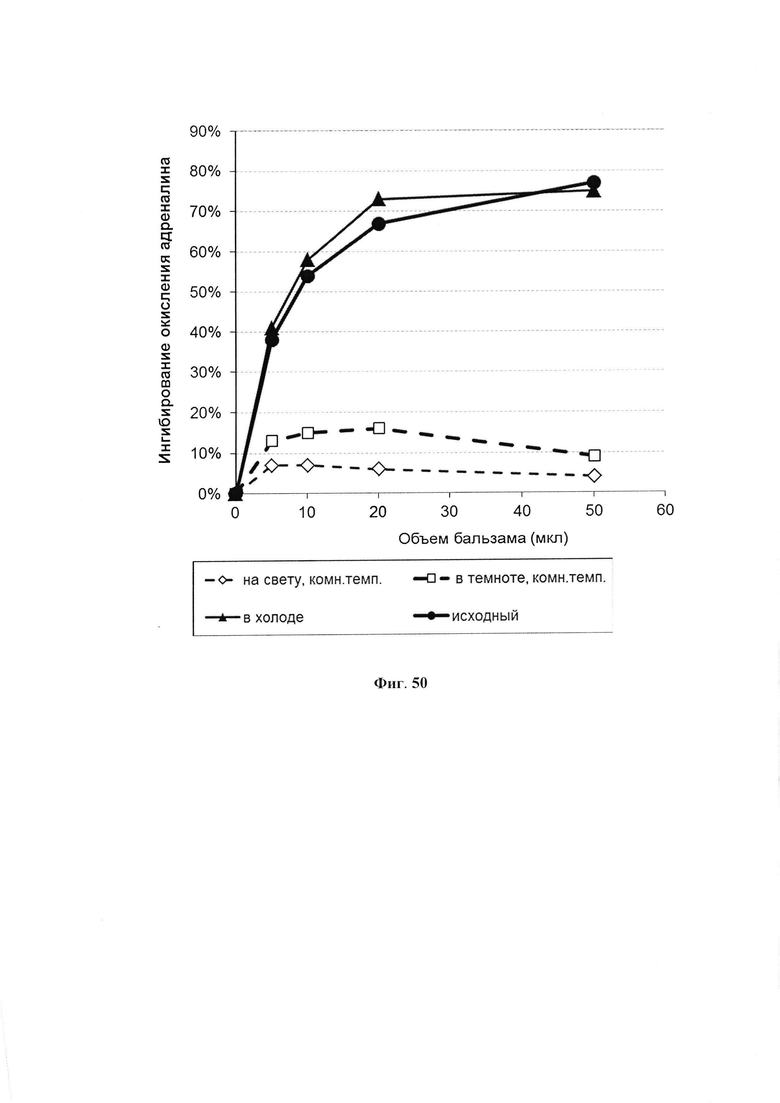
Изобретение относится к фармацевтической промышленности, а именно к фармацевтической композиции, обладающей антиоксидантной активностью. Фармацевтическая композиция, обладающая антиоксидантной активностью, полученная из личинок Galleria mellonella, включающая тимоген, тимозин-бета, лизоцим, супероксиддисмутазу, аспарагиновую кислоту, глутаминовую кислоту, глицин, аланин, лимонную кислоту, изолимонную кислоту, альфа-кетоглутаровую кислоту, в определенном количестве. Вышеописанная композиция характеризуется повышенным содержанием в ней биологически активных компонентов и антиоксидантной активностью. 6 з.п. ф-лы, 50 ил., 23 табл., 13 пр.
1. Фармацевтическая композиция, обладающая антиоксидантной активностью, полученная из личинок Galleria mellonella, включающая следующие ингредиенты:
тимоген от 0,5 до 6 мкг/мл,
тимозин-бета от 0,5 до 3 мкг/мл,
лизоцим от 0,1 до 2 мкг/мл,
супероксиддисмутаза от 1 до 15 мкг/мл,
аспарагиновую кислоту 400-580 мкг/мл,
глутаминовую кислоту 620-840 мкг/мл,
глицин 160-440 мкг/мл,
аланин 660-1200 мкг/мл,
лимонную кислоту 600-1200 мкг/мл,
изолимонную кислоту 100-200 мкг/мл,
альфа-кетоглутаровую кислоту 30-70 мкг/мл.
2. Фармацевтическая композиция по п. 1, характеризующаяся тем, что ее антиоксидантная активность, измеренная методом ингибирования аутоокисления адреналина, составляет от 150 до 500 ед./мл.
3. Фармацевтическая композиция по п. 1, характеризующаяся тем, что ее антиоксидантная активность, измеренная методом ингибирования люминесценции, сопровождающей термическое разложение α,α'-азодиизобутироамидин дигидрохлорида, составляет от 150 до 700 ед./мл.
4. Фармацевтическая композиция по п. 1, дополнительно обладающая нормализующим состояние симпатической гиперактивности свойством и оказывающая защитное действие при остром стрессе.
5. Фармацевтическая композиция по п. 1, дополнительно проявляющая лечебное действие при заболеваниях, выбранных из ишемии миокарда, туберкулеза, а также стимулирующая заживление инфицированных ран.
6. Фармацевтическая композиция по п. 1 в форме раствора или в форме сухой смеси.
7. Фармацевтическая композиция по п. 1, представляющая собой порошок, которая дополнительно содержит сорбит.
| ЛОГАРИФМИЧЕСКАЯ СЧЕТНАЯ ДОСКА | 1925 |
|
SU4198A1 |
| ОВСЕПЯН А.А | |||
| и др | |||
| Антиоксидантное и иммунопротекторное действие экстракта личинок восковой моли при окислительном стрессе у крыс, вызванном потреблением корма, обогащенного железом //Вестник новых мед | |||
| технологий, 2010, N1, электронное издание | |||
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО ПРОДУКТА ИЗ ЛИЧИНОК БОЛЬШОЙ ВОСКОВОЙ МОЛИ | 1991 |
|
RU2038086C1 |
| ПУРЫГИН П.П | |||
| и др | |||
| Выделение антибактериальных | |||
Авторы
Даты
2021-01-28—Публикация
2019-04-24—Подача