Перекрестные ссылки на родственные заявки.
Настоящая заявка утверждает привилегии временной заявки США с серийным номером 60/357,347, поданной 13 февраля 2002 года, а также временной заявки США с серийным номером 60/357,574, поданной 15 февраля 2002 года. Настоящая заявка также является частичным продолжением заявки США с серийным номером 10/215,680, поданной 9 августа 2002 года, которая представляет собой продолжение заявки США с серийным номером 09/517,798, поданной 2 марта 2000 года. Последняя в настоящее время является патентом США №6,462,071. Содержание указанных выше патентных заявок приводится здесь полностью в виде ссылки.
Область применения настоящего изобретения
Настоящее изобретение в основном касается использования стабилизированных водных растворов мочевины или ее производных для их введения в глаз человека или других млекопитающих. Мочевина и производные мочевины разжижают стекловидное тело и вызывают отсоединение задней части стекловидного тела, отделяя таким образом кортикальную часть стекловидного тела от внутренней ограничительной мембраны сетчатки. Сильное прикрепление кортикальной части к внутренней ограничительной мембране сетчатки создает тракцию сетчатки, что приводит к самопроизвольно возникающим разрывам сетчатки, вызывает идиопатическую перфорацию желтого пятна, а также кистозный отек. Отделение кортикальной части стекловидного тела от внутренней ограничительной мембраны сетчатки при использовании мочевины или ее производных исключает витреоретинальную тракцию; это допускает повторное прикрепление разрывов сетчатки, замыкание перфораций пятна, а также рассасывание кистозного отека нехирургическим способом.
Предпосылки настоящего изобретения
А. Анатомия глаза человека.
Глаз человека включает стекловидное тело, занимающее приблизительно 4/5 полости всего глазного яблока и находящееся позади хрусталика. Стекловидное тело образовано из желеобразного вещества, называемого эндолимфой стекловидного тела. Обычно эндолимфа глаза здорового человека содержит приблизительно 99% воды, а также 1% макромолеклярных веществ, включая коллаген, гиалуроновую кислоту, растворимые гликопротеины, сахара и другие метаболиты с низким молекулярным весом.
В основном сетчатка - это слой нервной ткани, образованной на внутренней задней поверхности глазного яблока. Сетчатку окружает слой клеток, называемых сосудистой оболочкой глаза. В сетчатке можно выделить: а) оптическую зону, принимающую участие в зрительном аппарате, а также б) неоптическую часть, не принимающую участие в зрительном аппарате. В оптической зоне сетчатки находятся палочковидные и колбочковидные зрительные клетки, являющиеся эффективными органами зрения. В центральную часть сетчатки входят артерии и вены, и они расширяются в наружном направлении, что обеспечивает циркуляцию крови в сетчатке.
Задний участок стекловидного тела находится в непосредственном контакте с сетчаткой. Сетки фибриллярных волокон выходят из сетчатки, они проницают собой стекловидное тело или внедряются в него, прикрепляя указанное стекловидное тело к сетчатке. (Sebag, J. Graefe's Arch.Clin.Exp.Opthalmol. 225,89-93; 1987).
Б. Случаи самопроизвольно возникающих разрывов сетчатки, идиопатической перфорации желтого пятна и кистозного отека; их лечение и клинические последствия.
Диабетическая ретинопатия, травма и другие офтальмологические нарушения иногда вызывают разрыв или подтекание кровеносных сосудов сетчатки, что приводит к кровоизлиянию в эндолимфу (т.е. кровоизлияние в стекловидное тело). Такие кровоизлияния в стекловидное тело обычно проявляются в виде замутнения жидкой части стекловидного тела или его потемнения.
С годами гель стекловидного тела глаза человека подвергается значительному разжижению. В возрасте свыше 40 лет наблюдается устойчивое увеличение разжиженной части стекловидного тела и уменьшение объема геля стекловидного тела, а к 80 годам более половины стекловидного тела находится в разжиженном состоянии. (McLeod, D. et al., Trans. Ophthal. Soc. UK, 1997; 97:225-231). Исследования стекловидного тела целиком с помощью оптического микроскопа показали, что первоначально процесс разжижения начинается в очагах, которые затем объединяются в единое целое. (Sebag J. et al., Invest. Ophthalmol. Vis. Sci. 1989; 30:1867-1871). Эти процессы могут привести к самопроизвольно возникающему отсоединение задней части стекловидного тела (PVD). Обычно такое отсоединение задней части стекловидного тела - неожиданный процесс, в течение которого разжиженная часть стекловидного тела из центра этого тела через отверстие прорывается в заднюю часть кортикальной части стекловидного тела, а затем отсекает оставшуюся часть кортикального геля от внутренней граничной оболочки сетчатки (Larsson, L et al., Graefe's Arch.Clin.Exp.Opthalmol., 1985; 223:92-95). Оставшийся кортикальный гель затем оседает спереди, занимая собой переднюю часть полости стекловидного тела. Этот процесс может индуцировать разрыв сетчатки, который при наличии остаточной витреоретинальной тракции вокруг этого разрыва может привести к самопроизвольно возникающей отслойке сетчатки (McLeod, D. et al., Trans. Ophthal. Soc. UK, 1997; 97:225-231). Витреоретинальная тракция также может привести к образованию перфорации желтого пятна; было также предположено, что появление некоторых форм кистозного отека желтого пятна вызвано витреоретинальной тракцией при неполном самопроизвольно возникающем отсоединении задней части стекловидного тела (Sebag J. et al., Surgey Ophthalmol. 1984; 28:493-498). Если самопроизвольно возникающее отсоединение задней части стекловидного тела сопровождается нарушением целостности сетчатки или ее отслойкой, то важно, чтобы такое нарушение целостности или отслойка были бы быстро диагностированы и чтобы эти повреждения были устранены хирургическим путем. Неспособность быстрой диагностики и хирургического вмешательства может вызвать гибель фоторецепторов сетчатки в зоне нарушения ее целостности или отслойки. Гибель клеток фоторецепторов сетчатки способно привести к потере зрения. Кроме того, если в течение значительного периода времени отслойку сетчатки не устраняют, то результатом этого может быть дальнейшее кровоизлияние внутрь стекловидного тела и/или образование фиброзной ткани в месте указанного кровоизлияния. Такое образование фиброзной ткани может вызвать формирование нежелательного скрепления стекловидного тела с сетчаткой.
Обычные хирургические методики, используемые при восстановлении разорванной или отслоившейся сетчатки, требуют, чтобы для визуализации поврежденного участка сетчатки (т.е. «обзора сетчатки сквозь стекловидное тело») хирург был в состоянии смотреть сквозь эндолимфу. При кровоизлиянии в стекловидное тела присутствие внутри него геморрагической крови может вызвать такое помутнение стекловидного тела, что это помутнение будет мешать хирургу видеть сетчатку сквозь стекловидное тело. Прояснение такого геморрагического помутнения стекловидного тела, достаточное для обзора сетчатки сквозь стекловидное тело, может занять приблизительно 12 месяцев или больше.
Термин «пневматическая ретинопексия» был применен Hilton, Grizzard (Hilton, G.F. et al., Opthalmology 1986; 93: 626-641) для обозначения такой операции отслойки сетчатки без надреза, которая включает инъекционное введение внутрь стекловидного тела расширяющегося газа методом криотерапии и/или фотокоагуляцию разрыва (или разрывов) сетчатки. Пациент фиксируется в таком положении, чтобы пузырьки воздуха закрывали разрывы сетчатки, что позволяет спонтанную ресорбцию находящейся за сетчаткой жидкости. Другие авторы указывали на осложнения, связанные с находящимся за сетчаткой газом (McDonald, H.R. et al. Opthalmology, 1987; 94:319-326); на формирование новых разрывов в сетчатке (Poliner, L.S. et al. Opthalmology, 1987; 94:315-318); на отслойку желтого пятна (Yeo, J.H. et al. Arch. Opthalmol. 1986; 104: 1161-1163); a также на вероятность меньшего успеха в случае афакического и псевдоафакического зрения (Chen, J.C. et al. Opthalmology, 1988; 95:601-608).
Пневматическая ретинопексия представляет собой способ восстановления разрывов сетчатки, использующий криопексию или фотокоагуляцию в сочетании с инъекцией газа внутрь стекловидного тела в целях проведения внутреннего тампонада разрывов сетчатки. Как сообщалось, после проведения пневматической ретинопексии происходит распространение имеющихся разрывов сетчатки, а также миграция субретинальной жидкости в желтое пятно (Yeo, J.H. et al. Arch. Opthalmol. 1986; 104:1161-1163). Подтверждается возникновение новых разрывов сетчатки, а также отслойки сетчатки в незатронутых ранее квадрантах у 20% пациентов; это происходит в пределах 2-4 недель после пневматической ретинопексии (Poliner, L.S. et al. Opthalmology, 1987; 94:315-318). У таких пациентов первоначальные отслойки сетчатки полностью рассосались, после чего с другой стороны первоначального разрыва возникли новые разрывы и связанные с ними отслойки; при этом происходило уплотнение стекловидного тела и тракция в незатронутых ранее квадрантах.
Большинство перфораций желтого пятна являются «идиопатическими», так как они возникают при отсутствии предшествующей какой-либо глазной патологии. Перфорации желтого пятна могут появиться непосредственно после нанесения повреждения тупым предметом (тупой травмы). С формированием желтого пятна могут быть связаны другие офтальмологические проблемы, включая кистозный отек желтого пятна, эпиретинальной мембраны, синдром витреомакулярной тракции, самопроизвольно возникающие разрывы сетчатки, гипертензивная ретинопатия, а также пролиферативная диабетическая ретинопатия (Aaberg, Т.М. Survey Opthalmol. 1970; 15:139-162).
Признаком формирования идиопатической перфорации желтого пятна является безболезненное искажение макулярного (центрального) зрения, или нерезкость изображения в острой или подострой форме. Вначале острота центрального зрения снижается только незначительно; однако по мере того как в течение недель и месяцев размеры перфорации пятна растут, острота зрения ухудшается, а затем стабилизируется на уровне от 20/200 до 20/800, а диаметр перфорации пятна составляет 500 мкм.
Примеры веществ, вызывающих разжижение стекловидного тела и/или отслойку заднего участка стекловидного тела или его отделение, приведены в патентах США с номерами 4,820,516 (Sawyer), 5,292,509 (Hageman), а также 5,866,120 (Karageozian et al).
Необходимо осветить разработку новых материалов и способов, ускоряющих разжижение стекловидного тела, а также отделение заднего участка стекловидного тела или его иссечение согласно используемой ранее технологии.
В. Более ранние терапевтические использования мочевины и производных мочевины
В патентах США с номерами 5,470,881 (Chariton et al.) и 5,629,344 (Charlton et al.) описаны местные аппликации мочевиной и/или производными мочевины на роговицу или на «поверхность глаза» в целях излечения таких состояний глаза, как сухость, неинфекционный кератит, неровность роговицы или конъюнктивального эпителия, офтальмологического рубцевания и ощущения «субъективного жжения». Необходимо отметить, что в указанных выше патентах описаны и используются составы мочевины, которые по своей природе являются неводными. Эти составы содержат гидрофобные неводные системы (типа белого вазелина, минерального масла и безводного жидкого ланолина). Некоторые из описанных составов являются водными по своей природе, однако вместо мочевины авторы патентов предлагают применять производные мочевины (типа уреидопропионовой кислоты или аллантоина).
Ранее сообщалось, что некоторые из используемых водных препаратов мочевины подвергаются гидролизу, продуцируя при этом в качестве побочного продукта аммиак. Аммиак при его местном применении представляет собой вещество, токсичное для глаза и еще более токсичное при использовании внутри стекловидного тела.
Мочевина - это небольшая молекула, молекулярная масса которой составляет 60,06. До некоторой степени мочевина является основанием, рН ее 10% водного раствора составляет 7,2. Мочевина хорошо растворима в воде, этаноле, метаноле и глицероле однако она практически нерастворима в хлороформе или эфире. Мочевина представляет собой бесцветные или белые кристаллы призматической формы или белый кристаллический порошок, устойчивый при хранении в сухих условиях при комнатной температуре. Свежеприготовленные растворы мочевины прозрачны, бесцветны и не обладают запахом. Однако постепенно эти растворы разлагаются и выделяют запах аммиака.
Мочевина представляет собой продукт метаболизма протеинов в организме человека, она выделяется с мочой человека при среднем количестве 30 г/сутки. В медицине мочевину используют широко. Растворы мочевины для инъекций уже свыше 40 лет включаются в Национальную Фармакопею США (USP 24, 2000, pp.1730). В качестве лекарственного продукта мочевина для инъекций (внутривенных) разрешена в США более 20 лет. В качестве продукта мочевина была зарегистрирована в США ив 1961 ее продавал концерн Abbot Pharmaceutical Co. под торговой маркой Ureaphill. В специальном издании, публикующем сведения об использовании врачами определенного препарата (Physician's Desk Reference; PDR, Edition 1961, Medical Economics Publishing), мочевина для инъекций упоминалась с 1961 по 1979 гг. Сведения указывают также на то, что мочевина для инъекций была зарегистрирована и распространялась во многих странах как осмотический диуретик в целях снижения внутричерепного давления, а также для снижения внутриглазного давления у пациентов с глаукомой (Tartat, R.C. et al., American Journal of Opthalmology; 52: 323-331; 1961). Помимо этого мочевину использую внутривенно для лечения болезненного криза при серповидно-клеточной болезни (анемии Геррика) (McCurdy, P.R.I.V. "Urea treatment of painful crisis of Sickle Cell Disease" New England Journal of medicine. 285:992-994; 1971).
Мочевину применяли и местно в качестве дерматологически активного ингредиента при лечении псориаза, ихтиоза, атопического дерматита, а также для удаления избытка кератина с сухой кожи (Remington. "The Science and Practice of Pharmacy" 19 Edition, Chapter 52, p.1041-1042, 1995).
Краткое содержание настоящего изобретения
В соответствии с настоящим изобретением мочевину, производные мочевины, тиомочевину, производные тиомочевины, гуанидин, производные гуанидина или соединение, имеющее приведенное далее формулу I, вводят внутрь стекловидного тела в целях разжижения эндолимфы стекловидного тела и индуцирования отсоединения задней части стекловидного тела, способствуя таким образом отделению кортикальной части стекловидного тела от внутренней ограничительной мембраны сетчатки. Сильное прикрепление кортикальной части к внутренней ограничительной мембране сетчатки вызывает тракцию сетчатки, что приводит к самопроизвольно возникающим разрывам сетчатки, вызывает идиопатическую перфорацию желтого пятна, а также кистозный отек. Отделение кортикальной части стекловидного тела от внутренней ограничительной мембраны сетчатки при использовании мочевины или ее производных исключает витреоретинальную тракцию; это допускает повторное прикрепление разрывов сетчатки, замыкание перфораций пятна, а также рассасывание кистозного отека, осуществляемые нехирургическим способом. Помимо этого полностью исключаются новые разрывы сетчатки, связанные с отслойкой сетчатки у пациентов, подвергшихся пневматической ретинопексией. Соединения, которые, так же как мочевина, тиомочевина, гуанидин и их производные, можно применять для реализации способов по настоящему изобретению, имеют следующую общую формулу I:
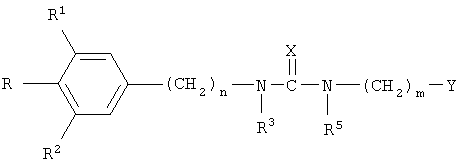
в которой R представляет собой водород, C1-C8алкильную, С3-С8 циклоалкильную, С1-С6 алкилфенильную или гидроксильную защитную группу;
R1 и R2 независимо представляет собой водород, С1-С6алкил, С3-С8 циклоалкил, С3-С6 алкинил, С1-С6 алкокси, С3-С6 алкенил, -S(O)q(С1-С6алкенил); или
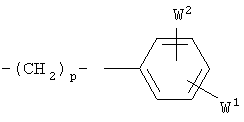
в которой А представляет собой -CH2-, -O-, -S-, -S(O)2; W1 и W2 независимо представляют собой водород, галоген, гидроксил, C1-C4алкил, C1-C4 алкокси, C1-C4 алкилтио, C2-C4 алкенил, C2-C4 алкинил;
R3 представляет собой водород, C1-C8алкил, C3-C8 циклоалкил, C1-C6 алкилфенил;
Х представляет собой О, S или NR4;
R4 представляет собой C1-C6 алкил, C1-C6 алкилфенил или C1-C6 алокси
R5 представляет собой C3-C8 циклоалкил или C1-C8 алкил
Y представляет собой
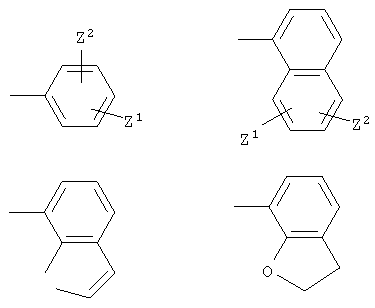
в которой Z1 и Z2 независимо представляют собой водород, С1-С6алкил, С3-С8 циклоалкил, С1-С6 алкокси, гидроксил, С2-С4 алкенил, С2-С6алкил, С1-С6 алкилтио, галоген, трифторметил или -NR6R7;
R6 и R7 независимо представляют собой водород, С3-С8 циклоалкил, С1-С6 алкил, С1-С4 алкилфенил;
n равно от 1 до 6 включительно;
m и р независимо равны от 1 до 6 включительно;
q равно 0, 1 или 2;
а также их фармацевтические соли.
Далее согласно настоящему изобретению обеспечиваются способы лечения различных офтальмологических нарушений у человека или животного путем введения такому пациенту терапевтически эффективного количества мочевины, производных мочевины, тиомочевины, производных тиочевины, гунидина, производных гуанидина или соединения, имеющего общую формулу I. Такое соединение может быть введено непосредственной инъекцией в стекловидное тело (а именно инъекцией внутрь стекловидного тела), или его можно ввести любым другим путем, вызывающим распределение в стекловидном теле терапевтически эффективного количества указанного соединения. Это соединение может быть введено в целях излечения специфических офтальмологических заболеваний или состояний, связанных с ростом внутриглазного давления и изменениями эндолимфы стекловидного тела. В одном варианте настоящего изобретения составы вызывают отсоединение задней части стекловидного тела от сетчатки, способствуя таким образом отделению кортикальной части стекловидного тела от внутренней ограничительной мембраны сетчатки. Отделение кортикальной части стекловидного тела от внутренней ограничительной мембраны сетчатки при использовании мочевины или ее производных исключает витреоретинальную тракцию; это допускает повторное прикрепление разрывов сетчатки, замыкание перфораций пятна, а также рассасывание кистозного отека, осуществляемые нехирургическим способом. Помимо этого полностью исключаются новые разрывы сетчатки, связанные с отслойкой сетчатки у пациентов после пневматической ретинопексии.
Далее в соответствии с настоящим изобретением обеспечиваются способы излечивания рубеоза (покраснения радужки) и/или неоваскулярной глаукомы. Рубеозом называют аномальное разрастание кровеносных сосудов в радужной оболочке глаза, а также в структурах, находящихся в передней части глаза и в здоровом состоянии лишенных видимых кровеносных сосудов. Обычно рубеоз возникает в результате ретинальной ишемии у пациентов, страдающих диабетической ретинопатией или закупоркой вен. Поскольку сетчатка лишается нормального кровотока, то организм вызывает формирование указанных аномальных кровеносных сосудов в качестве компенсаторного механизма снабжения глаза кислородом. К сожалению, формирование таких аномальных кровеносных сосудов часто приводит к закупорке угловой и трабекулярной сетки, через которую происходит дренаж жидкости из передней части глаза. Это вызывает подъем внутриглазного давления или «неоваскулярную глаукому», а также приводит к потере периферического зрения. Настоящее изобретение обеспечивает лечение рубеоза путем введения в стекловидное тело пораженного глаза некоторого количества: а) мочевины, производных мочевины, тиомочевины, производных тиомочевины, гуанидина, производных гуанидина, а также соединений, представленных общей формулой I; б) нестероидного противовоспалительного лекарственного средства (например, кеторалака, диклофенака и т.п.); или в)комбинации i) мочевины, производных мочевины, тиомочевины, производных тиомочевины, гуанидина, производных гуанидина, а также соединений, представленных общей формулой I; и ii) нестероидного противовоспалительного лекарственного средства (например, кеторалака, диклофенака и т.п.), которое достаточно для снижения или предотвращения неоваскуляризации радужки и/или других структур передней части глаза.
Помимо этого в соответствии с настоящим изобретением обеспечиваются способы защиты нервной системы от повреждений или лечения таких повреждений для того, чтобы вызвать регенерацию и/или восстановление некоторых передач импульсов по нерву, это осуществляется введением в поврежденный нерв или контактом с ним терапевтически эффективного количества мочевины, производных мочевины, тиомочевины, производных тиомочевины, гуанидина, производных гуанидина, а также соединений, представленных общей формулой I. Этот способ можно использовать для лечения или предупреждения повреждений или сниженной передачи сенсорных и/или моторных импульсов в любом из нервов, включая зрительные нервы, нервы ЦНС (например мозга и позвоночника), а также нервы периферической нервной системы. В случае такого применения соединение может быть введено любым пригодным для этого способом, включая инъекцию в стекловидное тело (для лечения или предупреждения повреждений зрительного нерва), инъекцию или доставку в поврежденный нерв, интратекальную, интракраниальную или интравентикулярную инъекцию (для лечения или предупреждения повреждений нервов мозга и позвоночника), или инъекцию или имплантацию, проводимые рядом с поврежденным нервом или в непосредственной близости от него.
Другие аспекты и составные части настоящего изобретения станут ясны квалифицированным в этой области людям после ознакомления с приведенным ниже подробным описанием и примерами.
Подробное описание настоящего изобретения.
Предпочтительным путем введения раскрываемых здесь составов и/или композиций является инъекция в стекловидное тело, причем водный раствор мочевины, производных мочевины, тиомочевины, производных тиомочевины, гуанидина, производных гуанидина, а также соединений, представленных общей формулой I, инжектируется непосредственно внутрь стекловидного тела, расположенного в задней части глаза. Или же соединение, разжижающее стекловидное тело и индуцирующее отделение стекловидного тела от сетчатки и эпителиальных мембран (называемое здесь и далее PVD), может быть введено любым удобным путем (например, местное применение), который приводит к существенному распределению указанных соединений в стекловидном теле в таком количестве, которое достаточно для того, чтобы вызвать необходимое разжижение стекловидного тела и отсоединение задней части стекловидного тела.
Предпочтительно инжектируемые стабилизированные водные растворы мочевины могут содержать определенные инертные ингредиенты, которые делают указанный раствор в существенной степени гипотоническим, изотоническим или гипертоническим, а также создают рН в диапазоне от 4,5 до 9,0; этот раствор нетоксичен для инъекции внутрь глаза. Такой стабилизированной раствор мочевины для инъекций может находиться в стеклянном пузырьке или в заполненном предварительно шприце, содержащихся при комнатной температуре или в условиях охлаждения так, чтобы они были готовы к применению. Помимо этого такие стабилизированные растворы мочевины вначале можно лиофилизировать до сухого состояния, а потом перед использованием их можно восстановить.
Для используемого в настоящем изобретении способа мочевину можно получить у нескольких производителей тонких химических соединений, ее чистота составляет 99,0-100,5%.
Настоящее изобретение обеспечивает стабилизированные водные растворы мочевины, которые содержат: а) мочевину (или производные мочевины), б) хлорид натрия, в) лимонную кислоту, а также г) воду. Один частный пример такого раствора приведен ниже в таблице I.
В стабилизированных водных растворах мочевины по настоящему изобретению концентрация мочевины обычно находится в диапазоне от приблизительно 0,003 мг на 50 мкл до приблизительно 15 мг на 50 мкл. В одном варианте настоящего изобретения концентрация мочевины в составах или композициях составляет от 0,005 мг на 50 мкл до 7,5 мг на 50 мкл. Лимонную кислоту обычно используют в концентрации от приблизительно 0,00001% до 1,0%, а в одном варианте настоящего изобретения количество присутствующей лимонной кислоты составляет от 0,00007% до 0,007%. Хлорид натрия в составах и композициях обычно используют в концентрации от приблизительно 0,05% до 3,6%, а в одном варианте настоящего изобретения количество присутствующего хлорида натрия составляет от 0,9% до 1,8%. В предпочтительном варианте настоящего изобретения состав содержит сочетание мочевины (в количестве от приблизительно 0,005 мг на 50 мкл до 7,5 мг на 50 мкл), лимонной кислоты (в количестве от 0,00007% до 0,007%) и хлорида натрия (в количестве от 0,9% до 1,8%). Раскрываемые здесь составы могут иметь рН от приблизительно 4,0 до приблизительно 9,0; а в предпочтительном варианте настоящего изобретения рН ниже 7 (например, находится в диапазоне от 4,0 до 6,5). Указанные составы могут также содержать один или более буферов (типа фосфатных буферов), ацетат и/или глицин.
Обычно указанные ингредиенты составов вначале растворяют в стерильной воде, фильтруют в стерильных условиях, а затем в виде раствора помещают в стеклянные или пластиковые пузырьки или в стеклянные или пластиковые шприцы. Помимо этого такой раствор может быть лиофилизован до сухого состояния. Таким образом, указанные фармацевтические составы представляют собой или жидкие составы или лиофилизованные составы и/или стерильные порошкообразные вещества. Эти составы можно сохранять в заранее заполненных шприцах, в стеклянных пузырьках, их можно сохранять в герметичных условиях при комнатной температуре, температуре холодильного хранения или температуре замороженного состояния; при этом в течение длительного времени (например, в течение 1 года, а в одном варианте настоящего изобретения - в течение 3 лет) их распад незначителен.
В приведенных ниже таблицах II-IV указаны конкретные примеры составов стабилизованной мочевины, который входят в общий состав, указанный выше в таблице I.
Как описано в приведенных далее примерах, составы стабилизированных водных растворов мочевины из таблиц I-IV можно вводить инъекцией непосредственно в стекловидное тело при дозировках, приносящих терапевтические эффекты, близкие к желаемому, в которые входит (но не обязательно им ограничивается) разжижение стекловидного тела, а также отсоединение задней части стекловидного тела по настоящему изобретению; при этом не оказывается существенного токсического воздействия на глаз или на связанные с ним анатомические структуры. Помимо этого количество мочевины, находящееся в указанных составах, может быть таким, чтобы оно служило связью между терапевтическими действиями, производимыми одним или более терапевтическими агентами. По-видимому (без желания связи с какой-либо конкретной теорией или механизмом действия), терапевтический агент, который вводят вместе с содержащим мочевину составом, более эффективно распределяется в глазу, обеспечивая желаемый терапевтический эффект. Другими словами, совместное введение вместе с мочевиной других терапевтических агентов улучшает их биологическую усвояемость, и эти терапевтические агенты могут обеспечить один или более терапевтических эффектов. Используемый здесь термин «совместное введение» не означает, что мочевина и терапевтические агенты следует вводить точно в одно и то же время. Напротив, в соответствии с приведенным здесь раскрытием настоящего изобретения совместным введением называют введение одного или более терапевтических агентов, отличных от мочевины, в такое время, когда желаемый терапевтический эффект уже обеспечен мочевиной. Таким образом, если вводят состав, содержащий мочевину, то в этом же составе возможно присутствие одного или более дополнительных терапевтических агентов; или эти терапевтические агенты могут быть введены незадолго до введения состава, содержащего мочевину, или вскоре после этого.
Помимо этого изобретены также способы лечения невропатий путем введения состава или композиции, содержащих такое количество мочевины, которое эффективно для усиления неврональной активности, типа нейротрансмиссии. Введение составов, содержащих мочевину, пациентам со сниженной функцией зрительного нерва приводит к улучшению этих функций.
Пример I
Лечение разрывов сетчатки
Под наблюдением находилось 7 мужчин и 5 женщин, средний возраст которых составлял 47 лет, с единичным или множественными разрывами сетчатки, помимо этого у 9 из 12 пациентов имелась отслойка желтого пятна. Спустя 3 суток после инъекции в стекловидное тело 1,5 мг мочевины в 50 мкл водном растворе, приготовленном согласно рецептуре из приведенной выше таблицы II, все пациенты получали пневматическую ретинопексию. Офтальмоскопическое и биомикроскопическое обследование глаз всех пациентов не выявило никакого неблагоприятного воздействия, вызванного инъекцией раствора мочевины в стекловидное тело. У 11 из 12 пациентов в течение 3-7 суток после инъекции раствора мочевины развивалось отсоединение задней части стекловидного тела (PVD), и не развивалось оно только у 1 пациента. У этого пациента на протяжении 90 суток также развилось PVD.
Полное повторное прикрепление сетчатки, а также прикрепление желтого пятна наблюдалось у 9 из 12 пациентов в течение 3 суток лечения, а за 7 суток у всех 12 пациентов наблюдалось полное повторное прикрепление сетчатки и прикрепление желтого пятна. За всеми пациентами наблюдали на протяжении 90 суток, и ни у одного из них не происходили новые разрывы сетчатки, а также отслойки сетчатки.
Имеются сведения, что только у 3% пациентов, получавших пневматическую ретинопексию без предварительного лечения мочевиной, через месяц после пневматической ретинопексии острота зрения улучшилась более чем на две строки (11 букв), и только у 7% пациентов такое улучшение произошло через 6 месяцев после пневматической ретинопексии. (Tomambe Р.Е. et al., Ophalmology, 1989; 96:772-783). В этом примере у 64% пациентов, получавших инъекцию мочевиной в стекловидное тело за 3 суток до проведения пневматической ретинопексии, через 6 месяцев после нее наблюдалось улучшение остроты зрения более чем на 2 строки (11 букв). Помимо этого через 1 месяц после пневматической ретинопексии у пациентов, получавших лечение мочевиной, наблюдалось среднее улучшение остроты зрения на 3,9 строки по диаграмме глаза (20 букв), а через 6 месяцев после пневматической ретинопексии среднее улучшение остроты зрения для каждого пациента, получавшего лечение мочевиной, составило 4,2 строки (21 букву). Таким образом, делается вывод, что: а) лечение пациентов мочевиной ускоряет повторное прикрепление разрывов сетчатки, а также повторное прикрепление отслоившегося желтого пятна после введения составов, содержащих мочевину; б) в результате индуцирования PVD не происходит возникновения новых разрывов сетчатки и связанной с ними отслойки сетчатки; а также в) у 64% пациентов, получавших наряду с пневматической ретинопексией лечение мочевиной, происходит улучшение зрения, в то время как такое улучшение происходило только у 3-7% пациентов, получавших пневматическую ретинопексию без лечения мочевиной.
Пример II
Лечение идиопатической перфорации желтого пятна
Под наблюдением находилась женщина 57 лет, у которой в течение 6 месяцев имелась 450 мкм идиопатическая перфорация желтого пятна. По классификации перфораций желтого пятна этот дефект имел третью стадию, а зафиксированная острота зрения пациентки до проведения лечения мочевиной составила 20/400. Пациентке однократно проводили инъекцию в стекловидное тело состава, содержащего 1,5 мг мочевины в 50 мкл раствора, приготовленного в соответствии с рецептурой из приведенной выше таблицы III. На протяжении 7 суток у пациентки произошло полное отделение стекловидного тела от сетчатки и эпителиальных мембран. Офтальмоскопическое, а также биомикроскопическое обследование глаз пациентки не выявило никакого неблагоприятного воздействия в результате инъекции раствора мочевины в стекловидное тело. Спустя 7 суток после проведения указанной инъекции в стекловидное тело этой пациентке инъекций в стекловидное тело ввели 0,3 мл расширяющегося газа (C3F8).
Спустя 1 неделю после введения этого газа размер перфорации желтого пятна с 450 мкл уменьшился до 200 мкл, а острота зрения пациентки улучшилась с 20/400 до 20/80. Спустя 2 недели после лечения размер перфорации желтого пятна с 450 мкл уменьшился до 90 мкл, а острота зрения пациентки улучшилась с 20/400 до 20/70. После 4 недель лечения размер перфорации желтого пятна с 450 мкл уменьшился до 60 мкл, а острота зрения пациентки улучшилась с 20/400 до 20/60.
У пациентов, которым не вводили раскрываемые здесь составы, перфорации желтого пятна третьей стадии сами по себе не закрывались и стандартным путем лечения перфораций желтого пятна являлось проведение хирургического вмешательства в стекловидное тело. Хирургия перфораций желтого пятна сосредоточена вокруг трех этапов: а) отделение задней части стекловидного тела от желтого пятна и от задней части полюса глаза; б) отшелушивание ткани по периметру перфорации; в) применение газа длительного действия и помещение пациента лицом вниз. Хирургия стекловидного тела, а также механическое отшелушивание мембраны задней части стекловидного тела методом отсасывания могут быть травматичными для зрительного нерва или для самой сетчатки, приводя к кровоизлияниям в сетчатку, повреждению слоя нервного волокна, а даже, вероятно, к разрывам сетчатки, что вызовет ухудшение зрения.
Необходимость хирургии стекловидного тела может быть полностью исключена путем введения некоторого количества соединения по настоящему изобретению, индуцирующего отсоединение задней части стекловидного тела. Таким образом удается избежать возможных осложнений, связанных с хирургией сетчатки и приводящих к плохому зрению. Как обсуждается здесь, соединения по настоящему изобретению разжижают эндолимфу стекловидного тела и вызывают отсоединение задней части стекловидного тела, отделяя таким образом кортикальную часть стекловидного тела от внутренней ограничительной мембраны сетчатки без необходимости механического разрыва стекловидного тела. Такое отделение кортикальной части стекловидного тела от внутренней ограничительной мембраны сетчатки исключает витреоретинальную тракцию и поэтому допускает повторное прикрепление разрывов сетчатки и замыкание перфораций пятна нехирургическим путем.
Пример III
Инъекции в стекловидное тело мочевиной в качестве адъюванта при пневматической ретинопексии
Настоящее изобретение обеспечивает способ уменьшения витреоретинальной тракции и индуцирования полного отсоединения задней части стекловидного тела (t-PVD) у субъектов с первичной самопроизвольно возникшей отслойкой сетчатки (PRRD) и подвергнутых лечению пневматической ретинопексией; лечение проводили с помощью введения состава, содержащего мочевину, из таблицы II (VRT-1001).
Параллельно при их согласии, основанном на полученной информации, были зарегистрированы пациенты обоих полов с PRRD, пригодные для лечения пневматической ретинопексией. Инъекцией в стекловидное тело им вводили 0,3 мл состава мочевины из таблицы II (VRT-1001, Vitreoritinal Technologies Inc., Irvine, CA, USA); на следующий день проводили пневматическую ретинопексию при использовании 0,4 мл 100% C3F8. Для "запаивания" отслойки сетчатки настолько скоро, насколько это возможно, использовали аргонный лазер. Контроль за пациентами осуществлялся методами биомикроскопии, фотографирования задней части сетчатки и ангиографии сетчатки (FAG), ультразвука (USG) и электроретинографии (ERG); контроль осуществляли до проведения указанной выше процедуры, а также спустя 1, 7, 15, 30 и 90 суток после нее. Регистрировалась также острота зрения (VC), внутриглазное давление (IOP), размещение поражений сетчатки, статус стекловидного тела, повторная применимость на сетчатке, осложнения или побочные действия. После наблюдения в течение 3 месяцев полная и стабильная применимость на сетчатке рассматривалась как успех.
Была произведена оценка состояния глаз 12 пациентов с первичной самопроизвольно возникшей отслойкой сетчатки. Возраст пациентов составлял от 27 до 60 лет (среднеарифметическое значение 45,8±9,7). У 58,3% пациентов не было отсоединения задней части стекловидного тела, а у 41,7% пациентов (согласно данным ультразвукового анализа) имелась частичное отсоединение верхней задней части стекловидного тела. После инъекции VRT-1001 в глаза у всех пациентов происходило полное отсоединение задней части стекловидного тела (у 75% наблюдался коллапс, а у 25% - нет). За все время наблюдения для всех случаев достигнута стабильная и полная повторная применимость на сетчатке после пневматической ретинопексии. В 50% случаев конечная острота зрения составляла 20/40 или выше (р<0,01), исходная острота зрения сохранена в 8,3% случаев. Для 8,3% пациентов произошло улучшение зрения на 1 строку, а у 83,4% - на 2 строки. Никаких изменений внутриглазного давления не наблюдалось (среднеарифметическое значение 13,4±3 мм Hg). Электроретинография была ниже нормальной (что и ожидалось после отсоединения сетчатки), при этом нет доказательств токсичности для сетчатки, а улучшение происходило к концу исследования. По данным ангиографии никаких изменений сетчатки не наблюдалось. Имелись незначительные осложнения, но они рассосались за несколько суток. Никаких сведений о побочных эффектах не было.
Описанные здесь способы показывают, что содержащие мочевину составы пригодны в качестве адъювантов при пневматической ретинопексии для увеличения успешности повторной применимости на сетчатке.
Пример IV
Лечение кровоизлияния в стекловидное тело
Составы и способы лечения, раскрываемые здесь, эффективны также для лечения кровоизлияния в стекловидное тело. В этом примере проводилось лечение 7 пациентов с кровоизлияниями в стекловидное тело, не поддающимися просветлению и связанные с диабетом. Каждый пациент получал однократную инъекцию в стекловидно тело 100 мкл состава, содержащего мочевину. Используемый в этом примере состав содержал 6% мочевины, 0,9% хлорида натрия и стерильную воду для инъекций (qs 100%).
У всех 7 пациентов наблюдалось просветление кровоизлияния в стекловидное тело; это просветление было достаточно для лечения сетчатки методом фотокоагуляции, лечение осуществляли в течение 2-4 недель после проведенной инъекции. Скорость очистки стекловидного тела от геморрагической крови оказалась существенно больше, чем наблюдаемое в клинической практике скорость при стандартных технологиях.
Пример V
Лечение, являющееся вспомогательным к операции на стекловидном теле
Раскрываемые здесь растворы можно вводить инъекцией в стекловидное тело в целях индукции только фармакологического витреолиза, или эти растворы можно использовать как вспомогательные вещества при операции на стекловидном теле.
В этом примере 5 пациентам, по различным показаниям нуждающимся в операции на стекловидном теле, в течение 1 недели до этой операции однократно проводили инъекцию внутрь стекловидного тела 100 мкл мочевины в водном растворе. Указанный состав содержал 6% мочевины, 0,9% хлорида натрия и стерильную воду для инъекций (qs 100%). Спустя 8-10 дней после инъекции мочевины всем пациентам была сделана операция на стекловидном теле по стандартной методике. Минимальное время ожидания между инъекцией мочевины и операцией составило от 1 до 3 суток.
Отмечено, что у пациентов, которые получали инъекцию мочевиной в стекловидное тело, спустя 1 неделю после этой инъекции (т.е. во время операции на стекловидном теле) произошло полное разжижение стекловидного тела и коллапс. В отличие от пациентов, которым до проведения операции не делали инъекцию мочевиной в стекловидное тело, разжижение стекловидного тела у пациентов, получавших мочевину, осуществлялось до такой степени, при которой тракция стекловидного тела на сетчатке снижалась полностью или до значительной степени, что давало возможность хирургу удалить все стекловидное тело путем аспирации шприцем. Никакой инструмент для разрезания стекловидного тела не применялся. В этом примере также введение составов, содержащих мочевину, привело к 70% уменьшению времени операции по сравнению со временем операции у пациентов, не получавших мочевину.
Пример VI
Лечение диабетической ретинопатии
Документально подтверждена связь низкого процента прогрессивной ретинопатии у субъектов с разжижением стекловидного тела и полным отсоединением задней части стекловидного тела (спонтанное или хирургически вызванное) со значительным риском быстро распространяющейся пролиферации новых кровеносных сосудов у пациентов, имеющих только частичное отсоединение задней части стекловидного тела; эти данные касаются как диабетиков (Tagawa, H. et al.Opthalmology, 1986; 93:596-601; Tagawa, H. et al.Opthalmology, 1993; 93:1188-1192), так и пациентов с окклюзией центральных вен (Hikichi Т. et al., RETINA, 1995; 15:29-33) или с окклюзией вен мозга (Kado M. et al., Am. J. of Opthalmology,1988; 105:20-24). Гистопатологические исследования предполагают, что кортикальная часть стекловидного тела может обеспечить клеточный каркас для неоваскуляризации сетчатки при диабетической ретинопатии, а также других ретиноваскулярных нарушениях.
Поэтому важную стратегию ведения диабетиков в той фазе, когда еще не возникла пролиферация, для их защиты от предстоящей васкуляризации сетчатки или диска зрительного нерва может обеспечить способность профилактически разжижать стекловидное тело, сильно ослабить клеточный каркас и вызвать отсоединение задней части стекловидного тела.
Инъекция мочевины в стекловидное тело приводит к распаду гиалуроновой кислоты стекловидного тела и разжижению самого стекловидного тела в течение нескольких суток. Кроме этого, после проведения терапии мочевиной наблюдалось отсоединение задней части стекловидного тела у людей (при использовании биомикроскопии на щелевой лампе) и у кроликов (с помощью специальной гистологической методики).
Способ лечения и/или предотвращения диабетической ретинопатии включает стадию введения пациенту состава или композиции, содержащей мочевину.
Каждому из 69 пациентов с непролиферативной диабетической ретинопатией проводили однократную инъекцию в стекловидное тело 50 мкл состава, включающего 3% мочевины, 0,9% хлорида натрия и стерильную воду для инъекций.
У всех 69 пациентов в течение 2-4 недель после введения состава происходило полное разжижение и коллапс стекловидного тела. Такое полное разжижение и коллапс стекловидного тела у пациентов с непролиферативной ретинопатией должно подавить рост и пролиферацию кровеносных сосудов, и, таким образом, подавить развитие диабетической ретинопатии. Наблюдение за всеми 69 пациентами осуществлялось в течение 6 месяцев после проведения манипуляций.
Пример VII
Лечение пигментной дегенерации сетчатки
В соответствии с настоящим изобретением мочевина, тиомочевина, гуанидин, а возможно, другие соединения, представленные приведенной выше общей формулой I, могут обеспечивать нейропротекторный/нейрорегенеративный эффект.В этом частном примере для демонстрации нейропротекторного эффекта использовали пациентов, страдающих пигментной дегенерацией сетчатки.
На 32 пациентах с пигментной дегенерацией сетчатки проводили рандомизированное изучение с повышением дозы при двойном замаскированном контроле плацебо. Всем пациентам однократной инъекцией в стекловидное тело вводили 50 мкл состава, содержащего мочевину. Три группы пациентов получали различные концентрации мочевины. Первая группа получала состав, содержащий 1,5% мочевины, 0,9% хлорида натрия и стерильную воду для инъекций. Вторая группа пациентов получала идентичный состав, в котором содержание мочевины составляло 3,0%. Третья группа получала идентичный состав, в котором содержание мочевины составляло 6,0%. Группа плацебо получала 50 мкл 0,9% хлорида натрия.
47% пациентов сообщили об улучшении остроты зрения по крайней мере на 3 строки согласно измерениям по таблицам ETDRS, в то время как только 14% пациентов, принимавших плацебо, сообщили об улучшении остроты зрения по крайней мере на 3 строки согласно измерениям по тем же таблицам.
Улучшения, продемонстрированные пациентами, получавшими мочевину, соответствовали увеличению поля зрения этих пациентов в среднем на 10 градусов. В изучении с использованием двойного замаскированного контроля плацебо нейропротекторный/нейрорегенеративные эффекты составов мочевины были продемонстрированы тем, что: а) острота зрения у пациентов, принимавших лечение мочевиной, увеличилась на 47%; б) у тех же пациентов произошло расширение или увеличение поля зрения. У пациентов, принимавших под контролем плацебо, не произошло никакого сильного увеличения поля зрения.
Пример VIII
Лечение невропатии
В соответствии с настоящим изобретением мочевина, производные мочевины, тиомочевина, производные тиомочевины, гуанидин, производные гуанидина, а также соединения, представленных приведенной выше общей формулой I, эффективны для лечения невропатии (например, расстройства нервной системы или повреждения нервов). В этом примере 33 незрячим пациентам с повреждением зрительного нерва (вызванного травмой и/или глаукомой) и остротой зрения, характеризующейся восприятием света или его отсутствием, вводили раскрываемый здесь состав, содержащий мочевину. Проводили рандомизированное изучение с повышением дозы под двойным замаскированным контролем плацебо; в эксперименте участвовало 33 пациента с повреждением зрительного нерва. Пациенты были рандоминизированы по 5 группам: 1 группу составляло 5 пациентов, 2 группу составляло 4 пациента, 3 группу составляло 8 пациентов, 4 группу составляло 8 пациентов и 5 группу составляло 8 пациентов. Каждому из пациентов проводили однократную инъекцию в стекловидное тело 50 мкл лечебного водного раствора по схеме, указанной в приведенной ниже таблице:
У 43% пациентов наблюдалось улучшение корректировки остроты зрения согласно измерениям по таблицам ETDRS. У 6 пациентов, не воспринимавших свет, произошло улучшение зрения до световосприятия. Два пациента, обладавших только световосприятием, смогли произвести подсчет пальцев с расстояния в 12 дюймов, у двух пациентов, не воспринимавших свет, острота зрения повысилась до 20/400 и 20/800, а у двух пациентов со световосприятием острота зрения повысилась до 20/600 и 20/800. Ни у одного из пациентов в группе, принимавшей плацебо, не произошло никакой коррекции остроты зрения (согласно измерениям по таблицам ETDRS).
В другом исследовании проводилось лечение трех пациентов с длительным (6 месяцев и больше) повреждением зрительного нерва, родственным раку зрительного нерва; лечение проводили однократной инъекцией в стекловидное тело 100 мкл состава, содержащего 6% мочевины. По окончании лечения все три пациента сообщили о значительном улучшении зрения, острота их зрения повысилась от возможности подсчитать пальцы с расстояния в 12 дюймов до 20/200.
Пример IX Лечение рубеоза
В соответствии с настоящим изобретением для лечения рубеоза могут быть эффективными: мочевина, тиомочевина, гуанидин, и другие соединения, представленные приведенной выше общей формулой I, и/или эти соединения в сочетании с нестероидными противовоспалительными лекарственными средствами (например, кеторалак, диклофенак, фторбипрофен, ибупрофен и т.п.). В этом примере пациенту, страдающему рубеозом, производили однократную инъекцию в стекловидное тело 100 мкл водного раствора, содержащего 6,0 вес.% мочевины, 0,9 вес.% хлорида натрия, а также 0,2 вес.% кеторалака в стерильной воде для инъекций (qs 100%). У пациента отмечалась очень хорошая корректировка остроты зрения и сильное уменьшение неоваскуляризации радужки, что зарегистрировано по результатам ангиографии до проведения инъекции мочевины/кетеролака и после этой инъекции.
Пример Х
Лечение диабетического отека желтого пятна
В соответствии с настоящим изобретением для лечения диабетического отека желтого пятна могут быть эффективными: мочевина, тиомочевина, гуанидин, и другие соединения, представленные приведенной выше общей формулой I, и/или эти соединения в сочетании с нестероидными противовоспалительными лекарственными средствами (например, кеторалак, диклофенак, фторбипрофен, ибупрофен и т.п.). В этом примере пациенту с диабетическим отеком желтого пятна, (родственному диабетической ретинопатии) производили однократную инъекцию в стекловидное тело 100 мкл водного раствора, содержащего 6,0 вес.% мочевины, 0,9 вес.% хлорида натрия, а также 0,07 вес.% кеторалака в стерильной воде для инъекций (qs 100%). На протяжении 8 недельного курса мониторинга у пациента отмечалось очень хорошее увеличение остроты зрения, составляющее по крайней мере 3 строчки согласно измерениям по таблицам ETDRS.
Квалифицированным в данной области людям должно быть понятно, что приведенные здесь конкретные примеры и варианты настоящего изобретения не ограничивают его. Настоящее изобретение можно применить на практике, используя широкий диапазон замен эквивалентных условий, составов и других параметров, не влияющих на границы настоящего изобретения или на любой его вариант.
На все цитируемые здесь публикации ссылки даны полностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВА ДЛЯ ВВЕДЕНИЯ В СТЕКЛОВИДНОЕ ТЕЛО ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ЗАБОЛЕВАНИЙ ГЛАЗ | 2000 |
|
RU2286157C2 |
| Способ навигационного лазерного лечения регматогенных периферических дегенераций сетчатки (варианты) | 2023 |
|
RU2812202C1 |
| СПОСОБ ЛЕЧЕНИЯ ПЕРИФЕРИЧЕСКИХ РЕТИНАЛЬНЫХ РАЗРЫВОВ, ОСЛОЖНЕННЫХ ВИТРЕАЛЬНОЙ ТРАКЦИЕЙ И СУБКЛИНИЧЕСКОЙ ОТСЛОЙКОЙ СЕТЧАТКИ | 2006 |
|
RU2325884C2 |
| Способ профилактики макулярного разрыва у больных с витреомакулярным тракционным синдромом 1а-1б стадии при наличии макулярного разрыва на парном глазу | 2018 |
|
RU2676606C1 |
| ПРИМЕНЕНИЕ АНТАГОНИСТА VEGF ПРИ ЛЕЧЕНИИ ХОРИОРЕТИНАЛЬНЫХ НЕОВАСКУЛЯРНЫХ НАРУШЕНИЙ И НАРУШЕНИЙ ПРОНИЦАЕМОСТИ У ПЕДИАТРИЧЕСКИХ ПАЦИЕНТОВ | 2014 |
|
RU2676274C2 |
| Способ комбинированного лазерного лечения клапанных разрывов сетчатки с витреоретинальным сращением по всей площади ретинального клапана | 2016 |
|
RU2625778C1 |
| Способ определения витреоретинальной тракции при периферических дегенерациях сетчатки | 2024 |
|
RU2826769C1 |
| АНТАГОНИСТЫ ИНТЕГРИНОВЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2721907C2 |
| Лечение глазных болезней типа дегенерации желтого пятна, глаукомы и диабетической ретинопатии с помощью лекарственных средств, устраняющих стареющие клетки | 2018 |
|
RU2815482C2 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ МАКУЛЯРНОГО ОТЕКА ПОСЛЕ ФАКОЭМУЛЬСИФИКАЦИИ КАТАРАКТЫ | 2010 |
|
RU2453297C2 |
Изобретение относится к медицине, а именно к офтальмологии, и может быть использовано при лечении зрительной невропатии или повреждении зрительного нерва человека или животного. Для этого в стекловидное тело глаза инъекционно вводят препарат, содержащий эффективное количество мочевины или производных мочевины. Предлагается также использование мочевины или ее производных при изготовлении стабилизированных водных растворов для инъекции в стекловидное тело. Изобретение обеспечивает исключение витреоретинальной тракции и позволит отделить внутреннюю ограничительную мембрану сетчатки от кортикальной части стекловидного тела за счет разжижения эндолимфы стекловидного тела. 2 н. и 17 з.п. ф-лы, 5 табл.
| ARROYO М.Н | |||
| et al | |||
| Silicone oil as a delivery vehicle for BCNU in rabbit proliferative vitreoretinopathy// Retina | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| ПРИМЕНЕНИЕ АНТАГОНИСТА ВЕЩЕСТВА Р ДЛЯ ЛЕЧЕНИЯ ЗУДА, ОКУЛЯРНЫХ И/ИЛИ ПАЛЬПЕБРАЛЬНЫХ БОЛЕЙ, И ОКУЛЯРНЫХ ИЛИ ПАЛЬПЕБРАЛЬНЫХ ДИЗЕСТЕЗИЙ | 1995 |
|
RU2135165C1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| ДАНИЛИЧЕВ В.Ф | |||
| Патология глаз | |||
| Ферменты и ингибиторы | |||
| - СПб | |||
| Предохранительное устройство для паровых котлов, работающих на нефти | 1922 |
|
SU1996A1 |
| LIU H.S | |||
| et al | |||
| Tolerance of normal rabbit eyes to the antineoplastic carmustine// Ophthalmologica | |||
| Способ получения фтористых солей | 1914 |
|
SU1980A1 |
Авторы
Даты
2008-11-27—Публикация
2003-02-13—Подача