Изобретение относится к области химии лекарственных средств, а именно к получению (S)-5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1Н-бензо[d]имидазола (эзомепразола) общей формулы I и/или его соли.
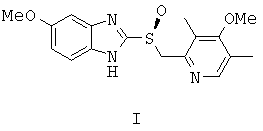
Эзомепразол (I), современный высокоэффективный противоязвенный препарат, является (S)-энантиомером омепразола и значительно превосходит последний по клиническому эффекту [Лапина Т.Л. Клиническая фармакология и терапия, 2002, 11, №2].
Единственным доступным эффективным методом получения эзомепразола (I) до 1996 г. было разделение рацемической смеси [Erlandsson P., Isaksson R., Lorentzon P., Lindberg P.J. Chromatogr. 1990, 532, 305; Kohl В., Senn-Bilfinger J. DE 4035455 (1990); Lindberg P., von Unge, S. WO 9427988 (1994); Deng J., Chi Y., Fu F., Cui X., Yu K., Zhu J., Jiang Y. Tetrahedron: Asymmetry, 2000, 11, 1729]. В 1996 г.был предложен способ энантиоселективного окисления 5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилтио)-1H-бензо[d]имидазола (II) в эзомепразол (I) [Larsson E.M., Stenhede U.J., Sorensen Н., von Unge Р. О. S., Cotton H.К. WO 9602535 (1996)], включавший в себя приготовление каталитического комплекса изопропилата титана (IV), D-диэтилтартрата (D-DET) и воды в присутствии сульфида (II), выдерживание полученного каталитического комплекса при повышенной температуре (до добавления окислителя), проведение реакции в присутствии основания, предпочтительно N,N-диизопропилэтиламина, в качестве окислителя использовался гидропероксид кумола (СНР), а растворителя - толуол, катализатор использовался в количестве 30 мольных % (схема 1). После обработки (экстракция водным раствором аммиака, подкисление водного слоя уксусной кислотой, экстракция метилизобутилкетоном), получения натриевой соли и перекристаллизации из ацетонитрила был получен эзомепразол (I) с выходом до 55%. Аналогично могут быть получены и другие, родственные эзомепразолу, оптически активные дигетарилсульфиды. Этот способ выбран нами в качестве прототипа.
Схема 1.
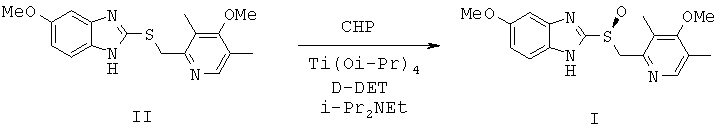
Дальнейшие исследования в этой области в основном сосредоточились на изменениях в обработке реакционной смеси с целью повышения качества получаемого продукта и практически не затрагивали стадии энантиоселективного окисления [Hashimoto H., Maruyama H. WO 2001087874 (2001); Hashimoto H., Urai T. WO 2001083473 (2001)]. В патенте [Kawada M., Yamano Т., Taya N. WO 2001014366 (2001)] к реакционной смеси были дополнительно добавлены молекулярные сита 3А. Замена хирального диола D-DET на монодентантный лиганд - метиловый эфир (S)-(+)-миндальной кислоты, также позволила получить эзомепразол (I), но со значительно меньшим выходом [Thennati R., Rehani R.B., Soni R.R., Chhabada V.C., Patel V.M. WO 2003089408 (2003)].
Задачей изобретения является создание способа получения эзомепразола I и/или его соли, позволяющего получать целевой продукт с высоким выходом и оптической чистотой.
Поставленная задача решается способом, заключающимся в асимметрическом окислении 5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилтио)-1H-бензо[d]имидазола (II) органическими пероксидами (предпочтительно гидропероксидом кумола) в органическом растворителе (предпочтительно в толуоле) в присутствии хирального каталитического комплекса, образующегося из хирального диола (предпочтительно D-диэтилтартрата), хирального амина (предпочтительно N,N-диметил-(R)-1-фенилэтиламина) и соединения титана (IV) (предпочтительно изопропилата титана (IV)). N,N-Диметил-(R)-1-фенилэтиламин может быть получен метилированием (R)-1-фенилэтиламина по любой из существующих методик, например, водной муравьиной кислотой [I.Angres, Н.Е.Zieger. J.Org. Chem.; 1975; 40(10); 1457-1460].
Заявляемый способ позволяет существенно повысить выход целевого эзомепразола (I) и/или его соли.
Изобретение иллюстрируется следующими примерами.
Пример 1. Асимметрический синтез (S)-5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1Н-бензо[d]имидазола (эзомепразола) (I) и его натриевой соли с использованием комплекса хиральных лигандов D-диэтилтартрата и N,N-диметил-(R)-1-фенилэтиламина.
К суспензии 0.545 г (1.66 ммоль) 5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилтио)-1Н-бензо[d]имидазола (II) в 2.5 мл толуола при 55°С добавили 9 мкл (0.50 ммоль) воды, 0.240 г (1.16 ммоль) D-диэтилтартрата и 0.220 г (0.77 ммоль) изопропилата титана (IV), перемешивали 1 ч при 55°С. Реакционную смесь охладили до 30°С и прибавили 0.120 г (0.81 ммоль) N,N-диметил-(R)-1-фенилэтиламина, перемешивали 15 мин, затем добавили 0.270 мкл гидропероксида кумола (86.5%-ный раствор в кумоле, 1.58 ммоль). Реакционную смесь перемешивали 4.5 ч при 30°С. Раствор экстрагировали водным аммиачным раствором (12.5% NH3, 3×3 мл). К объединенным водным фазам добавили 3 мл хлористого метилена, нейтрализовали уксусной кислотой, органическую фазу отделили, водную экстрагировали хлористым метиленом (2×5 мл). Растворитель отогнали, получили 0.537 г смеси, содержащей, по данным ВЭЖХ, 82.3% сульфоксида, 8.8% сульфида и не более 0.3% сульфона, оптическая чистота сульфоксида составила 83.8%.
Для получения натриевой соли к раствору 0.440 г полученной смеси в 3.5 мл ацетонитрила добавили раствор 0.070 г NaOH в 0.075 мл воды, перемешивали 1 ч при комнатной температуре. Выпавший осадок отфильтровали, промыли ацетоном, высушили на фильтре. Получили 0.320 г натриевой соли (S)-5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1Н-бензо[d]имидазола (эзомепразола) (I), общий выход, с учетом доли сырого продукта, взятого для получения соли, составил 64%, оптическая чистота более 99.5%.
Спектр ЯМР 1Н натриевой соли (S)-5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1Н-бензо[d]имидазола (эзомепразола) (I) совпал со спектром этого соединения, опубликованным ранее в литературе [Hanna Cotton, Thomas Elebring, Magnus Larsson, Lanna Li, Henrik Sorensen and Sverker von Unge, Tetrahedron: Asymmetry 11 (2000) 3819-3825].
Пример 2. Асимметрический синтез (S)-5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1Н-бензо[d]имидазола (эзомепразола) (I) и его натриевой соли с использованием комплекса хиральных лигандов D-диэтилтартрата и N,N-диметил-(S)-1-фенилэтиламина.
К суспензии 0.545 г (1.66 ммоль) 5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилтио)-1Н-бензо[d]имидазола (II) в 2.5 мл толуола при 55°С добавили 9 мкл (0.50 ммоль) воды, 0.240 г (1.16 ммоль) D-диэтилтартрата и 0.220 г (0.77 ммоль) изопропилата титана (IV), перемешивали 1 ч при 55°С. Реакционную смесь охладили до 30°С, прибавили 0.120 г (0.81 ммоль) N,N-диметил-(S)-1-фенилэтиламина, перемешивали 15 мин, затем добавили 0.270 мкл гидропероксида кумола (86.5%-ный раствор в кумоле, 1.58 ммоль). Реакционную смесь перемешивали 4.5 ч при 30°С. Раствор экстрагировали водным аммиачным раствором (12.5% NH3, 3×3 мл). К объединенным водным фазам добавили 3 мл хлористого метилена, нейтрализовали уксусной кислотой, органическую фазу отделили, водную экстрагировали хлористым метиленом (2×5 мл). Растворитель отогнали, получили 0.514 г смеси, содержащей, по данным ВЭЖХ, 82.4% сульфоксида и не более 0.3% сульфона, оптическая чистота сульфоксида составила 79%.
Для получения натриевой соли к раствору 0.498 г полученной смеси в 4 мл ацетонитрила добавили раствор 0.070 г NaOH в 0.075 мл воды, перемешивали 1 ч при комнатной температуре. Выпавший осадок отфильтровали, промыли ацетоном, высушили на фильтре. Получили 0.335 г натриевой соли (S)-5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1Н-бензо[d]имидазола (эзомепразола) (I), общий выход, с учетом доли сырого продукта, взятого для получения соли, составил 57%, оптическая чистота более 99.5%.
Пример 3. Асимметрический синтез (S)-5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1Н-бензо[d]имидазола (эзомепразола) (I) и его натриевой соли с использованием комплекса хиральных лигандов D-диэтилтартрата и N,N-диметил-(R)-1-фенилэтиламина при 35°С.
К суспензии 0.530 г (1.61 ммоль) 5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилтио)-1Н-бензо[d]имидазола (II) в 2.5 мл толуола при 50°С добавили 10 мкл (0.56 ммоль) воды, 0.240 г (1.16 ммоль) D-диэтилтартрата и 0.200 г (0.70 ммоль) изопропилата титана (IV), перемешивали 1 ч при 50°С. Реакционную смесь охладили до 35°С и прибавили 0.120 г (0.81 ммоль) N,N-диметил-(R)-1-фенилэтиламина, перемешивали 15 мин, затем добавили 0.260 мкл гидропероксида кумола (86.5%-ный раствор в кумоле, 1.52 ммоль). Реакционную смесь перемешивали 4 ч при 35°С. Раствор экстрагировали водным аммиачным раствором (12.5% NH3, 3×3 мл). К объединенным водным фазам добавили 3 мл метилизобутилкетона, нейтрализовали уксусной кислотой, органическую фазу отделили, водную экстрагировали метилизобутилкетоном (2×5 мл). Растворитель отогнали, получили 0.490 г смеси, содержащей, по данным ВЭЖХ, 81.3% сульфоксида, 7.5% сульфида и не более 0.3% сульфона, оптическая чистота сульфоксида составила 82.2%.
Пример 4. Асимметрический синтез (S)-5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1Н-бензо[d]имидазола (эзомепразола) (I) и его натриевой соли с использованием комплекса хиральных лигандов D-диэтилтартрата и N,N-диметил-(R)-1-фенилэтиламина при 25°С.
К суспензии 0.560 г (1.70 ммоль) 5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилтио)-1Н-бензо[d]имидазола (II) в 3 мл толуола при 53°С добавили 10 мкл (0.56 ммоль) воды, 0.260 г (1.26 ммоль) D-диэтилтартрата и 0.200 г (0.70 ммоль) изопропилата титана (IV), перемешивали 1 ч при 50°С. Реакционную смесь охладили до 35°С и прибавили 0.130 г (0.87 ммоль) N,N-диметил-(R)-1-фенилэтиламина, перемешивали 25 мин, затем добавили 0.280 мкл гидропероксида кумола (86.5%-ный раствор в кумоле, 1.64 ммоль). Реакционную смесь перемешивали 6 ч при 25°С. Раствор экстрагировали водным аммиачным раствором (12.5% NH3, 3×4 мл). К объединенным водным фазам добавили 3 мл хлористого метилена, нейтрализовали уксусной кислотой, органическую фазу отделили, водную экстрагировали хлористым метиленом (2×5 мл). Растворитель отогнали, получили 0.542 г смеси, содержащей, по данным ВЭЖХ, 74.3% сульфоксида, 14.4% сульфида и не более 0.3% сульфона, оптическая чистота сульфоксида составила 81.7%.
Энантиомерный избыток определяли с помощью хиральной ВЭЖХ на колонке Kromasil CHI-DMB (75×2 мм), элюент 10%-ный раствор изопропилового спирта в гексане, скорость подачи 100 мкл/мин, детектируемая длина волны 210 нм. Время удержания (S)-энантиомера составляет 6.1 мин, (R)-энантиомера - 7.5 мин.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНОГО 5-МЕТОКСИ-2-((4-МЕТОКСИ-3,5-ДИМЕТИЛПИРИДИН-2-ИЛ)МЕТИЛСУЛЬФИНИЛ)-1Н-БЕНЗО[d]ИМИДАЗОЛА | 2007 |
|
RU2341524C1 |
| СПОСОБЫ СИНТЕЗА ЗАМЕЩЕННЫХ СУЛЬФОКСИДОВ | 1995 |
|
RU2157806C2 |
| ЭНАНТИОСЕЛЕКТИВНЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ СУЛЬФОКСИДОВ | 2005 |
|
RU2380357C2 |
| СПОСОБ ПОЛУЧЕНИЯ ОМЕПРАЗОЛА | 1998 |
|
RU2211218C2 |
| КАЛИЕВАЯ СОЛЬ (S)-ОМЕПРАЗОЛА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ЕЕ ОСНОВЕ | 2000 |
|
RU2237666C2 |
| Способ получения производных пиридина или их фармацевтически приемлемых солей | 1987 |
|
SU1780535A3 |
| ПРОИЗВОДНЫЕ ПИРИДИНА | 1992 |
|
RU2035461C1 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОЛЕКАРСТВ ИНГИБИТОРОВ ПРОТОННОГО НАСОСА | 2003 |
|
RU2292342C2 |
| СПОСОБ ОПТИЧЕСКОЙ ОЧИСТКИ ЭНАНТИОМЕРНО ОБОГАЩЕННЫХ ПРОИЗВОДНЫХ БЕНЗИМИДАЗОЛА | 1996 |
|
RU2144031C1 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ПРОЛЕКАРСТВО ИНГИБИТОРА ПРОТОННОГО НАСОСА | 1999 |
|
RU2232159C2 |
Изобретение относится к способу получения (S)-5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил)-1Н-бензо[d]имидазола (эзомепразола) и/или его соли, которые используются в медицине в качестве противоязвенного средства. Способ заключается в энантиоселективном окислении органическими пероксидами 5-метокси-2- ((4-метокси-3,5-диметилпиридин-2-ил)метилтио)-1Н-бензо[d]имидазола в присутствии каталитического комплекса титана (IV) с одновременно двумя различными хиральными лигандами: хиральный диол (предпочтительно D-диэтилтартрат) и хиральный амин (предпочтительно N,N-диметил-(R)-1-фенилэтиламин). Способ позволяет существенно повысить выход целевого эзомепразола (I) и/или его соли.
Способ получения эзомепразола формулы (I) и/или его соли
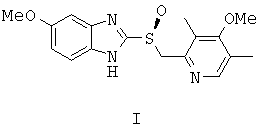
путем энантиоселективного окисления органическими пероксидами 5-метокси-2-((4-метокси-3,5-диметилпиридин-2-ил)метилтио)-1Н-бензо[d]имидазола формулы (II)
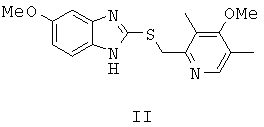
в органическом растворителе в присутствии каталитического комплекса титана (IV) с хиральными лигандами, отличающийся тем, что используются одновременно два разных хиральных лиганда - хиральный диол (предпочтительно D-диэтилтартрат) и хиральный амин (предпочтительно N,N-диметил-(R)-1-фенилэтиламин).
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| ФОРМА ОМЕПРАЗОЛА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2286991C2 |
| УСОВЕРШЕНСТВОВАННЫЙ СПОСОБ СИНТЕЗА 5-МЕТОКСИ-2-[(4-МЕТОКСИ-3,5-ДИМЕТИЛ-2-ПИРИДИЛ)МЕТИЛ]СУЛЬФИНИЛ-1Н-БЕНЗИМИДАЗОЛА | 1999 |
|
RU2197486C2 |
| WO 00/02876 А, 20.01.2000. | |||
Авторы
Даты
2008-11-27—Публикация
2007-04-12—Подача