Описываются производные пиридина, проявляющие активность при лечении или профилактике язв пищеварительного тракта.
Язвы желудка и двенадцатиперстной кишки, известные собирательно как пептические язвы, представляют собой локализованные изъязвления слизистой оболочки двенадцатиперстной кишки или желудка соответственно, которые подвергают нижележащие слои кишечной стенки воздействию кислотных секреций желудка и протеолитического фермента пепсина. Полагают, что они обязаны своим происхождением автолизу, который возникает при нарушении баланса между агрессивными факторами, такими как кислота или пепсин, и защитными факторами, такими как резистентность слизистых оболочек, слизистая секреция, кровоток или регуляция двенадцатиперстной кишки. Пептические изъязвления являются наиболее общим заболеванием желудочно-кишечного тракта и по оценке специалистов приблизительно от 10 до 20% взрослого мужского населения сталкиваются с пептической язвой в тот или иной период своей жизни.
Пептические язвы лечат или предупреждают в принципе медикаментозным лечением и предложено много фармакотерапевтических средств, среди которых имеются медикаменты с высокой степенью эффективности.
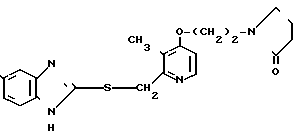
Клинически полезные медикаменты включают Н2-блокирующие средства, такие как циметидин и ранитидин, в качестве противоязвенных препаратов. Замечено, что ингибиторы Н+-К+-аденозинтрифосфатазы, фермента, специфически присутствующего в пристеночных клетках желудка, могут эффективно ингибировать секрецию желудочной кислоты у млекопитающих, включая человека, поэтому ожидают, что новый класс противоязвенных средств с этой точки зрения обретает существование. Более конкретно предложено было большое разнообразие соединений, имеющих бензимидазольную структуру. Среди этих соединений находится омепразол, в настоящее время находящийся в активной разработке, как наиболее обещающее соединение [1] В этом патенте описаны соединения с метоксигруппой в 4-м положении пиридинового кольца, и среди них омепразол, имеющий формулу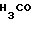
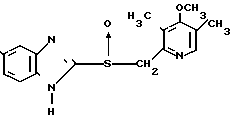 далее 2-(4-метоксиэтоксипиридин-2-ил)метилсульфинил-5-метил-1Н-бензимидазол, приведенный в примере получения.
далее 2-(4-метоксиэтоксипиридин-2-ил)метилсульфинил-5-метил-1Н-бензимидазол, приведенный в примере получения.
Известны родственные соединения бензимидазольного типа, обладающие противоязвенной активностью, в которых 4-е положение пиридинового кольца замещено алкоксиалкоксигруппой, в которой каждая алкоксигруппа содержит 1-2 углеродных атома. В примере этого патента описан 2-(3,5-диметил-4-метоксиэтоксипиридин-2- ил)метилсульфинил-5- фенил-1Н-бензимидазол. Описаны также другие замещения в различных положениях бензимидазольного и пиридинового колец. Данные биологических испытаний свидетельствуют о значительных биологических эффектах или секреции желудочной кислоты как на культуре клеток (в изолированных клетках), так и на лабораторных животных, когда 4-е положение пиридинового кольца замещено метоксигруппой.
Известны другие соединения имидазольного типа, в которых заместителем в 4-м положении пиридинового кольца является бензилоксигруппа [2]
Настоящее изобретение раскрывает класс новых соединений, обладающих более высокой противоязвенной активностью, чем омепразол, который в настоящее время расценивается как наиболее значительное соединение среди соединений бензимидазольного типа, обладающих противоязвенной активностью. В результате интенсивных исследований было установлено, что соединения, представленные формулой I, являются более сильнодействующими в подавлении секреции желудочной кислоты в сравнении с омепразолом. Настоящее изобретение создано на основе этого открытия.
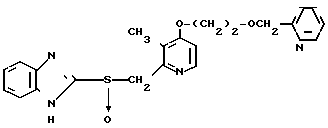
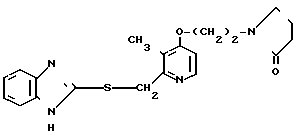
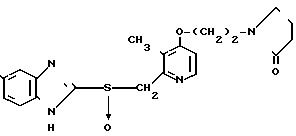
Настоящее изобретение включает класс производных пиридина, представленных общей формулой I: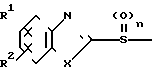 CH
CH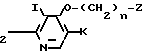 (I) в которой R1 и R2 могут быть одинаковыми или различными, и каждый представляет собой атом водорода, низший алкил, низшую алкоксигруппу, галоидированный низший алкил, низший алкоксикарбонил или карбоксильную группу, или атом галогена, Х означает группу, представленную формулой: -0, -S- или
(I) в которой R1 и R2 могут быть одинаковыми или различными, и каждый представляет собой атом водорода, низший алкил, низшую алкоксигруппу, галоидированный низший алкил, низший алкоксикарбонил или карбоксильную группу, или атом галогена, Х означает группу, представленную формулой: -0, -S- или 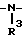 (в которой R3 является атомом водорода или низшим алкилом, фенилом, бензилом или низшей алкоксикарбонильной группой),
(в которой R3 является атомом водорода или низшим алкилом, фенилом, бензилом или низшей алкоксикарбонильной группой),
и А представляет:
1) группу формулы: -О (СН2)р-О,R4, где р целое число от 1 до 3, и R4 атом водорода или низший алкил, арил или аралкильная группа,
2) группу общей формулы: -О-(СН2)g-R5, где g целое число от 1 до 3, и R5 атом галогена или алкоксикарбонил, арил или гетероарильная группа,
3) группу общей формулы: -О-(СН)r-О)(СН2)S-О-R6 где r и S каждый независимо друг от друга представляет целое число от 1 до 5, а R6 атом водорода или низший алкил,
4) группу формулы
-N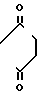
5) группу формулы
-N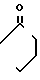
6) группу формулы
N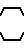 S
S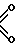
7) группу формулы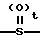 A где t целое число от нуля до 2, и А означает группу общей формулы:
A где t целое число от нуля до 2, и А означает группу общей формулы: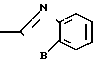 где В группа формулы: -NH-, -O- или -S-), низший алкил, алкоксикарбонилметил, пиридил или фурил или группу общей формулы:
где В группа формулы: -NH-, -O- или -S-), низший алкил, алкоксикарбонилметил, пиридил или фурил или группу общей формулы: (CH2)
(CH2)
8) группу общей формулы CH
CH в которой R8 ацетокси- или низший алкил, или
в которой R8 ацетокси- или низший алкил, или
9) группу общей формулы: -OR9, где R9 атом водорода или низший алкил или арил,
n целое число от 0 до 2, m целое число от 2 до 10 и
I и К, которые могут быть одинаковыми или различными, каждый представляет атом водорода или низший алкил, при условии, что когда Z группа, подпадающая под упомянутую выше категорию (9), R9 низшая алкильная группа,
m целое число от 3 до 10, и их фармацевтически приемлемые соли.
Те же определения для R1, R2, X, n, I, K, Z и m использованы в описании и в формуле изобретения.
В определении соединений общей формулы I низшая алкильная группа, упомянутая в связи с определением для R1, R2, R3, R4, R6, A, R7, R8, I и К в соединении I согласно изобретению, может представлять собой алкильную группу с прямой или разветвленной цепью, имеющей от 1 до 6 углеродных атомов. Примеры включают метил, этил, н-пропил, н-бутил, изобутил, изопропил, 1-метилпропил, трет-бутил, н-пентил, 1-этилпропил, изоамил и н-гексил, среди которых наиболее предпочтительны метильная и этильная группы.
Низшая алкоксигруппа и низшая алкоксичасть низшей алкоксикарбонильной группы, определенные выше в связи с R1 и R2, могут быть алкоксигруппой, производной от упомянутой выше низшей алкильной группы. Метокси- и этоксигруппы являются наиболее предпочтительными.
Атом галогена, определенный выше, включает хлор, бром, иод или фтор.
Арильная группа, определенная ранее в связи с R4 и R5, может быть фенилом, толилом, ксилилом, нафтилом или тому подобным, которая может быть замещена низшей алкокси- или гидроксильной группой, атомом галогена или тому подобным.
Примеры арилалкила, определенного ранее в связи с R4, включают бензильную и фенэтильную группу.
Примеры гетероарильной группы, определенной ранее в связи с R5, включают пиридильную и фурильную группы.
При определении Z в общей формуле I группы 1, 2, 3, 4, 5 и 9 являются предпочтительными. Наиболее предпочтительна группа 9. Что касается R1 и R2, то предпочтительны атомы водорода для обоих радикалов, а также сочетание низшего алкила, в числе которого метил, для R1 и водорода для R2. Х предпочтительно является -NH3, где R3 означает водород. Предпочтительное значение для n единицы. Предпочтительными значениями I и К являются оба водород, или когда I означает низший алкил, в числе которого находится метил, а К является атомом водорода, или когда I атом водорода, а К низший алкил, например, метил. Таким образом, I и К независимо друг от друга являются предпочтительно водородом или метилом, наиболее предпочтительно I представляет собой метил, а К водород.
Первый предпочтительный класс соединений среди соединений общей формулы I представлен следующей формулой А: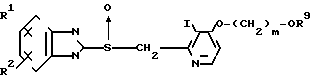 (где R1, R2, I, m и R9 имеют те же значения, которые определены для них ранее). В формуле А предпочтительными R1- и R2-заместителями являются оба атома водорода или R1 означает 5-низшую алкоксигруппу, 5-низший алкил или 5-галоидированный низший алкил, а R2 водород. Предпочтительным заместителем I является водород или метил, предпочтительное значение для m находится в интервале от 3 до 10, наиболее предпочтительным является 3, и предпочтительным R9-заместителем является низший алкил, между прочим метил или арил. Среди этих возможностей для соединений формулы А предпочтительным сочетанием является то, когда R1 и R2 оба представлены водородом, I означает метил, m равно 3 или R9 метил.
(где R1, R2, I, m и R9 имеют те же значения, которые определены для них ранее). В формуле А предпочтительными R1- и R2-заместителями являются оба атома водорода или R1 означает 5-низшую алкоксигруппу, 5-низший алкил или 5-галоидированный низший алкил, а R2 водород. Предпочтительным заместителем I является водород или метил, предпочтительное значение для m находится в интервале от 3 до 10, наиболее предпочтительным является 3, и предпочтительным R9-заместителем является низший алкил, между прочим метил или арил. Среди этих возможностей для соединений формулы А предпочтительным сочетанием является то, когда R1 и R2 оба представлены водородом, I означает метил, m равно 3 или R9 метил.
Второй группой предпочтительных соединений являются сочетания упомянутых заместителей, когда оба R1 и R2 являются водородом, I означает водород, m равно 3 и R9 метил.
Третьей группой предпочтительных соединений, подпадающих под формулу А, является та, когда оба R1 и R2 оба означают водород, I представляет собой метил, m равно двум или R9 бензил.
Второй класс соединений, подпадающих под общую формулу I, представлен следующей формулой В: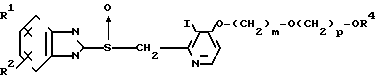 (в которой R1, R2, I, p, m и R4 имеют те же значения, которые были определены для них ранее). В формуле В предпочтительными заместителями R1 и R2 являются оба атома водорода, или когда R1 означает 5-низшую алкоксигруппу, 5-низший алкил или 5-галоидированный низший алкил, а R2 водород. Предпочтительное значение m от 2 до 3, предпочтительное значение для р 2 или 3, и предпочтительным заместителем R4 является метил или бензил. Из упомянутых возможностей для формулы В наиболее предпочтительным сочетанием является то, когда R1 представляет собой 5-метил, R2 водород, I метил, m равно 2, р равно 2 и R4 означает метил.
(в которой R1, R2, I, p, m и R4 имеют те же значения, которые были определены для них ранее). В формуле В предпочтительными заместителями R1 и R2 являются оба атома водорода, или когда R1 означает 5-низшую алкоксигруппу, 5-низший алкил или 5-галоидированный низший алкил, а R2 водород. Предпочтительное значение m от 2 до 3, предпочтительное значение для р 2 или 3, и предпочтительным заместителем R4 является метил или бензил. Из упомянутых возможностей для формулы В наиболее предпочтительным сочетанием является то, когда R1 представляет собой 5-метил, R2 водород, I метил, m равно 2, р равно 2 и R4 означает метил.
Примеры фармацевтически приемлемой соли включают соли неорганических кислот, такие как гидрохлориды, гидробромиды, сульфаты и фосфаты, соли органических кислот, такие как ацетат, малеат, тартрат, метансульфонат, бензолсульфонат и толуолсульфонат и соли аминокислот, таких как аргинин, аспарагиновая кислота и глутаминовая кислота.
Некоторые соединения согласно изобретению могут образовать соль с металлом, таким как натрий, калий, кальций или магний. Эти металлические соли также включены в число фармацевтически приемлемых солей согласно изобретению. Например, соединения, представленные общей формулой I, в которой Х означает группу 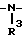 и R3 представляет собой атом водорода, или соединения, представленные общей формулой I, в которой Z означает группу, подпадающую под категорию 7 и В означает группу -NH-, могут существовать в виде металлической соли.
и R3 представляет собой атом водорода, или соединения, представленные общей формулой I, в которой Z означает группу, подпадающую под категорию 7 и В означает группу -NH-, могут существовать в виде металлической соли.
Поскольку соединение согласно изобретению может существовать также в форме гидрата или стереоизомера, то разумеется, что эти гидраты и стереоизомеры также включены в объем изобретения.
Действие соединения согласно изобретению будет описано со ссылкой на следующие фармакологические эксперименты.
Фармакологический эксперимент. Инигибирование активности Н+-К+ аденозинтрифосфатазы.
(I) Получение Н+-К+ аденозинтрифосфатазы.
Получена из желез дна желудка свежей слизистой оболочки желудка свиньи модифицированным методом Saccomani и соавторов (см. Biochem and Biophys. Acta 464, 313, 1977).
(2) Измерение активности Н+-К+ аденозинтрифосфатазы.
Соединение согласно изобретению инкубировали при различных концентрациях в 40 ммоль трис-HCl буферного раствора, имеющего рН 7,40, вместе с Н+-К+ аденозинтрифосфатазой и 10 мкг/мл белка при 37оС в течение 30 мин, с последующей добавкой 15 ммоль хлористого калия. Через 10 мин реакцию аденозинтрифосфатазы инициировали добавлением 3 ммоль хлористого магния и аденозинтрифосфата. Через 10 мин определяли количество высвободившейся неорганической фосфорной кислоты по методу Joda and Hokin (see Biochem. Biophys. Res. Com. 40, 880 (1970).
Испытываемое соединение использовали в виде раствора в метаноле.
Ингибирующее действие определяли вычитанием количества высвободившейся неорганической кислоты, наблюдаемого в случае добавления раствора испытываемого соединения, из количества, выделяемого в контроле, в котором добавляли только растворитель, для определения разницы, и деления этой разницы на последнее количество. Ингибирующее действие представлено в табл.1 в значениях ингибирующей концентрации ИК50.
Результаты испытания соединения 19 изобретения и трех сравнительных соединений А, В и С (см.табл.2) выражены также в виде ингибирующей активности, вычисленного следующим образом:
ингибирующей активности 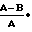 100 где А Н+-К+ АТФ активность в отсутствии испытываемого соединения,
100 где А Н+-К+ АТФ активность в отсутствии испытываемого соединения,
В Н+-К+ АТФ активность в присутствии испытываемого соединения.
Из результатов экспериментов видно, что соединения согласно изобретению оказывают высокое ингибирующее действие на активность Н+-К+аденозинтрифосфатазы и высоко стабильны, так что они могут эффективно подавлять секрецию кислоты и поэтому являются эффективным средством для терапии и профилактики пептической язвы у человека и животных.
Далее соединение согласно изобретению проявляет отличное восстановление секреции кислоты и представляет интерес для специалистов в данной области.
Использовали собак с хронической желудочной фистулой. Испытываемое соединение вводили интрадуоденально такой собаке в количестве 4 мг/кг. Через 1; 24; 48 и 72 ч, после введения собаке внутримышечно инъецироали пентагастрин (6 мкг на 1 кг). Определяли секрецию желудочной кислоты и определялось выделение ее в процентах по сравнению с контролем. Результаты этого теста представлены в табл. 4.
По этим результатам можно определить, что в течение одного часа от интрадуоденального введения стимулирования пентагастрином секреция желудочной кислоты полностью ингибировалась в обоих тестах как с соединением 19, так и с омепразолом. В этом тесте выделение кислоты с соединением 19 составляло 61,9 и 121,5% в сравнении с контрольной группой соответственно через 24 и 48 ч. С другой стороны, в том же с использованием омепразола секреция желудочной кислоты составляла 108,4% через 72 ч. В обоих случаях, как с соединением 19, так и с омепразолом, потребовалось 48 и 72 ч соответственно для восстановления кислотной секреции.
Фармакологический эксперимент 2. Инигибирующее действие на секрецию желудочной кислоты.
Использовали собак с хронической желудочной фистулой. Секрецию желудочной кислоты каждой собаки стимулировали сливанием гистамина в дозе 100 мкг/кг в час. Через час после инфузии гистамина каждой собаке интрадуоденально вводили каждое из испытываемых соединений, и через час после введения определяли количество желудочной кислоты, выделенной каждой подопытной собакой. Результаты сравнивали с контрольной группой, которой не вводили испытываемые соединения, и выражали ингибирование в процентных значениях.
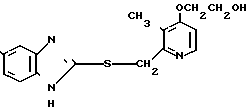
Ингибирующее действие на стимулированную гистамином секрецию желудочной кислоты у собак с хронической желудочной фистулой представлено в табл.3. Значения ингибирующей дозы ИД50, рассчитанные по кривой доза-ингибирование испытываемыми соединениями, составляли 59,9 мкг/кг для соединения 19 и 112,2 мкг/кг для омепразола, что свидетельствовало о том, что соединение 19 было в два раза более сильнодействующим, чем омепразол. Соединение 19 показано в табл.2 эксперимента 1 и в примере 33.
Результаты трех фармакологических экспериментов, описанных выше, показывают, что соединение согласно изобретению проявляет значительное ингибирующее действие на активность Н+-К+-аденозинтрифосфатазы.
Среди этих соединений соединение 19 обладает неожиданно боле сильновыраженной ингибирующей активностью на секрецию желудочной кислоты в сравнении с омепразолом, который сам является высокоэффективным ингибитором секреции желудочной кислоты среди соединений, имеющих строение бензимидазольного типа.
Далее следует заметить, что предлагаемое соединение неожиданно проявляет более быстрое восстановление и возобновлении желудочной секреции, чем омепразол.
В настоящее время считается, что ингибитор Н+-К+-аденозинтрифосфатазы имеет более сильную активность ингибирования секреции желудочной кислоты, чем Н2-блокирующее соединение, поэтому он в будущем имеет возможность занять первое место в качестве противоязвевного средства.
Но хотя желательна более сильная ингибирующая активность против секреции желудочной кислоты, слишком длительное ингибирование секреции желудочной кислоты не является предпочтительным для противоязвенного средства. Например, это вызывает быстрое разрастание энтерохромаффинодобных клеток и образование карциноида, происходящего в результате гипергастринемии, как описано в "Degistion" Vol. 35, suppel. I, pages 42-55 (1986), увеличение бактериальной флоры желудка и эндогенное продуцирование N-нитросоединений, как описано в "But. Med I." Vol. 289, page 717 (1984), и затруднения в определении соответствующего режима дозирования.
Таким образом, наиболее предпочтительным является ингибитор Н+-К+-аденозинтрифосфатазы, обладающей отличной способностью к восстановлению секреции желудочной кислоты.
Никакого токсикологического воздействия не наблюдалось при использовании соединения 19 (рабочий пример 33), которое является характерным соединением согласно изобретению, на гончих собаках, которым перорально вводили 10 мг/кг в день в течение недели, и на крысах, которым вводили перорально 50 мг/кг в день в течение одной недели.
Соединение 19 проявляет значительное ингибирующее действие на активность Н+-К+-аденозинтрифосфатазы в сочетании с желательной способностью быстрого восстановления секреции желудочной кислоты.
Соединение 19, как характерное соединение согласно изобретению, таким образом считается эффективным для лечения или профилактики пептических язв (язв желудка и язв двенадцатиперстной кишки) у животных, включая человека.
Соединение вводят для лечения или профилактики пептических язв либо перорально в виде порошка, гранул, капсул или сиропа, или перэнтерально в виде инъекции, или как наружный препарат или капли, или как суппозитории. Хотя доза заметно варьирует в зависимости от симптома, возраста и вида язвы (язв), она может составлять примерно от 0,01 до 200 мг/кг, предпочтительно от 0,05 до 50 мг/кг и еще предпочтительнее от 0,1 до 10 мг/кг в день и может вводиться в виде единичной дозы или в виде дробных доз, например, от 2 до 4 раз в день.
Лекарство может быть приготовлено в виде фармацевтического препарата с использованием обычных процессов приготовления. Более конкретно твердое лекарство для введения через рот может быть приготовлено смешением активного ингредиента с наполнителем и, если необходимо, со связующим, диспергирующим средством, смазкой, красителем, средством для улучшения вкуса и тому подобными, и превращением полученной таким образом смеси в таблетки, таблетки с покрытием, гранулы, порошки или капсулы.
Примеры наполнителей включают лактозу, кукурузный крахмал, сахарозу, глюкозу, сорбит, кристаллическую целлюлозу и двуокись кремния, тогда как связующие включают поливиниловый спирт, поливиниловый эфир, этилцеллюлозу, метилцеллюлозу, аравийскую камедь, трагакант, желатин, шеллак, гидроксипропилцеллюлозу, гидроксипропилкрахмал и поливинилпирролидон. Примеры диспергирующих средств включают крахмал, агар, желатин, порошок, кристаллическую целлюлозу, карбонат кальция, кислый карбонат кальция, цитрат кальция, декстрин и пепсин, тогда как смазывающие средства включают стеарат магния, тальк, полиэтиленгликоль, кремнезем и отвержденные растительные масла. Красящим средством может быть любое вещество, которое разрешено в качестве добавки к лекарству. Примеры вкусовых средств включает порошок какао, мятную траву, ароматический порошок, мятное масло, борнеол и порошкообразную корицу. Разумеется, что эти таблетки и гранулы могут быть, если необходимо, покрыты сахаром, желатином или тому подобным.
Инъекционный препарат может быть приготовлен смешением активного ингредиента с регулирующим значение рН средством, буфером, стабилизатором, растворителем или тому подобными, и обработкой полученной смеси обычными способами для получения внутримышечного, подкожного или внутривенного инъекционного препарата.
Соединение может быть получено различными способами, характерные примеры которых описаны ниже.
Способ получения А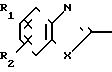 SH (II) где R1, R2 и Х имеют значения, определенные выше
SH (II) где R1, R2 и Х имеют значения, определенные выше
Y CH
CH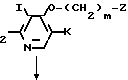 (III) где m, Z, I и К имеют значения, определенные выше, Y атом галогена или сульфонилоксигруппа,
(III) где m, Z, I и К имеют значения, определенные выше, Y атом галогена или сульфонилоксигруппа,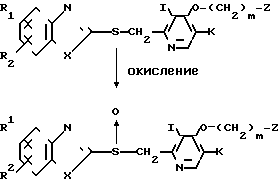

То есть соединение, представленное общей формулой II, подвергается взаимодействию с галогенидом или сульфонатом, представленным общей формулой III, с получением соединения, представленного общей формулой I, которое является целевым соединением согласно изобретению.
Примеры атома галогена, упомянутые в связи с определением Y, включают хлор, бром и иод, тогда как примеры сульфонилоксигруппы включают алкилсульфонилоксигруппы, такие как метилсульфонилокси- и этилсульфонилоксигруппа и ароматические сульфонилоксигруппы, такие как бензолсульфонилокси- и толилсульфонилоксигруппа.
Описанную выше реакцию предпочтительно выполняют в присутствии кислотного акцептора. Примеры кислотного акцептора включают карбонаты и кислые карбонаты щелочных металлов, такие как карбонат калия, карбонат натрия и кислый карбонат натрия, гидроокиси щелочных металлов, такие как гидроокись натрия и гидроокись калия и органические амины, такие как пиридин и триэтиламин. Примеры растворителя, используемого в реакции, включают спирты, такие как метиловый и этиловый спирты, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид и их смеси с водой.
Темпераутра реакции может быть от -40оС до точки кипения используемого растворителя, предпочтительно от 0 до 60оС.
Полученное соединение (I') может быть легко окислено в его сульфинильное производное (I"), которое является целевым соединением согласно изобретению, соответствующим соединению общей формулы I, в котором n равно 1.
Это окисление может быть выполнено обычным способом при использовании окислителя, такого как перекись водорода, надуксусная кислота, м-хлорнадбензойная кислота, гипохлорит натрия или гипобромит натрия. Растворитель, используемый в процессе окисления, обычно выбирают из дихлорметана, хлороформа, бензола, толуола, метанола, этанола и тому подобного. Температура окисления может быть от -70оС до точки кипения используемого растворителя, предпочтительно -60 до 25оС.
Кроме того, сульфоновое производное, которое является целевым соединением согласно изобретению, соответствующим соединению общей формулы I, в котором n равно 2, может быть получено, например, следующим способом: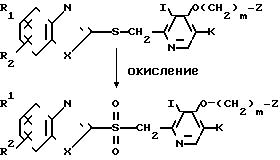
 где R1, R2, X, I, m и Z имеют значения, определенные ранее.
где R1, R2, X, I, m и Z имеют значения, определенные ранее.
Т.е. тиоэфирное производное, представленное общей формулой (I'), которое является целевым соединением согласно изобретению, окисляют до его сульфонового производного, представленного общей формулой (I'"), которое является другим целевым соединением согласно изобретению.
Более точно сульфоновое производное формулы I, которое является целевым соединением согласно изобретению, может быть получено растворением соединения формулы I в растворителе, выбранном среди ароматических углеводородов, таких как бензол, толуол и ксилол, галоидированных углеводородов, таких как дихлорметан, хлороформ, и четыреххлористый углерод, воды, спиртов, таких как метанол, и этанол, этилацетата, ацетона, уксусной кислоты и тому подобного с получением раствора, добавлением, по меньшей мере, двойного эквивалентного количества окислителя, выбранного среди перекиси водорода, надуксусной кислоты, м-хлоpнадбензойной кислоты, гипохлорита натрия, м-периодата натрия и тому подобного, к раствору при охлаждении льдом или при комнатной температуре и взаимодействием соединения формулы I с окислителем.
Альтернативно сульфоновое производное формулы I может быть получено описанным выше способом в растворителе, таком как хлороформ, путем добавления окислителя, такого как м-хлорнадбензойная кислота, с получением раствора, и взаимодействия сульфоксидного производного формулы I с окисляющим агентом.
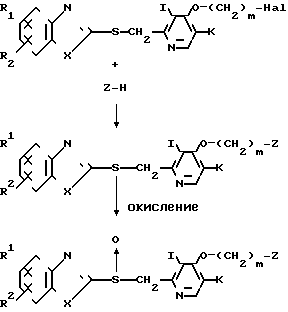
Способ получения В.
 где R1, R2, X, m, I, K и Z имеют значения, определенные ранее, и Hal означает атом галогена.
где R1, R2, X, m, I, K и Z имеют значения, определенные ранее, и Hal означает атом галогена.
Т. е. целевое соединение, представленное общей формулой I", может быть получено взаимодействием галогенида, представленного общей формулой IV со спиртом, мeркаптаном или амином, представленным общей формулой Z-Н (формула V). Эту реакцию предпочтительно проводят в присутствии кислотного акцептора. Примеры кислотного акцептора включают карбонаты и кислые карбонаты щелочных металлов, такие как карбонат калия и карбонат натрия, гидроокиси щелочных металлов, такие как гидроокись натрия и гидроокись калия и триэтиламин. Примеры растворителей, используемых в реакции, включают простые эфиры, такие как тетрагидрофуран и диоксан, кетоны, такие как ацетон и метилэтилкетон, бензольные гомологи, такие как бензол, толуол и ксилол, ацетонитрил, диметилформамид, диметилсульфоксид и гексаметилтриамид фосфорной кислоты. Реакция может быть проведена либо при охлаждении льдом, либо при температуре, не превышающей точку кипения используемого растворителя.
Полученное соединение формулы I', которое является целевым соединением согласно изобретению, может быть окислено в его сульфинильное производное, представленное общей формулой I", способом, аналогичным описанному ранее в способе получения А.
Способ получения С.
Соединение, представленное общей формулой I, где Х означает группу, представленную формулой -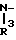 (в которой R3 является группой, выбранной среди определенных для нее ранее значений, за исключением атома водорода) может быть получено следующим способом:
(в которой R3 является группой, выбранной среди определенных для нее ранее значений, за исключением атома водорода) может быть получено следующим способом: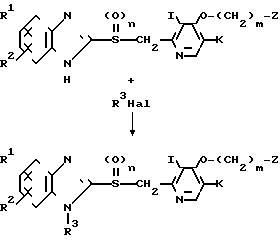
 где R1, R2, n, I, K, m и Z имеют значения, определенные ранее, Hal означает атом галогена, а R3 является группой, выбранной из значений, определенных выше для R3 в формуле I, за исключением атома водорода, т.е. низшим алкилом, фенилом, бензилом или низшей алкоксикарбонильной группой.
где R1, R2, n, I, K, m и Z имеют значения, определенные ранее, Hal означает атом галогена, а R3 является группой, выбранной из значений, определенных выше для R3 в формуле I, за исключением атома водорода, т.е. низшим алкилом, фенилом, бензилом или низшей алкоксикарбонильной группой.
Т.е. соединение, представленное общей формулой I"", которое является целевым соединением согласно изобретению, может быть получено конденсацией соединения, представленного общей формулой VI с галогенидом, представленным общей формулой VII, обычным способом.
Конденсация может быть осуществлена в отсутствии какого-либо растворителя или в органическом растворителе, инертном в условиях конденсации, выбранном из бензола, этанола, ксилола, тетрагидрофурана, хлороформа, четыреххлористого углерода, диметилформамида и тому подобного, либо при комнатной температуре или при охлаждении льдом или нагревании в течение нескольких часов обычным способом. Конденсация может быть ускорена использованием дегидрогалоидирующего агента, выбранного из неорганических солей, таких как кислый карбонат натрия, карбонат калия, карбонат натрия и каустическая сода или из органических оснований, таких как триэтиламин, пиридин, пиримидин и диэтиланилин.
Далее, тиоэфирное производное, представленное общей формулой I"", в которой n равно нулю, полученное конденсацией соединения, представленного общей формулой VI, где n равно нулю, с галогенидом формулой VII, может быть легко окислено в соответствующее производное сульфоксида (n равно единице) или сульфон (n равно двум), способом, аналогичным описанному.

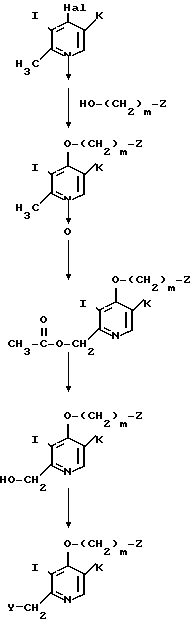
 ) где m, Z, I, K и Y имеют значения, определенные ранее.
) где m, Z, I, K и Y имеют значения, определенные ранее.
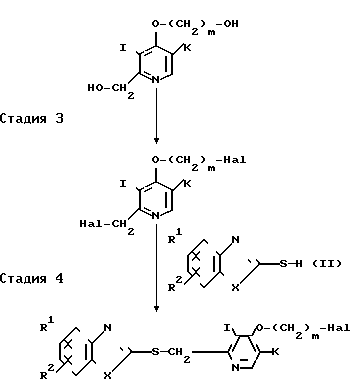
Стадия 1. Оксидное производное 4-галоидпиридина формулы VIII, (например, 1-оксид 4-хлор-2,3-диметилпиридина) взаимодействует с производным спирта, представленным общей формулой IX, в присутствии основания с образованием алкоксипроизводного, представленного общей формулой X.
Примеры оснований включают гидриды щелочного металла, такие как гидрид натрия и гидрид калия, щелочные металлы, такие как металлический натрий, алкоголяты натрия, такие как метилат натрия и гидроокиси щелочных металлов, такие как гидроокись натрия и гидроокись калия. Реакция может быть проведена либо в отсутствии растворителя, или в органическом растворителе, выбранном из числа простых эфиров, таких как тетрагидрофуран и диоксан, кетонов, таких как ацетон и метилэтилкетон, гомологов бензола, таких как бензол, толуол и ксилол, ацетонитрила, диметилформамида, диметилсульфоксида, гексаметилтриамида фосфорной кислоты и тому подобного, при температуре от охлаждения льдом до точки кипения используемого растворителя.
Стадия 2. Алкоксипроизводное общей формулы Х, полученное на стадии 1, нагревается в уксусном ангидриде при температуре от 60 до 100оС для получения ацетоксиметилпиридинового производного, представленного общей формулой XI.
Стадия 3. Ацетоксиметилпиридиновое производное формулы XI, полученное на стадии 2, гидролизуется в соответствующее 2-гидроксиметилпиридиновое производное, представленное общей формулой XII. Этот гидролиз обычно проводят в щелочных условиях.
Стадия 4. 2-Гидроксиметилпиридиновое производное формулы XII, полученное на стадии 3, галоидируется, например, хлорирующим средством, таким как хлористый тионил, в 2-галоидметилпиридиновое производное, представленное общей формулой III. В данном галоидировании используют в качестве растворителя, например, хлороформ или дихлорметан. Далее 2-гидроксиметилпиридиновое производное формулы XII взаимодействует с реакционноспособным сульфинилхлоридом, таким как метансульфонилхлоридом, для получения сульфонилоксипроизводного, представленного общей формулой III. В этой реакции в качестве растворителя используют, например, хлороформ, дихлорметан, простой эфир, тетрагидрофуран, пиридин или бензол.
Альтернативно соединение, представленное общей формулой Х, используемое в описанном способе, может быть получено следующим способом:

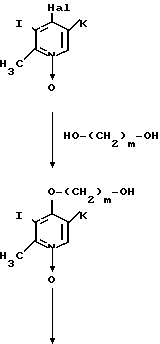


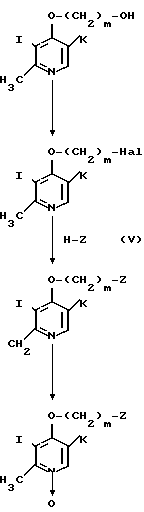

Стадия 1. Соединение, представленное общей формулой VIII, в которой Hal означает атом галогена, такой как атом хлора, подвеpгается конденсации с соединением, представленным общей формулой XIII, обычным способом с получением соединения, представленного общей формулой XIV.
Конденсацию предпочтительно проводят в присутствии основания, выбранного из гидридов щелочного металла, таких как гидрид натрия и гидрид калия, щелочных металлов, таких как металлический натрий, гидроокисей щелочных металлов, таких как гидроокись натрия и гидроокись калия и тому подобных. Конденсацию проводят либо в отсутствии растворителя, или в растворителе, выбранном из простых эфиров, таких как тетрагидрофуран и диоксан, кетонов, таких как ацетон и метилэтилкетон, гомологов бензола, таких как бензол, толуол и ксилол, ацетонитрила, диметилформамида, диметилсульфоксида, гексаметилтриамида фосфорной кислоты и тому подобного, при температуре, подходящим образом выбранный в интервале от охлаждения льдом до точки кипения используемого растворителя.
Стадия 2. Полученное алкоксипроизводное формулы XIV восстанавливают в соединение формулы XV. Точнее алкоксипроизводное формулы XIV гидрируют в присутствии катализатора 10% палладия на угле в смеси уксусного ангидрида и уксусной кислоты с получением восстановленного продукта формулы XV.
Стадия 3. Полученное соединение формулы XV галоидируют, например, с хлорирующим агентом, таким как тионилхлорид, с получением 2-галогенэтилпроизводного, представленного общей формулой XVI. При данном галоидировании в качестве растворителя используют, например, хлороформ или дихлорметан.
Стадия 4. Полученное соединение формулы XVI подвергают взаимодействию со спиртом, тиоспиртом или амином, представленным общей формулой V, с получением соединения, представленного общей формулой XVII. Эту реакцию предпочтительно проводят в присутствии кислотного акцептора как и в реакции, описанной в способе получения В.
Стадия 5. Полученное соединение формулы XVII окисляют с помощью окисляющего агента, такого как перекись водорода, надуксусная кислота или м-хлорнадбензойная кислота с получением соответствующего N-оксидного производного.
Альтернативно соединение, представленное общей формулой III, использованное в способе получения А в качестве исходного соединения, может быть получено следующим способом: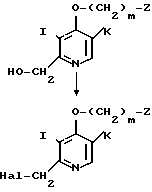
 где Hal означает атом галогена, а Z и m имеют определенные ранее значения.
где Hal означает атом галогена, а Z и m имеют определенные ранее значения.
Соединение, представленное общей формулой XII, галоидируют, например, хлорирующим средством, таким как хлористый тионил, при температуре от 0оС до комнатной температуры с получением галогенметилпиридинового производного, представленного общей формулой III. При галоидировании в качестве растворителя используют, например, хлороформ или дихлорметан.
Соединение формулы IV, использованное в способе получения В в качестве исходного соединения, может быть получено, например, следующим способом: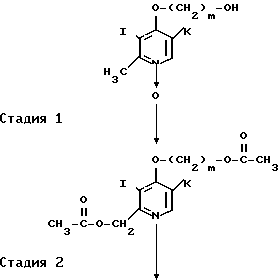

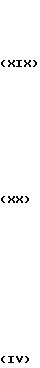 где Hal означает атом галогена, а остальные радикалы имеют определенные ранее значения.
где Hal означает атом галогена, а остальные радикалы имеют определенные ранее значения.
Стадия 1. Соединение, представленное общей формулой XIV, превращают в соответствующий ацетилат формулы XVIII обычным способом. В этой реакции используют, например, уксусный ангидрид или хлористый ацетил.
Стадия 2. Полученный ацетилат гидролизуют в присутствии кислоты или основания с получением соответствующего диолового производного формулы XIX.
Стадия 3. Диоловое производное формулы XIX галоидируют, например, хлорирующим агентом, таким как хлористый тионил, с получением дигалогенида, представленного общей формулой ХХ. При данном галоидировании в качестве растворителя используют, например, хлороформ или дихлорметан.
Стадия 4. Полученный дигалогенид формулы ХХ подвергают взаимодействию с соединением, представленным общей формулой II, с получением сульфидного производного, представленного общей формулой IV.
Эту реакцию проводят в присутствии кислотного акцептора, выбранного из карбонатов и кислых карбонатов щелочных металлов, таких как карбонат калия и карбонат натрия, щелочных гидроокисей, таких как гидроокись натрия и гидроокись калия. Примеры растворителей, используемых в реакции, включают спирты, такие как этанол и метанол, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид и их смеси с водой. Температура реакции может быть в интервале от 0оС до точки кипения используемого растворителя, предпочтительно от 40 до 60оС.
Альтернативно соединение формулы IV, использованное в способе получения В в качестве исходного соединения, может быть получено следующим способом: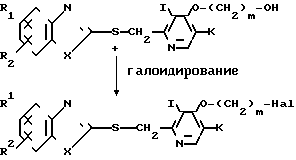
 где Hal означает атом галогена, а остальные символы имеют ранее определенные значения.
где Hal означает атом галогена, а остальные символы имеют ранее определенные значения.
Т. е. соединение формулы IV может быть получено галоидированием соединения формулы I''''', которое является целевым соединением согласно изобретению и получается по способу получения А обычным методом. Более точно соединение, представленное общей формулой I''''', галоидируют, например, хлорирующим агентом, таким как хлористый тионил, с получением галогенида, представленного общей формулой IV. В данном процессе галоидирования в качестве растворителя предпочтительно используют хлороформ или дихлорметан, и температуру реакции поддерживают в интервале от комнатной температуры до 80оС.
Следующие примеры получения касаются получения сырьевых материалов для использования при получении целевых соединений согласно изобретению.
Пример получения 1. Синтез N-оксида 4-(2-бензилоксиэтокси)-2,3-диметилпириди- на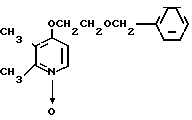
1,82 г (79,13 ммоль) натрия добавляли к 50 мл бензилоксиэтанола для получения смеси. Эту смесь перемешивали при 50оС в течение 2 ч. К полученной смеси при комнатной температуре добавляли 5,0 г (31,76 ммоль) N-оксида 4-хлор-2,3-диметилпиридина. Полученную смесь перемешивали при 110оС полтора часа, охлаждали до комнатной температуры и фильтровали для удаления нерастворимой фазы. Фильтрат абсорбировали на силикагеле с дихлорметаном. Силикагель обрабатывали 5-30%-ным этилацетатом в гексане для извлечения бензилоксиэтанола. Затем полученный силикагель обрабатывали 5-30%-ным метанолом в этилацетате и получали 7,15 г N-оксида 4-(2-бензилоксиэтокси)-2,3-диметилпиридина в виде масла.
Спектр ЯМР на ядрах 1Н (СДСl) δ: 2,20 (с, 3Н) 2,47 (с. 3Н) 3,8  4,0 (м, 2Н), 4,1
4,0 (м, 2Н), 4,1  4,25 (м. 2Н) 4,6 (с. 2Н) 6,65 (д, I 7,03 Гц, 1Н) 7,33) С, 5Н) 8,12 (д, I 7,03 Гц, 1Н).
4,25 (м. 2Н) 4,6 (с. 2Н) 6,65 (д, I 7,03 Гц, 1Н) 7,33) С, 5Н) 8,12 (д, I 7,03 Гц, 1Н).
Пример получения 2. Синтез 4-(2-бензилоксиэтокси)-2-оксиметил-3-метилпириди- на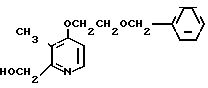
Смесь, содержащую 6,5 г N-оксида 4-(2-бензилоксиэтокси-2,3-диметилпиридина и 56 мл уксусного ангидрида перемешивали при 80-90оС 1 ч и перегоняют для удаления уксусного ангидрида. Полученный остаток слабо подщелачивали водным раствором карбоната натрия и экстрагировали метилэтилкетоном. Экстракт сушили над сульфатом магния и перегоняли для удаления метилэтилкетона. Таким образом, получали 7,0 г 2-ацетоксиметил-4-(2-бензилоксиэтокси)-3-метилпиридина. Это промежуточное соединение растворяли в 90 мл этанола с последующим добавлением 1,43 г гидроокиси натрия. Полученную смесь перемешивали при 40оС 1 ч, затем добавляли воду. Смесь экстрагировали метилэтилкетоном. Полученный таким образом экстракт сушили над сульфатом магния и получали 5,4 г 4-(2-бензилоксиэтокси)-2-гидроксиметил- 3-метилпиридина.
Спектр 1Н-Ф ЯМР (CDCl3) δ: 2.06 (с. 3Н) 3,7  3,95 (м, 2Н) 4,0
3,95 (м, 2Н) 4,0  4,3 (м. 2Н) 4,6 (с. 4Н) 6,70 (д, I 6,7 Гц, 1Н) 7,33 (с. 5Н) 8,27 (д, I=6,7 Гц, 1Н).
4,3 (м. 2Н) 4,6 (с. 4Н) 6,70 (д, I 6,7 Гц, 1Н) 7,33 (с. 5Н) 8,27 (д, I=6,7 Гц, 1Н).
Пример получения 3. Синтез 4-(2-бензилоксиэтокси)-2-хлорметил-3-метилпириди- на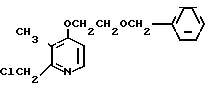
5,3 г 4-(2-бензилоксиэтокси)-2-гидроксиметил-3-метилпиридина растворяли в 60 мл хлороформа для получения раствора. К полученному раствору по каплям при охлаждении льдом добавляли раствор 5,8 г хлористого тионила в 40 мл хлороформа. Полученную смесь перемешивали при комнатной температуре 7 ч и перегоняли при пониженном давлении для получения остатка. К остатку добавляли 200 мл 2 н. водного раствора карбоната натрия. Полученную смесь экстрагировали хлороформом и экстракт сушили над сульфатом магния, перегоняли для удаления хлороформа. Получали 6,3 г целевого соединения, указанного в названии примера.
Спектр ЯМР на ядрах 1Н (CDCl3) δ: 2,27 (с. 3Н) 3,5  4,25 (м. 4Н) 4,56 (с. 2Н) 4,66 (с. 2Н) 6,7 (д. I 5,71 Гц, 1Н), 7,30 (с. 5Н) 8,27 (д. I 5,71 Гц, 1Н).
4,25 (м. 4Н) 4,56 (с. 2Н) 4,66 (с. 2Н) 6,7 (д. I 5,71 Гц, 1Н), 7,30 (с. 5Н) 8,27 (д. I 5,71 Гц, 1Н).
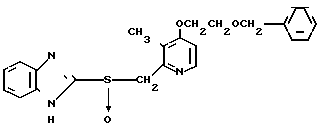
П р и м е р 1. 2-[{4-(2-Бензилоксиэтокси)-3-метилпиридин-2-ил}-метилтио] бензи- мидазол.
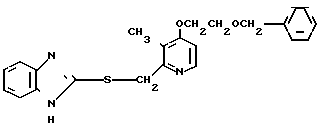
Смесь, содержащую 1,0 г 2-меркаптобензимидазола, 2,0 г 4-(2-бензилоксиэтокси)-2-хлорметил-3-метилпиридина, 302 мг гидроокиси натрия и 40 мл этанола перемешивали при нагревании до 60оС полтора часа и перегоняли при пониженном давлении для удаления этанола. Полученный остаток подвергали хроматографии на колонке силикагеля. Колонку обрабатывали 30-60%-ным этилацетатом в н-гексане и получали 2,0 г целевого соединения в виде белых кристаллов.
Спектр ЯМР на ядрах 1Н (СDCl3) δ: 2,8 (с. 3Н) 3,8  3,9 (м. 2Н) 4,15
3,9 (м. 2Н) 4,15  4,25 (м. 2Н) 4,37 (с. 2Н) 4,62 (с. 2Н) 6,74 (д. I 5,7 Гц, 1Н) 7,11
4,25 (м. 2Н) 4,37 (с. 2Н) 4,62 (с. 2Н) 6,74 (д. I 5,7 Гц, 1Н) 7,11  7,65 (м. 9Н) 8,32 (д. I 5,71 Гц, 1Н).
7,65 (м. 9Н) 8,32 (д. I 5,71 Гц, 1Н).
П р и м е р 2. 2-[{(4-(2-бензилоксиэтокси)-3-метилпиридин-2-ил}-метилсульфонил] бензимидазол.
0,98 тиоэфира, полученного выше, растворяли в 40 мл дихлорметана для получения раствора. К раствору по частям при температуре от -30 до -40оС добавляли 521 мг м-хлорнадбензойной кислоты с последующим добавлением 461 мг тиэтиламина. Полученную смесь нагревали до 0оС с последующим добавлением 20 мл 1н. водного раствора карбоната натрия. Полученную смесь перемешивали 30 мин и экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором поваренной соли, сушили над сульфатом магния и перегоняли для удаления дихлорметана. Полученный остаток кристаллизовали из смеси дихлорметан-эфир и получали 0,78 г целевого соединения в виде кристаллов.
М+1 (определенный методом FAB масс-спектрометрии: то же самое применяется дальше): 422
Спектр ЯМР на ядрах 1Н (CDCl3) δ: 2,2 (с. 3Н) 3,65 (3,98 (м. 2Н) 4,04  4,28 (м. 2Н) 4,59 (с. 2Н) 4,78 (с. 2Н) 6,98 (м. I 4,6 Гц, 1Н) 7,05
4,28 (м. 2Н) 4,59 (с. 2Н) 4,78 (с. 2Н) 6,98 (м. I 4,6 Гц, 1Н) 7,05 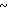 7,8 (м. 9Н) 8,22 (д. I 4,6 Гц, 1Н) 7,05
7,8 (м. 9Н) 8,22 (д. I 4,6 Гц, 1Н) 7,05 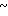 7,8 (м. 9Н) 8,22 (д. I 4,6 Гц, 1Н) 13,6 (шир, с, 1Н).
7,8 (м. 9Н) 8,22 (д. I 4,6 Гц, 1Н) 13,6 (шир, с, 1Н).
П р и м е р ы 3-5. Следующие соединения были получены способом, аналогичным описанному в примере 1 или 2.
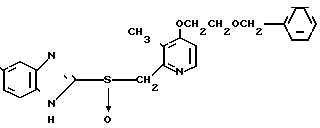
П р и м е р 3. 2-[{4-(2-бензилоксиэтокси)-3-метилпиридин-2-ил} метилсульфинил}-5-метокси-1Н-бензимидазол.
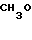
Спектр ЯМР на ядрах 1Н (CDCl3) δ: 2,13 (с. 3Н) 3,78 (с. 3Н) 3,62 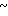 3,90 (м. 2Н) 4,1
3,90 (м. 2Н) 4,1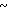 4,3 (м. 2Н) 4,5 (с. 2Н) 4,7 (с. 2Н) 6,76
4,3 (м. 2Н) 4,5 (с. 2Н) 4,7 (с. 2Н) 6,76 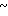 7,12 (м. 3Н) 7,23 (с. 5Н) 7,48 (д. I 9,1 Гц, 1Н) 8,14 (д. I 7,9 Гц, 1Н).
7,12 (м. 3Н) 7,23 (с. 5Н) 7,48 (д. I 9,1 Гц, 1Н) 8,14 (д. I 7,9 Гц, 1Н).
П р и м е р 4. 2-[{4-(2-бензилоксиэтокси)-3-метилпиридин-2-ил}метилсульфинил] 5-трифторметил-1Н-бензимидазол.
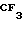
Спектр ЯМР на ядрах 1Н (CDCl3) δ: 2,18 (с. 3Н) 3,7  3,92 (м. 2Н) 4,1
3,92 (м. 2Н) 4,1  4,34 (м. 2Н) 4,58 (с. 2Н) 4,78 (с. 2Н), 6,94 (д. I 5,71 Гц, 1Н) 7,32 (с. 5Н) 7,59 (д. I 8,79 Гц, 1Н), 7,83 (д. I 8,79 Гц, 1Н) 7,99 (с. 1Н) 8,17 (д. I 5,71 Гц, 1Н).
4,34 (м. 2Н) 4,58 (с. 2Н) 4,78 (с. 2Н), 6,94 (д. I 5,71 Гц, 1Н) 7,32 (с. 5Н) 7,59 (д. I 8,79 Гц, 1Н), 7,83 (д. I 8,79 Гц, 1Н) 7,99 (с. 1Н) 8,17 (д. I 5,71 Гц, 1Н).
П р и м е р 5. 2-[{4-(2-(2-метоксиэтокси))-этокси-3-метилпиридин-2-ил} метилсульфинил]-5-трифторметил-1Н-бензимидазол.
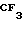
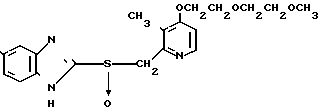
Натриевая соль 2-[{ 4-(2-(2-метоксиэтокси))этокси-3-метилпиридин-2-ил} метилсульфинил]-1Н-бензимидазола.
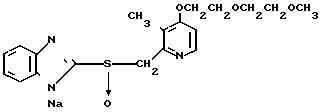
0,45 г 2-[{4-(2-(2-метоксиэтокси))этокси-3-метилпиридин-2-ил}метилтио] безимидазола растворяли в 40 мл дихлорметана для получения раствора. К этому раствору по частям при температуре -40оС добавляли 0,22 г м-хлорнадбензойной кислоты с последующим добавлением 0,16 г триэтиламина. Полученную смесь нагревали до 0оС и затем добавляли 20 мл 1н. водного раствора кислого карбоната натрия. Полученную смесь перемешивали 30 мин и экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния и перегоняли для удаления дихлорметана. К полученному остатку добавляли 12 мл 0,1 н. водного раствора гидроокиси натрия. Полученную смесь перемешивали при комнатной температуре в течение часа с последующей добавкой абсолютного этанола. Полученную смесь выпаривали досуха при пониженном давлении. Полученный остаток кристаллизовали из смеси этанол-эфир и получали 0,42 г целевого соединения в форме натриевой соли.
Спектр ЯМР на ядрах 1Н (DMCO-d6) δ: 2,16 (с. 3Н) 3,25 (с. 3Н) 3,3  3,9 (м. 6Н) 4,0
3,9 (м. 6Н) 4,0  4,14 (м. 2Н) 4,55 (АВ кв. I 13,18 Гц, Δν 13,55 Гц, 2Н) 6,8
4,14 (м. 2Н) 4,55 (АВ кв. I 13,18 Гц, Δν 13,55 Гц, 2Н) 6,8  6,9 (м. 3Н) 7,4
6,9 (м. 3Н) 7,4  7,5 (дд. I 6,15 Гц, 3,08 Гц, 2Н) 8,28 (д. I 5,27 Гц, 1Н).
7,5 (дд. I 6,15 Гц, 3,08 Гц, 2Н) 8,28 (д. I 5,27 Гц, 1Н).
П р и м е р ы 7-10. Следующие соединения были получены способом, аналогичным описанному в примере 6.
П р и м е р 7. Натриевая соль 5-метокси-2-[{4-(2-(2-метоксиэтокси))этокси-3-метил- пиридин-2-ил} метилсульфинил]-1Н-бензимидазола.

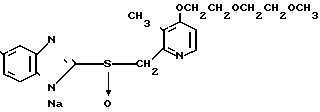
Спектр ЯМР на ядрах 1Н (CD3OD) δ: 2,14 (с. 3Н) 3,34 (с. 3Н) 3,6 (м. 4Н) 3,84 (с. 5Н) 4,18 (м. 2Н) 6,76 (дд. I 9,36 Гц, 2,52 Гц, 1Н) 6,9 (д. I 5,76 Гц, 1Н) 7,14 (д. I 2,52 Гц, 1Н), 7,5 (д. I 9,36 Гц, 1Н) 8,26 (д. I 5,76 Гц, 1Н).
П р и м е р 8. Натриевая соль 2-[{4-(2-(2-бензилоксиэтокси))этокси-3-метилпири- дин-2-ил} метилсульфинил]-1Н-бензимидазола.
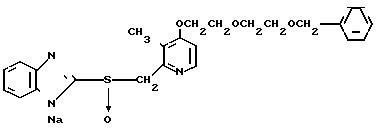
ЯМР-спектр на ядрах 1Н (ДМСО-d6) δ: 2,16 (с. 3Н) 3,4 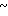 3,9 (м. 6Н) 3,96
3,9 (м. 6Н) 3,96 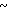 4,28 (м. 2Н) 4,49 (с. 2Н) 4,6 (АВ кв. I 12,6 Гц, Δν 12,85 Гц, 2Н) 6,8
4,28 (м. 2Н) 4,49 (с. 2Н) 4,6 (АВ кв. I 12,6 Гц, Δν 12,85 Гц, 2Н) 6,8 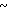 7,2 (м. 3Н) 7,29 (с. 5Н) 7,5 (дд. I 5,16 Гц, 3,03 Гц, 2Н) 8,25 (д. I 5,71 Гц, 1Н).
7,2 (м. 3Н) 7,29 (с. 5Н) 7,5 (дд. I 5,16 Гц, 3,03 Гц, 2Н) 8,25 (д. I 5,71 Гц, 1Н).
П р и м е р 9. Натриевая соль 2-[{4-(2-(2-бензилоксиэтокси))этокси-3-метилпиридин-2-ил} метилсульфинил]-5-метоксибензимидазола.
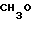
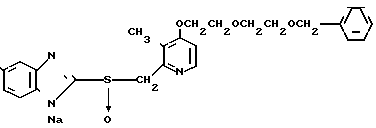
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,16 (с. 3Н) 3,63 (м. 4Н) 3,74 (с. 3Н) 3,85 (м. 2Н) 4,18 (м. 2Н) 4,49 (с. 2Н) 4,55 (АВ кв. I 13,18 Гц, Δν 13,55 Гц, 2Н) 6,6 (дд. I 9,35 Гц, 3,20 Гц, 1Н) 7,03 (д. I 2,63 Гц, 1Н) 6,89 (д. I 5,72 Гц, 1Н) 8,26 (д. I 5,72 Гц, 1Н).
П р и м е р 10. Натривая соль 2-[{4-(2-(2-бензилоксиэтокси)этокси-3-метилпиридин-2-ил} метилсульфинил]-5-трифторметилбензимидазол.

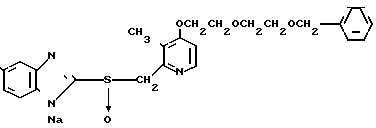
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,16 (с. 3Н) 3,62 (и. 4Н) 3,79 (м. 2Н) 4,48 (с. 2Н) 4,57 (АВ кв, I 13,18 Гц, Δν 12,29 Гц, 2Н) 6,93 (д. I 5,71 Гц, 1Н) 7,16 (дд, I 8,35 Гц, 1,75 Гц, 1Н) 7,29 (с. 5Н) 7,62 (д. I 8,35 Гц, 1Н) 8,28 (д. I 5,71 Гц, 1Н).
Пример получения 4. N-оксид 4-(2-оксиэтокси)-2,3-диметилпиридина.
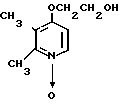
4,60 г (0,2 моль) металлического натрия растворяли в 80 мл этиленгликоля при охлаждении льдом до получения раствора. Этот раствор перемешивали в атмосфере азота при 100оС в течение 1 ч с последующим добавлением 15,76 г (0,1 моль) N-оксида 4-хлор-2,3-диметилпиридина при комнатной температуре. Полученную смесь перемешивали при 120оС 2 ч. После окончания реакции реакционную смесь перегоняли до сухого остатка для удаления этиленгликоля. Полученный остаток очищали хроматографией на колонке силикагеля (растворителем служила смесь хлороформ-метанол в отношении 19:1) и получали 13,28 г 4-(2-оксиэтокси)-2,3-диметилпиридина в виде N-оксида, представляющего собой белые кристаллы.
Спектр ЯМР на ядрах 1Н (СД3ОД) δ: 2,29 (с. 3Н) 2,55 (с. 3Н) 3,39 (т. 2Н) 4,20 (т. 2Н) 7,04 (д. Н) 8,18 (д. Н).
Пример получения 5. N-оксид 4-(2-хлорэтокси)-2,3-диметилпиридина.
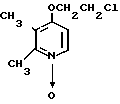
1,0 мл хлористого тионила постепенно добавляли к раствору 0,92 г (5 ммоль) 4-(2-оксиэтокси)-2,3-диметилпиридина N-оксида в 10 мл хлороформа при охлаждении льдом. Полученную смесь нагревали 2 ч с обратным холодильником, оставляли для охлаждения, нейтрализовали насыщенным водным раствором кислого карбоната натрия и дважды экстрагировали 100 мл метилэтилкетона. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и очищали хроматографией на колонке силикагеля (растворитель смесь хлороформа и метанола в соотношении 19:1) и получали 0,56 г N-оксида 4-(2-хлорэтокси)-2,3-диметилпиридина в виде бесцветных кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,24 (с. 3Н) 2,54 (с. 3Н) 3,86 (т. 2Н) 4,28 (т. 2Н) 6,62 (д. Н) 8,17 (д. Н).
Пример получения 6. N-оксид-2,3-диметил-4-(2-сукцинимидэтокси)пиридина.
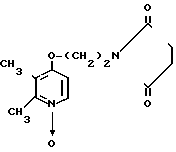
Смесь, содержащую 0,40 г (2 ммоль) N-оксида 4-(2-хлорэтокси)-2,3-диметилпиридина, 0,30 г (3 ммоль) сукцинимида, 0,48 г (3,5 ммоль) карбоната калия и 30 мл метилэтилкетона нагревали с обратным холодильником 2 ч, оставляли для охлаждения и фильтровали. Фильтрат выпаривали досуха для удаления метилэтилкетона. Полученный остаток очищали хроматографией на колонке (растворитель смесь хлороформа и метанола в соотношении 19:1) и получали 0,12 г N-оксида 2,3-диметил-4-(2-сукцинимидоэтокси)пиридина в виде белых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,12 (с. 3Н) 2,49 (с. 3Н) 2,73 (с. 4Н) 3,80  4,25 (м. 4Н) 6,51 (д. Н) 8.03 (д. Н).
4,25 (м. 4Н) 6,51 (д. Н) 8.03 (д. Н).
Пример получения 7. 2-Хлорметил-3-метил-4-(2-сукцинимидоэтокси)пиридин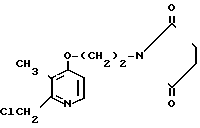
0,12 г N-оксида 2,3-диметил-4-(2-сукцинимидоэтокси)пиридина растворяли в 5 мл уксусного ангидрида для получения раствора. Этот раствор перемешивали при 100оС полчаса и охлаждали с последующим добавлением 30 мл этанола. Полученную смесь перемешивали при комнатной температуре полчаса и дистиллировали для удаления растворителя. Таким образом получали 0,14 г неочищенного 2-ацетоксиметил-3-метил-4-(2-сукцинимидоэтокси)пиридина в виде масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,10 (с. 3Н) 2,14 (с. 3Н) 2,72 (с. 4Н) 3,72  4,24 (м. 4Н) 5,15 (с. 2Н) 6,61 (д. Н) 8,24 (д. Н).
4,24 (м. 4Н) 5,15 (с. 2Н) 6,61 (д. Н) 8,24 (д. Н).
Данное ацетоксиметильное производное растворяли в 5 мл 1 н. соляной кислоты для получения раствора. Этот раствор перемешивали при 100оС в течение получаса, охлаждали, нейтрализовали насыщенным водным раствором кислого карбоната натрия и дважды экстрагировали 100 мл хлороформа. Полученный экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и получали 0,12 г неочищенного 2-гидроксиметил-3-метил-4-(2-сукцинимидоэтокси)пиридина в виде бесцветных кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,93 (с. 3Н) 2,68 (с. 4Н) 3,80-4,22 (м. 4Н) 4,56 (с. 2Н) 6,59 (д. 1Н) 8,21 (д. Н).
Это неочищенное гидроксиметильное производное растворяли в 5 мл хлороформа для получения раствора. К этому раствору по каплям добавляли при охлаждении льдом 0,11 г хлористого тионила. Полученную смесь нагревали с обратным холодильником полчаса, охлаждали, нейтрализовали насыщенным водным раствором кислого карбоната натрия и дважды экстрагировали 100 мл хлороформа. Полученный экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и сушили в вакууме. Получали 0,07 г 2-хлорметил-3-метил-4-(2-сукцинимидоэтокси)пиридина в виде белых полукристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,15 (с. 3Н) 2,68 (с. 4Н) 3,80 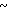 4,20 (м. 4Н) 4,60 (с. 2Н) 6,61 (д. Н) 8,22 (д. Н).
4,20 (м. 4Н) 4,60 (с. 2Н) 6,61 (д. Н) 8,22 (д. Н).
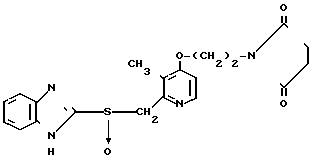
П р и м е р 11. 2-[{3-Метил-4-(2-сукцинимидоэтокси)пиридин-2-ил}метил-тио]-1Н- бензимидазол.
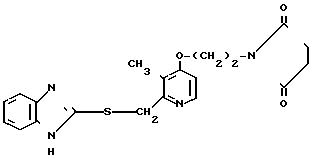
Смесь, содержащую 0,03 г (0,18 ммоль) 2-меркапто-1Н-бензимидазола, 0,06 г (0,21 ммоль) 2-хлорметил-3-метил-4-(2-сукцинимидоэтокси)пиридина, 0,03 г (0,21 ммоль) карбоната калия и 10 мл метилэтилкетона, нагревали с обратным холодильником в атмосфере азота 3 ч, охлаждали и фильтровали. Фильтрат концентрировали и сушили в вакууме с последующим добавлением воды. Полученную смесь три раза экстрагировали 50 мл хлороформа. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и очищали хроматографией на колонке силикагеля. Получали 0,08 г 2-[{3-метил-4-(2-сукцинимидоэтокси)пиридин-2-ил}метилтио]-1Н- бензимидазола в виде белых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,09 (с. 3Н) 2,63 (с. 4Н) 3,72 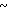 4,16 (м. 4Н) 4,27 (с. 2Н) 6,53 (д. Н) 6,90
4,16 (м. 4Н) 4,27 (с. 2Н) 6,53 (д. Н) 6,90 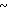 7,50 (м. 4Н) 8,13 (д. Н).
7,50 (м. 4Н) 8,13 (д. Н).
П р и м е р 12. 2-[{3-Метил-4-(2-сукцинимидоэтокси)пиридин-2-ил}метилсульфинил] -1Н-бензимидазол.
0,18 г 95%-ный м-хлорнадбензойной кислоты постепенно добавляли к раствору 0,40 г (1 ммоль) 2-[{3-метил-4-(2-сукциимидоэтокси)пиридин-2-ил}метилтио] -1Н- бензимидазола в 20 мл дихлорметана при -60оС для получения смеси. Смесь перемешивали полчаса с последующим добавлением 0,15 г триэтиламина. Полученную смесь нагревали до -10оС, затем добавляли 30 мл насыщенного водного раствора кислого карбоната натрия. Полученную смесь перемешивали 0,5 ч и экстрагировали дважды 50 мл дихлорметана. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и сушили в вакууме для получения неочищенного продукта. Неочищенный продукт кристаллизовали из смеси дихлорметандиэтиловый эфир и получали 0,36 г 2-[{3-метил-4-(2-сукцинимидоэтокси)пиридин-2-ил} метилсульфинил- 1Н-бензимидазола в виде белых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,12 (с. 3Н) 2,73 (с. 4Н) 3,83  4,29 (м. 4Н) 4,56 4,92 (м. 2Н) 6,65 (д. Н) 7,17
4,29 (м. 4Н) 4,56 4,92 (м. 2Н) 6,65 (д. Н) 7,17  7,72 (м. 4Н) 8,25 (д. Н).
7,72 (м. 4Н) 8,25 (д. Н).
П р и м е р 13. 5-Метокси-2-[{3-метил-4-(2-сукцинимидоэтокси)пиридин-2-ил} метилтио]-1Н-бензимидазол.
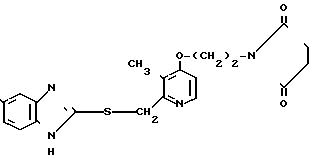
Целевое соединение получали способом, аналогичным описанному в примере 11.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,20 (с. 3Н) 2,74 (с. 4Н) 3,84 (с. 3Н) 3,88 ( 4,38 (м. 4Н) 4,35 (с. 2Н) 6,71 (д. Н) 6,80
4,38 (м. 4Н) 4,35 (с. 2Н) 6,71 (д. Н) 6,80  7,48 (м. 3Н) 8,35 (д. Н).
7,48 (м. 3Н) 8,35 (д. Н).
П р и м е р 14. 2-[{3-Метил-4-(2-сукцинимидоэтокси)пиридин-2-ил}-метилтио]-5- трифторметил-1Н-бензимидазол.
F3C 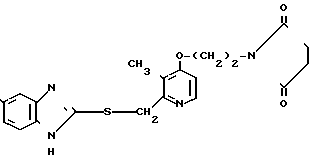
Указанное соединение получали способом, аналогичным описанному в примере 11.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,22 (с. 3Н) 2,75 (с. 4Н) 3,88  4,08 (м. 2Н) 4,08
4,08 (м. 2Н) 4,08  4,28 (м. 2Н) 46,45 (с. 2Н) 6,73 (д. Н) 7,32 (
4,28 (м. 2Н) 46,45 (с. 2Н) 6,73 (д. Н) 7,32 ( 7,86 (м. 3Н) 8,32 (д. Н).
7,86 (м. 3Н) 8,32 (д. Н).
П р и м е р 15. 5-Метокси-2-[{3-метил-4-(2-сукцинимидоэтокси)пиридин-2-ил} метилcульфинил]-1Н-бензимидазол.
Указанное соединение получали способом, аналогичным описанному в примере 12.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,13 (с. 3Н) 2,74 (с. 4Н) 3,86 (с. 3Н) 3,60 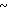 4,30 (м. 4Н) 4,50
4,30 (м. 4Н) 4,50 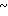 4,90 (м. 2Н) 6,65 (д. Н) 6,80
4,90 (м. 2Н) 6,65 (д. Н) 6,80 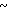 7,68 (м. 3Н) 8,25 (д. Н).
7,68 (м. 3Н) 8,25 (д. Н).
П р и м е р 16. 2-[{3-Метил-4-(2-сукцинимидоэтокси)пиридин-2-ил}метилсульфинил] -1Н-5-трифторметилбензимидазол.
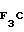
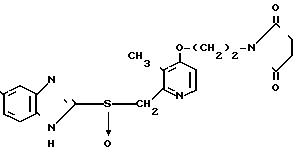
Указанное соединение получали способом, аналогичным описанному в примере 12.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,23 (с. 3Н) 2,75 (с. 4Н) 3,80  4,45 (м. 4Н) 4,67 (м. 2Н) 6,74 (д. Н) 7,30
4,45 (м. 4Н) 4,67 (м. 2Н) 6,74 (д. Н) 7,30  8,00 (м. 3Н) 8,37 (д. Н).
8,00 (м. 3Н) 8,37 (д. Н).
Пример получения 8. N-оксид 2,3-диметил-4-(2-пиридилметоксиэтокси)пиридина.
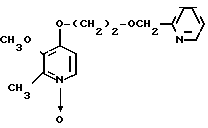
0,39 г 60%-ого гидрида натрия добавляли к суспензии 1,20 г (6,5 ммоль) N-оксида 4-(2-оксиэтокси)-2,3-диметилпиридина в 40 мл тетрагидрофурана при охлаждении льдом в атмосфере азота для получения смеси. Эту смесь перемешивали полчаса с последующим добавлением 0,83 г (6,5 ммоль) 2-хлорметилпиридина. Полученную смесь нагревали с обратным холодильником 8 ч, охлаждали и фильтровали. Фильтрат концентрировали и очищали хроматографией на колонке силикагеля (растворителем служила смесь этилацетат н-гексан в соотношении 4: 1 и хлороформ-метанол в соотношении 19:1). Получали 0,61 г N-оксида 2,3-диметил-4-(2-пиридилметоксиэтокси)пиридина.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,20 (с. 3Н) 2,50 (с. 3Н) 3,80 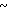 4,04 (м. 2Н) 4,04
4,04 (м. 2Н) 4,04 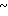 4,28 (м. 2Н) 4,70 (с. 2Н) 6,60 (д. Н) 7,00
4,28 (м. 2Н) 4,70 (с. 2Н) 6,60 (д. Н) 7,00 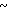 7,74 (м. 3Н) 8,04 (д. Н) 8,45 (д. Н).
7,74 (м. 3Н) 8,04 (д. Н) 8,45 (д. Н).
Пример получения 9. 2-Гидроксиметил-3-метил-4-(2-пиридилметоксиэтокси)пири- дин.
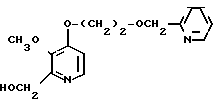
Смесь, содержащую 0,60 г N-оксида 2,3-диметил-4-(2-пиридилметоксиэтокси)пири- дина в уксусный ангидрид, перемешивали при 100оС полчаса и охлаждали, затем добавляли 40 мл этанола. Полученную смесь перемешивали полчаса при комнатной температуре и дистилляцией удаляли растворитель. Остаток сушили в вакууме и получали 0,47 г неочищенного 2-ацетокси-3-метил-4-(2-пиридилметоксиэтокси)пиридина в виде масла.
Этот неочищенный промежуточный продукт растворяли в 1 н. хлористоводородной кислоте для получения раствора. Этот раствор перемешивали при 100оС 1 ч, охлаждали, нейтрализовали насыщенным водным раствором кислого карбоната натрия и дважды экстрагировали 50 мл дихлорметана. Экстракт сшили над сульфатом магния и фильтровали. Фильтрат концентрировали и очищали хроматографией на колонке силикагеля (растворителем служил этилацетат) и получали 0,40 г 2-гидроксиметил-3-метил-4-(2-пиридилметоксиэтокси)пиридина в виде бесцветных полукристаллов.
П р и м е р 17. 2-[{3-Метил-4-(2-пиридилметоксиэтокси)пиридин-2-ил}метилтио]-1Н- бензимидазол.
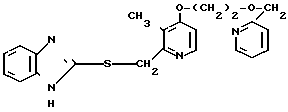
0,71 г (5 ммоль) хлористого тионила добавляли к раствору 0,40 г (1,5 ммоль) 2-гидроксиметил-3-метил-4-(2-пиридилметокси-этокси)пиридина в 10 мл хлороформа при охлаждении льдом для получения смеси. Эту смесь перемешивали при 0оС 2 ч. По окончании реакции смесь нейтрализовали насыщенным водным раствором кислого карбоната натрия и экстрагировали четыре раза 50 мл хлороформа. Экстракт сушили над сульфатом магния и фильтровали. Полученный фильтрат концентрировали и сушили в вакууме и получали 0,42 г неочищенного 2-хлорметил-3-метил-4-(2-пиридилметокси- этокси)пиридина в виде полукристаллов.
Смесь, содержащую 0,40 г этого неочищенного промежуточного соединения 0,18 г 2-меркапто-1Н-бензимидазола 0,19 г карбоната калия и 30 мл метилэтилкетона, нагревали с обратным холодильником в атмосфере азота 2 ч, охлаждали и фильтровали. Фильтрат концентрировали и очищали хроматографией на колонке силикагеля (растворитель смесь этилацетат н-гексан). Получали 0,38 г 2-[{ 3-метил-4-(2-пиридилметоксиэтокси)пиридин-2-ил} мет-илтио]-1Н- бензимидазола в виде бесцветного масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,26 (с. 3Н) 3,80  4,04 (м. 2Н) 4,10
4,04 (м. 2Н) 4,10  4,28 (м. 2Н) 4,35 (с. 2Н) 4,70 (с. 2Н), 6,70 (д. Н) 6,94
4,28 (м. 2Н) 4,35 (с. 2Н) 4,70 (с. 2Н), 6,70 (д. Н) 6,94  7,20 (м. 7Н) 8,25 (д. Н) 8,45 (д. Н).
7,20 (м. 7Н) 8,25 (д. Н) 8,45 (д. Н).
П р и м е р 18. 2-[{3-Метил-4-(2-пиридилметоксиэтокси)пиридин-2-ил}метилсульфи- нил]-1Н-бензимидазол.
0,16 г м-хлорнадбензойной кислоты добавляли к раствору 0,38 г 2-[{3-метил-4-(2-пиридилметоксиэтокси)пиридин-2-ил}ме- тилтио]-1Н- бензимидазола в 20 мл дихлорметана при -60оС в атмосфере азота для получения смеси. Эту смесь перемешивали полчаса. По окончании реакции в реакционную смесь добавляли 0,16 г триэтиламина. Полученную смесь нагревали до -10оС с последующим добавлением 30 мл насыщенного водного раствора кислого карбоната натрия. Полученную смесь перемешивали при комнатной температуре полчаса и трижды экстрагировали 50 мл дихлорметана. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и сушили в вакууме для получения неочищенного продукта. Это неочищенное соединение кристаллизовали из смеси дихлорметандиэтиловый эфир и получали 0,31 г 2-[{3-метил-4-(2-пиридилметоксиэтокси)пиридин-2-ил} метилсульфинил] 1Н-бензимидазола в виде белых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,17 (с. 3Н) 3,83 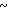 4,06 (м. 2Н) 4,06
4,06 (м. 2Н) 4,06 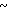 4,34 (м. 2Н) 4,72 (с. 2Н) 4,64
4,34 (м. 2Н) 4,72 (с. 2Н) 4,64 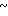 4,84 (м. 2Н) 6,70 (д. Н) 7,04
4,84 (м. 2Н) 6,70 (д. Н) 7,04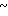 7,80 (м. 7Н) 8,27 (д. Н) 8,55 (д. Н).
7,80 (м. 7Н) 8,27 (д. Н) 8,55 (д. Н).
Пример получения 10. N-оксид 2,3-диметил-4-[2-(2-пирролидон)этокси]пиридина.
0,42 г гидрида натрия добавляли к 30 мл N,N-диметилформамида при комнатной температуре для получения смеси. Эту смесь охлаждали до 0оС с последующим добавлением 0,74 г 2-пирролидона. Полученную смесь перемешивали при 0оС полтора часа и охлаждали до комнатной температуры с последующим добавлением 1,17 г N-оксида 4-(2-хлорэтокси)-2,3-диметилпиридина. Полученную смесь перемешивали при температуре 60-80оС 5 ч и охлаждали с последующим добавлением 20 мл насыщенного водного раствора кислого карбоната натрия. Полученную смесь экстрагировали хлороформом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали для получения неочищенного продукта. Этот неочищенный продукт очищали хроматографией на колонке силикагеля и получали 430 мг N-оксида 2,3-диметил-4-[-2-(2-пирролидон)этокси]пиридина в виде желтых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,2 (с. 3Н) 2,54 (с. 3Н) 1,9 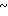 2,5 (м. 4Н) 3,57 (т. I 7 Гц, 2Н) 3,73 (т. I 6 Гц, 2Н) 4,1 6 (д. I6 Гц, 2Н) 6,65 (д. I 7 Гц, 1Н) 8,15 (д. I7 Гц, 1Н).
2,5 (м. 4Н) 3,57 (т. I 7 Гц, 2Н) 3,73 (т. I 6 Гц, 2Н) 4,1 6 (д. I6 Гц, 2Н) 6,65 (д. I 7 Гц, 1Н) 8,15 (д. I7 Гц, 1Н).
Пример получения 11. 2-Хлорметил-3-метил-4-[-2-(2-пирролидон)этокси] пири- дин.
10 мл уксусного ангидрида добавляли к 0,65 г N-оксида 2,3-диметил-4-[2-(2-пирролидон)этокси] пиридина при комнатной температуре для получения смеси. Эту смесь перемешивали при температуре 90оС 2 ч с последующим добавлением этанола. Полученную смесь отгоняли при пониженном давлении и получали 0,79 г неочищенного 2-ацетоксиметил-3-метил-4-[2-(2-пиррои- дон)этокси]пиридина.
20 мл 1 н. хлористоводородной кислоты добавляли к этому неочищенному промежуточному соединению для получения смеси. Эту смесь перемешивали при 100оС 2 ч, охлаждали, нейтрализовали насыщенным водным раствором кислого карбоната натрия и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли при пониженном давлении и получали 510 мг неочищенного 2-гидроксиметил-3-метил-4-[2-(2-пирролидон)этокси]пиридина в виде коричневато-желтых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,04 (с. 3Н) 1,9  2,6 (м. 4Н) 3,58 (т. I 7 Гц, 2Н) 3,73 (т. I 6 Гц, 2Н) 4,65 (с. 2Н) 6,7 (д. I7 Гц, 1Н) 8,3 (д. I 7 Гц, 1Н).
2,6 (м. 4Н) 3,58 (т. I 7 Гц, 2Н) 3,73 (т. I 6 Гц, 2Н) 4,65 (с. 2Н) 6,7 (д. I7 Гц, 1Н) 8,3 (д. I 7 Гц, 1Н).
500 г этого неочищенного промежуточного соединения растворяли в 10 мл дихлорметана для получения раствора. К этому раствору при -20оС добавляли по каплям 1,19 г хлористого тионила. Полученную смесь перемешивали при комнатной температуре 30 мин, нейтрализовали насыщенным водным раствором кислого карбоната натрия и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли при пониженном давлении и получали 0,57 мг неочищенного 2-хлорметил-3-метил-4-[2-(2-пирроидон)этокси]пиридина в виде масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,25 (с. 3Н) 1,8  2,5 (м. 4Н) 3,54 (т. I 7 Гц, 2Н) 3,68 (т. I 6 Гц, 2Н) 4,1 (т. I 6 Гц, 2Н) 6,62 (д. I 6 Гц, 1Н) 8,22 (д. I 6 Гц, 1Н).
2,5 (м. 4Н) 3,54 (т. I 7 Гц, 2Н) 3,68 (т. I 6 Гц, 2Н) 4,1 (т. I 6 Гц, 2Н) 6,62 (д. I 6 Гц, 1Н) 8,22 (д. I 6 Гц, 1Н).
П р и м е р 19. 2-[3-Метил-4-{2-(2-пирролидон)этокси}пиридин-2-ил]метилтио-1Н- бензимидазол.
20 мл метилэтилкетона добавляли к смеси, содержащей 0,55 г 2-хлорметил-3-метил-[2-(2-пирролидон)этокси] пиридина, 0,3 г 2-меркапто-1Н-бензимидазола и 0,33 г карбоната калия для получения смеси. Эту смесь нагревали с обратным холодильником 2 ч и фильтровали. Фильтрат концентрировали для получения неочищенного продукта. Этот сырой продукт очищали хроматографией на колонке силикагеля и получали 0,27 г целевого соединения в виде бледно-желтых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,26 (с. 3Н) 1,8  2,5 (м. 4Н) 3,57 (т. I 7 Гц, 2Н) 3,7 (т. I 6 Гц, 2Н) 4,13 (т. I 6 Гц, 2Н) 4,34 (с. 2Н) 6,66 (д. I 6 Гц, 1Н) 7,0
2,5 (м. 4Н) 3,57 (т. I 7 Гц, 2Н) 3,7 (т. I 6 Гц, 2Н) 4,13 (т. I 6 Гц, 2Н) 4,34 (с. 2Н) 6,66 (д. I 6 Гц, 1Н) 7,0  7,55 (м. 4Н) 8,25 (д. I 6 Гц, 1Н).
7,55 (м. 4Н) 8,25 (д. I 6 Гц, 1Н).
П р и м е р 20. 5-Метокси-2-[3-метил-4-{2-(2-пирролидон)этокси}пиридин-2-ил] метилтио-1Н-бензимидазол.

Указанное соединение было получено способом, аналогичным описанному в примере 19.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,24 (с. 3Н) 1,9  2,5 (м. 4Н) 3,56 (т. I 7 Гц, 2Н) 3,72 (т. I 6 Гц, 2Н) 3,83 (с. 3Н) 4,17 (т. I 6 Гц, 2Н) 4,4 (с. 2Н) 6,6
2,5 (м. 4Н) 3,56 (т. I 7 Гц, 2Н) 3,72 (т. I 6 Гц, 2Н) 3,83 (с. 3Н) 4,17 (т. I 6 Гц, 2Н) 4,4 (с. 2Н) 6,6  7,5 (м. 4Н) 8,35 (д. I 6 Гц, 1Н).
7,5 (м. 4Н) 8,35 (д. I 6 Гц, 1Н).
П р и м е р 21. 2-[3-Метил-4-{2-(2-пирроидон)этокси}пиридин-2-ил]метилтио-5- трифторметил-1Н-бензимидазол.
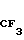
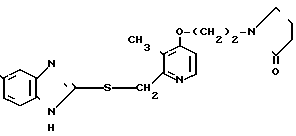
Указанное соединение получали способом, аналогичным описанному в примере 19.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,28 (с. 3Н) 1,9  2,55 (м. 4Н) 3,57 (т. I 7 Гц, 2Н) 3,74 (т. I 6 Гц, 2Н) 4,2 (т. I 6 Гц, 2Н) 4,4 (с. 2Н) 6,7
2,55 (м. 4Н) 3,57 (т. I 7 Гц, 2Н) 3,74 (т. I 6 Гц, 2Н) 4,2 (т. I 6 Гц, 2Н) 4,4 (с. 2Н) 6,7  7 (д. I 6 Гц, 1Н) 7,27
7 (д. I 6 Гц, 1Н) 7,27 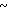 7,85 (м. 3Н) 8,38 (д. I 6 Гц, 1Н).
7,85 (м. 3Н) 8,38 (д. I 6 Гц, 1Н).
П р и м е р 22. 2-[3-Метил-4-{2-(2-пирролидон)этокси}пиридин-2-ил]метилсульфи-нил- 1Н-бензимидазол.
0,27 г 2-[3-метил-4-{ 2-(2-пирролидон)этокси}пиридин-2-ил]метилтио-1Н- бензимидазола растворяли в 20 мл дихлорметана для получения раствора. К этому раствору при -60оС добавляли 0,12 г 95%-ный м-хлорнадбензойной кислоты. Полученную смесь перемешивали при от -50 до -40оС 4 ч с последующим добавлением 0,9 г триэтиламина и насыщенного водного раствора кислого карбоната натрия. Полученную смесь экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали для получения неочищенного продукта. Этот неочищенный продукт кристаллизовали из смеси дихлорметан-эфир и получали 0,18 г целевого соединения.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,18 (с. 3Н) 1,9  2,5 (м. 4Н) 3,53 (т. I 7 Гц, 2Н) 3,73 (т. I 6 Гц, 2Н) 4,16 (т. I 6 Гц, 2Н) 4,74 (АВкв, I 14 Гц, Δν 16 Гц, 2Н) 6,7 (д. I 6 Гц, 1Н) 7,2
2,5 (м. 4Н) 3,53 (т. I 7 Гц, 2Н) 3,73 (т. I 6 Гц, 2Н) 4,16 (т. I 6 Гц, 2Н) 4,74 (АВкв, I 14 Гц, Δν 16 Гц, 2Н) 6,7 (д. I 6 Гц, 1Н) 7,2  7,7 (м. 4Н) 6,25 (д. I 6 Гц, 1Н).
7,7 (м. 4Н) 6,25 (д. I 6 Гц, 1Н).
П р и м е р 23. 5-Метокси-2-[3-метил-4-{-(2-пирролидон)этокси}пиридин-2-ил] метилсульфинил-1Н-бензимидазол.
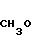
Указанное соединение получали способом, аналогичным описанному в примере 22.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,17 (с. 3Н) 1,9  2,5 (м. 4Н) 3,88
2,5 (м. 4Н) 3,88  3,78 (м. 4Н) 3,8 (с. 3Н) 4,1 (т. I 6 Гц, 2Н) 4,66 (АВ кв. I 13 Гц, Δν 12, 4 Гц, 2Н) 6,6 (д. I 6 Гц, 1Н) 6,77
3,78 (м. 4Н) 3,8 (с. 3Н) 4,1 (т. I 6 Гц, 2Н) 4,66 (АВ кв. I 13 Гц, Δν 12, 4 Гц, 2Н) 6,6 (д. I 6 Гц, 1Н) 6,77  7,6 (м. 3Н) 8,17 (д. I 6 Гц, 1Н).
7,6 (м. 3Н) 8,17 (д. I 6 Гц, 1Н).
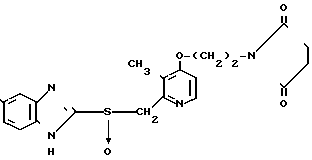
П р и м е р 24. 2-[3-Метил-4-{2-(2-пирролидон)этокси}пиридин-2-ил]метилсульфи-нил-5- трифторметил-1Н-бензимидазол.
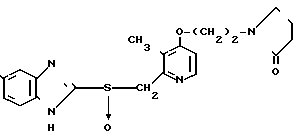
Указанное соединение получали способом, аналогичным описанному в примере 22.
Спектр ЯМР на ядрах 1Н ( СДСl3) δ: 2,17 (с. 3Н) 1,8  2,55 (м. 4Н) 3,4
2,55 (м. 4Н) 3,4 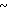 3,8 (м. 4Н) 4,75 (АВ кв. I 14,3 Гц, Δν 17,5 Гц, 2Н) 6,69 (д. I 6 Гц, 1Н) 7,24
3,8 (м. 4Н) 4,75 (АВ кв. I 14,3 Гц, Δν 17,5 Гц, 2Н) 6,69 (д. I 6 Гц, 1Н) 7,24 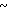 8,0 Э (м. 3Н) 8,2 (д. I6 Гц, 1Н).
8,0 Э (м. 3Н) 8,2 (д. I6 Гц, 1Н).
Пример получения 12. 2-Хлорметил-4-(2-гидроксиэтокси)-3-метилпиридин.
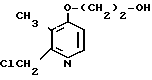
15 мл уксусного ангидрида добавляли к 25 г N-оксида 4-(2-гидрокси)-2,3-диметилпиридина для получения раствора. Раствор перемешивали при 90оС 2 ч с последующим добавлением этанола. Полученную смесь перегоняли при пониженном давлении и получали 4-(2-ацетоксиэтокси)-2-ацетоксиметил-3-метилпиридин.
20 г гидроокись натрия, 20 мл воды и 50 мл этанола добавляли к этому промежуточному соединению для получения смеси. Эту смесь перемешивали при комнатной температуре 10 мин и отгоняли для удаления этанола с последующим добавлением 50 мл насыщенного водного раствора поваренной соли. Полученную смесь экстрагировали 2-бутанолом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли при пониженном давлении для получения 20 г 4-(2-гидроксиэтокси)-2-гидроксиметил-3-метилпиридина.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,02 (с. 3Н) 3,9 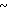 4,2 (м. 4Н) 4,50 (с. 2Н) 6,63 (д. I 6 Гц, 1Н) 8,15 (д. I 6 Гц, 1Н).
4,2 (м. 4Н) 4,50 (с. 2Н) 6,63 (д. I 6 Гц, 1Н) 8,15 (д. I 6 Гц, 1Н).
11,9 г полученного 4-(2-гидроксиэтокси)-2-гидроксиметил-3-метилпиридина растворяли в 200 мл дихлорметана для получения раствора. К этому раствору по каплям добавляли при 0оС 24 мл хлористого тионила. Полученную смесь перемешивали при комнатной температуре 2 ч и перегоняли при пониженном давлении для удаления дихлорметана и избыточного хлористого тионила. К остатку добавляли насыщенный водный раствор кислого карбоната натрия для получения смеси. Эту смесь экстрагировали хлороформом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и получали 10,9 г 2-хлорметил-4-(2-гидроксиэтокси)-3-метил- пиридина.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,3 (с. 3Н) 3,9  4,2 (м. 4Н) 4,69 (с. 2Н) 6,73 (д. I 6 Гц, 1Н) 8,3 (д. I Гц, 1Н).
4,2 (м. 4Н) 4,69 (с. 2Н) 6,73 (д. I 6 Гц, 1Н) 8,3 (д. I Гц, 1Н).
П р и м е р 25. 2-[4-(2-гидроксиэтокси)-3-метилпиридин-2-ил]метилтио-5-метокси- 1Н-бензимидазол.
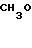
60 мл этанола добавляли к смеси, содержащей 0,7 г 2-хлор-4-(2-гидроксиэтокси)-3-метилпиридина, 0,63 г 2-меркапто-5-метокси-1Н-бензимидазола и 0,16 г гидроокиси натрия для получения смеси. Эту смесь перемешивали при 60оС 1 ч, концентрировали, очищали хроматографией на колонке силикагеля и получали 1,08 г указанного целевого соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,2 (с. 3Н) 3,72 (с. 3Н) 3,6  4,1 (м. 4Н) 4,6 (с. 2Н) 6,6
4,1 (м. 4Н) 4,6 (с. 2Н) 6,6  7,35 (м. 4Н) 8,14 (д. I 6 Гц, 1Н).
7,35 (м. 4Н) 8,14 (д. I 6 Гц, 1Н).
П р и м е р 26. 2-[4-(2-гидроксиэтокси)-3-метилпиридин-2-ил]метилтио-1Н-бензи- мидазол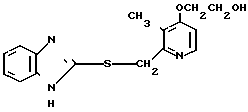
Указанное целевое соединение получали способом, аналогичным описанному в примере 25.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,24 (с. 3Н) 3,6  4,18 (м. 4Н) 4,7 (с. 2Н) 6,93 (д. I 6 Гц, 1Н) 7,0
4,18 (м. 4Н) 4,7 (с. 2Н) 6,93 (д. I 6 Гц, 1Н) 7,0  7,6 (м. 4Н) 8,25 (д. I 6 Гц, 1Н).
7,6 (м. 4Н) 8,25 (д. I 6 Гц, 1Н).
П р и м е р 27. 2-[4-(2-гидроксиэтокси)-3-метилпиридин-2-ил]метилтио-5-трифтор- метил- 1Н-бензимидазол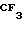
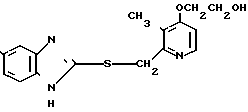
Указанное целевое соединение получали способом, аналогичным описанному в примере 25.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,25 (с. 3Н) 3,6  4,2 (м. 4Н) 4,75 (с. 2Н) 6,96 (д. I 6 Гц, 1Н) 7,3
4,2 (м. 4Н) 4,75 (с. 2Н) 6,96 (д. I 6 Гц, 1Н) 7,3  7,9 (м. 3Н) 8,25 (д. I 6 Гц, 1Н).
7,9 (м. 3Н) 8,25 (д. I 6 Гц, 1Н).
П р и м е р 28. 2-[4-(2-гидроксиэтокси)-3-метилпиридин-2-ил]метилусульфинилме- токси- 1Н-бензимидазол.
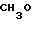
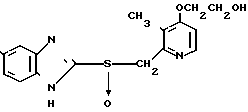
0,9 г 2-[4-(2-гидроксиэтокси)-3-метилпиридин-2-ил]метилтио-5-метокси-1Н- бензимидазола растворяли в смеси, содержащей 5 мл метанола и 80 мл дихлорметана для получения раствора. К этому раствору при -60оС добавляли 0,51 г м-хлорнадбензойной кислоты. Полученную смесь перемешивали при температуре от -50 до -40оС четыре с половиной часа, с последующим добавлением 0,33 г триэтиламина. К полученной смеси добавляли насыщенный водный раствор кислого карбоната натрия, и образовавшуюся смесь экстрагировали хлороформом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли при пониженном давлении и получали неочищенный продукт. Этот сырой продукт кристаллизовали из смеси дихлорметан-изопропиловый эфир и получали 0,58 г указанного целевого соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,17 (с. 3Н) 3,8 (с. 3Н) 3,6  4,18 (м. 4Н) 4,73 (АВ кв. I 14 Гц Δν 8 Гц, 2Н) 6,8
4,18 (м. 4Н) 4,73 (АВ кв. I 14 Гц Δν 8 Гц, 2Н) 6,8  7,6 (м. 4Н) 8,21 (д. I 6 Гц, 1Н).
7,6 (м. 4Н) 8,21 (д. I 6 Гц, 1Н).
П р и м е р 29. 2-[4-(2-гидроксиэтокси)-3-метилпиридин-2-ил]метилсульфинил-1Н- бензимидазол.
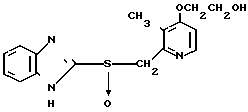
Указанное соединение получается по способу, аналогичному описанному в примере 28.
Масс-спектр М+1: 332.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,17 (с. 3Н) 3,6  4,2 (м. 4Н) 4,74 (с. 2Н) 6,95 (д. I 6 Гц, 1Н) 7,18
4,2 (м. 4Н) 4,74 (с. 2Н) 6,95 (д. I 6 Гц, 1Н) 7,18  7,77 (м. 4Н) 8,22 (д. I 6 Гц, 2Н).
7,77 (м. 4Н) 8,22 (д. I 6 Гц, 2Н).
П р и м е р 30. 2-[4-(2-гидроксиэтокси)-3-метилпиридин-2-ил]метилсульфинил -5-трифторметил-1Н-бензимидазол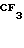
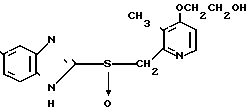
Указанное целевое соединение получали способом, аналогичным описанному в примере 28.
Пример получения 13. N-оксид-4-(3-метоксипропокси)-2,3-диметилпиридина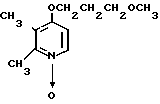
2,0 г (22 ммоль) 3-метоксипропанола растворяли в 50 мл диметилсульфоксида для получения раствора. К этому раствору при комнатной температуре добавляли 2,7 г (66 ммоль) гидрида натрия. Полученную смесь перемешивали при 60оС 1 ч и охлаждали до комнатной температуры с последующим добавлением 3,0 г (19 ммоль) N-оксида 4-хлор-2,3-диметилпиридина. Полученную смесь перемешивали при 40оС 1 ч. После завершения реакции реакционную смесь перегоняли для удаления диметилсульфоксида. Полученный остаток очищали хроматографией на колонке из силикагеля и получали 760 мг 4-(3-метоксипропокси)-2,3-пиридина в форме N-оксида.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,1 (м. 2Н) 2,2 (с. 3Н) 2,54 (с. 3H) 3,35 (с. 3Н) 3,55 (т. I 6 Гц, 2Н) 4,1 (т. I 6 Гц, 2Н) 6,65 (д. I 7,4 Гц, 1Н) 8,16 (д. I 7,4 Гц, 1Н).
Пример получения 14. 2-Хлорметил-4-(3-метоксипропокси)-3-метилпиридин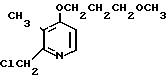
20 мл уксусного ангидрида добавляли к 760 мг (3,6 ммоль) N-оксида 4-(3-метоксипропокси)-2,3-диметилпиридина для проведения реакции при 90оС в течение 1 ч. Реакционную смесь перегоняли для удаления уксусного ангидрида с последующим добавлением насыщенного водного раствора кислого карбоната натрия. Полученную смесь экстрагировали хлороформом. Экстракт концентрировали и получали 700 мг 2-ацетоксиметил-4-(3-метоксипропокси)-3- метилпиридина в виде коричневого масла.
К полученному выше 2-ацетоксиметил-4-(3-метоксипропокси)-3-метилпиридину добавляли 500 мг гидроокиси натрия и 15 мл этанола. Полученную смесь перемешивали при 50оС 1 ч. По завершении реакции реакционную смесь перегоняли для удаления этанола с последующим добавлением воды. Полученную смесь экстрагировали хлороформом. Хлороформный слой концентрировали и получали 450 мг 2-гидроксиметил-4-(3-метоксипропокси)-3-метилпиридина в виде коричневого масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,04 (с. 3Н) 2,1 (м. 2Н) 3,35 (с. 3Н) 3,50 (т. I 5,7 Гц, 2Н) 4,12 (т. I 5,7 Гц, 2Н) 4,64 (с. 2Н) 6,7 (д. I 7 Гц, 1Н) 8,24 (д. I 7 Гц, 1Н).
450 мг 2-гидроксиметил-4-(3-метоксипропокси)-3-метилпиридина, полученного выше, растворяли в 20 мл дихлорметана для получения раствора. К этому раствору при 0оС по каплям добавляли 760 мг хлористого тионила. Полученную смесь перемешивали при комнатной температуре 2 ч. После завершения реакции реакционную смесь перегоняли для удаления дихлорметана и хлористого тионила. К полученному остатку добавляли насыщенный водный раствор кислого карбоната натрия. Полученную смесь экстрагировали хлороформом. Хлороформный слой концентрировали и получали 470 мг 2-хлорметил-4-(3-метоксипропокси)-3-метилпиридина в виде коричневых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,1 (м. 2Н) 2,27 (с. 3Н) 3,36 (с. 3Н) 3,56 (т. I5,7 Гц, 2Н) 4,12 (т. I 5,7 Гц, 2Н) 4,69 (с. 2Н) 6,71 (д. I 7 Гц, 1Н) 8,26 (д. I 7 Гц, 1Н).
П р и м е р 31. 2-[{4-(3-метоксипропокси)-3-метилпиридин-2-ил]метил-тио] -1Н- бензимидазол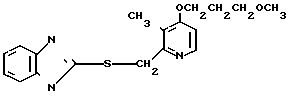
20 мл этанола добавляли к смеси, содержащей 280 мг (1,8 ммоль) 2-меркапто-1Н-бензимидазола, 470 мг (2 ммоль) 2-xлорметил-4-(3-метоксипропокси)-3-ме- тилпиридина и 100 мг (2,4 ммоль) гидроокиси натрия. Полученную смесь перемешивали при 50оС 3 ч. После окончания реакции реакционную смесь перегоняли для удаления этанола. Полученный остаток очищали хроматографией на колонке силикагеля и получали 590 мг 2-[{4-(3-метоксипропокси)-3-метилпиридин-2-ил} метилтио]-1Н -бензимида- зола в виде бледно-желтых кристаллов. Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,09 (т. I 6,1 Гц, 2Н) 2,26 (с. 3Н) 3,35 (с. 3Н) 3,56 (т. I 6,1 Гц, 2Н) 4,13 (т. I 6,1 Гц, 2Н) 4,37 (с. 2Н) 6,76 (д. I 6,1 Гц, 1Н) 7,1  7,25 (м. 2Н) 7,5 (шир.с. 2Н) 8,33 (д. I 6,1 Гц, 1Н).
7,25 (м. 2Н) 7,5 (шир.с. 2Н) 8,33 (д. I 6,1 Гц, 1Н).
П р и м е р 32. 2-{4-(3-Метоксипропокси)-3-метилпиридин-2-ил}метилсульфинил-1Н- бензимидазол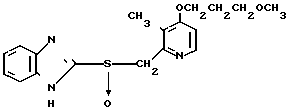
5 г 2-[{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилтио]-1Н- бензимидазола растворяли в смеси, содержащей 100 мл дихлорметана и 25 мл диэтилового эфира, для получения раствора. К этому раствору по частям при температуре -45оС добавляли 2,83 г 85%-ной м-хлорнадбензойной кислоты. После окончания реакции в реакционную смесь добавляли 2 г триэтиламина, полученную смесь нагревали до -10оС с последующим добавлением 50 мл 1 н.гидроокиси натрия. Полученную смесь перемешивали при комнатной температуре 30 мин. Водный слой дважды промывали 20 мл дихлорметана и доводили его рН до 112 М водным раствором уксуснокислого аммония. Водный слой трижды экстрагировали 50 мл дихлорметана. Полученный дихлорметановый слой два раза промывали 50 мл насыщенного водного раствора кислого углекислого натрия, сушили над сульфатом магния и перегоняли для удаления дихлорметана. Полученный маслянистый продукт кристаллизовали из смеси дихлорметан-эфир и получали 4,17 г указанного целевого соединения в виде белых кристаллов. Точка плавления 99-110оС (с разложением).
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,83  2,09 (м. 2Н) 2,13 (с. 3Н) 3,34 (с. 3Н) 3,52 (т. I 6,2 Гц, 2Н) 4,05 (т. I 6,2 Гц, 2Н) 4,79 (с. 2Н) 6,70 (д. I 5,7 Гц, 1Н) 7,07
2,09 (м. 2Н) 2,13 (с. 3Н) 3,34 (с. 3Н) 3,52 (т. I 6,2 Гц, 2Н) 4,05 (т. I 6,2 Гц, 2Н) 4,79 (с. 2Н) 6,70 (д. I 5,7 Гц, 1Н) 7,07  7,30 (м. 2Н) 7,30
7,30 (м. 2Н) 7,30  7,60 (шир.с. 2Н) 8,27 (д. I 5,7 Гц, 1Н).
7,60 (шир.с. 2Н) 8,27 (д. I 5,7 Гц, 1Н).
П р и м е р 33. Натриевая соль 2-[{4-(3-метоксипропокси)-3-метилпиридин-2-ил} метилсульфинил]-1Н- бензимидазола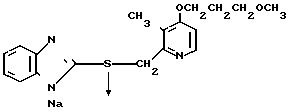
500 мг (1,46 ммоль) 2-[{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилтио] -1Н- бензимидазола растворяли в 20 мл дихлорметана для получения раствора. К этому раствору по частям при температуре -45оС добавляли 320 мг 85% -ной м-хлорнадбензойной кислоты. После завершения реакции в реакционную смесь добавляли 370 мг триэтиламина. Полученную смесь нагревали до -10оС с последующим добавлением насыщенного водного раствора карбоната натрия. Полученную смесь перемешивали при комнатной температуре 30 мин и экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния и перегоняли для удаления дихлорметана. Таким образом получали неочищенный продукт. Этот сырой продукт растворяли в 14,6 мл 0,1 н. водного раствора гидроокиси натрия для получения раствора. Этот раствор три раза перегоняли вместе с 30 мл этанола для удаления воды, как азеотропной смеси с этанолом, и сушили в вакууме. К полученному остатку добавляли эфир для осаждения белых кристаллов. Кристаллы три раза промывали эфиром с помощью декантации и сушили в вакууме. Получали 530 мг натриевой соли 2-[{4-(3-метоксипропокси)-3-метилпиридин-2-ил}ме-тилсульфинил]-1Н- бензимидазола. Т.пл. 140-141оС (с разлож.).
Масс-спектр М+1: 382.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,99 (т. I 6,1 Гц, 2Н) 2,17 (с. 3Н) 3,25 (с. 3Н) 3,49 (т. I 6,1 Гц, 2Н) 4,09 (т. I 6,1 Гц, 2Н) 4,56 (АВ кв. I 14,1 Гц, Δν 21,3 Гц, 2Н) 6,8  6,9 (м. 3Н) 7,4
6,9 (м. 3Н) 7,4  7,5 (м. 2Н) 8,27 (д. I 5,7 Гц, 1Н).
7,5 (м. 2Н) 8,27 (д. I 5,7 Гц, 1Н).
П р и м е р 34. 2-[{4-(3-гидроксипропокси)-3-метилпиридин-2-ил}метилтио] -1Н- бензимидазол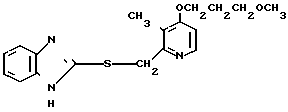
80 мл этанола добавляли к смеси, содержащей 1,39 г (9,27 ммоль) 2-меркаптобензимидазола, 2,0 г (9,27 ммоль) 2-хлорметил-4-(3-гидроксипропокси)-3-ме-тилпиридина и 0,44 г (11,1 ммоль) гидроокиси натрия. Полученную смесь перемешивали при 50оС 1 ч. После окончания реакции реакционную смесь концентрировали. Полученный остаток очищали хроматографией на колонке силикагеля и получали 1,7 г указанного целевого соединения, выход 56%
Масс-спектр М+1: 368
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,8  2,1 (м. 2Н) 2,24 (с. 3Н) 3,6 (т. I 6 Гц, 2Н) 4,2 (т. I 6 Гц, 2Н) 4,7 (с. 2Н) 7,0
2,1 (м. 2Н) 2,24 (с. 3Н) 3,6 (т. I 6 Гц, 2Н) 4,2 (т. I 6 Гц, 2Н) 4,7 (с. 2Н) 7,0  7,38 (м. 3Н) 7,38
7,38 (м. 3Н) 7,38  7,6 (м. 2Н) 8,35 (д. I 6 Гц, 1Н).
7,6 (м. 2Н) 8,35 (д. I 6 Гц, 1Н).
П р и м е р 35. Натриевая соль 2-[{4-(3-гидроксипропокси)-3-метилпиридин-2-ил}метилсульфинил]-1Н- бензимидазола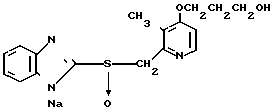
1,0 г (3,04 моль) 2-[{4-(3-гидроксипропокси)-3-метилпиридин-2-ил}метилтио]-1Н- бензимидазола растворяли в 100 мл дихлорметана для получения раствора. К этому раствору добавляли 580 мг 90%-ной м-хлорнадбензойной кислоты при температуре -45оС. Полученную смесь перемешивали 2 ч. После окончания реакции в реакционную смесь добавляли 470 мг триэтиламина. Полученную смесь нагревали до -20оС с последующим добавлением 30 мл насыщенного водного раствора кислого карбоната натрия. Полученную смесь перемешивали при комнатной температуре 30 мин и экстрагировали хлороформом. Хлороформный слой концентрировали для получения неочищенного продукта. Сырой продукт кристаллизовали из смеси дихлорметан-эфир и получали 830 мг 2-[{4-(3-гидроксипропокси)-3-метилпиридин-2-ил} метилсуль- финил] -1Н- бензимидазола. Этот продукт растворяли в 24 мл 0,1 н. водной гидроокиси натрия. Полученный раствор перегоняли вместе с этанолом для удаления воды в виде азеотропной смеси с этанолом и сушили под вакуумом, создаваемым вакуумным насосом. К полученному остатку добавляли эфир для осаждения бесцветных кристаллов. Кристаллы отделяли фильтрацией. Таким образом получали 860 мг указанного целевого соединения с 77% выходом.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,7  2,1 (м. 2Н) 2,16 (с. 3Н) 3,58 (т. I 6 Гц, 2Н) 4,12 (т. I 6 Гц, 2Н) 4,55 (АВ кв. I 13 Гц, Δ I 20 Гц, 2Н) 6,7
2,1 (м. 2Н) 2,16 (с. 3Н) 3,58 (т. I 6 Гц, 2Н) 4,12 (т. I 6 Гц, 2Н) 4,55 (АВ кв. I 13 Гц, Δ I 20 Гц, 2Н) 6,7  7,0 (м. 3Н) 7,3
7,0 (м. 3Н) 7,3  7,6 (м. 2Н) 8,27 (д. I 6 Гц, 1Н).
7,6 (м. 2Н) 8,27 (д. I 6 Гц, 1Н).
П р и м е р 36. 2-[{4-(2-хлорэтокси)-3-метилпиридин-2-ил}метилтио-1Н-бензимида- зол.
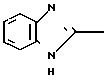 S
S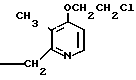
1,3 г неочищенного 2-меркаптобензимидазола, 20 г гидрохлорида 4-(2-хлорэтокси)-2-хлорметил-3-метилпиридина и 11 г гидроокиси натрия растворяли в 300 мл этанола для получения раствора. Этот раствор перемешивали при 60оС 2 ч и перегоняли при пониженном давлении для удаления этанола. Полученный остаток хроматографировали на колонке из силикагеля и элюировали 40%-ным этилацетатом в гексане и затем этилацетатом для получения 15,5 г указанного целевого соединения в виде белого твердого вещества.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,24 (3Н, с. СН) 3,80 (2Н, т. I 4 Гц, СН) 4,20 (2Н, т. I 4,7 Гц, СН) 4,40 (м. 2Н, С, СН2) 6,62 (1Н, д. I 6 Гц) 7,00  7,40 (4Н, м. Ар-Н) 8,28 (1Н, д. I 6 Гц, Пир-Н, Пир-Н).
7,40 (4Н, м. Ар-Н) 8,28 (1Н, д. I 6 Гц, Пир-Н, Пир-Н).
П р и м е р 37. Натриевая соль 2-[{4-(2-метилтиоэтокси)-3-метилпиридин-2-ил} метилсульфинил]-1Н- бензимидазола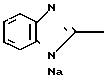 S
S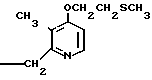
0,50 г тиоэфира, полученного в примере 35, растворяли в 20 мл дихлорметана для получения раствора. К этому раствору при температуре от -50 до -40оС по частям добавляли 0,36 г м-хлорнадбензойной кислоты. После окончания реакции в реакционную смесь при этой же температуре 0,21 г триэтиламина. Полученную смесь нагревали до -20оС с последующим добавлением 20 мл 1 н. водного раствора кислого карбоната натрия. Полученную смесь перемешивали 30 мин и экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором хлористого натрия, сушили над сульфатом магния и перегоняли для удаления дихлорметана.
Полученный неочищенный сульфоксид растворяли в 10 мл этанола с последующей добавкой 1 г 15%-ного водного раствора метилмеркаптида натрия. Полученную смесь перемешивали при 80оС 4 ч и перегоняли для удаления растворителя. Остаток хроматографировали на колонке из силикагеля и элюировали 2%-ным метанолом в хлороформе, содержащем 1% триэтиламина, а затем 10%-ным метанолом в хлороформе для получения очищенного продукта. К этому продукту добавляли 7,2 мл 1 н.водной гидроокиси натрия и 20 мл этанола. Полученную смесь выпаривали досуха при пониженном давлении и получали 460 мг указанного целевого соединения.
Масс-спектр М+1: 384.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,18 (3Н, с. СН), 2,90 (2Н, т. I 7 Гц, СН) 4,24 (2Н, т. I 7 Гц, СН), 4,78 (2Н, с. СН) 6,80  7,60 (4Н, м. Ар-Н) 6,98 (Н, д. I 6 Гц, Пир-Н) 8,30 (1Н, д. I 6 Гц, Пир-Н).
7,60 (4Н, м. Ар-Н) 6,98 (Н, д. I 6 Гц, Пир-Н) 8,30 (1Н, д. I 6 Гц, Пир-Н).
П р и м е р 38. 2-[{4-(2-феноксиэтокси)-3-метилпиридин-2-ил}метилтио] -1Н- бензимиазол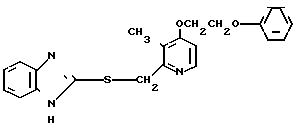
Смесь, содержащую 1,0 г [4-(2-феноксиэтокси)-3-метилпиридин-2-ил]метанола, 0,60 мл хлористого тионила и 12 мл дихлорметана выдерживали при 40оС в течение 60 мин для протекания реакции. Реакционную смесь перегоняли для удаления растворителя. Таким образом, получали остаток в виде коричневого сиропа. К остатку добавляли 50 мл этанола, 0,70 г гидроокиси натрия и 1,2 г 2-меркаптобензимидазола. Полученную смесь нагревали при 70оС 2 ч и перегоняли для удаления этанола. Полученный остаток хроматографировали на колонке из силикагеля и элюировали 30%-ным этилацетатом в гексане, а затем этилацетатом и получали 1,2 г указанного целевого соединения в виде белого твердого вещества.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,22 (3Н, с) 4,40 (2Н, с) 4,70 (2Н, с) 6,86  7,52 (10Н, м) 8,28 (1Н, д. I 6 Гц).
7,52 (10Н, м) 8,28 (1Н, д. I 6 Гц).
П р и м е р 39. Натриевая соль 2-[{3-метил-4-феноксиэтокси)пиридин-2-ил} метил-сульфинил]-1Н- бензимидазола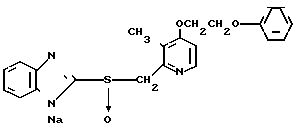
0,70 г тиоэфира, полученного в примере 37, растворяли в 200 мл дихлорметана для получения раствора. К этому раствору по частям при температуре от -30 до -40оС добавляли 0,39 г м-хлорнадбензойной кислоты. После окончания реакции в реакционную смесь при той же температуре добавляли 0,12 г триэтиламина. Полученную смесь нагревали от -10оС до 10оС за 30 мин. Образовавшийся дихлорметановый слой промывали насыщенным водным раствором кислого карбоната натрия, сушили над сульфатом магния и перегоняли для удаления дихлорметана. Полученный остаток растворяли в смеси, содержащей 20 мл этанола и 1,8 мл водной гидроокиси натрия для получения раствора. Этот раствор выпаривали досуха при пониженном давлении. Остаток кристаллизовали из смеси этанол-эфир и получали 0,61 г указанного целевого соединения в виде коричневого твердого вещества.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,17 (3Н, с) 4,32 (4Н, с) 4,36 (1Н, д) I 13 Гц) 4,68 (1Н, д. I 13 Гц) 6,74  7,44 (10Н, м) 8,22 (1Н, д. I 6 Гц).
7,44 (10Н, м) 8,22 (1Н, д. I 6 Гц).
П р и м е р 40. 2-[{4-(2-(2-хлорэтоки)-3-метилпиридин-2-ил}метилтио]-1Н- бензимидазол и 2-[{4-(2-(2-оксиэтокси)этокси-3-)- метилпиридин-2-ил}метилтио] 1Н-бензимидазол S
S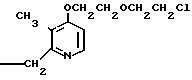
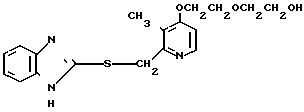
0,54 г гидроокиси натрия добавляли к этанольному раствору 3,1 г неочищенной смеси, содержащей 4-[2-(2-хлорэтокси)этокси]-2-хлорметил-3-метилпиридин и 2-хлорметил-4-[2-гидроксиэтокси)этокси-3-метил- пиридин, который был получен хлорированием в 2-гидроксиметил-4-[2-(2-гидроксиэтокси)этокси]-3-метилпиридина и 2,0 г 2-меркапто-1Н-бензимидазола для получения смеси. Эту смесь перемешивали при 60оС полтора часа, охлаждали и перегоняли при пониженном давлении для удаления этанола. Полученный остаток хроматографировали на колонке силикагеля и элюировали смесью этилацетата с н-гексаном и затем смесью метанол-этилацетат. Получали 1,0 г 2-[{4-(2-(2-хлорэтокси)этокси)-3-метилпиридин-2-ил}-метилтио]-1Н- бензи- мидазола.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,28 (с. 3Н) 3,56  4,04 (м. 6Н) 4,04
4,04 (м. 6Н) 4,04  4,32 (м. 2Н) 4,4 (с. 2Н) 6,76 (д. I 6 Гц, 1Н) 7,08
4,32 (м. 2Н) 4,4 (с. 2Н) 6,76 (д. I 6 Гц, 1Н) 7,08  7,32 (м. 3Н) 7,4
7,32 (м. 3Н) 7,4  7,56 (м. 2Н) 8,36 (д. I 6 Гц, 1Н) и 1,9 г 2-[{4-(2-(2-гидроксиэтокси)этокси)-3-метилпиридин-2-ил}метилтио] 1Н-бензимидазола.
7,56 (м. 2Н) 8,36 (д. I 6 Гц, 1Н) и 1,9 г 2-[{4-(2-(2-гидроксиэтокси)этокси)-3-метилпиридин-2-ил}метилтио] 1Н-бензимидазола.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,24 (с. 3Н) 3,56  4,28 (м. 8Н) 4,4 (с. 2Н) 6,12 (д. I 7 Гц, 1Н) 7,04
4,28 (м. 8Н) 4,4 (с. 2Н) 6,12 (д. I 7 Гц, 1Н) 7,04  7,32 (м. 2Н) 7,4
7,32 (м. 2Н) 7,4  7,68 (м. 2Н) 8,32 (д. I 7 Гц, 1Н).
7,68 (м. 2Н) 8,32 (д. I 7 Гц, 1Н).
П р и м е р 41. Натриевая соль 2-[{4-(2-(2-хлорэтокси)этокси)-3-метилпиридин-2- ил}-метилсульфинил] -1Н-бензимидазола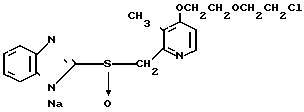
0,57 г м-хлорнадбензойной кислоты по частям добавляли к раствору 1,0 г 2-[{ 4-(2-) (2-хлорэтокси)этокси-3-метилпиридин-2-ил} метилтио]-1Н- бензимидазола в 80 мл дихлорметана при перемешивании и обезвоживании при -50оС. Полученную смесь перемешивали 2 ч и нагревали до -30оС с последующим добавлением 0,51 г триэтиламина при той же температуре. Полученную смесь подщелачивали 2 н. водным раствором карбоната натрия при -10оС и экстрагировали дихлорметаном. Экстракт сушили над сульфитом магния и перегоняли для удаления дихлорметана. Таким образом получали в остатке 1,0 г продукта. Этот остаток растворяли в 26 мл 0,1 н.водной гидроокиси натрия с последующим добавлением этанола. Полученную смесь перегоняли при пониженном давлении. К полученному остатку добавляли этанол, и смесь снова перегоняли при пониженном давлении для получения остатка. К этому остатку добавляли эфир и получали 1,07 г кристаллов.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,17 (с. 3Н) 3,56  3,96 (м. 6Н) 4,0
3,96 (м. 6Н) 4,0  4,28 (м. 2Н) 4,04 (д. I 12,6 Гц, 1Н) 4,68 (д. I 12,6 Гц, 1Н) 6,76
4,28 (м. 2Н) 4,04 (д. I 12,6 Гц, 1Н) 4,68 (д. I 12,6 Гц, 1Н) 6,76  8,04 (м. 3Н) 7,36
8,04 (м. 3Н) 7,36  7,6 (м. 2Н) 8,26 (д. I 6 Гц, 1Н).
7,6 (м. 2Н) 8,26 (д. I 6 Гц, 1Н).
П р и м е р 42. 2-[{4-(3-этокси)пропокси-3-метилпиридин-2-ил}метилтио] -1Н- бензимидазол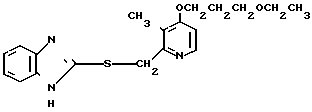
Смесь, содержащую 4,2 г4-(3-этоксипропокси)-3-метилпиридин-2-ил}метилового эфира метансульфокислоты 1,87 г 2-меркаптобензимидазола и 30 мл этанола, перемешивали при комнатной температуре 1 ч и перегоняли для удаления этанола. Полученный остаток хроматографировали на колонке их силикагеля и получали 0,88 г целевого соединения и 5,1 г метансульфоната целевого соединения.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,19 (т. I 7,0 Гц, 3Н) 1,9  2,1 (м. 2Н) 2,24 (с. 3Н) 3,48 (кв. I 7,0 Гц, 2Н) 3,58 (т. I 6,2 Гц, 2Н) 4,11 (т. I 6,2 Гц, 2Н) 4,36 (с. 2Н) 6,73 (д. I 5,7 Гц, 1Н) 6,97
2,1 (м. 2Н) 2,24 (с. 3Н) 3,48 (кв. I 7,0 Гц, 2Н) 3,58 (т. I 6,2 Гц, 2Н) 4,11 (т. I 6,2 Гц, 2Н) 4,36 (с. 2Н) 6,73 (д. I 5,7 Гц, 1Н) 6,97  7,20 (м. 2Н) 7,32
7,20 (м. 2Н) 7,32  7,55 (м. 2Н) 8,31 (д. I 5,7 Гц, 1Н).
7,55 (м. 2Н) 8,31 (д. I 5,7 Гц, 1Н).
П р и м е р 43. Натриевая соль 2-[{4-(3-этоксипропокси)-3-метилпиридин-2-ил}ме-тилсульфинил]-1Н- бензимидазола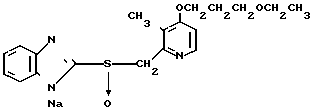
0,6 г 2-[{4-(3-метилпиридин-2-ил}метилтио]-1Н-бензимидазола растворяли в 30 мл дихлорметана для получения раствора. К этому раствору при -45оС добавляли 0,37 г 85%-ной м-хлорнадбензойной кислоты. Через 2 ч к полученной смеси добавляли 0,43 г триэтиламина с последующим добавлением 30 мл насыщенного водного раствора кислого карбоната натрия. Полученную смесь энергично перемешивают при комнатной температуре 1 ч и экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали для получения остатка. Этот остаток растворяли в 16 мл 0,1 н. водной гидроокиси натрия и полученный раствор перегоняли для удаления воды. Остаток сушили при пониженном давлении и кристаллизовали из эфира. Получали 0,54 г целевого соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,11 (т. I 7,0 Гц, 3Н) 1,7 (2,1 (м. 2Н) 2,15 (с. 3Н) 3,2  3,5 (м. 4Н) 3,65 (с. 3Н) 4,09 (т. I6,2 Гц, 2Н) 4,49 (АВ кв. I 11,8 Гц, Δν 17,0 Гц, 2Н) 6,65
3,5 (м. 4Н) 3,65 (с. 3Н) 4,09 (т. I6,2 Гц, 2Н) 4,49 (АВ кв. I 11,8 Гц, Δν 17,0 Гц, 2Н) 6,65  7,0 (м. 3Н) 7,2
7,0 (м. 3Н) 7,2  7,6 (м. 2Н) 8,2 (д. I 5,6 Гц, 1Н).
7,6 (м. 2Н) 8,2 (д. I 5,6 Гц, 1Н).
П р и м е р 44. 2-[{4-(3-метоксиметокси)пропокси-3-метилпиридин-2-ил}-метил-тио] 1Н-бензимидазол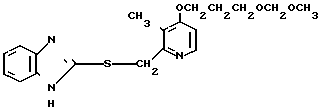
Смесь, содержащую 1,8 г4-(3-метоксиметокси)пропокси-3-метилпиридин-2-ил} метилового эфира метансульфокислоты, 0,76 г 2-меркаптобензимидазола, 0,29 г гидроокиси натрия и 50 мл этанола, перемешивали при комнатной температуре 1 ч и перегоняли для удаления этанола. Полученный остаток очищали на колонке силикагеля методом хроматографии и получали 1,4 г целевого соединения.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,9-2,2 (м. 2Н) 2,26 (с. 3Н) 3,33 (с. 3Н) 3,73 (т. I 8,1 Гц, 2Н) 4,16 (т. I 6,1 Гц, 2Н) 4,38 (с. 2Н) 4,62 (с. 3Н) 6,76 (д. I 5,7 Гц, 1Н) 7,0  7,2 (м. 2Н) 7,3
7,2 (м. 2Н) 7,3  7,6 (м. 2Н) 8,34 (д. I 5,7 Гц, 1Н).
7,6 (м. 2Н) 8,34 (д. I 5,7 Гц, 1Н).
П р и м е р 45. Натриевая соль 2-[{4-(3-метоксиметокси)пропокси-3-метилпири- дин-2-ил}метилсульфинил] -1Н-бензимидазола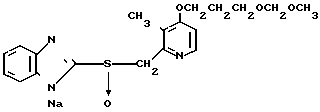
0,6 г 2-[{4-(3-метоксиметокси)пропокси-3-метилпиридин-2-ил}метилтио]-1Н- бензимидазола растворяли в 40 мл дихлорметана для получения раствора. К этому раствору при температуре -45оС добавляли 0,35 г 85%-ной м-хлорнадбензойной кислоты. Через 2 ч к смеси при -30оС добавляли 0,64 г триэтиламина с последующим добавлением 40 мл насыщенного водного раствора кислого карбоната натрия. Полученную смесь энергично перемешивали при комнатной температуре 30 мин и экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали до получения остатка. Остаток растворяли в 14,4 мл 0,1 н.водной гидроокиси натрия для получения раствора. Этот раствор перегоняли для удаления воды, остаток сушили при пониженном давлении, кристаллизовали из эфира и получали 0,57 г целевого соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,9  2,2 (м. 2Н) 2,17 (с. 3Н) 3,22 (с. 3Н) 3,63 (т. I 5,7 Гц, 2Н) 4,12 (т. I 5,7 Гц, 2Н) 4,56 (с. 2Н) 4,41
2,2 (м. 2Н) 2,17 (с. 3Н) 3,22 (с. 3Н) 3,63 (т. I 5,7 Гц, 2Н) 4,12 (т. I 5,7 Гц, 2Н) 4,56 (с. 2Н) 4,41  4,85 (2Н) 6,84 (7,1 (м. 3Н) 7,4
4,85 (2Н) 6,84 (7,1 (м. 3Н) 7,4  7,62 (м. 2Н) 8,26 (д. I 6,1 Гц, 1Н).
7,62 (м. 2Н) 8,26 (д. I 6,1 Гц, 1Н).
П р и м е р 46. 2-[{4-(2-метоксиэтокси)этокси-3,5-димeтилпиридин-2-ил} метил- тио]-1Н- бензимидазол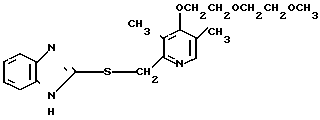
Смесь, содержащую 3,0 г4-(2-метоксиэтокси)этокси-3,5-диметилпиридин-2-ил} метилового эфира метансульфокислоты, 1,17 г 2-меркаптобензимидазола и 30 мл этанола перемешивали при комнатной температуре 1 ч и перегоняли для удаления этанола. Остаток очищали хроматографией на колонке из силикагеля и получали 0,9 г целевого соединения.
Спектр ЯМР на ядpах 1Н (СДСl3) δ: 2,28 (с. 3Н) 2,33 (с. 3Н) 3,37 (c. 3H)3,5  3,9 (м. 6Н) 3,9
3,9 (м. 6Н) 3,9  4,2 (м. 2Н) 4,37 (с. 2Н) 7,1
4,2 (м. 2Н) 4,37 (с. 2Н) 7,1  7,3 (м. 3Н) 7,3
7,3 (м. 3Н) 7,3 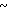 7,65 (м. 2Н) 8,24 (с. 1Н).
7,65 (м. 2Н) 8,24 (с. 1Н).
П р и м е р 47. Натриевая соль 2-[{4-(2-метоксиэтокси)этокси-3,5-диметилпири- дин-2-ил}метилсульфинил] -1Н-бензимидазола
0,5 г 2-[{4-(2-метоксиэтокси)этокси-3,5-диметилпиридин-2-ил}метилтио] -1Н- бензимидазола растворяли в 30 мл дихлорметана для получения раствора. К этому раствору при -45оС добавляли 0,29 г 85%-ной м-хлорнадбензойной кислоты. Через 2 ч к полученной смеси добавляли 0,34 триэтиламина с последующим добавлением 30 мл насыщенного раствора карбоната натрия. Смесь энергично перемешивали при комнатной температуре 1 ч и экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали с получением остатка. Этот остаток растворяли в 12 мл 0,1 н. водной гидроокиси натрия для получения раствора. Этот раствор перегоняли для удаления воды. Полученный остаток сушили при пониженном давлении и кристаллизовали из эфира. Получали 0,57 г целевого соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,21 Э (с. 6Н) 3,25 (с. 3Н) 3,3  3,7 (м. 6Н) 3,7
3,7 (м. 6Н) 3,7  4,0 (м. 2Н) 4,39 (АВ кв. I 13,2 Гц, Δν 20,7 Гц, 2Н) 6,65
4,0 (м. 2Н) 4,39 (АВ кв. I 13,2 Гц, Δν 20,7 Гц, 2Н) 6,65  6,9 (м. 2Н) 7,2
6,9 (м. 2Н) 7,2  7,5 (м. 2Н) 8,21 (с. 1Н).
7,5 (м. 2Н) 8,21 (с. 1Н).
П р и м е р 48. 5-Карбокси-2-[{4-(2-бензилокси)этокси-3-метилпиридин-2-ил} метилтио]-1Н-бензимидазол
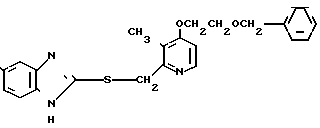
Смесь, содержащую 1,26 г 5-карбоксимеркаптобензимидазола, 1,8 г 4-(2-бензилоксиэтокси)-2-хлорметил-3-метилпири- дина, 0,57 г гидроокиси натрия и 150 мл метанола, перемешивали при 50оС полтора часа и перегоняли при пониженном давлении для удаления метанола. Полученный остаток очищали хроматографией на колонке силикагеля и перекристаллизовывали из смеси метанол-этилацетат. Получали 1,52 г целевого соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,25 (с. 3Н) 3,65  3,9 (м. 2Н) 4,1
3,9 (м. 2Н) 4,1  4,3 (м. 2Н) 4,58 (с. 2Н) 4,74 (с. 2Н) 6,95 (д. I 5,7 Гц, 1Н) 7,92 (с. 5Н) 7,50 (д. I 8,3 Гц, 1Н) 7,79 (дд. I 1,3 Гц, 8,3 Гц, 1Н) 8,04 (с. 1Н) 8,24 (д. I 5,7 Гц, 1Н).
4,3 (м. 2Н) 4,58 (с. 2Н) 4,74 (с. 2Н) 6,95 (д. I 5,7 Гц, 1Н) 7,92 (с. 5Н) 7,50 (д. I 8,3 Гц, 1Н) 7,79 (дд. I 1,3 Гц, 8,3 Гц, 1Н) 8,04 (с. 1Н) 8,24 (д. I 5,7 Гц, 1Н).
П р и м е р 49. 5-(токсикарбонил-2-[{4-(2-бензилокси)этокси-3-метилпиридин-2-ил} метилтио]-1Н-бензимидазол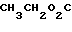
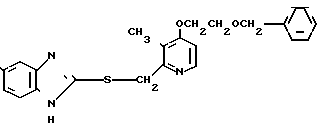
Смесь, содержащую 1,0 г 5-карбокси-3-[{4-(2-бензилокси)этокси-3-метилпиридин-2-ил}метилтио] -1Н-бензимидазола, 200 мл этанола и 1 мл концентрированной серной кислоты нагревали с обратным холодильником 4 ч при дегидратации системы с помощью молекулярного сита. Полученную смесь нейтрализовали насыщенным водным раствором карбоната натрия и перегоняли для удаления этанола с последующим добавлением насыщенного водного раствора кислого карбоната натрия. Полученную смесь экстрагировали хлороформом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали для получения неочищенного продукта. Этот сырой продукт очищали хроматографией на колонке из силикагеля и получали 0,76 г указанного соединения.
Спектр ЯМР на ядрах 1Н (ДСМО-d6) δ: 1,35 (т. I 7,0 Гц, 3Н) 2,25 (с. 3Н) 3,7  3,9 (м. 2Н) 4,15
3,9 (м. 2Н) 4,15 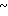 4,3 (м. 2Н) 4,24 (кв. I 7,0 Гц, 2Н) 4,57 (с. 2Н) 4,75 (с. 2Н) 6,96 (д. I 5,7 Гц), 7,32 (с. 5Н) 7,52 (д. I 8,5 Гц, 1Н) 7,79 (дд. I 1,3 Гц, 8,5 Гц, 1Н) 8,05 (д. I 1,3 Гц, 1Н) 8,24 (д. I 5,7 Гц, 1Н).
4,3 (м. 2Н) 4,24 (кв. I 7,0 Гц, 2Н) 4,57 (с. 2Н) 4,75 (с. 2Н) 6,96 (д. I 5,7 Гц), 7,32 (с. 5Н) 7,52 (д. I 8,5 Гц, 1Н) 7,79 (дд. I 1,3 Гц, 8,5 Гц, 1Н) 8,05 (д. I 1,3 Гц, 1Н) 8,24 (д. I 5,7 Гц, 1Н).
П р и м е р 50. Натриевая соль 5-этоксикарбонил-2-[{4-(2-бензилокси)этокси-3-ме-тилпиридин-2-ил} метилсульфинил]-1Н-бензимидазола
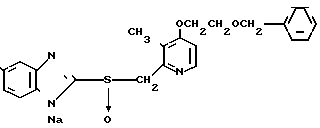
0,7 г 5-этоксикарбонил-2-[{4-(2-бензилокси)этокси-3-метилпиридин-2-ил} метилтио] -1Н-бензимидазола растворяли в 50 мл дихлорметана для получения раствора. К этому раствору при температуре -45оС добавляли 0,3 г 85%-ной м-хлорнадбензойной кислоты. Через 2 ч полученную смесь нагревали до -30оС с последующим добавлением 0,43 г триэтиламина. Через 30 мин полученную смесь нагревали до -10оС и затем добавляли 50 мл насыщенного водного раствора кислого карбоната натрия. Полученную смесь энергично перемешивали при комнатной температуре 30 мин и экстрагировали дихлорметаном. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали, а остаток растворяли в 10 мл дихлорметана с последующей добавкой 0,056 г 60%-ного гидрида натрия. Полученную смесь перемешивали при комнатной температуре 30 мин и перегоняли для удаления дихлорметана. Образовавшийся остаток кристаллизовали из эфира и получали 0,59 г указанного соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,34 (т. I 7,0 Гц, 3Н) 2,18 (с. 3Н) 3,7  3,9 (м. 2Н) 4,1
3,9 (м. 2Н) 4,1  4,3 (м. 2Н) 4,24 (кв. I 7,0 Гц, 2Н) 4,57 (с. 3Н) 4,65 (с. 2Н) 6,94 (д. I 5,7 Гц, 1Н) 7,30 (с. 5Н) 7,50
4,3 (м. 2Н) 4,24 (кв. I 7,0 Гц, 2Н) 4,57 (с. 3Н) 4,65 (с. 2Н) 6,94 (д. I 5,7 Гц, 1Н) 7,30 (с. 5Н) 7,50  7,86 (м. 3Н) 8,26 ( I 5,7 Гц, д. 1Н).
7,86 (м. 3Н) 8,26 ( I 5,7 Гц, д. 1Н).
П р и м е р 51. 2-[4-(4-метоксибутокси)пиридин-2-ил]метилтио-1Н-бензимида-зол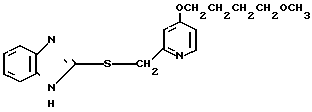
Смесь, содержащую 2,55 г (0,017 моль) 2-меркаптобензимидазола, 5,09 г (0,022 моль) 2-хлорметил-4-(4-метоксибутокси)пиридина 0,84 г (0,020 моль) 95% -ной гидроокиси натрия и 60 мл этанола перемешивали при 40оС полтора часа. После окончания реакции реакционную смесь перегоняли для удаления растворителя. Полученный остаток очищали хроматографией на колонке из силикагеля (смесью этилацетата и н-гексана) и получали 4,13 г указанного соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,43 1,84 (м. 4Н) 3,21 (с. 3Н) 3,31 (т. I 6,2 Гц, 2Н) 3,99 (т. I 6,2 Гц, 2Н) 4,59 (с. 2Н) 6,75
1,84 (м. 4Н) 3,21 (с. 3Н) 3,31 (т. I 6,2 Гц, 2Н) 3,99 (т. I 6,2 Гц, 2Н) 4,59 (с. 2Н) 6,75  6,89 (м. 1Н) 7,04
6,89 (м. 1Н) 7,04  7,21 (м. 2Н) 7,25
7,21 (м. 2Н) 7,25  7,56 (м. 2Н) 8,31 (д. I 6,2 Гц, 1Н).
7,56 (м. 2Н) 8,31 (д. I 6,2 Гц, 1Н).
П р и м е р 52. Натриевая соль 2-[4-(4-метоксибутокси)пиридин-2-ил]метилсуль-финил-1Н-бензимидазола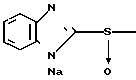 CH
CH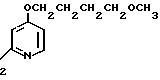
2,06 г (0,006 моль) 2-[4-(4-метоксибутокси)пиридин-2-ил]метилтио-1Н-бензимида-зола растворяли в 80 мл дихлорметана для получения раствора. К этому раствору при -40оС в атмосфере азота добавляли 1,30 г (0,006 моль) 80% -ной м-хлорнадбензойной кислоты и 5 мл метанола. Полученную смесь перемешивали полтора часа. После завершения реакции в реакционную смесь добавляли 1,0 г триэтиламина. Полученную смесь нагревали до -10оС с последующим добавлением 50 мл 2 н. водного раствора карбоната натрия. Полученную смесь перемешивали при комнатной температуре 30 мин и два раза экстрагировали 150 мл дихлорметана. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя, а полученный остаток сушили в вакууме до получения масла. Это масло растворяли в 54 мл 0,1 н. водной гидроокиси натрия с последующим добавлением этанола. Полученную смесь перегоняли для удаления растворителя. Образовавшийся остаток три раза промывали эфиром, сушили в вакууме и получали 2,02 г указанного соединения в виде белого порошка.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,40  1,74 (м. 4Н) 3,17
1,74 (м. 4Н) 3,17  3,40 (м. 2Н) 3,23 (с. 3Н) 3,66
3,40 (м. 2Н) 3,23 (с. 3Н) 3,66  3,88 (м. 2Н) 4,48 (АВ кв. I 12,5 Гц, Δν 12,7 Гц, 2Н) 6,60
3,88 (м. 2Н) 4,48 (АВ кв. I 12,5 Гц, Δν 12,7 Гц, 2Н) 6,60  7,00 (м. 3Н), 7,35
7,00 (м. 3Н), 7,35  7,58 (м. 2Н) 8,32 (д. I 6,6 Гц, 1Н).
7,58 (м. 2Н) 8,32 (д. I 6,6 Гц, 1Н).
П р и м е р 53. 2-[4-(3-метоксипропокси)пиридин-2-ил]метилтио-1Н-бензимида-зол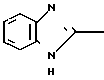 S
S CH
CH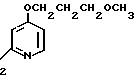
1,65 г (0,005 моль) 2-[4-(3-метоксипропокси)пиридин-2-ил]метилтио-1Н-бензими- дазола растворяли в 50 мл дихлорметана для получения раствора. К этому раствору при -40оС в атмосфере азота добавляли 1,08 г (0,005 моль) 80% -ной м-хлорнадбензойной кислоты. Полученную смесь перемешивали 15 мин. После окончания реакции в реакционную смесь добавляли 0,8 г триэтиламина. Полученную смесь нагревали до -10оС с последующим добавлением 30 мл 2 н. водного раствора карбоната натрия. Полученную смесь перемешивали при комнатной температуре 30 мин и трижды экстрагировали 100 мл дихлорметана. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и сушили в вакууме. Полученный остаток растворяли в 50 мл 0,1 н. водной гидроокиси натрия с последующим добавлением этанола. Полученную смесь перегоняли для удаления растворителя, а остаток промывали эфиром, сушили в вакууме и получали 1,70 г соединения, указанного в названии примера, в виде белых кристаллов.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,70  1,98 (м. 2Н) 3,22 (с. 3Н) 3,37 (т. I 6,2 Гц, 2Н) 3,44
1,98 (м. 2Н) 3,22 (с. 3Н) 3,37 (т. I 6,2 Гц, 2Н) 3,44  3,89 (м. 2Н) 4,47 (АВ кв. I 12,3 Гц, Δν 10,6 Гц, 2Н) 6,70
3,89 (м. 2Н) 4,47 (АВ кв. I 12,3 Гц, Δν 10,6 Гц, 2Н) 6,70  6,94 (м. 4Н) 7,42
6,94 (м. 4Н) 7,42  7,53 (м. 2Н) 8,32 (д. I 5,8 Гц, 1Н).
7,53 (м. 2Н) 8,32 (д. I 5,8 Гц, 1Н).
П р и м е р 55. 2-[4-{3-(2-метоксиэтокси)пропокси-3-метилпиридин-2-ил] метилтио-1Н- бензимидазол S
S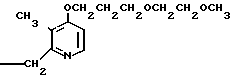
2,24 г триэтиламина и 1,27 г метансульфонилхлорида добавляли к раствору 1,4 г неочищенного 2-гидроксиметил-4-{ 3-(2-метокси)} -3-метилпиридина в дихлорметане при -30оС. Полученную смесь постепенно нагревали до комнатной температуре с последующим добавлением насыщенного водного раствора кислого карбоната натрия. Полученную смесь перемешивали 30 мин и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли при пониженном давлении для удаления хлороформа. Получали 1,9 г неочищенного [4-{ 3-(2-метоксиэтокси)пропокси} 3-метил-пиридин-2-ил] метилового эфира метансульфокислоты в виде красного масла. К этому маслу добавляли 0,83 г 2-меркапто-1Н-бензимидазола. Полученную смесь перемешивали вместе с 20 мл этанола при комнатной температуре в течение 30 мин, затем добавляли насыщенный водный раствор кислого карбоната натрия. Полученную смесь перемешивали при комнатной температуре 30 мин и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли при пониженном давлении для получения остатка. Остаток хроматографировали на колонке их силикагеля и элюировали смесью этилацетата и н-гексана. Получали 1,55 г масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,12 (кв. I 6,15 Гц, 2Н) 2,25 (с. 2Н) 3,36 (с. 3Н) 3,56 (м. 2Н) 3,66 (т. I 6,15 Гц, 2Н) 4,14 (т. I 6,15 Гц, 2Н) 4,37 (с. 2Н) 6,77 (д. I 5,72 Гц, 1Н) 7,1  7,25 (м. 2Н) 7,52 (м. 2Н) 8,33 (д. I 5,72 Гц, 1Н).
7,25 (м. 2Н) 7,52 (м. 2Н) 8,33 (д. I 5,72 Гц, 1Н).
П р и м е р 56. Натриевая соль 2-[4-{3-(2-метоксиэтокси)пропокси}3-метилпири- дин-2-ил] метилсульфонил-1Н-бензимидазола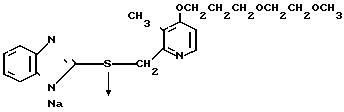
681 мг 85%-ной м-хлорнадбензойной кислоты по частям добавляли к раствору 1,3 г 2-[4-{3-(2-метоксиэтокси)пропокси}-3-метилпиридин-2-ил]метилтио- 1Н-бензимидазола в 70 мл дихлорметана при перемешивании и удалении влаги. Полученную смесь перемешивали 30 мин с последующим добавлением 483 мг триэтиламина. Полученную смесь нагревали до -20оС, затем добавляли 2 н. водный раствор карбоната натрия. Смесь перемешивали при комнатной температуре 30 мин и два раза экстрагировали хлороформом. Экстракт промывали насыщенным водным раствором кислого карбоната натрия, сушили над сульфатом магния и отгоняли при пониженном давлении для получения неочищенного масла. К этому маслу добавляли 30 мл 0,1 н. водной гидроокиси натрия и этанол. Полученную смесь перегоняли при пониженном давлении и температуре 40оС для удаления среды. К полученному остатку снова добавляли этанол и смесь перегоняли при пониженном давлении для удаления среды. Остаток кристаллизовали из безводного эфира и получали 1,24 г кристаллов.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,98 (кв. I 6,15 Гц, 2Н) 2,15 (с. 3Н) 3,22 (с. 3Н) 3,47 (м. 4Н) 3,56 (т. I 6,15 Гц, 2Н) 4,09 (т. I 6,15 Гц, 2Н) 4,42 (АВ кв. I 13,18 Гц, Δν= 14,74 Гц, 1Н) 6,8  7,0 (м. 3Н) 7,39
7,0 (м. 3Н) 7,39  7,57 (м. 2Н) 8,27 (д. I 5,71 Гц, 1Н).
7,57 (м. 2Н) 8,27 (д. I 5,71 Гц, 1Н).
П р и м е р 57. 2-[{4-(4-метоксибутокси)-3-метилпиридин-2-ил}метилтио] -1Н- бензимидазол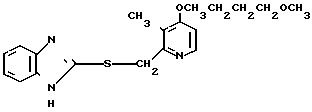
611 мг триэтиламина и 686 мг метансульфонилхлорида добавляли к раствору 0,84 г неочищенного 2-гидрокси-4-(4-метоксибутокси)-3-метилпиридина в 30 мл дихлорметана при -20оС при перемешивании и удалении влаги с получением смеси. Эту смесь постепенно доводили до комнатной температуры, затем добавляли насыщенный водный раствор кислого карбоната натрия. Смесь перемешивали 30 мин и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли при пониженном давлении для удаления хлороформа. Таким образом получали красное масло. К этому маслу добавляли 580 мг 2-меркапто-1Н-бензимидазола и 30 мл этанола. Полученную смесь перемешивали при комнатной температуре 30 мин, подщелачивали 2 н. водным раствором карбоната натрия и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли при пониженном давлении для удаления хлороформа. Полученный остаток хроматографировали на колонке из силикагеля и элюировали смесью этилацетата и н-гексана. Получали 0,42 г масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,4  2,16 (м. 4Н) 2,26 (с. 3Н) 3,35 (с. 3Н) 3,45 (т. I 5,72 Гц, 2Н) 4,06 (т. I 5,72 Гц, 2Н) 4,37 (с. 2Н) 6,74 (д. I 5,71 Гц, 1Н) 7,1
2,16 (м. 4Н) 2,26 (с. 3Н) 3,35 (с. 3Н) 3,45 (т. I 5,72 Гц, 2Н) 4,06 (т. I 5,72 Гц, 2Н) 4,37 (с. 2Н) 6,74 (д. I 5,71 Гц, 1Н) 7,1  7,25 (м. 2Н) 7,48
7,25 (м. 2Н) 7,48  7,56 (м. 2Н) 8,33 (д. I 5,72 Гц, 1Н).
7,56 (м. 2Н) 8,33 (д. I 5,72 Гц, 1Н).
Пример получения 15.
[4-{ 3-(2-метоксиэтокси)пропокси} -3-ме- тилпиридин-2-ил]метиловый эфир метансульфокислоты
CH3- -
-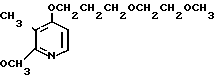
2,24 г триэтиламина и 1,27 г метансульфонилхлорида добавляли к раствору 1,4 г неочищенного 2-гидрокси-4-{ 3-(3-метоксиэтокси)}-3-метилпиридина в дихлорметане при -30оС для получения смеси. Эту смесь доводили до комнатной температуры с последующим добавлением насыщенного водного раствора кислого карбоната натрия. Полученную смесь перемешивали 30 мин и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли при пониженном давлении для удаления хлороформа. Получали 1,9 г неочищенного красного масла.
П р и м е р 58. 2-[4-{3-(2-метоксиэтокси)пропокси}-3-метилпиридин-2-ил] метил-тио-1Н- бензимидазол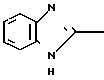 S
S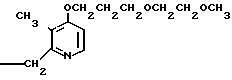
Смесь, содержащую 1,9 г неочищенного [4-{3-(2-метоксиэтокси)пропокси}-3-метил- пиридин-2-ил] метилового эфира метансульфокислоты, 0,83 г 2-меркапто-1Н-бензимидазола и 20 мл этанола, перемешивали при комнатной температуре 1 ч, подщелачивали насыщенным водным раствором кислого карбоната натрия и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли при пониженном давлении. Полученный остаток хроматографировали на колонке из силикагеля и элюировали смесью этилацетата и н-гексана. Получали 1,5 г маслянистого продукта.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,12 (кв. I 6,2 Гц, 2Н) 2,25 (с. 3Н) 3,36 (с. 3Н) 3,57 (м. 2Н) 3,66 (т. I 6,2 Гц, 2Н) 4,14 (т. I 6,2 Гц, 2Н) 4,37 (с. 2Н) 6,77 (д. I 3,1 Гц, 1Н) 7,15 (м. 2Н) 7,53 (м. 2Н) 8,39 (д. I 3,1 Гц, 1Н).
Пример получения 16.
2-Хлорметил-4-(4-метоксибутокси)пири- дин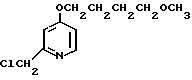
5,6 г неочищенного 2-гидроксиметил-4-(4-метоксибутокси)пиридина растворяли в 80 мл хлороформа для получения раствора. К этому раствору по каплям добавляли раствор 3,8 г хлористого тионила в 10 мл хлороформа при 0оС в течение 1 ч. После завершения реакции реакционную смесь нейтрализовали насыщенным водным раствором кислого карбоната натрия и два раза экстрагировали 200 мл хлороформа. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя. Полученный остаток сушили в вакууме и получали 5,09 г указанного соединения в виде неочищенного масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,55  2,05 (м. 4Н) 3,35 (с. 3Н) 3,38
2,05 (м. 4Н) 3,35 (с. 3Н) 3,38  3,53 (м. 2Н) 3,91
3,53 (м. 2Н) 3,91  4,17 (м. 2Н) 4,61 (с. 2Н) 6,55
4,17 (м. 2Н) 4,61 (с. 2Н) 6,55  7,01 (м. 2Н) 8,36 (д. I 6,2 Гц, 1Н).
7,01 (м. 2Н) 8,36 (д. I 6,2 Гц, 1Н).
Пример получения 17.
2-Гидроксиметил-4-(4-метоксибутокси) пиридин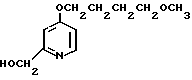
5,06 г (0,024 моль) 1-оксида 4-(4-метоксибутокси)-2-метилпиридина растворяли в 80 мл уксусного ангидрида для получения раствора. Этот раствор перемешивали при 100оС 1 ч, охлаждали и перегоняли для удаления растворителя. К остатку добавляли 150 мл 1 н. хлористоводородной кислоты. Полученную смесь перемешивали при 100оС 1 ч, охлаждали, нейтрализовали кислым карбонатом натрия и два раза экстрагировали 200 мл хлороформа. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя, а остаток сушили в вакууме и получали 5,66 г указанного соединения в виде неочищенного масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,58  2,08 (м. 4Н) 3,32
2,08 (м. 4Н) 3,32  3,54 (м. 2Н) 3,34 (с. 3Н) 3,82
3,54 (м. 2Н) 3,34 (с. 3Н) 3,82  4,16 (м. 2Н) 4,69 (с. 2Н) 5,02 (с. 1Н) 6,54
4,16 (м. 2Н) 4,69 (с. 2Н) 5,02 (с. 1Н) 6,54  6,88 (м. 2Н) 8,30 (д. I 6,2 Гц, 1Н).
6,88 (м. 2Н) 8,30 (д. I 6,2 Гц, 1Н).
Пример получения 18.
1-Оксид 4-(4-метоксибутокси)-2-метилпиридина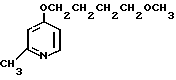
6,77 г (0,065 моль) 4-метоксибутанола растворяли в 60 мл диметилсульфоксида для получения раствора. К этому раствору при комнатной температуре в атмосфере азота добавляли 2,6 г (0,065 моль) 60%-ного гидрида натрия. Полученную смесь нагревали до 60оС, перемешивали один час и охлаждали до комнатной температуры. К полученной смеси по каплям добавляли раствор 4,66 г (0,032 ммоль) 1-оксида 4-хлор-2-метилпиридина в 20 мл диметилсульфоксиды. Смесь перемешивали при 40оС 1 ч. После завершения реакции к смеси добавляли 5 мл воды, и полученную смесь выпаривали досуха для удаления растворителя. К остатку добавляли 150 мл воды. Полученную смесь 4 раза экстрагировали 200 мл хлороформа. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя. Остаток очищали хроматографией на колонке из силикагеля (проявляли смесью этилацетат-метанол) и получали 5,06 г указанного соединения в виде масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,54  2,07 (м. 4Н) 2,52 (с. 3Н) 3,36 (с. 3Н) 3,44 (т. I 6,2 Гц, 2Н) 4.01 (т. I 6,2 Гц, 2Н) 6,60
2,07 (м. 4Н) 2,52 (с. 3Н) 3,36 (с. 3Н) 3,44 (т. I 6,2 Гц, 2Н) 4.01 (т. I 6,2 Гц, 2Н) 6,60  6,84 (м. 2Н) 8,14 (д. I 5,3 Гц, 1Н).
6,84 (м. 2Н) 8,14 (д. I 5,3 Гц, 1Н).
Пример получения 19.
4-Метоксибутанол СН3ОСН2СН СН2ОН.
27,04 г (0,3 моль) 1,4-бутандиола растворяли в 150 мл тетрагидрофурана для получения раствора. К этому раствору при 0оС в атмосфере азота добавляли 7,2 г (0,18 моль) 60%-ного гидрида натрия. Полученную смесь нагревали с обратным холодильником 1 ч и охлаждали до 0оС. К полученной смеси по каплям добавляли 21,73 г (0,15 моль) 98%-ного метила. Смесь перемешивали при температуре 30оС или ниже в течение полутора часа. После окончания реакции реакционную смесь фильтровали. Фильтрат перегоняли для удаления растворителя. К остатку добавляли 200 мл воды и полученную смесь промывали 200 мл н-гексана и экстрагироовали 200 мл хлороформа 4 раза. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя. Получали 14,5 г указанного соединения.
Спектр ЯМР на ядрах 1Н( СДСl3) δ: 1,54  1,80 (м. 4Н) 1,71 (с. 1Н) 3,32 (с. 3Н) 3,34
1,80 (м. 4Н) 1,71 (с. 1Н) 3,32 (с. 3Н) 3,34 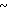 3,73 (м. 4Н).
3,73 (м. 4Н).
Пример получения 20.
2-Хлорметил-4-(3-метоксипропокси)пи- ридин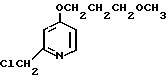
Раствор 2,60 г (6% 0,022 моль) хлористого тионила в 10 мл хлороформа по каплям добавляли к раствору 3,64 г (0,018 моль) 2-гидроксиметил-4-метоксипропоксипиридина в 60 мл хлороформа при охлаждении льдом. Полученную смесь перемешивали 1 ч, нейтрализовали насыщенным водным раствором кислого карбоната натрия и экстрагировали хлороформом. Хлороформовый слой сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении получал 3,23 г указанного соединения в виде неочищенного продукта.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,80  2,20 (м. 2Н) 3,31 (с. 3Н) 3,49 (т. I6,2 Гц, 2Н) 4,07 (т. I 6,2 Гц, 2Н) 4,55 (с. 2Н) 6,52
2,20 (м. 2Н) 3,31 (с. 3Н) 3,49 (т. I6,2 Гц, 2Н) 4,07 (т. I 6,2 Гц, 2Н) 4,55 (с. 2Н) 6,52  6,96 (м. 2Н) 8,26 (д. I 5,3 Гц, 1Н).
6,96 (м. 2Н) 8,26 (д. I 5,3 Гц, 1Н).
Пример получения 21.
2-Гидроксиметил-4-(3-метоксипропок-си)пиридин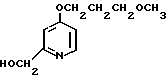
4,05 г (0,02 моль) 1-оксида 4-метоксипропокси-2-метилпиридина растворяли в 50 мл уксусного ангидрида для получения раствора. Этот раствор перемешивали при 90оС полчаса и охлаждали с последующим добавлением этанола. Полученную смесь концентрировали при пониженном давлении, затем добавляли 150 мл хлористоводородной кислоты. Полученную смесь перемешивали при 100оС 1 ч, охлаждали, нейтрализовали кислым карбонатом натрия и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя. Таким образом, получали 3,64 г неочищенного указанного соединения.
Спектр ЯМР на ядрах 1Н (СДС3) δ: 1,83  2,20 (м. 2Н) 3,30 (с. 3Н) 3,49 (т. I5,3 Гц, 2Н) 4,05 (т. I 5,3 Гц, 2Н) 4,64 (с. 2Н) 4,70 (с. 1Н) 6,48
2,20 (м. 2Н) 3,30 (с. 3Н) 3,49 (т. I5,3 Гц, 2Н) 4,05 (т. I 5,3 Гц, 2Н) 4,64 (с. 2Н) 4,70 (с. 1Н) 6,48  6,86 (м. 2Н) 8,21 (д. I 6,2 Гц, 1Н).
6,86 (м. 2Н) 8,21 (д. I 6,2 Гц, 1Н).
Пример получения 22.
1-Оксид-4-(3-метоксипропокси)-2-метил- пиридина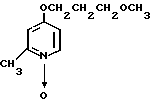
5,85 г (0,065 моль) метоксипропанола растворяли в 60 мл диметилсульфоксида для получения раствора. К этому раствору при комнатной температуре в атмосфере азота добавляли 2,6 г (0,065 моль) гидрида натрия. Полученную смесь перемешивали при 60оС полчаса. К смеси при охлаждении льдом по каплям добавляли раствор 4,66 г (0,0325 моль) 1-оксида 4-хлор-2-метилпиридина в 20 мл диметилсульфоксида. Смесь перемешивали при 40оС 1 ч. После окончании реакции реакционную смесь концентрировали при пониженном давлении с получением твердого вещества. К этому твердому веществу добавляли 200 мл воды. Полученную смесь экстрагировали хлороформом, экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали хроматографией на колонке из силикагеля (смесь этилацетат-метанол). Получали 4,09 г указанного соединения.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,80  2,24 (м. 2Н) 2,48 (с. 3Н) 3,31 (с. 3Н) 3,48 (т. I 6,3 Гц, 2Н) 4,02 (т. I 6,3 Гц, 2Н) 6,50
2,24 (м. 2Н) 2,48 (с. 3Н) 3,31 (с. 3Н) 3,48 (т. I 6,3 Гц, 2Н) 4,02 (т. I 6,3 Гц, 2Н) 6,50 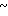 6,78 (м. 2Н) 8,04 (д. I 7,2 Гц, 1Н).
6,78 (м. 2Н) 8,04 (д. I 7,2 Гц, 1Н).
Пример получения 23.
1-Оксид 4-хлор-2-метоксипиридина
15,4 г (0,1 моль) 1-оксида 2-метил-4-нитропридина добавляли к 78,5 г (1 моль) хлористого ацетила при -10оС. Полученную смесь перемешивали при охлаждении льдом полчаса. После завершения реакции в реакционную смесь добавляли 300 мл воды со льдом. Полученную смесь нейтрализовали карбонатом натрия и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали хроматографией на колонке силикагеля (смесь этилацетата, н-гексана и метанола). Получали 4,7 г указанного соединения.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,48 (с. 3Н) 6,94  7,30 (м. 2Н) 8,09 (д. I 7,2 Гц, 1Н).
7,30 (м. 2Н) 8,09 (д. I 7,2 Гц, 1Н).
П р и м ер 59. Натриевая соль 2-[{4-(4-метоксибутокси)-3-метилпиридин-2-ил}ме-тилсульфинил]-1Н- бензимидазола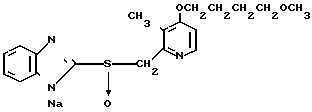
0,4 г 2-[{4-метоксибутокси-3-метилпиридин-2-ил}метилтио]-1Н-бензимидазола растворяли в 40 мл дихлорметана при обезвоживании для получения раствора. К этому раствору при -40оС по частям добавляли 227 мг м-хлорнадбензойной кислоты. Полученную смесь перемешивали 30 мин с последующим добавлением 160 мг триэтиламина. Смесь нагревали до -20оС с последующим добавлением 30 мл 2 н. водного раствора карбоната натрия. Полученную смесь перемешивали 40 мин и экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором кислого карбоната натрия, сушили над сульфатом магния и перегоняли при пониженном давлении для удаления дихлорметана. Таким образом получали 0,43 г маслянистого продукта. Это вещество растворяли в смеси, содержащей 11,2 мл 0,1 н. водной гидроокиси натрия и 30 мл этанола, и полученный раствор перегоняли при пониженном давлении для удаления растворителя. К остатку добавляли этанол и полученную смесь перегоняли при пониженном давлении для удаления растворителя. Остаток кристаллизовали из смеси этанол-эфир и получали 0,37 г указанного соединения в виде кристаллов.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,84 (м. 4Н) 2,16 (с. 3Н) 3,24 (с. 3Н) 3,38 (т. I 6,2 Гц, 2Н) 4,06 (т. I 6,2 Гц, 2Н) 4,55 (АВ кв. I 13,2 Гц, Δν 18,1 Гц, 2Н) 6,8  6,98 (м. 3Н) 7,4
6,98 (м. 3Н) 7,4  7,6 (м. 2Н) 8,27 (д. I 5,3 Гц, 1Н).
7,6 (м. 2Н) 8,27 (д. I 5,3 Гц, 1Н).
Пример получения 24.
1-Оксид 4-(3-метоксипропокси)-2,3,5-триметилпиридина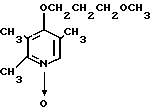
4,5 г (0,05 моль) метоксипропанола растворяли в 45 мл диметилсульфоксида для получения раствора. К этому раствору добавляли 2,0 г 60%-ного гидрида натрия при комнатной температуре в атмосфере азота. Полученную смесь нагревали до 60оС и перемешивали 1 ч. После окончания реакции в реакционную смесь при комнатной температуре по каплям добавляли раствор 4,3 г (0,025 моль) 1-оксида 4-хлор-2,3,5-триметилпиридина в 15 мл диметилсульфоксида. Полученную смесь перемешивали при 60оС 5 ч, охлаждали и перегоняли досуха для удаления растворителя. К остатку добавляли 200 мл воды. Полученную смесь экстрагировали пять раз 150 мл хлороформа. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя. Остаток очищали хроматографией на колонке силикагеля (смесью этилацетата и н-гексана) и получали 4,27 г соединения в виде масла.
Пример получения 25.
2-Гидроксиметил-4-(3-метоксипропо- кси)-3,4-диметилпиридин
HO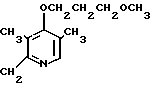
4,25 г (0,019 моль) 1-оксида 4-(3-метоксипропокси)-2,3,5-триметилпиридина растворяли в 40 мл уксусного ангидрида для получения раствора. Этот раствор перемешивали при 100оС 30 мин, охлаждали и перегоняли для удаления растворителя. Таким образом получали масло. К маслу добавляли 50 мл 1 н. хлористоводородной кислоты. Полученную смесь перемешивали при 100оС 1 ч, охлаждали, нейтрализовали кислым карбонатом натрия и три раза экстрагировали 150 мл хлороформа. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя. Остаток сушили в вакууме и получали 4,70 г указанного соединения в виде неочищенного масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,80  2,28 (м. 2Н), 2,08 (с. 3Н) 2,23 (с. 3Н) 3,34 (с. 3Н) 3,58 (т. I 6,2 Гц, 2Н) 3,87 (т. I6,2 Гц, 2Н) 4,57 (с. 2Н) 8,10 (с. 1Н).
2,28 (м. 2Н), 2,08 (с. 3Н) 2,23 (с. 3Н) 3,34 (с. 3Н) 3,58 (т. I 6,2 Гц, 2Н) 3,87 (т. I6,2 Гц, 2Н) 4,57 (с. 2Н) 8,10 (с. 1Н).
Пример получения 26.
2-Хлорметил-4-(3-метоксипропокси)-3,5-диметилпиридин
Cl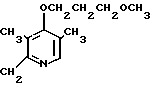
4,70 г неочищенного 2-гидроксиметил-4-(3-метоксипропокси)-3,5-диметилпириди- на растворяли в 50 мл хлороформа для получения раствора. К этому раствору при 0оС по каплям добавляли раствор 2,7 г хлористого тионила в 10 мл хлороформа, полученную смесь перемешивали при 0оС 1 ч. После завершения реакции реакционную смесь нейтрализовали насыщенным водным раствором кислого карбоната натрия и два раза экстрагировали 150 мл хлороформа. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя. Полученный остаток сушили в вакууме и получали 4,52 г указанного соединения в виде неочищенного масла.
Спектр ЯМР на ядрах (СДСl3) δ: 1,70  2,20 (м. 2Н) 2,26 (с. 3Н) 2,34 (с. 3Н) 3,38 (с. 3Н) 3,61 (т. I 6,2 Гц, 2Н) 3,91 (т. I6,2 Гц, 2Н) 4,67 (с. 2Н) 8,18 (с. 1Н).
2,20 (м. 2Н) 2,26 (с. 3Н) 2,34 (с. 3Н) 3,38 (с. 3Н) 3,61 (т. I 6,2 Гц, 2Н) 3,91 (т. I6,2 Гц, 2Н) 4,67 (с. 2Н) 8,18 (с. 1Н).
П р и м е р 60. 2-[4-(3-метоксипропокси)-3,4-диметилпиридин-2-ил]метил-тио-1Н- бензимидазол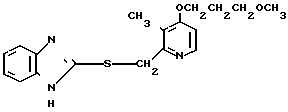
Смесь, содержащую 2,25 г (0,015 моль) 2-меркаптобензимидазола, 4,52 г (0,0185 моль) 2-хлорметил-4-(3-метоксипропокси)-3,5-диметилпиридина, 0,63 г (0,015 моль) 95%-ной гидроокиси натрия и 50 мл этанола перемешивали при 40оС 6 ч. После окончания реакции реакционную смесь перегоняли для удаления растворителя. Остаток очищали хроматографией на колонке из силикагеля (смесь этилацетата и н-гексана) и получали 4,62 г соединения в виде бледно-желтого масла.
П р и м е р 61. Натриевая соль 2-[4-(3-метоксипропокси)-3,4-диметилпиридин-2-ил]метилсульфинил- 1-бензимидазола.
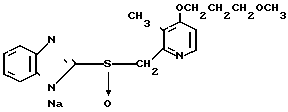
1,5 г 2-[4-(3-метоксипропокси)-3,4-диметилпиридин-2-ил] метилтио-1Н- бензимидазола растворяли в 80 мл дихлорметана при удалении влаги для получения раствора. К раствору по частям при температуре -40оС добавляли 870 мг м-хлорнадбензойной кислоты. Полученную смесь перемешивали 30 мин, затем добавляли 599 мг триэтиламина. Смесь нагревали до -20оС с последующим добавлением 80 мл 2 н. водного раствора карбоната натрия. Полученную смесь перемешивали 1 ч и экстрагировали дихлорметаном. Экстракт промывали насыщенным водным раствором кислого карбоната натрия, сушили над сульфатом магния и перегоняли при пониженном давлении. Получали 1,4 г кристаллов. 800 мг кристаллов растворяли в смеси, содержащей 21,4 мл 0,1 н.водной гидроокиси натрия и этанол. Полученный раствор перегоняли при пониженном давлении для удаления растворителя. Остаток растворяли в этаноле и раствор перегоняли при пониженном давлении для удаления растворителя. Полученный остаток кристаллизовали из смеси этанол-эфир и получали 800 мг кристаллов.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,94 (квин. I 6,2 Гц, 2Н) 2,17 (с. 3Н) 2,19 (с. 3Н) 3,25 (с. 3Н) 3,51 (т. I 6,6 Гц, 2Н) 3,80 (т. I 6,6 Гц, 2Н) 4,51 (АВ кв. I 13,2 Гц, Δν 17,0 Гц, 2Н) 6,8  6,9 (м. 2Н) 7,4
6,9 (м. 2Н) 7,4  7,7 (м. 2Н) 8,21 (с. 1Н).
7,7 (м. 2Н) 8,21 (с. 1Н).
П р и м е р 62. 2-[4-[3-(2-метоксиэтокси)метоксипропокси]-3-метилпиридин-2-ил] метилтио-1Н-бензимидазол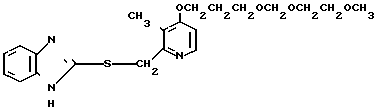
1,8 г 2-гидроксиметил-4-[3-{ (2-метоксиэтокси)метокси}пропокси]-3- метилпиридина растворяли в 40 мл дихлорметана при удалении влаги для получения раствора в с последующим добавлением 2,47 г триэтиламина. К полученной смеси добавляли при охлаждении льдом по частям 1,4 г метансульфонилхлорида. Смесь перемешивали 30 мин, подщелачивали насыщенным раствором (водным) углекислоты и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли при пониженном давлении. Остаток растворяли в 30 мл этанола с последующим добавлением 917 мг 2-меркапто-1Н-бензимидазола и 367 мг гидроокиси натрия. Смесь перемешивали при комнатной температуре 30 мин и перегоняли при пониженном давлении для удаления этанола. Остаток хроматографировали на колонке из силикагеля и элюировали смесью этилацетата и н-гексана. Получали 2,1 г указанного соединения в форме тиоэфира.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,11 (квин. I 6,2 Гц, 2Н) 2,25 (с. 3Н) 3,35 (с. 3Н) 3,58 (м. 4Н) 3,75 (т. I 6,2 Гц, 2Н) 4,13 (т. I 6,2 Гц, 2Н) 4,33 (с. 2Н) 4,71 (с. 2Н) 6,75 (д.н. 5,7 Гц, 1Н) 7,1  7,3 (м. 2Н) 7,4
7,3 (м. 2Н) 7,4  7,6 (м. 2Н) 8,32 (д. I 5,7 Гц, 1Н).
7,6 (м. 2Н) 8,32 (д. I 5,7 Гц, 1Н).
П р и м е р 63. Натриевая соль 2-[4-[3-{2-метоксиэтокси)метокси}пропокси]-3-ме- тилпиридин-2-ил] метилсульфинил-1Н-бензимидазола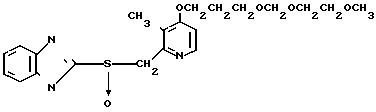
1,1 г 2-[4-[3-{ (2-метоксиэтокси)метоксипропокси]-3-метилпиридин-2-ил] метилтио-1Н-бензимидазола растворяли в 80 мл дихлорметана при удалении влаги для получения раствора. К этому раствору при температуре -40оС по частям добавляли 544 мг м-хлорнадбензойной кислоты. Полученную смесь перемешивали 30 мин с последующим добавлением 379 мг триэтиламина. Полученную смесь нагревали до -20оС, затем добавляли 40 мл 2 н. водного раствора карбоната натрия. Смесь перемешивали 30 мин и экстрагировали хлороформом. Экстракт промывали насыщенным водным раствором кислого карбоната натрия, сушили над сульфатом магния и перегоняли при пониженном давлении для удаления растворителя. Остаток растворяли в смеси, содержащей 24 мл 0,1 н. водной гидроокиси натрия и 40 мл этанола. Полученный водный раствор перегоняли при пониженном давлении для удаления растворителя с последующим добавлением 40 мл этанола. Смесь снова перегоняли при пониженном давлении для удаления этанола. Остаток кристаллизовали из смеси этанол-эфир и получали 0,98 г целевого соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,02 (квин, I 6,2 Гц, 2Н) 2,17 (с. 3Н) 3,23 (с. 3Н) 3,49 (м. 4Н) 3,65 (т. I 6,2 Гц, 2Н) 4,12 (т. I 6,2 Гц, 2Н) 4,56 (АВ кв. I 21,1 Гц, Δν 16,8 Гц, 2Н) 4,62 (с. 2Н) 6,84  6,99 (м. 3Н) 7,4
6,99 (м. 3Н) 7,4 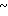 7,5 (м. 2Н) 8,23 (д. I 5,7 Гц, 1Н).
7,5 (м. 2Н) 8,23 (д. I 5,7 Гц, 1Н).
Пример получения 27.
N-окид 4-(2-фторметокси)этокси-2,3-диметилпиридина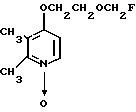
0,49 г гидрида натрия постепенно добавляли при комнатной температуре в атмосфере азота к раствору 1,0 г N-оксида 4-(2-оксиэтокси)-2,3-диметилпиридина в 40 мл диметилформамида. После прекращения пенообразования к полученной смеси при температуре -50оС добавляли 1 мл бромфторметана. Полученную смесь постепенно нагревали и перемешивали при 15-20оС 3 ч. К смеси добавляли этанол для поглощения избыточного гидрида натрия. К смеси добавляли 5 мл 1 н. водной хлористоводородной кислоты и через полученную смесь пропускали газообразный азот для удаления бромфторметана. К смеси добавляли воду. Полученную смесь экстрагировали хлороформом и экстракт сушили над сульфатом магния и перегоняли при пониженном давлении для удаления растворителя. Остаток хроматографировали на колонке силикагеля, элюировали хлороформом, содержащим 1-5% метанола, и получали 0,6 г указанного соединения.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,24 (с. 3Н) 2,56 (с. 3Н) 4,24 (м. 5Н) 5,3 (д. I 55,8 Гц, 2Н) 6,54 (д. I 6,2 Гц, 1Н) 8,12 (д. I 6,2 Гц, 1Н).
Пример получения 28.
4-(2-Фторметокси)этокси-2-гидрокси-метил-3-метилпиридин
Смесь, содержащую неочищенный N-оксид 4-(2-фторметокси)этокси-2,3-диметилпиридина, полученный из 6,0 г неочищенного N-оксида 4-(2-оксиэтокси)-2,3-диметилпиридина и 40 мл уксусного ангидрида, перемешивали при температуре от 90 до 100оС в течение 40 мин и перегоняли при пониженном давлении для удаления уксусного ангидрида. Остаток слабо подщелачивания 2 н. водным раствором карбоната натрия и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли при пониженном давлении для удаления растворителя. Остаток растворяли в 30 мл этанола с последующим добавлением 0,33 г гидроокиси натрия. Полученную смесь перемешивали при комнатной температуре 30 мин, слабо подщелачивали насыщенным водным раствором хлористого аммония и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли при пониженном давлении для удаления растворителя. Остаток хроматографировали на колонке из силикагеля и элюировали смесью этилацетата и н-гексана. Получали 1,2 г указанного соединения в виде кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,0 (с. 3Н) 4,17 (м. 4Н) 4,64 (с. 2Н) 5,36 (д. I 56,3 Гц, 2Н) 6,71 (д. I 5,7 Гц, 1Н) 8,30 (д. I 5,7 Гц, 1Н).
Пример получения 29.
4-(2-фторметокси)этокси-3-метилпири- дин-2-ил}метиловый эфир метансульфокислоты
CH3-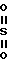 -O-
-O-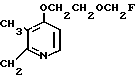
160 мг метансульфонилхлорида по каплям добавляли к раствору 0,2 г 4-(2-фторметокси)этокси-2-гидроксиметил-3-метилпи- ридина и 143 мг триэтиламина в 10 мл хлороформа при удалении влаги и при температуре -50оС. Полученную смесь постепенно нагревали до комнатной температуры, подщелачивали насыщенным водным раствором кислого карбоната натрия и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и перегоняли для удаления растворителя. Получали 0,38 г указанного соединения в виде неочищенного масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,30 (с. 3Н) 3,08 (с. 3Н) 4,2 (м. 4Н) 5,4 (д. I 55,8 Гц, 2Н) 5,38 (с. 2Н) 6,84 (д. I 6 Гц, 1Н) 8,36 (д. I 6 Гц, 1Н).
П р и м е р 64. 2-[{4-(2-фторметокси)этокси-3-метилпиридин-2-ил}метилтио]-1Н- бензимидазол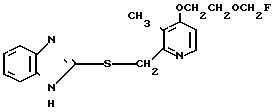
Смесь, содержащую неочищенный4-(2-фторметокси)этокси-3-метилпиридин-2-ил} метиловый эфир метансульфокислоты, полученный из 0,6 г 4-(2-фторметокси)этокси-2-гидроксиметил-3-метилпиридина, 0,42 г 2-меркапто-1Н-бензимидазола и 30 мл этанола, перемешивали при комнатной температуре 30 мин и перегоняли при пониженном давлении для удаления этанола. Полученный остаток хроматографировали на колонке силикагеля и элюировали смесью метанол-этилацетат. Получали 0,3 г масляного продукта.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,25 (с. 3Н) 2,98 (с. 3Н) 4,13 (м. 4Н) 4,41 (с. 2Н) 5,33 (д. I 56,3 Гц, 2Н) 6,72 (д. I 5,7 Гц, 1Н) 7,1  7,2 (м. 2Н) 7,4
7,2 (м. 2Н) 7,4  7,6 (м. 2Н) 8,32 (д. I 5,7 Гц, 1Н).
7,6 (м. 2Н) 8,32 (д. I 5,7 Гц, 1Н).
П р и м е р 65. Натриевая соль 2-[{4-(2-фторметокси)этокси-3-метилпиридин-2-ил}метилсульфинил] 1Н-бензимидазола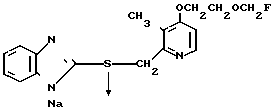
184 мг м-хлорнадбензойной кислоты по частям добавляли к раствору 0,3 г 2-[4-(2- фторметокси)этокси-3-метилпиридин-2-ил- метилтио]-1Н- бензимидазола в 30 мл дихлорметана при перемешивании и удалении влаги при температуре -40оС. Полученную смесь перемешивали 30 мин с последующим добавлением 129 мг триэтиламина. Смесь нагревали до комнатной температуры, слабо подщелачивали насыщенным водным раствором кислого карбоната натрия и экстрагировали хлороформом. Экстракт сушили над сульфатом магния и дистиллировали при пониженном давлении для удаления растворителя. Полученный остаток растворяли в 30 мл безводного тетрагидрофурана в атмосфере азота для получения раствора. К этому раствору при -20оС добавляли 36,2 г 60%-ного гидрида натрия. После исчезновения пены смесь перегоняли при пониженном давлении для удаления тетрагидрофурана. Остаток кристаллизовали из безводного эфира и получали 260 мг целевого соединения в виде кристаллов.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,18 (с. 3Н) 4,14 (м. 4Н) 4,56 (АВ кв. I 13,2 Гц, Δν 21,3 Гц, 2Н) 5,37 (д. I 56,7 Гц, 2Н) 6,8  7,0 (м. 3Н) 7,4
7,0 (м. 3Н) 7,4  7,5 (м. 2Н) 8,29 (д. I 5,3 Гц, 1Н).
7,5 (м. 2Н) 8,29 (д. I 5,3 Гц, 1Н).
П р и м е р 66. 2-[[4-{2-(1Н-бензимидазол-2-илтио)этокси}2,3-метилпиридин-2-ил] метилтио]-1Н-бензимидазол S
S
Смесь, содержащую 1,34 г (0,004 моль) 2-[{4-(2-хлорэтокси)-3-метилпиридин-2-ил} метилтио} -1Н-бензимидазола 0,53 г (0,0035 моль) 2-меркапто-1Н-бензимидазола 0,17 г (0,004 моль) 95%-ной гидроокиси натрия и 30 мл этанола, перемешивали при 80оС 8 ч. После завершения реакции реакционную смесь фильтровали для удаления неорганического вещества. Фильтрат перегоняли для удаления растворителя. Остаток очищали хроматографией на колонке силикагеля (смесью этилацетата и н-гексана) и получали 1,08 г указанного соединения в виде белых кристаллов.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,15 (с. 3Н) 3,73 (т. I 7,1 Гц, 2Н) 4,23 (т. I 7,1 Гц, 2Н) 4,68 (с. 2Н) 6,96  7,22 (м. 5Н) 7,32
7,22 (м. 5Н) 7,32  7,54 (м. 4Н) 8,25 (д. I 5,3 Гц, 1Н).
7,54 (м. 4Н) 8,25 (д. I 5,3 Гц, 1Н).
П р и м е р 67. Двунатриевая соль 2-[[4-{2-(1Н-бензимидазол-2-илсульфинил)эток-си}-3-метилпиридин-2- ил]метилсульфинил]-1Н-бензимидазола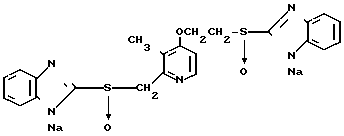
0,90 г (0,002 моль) 2-[[4-{2-(1Н-бензимидазол-2-илтио)этокси}-3-метилпиридин-2-ил] метилтио}-1Н-бензимидазола суспендировали в 40 мл дихлорметана для получения суспензии. К суспензии добавляли метанол до тех пор, пока она не станет прозрачной. К полученной смеси в атмосфере азота при температуре -60оС добавляли 0,43 г (0,002 моль) 80%-ной м-хлорнадбензойной кислоты. Смесь перемешивали полчаса. После окончания реакции в реакционную смесь добавляли 0,5 г триэтиламина. Полученную смесь нагревали до -10оС с последующим добавлением 30 мл насыщенного водного раствора карбоната натрия. Смесь перемешивали при комнатной температуре полчаса и фильтровали. Фильтрат три раза экстрагировали 100 мл дихлорметана. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя 0,14 г остатка растворяли в 0,1 н. водной гидроокиси натрия с последующим добавлением этанола. Полученную смесь перегоняли для удаления растворителя. Остаток промывали эфиром и получали 0,15 г целевого указанного соединения в виде желтых кристаллов.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,18 (с. 3Н) 3,20  3,75 (м. 2Н) 4,19
3,75 (м. 2Н) 4,19  4,74 (м. 4Н) 6,68
4,74 (м. 4Н) 6,68  7,08 (м. 5Н) 7,16
7,08 (м. 5Н) 7,16  7,53 (м. 4Н) 8,20 (д. I 6,2 Гц, 1Н).
7,53 (м. 4Н) 8,20 (д. I 6,2 Гц, 1Н).
П р и м е р 68. 2-[[4-(2-(бензотиазол-2-ил)этокси-3-метилпиридин-2-ил] метилтио] 1Н-бензимидазол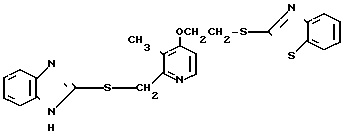
Смесь, содержащую 1,34 г (0,004 моль) 2-[{4-(2-хлорэтокси)-3-метилпиридин-2-ил} метилтио] -1Н-бензимидазола, 0,59 г (0,035 моль) 2-меркаптобензотиазола, 0,17 г (0,004 моль) 95%-ной гидроокиси натрия и 30 мл этанола, перемешивали при 80оС 16 ч. После завершения реакции реакционную смесь фильтровали для удаления неорганического вещества. Фильтрат перегоняли для удаления растворителя, а остаток очищали хроматографией на колонке из силикагеля (смесь этилацетата и н-гексана) и получали 1,20 г указанного соединения в виде белых кристаллов.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,08 (с. 3Н) 3,79 (т. I 6,2 Гц, 2Н) 4,40 (т. I6,2 Гц, 2Н) 4,60 (с. 2Н) 6,88 (7,21 (м. 3Н) 7,22  7,50 (м. 4Н) 7,68
7,50 (м. 4Н) 7,68  8,00 (м. 2H), 8,16 (д. I 6,2 Гц, 1Н).
8,00 (м. 2H), 8,16 (д. I 6,2 Гц, 1Н).
П р и м е р 69. Натриевая соль 2-[[4-{2-(бензотиазол-2-илсульфинил)этокси}-3-ме-тилпиридин-2-ил] метилсульфинил]-1Н-бензимидазол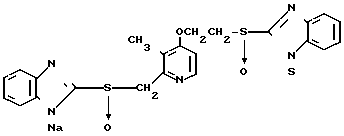
0,93 г (0,002 моль) 2-[[4-{2-(2-бензотиазол-2-илтио)этокси}-3-метилпиридин-2-ил]ме- тилтио] 1Н-бензимидазола суспендировали в 40 мл дихлорметана. К полученной суспензии добавляли метанол до тех пор, пока она не становилась прозрачной. К полученной смеси добавляли в атмосфере азота при температуре -60оС, 0,43 г 80%-ной м-хлорнадбензойной кислоты. Смесь перемешивали полчаса. После завершения реакции в реакционную смесь добавляли 0,6 г триэтиламина, и полученную смесь нагревали до -10оС с последующим добавлением 30 мл насыщенного водного раствора кислого карбоната натрия. Смесь перемешивали при комнатной температуре полчаса и два раза экстрагировали 100 мл дихлорметана. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат перегоняли для удаления растворителя. 0,8 г полученного остатка растворяли в 0,1 н. гидроокиси натрия с последующим добавлением этанола. Смесь перегоняли для удаления растворителя. Остаток промывали эфиром и получали 0,69 г указанного соединения.
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,06 (с. 3Н) 3,66  4,00 (м. 2Н) 4,19
4,00 (м. 2Н) 4,19  4,86 (м. 4Н) 6,74
4,86 (м. 4Н) 6,74  7,04 (м. 3Н) 7,15
7,04 (м. 3Н) 7,15  7,54 (м. 4Н) 7,64
7,54 (м. 4Н) 7,64  7,96 (м. 2Н) 8,21 (д. I 6,2 Гц, 1Н).
7,96 (м. 2Н) 8,21 (д. I 6,2 Гц, 1Н).
Соединения примеров 70-91 получены по способу, аналогичному описанному выше.
П р и м е р 70. 2-[{4-(2-фуранилметилсульфинил)этокси-3-метилпиридин-2-ил} метилсульфинил]-1Н-бензимидазол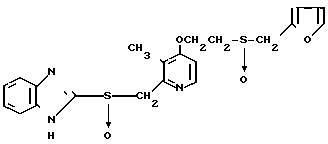
ЯМР-спектр на ядрах 1Н (ДМСО-d) δ: 2,36 (с. 3Н) 3,0  3,5 (м. 2Н) 4,0
3,5 (м. 2Н) 4,0  4,6 (м. 4Н) 4,73 (с. 2Н) 6,44 (с. 2Н) 7,02 (д. I 5,4 Гц, 1Н) 7,16
4,6 (м. 4Н) 4,73 (с. 2Н) 6,44 (с. 2Н) 7,02 (д. I 5,4 Гц, 1Н) 7,16  7,2 (м. 2Н) 7,28
7,2 (м. 2Н) 7,28  7,76 (м. 3Н) 8,24 (д. I 5,4 Гц, 1Н).
7,76 (м. 3Н) 8,24 (д. I 5,4 Гц, 1Н).
П р и м е р 71. 2-[{4-(2-(1,1-Диоксотиоморфолино))этокси-3-метилпиридин-2-ил} метилтио]-1Н-бензимидазол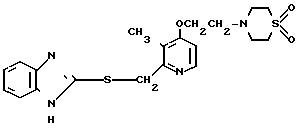
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,21 (с. 3Н) 2,99 (т. I 5,8 Гц, 2Н) 3,07 (с. 8Н) 4,16 (т. I 5,8 Гц, 2Н) 4,68 (с. 2Н) 6,95 (д. I 6,1 Гц, 1Н) 6,95  7,2 (м. 2Н) 7,3
7,2 (м. 2Н) 7,3  7,5 (м. 2Н) 8,2 (д. I 6,1 Гц, 1Н).
7,5 (м. 2Н) 8,2 (д. I 6,1 Гц, 1Н).
П р и м е р 72. 2-[{3-метил-4-(2-метилсульфонил)этокси}пиридин-2-ил] метилтио-1Н- бензимидазол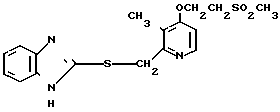
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,28 (с. 3Н) 3,08 (с. 3Н) 3,72 (т. I 6,2 Гц, 2Н) 3,66 (т. I 6,2 Гц, 2Н) 3,94 (с. 2Н) 6,8  7,6 (м. 7Н) 8,6 (д. I 5,7 Гц, 1Н).
7,6 (м. 7Н) 8,6 (д. I 5,7 Гц, 1Н).
П р и м е р 73. 2-[{4-(2-этоксикарбонилметокси)этокси-3-метилпиридин-2-ил} метилсульфинил]-1Н-бензимидазол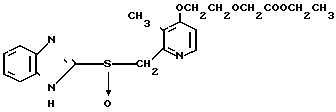
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,22 (т. I 7,2 Гц, 3Н) 2,16 (с. 3Н) 3,16  3,58 (м. 2Н) 3,64
3,58 (м. 2Н) 3,64  4,6 (м. 6Н) 4,76 (с. 2Н) 7,04 (д. I 7 Гц, 1Н) 7,16
4,6 (м. 6Н) 4,76 (с. 2Н) 7,04 (д. I 7 Гц, 1Н) 7,16  7,24 (м. 2Н) 7,32
7,24 (м. 2Н) 7,32  7,80 (м. 2Н) 8,24 (д. I 7 Гц, 1Н).
7,80 (м. 2Н) 8,24 (д. I 7 Гц, 1Н).
П р и м е р 75. 2-[[3-метил-4-{(2-фенилтио)этокси}пиридин-2-ил]метилтио] -1Н- бензимидазол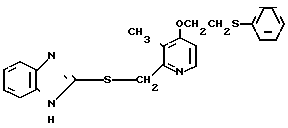
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 2,08 (с. 3Н) 3,24 (т. I 6,1 Гц, 2Н) 4,06 (т. I 6,1 Гц, 2Н) 4,38 (с. 2Н) 6,52 (д. I 5,8 Гц, 1Н) 7,04  7,64 (м. 10Н) 8,23 (д. I 5,8 Гц, 1Н).
7,64 (м. 10Н) 8,23 (д. I 5,8 Гц, 1Н).
П р и м е р 76. 2-[[3-метил-4-{2-пиридилтио)этокси}пиридин-2-ил]метилтио]-1Н- бензимидазол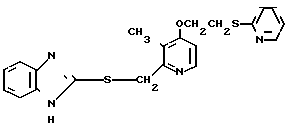
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,14 (с. 3Н) 3,6 (т. I 6,1 Гц, 2Н) 4,32 (т. I6,1 Гц, 2Н) 4,7 (с. 2Н) 7,0  7,8 (м. 10Н) 8,2
7,8 (м. 10Н) 8,2  8,6 (м. 2Н).
8,6 (м. 2Н).
П р и м е р 77. 2-[[3-метил-4-{(2-метилсульфинил)этокси}пиридин-2-ил] метилсуль- финил] 1Н-бензимидазол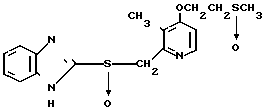
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,16 (с. 3Н) 2,64 (с. 3Н) 3,16 (м. 2Н) 4,44 (м. 2Н) 4,78 (с. 2Н) 7,0 (д. I 5,8 Гц, 1Н) 7,4  7,5 (м. 2Н) 7,5
7,5 (м. 2Н) 7,5  7,7 (м. 2Н) 8,2 (д. I 5,8 Гц, 1Н).
7,7 (м. 2Н) 8,2 (д. I 5,8 Гц, 1Н).
П р и м е р 78. 2-[4-{(2-бензилтио)этокси}-3-метилпиридин-2-ил]метилтио] -1Н- бензимидазол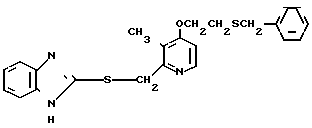
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,24 (с. 3Н) 2,84 (т.н. I 5,8 Гц, 2Н) 4,18 (т. I 5,8 Гц, 2Н) 4,68 (с. 2Н) 6,86 (д. I 6,5 Гц, 1Н) 7,0  7,54 (м. 9Н) 8,23 (д. I 6,5 Гц, 1Н).
7,54 (м. 9Н) 8,23 (д. I 6,5 Гц, 1Н).
П р и м е р 79. 2-[{4-(2-метокси)пропокси-3-метилпириди-2-ил}-метилсульфонил]-1Н- бензимидазол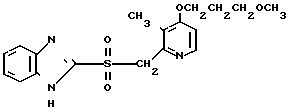
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 2,0 (т. I 7,5 Гц, 2Н) 2,2 (с. 3Н) 3,28 (с. 3Н) 3,5 (т. I 7,5 Гц, 2Н) 4,09 (т. I 7,5 Гц, 2Н) 5,06 (с. 2Н) 6,92 (д. I 5,4 Гц, 1Н) 7,35  7,52 (м. 2Н) 7,64
7,52 (м. 2Н) 7,64  7,8 (м. 2Н) 8,03 (д. I 5,4 Гц, 1Н).
7,8 (м. 2Н) 8,03 (д. I 5,4 Гц, 1Н).
П р и м е р 80. 5-метокси-2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил} метил-тио-1Н- бензимидазол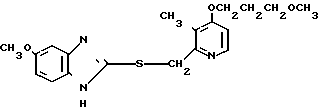
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,92  2,18 (м. 2Н) 2,22 (с. 3Н) 3,31 (с. 3Н) 3,52 (т. I 6,1 Гц, 2Н) 3,80 (с. 3Н) 4,09 (т. I 6,1 Гц, 2Н) 4,30 (с. 2Н) 6,64 6,81 (м. 2Н) 6,97 (д. I 2,2 Гц, 1Н) 7,33 (д. I 8,5 Гц) 8,25 (д. I 5,7 Гц, 1Н).
2,18 (м. 2Н) 2,22 (с. 3Н) 3,31 (с. 3Н) 3,52 (т. I 6,1 Гц, 2Н) 3,80 (с. 3Н) 4,09 (т. I 6,1 Гц, 2Н) 4,30 (с. 2Н) 6,64 6,81 (м. 2Н) 6,97 (д. I 2,2 Гц, 1Н) 7,33 (д. I 8,5 Гц) 8,25 (д. I 5,7 Гц, 1Н).
П р и м е р 81. 5-метил-2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил} метилтио- 1Н-бензимидазол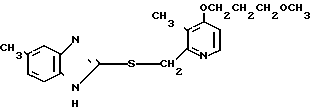
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,94 2,19 (м. 2Н) 2,22 (с. 3Н) 2,42 (с. 3Н) 3,31 (с. 3Н) 3,52 (т. I 6,1 Гц, 2Н) 4,08 (т. I 6,1 Гц, 2Н) 4,31 (с. 2Н) 6,67 (д. I 5,7 Гц, 1Н) 6,80
2,19 (м. 2Н) 2,22 (с. 3Н) 2,42 (с. 3Н) 3,31 (с. 3Н) 3,52 (т. I 6,1 Гц, 2Н) 4,08 (т. I 6,1 Гц, 2Н) 4,31 (с. 2Н) 6,67 (д. I 5,7 Гц, 1Н) 6,80 7,00 (м. 1Н) 7,15
7,00 (м. 1Н) 7,15 7,40 (м. 2Н) 8,23 (д. I 5,7 Гц, 1Н).
7,40 (м. 2Н) 8,23 (д. I 5,7 Гц, 1Н).
П р и м е р 82. 5,6-диметил-2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил} метилтио-1Н-бензимидазол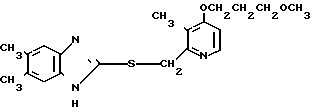
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,95 2,17 (м. 2Н) 2,24 (с. 3Н) 2,34 (с. 6Н) 3,35 (с. 3Н) 3,55 (т. I 6,2 Гц, 2Н) 4,12 (т. I6,2 Гц, 2Н) 4,35 (с. 2Н) 6,74 (д. I 5,7 Гц), 7,29 (с. 2Н) 8,32 (д. I 5,7 Гц).
2,17 (м. 2Н) 2,24 (с. 3Н) 2,34 (с. 6Н) 3,35 (с. 3Н) 3,55 (т. I 6,2 Гц, 2Н) 4,12 (т. I6,2 Гц, 2Н) 4,35 (с. 2Н) 6,74 (д. I 5,7 Гц), 7,29 (с. 2Н) 8,32 (д. I 5,7 Гц).
П р и м е р 83. 2-хлор-2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил} метилтио-1Н- бензимидазол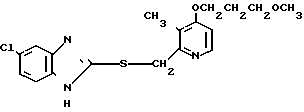
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,93 2,18 (м. 2Н) 2,25 (с. 3Н) 3,35 (с. 3Н) 3,56 (т. I 6,2 Гц, 2Н) 4,13 (т. I 0,6 Гц, 2Н) 4,36 (с. 2Н) 6,76 (д. I 5,7 Гц, 1Н) 7,10 (дд. I 8,8 Гц, 2,2 Гц, 1Н) 7,42 (д. I 8,8 Гц, 1Н) 7,50 (д. I 2,2 Гц, 1Н) 8,31 (д. I 5,7 Гц, 1Н).
2,18 (м. 2Н) 2,25 (с. 3Н) 3,35 (с. 3Н) 3,56 (т. I 6,2 Гц, 2Н) 4,13 (т. I 0,6 Гц, 2Н) 4,36 (с. 2Н) 6,76 (д. I 5,7 Гц, 1Н) 7,10 (дд. I 8,8 Гц, 2,2 Гц, 1Н) 7,42 (д. I 8,8 Гц, 1Н) 7,50 (д. I 2,2 Гц, 1Н) 8,31 (д. I 5,7 Гц, 1Н).
П р и м е р 84. 2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилтио-5- трифторметил-1Н-бензимидазол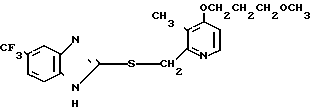
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,92 2,19 (м. 2Н) 2,27 (с. 3Н) 3,36 (с. 3Н) 3,56 (т. I 5,9 Гц, 2Н) 4,15 (т. I 6,1 Гц, 2Н) 4,38 (с. 2Н) 6,79 (д. I 5,7 Гц, 1Н) 7,23
2,19 (м. 2Н) 2,27 (с. 3Н) 3,36 (с. 3Н) 3,56 (т. I 5,9 Гц, 2Н) 4,15 (т. I 6,1 Гц, 2Н) 4,38 (с. 2Н) 6,79 (д. I 5,7 Гц, 1Н) 7,23  7,60 (м. 2Н) 7,71 (с. 1Н) 8,35 (д. I 5,76 Гц, 1Н).
7,60 (м. 2Н) 7,71 (с. 1Н) 8,35 (д. I 5,76 Гц, 1Н).
П р и м е р 85. Натриевая соль 5-метокси-2-{4-(3-метоксипропокси)-3-метилпири- дин-2-ил} метилсульфинил-1Н-бензимидазола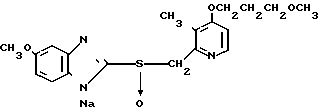
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,84  2,06 (м. 2Н) 2,14 (с. 3Н) 3,25 (с. 3Н) 3,49 (т. I 6,2 Гц, 2Н) 3,72 (с. 3Н) 4,09 (т. I6,2 Гц, 2Н) 4,53 (АВ кв. I 12,7 Гц, Δν 18,0 Гц, 2Н) 6,54 (дд. I 8,8 Гц, 2,6 Гц, 1Н) 6,91 (д. I 5,7 Гц, 1Н) 7,00 (д. I 2,6 Гц, 1Н) 7,34 (д. I 8,8 Гц, 1Н) 8,27 (д. I 5,7 Гц, 1Н).
2,06 (м. 2Н) 2,14 (с. 3Н) 3,25 (с. 3Н) 3,49 (т. I 6,2 Гц, 2Н) 3,72 (с. 3Н) 4,09 (т. I6,2 Гц, 2Н) 4,53 (АВ кв. I 12,7 Гц, Δν 18,0 Гц, 2Н) 6,54 (дд. I 8,8 Гц, 2,6 Гц, 1Н) 6,91 (д. I 5,7 Гц, 1Н) 7,00 (д. I 2,6 Гц, 1Н) 7,34 (д. I 8,8 Гц, 1Н) 8,27 (д. I 5,7 Гц, 1Н).
П р и м е р 86. Натриевая соль 5-метил-2-{4-(3-метоксипропокси)-3-метилпиридин- 2- ил}метилсульфинил- 1Н-бензимидазола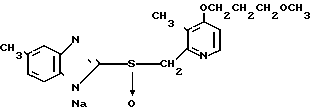
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,84  2,05 (м. 2Н) 2,14 (с. 3Н) 2,37 (с. 3Н) 3,25 (с. 3Н) 3,48 (т. I 6,2 Гц, 2Н) 4,09 (т. I6,2 Гц, 2Н) 4,53 (АВ кв. I 12,8 Гц, Δν 17,3 Гц, 2Н) 6,71 (дд. I 7,9 Гц, 1,5 Гц, 1Н) 6,91 (д. I 5,7 Гц, 1Н) 7,26 (с. 1Н) 7,35 (д. I 7,9 Гц, 1Н) 8,27 (д. I 5,7 Гц, 1Н).
2,05 (м. 2Н) 2,14 (с. 3Н) 2,37 (с. 3Н) 3,25 (с. 3Н) 3,48 (т. I 6,2 Гц, 2Н) 4,09 (т. I6,2 Гц, 2Н) 4,53 (АВ кв. I 12,8 Гц, Δν 17,3 Гц, 2Н) 6,71 (дд. I 7,9 Гц, 1,5 Гц, 1Н) 6,91 (д. I 5,7 Гц, 1Н) 7,26 (с. 1Н) 7,35 (д. I 7,9 Гц, 1Н) 8,27 (д. I 5,7 Гц, 1Н).
П р и м е р 87. Натриевая соль 5,6-диметил-2-{4-(3-метоксипропокси)-3-метилпири- дин-2-ил} метилсульфинил-1Н-бензимидазола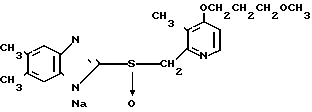
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,82  2,08 (м. 2Н) 2,13 (с. 3Н) 2,27 (с. 6Н) 3,24 (с. 3Н) 3,47 (т. I 6,6 Гц, 2Н) 4,08 (т. I6,7 Гц, 2Н) 4,54 (АВ кв. I 13,0 Гц, Δν 19,8 Гц, 2Н) 6,90 (д. I 5,7 Гц, 1Н) 7,25 (с. 2Н) 8,26 (д. I 5,7 Гц, 1Н).
2,08 (м. 2Н) 2,13 (с. 3Н) 2,27 (с. 6Н) 3,24 (с. 3Н) 3,47 (т. I 6,6 Гц, 2Н) 4,08 (т. I6,7 Гц, 2Н) 4,54 (АВ кв. I 13,0 Гц, Δν 19,8 Гц, 2Н) 6,90 (д. I 5,7 Гц, 1Н) 7,25 (с. 2Н) 8,26 (д. I 5,7 Гц, 1Н).
П р и м е р 88. Натриевая соль 5-хлор-2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилсульфинил- 1Н-бензимидазола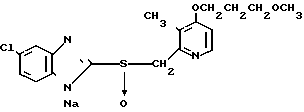
Cпектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,80  2,06 (м. 2Н) 2,13 (с. 3Н) 3,25 (с. 3Н) 3,48 (т. I 6,2 Гц, 2Н) 4,09 (т. I 6,2 Гц, 2Н) 4,54 (АВ кв. I 12,9 Гц, I 15,3 Гц, 2Н) 6,65
2,06 (м. 2Н) 2,13 (с. 3Н) 3,25 (с. 3Н) 3,48 (т. I 6,2 Гц, 2Н) 4,09 (т. I 6,2 Гц, 2Н) 4,54 (АВ кв. I 12,9 Гц, I 15,3 Гц, 2Н) 6,65 6,92 (м. 2Н) 7,25
6,92 (м. 2Н) 7,25  7,50 (м. 2Н) 8,27 (д. I 5,3 Гц).
7,50 (м. 2Н) 8,27 (д. I 5,3 Гц).
П р и м е р 89. Натриевая соль 2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил} метилсульфинил-5- трифторметил-1Н-бензимидазола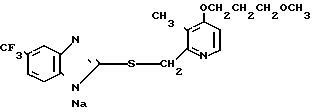
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,84  2,06 (м. 2Н) 2,14 (с. 3Н) 3,25 (с. 3Н) 3,48 (т. I 6,2 Гц, 2Н) 4,09 (т. I 6,1 Гц, 2Н) 4,56 (АВ кв. I 13,2 Гц, Δν 13,5 Гц, 2Н) 6,92 (д. I 5,3 Гц, 1Н) 7,01
2,06 (м. 2Н) 2,14 (с. 3Н) 3,25 (с. 3Н) 3,48 (т. I 6,2 Гц, 2Н) 4,09 (т. I 6,1 Гц, 2Н) 4,56 (АВ кв. I 13,2 Гц, Δν 13,5 Гц, 2Н) 6,92 (д. I 5,3 Гц, 1Н) 7,01  7,22 (м. 1Н) 7,45
7,22 (м. 1Н) 7,45  7,82 (м. 2Н) 8,21 (д. I 5,3 Гц, 1Н).
7,82 (м. 2Н) 8,21 (д. I 5,3 Гц, 1Н).
П р и м е р 90. 2-{4-метоксипропокси-5-метилпиридин-2-ил}метилтио-1Н-бензими- дазол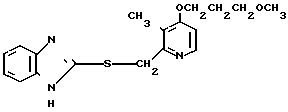
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,90  2,24 (м. 2Н) 2,16 (с. 3Н) 3,31 (с. 3Н) 3,51 (т. I 6,2 Гц, 2Н) 4,08 (т. I 6,2 Гц, 2Н) 4,22 (с. 2Н) 6,74 (с. 1Н) 6,99
2,24 (м. 2Н) 2,16 (с. 3Н) 3,31 (с. 3Н) 3,51 (т. I 6,2 Гц, 2Н) 4,08 (т. I 6,2 Гц, 2Н) 4,22 (с. 2Н) 6,74 (с. 1Н) 6,99  7,22 (м. 2Н) 7,32
7,22 (м. 2Н) 7,32  7,58 (м. 2Н) 8,16 (с. 1Н).
7,58 (м. 2Н) 8,16 (с. 1Н).
П р и м е р 91. Натриевая соль 2-{4-(3-метоксипропокси)-5-метилпиридин-2-ил} метилсульфинил-1Н- бензимидазола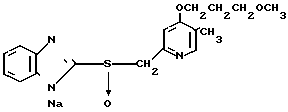
Спектр ЯМР на ядрах 1Н (ДМСО-d6) δ: 1,56  1,87 (м. 2Н) 2,00 (с. 3Н) 3,16 (с. 3Н) 3,20
1,87 (м. 2Н) 2,00 (с. 3Н) 3,16 (с. 3Н) 3,20  3,72 (м. 4Н) 6,16
3,72 (м. 4Н) 6,16  6,60 (м. 2Н) 6,49 (с. 1Н) 6,68
6,60 (м. 2Н) 6,49 (с. 1Н) 6,68  6,92 (м. 2Н) 7,28
6,92 (м. 2Н) 7,28  7,50 (м. 2Н) 8,13 (с. 1Н).
7,50 (м. 2Н) 8,13 (с. 1Н).
П р и м е р 92. 2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилтиобензоти- азол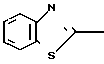 S
S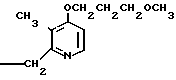
Смесь, содержащую 0,8 г 2-хлорметил-4-(3-метоксипропокси)-3-метилпиридина гидрохлорида, 0,5 г 2-меркаптобензотиазола, 0,36 г гидроокиси натрия и 30 мл этанола, перемешивали при комнатной температуре 6 ч и перегоняли при пониженном давлении для удаления этанола. Остаток очищали хроматографией на силикагеле и получали 0,85 г целевого указанного соединения в виде бледно-желтых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,9 2,2 (м. 2Н) 2,30 (с. 3Н) 3,35 (с. 3Н) 3,56 (т. I 6,1 Гц, 2Н) 4,10 (т. I 6,1 Гц, 2Н) 4,81 (с. 2Н) 6,70 (д. I 5,7 Гц, 1Н) 7,1
2,2 (м. 2Н) 2,30 (с. 3Н) 3,35 (с. 3Н) 3,56 (т. I 6,1 Гц, 2Н) 4,10 (т. I 6,1 Гц, 2Н) 4,81 (с. 2Н) 6,70 (д. I 5,7 Гц, 1Н) 7,1  7,5 (м. 2Н) 7,5
7,5 (м. 2Н) 7,5 7,9 (м. 2Н) 8,29 (д. I 5,7 Гц, 1Н).
7,9 (м. 2Н) 8,29 (д. I 5,7 Гц, 1Н).
П р и м е р 93. 2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил} метилсульфинилбензотиазол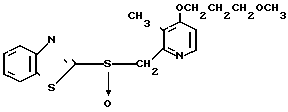
0,6 г 2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилтиобензотиазола растворяли в 20 мл дихлорметана для получения раствора. К раствору при температуре -45оС добавляли 0,36 г 80%-ной м-хлорнадбензойной кислоты. Через час к полученной смеси добавляли 0,34 г триэтиламина и 30 мл насыщенного водного раствора кислого карбоната натрия. Полученную смесь перемешивали при комнатной температуре 30 мин. Дихлорметановый слой отделяли, два раза промывали насыщенным водным раствором кислого карбоната натрия, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали для получения остатка. Остаток очищали хроматографией на колонке силикагеля и получали 0,17 г соединения, указанного в названии примера в виде белых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,95  2,18 (м. 2Н) 2,20 (с. 3Н) 3,34 (с. 3Н) 3,54 (т. I 6,1 Гц, 2Н) 4,10 (т. I 6,1 Гц, 2Н) 4,67 (с. 2Н) 6,71 (д. I 5,7 Гц, 1Н) 7,40
2,18 (м. 2Н) 2,20 (с. 3Н) 3,34 (с. 3Н) 3,54 (т. I 6,1 Гц, 2Н) 4,10 (т. I 6,1 Гц, 2Н) 4,67 (с. 2Н) 6,71 (д. I 5,7 Гц, 1Н) 7,40  7,0 (м. 2Н) 7,92
7,0 (м. 2Н) 7,92  8,20 (м. 2Н) 8,25 (д. I 5,7 Гц, 1Н).
8,20 (м. 2Н) 8,25 (д. I 5,7 Гц, 1Н).
П р и м е р 94. 2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилтио-1- метилбензимидазол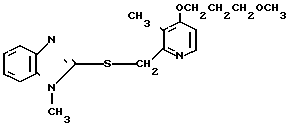
0,5 г 2-{4-(3-гидроксипропокси)-3-метилпиридин-2-ил}метилтио-1Н-бензимидазола растворяли в 30 мл диметилформамида для получения раствора. К раствору при 0оС добавляли 0,24 г 60%-ного гидрида натрия. Полученную смесь перемешивали при 40оС 1 ч и снова охлаждали до 0оС с последующим добавлением иодистого метила. Смесь перемешивали при комнатной температуре 3 ч. Затем к полученной смеси добавляли насыщенный водный раствор хлористого аммония для прекращения реакции. Реакционную смесь перегоняли при пониженном давлении для удаления растворителя и очищали хроматографией на колонке из силикагеля. Получали 0,3 г указанного соединения в виде бледно-желтых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,95  2,21 (м. 2Н) 2,30 (с. 3Н) 3,35 (с. 3Н) 3,54 (т. I 6,2 Гц, 2Н) 3,67 (с. 3Н) 4,10 (т. I6,2 Гц, 2Н) 4,80 (с. 2Н) 6,68 (д. I 5,7 Гц, 1Н) 7,16
2,21 (м. 2Н) 2,30 (с. 3Н) 3,35 (с. 3Н) 3,54 (т. I 6,2 Гц, 2Н) 3,67 (с. 3Н) 4,10 (т. I6,2 Гц, 2Н) 4,80 (с. 2Н) 6,68 (д. I 5,7 Гц, 1Н) 7,16  7,30 (м. 3Н) 7,57
7,30 (м. 3Н) 7,57  7,80 (м. 1Н) 8,29 (д. I 5,7 Гц, 1Н).
7,80 (м. 1Н) 8,29 (д. I 5,7 Гц, 1Н).
П р и м е р 95. 2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилсульфинил-1- метилбензимидазол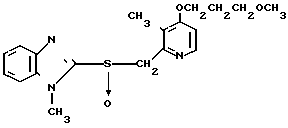
0,25 г 2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилтио-1- метилбензимидазола растворяли в 20 мл дихлорметана для получения раствора. К раствору при -50оС добавляли 0,18 г 80%-ной м-хлорнадбензойной кислоты. Полученную смесь перемешивали 1 ч с последующим добавлением 0,14 г триэтиламина и 20 мл насыщенного водного раствора кислого карбоната натрия. Смесь перемешивали при комнатной температуре 1 ч. Дихлорметановый слой отделяли промывали два раза насыщенным водным раствором кислого карбоната натрия, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали для получения остатка. Остаток очищали хроматографией на колонке из силикагеля и получали 0,12 г указанного соединения в виде бледно-желтых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,93 2,12 (м. 2Н) 2,22 (с. 3Н) 3,33 (с. 3Н) 3,53 (т. I 6,2 Гц, 2Н) 3,98 (с. 3Н) 4,06 (т. I6,2 Гц, 2Н) 4,96 (с. 2Н) 6,65 (д. I 5,7 Гц, 1Н) 7,25
2,12 (м. 2Н) 2,22 (с. 3Н) 3,33 (с. 3Н) 3,53 (т. I 6,2 Гц, 2Н) 3,98 (с. 3Н) 4,06 (т. I6,2 Гц, 2Н) 4,96 (с. 2Н) 6,65 (д. I 5,7 Гц, 1Н) 7,25  7,40 (м. 3Н) 7,75
7,40 (м. 3Н) 7,75  7,87 (м. 1Н) 8,15 (д. I5,7 Гц, 1Н).
7,87 (м. 1Н) 8,15 (д. I5,7 Гц, 1Н).
П р и м е р 96. 1-этоксикарбонил-2-{4-3-метилпропокси)-3-метилпиридин-2-ил} метилтиобензимидазол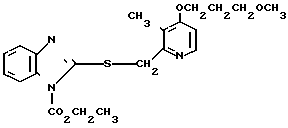
0,8 г 2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил}метилтио-1Н- бензимидазола растворяли в 10 мл диметилформамида для получения раствора. К этому раствору при 0оС добавляли 0,23 г 60%-ного гидрида натря. Полученную смесь перемешивали 15 мин. К смеси добавляли по каплям при 0оС 0,4 г этилового эфира угольной кислоты. Полученную смесь перемешивали при комнатной температуре 1 ч. К этой смеси добавляли насыщенный водный раствор хлористого аммония для прекращения реакции. Реакционную смесь экстрагировали хлороформом. Экстракт сушили над сульфатом магния и фильтровали. Фильтрат концентрировали для получения остатка. Этот остаток очищали хроматографией на колонке из силикагеля и получали 0,82 г указанного соединения в вде белых кристаллов.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,50 (т. I 7,0 Гц, 3Н) 1,95  2,20 (м. 2Н) 2,32 (с. 3Н) 3,36 (с. 3Н) 3,56 (т. I 6,2 Гц, 2Н) 4,10 (т. I 6,2 Гц, 2Н) 4,54 (кв. I 7,0 Гц, 2Н) 4,77 (с. 2Н) 6,69 (д. I 5,7 Гц, 1Н) 7,1
2,20 (м. 2Н) 2,32 (с. 3Н) 3,36 (с. 3Н) 3,56 (т. I 6,2 Гц, 2Н) 4,10 (т. I 6,2 Гц, 2Н) 4,54 (кв. I 7,0 Гц, 2Н) 4,77 (с. 2Н) 6,69 (д. I 5,7 Гц, 1Н) 7,1  7,4 (м. 2Н) 7,4
7,4 (м. 2Н) 7,4  7,7 (м. 1Н) 7,7
7,7 (м. 1Н) 7,7  7,95 (м. 1Н) 8,30 (д. I 5,7 Гц, 1Н).
7,95 (м. 1Н) 8,30 (д. I 5,7 Гц, 1Н).
П р и м е р 97. 1-этоксикарбонил-2-{4-(3-метоксипропокси)-3-метилпиридин-2-ил} метилсульфинилбензимидазол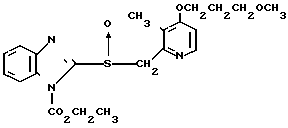
0,6 г 1-этоксикарбонил-2-{ 4-(3-метоксипропокси)-3-метилпиридин-2-ил} метилтиобензимидазола растворяли в 20 мл дихлорметана для получения раствора. К раствору при -45оС добавлял 0,4 г м-хлорнадбензойной кислоты. Через 1 ч к полученной смеси добавляли 0,3 г триэтиламина и 20 мл насыщенного водного раствора кислого карбоната натрия. Смесь перемешивали при комнатной температуре 30 мин. Дихлорметановый слой отделяли, два раза промывали насыщенным водным раствором кислого карбоната натрия, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и получали остаток. Остаток очищали хроматографией на колонке из силикагеля и получали 0,21 г соединения, указанного в названии примера, в виде желтого масла.
Спектр ЯМР на ядрах 1Н (СДСl3) δ: 1,54 (т. I 7,0 Гц, 3Н) 1,99  2,20 (м. 2Н) 2,30 (с. 3Н) 3,35 (с. 3Н) 3,55 (т. I 6,2 Гц, 2Н) 4,06 (т. I 6,2 Гц, 2Н) 4,61 (кв. I 7,0 Гц, 2Н) 4,74 (АВ кв. I 12,8 Гц, Δν 8,6 Гц, 2Н) 6,60 (д. I 5,7 Гц, 1Н) 7,3 7,5 (м. 2Н) 7,7
2,20 (м. 2Н) 2,30 (с. 3Н) 3,35 (с. 3Н) 3,55 (т. I 6,2 Гц, 2Н) 4,06 (т. I 6,2 Гц, 2Н) 4,61 (кв. I 7,0 Гц, 2Н) 4,74 (АВ кв. I 12,8 Гц, Δν 8,6 Гц, 2Н) 6,60 (д. I 5,7 Гц, 1Н) 7,3 7,5 (м. 2Н) 7,7  8,0 (м. 2Н) 8,03 (д. I 5,7 Гц, 1Н).
8,0 (м. 2Н) 8,03 (д. I 5,7 Гц, 1Н).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных пиридина или их фармацевтически приемлемых солей | 1987 |
|
SU1780535A3 |
| ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО АМИДА ИЛИ ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ, ОБЛАДАЮЩАЯ АНТИАЦЕТИЛХОЛИНЭСТЕРОДНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2010794C1 |
| ПРОИЗВОДНЫЕ БУТЕНОВОЙ ИЛИ ПРОПЕНОВОЙ КИСЛОТЫ | 1992 |
|
RU2041871C1 |
| ПРОИЗВОДНЫЕ ДИФЕНИЛМЕТИЛИМИДАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1990 |
|
RU2024521C1 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1989 |
|
RU2007406C1 |
| ПРОИЗВОДНЫЕ 4,5,6,7-ТЕТРАГИДРОБЕНЗИМИДАЗОЛА | 1991 |
|
RU2033414C1 |
| ПРОИЗВОДНОЕ АМИНОБЕНЗОЙНОЙ КИСЛОТЫ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1993 |
|
RU2067979C1 |
| ПРОИЗВОДНЫЕ ИНДОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2045518C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ИМИДАЗОЛА | 1990 |
|
RU2026293C1 |
| ПРОИЗВОДНЫЕ ГЛИЦЕРИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1989 |
|
RU2040521C1 |
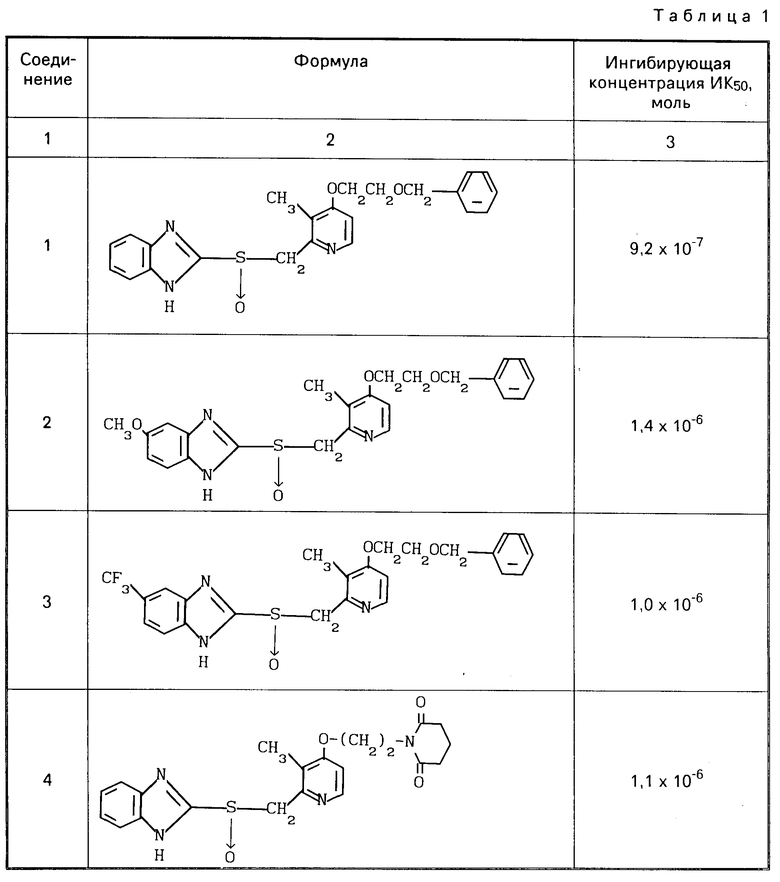
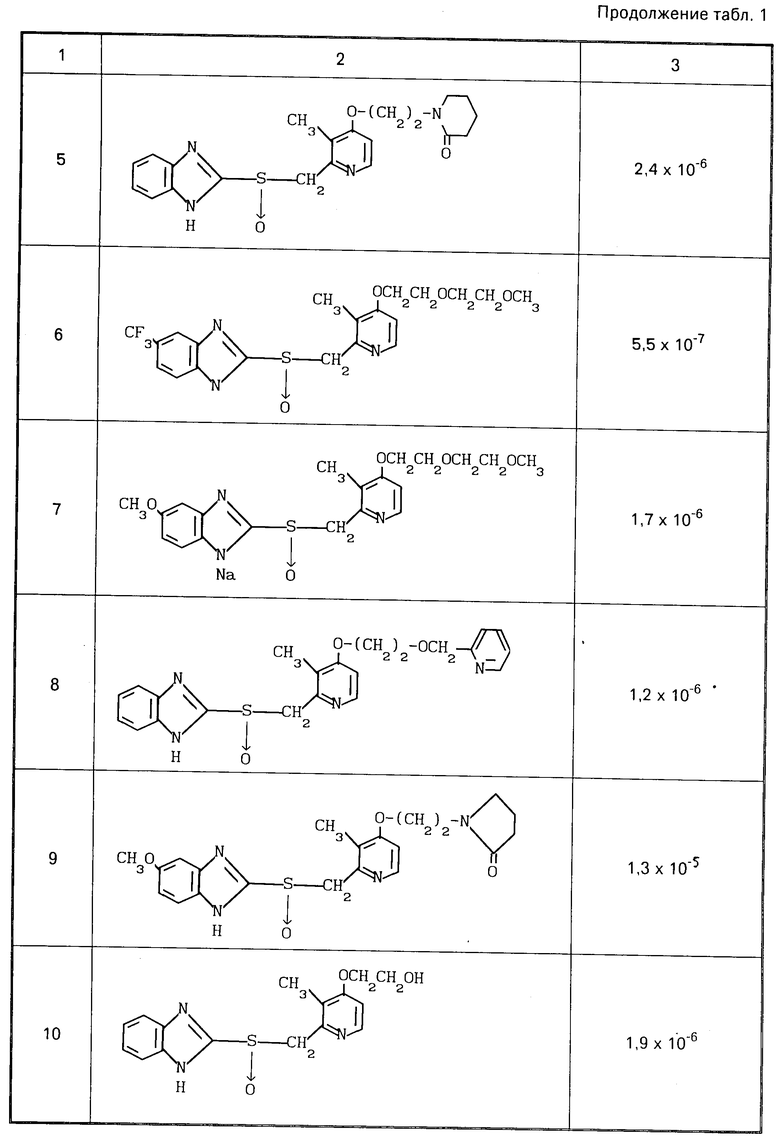
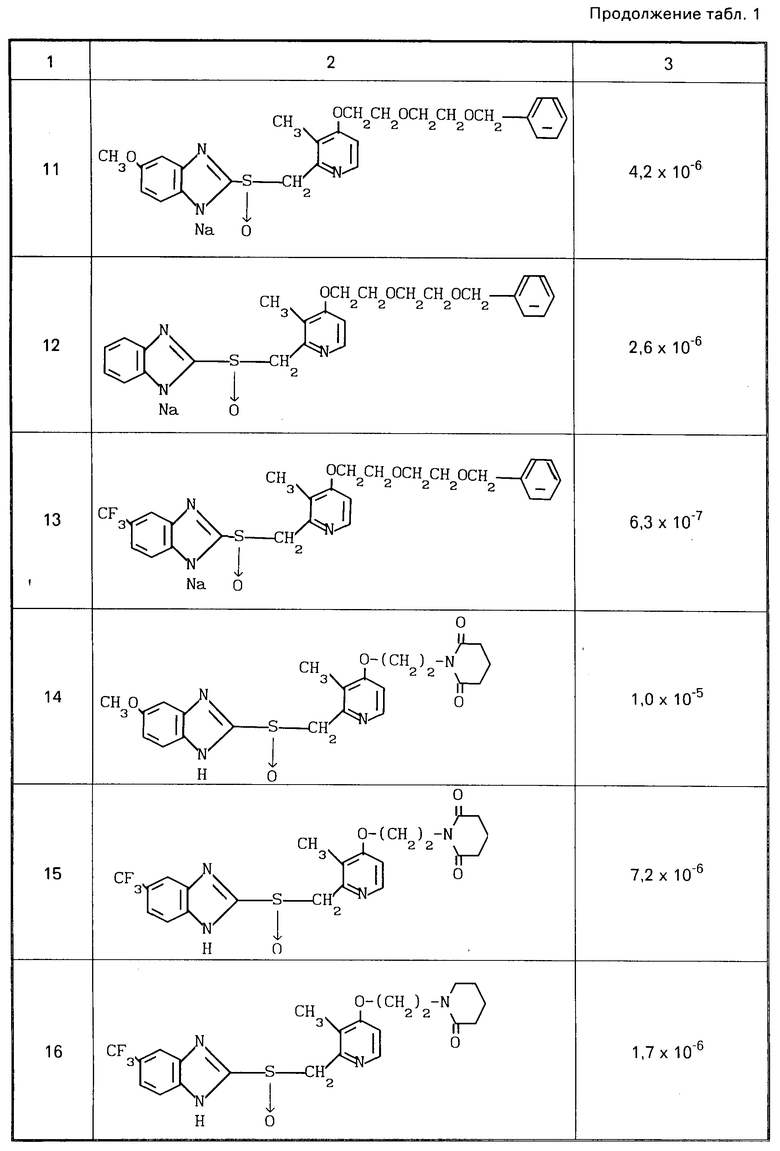
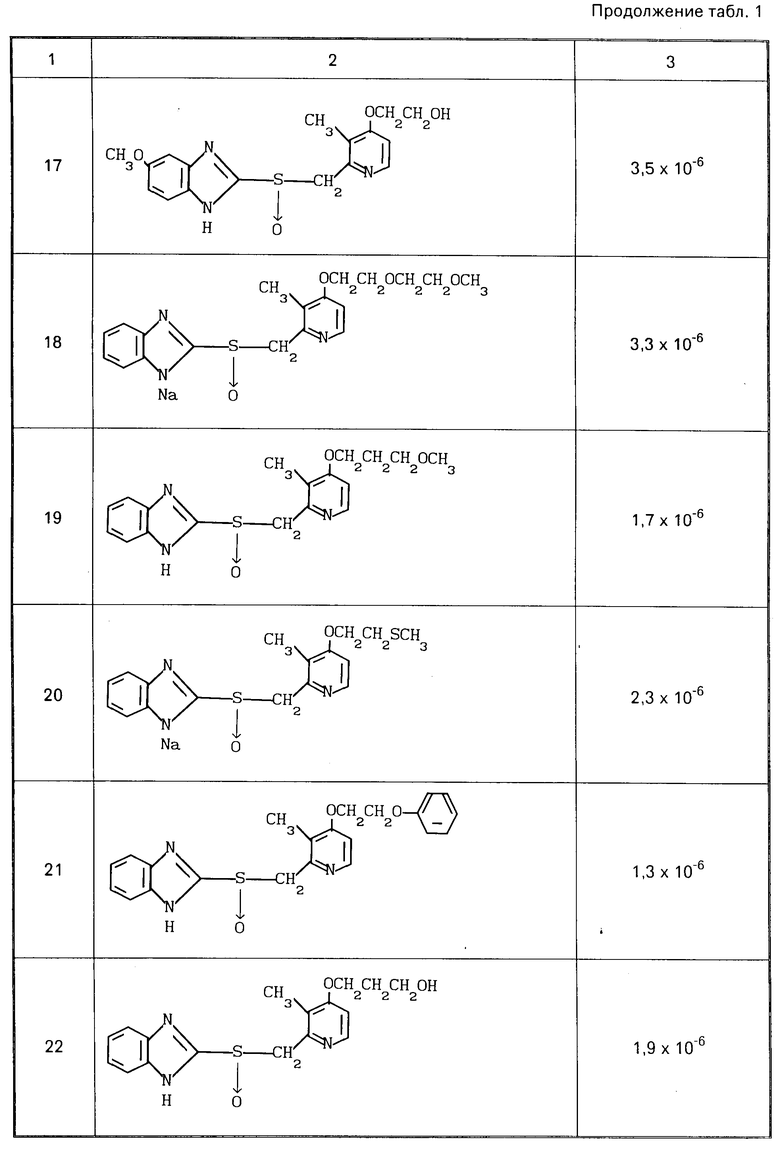
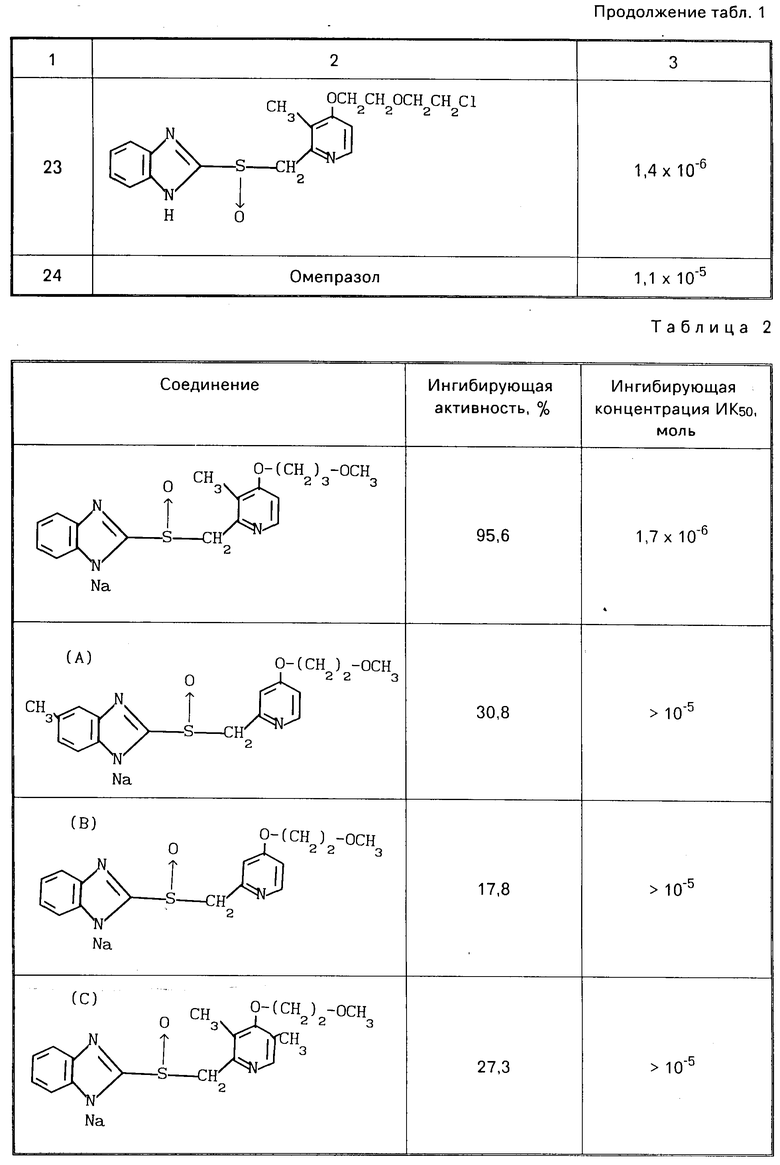
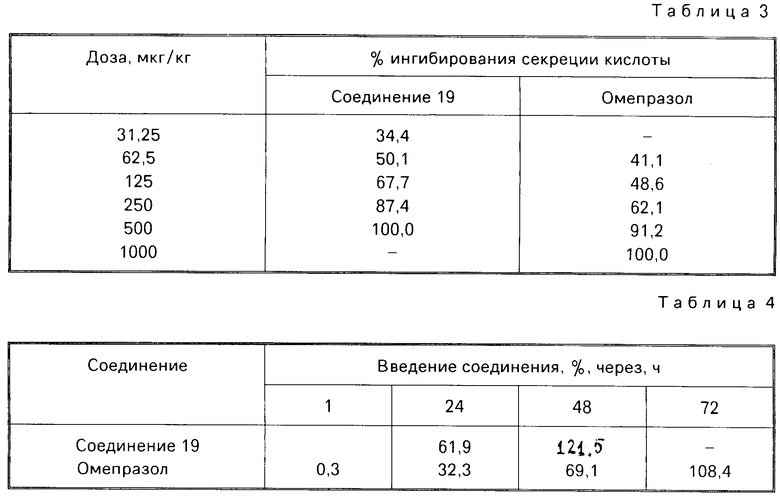
Использование: в медицине, в качестве веществ ингибирующих активность H+-K+ - аденозинтрифосфатазы. Сущность изобретения: продукт-производные пиридина ф-лы I, где R1 и R2 - водород, низший алкокси, галоидированный низший алкоксикарбонил, карбокси или галоген, X-группа-0-, -S- или -NR3 , где R3 - водород или щелочной металл, низший алкил или низший алкоксикарбонил, Z-группа -O-(CH2)p-OR4, где R4 - водород, алкил или бензил, p-целое число от 1 до 3; группа -O(CH2)q-R5, где q целое число от 1 до 3, R5 - галоген, низший алкоксикарбонил, фенил или пиридил; группа ф-лы -O-(CH2)r-O-(CH2)s-OR6, где r и s- целое число от 1 до 5, R6 - водород или низший алкил; группа ф-л II, III, IV и V, где t целое число от 0 до 2; A-группа ф-лы VI, где B-группа ф-лы -NH или S; A-низший алкил, пиридил или фурил или группа ф-лы VII, где R7 - водород, w-целое число 0 или 1; или Z- группа OR9, где R9 - водород , низший алкил или фенил; n-целое число от 0 до 2, m-целое число от 2 до 10; I и K-водород или низший алкил. 4 табл. Структура ф-л I, II, III, IV, V, VI и VII: 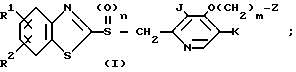
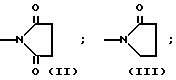
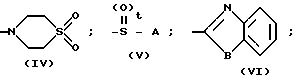
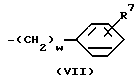
ПРОИЗВОДНЫЕ ПИРИДИНА общей формулы I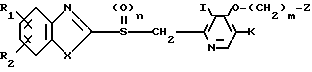
где R1 и R2 одинаковые или различные, каждый водород, низший алкокси, галоидированный низший алкил, низший алкоксикарбонил, карбоксильная группа или галоген;
Х группа формулы: -О-, -S-
или
где R3 водород или щелочной металл, низший алкил или низший алкоксикарбонил;
Z группа общей формулы
-O-(CH2)p-OR4,
где p-целое число от 1 до 3;
R4 водород, низший алкил или бензил;
группа общей формулы
-O-(CH2)q-R5,
где q целое число от 1 до 3;
R5 галоген, низший алкоксикарбонил, фенил или пиридил;
группа общей формулы
-O-(CH2)r-O-(CH2)s-OR6,
где r и s каждый целое число от 1 до 5,
R6 водород или низший алкил;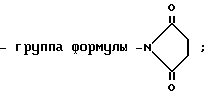
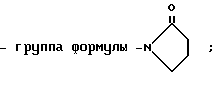
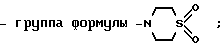
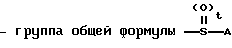
где t целое число от 0 до 2;
А группа общей формулы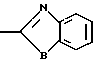
где В группа формулы -NH- или -S-,
или А низший алкил, пиридил или фурил или группа формулы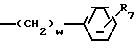
где R7 водород;
w целое число нуль или 1;
группа общей формулы -OR9,
где R9 водород, низший алкил или фенил;
n целое число от 0 до 2;
m целое число от 2 до 10;
J и K могут быть одинаковыми или различными, каждый водород или низший алкил, при условии, что когда Z группа формулы -OR9, где R9 - низший алкил, m целое число от 3 до 10, и при условии, когда Z группа формулы -O-(CH2)q R5, где q целое число от 1 до 3, R5 фенил, m целое число от 5 до 10.
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБ ОБЛАГОРАЖИВАНИЯ ВОЛОСЯНОГО ПОКРОВА | 0 |
|
SU167943A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
Авторы
Даты
1995-05-20—Публикация
1992-10-06—Подача