ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Область техники, к которой относится изобретение
Настоящее изобретение относится в основном к структурам миметиков с обратной конфигурацией и к библиотеке соответствующих химических соединений. Настоящее изобретение также относится к применениям при лечении медицинских расстройств, например раковых заболеваний, и к фармацевтическим композициям, включающим миметики.
Описание достигнутого уровня техники
В течение многих лет проводился случайный скрининг молекул на возможную активность в качестве терапевтических средств, что привело к открытию большого числа важных лекарственных средств. Хотя успехи в молекулярной биологии и компьютерной химии вызвали повышенный интерес к тому, что стали называть «рациональной разработкой препаратов», такие методики не доказали своей полезности с точки зрения быстроты или надежности, как это изначально предполагалось. Таким образом, в последние годы снова отмечается усиление интереса к рандомизированному (случайному) скринингу лекарственных препаратов и, соответственно, возвращение к нему. В этой связи были сделаны особые усилия по разработке новых методик, основанных на создании комбинаторных библиотек химических соединений и скрининге таких библиотек для поиска биологически активных агентов.
В целом, комбинаторные библиотеки химических веществ представляют собой просто коллекцию молекул. Такие библиотеки различаются по виду химических соединений, имеющихся в этой библиотеке, а также по способам, используемым как для создания библиотеки, так и для идентификации того, какие представители взаимодействуют с интересующими биологическими мишенями. Хотя данная область является достаточно молодой, способы создания и скрининга библиотек уже стали достаточно разнообразными и усложненными. Например, в последнем обзоре, посвященном различным комбинаторным химическим библиотекам, было идентифицировано большое число таких методик (Dolle, J. Com. Chem., 2(3): 383-433, 2000), включая использование и таких членов библиотек, которые содержат определенные метки, так и таких соединений из их числа, которые таких меток не содержат (Janda, Proc. Natl. Acad. Sci. USA 91: 10779-10785, 1994).
Создаваемые вначале комбинаторные химические библиотеки ограничивались в основном агентами пептидного или нуклеотидного происхождения. В этой связи методики Houghten et al. иллюстрируют пример того способа, который получил название «двойной итеративный» метод и который используется для сборки комбинаторных библиотек растворимых пептидов с помощью методик синтеза с расщеплением (сплит-синтеза) (Nature (London) 354: 84-86, 1991; Biotechniques 13: 412-421, 1992; Bioorg. Med. Chem. Lett. 3: 405-412, 1993). В рамках данной методики получают библиотеки растворимых пептидов, содержащие десятки миллионов членов. Такие библиотеки, как было показано, эффективны в плане идентификации опиоидных пептидов, таких как метионин- и лейцин-энкефалин (Dooley and Houghten, Life Sci. 52, 1509-1517, 1993), а библиотека N-ацилированных пептидов использовалась для идентификации ацеталинов, которые являются мощными антагонистами опиоидов (Dooley et al., Proc. Natl. Acad. Sci. USA 90: 10811-10815, 1993). Совсем недавно была создана библиотека всех опиоидных пептидов, состоящих из D-аминокислот, и был проведен скрининг на их анальгетическую активность против μ-опиоидного рецептора (Dooley et al., Science 266: 2019-2022, 1994).
Хотя комбинаторные библиотеки, содержащие агенты пептидного и нуклеотидного происхождений, играют важную роль, в данной области все еще сохраняется потребность в библиотеках, содержащих агенты другого происхождения. Например, традиционные пептидные библиотеки предназначены в значительной мере просто для варьирования аминокислотной последовательностью в рамках процедур создания новых членов библиотеки. В то время как хорошо известно, что вторичная структура пептидов важна для их биологической активности, такие пептидные библиотеки не обеспечивают представления устойчивой вторичной структуры членам такой библиотеки.
В этой связи ряд исследователей для создания конформационно устойчивой вторичной структуры используют циклизованные пептиды с дисульфидными мостиками (Tumelty et al., J. Chem. Soc. 1067-68, 1994; Eichler et al., Peptide Res. 7: 300-306, 1994). Однако такие циклизованные пептиды в основном являются все еще достаточно гибкими и характеризуются трудной биологической доступностью, из-за чего имеют весьма ограниченный успех.
В последнее время были разработаны непептидные соединения, которые близко имитируют вторичную структуру с обратной конфигурацией, найденную в биологически активных белках или пептидах. Например, в патенте США № 5440013 (Kahn) и в опубликованных заявках PCT WO 94/03494, WO01/00210A1 и WO01/16135A2 (Kahn) описываются непептидные соединения с устойчивой конформацией, которые имитируют трехмерную структуру с обратной конфигурацией. Кроме того, в патенте США № 5929237 и в частично продолженной заявке на патент США № 6013458 (обе принадлежат Kahn) описываются конформационно устойчивые соединения, которые имитируют вторичную структуру областей биологически активных пептидов и белков с обратной конфигурацией. Синтез и идентификация конформационно устойчивых миметиков с обратной конфигурацией и их применение в случае различных заболеваний описаны в обзоре Обрехта (Obrecht, Advances in Med. Chem., 4, 1-68, 1999).
Несмотря на то что были достигнуты существенные успехи в области синтеза и идентификации конформационно устойчивых миметиков с обратной конфигурацией, в данной области все еще остается потребность в малых молекулах, которые бы имитировали вторичную структуру пептидов. В данной области сохраняется также потребность в библиотеках, содержащих такие агенты, а также в методиках синтеза и скрининга представителей таких библиотек относительно интересующих мишеней, в особенности биологических мишеней, с целью идентификации биологически активных представителей таких библиотек.
Настоящее изобретение также удовлетворяет данные потребности и обеспечивает дополнительные преимущества за счет разработки конформационно устойчивых соединений, которые имитируют вторичную структуру областей с обратной конфигурацией, имеющихся в биологически активных пептидах и белках.
Сигнальный путь, вовлекающий Wnt, регулирует большое число процессов, включая рост клеток, онкогенез и развитие (Moon et al., 1997, Trends Genet. 13, 157-162; Miller et al., 1999, Oncogene 18, 7860-7872; Nusse and Varmus, 1992, Cell 69, 1073-1087; Cadigan and Nusse, 1997, Genes Dev. 11, 3286-3305; Peifer and Polakis, 2000 Science 287, 1606-1609; Polakis 2000, Genes Dev. 14, 1837-1851). Сигнальный путь, вовлекающий Wnt, интенсивно исследовался у большого числа организмов. Активация транскрипции, в которую вовлечен TCF4/β-катенин, под действием Wnt сигнальной трансдукции, как было показано, играет ключевую роль в осуществлении ее биологических функций (Molenaar et al., 1996, Cell 86: 391-399; Gat et al., 1998 Cell 95: 605-614; Orford et al., 1999 J. Cell. Biol. 146: 855-868; Bienz and Clevers, 2000, Cell 103: 311-20).
В отсутствие Wnt сигнала происходит одновременное взаимодействие супрессора опухолевого гена, ассоциированного с аденоматозным полипозом кишечника (APC) с гликогенсинтазой киназы сериновой киназы (GSK)-3β и β-катенином (Su et al., 1993, Science 262, 1734-1737; Yost et al., 1996 Genes Dev. 10, 1443-1454; Hayashi et al., 1997, Proc. Natl. Acad. Sci. USA, 94, 242-247; Sakanaka et al., 1998, Proc. Natl. Acad. Sci. USA, 95, 3020-3023; Sakanaka and William, 1999, J. Biol. Chem. 274, 14090-14093). Фосфорилирование APC под действием GSK-3β регулирует взаимодействие АРС с β-катенином, которое, в свою очередь, регулирует сигнальную функцию β-катенина (B. Rubinfeld et al., Science 272, 1023, 1996). Сигнальный эффект Wnt стабилизирует β-катенин, позволяя осуществлять его перемещение в ядро, где он взаимодействует с агентами группы лимфоидного энхансерного фактора (LEF1)/T-клеточного фактора (TCF4), входящими в семейство факторов транскрипции (Behrens et al., 1996 Nature 382, 638-642; Hsu et al., 1998, Mol. Cell. Biol. 18, 4807-4818: Roose et al., 1999 Science 285, 1923-1926).
Недавно было показано, что известный онкоген, c-myc, является геном-мишенью в процессе β-катенин/TCF4-опосредованной транскрипции (He et al., 1998 Science 281, 1509-1512; Kolligs et al., 1999 Mol. Cell. Biol. 19, 5696-5706). Были идентифицированы многие другие важные гены, включая гены циклина D1 и металлопротеиназы, которые также вовлекаются в онкогенез как регулируемые TCF-4/бета-катениновым механизмом транскрипции (Crawford et al., 1999, Oncogene 18, 2883-2891; Shtutman et al., 1999, Proc. Natl. Acad. Sci. USA, 11, 5522-5527; Tetsu and McCormick, 1999 Nature, 398, 422-426).
Кроме того, было показано, что суперэкспрессия некоторых медиаторов, расположенных по ходу сигнального пути, опосредованном Wnt, регулирует апоптоз (Moris et al., 1996, Proc. Natl. Acad. Sci. USA, 93, 7950-7954; He et al., 1999 Cell 99, 335-345: Orford et al., 1999, J. Cell. Biol., 146, 855-868; Strovel and Sussman, 1999, Exp. Cell. Res., 253, 637-648). Суперэкспрессия APC в клетках колоректального рака человека индуцирует апоптоз (Moris et al., 1996, Proc. Natl. Acad. Sci. USA, 93, 7950-7954), а эктопическая экспрессия β-катенина ингибрует апоптоз, ассоциированный с потерей способности присоединяться к внеклеточному матриксу (Orford et al., 1999, J. Cell. Biol., 146, 855-868). Ингибирование транскрипции по пути TCF4/β-катенина за счет экспрессии доминант-негативного мутанта TCF4 блокирует Wnt-1-опосредованную выживаемость клеток и придает клеткам чувствительность к апоптозным стимулам, таким как противораковый агент (Shaoqiong Chen et al., 2001, J. Cell. Biol., 152, 1, 87-96), а мутация APC ингибирует апоптоз, поскольку позволяет конститутивную экспрессию сурвивина - известного антиапоптозного белка (Tao Zhang et al., 2001, Cancer Research, 62, 8664-8667).
Хотя в клетках рака человека не было обнаружено мутаций по гену Wnt, мутация в APC или β-катенине, как в случае большинства колоректальных опухолей, приводит к несоответствующей активации TCF4, суперэкспрессии c-myc и к неопластическому росту (Budinfeld et al., 1997, Science, 275, 1790-1792; Morin et al, 1997, Science, 275, 1787-1790; Casa et al., 1999, Cell. Growth. Differ. 10, 369-376). Равным образом ген-супрессор опухоли (APC) теряется или инактивируется в 85% случаев колоректального рака и в большинстве других видов рака (Kinzler and Vogelstein, 1996, Cell 87, 159-170). Принципиальная роль APC заключается в том, что он является отрицательным регулятором каскада переноса сигнала Wnt. Главной особенностью этого пути является то, что он связан с модуляцией стабильности и локализации цитозольного пула β-катенина через взаимодействие с крупным аксиновым комплексом, который включает APC. Данное взаимодействие приводит к фосфорилированию β-катенина, делая его мишенью для разложения.
Белки, связывающиеся с CREB (CBP)/p300, были первоначально идентифицированы в тестах на взаимодействие белка, определяемых в первую очередь их ассоциацией с фактором транскрипции CREB (Chrivia et al., 1993, Nature, 365, 855-859) и затем взаимодействием с белком E1A, трансформированным аденовирусом (Stein et al., 1990, J. Viol., 64, 4421-4427; Eckner et al., 1994, Genes. Dev., 8, 869-884). CBP может участвовать во множестве клеточных функций, включая функцию коактиватора транскрипции (Shikama et al., 1997, Trends. Cell Biol., 7, 230-236: Janknecht and Hunter, 1996, Nature, 383, 22-23). CBP/p300 потенцирует опосредованную β-катенином активацию промотора siamois как известной Wnt-мишени (Hecht et al., 2000, EMBO J. 19, 8, 1839-1850). β-катенин непосредственно взаимодействует с CREB-связывающим доменом CBP, при этом β-катенин вступает в синергическое взаимодействие с CBP, стимулируя активацию транскрипции TCF-4/β-катенина (Ken-Ichi Takemaru and Randall T. Moon, 2000 J. Cell. Biol., 149, 2, 249-254).
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
На основе приведенного выше краткого описания достигнутого в данной области уровня видно, что TCF4/β-катенин и CBP-комплекс в пути, опосредованном Wnt, могут быть использованы в качестве молекул-мишеней для регуляции клеточного роста, онкогенеза, апоптоза клеток и т.п. Соответственно, настоящее изобретение отвечает на потребность в соединениях, которые способны блокировать транскрипцию через механизм участия TCF4/β-катенина за счет ингибирования CBP, и в этой связи может использоваться для лечения рака и в особенности колоректального рака.
В общих чертах настоящее изобретение относится к новому типу конформационно устойчивых соединений, которые имитируют вторичную структуру участков молекул биологически активных пептидов и белков с обратной конфигурацией. Настоящее изобретение также описывает библиотеки, содержащие такие соединения, а также их синтез и скрининг.
Соединения по настоящему изобретению описываются общей формулой (I):
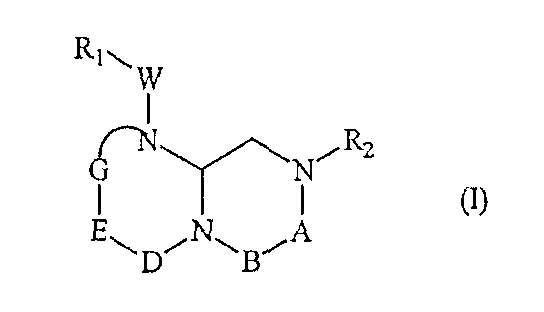
где А обозначает -(CHR3)- или -(C=O)-, B обозначает -(CHR4)- или -(C=O)-, D обозначает -(CHR5)- или -(C=O)-, E обозначает -(ZR6)- или -(C=O)-, G обозначает -(XR7)n-, -(CHR7)-(NR8)-, -(C=O)-(XR9)- или -(C=O)-, W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует, Y обозначает атом кислорода, серы или -NH-, X и Z независимо обозначают атом азота или CH, n=0 или 1, и R1, R2, R3, R4, R5, R6, R7, R8 и R9 могут быть одинаковыми или разными и независимо выбраны из фрагмента боковой цепи аминокислот или их производных, а также включают остаток молекулы, линкер и твердую подложку и их стереоизомеры.
В одном варианте, где А обозначает -(CHR3)-, B обозначает -(C=O)-, D обозначает -(CHR5)-, E обозначает -(C=O)- и G обозначает -(XR7)n-, соединения по настоящему изобретению описываются приведенной ниже формулой (II):
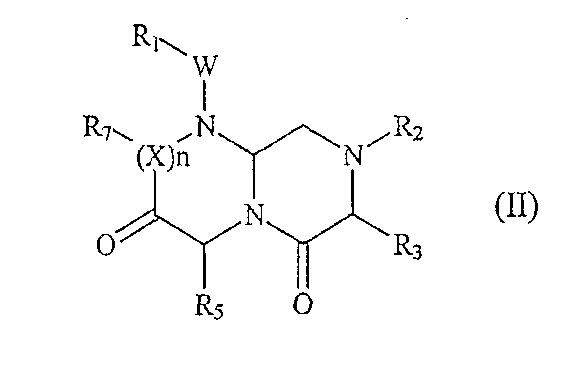
где W, X, Y и n определены выше и R1, R2, R3, R5, и R7 определены в приведенном ниже подробном описании.
В том варианте осуществления изобретения, где А обозначает -(C=O)-, B обозначает -(CHR4)-, D обозначает -(C=O)-, E обозначает -(ZR6)- и G обозначает -(C=O)-(XR9)-, соединения по настоящему изобретению описываются приведенной ниже формулой (III):
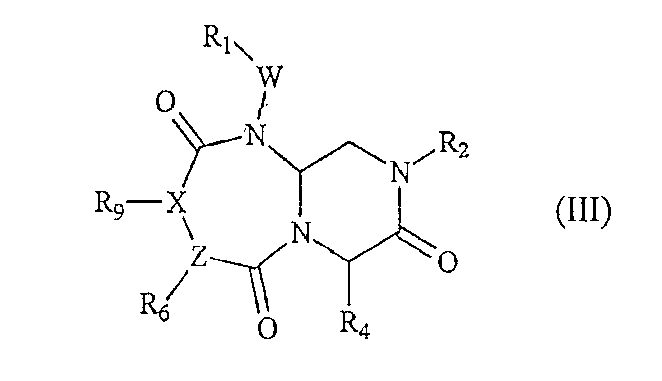
где W, X и Y определены выше, Z обозначает атом азота или CH (при условии, что когда Z обозначает CH, то X обозначает атом азота), и R1, R2, R4, R6 и R9 определены в приведенном ниже подробном описании.
В том варианте осуществления изобретения, где А обозначает -(C=O)-, B обозначает -(CHR4)-, D обозначает -(C=O)-, E обозначает -(ZR6)- и G обозначает -(XR7)n-, соединения по настоящему изобретению описываются приведенной ниже формулой (IV):
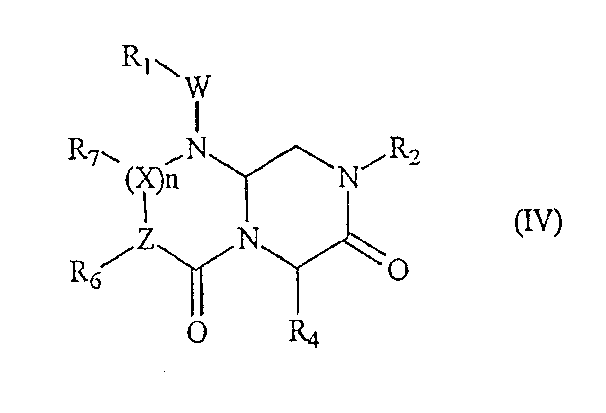
где W, Y и n определены выше, Z обозначает атом азота или CH (если Z обозначает атом азота, то n равно 0, и когда Z обозначает CH, то Х обозначает атом азота и n не равно 0) и R1, R2, R4, R6, и R7 определены в приведенном ниже подробном описании.
Настоящее изобретение также относится к библиотекам, содержащим одно или несколько соединений приведенной выше формулы (I), а также к способам синтеза таких библиотек и способам их скрининга для идентификации биологически активных соединений. В изобретении описаны также композиции, содержащие соединение по настоящему изобретению в сочетании с фармацевтически приемлемым носителем или разбавителем.
Настоящее изобретение также относится к способам идентификации биологически активного соединения с использованием библиотек, содержащих одно или несколько соединений формулы (I). В родственном аспекте настоящее изобретение относится к способу проведения теста на связывание, включающего: а) получение композиции, содержащей первый коактиватор и взаимодействующий белок, где первый коактиватор включает связывающий мотив LXXLL, LXXLI или FXXFF, где X представляет собой любую аминокислоту; b) объединение первого коактиватора и взаимодействующего белка с исследуемым соединением; и с) выявление наличия изменений в уровне связывания между первым коактиватором и взаимодействующим белком в присутствии соединения общей формулы (I).
Настоящее изобретение также относится к способам профилактики или лечения расстройств, связанных с сигнальным путем через Wnt. Расстройства, которые могут поддаваться лечению или профилактике при использовании соединения или композиции по настоящему изобретению, включают опухоль или рак (например, KSHV-ассоциированную опухоль), рестеноз, вызванный ангиопластикой, поликистоз почек, аберрантный ангиогенез, ревматоидный артрит, язвенный колит, туберозный склероз, облысение и болезнь Альцгеймера. Такие способы включают введение субъекту, нуждающемуся в этом, соединения или композиции по настоящему изобретению в количестве, эффективном для достижения желательного результата.
В родственном аспекте настоящее изобретение также относится к способам усиления разрастания нейрита, дифференцировки невральной стволовой клетки и апоптоза раковых клеток. Такие способы включают введение в соответствующие клетки соединения или композиции по настоящему изобретению в количестве, эффективном для достижения желательного результата.
Эти и другие аспекты настоящего изобретения станут более очевидными из прилагаемых рисунков и схем, а также из подробного описания. В этой связи следует отметить, что в описании цитируются различные документы и другие материалы, которые более подробно раскрывают некоторые детали, относящиеся к раскрываемым соединениям и/или композициям, и которые включены в описание полностью в качестве ссылок.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг.1 показана общая схема синтеза, используемая для получения миметиков с обратной конфигурацией по настоящему изобретению.
На фиг.2 приведена общая схема синтеза, используемая для получения миметиков с обратной конфигурацией по настоящему изобретению.
На фиг.3 показан график, полученный на основе измерения показателя IC50 для соединения А по настоящему изобретению с использованием клеток SW480, где ингибирование роста клеток на модели клеток SW480 измеряют при различных концентрациях соединения А, полученного по процедуре примера 4, с получением показателя IC50. Конкретно, определяют степень ингибирования активности люциферазы светлячка и рениллы под действием соединения А. В результате определяют значение показателя IC50 для соединения А на модели роста клеток SW480, как показано в таблице 4. Описание подробных процедур приведено в примере 6.
Фиг.4. Клетки РС-12 культивируют после их наслаивании в чашках в течение 10 дней для дифференцировки под действием 50 нг/мл фактора роста нервных клеток (NGF) (как описано в примере 7). (A, B) клетки PC-12, трансфицированные вектором (A), и клетки PC-12, осуществляющие супреэкспрессию wt PS-1 (B), демонстрируют обширный рост нейрита через 10 дней при наличии NGF. (С) Клетки PC-12, экспрессирующие мутантный PS-1/L286V, не демонстрируют выраженных характерных признаков нейрита при культивировании в тех же условиях. (D, E) Иммунофлуоресцентный анализ GAP-43 (по методике, описанной в примере 7) как молекулярного маркера роста нейрита демонстрирует интенсивное окрашивание GAP-43 в нейритах (D) при трансфекции вектором и суперэкспрессии PS-1/WT в клетках PC-12 (E). (F) В отсутствие роста нейрита отмечается слабое иммунное окрашивание по GAP-43 в мутантных клетках. Приведенные данные отражают результаты по меньшей мере двух независимых экспериментов. (G) Дифференцированные клетки трансфицируют с использованием Topflash, репортерной конструкции, созданной на основе TCF/β-катенина. Клетки лизируют и измеряют активность люциферазы через 6 часов после трансфекции (по методике, описанной в примере 7). Приведенные данные представляют собой среднее арифметическое значение результатов трех независимых экспериментов (±SD (стандартное отклонение)). Звездочкой отмечено значение Р<0,05.
Фиг.5. Соединение D фенотипически корректирует дефицитную нейрональную дифференциацию в мутантной форме осуществляющих суперэкспрессию клеток PC-12, PS-1/L286V. Мутантные клетки подвергают воздействию 10 мкМ соединения D, дополнительно к NGF, в процессе дифференциации (Misner et al., Proc. Natl. Acad. Sci. USA 98, 11714 (2001)). (A) Наблюдают увеличение нейрита и его удлинение в осуществляющих суперэкспрессию клетках PC-12, PS-1/L286V, при обработке соединением D. (B) Уровень GAP-43 (зеленого пигмента) в значительной мере повышается в мутантных клетках и отмечается в нейритах. (C) Количественное определение длины нейрита в клетках PC-12. Количество мутантных клеток, имеющих нейриты с длиной более, чем двойной диаметр клетки, составляет менее 10% от их количества, наблюдаемых в клетках PC-12, трансфицированных вектором и осуществляющих суперэкспрессию, PS-1/WT. Количество мутантных PS-1/L286V клеток, которые содержат нейриты выявляемой длины, значительно повышается после обработки 10 мкМ соединения D. Приведенные результаты представляют собой среднее значение (±SD) результатов трех независимых определений. Звездочкой отмечено значение P<0,05.
Фиг.6. Экспрессия рецептора эфрина B2 (EphB2).
Проводят иммунофлуоресцентный анализ и анализ методом ПЦР-ОТ для выявления экспрессии рецептора EphB2 (как описано в примере 7). (A, B) рецепторы EphB2 четко выявляются в нейритах трансфицированных вектором и осуществляющих суперэкспрессию PS-1/WT клеток. Интенсивность окрашивания коррелирует с высоким уровнем экспрессии. (С) И, наоборот, клетки PS-1/L286V РС-12 характеризовались явно сниженным уровнем экспрессии EphB2. (D) Обработка мутантных клеток соединением D ведет к повышенной экспрессии рецептора EphB2, которая фокусируется в точках роста нейрита. (E) Ранее было показано, что экспрессия рецептора EphB2 регулируется в ходе транскрипции (Guo et al., J. Neurosci. 17, 4212 (1997)). Линия 1: трансфицированные вектором PC-12 клетки; линия 2: клетки PS-1/WT, осуществляющие суперэкспресию; линия 3: мутантные клетки PS-1/L286V, осуществляющие суперэкспресию; линия 4: мутантные клетки, обработанные соединением D. Анализ методом ПЦР-ОТ показывает, что уровень мессенджера для рецептора EphB2 в мутантных суперэкспрессирующих клетках PS-1/L286V снижается в сравнении с трансфицированными вектором и осуществляющими суперэкспрессию wt PS-1 PC-12 клетками. Обработка 10 мкМ соединением D оказывает позитивную регуляцию на мРНК для EphB2. В качестве внутреннего контроля используют GAPDH.
Фиг.7 (А) Соединение D останавливает рост клеток в G1 фазе. Проводят анализ сортированных клеток по интенсивности флуоресценции (FACS анализ) на клетках SW480 (нижняя панель) и клетках HCT116 (верхняя панель), обработанных в течение 24 часов соединением D (25 мкМ) (справа) или контролем (0,5% ДМСО (слева)). 5,5×106 клеток фиксируют и окрашивают йодидом пропидия (PI). (B) Соединение D селективно активирует каспазы клеточной линии клеток карциномы толстой кишки. Клетки SW480 и HCT116 (левый график) (105) вместе с нормальными колоноцитами CCD18Co (правый график) обрабатывают контрольным агентом (0,5% ДМСО) или соединением D (25 мкМ). Через 24 часа после обработки клетки лизируют и измеряют ферментативную активность каспазы-3/7. Вычисляют относительную флуоресценцию в условных единицах (RFU) вычитанием величины слепой пробы (контроль, без клеток) от значения, полученного для обработанных образцов (соединение D или контроль), и строят соответствующий график.
Фиг.8. Соединение D снижает рост колоний в мягком агаре зависимым от дозы образом. В ячейки в тройном повторе к клеткам SW480 (5000 клеток/ячейку) добавляют повышающиеся концентрации 5-фторурацила (5-FU) (0,5-32 мкМ) и соединения D (0,25-5 мкМ). Клетки промывают и суспендируют в полутвердой ростовой среде с агаром. Через 8 дней подсчитывают количество колоний (колонии с диаметром более 60 мкМ) и строят график зависимости от концентрации соединения. Определяют и указывают среднее значение ± стандартная ошибка результатов трех независимых определений. Количество колоний в контрольном образце в отсутствие соединения составляет 1,637 ± 71.
Фиг.9 (А) Соединение С снижает рост опухоли на модели голых мышей (nude). (В) Соединение С слегка снижает вес тела голых мышей.
Фиг.10. Активность сурвивина в процессе транскрипции подвергается позитивной регуляции под действием Wnt1, но выключается соединением D. Процентный уровень люциферазной активности измеряют в клетках дикого типа CBP+/- и в клетках p300+/-3T3 в отсутствие Wnt1 и соединения D или в присутствии Wnt1, соединения D или их обоих.
Фиг.11. Соединение А (правый график) и соединение D (левый график) ингибируют активность сурвивинового репортера люциферазы в клетках SW480. Люциферазную активность, контролируемую промотором сурвивина, измеряют в клетках SW480, обработанных соединением A или D в разных концентрациях.
Фиг.12. Анализ по методу ПЦР-ОТ показывает, что обработка соединением D снижает уровень экспрессии гена сурвивина.
Фиг.13. Соединение D снижает ассоциацию различных белков с промотором сурвивина. Проводят ChIP-тест в клетках SW480, обработанных соединением D (25 мкМ), или в контрольных клетках (0,5% ДМСО) в течение 18 часов.
Фиг.14. Соединение D снижает экспрессию сурвивина на уровне трансляции. (А) Проводят вестерн-блоттинг экстрактов клеток, обработанных только носителем (0,5% ДМСО), 10 мкМ или 25 мкМ соединения D или 5 мкМ 5-FU, с использованием моноклонального антитела против сурвивина 6Е4 (Cell Signaling Technology). (В) Иммунофлуоресцентная микроскопия сурвивина. Культивируемые раковые клетки фиксируют и окрашивают зеленым красителем для выявления сурвивина. (С) Иммунофлуоресцентная микроскопия сурвивина. Клетки SW480, обработанные соединением D, фиксируют и обрабатывают зеленым красителем для выявления сурвивина.
Фиг.15. Соединение D активирует, повышает активность каспазы 3 (но не активность каспазы 2) через подавление экспрессии сурвивина. Клетки культуры после трансфекции или без трансфекции конструкцией, содержащей ген сурвивина, обрабатывают стауспорином (0,5 мкМ), соединением D (2,5 мкМ или 5,0 мкМ) или обоими агентами. Определяют активности каспазы 2 и каспазы 3 в данных клетках.
Фиг.16. Соединение D усиливает гибель клеток через подавление экспрессии сурвивина. Культивированные раковые клетки после трансфекции или без трансфекции конструкцией, содержащей ген сурвивина, обрабатывают стауспорином (0,5 мкМ), соединением D (5,0 мкМ) или обоими агентами. Определяют уровень гибели клеток в данной культуре.
Фиг.17. Соединение D повышает число клеток, находящихся на стадии G0. Культивированные раковые клетки после трансфекции или без трансфекции конструкцией, содержащей ген сурвивина, обрабатывают стауспорином (0,5 мкМ), соединением D (5 мкМ) или обоими агентами. Проводят сортировку клеток по интенсивности флуоресценции (FACS анализ) и определяют процент клеток, находящихся на стадии G0.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к конформационно устойчивым соединениям, которые имитируют вторичную структуру областей биологических пептидов и белков с обратной конфигурацией (определяемых в настоящем описании также как миметики с обратной конфигурацией), а также описывает относящиеся к ним химические библиотеки.
Миметические структуры с обратной конфигурацией по настоящему изобретению используются в качестве биологически активных агентов, включая (без ограничения) использование их в качестве диагностических, профилактических и/или терапевтических средств. Библиотеки, включающие миметические структуры с обратной конфигурацией по настоящему изобретению, могут применяться при идентификации биологически активных агентов, подходящих для такого использования. В практике осуществления настоящего изобретения такие библиотеки могут содержать от десятков до сотен тысяч (или более) индивидуальных структур с обратной конфигурацией (называемых в настоящем описании также как «составные единицы» библиотеки).
В одном аспекте настоящего изобретения в нем раскрывается миметическая структура с обратной конфигурацией приведенной ниже формулы (I):

где А обозначает -(CHR3)- или -(C=O)-, B обозначает -(CHR4)- или -(C=O)-, D обозначает -(CHR5)- или -(C=O)-, E обозначает -(ZR6)- или -(C=O)-, G обозначает -(XR7)n-, -(CHR7)-(NR8)-, -(C=O)-(XR9)- или -(C=O)-, W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует, Y обозначает атом кислорода, серы или -NH-, X и Z независимо обозначают атом азота или CH, n=0 или 1 и R1, R2, R3, R4, R5, R6, R7, R8 и R9 могут быть одинаковыми или разными и независимо выбраны из фрагмента боковой цепи аминокислот или их производных, а также включают остаток молекулы, линкер и твердую подложку и их стереоизомеры.
В одном варианте осуществления настоящего изобретения R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из аминоС2-5алкила, гуанидинС2-5алкила, С1-4алкилгуанидиноС2-5алкила, диС1-4алкилгуанидино-С2-5алкила, амидиноС2-5алкила, С1-4алкиламидиноС2-5алкила, диС1-4алкиламидиноС2-5алкила, С1-3алкокси, фенила, замещенного фенила (где заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бензила, замещенного бензила (где заместители на бензильном фрагменте независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), нафтила, замещенного нафтила (где заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бис-фенилметила, замещенного бис-фенилметила (где заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридила, замещенного пиридила (где заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридилС1-4алкила, замещенного пиридилС1-4алкила, (где пиридиновые заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиримидилС1-4алкила, замещенного пиримидилС1-4алкила (где пиримидиновые заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), триазин-2-ил-С1-4алкила, замещенного триазин-2-ил-С1-4алкила (где триазиновые заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазолС1-4алкила, замещенного имидазолС1-4алкила (где имидазольные заместители независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазолинилС1-4алкила, N-амидинопиперазинил-N-С0-4алкила, гидроксиС2-5алкила, С1-5алкиламиноС2-5алкила, гидроксиС2-5алкила, С1-5алкиламиноС2-5алкила, С1-5диалкиламиноС2-5алкила, N-амидинопиперидинилС1-4алкила и 4-аминоциклогексилС0-2алкила.
В одном варианте осуществления изобретения R1, R2, R6 в Е и R7, R8 и R9 в G могут быть одинаковыми или разными и могут представлять собой остаточную часть соединения, и R3 в A, R4 в B или R5 в D выбран из фрагмента боковой цепи аминокислоты или его производного. В контексте настоящего описания термин «остаточная часть соединения» обозначает любой фрагмент, агент, соединение, подложку, молекулу, линкер, аминокислоту, пептид или белок, ковалентно присоединенные к миметической структуре с обратной конфигурацией в положениях R1, R2, R5, R6, R7, R8 и/или R9. Данный термин также включает фрагменты боковой цепи аминокислоты и их производные.
В другом варианте R3 в А, R5 в D, R6 в Е и R7,R8 и R9 в G могут быть одинаковыми или разными и могут представлять собой остаточную часть соединения, будучи указанными поодиночке или в некотором сочетании, и в одном аспекте все из R1, R2 и R4 в В обозначают боковую цепь аминокислоты. В данном случае термин «остаточная часть соединения» обозначает любой фрагмент, агент, соединение, подложку, молекулу, линкер, аминокислоту, пептид или белок, ковалентно присоединенные к миметической структуре с обратной конфигурацией в положениях R3, R5, R6, R7, R8 и/или R9. Данный термин также включает фрагменты боковой цепи аминокислот и их производные.
В контексте настоящего описания термин «остаточная часть соединения» обозначает любой фрагмент, агент, соединение, подложку, молекулу, атом, линкер, аминокислоту, пептид или белок, ковалентно присоединенные к миметической структуре с обратной конфигурацией. Данный термин также включает фрагменты боковой цепи аминокислот и их производные. В одном аспекте настоящего изобретения любое одно или более положений из R1, R2, R3, R4, R5, R6, R7, R8 и/или R9 могут обозначать остаточную часть соединения. В одном аспекте осуществления настоящего изобретения один или несколько из R1, R2 и R4 обозначают фрагмент боковой цепи аминокислоты или его производное.
В контексте настоящего описания термин «фрагмент боковой цепи аминокислоты» обозначает любой фрагмент, представляющий собой боковую цепь аминокислоты, присутствующий в природных белках, включая (без ограничения) фрагменты боковой цепи природных аминокислот, приведенные в таблице 1. Другие фрагменты боковой цепи природных аминокислот по настоящему изобретению включают (без ограничения) фрагменты боковой цепи 3,5-дибромтирозина, 3,5-дииодтирозина, гидроксилизина, γ-карбоксиглютамата, фосфотирозина и фосфосерина. Кроме того, в практике осуществления настоящего изобретения могут использоваться гликозилированные боковые цепи аминокислот, включая (без ограничения) гликолизированные треонин, серин и аспарагин.
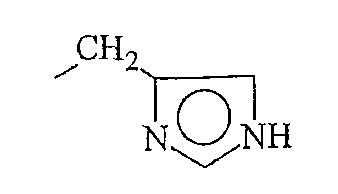
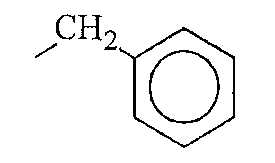
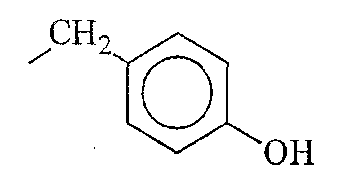
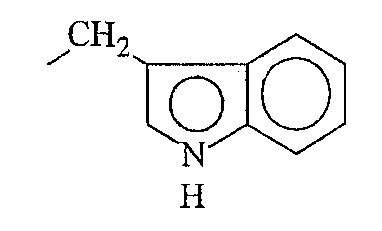
Кроме фрагментов боковой цепи природных аминокислот, фрагменты боковой цепи аминокислоты по настоящему изобретению включают различные их производные. В контексте настоящего описания термин «производные» фрагментов боковой цепи аминокислоты включают модификации и/или вариации, введенные во фрагменты боковой цепи природных аминокислот. Например, фрагменты боковой цепи аминокислот аланина, валина, лейцина, изолейцина и фенилаланина могут быть в целом отнесены к классу короткоцепочечных алкильных, арильных или арилалкильных фрагментов. Производные фрагментов боковой цепи аминокислот включают другие линейно-цепочечные или разветвленные, циклические или нециклические, замещенные или незамещенные, насыщенные или ненасыщенные, короткоцепочечные алкильные, арильные или арилалкильные фрагменты.
В контексте настоящего описания термин «короткоцепочечные алкильные фрагменты» содержат 1-12 атомов углерода, термин «короткоцепочечные арильные фрагменты» содержат 6-12 атомов углерода и термин «короткоцепочечные аралкильные фрагменты» содержат 7-12 атомов углерода. Таким образом, в одном варианте осуществления настоящего изобретения производное боковой цепи аминокислоты выбрано из С1-12 алкила, С6-12 арила и С7-12 арилалкила и в более предпочтительном варианте осуществления настоящего изобретения - из С1-7 алкила, С6-10 арила и С7-11 арилалкила.
Производные боковой цепи аминокислот по настоящему изобретению включают также замещенные производные короткоцепочечных алкильных, арильных и арилалкильных фрагментов, в которых заместители выбраны (без ограничения) из одного или нескольких следующих химических фрагментов: -OH, -OR, -COOH, -COOR, -CONH2, -NH2, -NHR, -NRR, -SH, -SR, -SO2R, -SO2H, -SOR и галогена (включая F, Cl, Br и I), где каждое из значений R независимо выбрано из линейно-цепочечного или разветвленного, циклического или нециклического, замещенного или незамещенного, насыщенного или ненасыщенного короткоцепочечного алкильного, арильного или аралкильного фрагментов. Кроме того, циклические короткоцепочечные алкильные, арильные и арилалкильные фрагменты по настоящему изобретению включают нафталин, также гетероциклические соединения, такие как тиофен, пиррол, фуран, имидазол, оксазол, тиазол, пиразол, 3-пирролин, пирролидин, пиридин, пиримидин, пурин, хинолин, изохинолин и карбазол. Производные боковой цепи аминокислот включают также гетероалкильные производные алкильной части короткоцепочечного алкильного и аралкильного фрагментов, включая (без ограничения) алкил- и аралкилфосфонаты и силаны.
В конкретном варианте репрезентативные фрагменты R1, R2, R3, R4, R5, R6, R7, R8 и R9 включают (без ограничения) -OH, -OR, -COR, -COOR, -CONH2, -CONR, -CONRR, -NH2, -NHR, -NRR, -SO2R и -COSR, где каждое значение R определено выше.
В еще одном варианте осуществления настоящего изобретения и в дополнение к определенному выше фрагменту боковой цепи аминокислоты или его производному (или к остаточной части соединения в случае R1, R2, R3, R5, R6, R7, R8 и R9), R1, R2, R3, R4, R5, R6, R7, R8 или R9 могут представлять собой линкер, облегчающий связывание соединения с другим фрагментом или соединением. Например, соединения по настоящему изобретению могут быть присоединены к одному или нескольким известным соединениям, таким как биотин, для использования в диагностических исследованиях или в процедурах скрининга. Кроме того, R1, R2, R3, R4, R5, R6, R7, R8 или R9 может представлять собой линкер, соединяющий соединение с твердой подложкой (такой как подложка, используемая в твердофазном пептидном синтезе) или, альтернативно, может сам представлять подложку. В данном варианте связывание с другим фрагментом или соединением или с твердой подложкой предпочтительно в положении R1, R2, R7, R8 или R9 и более предпочтительно в положении R1 или R2.
В том варианте осуществления настоящего изобретения, где А обозначает -(CHR3)-, B обозначает -(C=O)-, D обозначает -(CHR5)-, E обозначает -(C=O)- и G обозначает -(XR7)n-, миметическое соединение с обратной конфигурацией по настоящему изобретению имеет следующую формулу (II):

где R1, R2, R3, R5, R7, W, X и n определены выше. В предпочтительном варианте осуществления настоящего изобретения R1, R2 и R7 обозначают остаточную часть соединения и R3 и R5 выбраны из фрагментов боковой цепи аминокислот.
В том варианте осуществления настоящего изобретения, где А обозначает -(C=O)-, B обозначает -(CHR4)-, D обозначает -(C=O)-, E обозначает -(ZR6)-, G обозначает -(C=O)-(XR9)-, миметическое соединение с обратной конфигурацией по настоящему изобретению имеет следующую формулу (III):

где R1, R2, R4, R6, R9, W и X определены выше, Z обозначает атом азота или CH (если Z обозначает CH, то X обозначает атом азота). В предпочтительном варианте осуществления настоящего изобретения R1, R2,R6 и R9 обозначают остаточную часть соединения, а R4 выбран из фрагментов боковой цепи аминокислот.
В более конкретном варианте осуществления настоящего изобретения, где А обозначает -(C=O)-, B обозначает -(CHR4)-, D обозначает -(C=O)-, E обозначает -(ZR6)- и G обозначает -(XR7)n-, миметическое соединение с обратной конфигурацией по настоящему изобретению имеет следующую формулу (IV):

где R1, R2, R4, R6, R7, W, Х и n определены выше и Z обозначает атом азота или CH (в том случае, когда Z обозначает атом азота, n равно нулю, и когда Z обозначает CH, то Х обозначает атом азота и n не равен нулю). В предпочтительном варианте осуществления настоящего изобретения R1, R2,R6 и R7 обозначают остаточную часть соединения, а R4 выбран из фрагментов боковой цепи аминокислот. В одном аспекте осуществления настоящего изобретения R6 или R7 выбран из фрагментов боковой цепи аминокислот, Z и X оба обозначают CH.
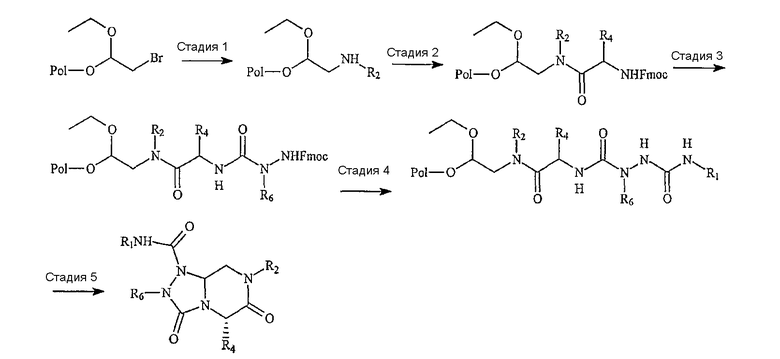
Данные соединения могут быть получены при использовании молекул соответствующих исходных компонентов (далее называемых как «компонентные части»). В общих чертах синтез миметическух структур с обратной конфигурацией формулы (I) включает объединение первой и второй компонентной части с образованием объединенного интермедиата на основе первого-второго компонента, далее, при необходимости, объединяют третью и/или четвертую компонентные части с образованием объединенного интермедиата на основе третьего-четвертого компонентов (если это коммерчески доступно, может быть использован один третий интермедиат), далее объединенные первый-второй интермедиат и третий-четвертый интермедиат (или только третий интермедиат) связывают с получением первого-второго-третьего-четвертого интермедиата (или первого-второго-третьего интермедиата), которое циклизуют с образованием миметической структуры с обратной конфигурацией по настоящему изобретению. Альтернативно, миметические структуры с обратной конфигурацией формулы (I) могут быть получены при последовательном связывании индивидуальных компонентных частей, осуществляемом постадийно либо в растворе, либо в рамках традиционной методики твердофазного синтеза пептидов.
Сборка на основе конкретных компонентных частей с получением соединения по настоящему изобретению проиллюстрирована на фиг.1. Например, «первая компонентная часть» может иметь следующую формулу S1:

где R2 определен выше, а R обозначает защитную группу, подходящую для использования в пептидном синтезе, где данная защитная группа может быть присоединена к полимерной подложке, позволяя осуществлять твердофазный синтез. Подходящие R группы включают алкильные группы, и в предпочтительном варианте R обозначает метильную группу. На фиг.1 одна из R групп представляет собой полимерную (твердую) подложку, обозначенную на чертеже термином «Pol». Такие первые компонентные части могут быть легко синтезированы путем восстановительного аминирования H2N-R2 с использованием CH(OR)2-CHO или при проведении реакции замещения между H2N-R2 и CH(OR)2-CH2-LG (где LG обозначает удаляемую группу, например галогеновую (Hal) группу).
«Вторая компонентная часть» может иметь следующую формулу S2:
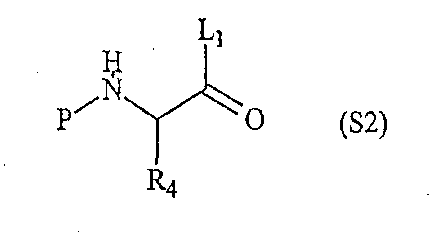
где Р обозначает защитную группу для аминогруппы, подходящую для использования в пептидном синтезе, L1 обозначает группу, активирующую гидроксил или карбоксил, и R4 определен выше. Предпочтительные защитные группы включают трет-бутилдиметилсилил (TBDMS), трет-бутилоксикарбонил (BOC), метилоксикарбонил (MOC), 9H-флуоренилметилоксикарбонил (FMOC) и аллилоксикарбонил (Alloc). N-защищенные аминокислоты коммерчески доступны, в частности, например, FMOC аминокислоты доступны из множества источников. Для того чтобы создать условия для взаимодействия второй компонентной части с первой компонентной частью, L1 будет обозначать группу, активирующий карбоксил, а превращение карбоксильных групп в активированные карбоксильные группы может быть легко достигнуто с использованием известных в данной области методик, которые применяются для активации карбоксильных групп. Подходящие активированные группы карбоновой кислоты включают галогенангидриды, где L1 обозначает галогенид, такой как хлорид или бромид, ангидриды карбоновых кислот, где L1 обозначает ацильную группу, такую как ацетил, реакционно-способные сложные эфиры, такие как N-гидроксисукцинимидные эфиры и пентафторфенильные эфиры, и другие активированные интермедиаты, такие как активные интермедиаты, образуемые в сопряженной реакции при использовании карбодиимида, такого как дициклогексилкарбодиимид (DCC). Соответственно, коммерчески доступные N-защищенные аминокислоты могут быть превращены в активированные формы карбоновых кислот с использованием известных в данной области методик.
В случае, если в качестве второй компонентной части используют азидопроизводное аминокислот, то такого рода соединения могут быть получены из соответствующей аминокислоты по методике реакции, описанной Zaloom et al. (J. Org. Chem. 46: 5173-76, 1981).
Альтернативно, первая компонентная часть по настоящему изобретению может иметь следующую формулу S1':
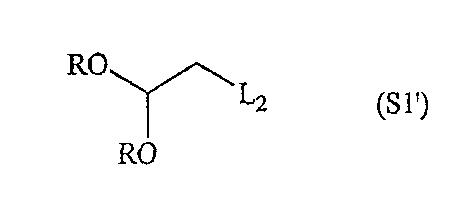
где Rопределен выше и L2 обозначает удаляемую группу, такую как атом галогена или тозильная группа, и вторая компонентная часть по настоящему изобретению может иметь следующую формулу S2':
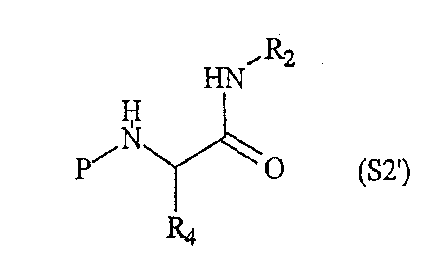
где R2, R4 и P были определены выше.
«Третья компонентная часть» по настоящему изобретению может иметь следующую формулу S3:

где G, E, L1 и L2 были определены выше. Подходящие варианты третьей компонентной части коммерчески доступны от множества источников или могут быть получены в соответствии с методиками, известными в органической химии.
На фиг.1 в соединении формулы (1) имеются значения: для А -(C=O)-, для B -(CHR4)-, для D -(C=O)- и для Е -(CR6)-. Соединения формулы (1), в которых карбонильная группа находится в положении В и R-группа находится в положении В, то есть соединения, в которых А обозначает -(CHR3)- и B обозначает -(C=O)-, могут быть получены по методике, аналогичной методике, приведенной на фиг.1 и проиллюстрированной на фиг.2. На фиг.2 также проиллюстрирована реакция добавления четвертной компонентной части к интермедиату на основе первого-второго-третьего компонента, а не реакция присоединения четвертой компонентной части к третьей компонентной части перед проведением реакции с интермедиатом на основе первого-второго компонента. Кроме того, на фиг.2 проиллюстрировано получение соединения по настоящему изобретению, в которых D обозначает -(CHR5)- (а не -(C=O)-, как показано на фиг.1) и E обозначает -(C=O)- (а не -(CHR6)-, как показано на фиг.1). И, наконец, на фиг.2 показано получение соединений, в которых G обозначает NR7.
Таким образом, как показано выше, миметические соединения с обратной конфигурацией по настоящему изобретению формулы (I) могут быть синтезированы реакцией первой компонентной части со второй компонентной частью с образованием объединенного первого-второго интермедиата и с проведением впоследствии реакции полученного объединенного первого-второго интермедиата с третьей компонентной частью с образованием объединенного интермедиата на основе первого-второго-третьего-четвертого компонента и далее циклизации такого интермедиата с образованием миметической структуры с обратной конфигурацией.
Синтез репрезентативных компонентных частей по настоящему изобретению описан в примерах получения и в рабочих примерах.
Миметические структуры с обратной конфигурацией, описываемые формулами (III) и (IV), могут быть получены по методикам, аналогичным методикам, применяемым при модульном синтезе описанных выше компонентов, но при внесении соответствующих модификаций в указанные компонентные части.
Миметические структуры с обратной конфигурацией по настоящему изобретению могут использоваться как биологически активные агенты, такие как средства, применяемые для диагностики, профилактики и лечения. Так, например, миметические структуры с обратной конфигурацией по настоящему изобретению могут использоваться для модуляции фактора транскрипции клеточного сигнала, относящегося к пептидам теплокровных животных, в соответствии с методикой, включающей введение животным эффективного количества соединения формулы (I).
Кроме того, миметические структуры с обратной конфигурацией по настоящему изобретению могут быть также эффективны с точки зрения ингибирования связывания пептида с доменами PTB у теплокровного животного; модуляции рецептора, связанного с G белком (GPCR), и ионного канала у теплокровного животного; а также модуляции цитокинов у теплокровного животного.
Тем временем было показано, что соединения формулы (I), в особенности соединения формулы (VI), эффективны в плане ингибирования или лечения расстройств, в которые вовлекается Wnt-сигнальный путь, таких как рак, в особенности колоректальный рак.
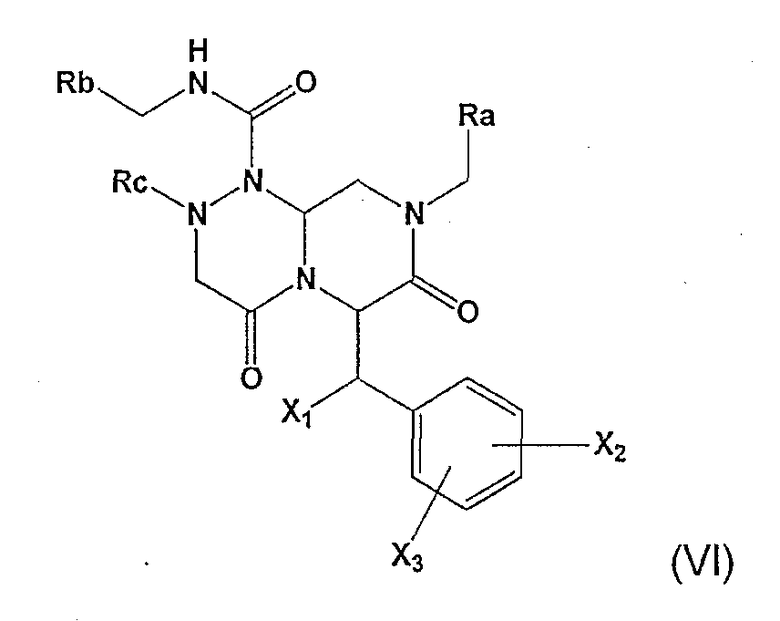
где Ra обозначает фенильную группу, замещенную фенильную группу, содержащую один или несколько заместителей, где один или несколько заместителей независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурильной или гидроксильной групп; бензильной группы, замещенной бензильной группы при наличии одного или нескольких заместителей, где указанные один или несколько заместителей независимо выбраны из одной или нескольких групп амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурильной и гидроксильной групп; или бициклической арильной группы, содержащей от 8 до 11 членов в кольце, которое может включать от 1 до 3 гетероатомов, выбранных из атомов азота, кислорода или серы, Rb обозначает моноциклическую арильную группу, содержащую от 5 до 7 членов в кольце, которое может содержать от 1 до 2 гетероатомов, выбранных из атомов азота, кислорода или серы, и арильное кольцо в соединении может содержать один или несколько заместителей, выбранных из группы, состоящей из галогенида, гидрокси, циано, низших алкильных и низших алкоксигрупп; Rc обозначает насыщенный или ненасыщенный С1-6алкил, С1-6алкокси, перфторС1-6алкильную группу; и X1, X2 и Х3 могут быть одинаковыми или разными и независимо выбраны из водорода, гидроксила и галогенида.
В другом аспекте настоящее изобретение относится к фармацевтической композиции, включающей безопасное и эффективное количество соединения общей формулы (VI) и фармацевтически приемлемый носитель, которая может использоваться для лечения расстройств, модулированных Wnt-сигнальным механизмом, в особенности комплексом TCF4-β-катенин-CBP.
Кроме того, настоящее изобретение относится к способу ингибирования роста опухолевых клеток путем использования описанной выше композиции по настоящему изобретению, к способу индукции апоптоза опухолевых клеток путем использования указанной выше композиции согласно настоящему изобретению, к способу лечения расстройства, модулированного комплексом TCF4-β-катенин-CBP, за счет использования указанной выше композиции по настоящему изобретению и к способу лечения рака, такого как колоректальный рак, путем введения композиции по настоящему изобретения вместе с другим противораковым средством, таким как 5-фторурацил (5-FU), таксол, цисплатин, митомицин С, тегафур, ралтитрексед, капецитабин и иринотекан и т.п.
В предпочтительном варианте осуществления настоящего изобретения соединение по настоящему изобретению имеет (6S,10R)-конфигурацию, как показано ниже:
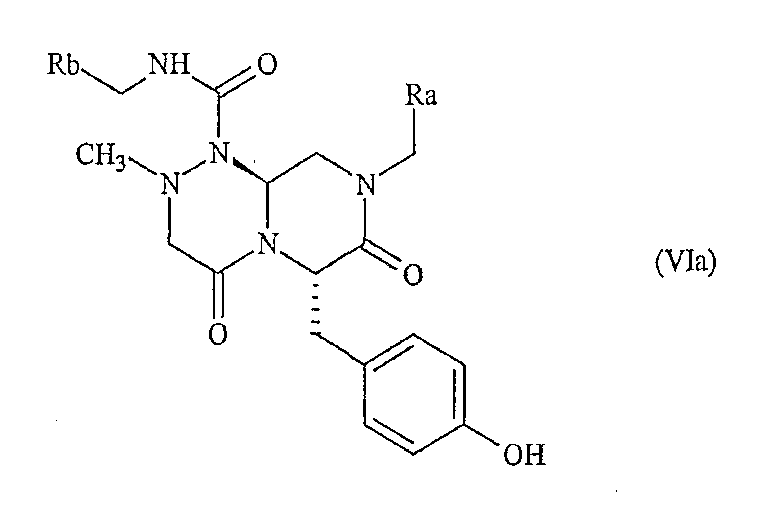
где Ra и Rb имеют значения, описанные выше.
В другом аспекте настоящего изобретения описываются библиотеки, содержащие миметические структуры с обратной конфигурацией. В ходе сборки библиотеки по настоящему изобретению могут быть подвергнуты скринингу для идентификации отдельных ее представителей, обладающих биологической активностью. Такие методы скрининга библиотек на наличие биологически активных членов могут включать, например, оценку связывающей активности представителей данной библиотеки или оценку эффекта членов такой библиотеки в рамках функционального теста. Обычно скрининг проводят путем взаимодействия членов такой библиотеки (или подмножества членов библиотеки) с интересующей мишенью, такой как, например, антитело, фермент, рецептор или клеточная линия. Члены библиотеки, которые способны к взаимодействию с интересующей мишенью, обозначаются в настоящем описании как «биологически активные члены библиотеки» или «биологически активные миметики». Например, биологически активный миметик может представлять собой член библиотеки, который способен к связыванию с антителом или рецептором, или который способен ингибировать фермент, или который способен проявлять или оказывать антагонистическое воздействие на функциональный ответ, ассоциированный, например, с клеточной линией. Иными словами, скрининг библиотеки по настоящему изобретению определяет, какие члены библиотеки способны взаимодействовать с одной или несколькими интересующими биологическими мишенями. Кроме того, в том случае, когда происходит взаимодействие, биологически активный(ые) миметик(и) могут быть идентифицированы среди членов библиотеки. Идентификация одного (или ограниченного числа) биологического(их) миметика(ов) в библиотеке приводит к получению миметических структур с обратной конфигурацией, которые сами являются биологически активными и могут в этой связи использоваться в качестве диагностических, профилактических или терапевтических агентов, а также могут использоваться для проведения более усовершенствованной идентификации важнейших соединений в данных областях.
Синтез пептидных миметиков для библиотеки по настоящему изобретению может быть осуществлен с использованием известных методик пептидного синтеза в сочетании с первой, второй и третьей компонентными частями по настоящему изобретению. Более конкретно, любая аминокислотная последовательность может быть добавлена к N-концевой и/или С-концевой части конформационно ограниченного миметика с обратной конфигурацией. В этой связи миметики могут быть синтезированы на твердой подложке (такой как смола РАМ) с использованием известных методик (см., например, John M. Stewart and Janis D. Young, Solid Phase Peptide Synthesis,1984, Pierce Chemical Comp., Rockford, III) или на силилированной смоле при ее присоединении с использованием спиртовых агентов (см. Randolph et al., J. Am. Chem. Soc. 117:5712-14, 1995).
Дополнительно для синтеза пептидных миметиков по настоящему изобретению может использоваться сочетание методик синтеза в растворе и методик твердофазного синтеза. Например, может использоваться твердая подложка для синтеза линейной пептидной последовательности, вплоть до той точки, когда к последовательности добавляется конформационно ограниченная часть. Соответствующая конформационно устойчивая структура миметика с обратной конфигурацией, которая была ранее синтезирована по методике синтеза в растворе, может быть добавлена в качестве «следующей» аминокислоты при осуществлении процедуры твердофазного синтеза (например, конформационно ограниченный миметик с обратной конфигурацией, который содержит и N-конец, и С-конец, может использоваться в качестве следующей аминокислоты, добавляемой к линейному пептиду). При включении в последовательность конформационно ограниченных структур миметиков с обратной конфигурацией могут быть введены дополнительные аминокислоты для завершения присоединения пептида к твердой подложке. Альтернативно, линейные защищенные по N-концу и С-концу пептидные последовательности могут быть синтезированы на твердой подложке, далее удалены с этой подложки и присоединены к конформационно устойчивым миметическим структурам в растворе с использованием известных методик связывания в растворе.
В другом аспекте настоящего изобретения описываются способы конструирования библиотек. Традиционные методики комбинаторной химии (см., например, Gallop et al., J. Med. Chem. 37:1233-1251, 1994) позволяют быстро получать огромное число соединений путем последовательного комбинирования реагента с основной складчато-молекулярной структурой. Для конструирования пептидных библиотек, получаемых на основе природных аминокислот, используются комбинаторные методики. Так, например, при наличии 20 смесей из 20 соответствующим образом замещенных и различающихся аминокислот при их связывании с друг другом из указанных 20 аминокислот может быть создана библиотека из 400 (то есть 202) дипептидов. При повторе данной процедуры 7 раз можно получить пептидную библиотеку, включающую примерно 26 миллиардов (то есть 208) октапептидов.
Конкретно, синтез пептидных миметиков для библиотеки по настоящему изобретению может быть осуществлен с использованием известных методик пептидного синтеза, например основной схемы создания библиотеки миметиков [4.4.0] с обратной конфигурацией, следующим образом:
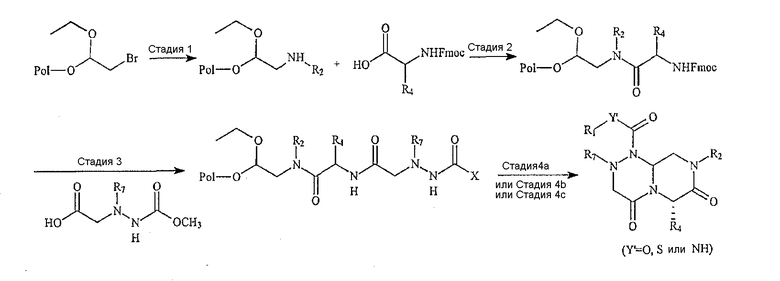
Синтез пептидных миметиков для библиотек по настоящему изобретению проводят с использованием устройства FlexChem Reactor Block, который включают 96-ячеечный планшет, по известным методикам. В указанной выше схеме термин «Pol» обозначает бромацеталевую смолу (Advanced Chem Tech) и ниже приведена подробная процедура синтеза.
Стадия 1
Бромацеталевую смолу (37 мг, 0,98 ммоль/г) и раствор R2-амина в ДМСО (1,4 мл) вводят в Robbins block (FlexChem), включающий 96-ячеечные планшеты. Реакционную смесь встряхивают при 60°С с использованием вращающегося нагревателя [Robbins Scientific] в течение 12 часов. Смолу промывают ДМФА, MeOH и затем DCM.
Стадия 2
Раствор коммерчески доступных Fmoc аминокислот (4 эквив.), PyBob (4 эквив.), HOAt (4 эквив.) и DIEA (12 эквив.) в ДМФА добавляют к смоле. После встряхивания реакционной смеси в течение 12 часов при комнатной температуре смолу промывают с использованием ДМФА, MeOH и затем DCM.
Стадия 3
К набухшей под действием ДМФА смоле перед реакцией добавляют 25% пиперидин в ДМФА и реакционную смесь встряхивают при комнатной температуре в течение 30 минут. Данную стадию удаления защитного агента повторяют снова и смолу промывают ДМФА, метанолом и затем DCM. Далее к смоле добавляют раствор гидразиновой кислоты (4 эквив.), HOBt (4 эквив.) и DIC (4 эквив.) в ДМФА и реакционную смесь встряхивают в течение 12 часов при комнатной температуре. Смолу промывают ДМФА, MeOH и затем DCM.
Стадия 4а (где гидразиновая кислота представляет собой MOC-карбамат)
Смолу, полученную на стадии 3, обрабатывают муравьиной кислотой (1,2 мл в каждую ячейку) в течение 18 часов при комнатной температуре. После удаления смолы фильтрованием фильтрат конденсируют при пониженном давлении с использованием SpeedVac [SAVANT], получая продукт в виде масла. Далее продукт разбавляют 50% смесью вода/ацетонитрил и лиофилизируют после заморозки.
Стадия 4b (где Fmoc гидразиновую кислоту используют для получения мочевины через изоцинат)
К набухшей под действием ДМФА смоле перед реакцией добавляют 25% пиперидин в ДМФА и реакционную смесь встряхивают при комнатной температуре в течение 30 минут. Данную стадию удаления защитного агента повторяют снова и смолу промывают с использованием ДМФА, метанолом и затем DCM. К набухшей под действием ДСМ смоле перед реакцией добавляют изоцинат (5 эквив.) в DCM. После встряхивания реакционной смеси в течение 12 часов при комнатной температуре смолу промывают ДМФА, MeOH и затем DCM. Смолу обрабатывают муравьиной кислотой (по 1,2 мл к каждой ячейке) в течение 18 часов при комнатной температуре. После удаления смолы фильтрованием фильтрат конденсируют при пониженном давлении с использованием SpeedVac [SAVANT], получая продукт в виде масла. Далее продукт разбавляют 50% смесью вода/ацетонитрил и затем лиофилизируют после заморозки.
Стадия 4с (где Fmoc гидразиновую кислоту используют для получения мочевины через активный карбамат)
К набухшей под действием ДМФА смоле перед реакцией добавляют 25% пиперидин в ДМФА и реакционную смесь встряхивают при комнатной температуре в течение 30 минут. Данную стадию удаления защитного агента повторяют снова и смолу промывают с использованием ДМФА, МеОН и затем DCM. К набухшей под действием DCM смоле перед реакцией добавляют п-нитрофенилхлорформиат (5 эквив.) и диизопропилэтиламин (5 эквив.) в DCM. После встряхивания реакционной смеси в течение 12 часов при комнатной температуре смолу промывают с использованием ДМФА, MeOH и затем DCM. К данной смоле добавляют первичные амины в DCM на 12 часов при комнатной температуре и смолу промывают с использованием ДМФА, MeOH и затем DCM. После реакции смолу обрабатывают муравьиной кислотой (по 1,2 мл в каждую ячейку) в течение 18 часов при комнатной температуре. После удаления смолы фильтрованием фильтрат конденсируют при пониженном давлении с использованием SpeedVac [SAVANT], получая продукт в виде масла. Далее данный продукт разбавляют 50% смесью вода/ацетонитрил и затем лиофилизируют после заморозки.
Для получения библиотеки, включающей данные блоки, синтезируют ключевые гидразиновые кислоты по процедуре, приведенной в примерах получения соединений.
Далее в таблицах 2А и 2В показана библиотека [4.4.0] миметиков с обратной конфигурацией, которые могут быть получены в соответствии с настоящим изобретением и репрезентативная методика получения которых описана в примере 4.
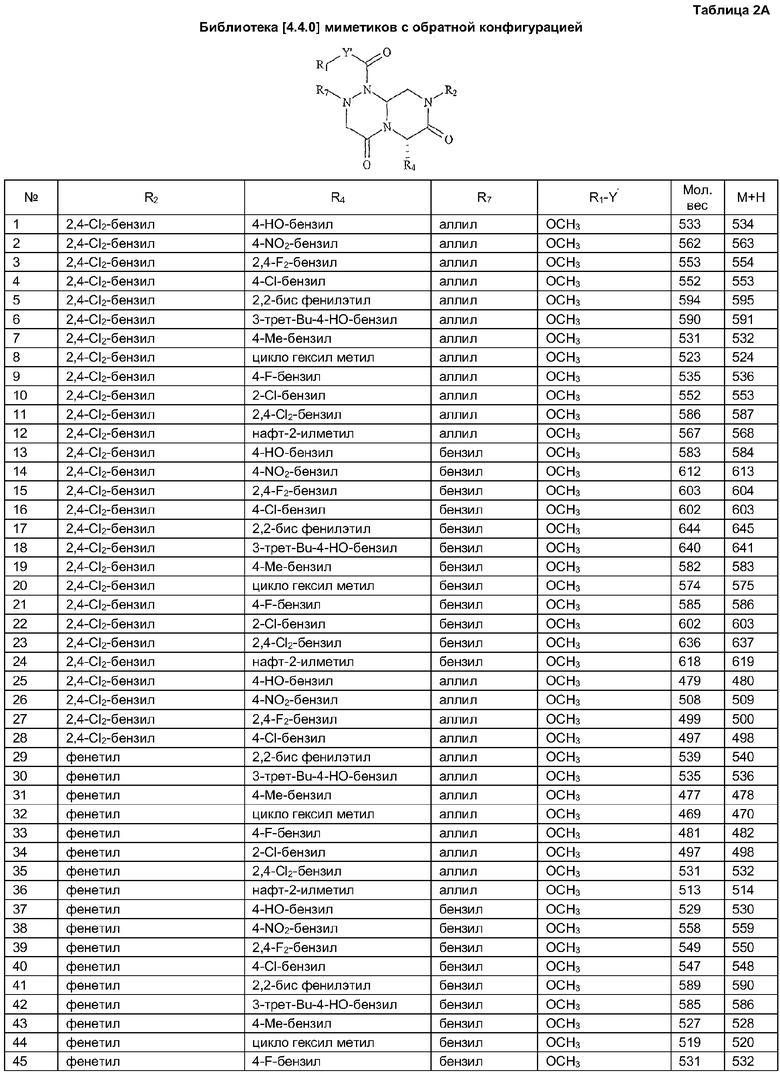
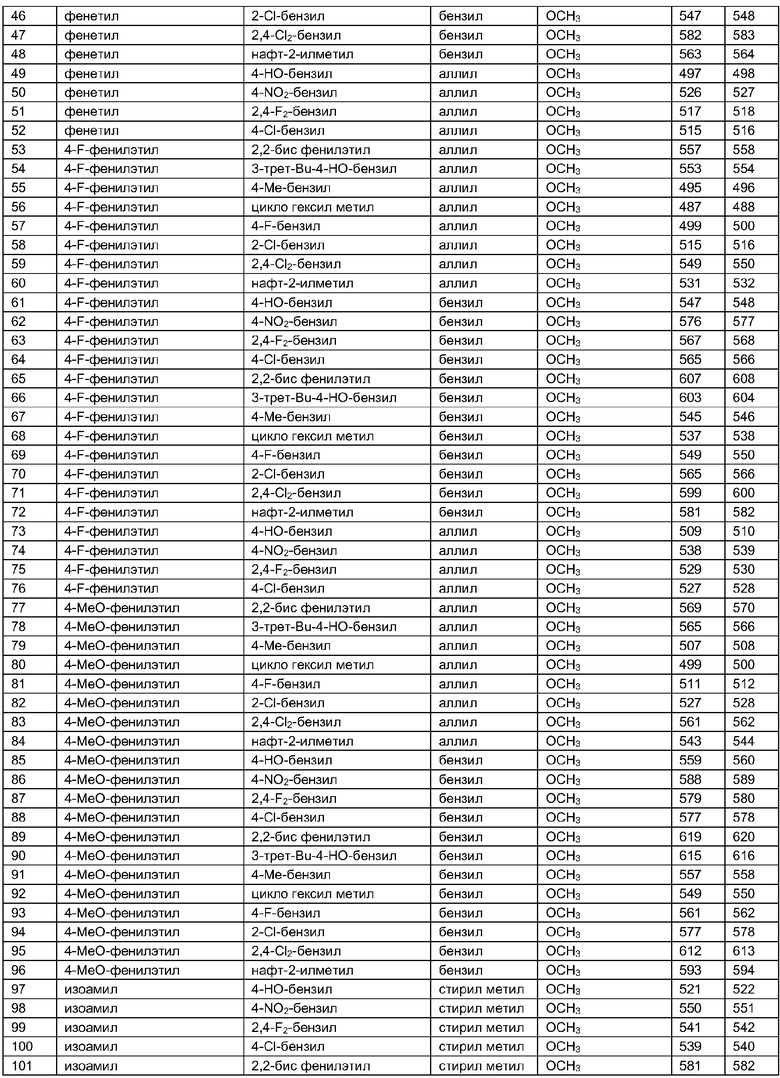
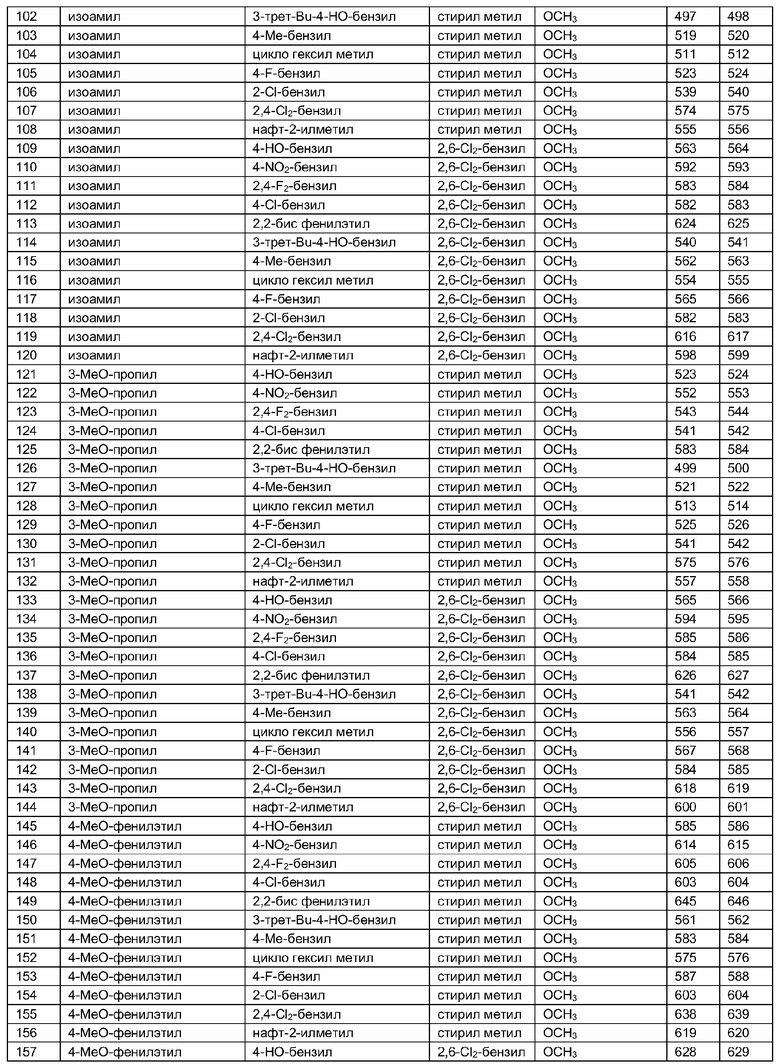
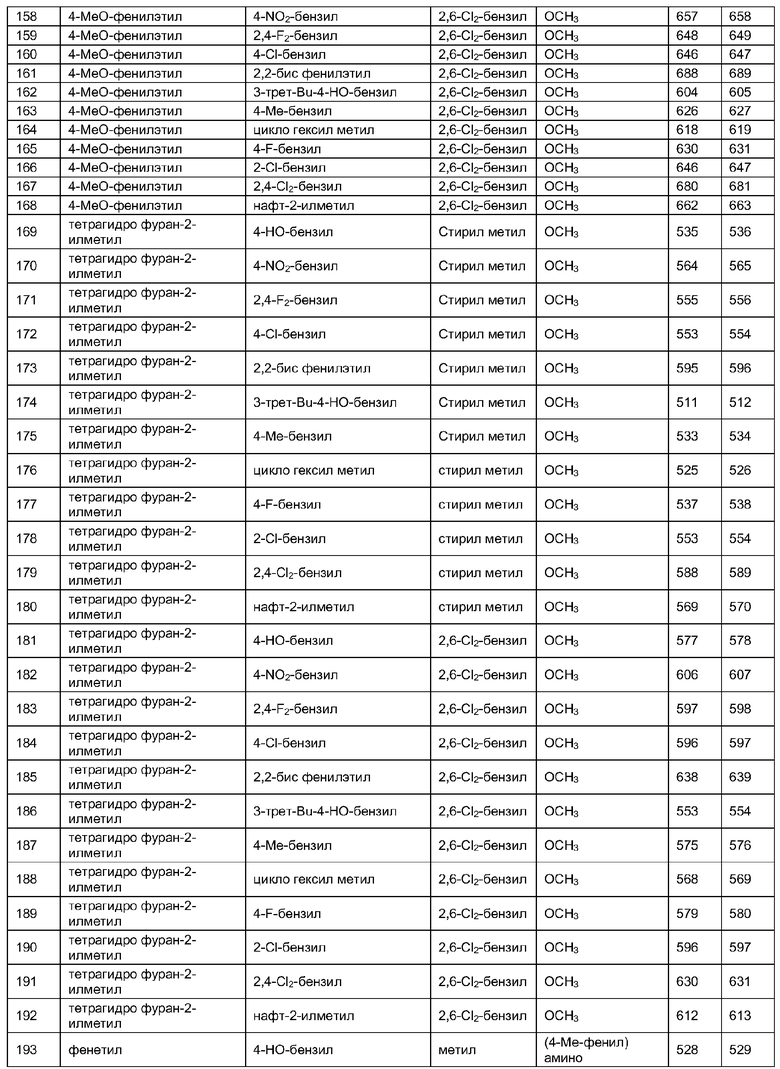
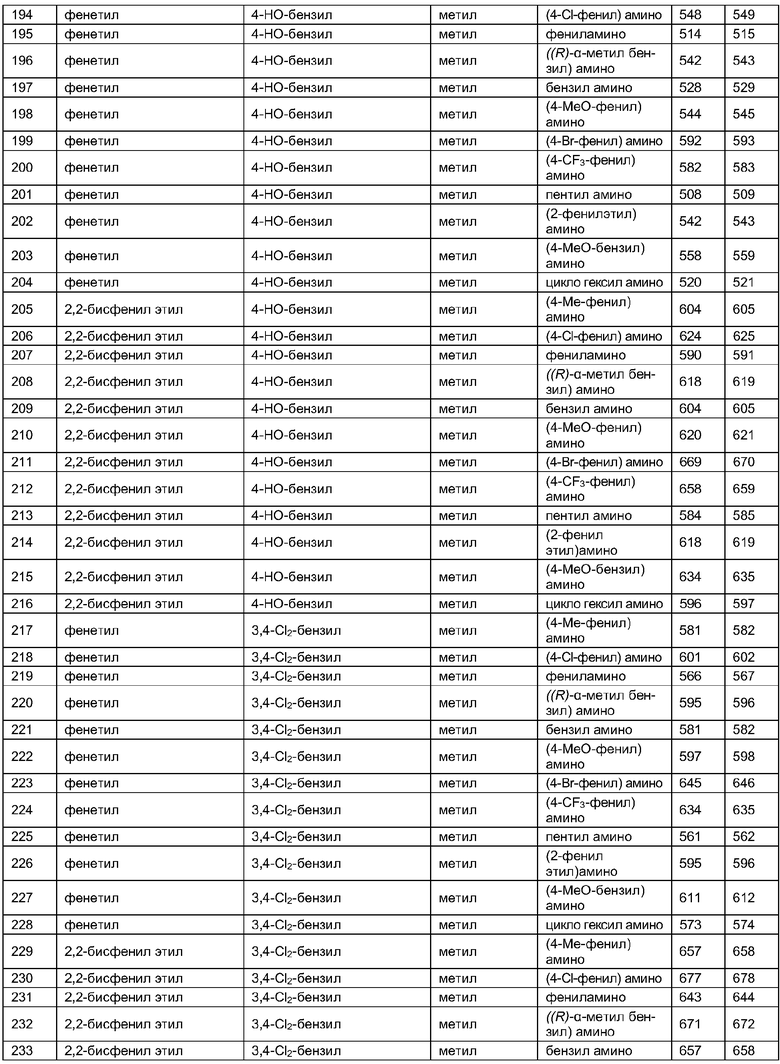
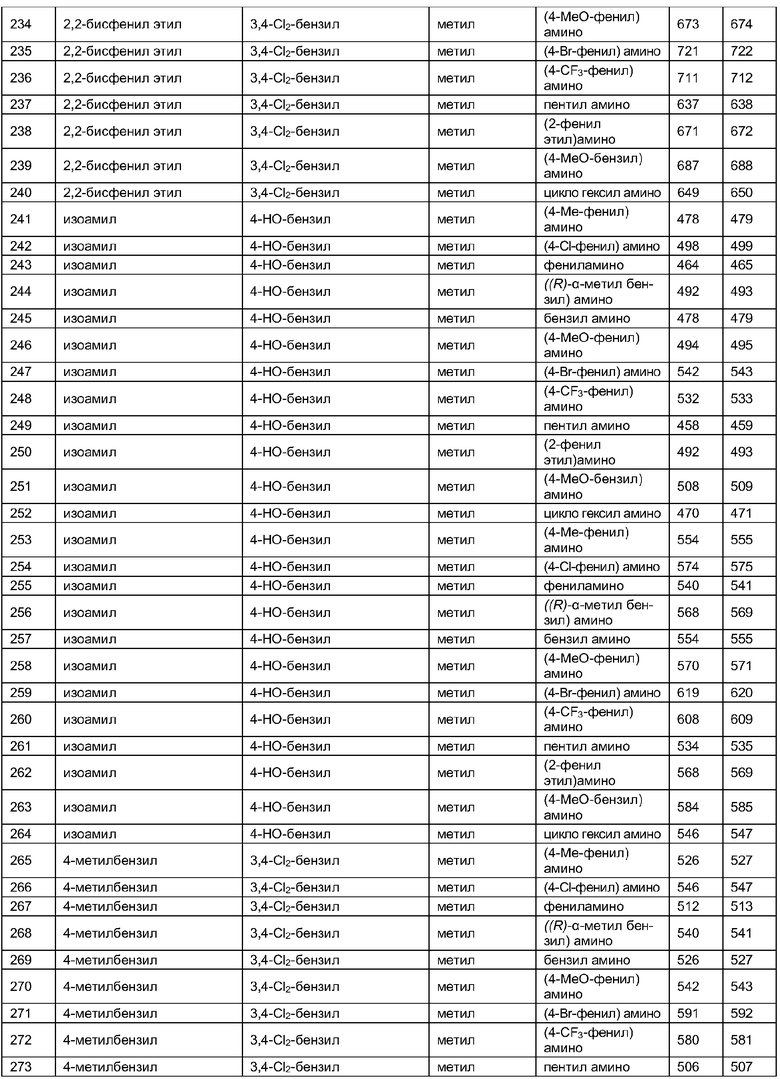
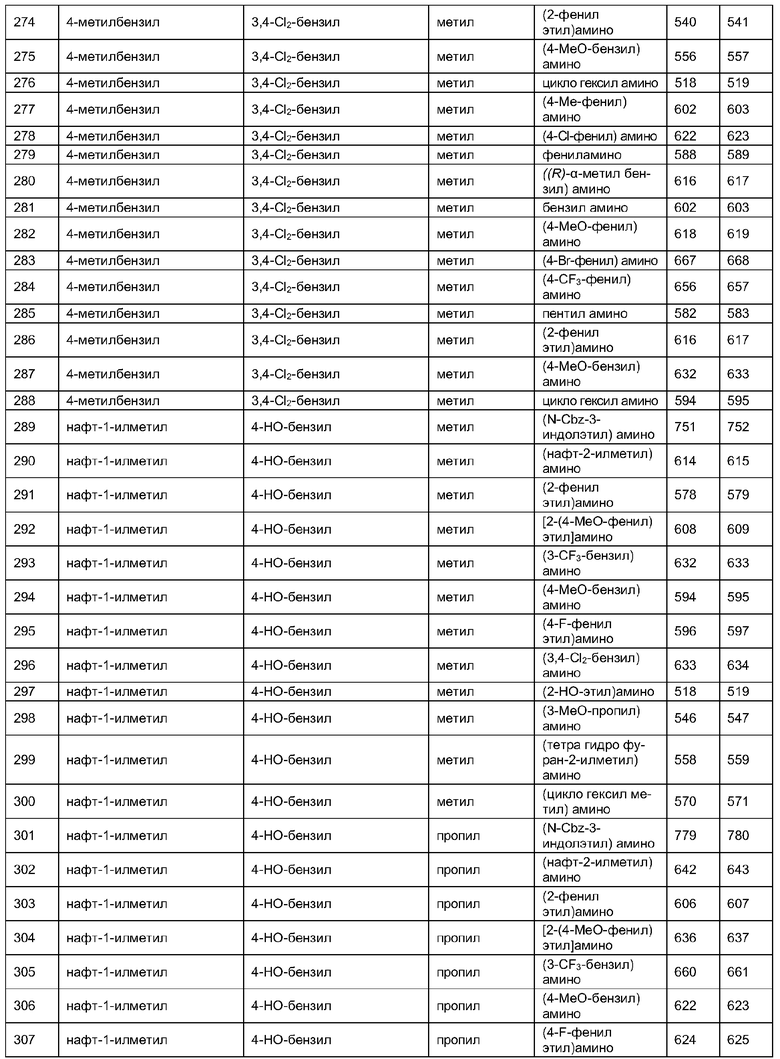
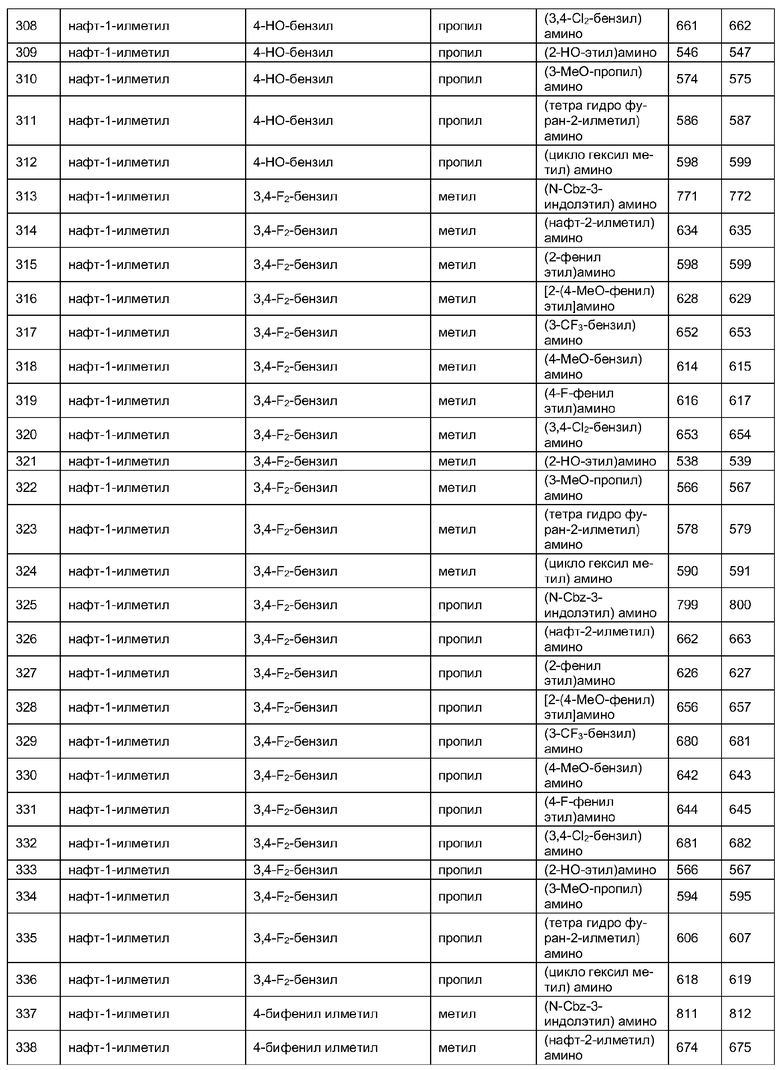
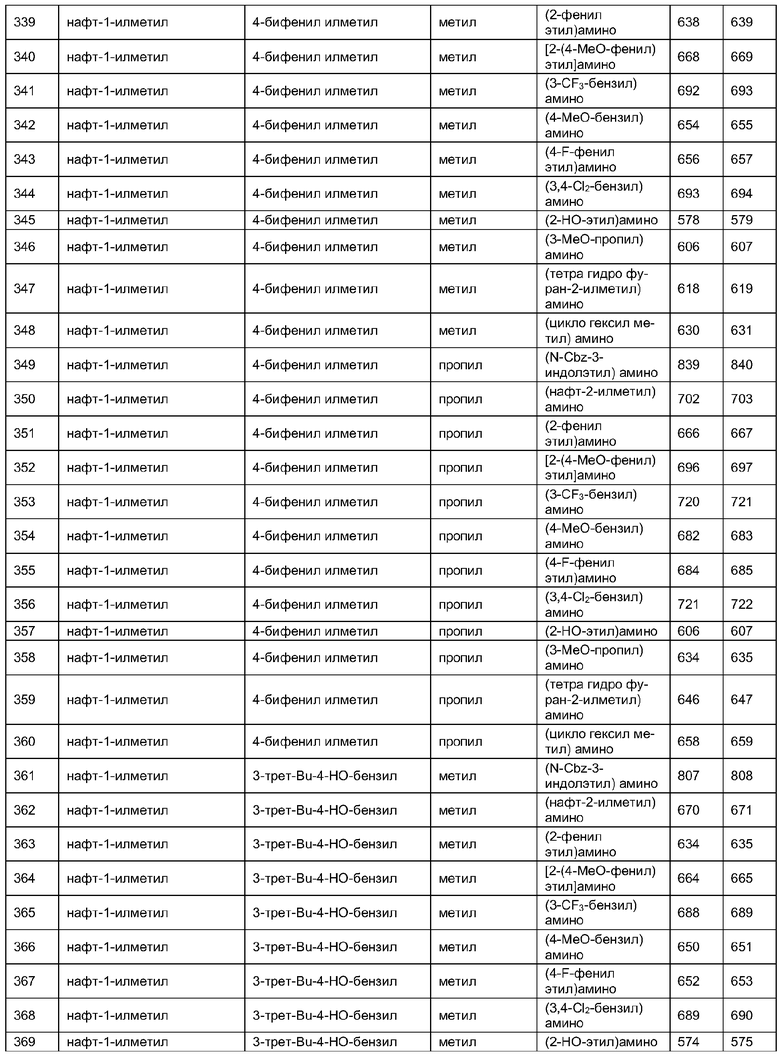
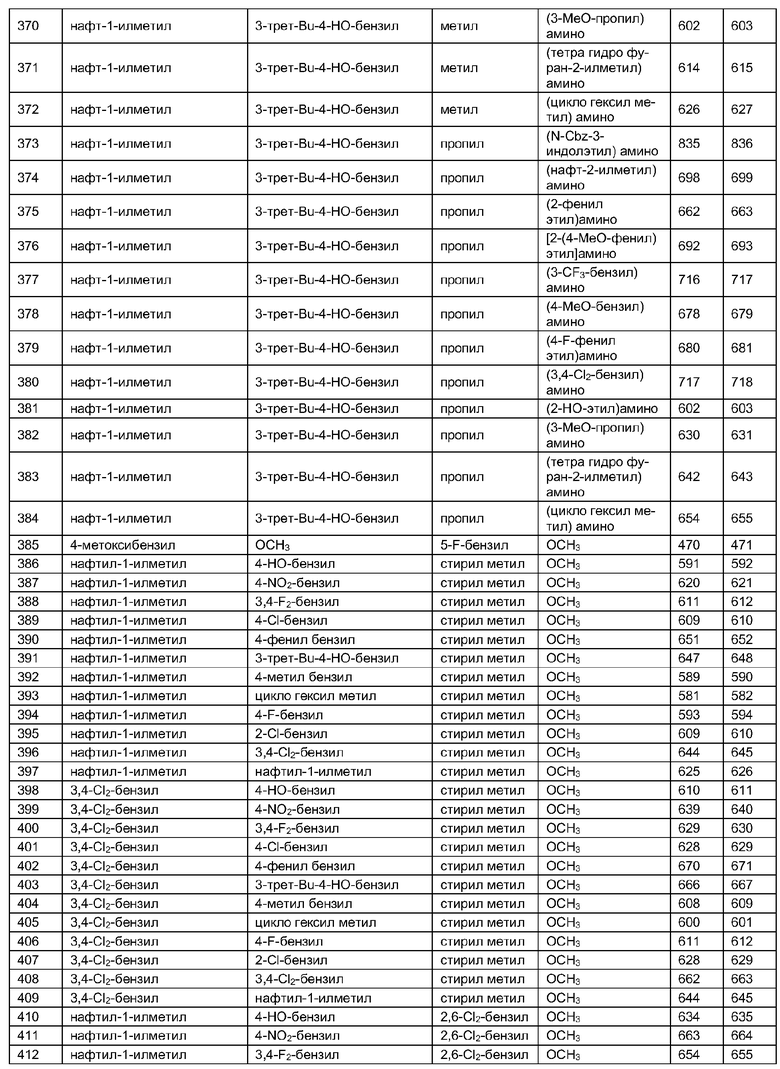
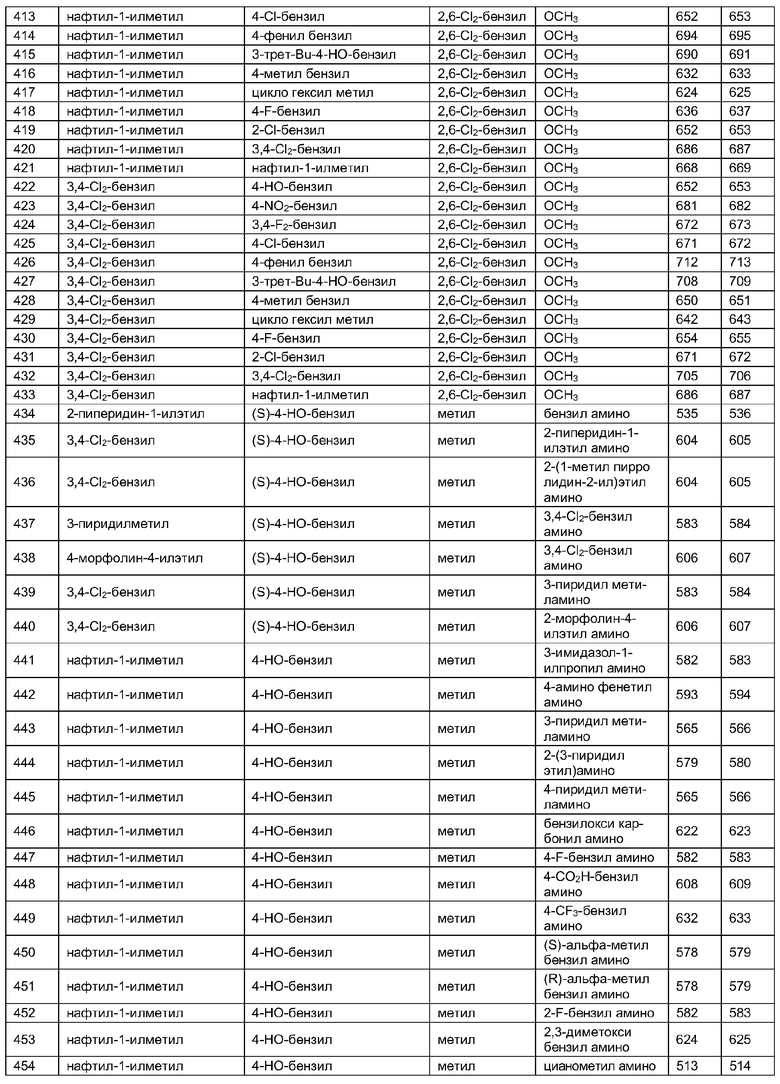
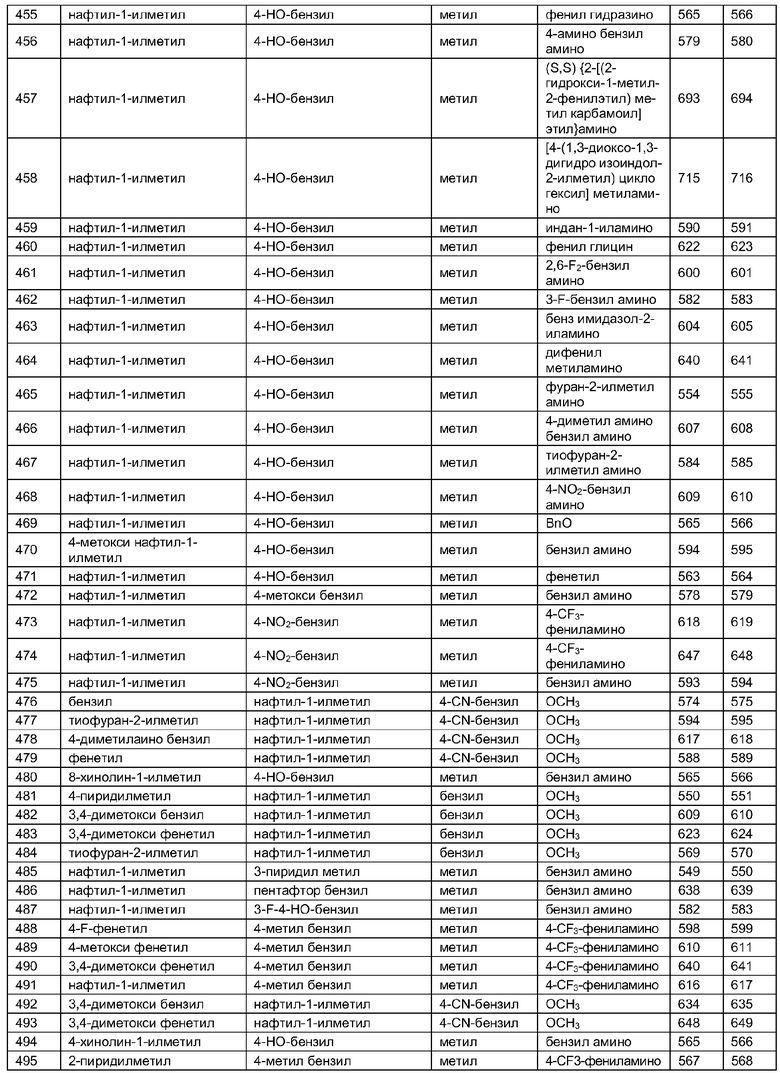
Таблица 2В (смотри в конце описания).
Кроме того, синтез пептидных миметиков для библиотеки по настоящему изобретению может быть проведен с использованием основной схемы для синтеза библиотеки [4.3.0] миметиков с обратной конфигурацией следующим образом:
Синтез пептидных миметиков для библиотек бициклических матриц по настоящему изобретению проводят с использованием FlexChem Reactor Block, который включает 96-ячеечный планшет, по известным методикам. В указанной выше схеме термин «Pol» обозначает бромацеталевую смолу (AdvancedChemTech), и ниже приведена подробная процедура синтеза.
Стадия 1
Бромацеталевую смолу (1,6 ммоль/г) и раствор R1 амина в ДМСО (2 М раствор) помещают в 96-ячеечный Robbins block (FlexChem). Реакционную смесь встряхивают при 60°С с использованием вращающейся печи [Robbins Scientific] в течение 12 часов. Далее смолу промывают с использованием ДМФА, MeOH и затем DCM.
Стадия 2
Раствор коммерчески доступных Fmoc-аминокислот (4 эквив.), PyBob (4 эквив.), HOAt (4 эквив.) и DIEA (12 эквив.) в ДМФА добавляют к смоле. После встряхивания реакционной смеси в течение 12 часов при комнатной температуре смолу промывают с использованием ДМФА, MeOH и затем DCM.
Стадия 3
К набухшей под действием ДМФА смоле перед реакцией добавляют 25% пиперидин в ДМФА и реакционную смесь встряхивают при комнатной температуре в течение 30 минут. Данную стадию удаления защитного агента повторяют снова и смолу промывают ДМФА, метанолом и затем DCM. Раствор гидразинкарбамоилхлорида (4 эквив.), HOBt (4 эквив.) и DIC (4 эквив.) в ДМФА добавляют к смоле. После встряхивания реакционной смеси в течение 12 часов при комнатной температуре смолу промывают ДМФА, MeOH и затем DCM.
Стадия 4
К набухшей под действием ДМФА смоле перед реакцией добавляют 25% пиперидин в ДМФА. После этого встряхивают реакционную смесь при комнатной температуре в течение 30 минут. Данную стадию удаления защитного агента повторяют снова и смолу промывают ДМФА, метанолом и затем DCM. К набухшей под действием ДМФА смоле перед реакцией добавляют R1-изоцинат (5 эквив.) в DCM. После встряхивания реакционной смеси в течение 12 часов при комнатной температуре смолу промывают с использованием ДМФА, MeOH и затем DCM.
Стадия 5
Смолу обрабатывают муравьиной кислотой (по 1,2 мл в каждую ячейку) в течение 18 часов при комнатной температуре). После удаления смолы фильтрованием фильтрат конденсируют при пониженном давлении с использованием SpeedVac [SAVANT], получая продукт в виде масла. Далее продукты разбавляют смесью 50% вода/ацетонитрил и лиофилизируют после заморозки.
В таблице 3 приведена библиотека [4.3.0] миметиков с обратной конфигурацией, которые могут быть получены в соответствии с настоящим изобретением и репрезентативная методика получения которых приведена в примере 5.
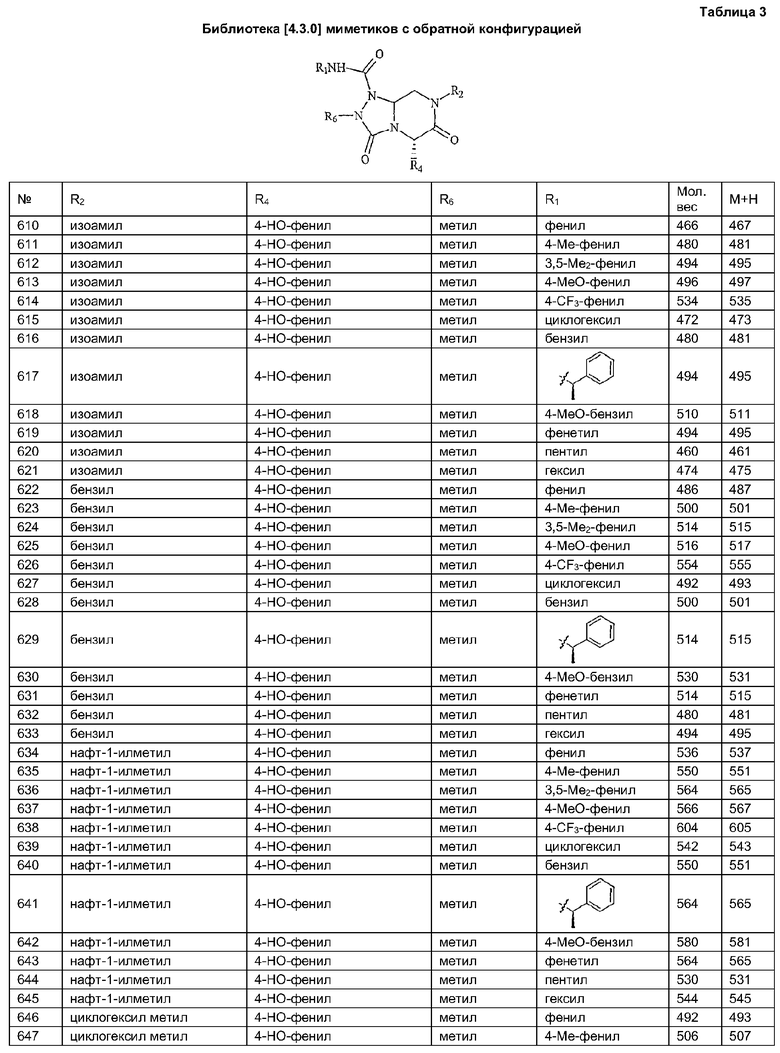
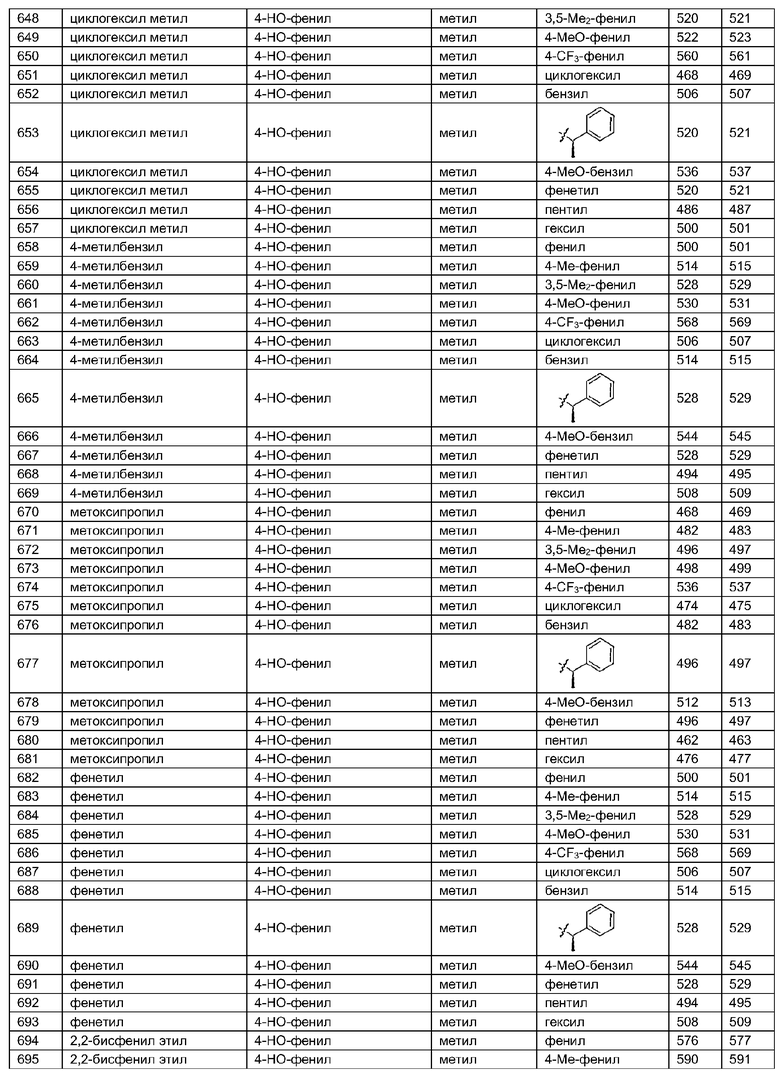
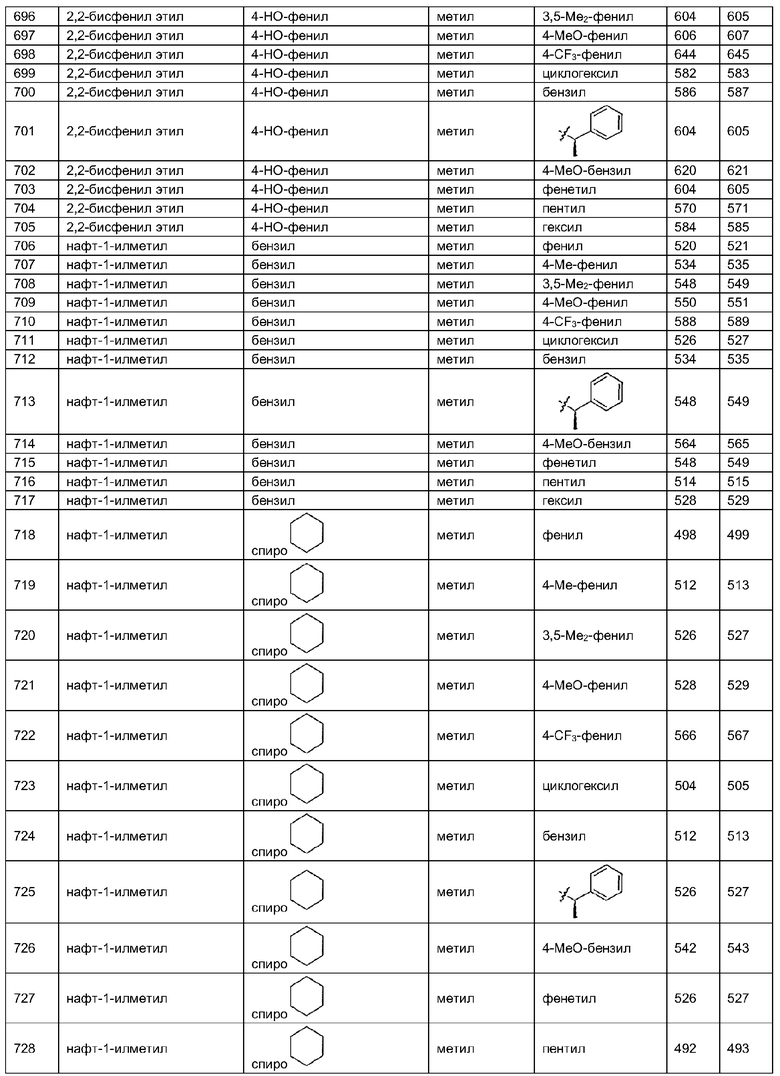
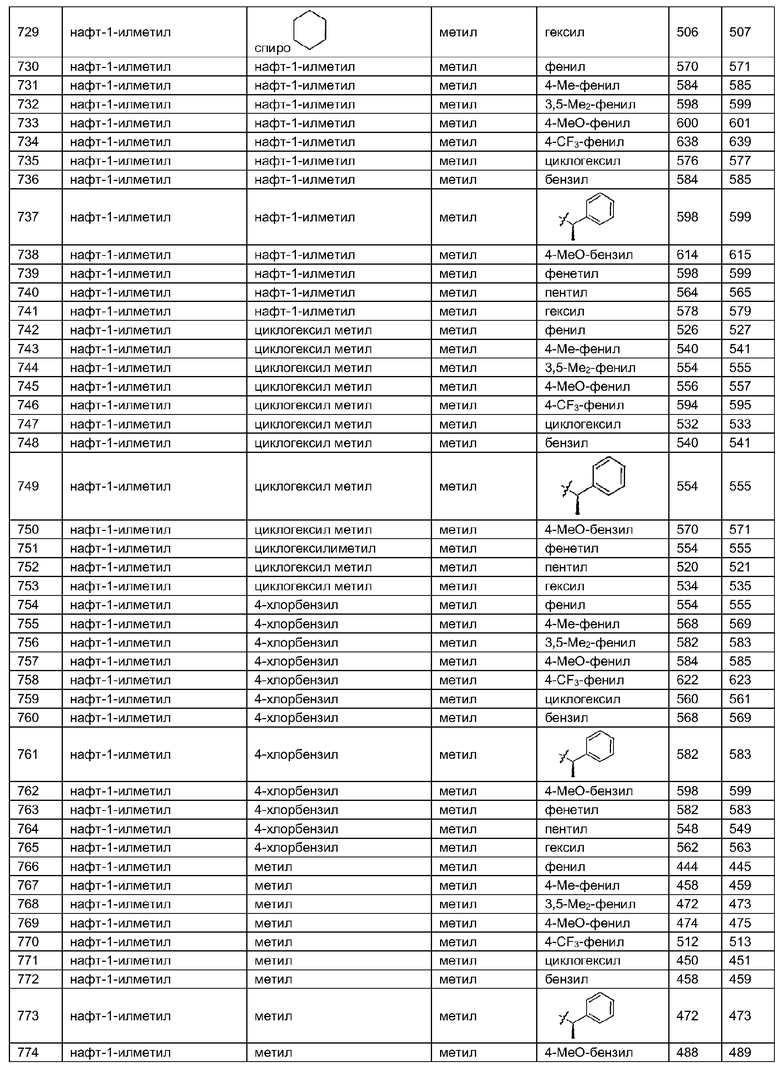
В другом аспекте настоящее изобретение относится к способам скрининга библиотек на наличие биологической активности и к способам выделения биологически активных членов библиотеки.
В еще одном аспекте настоящее изобретение относится к способу проведения теста на связывание. Данный способ относится к созданию композиции, которая включает первый коактиватор, взаимодействующий белок и исследуемое соединение. Аминокислотная структура первого коактиватора включает связывающий мотив LXXLL, LXXLI или FxxFF, где Х обозначает любую аминокислоту. Данный способ включает также выявление наличия изменений в связывании между первым коактиватором и взаимодействующим белком, возникающими в связи с присутствием соединения, и затем характеристику исследуемого соединения с точки зрения его эффекта на связывание.
Указанный тест может быть также проведен с помощью любых способов, позволяющих измерять эффект исследуемого соединения на связывание двух белков. В данной области известно много такого рода тестов, которые могут использоваться в способе согласно настоящему изобретению, включая так называемые двугибридные и сплит-гибридные системы.
Двугибридная система и различные способы проведения теста с использованием данной системы описаны, например, в патенте США 6410245. Сплит-гибридная система была описана в литературе (см., например, Hsiu-Ming Shiu et al., Proc. Natl. Acad. Sci. USA, 93: 13896-13901, ноябрь 1996 г.; и John D. Crispino, et al., Molecular Cell, 3: 1-20, февраль 1999 г.) В сплит-гибридной системе (Split-Hybrid) используется гибридный белок, при этом белок X сливают с lexA доменами связывания ДНК (pLexA), а белок Y сливают с активатором транскрипции VP16 (pSHM.1-LacZ). Взаимодействие между lexA-X и VP16-Y ведет к экспрессии белка-репрессора тетрациклина (TetR). TetR препятствует транскрипции репортерного гена HIS3, делая эти клетки неспособными расти на средах без гистидина. Разрушение белок-белкового взаимодействия восстанавливает способность этих клеток расти в таких средах за счет сдвига экспрессии тетрациклинового рецептора вдоль по направлению транскрипции. Соответственно, соединения по настоящему изобретению могут быть добавлены к растущим клеткам, и если добавление такого соединения восстанавливает способность клеток расти на средах, то такое соединение может рассматриваться как средство, способное эффективно разрушать белок-белковое взаимодействие.
Дрожжевые штаммы, требуемые для создания работающей сплит-гибридной системы, могут использоваться вместе с двумя гибридными конструкциями LexA/VР16, описанными, например, в работе Stanley M. Hollenberg, et al. Molecular and Cellular Biology 15(7): 3813-3822, июль 1995 г. Использование полезной модификации сплит-гибридной системы (Split-Hybrid) описано в Takemaru, K.I and Moon, R.T. J. of Cell Biol. 149: 249-254, 2000.
Возможны также другие форматы исследования. Например, тесты на репортерный ген AP-1 методом ELISA путем блокирования продукции IL-2 T-клеточными линиями после стимуляции CD3 и CD28 при поиске ингибиторов транскрипции IL-2. Тест на прямое связывание (между коактиваторами и их соответствующими веществами-партнерами) может проводиться методом плазмонной поверхностной резонансной спектроскопии (Biacore, Sweden, с набором подходящего оборудования от производителя) или методом ELISA.
Примеры регуляторов транскрипции включат, без ограничения, VP16, VP64, p300, CBP, PCAF, SRC1, PvALF, AtHD2A и ERF-2. См., например, Robyr et al., (2000) J. Mol. Endocrinol. 14: 329-347; Collingwood et al., (1999), J. Mol. Endocrinol. 23: 255-275; Leo et al., (2000) Gene 245: 1-11; Manteufell-Cymborowska (1999) Acta Biochim. Pol. 46: 77-89; McKenna et al., (1999) J. Steroid Biochem. Mol. Biol. 69: 3-12; Malik et al., (2000) Trends Biochem Sci. 25:277-283; и Lemon et al., (1999) Curr. Opin. Genet. Dev. 9: 499-504. Другие примеры факторов транскрипции включают, без ограничения, OsGAI, HALF-1, C1, AP1, ARF-5, -6, -7 и -8, CPRF1, CPRF4, MYC-RP/GP и TRAB1. См., например, Ogawa et al., (2000) Gene 245: 21-29; Okanami et al., (1996) Genes Cells 1: 87-99; Goff et al., (1991) Genes Dev. 5: 298-309; Cho et al., (1999) Plant. Mol. Biol. 40: 419-429; Ulmason et al. (1999) Proc. Natl. Acad. Sci USA 96: 5844-5849; Sprenger-Haussels et al., (2000) Plant. J. 22: 1-8; Gong et al. (1999) Plant. Mol. Biol. 41: 33-44; и Hobo et al. (1999) Proc. Natl. Acad. Sci USA 96: 15348-15353.
В предпочтительном варианте осуществления настоящего изобретения коактиватор транскрипции представляет собой человеческий коактиватор транскрипции. В другом предпочтительном варианте осуществления изобретения коактиватор транскрипции представляет собой член семейства коактиваторов p300/CBP, который обладают гистонацетилтрансферазной активностью. p300 описан, например, Eckner et al., 1994 г. и CBP описан Bannister and Kouzarides, 1996 г. В контексте настоящего изобретения ссылка на p300/CBP относится к человеческим, аллельному и синтетическому, вариантам p300 и к другим вариантам из млекопитающих и их аллельным и синтетическим вариантам, а также к фрагментам р300 форм из человека и других млекопитающих. В одном аспекте описания данного теста взаимодействующий белок представляет собой фактор транскрипции или второй коактиватор.
В одном аспекте описания данного теста взаимодействующий белок представляет собой любой из приведенных ниже белков: RIP140, SRC-1 (NCoA-1), TIF2 (GRIP-1, SRC-2), p (CIP, RAC-3, ACTR, AIB-1, TRAM-1, SRC-3), CBP (p300), TRAP (DRIP), PGC-1, CARM-1, PRIP (ASC-2, AIB3, RAP250, NRC), GT-198 и SHARP (CoAA, p68, p72). В другом аспекте данного теста взаимодействующий белок представляет собой любой один из приведенных ниже: TAL1, p73, MDm2, TBP, HIF-1, Ets-1, RXR, p65, AP-1, Pit-1, HNF-4, Stat2, HPV E2, BRCA1, p45 (NF-E2), c-Jun, c-myb, Tax, Sap1, YY1, SREBP, ATF-1, ATF-4, Cubitus, Interruptus, Gli3, MRF, AFT-2, JMY, dMad, PyLT, HPV E6, CITTA, Tat, SF-1, E2F, junB, РНК-геликаза A, C/EBP β, GATA-1, Neuro D, Microphthalimia, E1A, TFIIB, p53, P/CAF, Twist, Myo D, pp9О RSK, c-Fos и SV40 Large T. В другом аспекте настоящего теста взаимодействующий белок представляет собой любой один из приведенных ниже: ERAP140, RIP140, RIP160, Trip1, SWI1 (SNF), ARA70, RAP46, TIF1, TIF2, GRIP1 и TRAP. В другом аспекте настоящего изобретения взаимодействующий белок представляет собой любой один из приведенных ниже: VP16, VP64, p300, CBP, PCAF, SRC1 PvALF, AtHD2A, ERF-2, OsGAI, HALF-1, C1, AP-1, ARF-5, ARF-6, ARF-7, ARF-8, CPRF1, CPRF4, MYC-RP/GP и TRAB1. В другом аспекте настоящего изобретения первый коактиватор представляет собой CBP или p300.
Исследуемые соединения выбраны из соединений, описанных в настоящем изобретении. Например, из соединений формул (I), (II), (III), (IV), (VI) и (VIa). В типичном случае исследуемое соединение оценивают в нескольких разных концентрациях, где указанные концентрации могут быть выбраны частично на основании условий теста, например концентраций первого коактиватора и взаимодействующего белка. Концентрации в диапазоне от 0,1 до 10 мкМ являются типичными. В другом аспекте в тесте оценивается относительная эффективность двух соединений по влиянию на взаимодействие по связыванию между двумя белками, где по меньшей мере один из указанных двух соединений является соединением по настоящему изобретению. Более эффективное соединение может служить в качестве эталонного соединения в исследовании взаимосвязи между структурой соединения и его активностью.
Библиотеки по настоящему изобретению подвергают скринингу на их биологическую активность с использованием различных методик и способов. В целом, скрининг может быть проведен при (1) взаимодействии миметиков из библиотеки с интересующей биологической мишенью, такой как рецептор, с созданием условий для связывания между миметиками из библиотеки и мишенью и (2) выявлении наличия связывания в рамках соответствующего теста, такого как калориметрический тест, описанный Lam et al. (Nature 354: 82-84, 1991) или Griminski et al. (Biotechnology 12: 1008-1011, 1994) (обе работы включены в настоящее описание в качестве ссылки). В предпочтительном варианте осуществления настоящего изобретения члены библиотеки находятся в растворе, а мишень иммобилизируется на твердой фазе. Альтернативно, библиотека может быть иммобилизована на твердой фазе и может быть произведен тест путем контакта с мишенью, находящейся в растворе.
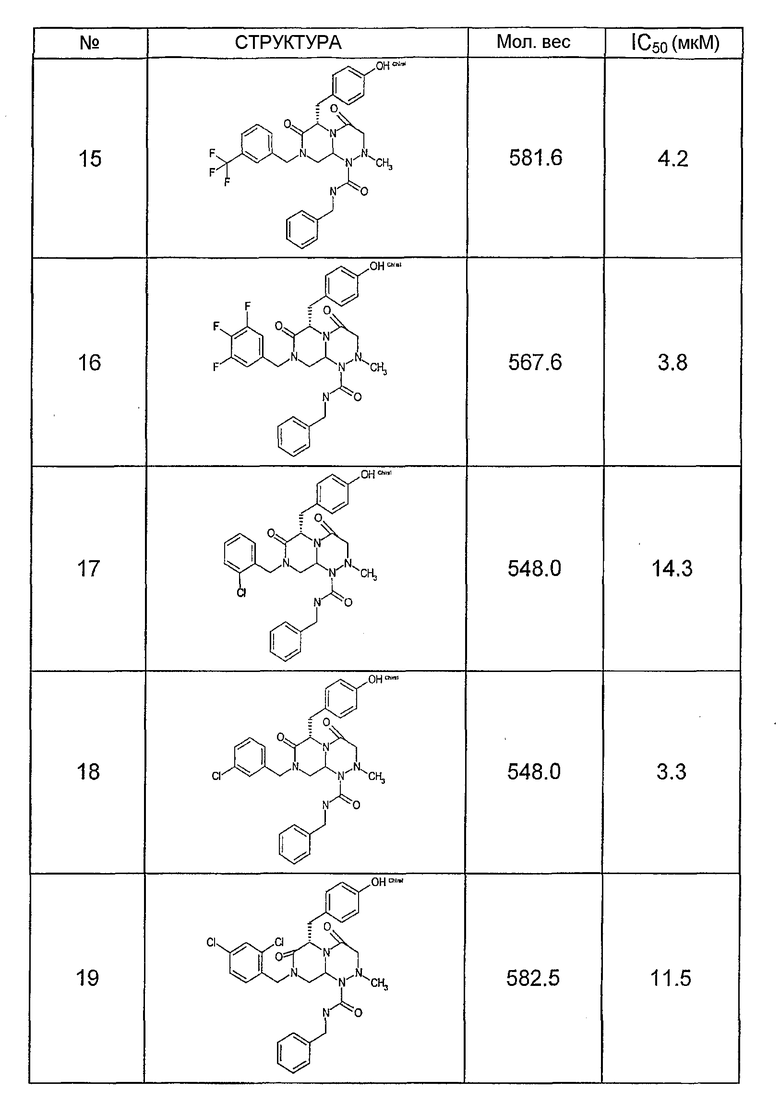
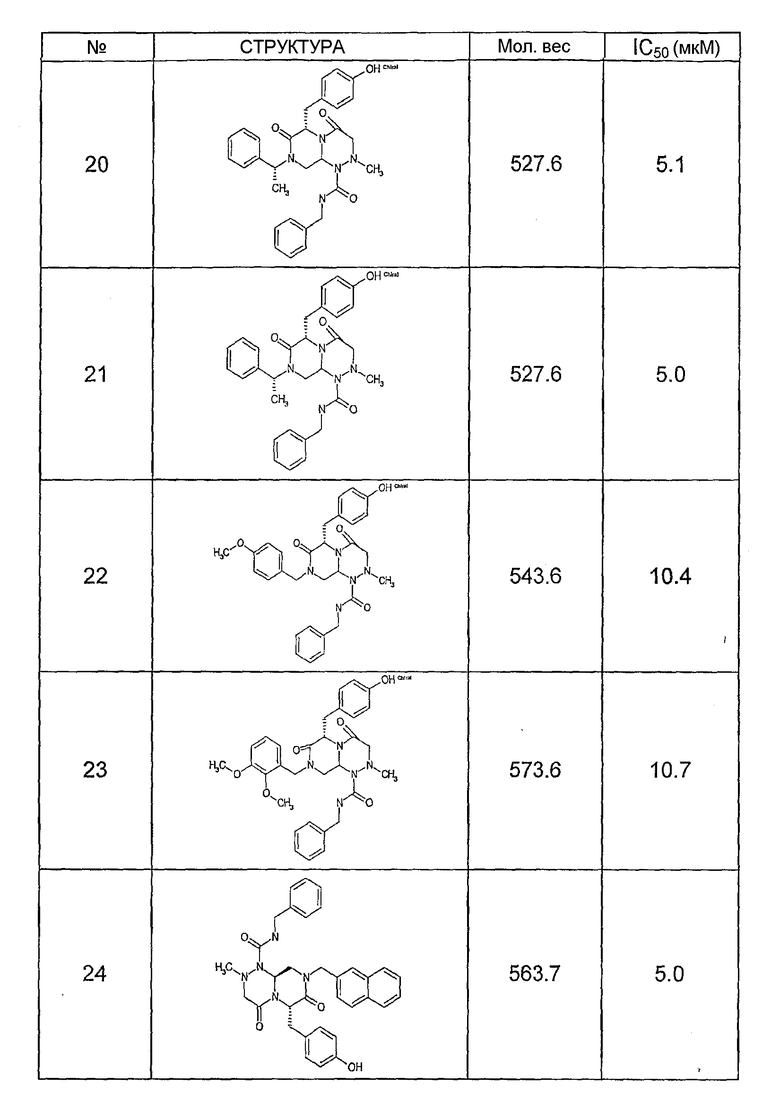
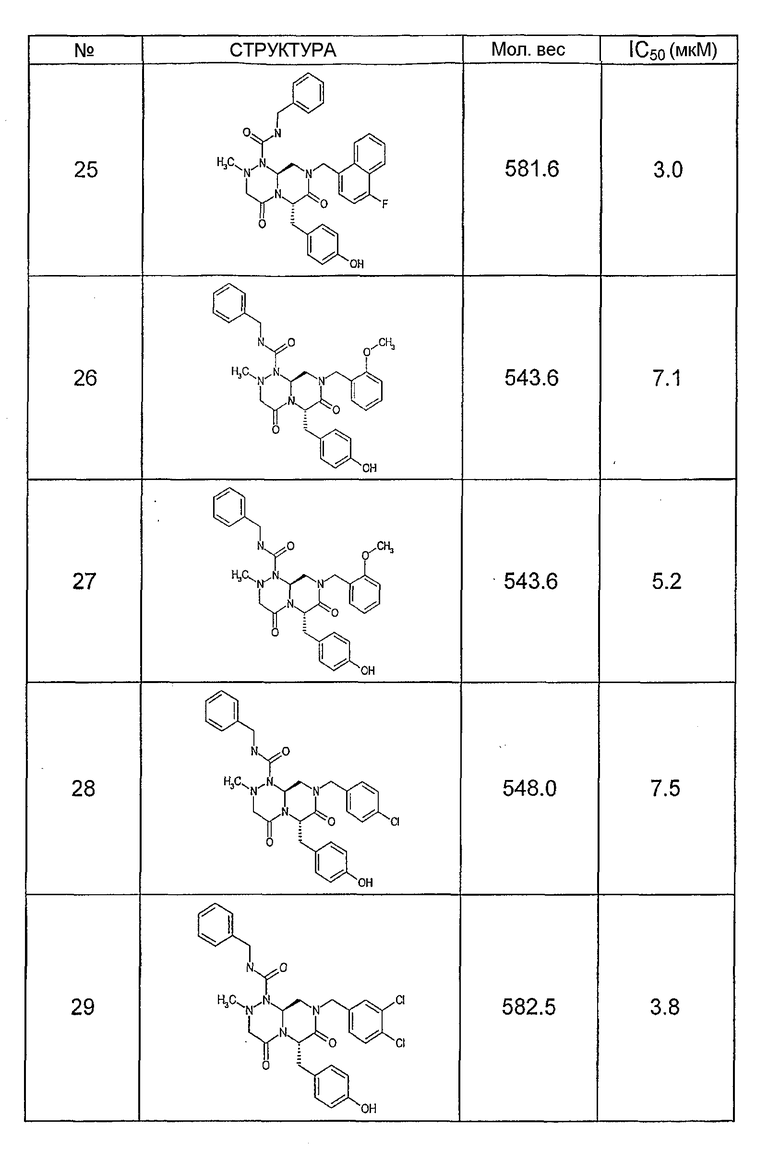
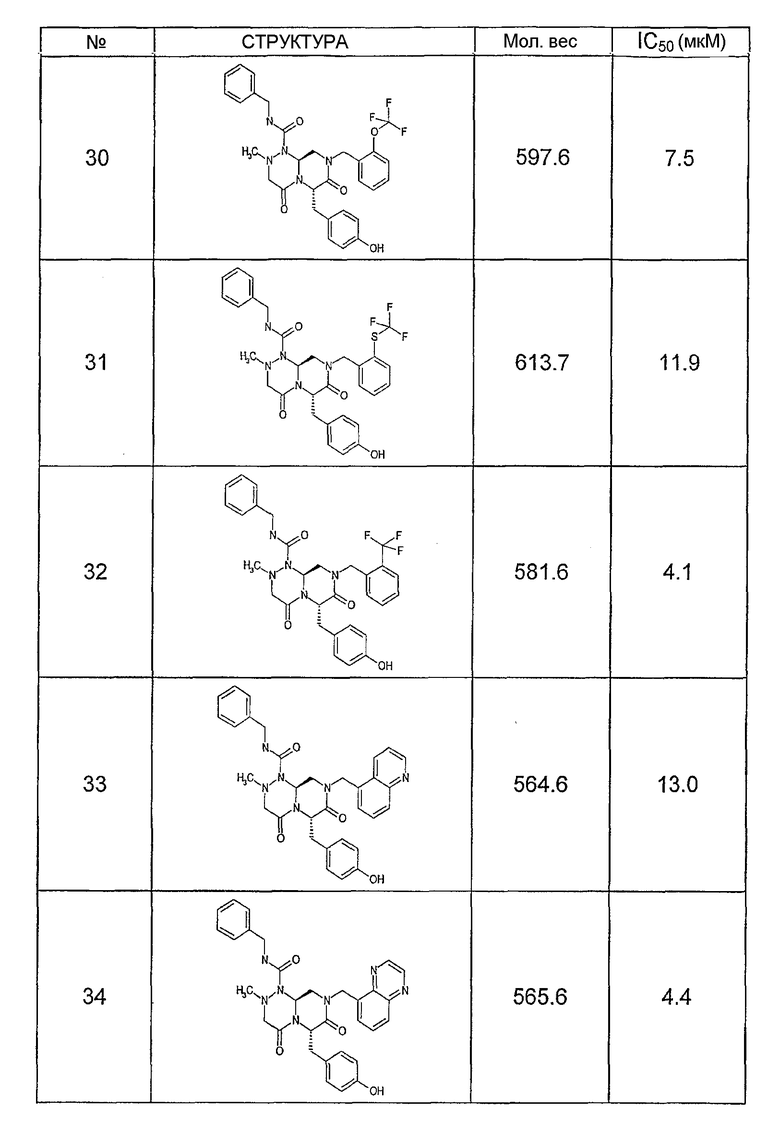
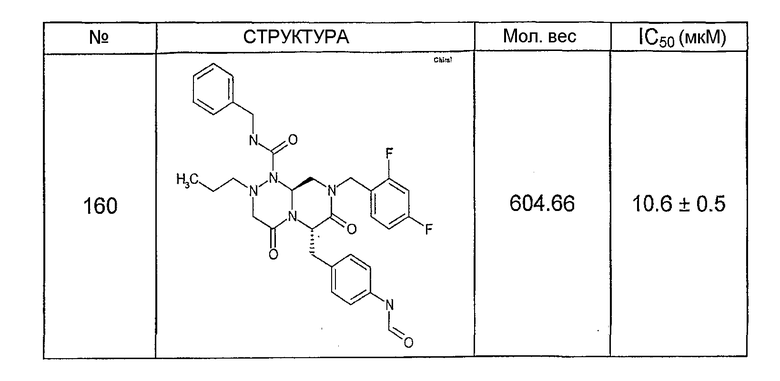
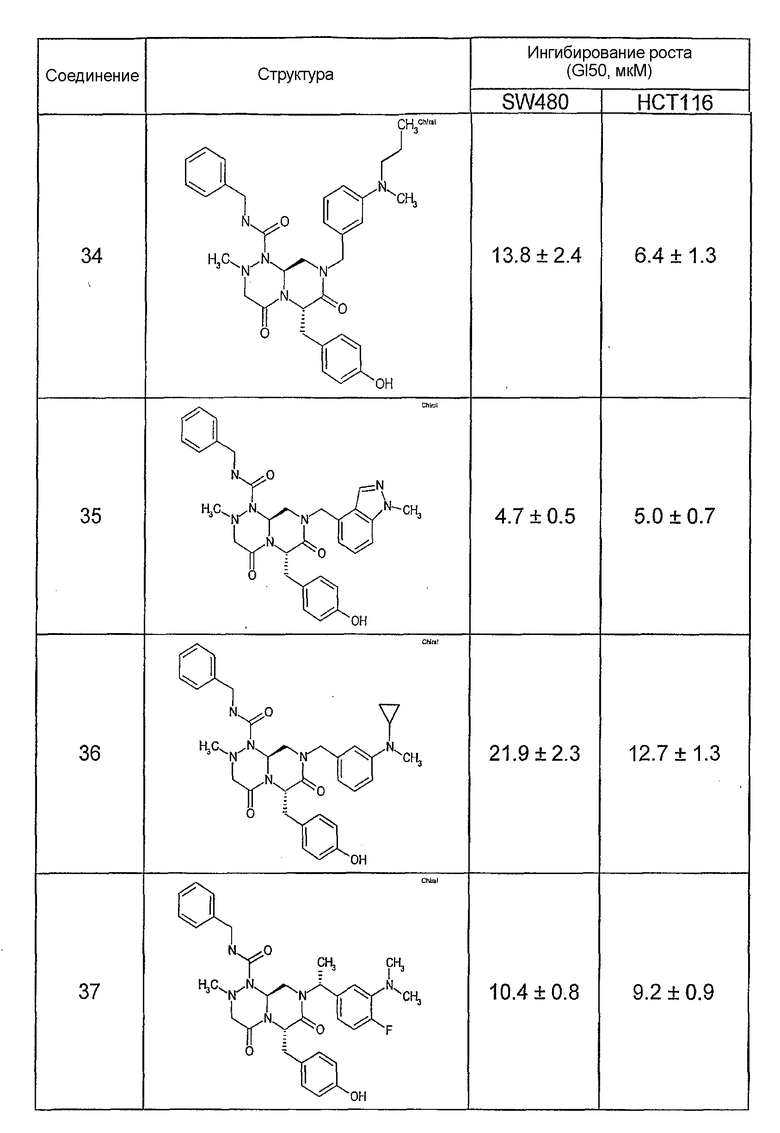
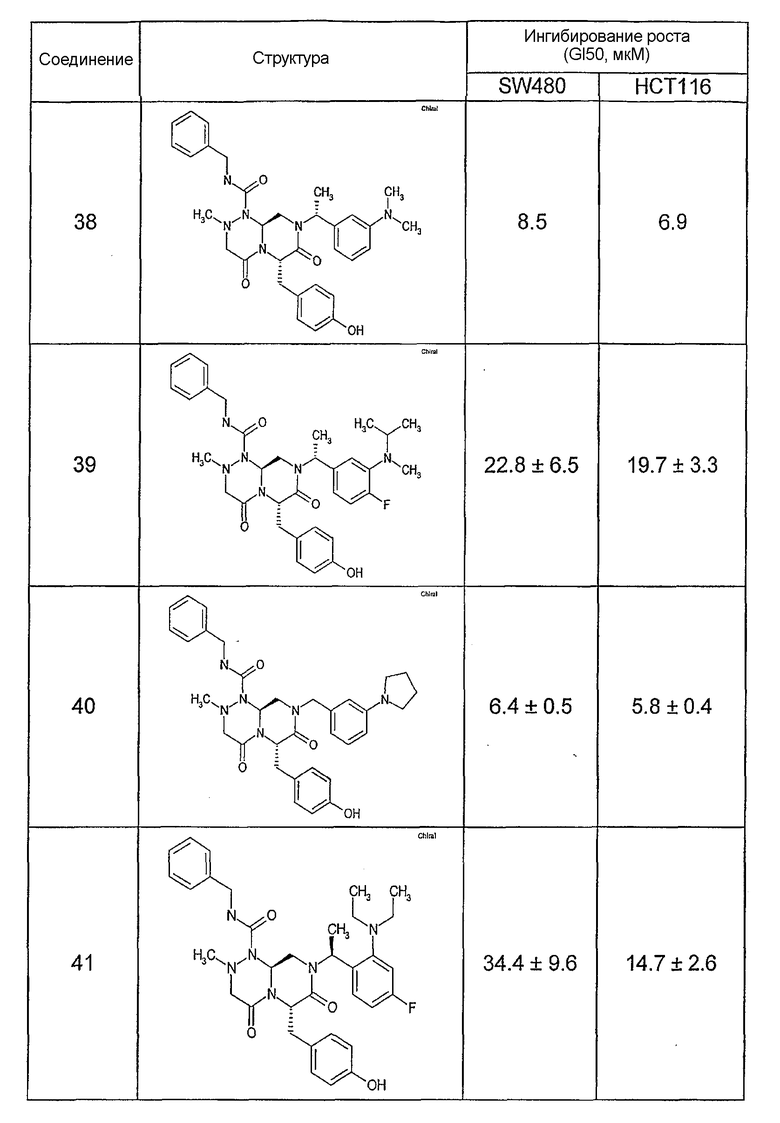
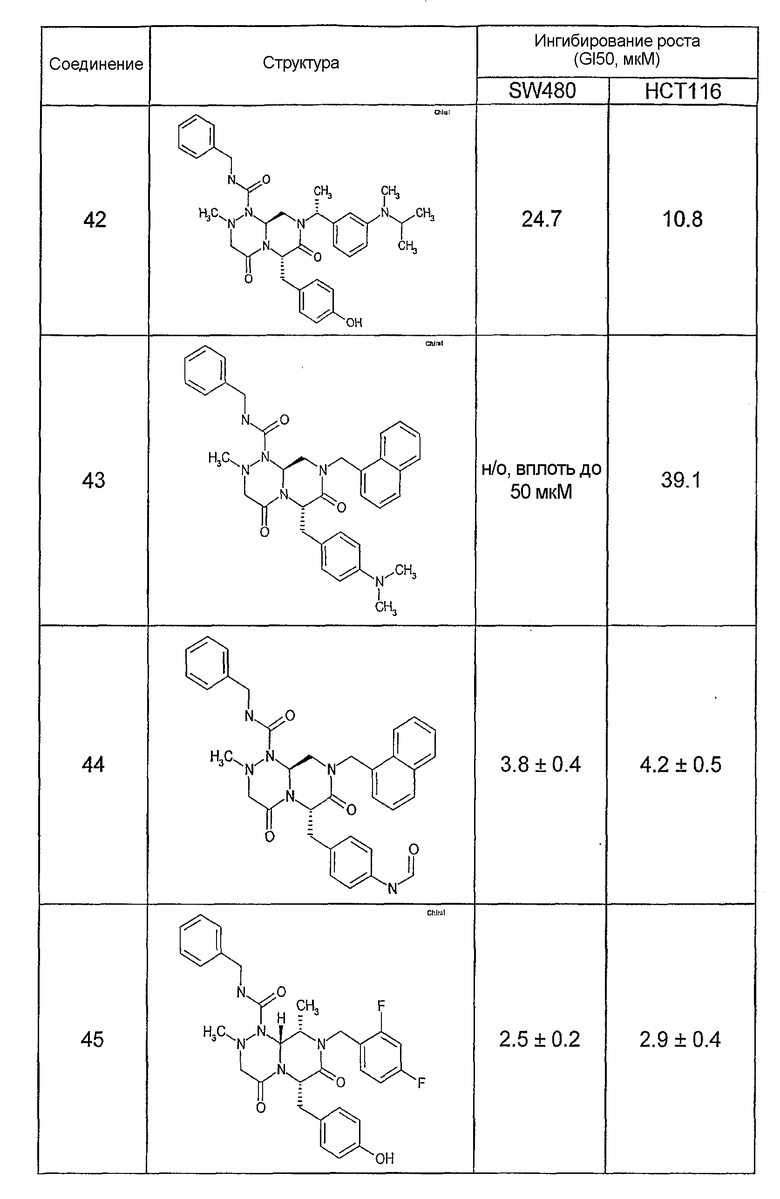
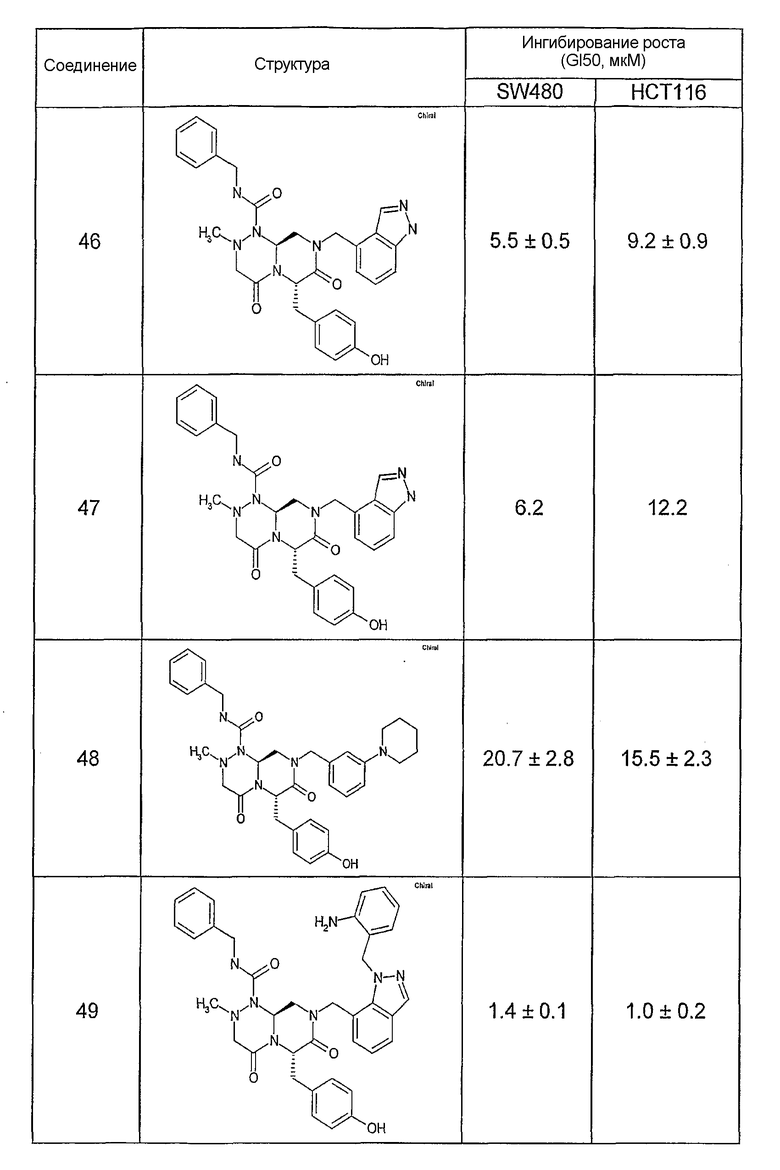
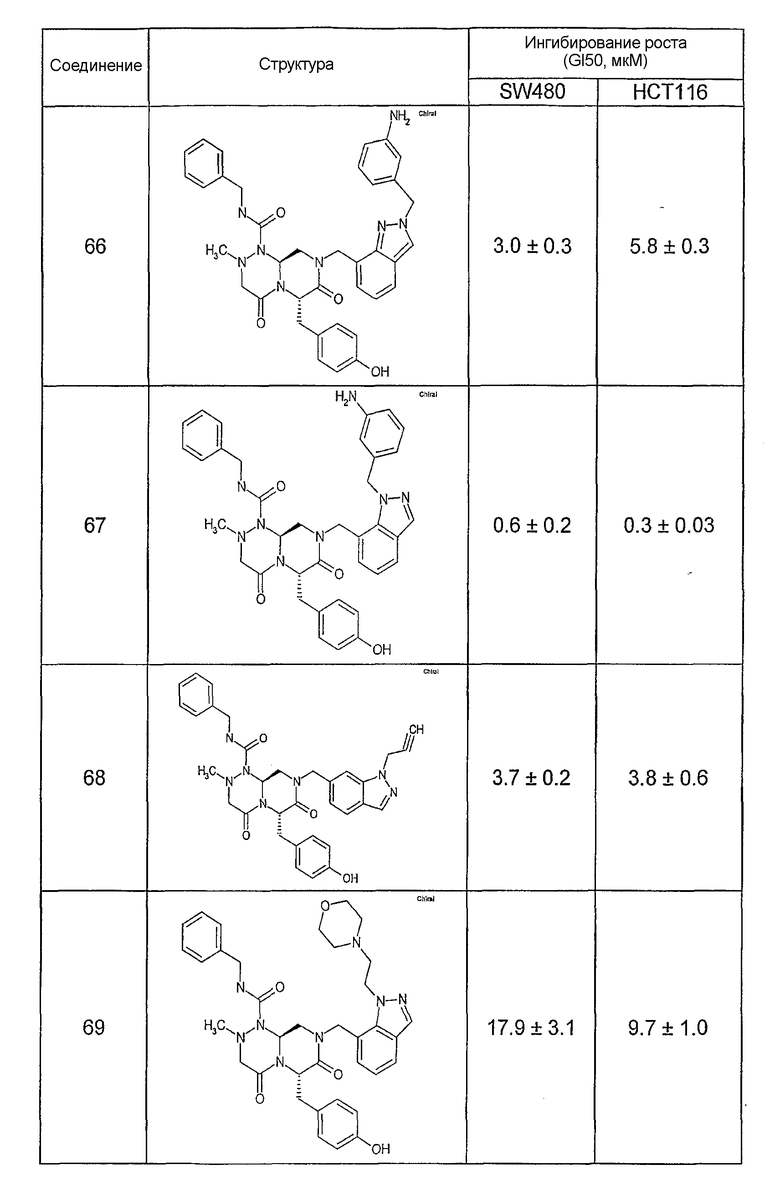
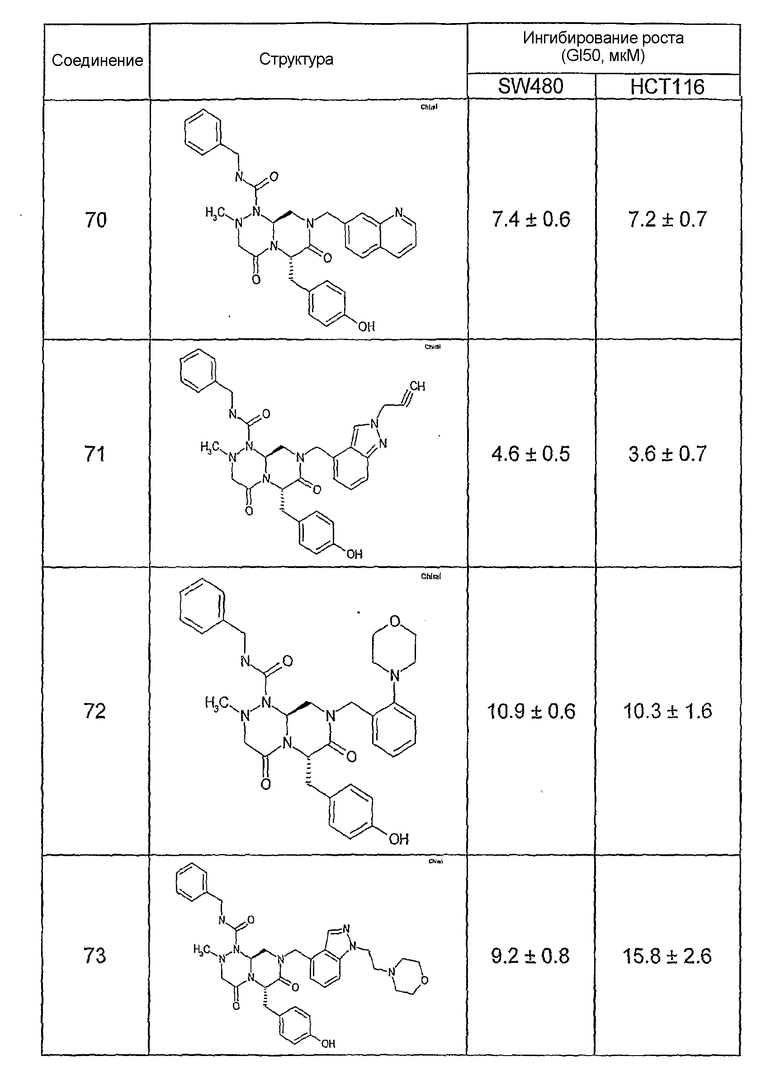
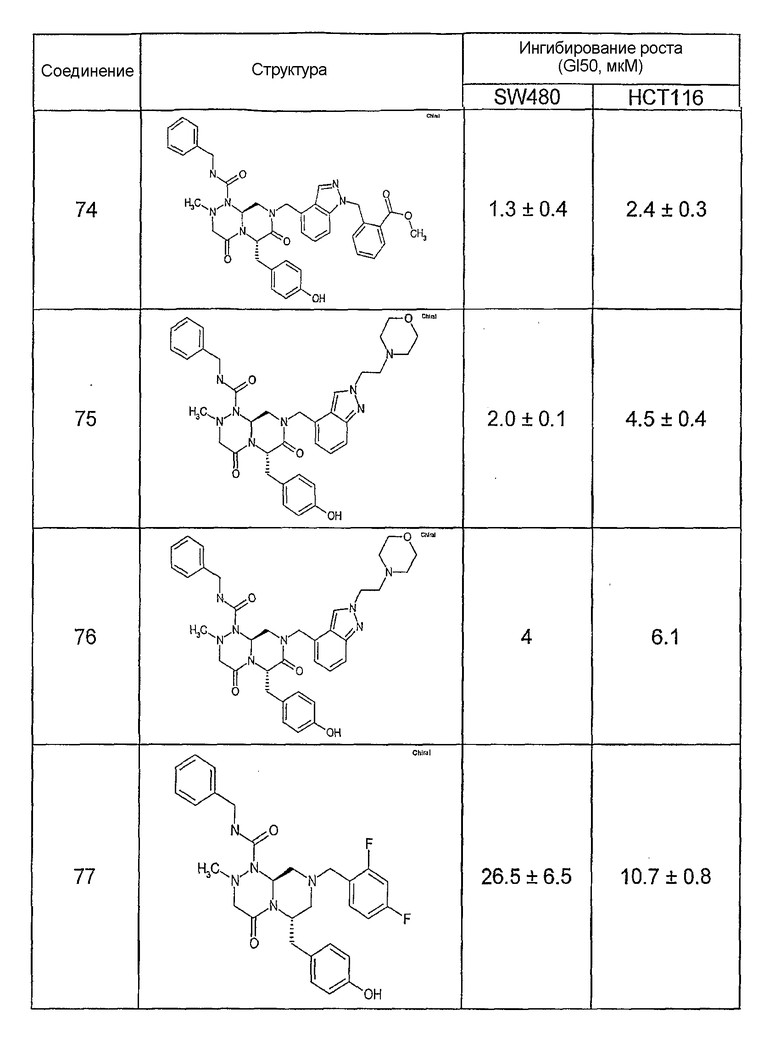
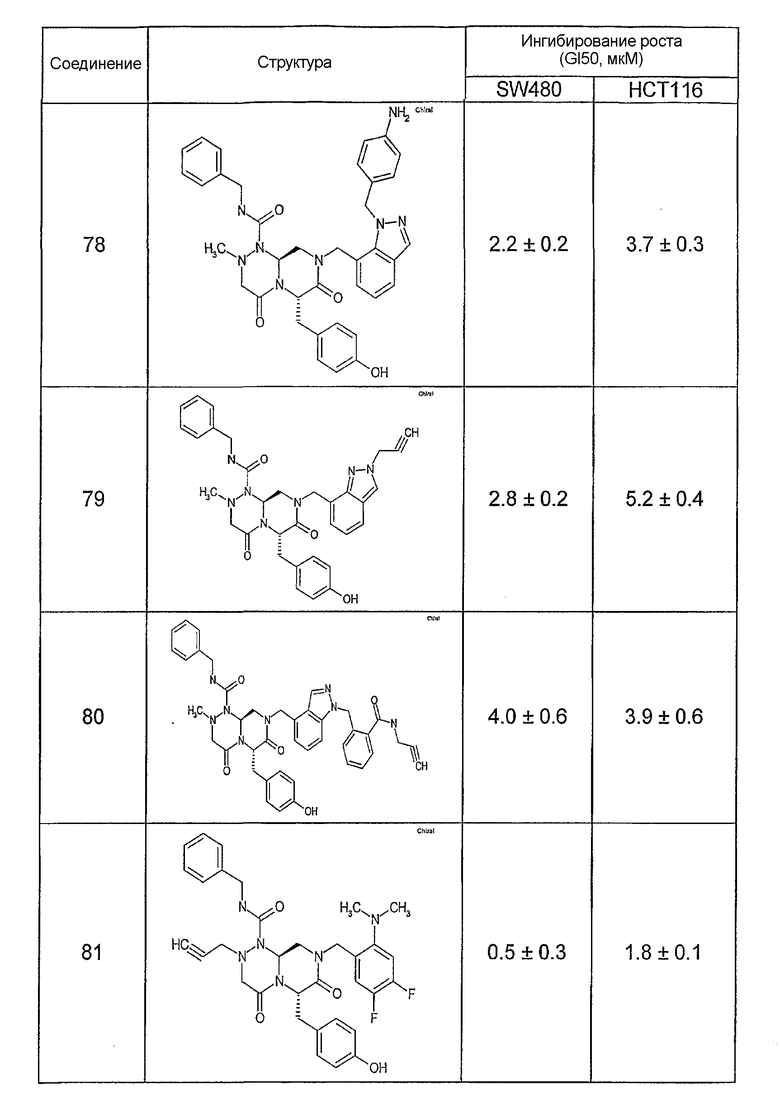
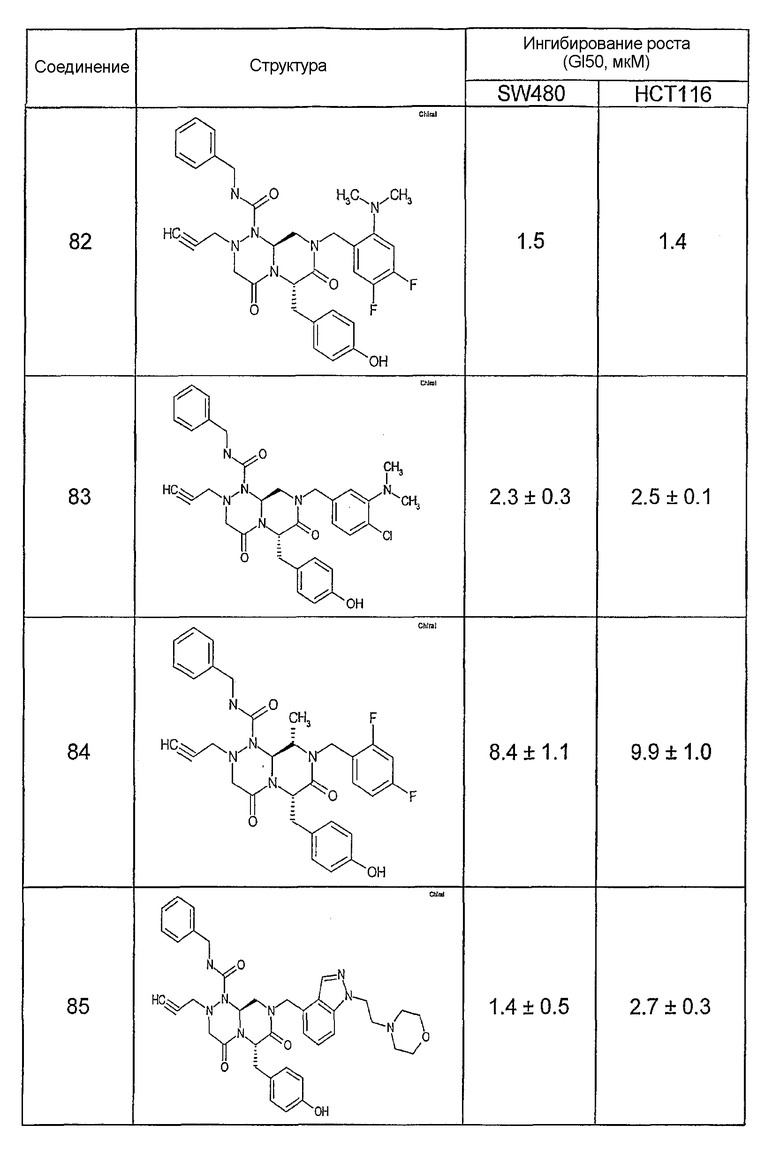
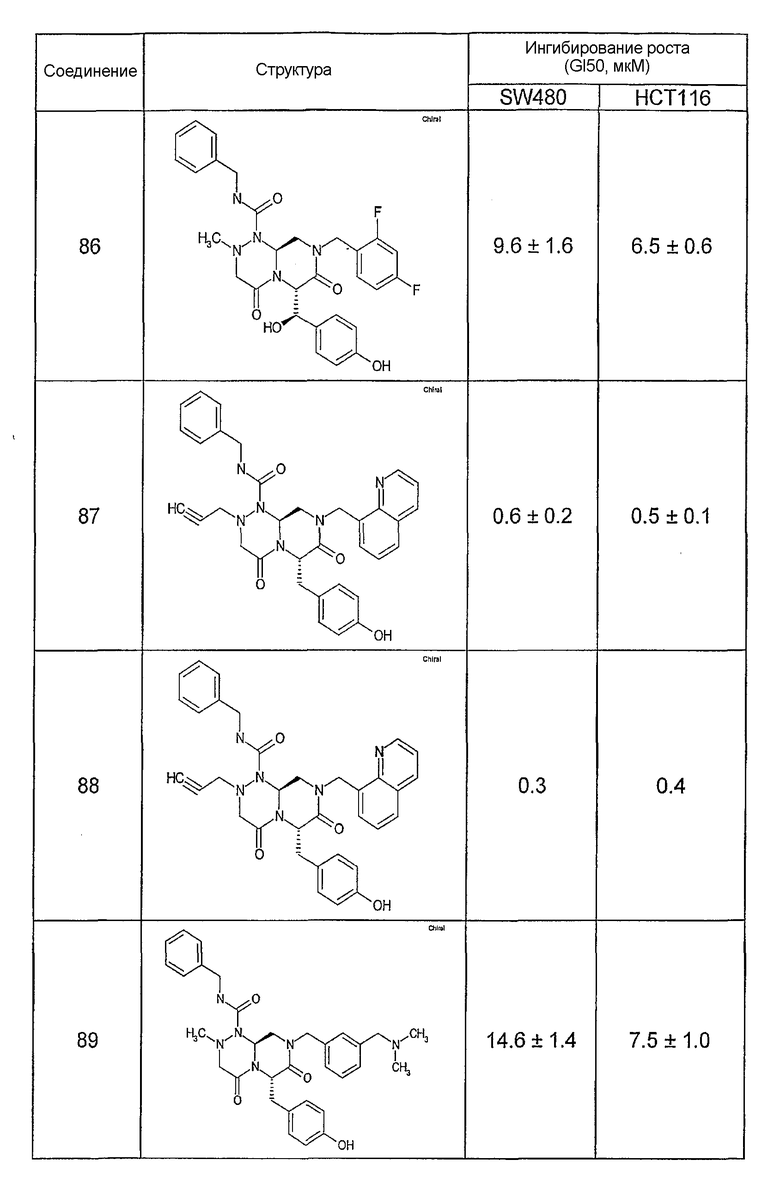
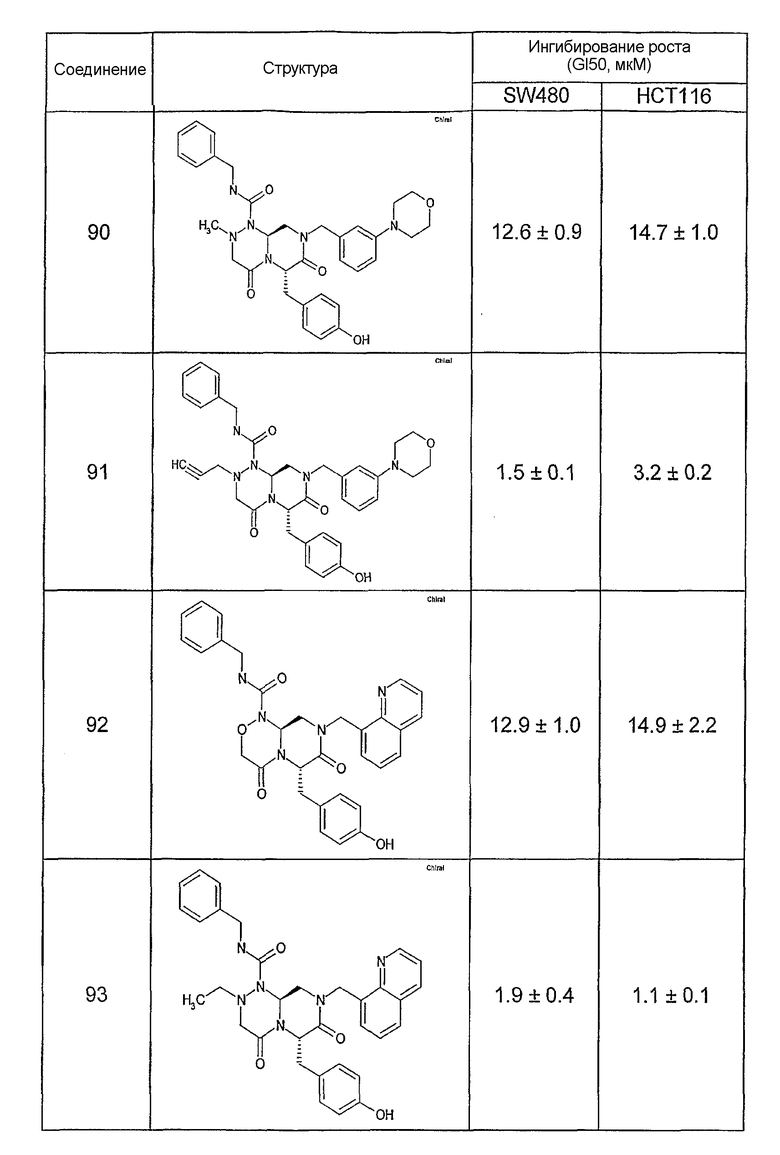
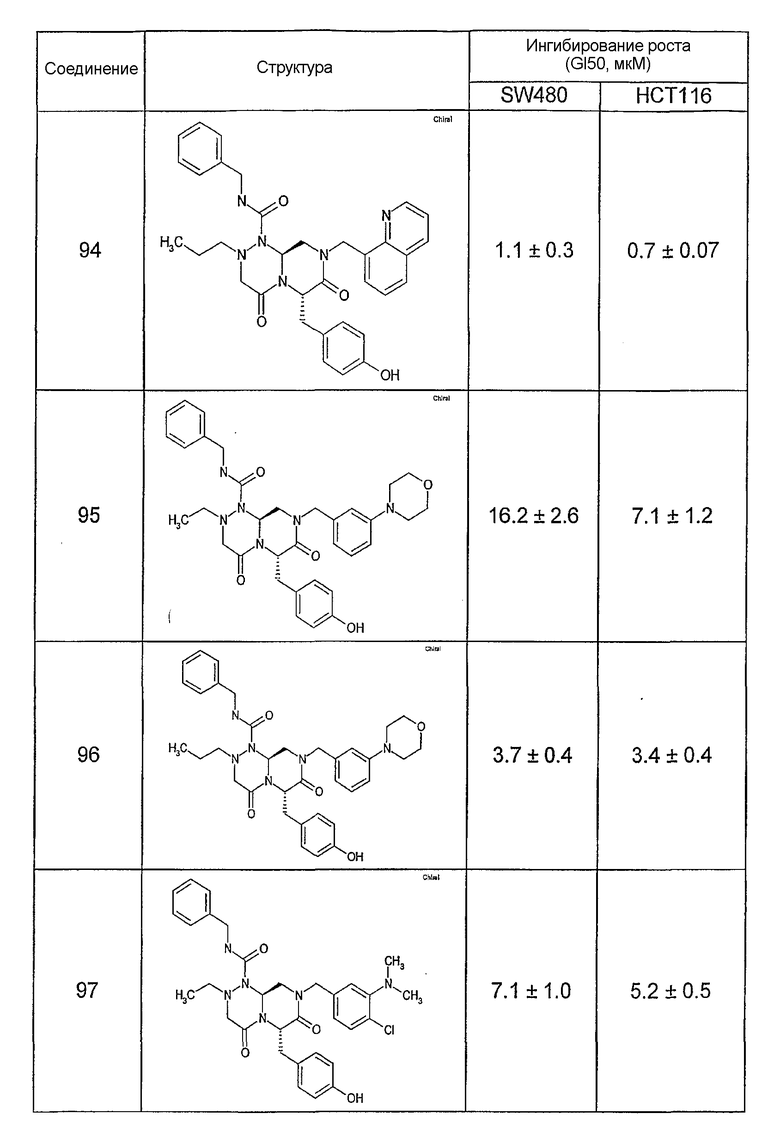
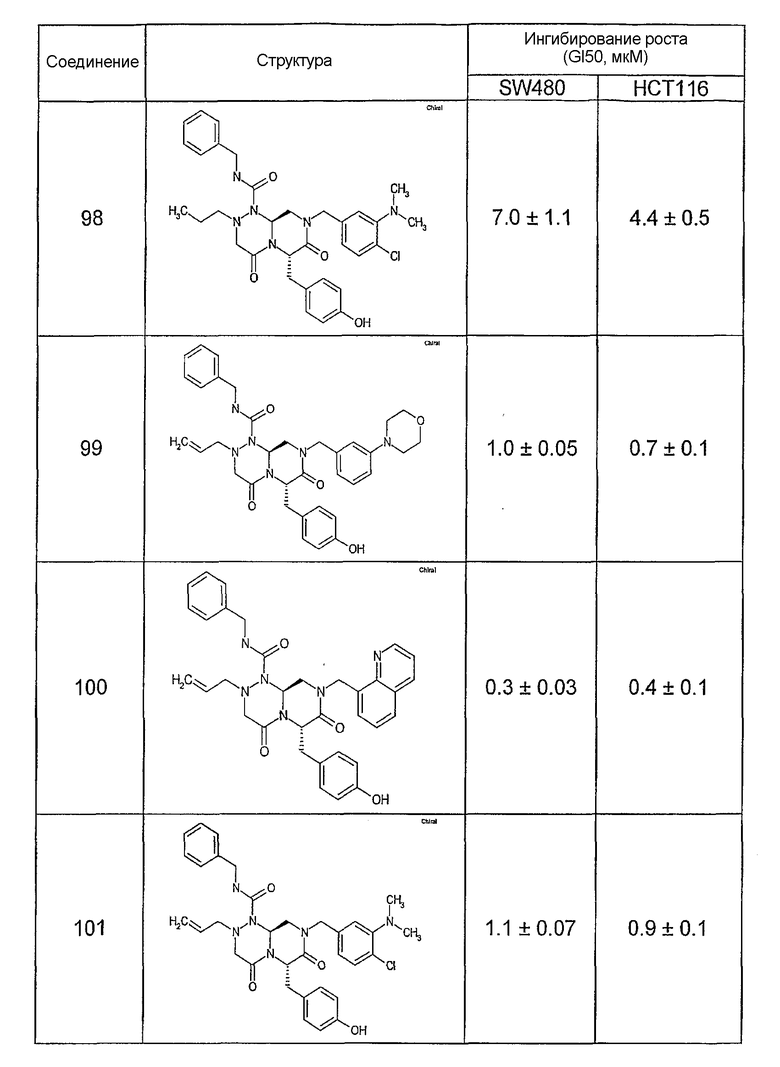
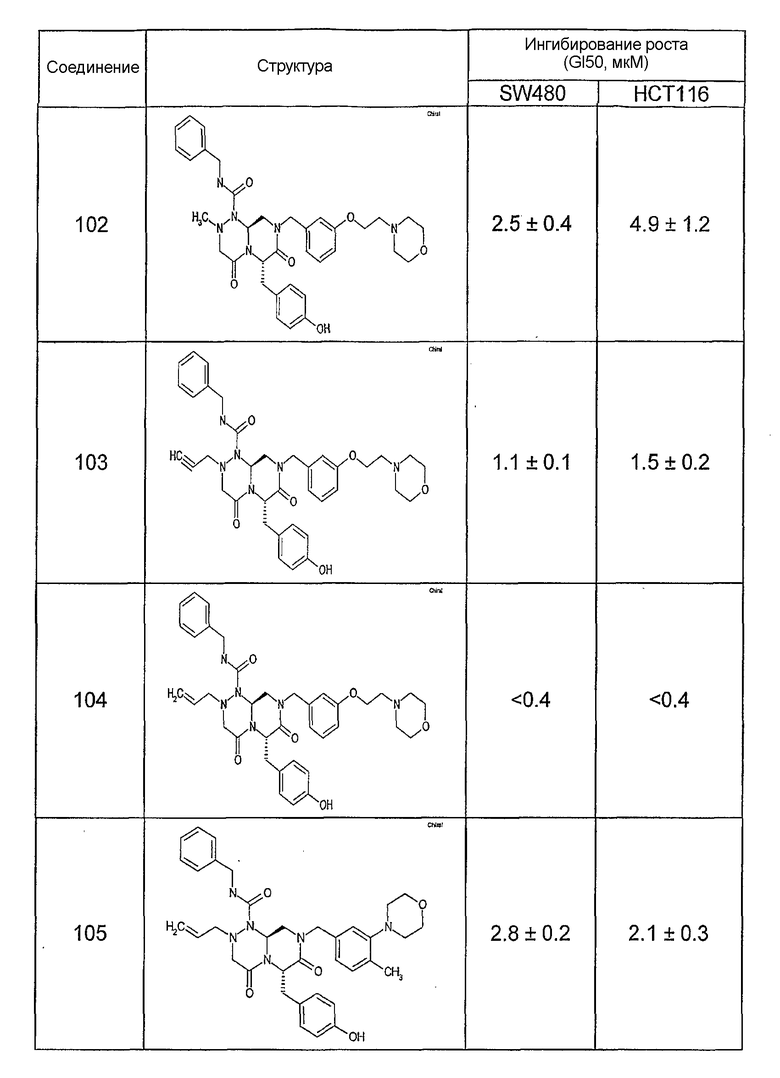
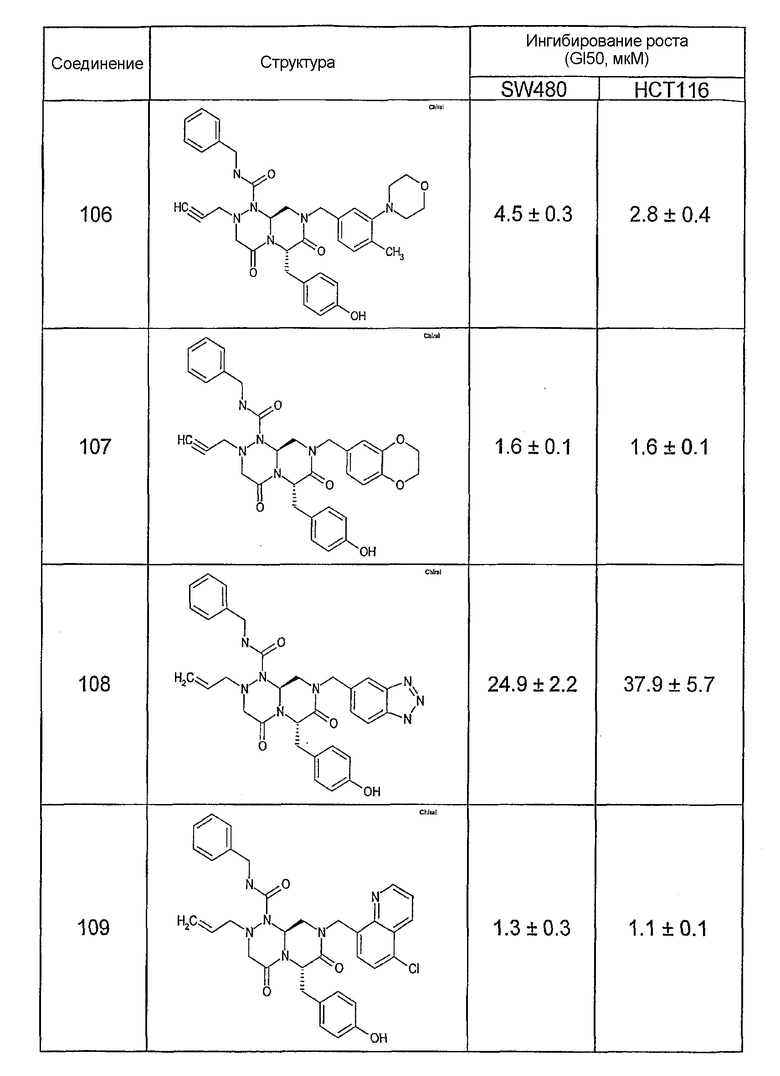
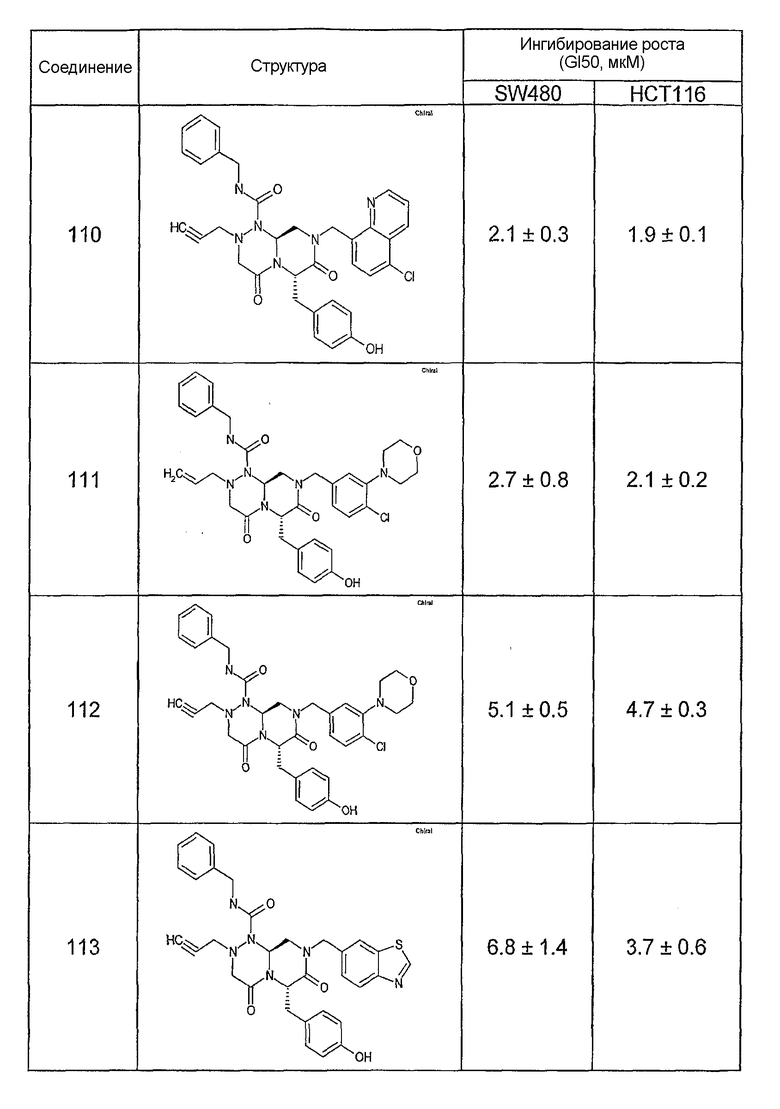
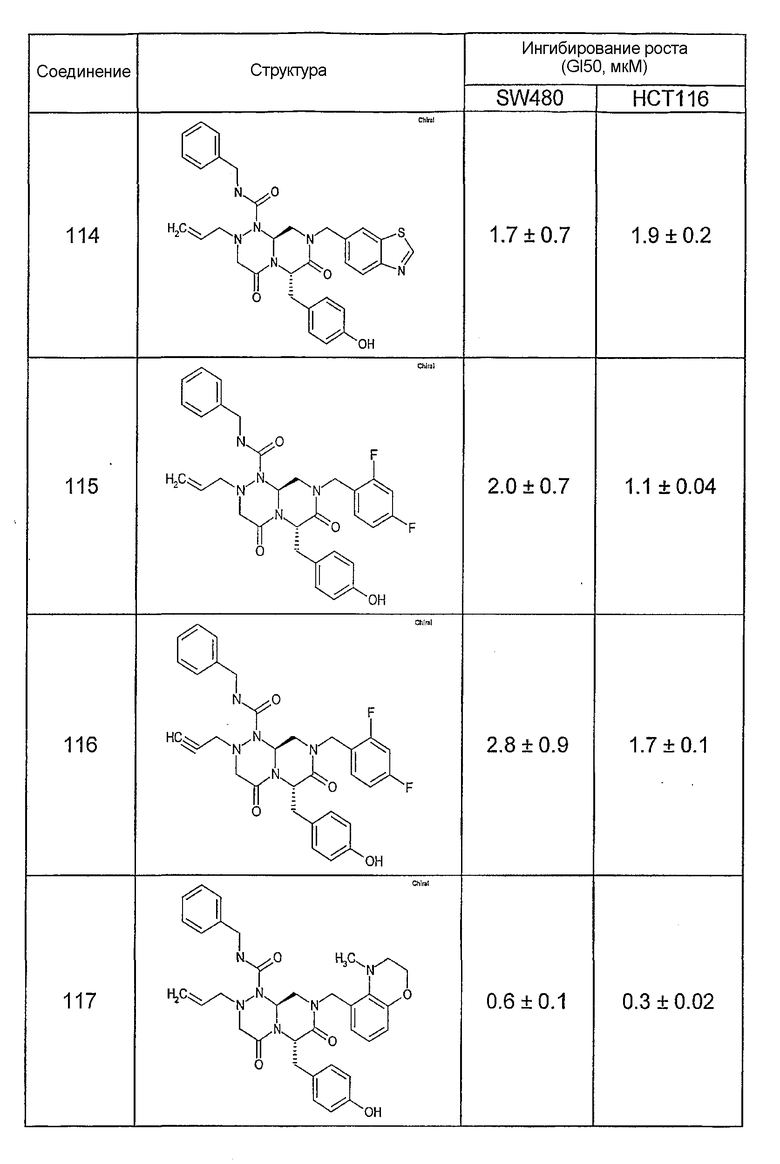
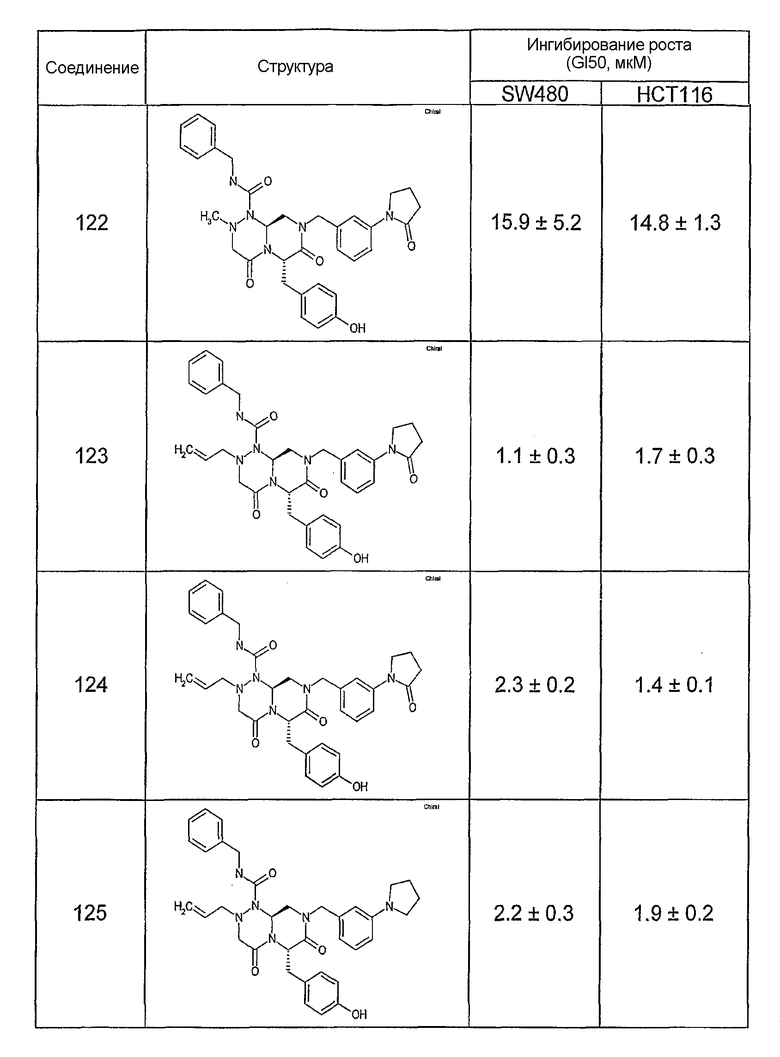
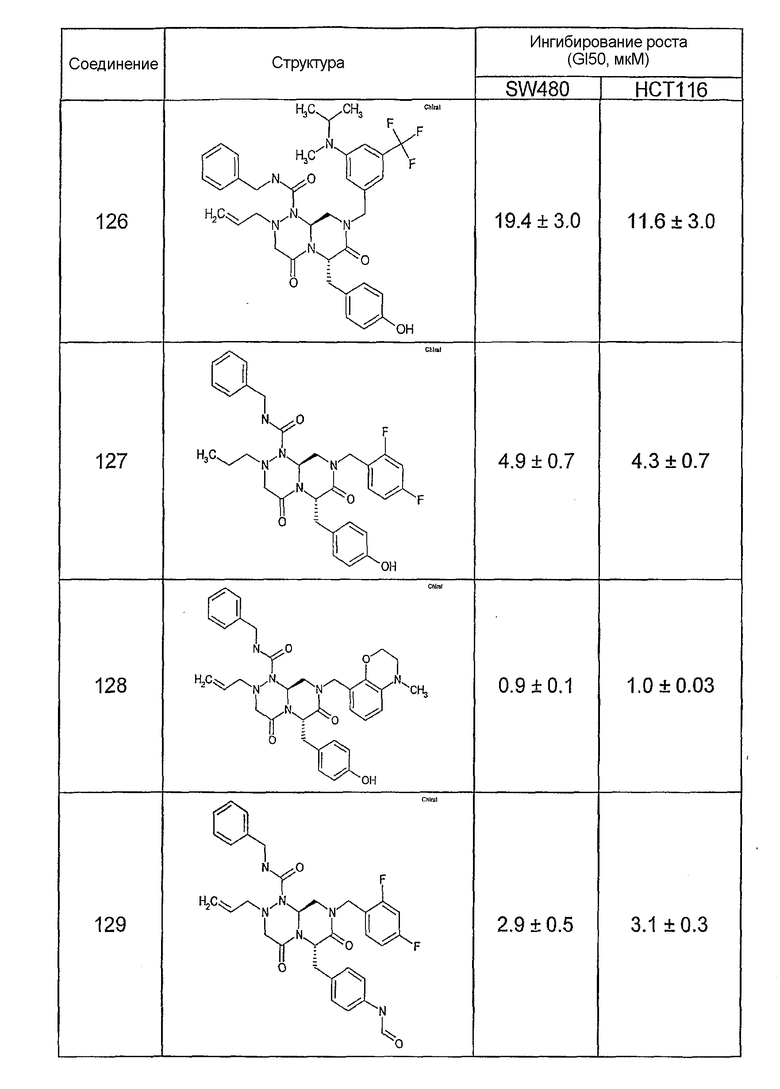
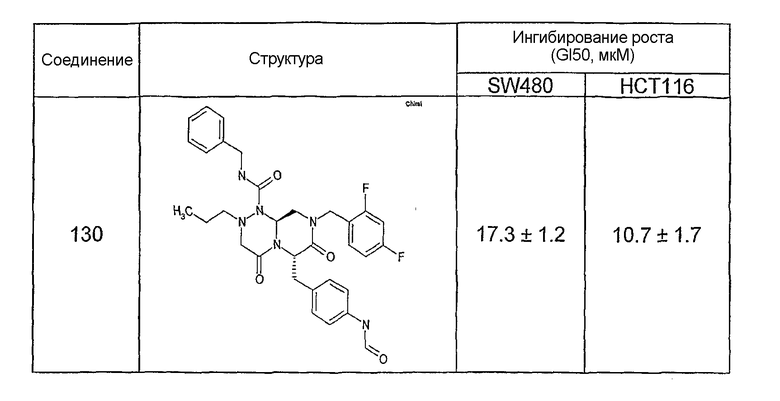
Ниже в таблице 4 показаны соединения, выбранные по результатам теста на биологическую активность из библиотеки по настоящему изобретению, а также соответствующие им значения IC50, которые измеряют в рамках теста на репортерный ген, описанный в примере 6.
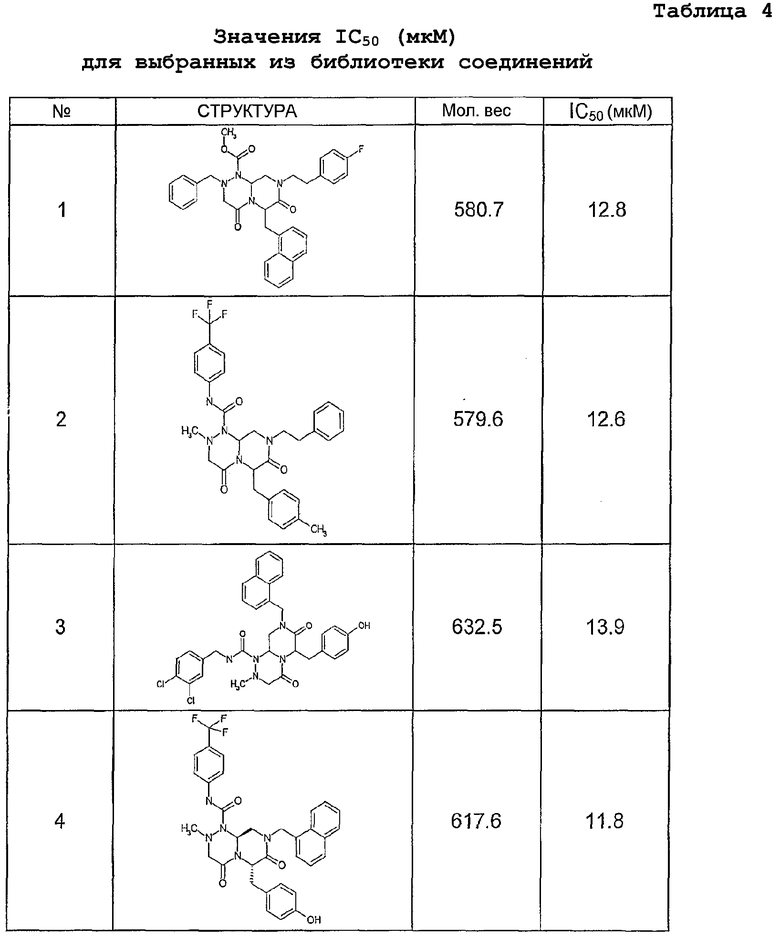
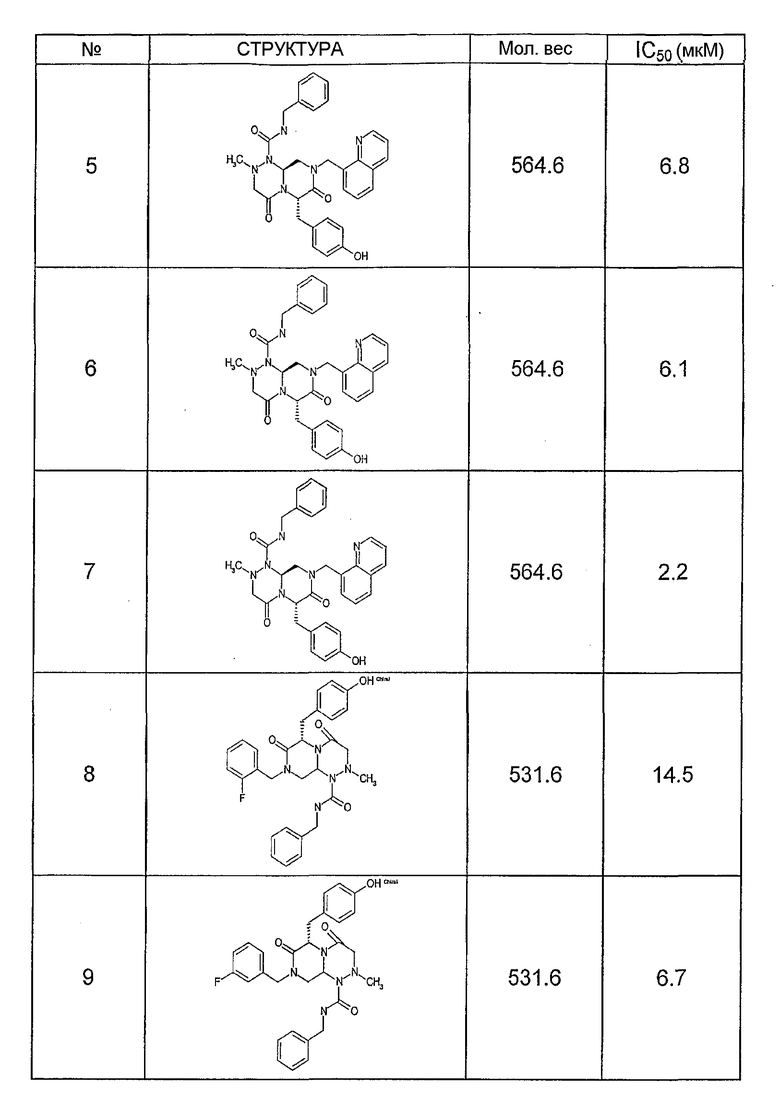
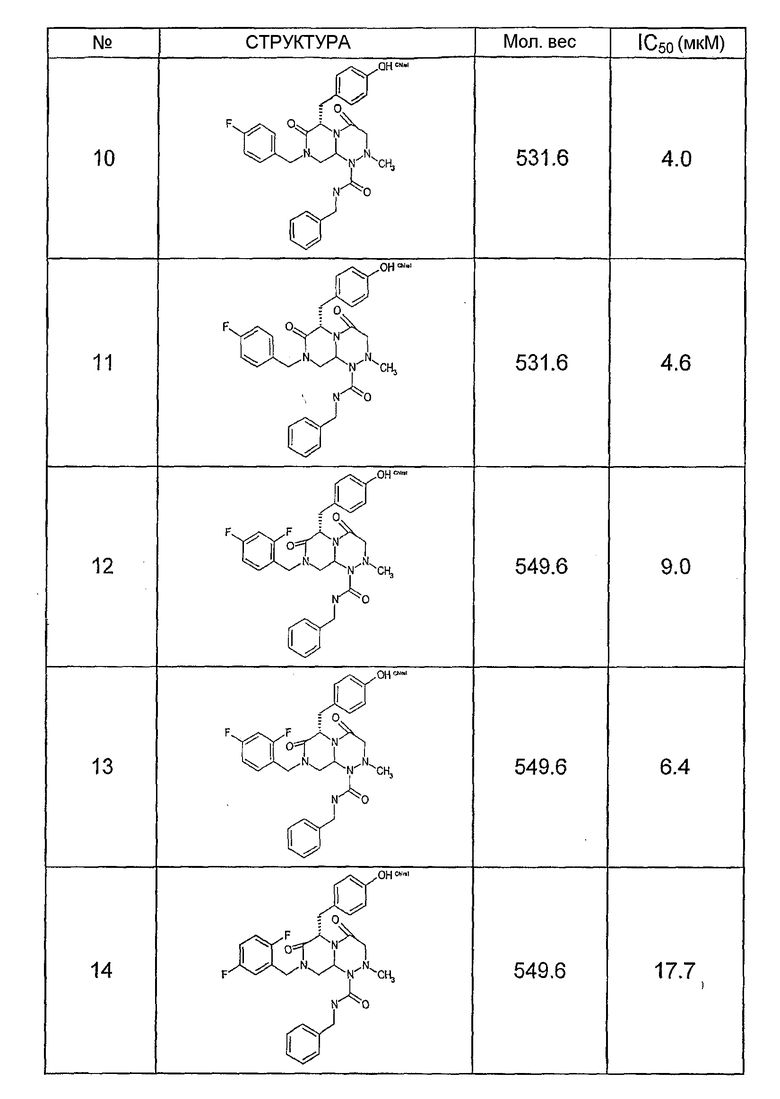
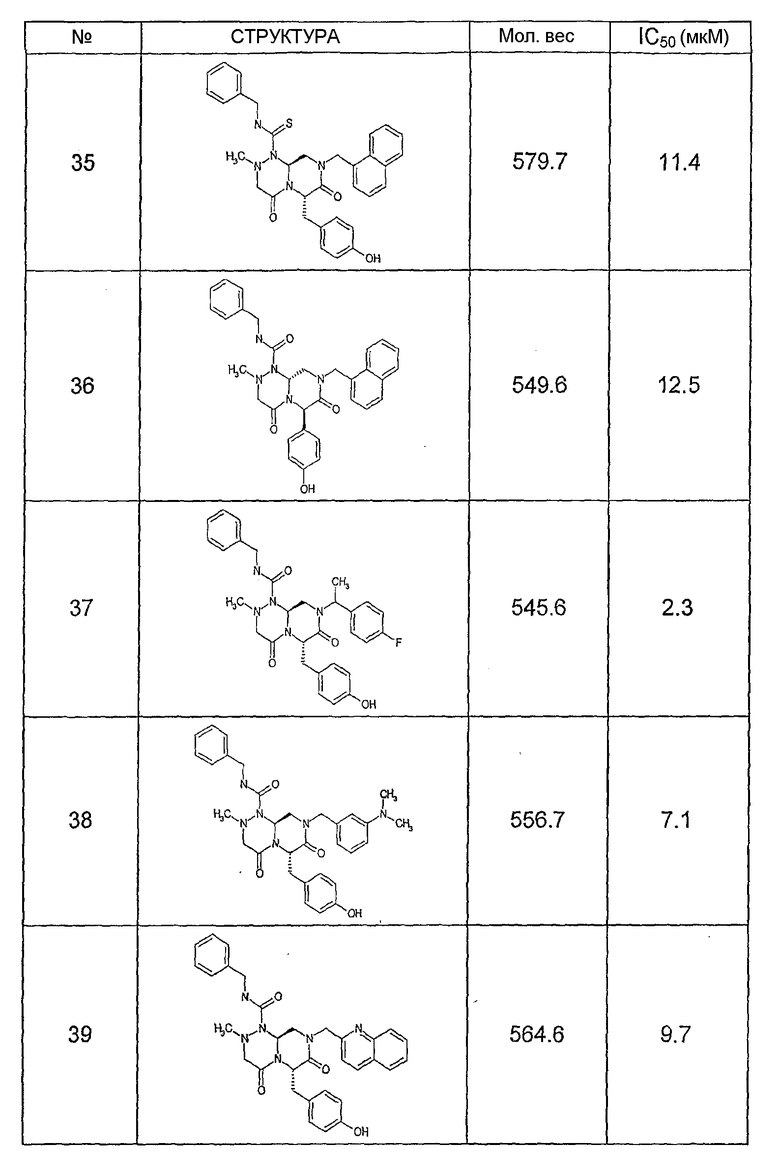
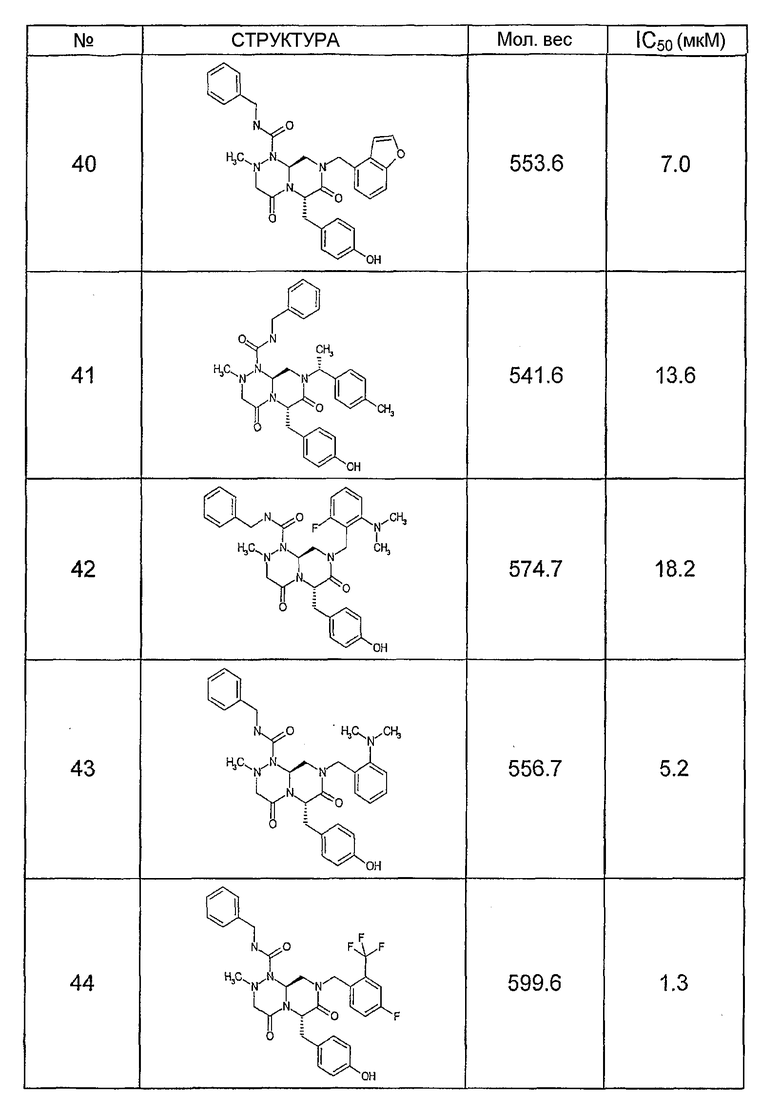
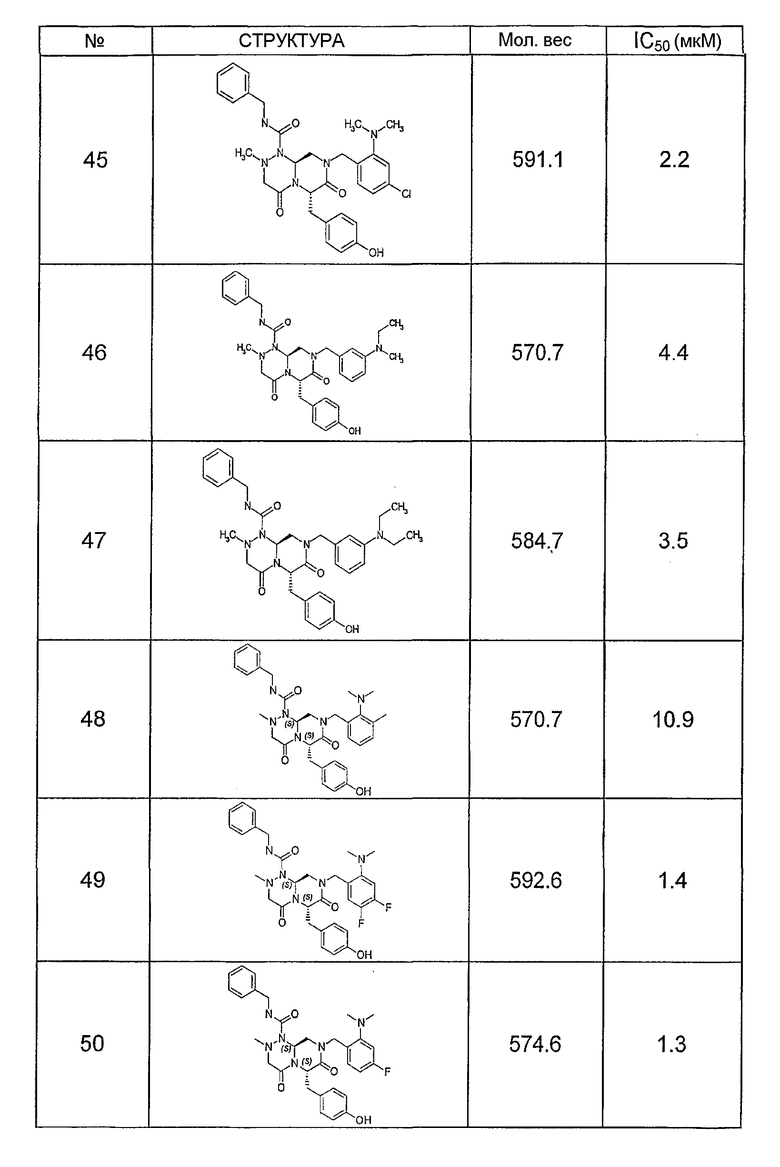
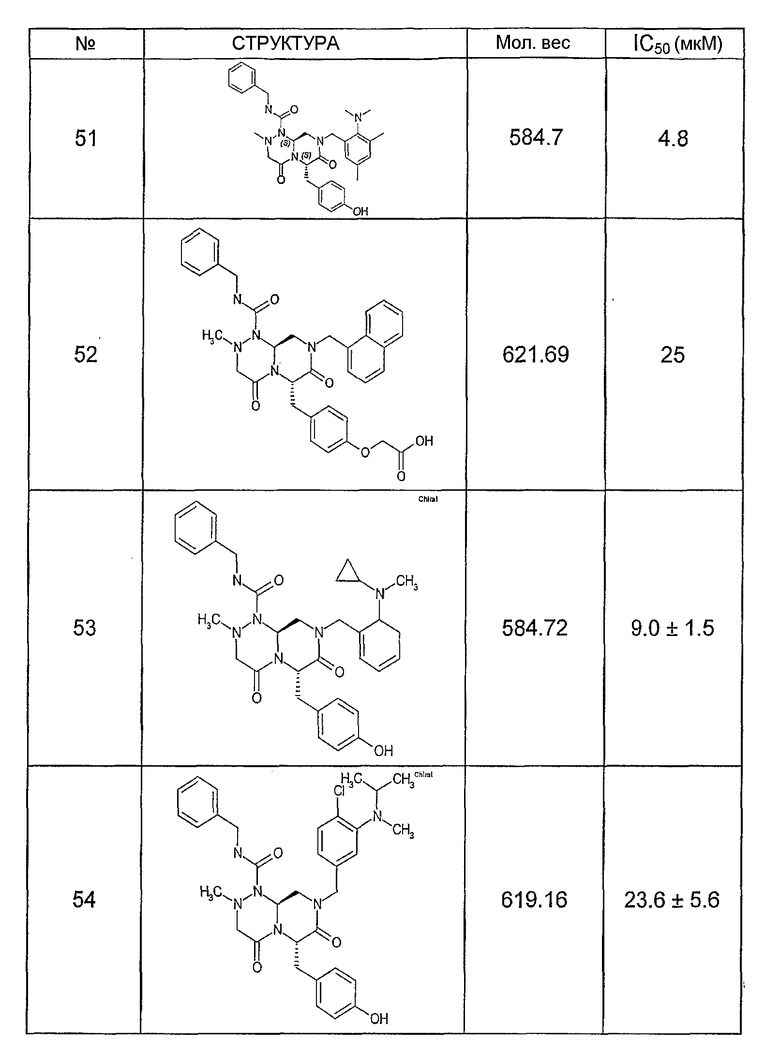
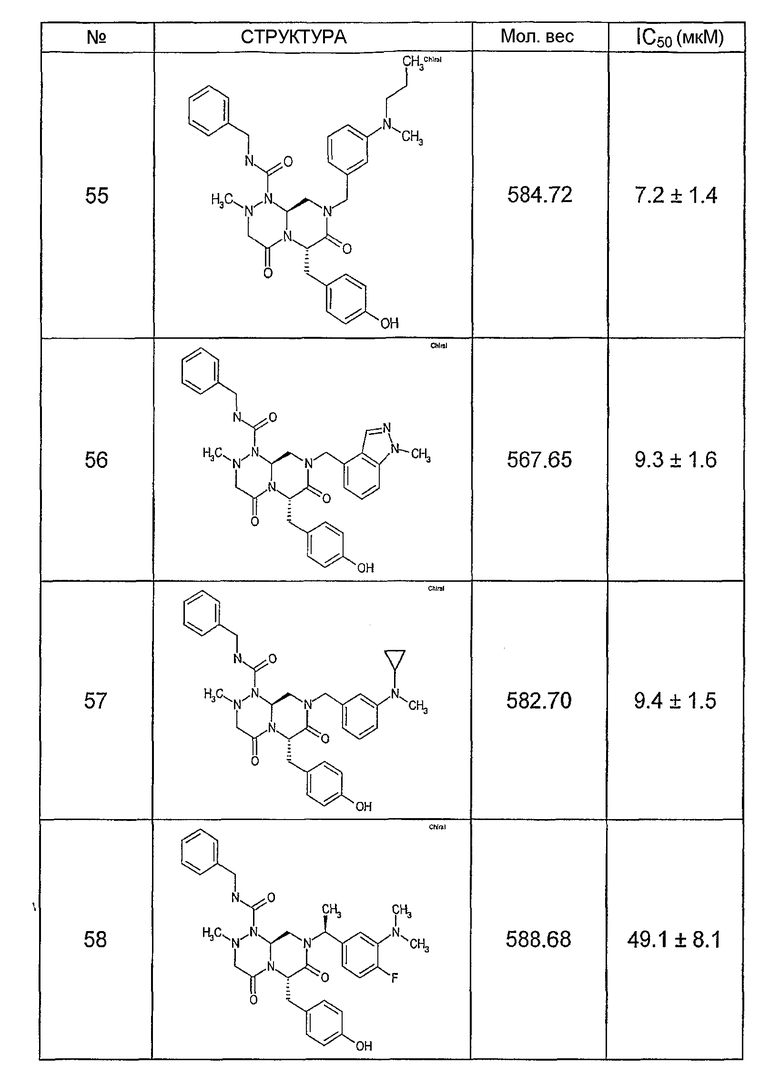

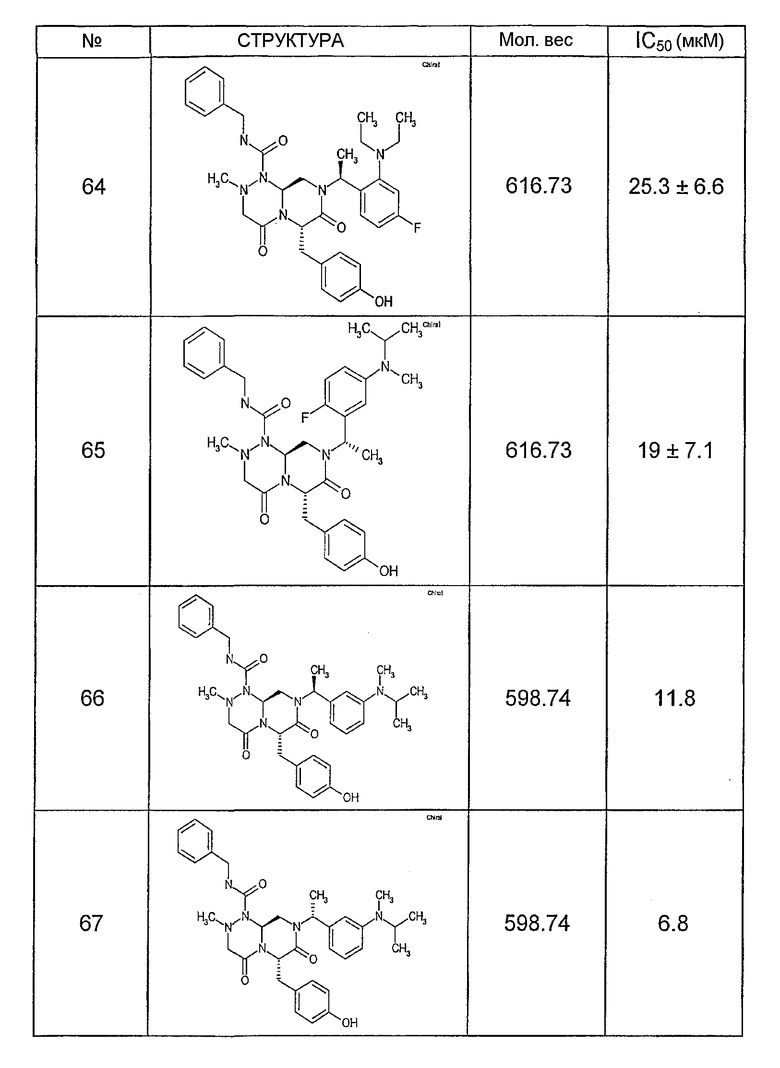
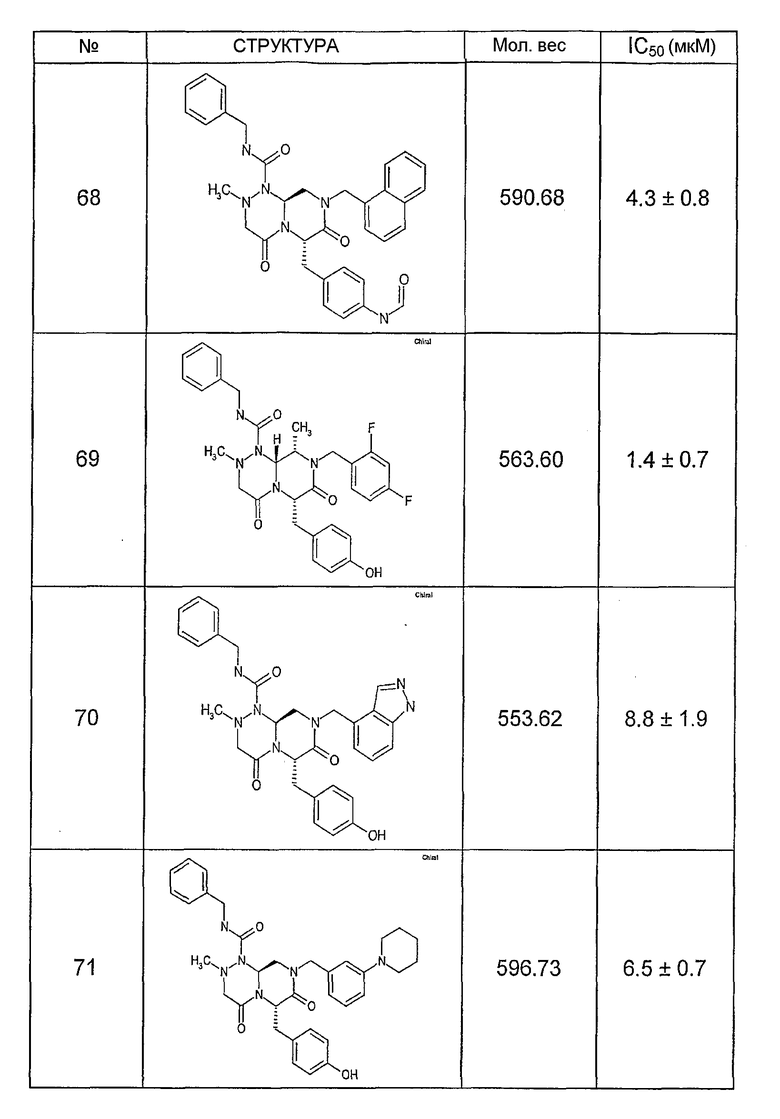
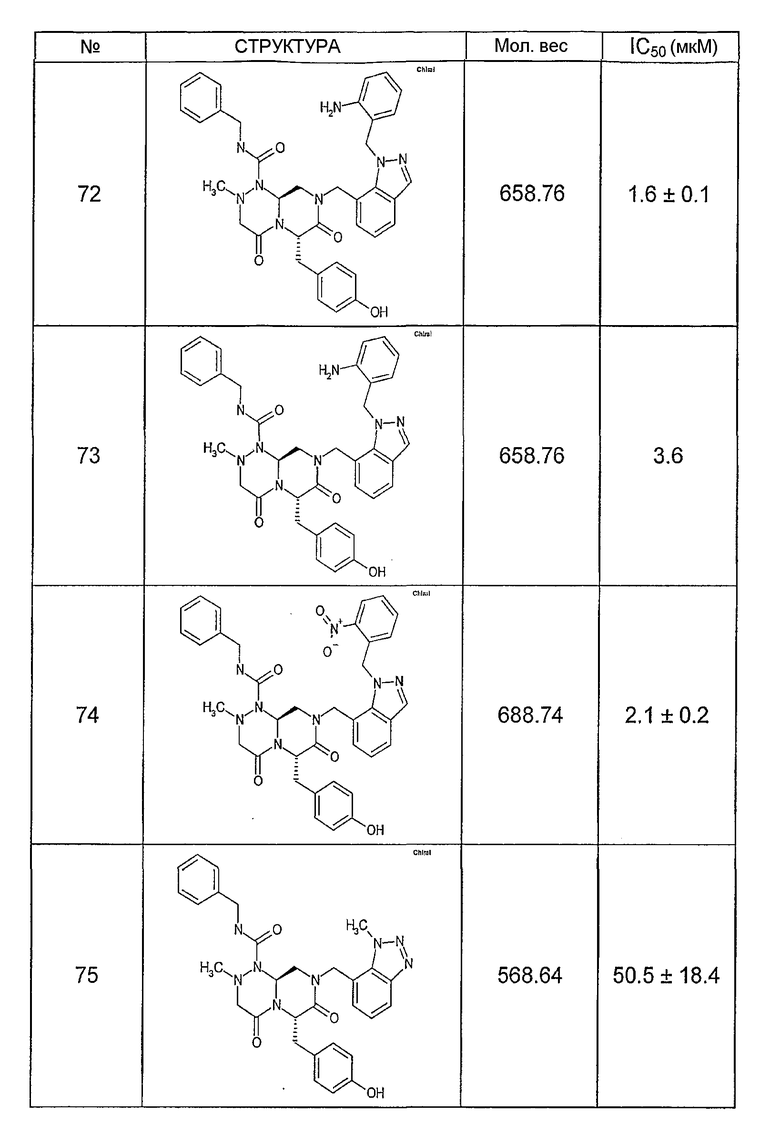
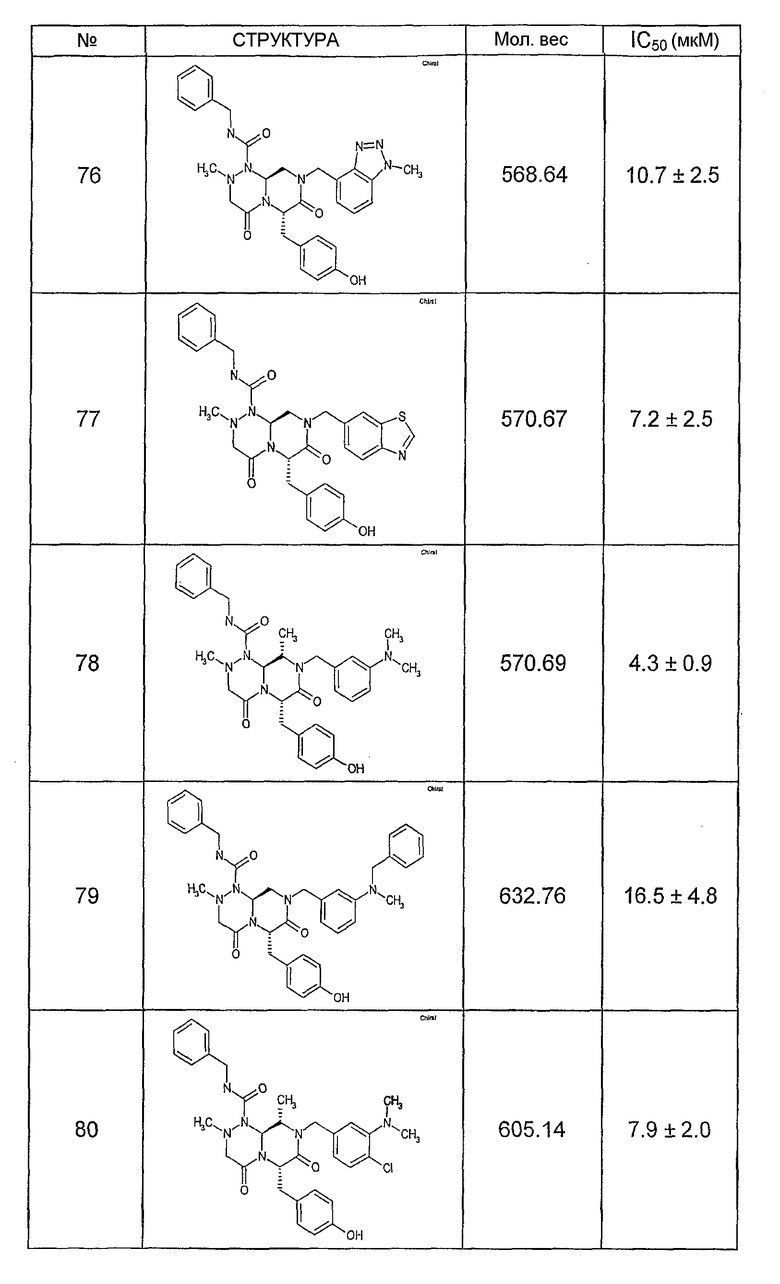
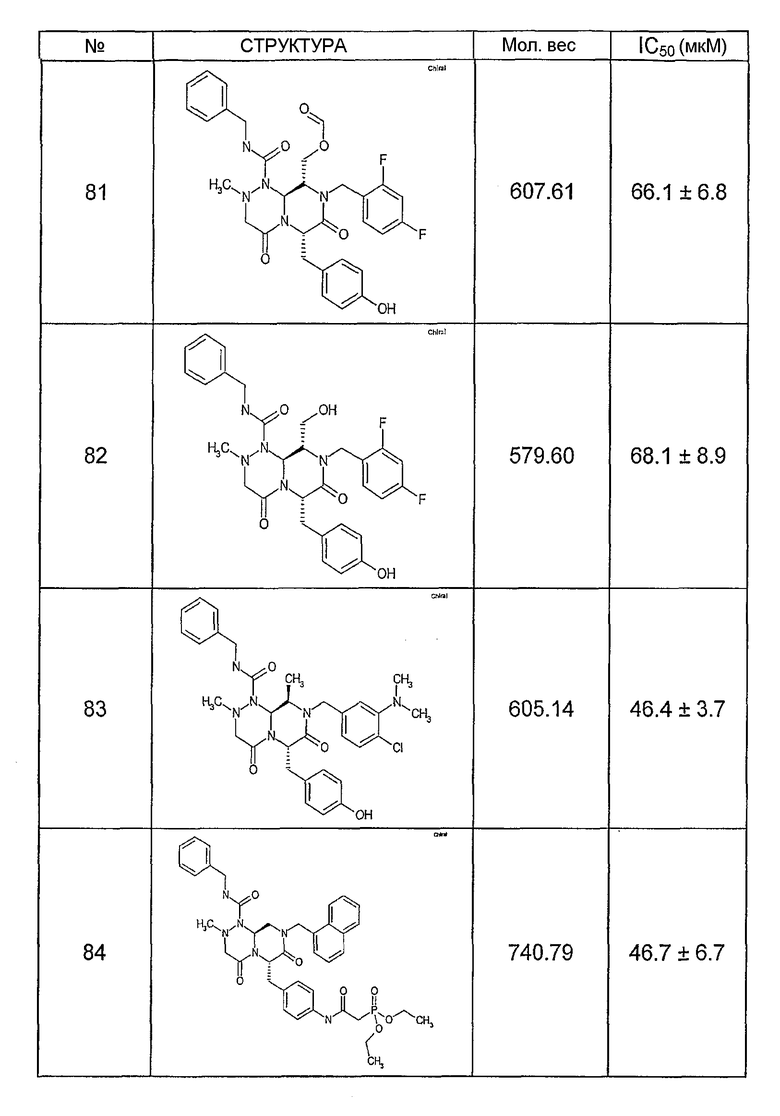
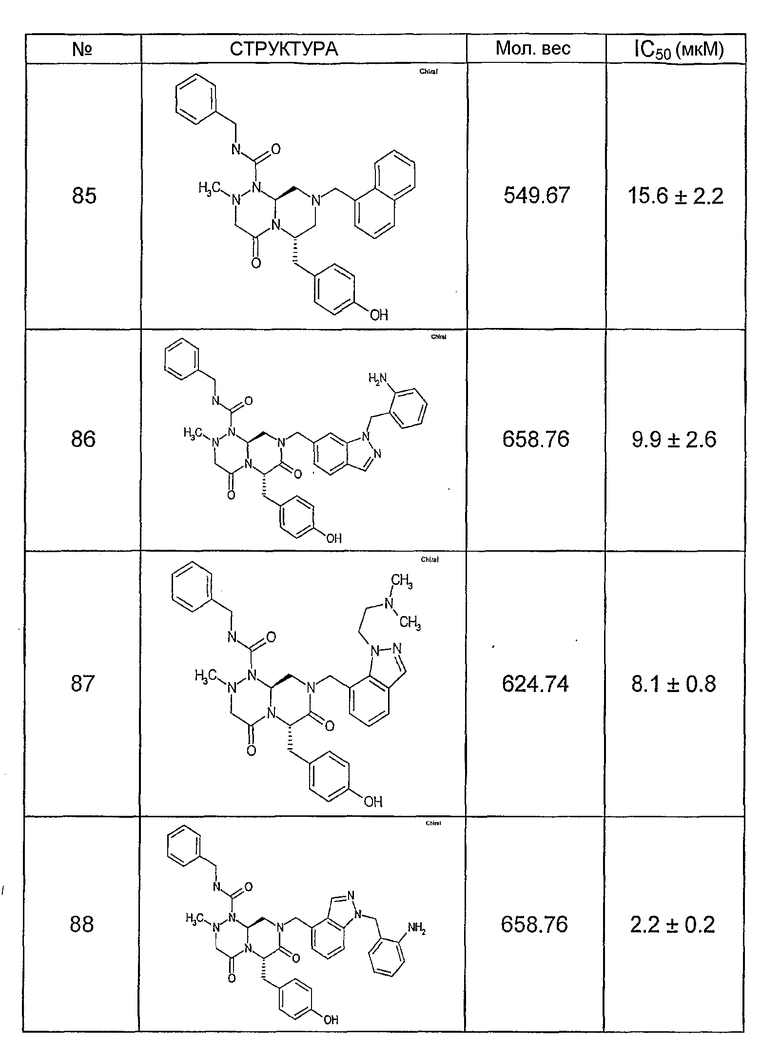
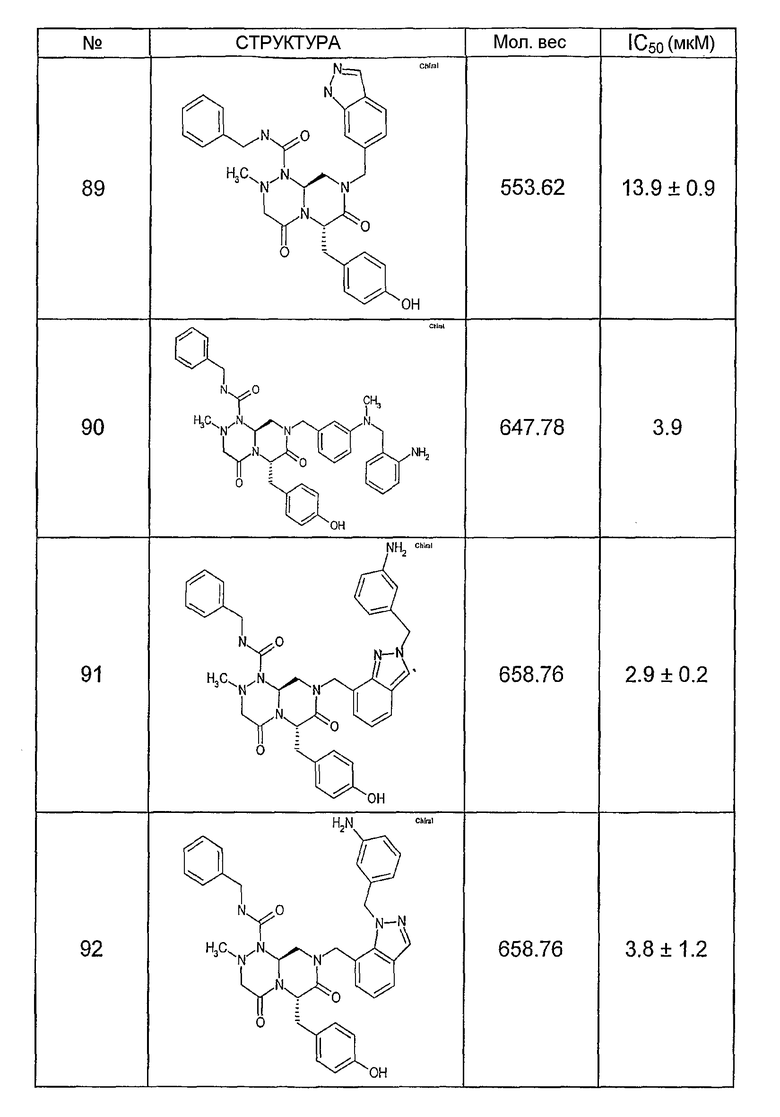
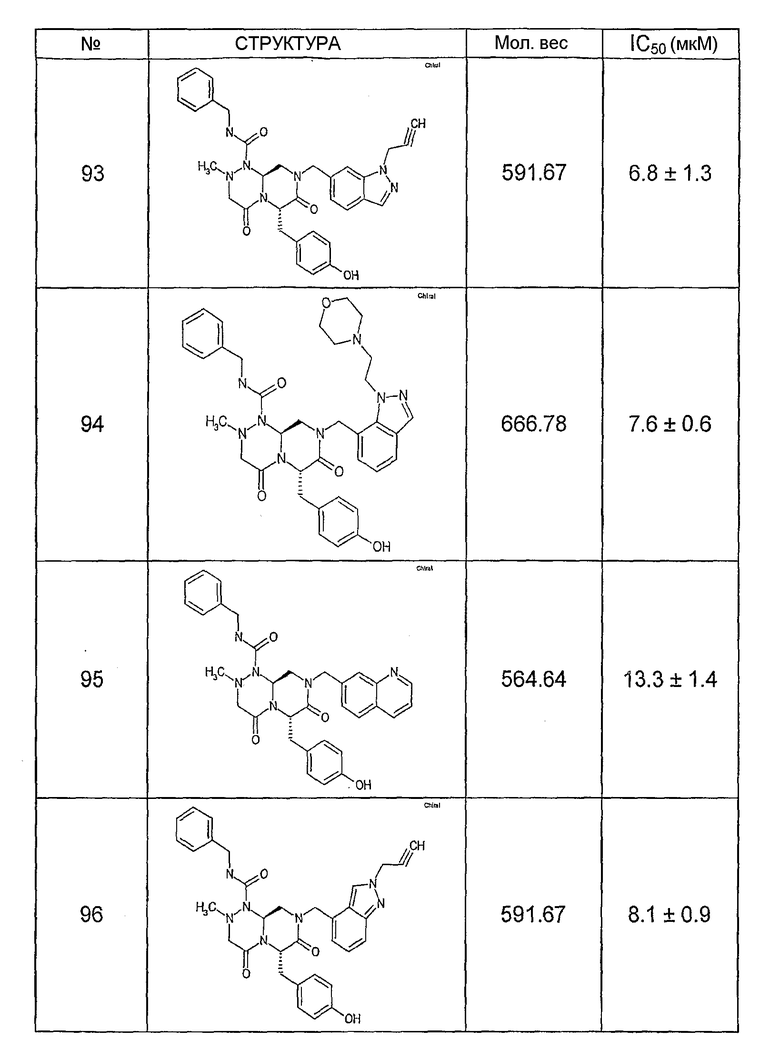
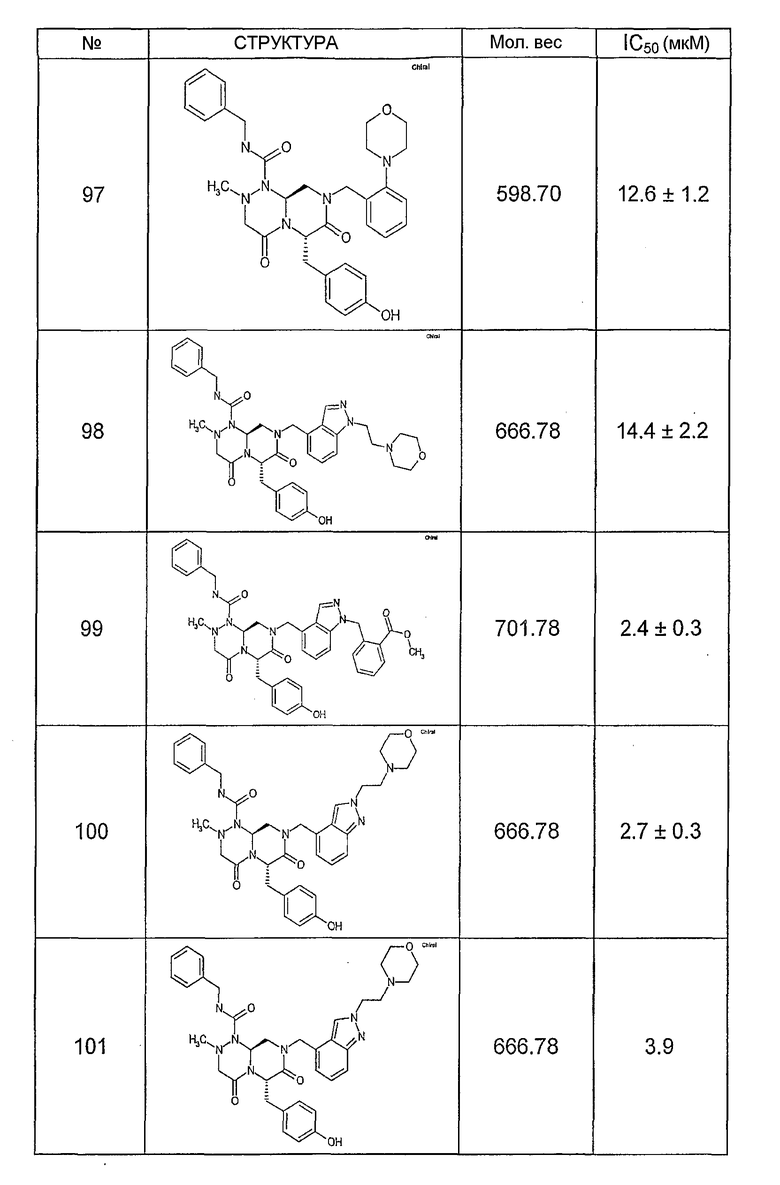
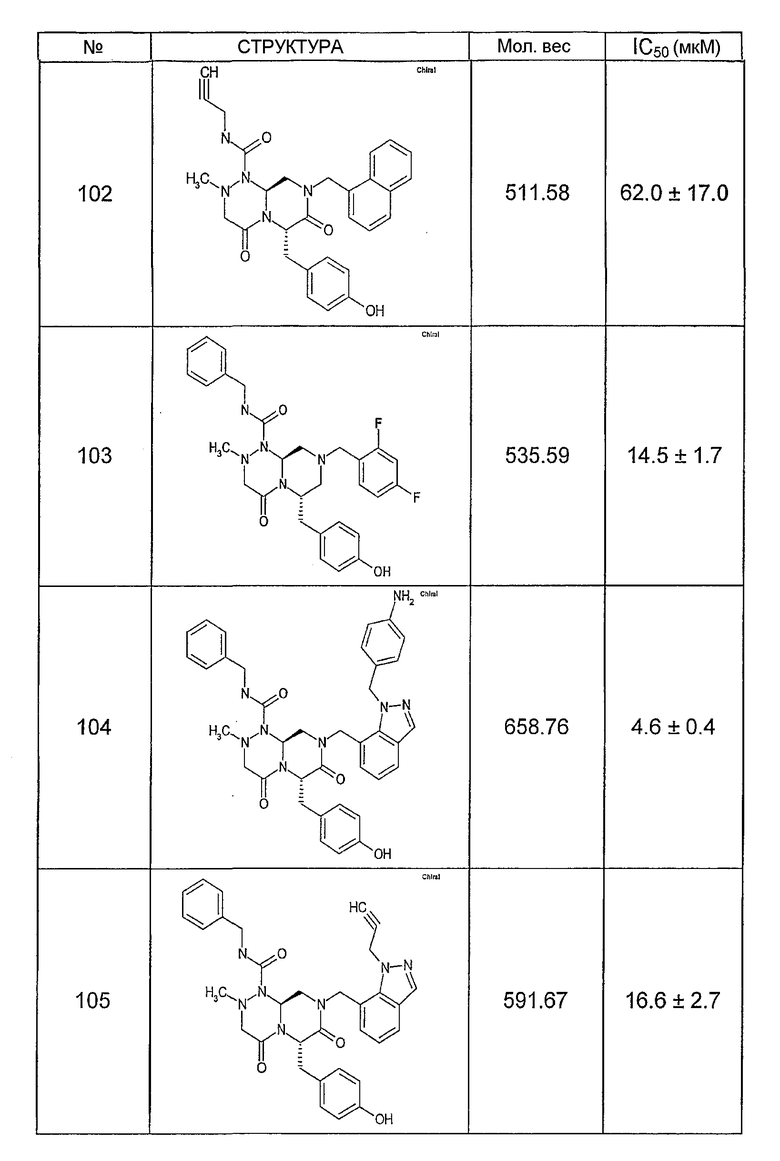
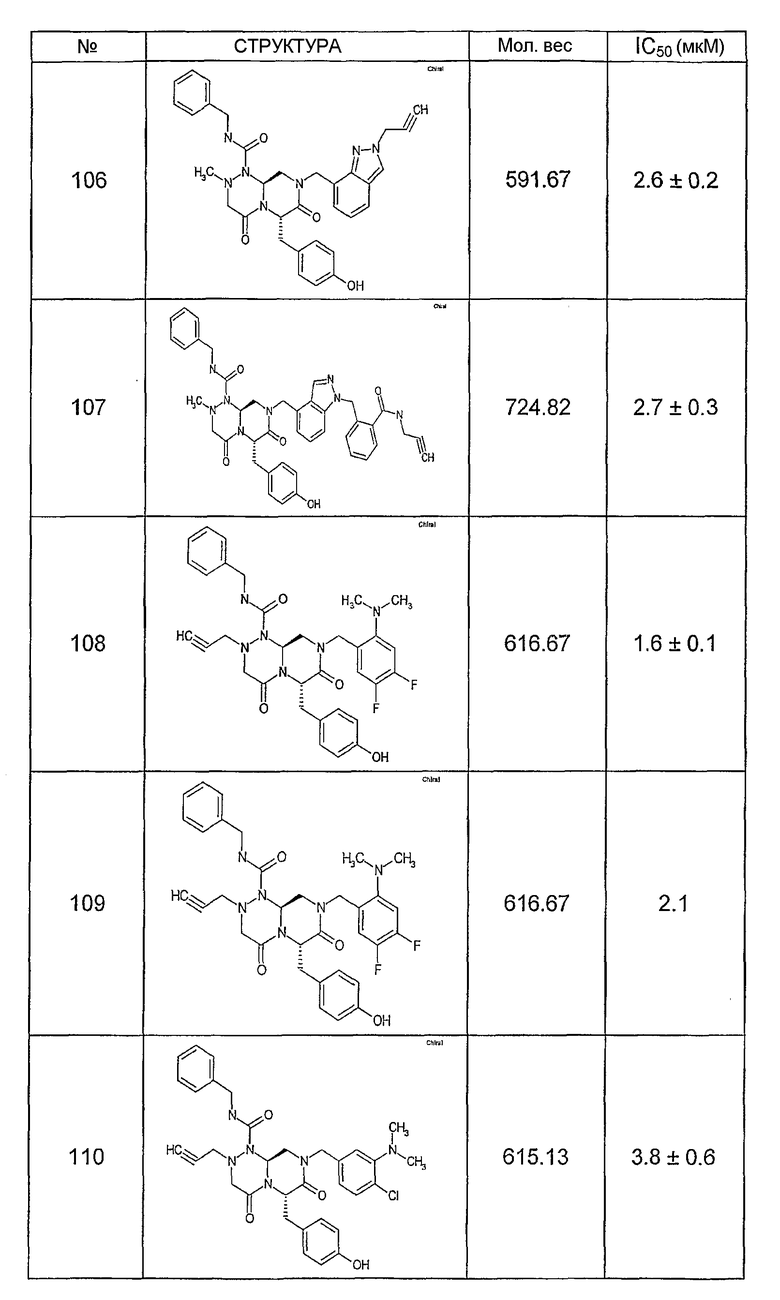
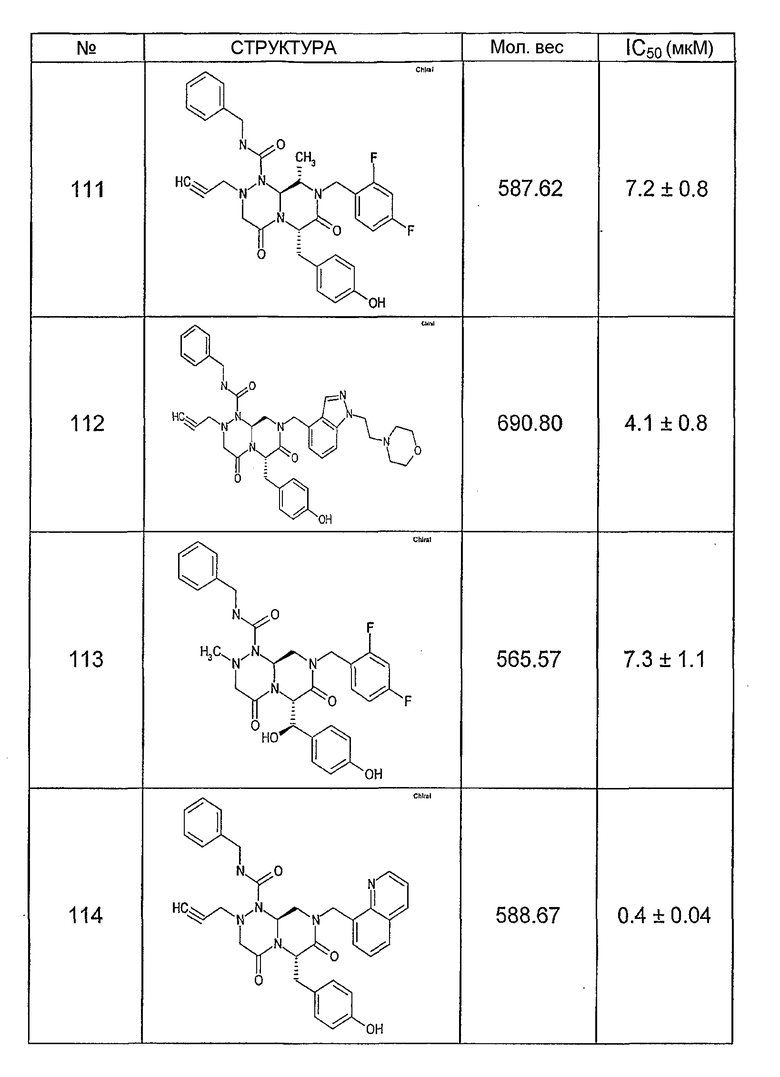
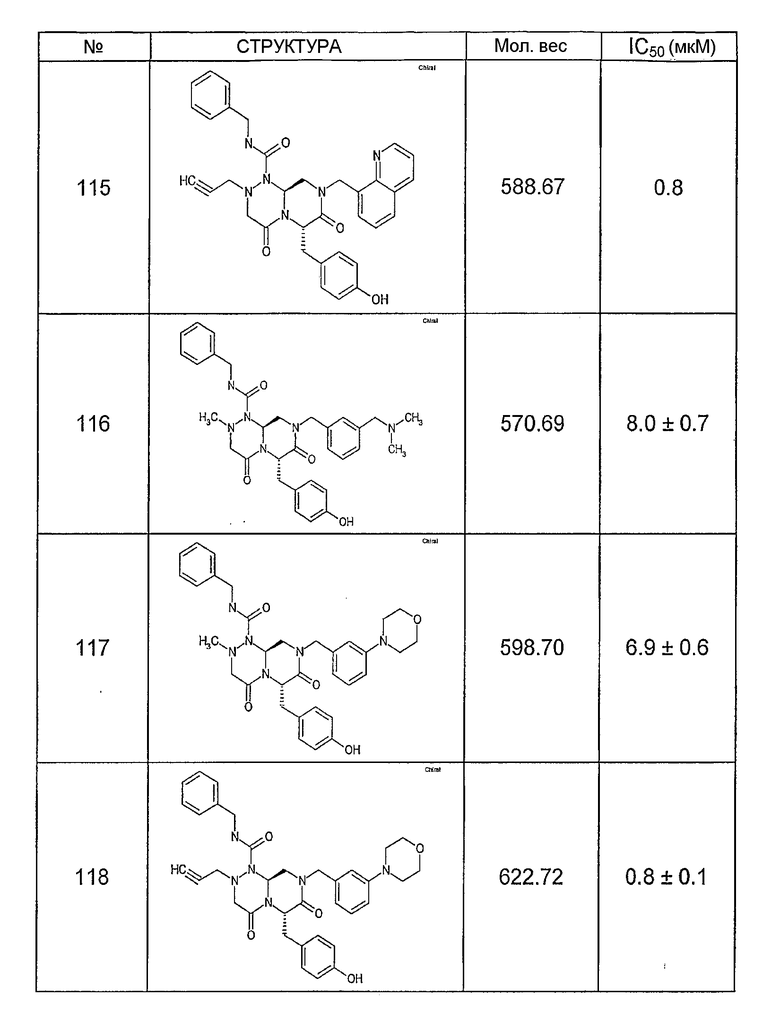
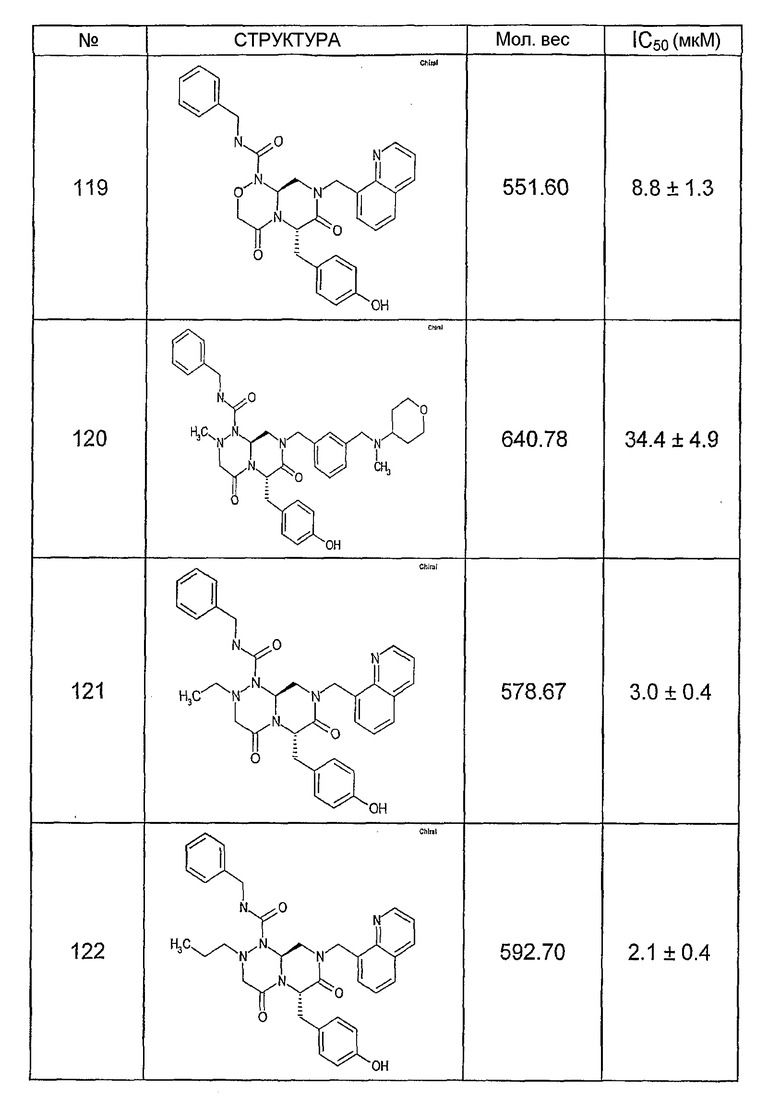
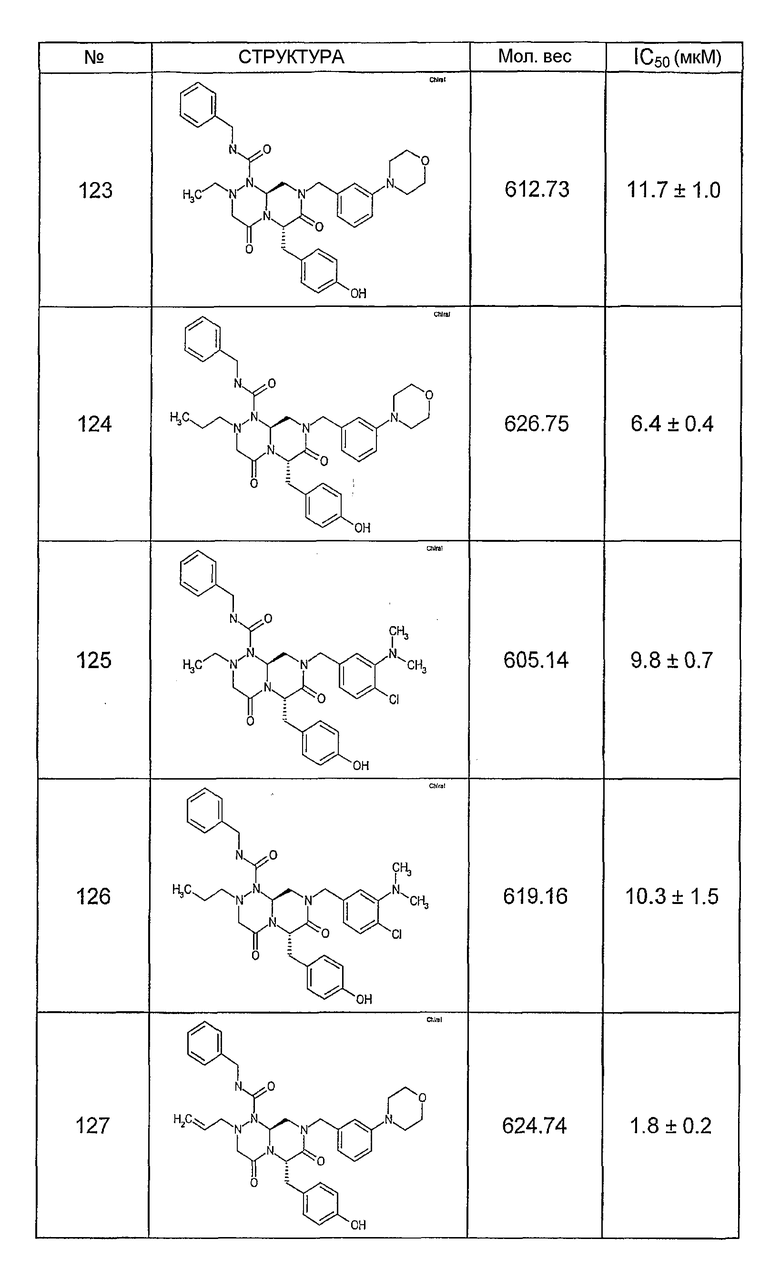
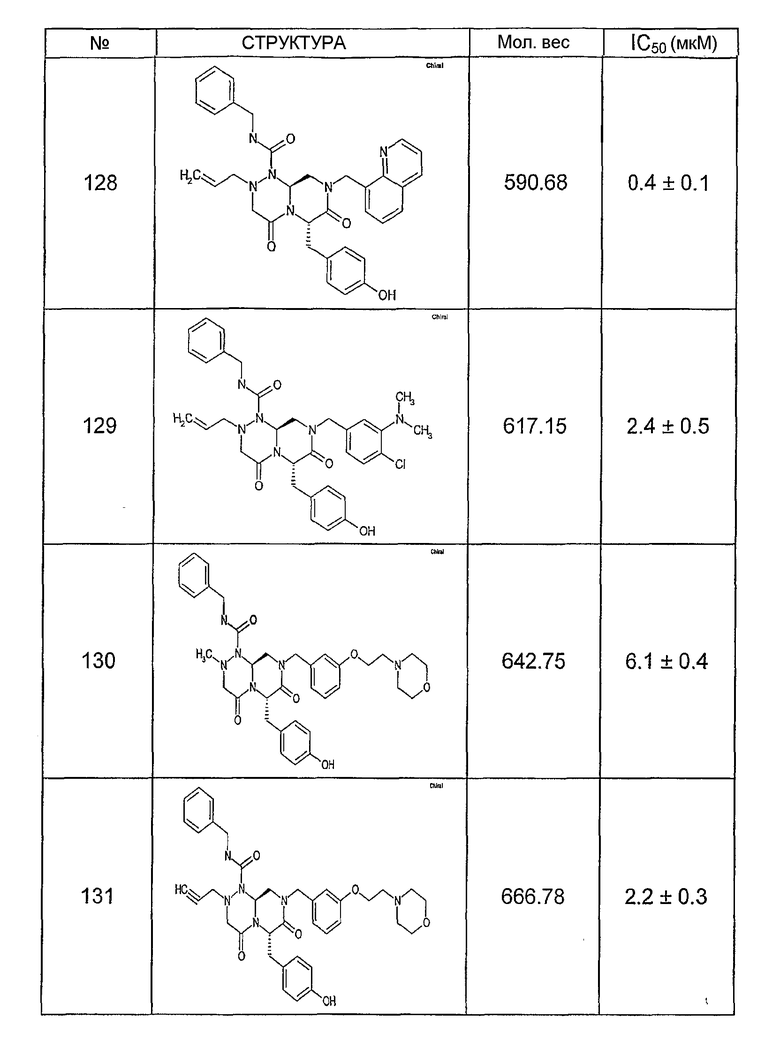
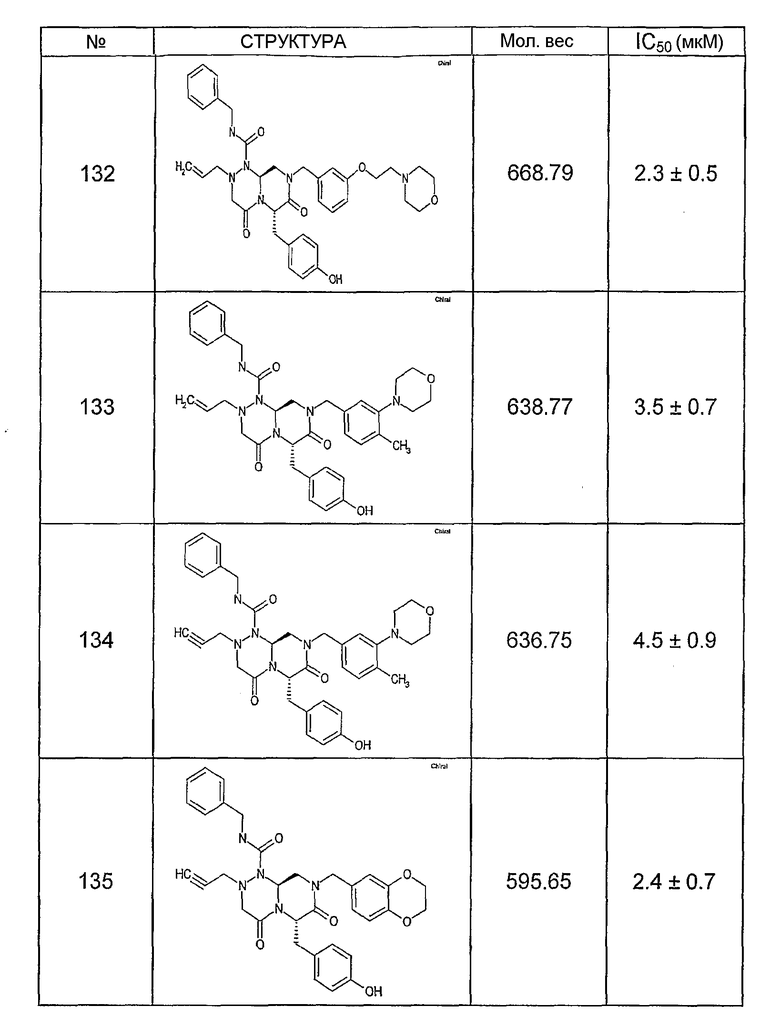
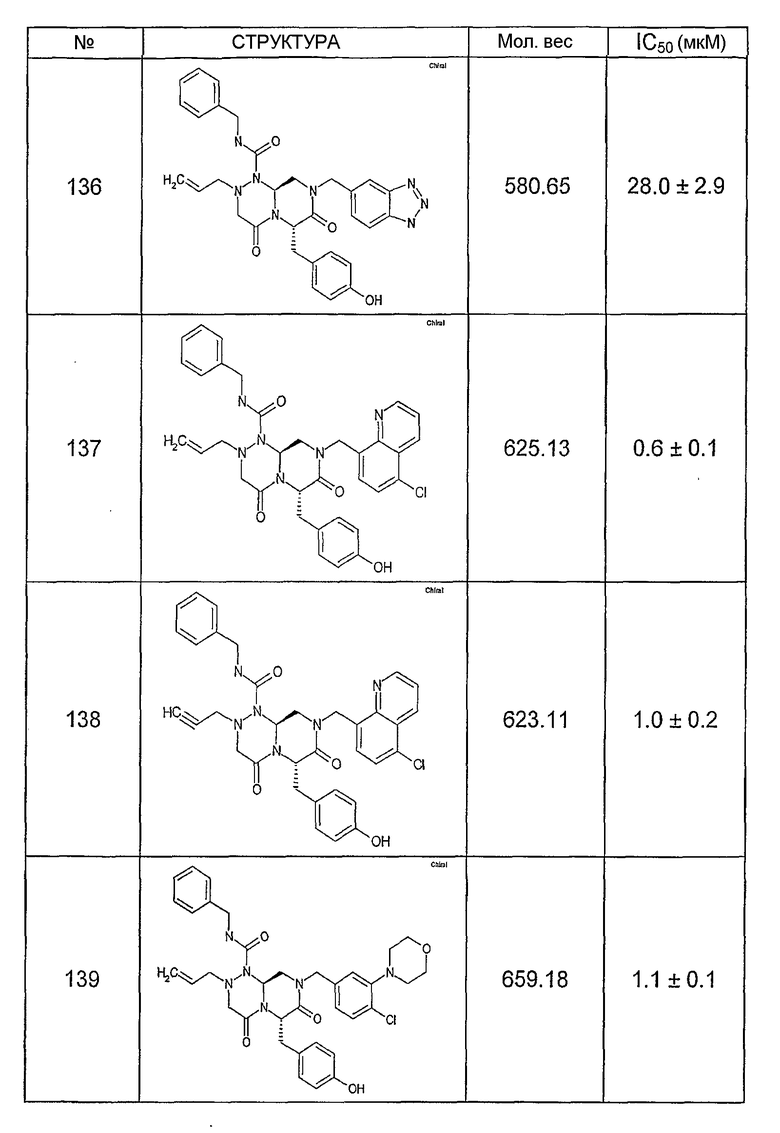
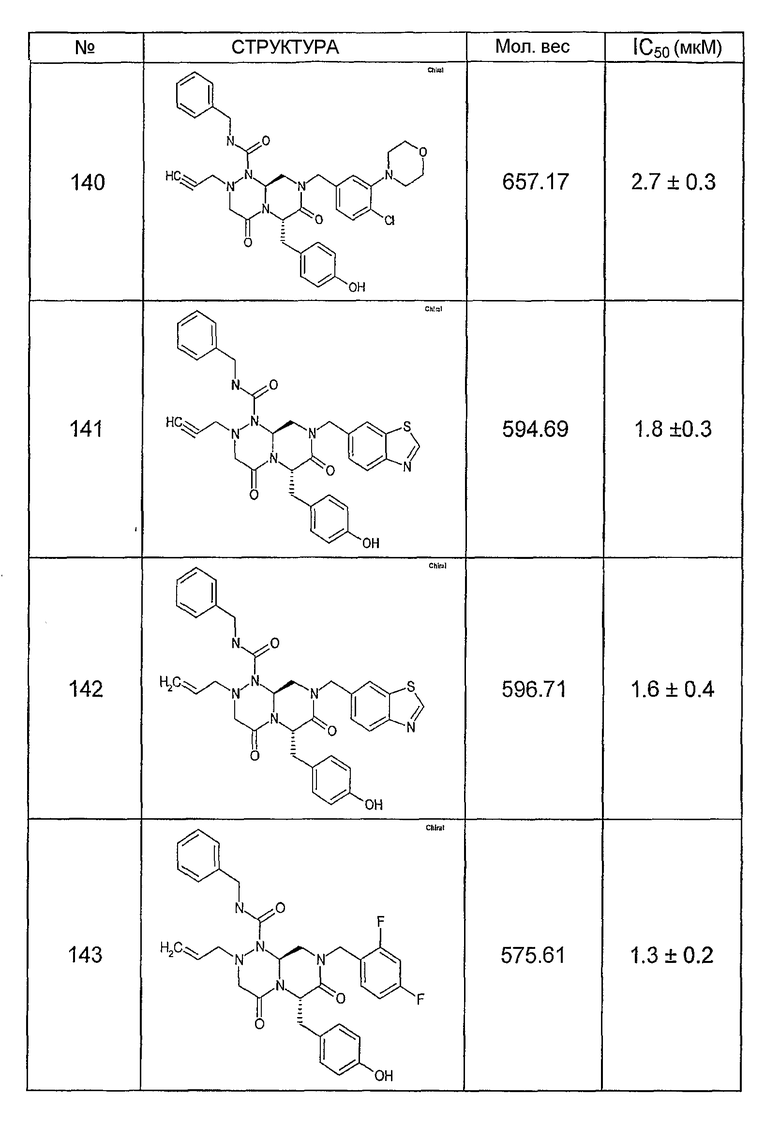
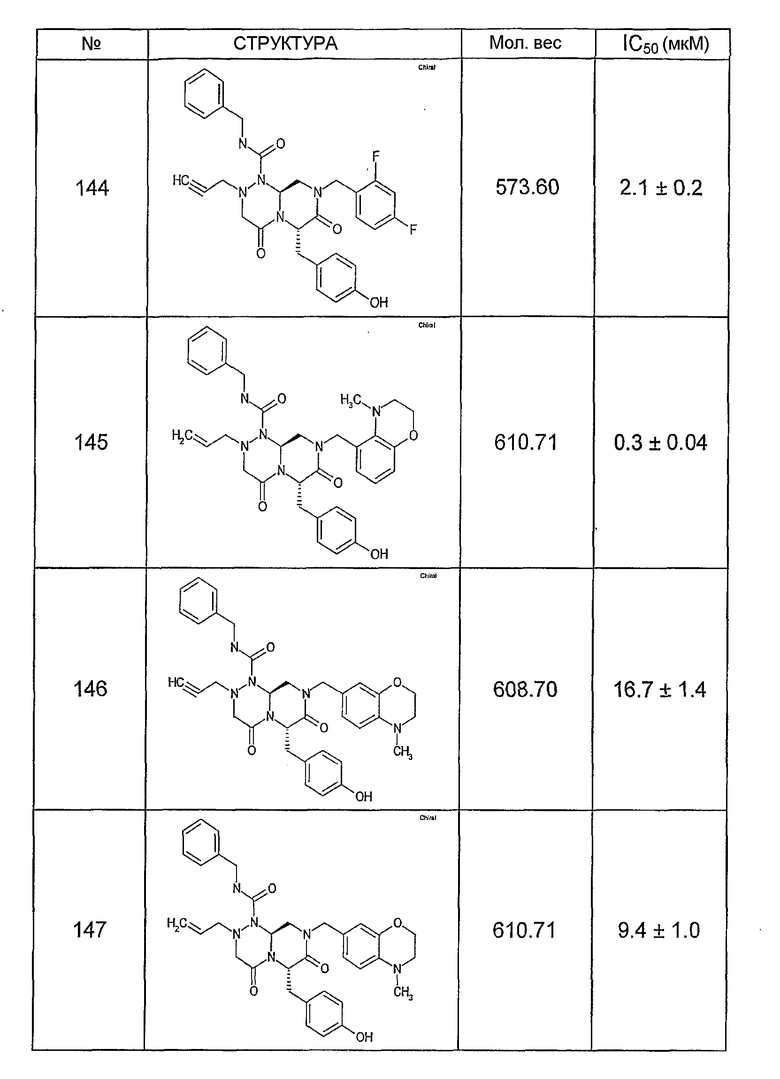
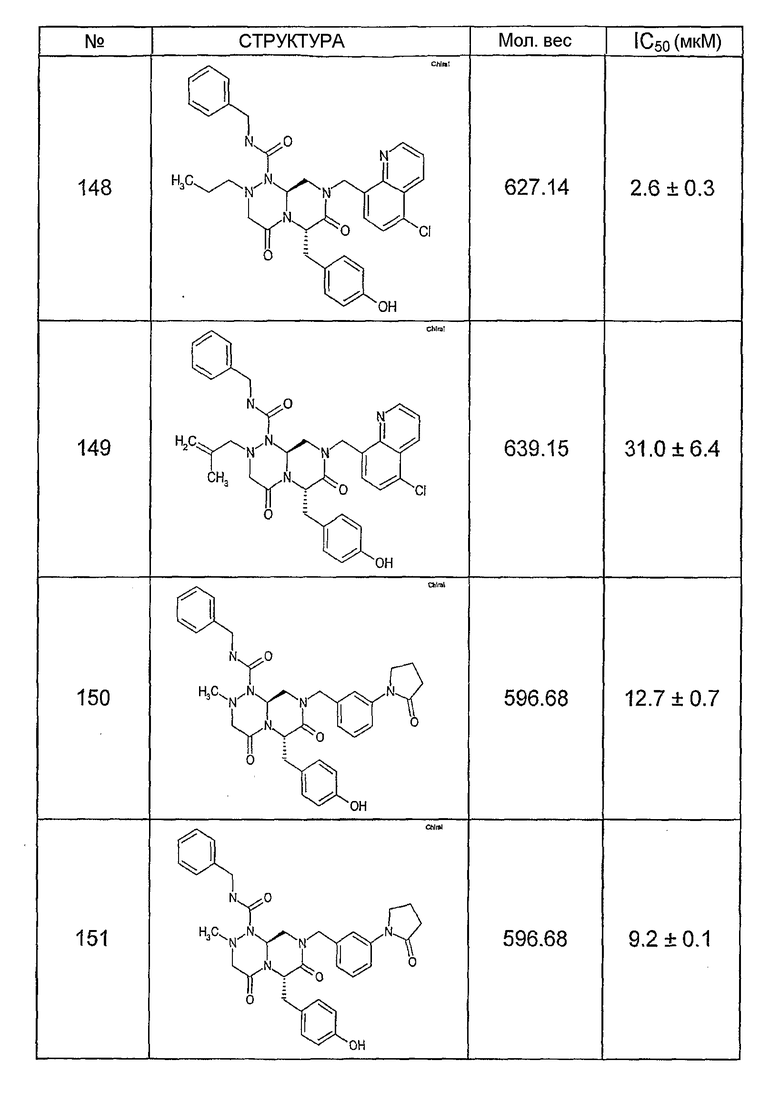
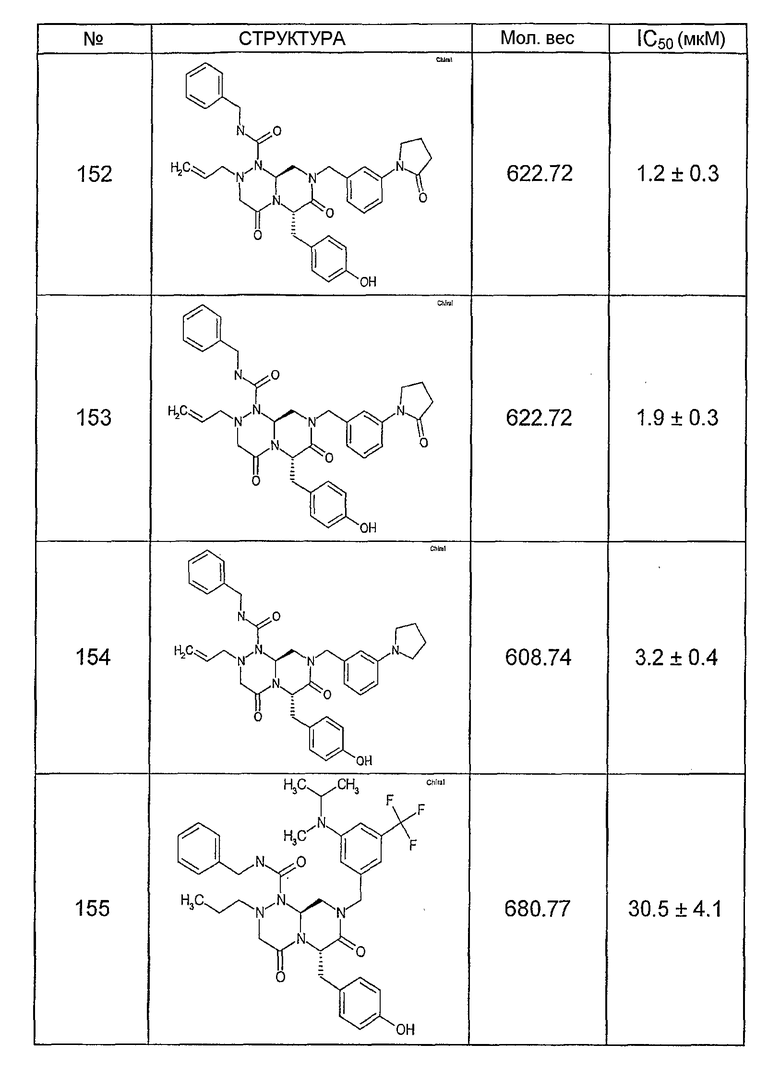
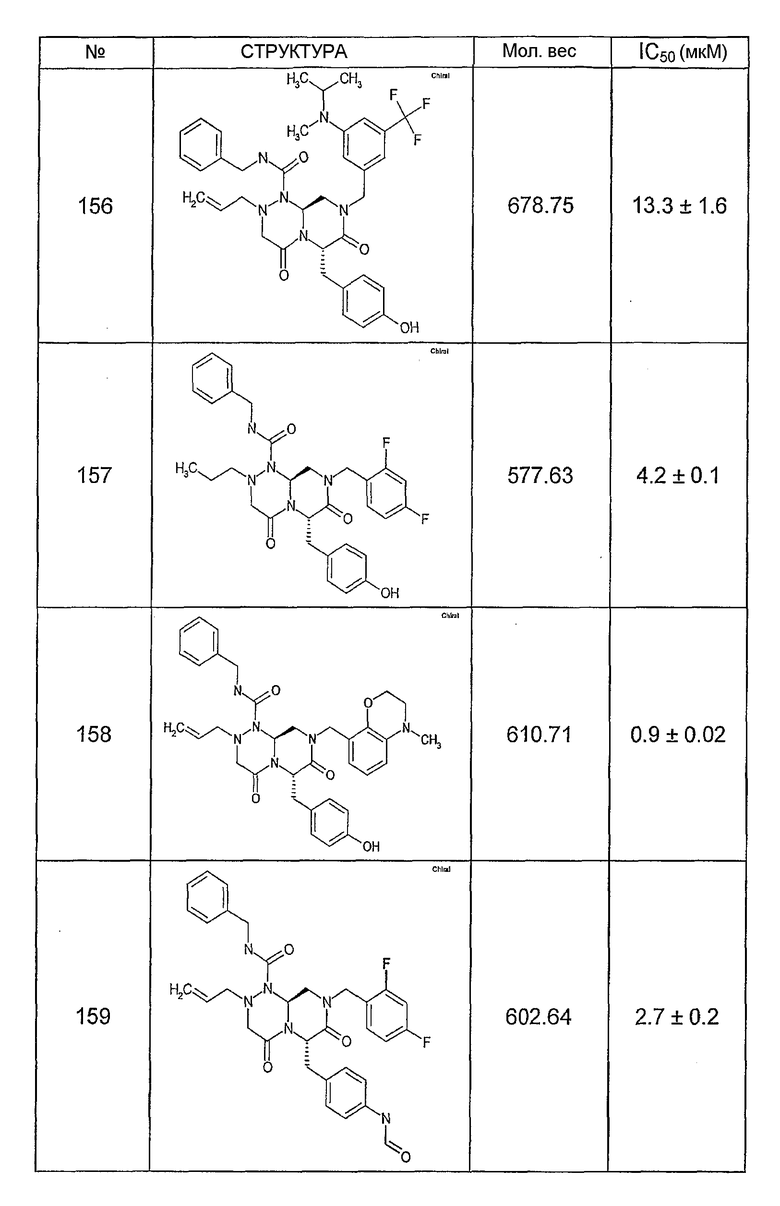
Было найдено, в соответствии с настоящим изобретением, что соединения общей формулы (I) и в особенности соединения общей формулы (VI) могут ингибировать CBP-опосредованную активацию транскрипции в раковых клетках за счет их специфического связывания с CBP. Такой подход поддерживается иммунопреципитацией CBP в клетках SW480 при использовании соединений по настоящему изобретению.
Соединения по настоящему изобретению могут также ингибировать экспрессию сурвивина SW480 и в этой связи ингибировать онкогенную активность в раковых клетках. Соединения по настоящему изобретению могут использоваться для подавления раковых клеток и могут, таким образом, быть полезными для регуляции клеточного роста. Эти результаты также подтверждаются тем, что соединения по настоящему изобретению могут индуцировать активацию каспазы-3 в клетках SW480 и в этой связи индуцировать апоптозную активность в клетках. Соединения по настоящему изобретению могут быть также полезными в случае их использования для индукции апоптоза в клетках.
Для подтверждения онкогенной активности в раковых клетках был проведен тест на цитотоксичность in vitro с использованием MTS по следующей процедуре.
(1) Тест на цитотоксичность
Клетки SW480 или HCT116 помещают в 96-ячеечный микропланшет (104 клеток/ячейку) и инкубируют в течение 24 часов при 37°С. Клетки обрабатывают TCF4 в разных концентрациях в течение 24 часов. К каждой ячейке добавляют 20 мкл раствора MTS (Promega) и инкубируют в течение 2 часов при 37°C. Жизнеспособность клеток оценивают, измеряя поглощение при длине волны 490 нм с использованием счетчика для микропланшетов (Molecular Device), и затем вычисляют цитотоксичность соединения при каждой концентрации.
(2) Тест на ингибирование роста
Клетки SW480 или HCT116 помещают в 96-ячеечный микропланшет (104 клеток/ячейку) и инкубируют в течение 24 часов при 37°С. 20 мкл раствора внутрикомплексной соли [3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксифенил)-2-(4-сульфофенил)-2Н-тетразолия] (MTS) (Promega) добавляют к каждой ячейке и инкубируют в течение 2 часов при 37°C и затем измеряют поглощение в каждой ячейке (отрицательный контроль). После этого клетки обрабатывают TCF4 в разных концентрациях в течение 48 часов. К каждой ячейке добавляют по 20 мкл раствора MTS (Promega) и инкубируют все в течение 2 часов при 37°C. Жизнеспособность клеток определяют, измеряя поглощение при длине волны 490 нм с использованием счетчика для микропланшетов (Molecular Device), и затем вычисляют цитотоксичность соединения при каждой концентрации.
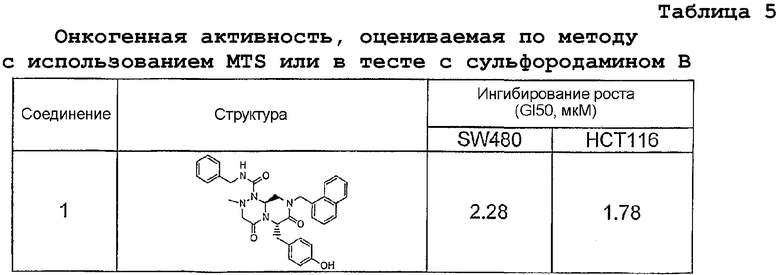
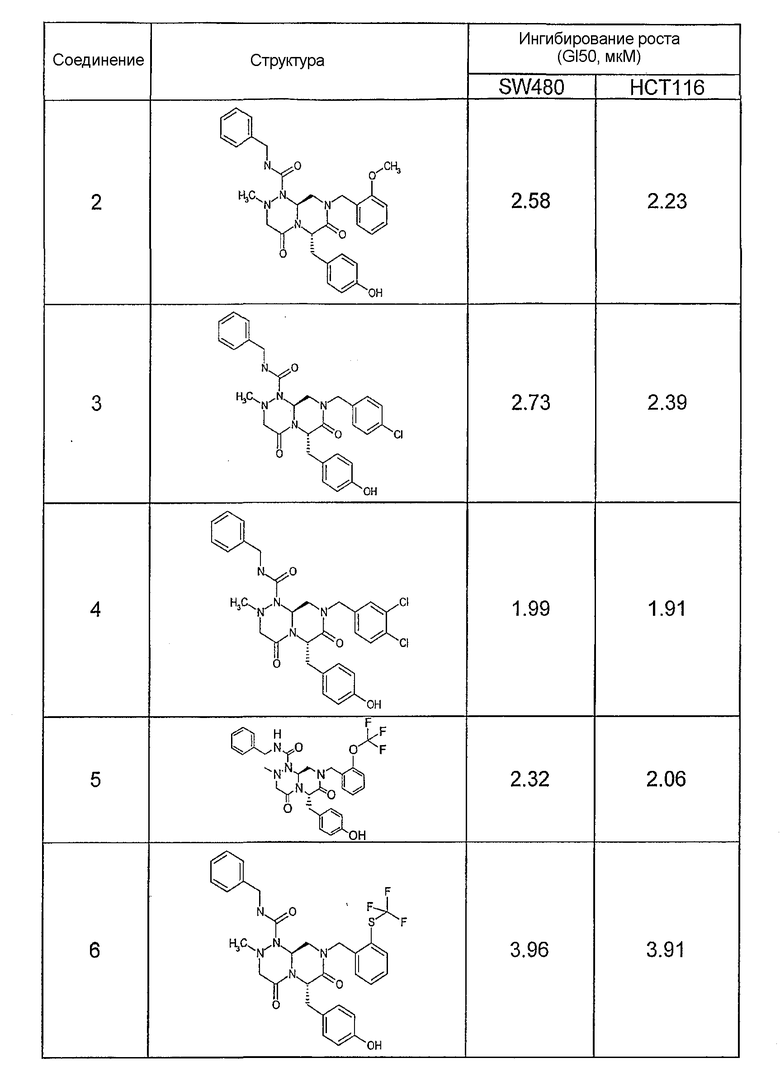
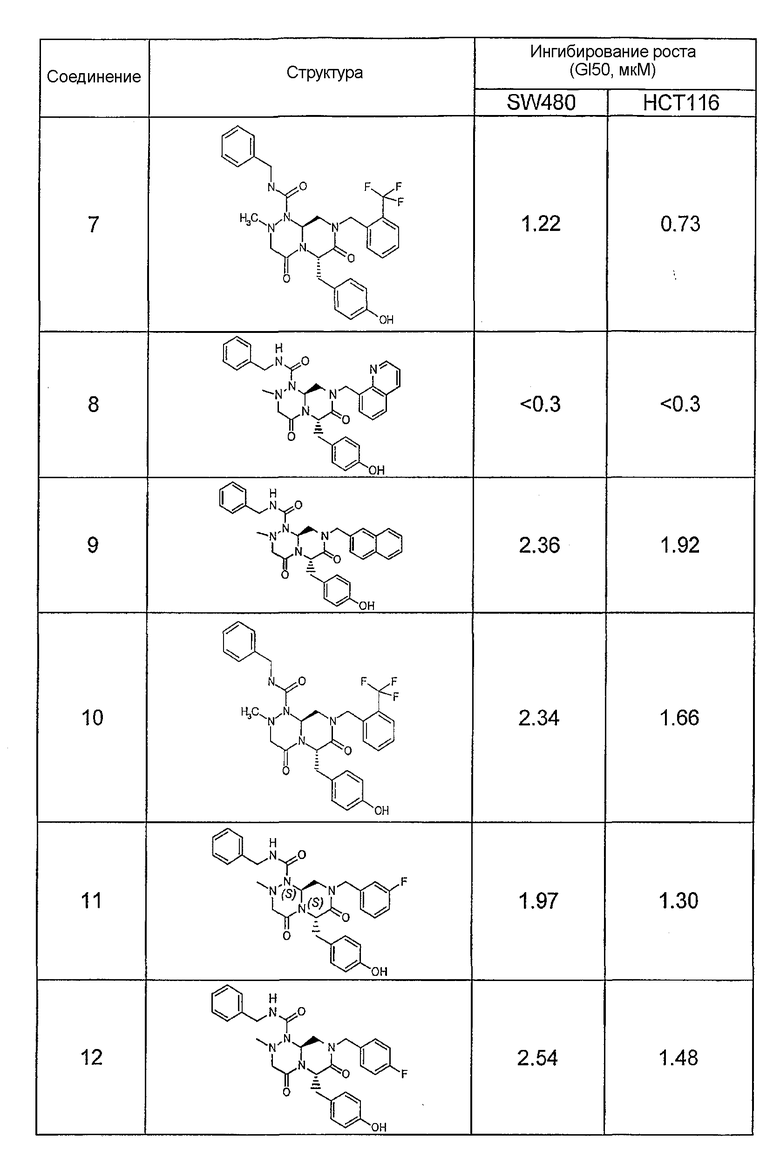
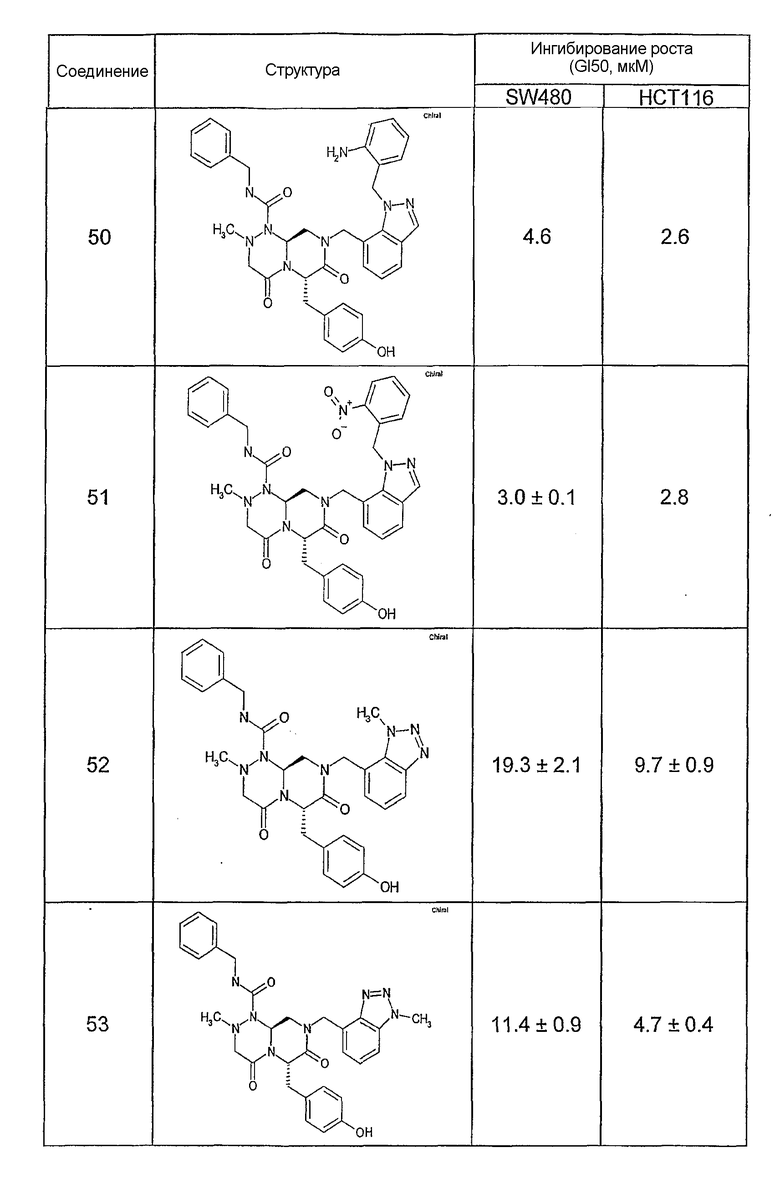
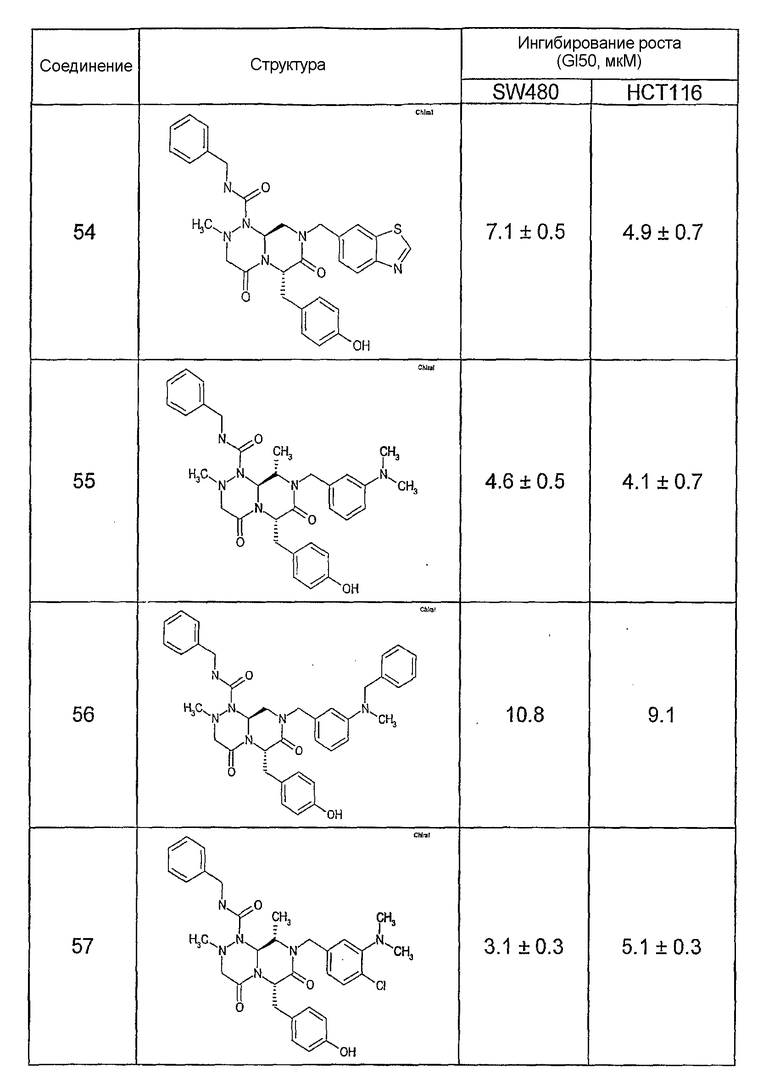
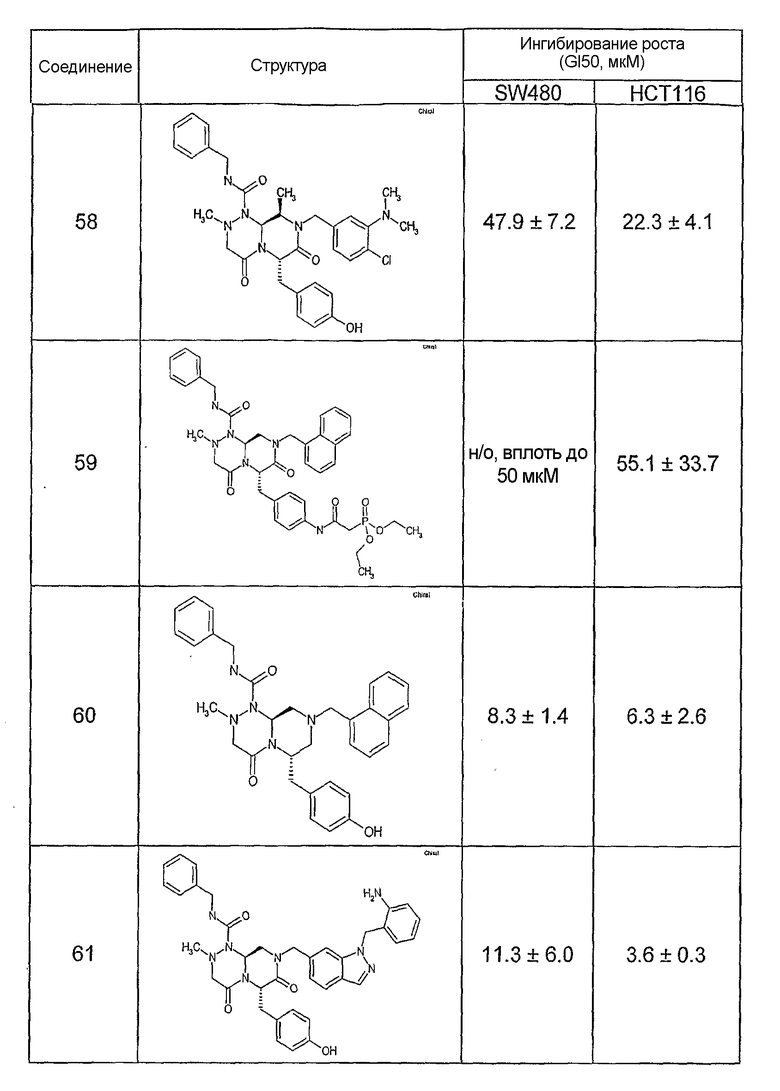
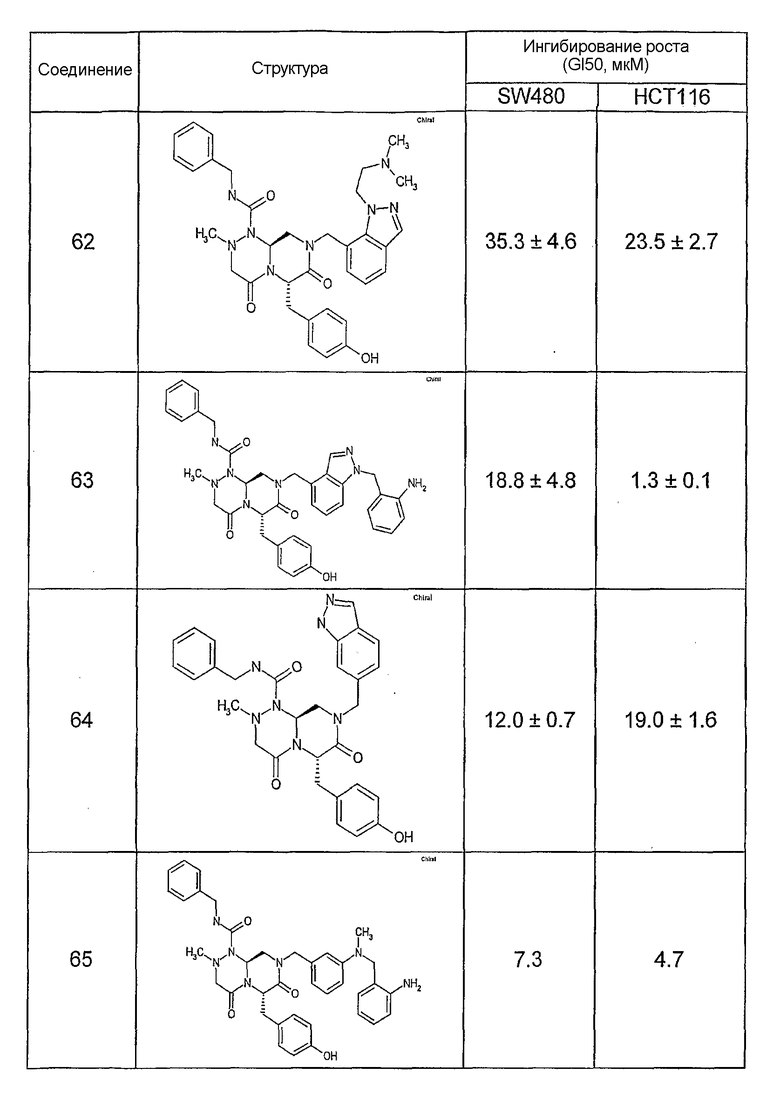
Результаты определения онкогенной активности для выбранных соединений из библиотека приведены в таблице 5. Номера соединения в таблице 5 не соотносятся с нумерацией соединений в таблице 4.
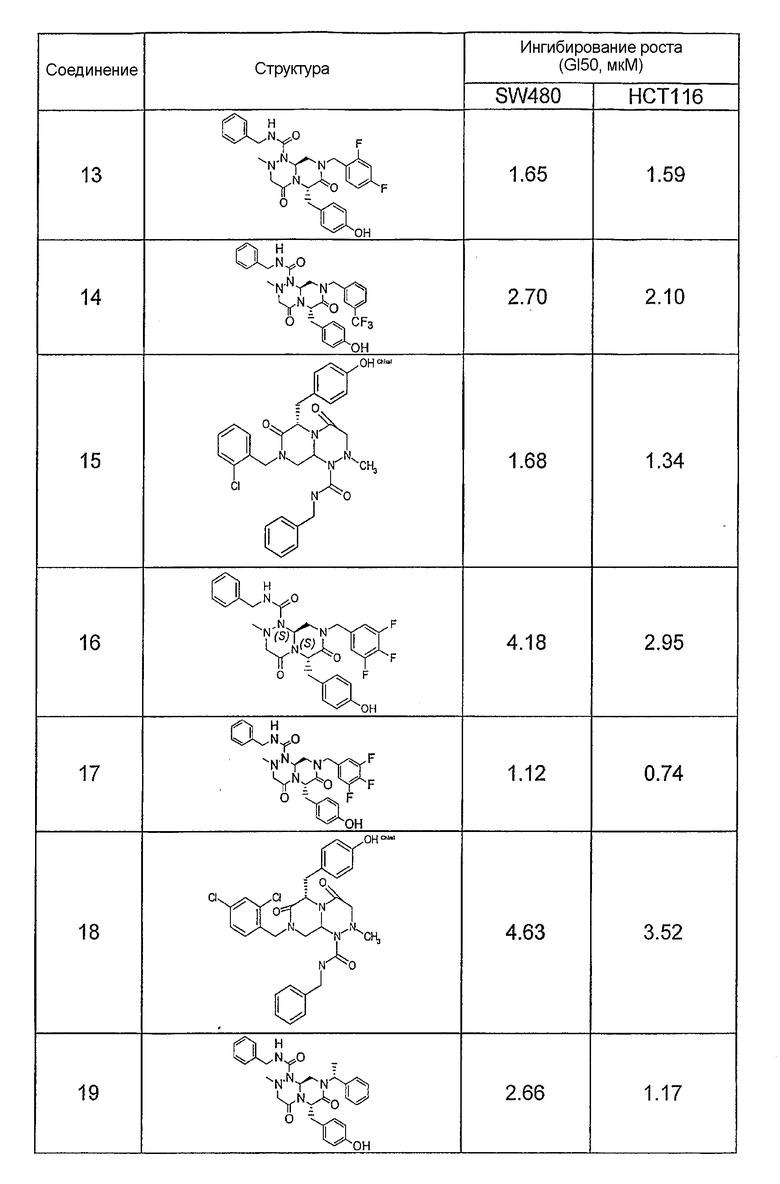
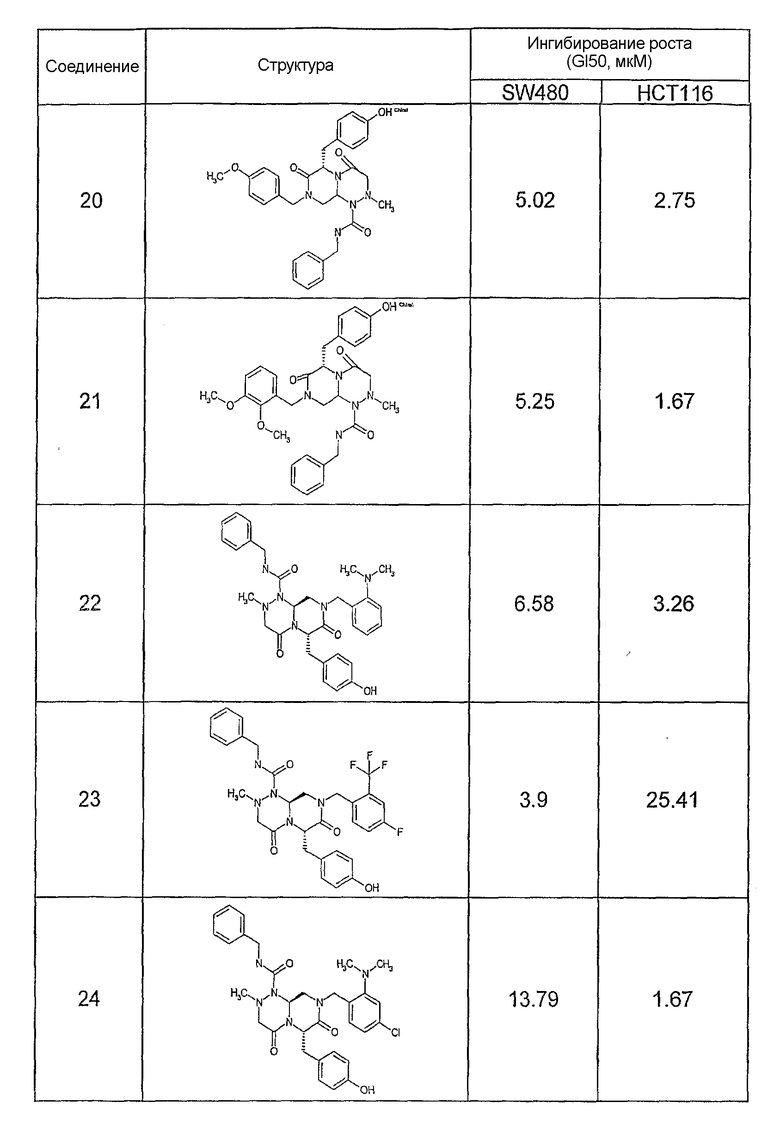
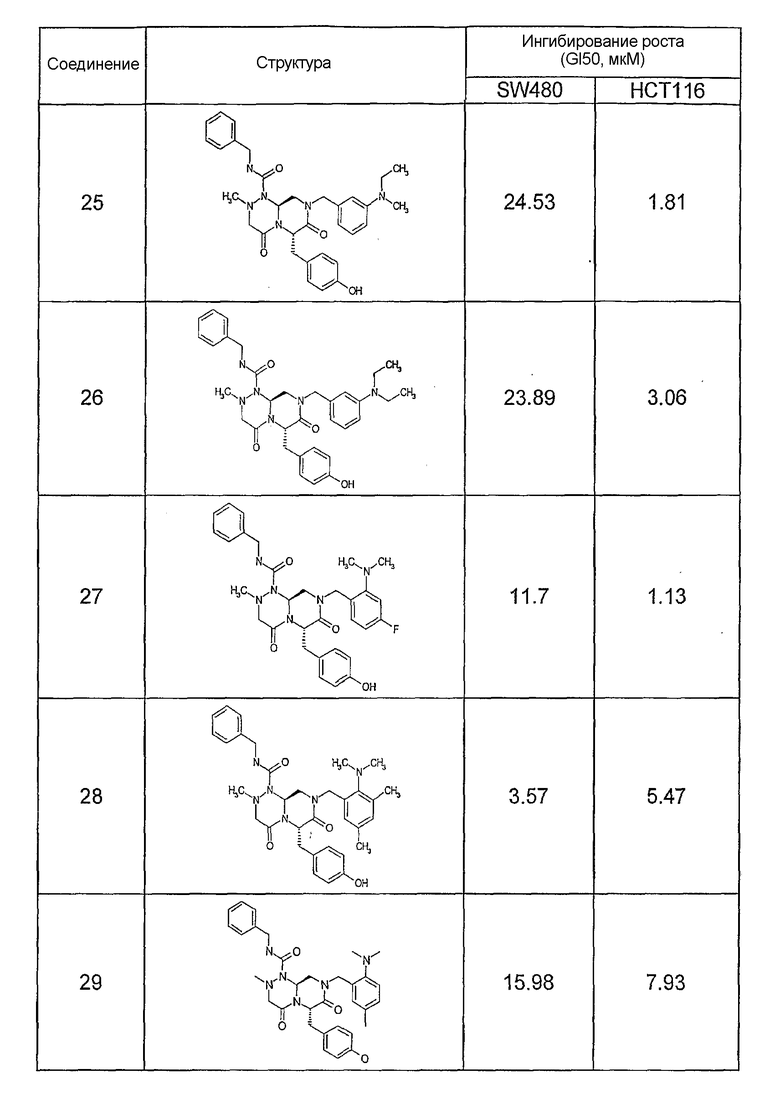
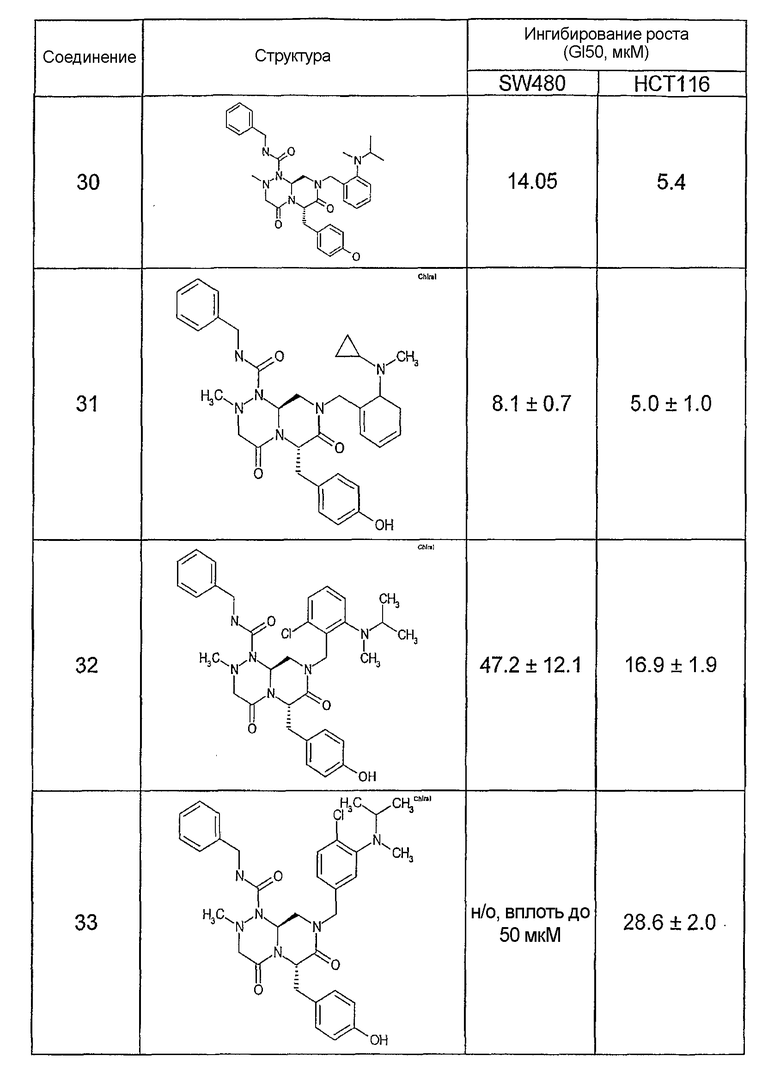

В других аспектах настоящее изобретение относится к фармацевтическим композициям, содержащим соединение общей формулы (I), или соединение общей формулы (II), или соединение общей формулы (III), или соединение общей формулы (IV), или соединение общей формулы (VI). Указанные композиции могут использоваться в различных методах (например, при лечении рака или болезни Альцгеймера) по настоящему изобретению, как будет подробно описано ниже.
Фармацевтическая композиция по настоящему изобретению может быть изготовлена в форме, совместимой с планируемым способом введения. Примеры способов введения включают парентеральное, например внутривенное, интрадермальное, подкожное, пероральное (например, путем ингаляции), чрескожное (местное), трансмукозальное и ректальное введение. Растворы или суспензии, используемые для парентерального введения, интрадермального или подкожного введения, могут включать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физиологический раствор, жирные масла, полиэтиленгликоли, глицерин, пропиленгликоли или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты, используемые для корректировки тонизирующих свойств, такие как хлорид натрия или декстроза. Кроме того, для корректировки pH могут использоваться кислоты или основания, такие как хлористоводородная кислота или гидроксид натрия. Парентеральный препарат может быть включен в ампулы, одноразовые шприцы или флаконы с множественной дозой, изготовленные из стекла или пластика.
Фармацевтические композиции, пригодные для использования в виде инъекций, включают стерильные водные растворы (водорастворимые) или дисперсии и стерильные порошки для получения экстемпоральных препаратов стерильных инъецируемых растворов или дисперсий. Для целей внутривенного введения приемлемые носители включают физиологический раствор, бактериостатическую воду, Кремофор ELTM (Cremophor ELTM) (BASF, Parsippany, NJ) или фосфатно-буферный раствор (PBS). Во всех случаях композиция должна быть стерильной и текучей в той мере, которая позволяет легко вводить ее с помощью шприца. Она должна быть стабильной в условиях производства и хранения и должна содержать консерванты, препятствующие контаминации микроорганизмами, такими как бактерии и грибы. Используемый носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и соответствующие смеси на их основе. Текучесть может быть регулируемой, например, за счет использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и за счет использования поверхностно-активных веществ. Воздействие микроорганизмов можно предотвратить, если использовать различные антибактериальные и противогрибковые средства, например парабены, хлорбутанол, фенол, аскорбиновая кислота, тимеросал и т.п. Во многих случаях в состав композиции предпочтительно включать средства для поддержания изотоничности, например сахара, полиспирты, такие как маннит, сорбит и хлорид натрия. Пролонгированная абсорбция инъецируемых композиций может быть достигнута при включении в композицию агента, который задерживает абсорбцию, например моностеарата алюминия и желатина.
Стерильные инъецируемые растворы могут быть получены при включении активного соединения (например, соединения, имеющего общую формулу (I), (II), (III), (IV) или (VI)) в соответствующем количестве и в соответствующем растворителе в отдельности или в сочетании с указанными выше ингредиентами, при необходимости, с последующим фильтрованием для стерилизации. В целом, дисперсии изготавливают путем включения активного соединения в стерильный носитель, который содержит дисперсионную среду и другие требуемые ингредиенты из числа перечисленных выше. В случае использования стерильных порошков для получения стерильных инъецируемых растворов предпочтительные способы получения включают вакуумную сушку и сушку при замораживании, которая приводит к получению порошка активного ингредиента в сочетании с дополнительным желательным ингредиентом из предварительно профильтрованного стерильного раствора.
Пероральные композиции в основном включают инертный разбавитель или пищевой носитель. Они могут быть включены в желатиновые капсулы или могут быть подвержены прессованию с получением таблеток. Для целей перорального терапевтического введения активное соединение может быть включено вместе с эксципиентами в состав препарата и может использоваться в виде таблеток, пастилок или капсул. Пероральные композиции могут быть также изготовлены с включением текучего носителя с целью использования их в качестве жидкости для полоскания, где указанное соединение в текучем носителе употребляют через рот, при этом оно может быть проглочено или использовано для полоскания и быть выплюнутым. Фармацевтически совместимые связывающие агенты и/или вспомогательные материалы могут быть включены в качестве составных частей такой композиции. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любой из приведенных ниже ингредиентов или соединения родственной природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакант или желатин; эксципиент, такой как крахмал или лактоза; средство, дезинтегрант, такой как альгиновая кислота, Примогель (Primogel) или кукурузный крахмал; лубрикант, такой как стеарат магния или Стеротес (Sterotes); глидант, такой как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин, или вкусовой агент, такой как мятная добавка, метилсалицилат или вкусовая добавка со вкусом апельсина.
В случае введения методом ингаляции соединение доставляют в форме распыляемого аэрозоля из находящегося под давлением контейнера или диспенсера, который содержит подходящий пропеллент, например газ, такой как диоксид углерода, или из небулайзера.
Системное введение может быть осуществлено трансмукозальным или чрескожным способом. Для целей трансмукозального или чрескожного введения в состав такой композиции вводят средство, способствующее проникновению, которое подходит для того барьера, через который должен пройти данный препарат. Такие средства, способствующие проникновению, хорошо известны в данной области и включают, например, для целей мукозального введения, детергенты, соли желчных кислот и производные фузидиновой кислоты. Мукозальнное введение может быть осуществлено посредством использования назальных спреев или суппозиториев. Для целей чрескожного введения активные соединения изготавливают в виде мазей, целебных мазей, гелей или кремов, которые известны в данной области.
Соединения могут также изготовливаться в виде суппозиториев (например, при использовании традиционных основ для суппозиториев, таких как масло какао и другие глицериды) или в виде удерживаемых клизм для осуществления ректальной доставки.
В одном варианте осуществления настоящего изобретения активные соединения изготавливают с использованием носителей, которые будут препятствовать быстрому выведению соединения из организма, с получением таких форм, как формы с контролируемым высвобождением, включающие имплантаты и системы доставки на основе микроинкапсулированных форм. Могут использоваться биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Способы получения таких композиций хорошо известны специалистам в данной области. Соответствующие материалы могут быть также получены в коммерческом варианте от компаний Alza Corporation и Nova Pharmaceuticals, Inc. В качестве фармацевтически приемлемых носителей могут также использоваться липосомальные композиции (включающие направленные на инфицированные клетки липосомы, содержащие моноклональные антитела к вирусным антигенам). Указанные формы могут быть получены в соответствии с методиками, известными специалистам в данной области, которые описаны, например, в патенте США № 4522811.
Особенно удачным следует считать вариант изготовления композиций для перорального или парентерального введения в виде единичных дозированных форм для достижения легкости введения и однородности дозировок. Единичная дозированная форма, в контексте настоящего описания, относится к физически дискретным единицам, пригодным для введения в виде разовых дозировок субъектам, подлежащим лечению, где каждая единица содержит заданное количество активного соединения, продуцирующее, по расчетам, в случае сочетания с требуемым фармацевтическим носителем, желательный терапевтический эффект. Спецификация на единичные дозированные формы диктуется и напрямую зависит от уникальных характеристик активного соединения, от того конкретного терапевтического эффекта, которого хотят достичь, а также от ограничений, в целом присущих технике изготовления препаратов, таких как активные соединения, подлежащие введению индивидуумам.
Токсичность и терапевтическая эффективность таких соединений может быть определена в рамках стандартных фармацевтических процедур в клеточных структурах или с использованием экспериментальных животных, проводимых, например, для определения показателей LD50 (доза, которая является летальной для 50% популяций) и ED50 (доза, которая является эффективной для 50% популяций). Соотношение доз, оказывающих токсический и терапевтический эффект, представляет собой терапевтический индекс и выражается в виде коэффициента LD50/ED50. Соединения, которые демонстрируют более высокие значения терапевтических индексов, являются предпочтительными. Если используют соединения, которые демонстрируют токсический побочный эффект, то должны предприниматься соответствующие меры предосторожности для разработки системы доставки, которая будет направлять такие соединения в область поврежденной ткани, с тем чтобы минимизировать потенциальное повреждение неинфицированных клеток и таким образом снизить побочные эффекты.
Данные, полученные при тестировании клеточных культур и при исследовании животных, могут использоваться в процедурах изготовления широкого перечня дозированных форм для применения людьми. Дозировки таких соединений укладываются предпочтительно в диапазон циркулирующих в крови концентраций, которые включают ED50, при проявлении небольшой токсичности или вообще при ее отсутствии. Указанные дозировки могут варьировать в пределах диапазона, в зависимости от используемой дозированной формы и от выбранного способа введения. Для любого соединения, используемого в способе по настоящему изобретению, терапевтически эффективная доза может быть вначале установлена в тесте на клеточной культуре. Доза может быть изготовлена с учетом результатов, полученных при исследовании на модели животных, с целью попадания в диапазон концентраций, циркулирующих в плазме, которые включают показатель IC50 (то есть концентрацию исследуемого соединения, которая достигает половинного уровня от максимального ингибирования симптомов), определяемый в клеточной культуре. Такая информация может использоваться как основа для более точного определения полезных доз при приеме людьми. Уровни в плазме могут быть определены, например, методом высокоэффективной жидкостной хроматографии.
Например, в некоторых вариантах фармацевтическая композиция по настоящему изобретению представляет собой композицию, приемлемую для перорального введения в виде стандартной дозированной формы, такой как таблетка или капсула, которая содержит от примерно 1 мг до примерно 1 г соединения по настоящему изобретению. В некоторых других вариантах фармацевтическая композиция по настоящему изобретению представляет собой композицию, приемлемую для внутривенной, подкожной или внутримышечной инфекции. Пациент может получать, например, внутривенную, подкожную или внутримышечную дозу, включающую от примерно 1 мкг/кг до примерно 1 г/кг соединения по настоящему изобретению. Вводимая внутривенно, подкожно или внутримышечно доза может быть доставлена с помощью инъекции болюсом или путем непрерывной инфузии в течение определенного периода времени. Альтернативно, пациент может получать дневную пероральную дозу, примерно равную дневной парентеральной дозе, при этом композиция может вводиться от 1 до 4 раз в день.
В приведенной ниже таблице указаны репрезентативные фармацевтические дозированные формы, содержащие соединение или его фармацевтически приемлемую соль для целей терапевтического или профилактического применения у людей:
Фармацевтическая композиция, содержащая соединение общей формулы (I), или (II), или (III), или (IV), или (VI) может использоваться при лечении расстройств, модулированных сигнальным механизмом, в который вовлечен Wnt, в частности рака, и в особенности колоректального рака.
В одном аспекте настоящее изобретение относится к соединениям, которые ингибируют связывание радиоактивно меченного производного энкефалина с δ- и μ-опиатными рецепторами. Соответственно, миметики с обратной конфигурацией по настоящему изобретению могут использоваться в качестве агонистов рецептора и в качестве потенциальных анальгетиков.
В другом аспекте настоящее изобретение относится к способам подавления роста опухоли. Такие способы включают стадию введения субъекту (например, млекопитающему), имеющему опухоль, соединения общей формулы (I), в особенности общей формулы (VI), в количестве, эффективном для ингибирования роста опухоли. Считается, что соединение или композиция ингибирует рост опухоли, если размеры опухоли становятся статистически значимо меньше у субъектов, подвергающихся лечению соединением или композицией, чем соответствующие размеры при отсутствии лечения.
Ингибирующий эффект конкретного соединения или композиции по настоящему изобретению на рост опухоли может быть охарактеризован с использованием любого соответствующего способа, известного в данной области. Так, например, может быть оценен эффект соединения или композиции на экспрессию сурвивина. Соединения или композиции, оказывающие отрицательную регуляцию на экспрессию сурвивина, будут, скорее всего, обладать ингибирующим эффектом и в отношении роста опухоли. Кроме того, могут также использоваться тесты с использованием клеточных линий опухолевых клеток (например, тесты в мягком агаре с использованием клеток SW480) и тесты с использованием модели животных для оценки роста опухоли (например, мышей nude с привитыми опухолевыми клетками и мышей Min), на основе которых можно оценить ингибирующий эффект данного соединения или композиции на рост опухоли, как это будет более подробно описано в разделе примеров. Другие примеры моделей с использованием животных или ксенотрансплантатов для анализа роста опухоли включают системы для оценки рака молочной железы (Guo et al., Cancer Res. 62: 4678-84, 2002; Lu et al., Breast Cancer Res. 57: 183-92, 1999), рака поджелудочной железы (Bouvet et al., Cancer Res. 62; 1534-49, 2002), опухоли яичника (Nilsson et al., Cancer Chemother. Pharmacol. 49: 93-100, 2002; Bao et al., Gynecol. Oncol. 78: 373-9, 2000), меланомы (Demidem et al., Cancer Res. 61: 2294-300, 2001), колоректального рака (Brown et al., Dig. Dis. Sci. 45: 1578-84, 2000; Tsunoda et al., Anticancer Res. 19: 1149-52, 1999; Cao et al., Clin. Cancer Res. 5: 267-74, 1999; Shawler et al., J. Immunother. Emphasis Tumor Immunol. 17: 201-8, 1995; McGregor et al., Dis. Colon. Rectum. 36: 834-9, 1993; Verstijnen et al., Anticancer Res. 8: 1193-200, 1988); гепатоцеллюлярного рака (Labomte et al., Hepatol. Res, 18: 72-85, 2000) и рака желудка (Takahashi et al., Int. J. Cancer 85: 243-7, 2000).
Соединение или композиция, которые ингибируют рост опухоли, могут быть введены субъекту, имеющему опухоль, в соответствующем режиме, выбор которого зависит, например, от ткани, которая подвержена опухолевому процессу. Соответствующая дозировка может быть определена с использованием знаний и техники, известных в данной области, которые описаны выше. Эффект лечения с использованием рассматриваемых соединений или композиций на опухолевый рост может отслеживаться с использованием известных в данной области способов. Так, например, для этого применимы различные методики, позволяющие оценить степень прогрессирования и/или роста колоректального рака, включая колоноскопию, сигмоидоскопию, биопсию, компьютерную томографию, ультразвуковое обследование, получение снимков с использованием методов ядерно-магнитного резонанса и позитронную эмиссионную томографию. Методики отслеживания степени прогрессирования и/или роста рака яичников включают, например, ультразвуковое обследование, компьютерную томографию, получение снимков с использованием методов магнитного резонанса, рентгеновское обследование грудной клетки, лапароскопию и отбор образцов для анализа.
В родственном аспекте настоящее изобретение относится к способу лечения или профилактики рака. Такие способы включают стадию введения субъекту, при необходимости, соединения или композиции общей формулы (I), в особенности соединения формулы (VI), в количестве, эффективном для лечения или профилактики рака у данного субъекта. Под лечением рака следует понимать снижение или устранение прогрессирования рака (например, роста рака и метастазирования). Под профилактикой рака следует понимать предотвращение или задержку развития рака. Различные типы рака могут поддаваться лечению или профилактике согласно настоящему изобретению. Они включают, без ограничения, рак легкого, рак молочной железы, колоректальный рак, рак желудка, рак поджелудочной железы, рак печени, рак матки, рак яичника, глиомы, меланому, лимфому и лейкоз.
Субъект, нуждающийся в таком лечении, может представлять собой человека или примата, отличного от человека, или другое животное, имеющее различные виды рака. Субъект, нуждающийся в профилактике, может представлять собой человека или примата, отличного от человека, или любое другое животное, которое имеет риск развития рака. Способы диагностики рака и скрининга индивидуумов с высоким риском развития рака известны в данной области и могут использоваться при осуществлении настоящего изобретения. Так, например, диагностика колоректального рака может быть проведена на основе фекальной пробы на скрытое кровотечение, результатов сигмоидоскопии, колоноскопии, при использовании клизмы с барием на фоне контрастного вещества и виртуальной колоноскопии. Индивидуум с высоким риском развития колоректального рака может иметь один или несколько факторов риска колоректального рака, такие как семейная предрасположенность к колоректальному раку или к полипам, известные случаи наличия синдромов колоректального наследственного рака, наличие в анамнезе индивидуума указания об аденоматозных полипах и наличие в истории болезни хронического воспалительного заболевания кишечника.
Соединение общей формулы (I), используемое при лечении или профилактике рака, может быть идентифицировано на основе известных в данной области методик. Могут также использоваться описанные выше методики, подходящие для выбора соединений, обладающих ингибирующим эффектом на рост опухоли. Режим введения, используемая дозировка данного соединения, эффективность лечения могут быть определены с использованием знаний и методик, известных в данной области. Факторы, которые могут рассматриваться как значимые в рамках такого определения, включают, например, вид и стадию рака, который подлежит лечению.
Соединение общей формулы (I), используемое при лечении или профилактике рака, может вводиться в сочетании с антинеопластическим агентом. Антинеопластический агент представляет собой соединение, которое ингибирует рост опухоли. Примеры антинеопластических агентов включают фторурацил, 5-фтор-2,4(1Н,3Н)пиримидиндион (5-FU), таксол, цисплатину, митомицин С, тегафур, ралтитрексед, капецитабин и иринотекан (Arango et al., Cancer Research 61, 2001, 4910-4915). В случае соединения общей формулы (I), вводимого в сочетании с антинеопластическим агентом, необязательно, чтобы такое соединение и антинеопластический агент вводились одновременно. Указанное соединение и агент могут вводиться раздельно и в те временные точки, если известно, что они оказывают эффект на одни и те же раковые клетки.
В другом родственном аспекте настоящее изобретение относится к способам усиления апоптоза раковых клеток. Такие способы включают стадию взаимодействия раковых клеток с соединением общей формулы (I), в особенности с соединением общей формулы (VI), в количестве, эффективном для усиления апоптоза данных клеток. Считается, что соединение усиливает апоптоз, если число раковых клеток, подвергающихся апоптозу, статистически значимо увеличивается в присутствии соединения, чем в отсутствие такого соединения. Такие соединения могут быть идентифицированы с использованием методов, известных в данной области (например, путем измерения активности каспазы и/или определения уровня гибели клеток), с использованием культур клеточных линий рака, ксенотрансплантатов или моделей рака на животных. Предпочтительно соединение является более активным по усилению апоптоза раковых клеток, чем нормальных клеток. Раковые клетки, подвергающиеся лечению согласно настоящему способу, могут представлять собой клетки, имеющие разное тканевое происхождение.
Другой аспект осуществления настоящего изобретения относится к способу лечения расстройства, модулированного сигнальным механизмом, в который вовлечен Wnt, при этом данный способ включает введение пациенту безопасного и эффективного количества соединения (I), в особенности соединения общей формулы (VI). Фармацевтическая композиция, содержащая соединение по настоящему изобретению, также может использоваться для достижения данной цели. В этой связи в настоящем изобретении было показано, что соединение общей формулы (I), в особенности соединение общей формулы (VI), или содержащая их фармацевтическая композиция могут быть полезны при лечении расстройства, модулированного комплексом TCF4-β-катенин-CBP, который, как считается, отвечает за инициацию суперэкспрессии раковых клеток, связанную с Wnt-опосредованным сигнальным механизмом. Таким образом, другой аспект настоящего изобретения относится к способу лечения расстройства, опосредованного комплексом TCF4-β-катенин-CBP, с использованием соединений общей формулы (I), в особенности соединения общей формулы (VI).
Настоящее изобретение также относится к соединениям и способам ингибирования экспрессии сурвивина. Сурвивин представляет собой ген-мишень в пути, в который вовлечен TCF/бета-катенин, и, более конкретно, мишень в пути, вовлекающем TCF/бета-катенин/CBP. Он является членом семейства белков IAP (ингибитор апоптозного белка). Биологическая активность, ассоциированная с сурвивином, включает высокую экспрессию на стадии G2/M агентов, регулирующих вход и выход из клеточного цикла; ассоциацию с микротрубочками, центросомами, средним телом, зависящую от фаз клеточного цикла, и антиапоптоз через механизм прямого или опосредованного взаимодействия с каспазами (например, с каспазой 3, 7 и 9). В контексте рака, существенно, что сурвивин интенсивно экспрессируется во многих опухолевых клетках и экспрессируется в меньшей степени или вообще не экспрессируется в клетках нормальной ткани. Кроме того, показано, что раковые больные, у которых в опухоли экспрессируется сурвивин, характеризуются сниженным уровнем выживаемости. Кроме того, степень экспрессии сурвивина коррелирует с другими маркерами рака, например с Ki67, PNCA, p53, APC и т.п.
Действие конкретного соединения по настоящему изобретению на экспрессию сурвивина может быть охарактеризовано с использованием известных в данной области способов. Такие способы включают методики, используемые для характеристики экспрессии сурвивина на уровне транскрипции или трансляции. Примеры таких способов, применяемых для оценки экспрессии сурвивина на уровне транскрипции, включают анализ с использованием микроматрицы на основе кДНК, полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР), метод иммунопреципитации хроматина (ChIP) и тесты для оценки репортерной активности, осуществляемой под действием промотора сурвивина. Примеры способов, применяемых для оценки экспрессии сурвивина на уровне трансляции, включают вестерн-блоттинг, иммунохимический анализ, определение активности каспаз. Подробное описание указанных выше репрезентативных методик приведено ниже в примерах.
Как отмечалось выше, настоящее изобретение относится к способам ингибирования экспрессии сурвивина. Такие способы включают стадию приведения в контакт сурвивин-экспрессирующей клетки с соединением по настоящему изобретению в количестве, эффективном для ингибирования экспрессии сурвивина. Считается, что соединение ингибирует экспрессию сурвивина, если экспрессия сурвивина в клетке снижается в присутствии соединения в сравнении с экспрессией сурвивина в отсутствие такого соединения. Сурвивин-экспрессирующие клетки включают опухолевые клетки, которые его экспрессируют, такие как клетки, находящиеся в ткани или взятые из ткани, например ткани рака легкого, рака молочной железы, рака желудка, рака поджелудочной железы, рака печени, рака матки, рака яичника, глиом, меланомы, колоректального рака, лимфомы и лейкоза. Стадия приведения в контакт сурвивин-экспрессирующих клеткок с данным соединением может осуществляться in vitro, ex vivo или in vivo. Соединение, полезное в плане ингибирования экспрессии сурвивина, может быть идентифицировано, а эффект воздействия конкретного соединения по настоящему изобретению может быть охарактеризован с использованием соответствующих методик, известных в данной области, которые были подробно описаны выше.
Было показано, что соединения по настоящему изобретению ингибируют экспрессию сурвивина. Blanc-Brude et al. (Nat. Medicine 8:987 (2002)) показали, что сурвивин представляет собой ключевой регулятор, участвующий в процессе апоптоза гладкомышечных клеток, который важен при ремоделировании патологических процессов в сосудистой стенке. Соответственно, в другом аспекте настоящее изобретение относится к способу лечения или профилактики рестеноза, ассоциированного с ангиопластикой, включающему введение субъекту, при наличии такой необходимости, безопасного и эффективного количества миметика с обратной конфигурацией по настоящему изобретению. В одном варианте настоящее изобретение относится к лечению рестеноза, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту с рестенозом, с целью снижения тяжести, области поражения или степени и других показателей поражения при рестенозе. В другом варианте настоящее изобретение относится к профилактике рестеноза, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, в отношении которого ожидается возможность развития нового или дополнительного рестеноза, для снижения ожидаемых показателей тяжести, размеров очага поражения или его степени и других характеристик рестеноза. Данный субъект необязательно представляет собой млекопитающее.
Соединения по настоящему изобретению, как было показано, ингибируют транскрипцию TCF/В-катенина. Rodova et al. (J. Biol. Chem. 277: 29577 (2002)) показали, что промотор PKD-1 является мишенью на пути, опосредованном участием В-катенин/TCF. Соответственно, другой аспект настоящего изобретению относится к способу лечения или профилактики поликистоза почек, включающему введение субъекту, при наличии необходимости, безопасного и эффективного количества миметика с обратной конфигурацией по настоящему изобретению. В одном варианте настоящее изобретение относится к лечению поликистоза почек, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, имеющему поликистоз почек, с достижением снижения тяжести, размеров очага поражения, его степени и других показателей поражения при поликистозе почек. В другом варианте настоящее изобретение относится к профилактике поликистоза почек, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, в отношении которого ожидается возможность развития новой или дополнительной поликистозной болезни почек, с достижением снижения ожидаемой тяжести, размеров очага поражения, его степени и других показателей поликистоза почек. Необязательно данный субъект представляет собой млекопитающее.
Соединения по настоящему изобретению, как было показано, ингибируют экспрессию сигнального пути, в который вовлечен Wnt. Hanai et al. (J. Cell Biol. 158: 529 (2002)) показали, что эндостатин - известный ангиогенный фактор, ингибирует сигнальный механизм, опосредованный участием Wnt. Соответственно, другой аспект настоящего изобретению относится к способу лечения или профилактики аберрантного ангиогенеза, включающему введение субъекту, при наличии необходимости, безопасного и эффективного количества миметика с обратной конфигурацией по настоящему изобретению. В одном варианте настоящее изобретение относится к лечению аберрантного ангиогенеза, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту с аберрантным ангиогенезом, для снижения тяжести, размеров очага поражения, его степени и других показателей аберрантного ангиогенеза. В другом варианте настоящее изобретение относится к профилактике аберрантного ангиогенеза, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, в отношении которого ожидается возможность развития нового или дополнительного заболевания, определяемого аберрантным ангиогенезом, для снижения ожидаемой тяжести, размеров очага поражения, его степени и других показателей аберрантного ангиогенеза. Необязательно данный субъект представляет собой млекопитающее.
Соединения по настоящему изобретению, как было показано, ингибируют экспрессию сигнального пути, в который вовлечен Wnt. Sen et al. (P.N.A.S. (USA) 97: 2791 (2000)) показали, что млекопитающие с ревматоидным артритом характеризуются повышенной экспрессией Wnt и Fz в синовиальной ткани, пораженной РА. Соответственно, другой аспект настоящего изобретению относится к способу лечения или профилактики ревматоидного артрита, включающему введение субъекту, при наличии такой необходимости, безопасного и эффективного количества миметика с обратной конфигурацией по настоящему изобретению. В одном варианте настоящее изобретение относится к лечению ревматоидного артрита, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту с ревматоидным артритом, с достижением при этом снижения тяжести, размеров очага поражения, его степени и других показателей ревматоидного артрита. В другом варианте настоящее изобретение относится к профилактике ревматоидного артрита, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, в отношении которого ожидается возможность развития нового или дополнительного заболевания, определяемого ревматоидным артритом, для снижения ожидаемой тяжести, размеров очага поражения, его степени и других показателей ревматоидного артрита. Необязательно данный субъект представляет собой млекопитающее.
Соединения по настоящему изобретению, как было показано, ингибируют экспрессию сигнального пути, в который вовлечен Wnt. Uthoff et al. (Int. J. Oncol. 19: 803 (2001)) продемонстрировали дифференциальную позитивную регуляцию Disheveled и Fz (молекулы Wnt-пути) в случае язвенного колита (в сравнении с пациентами с болезнью Крона). Соответственно, другой аспект настоящего изобретению относится к способу лечения или профилактики язвенного колита, включающему введение субъекту, при наличии необходимости в таком лечении, безопасного и эффективного количества миметика с обратной конфигурацией по настоящему изобретению. В одном варианте настоящее изобретение относится к лечению язвенного колита, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, имеющему язвенный колит, с достижением при этом снижения тяжести, размеров очага поражения, его степени и других показателей язвенного колита. В другом варианте настоящее изобретение относится к профилактике язвенного колита, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, в отношении которого ожидается возможность развития нового или дополнительного поражения язвенным колитом, для снижения ожидаемой тяжести, размеров очага поражения, его степени и других показателей язвенного колита. Необязательно данный субъект представляет собой млекопитающее.
Соединения по настоящему изобретению, как было показано, ингибируют сигнальный механизм, в который вовлечен Wnt, TCF/катенин. Соответственно, другой аспект настоящего изобретению относится к способу лечения или профилактики туберозного склероза (TSC), включающему введение субъекту, при наличии такой необходимости, безопасного и эффективного количества миметика с обратной конфигурацией по настоящему изобретению. Субъекты с TSC обычно характеризуются развитием множественных очаговых поражений в головном мозге, сердце, почке и других тканях (см., например, Gomez, M. R. Brain Dev. 17(suppl): 55-57 (1995)). Исследования клеток млекопитающих показали, что суперэкспрессия TSC1 (который экспрессирует гамартин) и TSC2 (который экспрессирует туберин) приводит к отрицательной регуляции пролиферации клеток и индуцирует остановку G1/S перехода (см., например, Miloloza et al., Hum. Mol. Genet. 9: 1721-1727 (2000)). Другие исследования показали, что гамартин и туберин функционируют на уровне комплекса деградации β-катенина и, более конкретно, что эти белки оказывают отрицательное регулирующее воздействие на стабильность и активность β-катенина за счет участия в комплексе деградации β-катенина (см., например, Mak, B.C. et al., J. Biol. Chem. 278(8): 5947-5951, (2003)). Бета-катенин представляет собой белок размером 95 кДа, который участвует в клеточной адгезии за счет ассоциации с членами связанного с мембраной семейства кадгеринов, а также вовлекается в процессы пролиферации и дифференциации клеток в качестве ключевого компонента пути Wnt/Wingless (см., например, Daniels, D. L. et al., Trends Biochem. Sci. 26: 672-678 (2001)). Некорректная регуляция, возникающая при осуществлении данного пути, вызывает, как было показано, онкогенный эффект у людей и грызунов. Настоящее изобретение относится к соединениям, которые модулируют активность β-катенина и в особенности их взаимодействия с другими белками и которые, соответственно, могут использоваться при лечении TSC. Таким образом, в одном варианте настоящее изобретение относится к лечению TSC, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, имеющему TSC, с достижением при этом снижения тяжести, размеров очага поражения, его степени и других показателей TSC. В другом варианте настоящее изобретение относится к профилактике TSC, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, в отношении которого ожидается возможность развития нового или дополнительного поражения TSC, для снижения ожидаемой тяжести, размеров очага поражения, его степени и других показателей TSC. Необязательно данный субъект представляет собой млекопитающее.
Соединения по настоящему изобретению, как было показано, ингибируют экспрессию сигнального механизма, пути, в который вовлечен Wnt. Ядерный антиген, связанный с латентностью (LANA), определяющий развитие ассоциированной с герпес-вирусом саркомы Капоши, экспрессируется в KSHV-ассоциированных опухолях, включая саркому Капоши (KS) и β-клеточные злокачественные новообразования, такие как первичная эффузионная лимфома (PEL) и многоочаговая болезнь Кастлемена. Fujimuro, M. et al. (Nature Medicine 9(3): 300-306 (2003)) показали, что активность LANA в плане стабилизации β-катенина опосредована, по всей видимости, перераспределением отрицательного регулятора GSK-3 β. Настоящее изобретение относится к соединениям и способам, подходящим для ингибирования взаимодействий β-катенинового белка, например, для ингибирования образования комплекса β-катенин/TCF. Таким образом, соединения по настоящему изобретению нарушают LANA-индуцированную аккумуляцию комплекса β-катенин/TCF и, по меньшей мере частично, последствия инфекции KSHV. Соответственно, другой аспект настоящего изобретению относится к способу лечения или профилактики состояния, связанного с инфекцией ассоциированной с герпес-вирусом саркомой Капоши (KSHV). Указанные состояния включают KSHV-ассоциированные опухоли, такие как саркома Капоши (KS) и первичная эффузионная лимфома (PEL). Данный способ включает введение субъекту, при наличии необходимости, безопасного и эффективного количества миметика с обратной конфигурацией по настоящему изобретению. В одном варианте настоящее изобретение относится к лечению KSHV-ассоциированной опухоли, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, имеющему KSHV-ассоциированную опухоль, с достижением при этом снижения тяжести, размеров очага поражения, его степени и других показателей KSHV-ассоциированной опухоли. В другом варианте настоящее изобретение относится к профилактике KSHV-ассоциированной опухоли, например, посредством введения миметика с обратной конфигурацией по настоящему изобретению субъекту, в отношении которого ожидается возможность развития новых или дополнительных KSHV-ассоциированных опухолей, для снижения ожидаемой тяжести, размеров очага поражения, его степени и других показателей опухоли. Необязательно данный субъект представляет собой млекопитающее.
LEF/TCF ДНК-связывающие белки действуют в комплексе с активированным β-катенином (продуктом сигнального пути, в который вовлечен Wnt) для трансактивации генов-мишеней в направлении по ходу считывания информации. DasGgupta, R. и Fuchs, E. (Development 126(20): 4557-68 (1999)) продемонстрировали важность активированных комплексов LEF/TCF в конкретных временных точках в ходе развития волос и в циклическом процессе, в рамках которых наблюдаются изменения клеточной функции и переход к дифференцировке. Кроме того, было показано, что β-катенин является необходимым элементом кожного морфогенеза, участвующим в образовании волосяной фолликулы, и его суперэкспрессия вызывает «пушистый» фенотип у мышей (Gat et al., Cell 95: 605-614 (1998) и Fuchs, E Harvey Lect. 94: 47-48 (1999)). (См. также Xia, X. et al., Proc. Natl. Acad. Sci. USA 98: 10863-10868 (2001)). Соединения по настоящему изобретению, как было показано, ингибируют экспрессию сигнального механизма, в который вовлечен Wnt, и препятствуют образованию β-катениновых комплексов. Соответственно, настоящее изобретение относится к способу модуляции роста волос, включающему введение субъекту, при наличии необходимости, безопасного и эффективного количества миметика с обратной конфигурацией по настоящему изобретению, где указанное количество является эффективным для модуляции волос у субъекта. Необязательно данный субъект представляет собой млекопитающее.
Настоящее изобретение относится к соединениям, полезным при лечении или профилактике болезни Альцгеймера. Болезнь Альцгеймера (AD) представляет собой нейродегенеративное заболевание с прогрессирующей деменцией. Указанное заболевание сопровождается тремя основными структурными изменениями в мозге, а именно: отмечается i) отложение внутриклеточного белка (также известного, как нейрофибриллярное сплетение, или NFT), ii) отложение внеклеточного белка, называемого амилоидными бляшками, которые окружены дистрофическими невритами, и iii) диффузная потеря нейронов.
Соединения или композиции по настоящему изобретению позволяют избежать дефектов в нейрональной дифференцировке, вызываемых мутацией в презенелине-1, и снижать уровень или скорость дифференцировки популяции нейрональных предшественников в нейроны, наблюдаемые в головном мозге при болезни Альцгеймера. Презенилины представляют собой трансмембранные белки, функции которых связаны с передвижением, метаболизмом и расщеплением Notch белка и амилоидного белка-предшественника. Миссенс-мутации в презенилине-1 (PS-1) ассоциированы с ранним развитием семейной болезни Альцгеймера (Fraser et al., Biochem. Soc. Symp. 67, 89 (2001)). Соединения по настоящему изобретению могут применяться не только индивидуумами с семейной болезнью Альцгеймера типа PS-1, но также и пациентами с болезнью Альцгеймера из основной группы.
Дополнительно, настоящее изобретение относится к способу лечения и профилактики болезни Альцгеймера, включающему введение субъекту, при наличии такой необходимости, безопасного и эффективного количества миметика с обратной конфигурацией по настоящему изобретению, где указанное количество является эффективным для лечения или профилактики болезни Альцгеймера у субъекта. Под лечением в контексте болезни Альцгеймера следует понимать снижение или устранение проявления симптомов, характерных для болезни Альцгеймера, или задержку развития данного заболевания. Под профилактикой болезни Альцгеймера следует понимать предотвращение или задержку начала данного заболевания.
Субъектом, нуждающимся в таком лечении, может быть человек, или примат, отличный от человека, или другое животное, которое имеет болезнь Альцгеймера на разных стадиях ее развития. Способы диагностики болезни Альцгеймера известны в данной области (см., например, Dinsmore, J. Am. Osteopath. Assoc. 99(9 Suppl): S1-6, 1999; Kurz et al., J. Neural Transm Suppl. 62: 127-33, 2002; Storey et al., Front Viosci. 7: e155-84, 2002; Marin et al., Geriatrics 57: 36-40, 2002; Kril and Halliday, Int. Rev. Neurobiol. 48: 167-217, 2001; Gurwitz, Trends Neurosci. 23: 386, 2000; Muller-Spahn and Hock, Eur. Arch. Psychiatry Clin. Neurosci. 249 Suppl. 3: 37-43; Fox and Rossor, Rev. Neuro. (Paris) 155 Suppl. 4: S33-7, 1999), которые включают применение нейропсихологических мероприятий, способов оценки функционального состояния, биологических маркеров и аутопсию тканей мозга. Субъектом, нуждающимся в профилактике, может быть человек, или примат, отличный от человека, или другое животное, которое имеет риск развития болезни Альцгеймера, такой как индивидуум, имеющий мутацию в некоторых генах, ответственных за данное заболевание (в генах, кодирующих амилоидный белок-предшественник, презенилин-1 и презенилин-2), и/или в гене, вовлеченном в патогенез данного заболевания (например, в гене Е аполипопротеина) (Rocchi et al., Brain Res. Bull. 61: 1-24, 2003).
Соединения со структурой, описываемой формулой (I), могут быть оценены при проведении скрининга на наличие у них активности, подходящей для их использования при лечении или профилактике болезни Альцгеймера, в рамках любого подходящего способа из числа имеющихся в данной области. Такой скрининг вначале может быть проведен в культуре клеток in vitro (например, PC-12 клеток, как описано в примере 8). Соединения, способные спасти от дефектов в нейрональной дифференцировке, вызываемых мутациями в презенилине-1, могут быть также подвергнуты скринингу на различных моделях животных, используемых для изучения болезни Альцгеймера. Альтернативно, соединения, имеющие структуру указанной формулы (I), могут быть непосредственно протестированы на моделях животных, применяемых при изучении болезни Альцгеймера. Многие модельные системы, известные в данной области, могут использоваться при осуществлении настоящего изобретения (см., например, Rowan et al., Philos. Trans. R. Soc. Lond. B. Biol. Sci. 358: 821-8, 2003; Lemere et al., Neurochem. Res. 28: 1017-27, 2003; Sant'Angelo et al., Neurochem, Res. 28: 1009-15, 2003; Weiner Harv. Rev. Psychiatry 4: 306-16, 1997). Эффекты выбранных соединений на результаты лечения или профилактики болезни Альцгеймера могут быть оценены или отслежены с использованием известных в данной области методик, которые применяются для оценки прогрессирования болезни Альцгеймера, и в том числе указанных выше методик диагностики данного заболевания.
Настоящее изобретение также относится к способам усиления разрастания нейрита. Такие способы включают стадию взаимодействия нейрона с соединением формулы (I) в количестве, эффективном для увеличения длины нейрита. Такие способы полезны при лечении нейродегенеративных заболеваний (например, глаукомы, макулярной дегенерации, болезни Паркинсона и болезни Альцгеймера), а также при поражении нервной системы. Считается, что соединение способствует разрастанию нейрита, если длины нейритов в нейронах статистически значимо выше в присутствии рассматриваемого соединения, чем в отсутствие такого соединения. Такое соединение может быть идентифицировано в культуре клеток in vitro (например, РС-12 клеток, В104 клеток нейробластомы) (Bitar et al., Cell Tissue Res. 298: 233-42, 1999; Pellitteri et al., Eur. J. Histochem. 45: 367-76, 2001; Satoh et al., Biochem. Biophys. Res. Commun. 258; 50-3, 1999; Hirata and Fuhisawa J. Neurobiol. 32: 415-25, 1997; Chauvet et al., Glia 18: 211-23, 1996; Vetter and Bishop, Curr. Biol. 5: 168-78, 1994; Koo et al., Proc. Natl. Acad. Sci. USA. 90: 4748-52, 1993; Skubitz et al., J. Cell Biol. 115: 1137-48, 1991; O'Shea et al., Neuron 7: 231-7, 1991; Rydel and Greene, Proc. Natl. Acad. Sci. USA. 85: 1257-61, 1988) или с использованием эксплантатов (Kato et al., Brain Res. 31: 143-7, 1983; Vanhems et al., Eur. J. Neurosci. 2: 776-82, 1990; Carri et al., Int. J. Dev. Neurosci. 12: 567-78, 1994). Взаимодействие нейрона с соединением по настоящему изобретению может быть осуществлено in vitro или in vivo. Полученный после такого воздействия in vitro нейрон может быть далее трансплантирован в ткань при соответствующей необходимости (Lacza et al., Brain Res. Protoc. 11: 145-54, 2003; Chu et al., Neurosci. Lett 343: 129-33, 2003; Fukunaga et al., Cell Transplant 8: 435-41, 1999).
Настоящее изобретение также относится к способам усиления дифференцировки невральной стволовой клетки, включающим взаимодействие невральной стволовой клетки с соединением формулы (I) в количестве, эффективном для усиления дифференцировки невральной стволовой клетки. Такие способы также полезны при лечении нейродегенеративных заболеваний (например, глаукомы, макулярной дегенерации, болезни Паркинсона и болезни Альцгеймера), а также при повреждении нервной системы. Термин «невральная стволовая клетка» относится к клоногенной, недифференцированной, мультипотентной клетке, способной в соответствующих условиях дифференцироваться в нейрон, астроцит или олигодендроцит. Считается, что соединение усиливает дифференцировку невральных стволовых клеток, если невральные стволовые клетки демонстрируют статистически значимую более высокую степень дифференцировки в присутствии соединения, чем в отсутствие соединения. Такое соединение может быть идентифицировано с помощью способов, в которых используют культивируемые in vitro стволовые клетки или модели животных (Albranches et al., Biotechnol. Lett. 25: 725-30, 2003; Deng et al., Exp. Neurol. 182: 373-82, 2003; Munoz-Elias et al., Stem Cells 21: 437-48, 2003; Kudo et al., Biochem. Pharmacol. 66: 289-95, 2003; Wan et al., Chin. Med. J. 116: 428-31, 2003; Kawamorita et al., Hum. Cell 15: 178-82, 2002; Stavridis and Smith, Biochem. Soc. Trans. 31: 45-9, 2003; Pachernik et al., Reprod. Nutr. Dev. 42: 317-26, 2002; Fukunaga et al., supra). Невральная стволовая клетка может представлять собой культивируемую стволовую клетку, стволовую клетку, свежевыделенную из ткани-источника, или стволовую клетку внутри организма-источника. Таким образом, взаимодействие невральной стволовой клетки с соединением по настоящему изобретению может быть осуществлено in vitro (в случае культивируемых или свежевыделенных стволовых клеток) или in vivo (в случае стволовой клетки, находящейся в организме-источнике). Полученная дифференцированная стволовая клетка после ее обработки in vitro может быть трансплантирована далее в ткань, которая нуждается в таком воздействии (Lacza et al., supra, Chu et al., supra, Fukunaga et al., supra). Такая ткань включает ткань мозга или другую нервную ткань, которая страдает от последствий травмы или нейродегенеративного заболевания.
Приведенные ниже неограничивающие примеры иллюстрируют соединения, композиции и способы их использования согласно настоящему изобретению.
ПРИМЕРЫ
ПРЕПАРАТИВНЫЙ ПРИМЕР 1
Получение (N-Fmoc-N'-R3-гидразино)уксусной кислоты
(1) Получение N-Fmoc-N'-метилгидразина
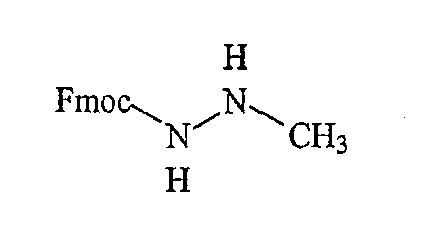
Двугорлую круглодонную колбу объемом 2 литра закрывают стеклянной пробкой и вставляют кальциевую трубку. Добавляют раствор сульфата метилгидразина (20 г, 139 ммоль, где R3 обозначает метил) в ТГФ (300 мл) и затем раствор DiBoc (33 г, 153 ммоль) в ТГФ. Насыщенный водный раствор бикарбоната натрия (500 мл) добавляют по каплям через капельную воронку в течение 2 часов при энергичном перемешивании. Через 6 часов медленно добавляют раствор Fmoc-Cl (39 г, 153 ммоль) в ТГФ. Полученную суспензию перемешивают в течение 6 часов при 0°С. Далее смесь экстрагируют этилацетатом (ЭА, 500 мл) и оставляют органический слой. Раствор сушат с сульфатом натрия и выпаривают в вакууме. Следующую стадию проводят без очистки.
Двугорлую круглодонную колбу объемом 1 литр закрывают стеклянной пробкой и вставляют кальциевую трубку. Вводят раствор продукта, полученного на предыдущей стадии в MeOH (300 мл) и медленно добавляют через капельную воронку концентрированную HCl (30 мл, 12 н.) на ледяной бане с магнитной мешалкой и перемешивают в течение ночи. Смесь экстрагируют ЭА (1000 мл) и оставляют органический слой. Данный раствор сушат сульфатом натрия и затем выпаривают в вакууме. Остаток очищают рекристаллизацией из н-гексана и ЭА с получением N-Fmoc-N'-метилгидразина (32,2 г, 83%).
1H-ЯМР (ДМСО-d6) δ 7,90-7,88 (д, J=6 Гц, 2H), 7,73-7,70 (д, J=9 Гц, 2H), 7,44-7,31 (м, 4H), 4,52-4,50 (д, J=6 Гц, 2H), 4,31-4,26 (т, J=6 Гц, 1H), 2,69 (с, 1H).
(2) Получение сложного трет-бутилового эфира (N-Fmoc-N'-метилгидразино)уксусной кислоты
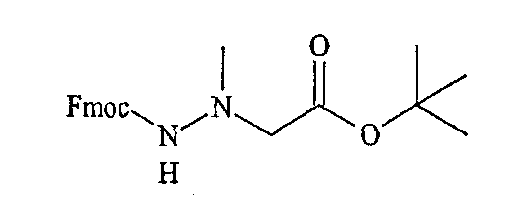
Двугорлую круглодонную колбу объемом 1 литр закрывают стеклянной пробкой и присоединяют обратный холодильник к кальциевой трубке. Добавляют раствор N-Fmoc-N'-метилгидразина (20 г, 75 ммоль) в толуоле (300 мл). Медленно добавляют раствор трет-бутилбромацетата (22 г, 111 ммоль) в толуоле (50 мл). Медленно добавляют Cs2CO3 (49 г, 149 ммоль). Медленно добавляют NaI (11 г, 74 ммоль) при энергичном встряхивании. Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 1 дня. Смесь, содержащую продукт, фильтруют и экстрагируют этилацетатом (500 мл). Полученный раствор сушат над сульфатом натрия и выпаривают в вакууме. Продукт очищают хроматографией с использованием смеси гексан:этилацетат (2:1) с получением сложного трет-бутилового эфира (N-Fmoc-N'-метилгидразино)уксусной кислоты (19,8 г, 70%).
1H-ЯМР (CDCl3-d) δ 7,78-7,75 (д, J=9 Гц, 2H), 7,61-7,59 (д, J=6 Гц, 2H), 7,43-7,26 (м, 4H), 4,42-4,40 (д, J=6 Гц, 2H), 4,23 (ушир., 1H), 3,57 (с, 2H), 2,78 (с, 3H), 1,50 (с, 9H).
(3) Получение (N-Fmoc-N'-метилгидразино)уксусной кислоты

Двугорлую круглодонную колбу объемом 1 литр закрывают стеклянной пробкой и присоединяют обратный холодильник к кальциевой трубке. Добавляют сложный трет-бутиловый эфир (N-Fmoc-N'-метилгидразино)уксусной кислоты (20 г, 52 ммоль). Медленно, при энергичном встряхивании в бане с ледяной водой добавляют раствор HCl (150 мл, 4 М раствор в диоксане). Реакционную смесь перемешивают при комнатной температуре в течение 1 дня. Далее раствор полностью концентрируют при пониженном давлении при 40°С. Добавляют насыщенный водный раствор NaHCO3 (100 мл) и водный слой промывают диэтиловым эфиром (100 мл). Медленно, по каплям добавляют концентрированную HCl при 0°С (pH 2-3). Смесь экстрагируют и оставляют органический слой (500 мл, МС). Раствор сушат над сульфатом натрия и выпаривают в вакууме. Остаток очищают перекристаллизацией с использованием н-гексана и этилацетата с получением (N-Fmoc-N'-метилгидразино)уксусной кислоты (12 г, 72%).
1H-ЯМР (ДМСО-d6) δ 12,38 (с, 1H), 8,56 (ушир., 1Н), 7,89-7,86 (д, J=9 Гц, 2H), 7,70-7,67 (д, J=9 Гц, 2H), 7,43-7,29 (м, 4H), 4,29-4,27 (д, J=6 Гц, 2H), 4,25-4,20 (т, J=6 Гц, 1H), 3,47 (с, 2H), 2,56 (с, 3H).
ПРЕПАРАТИВНЫЙ ПРИМЕР 2
Получение (N-Moc-N'-R7-гидразино)уксусной кислоты
(1) Получение сложного этилового эфира (N'-метоксикарбонилгидразино)уксусной кислоты
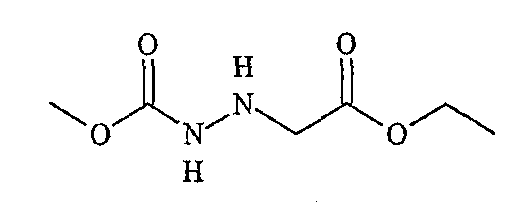
MOC-NH-NH2 (50 г, 0,55 моль) растворяют в ДМФА (300 мл) и затем в реакционный сосуд добавляют этилбромацетат (68 мл, 0,555 моль) и карбонат калия (77 г, 0,555 моль). Смесь нагревают до 50°С в течение 5 часов. После завершения реакции смесь фильтруют, разбавляют с использованием EtOAc и промывают насыщенным раствором соли (три раза). Неочищенный продукт очищают на колонке (элюент: гексан/EtOAc = 4/1) с получением 72 г бесцветного масла.
(2) Этиловый сложный эфир [N-R7-N'-метоксикарбонилгидразино]уксусной кислоты
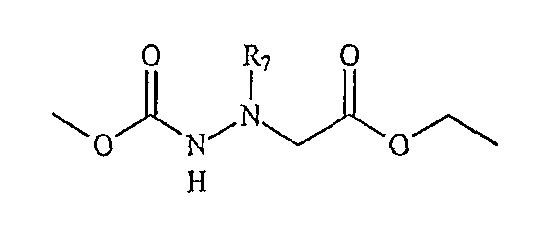
Этиловый сложный эфир (10 г, 0,05 моль), карбонат калия (6,9 г, 0,05 моль) и R7-бромид (14,1 г, 0,06 моль) растворяют в ДМФА (200 мл) и полученную смесь нагревают до 50°С в течение 5 часов. После завершения реакции смесь фильтруют, разбавляют этилацетатом и промывают насыщенным раствором соли (три раза). Неочищенный продукт очищают хроматографией на колонке (элюент: гексан/EtOAc = 4/1).
(3) [N-R7-N'-метоксикарбонилгидразино]уксусная кислота
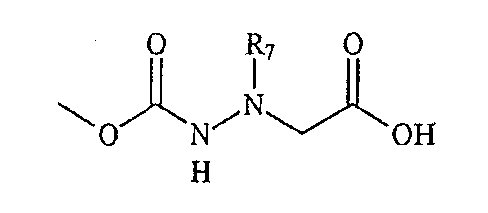
Алкилированный этиловый сложный эфир (9,5 г, 0,03 моль) растворяют в смеси ТГФ/вода (1/1 мл) и добавляют 2 н. раствор NaOH (28,3 мл) при 0°С. Смесь перемешивают при комнатной температуре в течение 2 часов. После того как исходный сложный эфир уже не выявляется в УФ, раствор разбавляют этилацетатом и отделяют. Водный слой подкисляют до pH 3-4 с использованием 1 н. NCl и соединение экстрагируют DCM (три раза). Объединенный органический слой сушат над MgSO4 и выпаривают с получением желтого твердого вещества.
ПРИМЕР 1
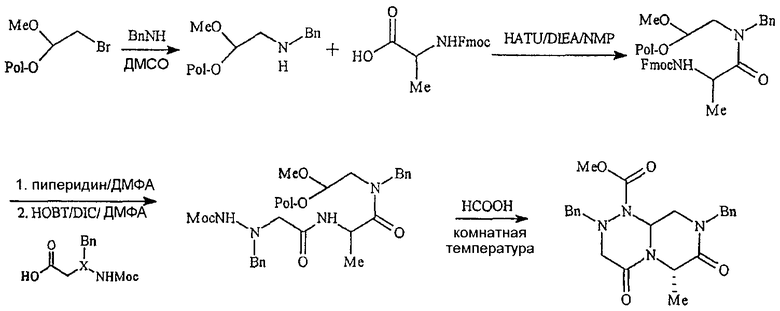
(1) Получение Nβ-Moc-Nα-бензилгидразиноглицина
Это соединение получают по описанной в литературе методике (Cheguillaume et al., Synlett 2000, 3, 311).
(2) Получение 1-метоксикарбонил-2,8-дибензил-6-метил-4,7-диоксогексагидропиразино[2,1-с][1.2.4]триазина
Бромацеталевую смолу (60 мг, 0,98 ммоль/г) и раствор бензиламина в ДМСО (2,5 мл, 2 М) помещают во флакон с закручивающимся колпачком. Реакционную смесь встряхивают при 60°С с использованием вращающейся печи [Robbins Scientific] в течение 12 часов. Смолу собирают фильтрованием, промывают ДМФА и затем DCM с получением первой компонентной части.
К смоле добавляют раствор Fmoc-аланина (4 эквив., коммерчески доступный, в качестве второй компонентной части), HATU (PerSeptive Biosystems, 4 эквив.) и DIEA (4 эквив.) в NMP (Advanced ChemTech). После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM и затем ДМФА.
К смоле добавляют 20% пиперидин в ДМФА. После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM и затем снова ДМФА.
К приготовленной по описанной выше методике смоле добавляют раствор Nβ-Moc-Nα-бензилгидразиноглицина (4 эквив. соединения (3), полученного в рамках препаративного примера 2, где R7 обозначает бензил, в качестве 3-й компонентной части), HOBT (Advanced ChemTech) (4 эквив.) и DIC (4 эквив.) в ДМФА. После встряхивания реакционной смеси в течение 3 часов при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM и затем MeOH. Смолу сушат в вакууме при комнатной температуре.
Смолу обрабатывают муравьиной кислотой (2,5 ил) в течение 18 часов при комнатной температуре. После удаления смолы фильтрованием фильтрат конденсируют при пониженном давлении с получением продукта в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ м.д.: 1,51 (д, 3H), 2,99 (м, 1H), 3,39 (д, 1H), 3,69 (м, 1H), 3,75 (м, 1Н), 3,82 (с, 3Н), 4,02 (д, 1Н), 4,24 (д, 1H), 4,39 (д, 1Н), 4,75 (д, 1Н), 5,14 (кв., 1H), 5,58 (дд, 1Н), 7,10-7,38 (м, 10H).
ПРИМЕР 2
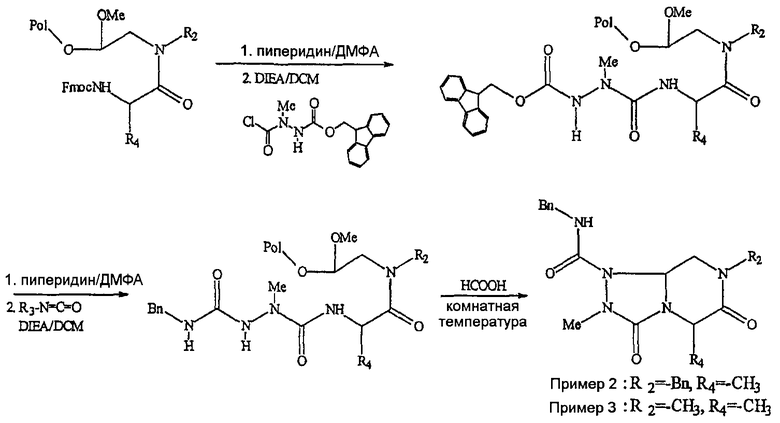
(1) Получение N'-Fmoc-N-метилгидразинокарбонилхлорида
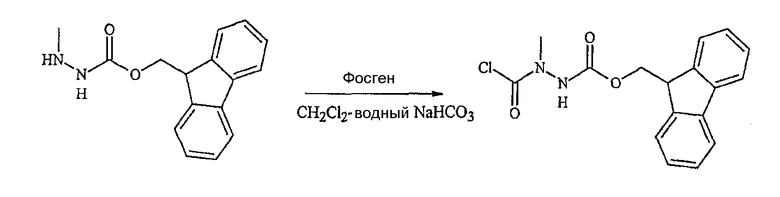
Охлажденную льдом двухфазную смесь 9Н-флуорен-9-илметилового сложного эфира N-метилгидразинкарбоновой кислоты (107 мг, 0,4 ммоль) в 15 мл CH2Cl2 и 15 мл насыщенного водного NaHCO3 быстро перемешивают при добавлении в виде одной порции 1,93 M фосгена в толуоле (1,03 мл, 2 ммоль). Реакционную смесь перемешивают в течение 30 минут, собирают органическую фазу и водную фазу экстрагируют CH2Cl2. Объединенные органические слои сушат над MgSO4, фильтруют и конденсируют в вакууме с получением 128 мг (97%) карбамоилхлорида в виде пенистого твердого вещества. [Осторожно: пары фосгена очень токсичны. Работать только в вытяжном шкафу]. Данный продукт используют на следующей стадии твердофазного синтеза без дополнительной очистки.
(2) Получение бензиламида 2,5-диметил-7-бензил-3,6-диоксогексагидро[1.2.4]триазоло[4,5-a]пиразин-1-карбоновой кислоты
Бромацеталевую смолу (30 мг, 0,98 ммоль/г) и раствор бензиламина в ДМСО (1,5 мл, 2 М) помещают во флакон с закручивающимся колпачком. Реакционную смесь встряхивают при 60°С с использованием вращающейся печи [Robbins Scientific] в течение 12 часов. Смолу собирают фильтрованием, промывают ДМФА и затем DCM с получением первой компонентной части.
К смоле добавляют раствор Fmoc-аланина (3 эквив., коммерчески доступный, в качестве второй компонентной части), HATU (PerSeptive Biosystems, 3 эквив.) и DIEA (3 эквив.) в NMP (Advanced ChemTech). После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM, затем снова ДМФА и добавляют вторую компонентную часть к первой компонентной части.
К смоле добавляют 20% пиперидин в ДМФА. После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM и затем снова ДМФА.
К смоле, приготовленной ранее, добавляют раствор N'-Fmoc-N-метилгидразинокарбонилхлорида (при объединении третьей и четвертой компонентных частей, 5 эквив.), полученного на стадии (1), и DIEA (5 эквив.) в DCM. После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM и ДМФА.
К смоле добавляют 20% пиперидин в ДМФА (10 мл на 1 г смолы). После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирают фильтрованием и промывают ДМФА, DCM и затем ДМФА.
Смолу обрабатывают смесью бензилизоцианата (4 эквив.) и DIEA (4 эквив.) в DCM в течение 4 часов при комнатной температуре. Затем смолу собирают фильтрованием и промывают ДМФА, DCM и затем MeOH. Смолу сушат в вакууме при комнатной температуре.
Смолу обрабатывают муравьиной кислотой в течение 14 часов при комнатной температуре. После удаления смолы фильтрованием фильтрат конденсируют при пониженном давлении с получением продукта в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ м.д.: 1,48 (д, 3H), 2,98 (с, 3H), 3,18 (м, 1H), 3,46 (м, 1H), 4,37-4,74 (м, 5H), 5,66 (дд, 1H), 6,18 (м, 1H), 7,10-7,40 (м, 10H).
ПРИМЕР 3
Получение бензиламида 2,5,7-триметил-3,6-диоксогексагидро[1.2.4]триазоло[4,5-a]пиразин-1-карбоновой кислоты
Указанное в заголовке соединение получают согласно той же процедуре, которая описана в примере 2, но при использовании в реакции с бромацеталевой смолой раствора метиламина вместо бензиламина.
1H-ЯМР (400 МГц, CDCl3) δ м.д.: 1,48 (д, 3H), 2,99 (с, 3H), 3,03 (с, 3H), 3,38 (м, 1H), 3,53 (дд, 1H), 4,36 (дд, 1H), 4,52 (кв., 1H), 4,59 (дд, 1H), 5,72 (дд, 1H), 6,19 (ушир.т, 1H), 7,10-7,38 (м, 5H).
ПРИМЕР 4
Получение бензиламида 2-метил-5-(п-гидроксифенилметил)-7-нафтилметил-3,6-диоксогексагидро[1.2.4]триазоло[4,5-a]пиразин-1-карбоновой кислоты
Бромацеталевую смолу (30 мг, 0,98 ммоль/г) и раствор нафтилметиламина в ДМСО (1,5 мл, 2 М) помещают во флакон с закручивающимся колпачком. Реакционную смесь встряхивают при 60°С с использованием вращающейся печи [Robbins Scientific] в течение 12 часов. Смолу собирают фильтрованием, промывают ДМФА, затем DCM с получением первой компонентной части.
К смоле добавляют раствор Fmoc-Tyr(OBut)-OH (3 эквив.), HATU (PerSeptive Biosystems, 3 эквив.) и DIEA (3 эквив.) в NMP (Advanced ChemTech). После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM, затем снова ДМФА и добавляют вторую компонентную часть к первой компонентной части.
К смоле добавляют 20% пиперидин в ДМФА. После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM и затем ДМФА.
К приготовленной выше смоле добавляют раствор N'-Fmoc-N-метилгидразинокарбонилхлорида (5 эквив.) и DIEA (5 эквив.) в DCM. После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM и ДМФА.
К смоле добавляют 20% пиперидин в ДМФА (10 мл на 1 г смолы). После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирают фильтрованием и промывают ДМФА, DCM и затем ДМФА.
Смолу обрабатывают смесью бензилизоцианата (4 эквив.) и DIEA (4 эквив.) в DCM в течение 4 часов при комнатной температуре. Затем смолу собирают фильтрованием и промывают ДМФА, DCM и затем MeOH. Смолу сушат в вакууме при комнатной температуре.
Смолу обрабатывают муравьиной кислотой в течение 14 часов при комнатной температуре. После удаления смолы фильтрованием фильтрат конденсируют при пониженном давлении с получением продукта в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ м.д.: 2,80-2,98 (м, 5H), 3,21-3,37 (м, 2H), 4,22-4,52 (м, 2H), 4,59 (т, 1H), 4,71 (д, 1H), 5,02 (дд, 1H), 5,35 (д, 1H), 5,51 (д, 1H), 6,66 (т, 2H), 6,94 (дд, 2H), 7,21-8,21 (м, 12H).
ПРИМЕР 5
Получение бензиламида 2-метил-6-(п-гидроксифенилметил)-8-нафтил-4,7-диоксогексагидропиразино[2,1-с][1.2.4]триазин-1-карбоновой кислоты
Бромацеталевую смолу (60 мг, 0,98 ммоль/г) и раствор нафтиламина в ДМСО (2,5 мл, 2 М) помещают во флакон с закручивающимся колпачком. Реакционную смесь встряхивают при 60°С с использованием вращающейся печи [Robbins Scientific] в течение 12 часов. Смолу собирают фильтрованием, промывают ДМФА, затем DCM.
К смоле добавляют раствор Fmoc-Tyr(OBut)-OH (4 эквив.), HATU [PerSeptive Biosystems] (4 эквив.) и DIEA (4 эквив.) в NMP (Advanced ChemTech). После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM и затем ДМФА.
К смоле добавляют 20% пиперидин в ДМФА. После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирают фильтрованием, промывают ДМФА, DCM и затем ДМФА.
К приготовленной по описанной выше методике смоле добавляют раствор Nβ-Fmoc-Nα-бензилгидразиноглицина (4 эквив.), HOBT [Advanced ChemTech] (4 эквив.) и DIC (4 эквив.) в ДМФА. После встряхивания реакционной смеси в течение 3 часов при комнатной температуре смолу собирают фильтрованием, промывают ДМФА и затем DCM. К смоле добавляют 20% пиперидин в ДМФА (10 мл на 1 г смолы). После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирают фильтрованием и промывают ДМФА, DCM и затем ДМФА.
Смолу обрабатывают смесью бензилизоцианата (4 эквив.) и DIEA (4 эквив.) в DCM в течение 4 часов при комнатной температуре. Затем смолу собирают фильтрованием и промывают ДМФА, DCM и затем MeOH. Смолу после сушки в вакууме при комнатной температуре обрабатывают муравьиной кислотой (2,5 мл) в течение 18 часов при комнатной температуре. После удаления смолы фильтрованием фильтрат конденсируют при пониженном давлении с получением продукта в виде масла.
1H-ЯМР (400 МГц, CDCl3) δ м.д.: 2,73 (с, 3H), 3,13 (д, 1H), 3,21-3,38 (м, 3H), 3,55 (д, 1H), 3,75 (т, 1H), 4,22 (дд, 1H), 4,36 (дд, 1H), 4,79 (д, 1H), 5,22 (т, 1H), 5,47 (м, 2H), 6,68 (д, 2H), 6,99 (д, 2H), 7,21-8,21 (м, 12H);
МС (m/z, ESI) 564,1 (MH+) 586,3 (MNa+).
ПРИМЕР 6
Биотест для определения показателя IC50 для клеток SW480
и тест на цитотоксичность для клеточных линий
Используемое в данном примере соединение, подлежащее тестированию (соединение А), получают по методике примера 4.
а. Тест для оценки репортерного гена
Клетки SW480 обрабатывают при использовании трансфицирующего реагента SuperfectTM (Qiagen, 301307). За 1 день до трансфекции клетки подвергают легкой обработке трипсином и вносят в 6-ячеечный планшет (5×105 клеток/ячейку), так что в день трансфекции достигается уровень конфлюентности 50-80%.
Четыре микрограмма (TOPFlash) и один микрограмм (pRL-null) ДНК разбавляют с использованием 150 мкл бессывороточной среды и добавляют 30 мкл трансфицирующего реагента SuperfectTM. Смесь ДНК/Superfect инкубируют при комнатной температуре в течение 15 минут, затем к данному комплексу добавляют 1 мл 10% FBS-DMEM и оставляют еще на 3 часа для инкубации. При образовании комплексов клетки промывают 2 раза PBS без антибиотиков.
К клеткам добавляют комплексы ДНК/трансфицирующий реагент SuperfectТМ и проводят инкубацию при 37°С в атмосфере 5% CO2 в течение 3 часов. После инкубации добавляют восстанавливающую среду, содержащую 10% FBS, доводя конечный объем до 1,18 мл. После инкубации в течение 3 часов клетки собирают и пересевают в 96-ячеечный планшет (3×104 клеток/ячейку). После ночной инкубации при 37°С в атмосфере 5% CO2 клетки обрабатывают соединением А в течение 24 часов. В итоге измеряют активность в рамках теста на люциферазу (Promega, E1960).
На фиг.3 проиллюстрированы результаты определения показателя IC50 для соединения А в клетках SW480.
b. Тест с использованием сульфородамина B (SRB)
Ростингибирующий эффект соединения А на перечисленные ниже клетки оценивают в тесте с сульфородамином B. Клетки SW480 в 100 мкл среды вносят в каждую ячейку 96-ячеечного планшета и оставляют для прикрепления на 24 часа. К ячейкам до желательных конечных концентраций добавляют соединение А и планшет инкубируют при 37°С в течение 48 часов. Затем клетки фиксируют при осторожном добавлении к каждой ячейке 100 мкл холодной (4°С) 10% трихлоруксусной кислоты и проводят инкубацию при 4°С в течение 1 часа. Планшеты промывают пять раз деионизированной водой и оставляют для сушки на воздухе. Затем клетки окрашивают при добавлении к ячейкам на 15 минут 100 мкл раствора SRB (0,4% SRB (вес/объем) в 1% уксусной кислоте (объем/объем)). После окрашивания планшеты быстро промывают пять раз 1% уксусной кислотой для удаления несвязанного красителя и оставляют для сушки на воздухе. Перед измерением оптической плотности содержимого планшетов связанный краситель солюбилизируют с использованием 10 ммоль/л Трис основания (pH 10,5). Оптическую плотность (ОП) измеряют при длине волны 515 нм на счетчике для планшетов Molecular Device. Ингибирование роста выражают в виде относительной жизнеспособности клеток (% от контроля) и вычисляют показатель GI50 с использованием кривой концентрация-ответ после проведения преобразования log/пробит.
В таблице 6 приведены результаты теста на цитотоксичность in vitro (SRB) для соединения А, полученного по процедуре примера 4. Данные в таблице 6 приведены в мкг/мл.
ПРИМЕР 7
Модель с использованием мышей линии min
Выбранные соединения по настоящему изобретению (соединение B и соединение С) оценивают на модели мышей min для оценки их эффективности в качестве антираковых средств.
соединение В
соединение С
Мыши линии min представляют собой широко используемую модель для тестирования указанного типа эффективности. Подсчитывают количество полипов, образованных в тонком кишечнике и в толстой кишке мышей после различных видов обработки (таблица 7). Полученные данные показывают, что оба соединения при введении в дозе примерно 300 мг/кг снижают количество полипов у мышей линии min в сравнении с их количеством у контрольных мышей, обработанных только носителем.
Данные, полученные с использованием мышей линии min
(160 м.д.)
ПРИМЕР 8
Хемогеномное ингибирование взаимодействия CBP/β-катенин
спасает от дефектов нейрональной дифференциации,
вызванной мутацией презенилина-1
В данном примере используют приведенное ниже соединение (соединение D):
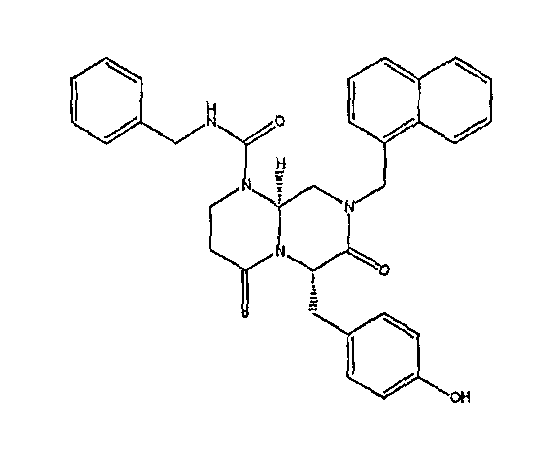
Материалы и методы
Плазмиды. Репортерные конструкции TOPFLASH и FOPFLASH трансформируют в компетентные клетки DH5α по стандартной процедуре. Плазмиды, используемые для анализа трансфекции, выделяют и очищают с использованием набора EndoFree Maxi Kit (Qiagen, Valencia, CA).
Культура клеток PC-12. Клетки PC-12 поддерживают на среде RPMI 1640 с добавкой 10% лошадиной сыворотки, 5% фетальной сыворотки теленка, 4,5 г/л глюкозы, 2 мМ L-глутамина, 1,0 мМ пирувата натрия и 10 мкг/мл пенициллина-стрептомицина.
Клеточная дифференцировка. На чашки с клеточной культурой наслаивают на ночь коллаген в концентрации 0,25 мг/мл (Cohesion, CA), 10 мкг/мл поли-L-лизина (Sigma-Aldrich, St. Louis, MO) и 12 мкг/мл полиэтиленимина (ICN, La Mesa, CA). Клетки культивируют на покрытых чашках с полностью 15000 клеток/см2, и далее отмечается их дифференциация до нейроно-подобного фенотипа при инкубации в среде со сниженным содержанием сыворотки (1% фетальной сыворотки теленка), содержащей 50 мг/мл фактора роста нервной ткани (NGF) (Sigma-Aldrich) в течение 10 дней. NGF-содержащую среду меняют каждые 2-3 дня.
Обработка соединением D. Соединение D, представляющее собой малую молекулу ингибитора взаимодействия β-катенин/CBP, растворяют в ДМСО с концентрацией 100 мМ. Дифференцированные клетки PC-12/L286V обрабатывают возрастающими концентрациями данного соединения в течение 4 часов. После окончания периода обработки инициируют трансфекцию. Для проведения эксперимента по клеточной дифференциации добавляют соединение D в концентрации 10 мкм вместе с NGF на весь период дифференцировки.
Трансфекция. Клетки PC-12 культивируют с достижением их дифференцировки на чашках диаметром 60 мм. В конце 10-дневного периода дифференцировки клетки подвергают трансфекции репортерными конструкциями TOPFLASH и FOPFLASH по 2 мкг на чашку диаметром 60 мм. Трансфекцию проводят с использованием реагента Superfect (Qiagen) в соответствии с инструкциями производителя.
Люциферазные тесты. Клетки лизируют через 6 часов после трансфекции с внесением 100 мкл лизирующего реагента в культуру клеток (Promega, Madison, WI) и соскребают лизированный материал в микроцентрифужные пробирки. Затем пробирки подвергают центрифугированию в течение короткого периода времени (примерно 10 секунд) со скоростью 12000 об/мин для осаждения клеточных осколков. Люциферазную активность измеряют в смеси 20 мкл клеточного лизата и 100 мкл субстрата, получаемого от компании Luciferase Assay System (Promega). Люциферазную активность измеряют с использованием счетчика Packard LumiCount (Hewlett Packard). Количественную оценку люциферазной активности проводят в тройном повторе и повторяют по меньшей мере еще три независимых эксперимента.
Иммунофлуоресценция. Клетки помещают с плотностью 10000 клеток/см2 в ячейки 6-ячеечного культурального планшета, покрытые стерильными покровными стеклами размером 22×22 мм. Дифференцировку инициируют по описанной выше методике, продолжая ее в течение 10 дней. Дифференцированные клетки фиксируют метанолом в течение 15 минут при -20°С. После данной обработки проводят 15-минутную инкубацию с использованием PBS + 0,1% Тритон Х-100. Покровные стекла инкубируют с антителами против рецептора Ephrin B2 (Santa Cruz Biotechnology) и Gap-43 (Novus Biologicals) в течение 40 минут при 37°С. После серии промывок с использованием смеси PBS/Тритон Х-100 добавляют вторичное антитело, конъюгированное с FITC (Jackson ImmunoResearch, Westgrove, PA). Все слайды со снимками получают с использованием конфокального лазерного сканирующего устройства Nikon PCM2000, установленного в Nikon Eclipse E600 микроскопе (Nikon, Melville, NY).
Количественное определение длины нейрита. Количество клеток определяют в шести случайным образом выбранных микроскопных полях (10×). В каждом поле подсчитывают общее число клеток, а также клеток, которые имеют нейриты, более чем в два раза превышающие длину клеточного тела. Количество клеток с такими отростками затем выражают в виде процента относительно общего числа клеток. Получают показатели на основе результатов двух или трех независимых экспериментов.
ПЦР-ОТ. При анализе уровней мРНК для рецептора Ephrin B2 (EphB2) из дифференцированных клеток выделяют суммарную ДНК с использованием Trizol (Invitrogen-GIBCO-BRL, Baltimore, MD). 2 мкг РНК подвергают обратной транскрипции в смеси общего объема 20 мкл с включением случайного гексамера (50 нг) и с использованием системы обратной транскрипции Superscript II Invitrogen-GIBCO-BRL, в соответствии с рекомендациями производителя. ПЦР проводят в объеме 50 мкл, содержащем 5 мкл кДНК, 100 пмоль праймеров, 100 мкМ dNTP, 1Х Taq буфера и 1,4 мМ MgCl2. Реакционные смеси нагревают до 80°С в течение 10 минут, после чего добавляют Taq. Амплифицируют кДНК в течение 25 (рецептор EphB2) или 15 (GAPDH) циклов. Один цикл амплификации состоит из 1 минуты обработки при 94°С, 2 минут при 60°С и 2 минут при 72°С с конечным периодом растяжения 10 минут при 72°С. ПЦР продукты разрешают и визуализируют электрофорезом в 2% геле и окрашивают бромидом этидия. Используемые в ПЦР праймеры для рецептора EphB2 включают 5'-CACTACTGGACCGCACGATAC-3' и 5'-TCTACCGACTGGATCTGGTTCA-3'. Праймерные пары для GAPDH представляют собой 5'-GGTGCTGAGTATGTCGTGGA-3' и 5'-ACAGTGTTCTGGGTGGCAGT-3'.
Результаты
Линию крысиных клеток PC-12 получают из невральной ткани при обработке фактором роста нервной ткани (NGF) и подвергают далее дифференцировке до нейритных нейронов симпатетического типа (Greene and Tischler, Proc. Natl. Acad. Sci. USA 73, 2424 (1976)). С использованием модели на основе клеток PC-12 описывают эффекты мутации в PS-1, ассоциированной с ранним развитием наследственного расстройства вегетативной нервной системы (FAD), PS-1/L286V, на опосредованную участием TCF/β-катенина транскрипцию и нейрональную дифференцировку. Было показано, что специфическое блокирование транскрипции, опосредованное участием TCF/β-катенином/CBP, ослабляет индуцированные PS-1 дефекты в нейрональной дифференцировке.
Клетки PC-12, стабильно осуществляющие суперэкспрессию либо PS-1 дикого типа (PS-1/WT), либо PS-1 мутантного типа (PS-1/L286V), и трансфицированную вектором контрольную клеточную линию (Guo et al., Neuroreport, 8, 379 (1996)) помещают на чашки с коллагеном, поли-L-лизином и полиэтиленимином. Дифференцировку индуцируют обработкой 50 нг/мл NGF в течение 10 дней. Клетки PS-1/WT, осуществляющие суперэкспрессию, или клетки, трансфицированные вектором, характеризуются масштабным формированием нейритов (аналогично клеточным клонам PC-12 из ATCC), тогда как мутантные клетки PS-1/L286V демонстрируют лишь слабое формирование нейритов (фиг.4А-С). Кроме того, трансфицированные вектором контрольные клетки PC-12 и PS-1/WT клетки демонстрируют масштабную экспрессию маркера нейрональной дифференцировки GAP-43 (Gorgels et al., Neurosci. Lett. 83, 59 (1987)), (фиг.4D, E), тогда как клетки PS-1/L286V по существу не содержат данного маркера (фиг.4F).
Для оценки влияния мутации PS-1/L286V на каноническую сигнальную функцию Wnt/β-катенина авторы проводят временную трансфекцию NGF-обработанных PC-12 клеток с использованием Topflash, репортерной конструкцией Wnt/β-катенинового сигнального пути (Morin et al., Science 275, 1787 (1997)). Как показано на фиг.4F, клетки PS-1/WT, осуществляющие суперэкспрессию, имеют схожие уровни агента сигнального TGF/β-катенина с контрольными клетками, трансфицированными вектором. Однако мутантные клетки PS-1/L286V демонстрируют существенно повышенную (в 10 раз) экспрессию Topflash. И, наоборот, негативный контроль с репортерной конструкцией Fopflash не демонстрирует каких-либо различий.
Была выдвинута гипотеза, согласно которой разбалансировка сигнальной функции механизма, опосредованного участием TGF/β-катенина в мутантных клетках PS-1/L286V, ответственна за дефектную дифференцировку и рост нейритов. Для оценки данной гипотезы используют соединение D, представляющее собой специфическую малую молекулу ингибиторного действия на сигнальный путь, осуществляемый через взаимодействие TGF/β-катенин (Emami et al., Cancer Cell, в печати). Указанная малая молекула селективно блокирует взаимодействие β-катенин/CBP, но не взаимодействие β-катенин/p300, прерывая таким образом функцию механизма транскрипции, осуществляемого через взаимодействие TGF/β-катенин. Обработка мутантных клеток PS-1/L286V с использованием 10 мкМ соединения D плюс NGF снижает транскрипцию репортерного гена TGF/β-катенина и ведет по существу к нормальному росту нейрита и дифференцировке (фиг.5А), аналогично тому, как отмечается в суперэкспрессирующих клетках PS-1/WT (фиг.5A, B), в сравнении с необработанными клетками (фиг.4С). Кроме того, мутанты PS-1/L286V, обработанные соединением D, демонстрируют аналогичную интенсивность окрашивания по GAP-43, как клетки PS-1/WT, так и клетки, трансфицированные вектором (фиг.4В). Для того чтобы показать, что мутантные клетки, обработанные соединением D, характеризуются аналогичным развитием нейритов, как и в случае контрольных векторных клеток или клеток PS-1/WT, было подсчитано количество клеток, которые имеют нейриты, более чем в два раза превосходящие длину тела клетки. Обработка соединением D существенно повышает процент клеток, имеющих нейриты на уровне, аналогичном таковому у трансфицированных вектором клеток и у клеток PS-1/WT, осуществляющих суперэкспрессию (фиг.5С). Был сделан вывод о том, что блокирование транскрипции, опосредованной участием TGF/β-катенин/CBP, корректирует многие фенотипические дефекты в росте нейрита и нейрональной дифференцировке, вызванные мутаций PS-1/L286V.
Рецепторы эфрина В2 (Ephrin B2, (EphB2)) участвуют в формировании синапса (Wilkinson, Nat. Rev. Neurosci. 2, 155 (2001)), а семейство эфрина А, как недавно было показано, играет определенную роль в создании соответствующей морфологии дендритных шипов в гиппокампе (Murai et al., Nat. Neurosci. 6, 153 (2003)). Наблюдается фокусированная экспрессия EphB2, которая локализуется вместе с нейрональными процессами в вектор- и PS-1/WT-трансфицированных клетках (фиг.6А, В), тогда как мутантные клетки PS-1/L286V демонстрируют очень слабый и размытый сигнал EphB2 (фиг.6С). Повышенная сигнальная функция пути TGF/β-катенин в мутантных клетках PS-1/L286V проявляется уже в сниженной экспрессии EphB2, как следует из результатов проведения ПЦР-ОТ (фиг.6Е, линия 3). Кроме того, добавление 10 мкМ соединения D ведет к повышению уровня мессенджера для EphB2 (фиг.6Е, линия 4), а также экспрессии EphB2 в этих клетках (фиг.6D). Эти результаты согласуются с данными Батлле с соавт. (Batlle et al., Cell 11, 251 (2002)), которые недавно показали, что экспрессия рецепторов EphB2/EphB3 и их лиганда эфрин-В1 обратным образом контролируются в криптах толстого кишечника через транскрипцию, опосредованную TGF/β-катенином, и что соответствующая регуляция важна для правильной пролиферации клеток, дифференцировки и их сортировки. Авторы представляют доказательство того, что мутация PS-1/L286V, ведущая к усилению сигнального пути через TGF/β-катенин, снижению экспрессии рецепторов EphB2, корректируется соединением D, подавляющим взаимодействие β-катенин/CBP.
ПРИМЕР 9
Соединение D вызывает остановку на фазе G1/S
и повышает активность каспазы
Анализ методом проточной цитометрии (FACS-анализ)
Для анализа клеток сортировкой по интенсивности флуоресценции примерно 5×106 клеток из вариантов, обработанных соединением D или носителем, фиксируют 70% охлажденным этанолом и хранят при -20°C в течение по меньшей мере 30 минут. Клетки промывают один раз 1×PBS и инкубируют с раствором йодистого пропидия (PI) (85 мкг/мл йодистого пропидия, 0,1% нонидет Р-40 (Nonidet P-40), 10 мг/мл РНКазы) в течение 30 минут при комнатной температуре. Для каждого образца берут по 10000 окрашенных клеток с использованием проточного цитометра Beckman Coulter EPICS XL-MCL и определяют процент клеток, находящихся на разных фазах клеточного цикла, с помощью программного обеспечения Expo32 ADC (Coulter Corporation, Miami, Florida, 33196).
Тест на определение активности каспазы-3
Клетки SW480, HCT116 и CCD18Co помещают в 96-ячеечные планшеты по 105 клеток в ячейку на 24 часа перед обработкой. К каждой ячейке добавляют 25 мкМ соединения D или контроля (0,5% ДМСО). Через 24 часа после обработки клетки лизируют и оценивают активность каспазы с использованием набора для определения активности каспазы-3/7 (Apo-One Homogeneous caspase-3/7 assay, #G77905, Promega). Единицы относительной флуоресценции (RFU) определяют при вычитании значения слепых проб (контроль, без клеток) из результатов определения данного показателя в экспериментальных вариантах.
Соединение D вызывает остановку на фазе G1/S и повышает активность каспазы
Было показано, что ингибирование экспрессии гена циклина D1 вызывает остановку на фазе G1/S клеточного цикла (Shintani et al., «Infrequent alternation of RB pathway (Rb-p16INK4A-cyclin D1) in adenoid Cystic carcinoma of salivary glands», Anticancer Res. 20: 2169-75 (2000)). Клетки HCT116 (фиг.7А, верхняя панель) и SW480 (фиг.7А, нижняя панель) обрабатывают соединением D (25 мкМ) (фиг.7А, справа) или контролем (0,5% ДМСО) (фиг.7А, слева) в течение 24 часов. Клетки последовательно окрашивают йодистым пропидием (PI) и определяют содержание ДНК методом флуоресцентной цитометрии. Как и ожидалось, контрольные клетки (фиг.7А, слева) проходят нормальный цикл, тогда как клетки, обработанные соединением D (фиг.7А, справа), аккумулируют в повышенных количествах на фазе G1/S клеточного цикла. Таким образом, видно, что соединение D вызывает остановку цикла клеток на фазе G1.
Каспазы представляют собой цистеиновые протеазы, которые в основном активируются в данной популяции клеток под действием апоптозного стимула. Для оценки уровня апоптозной индукции в клетках SW480, HCT116 и в колоноцитах дикого типа (клетки CCD18Co) указанные клетки обрабатывают либо соединением D (25 мкМ), либо контролем (0,5% ДМСО) в течение 24 часов с последующим определением активности каспазы-3/7. Как видно на фиг.7В, соединение D специфически и существенно активирует путь, вовлекающий каспазу-3/7, в клетках SW480 и НCТ116 в сравнении с клетками ССD18Со.
ПРИМЕР 10
Соединение D снижает пролиферацию
трансформированных колоректальных клеток
Тесты на мягком агаре
Тест по определения колониеобразующей активности на мягком агаре проводят с использованием клеток SW480, при введении некоторых модификаций в описанную ранее процедуру (Moody et al., «A vasoactive intestinal peptide antagonist inhibits non-small cell lung cancer growth», Proc. Natl. Acad. Sci. USA, 90: 4345-49 (1993)).
На каждую ячейку (35 мм) в 6-ячеечном планшете (Nalge Nunc Internetional, Roskide, Denmark) наслаивают по 1 мл 0,8% низового агара в среде DMEM, содержащей 10% фетальной сыворотки теленка. После затвердевания к каждой ячейке добавляют по 1 мл среды DMEM, содержащей 0,4% верхнего агара, 10% фетальной сыворотки теленка, соединение с двойной концентрацией и 5000 одиночных жизнеспособных клеток. Культуры инкубируют при 37°С в увлажненном инкубаторе с содержанием 5% CO2. Ежедневно подсчитывают число колоний в мягком агаре и после инкубации в течение 8 дней делают фотоснимки. Определяют количество колоний, имеющих диаметр >60 мкМ.
Соединение D снижает уровень пролиферации трансформированных колоректальных клеток
Проводят тесты на колониеобразующую активность в мягком агаре с использованием клеток SW480, обработанных соединением D (0,25-5 мкМ) и 5-фторурацилом (5-FU) (0,5-32 мкМ). Как видно на фиг.8А, соединение D вызывает зависимое от дозы снижение числа образованных колоний. Показатель IC50 для соединения D и 5-FU составляет 0,87±0,11 мкМ и 1,98±0,17 мкМ соответственно. Таким образом, соединение D повышает активность каспазы и снижает рост in vitro колоректальных клеток, которые были трансформированы мутациями, активирующими сигнальный путь, опосредованный β-катенином.
ПРИМЕР 11
Соединение С снижает опухолевый рост на модели мышей Nude
Клетки SW620 (9×106 клеток/мышь) трансплантируют подкожно мышам линии nude на день 0. Мышам вводят внутрибрюшинно 200 мг/кг соединения С через день до 21 дня после 4-кратного введения по 300 мг/кг через день, начиная с дня 1. Соединение С снижает рост опухоли у экспериментальных мышей в сравнении с контрольными мышами, которым вводили носитель (фиг.9А), и несколько снижает вес тела экспериментальных мышей относительно веса контрольных мышей, которым вводили носитель (фиг.9В).
ПРИМЕР 12
Соединение D подавляет экспрессию сурвивина
Эффект соединения D на экспрессию сурвивина исследовали на уровне транскрипции и трансляции. Методы оценки транскрипции включают анализ с использованием микроматриц на основе кДНК, ПЦР-ОТ, анализ репортеров для сурвивина и иммунопреципитацию хроматина (ChIP). Методики, используемые для оценки трансляции, включают вестерн-блоттинг и иммуногистохимический анализ.
Конструируют плазмиду, содержащую люциферазу, функционирующую под контролем промотора сурвивина, и трансфицируют в клетки дикого типа, клетки CBP+/- или p300+/-3Т3. Результаты показывают (фиг.10), что Wnt1 стимулирует экспрессию гена сурвивина во всех трех типах клеток, тогда как соединение D снижает экспрессию гена сурвивина и снижает стимуляцию экспрессии гена сурвивина под действием Wnt1 в этих клетках. Аналогично, соединение D и его аналог (соединение А), как было показано, ингибирует экспрессию сурвивина в клетках SW480 (фиг.11).
Анализ ПЦР с обратной транскрипцией в масштабе реального времени проводят согласно процедуре, предлагаемой в наборе для проведения ПЦР SYBR Green PCR Master Mix Kit (Perkin Elmer Biosystems, Shelton, ST). Суммарную матричную РНК для проведения ПРЦ-ОТ экстрагируют с использованием набора RNeasy Midi Kit (Qiagen) из клеток, обработанных соединением D (25 мкМ), или из контрольных клеток (0,5% ДМСО) через 24 часа после обработки. Праймеры, используемые для проведения ПЦР-ОТ, представляют собой: 5'-AGCCCTTTCTCAAGGACCAC-3' и 5'-GCACTTTCTTCGCAGTTTCC-3'. В таблице 8 приведены результаты данного анализа. Соотношение менее чем 0,5 указывает на значительное снижение экспрессии гена, вызванное обработкой соединением D, тогда как соотношение более чем 1,5 указывает на существенное повышение экспрессии гена. Соотношение около 1 указывает на отсутствие изменения. Как показано в таблице 8 и фиг.12, экспрессия гена сурвивина существенно снижается в присутствии соединения D в сравнении с контролем.
Генная экспрессия при наличии соединения D и в его отсутствие
Проводят ChIP-анализ с использованием клеток SW480, обработанных соединением D (25 мкМ), или контрольных клеток (0,5% ДМСО). Как показано на фиг.13, промотор сурвивина встречается в сочетании с CBP, β-катенином, TCF4 и ацетилированным гистоном в клетках, подвергнутых обработке в качестве контрольных. Обработка соединением D снижает ассоциацию указанных белков с промотором сурвивина.
Для характеристики эффекта соединения D на экспрессию сурвивина на уровне трансляции проводят вестерн-блотт-анализ экстрактов клеток, обработанных только носителем (0,5% ДМСО), 10 мкМ или 25 мкМ соединения D или 5 мкм 5-FU при использовании моноклонального антитела к сурвивину 6Е4 (Cell Signaling Technology). Полученные результаты (фиг.14А) показывают, что обработка соединением D в обеих концентрациях и обработка 5-FU снижают количество белка, определяемого сурвивином. Обработка соединением D в обеих концентрациях была более эффективной в плане снижения экспрессии сурвивина, чем обработка с использованием 5-FU, а обработка соединением D в более высокой концентрации (т.е. 25 мкМ) была наиболее эффективной.
Эффект соединения D на экспрессию сурвивина на уровне трансляции оценивают также с использованием иммунофлуоресцентной микроскопии. В отсутствие соединения D сурвивин локализуется в аппарате митотического веретена, что согласуется с представлением о том, что сурвивин участвует в расхождении хромосом (фиг.14В). Такая картина экспрессии не наблюдается в клетках SW480 после обработки соединением D, поскольку определяемый сурвивином белок выявляется в небольших количествах или вообще не выявляется (фиг.14С).
ПРИМЕР 13
Эффекты различных соединений на экспрессию сурвивина и TCF4
Описаны эффекты различных соединений, имеющих общую формулу (I), на экспрессию сурвивина и TCF4. Результаты анализа показаны в таблице 9.
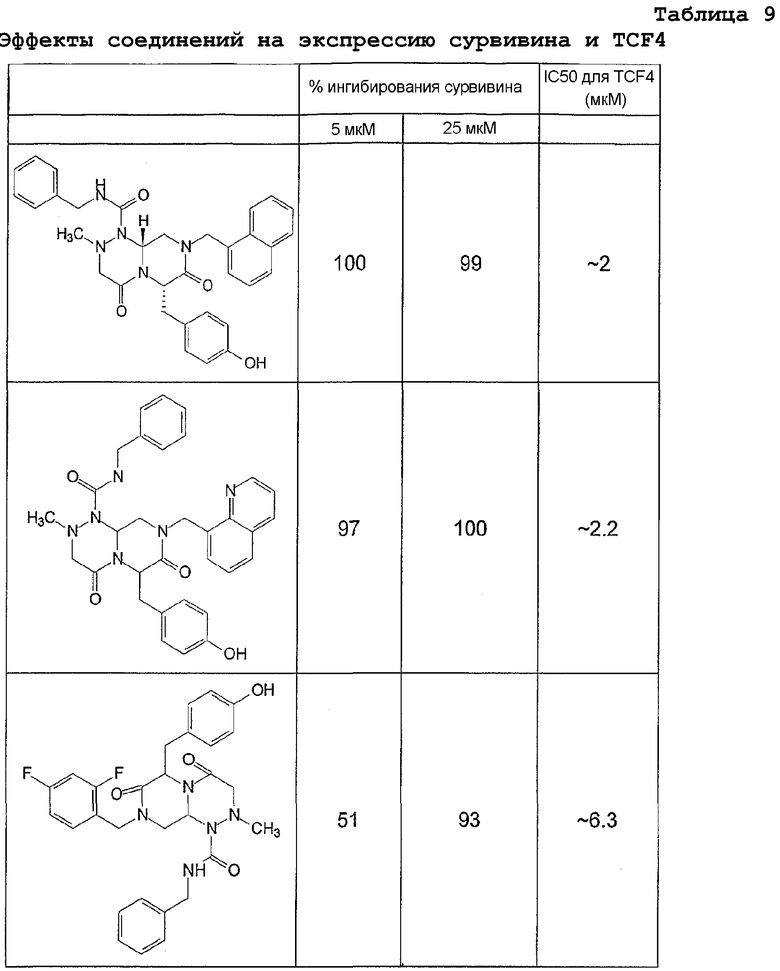
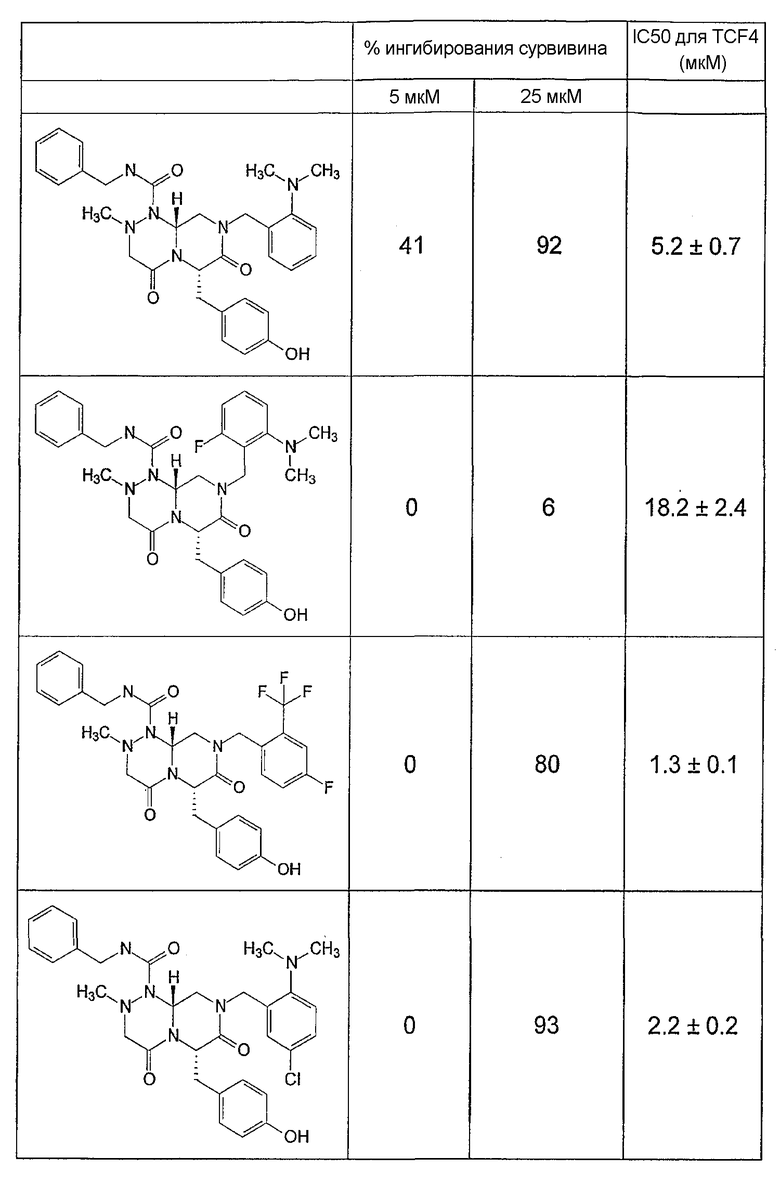
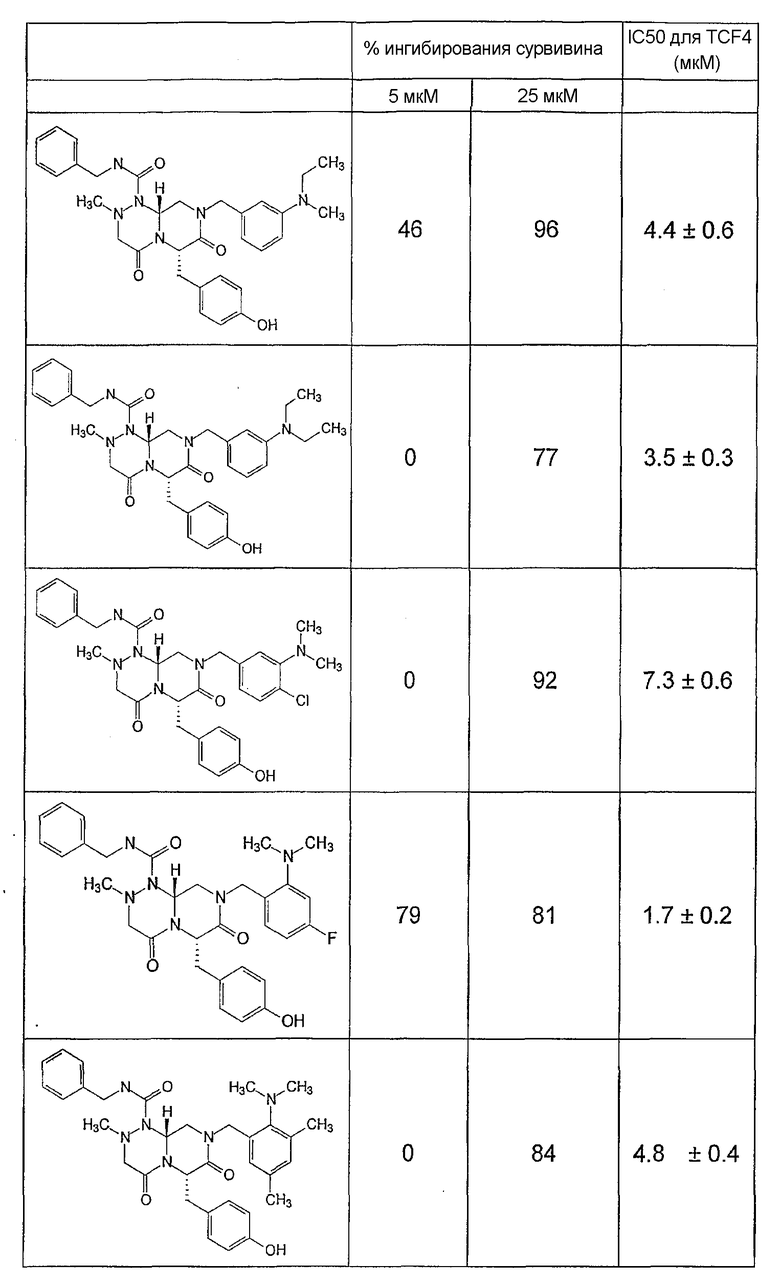
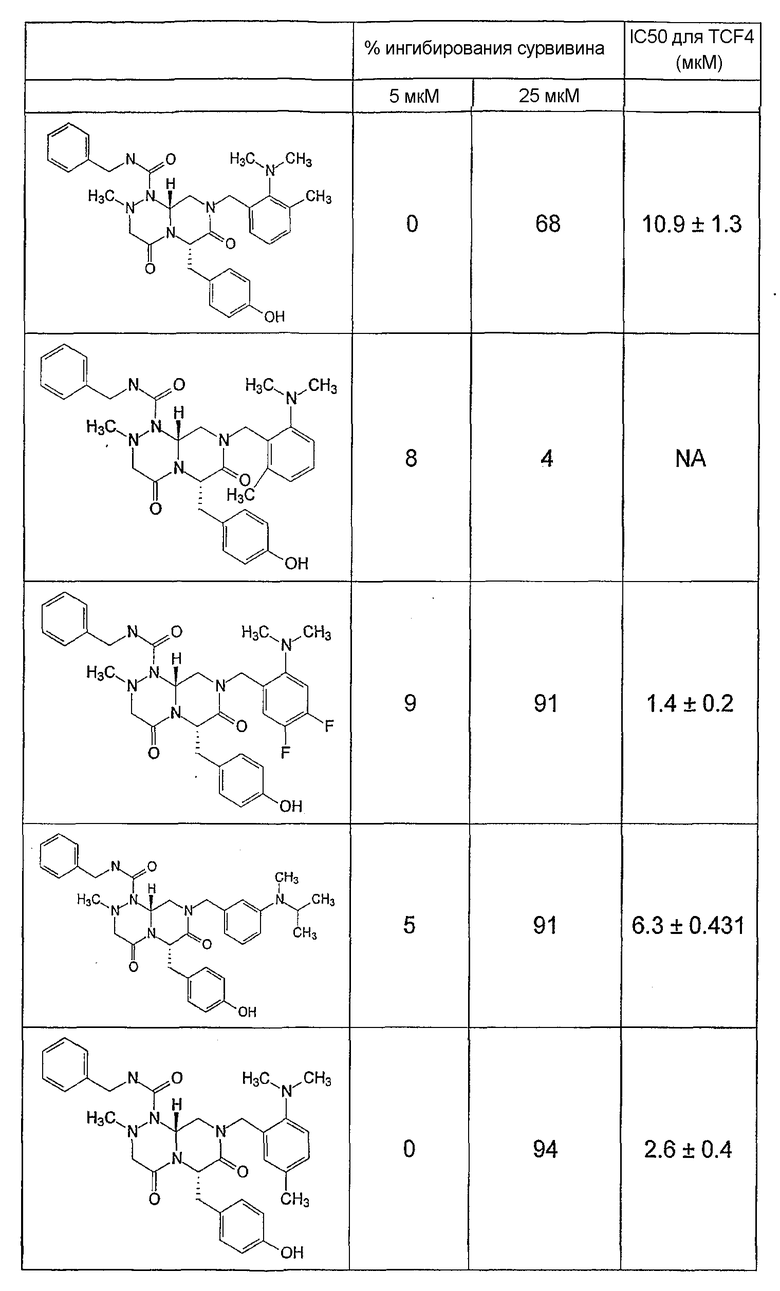
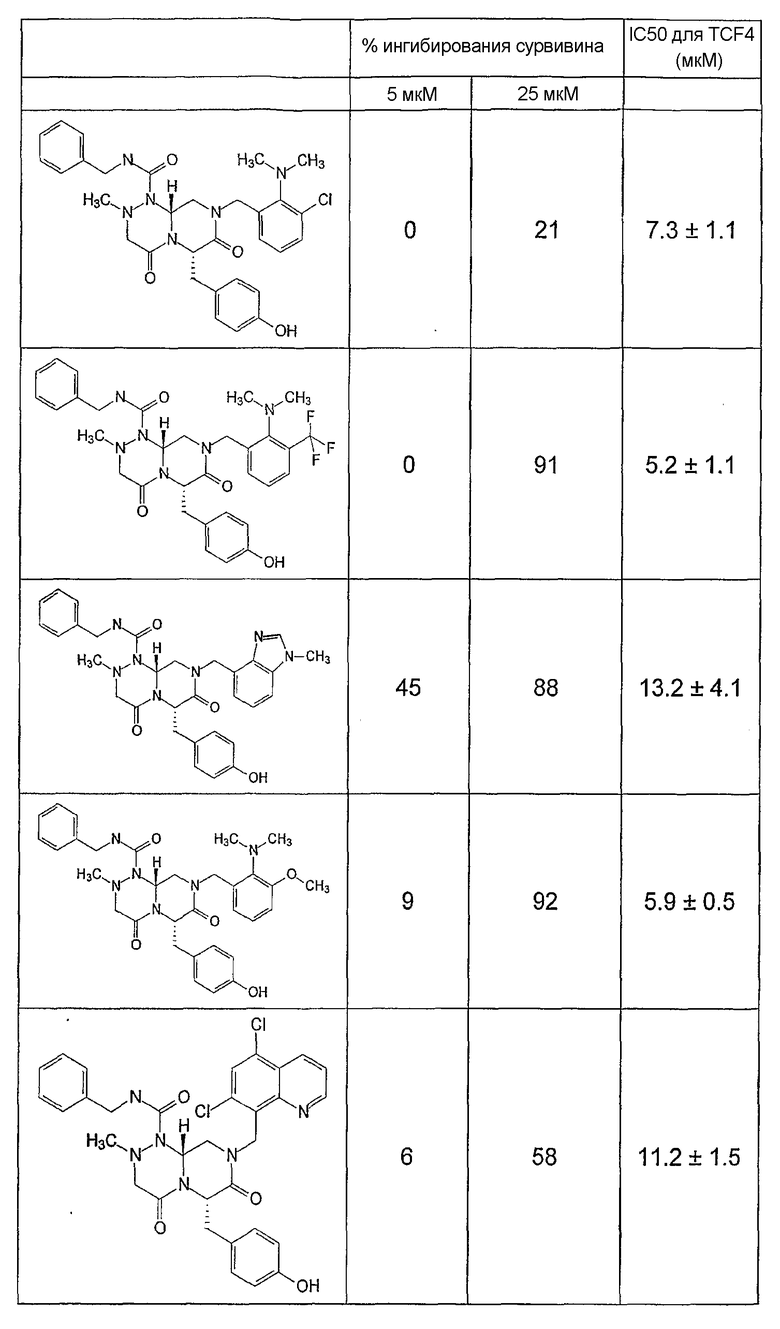
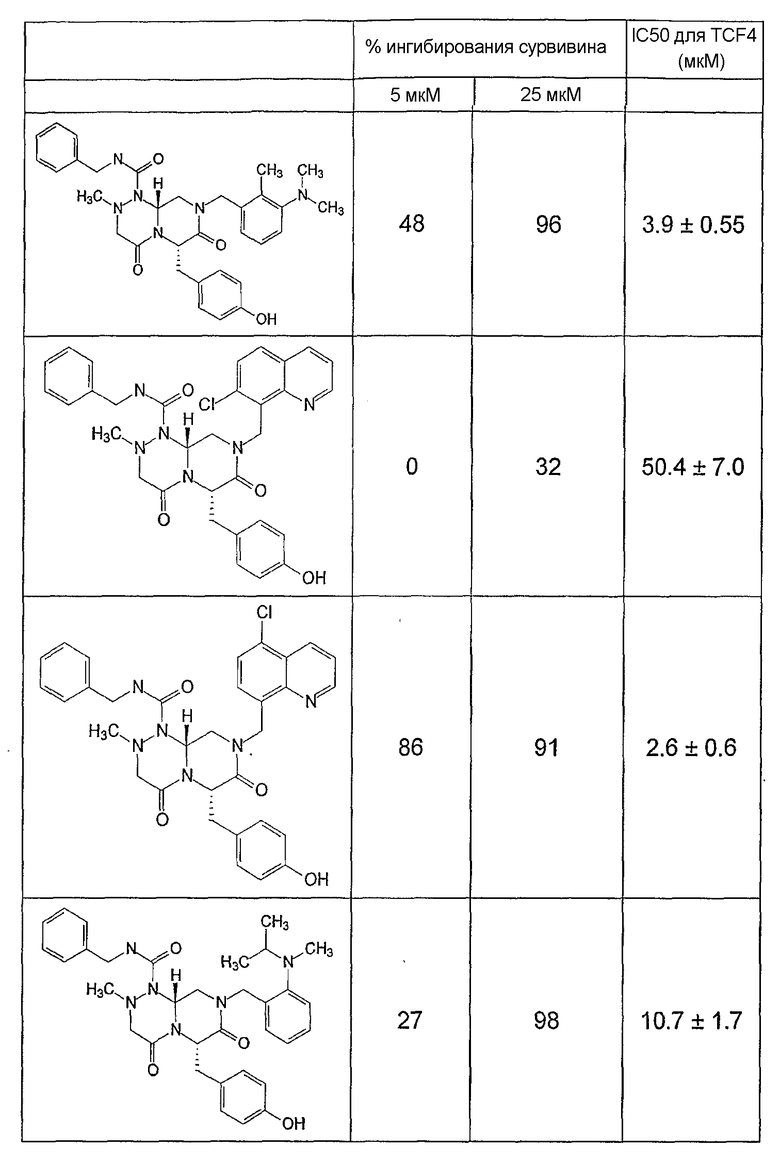
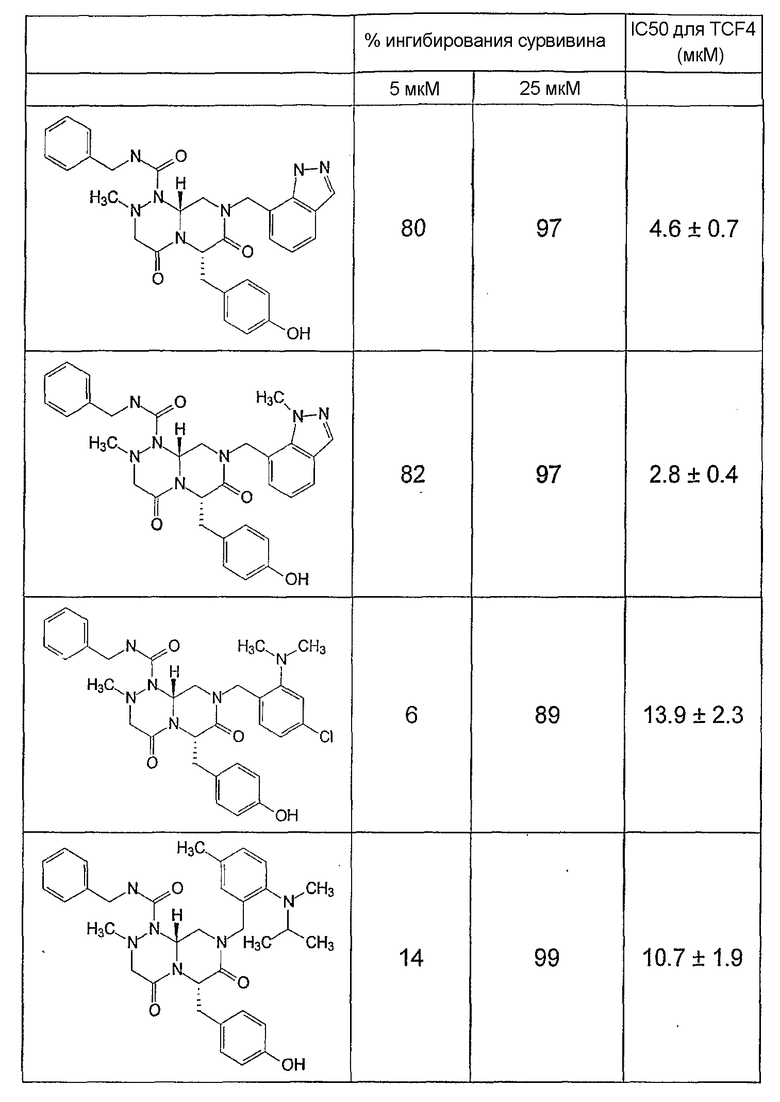
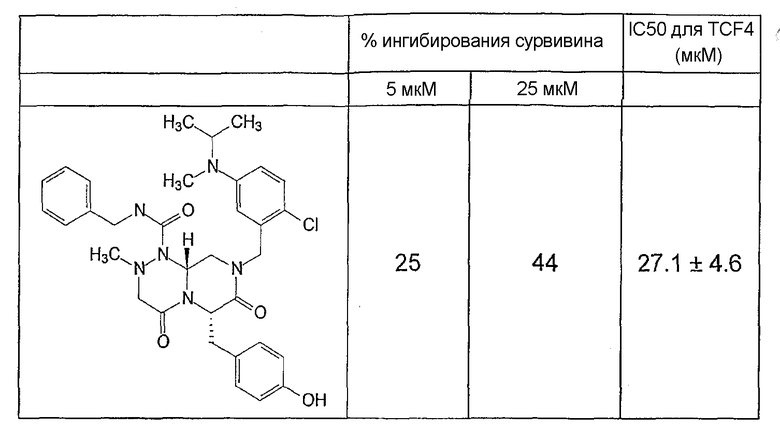
ПРИМЕР 14
Соединение D усиливает апоптоз
через подавление экспрессии сурвивина
Для оценки эффекта соединения D на апоптоз и роли сурвивина в таком эффекте определяют активность каспаз 2 и 3 в культуре опухолевых клеток, обработанных либо соединением D, либо с использованием варианта контрольной обработки. Результаты показывают (фиг.15), что (1) соединение D (2,5 мкМ или 5,0 мкМ) повышает активность каспазы 3, но не активность каспазы 2; (2) стауспорин (0,5 мкМ) повышает активность и каспазы 2, и каспазы 3; (3) совместная обработка стауспорином и соединением D приводит к синергической стимуляции активности каспазы 3, но не к синергической стимуляции активности каспазы 2; и (4) трансфекция геном сурвивина снижает стимуляцию активности каспазы 3, индуцированную обработкой стауспорином или соединением D, и синергическую стимуляцию каспазы 3, индуцированную совместной обработкой стауспорином и соединением D. Приведенные выше результаты дают основание полагать, что соединение D стимулирует активность каспазы 3 за счет экспрессии гена сурвивина.
Эффект соединения D на апоптоз и роль сурвивина в таком эффекте далее исследуют, определяя показатель гибели клеток в культуре опухолевых клеток, обработанных стауспорином (0,5 мкМ), соединением D (5,0 мкМ) или обоими соединениями. Полученные результаты (фиг.16) показывают, что и соединение D, и стауспорин способствуют гибели клеток, а трансфекция геном сурвивина снижает возрастание показателя гибели клеток, индуцированное обработкой стауспорином, соединением D или обоими соединениями. Приведенные выше результаты позволяют полагать, что соединение D усиливает апоптоз за счет подавления экспрессии гена сурвивина.
Для оценки влияния соединения D на клеточный цикл и роли сурвивина в таком эффекте проводят анализ сортированных клеток по интенсивности флуоресценции в культуре опухолевых клеток, осуществляя трансфекцию конструкцией, как содержащей, так и не содержащей ген сурвивина, с последующей обработкой их стауспорином (0,5 мкМ), соединением D (5 мкМ) или обоими соединениями. Результаты показывают (фиг.17), что и стауспорин, и соединение D снижают число клеток, находящихся на фазе G0, а суперэкспрессия сурвивина в клетках снижает эффект обработки стауспорином, соединением D или обоими соединениями. Приведенные результаты дают основание полагать, что эффект соединения D на клеточный цикл может быть по меньшей мере частично связан с подавлением экспрессии гена сурвивинва.
Следует понимать, что несмотря на то, что настоящее изобретение было описано на примере конкретных вариантов его осуществления, данное описание приведено лишь с целью иллюстрации и могут быть введены различные модификации без отступления от области и принципов настоящего изобретения. Соответственно, настоящее изобретение не ограничивается ничем, кроме прилагаемой формулы изобретения.
Все приведенные выше патенты США, публикации по заявкам на патент США, информация о заявках на патент США, об иностранных патентах, заявках на иностранные патенты, а также непатентные публикации, цитированные в настоящем описании и/или приведенные в регистрационном досье по заявке, включая заявку на патент США № 10/087443, зарегистрированную 1 марта 2002 года, и заявку на патент США № 09/976470, зарегистрированную 12 октября 2001 года, включены в настоящее описание в качестве ссылок.
Из приведенного выше описания следует понимать, что несмотря на то, что с целью иллюстрации в описании приведены конкретные варианты осуществления настоящего изобретения, в него могут быть внесены различные модификации без отступления от области и принципов настоящего изобретения. Соответственно, настоящее изобретение ничем не ограничивается, кроме как прилагаемой формулой изобретения.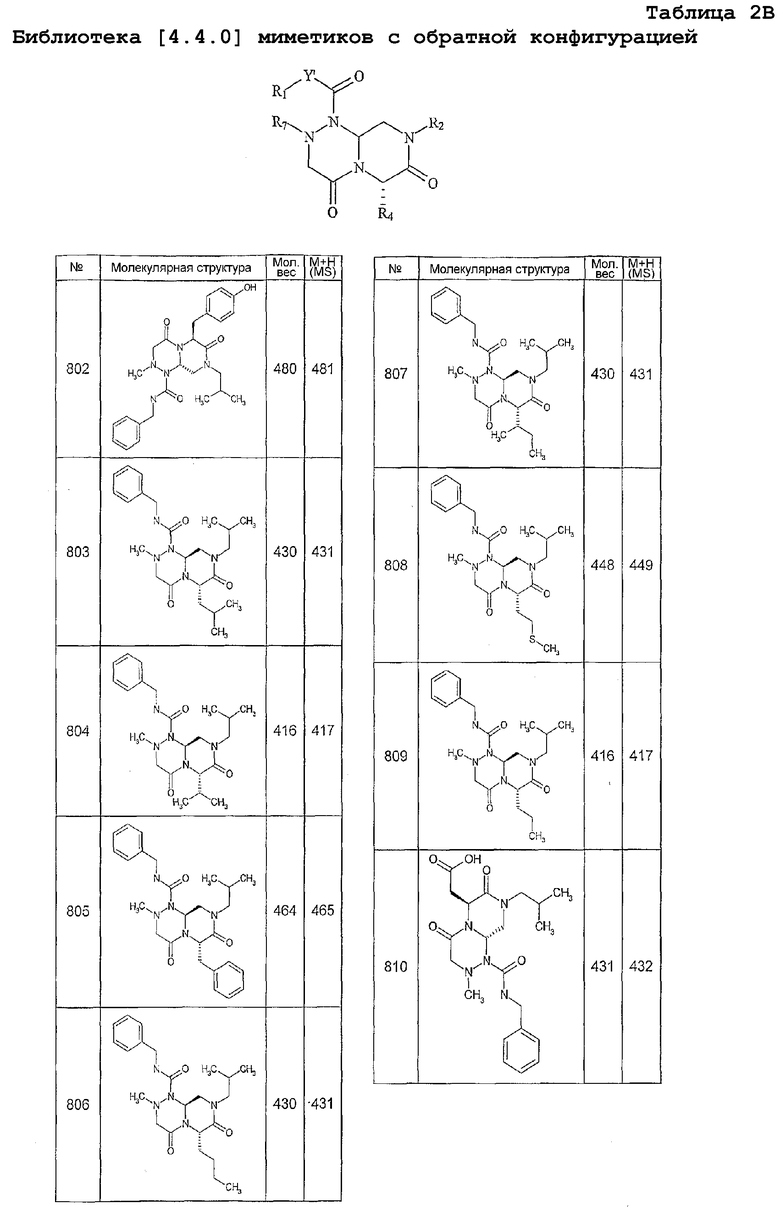
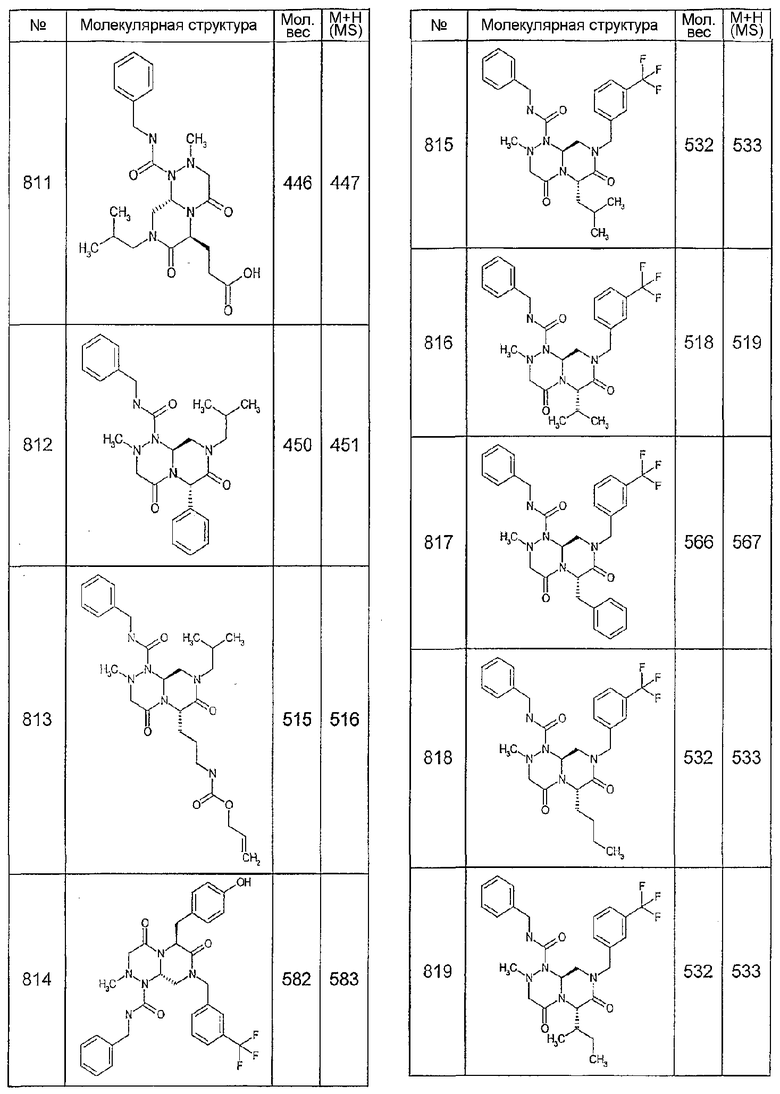
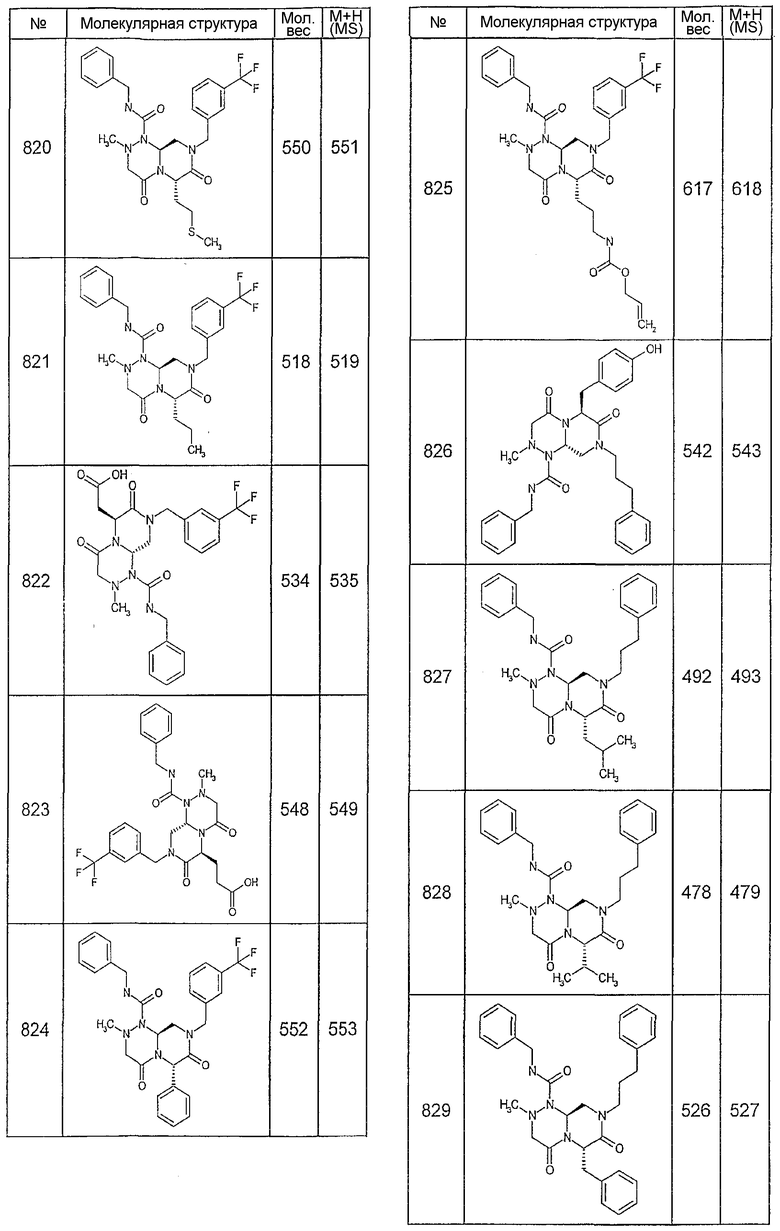
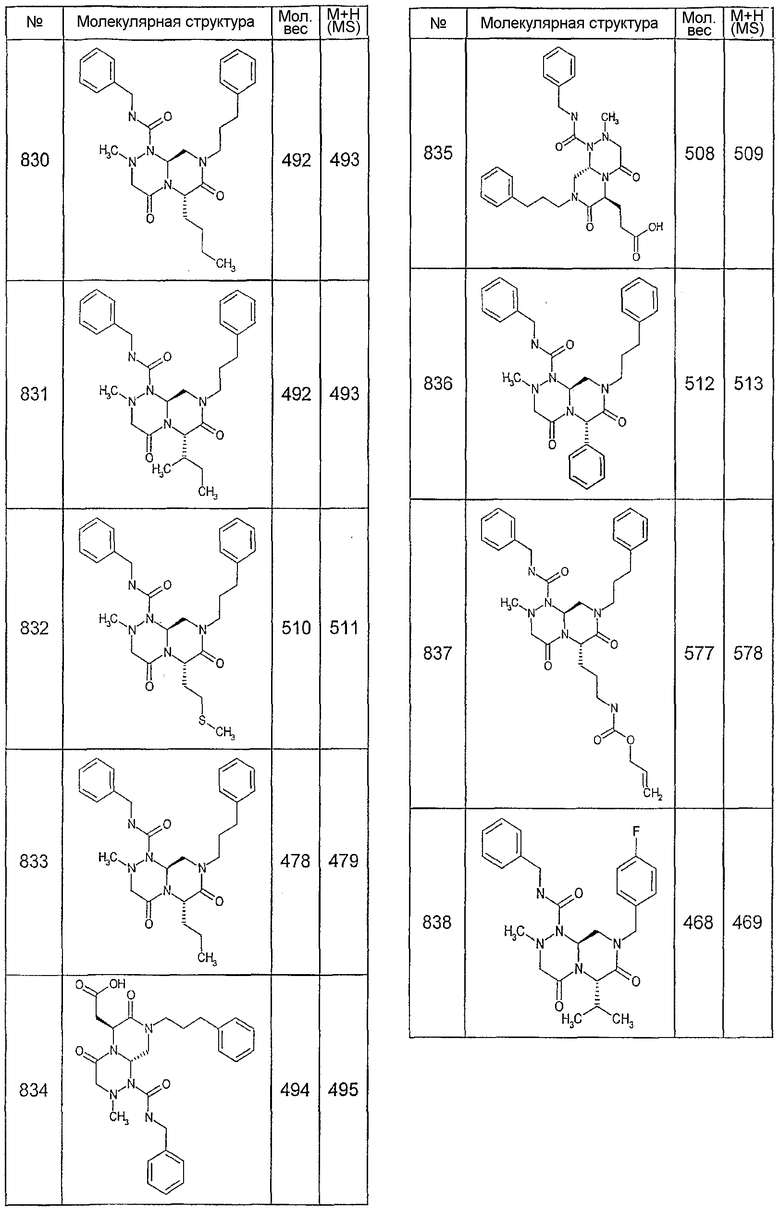
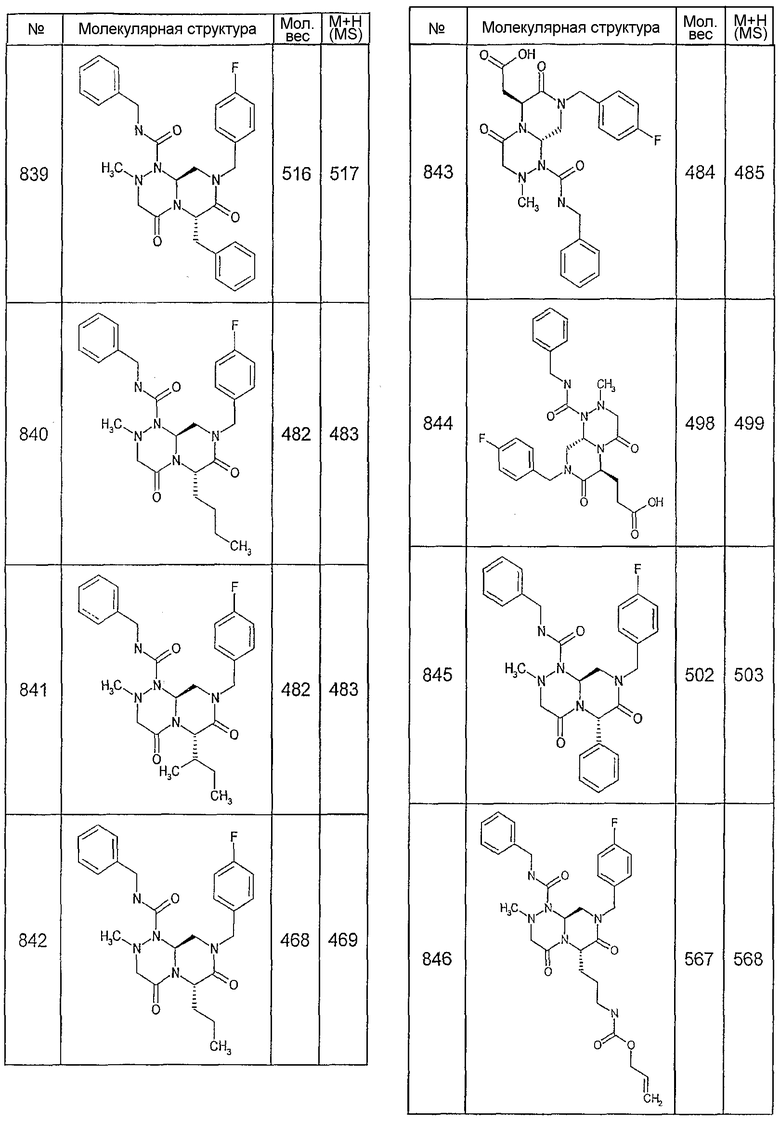
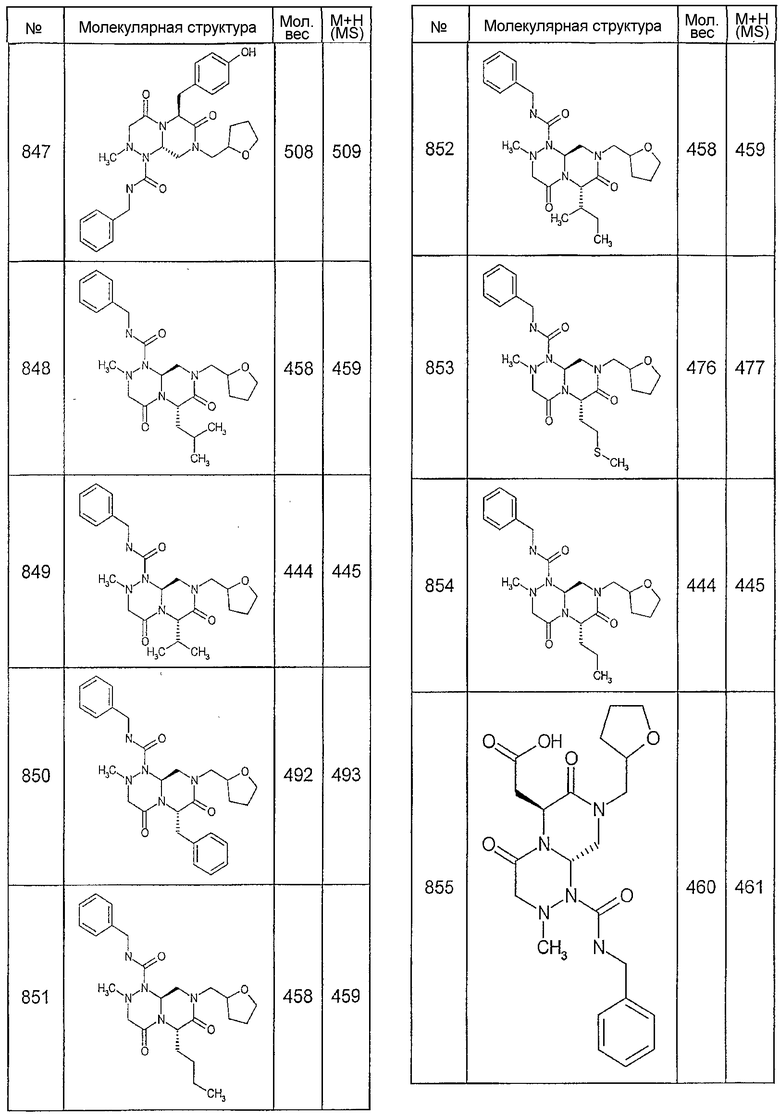
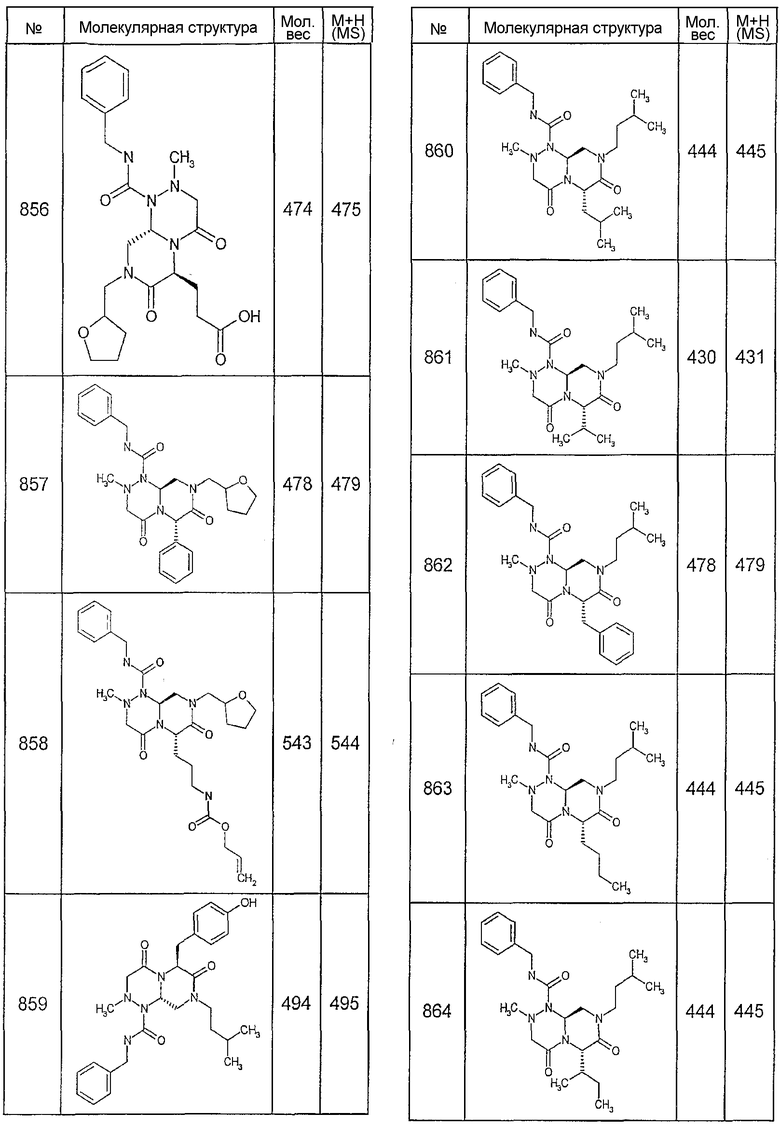
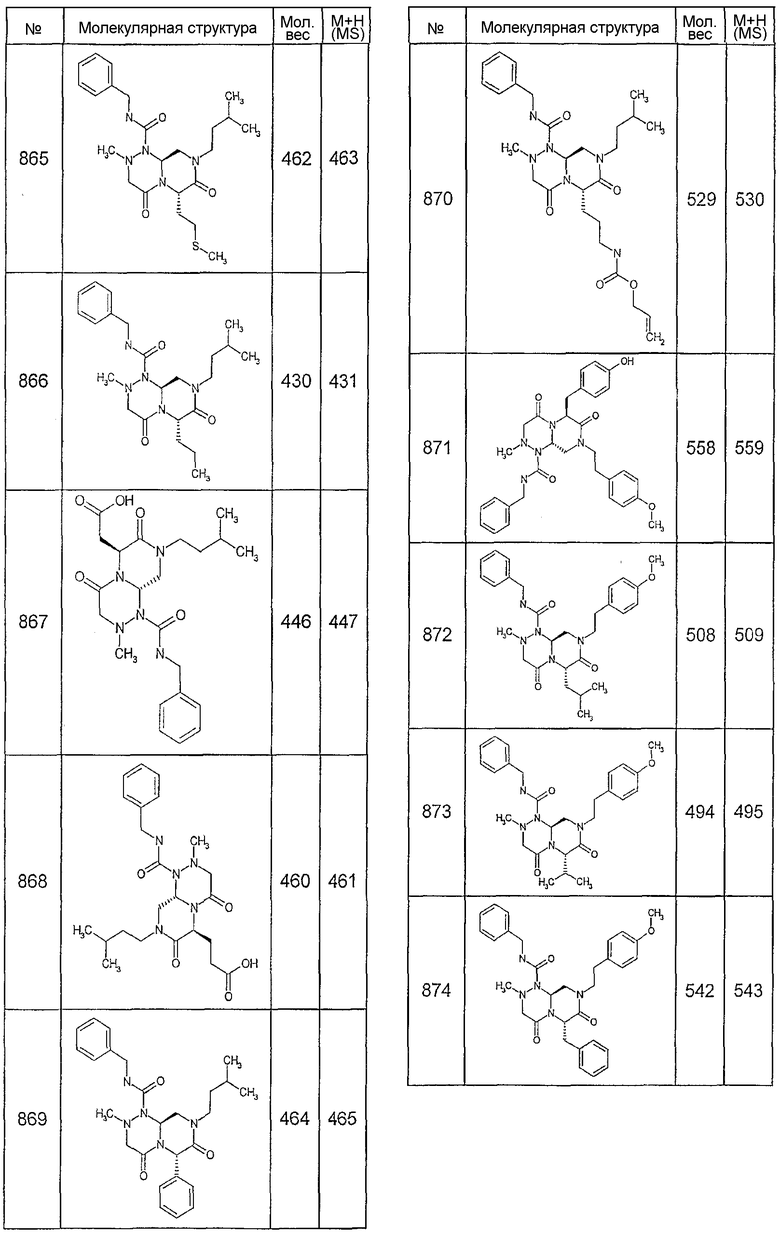
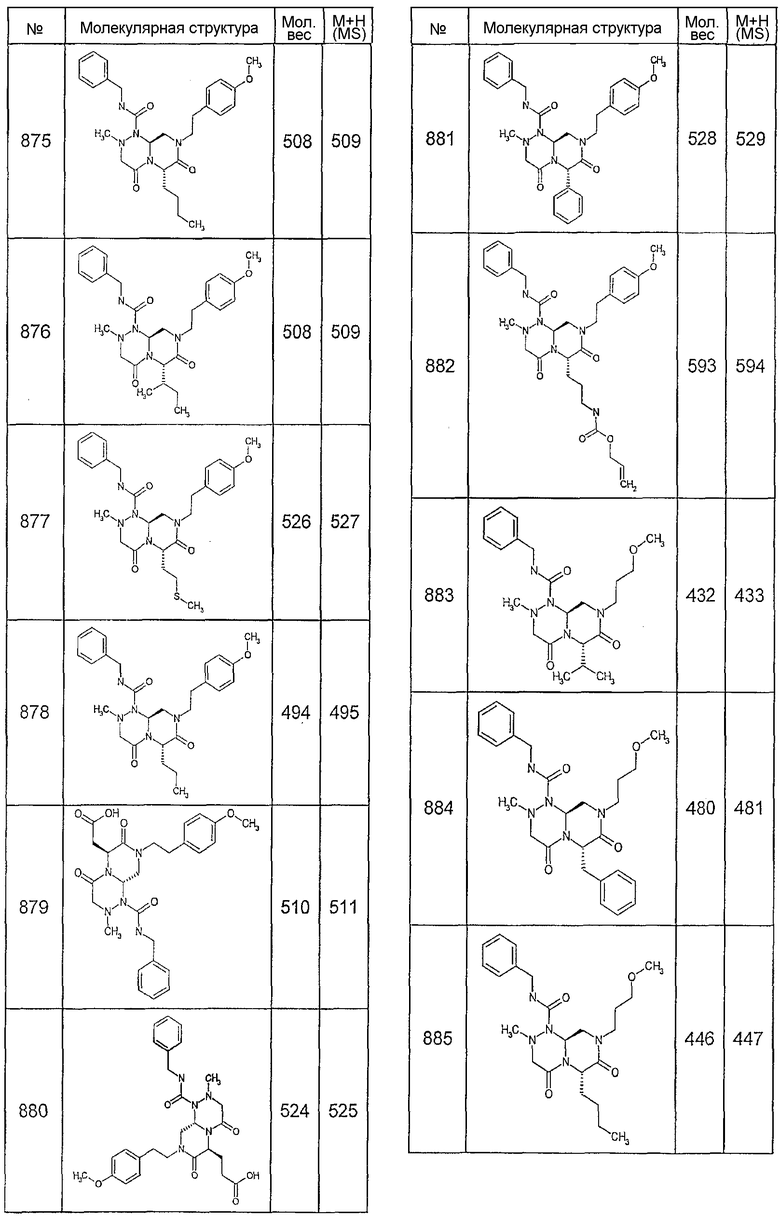
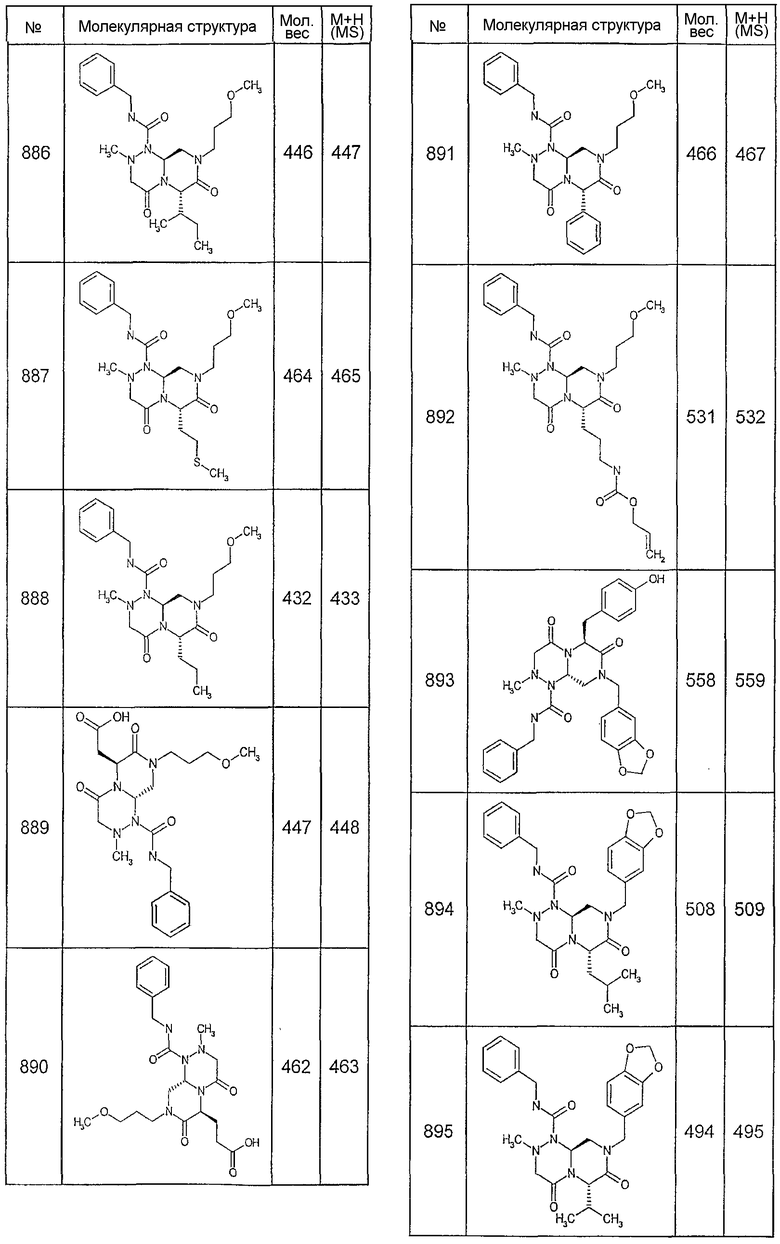
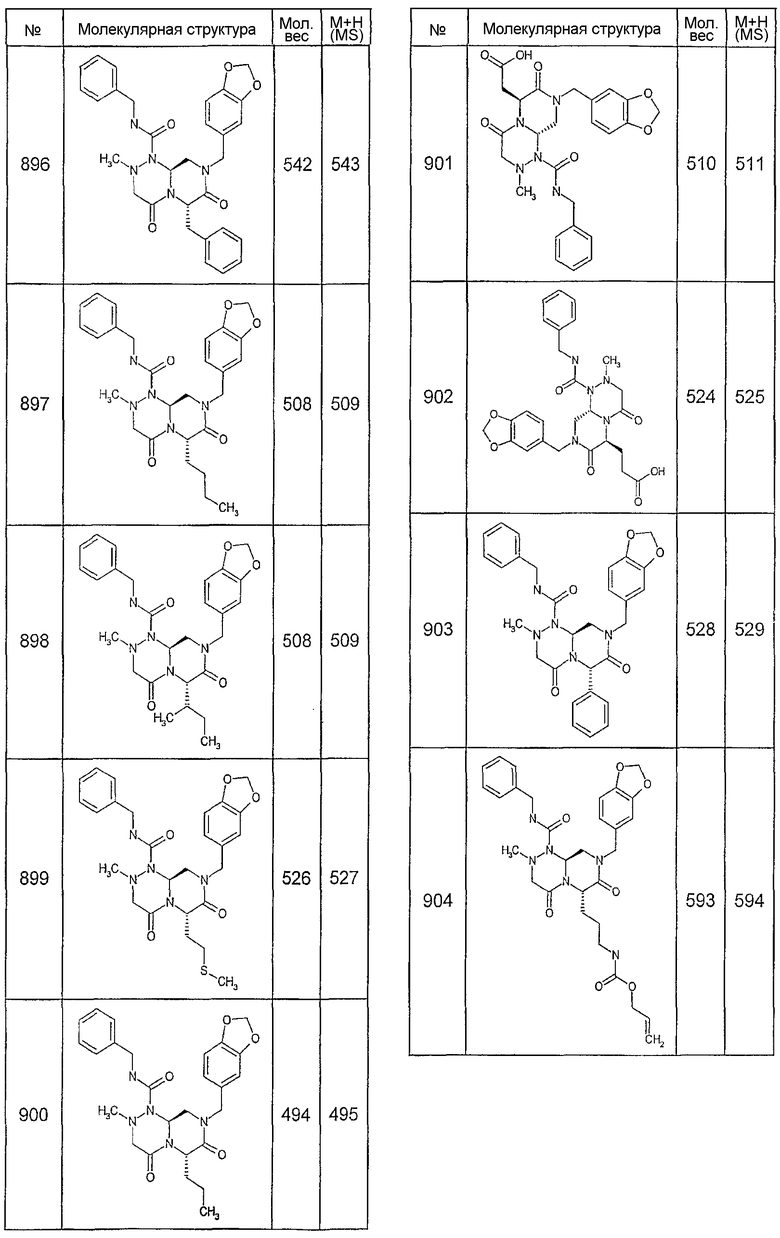
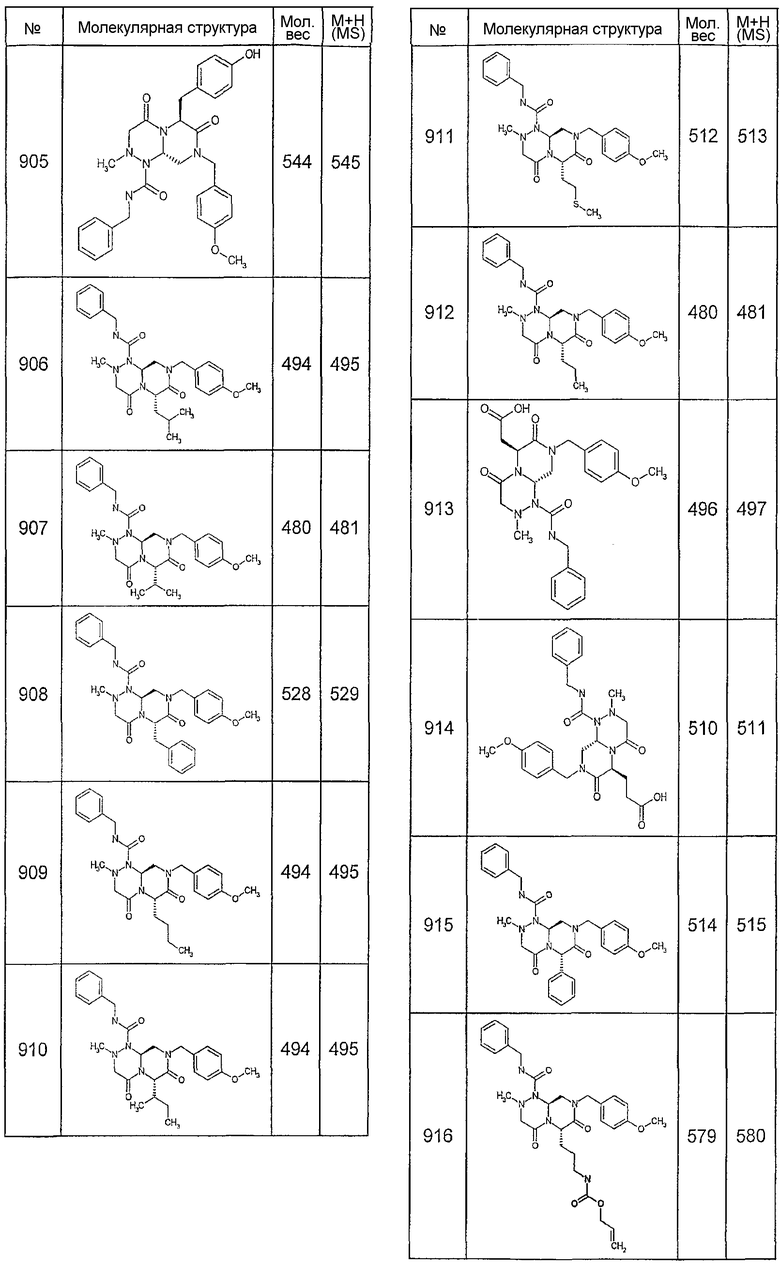
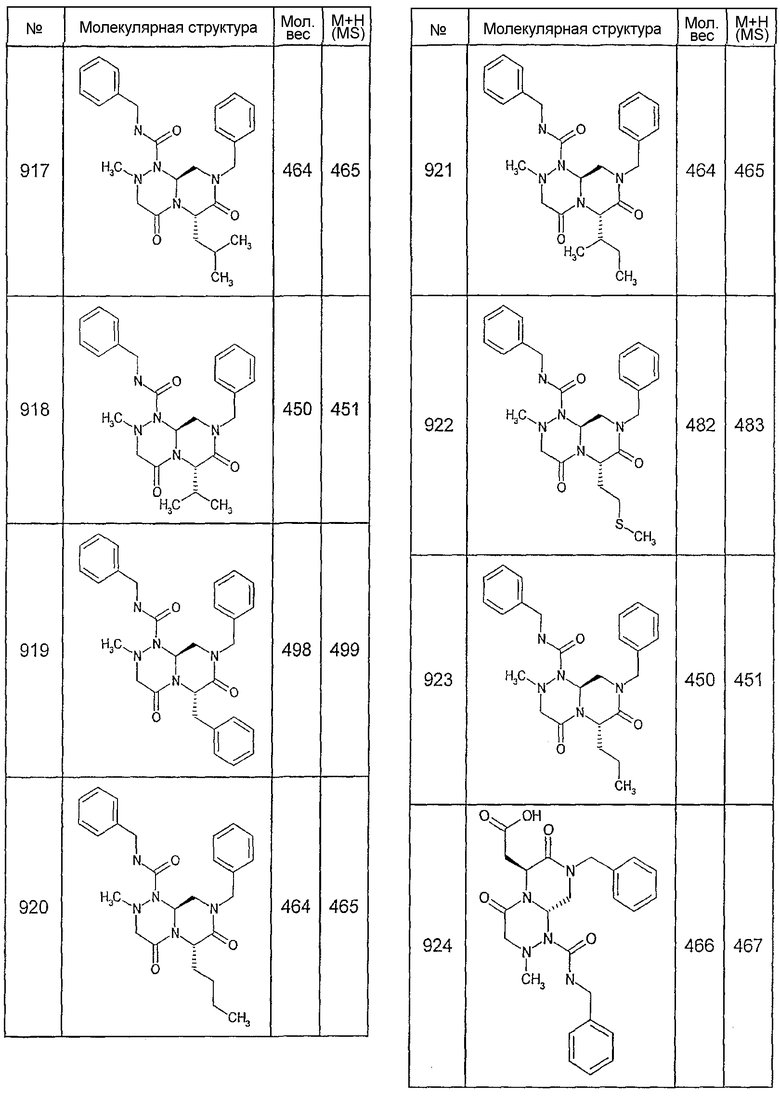
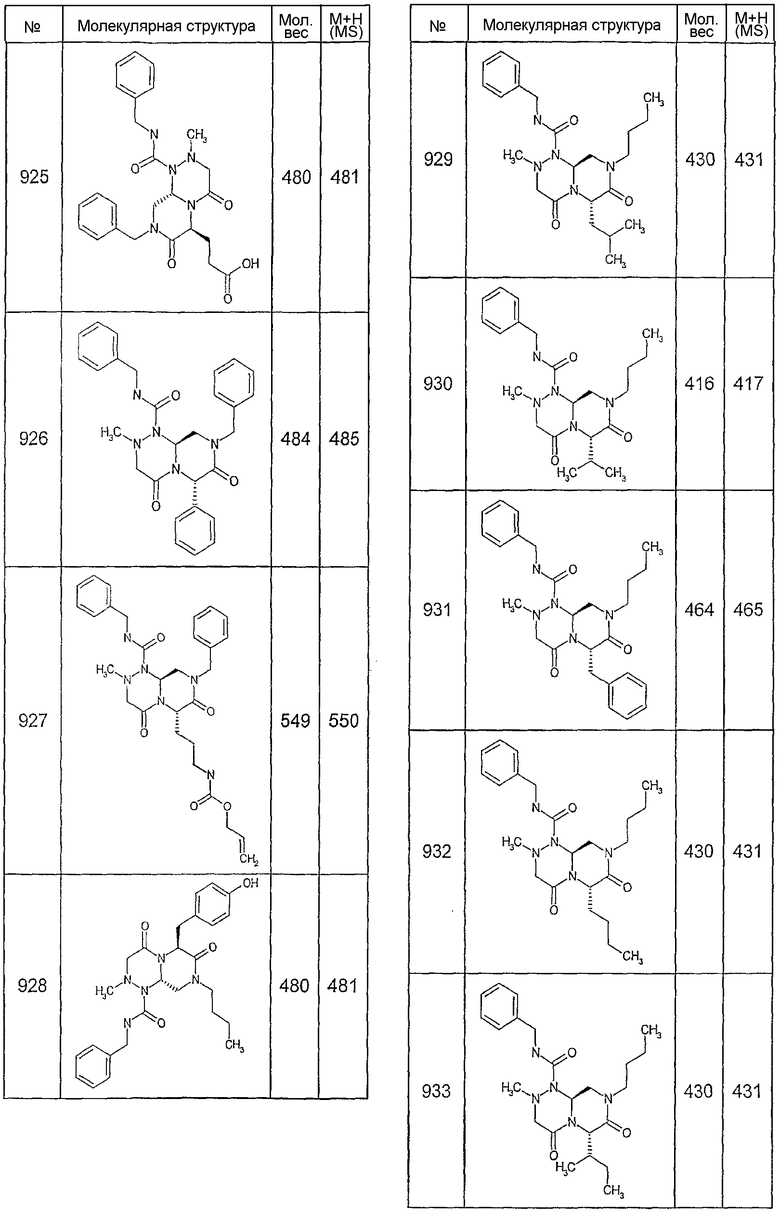
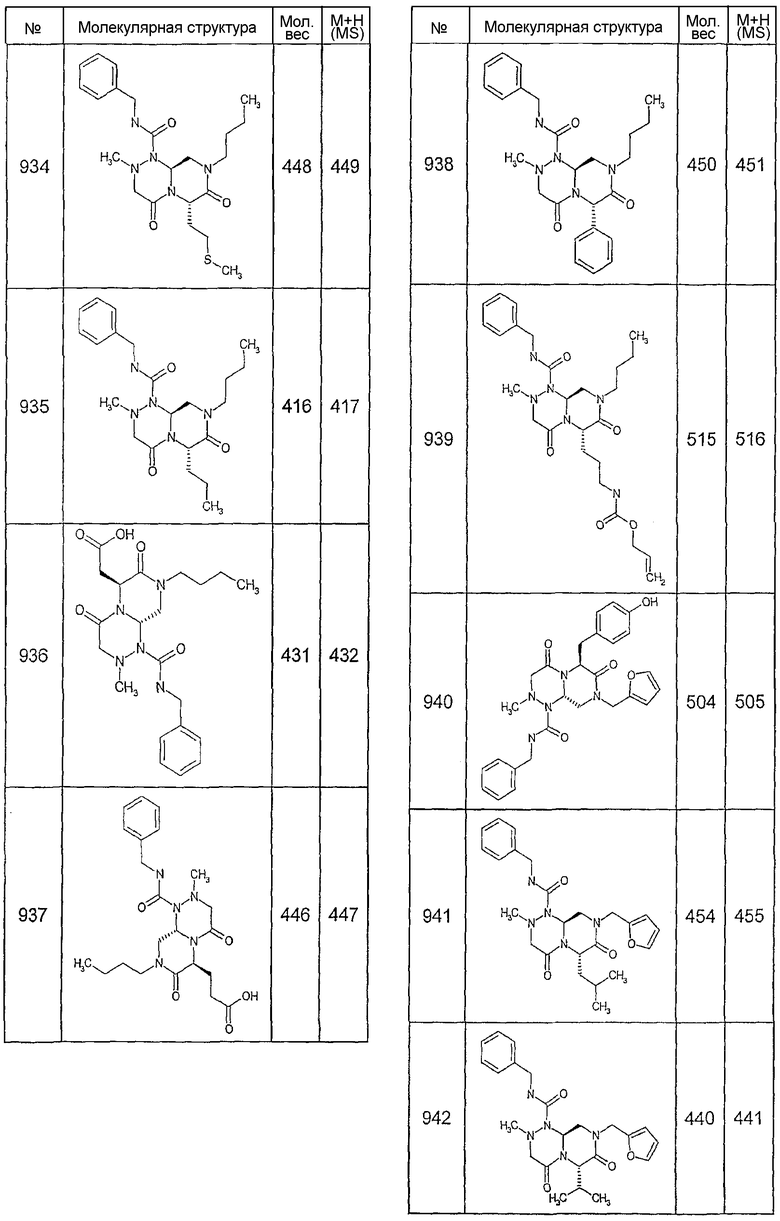
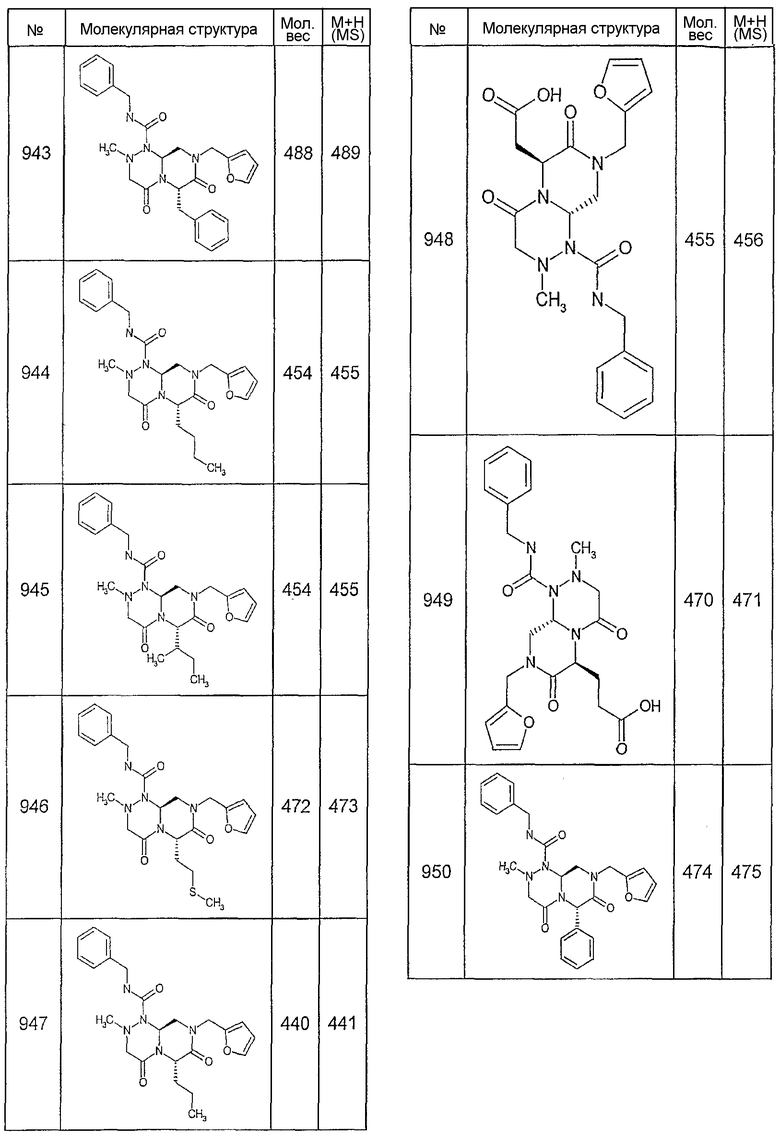
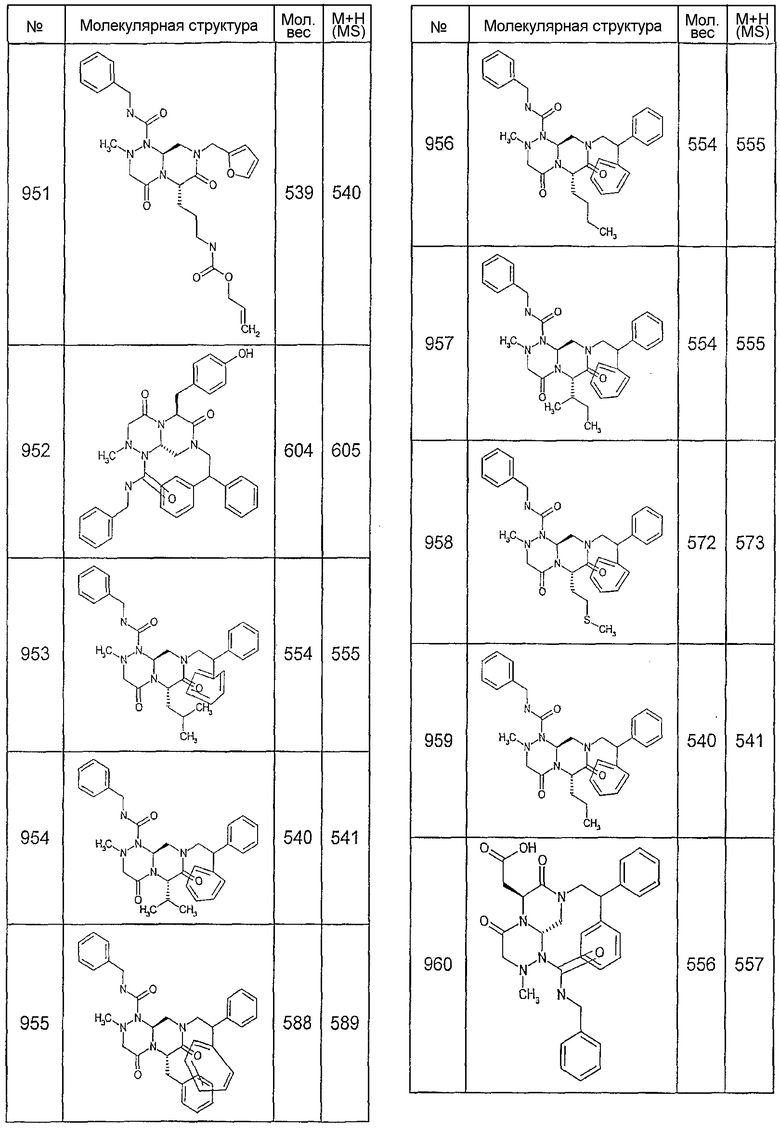

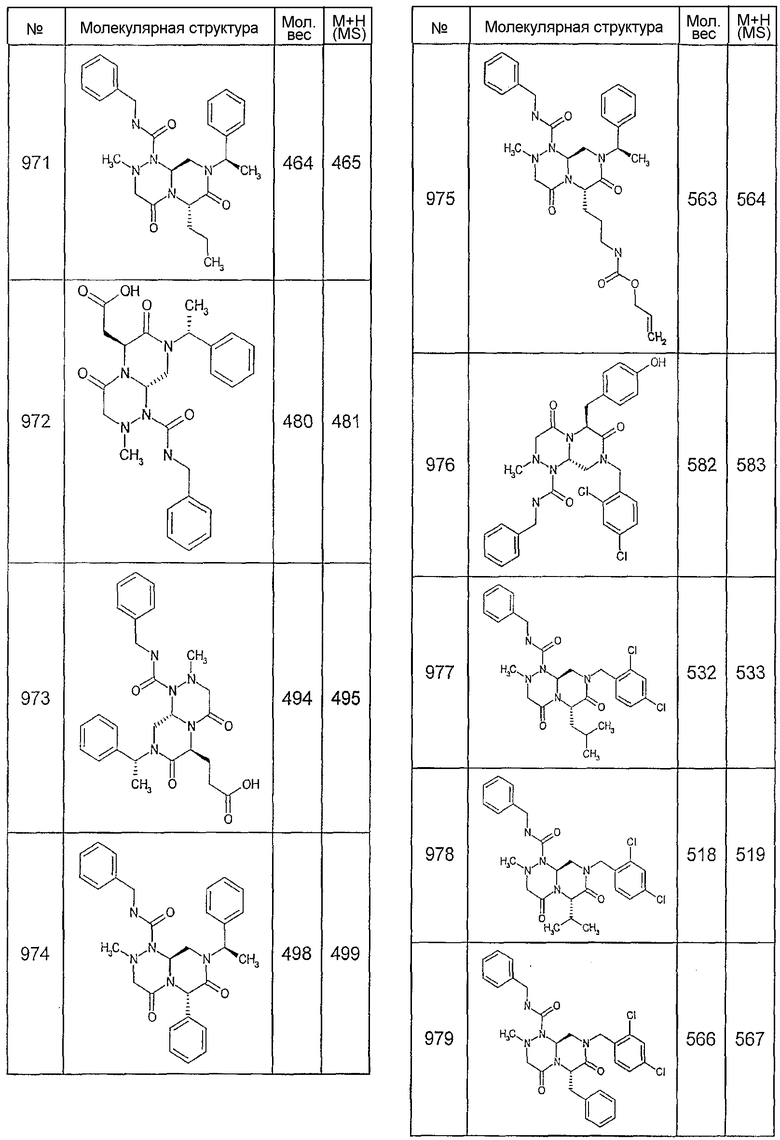
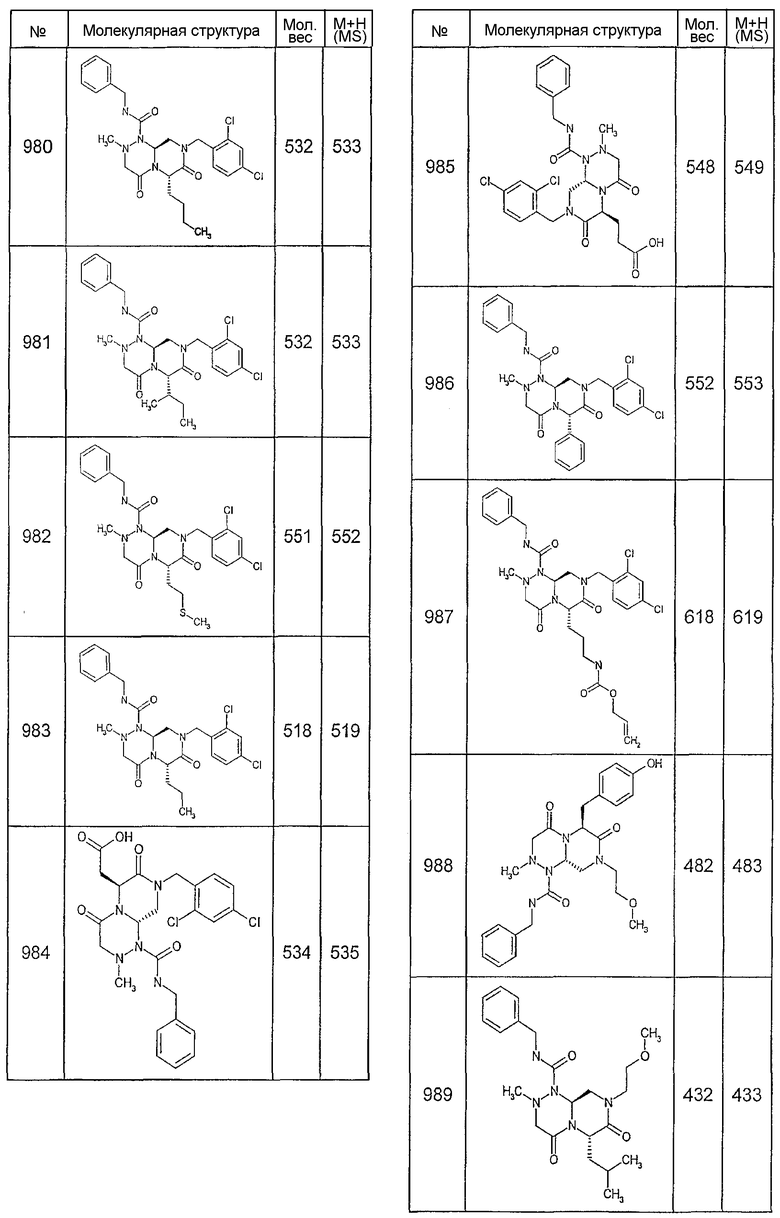
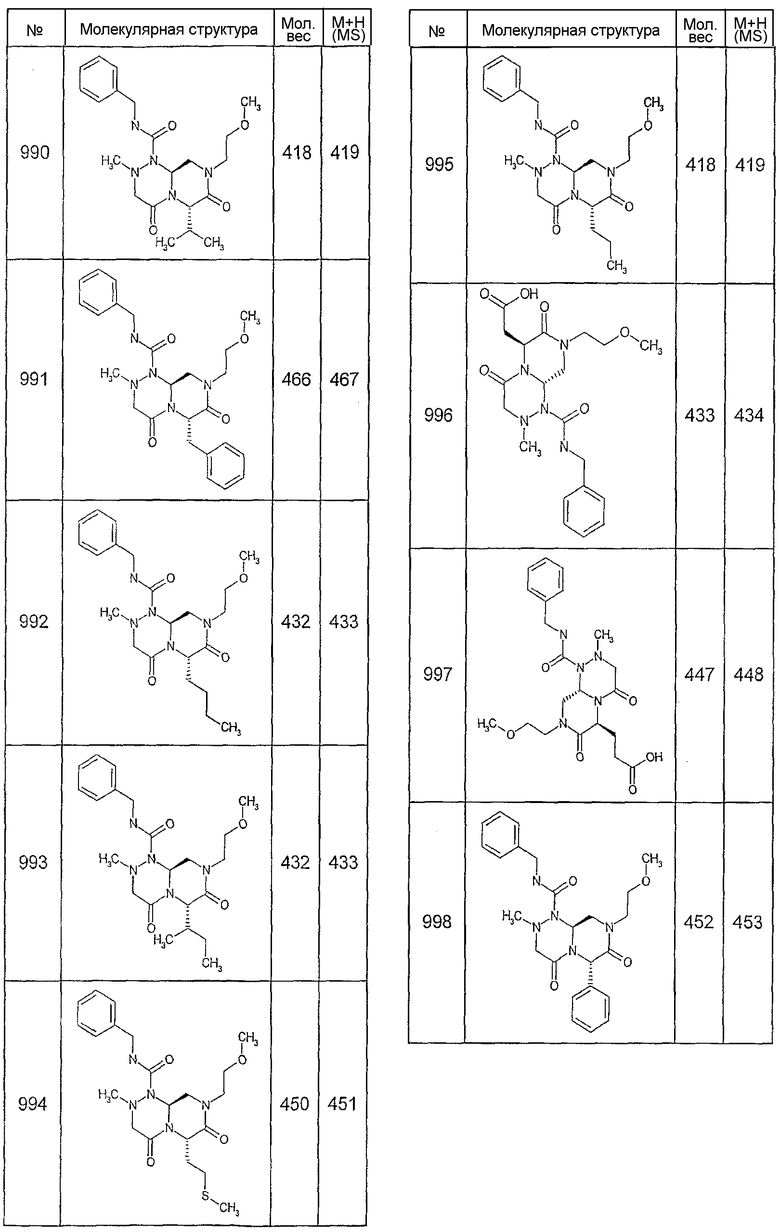
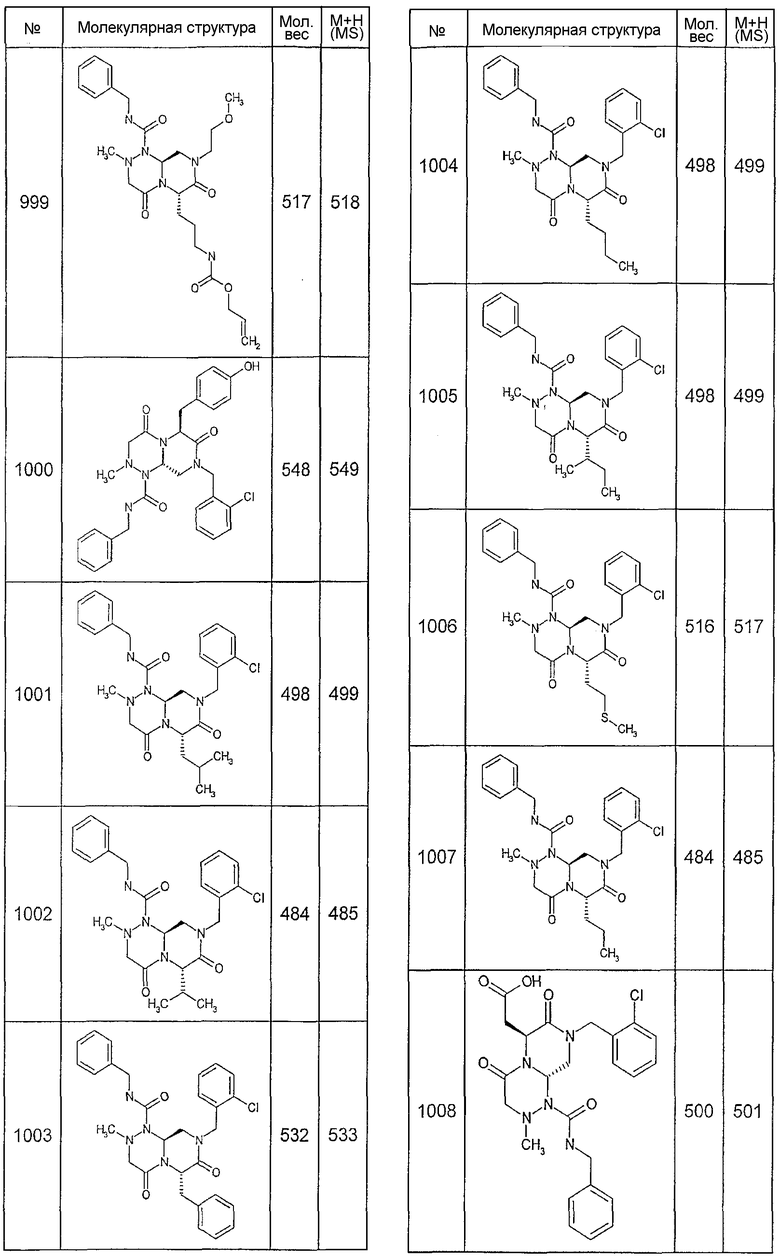
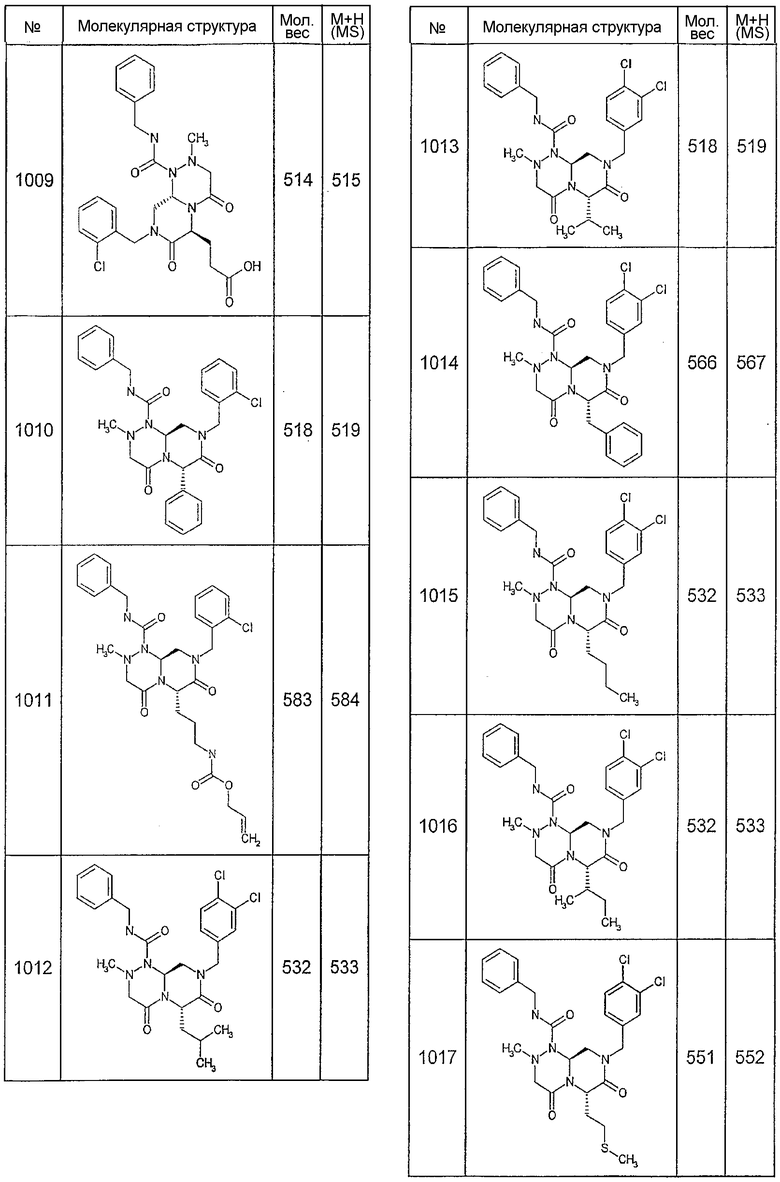
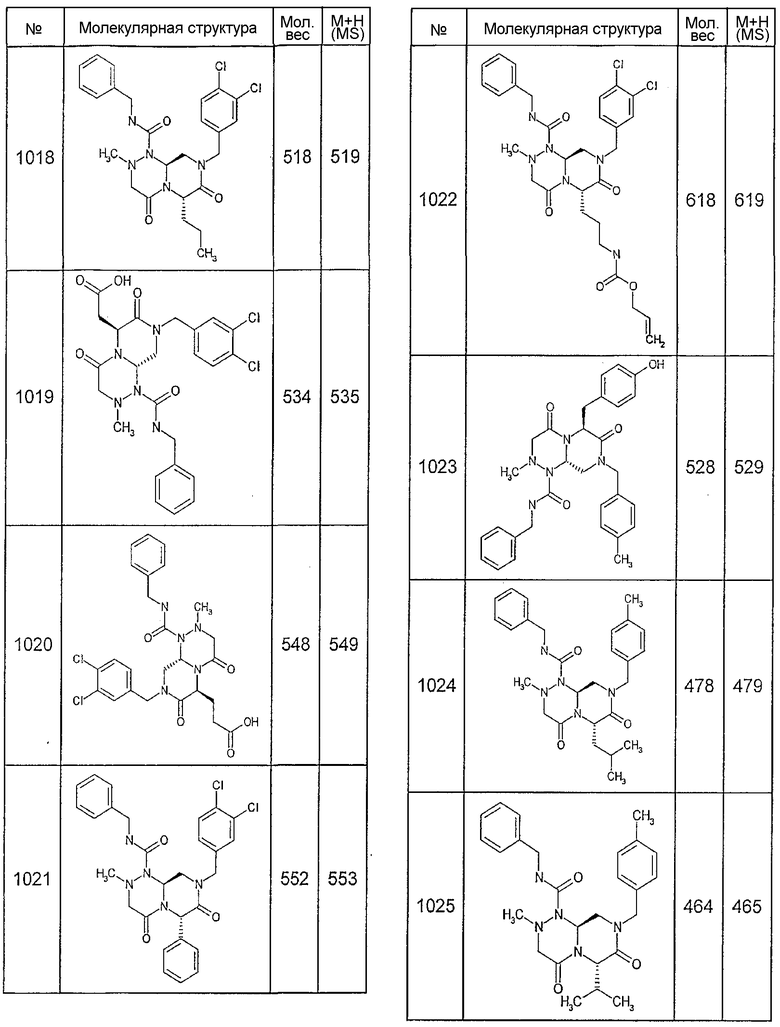
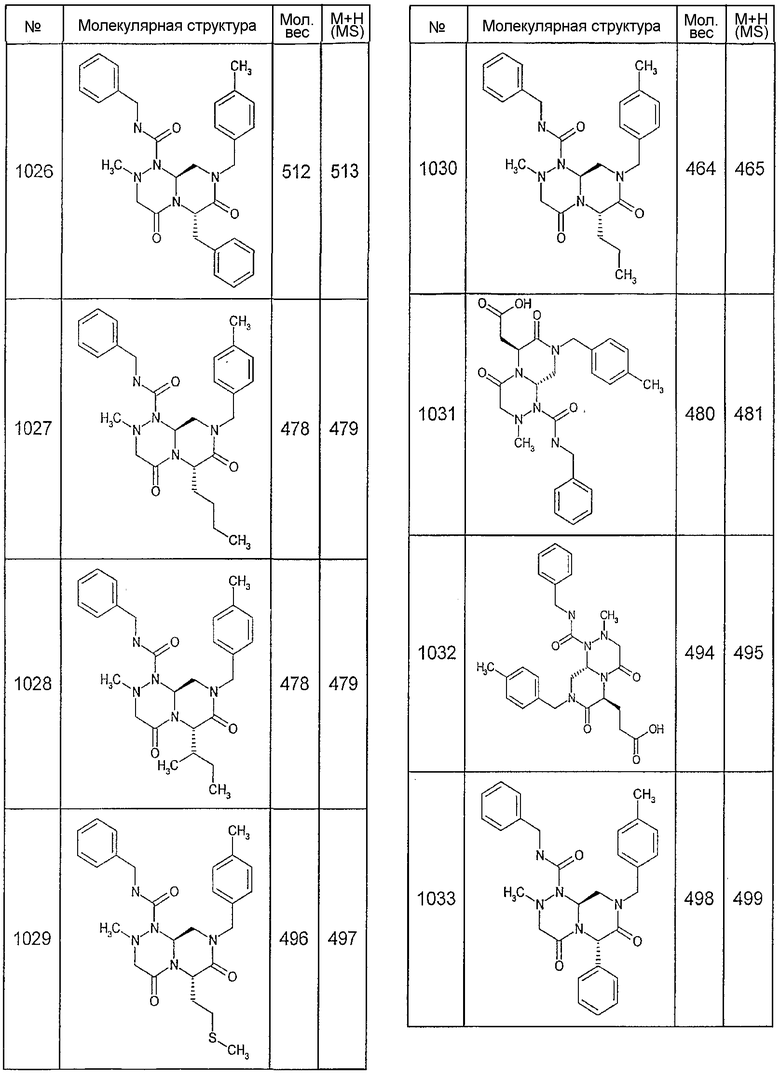
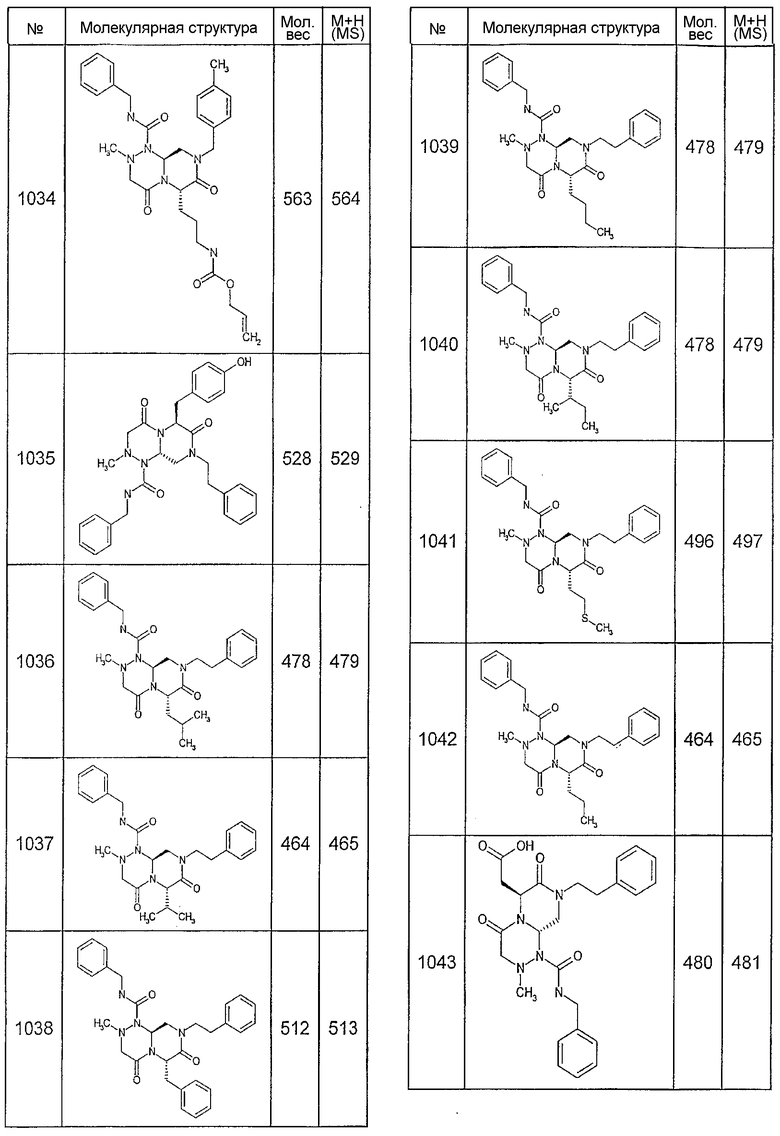
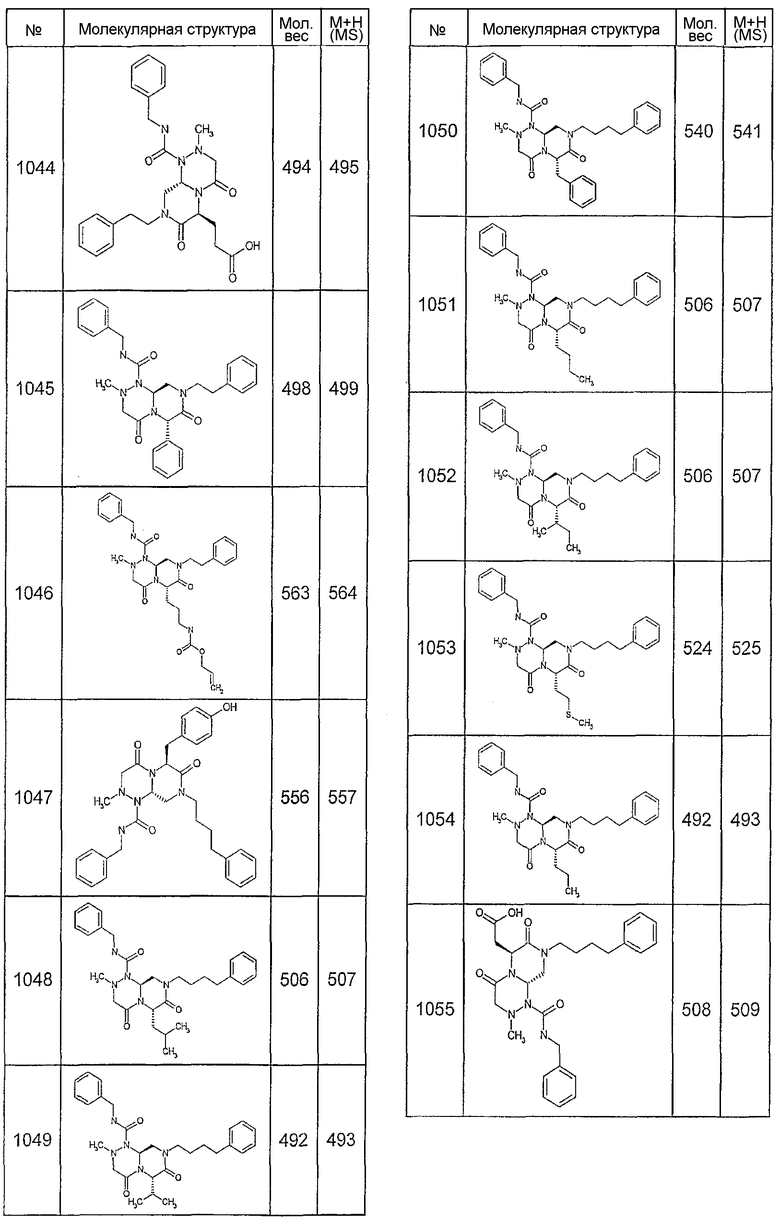
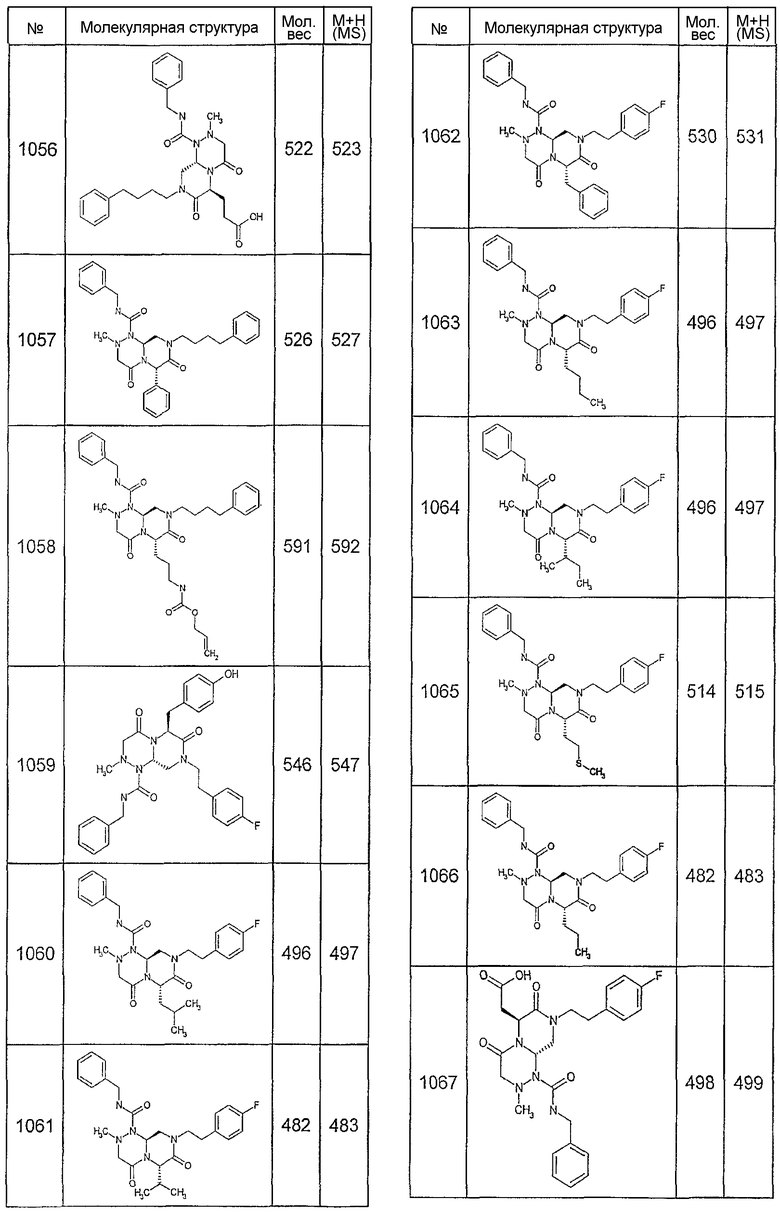
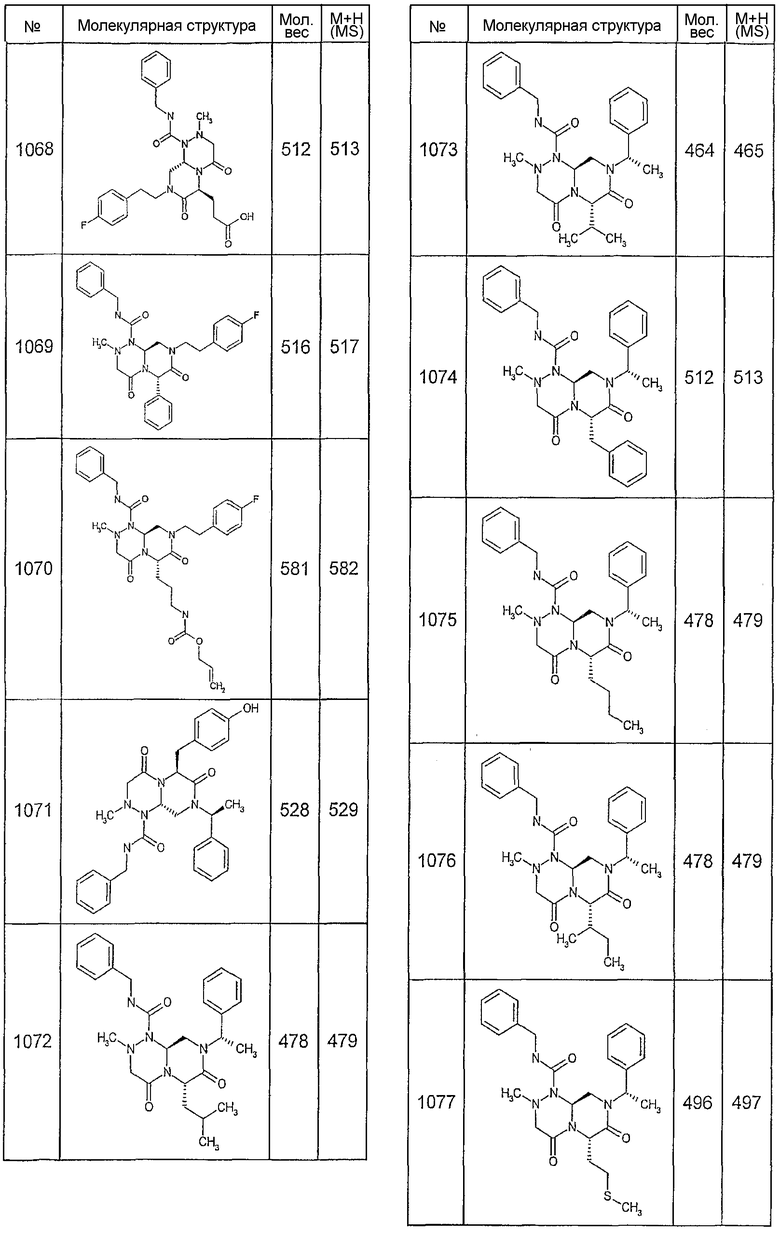
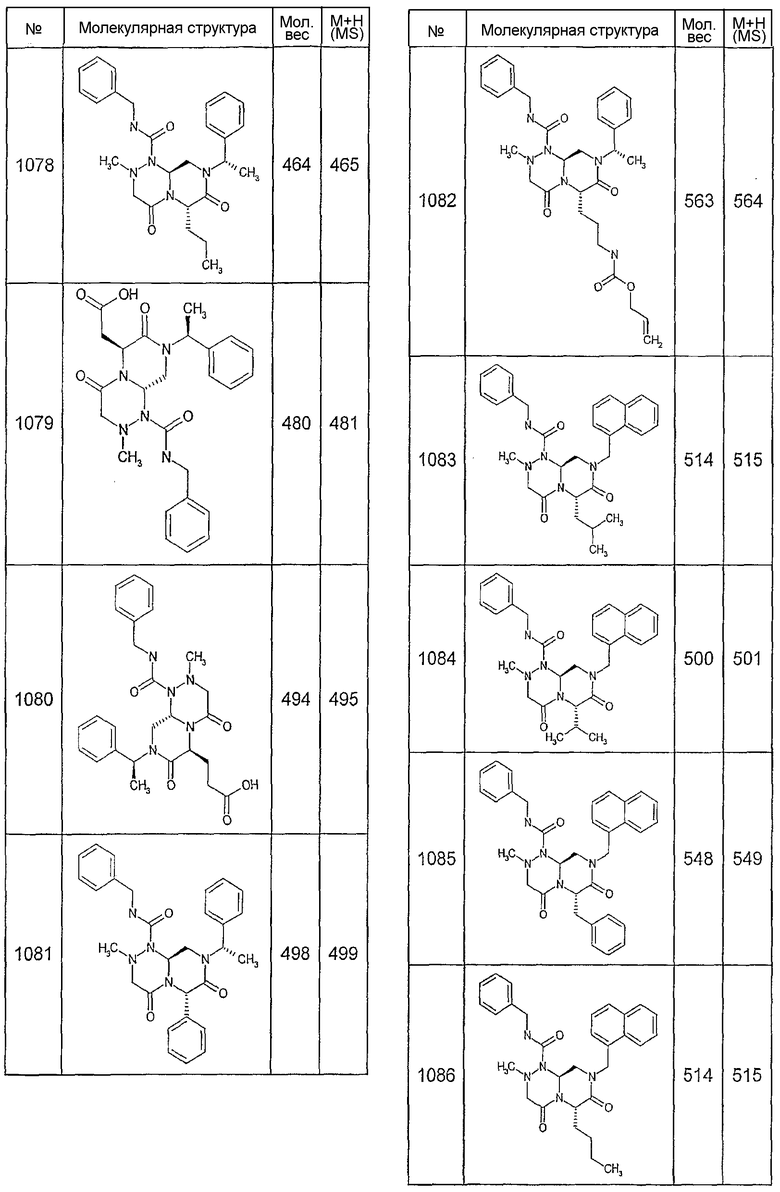
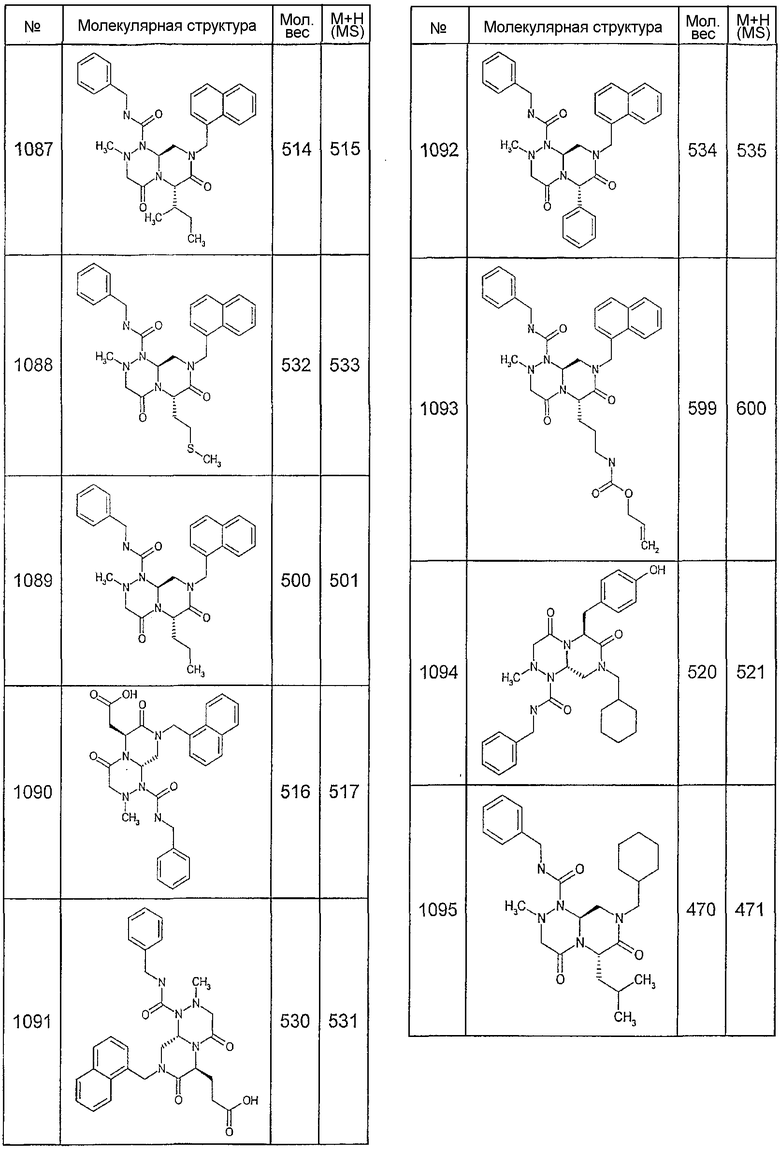
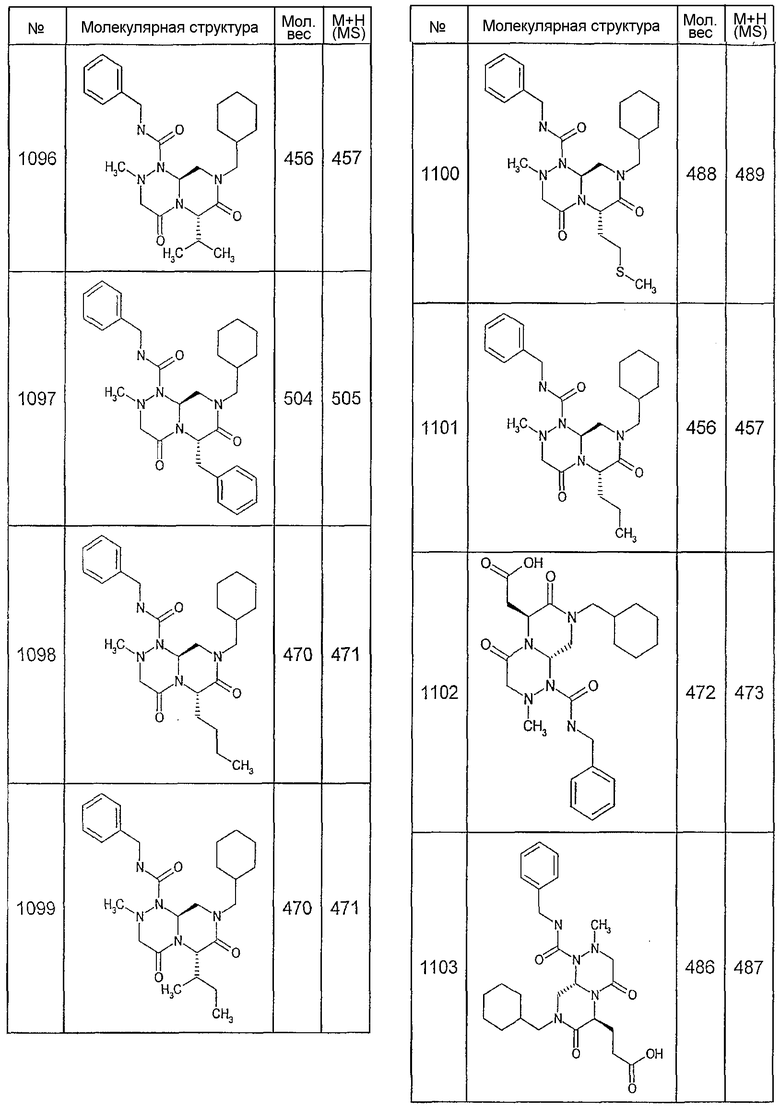
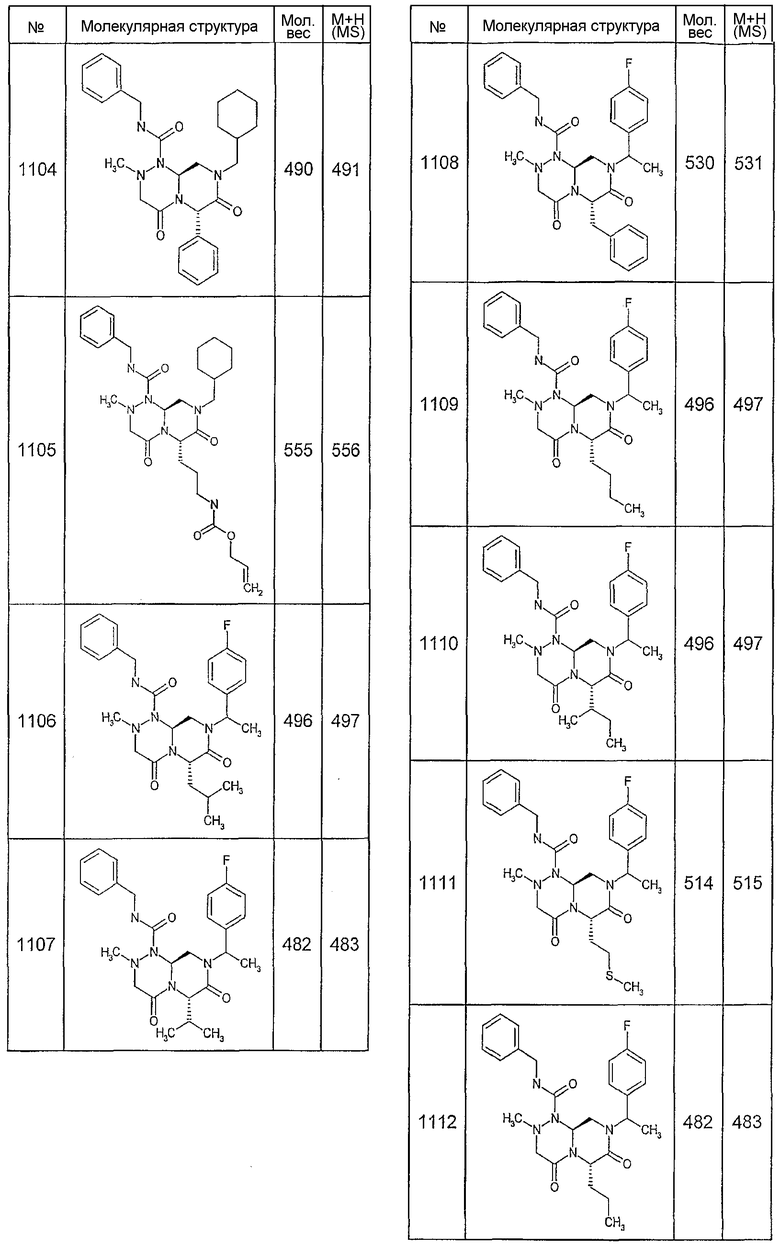
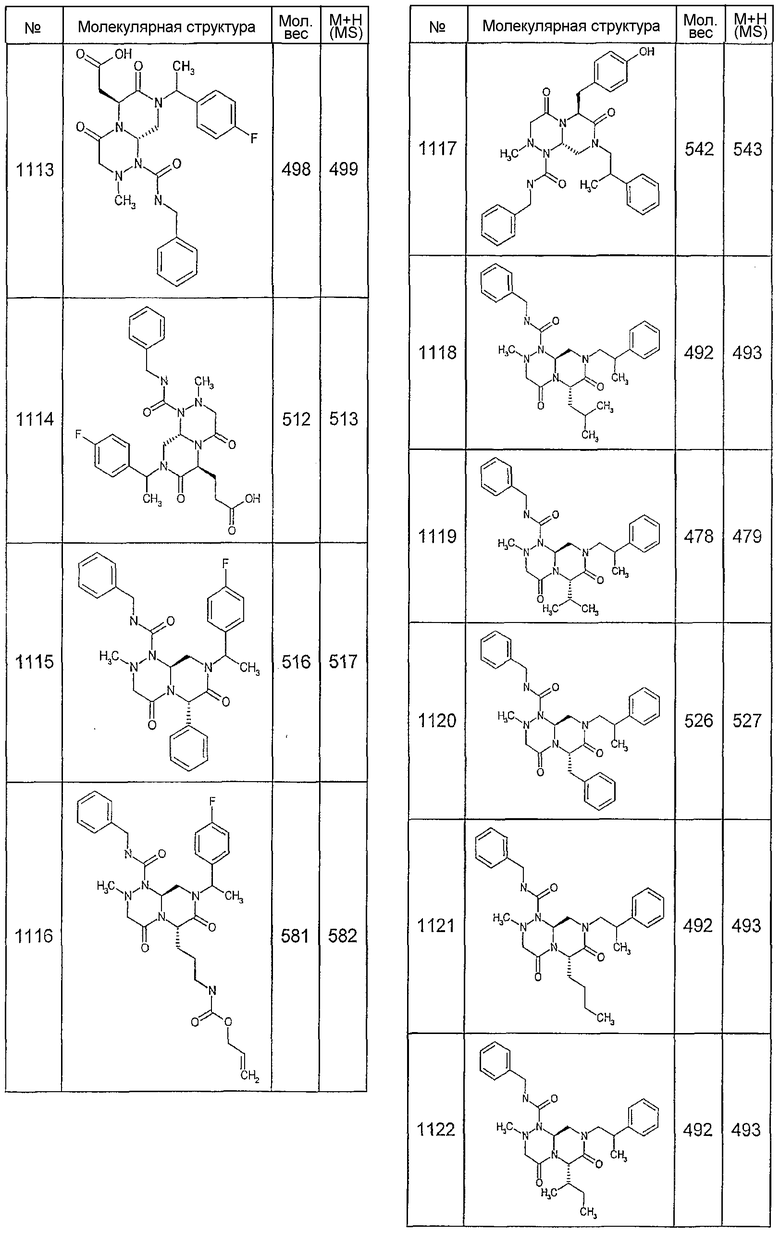
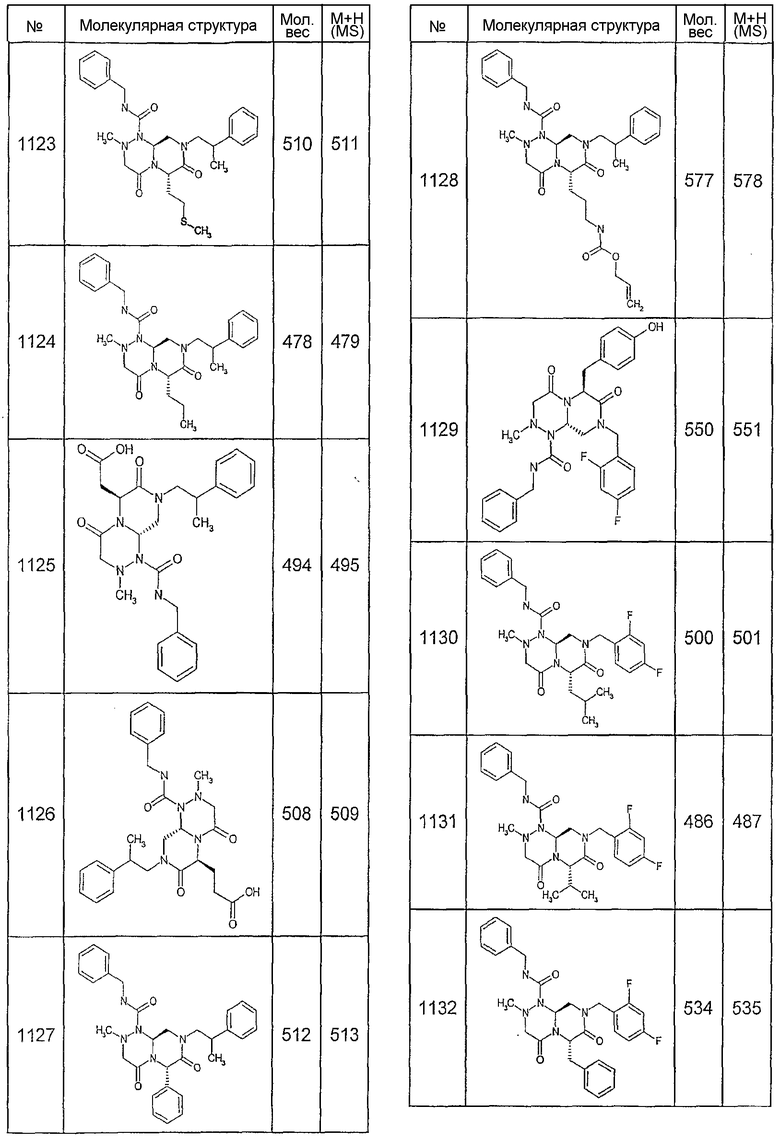
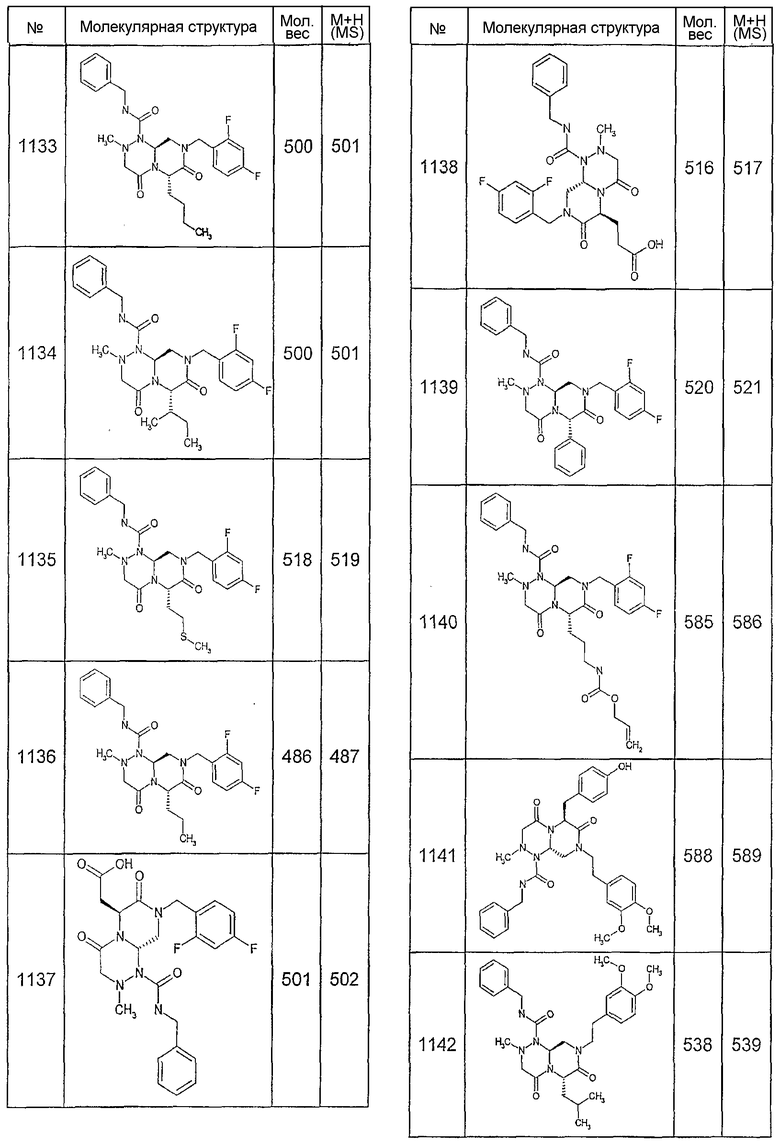
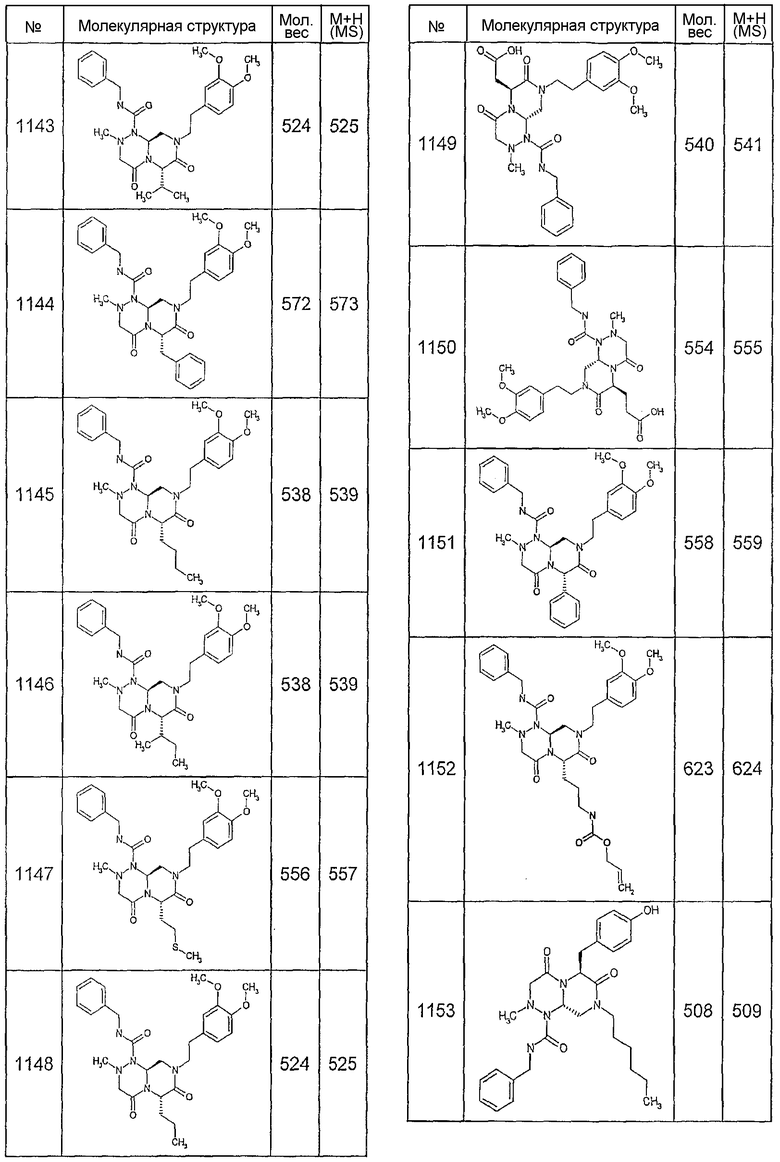
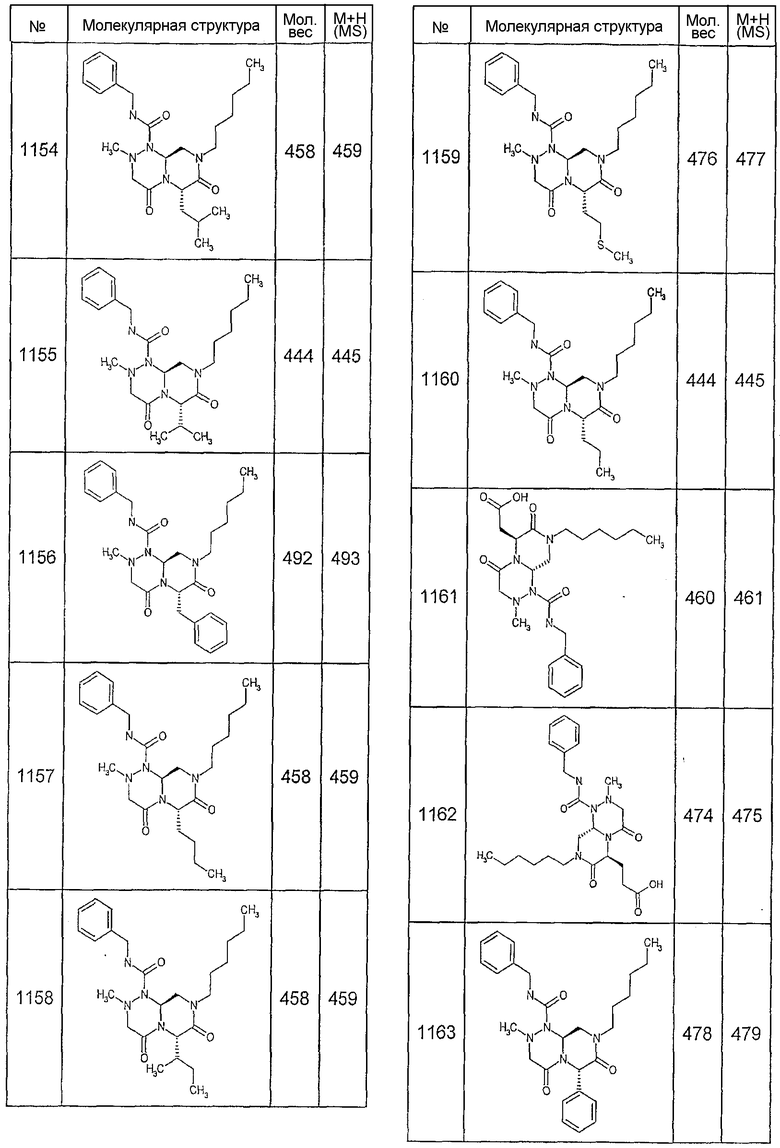
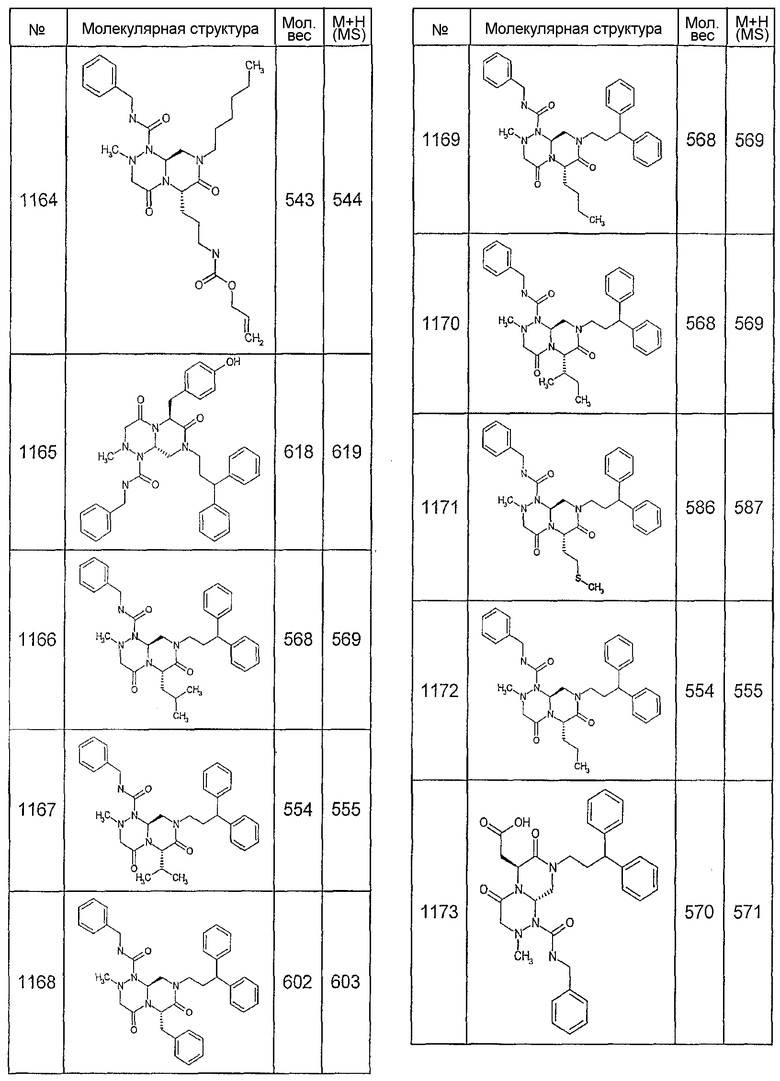
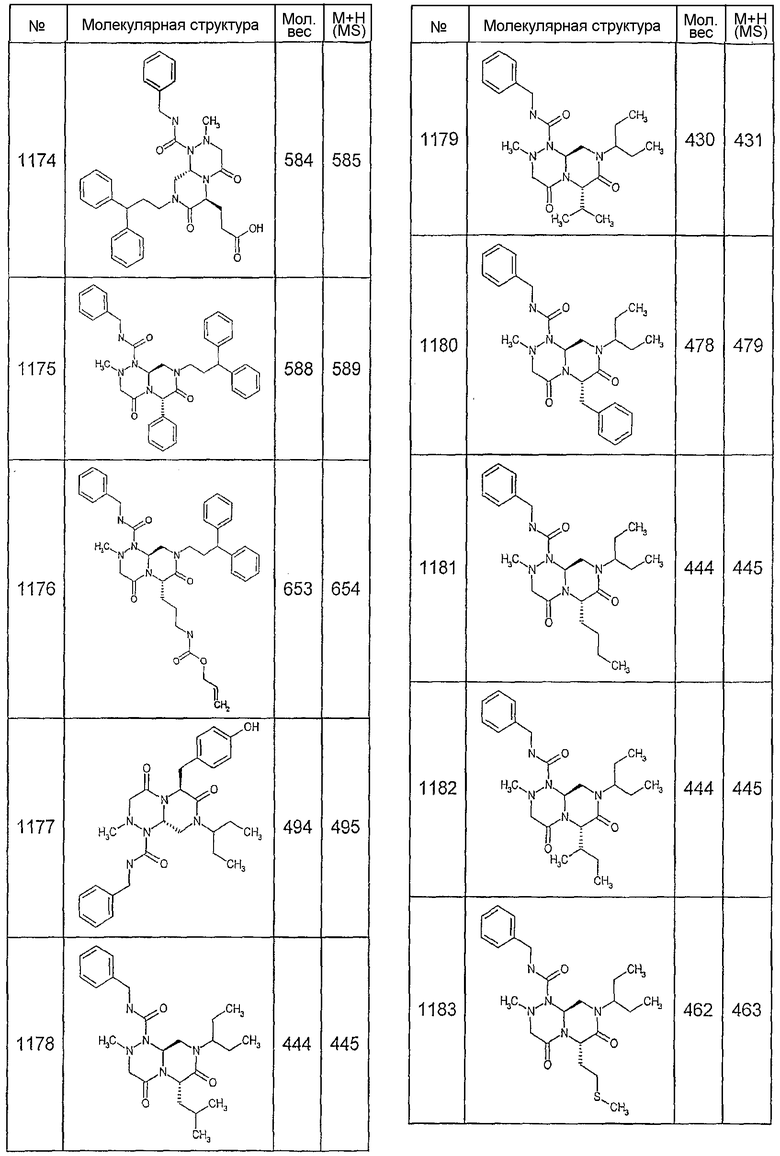
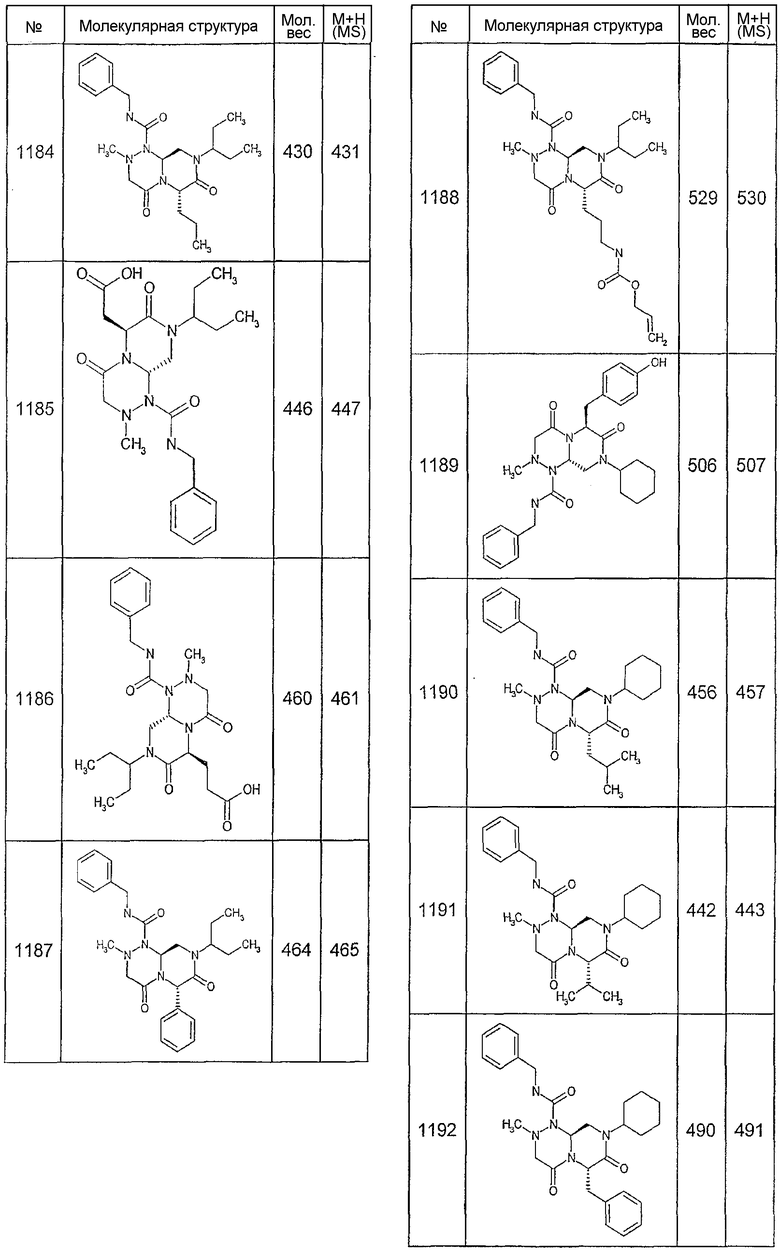
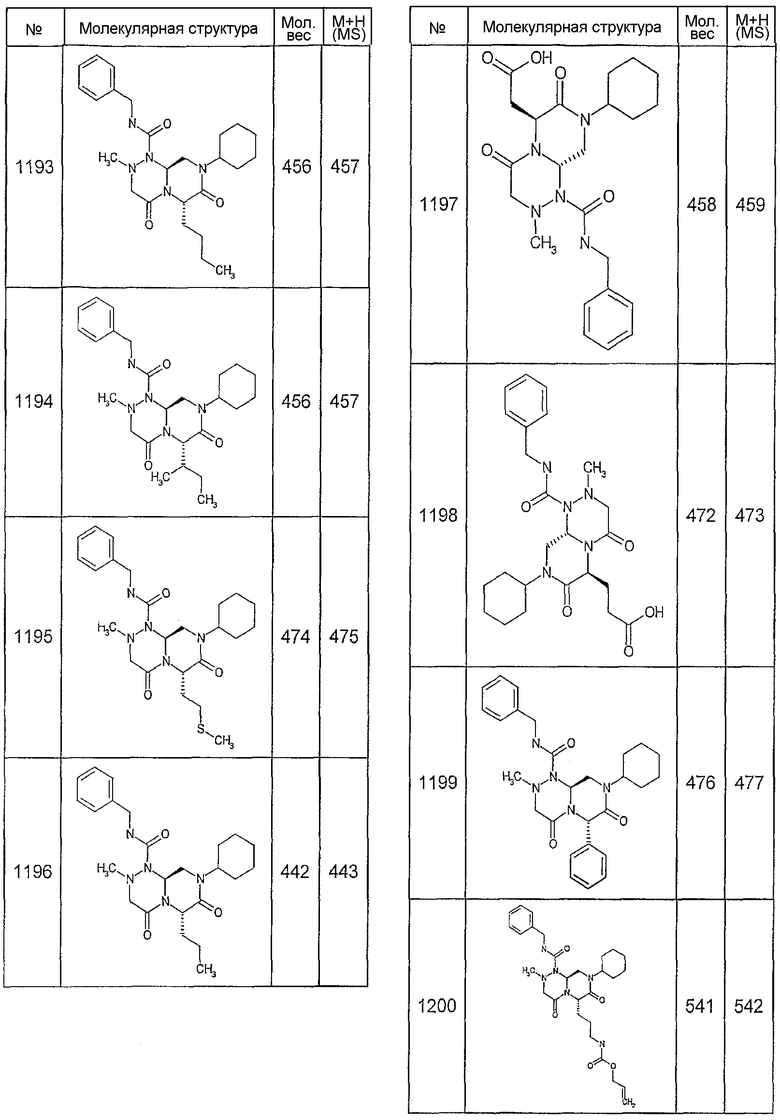
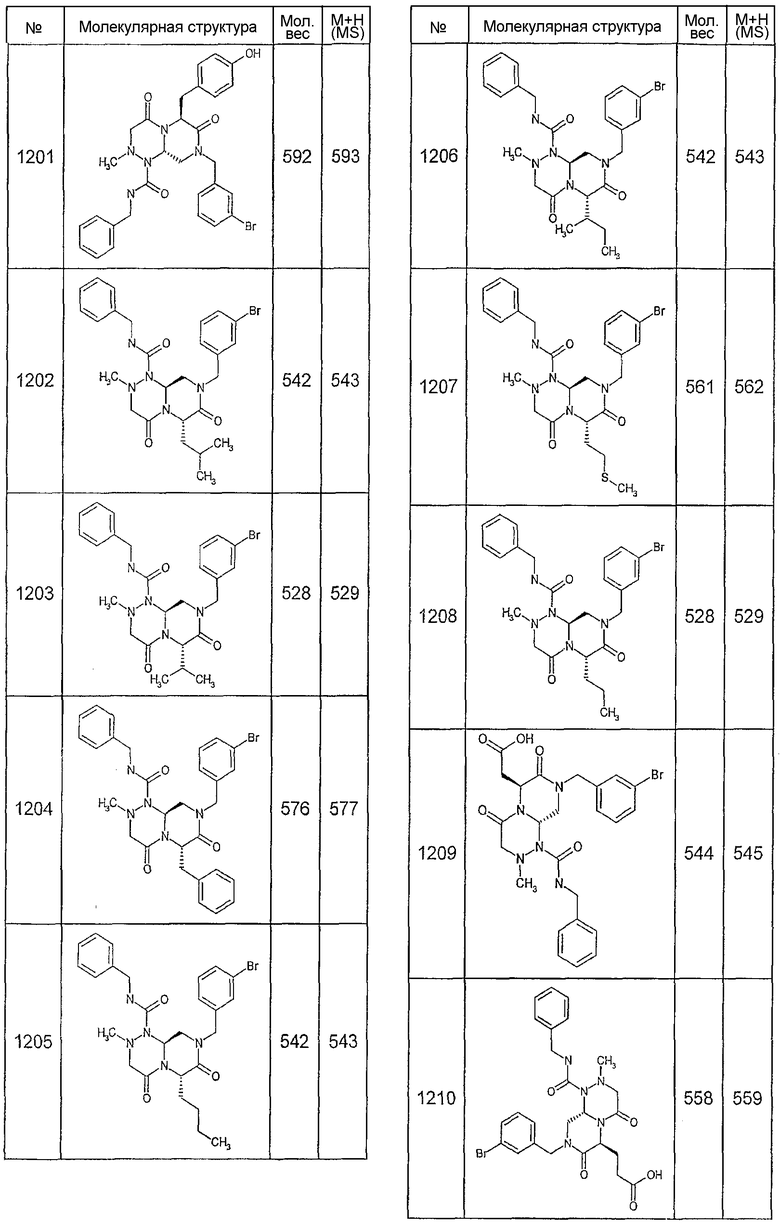
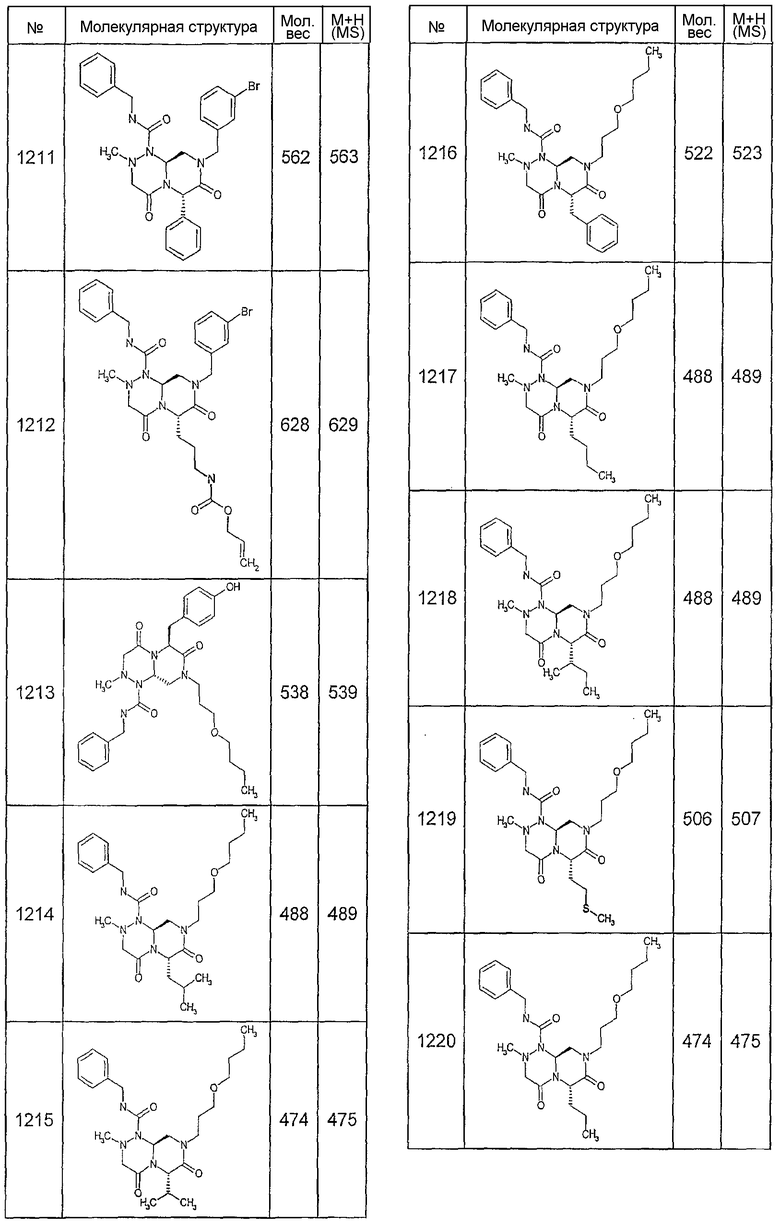
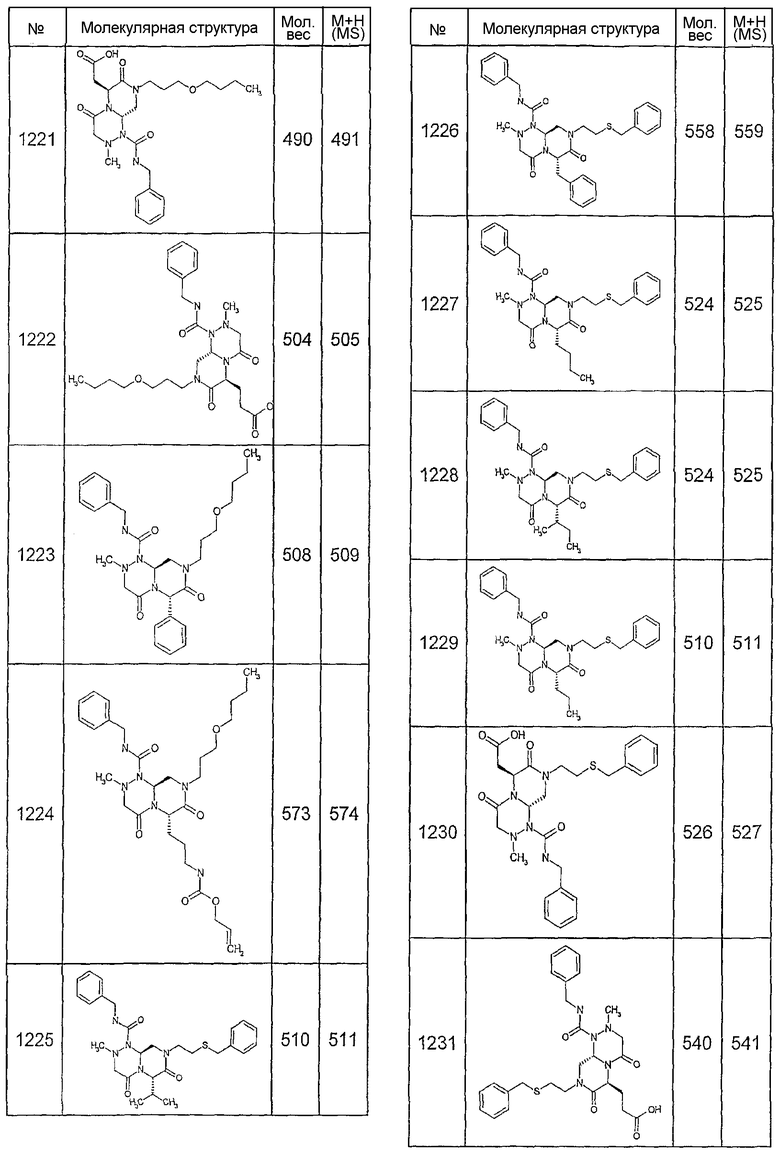
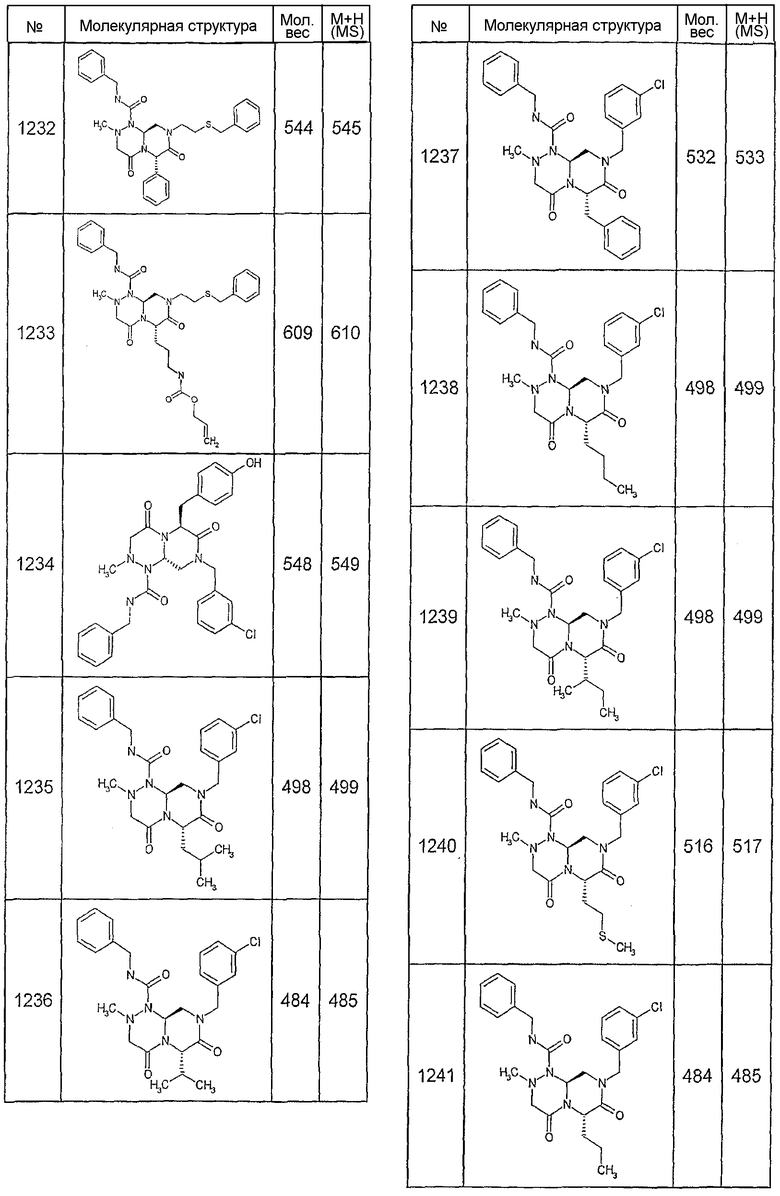
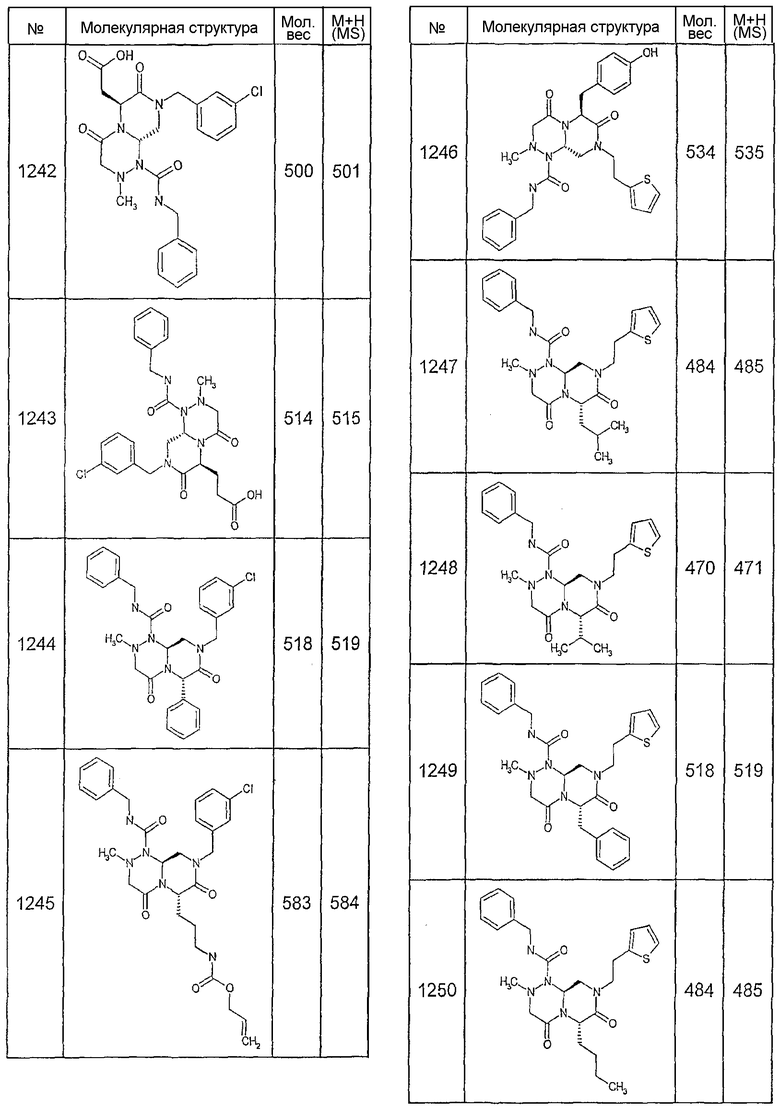
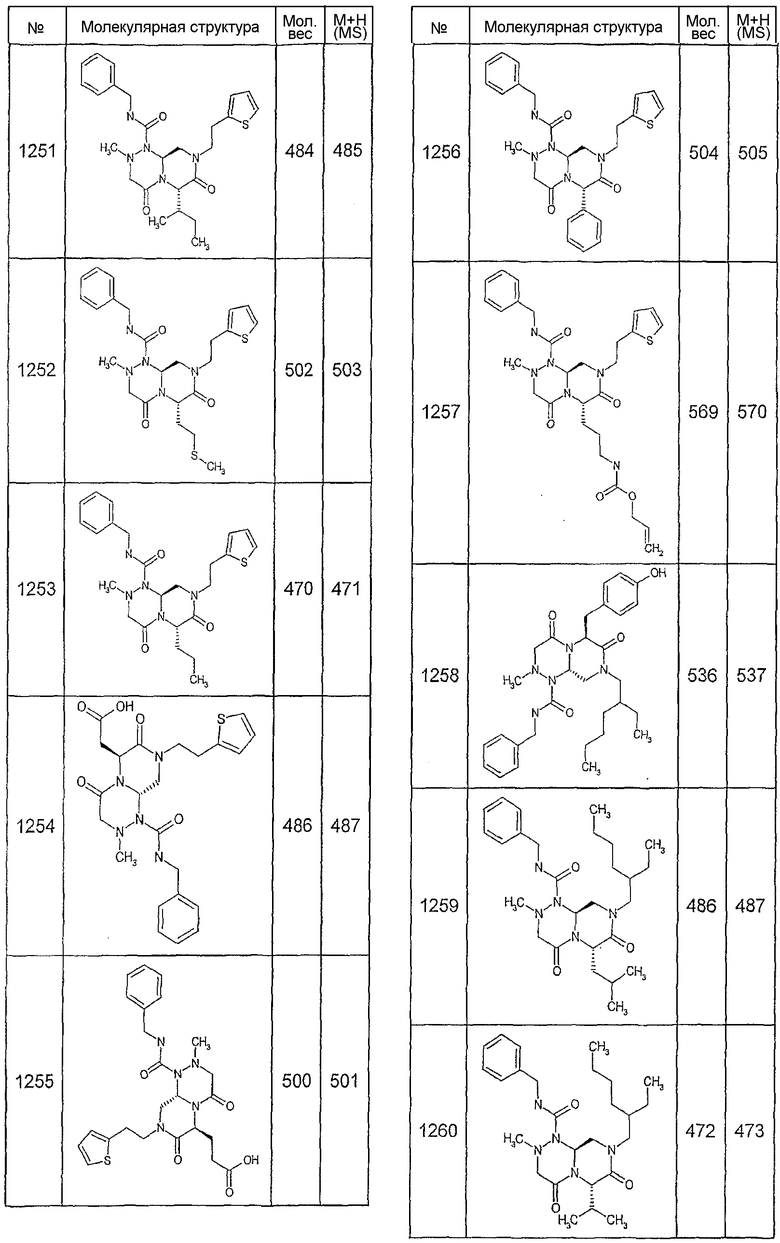
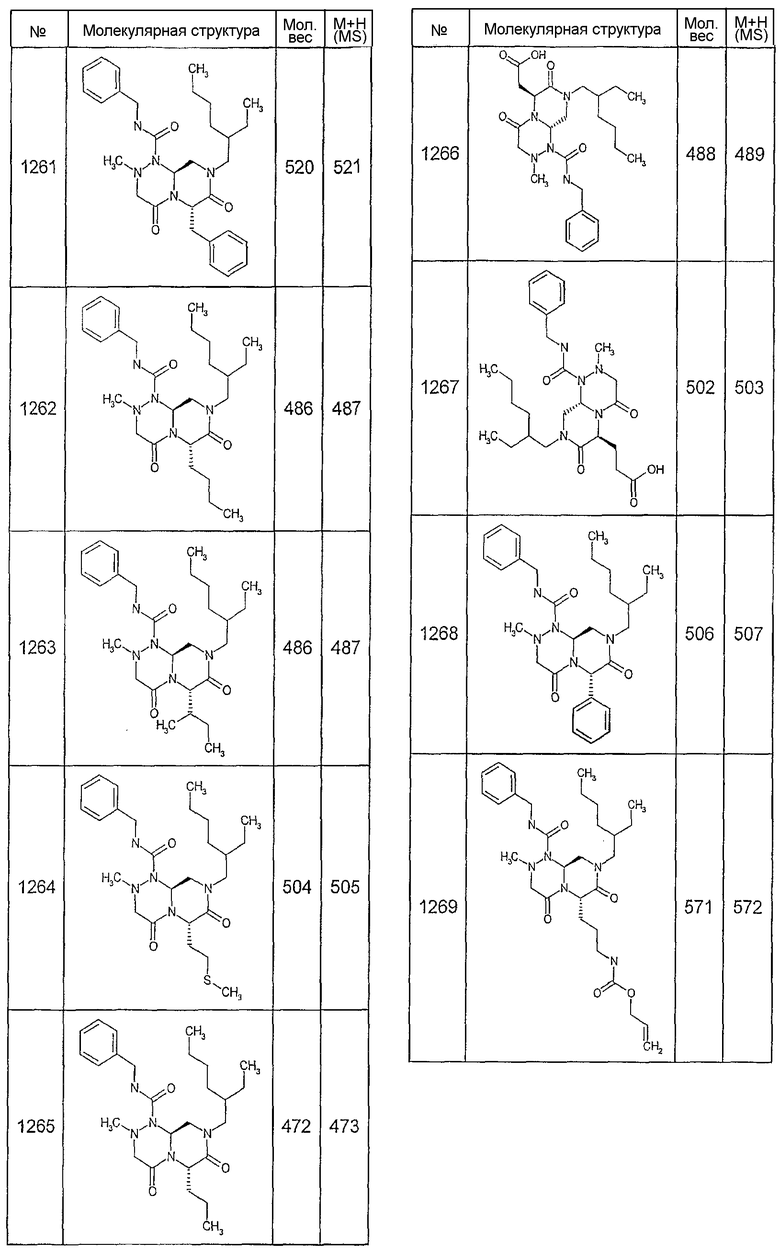
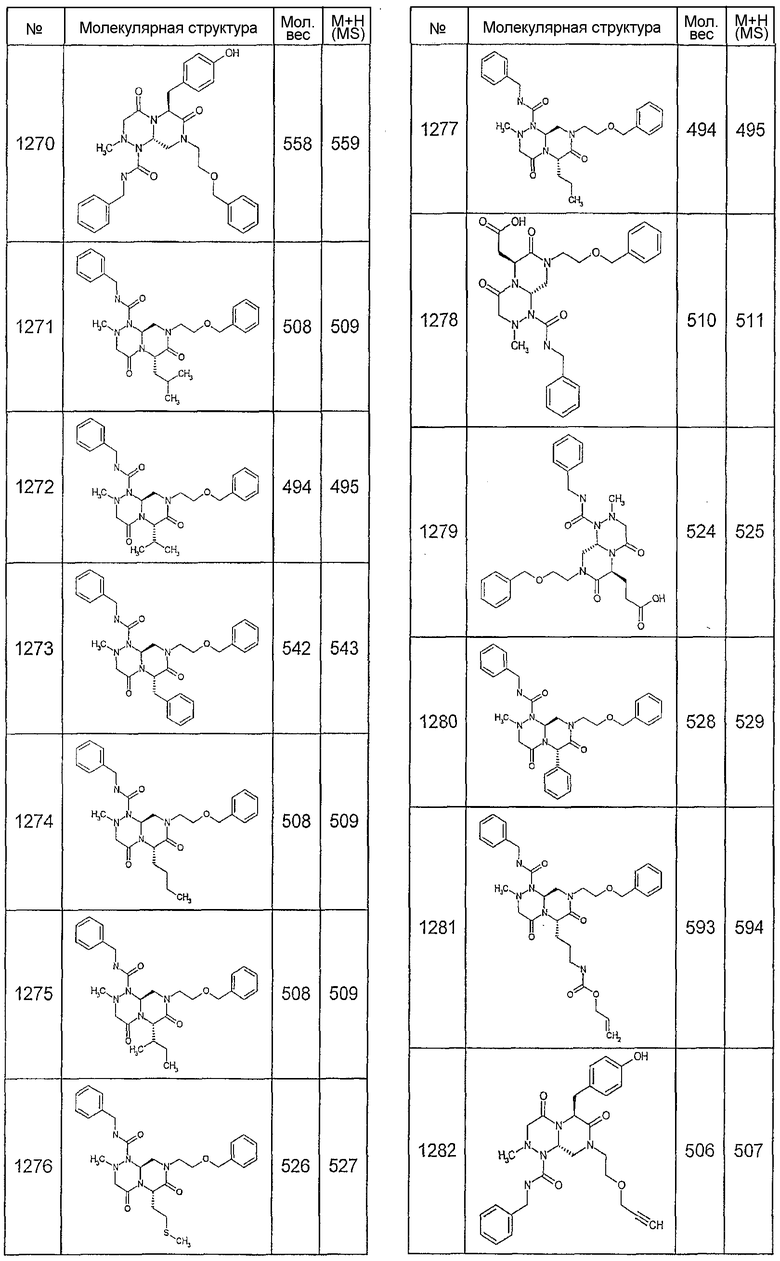
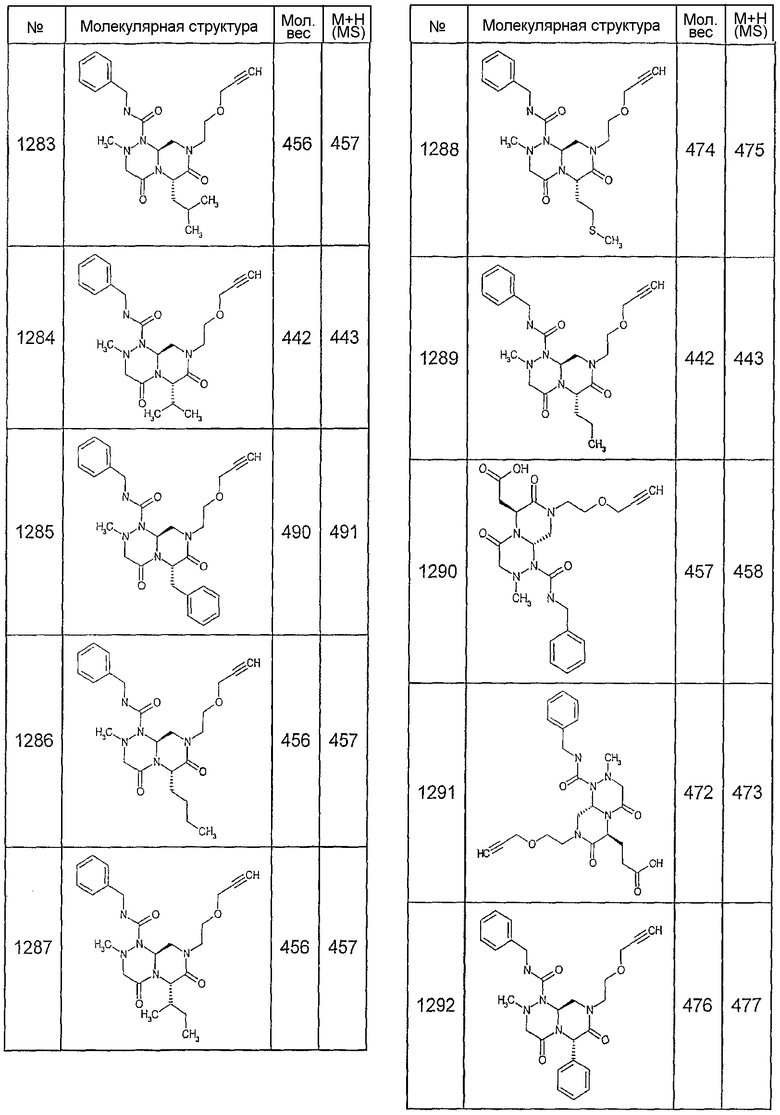
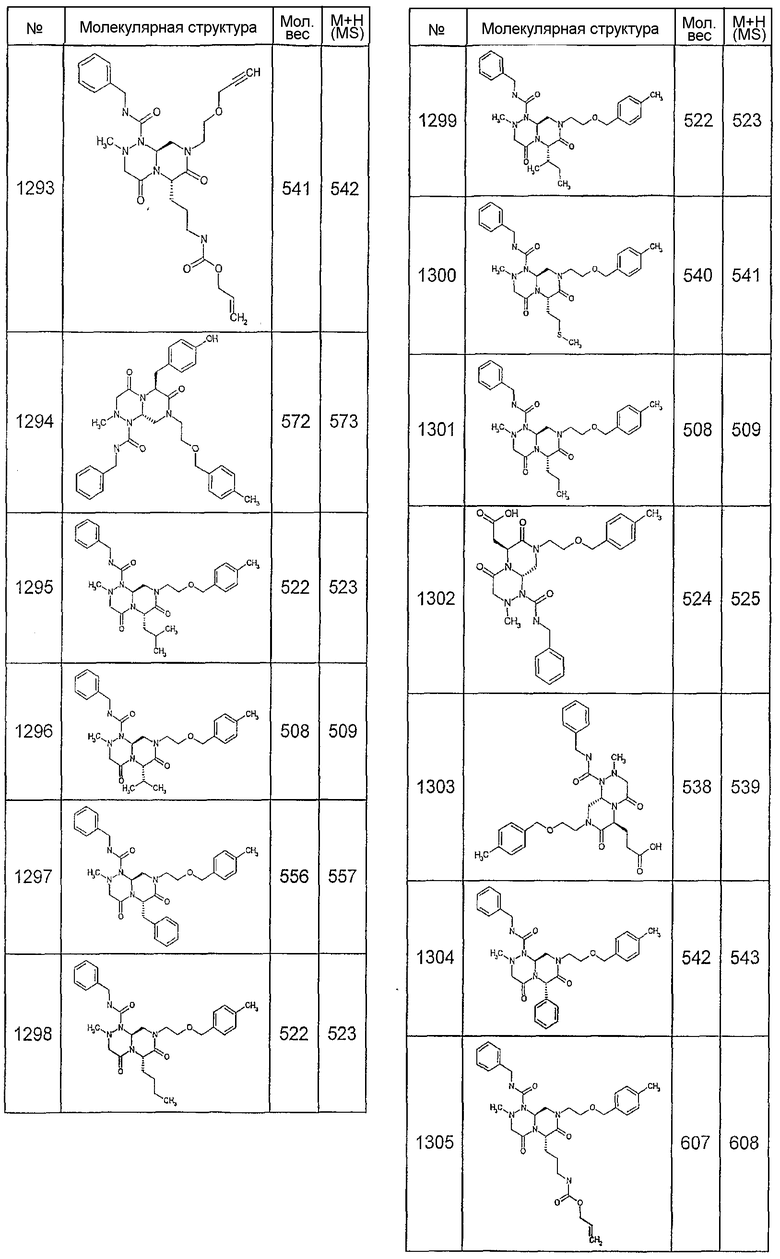
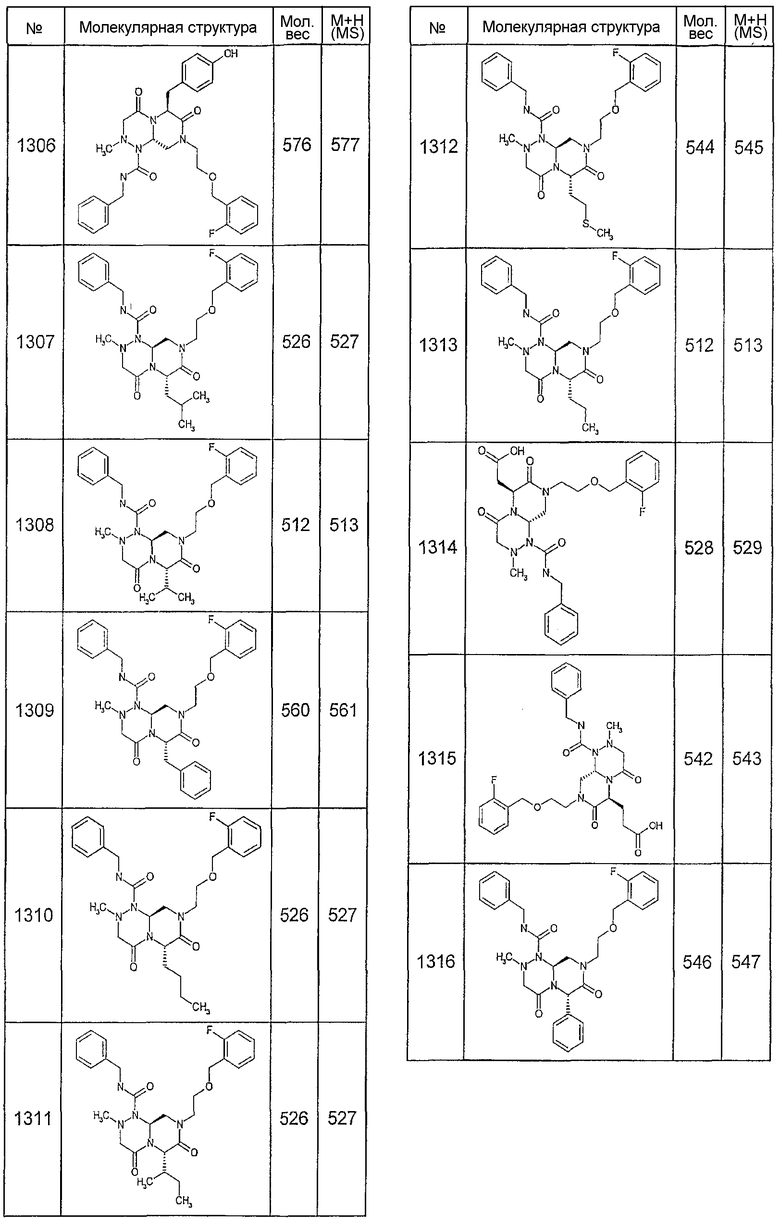
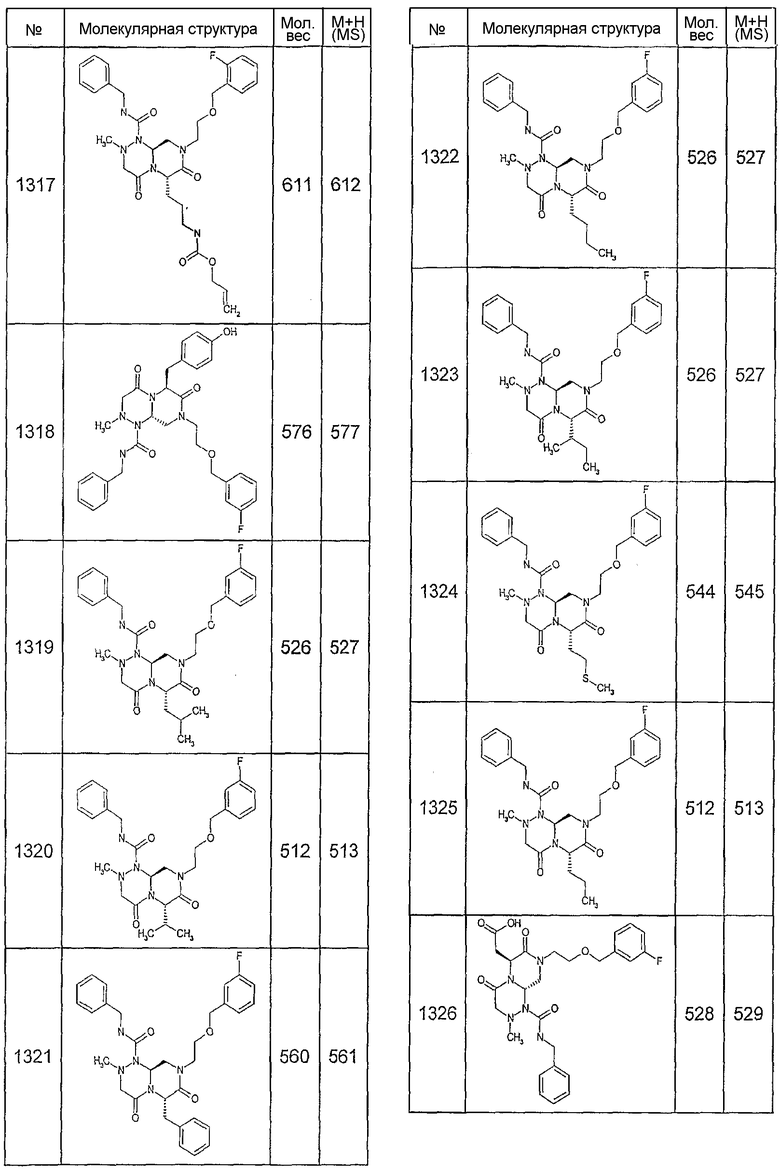
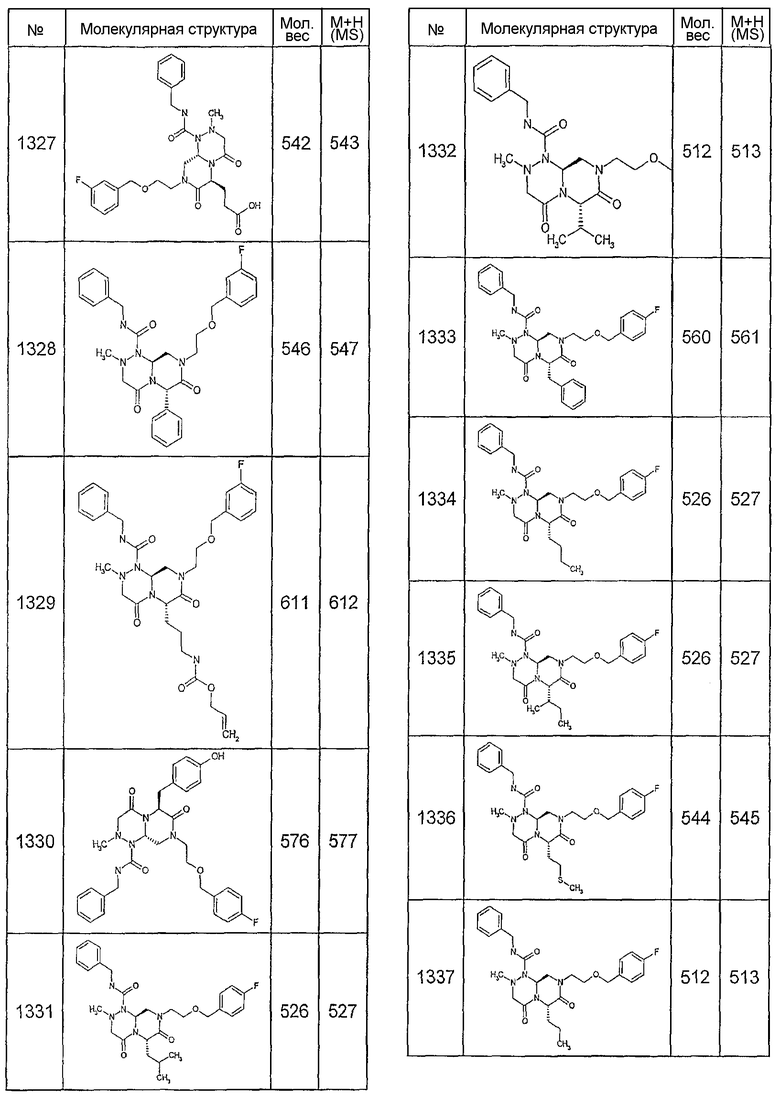
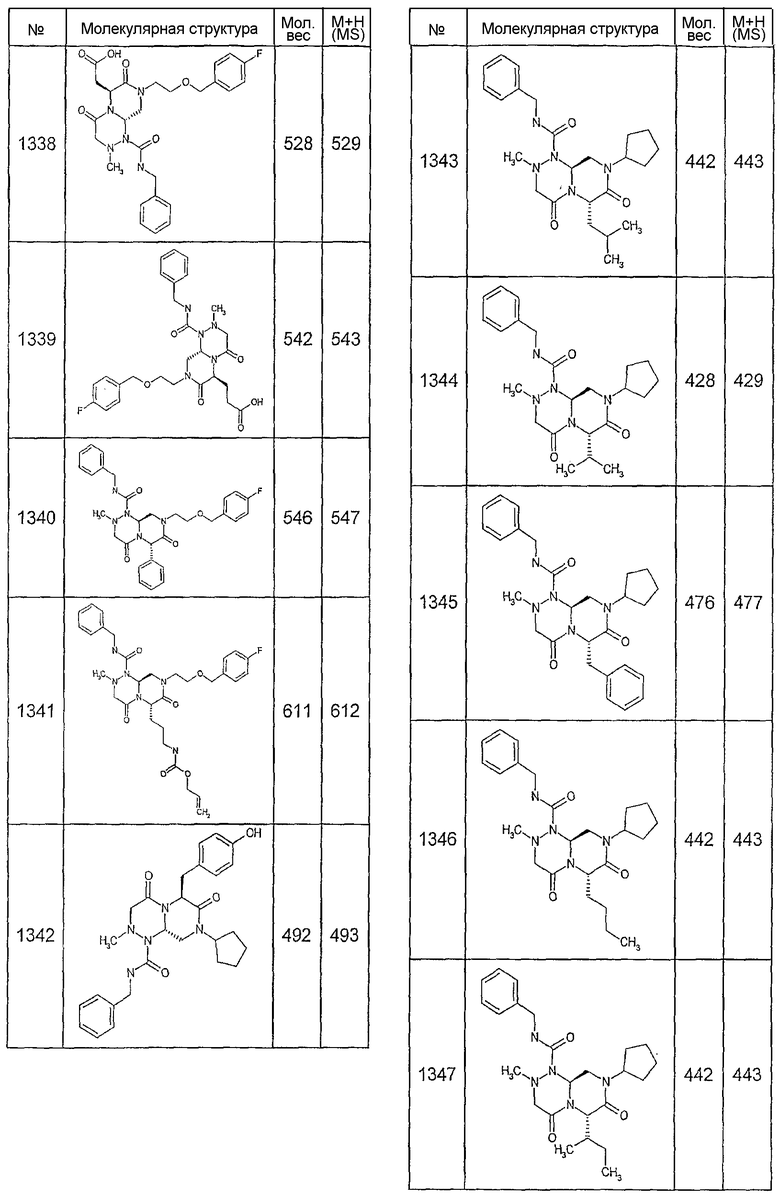
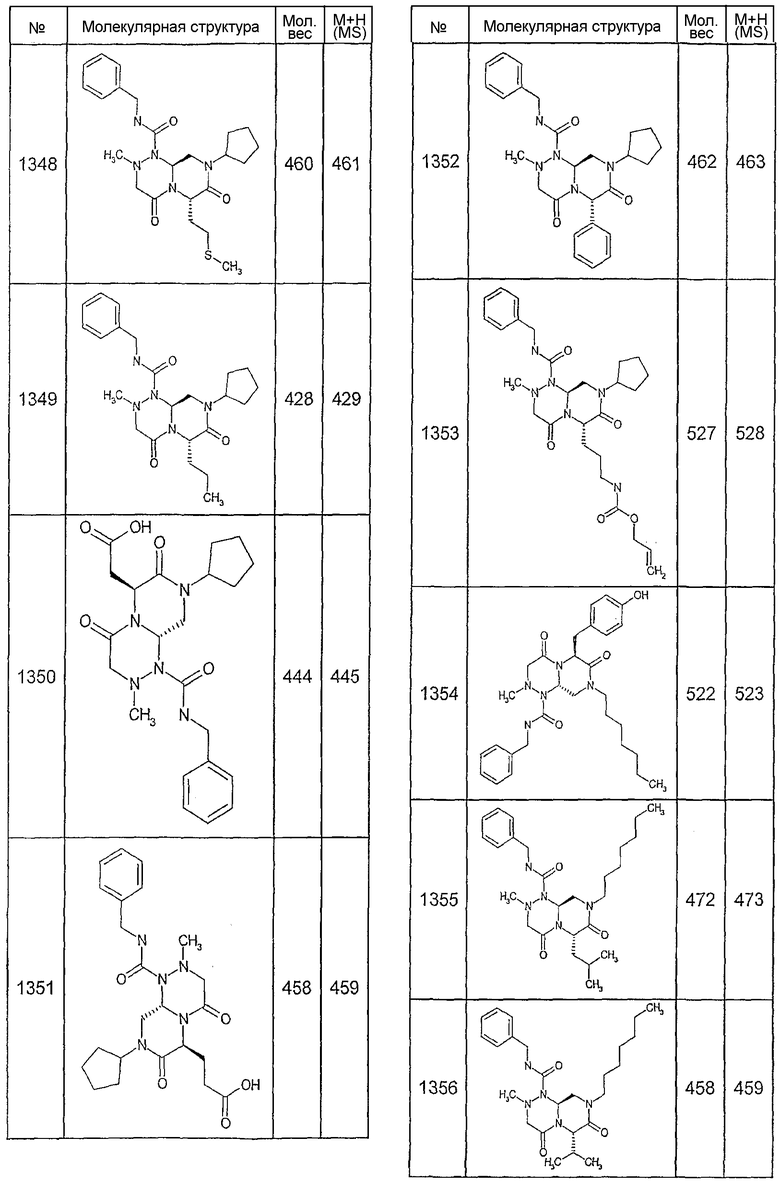

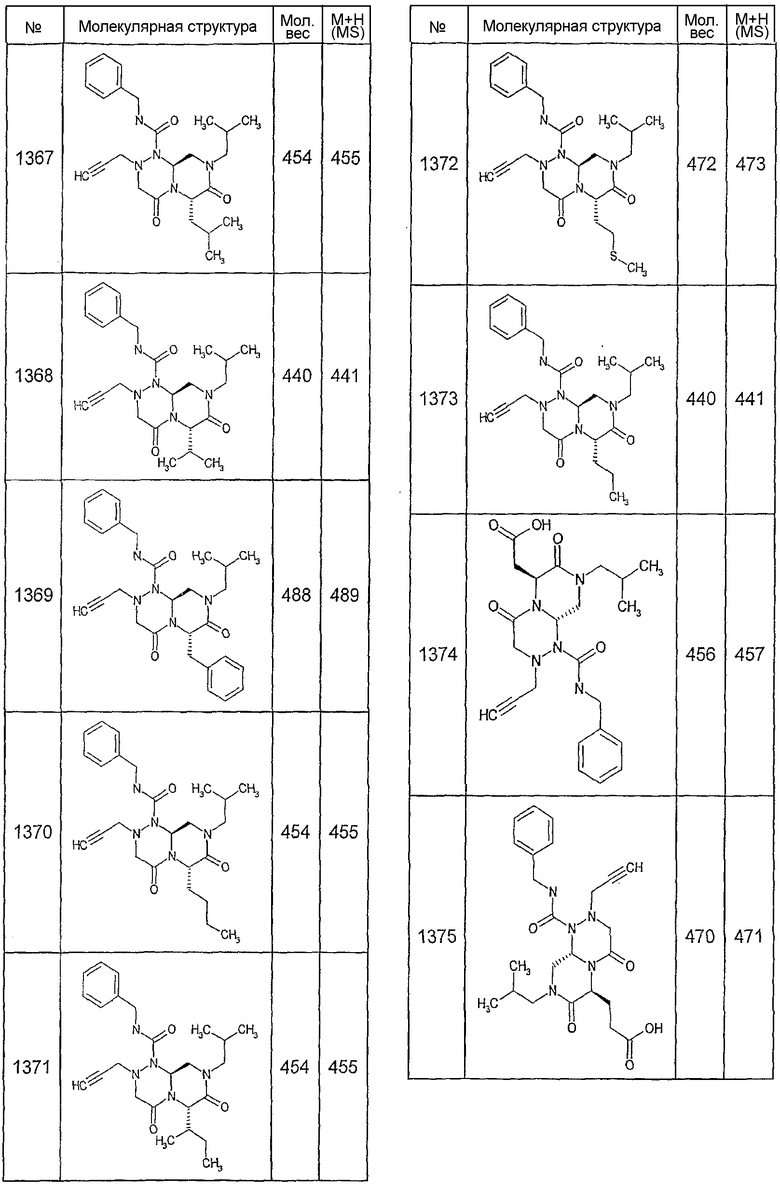
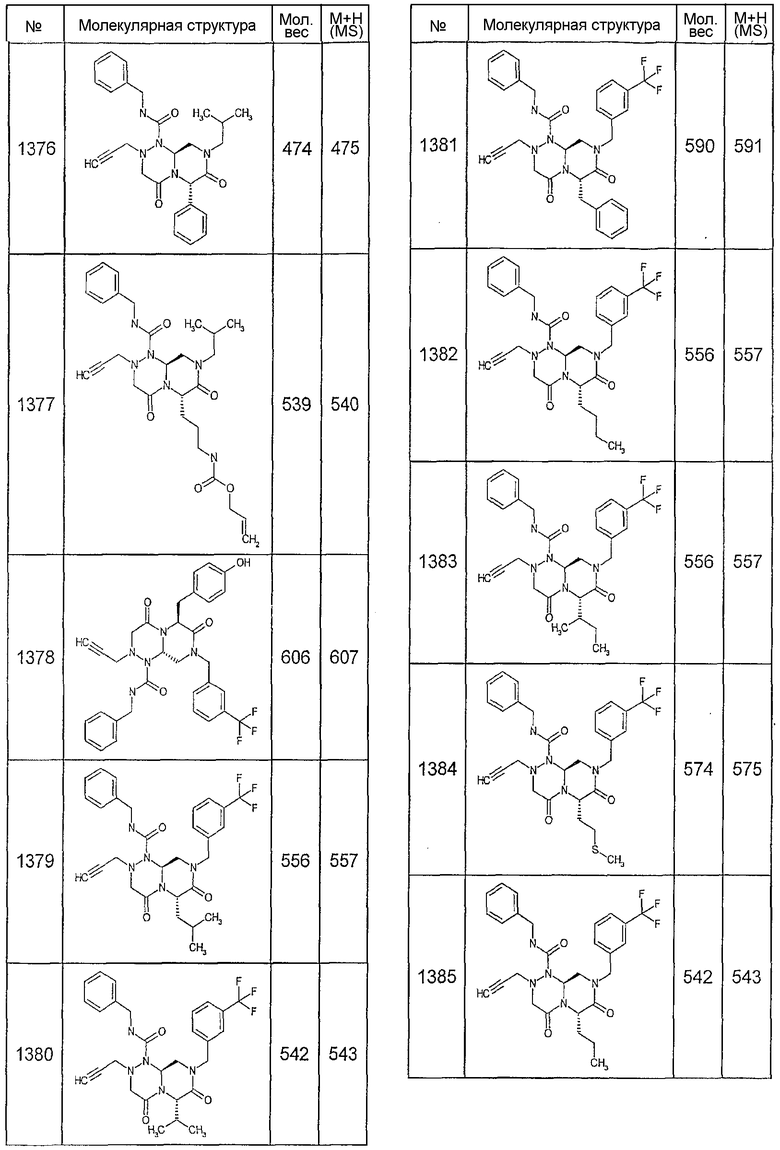
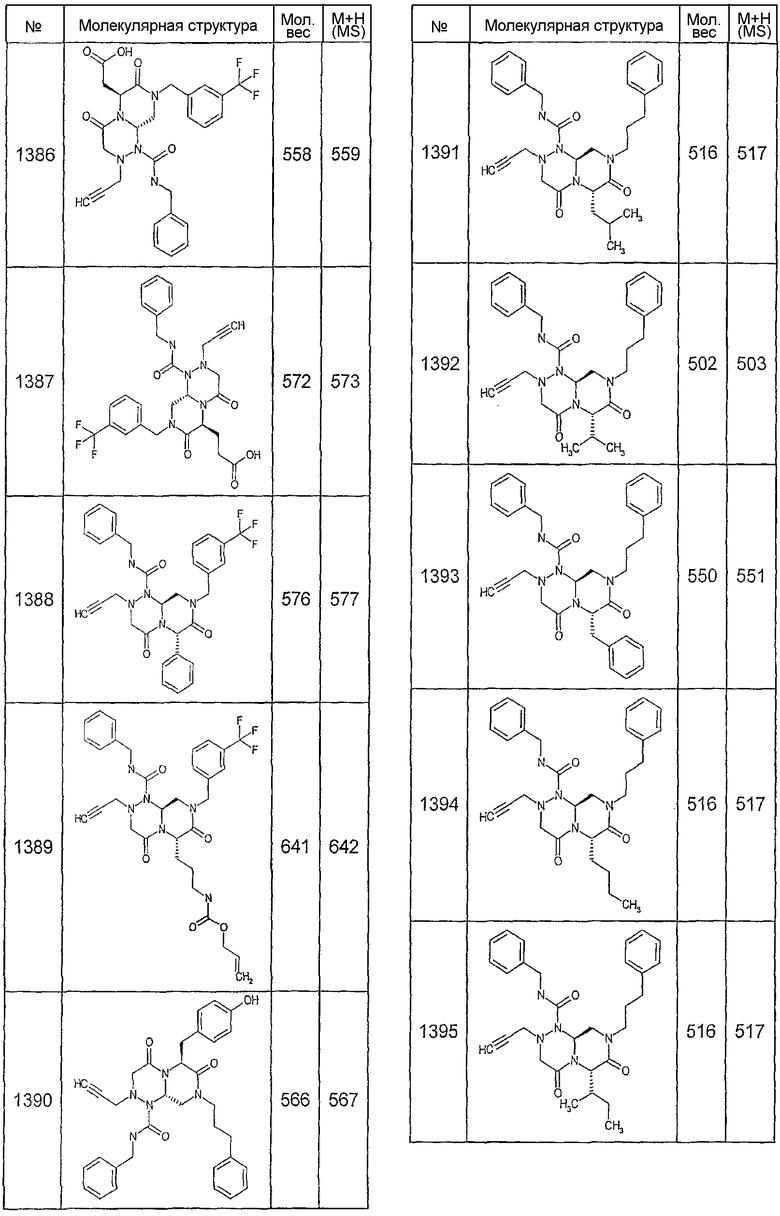
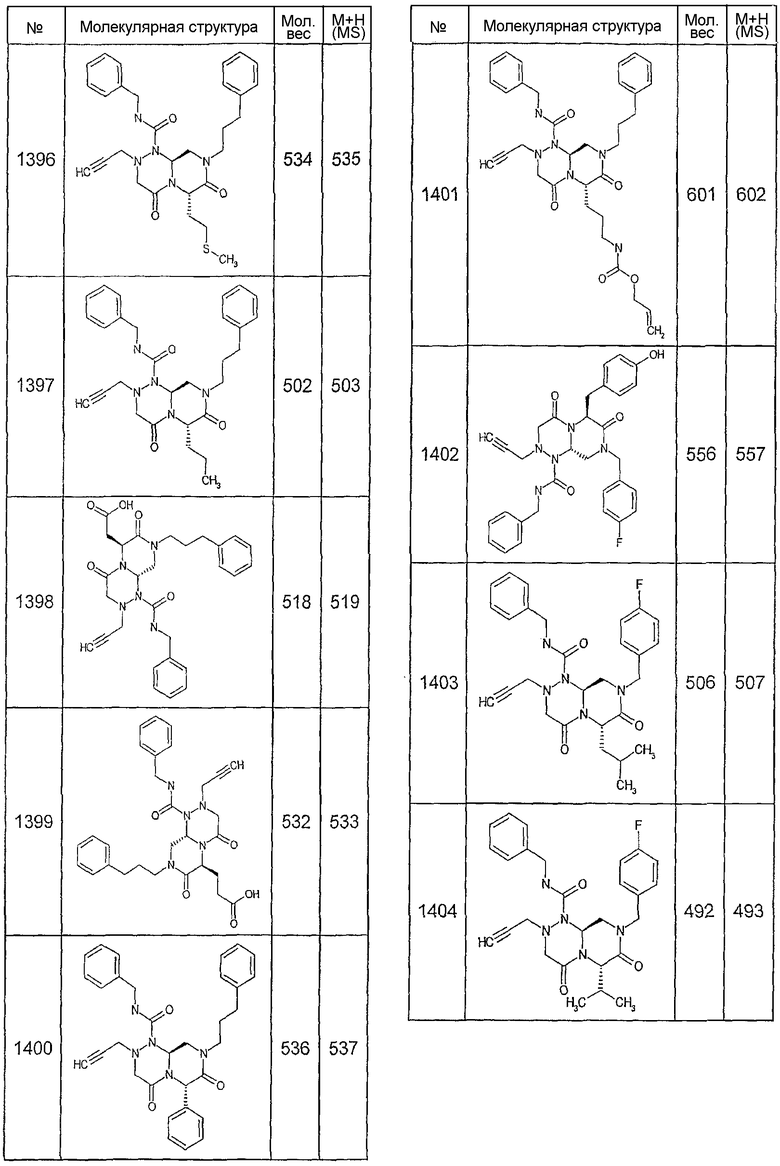
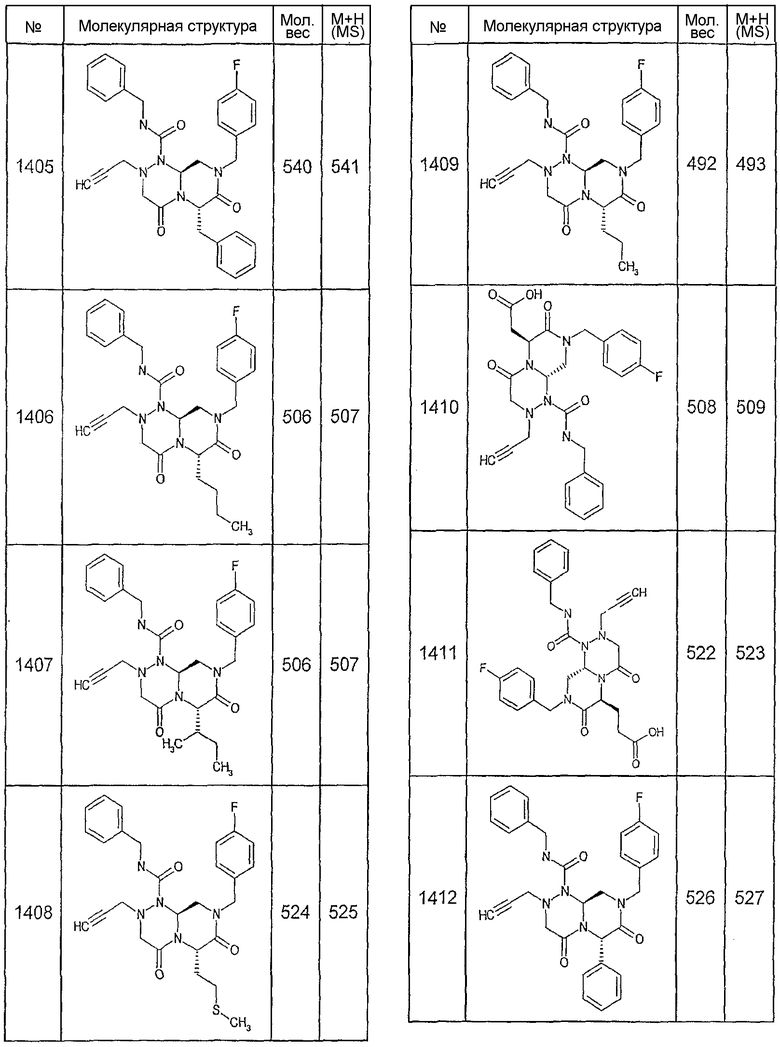
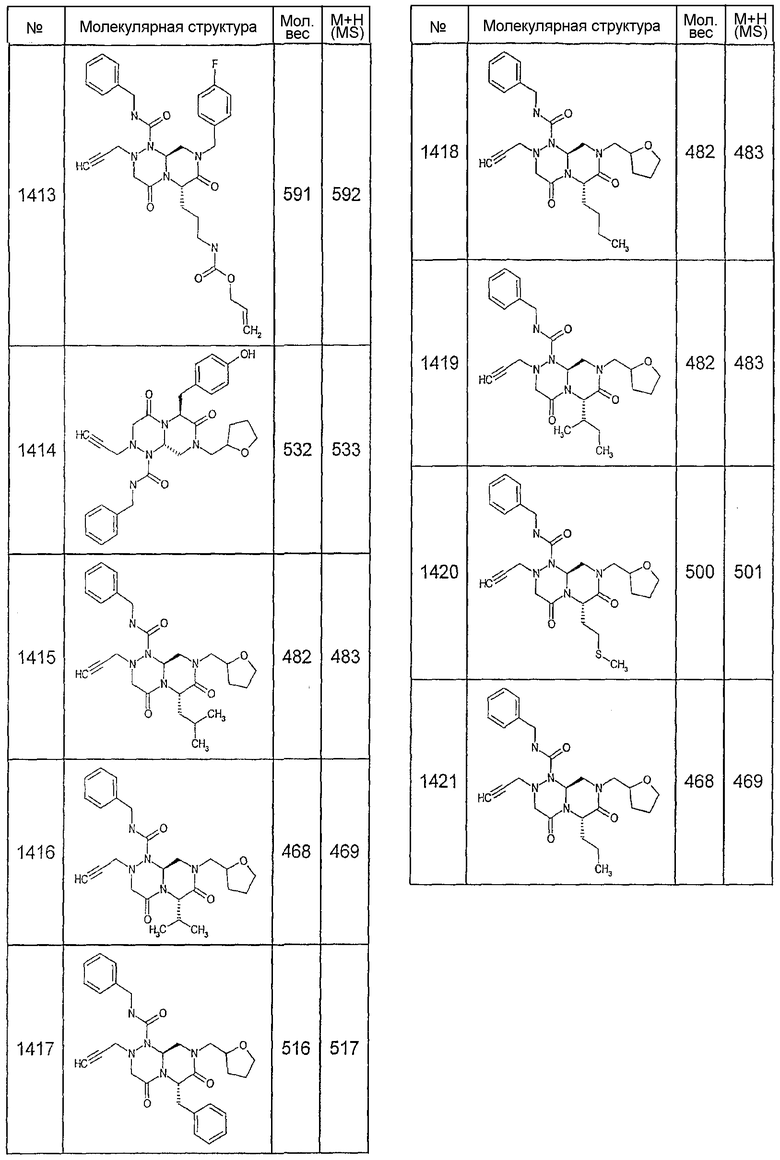
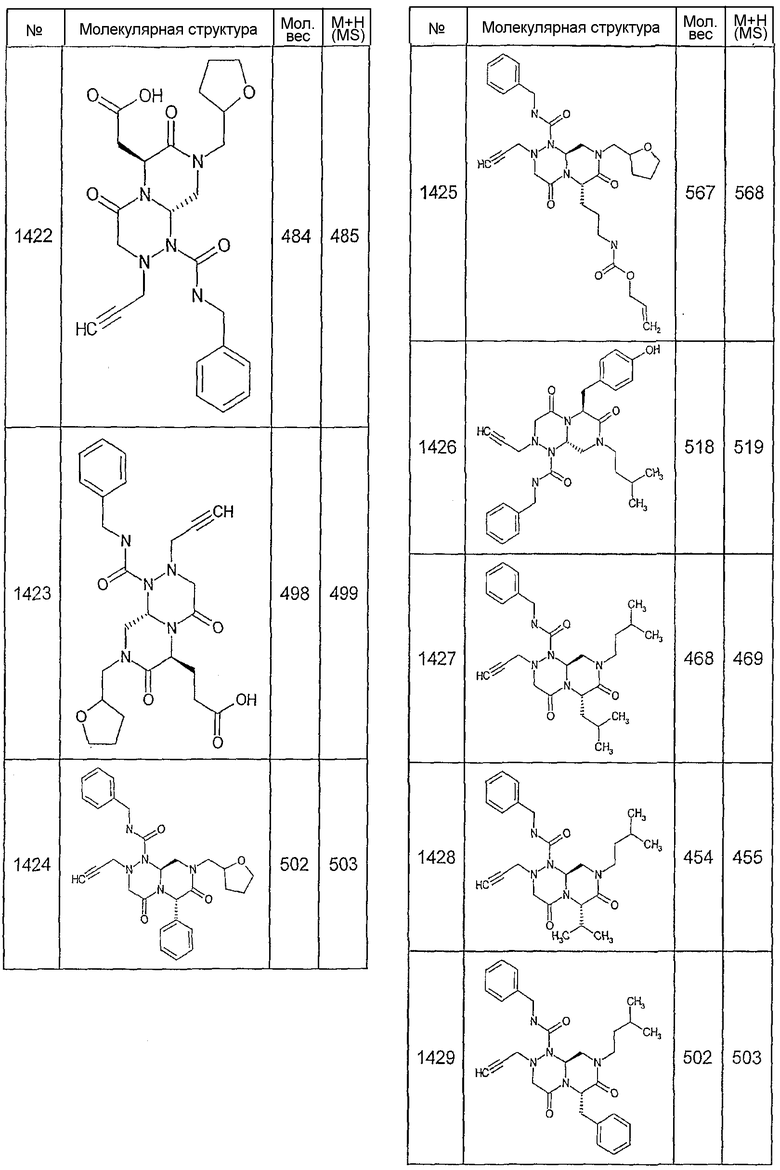
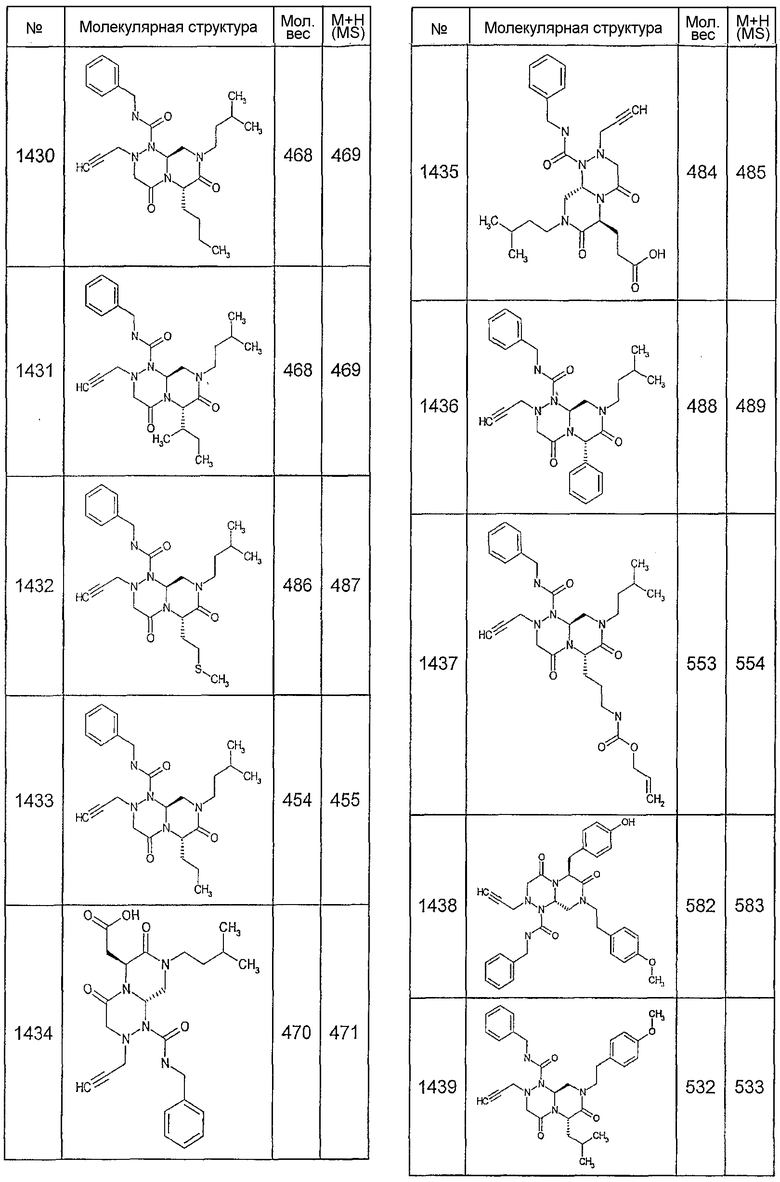
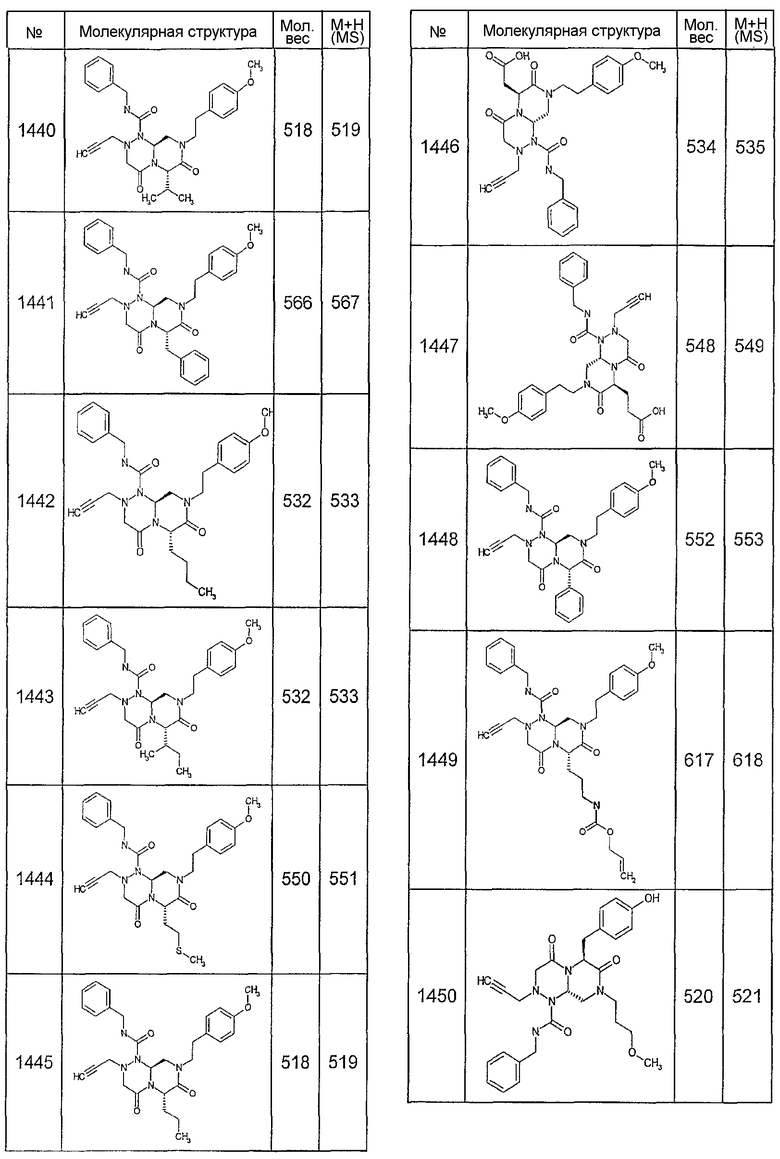
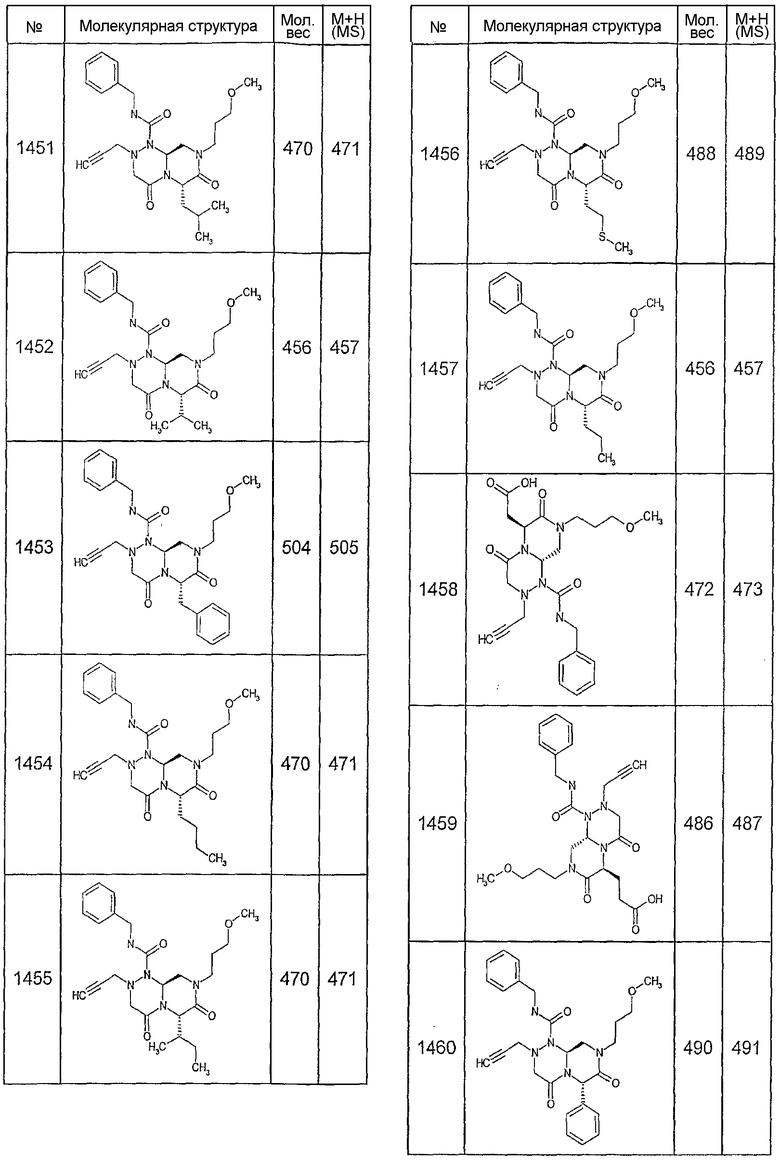
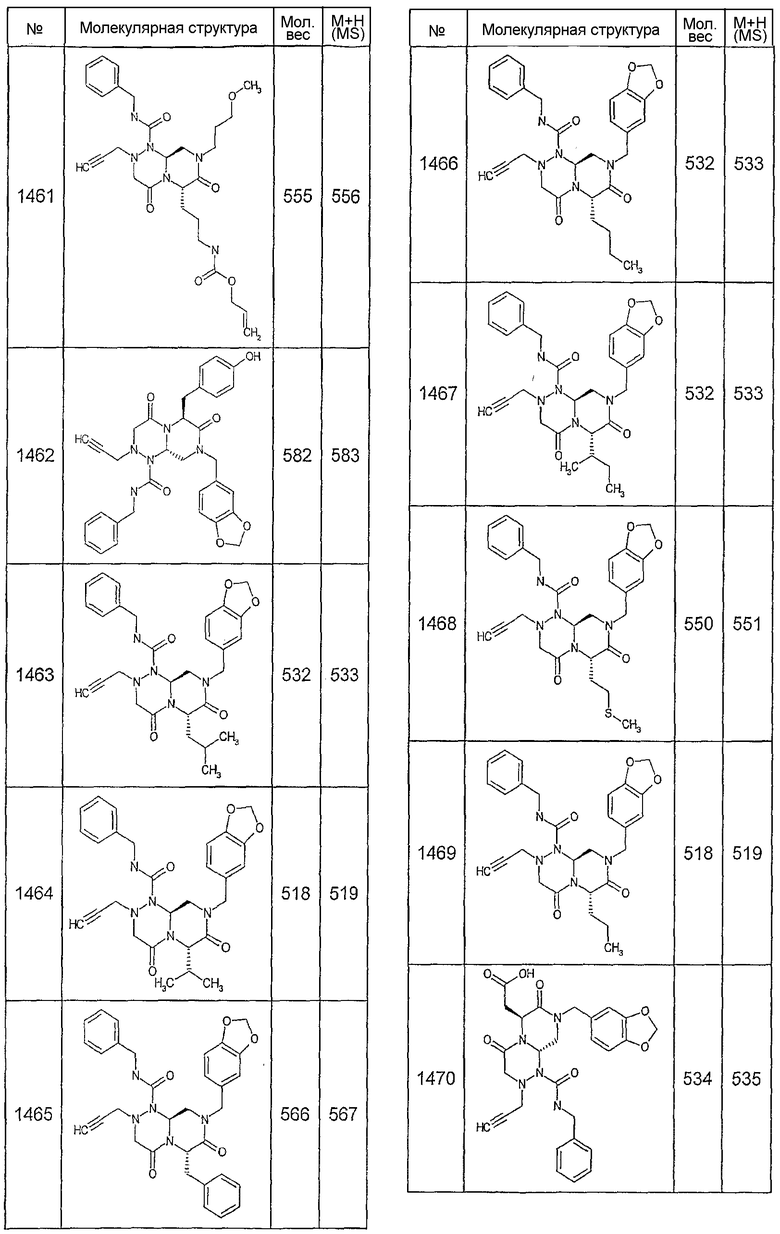
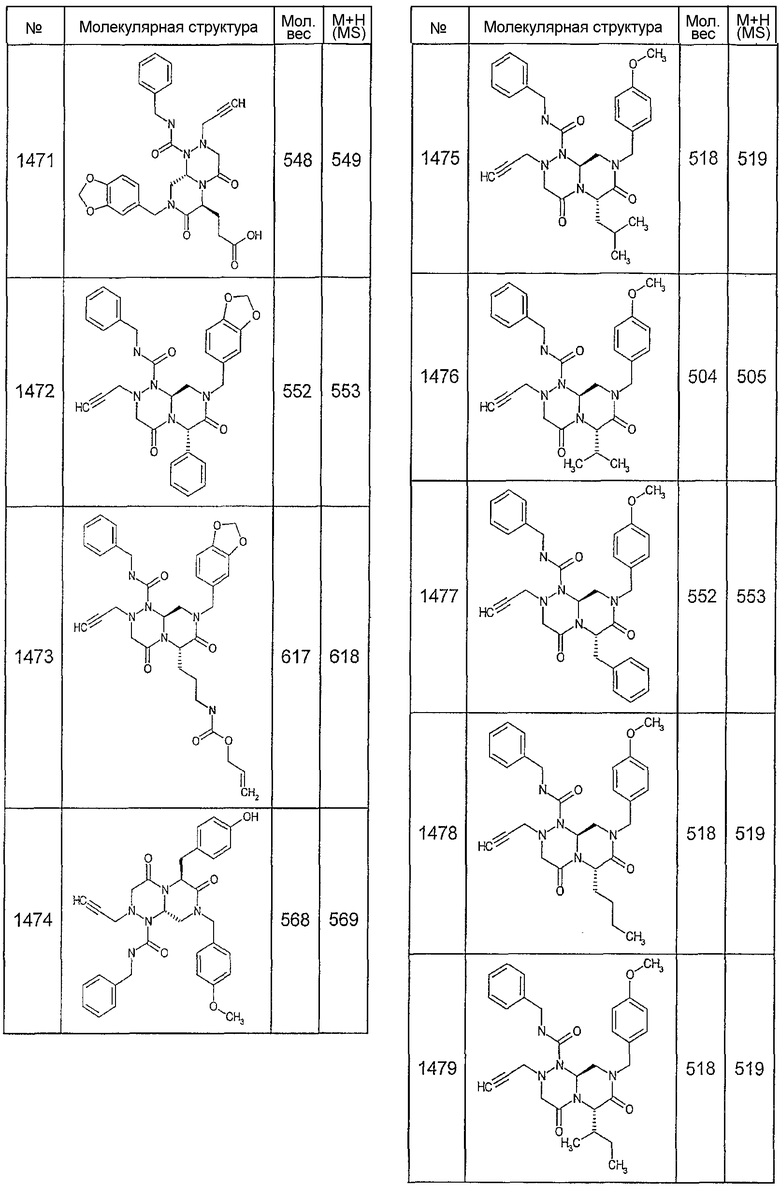
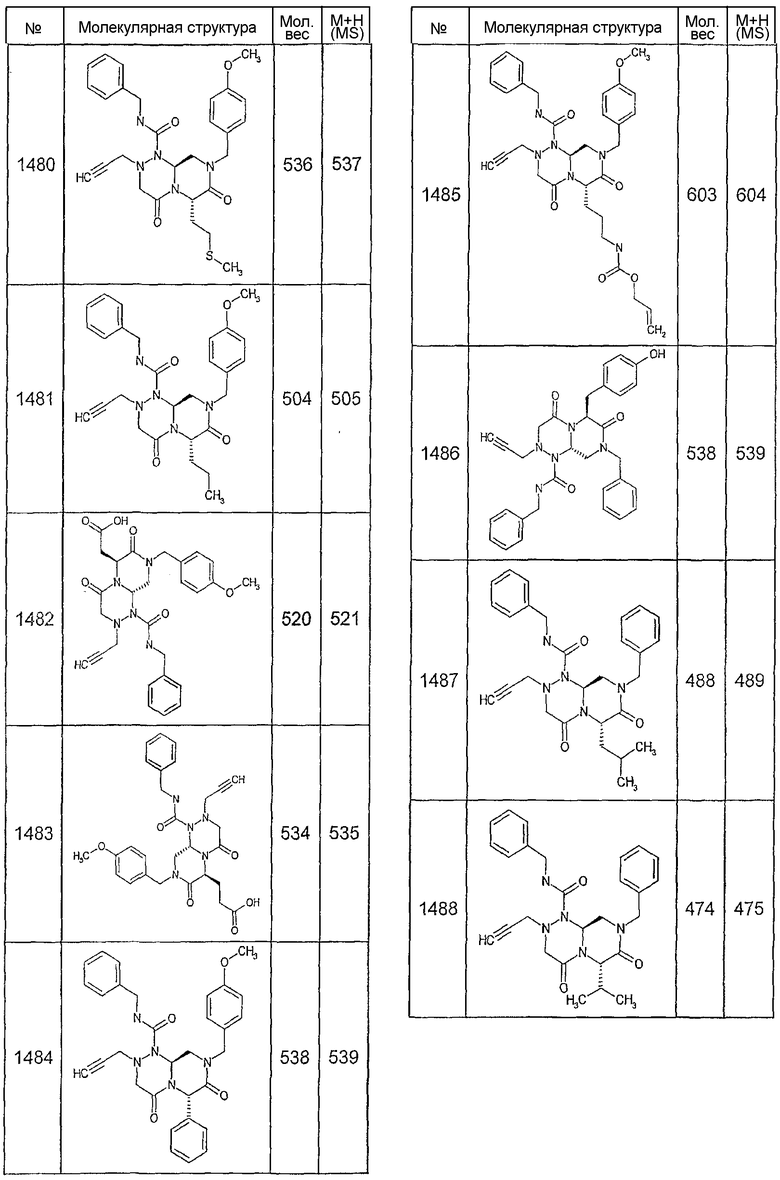
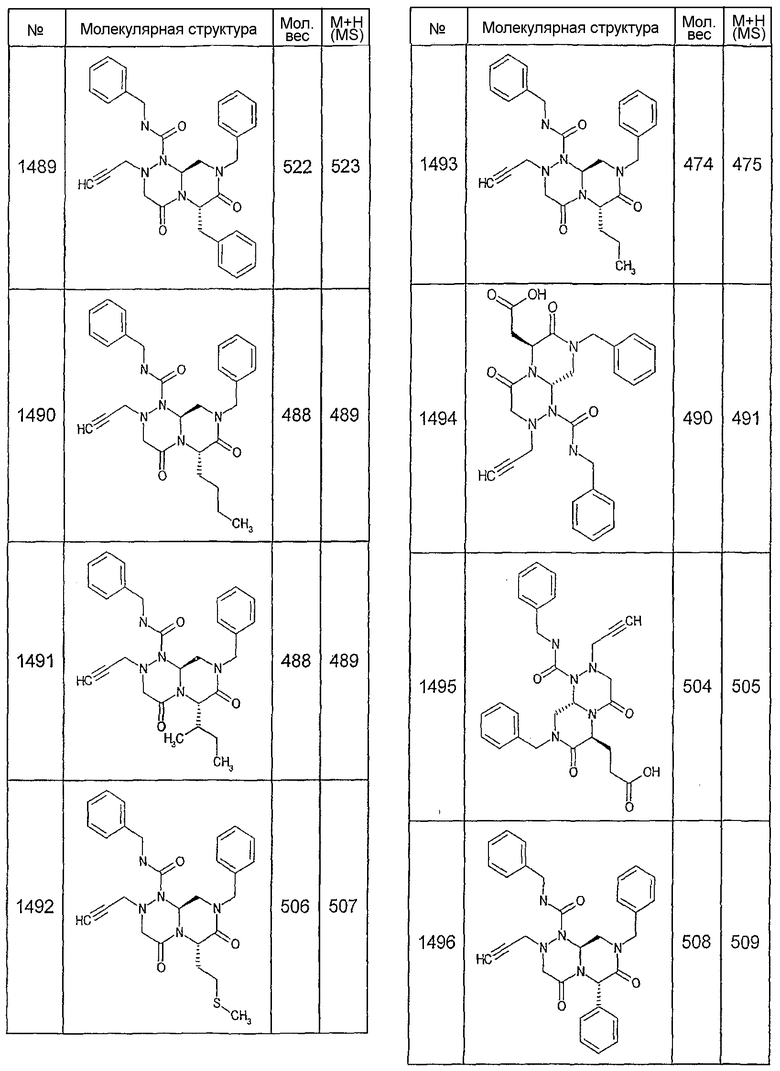
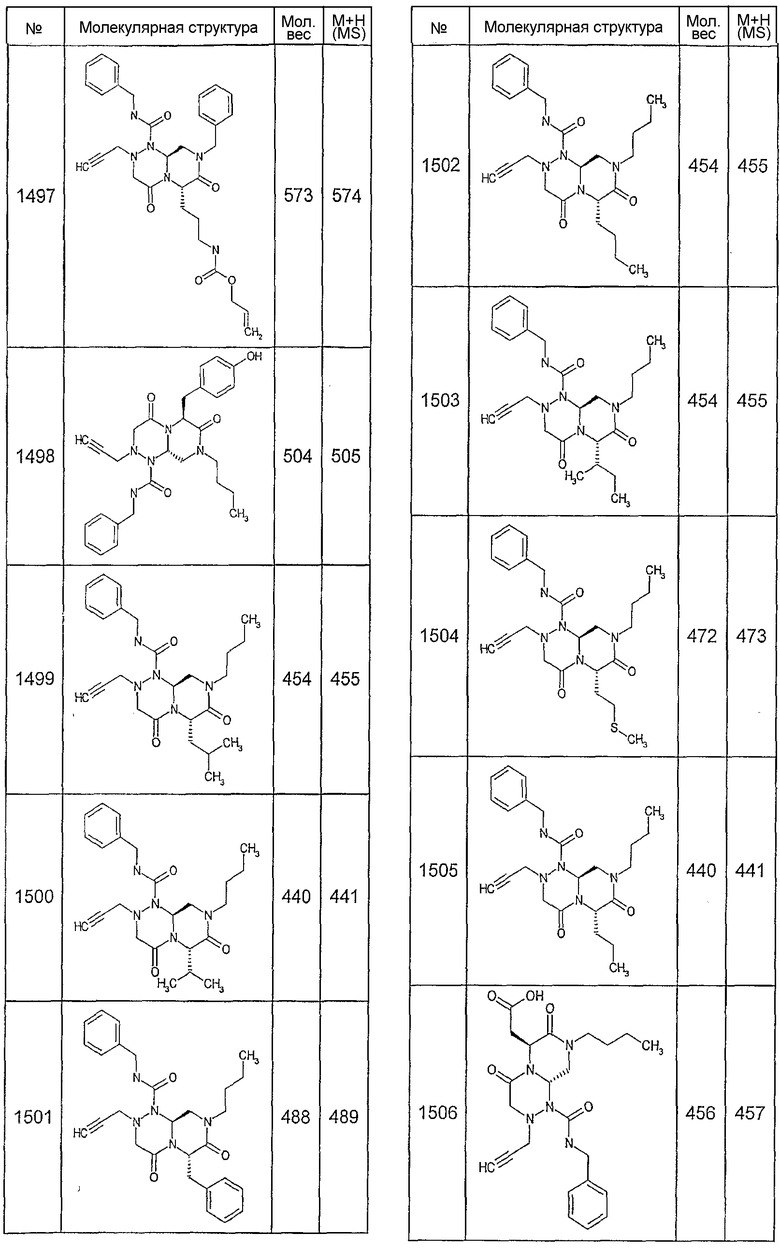
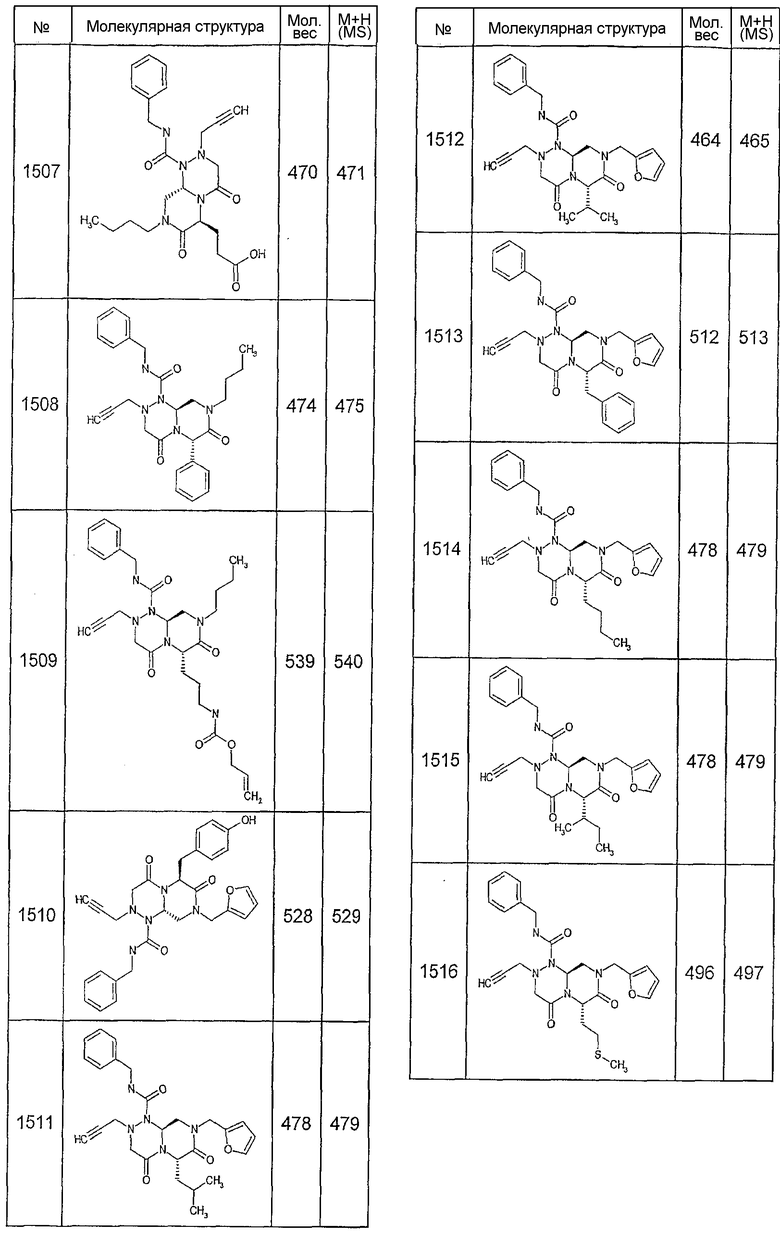
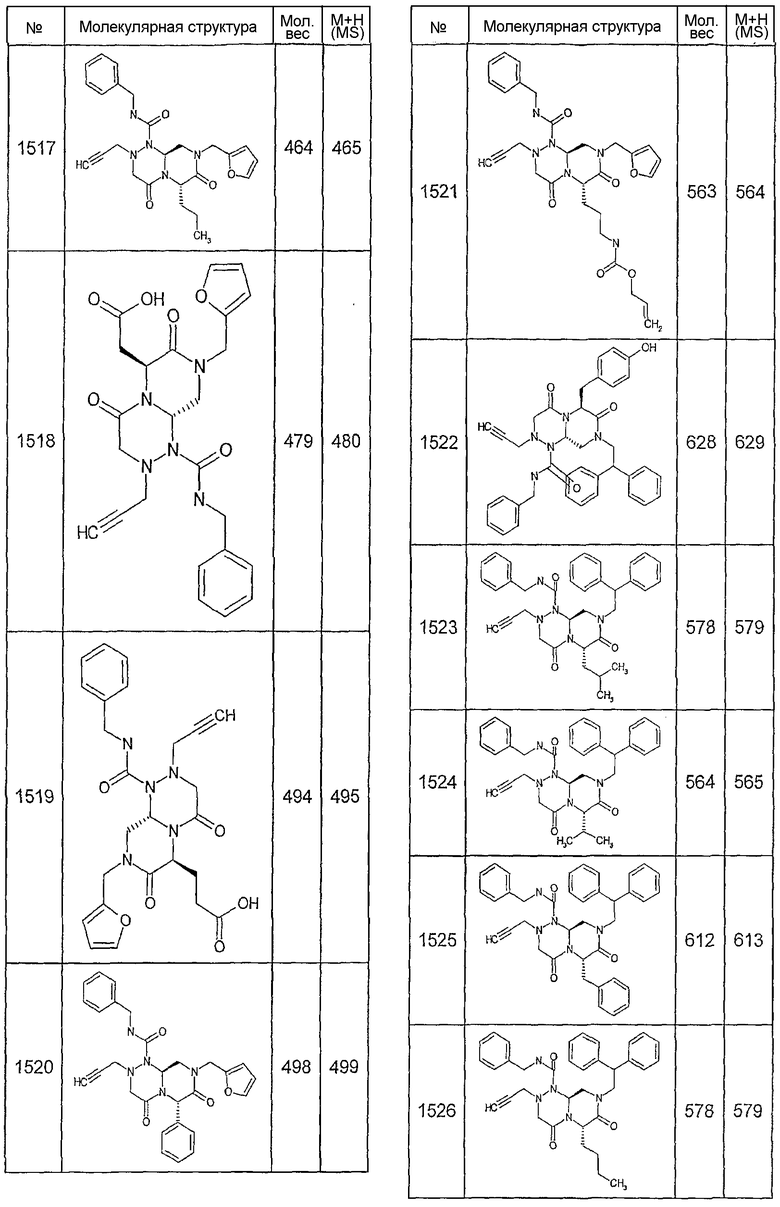
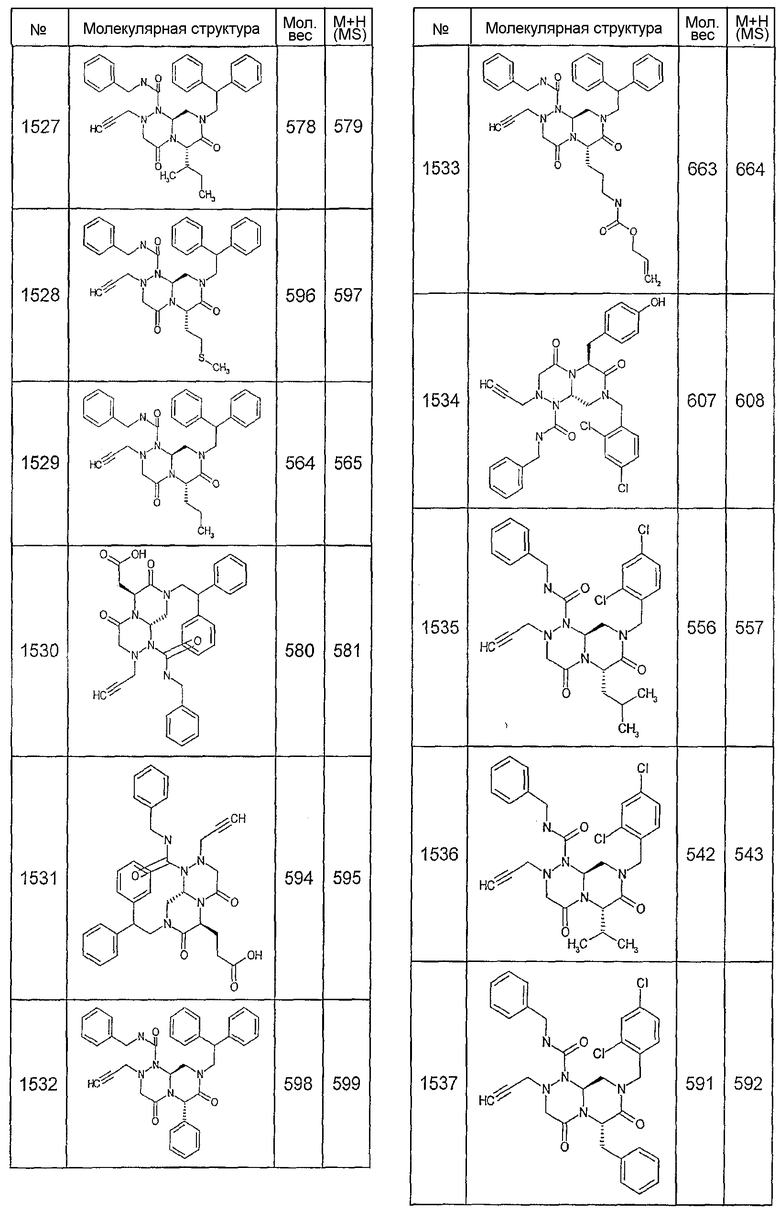
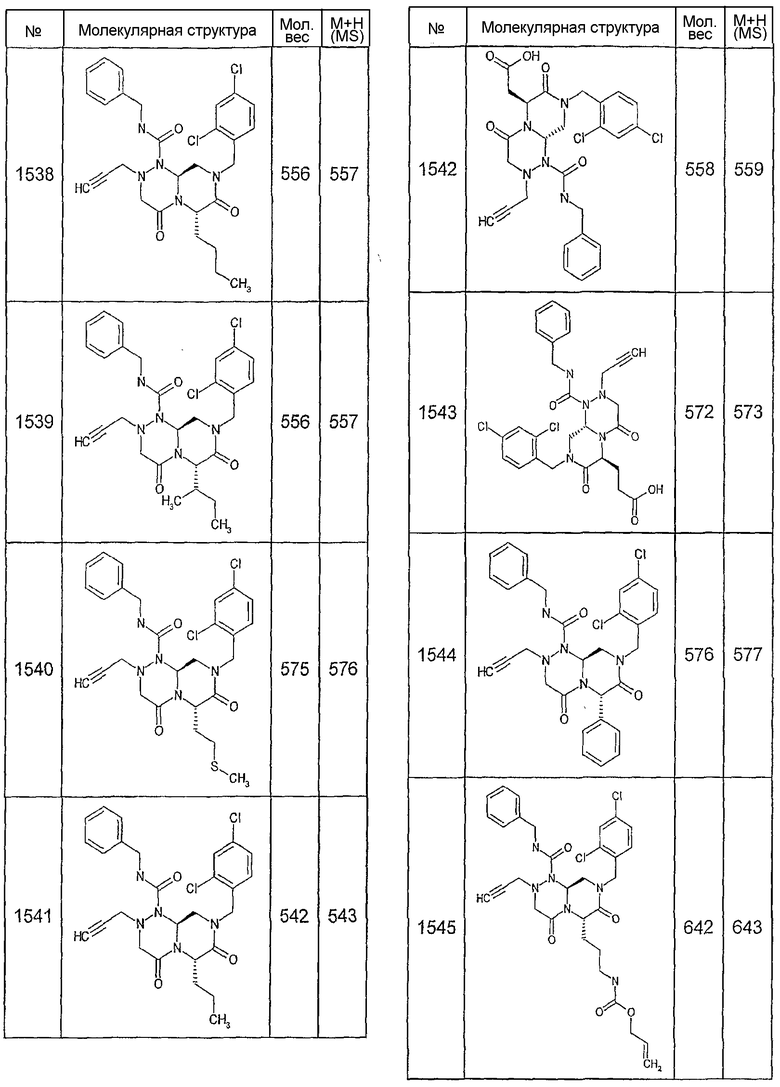
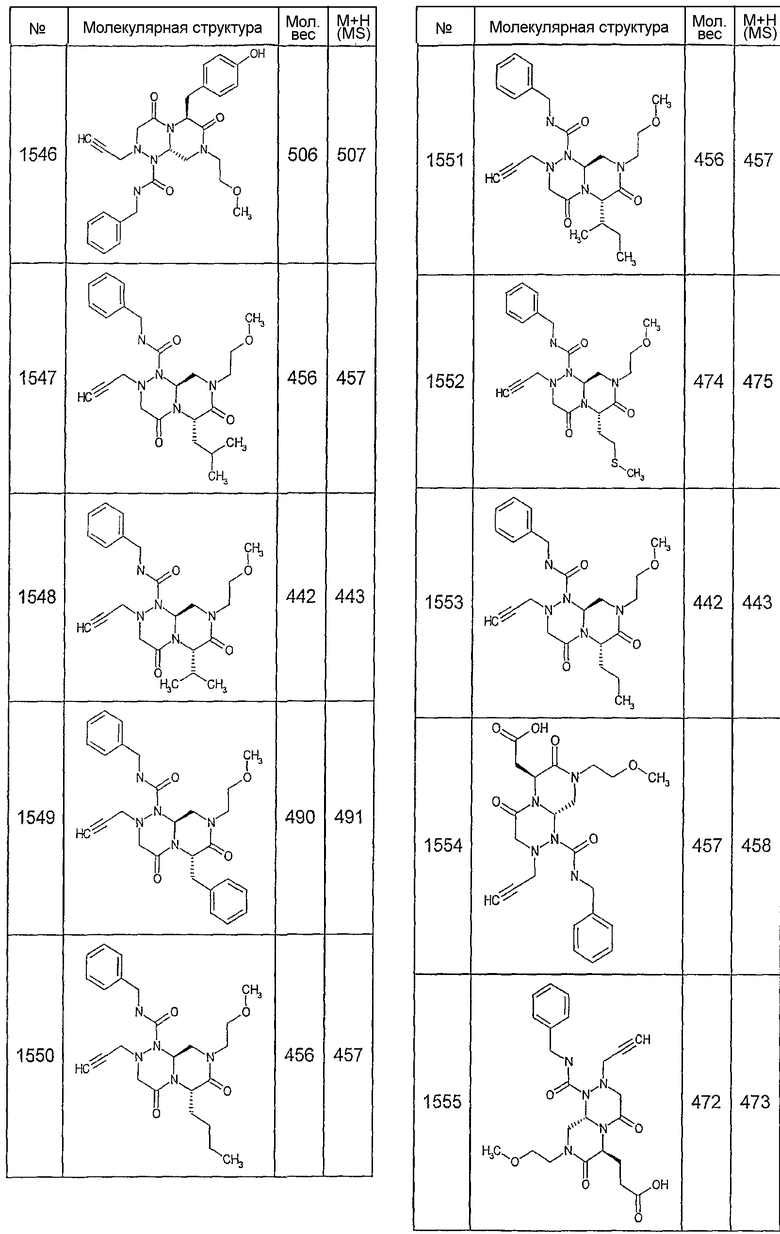
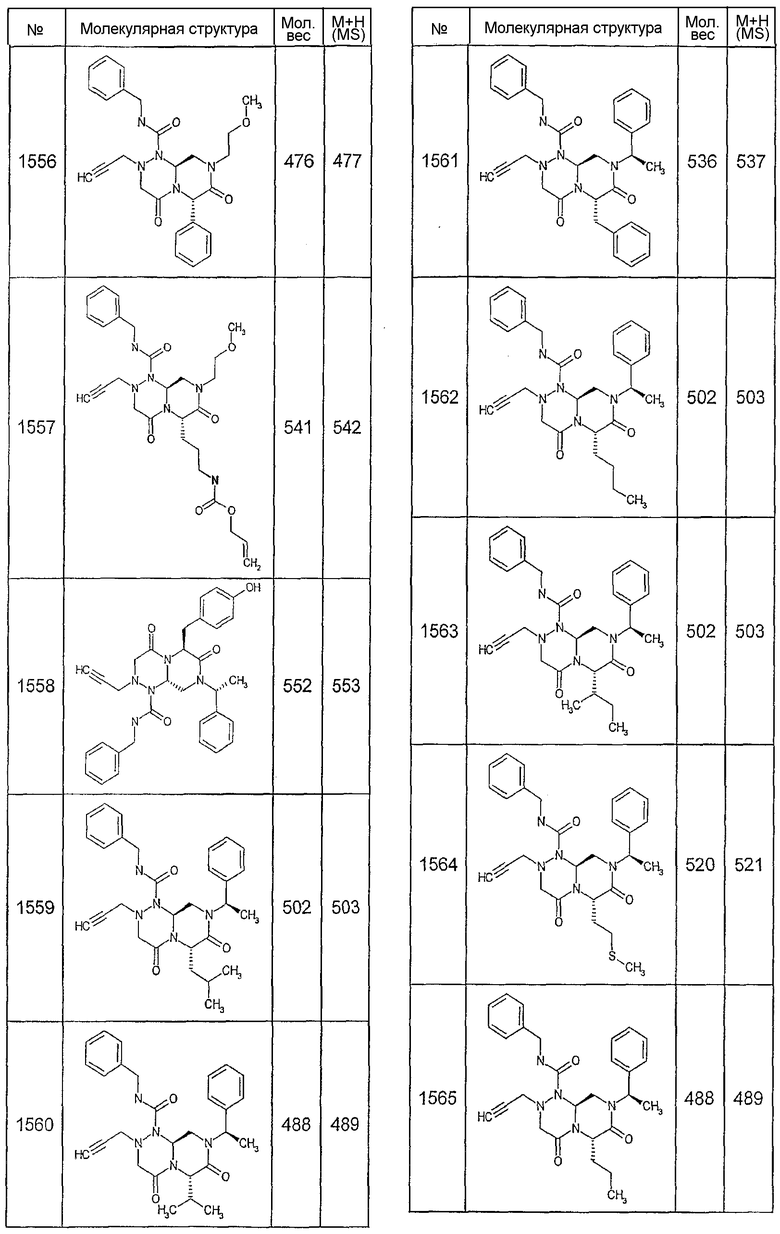
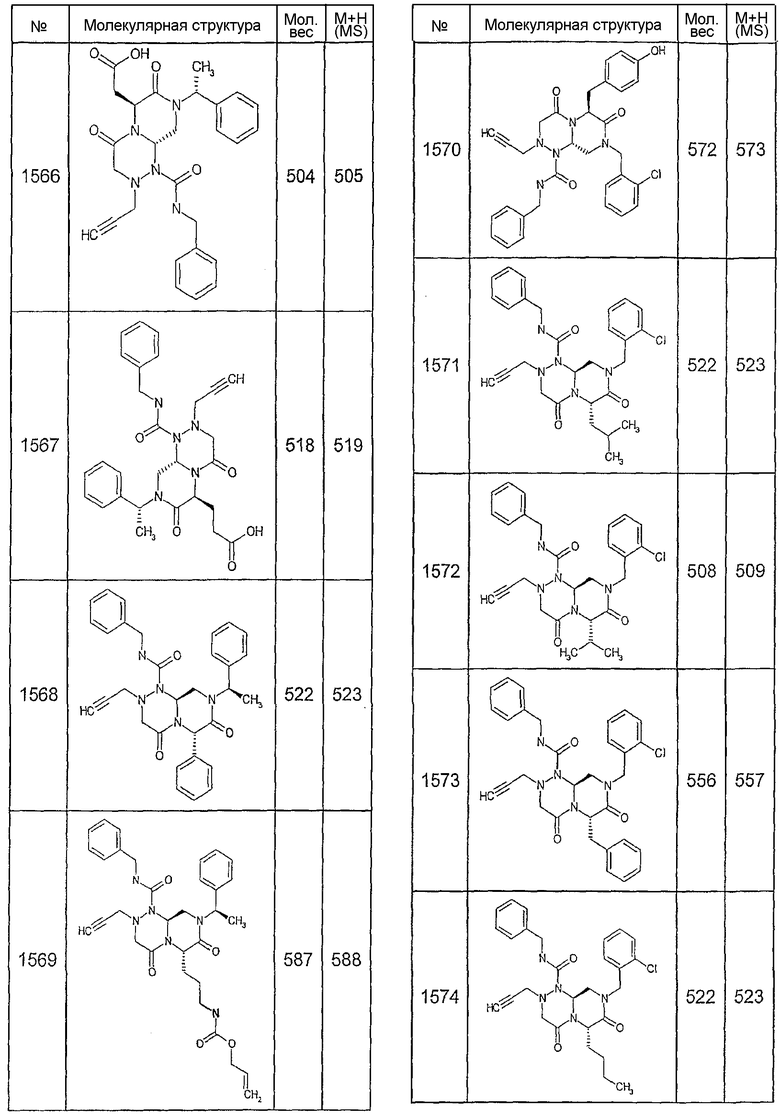
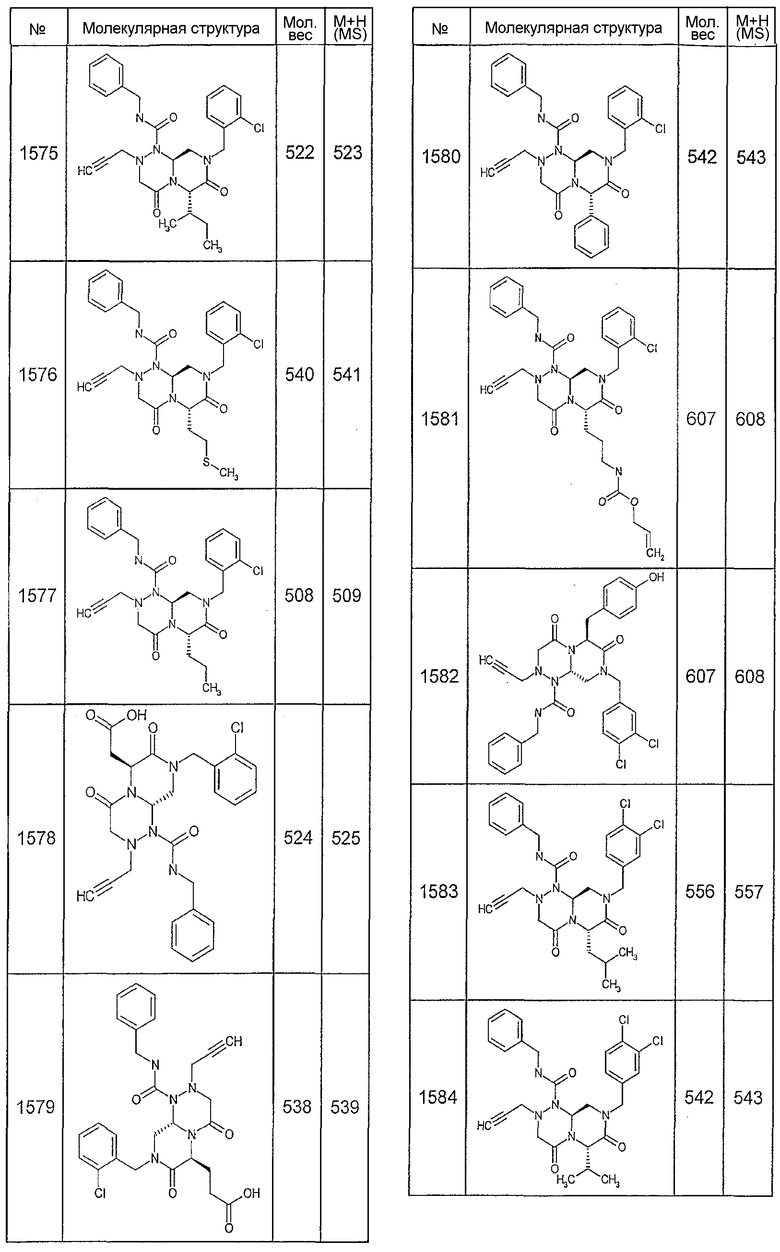
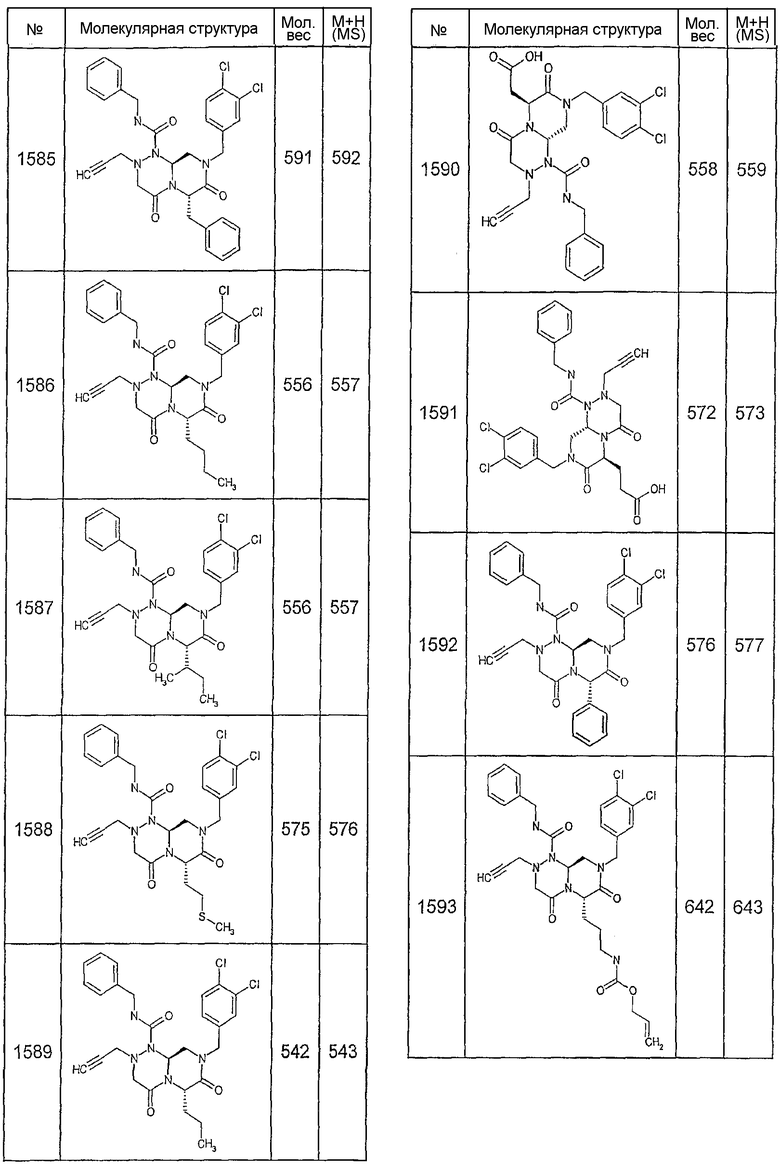
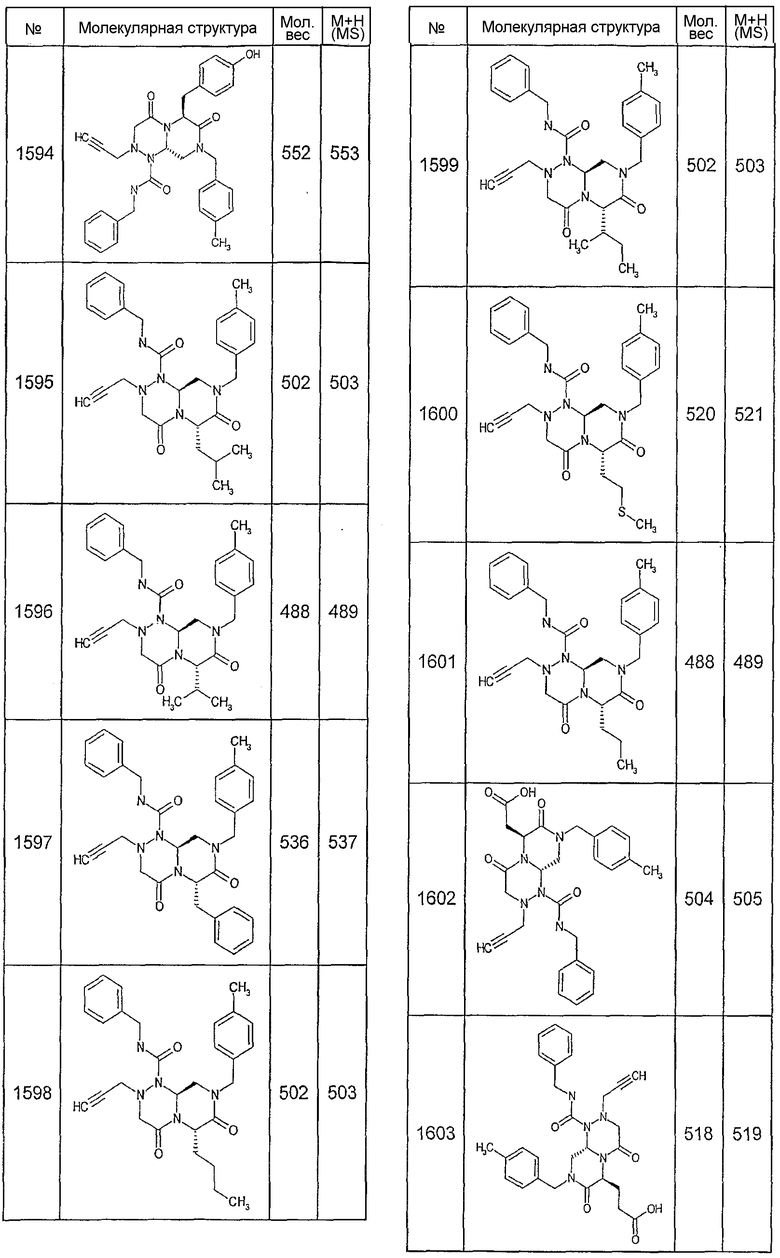
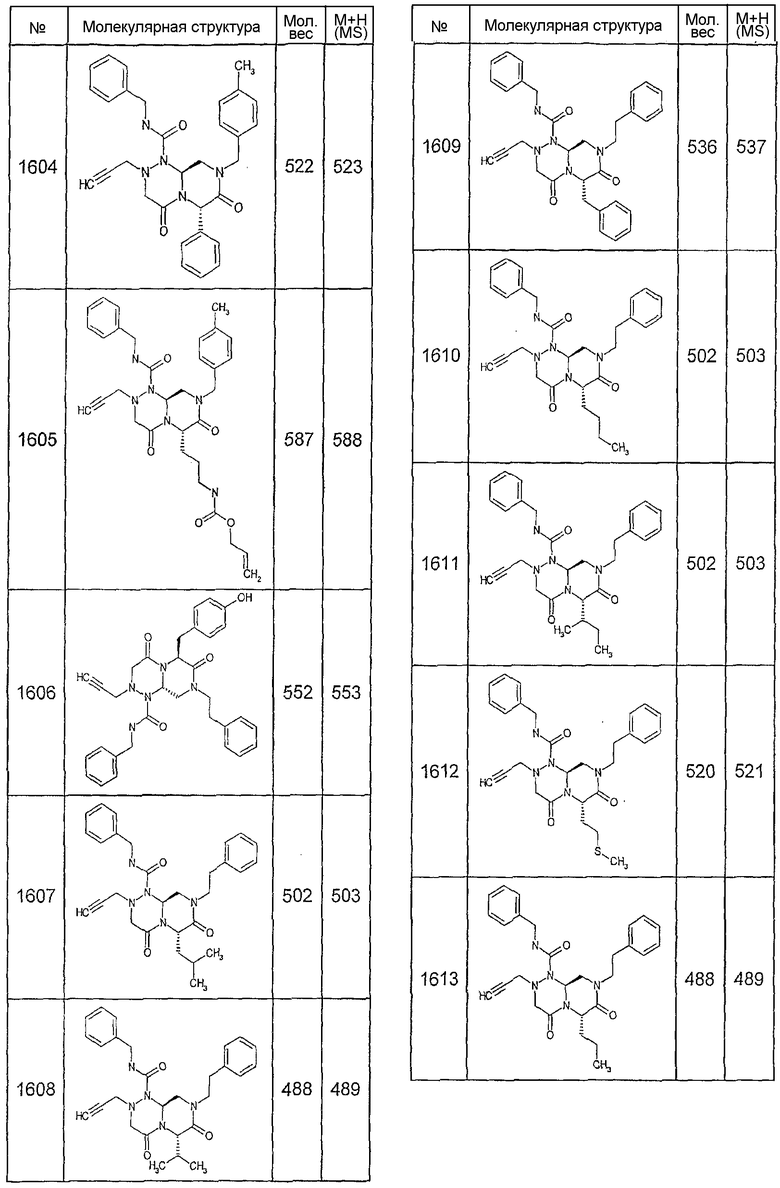

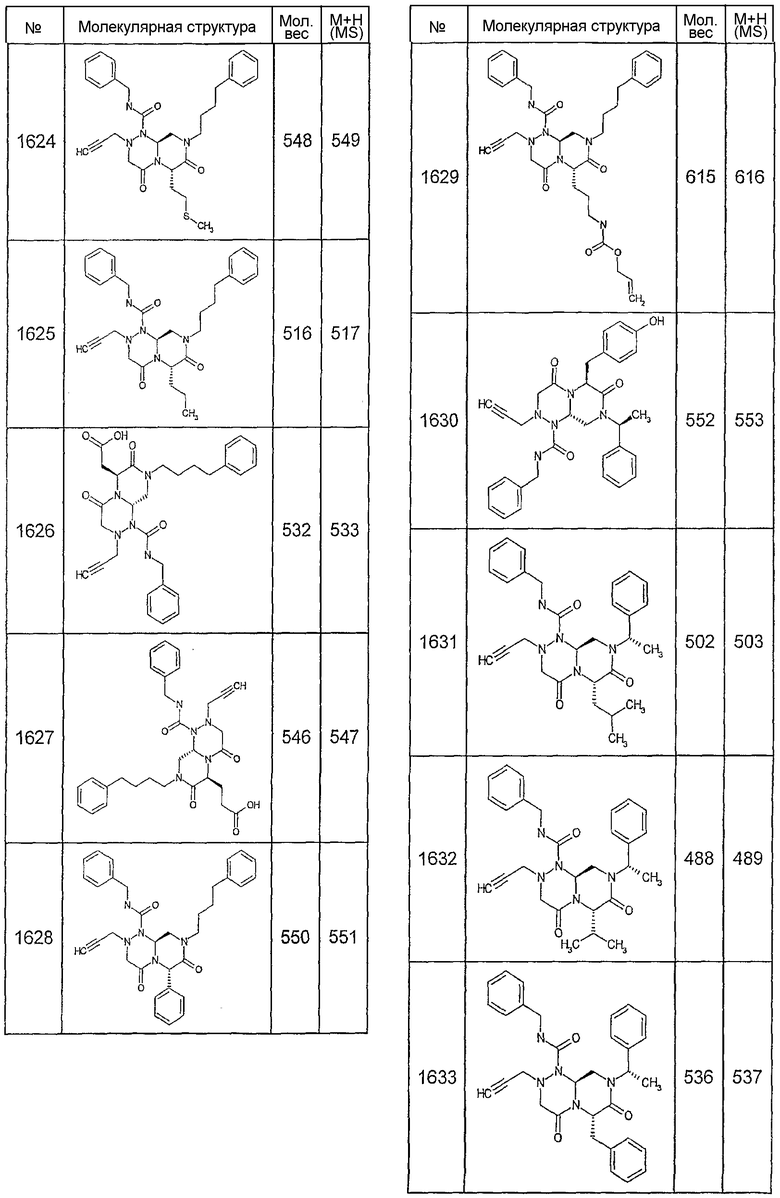
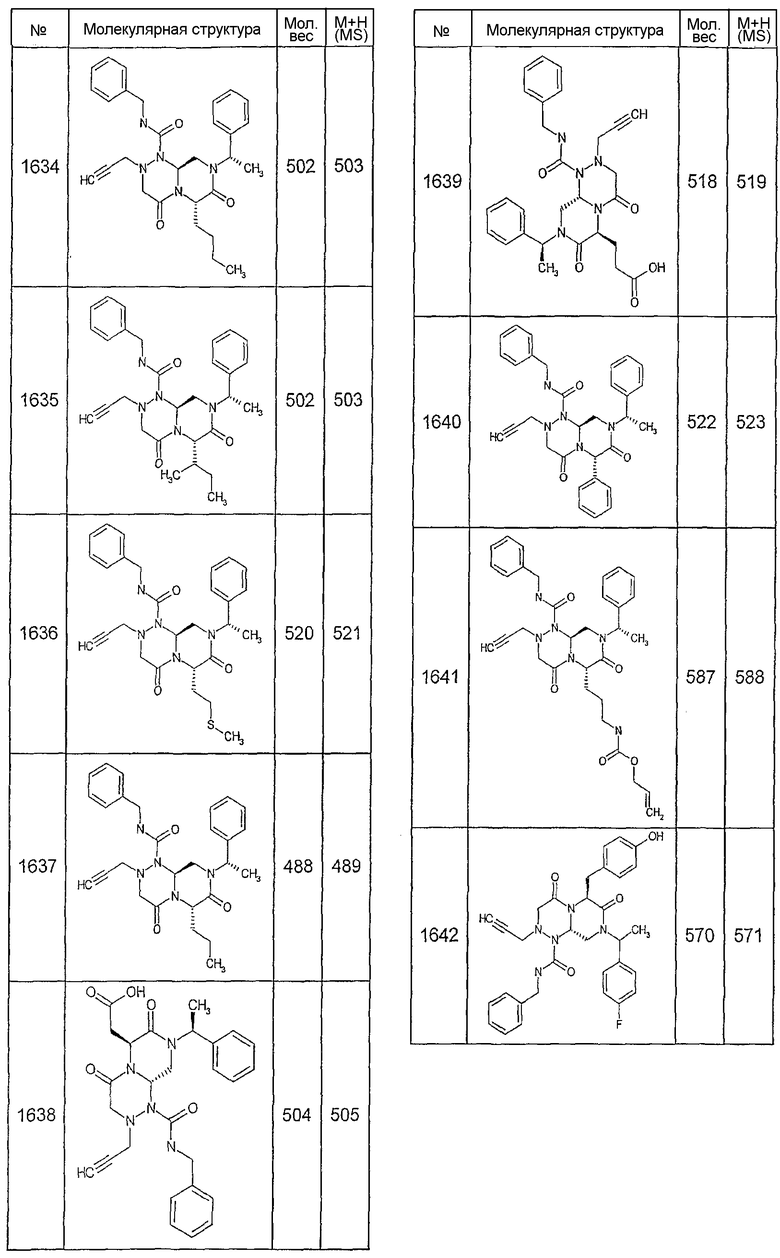
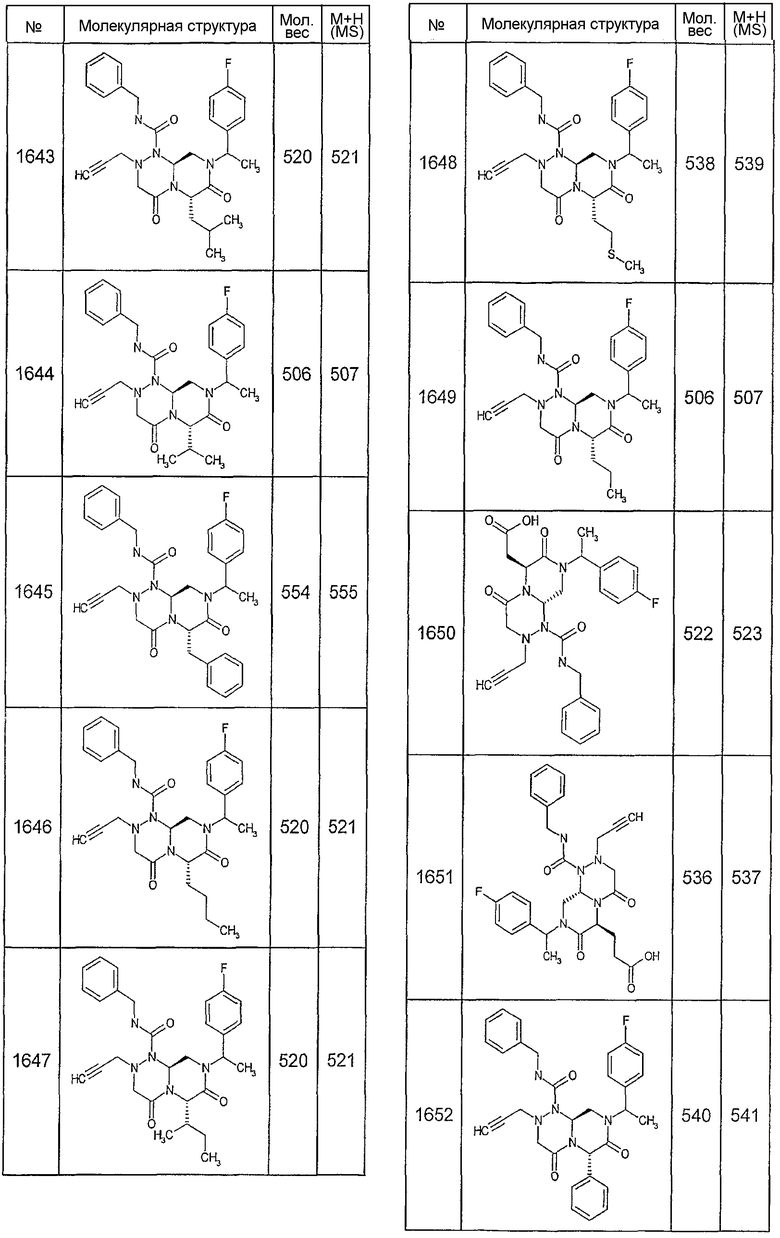
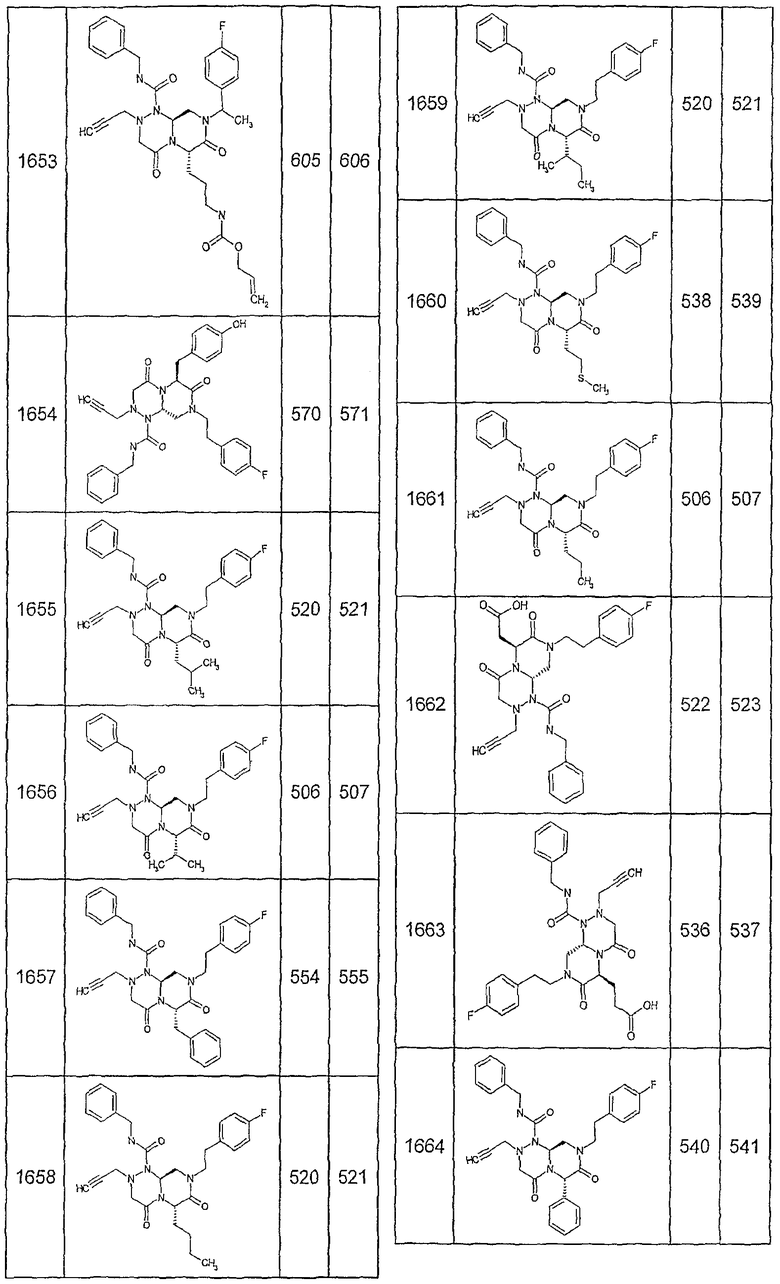

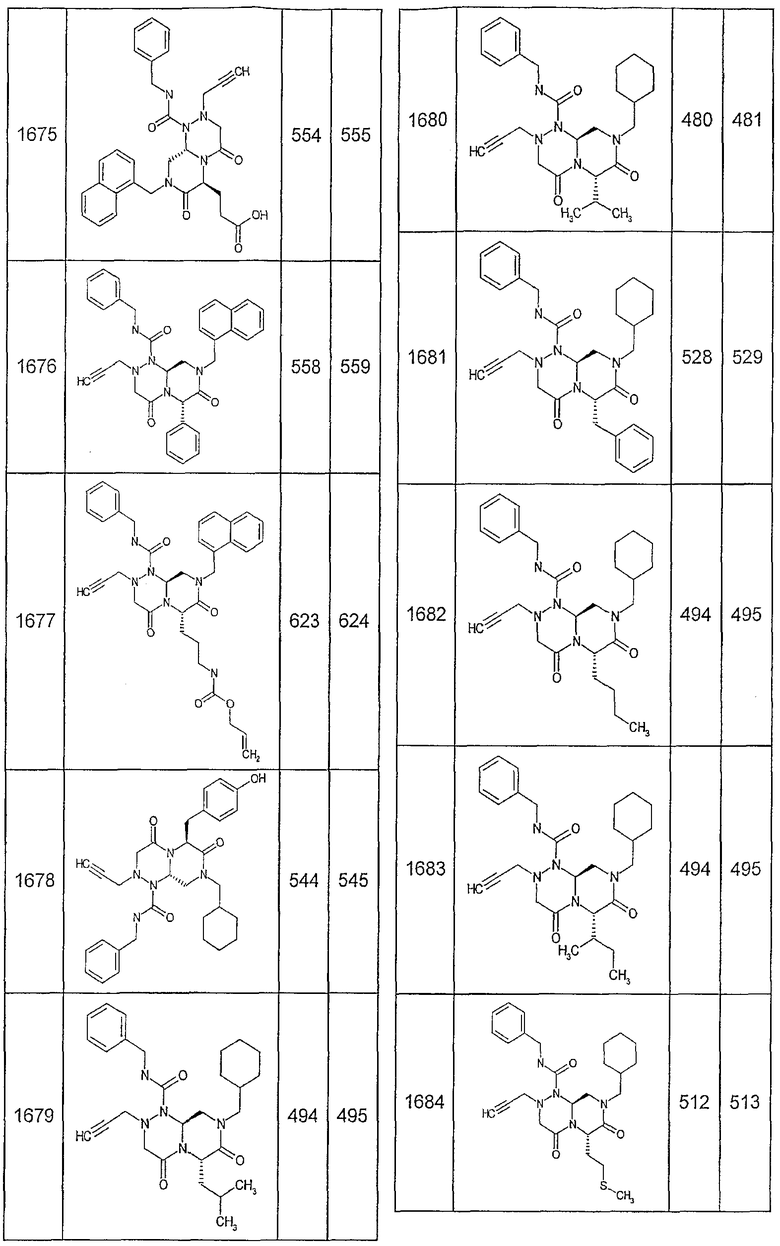
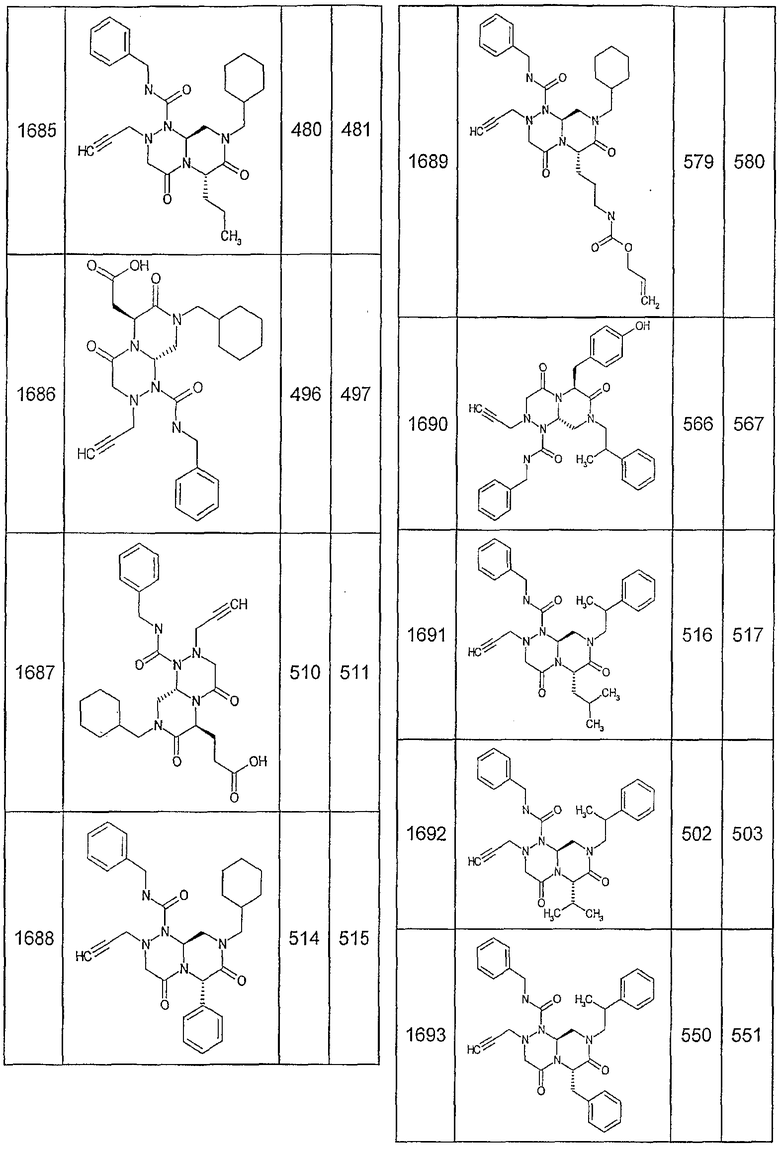
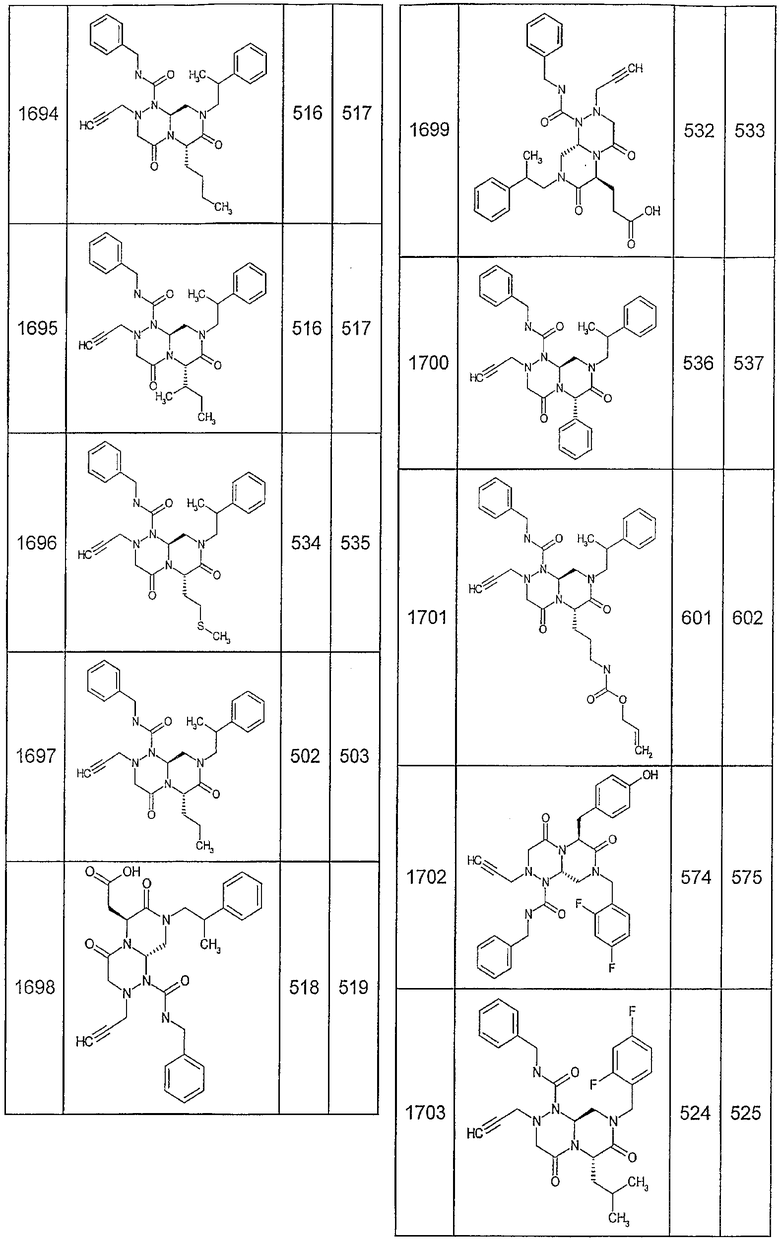
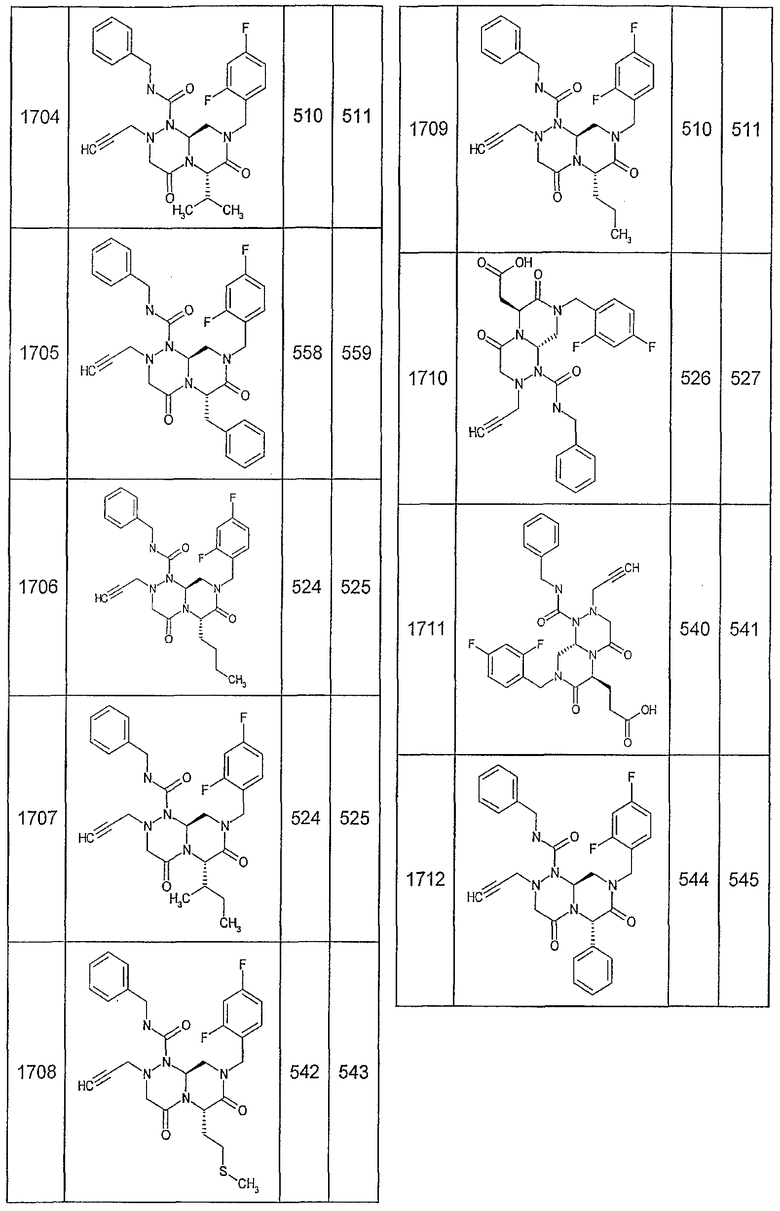
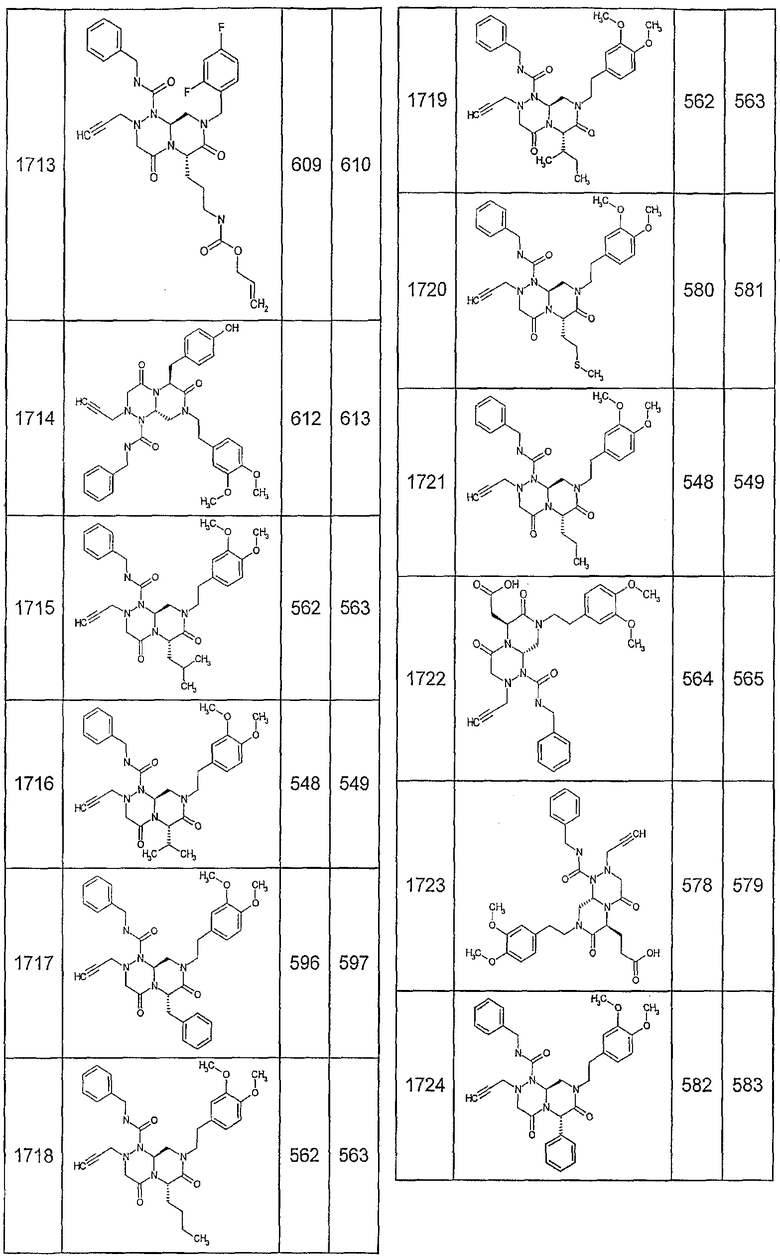
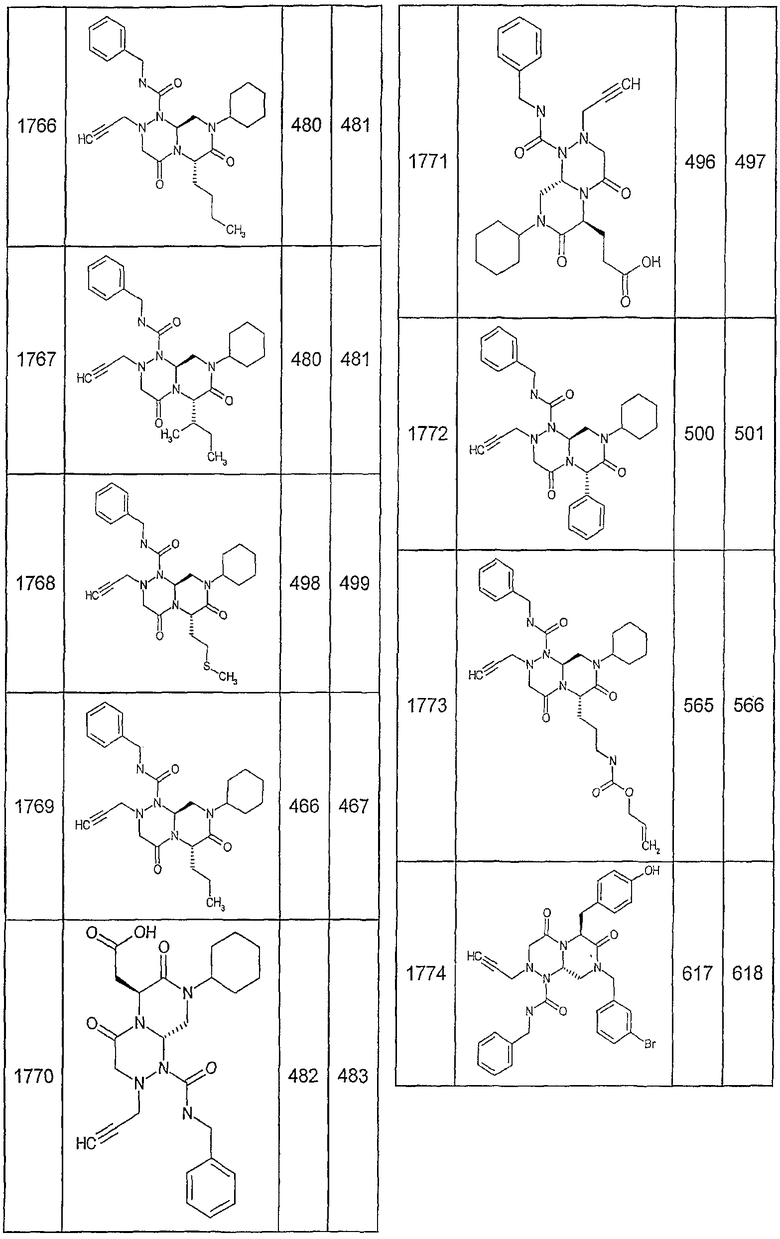
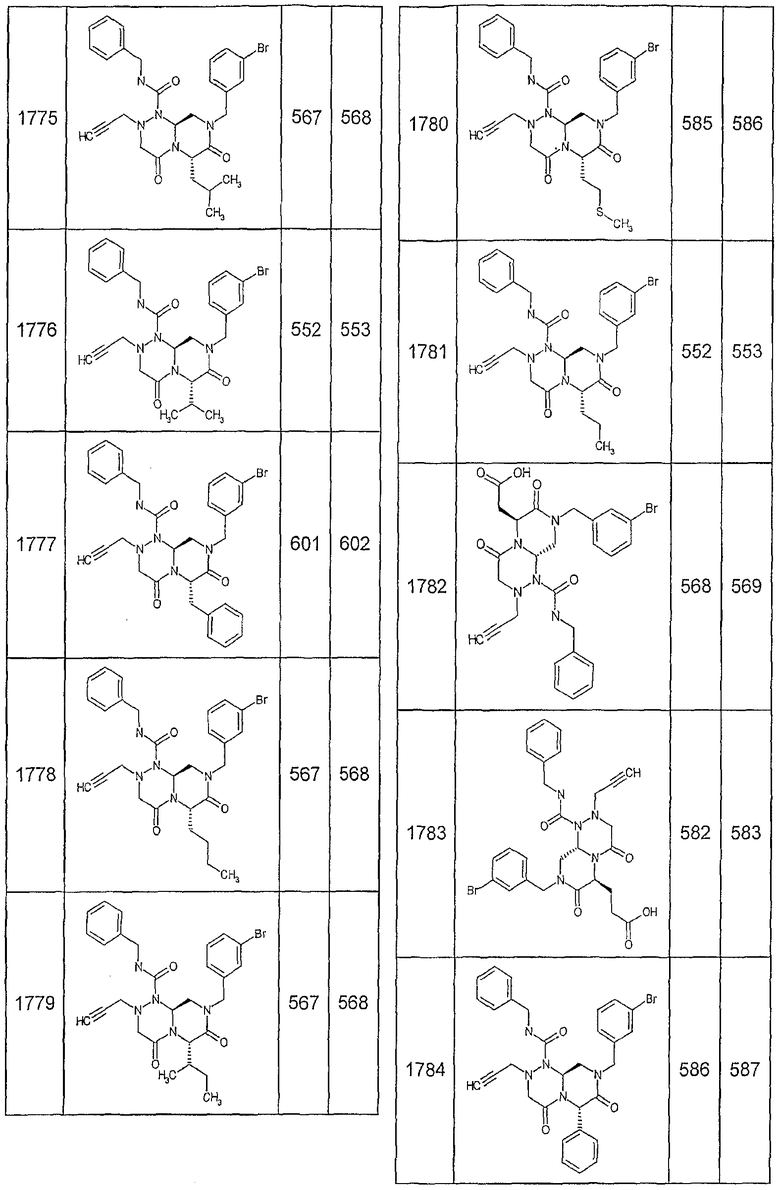
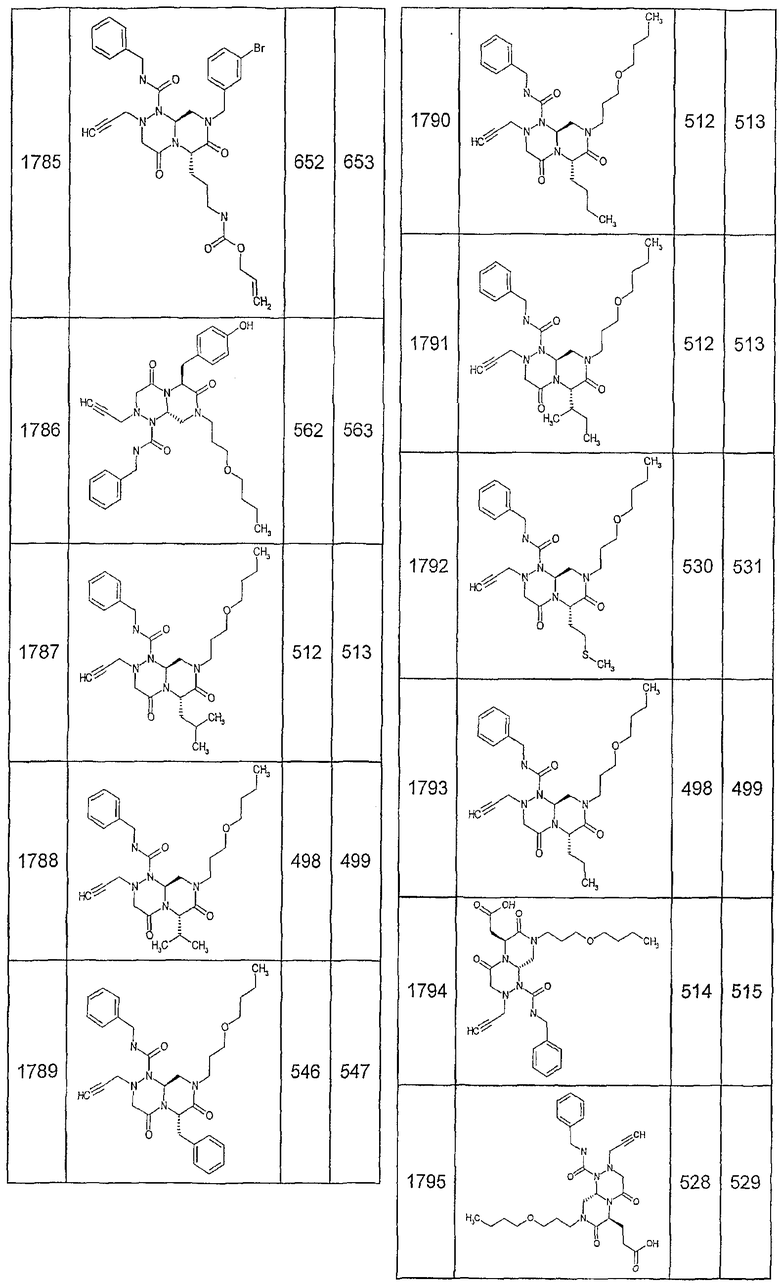
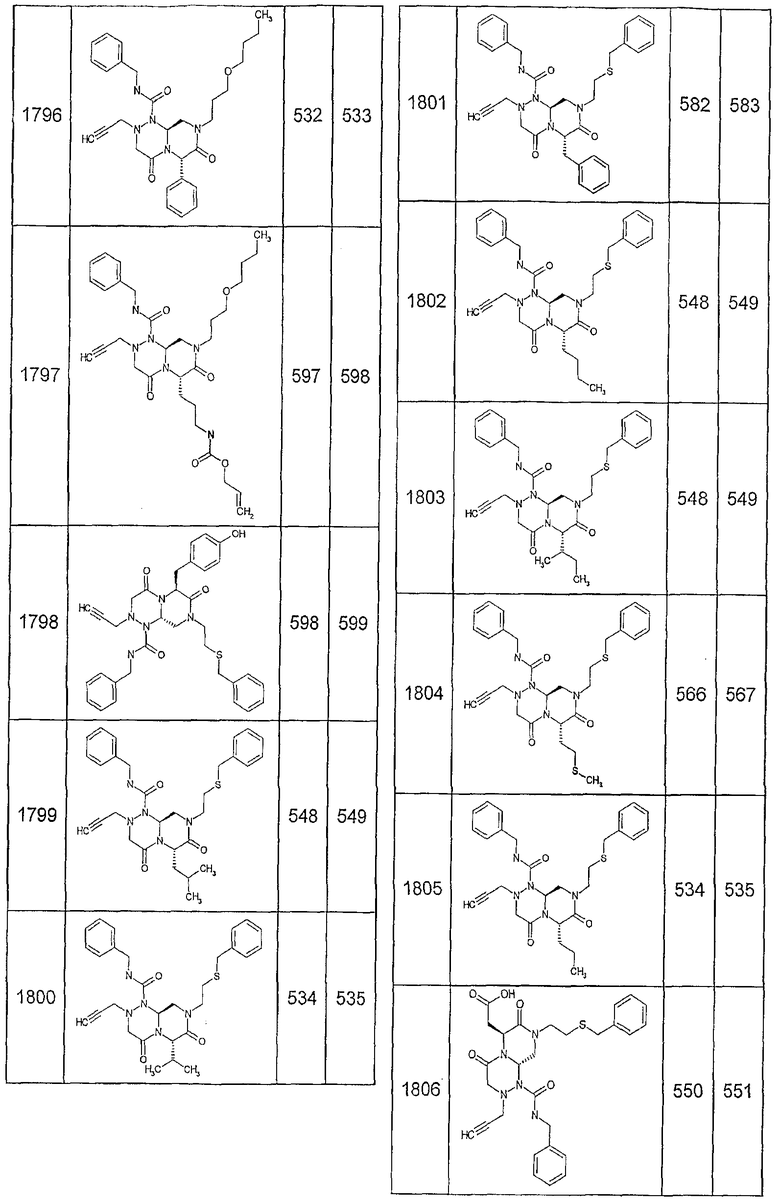
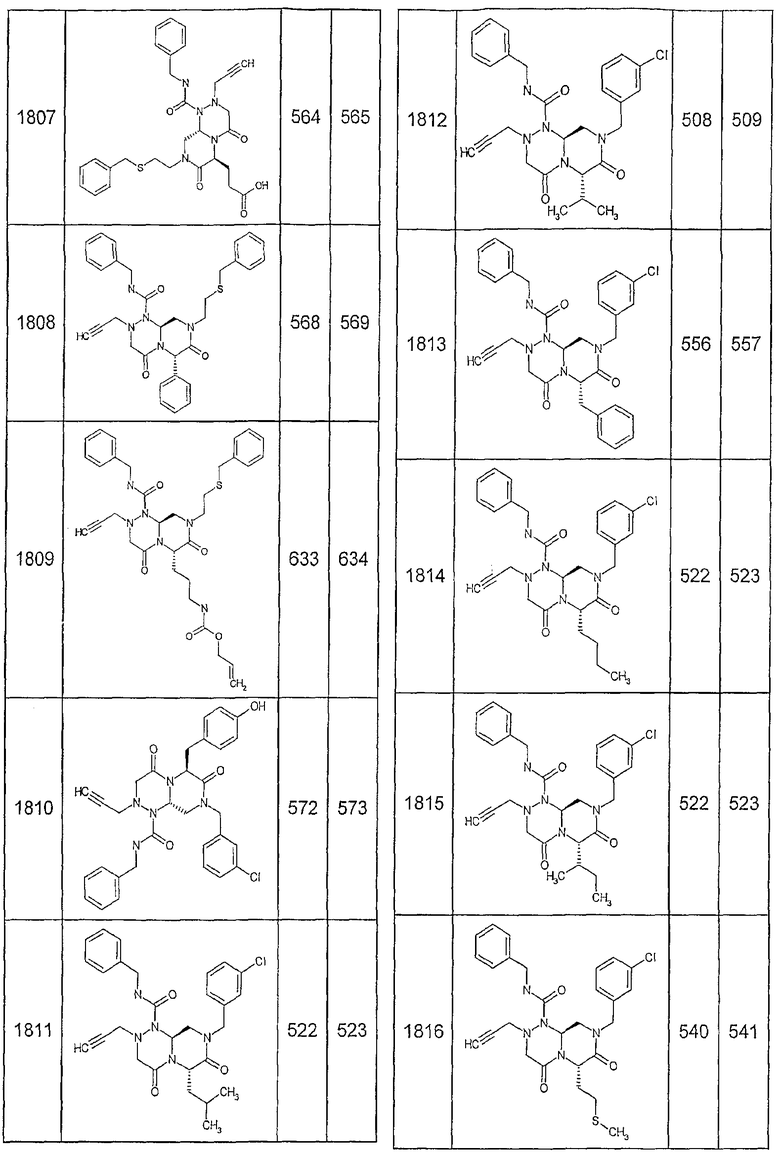
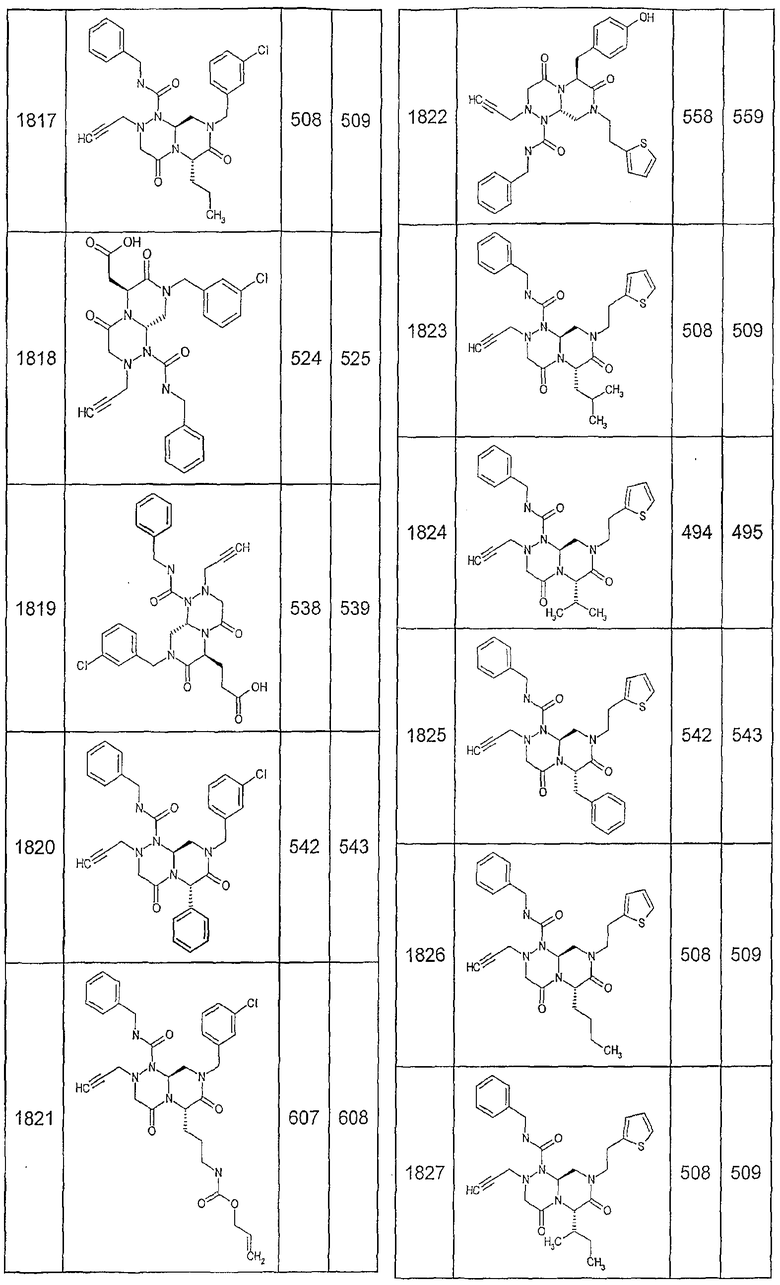

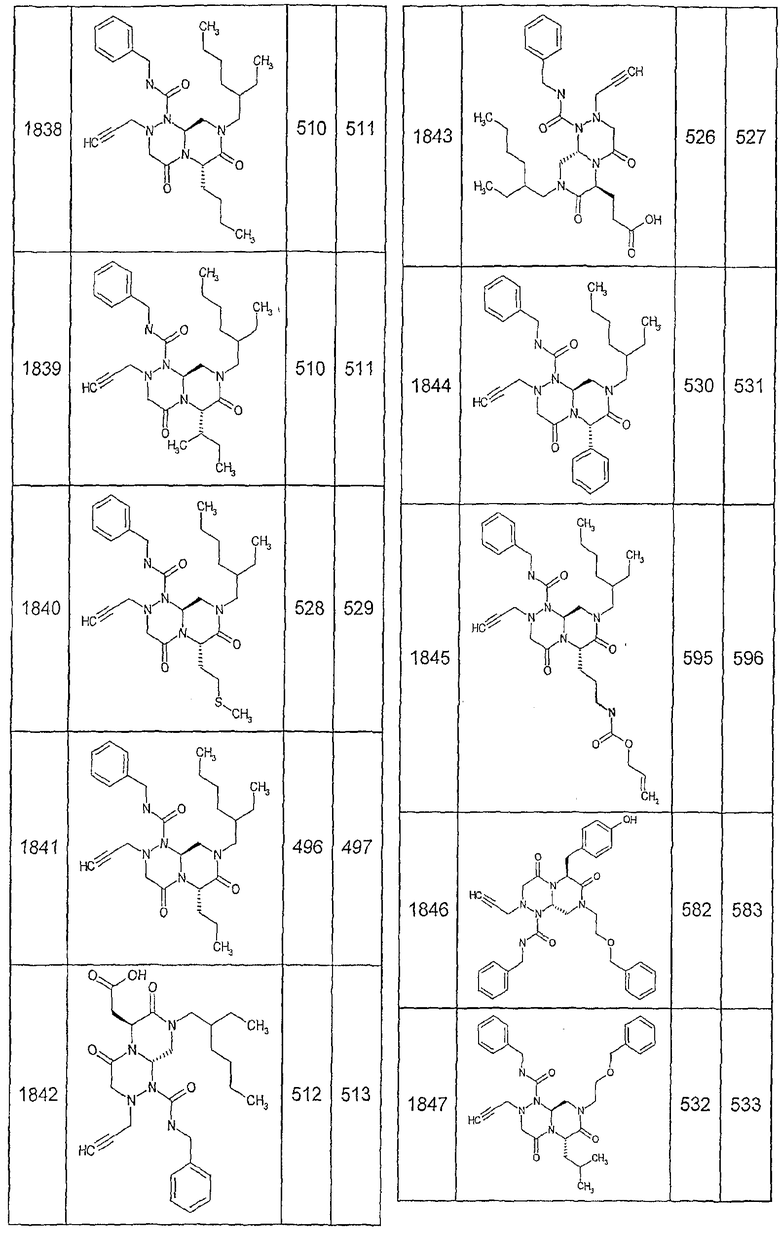
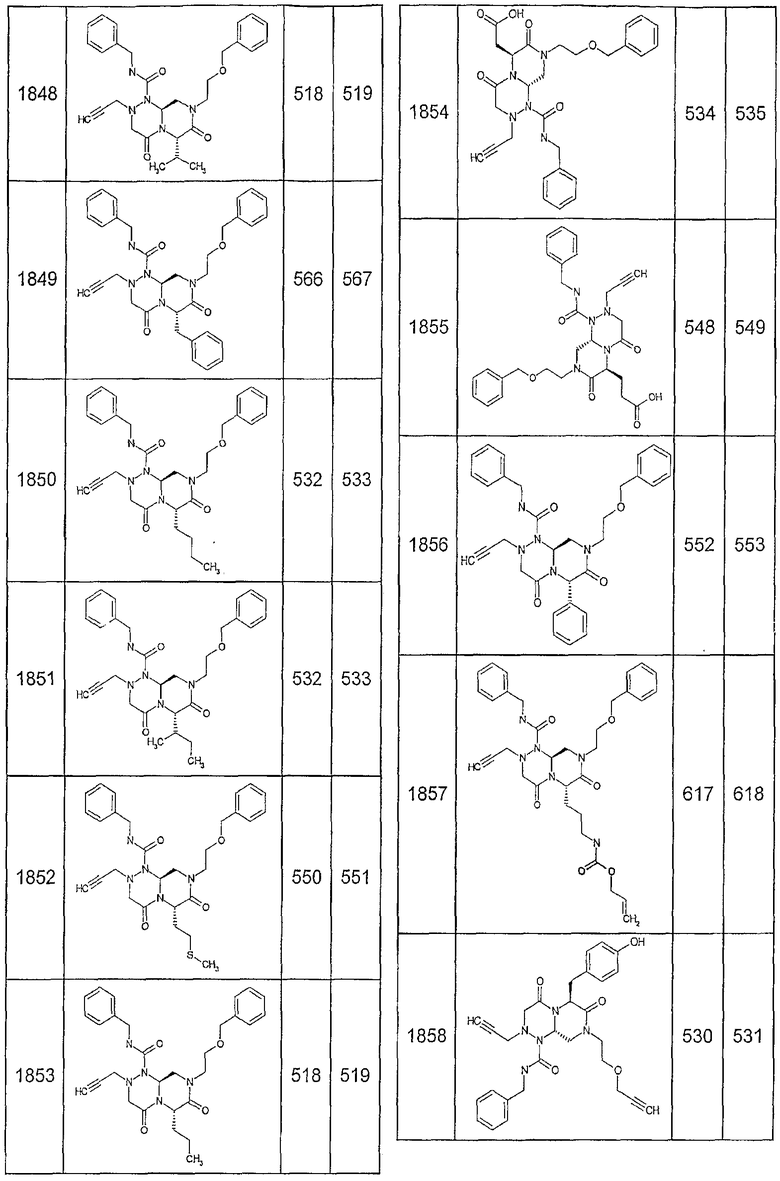
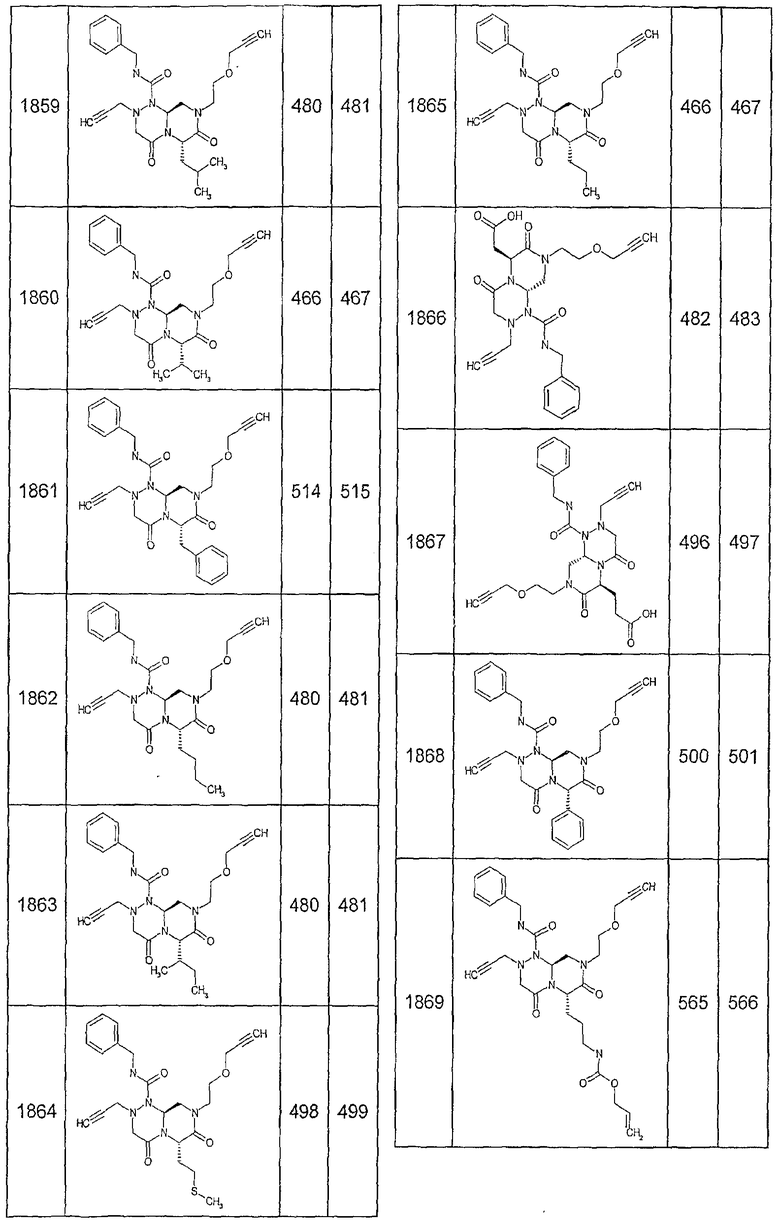
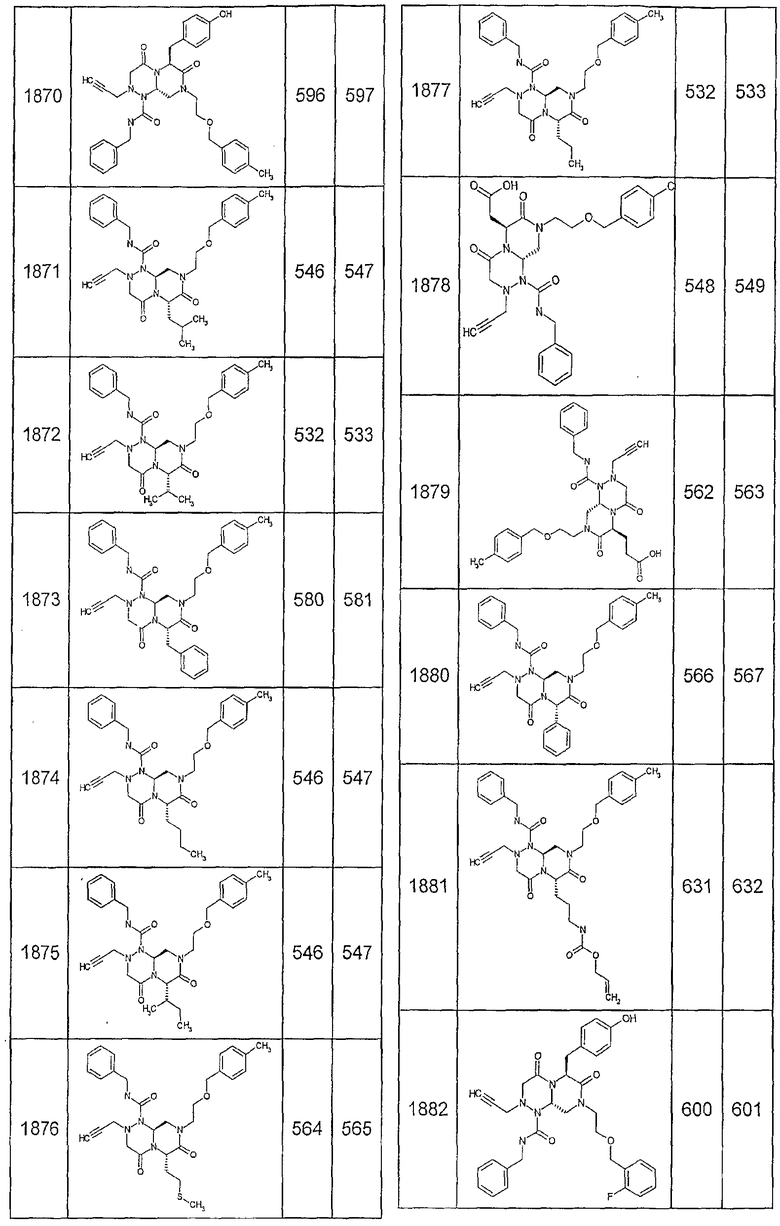
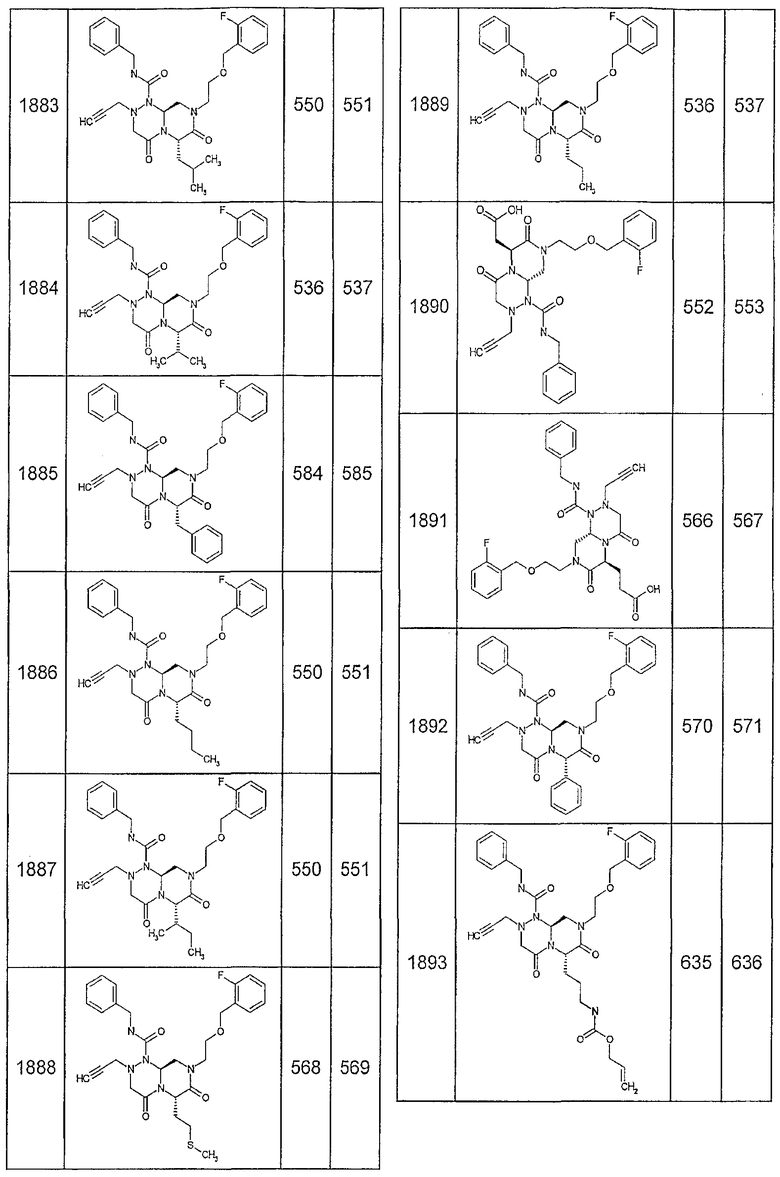
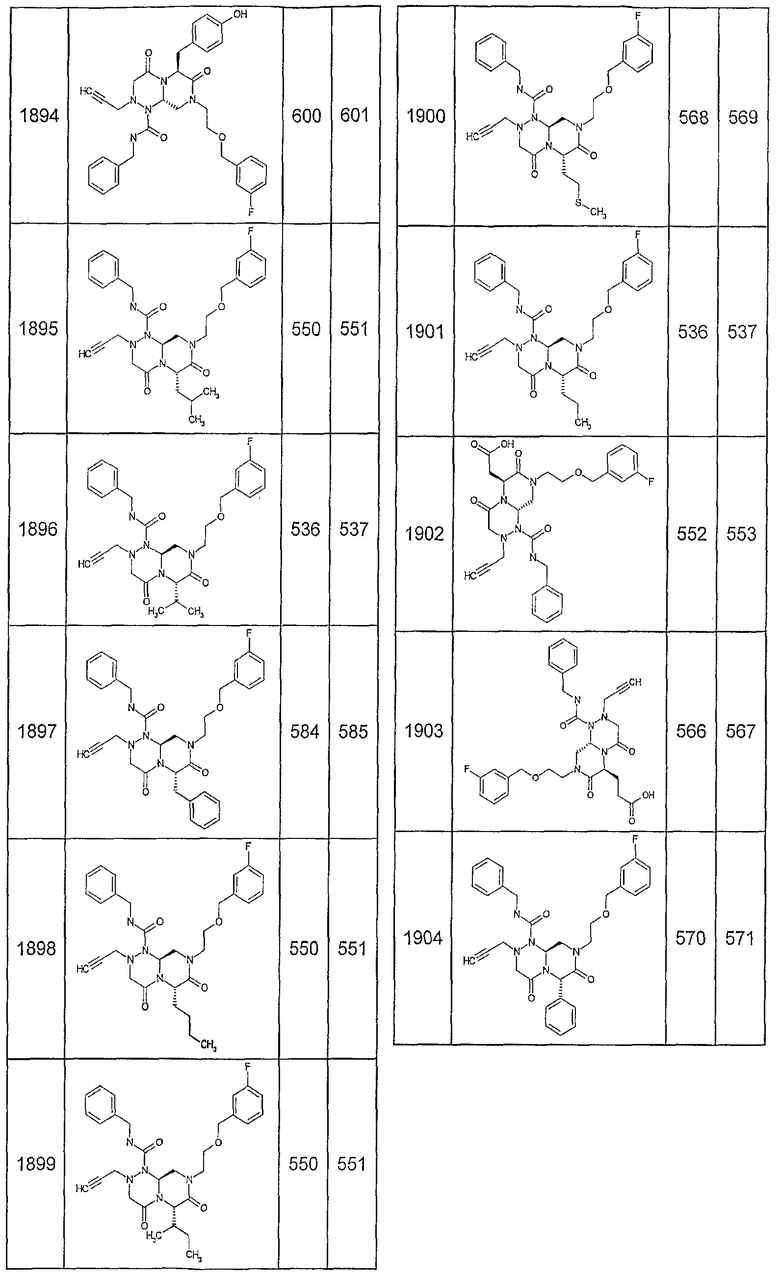
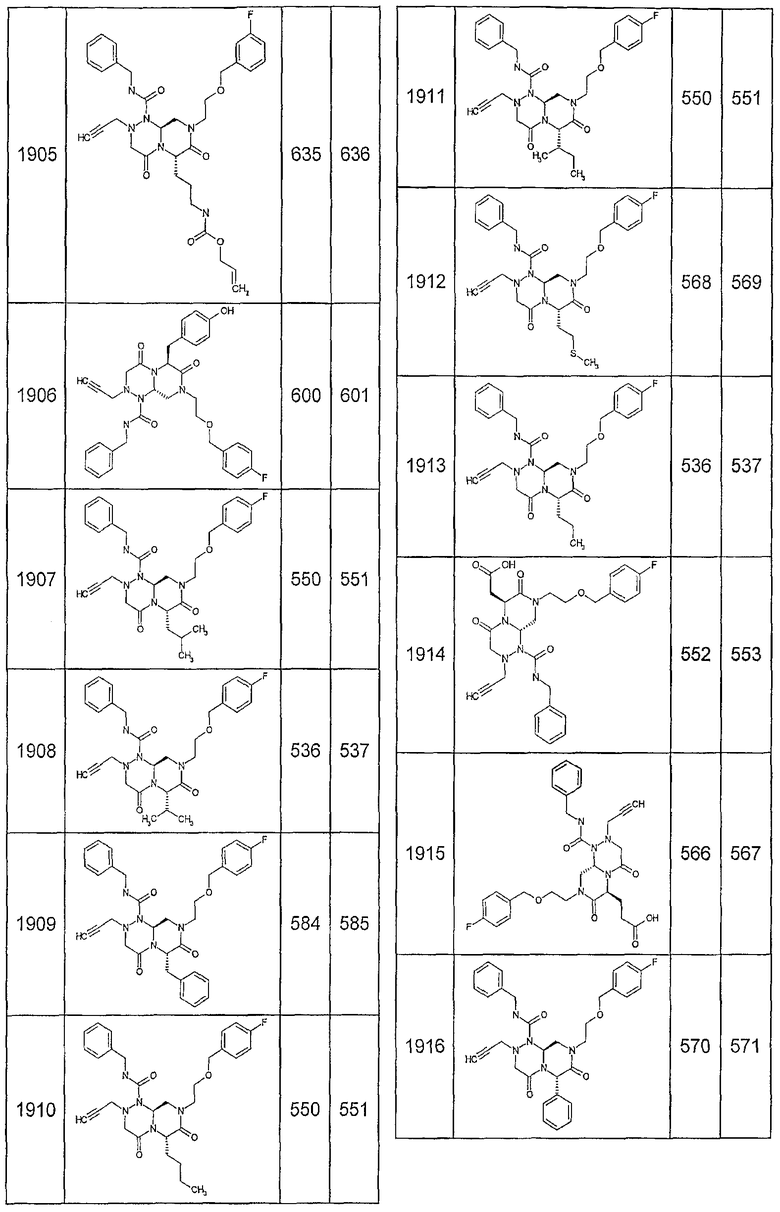
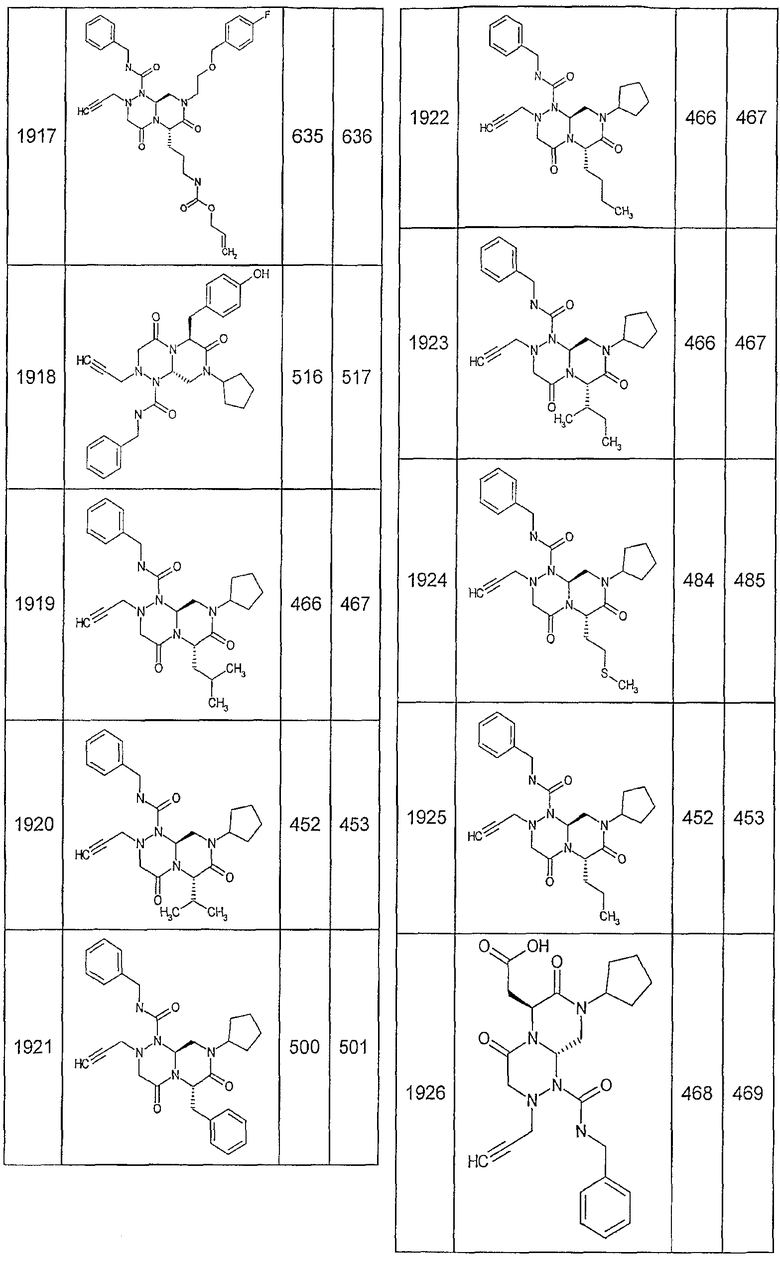
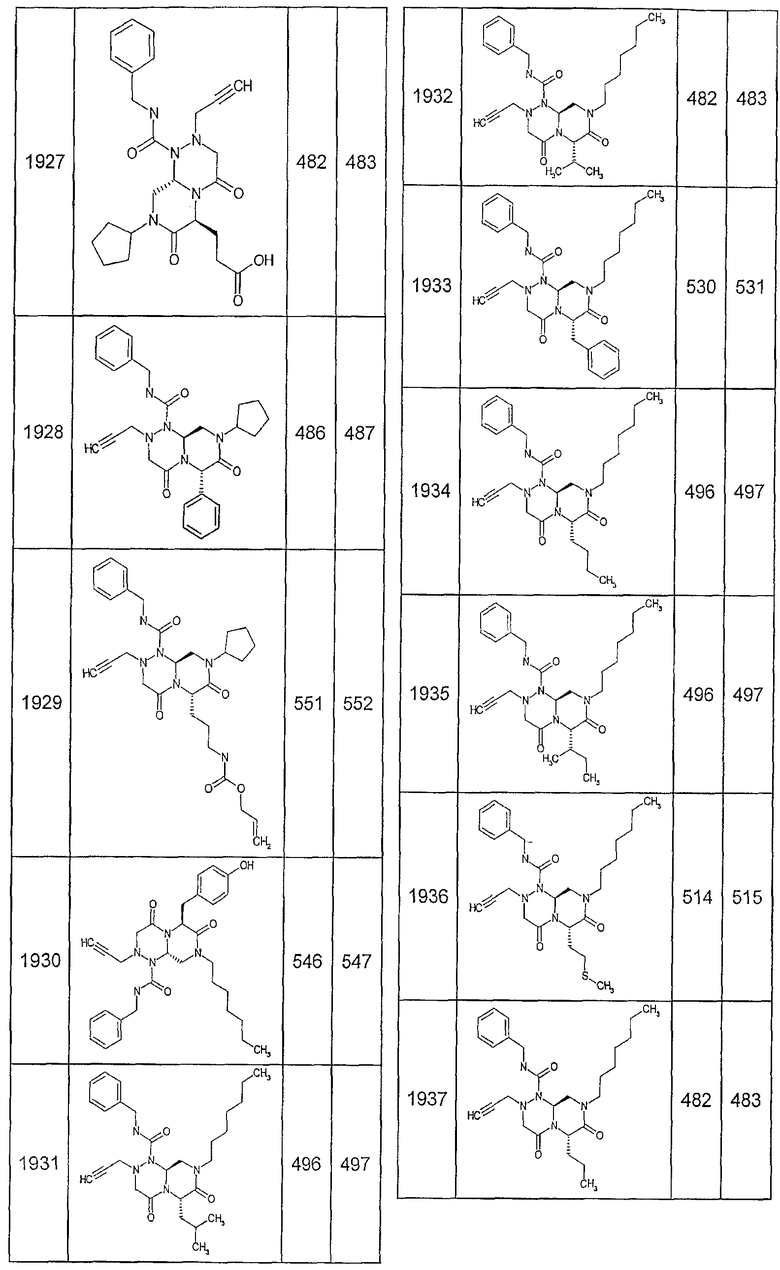
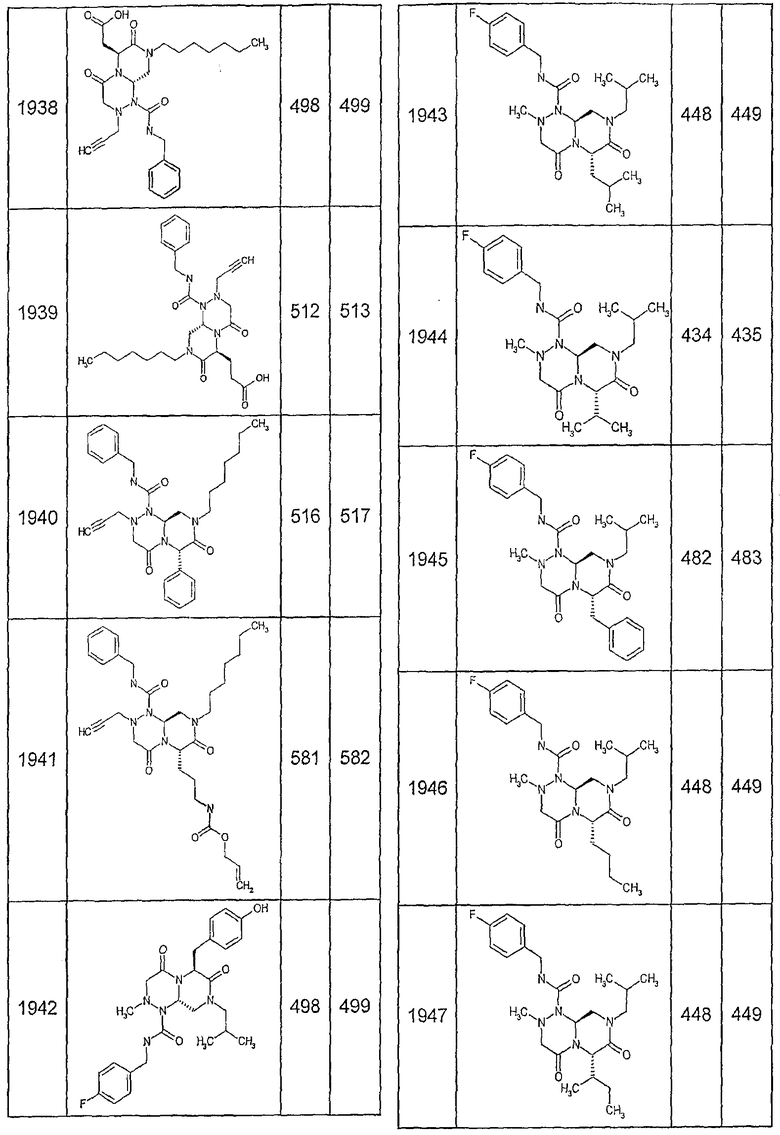
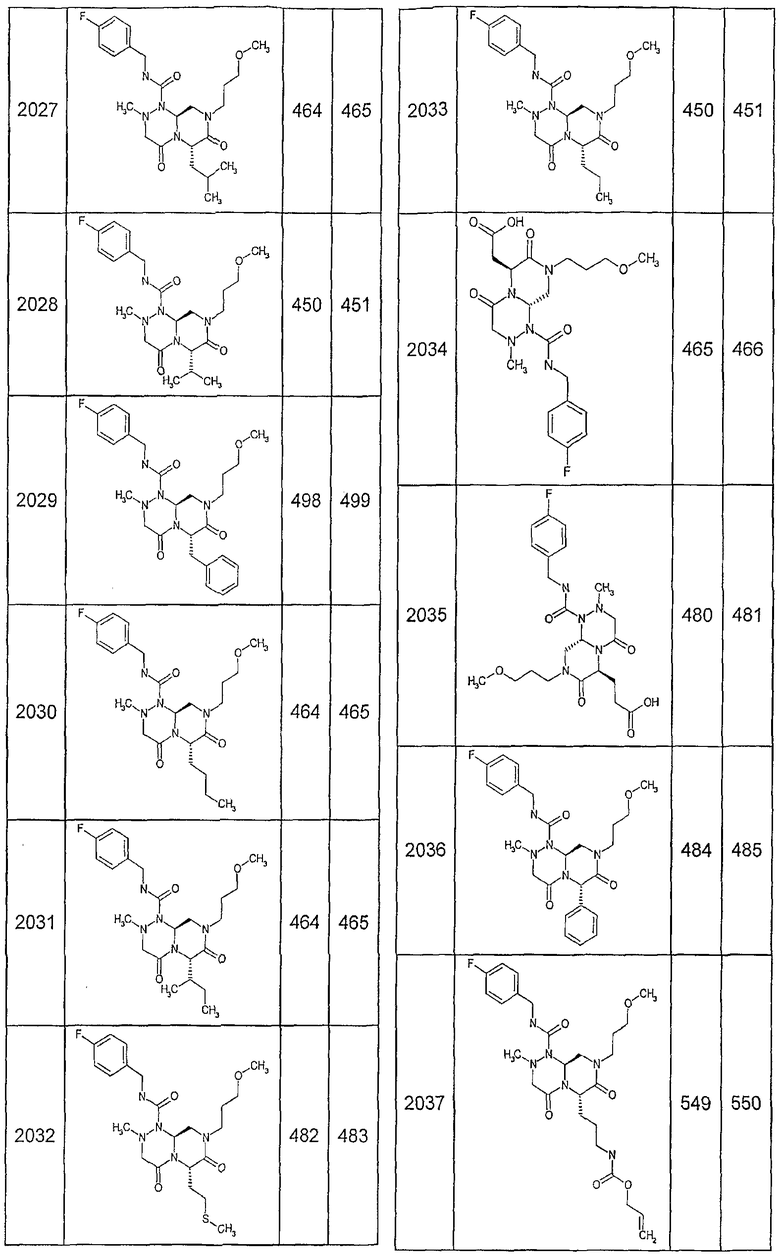
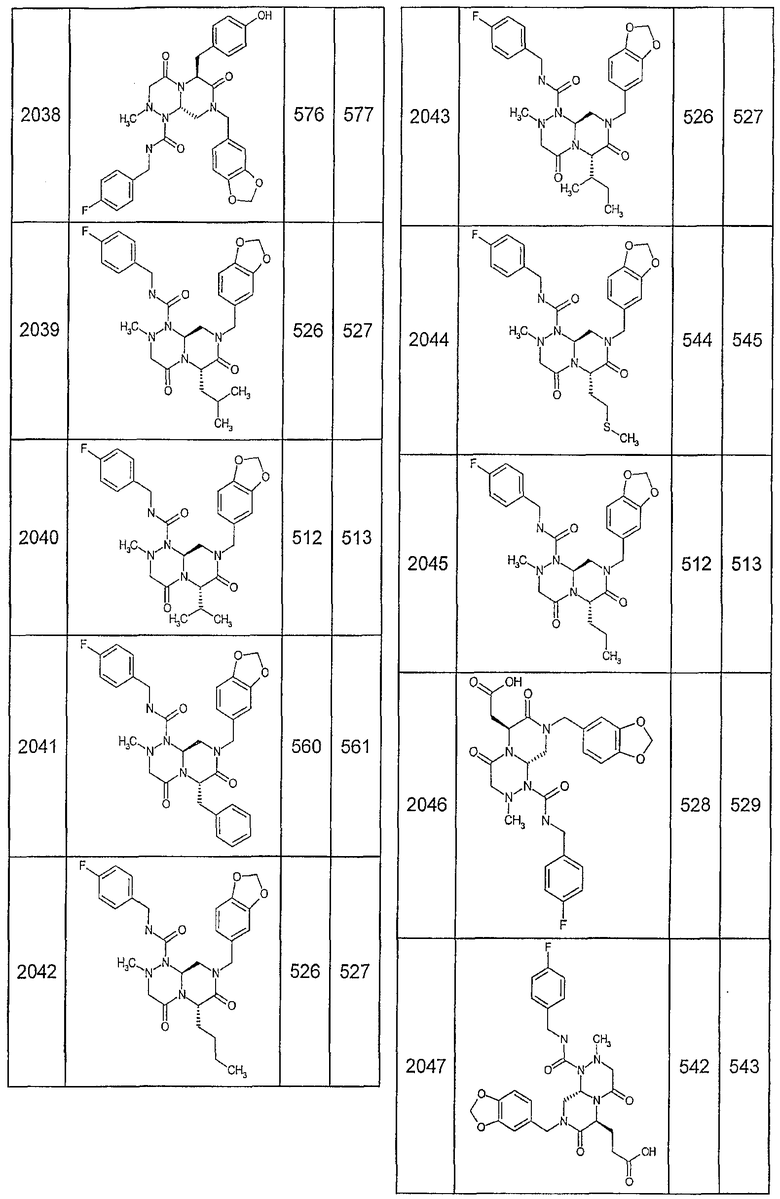
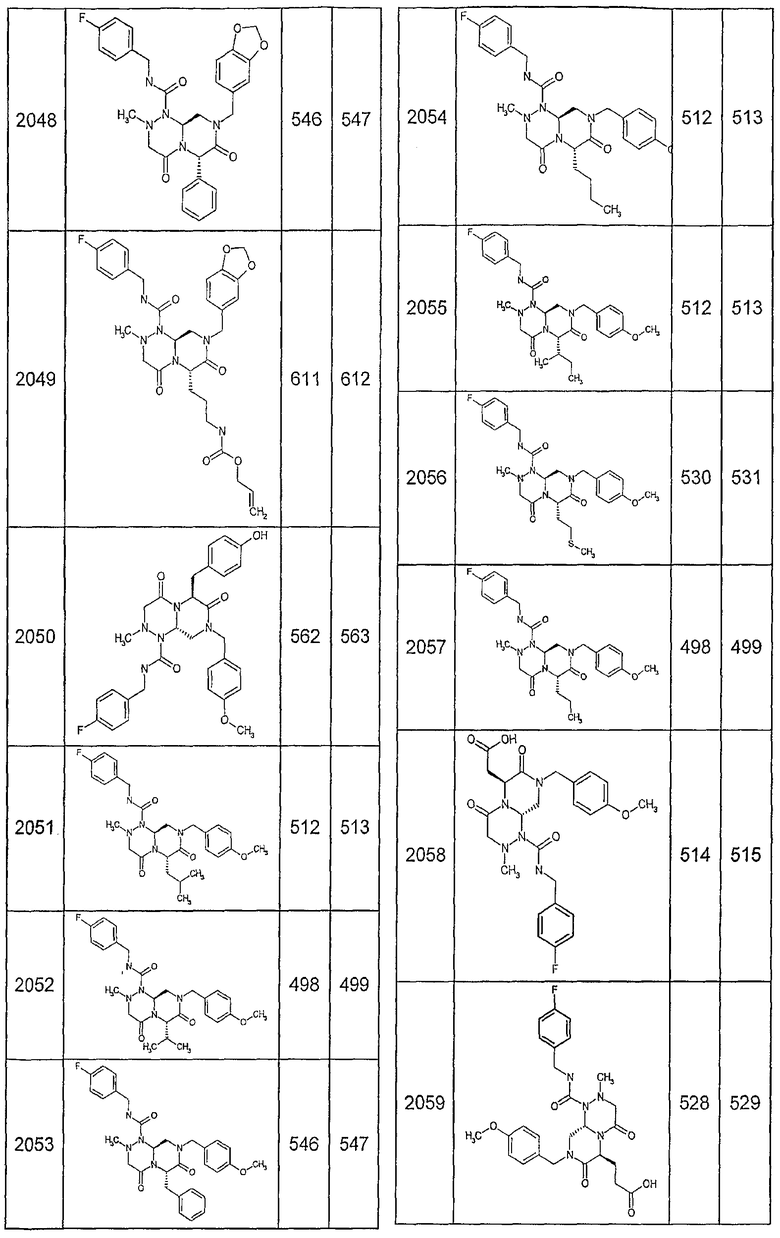
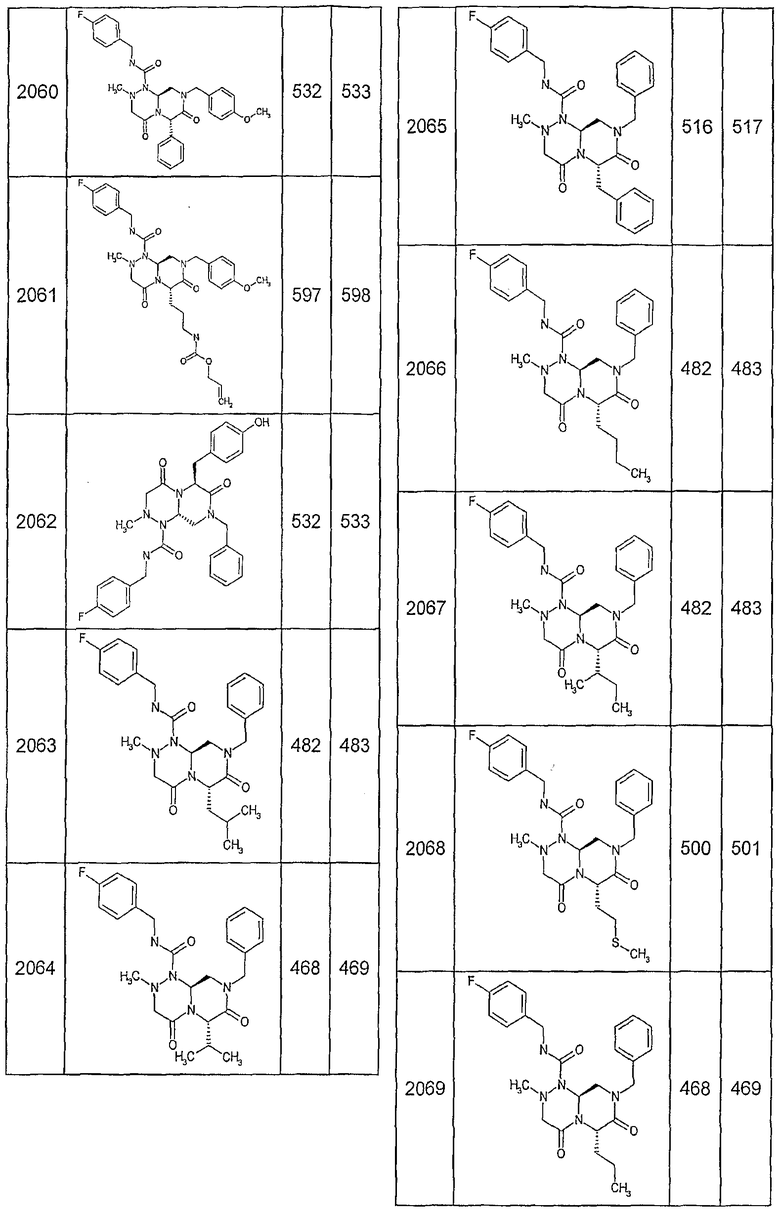
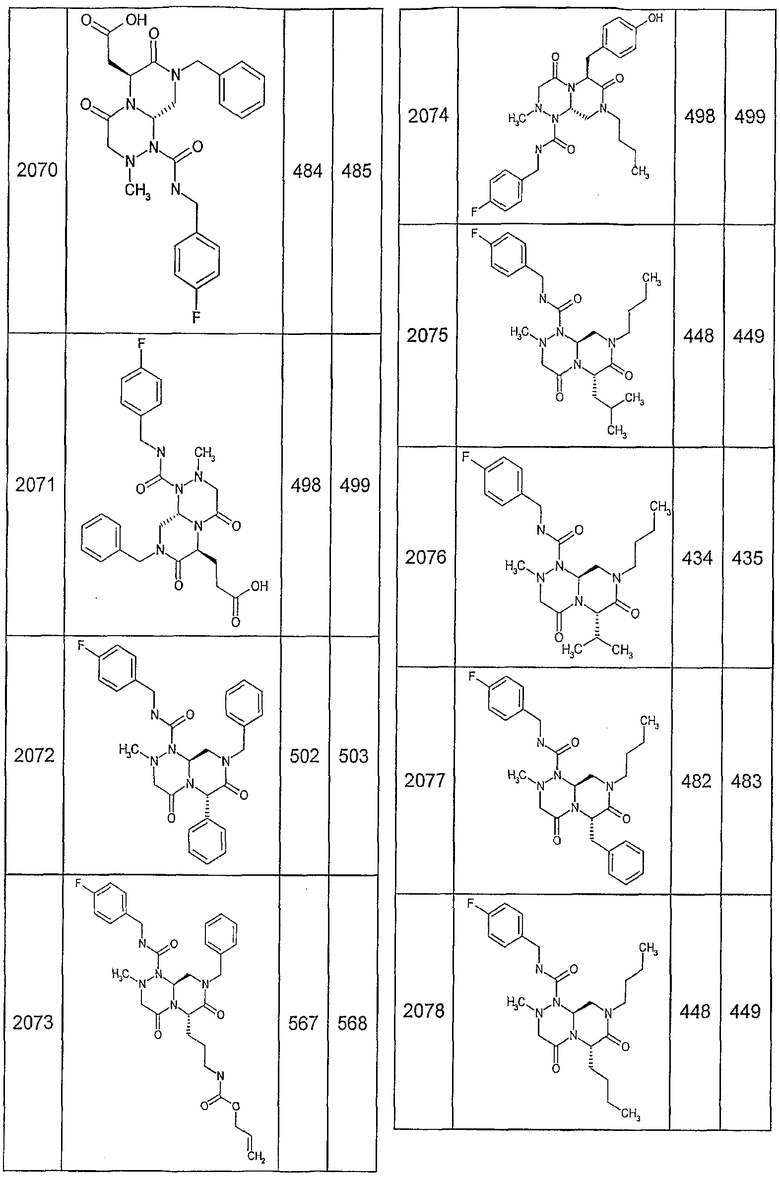
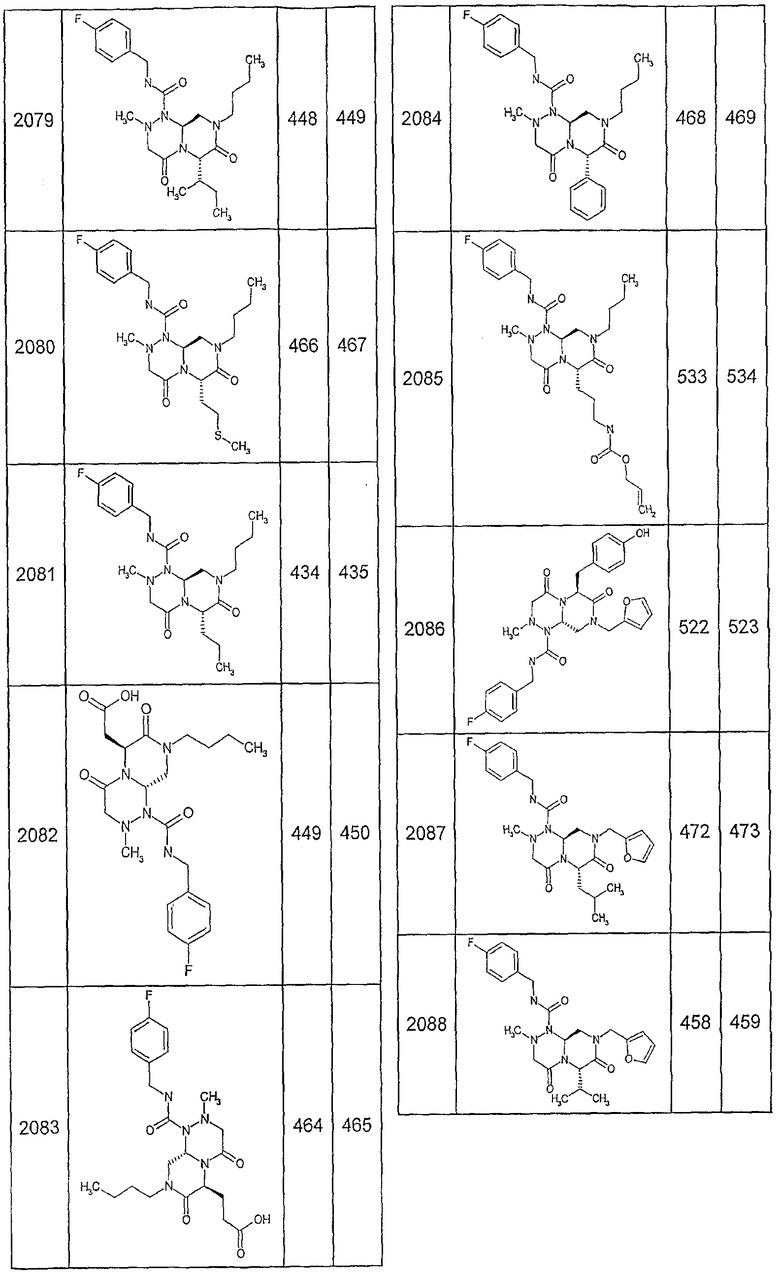
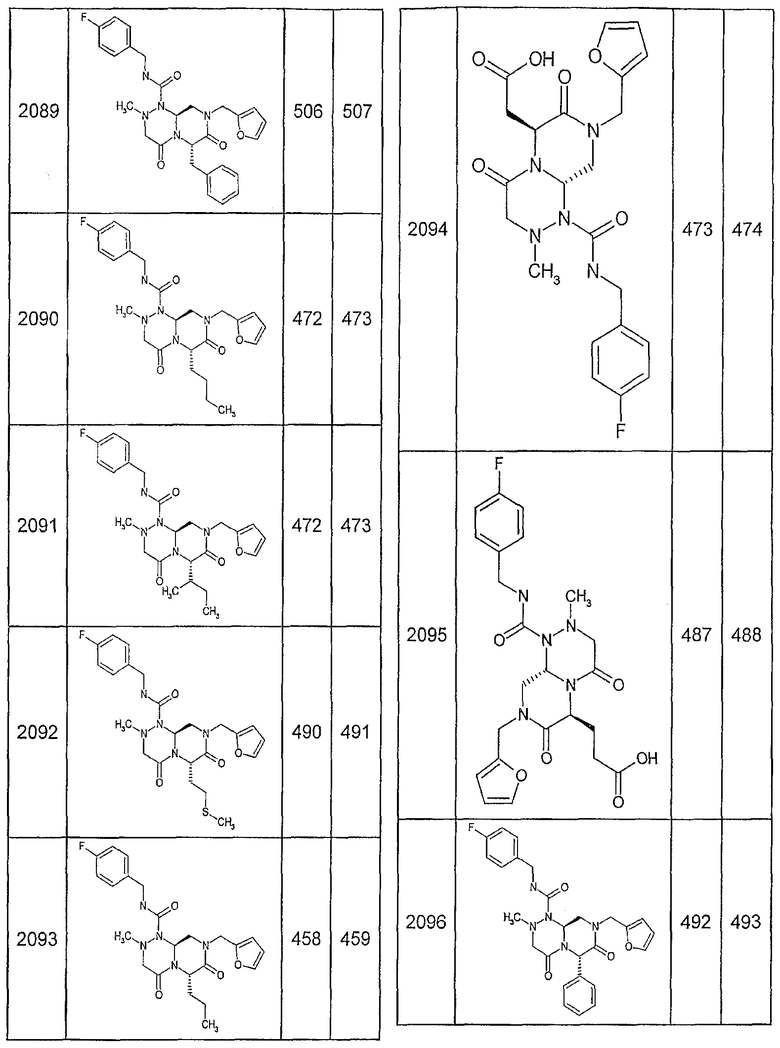
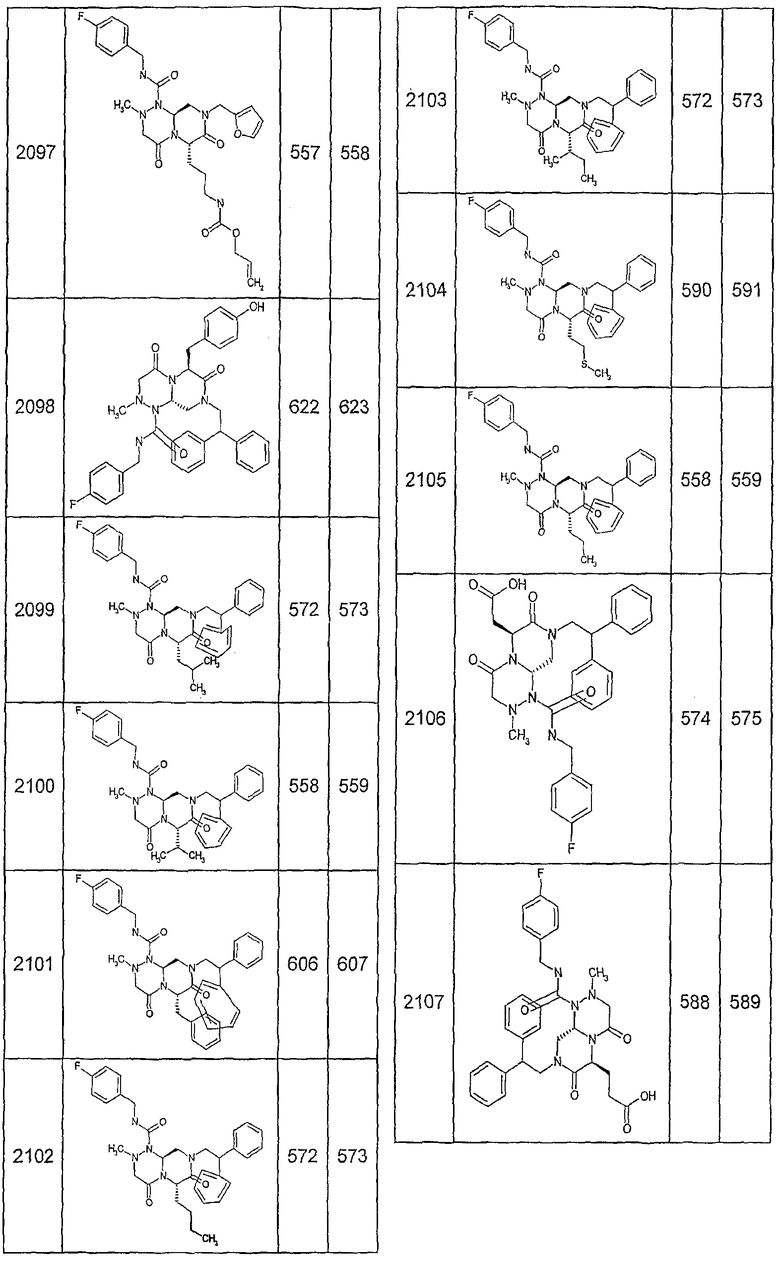

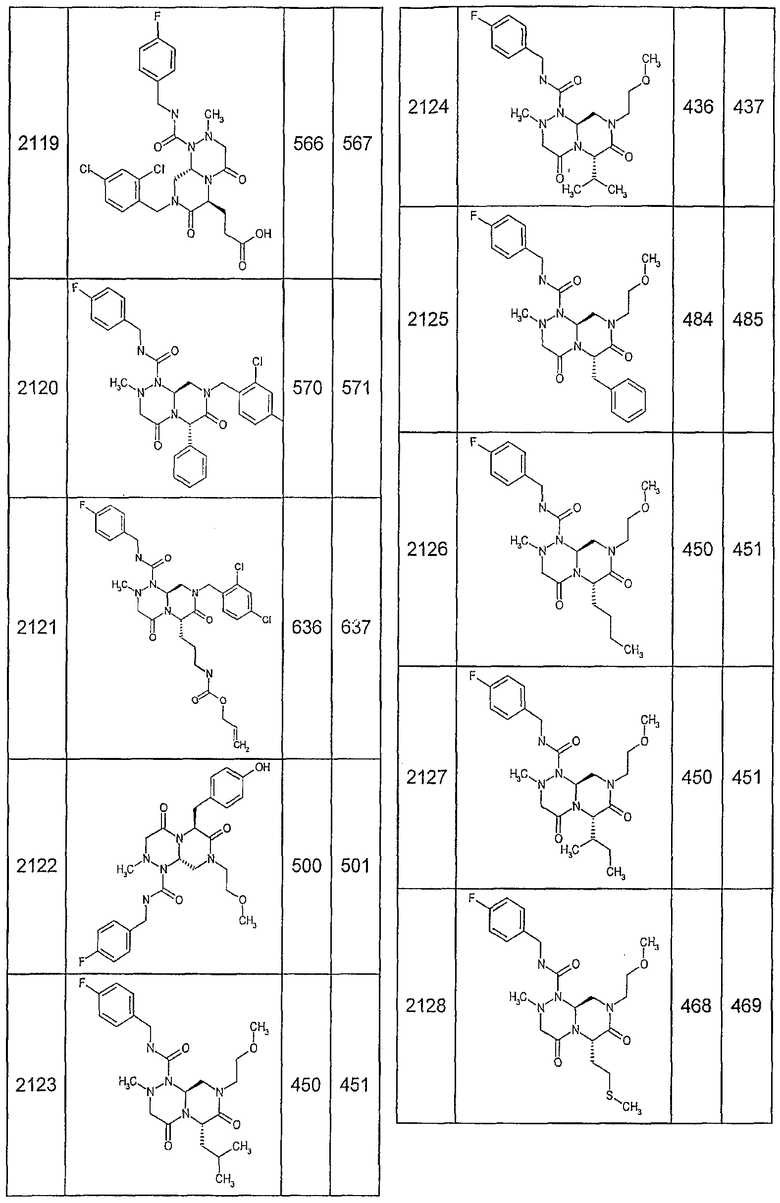
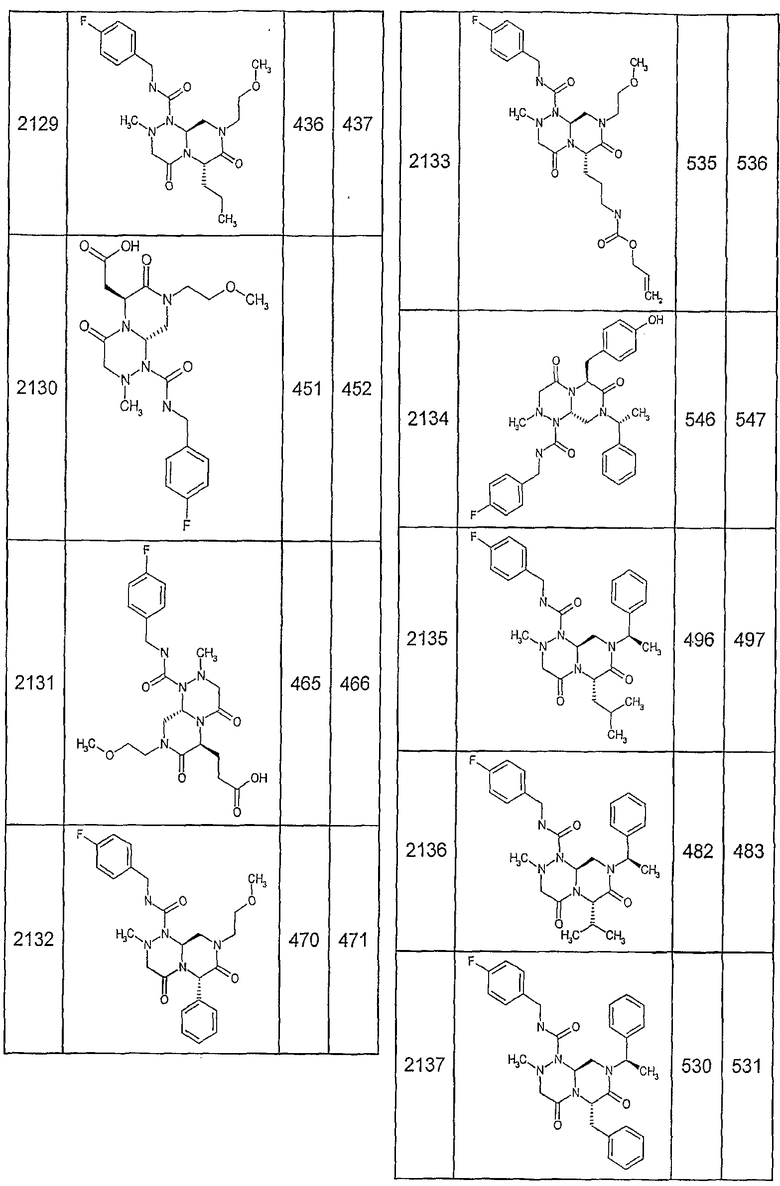

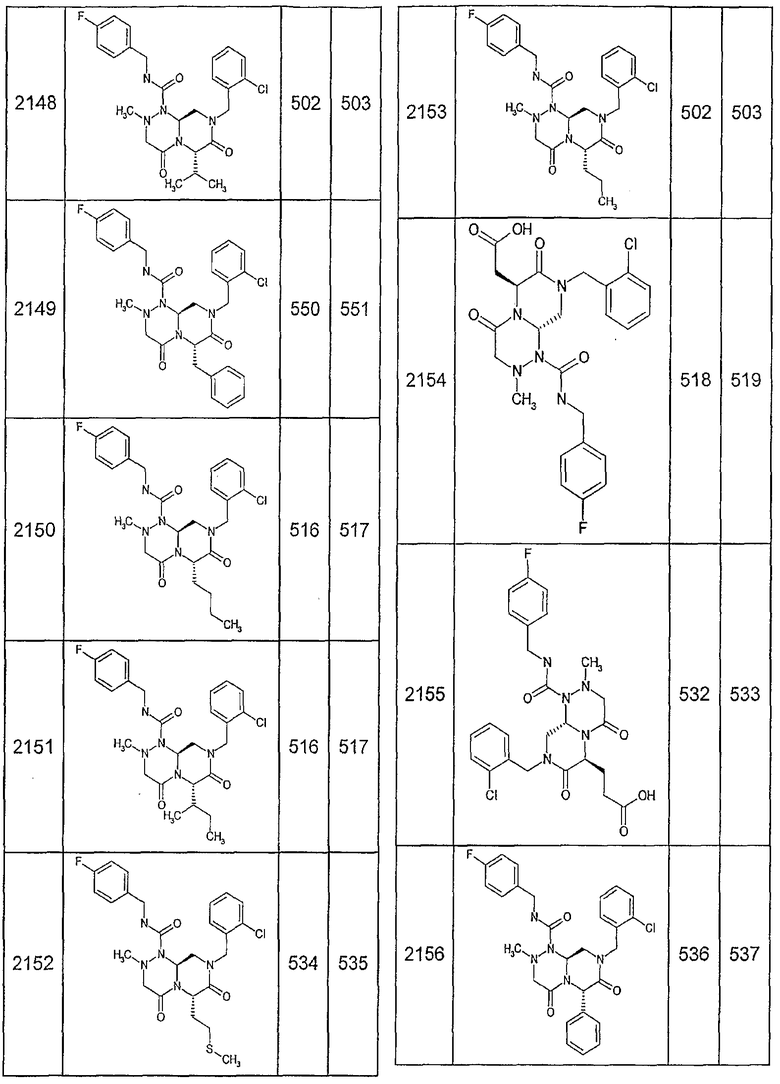
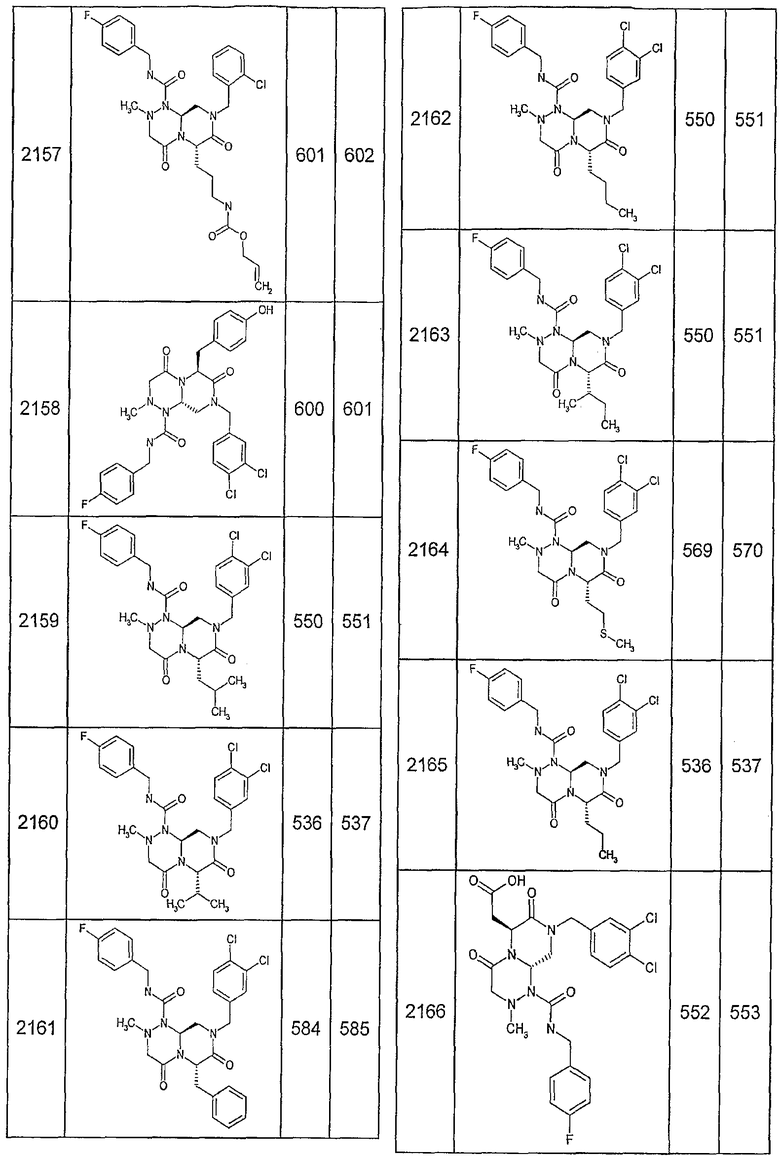
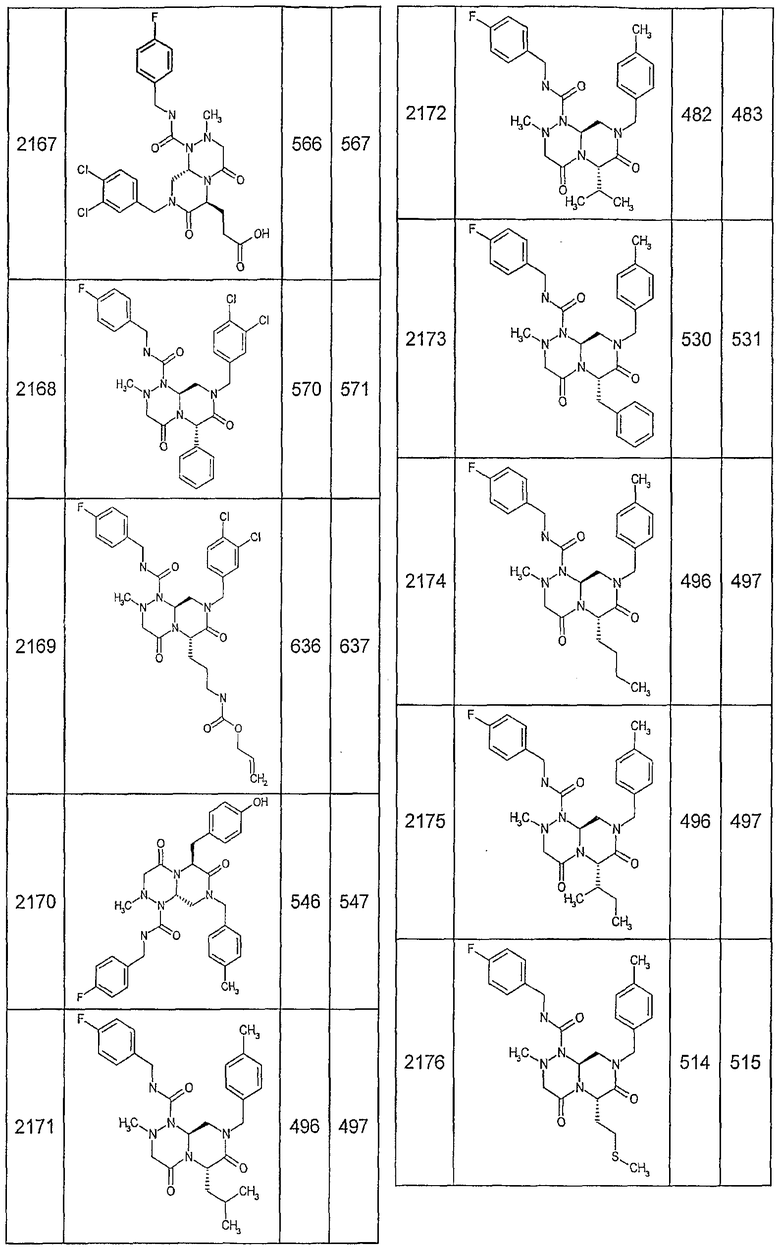
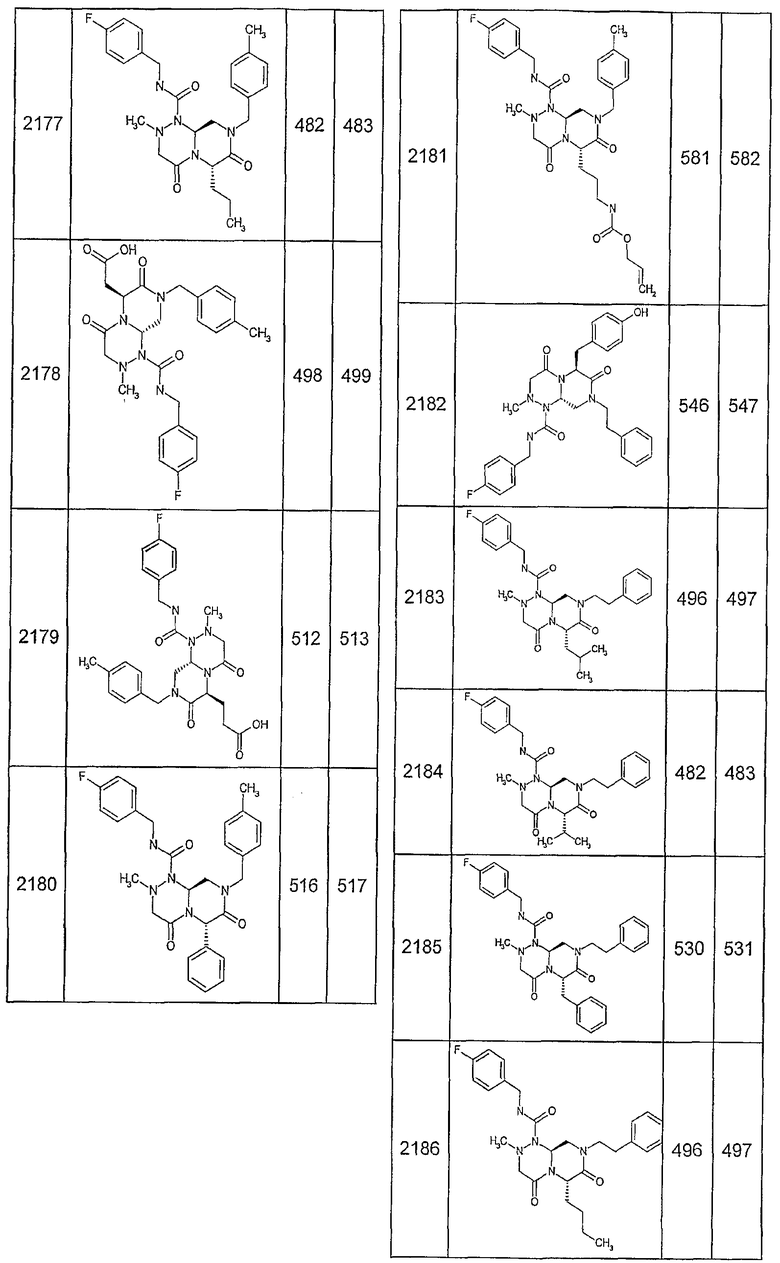
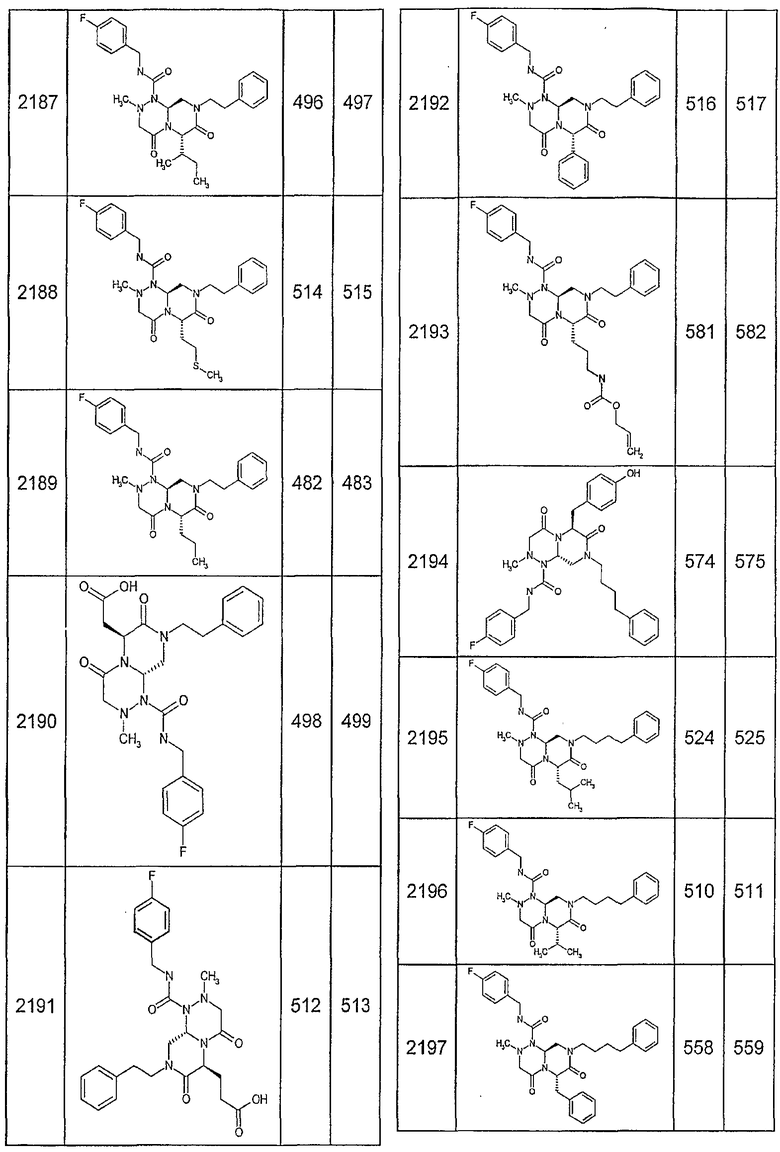
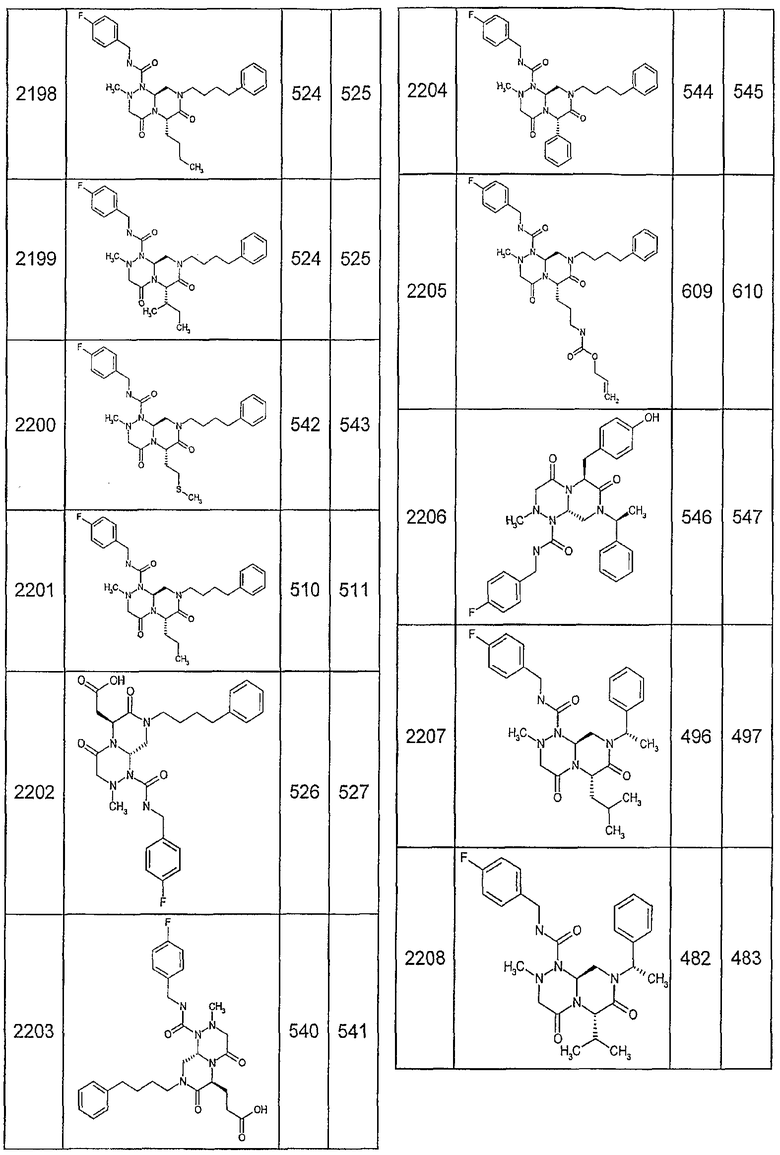
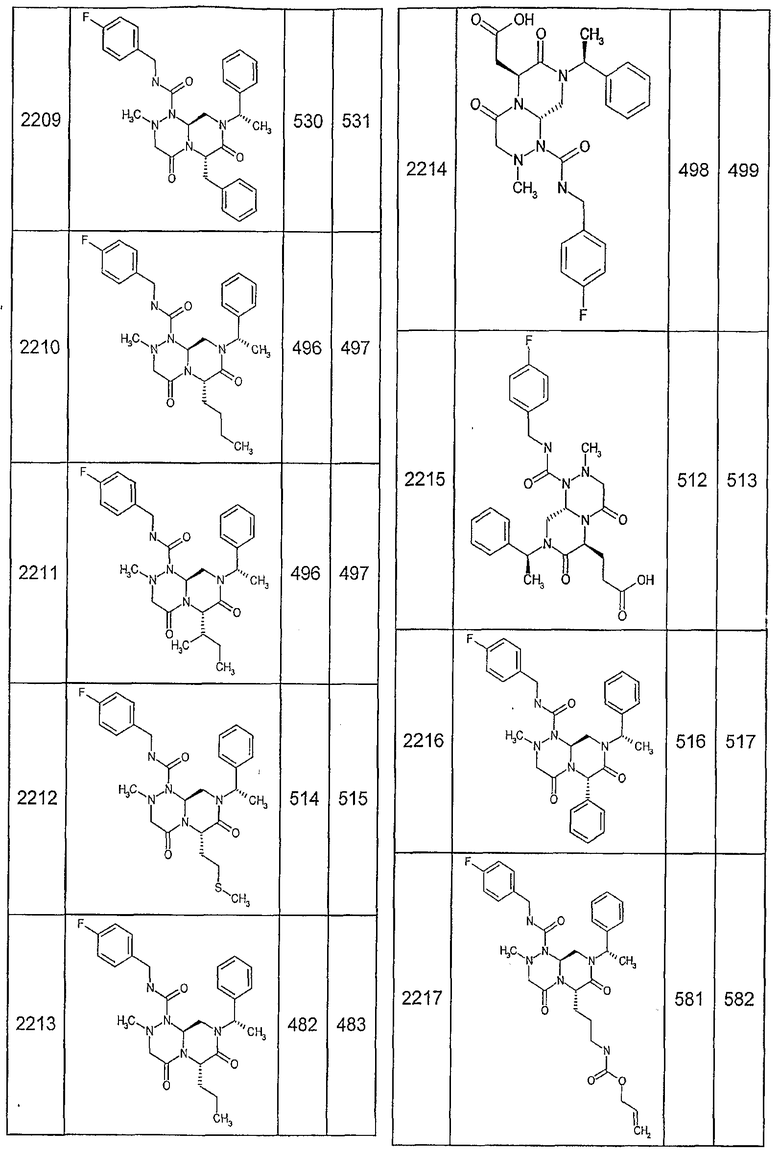
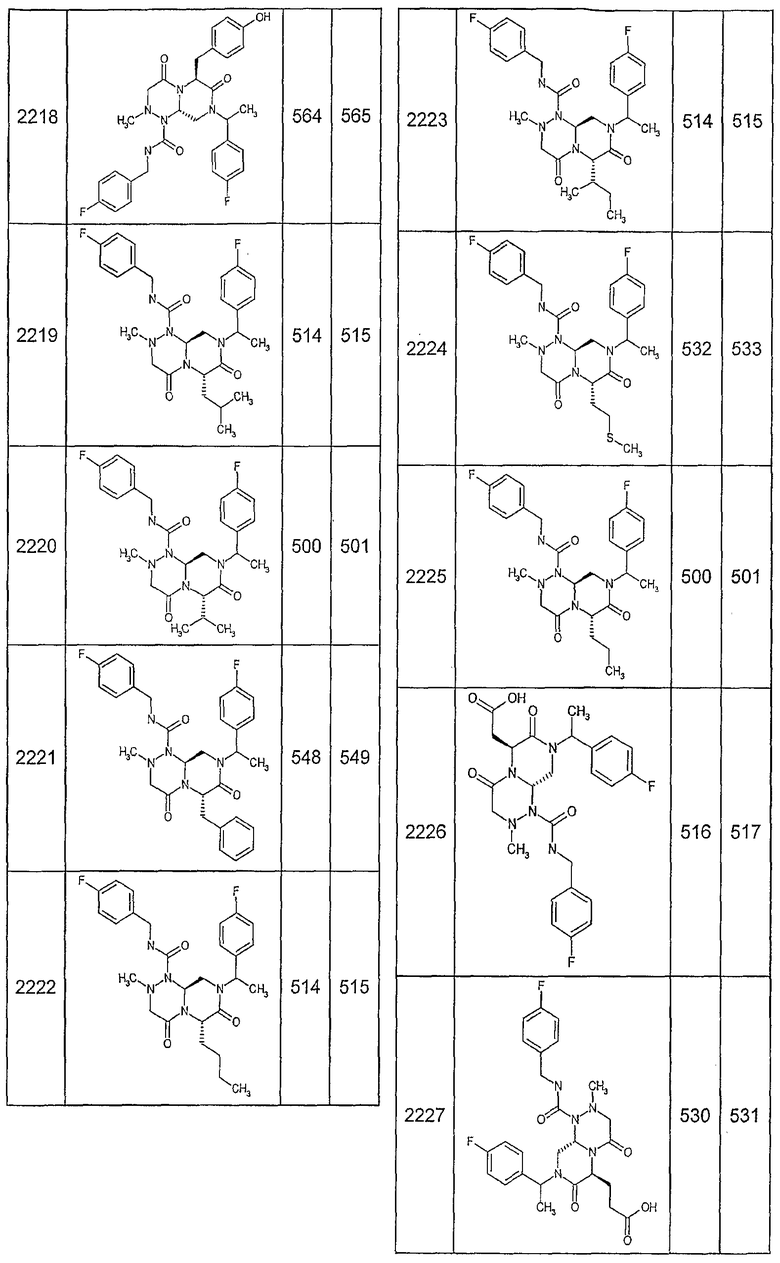
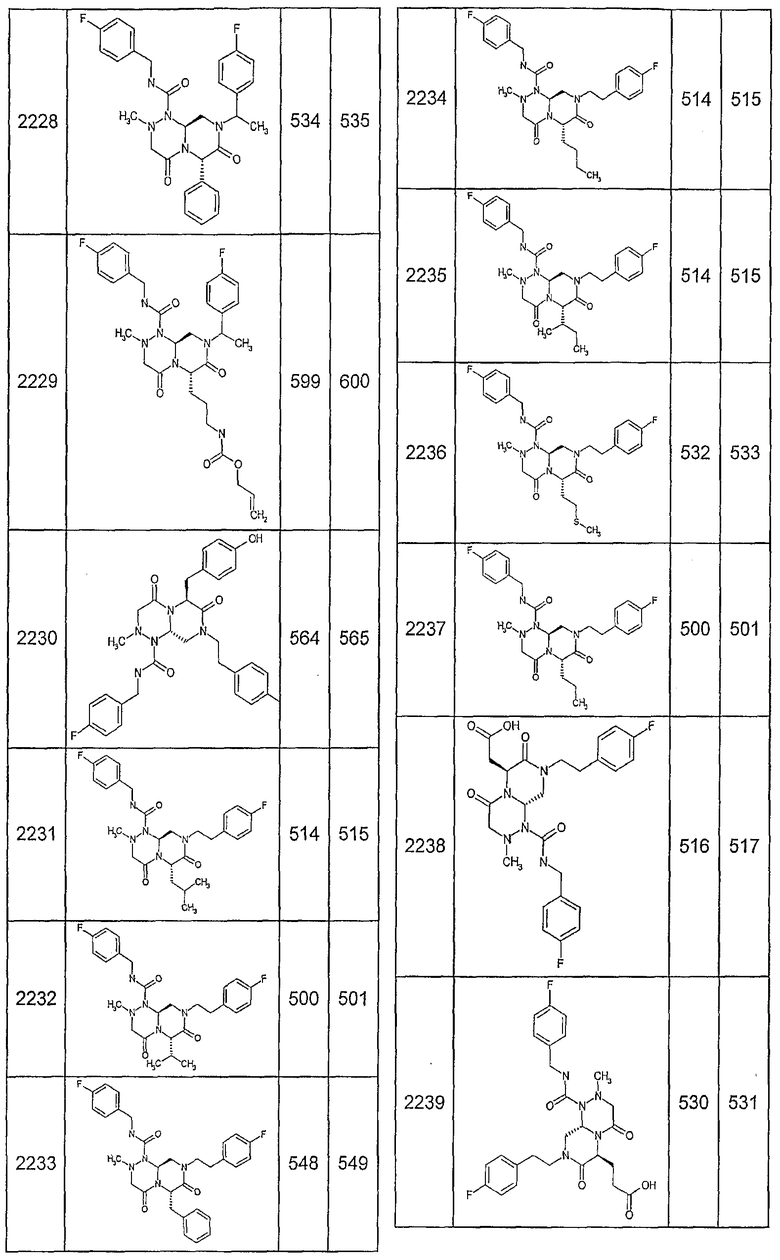
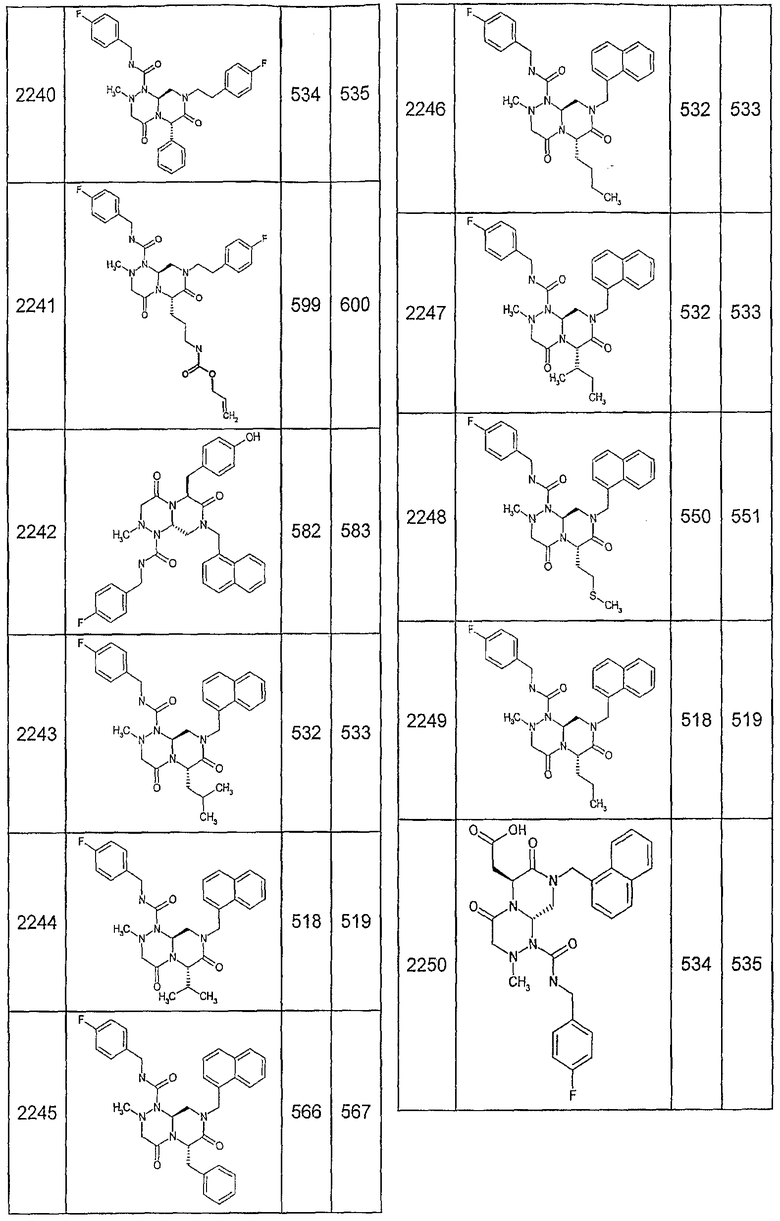
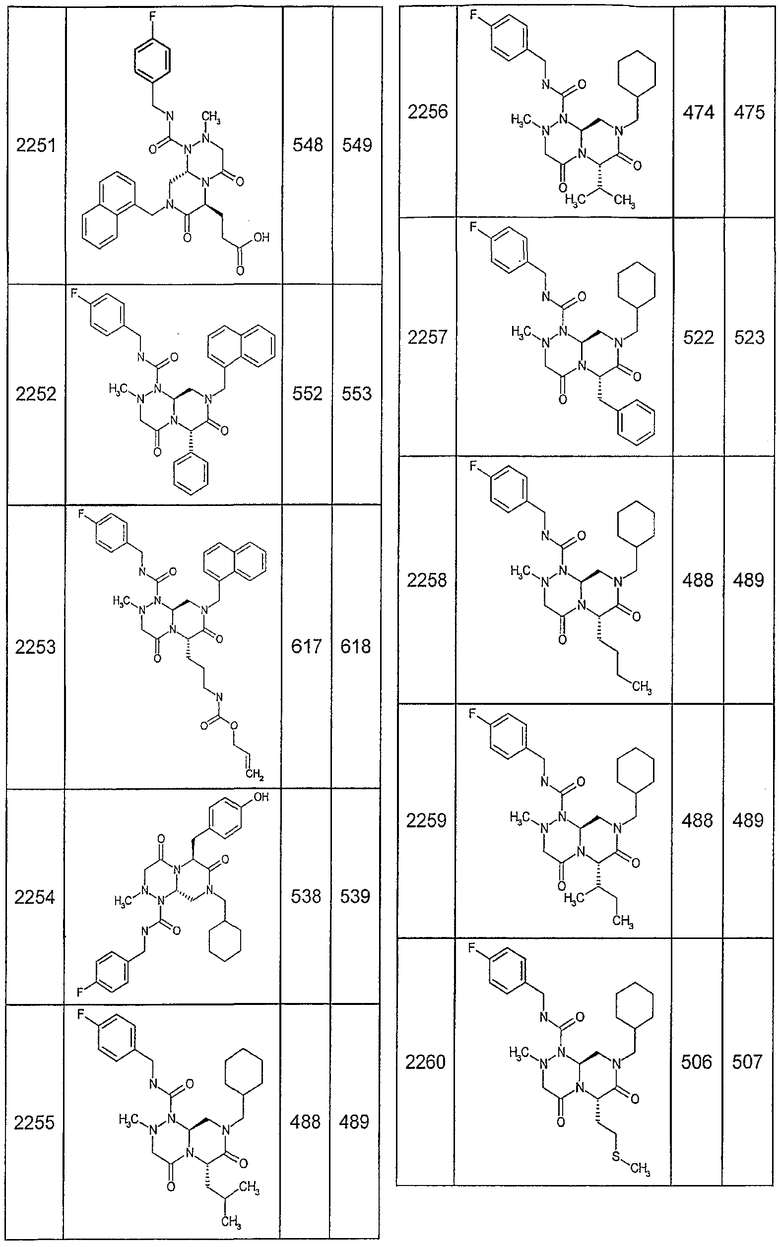
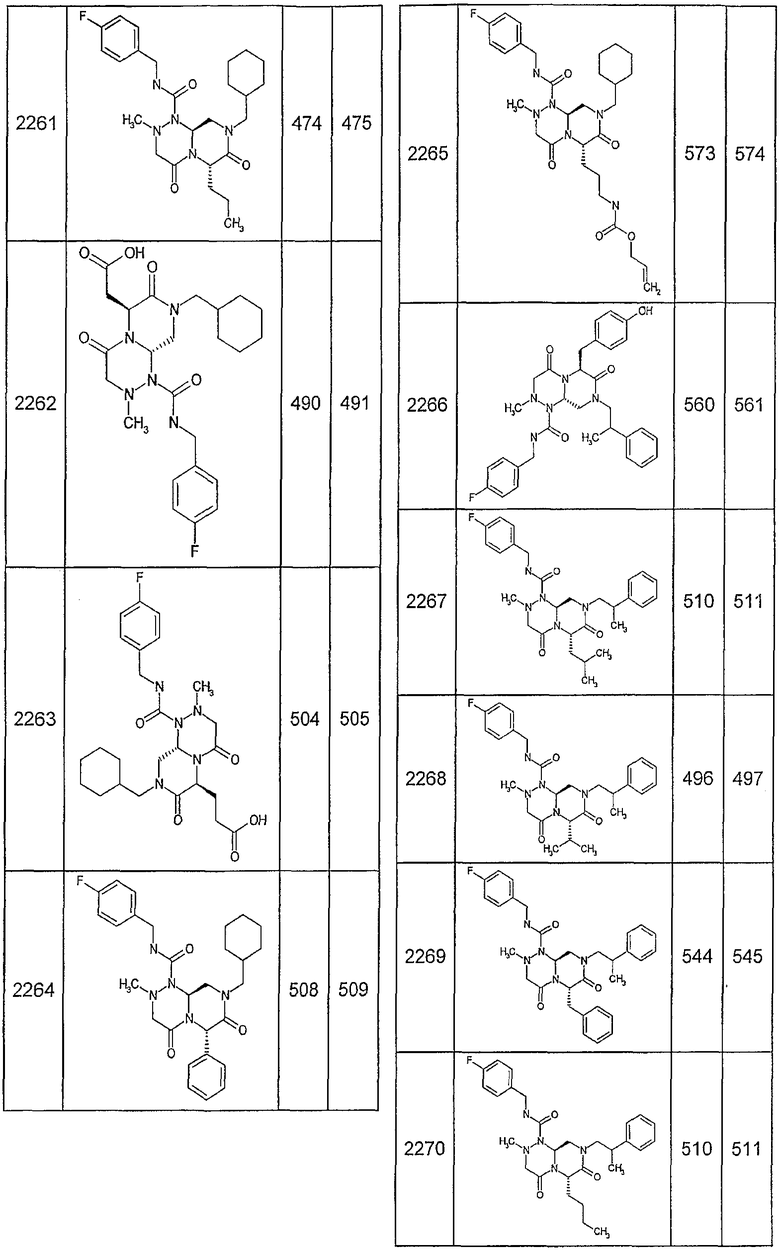
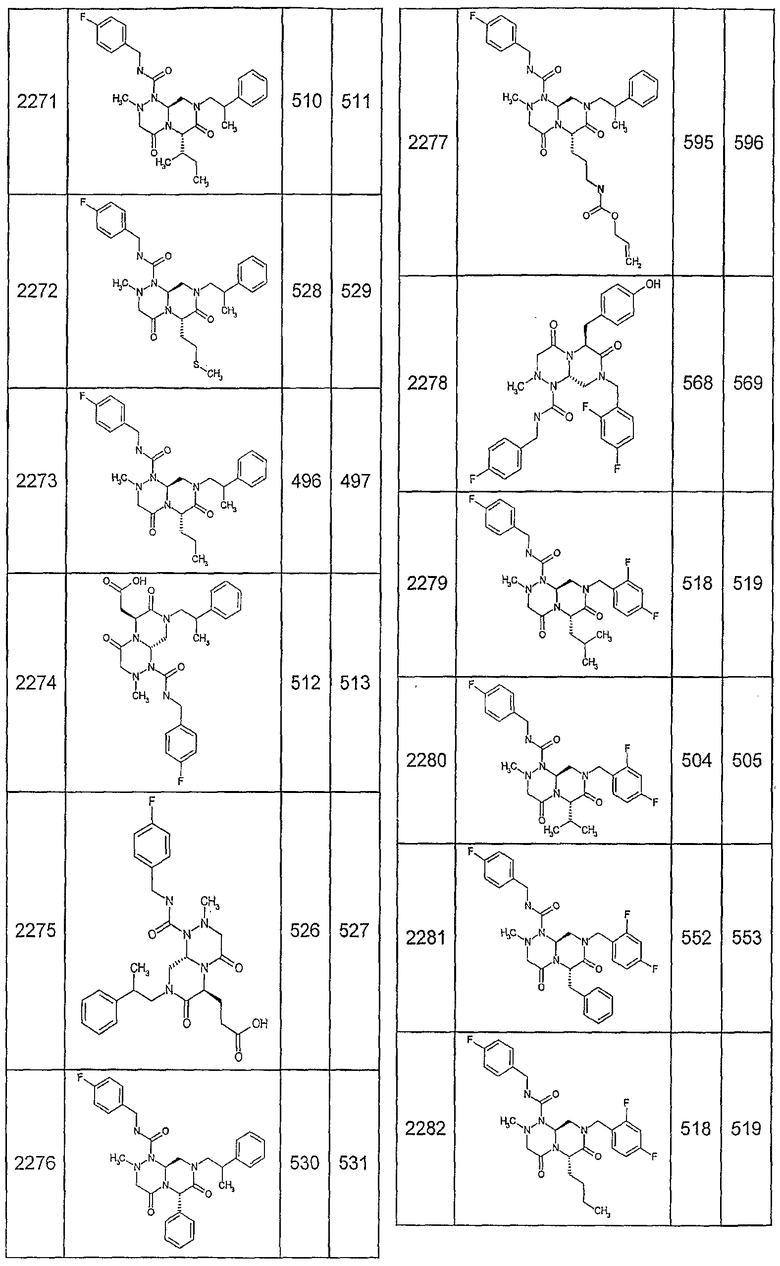
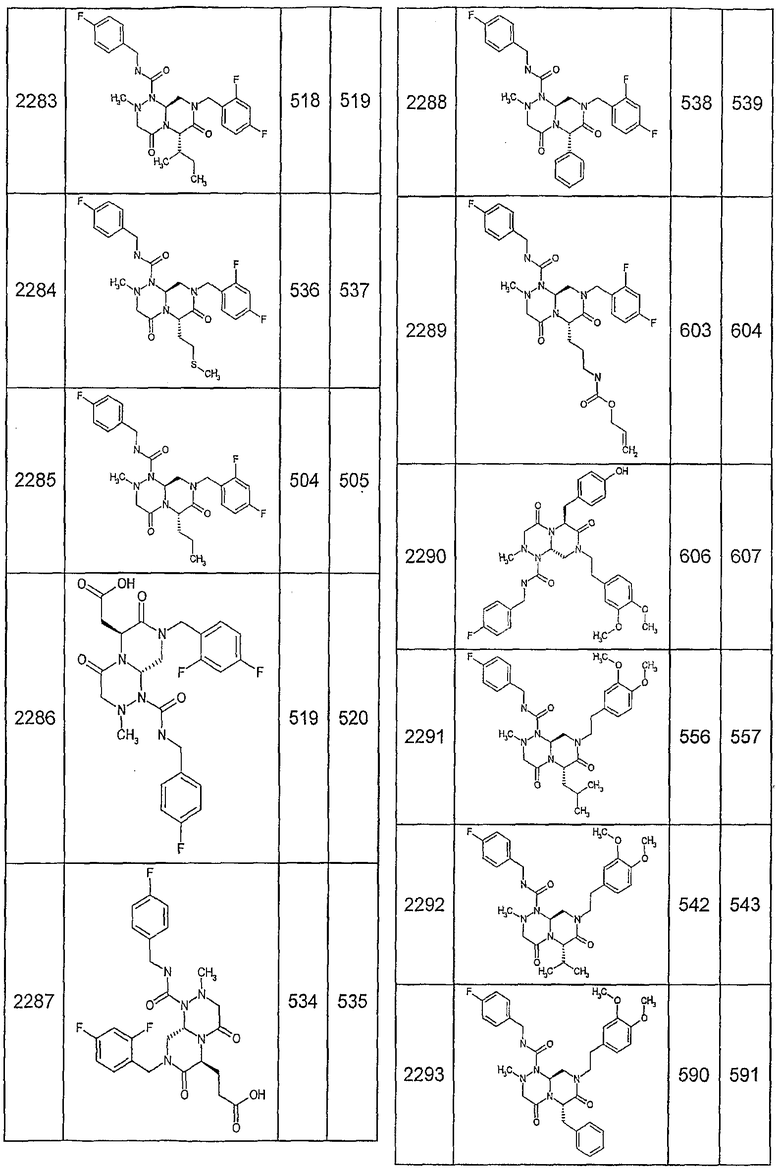

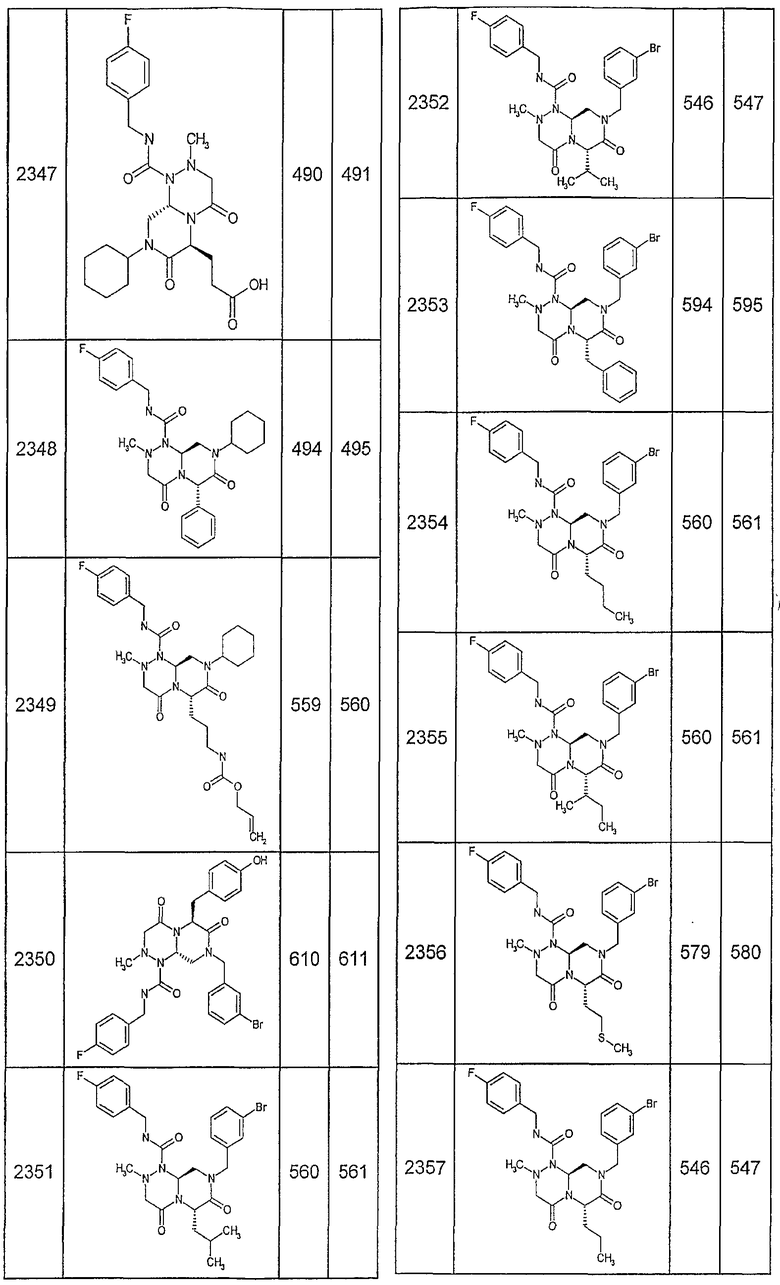
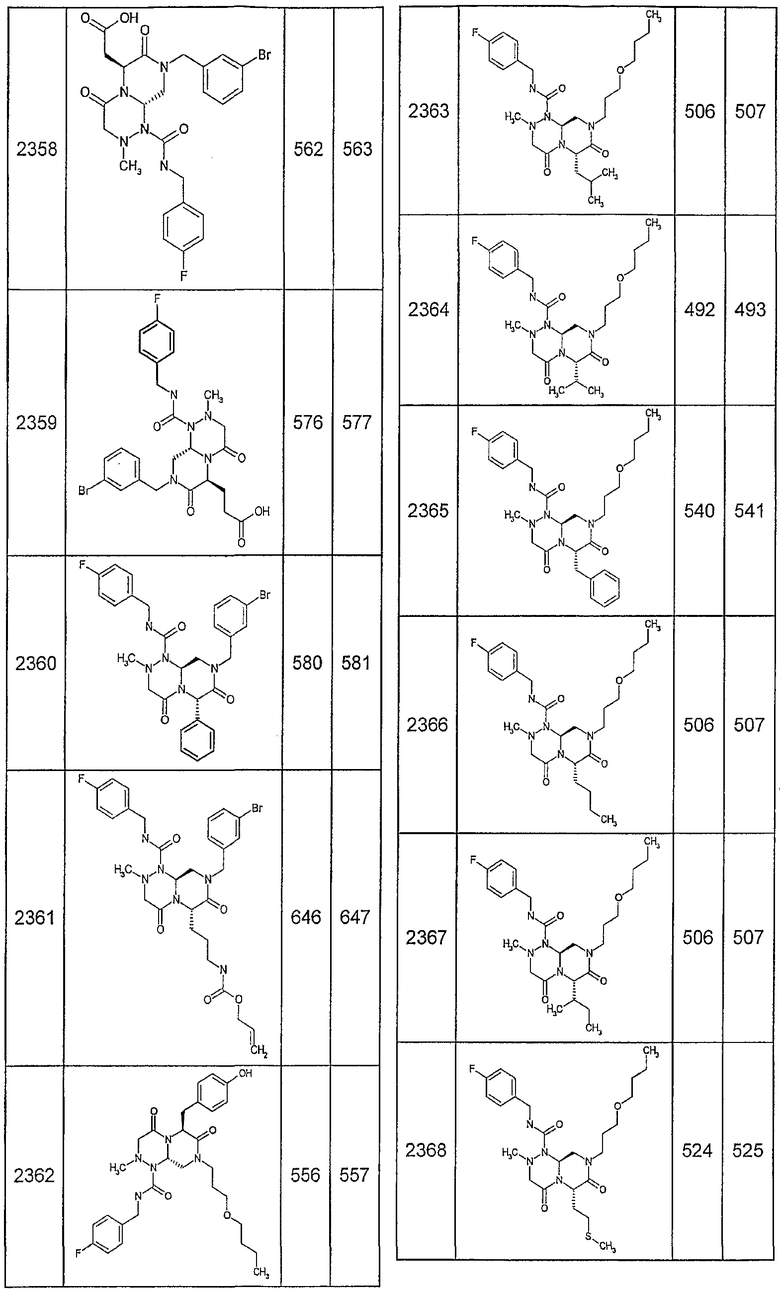
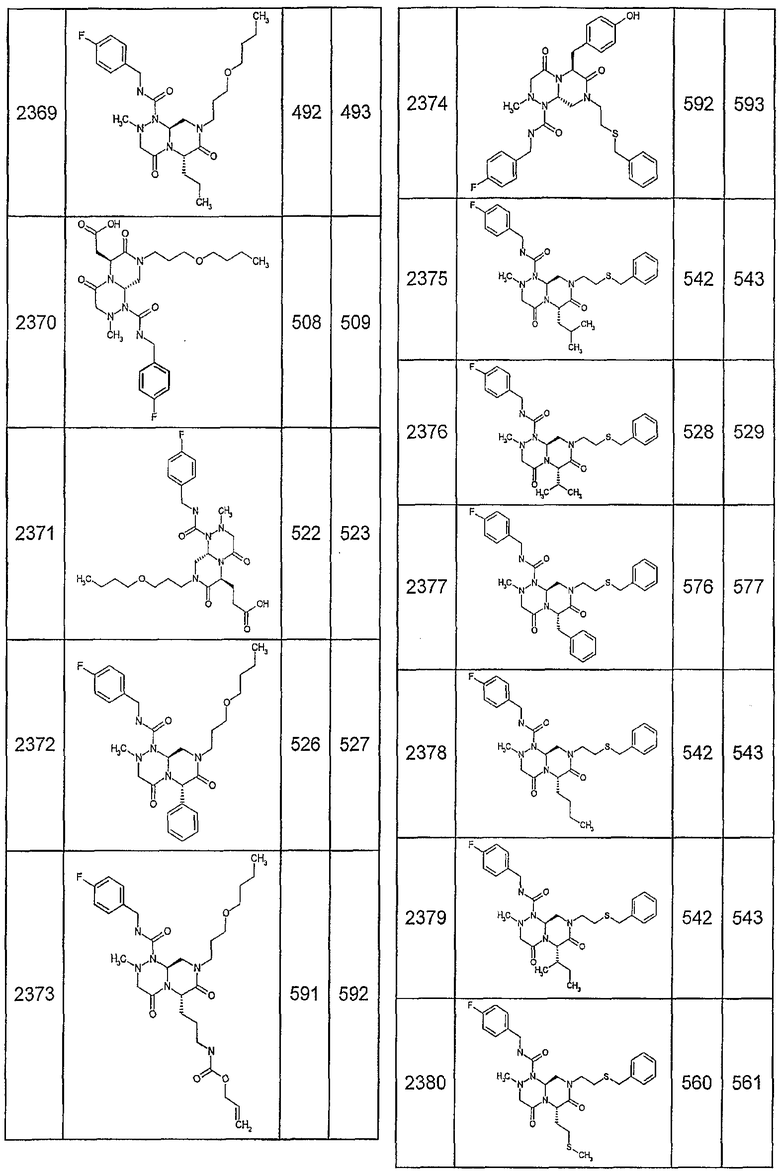
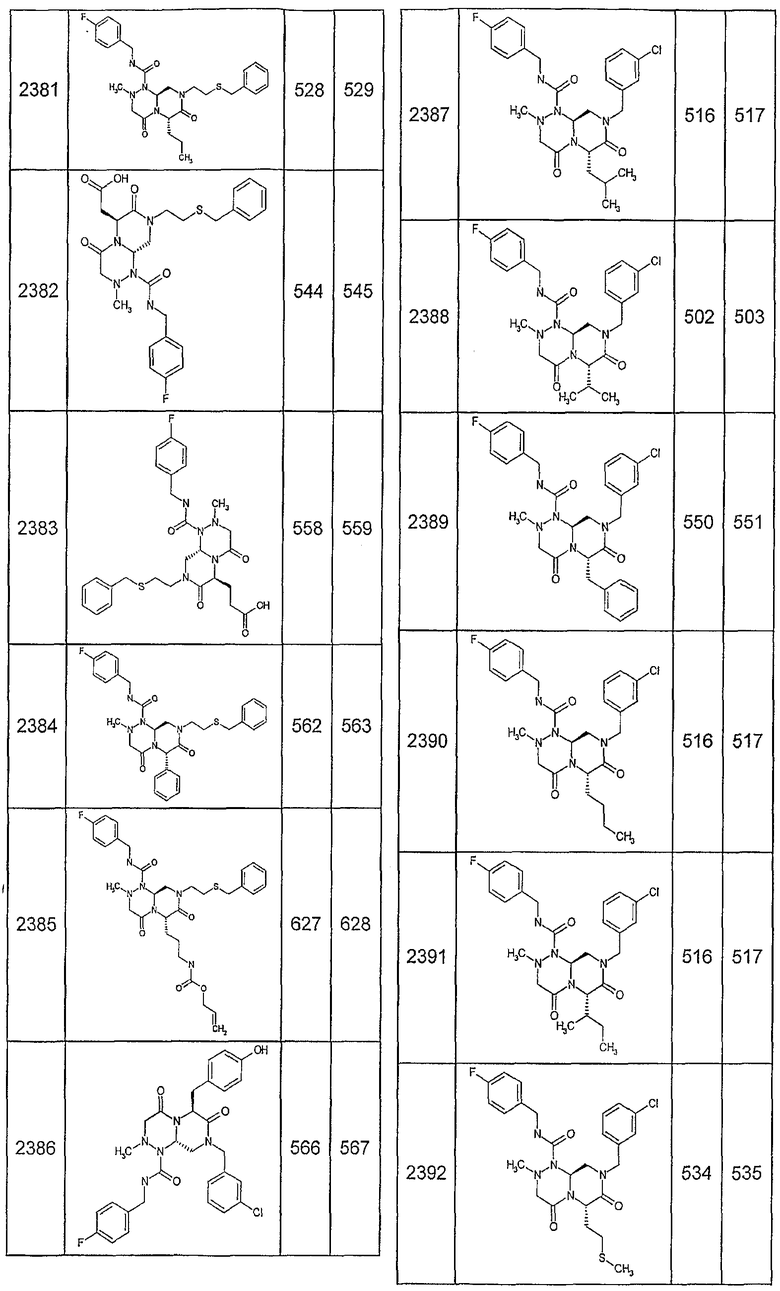
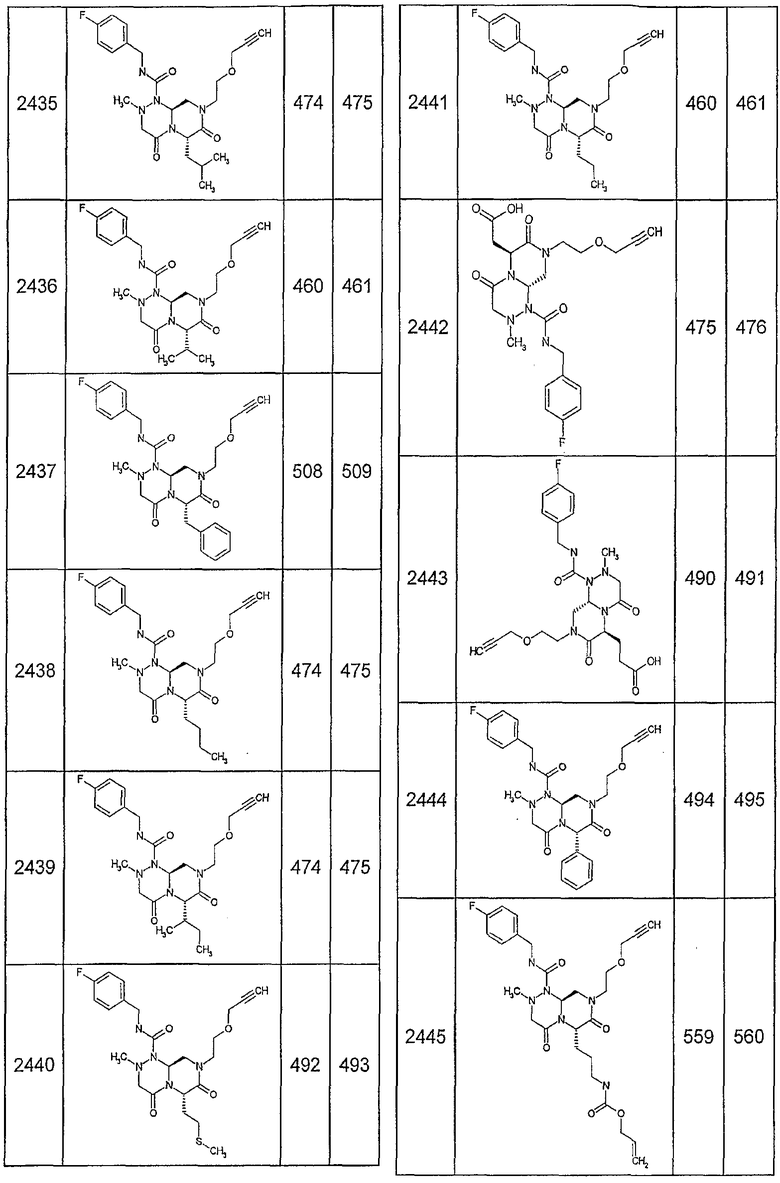
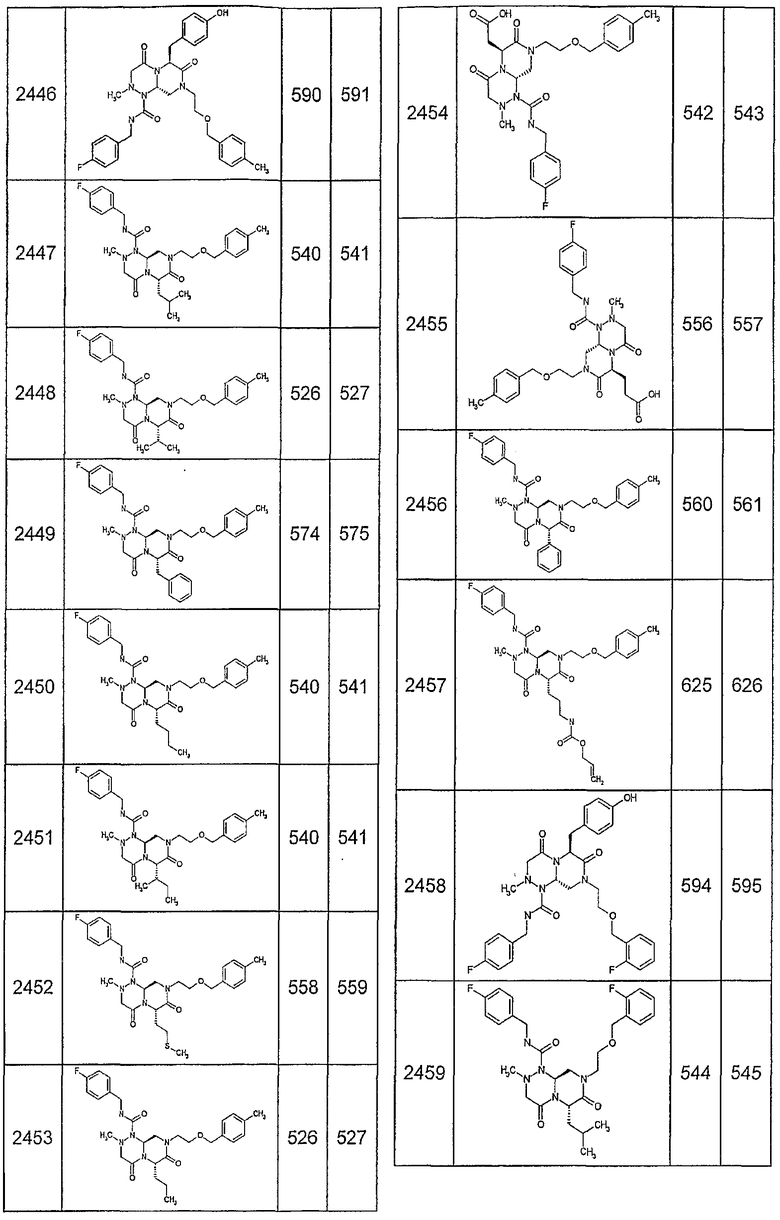
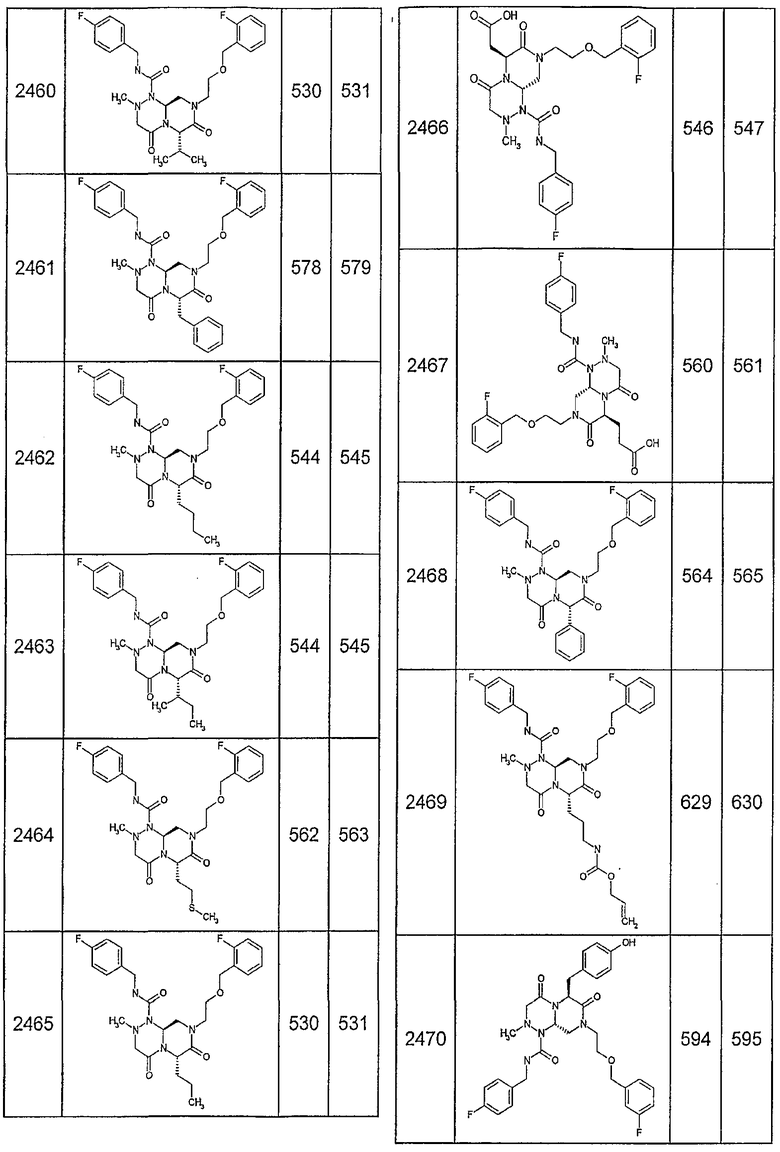
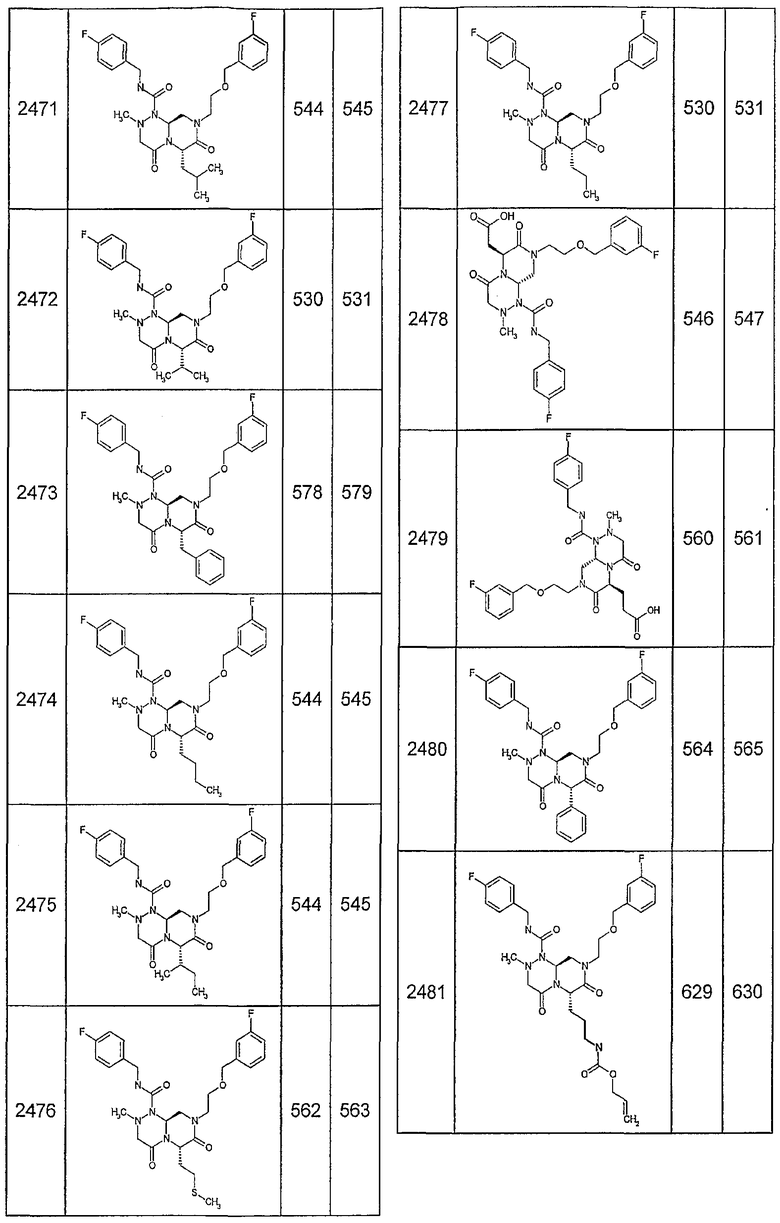

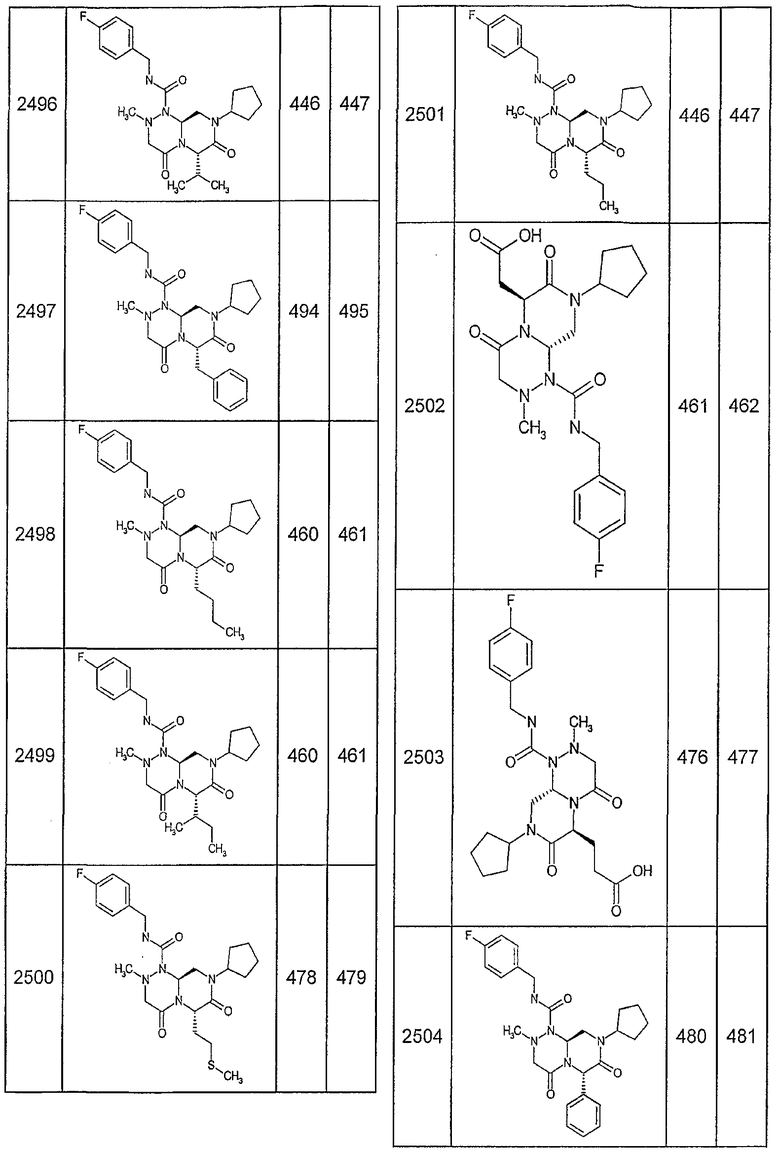
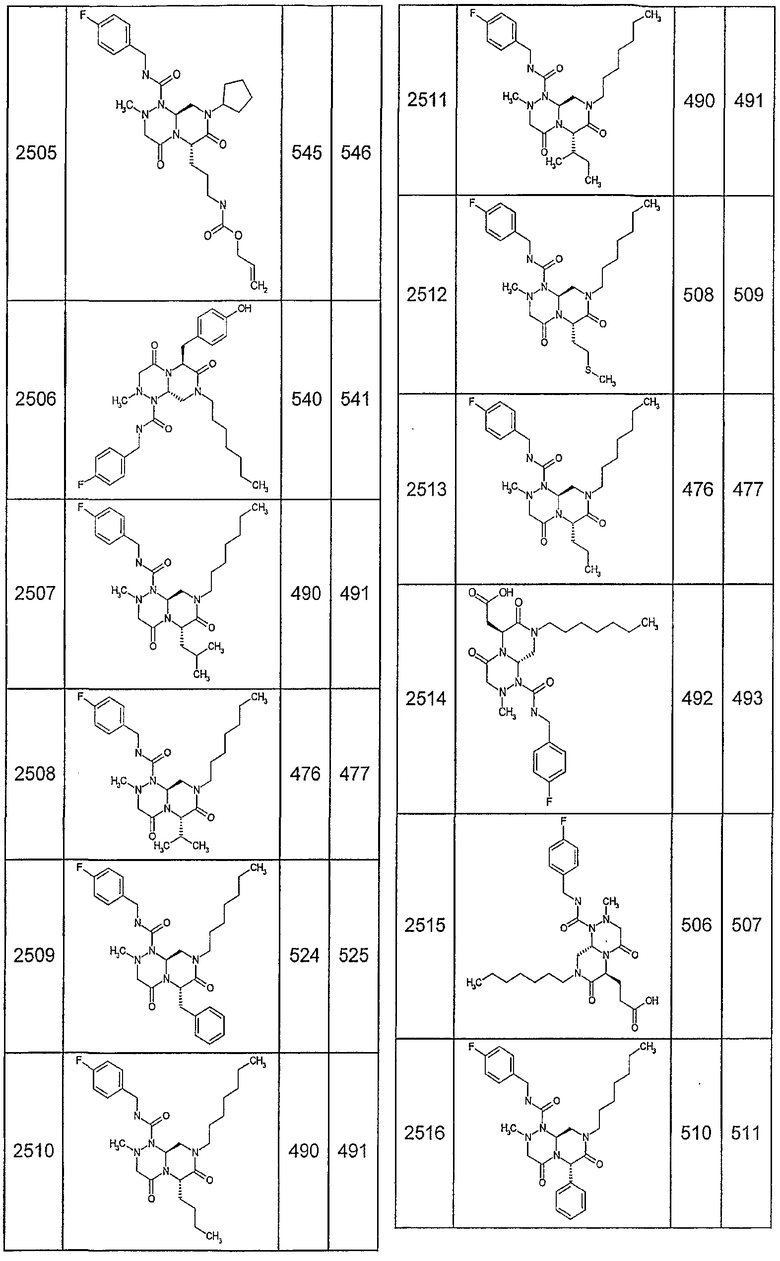
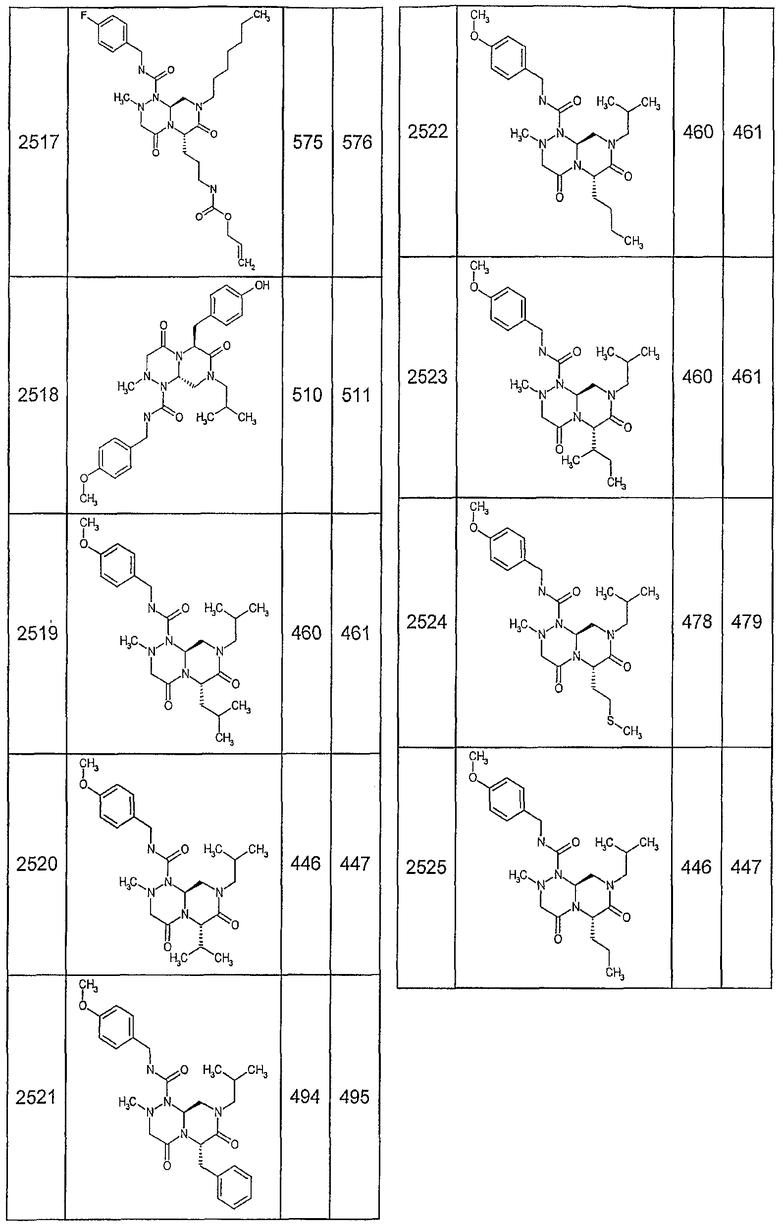
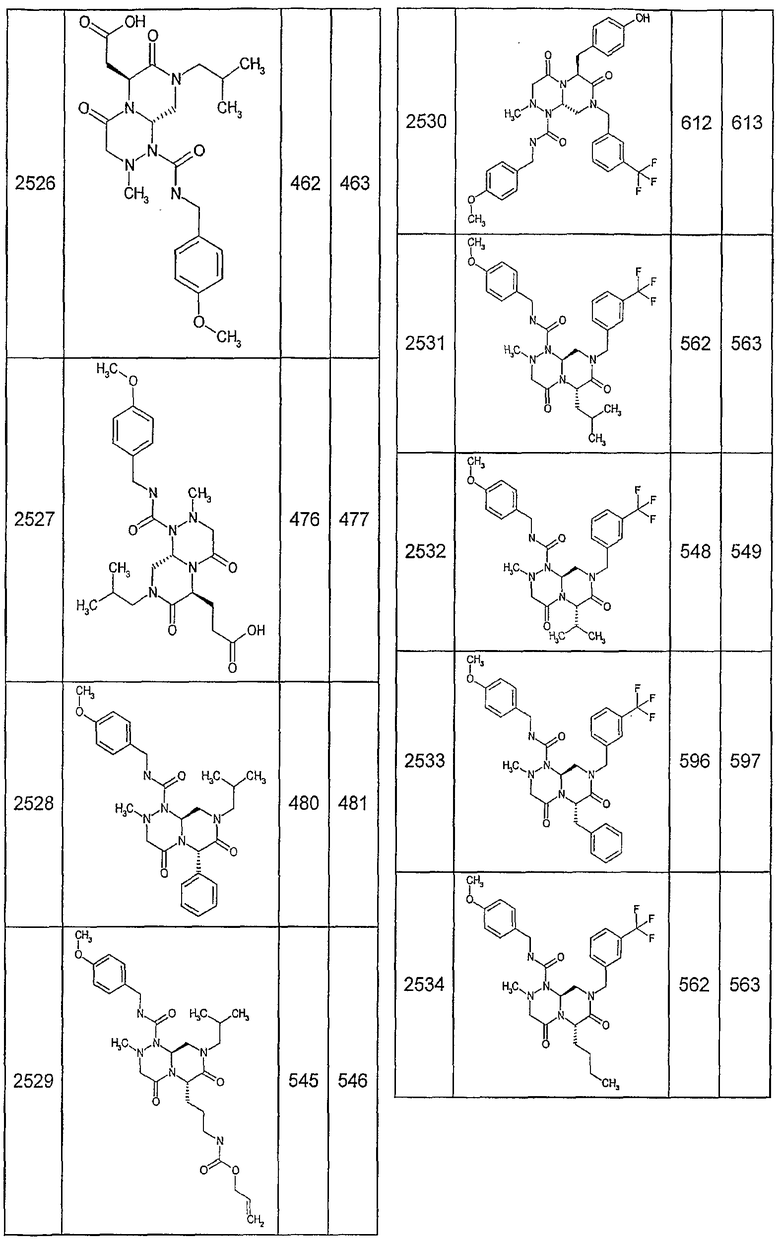
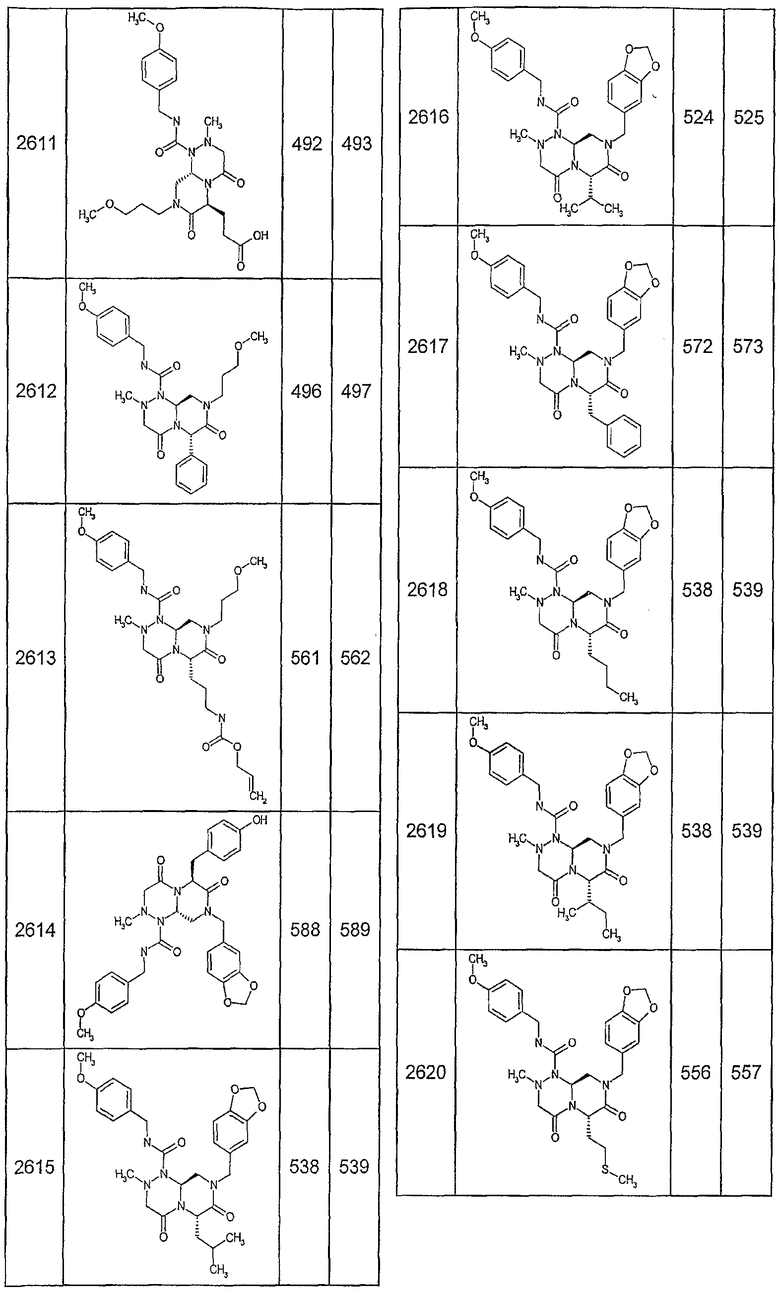
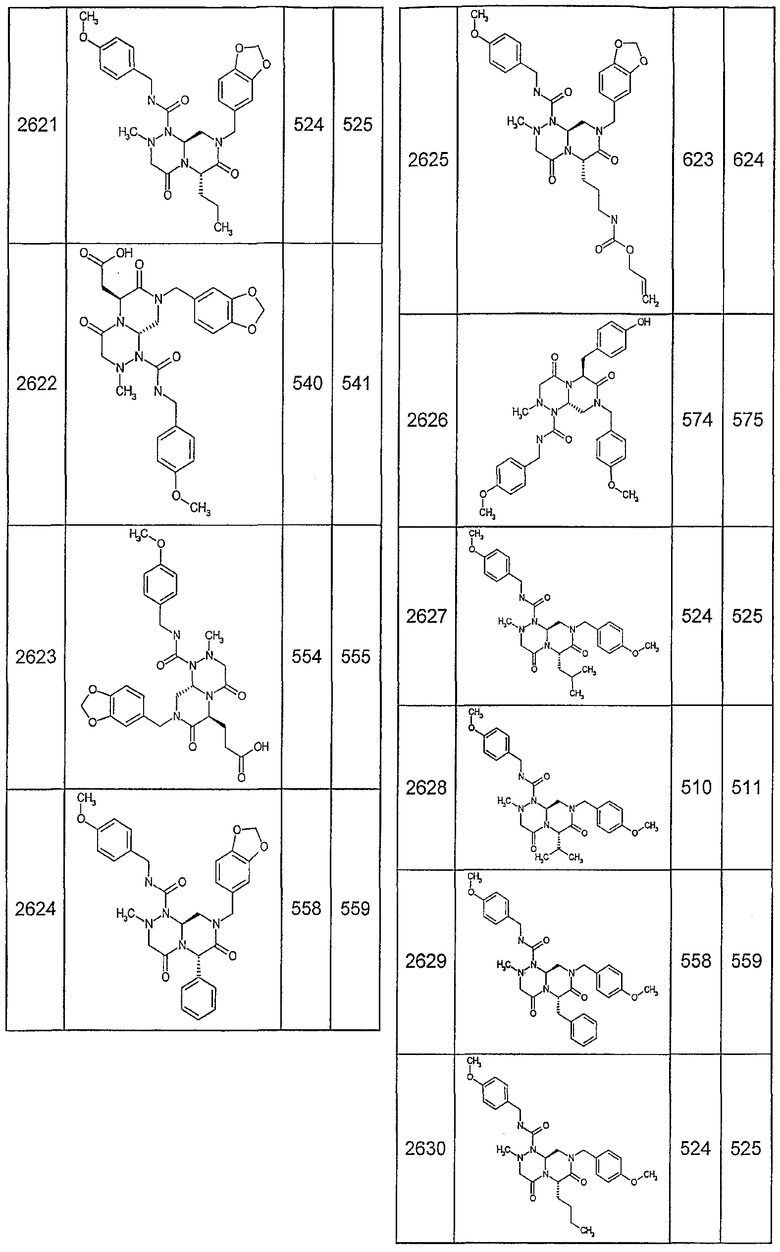
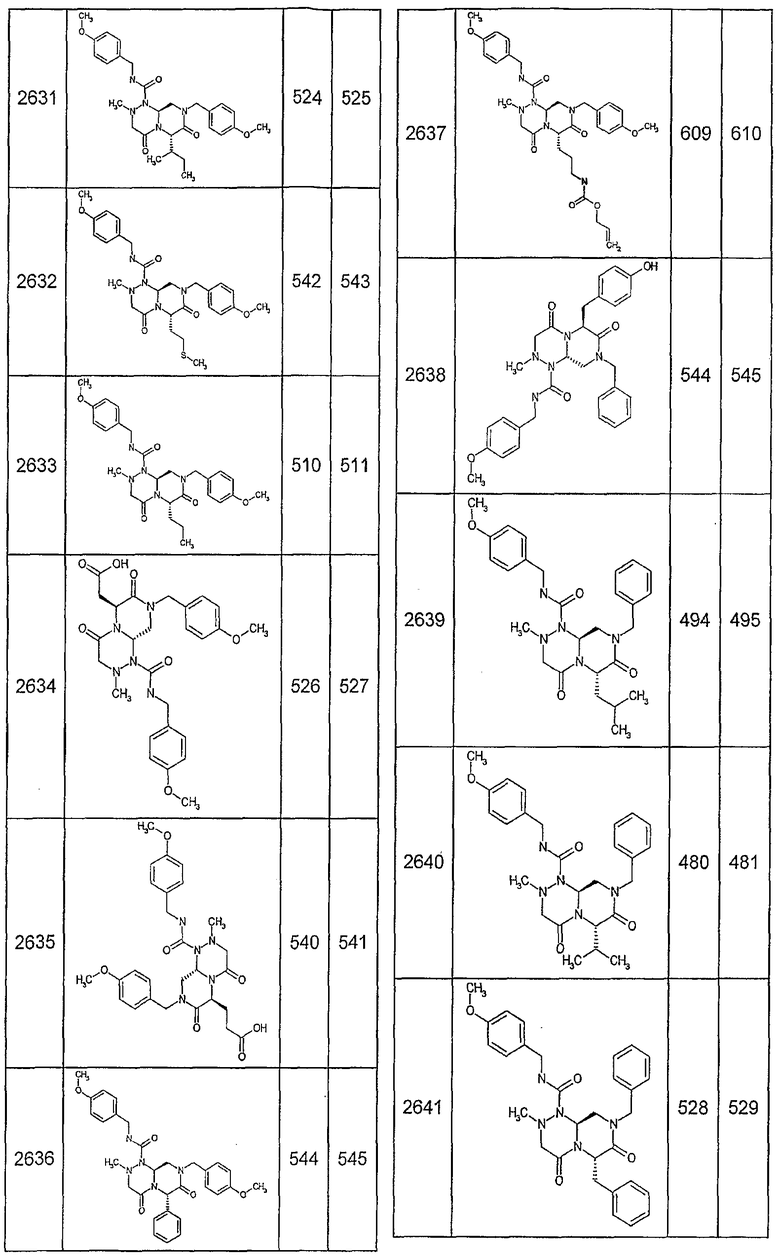
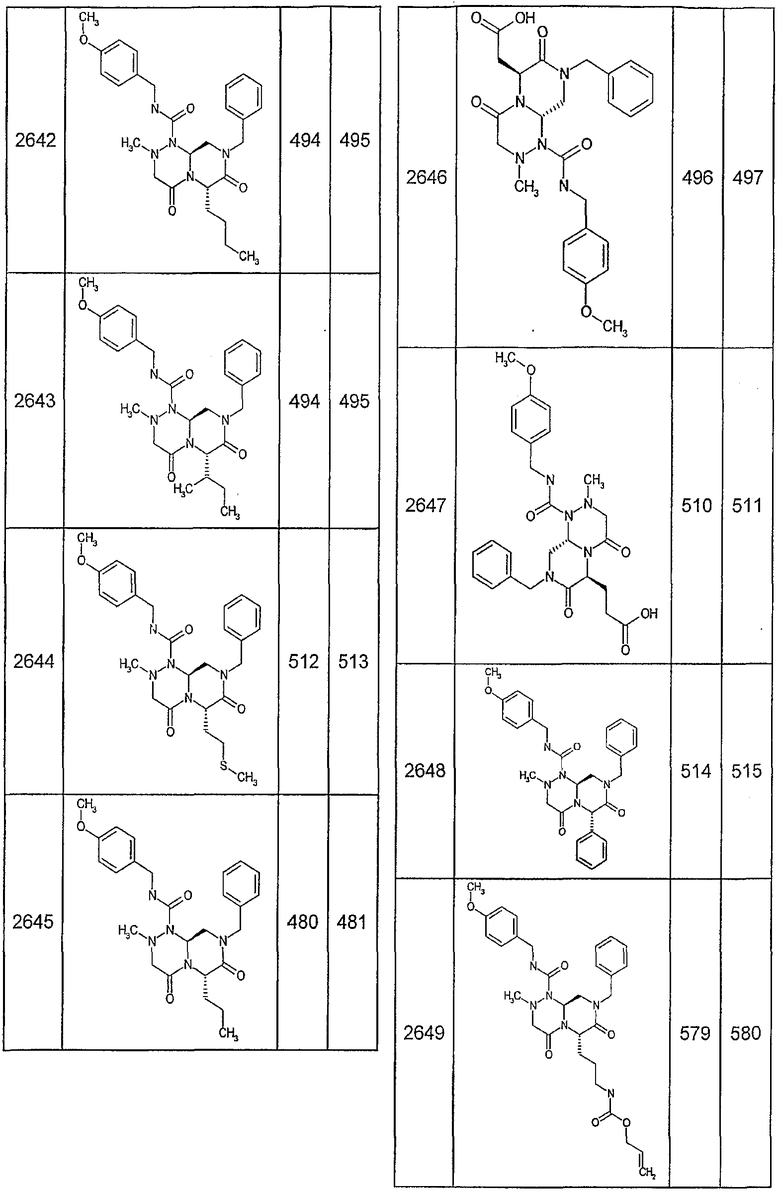
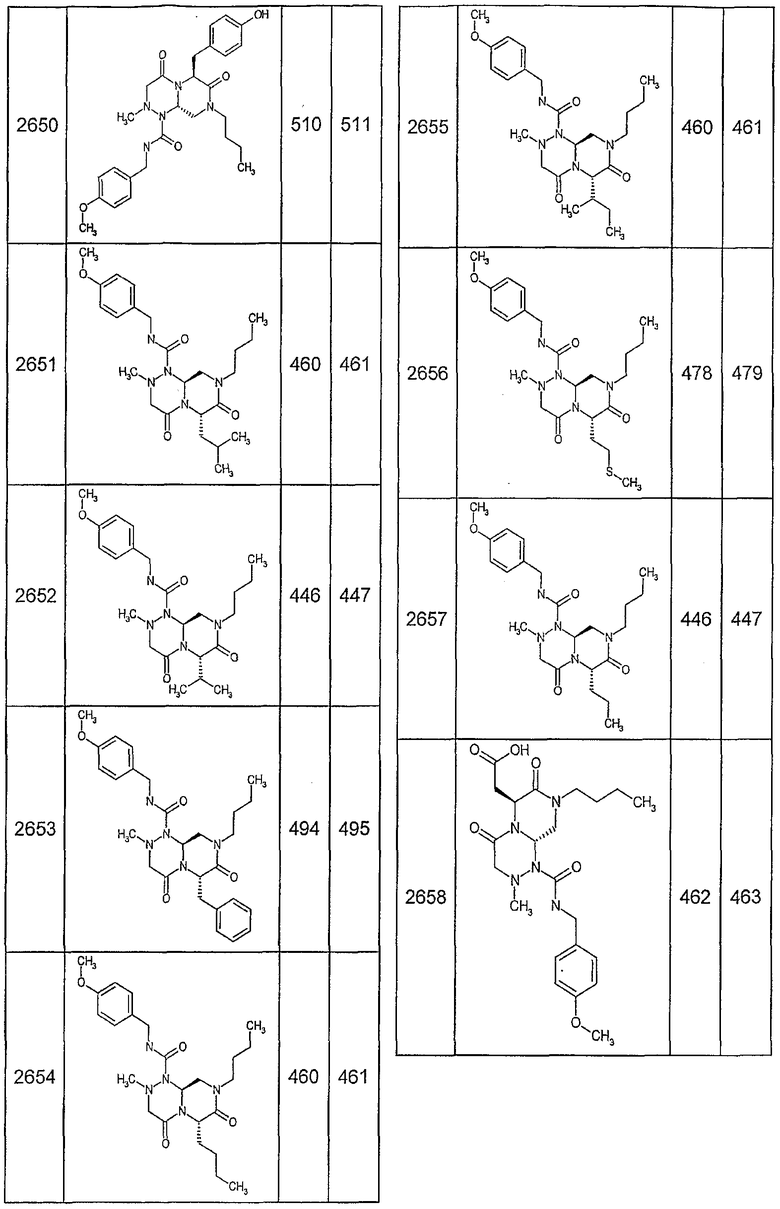
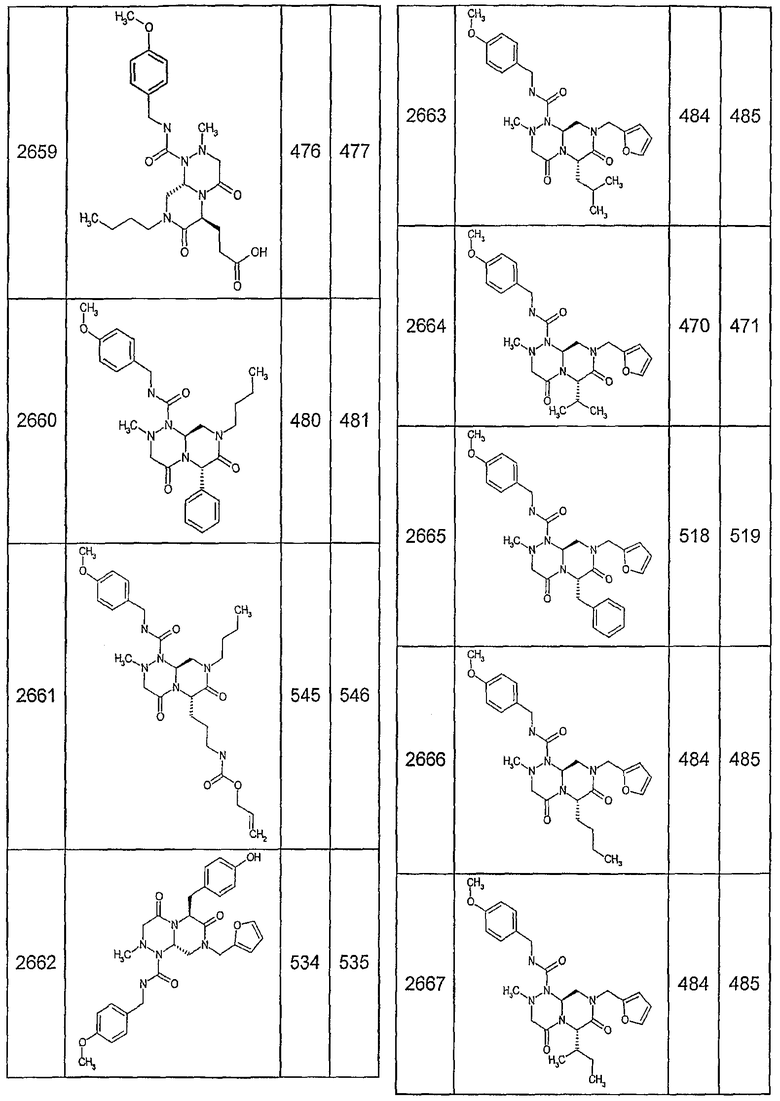
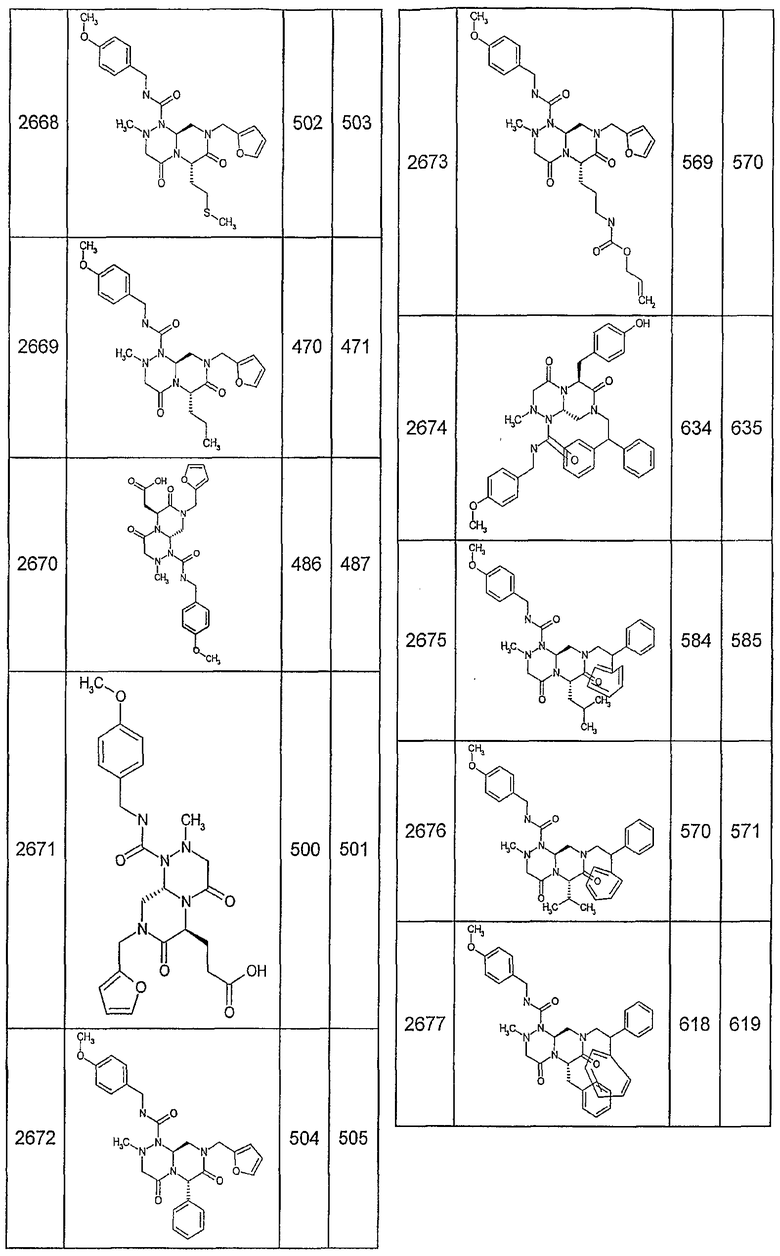
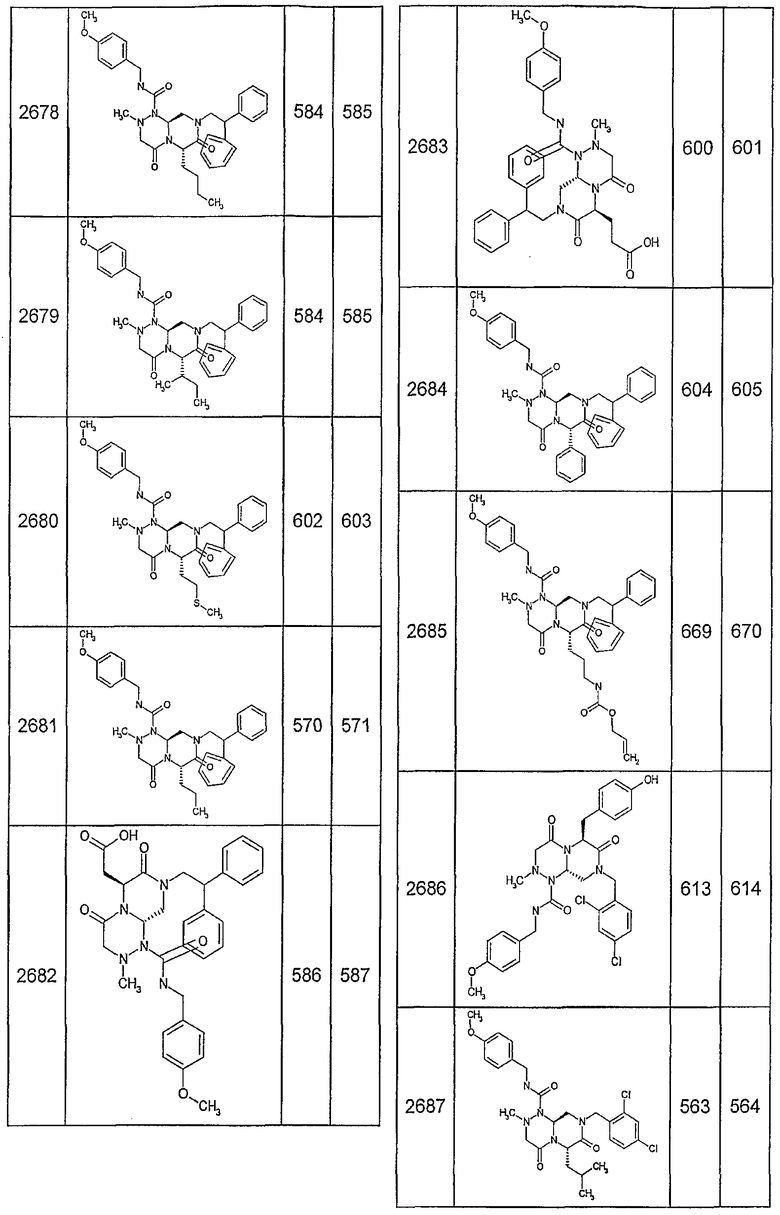
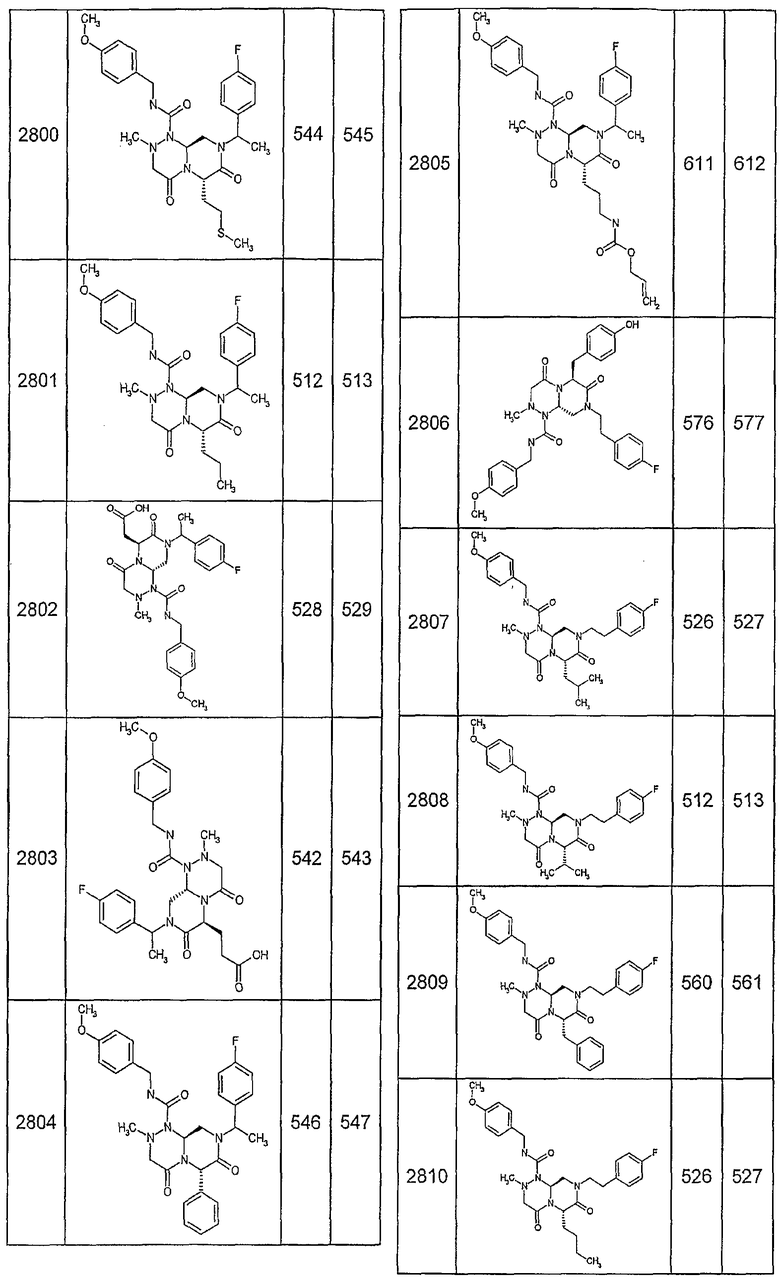

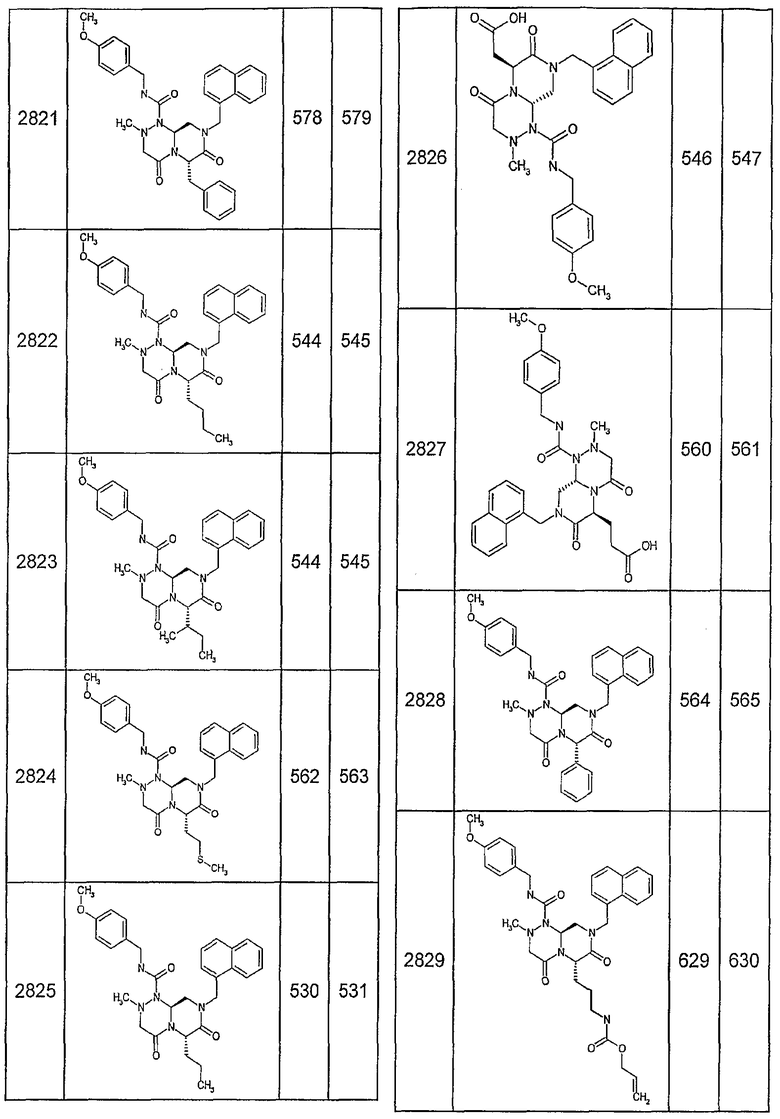
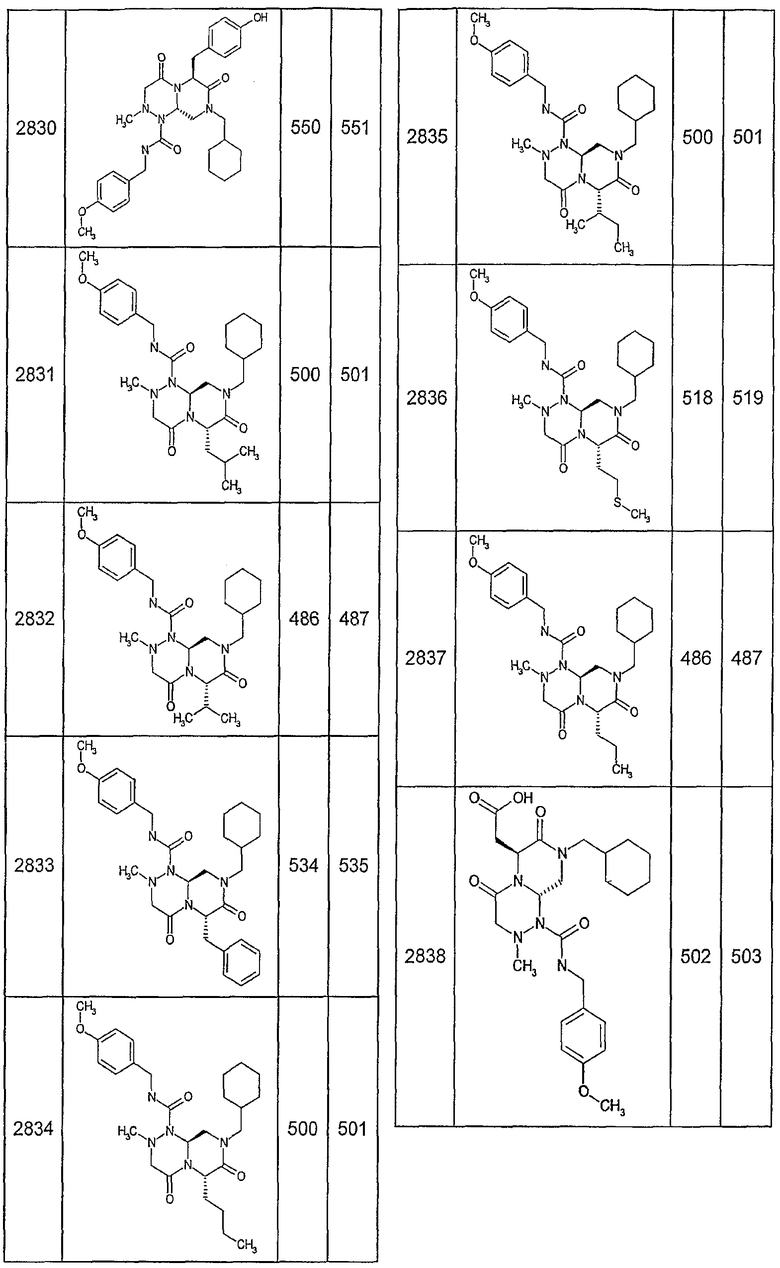
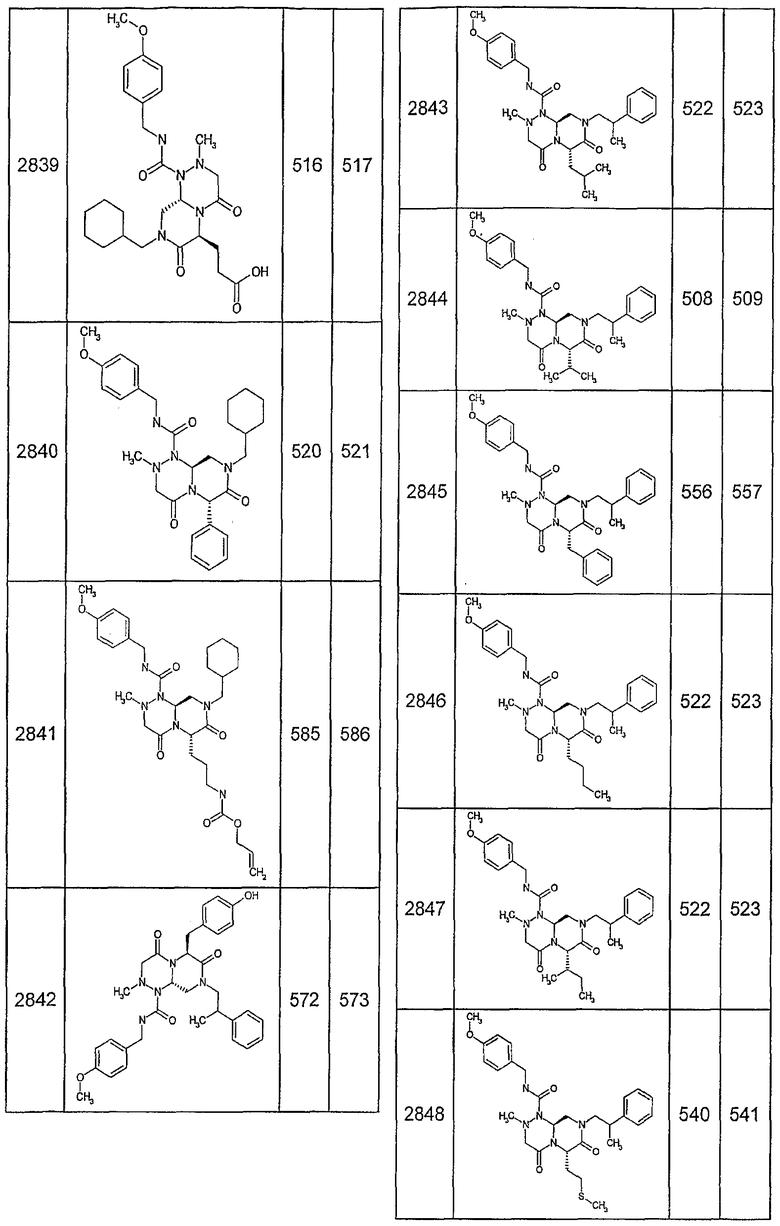
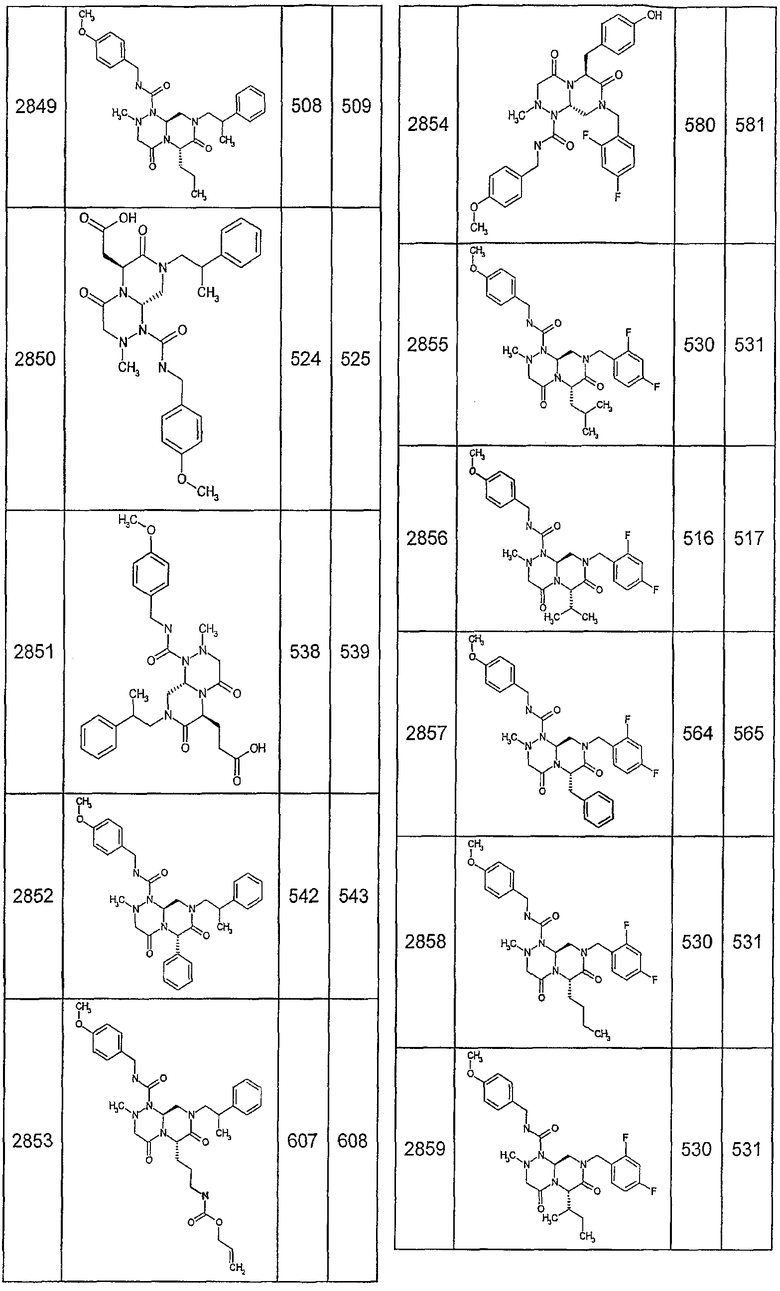
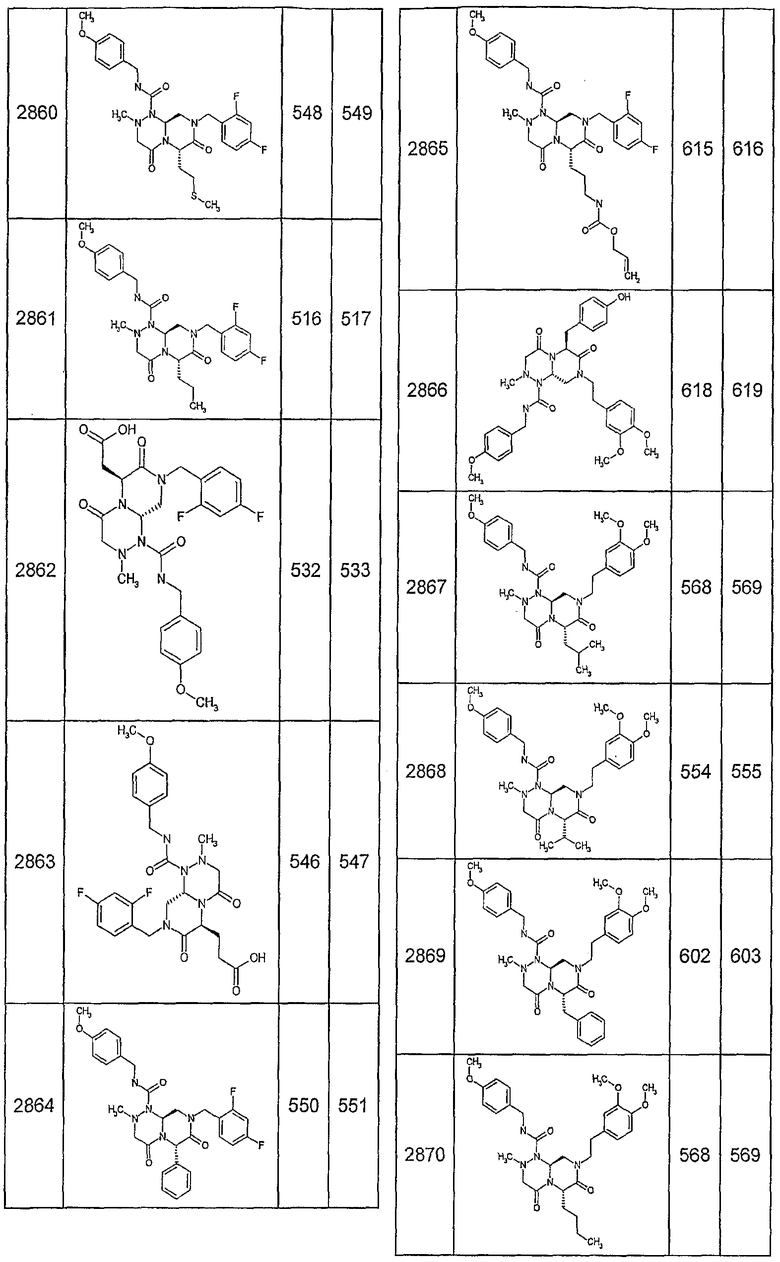
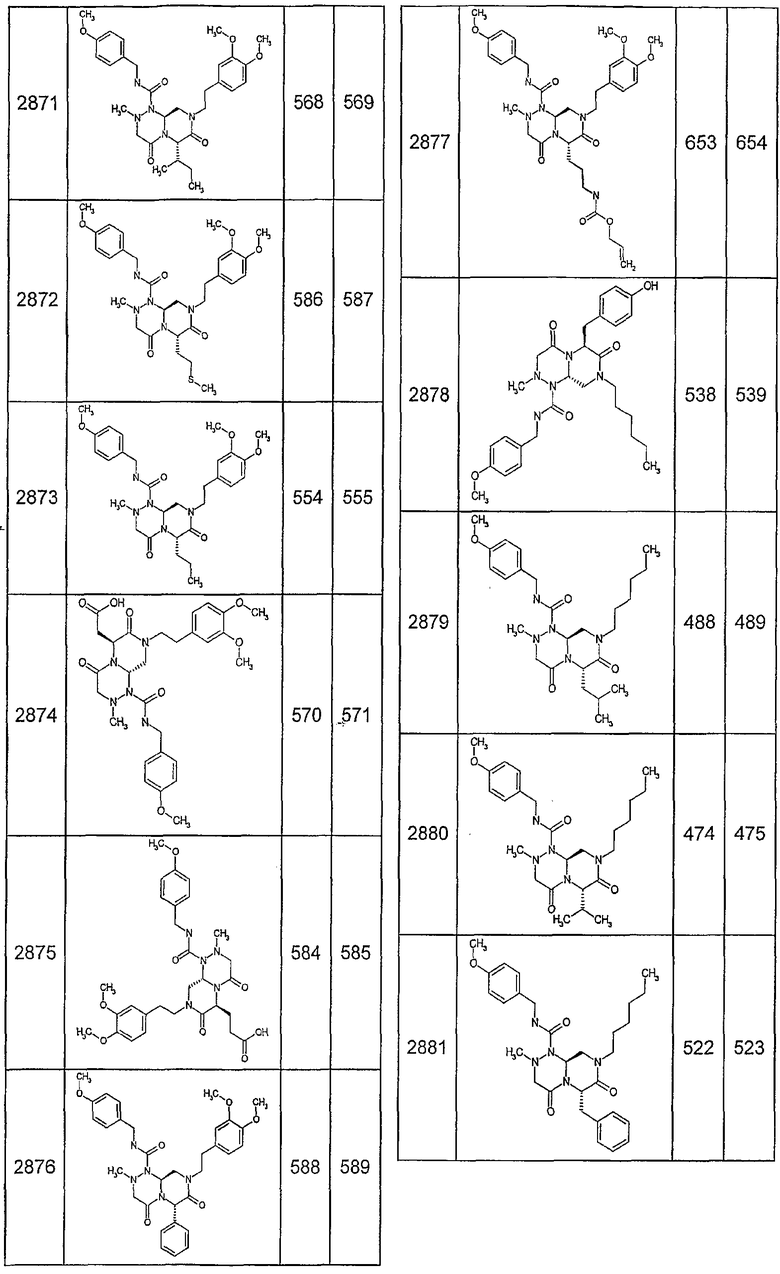
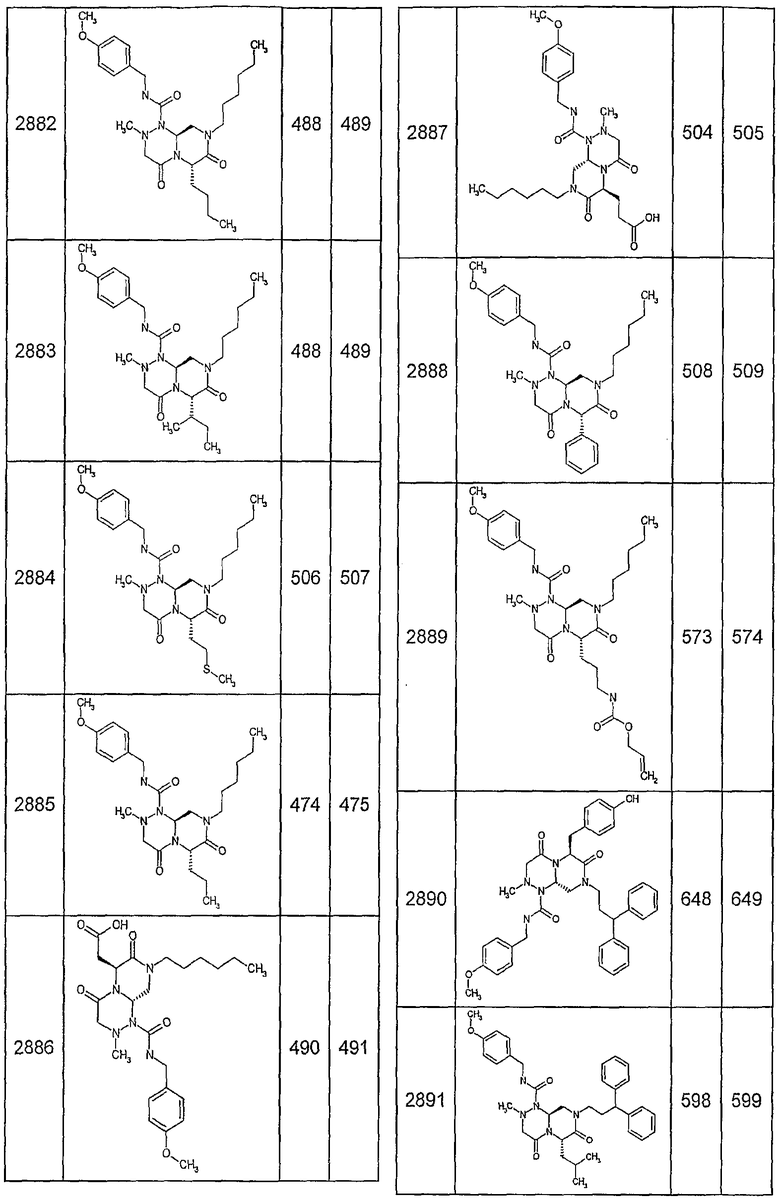
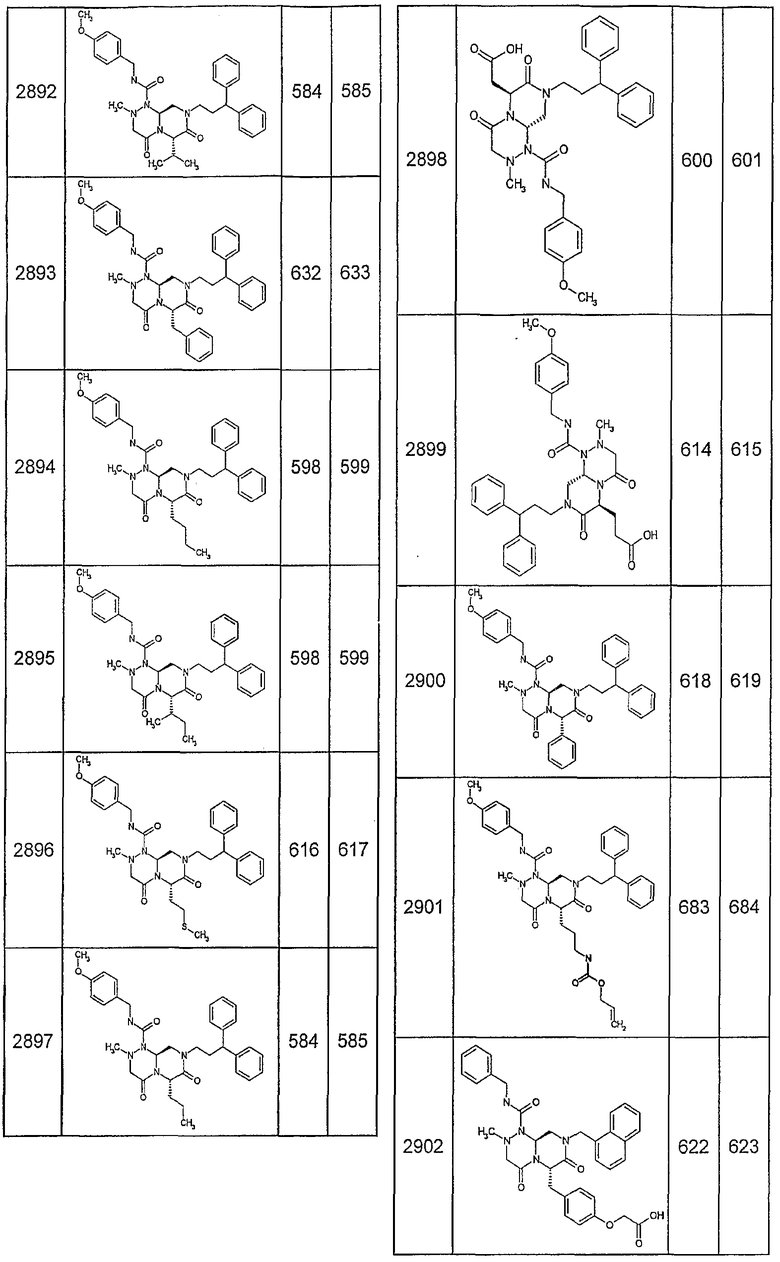
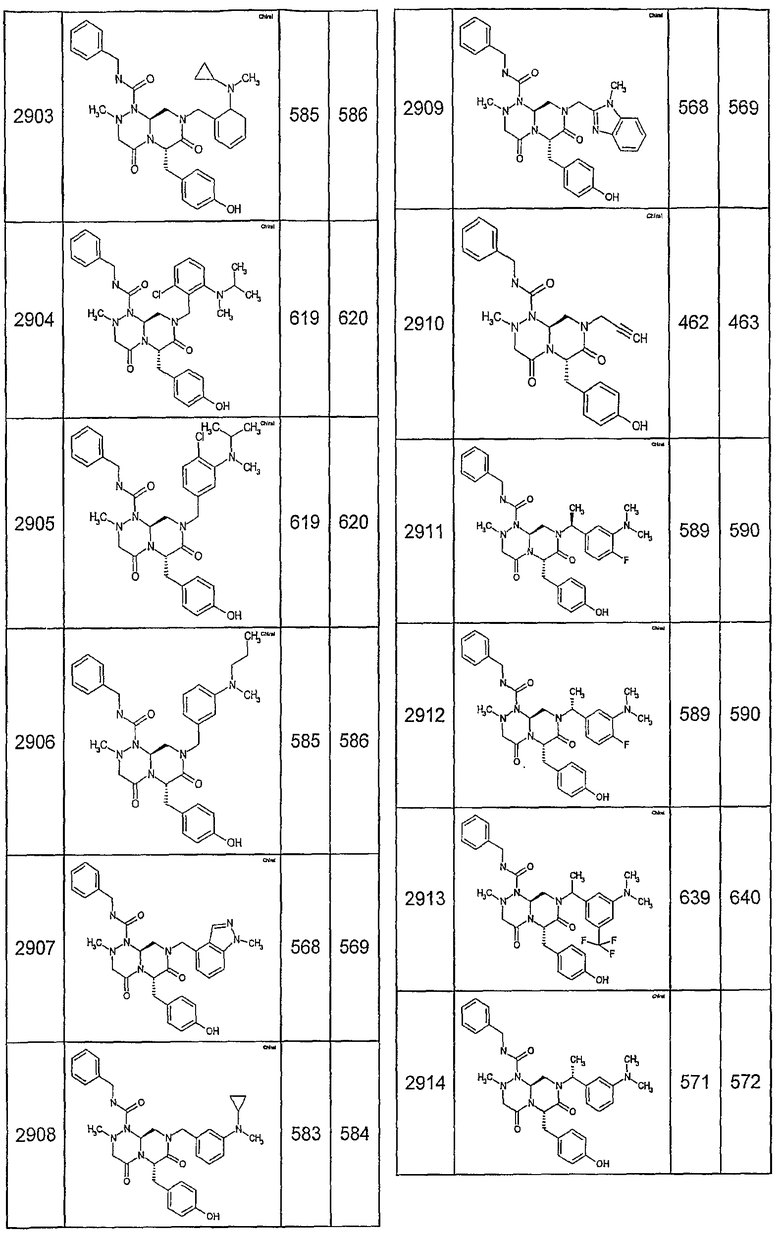
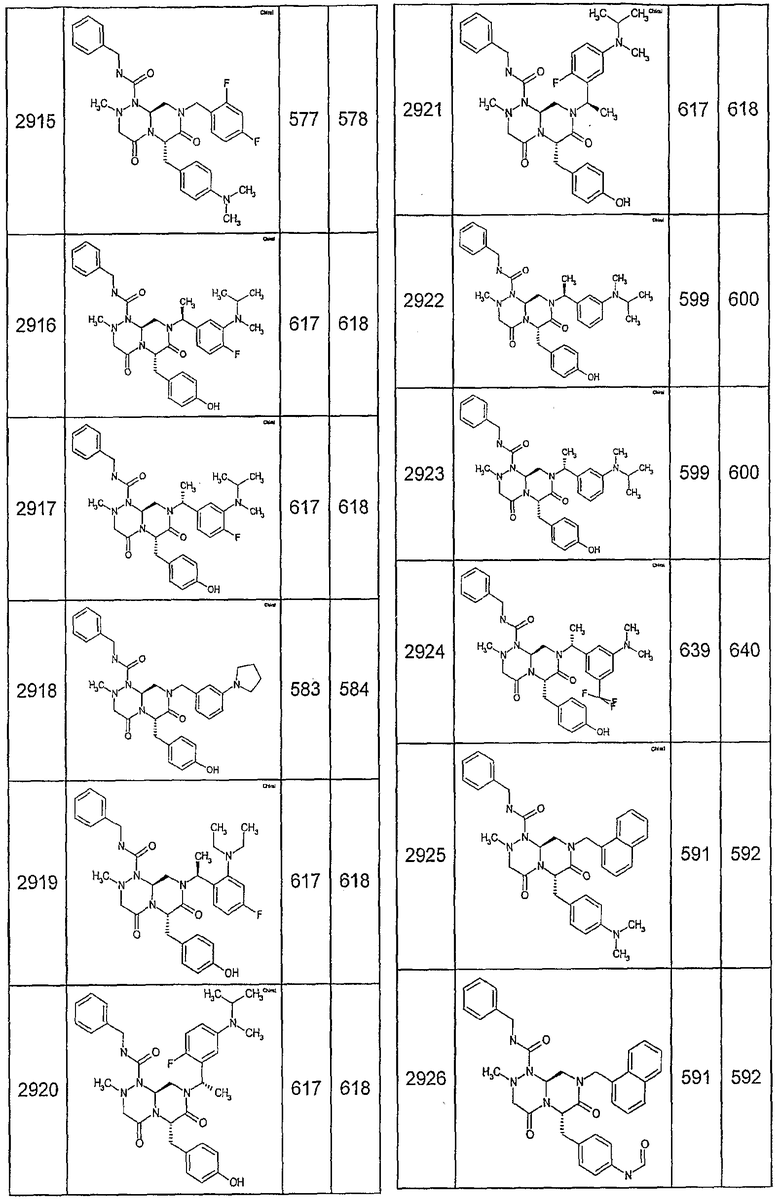
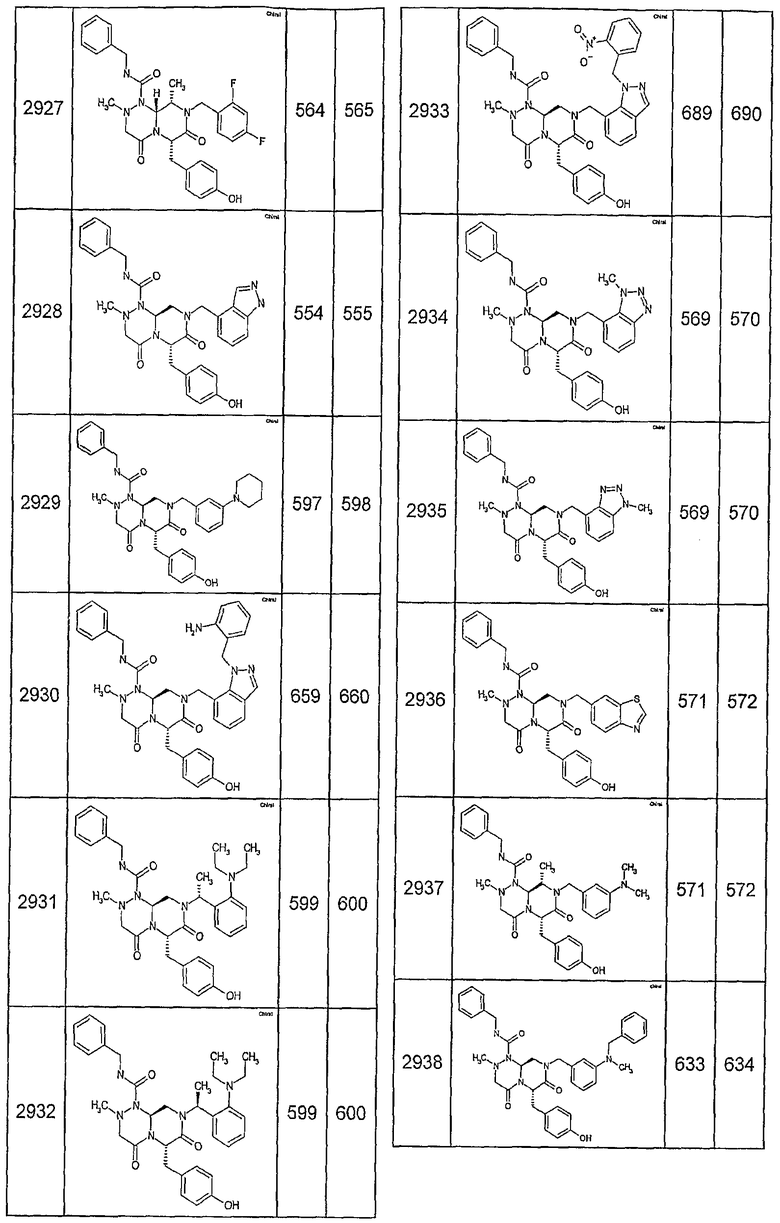
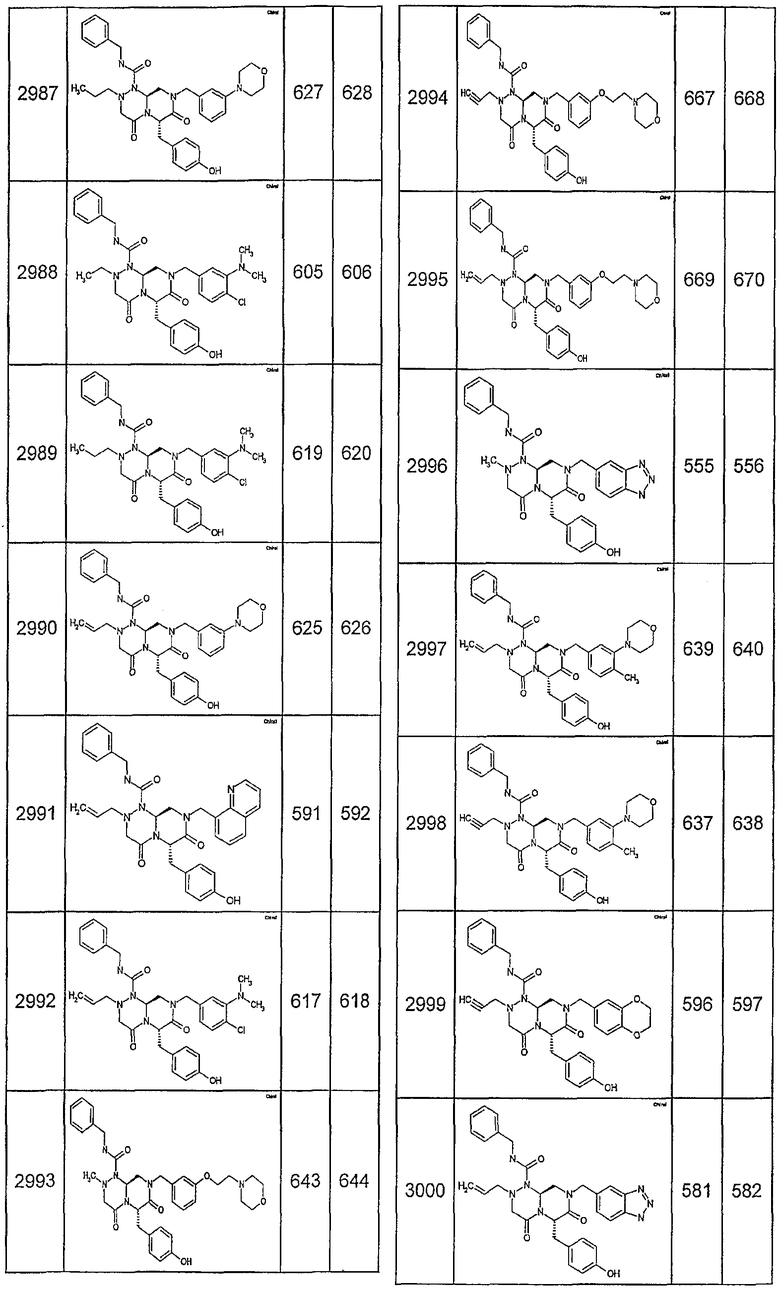
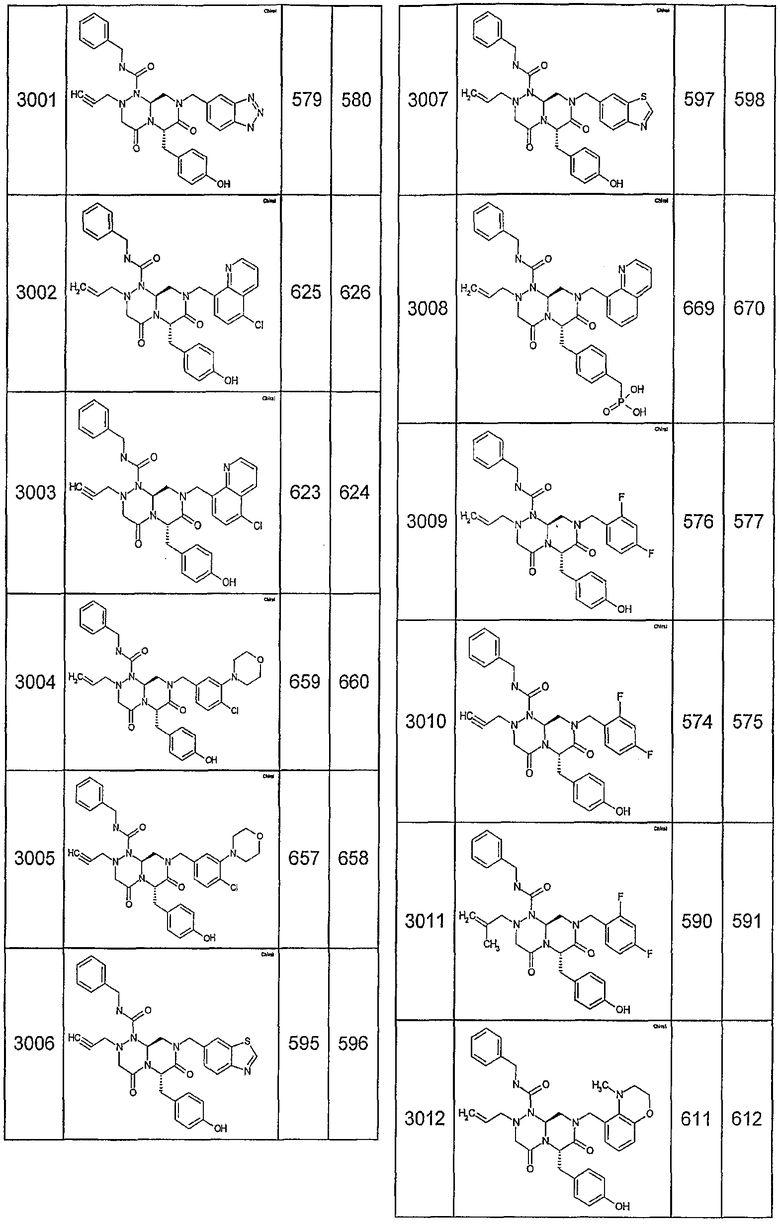
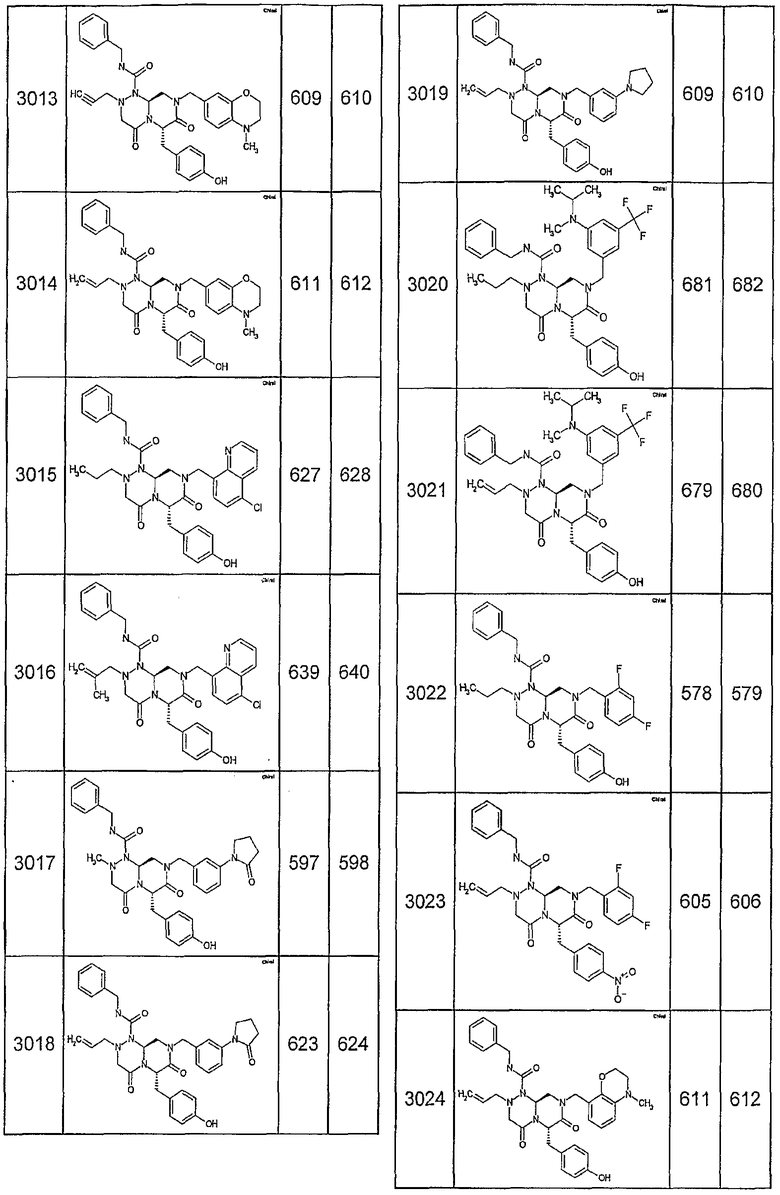
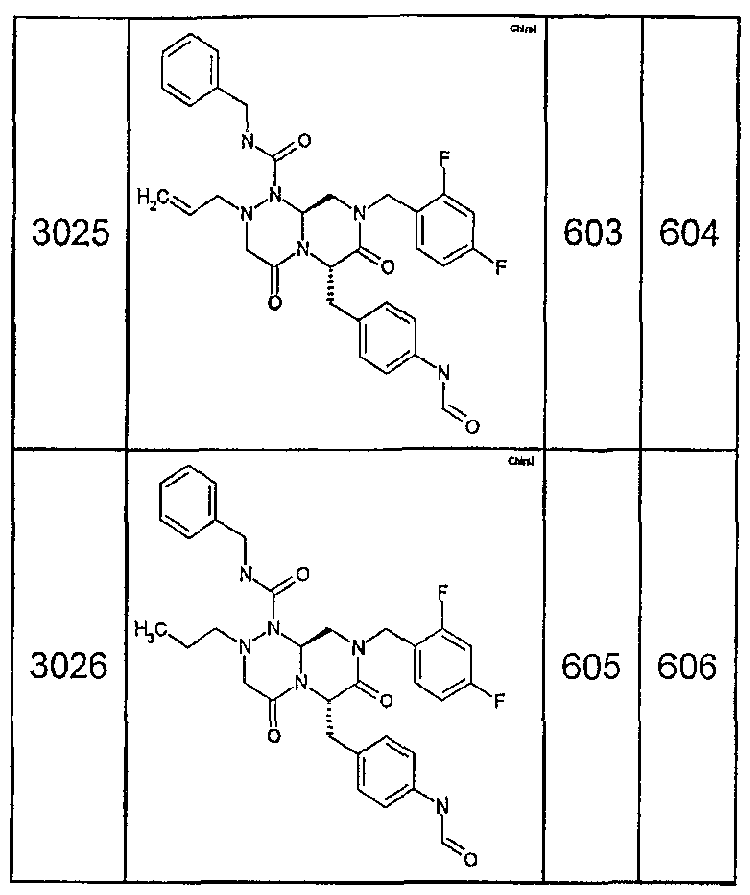
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДУЛЯЦИЯ БЕТА-КАТЕНИН/TCF-АКТИВИРУЕМОЙ ТРАНСКРИПЦИИ | 2004 |
|
RU2383547C2 |
| БЕТА-ЦЕПОЧЕЧНЫЕ МИМЕТИКИ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2003 |
|
RU2333213C2 |
| НОВЫЕ СОЕДИНЕНИЯ МИМЕТИКИ ОБРАТНОГО ПОВОРОТА И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2457210C2 |
| АЛЬФА-СПИРАЛЬНЫЕ МИМЕТИКИ И СПОСОБЫ, СВЯЗАННЫЕ С НИМИ | 2009 |
|
RU2512538C2 |
| НОВЫЕ СОЕДИНЕНИЯ, ПРЕДСТАВЛЯЮЩИЕ СОБОЙ МИМЕТИКИ ОБРАТНОГО ПОВОРОТА, И ИХ ПРИМЕНЕНИЕ (3) | 2008 |
|
RU2470024C2 |
| МИМЕТИКИ С ОБРАТНОЙ КОНФИГУРАЦИЕЙ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2005 |
|
RU2434017C2 |
| ПЕПТИДНЫЕ ЭПОКСИКЕТОНЫ ДЛЯ ИНГИБИРОВАНИЯ ПРОТЕАСОМЫ | 2007 |
|
RU2450016C2 |
| ПРОТИВОРАКОВОЕ СРЕДСТВО | 2016 |
|
RU2729936C2 |
| КОНЪЮГАТ, СОДЕРЖАЩИЙ ЛИГАНД РЕЦЕПТОРОВ НЕЙРОТЕНЗИНА, И ЕГО ПРИМЕНЕНИЕ | 2015 |
|
RU2743781C2 |
| ПТЕРИДИНЫ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ HCV, И СПОСОБЫ ПОЛУЧЕНИЯ ПТЕРИДИНОВ | 2006 |
|
RU2447074C2 |
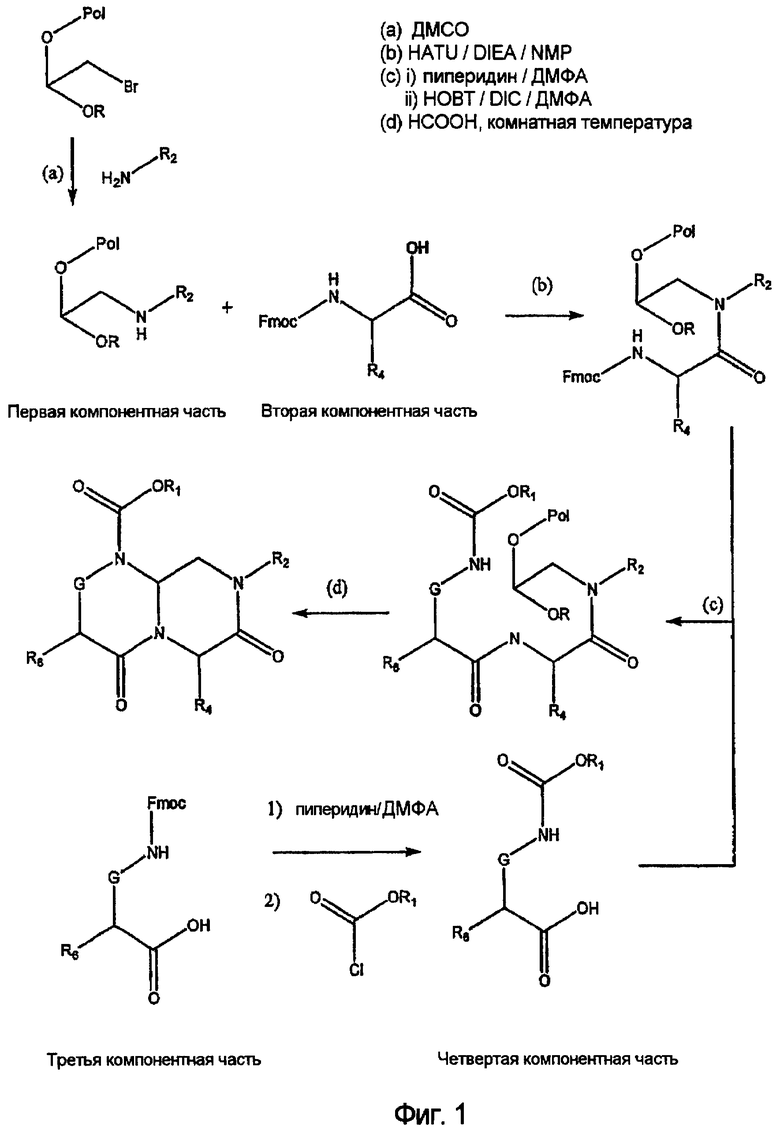
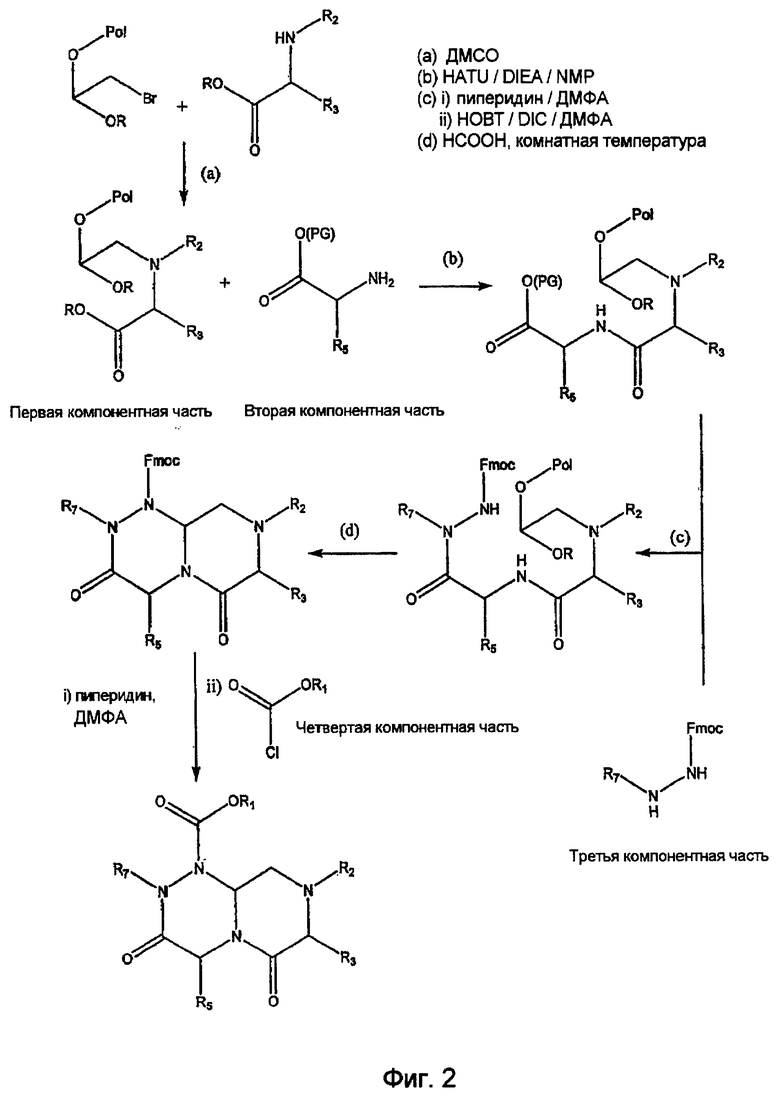
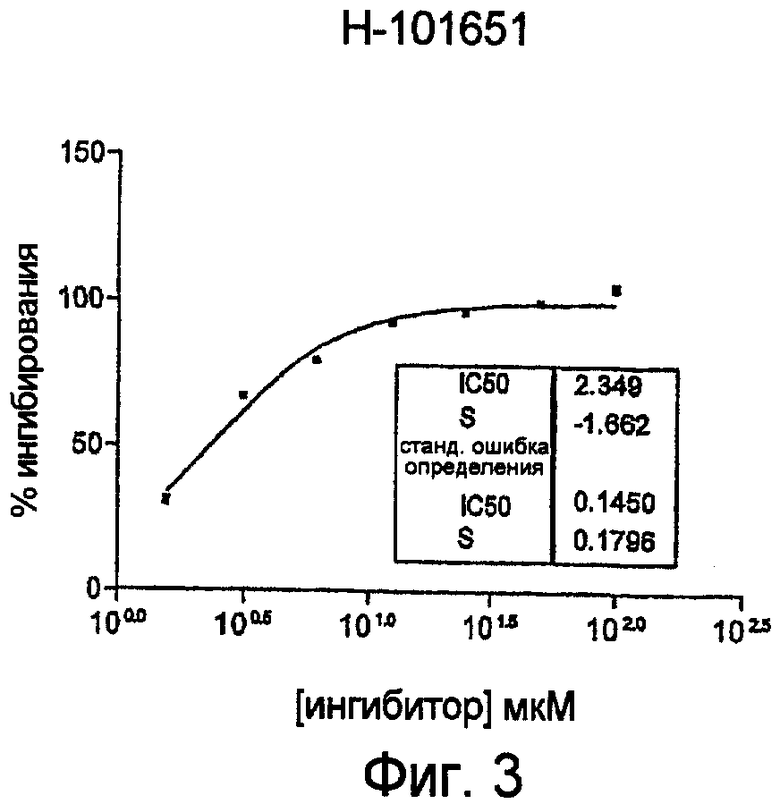





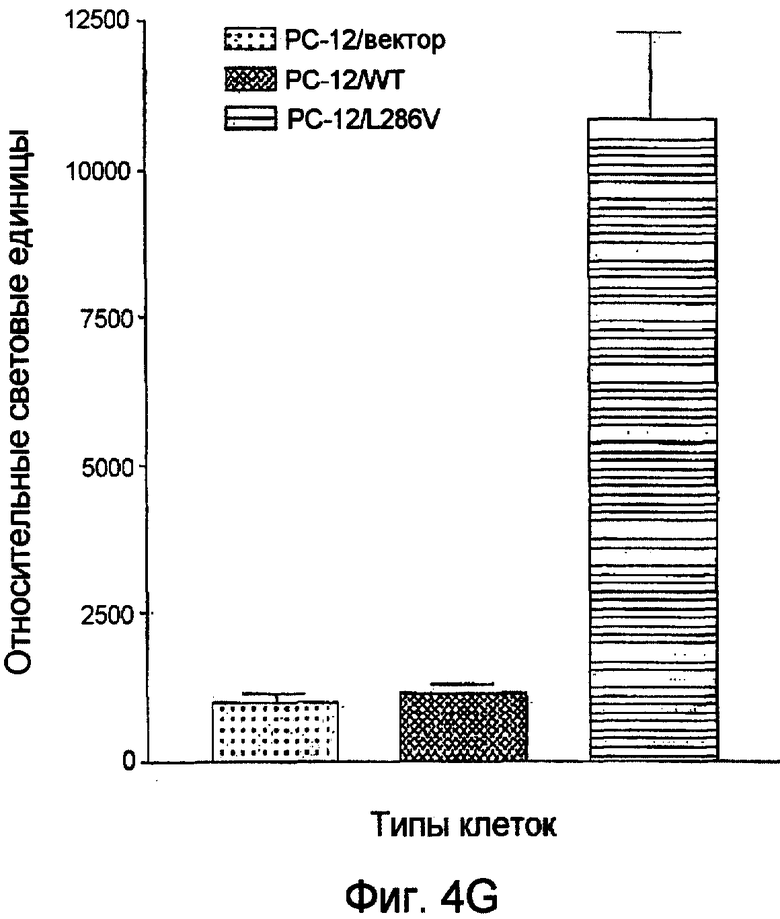
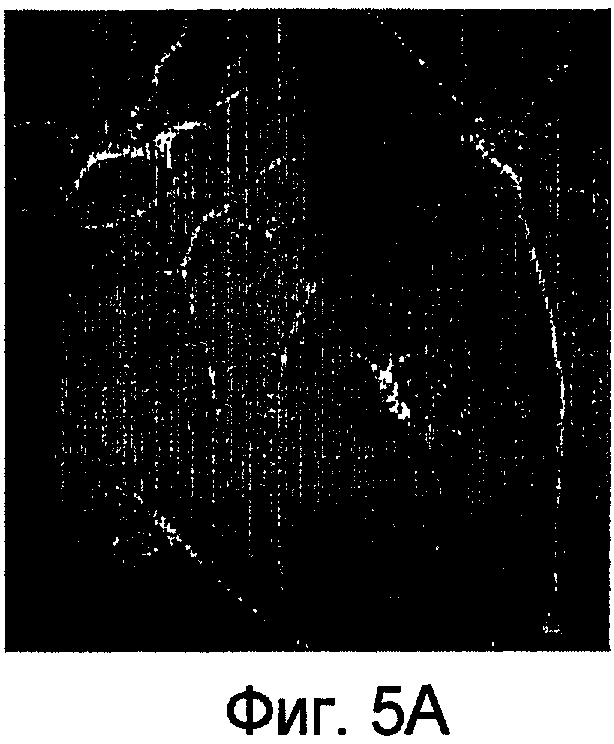
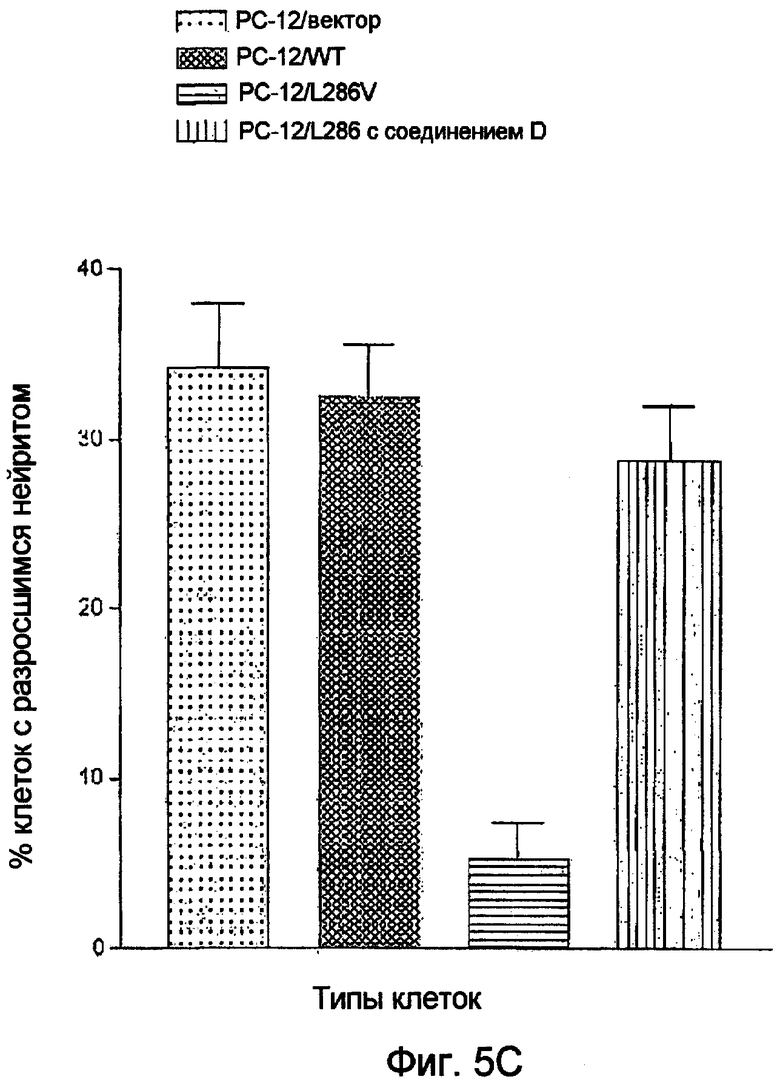





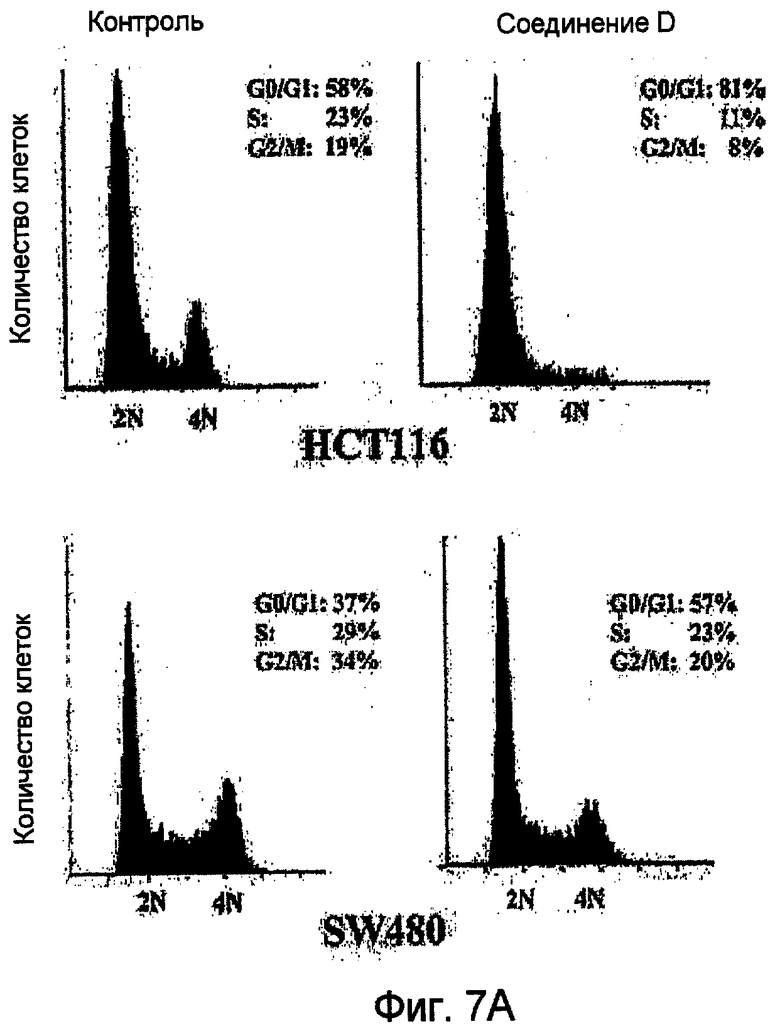
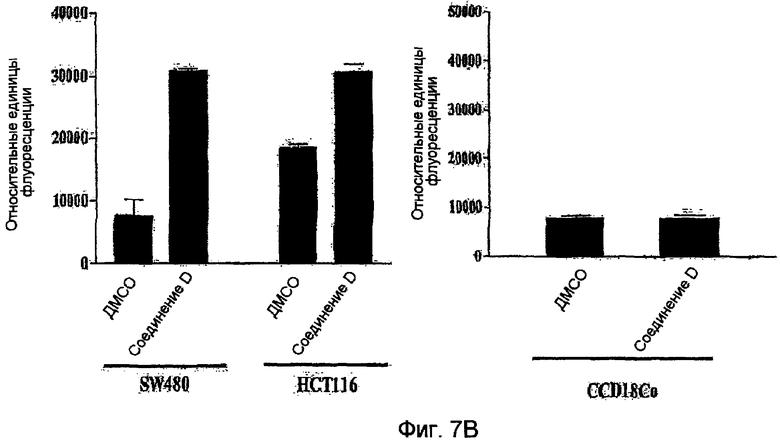
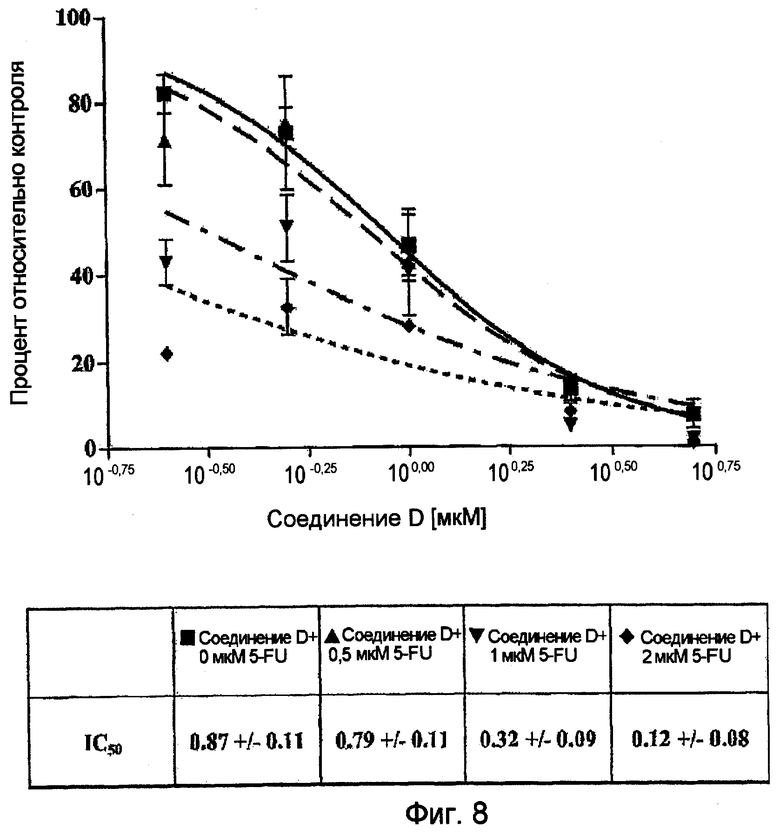
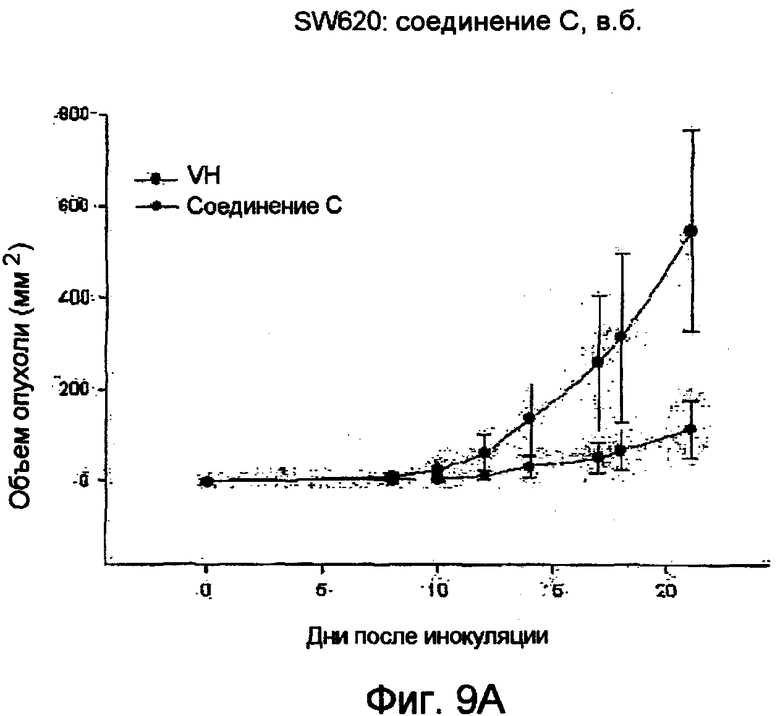
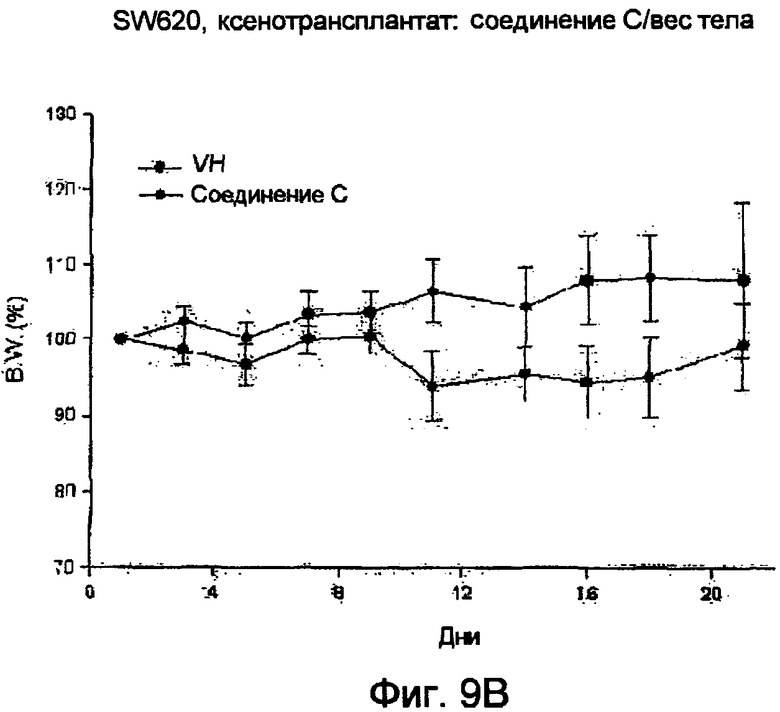
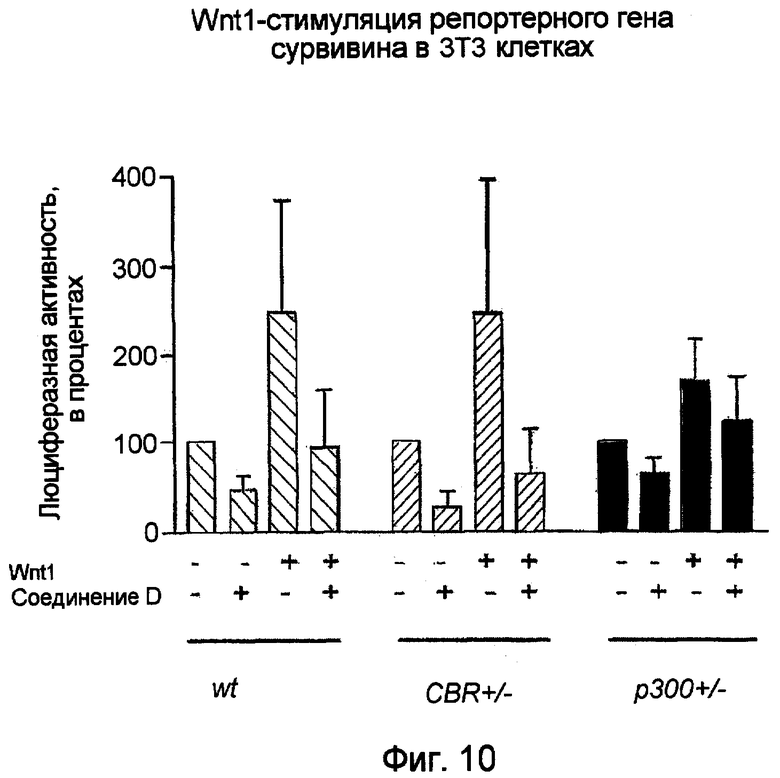
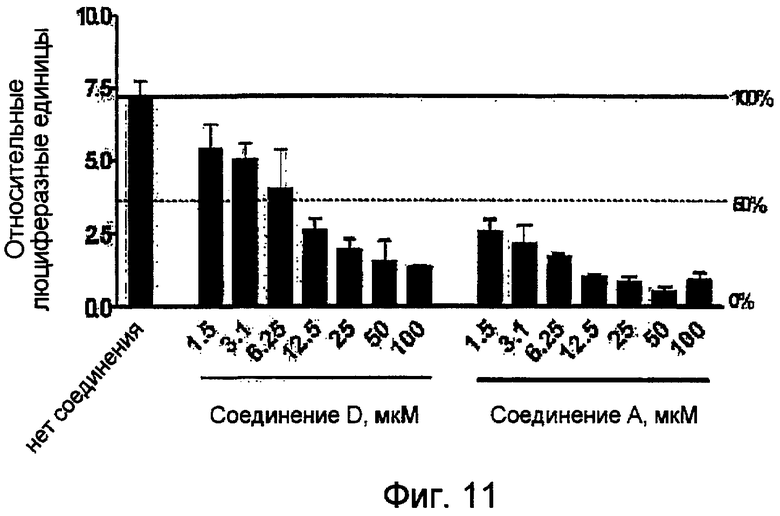
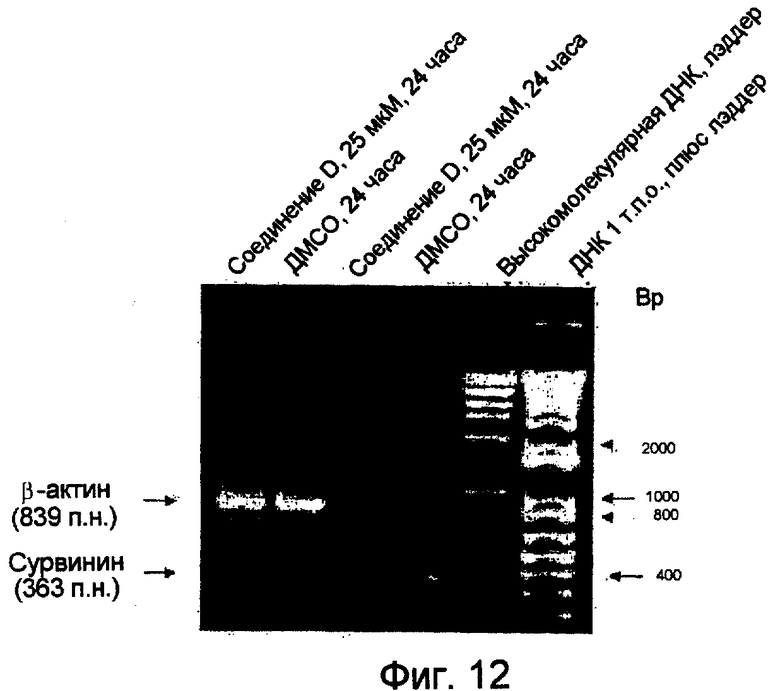

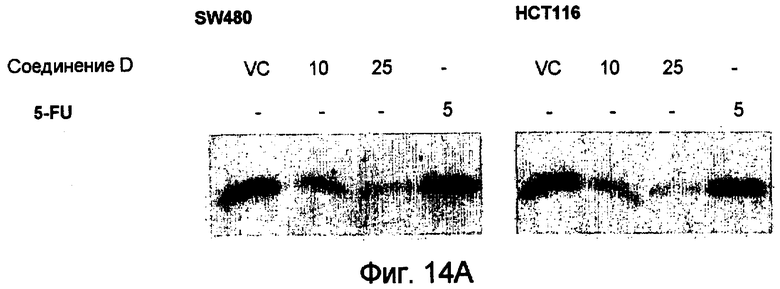

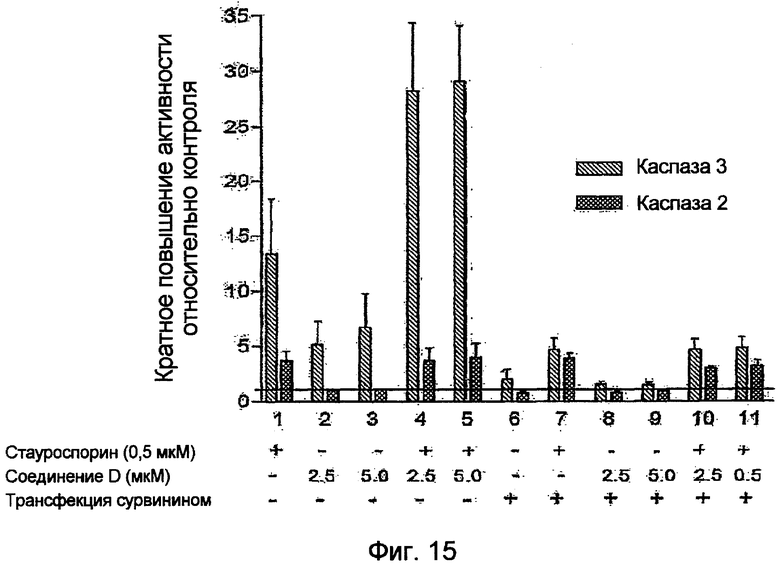
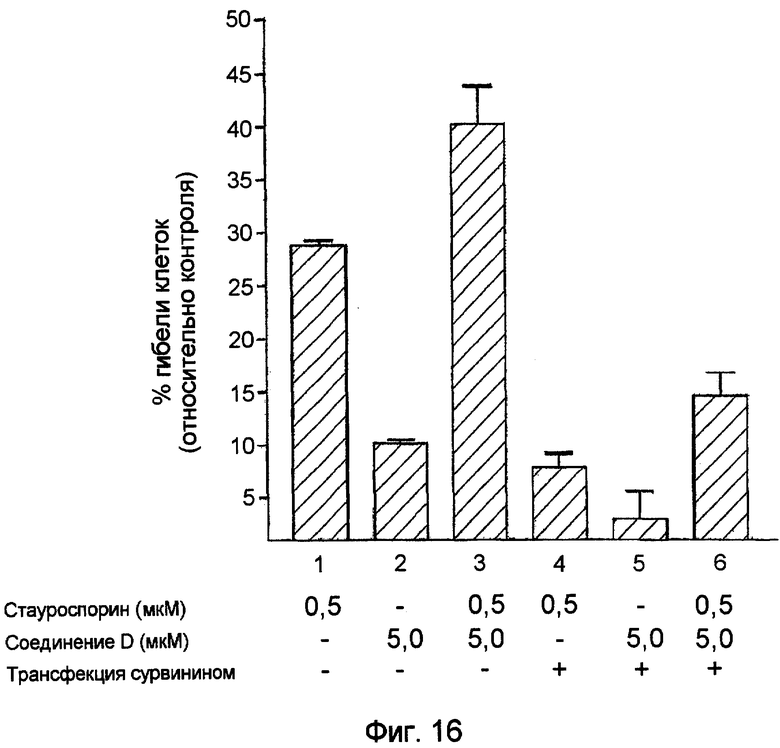
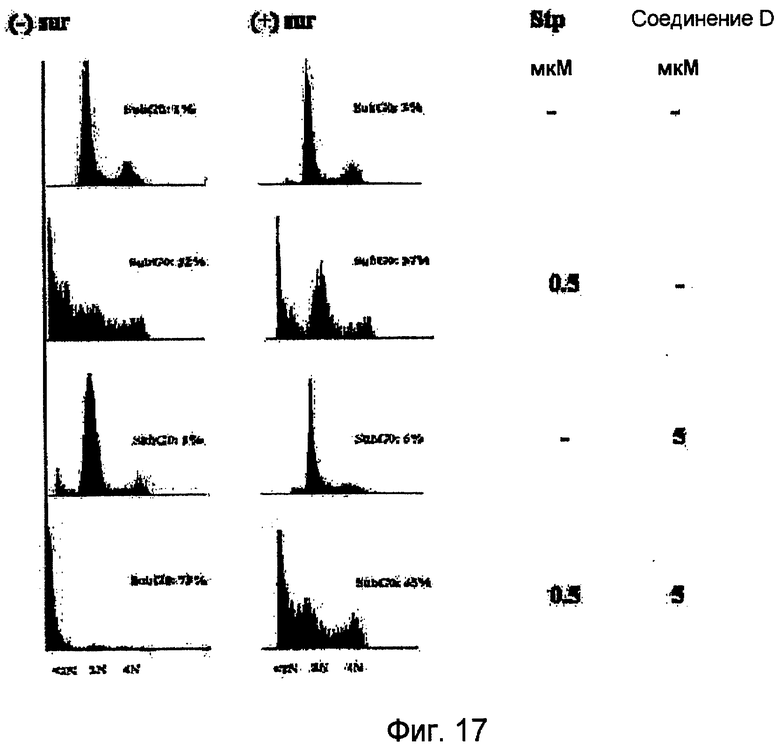
Изобретение относится к новым соединениям общей формулы (1), в том числе соединений (VI), относящихся к типу конформационно устойчивых соединений, которые имитируют вторичную структуру участков молекул биологически активных пептидов и белков с обратной конфигурацией. Соединения могут быть использованы как противоопухолевые соединения для лечения и профилактики рака, такого как колоректальный рак, для лечения ревматоидного артрита и язвенного колита. Соединения способствуют повышению апоптоза и усилению разрастания нейрита и ингибируют экспрессию сурвирина в клетке. В соединениях, соответствующих общей формуле (I) и (VI)
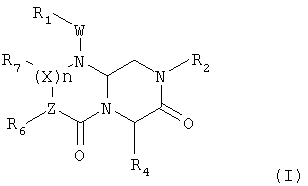
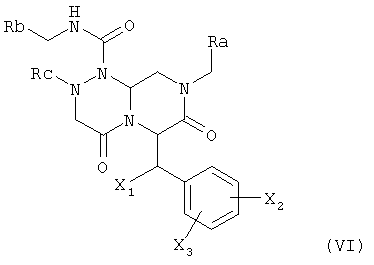
В формуле (I) W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует, Y обозначает атом кислорода, Z обозначает атом азота или СН, Х обозначает атом азота или СН, n=0 или 1, при условии, что когда Z обозначает СН, то Х обозначает атом азота и n=1; и когда Z обозначает атом азота, то n=0; в формуле (VI) X1 означает гидроксил и по крайней мере один из Х2 и Х3 является гидроксилом, либо X1 означает водород и Х2 и Х3 могут быть одинаковыми или разными и независимо выбраны из водорода, гидроксила и галогена. Другие радикалы имеют значения, указанные в формуле изобретения. 10 н. и 6 з.п. ф-лы, 33 ил., 9 табл.
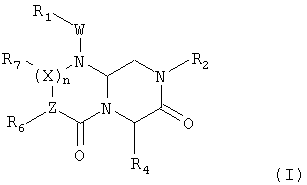
где W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует,
Y обозначает атом кислорода,
Z обозначает атом азота или СН,
Х обозначает атом азота или СН,
n=0 или 1,
при условии, что:
когда Z обозначает СН, то Х обозначает атом азота и n=1; и
когда Z обозначает атом азота, то n=0,
R1 обозначает:
насыщенный C1-6алкил;
замещенный C1-6алкил, содержащий один или несколько заместителей {где один или несколько заместителей независимо выбраны из гидроксила, галогена, фенила, нафтила, замещенного фенила (где указанные заместители на фенильном фрагменте независимо выбраны из галогена, C1-3алкокси, или амино), или
С1-4алкокси};
ацетонитрильная группа;
анилиногруппа;
С5-6циклоалкил;
С5-6циклоалкилС1-2алкил;
С2-3алкинил;
морфолинилС1-2алкил;
пиперидинилС1-2алкил;
С1-2алкил-пирролидинил-С1-3алкил;
фенил;
замещенный фенил (где один или несколько заместителей на фенильном кольце независимо выбраны из группы, включающей галоген, трифторС1-4алкил, С1-4алкил, и C1-3алкокси;
бензил;
замещенный бензил (где один или более заместителей на фенильном кольце независимо выбраны из амино, С1-4диалкиламино, галогена, трифторС1-4алкила, С1-4алкила, С2-3алкинила, C1-3алкокси, нитро, карбоксила, метилкарбоксила, циано, гидроксила или группы оксогексагидротиеноимидазолил-пентаноиламино-гексаноиламино-метил); замещенный бензил, содержащий заместитель на метильной группе (где указанный заместитель на метильной группе представляет собой С1-3алкил);
тиофенилС1-2алкил;
фуранилС1-2алкил;
тетрагидрофуранилС1-2алкил;
пиридинилС1-2алкил;
инданил;
бензодиоксолилС1-2алкил;
бициклический арил-С1-2алкил, содержащий от 8 до 11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы;
бензилкарбоксидигидроиндолилС1-3алкил;
бензилкарбоксиС1-3алкил;
N-(2-гидрокси-1-метил-2-фенилэтил)-N-метилпропионамид;
диоксоизоиндолинилС1-2алкилС5-6циклоалкил; или
дифенилС1-3алкил;
R2 обозначает:
С1-8алкил;
замещенный С1-8алкил {где заместители независимо выбраны из фенила, бензилтио, С1-4алкокси, замещенного фенила (где заместители на фенильном фрагменте выбраны из галогена, гидроксила, С1-3алкокси, фенокси, нитрофенокси, аллилокси, бензилокси, С1-4диалкиламинофенокси, циклопропилметокси, морфолинила или амино)};
С3-6циклоалкилС1-2алкил;
С2-3алкинил;
бициклическую арильную группу, содержащую от 8 до 11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы;
бензил;
замещенный бензил, содержащий один или несколько заместителей на фенильном кольце {где один или несколько заместителей на фенильном кольце выбраны из гидроксила, амино, N-метилбензиламино, С5-6циклоалкилокси, C1-3алкилтио, C1-3алкилсульфонила, хлорфенилтио, хлорбензолсульфонила, аллилокси, фенокси, морфолинилкарбонила, карбамоила, циклоалкилкарбамоила, фуранилметилкарбамоила, тиофенилметилкарбамоила, бензилкарбамоила, циклоалкилметилокси, фторфенокси, инданила, оксопирролидинила, ацетила, формамида, гидроксикарбамоила, C1-3алкоксикарбамоила, гидроксиС1-3алкилкарбамоила, гидразинкарбонила, C1-6алкилкарбоксилгидразинкарбонила, пиперидинилкарбонила, пирролидинилкарбонила, С1-4диалкиламинокарбонила, тетразолила, дифениламино, циклопропил(метил)амино, бензил(метил)амино, аминобензил(метил)амино, тетрагидропиранилС1-4алкиламинометила, С1-4алкилгексанамидо, фосфоноС1-2алкила, галогена, трифторС1-4алкила, трифторС1-4алкилтио, дифторС1-3алкилокси, трифторС1-3алкилокси, С1-4алкила, C1-6алкокси, нитро, карбоксила, пропандикарбоксиламинокарбонила, аллилокси, хлорС1-2алкилуреидо, морфолинила, морфолинилС1-2алкокси, пиперазинила, пирролидинила, тетразолила, пиридинила, замещенного пиридинила (где заместители выбраны из C1-2алкокси, оксо, амино, морфолинилом, или галогеном), N-пиперидинилС1-2алкокси, фенила, замещенного фенила (гидроксилом, карбоксилом, амино, циано, C1-2алкокси, формамидом или ацетиламино), пиперидинила, тиофенила, С1-4алкиламино, C1-4диалкиламинометила, С1-4диалкиламино или С1-12алкилсульфонилокси};
замещенный бензил, содержащий заместитель на метильной группе (где заместителем на метильной группе является C1-3алкил);
замещенный бензил, содержащий заместитель и на фенильном кольце и на метильной группе (где заместителем на метильной группе является C1-3алкил и один или несколько заместителей на фенильном кольце включают галоген, С1-3алкил, C1-4диалкиламино, С1-4алкиламино или трифторС1-3алкил);
дигидробензодиоксинилС1-2алкил;
дигидробензофуранилС1-2алкил;
метил-дигидробеноксазинилС1-2алкил;
пиперидинилС1-2алкил;
моноциклическую арил-С1-3алкильную группу, содержащую 5-7 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы, и
указанное кольцо в данном соединении может включать один или несколько заместителей, выбранных из группы, состоящей из галогена, амино, C1-3алкокси, аллилокси, хинолинила, С1-4алкилацетиленила, бензилкарбамоила, тиофенилкарбамоила, С1-4диалкилкарбамоила, C1-4алкоксиацетилиндолила, пирролидинилпиперидинила, циклопропила, циклопропилметилокси, пиридинила, формамида, бензила, замещенного галогеном бензила, фенокси, диалкиламинофенокси, бензилокси, фенила, замещенного фенила (гидроксилом, галогеном, циано, С1-2алкилсульфонилом, C1-2алкилтио или C1-2алкилокси), формамида, или карбоксила;
бициклический арил-С1-2алкил, содержащий 8-11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы;
замещенный бициклический арил-С1-2алкил, содержащий 8-11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы {где один или несколько заместителей на арильном кольце независимо выбраны из C1-3алкила, ацетила, толуолсульфонила, циклопропанкарбонила, этоксибутиральдегида, ацетилС1-3алкокси, гидроксиС1-3алкила, ацетальдегида, C1-6алкилкарбоксиламинометилкарбонила, оксо, пиридинила, аминоацетила, бензилкарбоксила, бензилкарбамоила, аминобензила, нитробензила, С1-4диалкиламиноС1-2алкила, С2-3алкинила, морфолинила, морфолинилС1-2алкила, амино, С1-4диалкиламино, галогена, циано, циклопропилметила, NO2, пиперидинилкарбонила, C1-3алкокси, бензолсульфонила, хлорбензолсульфонила, фенила, замещенного фенила (галогеном, аллилом, или морфолинилС1-2алкилом), бензила, замещенного бензила (карбоксилом, амино, С2-3алкинилкарбамоилом, гидроксилом, или NO2), карбоксила, пиперидинила, гидроксипиперидинила, гидроксиэтилпиперазинила, метилбутеноила};
замещенный бициклический арилС1-2алкил, содержащий 8-11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы, где один или несколько заместителей на арильном кольце включают галоген и заместителем на метильной группе является метил;
замещенный бициклический арилС1-2алкил, содержащий 8-11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы, где заместители на метильной группе включают метил;
замещенный бициклический арилС1-2алкил, содержащий в кольце атом серы, где сера связана с диоксидом;
замещенный феноксиС1-3алкил, имеющий один или несколько заместителей (где один или несколько заместителей независимо выбраны из фенила, фенилацетиламино, нитро, амино, бензоиламино, фторбензолсульфониламино, ацетиламино, бензилуреидо, бромфенилуреидо, или C1-6алкилуреидо);
ацетильная группа, имеющая заместитель, выбранный из бензилокси, морфолинила, тиоморфолинила, фенилпиперазинила, С1-2алкоксифенилпиперазинила, C1-2алкоксибензилокси, ацетилпиперазинила, [(бензилкарбамоил-5-изобутил-2-метил-4,6-диоксо-октагидропиридопиридазин-7ил)ацетил]-пиперазинила, нитрофенилпиперазинила, бензодиоксолилС1-2алкилпиперазинила, С1-2алкилпиперазинила, дифениламино, (хлорфенил)(фенил)амино, или (бензил)(фенил)амино;
карбамоилметильная группа, имеющая заместитель, выбранный из С5-6циклоалкила, C1-4алкоксифенилфенила, нитробензотиазолила, метилтиазолила, (трет-бутил-дифенил-силанилокси)фенилфенила, гидроксифенилфенила, C1-6алкилкарбоксиламинобензила, C1-3алкоксипиридинила, бензоилфенила, (C1-3алкилфенила), (диоксодигидроизоиндолил)-С1-4алкоксифенилфенила, амино-С1-3алкоксифенилфенила, фторфенила, трифторметоксифенила, С1-6алканоиламиноС1-3алкоксифенилфенила, фторфенилметила, трифторметоксифенилметила, бензодиоксолилметила, фенилС1-3алкила, морфолинилфенила, сульфамоилфенилС1-2алкила, оксопирролидинилС1-3алкила, или С1-2алкилпиридинила;
фенилаллил;
карбоксиС1-2алкил;
дифенилС1-4алкил;
дифениламинооксопропил;
дифениаллил;
бис(С1-3алкоксифенил)аминокарбонил;
морфолинилС1-3алкил;
тетрагидронафталенил;
бензилгидроксибензил;
карбазолил-N-C1-2алкил;
бензолсульфонил-тетрагидрокарбазолилС1-3алкил;
дибензофуранилС1-2алкил;
фенилпиперазинилалканоил;
феноксазинил-N-C1-2алкил;
бисфенилС1-4алкил;
дифениламиноС1-4алкил;
трифенилС1-3алкил;
тетрагидрофуранилметил;
R4 обозначает:
C1-6алкил;
замещенный С1-4алкил {где заместители независимо выбраны из карбоксила, С1-4алкилтио, тио, трифтор-, С1-4алкокси, формила, аллилкарбоксиамина, метилсульфонила, аллилоксикарбоксиламина, нафтила, фенила, или гидроксифенила};
С5-6циклоалкил;
С5-6циклоалкилС1-2алкил;
С2-3алкинил;
С1-2алкиленил;
гидроксиоксоциклогексадиенилаС1-2алкил;
карбоксиС1-2алкила;
фенил;
гидроксифенил;
диоксоимидазолидинилС1-3алкил;
тетразолилС1-2алкил;
дигидробензоксазолилС1-3алкил;
моноциклическую арильную - C1-3алкил группу, содержащую 5-7 членов в кольце, которое может включать 1-2 гетероатома, выбранных из атомов азота, кислорода или серы, и указанное арильное кольцо в данном соединении может включать один или несколько заместителей, выбранных из группы, состоящей из амино, нитро, формиламино, оксо, гидрокси, и C1-6алкила;
бензил;
замещенный бензил, содержащий один или несколько заместителей на фенильном кольце (где один или несколько заместителей на фенильном кольце выбраны из амино, С1-4диалкиламино, аминоокси, аминосульфонилокси, С1-4алкиламиносульфонилокси; C1-2алкилсульфониламино, аминосульфониламино, формамидо, карбамоил, C1-2алкилкарбамоил, С1-4диалкилкарбамоилокси, С1-2алкоксикарбамоил, гидроксикарбамоил, гидроксиС1-4алкилкарбамоил, карбамоилокси, бипиперидинилкарбонилокси, дигидроксиС3-6алкокси, формиламино, формиламиноС1-2алкил, ацетиламино, карбоксиамино, аминоацетиламино, гидроксиацетиламино, бензилкарбоксиамино, уреидо, гидроксиуреидо, карбамоилуреидо, гидразинкарбонил, карбамимидоил, гидроксикарбамимидоил, формамидо, нитро, гуанидино, галогена, С1-4алкила, гидроксиС1-4алкила, дигидроксиС1-4алкила, аминоС1-4алкила, карбоксиС1-3алкокси, аллила, нитро, карбоксила, пентандиоил-карбамоила, циано, гидроксила, C1-3алкокси, фенила или фенокси);
замещенный бензил, содержащий заместители на фенильном кольце и на метильной группе (где заместителем на метильной группе является гидроксил, и один или несколько заместителей на фенильном кольце представляют собой гидроксил);
бициклический арил-метил, содержащий 8-11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы,
замещенный бициклический арил-метил, содержащий 8-11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы (где один или несколько заместителей на арильном кольце включают галоген, (бензилуреидо)(С1-2алкил)аминоацетил, тиоксо или оксо);
оксо-дигидроиндолилметил;
нафтамидоС1-2алкил;
бензамидоС1-3алкил;
фторбензамидоС1-3алкил;
R6 обозначает:
водород;
бензил;
замещенный бензил (где заместители выбраны из галогена, амино, С1-4диалкиламино или C1-3алкокси);
фенил; или
метил;
R7 обозначает:
C1-6алкил;
замещенный С1-4алкил (где заместители выбраны из карбоксила или трифторгруппы);
С2-3алкинил;
С2-4алкенил;
С1-3алкоксиацетил;
фенилС2-3алкил;
фенилС2-3алкенил;
бензил;
замещенный бензил, содержащий один или несколько заместителей на фенильном кольце (где один или несколько заместителей на фенильном кольце выбраны из галогена, карбоксила или циано).
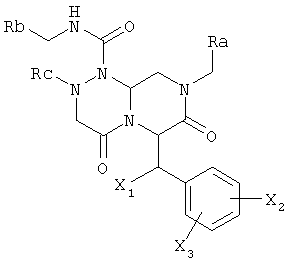
где Ra обозначает фенильную группу;
замещенную фенильную группу, содержащую один или несколько заместителей, где один или несколько заместителей независимо выбраны из гидросила, амино, N-метилбензиламино, С5-6циклоалкилокси, C1-3алкилтио, C1-3алкилсульфонил, хлорфенилтио, хлорбензолсульфонил, аллилокси, фенокси, морфолинилкарбонил, карбамоил, циклоалкилкарбамоил, фуранилметилкарбамоил, тиофенилметилкарбамоил, бензилкарбамоил, циклоалкилметилокси, фторфенокси, инданила, оксо-пирролидинила, ацетила, формамида, гидроксикарбамоила, C1-3алкоксикарбамоила, гидроксиС1-3алкилкарбамоила, гидразинкарбонила, С1-6алкилкарбоксилгидразинкарбонила, пиперидинил-карбонила, пирролидинил-карбонила, С1-4диалкиламинокарбонила, тетразолила, дифениламине, циклопропил(метил)амино, бензил(метил)амино, аминобензил(метил)амино, тетрагидропиранилС1-4алкиламинометила, С1-4алкилгексанамидо, фосфоноС1-2алкила, галогена, трифторС1-4алкила, трифторС1-4алкилтио, дифторС1-3алкокси, трифторС1-3алкокси, С1-4алкил, C1-6алкокси, нитро, карбоксила,
пропандикарбоксиламинокарбонила, аллилокси, хлорС1-2алкилуреидо, морфолинила, морфолинилС1-2алкокси, пиперазинила, пирролидинила, тетразолила, пиридинила, замещенного пиридинила (C1-3алкокси, оксо, амино, морфолинилом или галогеном), N-пиперидинилС1-2алкокси, фенилом, замещенным фенилом (гидроксилом, карбоксилом, амино, циано, C1-2алкокси, формамидом, или ацетиламино), пиперидинилом, тиофенилом, С1-4алкиламино, С1-4диалкиламинометилом, С1-4диалкиламино или С1-12алкилсульфонилокси;
бициклическая арильная группа, содержащая 8-11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы;
замещенный бициклический арилС1-2алкил, содержащий 8-11 членов в кольце, которое может включать 1-3 гетероатома, выбранных из атомов азота, кислорода или серы, (где один или несколько заместителей на арильном кольце независимо выбраны из C1-3алкила);
пиридинил, замещенный фенилом(который в свою очередь может быть замещен (гидроксилом, С1-2алкокси, С1-2алкилсульфонилом, галогеном, С1-2алкилтио, циано), циклопропилом, пиридинилом, С1-4алкиацетиленилом, карбоксилом, формамидом, C1-2алкилкарбамоилом, бензилкарбамоилом, тиофенилкарбамоилом, С1-4диалкилкарбамоилом или пирролидинилпиперидинилом;
Rb обозначает фенил, замещенный фенил (где заместители выбраны из амино, C1-4диалкиламино, галогена, трирфторС1-4алкила, С1-4алкила, С2-3алкинила, C1-3алкокси, нитро, карбоксила, метилкарбоксила, циано, гидроксила или оксогексагидротиеноимидазолил-пентаноиламино-гексаноиламино-метила) или морфолинилметил; и
Rc обозначает C1-6алкил, С2-3алкинил, С2-3алкенил, бензил, замещенный бензил, содержащий один или несколько заместителей на фенильном кольце (где указанные заместители на фенильном кольце независимо выбраны из галогена, карбоксила или циано); и
либо X1 означает гидроксил, и по крайней мере один из Х2 и Х3 является гидроксилом, либо X1 означает водород, и Х2 и Х3 могут быть одинаковыми или разными и независимо выбраны из водорода, гидроксила и галогена.
| ПРОИЗВОДНЫЕ КОНДЕНСИРОВАННОГО 1,2,4-ТИАДИАЗИНА И КОНДЕНСИРОВАННОГО 1,4-ТИАЗИНА, ИХ ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ | 1997 |
|
RU2199542C2 |
| US 5929237 A, 27.07.1999 | |||
| US 60113458 А, 11.01.2000. | |||
Авторы
Даты
2008-12-27—Публикация
2004-03-17—Подача