УРОВЕНЬ ТЕХНИКИ
Область техники, к которой относится изобретение
Изобретение относится к соединениям и способам модуляции транскрипции, активируемой β-катенином/TCF, например, селективным ингибированием генов, на которые нацелен путь Wnt/β-катенина.
Описание предшествующего уровня техники
Путь Wnt/β-катенина инициирует каскад передачи сигнала, критический как для нормального развития, так и для инициации и прогрессирования рака (Wodarz et al., “Mechanisms of Wnt signaling in development,” Annu. Rev. Cell Dev. Biol. 14:59-88 (1998); Morin, P.J. “Beta-catenin signaling and cancer,” Bioessays 21:1021-30 (1999); Moon et al., “The promise and perils of Wnt signaling through beta-catenin,” Science 296:1644-46 (2002); Oving et al., “Molecular causes of colon cancer,” Eur. J. Clin. Invest. 32:448-57 (2002)). Отличительным признаком этого пути является то, что он активирует транскрипционную роль мультифункционального белка β-катенина. В нормальных клетках большая часть β-катенина обнаруживается в клеточной мембране в связанном с кадгерином виде, где он играет важную роль в адгезии клеток. Другой пул β-катенина обнаружен в цитоплазме и ядре, где он регулирует транскрипцию (Gottardi et al., “Adhesion signaling: how beta-catenin interacts with its partners,” Curr. Biol. 11:R792-4 (2001)). В его различных ролях в качестве медиатора клеточной адгезии в плазматической мембране и в качестве активатора транскрипции β-катенин взаимодействует со множеством белков, большинство которых, несмотря на отсутствие значимой гомологии последовательности, конкурируют за одни и те же армадилло-повторы β-катенина. Кристаллическая структура вместе с мутационными исследованиями картировала сайты связывания β-катенина нескольких белков в различные армадилло-повторы (Gottardi et al., “Adhesion signaling: how beta-catenin interacts with its partners,” Curr. Biol. 11:R792-4 (2001); Huber et al., “The structure of the beta-catenin/E-cadherin complex and the molecular basis of diverse ligand recognition by beta-catenin,” Cell 105:391-402 (2001)).
Цитоплазматический пул β-катенина регулируется через фосфорилирование “деструктивным комплексом”, который включает в себя гликогенсинтазу-киназу-3β (GSK-3β), казеинкиназу-1α (СК-1α), белок скелета молекулы, аксин, и опухолевый супрессор, белок аденоматозного семейного кишечного полипоза (АРС), среди других белков (Behrens J., “Control of beta-catenin signaling in tumor development,” Ann. N.Y. Acad. Sci. 910:21-33 (2000); discussion 33-5). В отсутствие передачи сигнала Wnt, фосфорилирование метит цитоплазматический β-катенин для направляемого SCF-комплексом (Skp1-Cullin-F-box) убиквитинилирования и протеосомной деградации. Активация Wnt-пути инактивирует функцию GSK-3β, предотвращая фосфорилирование β-катенина, позволяя посредством этого накапливание β-катенина в цитоплазме и последующее перемещение в ядро, где он образует транскрипционно активный комплекс и запускает экспрессию его генов-мишеней. Ключевой стадией в активации генов-мишеней является образование комплекса между β-катенином и членами семейства фактора Т-клеток (TCF)/лимфоидного энхансерного фактора (LEF-1) факторов транскрипции (Brantjes et al., “TCF: Lady Justice casting the final verdict on the outcome of Wnt signaling,” Biol. Chem. 383:255-61 (2002)). Для генерирования транскрипционно активного комплекса β-катенин рекрутирует коактиваторы транскрипции, CREB-связывающий белок (СВР) или его близкородственный гомолог р300 (Hecht et al., “The p300/CBP acetyltransferases function as transcriptional coactivators of beta-catenin in vertebrates,” EMBO J. 19:1839-50 (2000); Takemaru et al., “The transcriptional coactivator CBP interacts with beta-catenin to activate gene expression,” J. Cell Biol. 149:249-54 (2000)), а также другие компоненты основного аппарата транскрипции.
Точный механизм, при помощи которого комплекс β-катенин/TCF активирует транскрипцию Wnt-чувствительных генов, не выяснен, но домены β-катенина, участвующие в активации транскрипции, были картированы в NH2- и СООН-концах (Staal et al., “Wnt signals are transmitted through N-terminally dephosphorylated beta-catenin,” EMBO J. 3:63-68 (2002)). СООН-концевой район β-катенина состоит из приблизительно 100 аминокислот, и было показано, что он взаимодействует с ТАТА-связывающим белком (ТВР) (Hecht et al., “Functional characterization of multiple transactivating elements in beta-catenin, some of which interact with the TATA-binding protein in vitro,” J. Biol. Chem. 274:18017-25 (1999)). При слиянии с LEF-1 СООН-конец является достаточным для стимуляции трансактивации (Vleminsky et al., “The C-terminal transactivation domain of beta-catenin is necessary and sufficient for signaling by the LEF-1/beta-catenin complex in Xenopus laevis,” Mech. Dev. 81:65-74 (1999)). NH2-концевая часть β-катенина состоит из приблизительно 130 аминокислот, содержащих сайты фосфорилирования GSK-3β, необходимые для протеосомной деградации.
Путь Wnt/β-катенина в норме регулирует экспрессию ряда генов, участвующих в стимуляции пролиферации и дифференцировки. Однако, в >85% случаев рака ободочной кишки один из компонентов деструктивного комплекса, APC, и/или сам β-катенин является мутированным, приводящим к увеличению ядерного β-катенина и конститутивной активации генов-мишеней (Fearnhead et al., “Genetics of colorectal cancer: hereditary aspects and overview of colorectal tumorigenesis,” Br. Med. Bull. 64:27-43 (2002)). Многие из этих генов, в том числе cyclin D1 (Shtutman et al., “The cyclin D1 gene is target of the beta-catenin/LEF-1 pathway,” Proc. Natl. Acad. Sci. USA 96:5522-27 (1999); Tetsu et al., “Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells,” Nature 398:442-26 (1999)) и c-myc (He et al., “Identification of с-MYC as a target of the APC pathway,” Science 281:1509-12 (1998)), которые играют решающие роли в росте, пролиферации и дифференцировке клеток, вместе с генами, необходимыми для инвазивного роста, такими как matrilysin (Crawford et al., “The metalloproteinase matrilysin is a target of beta-catenin transactivation in intestinal tumors,” Oncogene 18:2883-91 (1999)), fibronectin (Gradl et al., “The Wnt/Wg signal transducer beta-catenin controls fibronectin expression,” Mol. Cell. Biol. 19:5576-87 (1999)), CD44 (Wielenga et al., “Expression of CD44 in Apc and Tcf mutant mice implies regulation by WNT pathway,” Am. J. Pathol. 154:515-23 (1999)), µPAR (Mann et al., “Target genes of beta-catenin-T cell-factor/lymphoid-enhancer-factor signaling in human colorectal carcinomas”, Proc. Natl. Acad. Sci. USA 96:1603-08 (1999)), и активируются ненадлежащим образом.
При условии, что большинство случаев рака ободочной кишки включает в себя активацию пути передачи сигнала β-катенина, и при условии того факта, что множественные мутации приводят к этой активации, существует явная необходимость в лекарственных средствах, которые ослабляют ядерные функции β-катенина. Данное изобретение обеспечивает агенты, которые противодействуют β-катенин/TCF-опосредуемой транскрипции, и обеспечивает также связанные с этим преимущества, описанные подробно ниже.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Вкратце, данное изобретение обеспечивает агенты, которые являются антагонистами β-катенин/TCF-опосредуемой транскрипции, и способы их применения. В одном аспекте данное изобретение обеспечивает способы, посредством которых субпопуляция β-катенин/TCF-чувствительных генов специфически отрицательно регулируется, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. В другом аспекте данное изобретение обеспечивает способы, посредством которых связывание между СВР и β-катенином разрушается, но связывание между структурно родственным коактиватором р300 и β-катенином не разрушается, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. В другом аспекте, данное изобретение обеспечивает способы, посредством которых гены, которые стимулируются СВР, но не р300, селективно активируются, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. Кроме того, данное изобретение обеспечивает способы, посредством которых гены, которые стимулируются р300, но не СВР, селективно активируются, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. В другом аспекте данное изобретение обеспечивает способы, при помощи которых клетки карциномы лечат химическим агентом для остановки развития в G1-фазе клеточного цикла, где пролонгированное лечение этим химическим агентом индуцирует апоптоз, который не детектируется в нормальных клетках ободочной кишки (колоноцитах). Этими клетками карциномы могут быть, например, клетки ободочной кишки, молочной железы, предстательной железы и т.д.
Например, в одном аспекте данное изобретение обеспечивает способ модуляции β-катенин-индуцируемой экспрессии генов. Этот способ предусматривает контактирование композиции с агентом, где эта композиция содержит β-катенин, СВР и р300, и β-катенин имеет вероятность связывания с СВР в сравнении с р300. Этот агент присутствует в данной композиции в количестве, эффективном для изменения вероятности связывания β-катенина с СВР в сравнении с р300. Другими словами, в отсутствие этого агента β-катенин связывается с СВР и р300 в отличающейся степени, чем степень связывания, наблюдаемая в присутствии этого агента. Например, в зависимости от его химической структуры, этот агент может производить следующее: увеличивать связывание СВР с β-катенином, при необязательном уменьшении связывания р300 с β-катенином; или увеличивать связывание р300 с β-катенином при необязательном уменьшении связывания СВР с β-катенином. Этот способ может выполняться in vivo или ex vivo. В одном аспекте этот способ выполняют ex vivo и данная композиция содержит стволовую клетку. В другом аспекте этот способ выполняют in vivo, и эта композиция находится в млекопитающем. Способ данного изобретения может быть использован для лечения различных медицинских состояний. Например, в различных аспектах данного изобретения: это млекопитающее может страдать от рака, и это количество является эффективным для лечения рака; эта композиция находится в клетке, и этот агент увеличивает вероятность того, что эта клетка будет дифференцироваться; эта композиция находится в клетке, и этот агент увеличивает вероятность того, что эта клетка будет пролиферировать.
В другом аспекте данное изобретение обеспечивает композицию, содержащую β-катенин, СВР, р300 и агент. β-катенин имеет большую вероятность связывания с СВР в сравнении с р300, и этот агент присутствует в этой композиции в количестве, эффективном для изменения вероятности связывания β-катенина с СВР в сравнении с р300. Другими словами, в отсутствие этого агента β-катенин связывается с СВР и р300 в отличающейся степени, чем степень связывания, наблюдаемая в присутствии этого агента. Например, в зависимости от его химической структуры, этот агент может производить следующее: увеличивать связывание СВР с β-катенином, при необязательном уменьшении связывания р300 с β-катенином; или увеличивать связывание р300 с β-катенином при необязательном уменьшении связывания СВР с β-катенином. Эта композиция может находиться in vivo или ex vivo. В одном аспекте эта композиция находится ex vivo и эта композиция дополнительно содержит стволовую клетку. В другом аспекте эта композиция находится in vivo и эта композиция находится в млекопитающем, например в мыши.
В другом аспекте данное изобретение обеспечивает способ модуляции активности Wnt-пути, предусматривающий: (а) контактирование компонентов Wnt-пути с соединением, которое активирует Wnt-путь, для обеспечения активированного Wnt-пути; и (b) контактирование активированного Wnt-пути с химическим агентом, который полностью или существенно препятствует связыванию между р300 и катенином, но вызывает незначительное ингибирование или не вызывает ингибирования связывания между СВР и катенином. Необязательно, Wnt-путь находится внутри клетки. Необязательно, этот способ выполняют ex vivo. Необязательно, соединение, которое активирует Wnt-путь, выбрано из LiCl или ингибитора GSK.
В другом аспекте данное изобретение обеспечивает способ модуляции пролиферации клеток, предусматривающий: (а) обеспечение популяции клеток при условиях, где часть этой популяции будет пролиферировать и часть этой популяции будет дифференцироваться; и (b) добавление химического агента к этой популяции, где этот агент вызывает увеличение части клеток, которые пролиферируют, относительно части клеток, которые дифференцируются. В различных необязательных вариантах осуществления этого способа: это соединение препятствует связыванию между р300 и катенином; этот способ дополнительно предусматривает добавление агента к этой популяции, который активирует Wnt-путь; этой популяцией клеток является популяция стволовых клеток; этот способ выполняют ex vivo; этот способ дополнительно предусматривает добавление агента, который вызывает дифференцировку популяции клеток, где, например, клетки в данной популяции дифференцируются с образованием клеток крови, или клетки в данной популяции дифференцируются с образованием нервных клеток.
В другом аспекте данное изобретение обеспечивает способ для поддержания стволовой клетки в недифференцированном состоянии, предусматривающий контактирование этой стволовой клетки с агентом, который ингибирует клеточную дифференцировку или стимулирует пролиферацию клеток, в количестве, эффективном для поддержания стволовой клетки в недифференцированном состоянии. В некоторых вариантах осуществления, агент, используемый в этом способе, селективно ингибирует взаимодействие β-катенин/р300 относительно взаимодействия β-катенин/СВР.
Вкратце, в других аспектах данное изобретение обеспечивает:
способ селективного ингибирования взаимодействия β-катенин/СВР относительно взаимодействия β-катенин/р300, причем этот способ предусматривает введение соединения в композицию, где эта композиция содержит β-катенин, СВР и р300, и это соединение селективно ингибирует взаимодействие β-катенин/СВР относительно взаимодействия β-катенин/р300;
способ селективного ингибирования взаимодействия β-катенин/р300 относительно взаимодействия β-катенин/СВР, причем этот способ предусматривает введение соединения в композицию, где эта композиция содержит β-катенин, СВР и р300, и это соединение селективно ингибирует взаимодействие β-катенин/р300 относительно взаимодействия β-катенин/СВР;
способ усиления перемещения β-катенина из ядра в цитозоль, причем этот способ предусматривает введение соединения в клетку, где эта клетка содержит ядро и цитозоль, а ядро содержит β-катенин, и это соединение вызывает перемещение β-катенина из ядра в цитозоль;
способ селективного ингибирования экспрессии генов, на которые нацелен Wnt/β-катенин-путь, причем этот способ предусматривает введение соединения в композицию, содержащую гены, на которые нацелен Wnt/β-катенин-путь, причем это соединение вызывает изменение экспрессии генов, на которые нацелен Wnt/β-катенин-путь.
В способах и композициях данного изобретения химический агент необязательно выбран из соединений формулы (I):
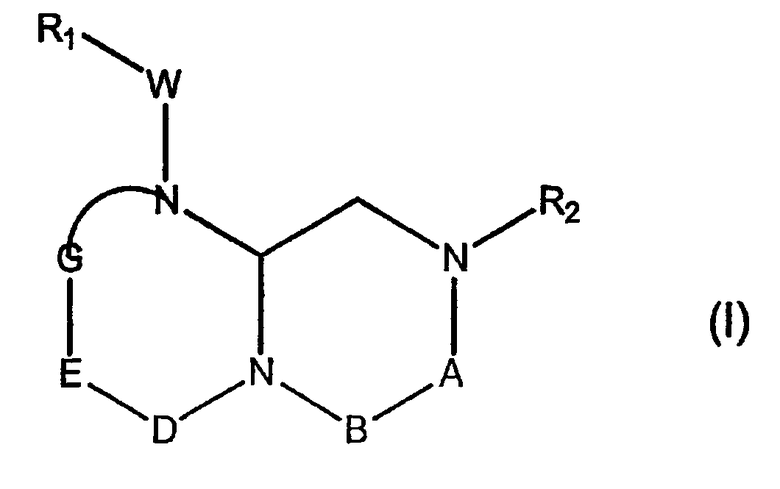
где А обозначает -(CHR3)- или -(С=О)-, В обозначает -(CHR4)- или -(С=О)-, D обозначает -(CHR5)- или -(С=О)-, Е обозначает -(ZR6)- или -(С=О)-, G обозначает -(XR7)n-, -(CHR7)-(NR8)-, -(С=О)-(XR9)- или -(С=О)-, W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует, Y обозначает кислород или серу, Х и Z обозначают независимо азот или СН, n=0 или 1; и R1, R2, R3, R4, R5, R6, R7, R8 и R9 являются одинаковыми или различными и независимо выбраны из части боковой цепи аминокислоты, производного части боковой цепи аминокислоты или остальной молекулы, и их стереоизомеров.
В некоторых вариантах осуществления, R1, R2, R3, R4, R5, R6, R7, R8 и R9 формулы (I) независимо выбраны из группы, состоящей из аминоС2-5алкила, гуанидиноС2-5алкила, С1-4алкилгуанидиноС2-5алкила, диС1-4алкилгуанидино-С2-5алкила, амидиноС2-5алкила, С1-4алкиламиноС2-5алкила, диС1-4алкиламидиноС2-5алкила, С1-3алкокси, фенила, замещенного фенила (где заместители выбраны независимо из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бензила, замещенного бензила (где заместители на бензиле независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), нафтила, замещенного нафтила (где заместители независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бис-фенилметила, замещенного бис-фенилметила (где заместители независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридила, замещенного пиридила (где заместители независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридилС1-4алкила, замещенного пиридилС1-4алкила (где заместители пиридина независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиримидилС1-4алкила, замещенного пиримидилС1-4алкила (где заместители пиримидина независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси или нитро, карбокси, циано, сульфурила или гидроксила), триазин-2-ил-С1-4алкила, замещенного триазин-2-ил-С1-4алкила (где заместители триазина независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазоС1-4алкила, замещенного имидазолС1-4алкила (где заместители имидазола независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазолинилС1-4алкила, N-амидинопиперазинил-N-С0-4алкила, гидроксиС2-5алкила, С1-5алкиламиноС2-5алкила, С1-5диалкиламиноС2-5алкила, N-амидинопиперидинилС1-4алкила и 4-аминоциклогексилС0-2алкила.
В некоторых вариантах осуществления, А обозначает -(CHR3)-, В обозначает -(С=О)-, D обозначает -(CHR5)-, Е обозначает -(С=О)-, G обозначает -(XR7)n-, и это соединение имеет следующую общую формулу (II):
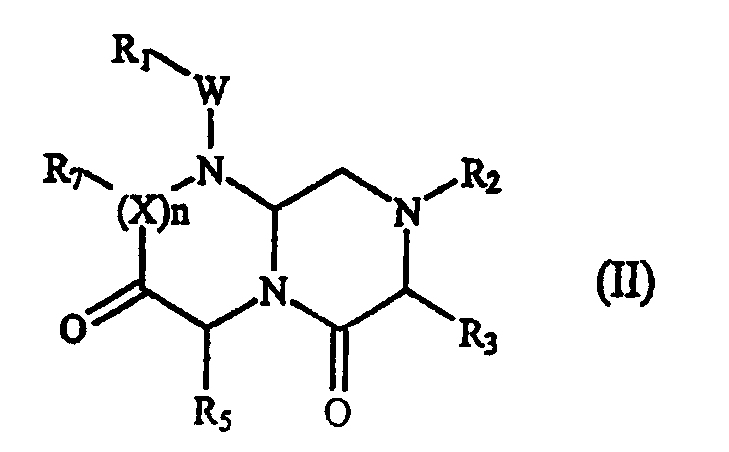
где R1, R2, R3, R5, R7, W, X и n имеют определенные в формуле (I) значения.
В некоторых вариантах осуществления, А обозначает -(С=О)-, В обозначает -(CHR4)-, D обозначает -(С=О)-, Е обозначает -(ZR6)-, G обозначает -(С=О)-(XR9)-, и это соединение имеет следующую общую формулу (III):
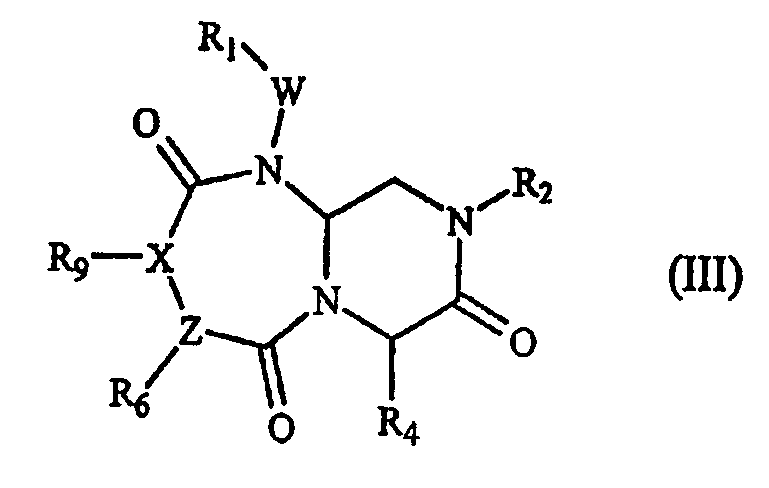
где R1, R2, R4, R6 R9, W и Х имеют определенные в формуле (I) значения, Z обозначает азот или СН (когда Z обозначает СН, тогда Х обозначает азот).
В некоторых вариантах осуществления, А обозначает -(С=О)-, В обозначает -(CHR4)-, D обозначает -(С=О)-, Е обозначает -(ZR6)-, G обозначает -(XR7)n-, и это соединение имеет следующую общую формулу (IV):
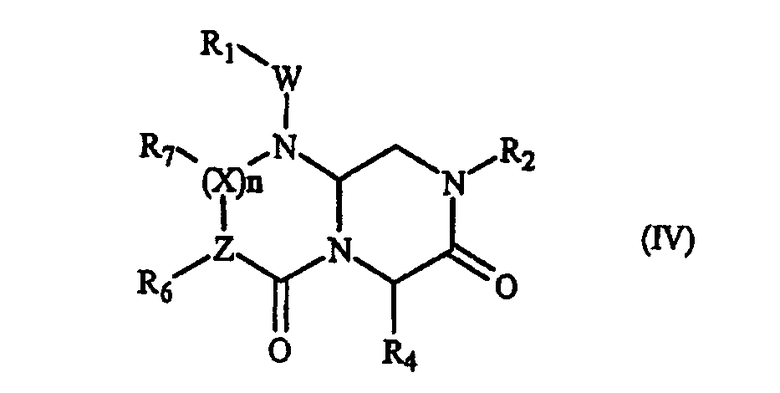
где R1, R2, R4, R6, R7, W, X и n имеют определенные в формуле (I) значения, и Z обозначает азот или СН, при условии, что, когда Z обозначает азот, тогда n равно нулю, и когда Z обозначает СН, тогда Х обозначает азот и n не равно нулю.
В некоторых вариантах осуществления, это соединение имеет следующую общую формулу (VI):
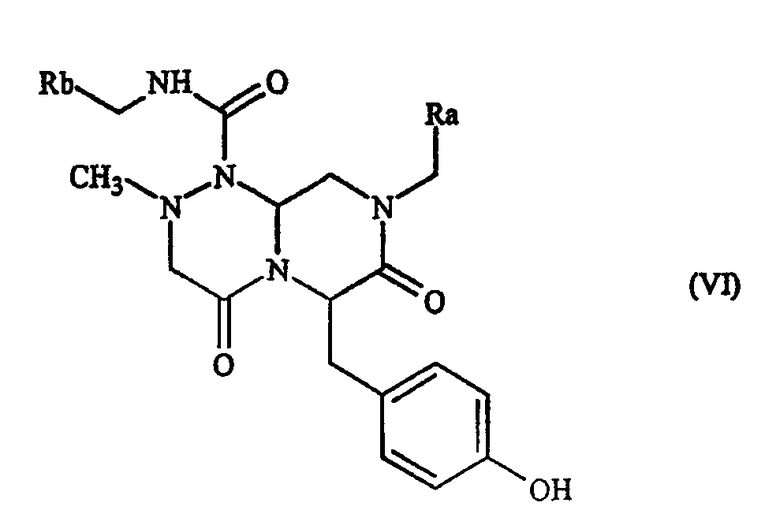
где Ra обозначает бициклическую арильную группу, имеющую 8-11 членов кольца, которые могут иметь 1-3 гетероатома, выбранных из азота, кислорода или серы, и Rb обозначает моноциклическую арильную группу, имеющую 5-7 членов кольца, которые могут иметь 1-2 гетероатома, выбранных из азота, кислорода или серы, и арильное кольцо в этом соединении может иметь один или несколько заместителей, выбранных из группы, состоящей из галогенида, гидрокси, циано, низшей алкильной группы и низшей алкоксигруппы. Необязательно, Ra обозначает нафтильную, хинолинильную или изохинолинильную группу, а Rb обозначает фенил, пиридил или пиперидил, все из которых могут быть замещенными одним или несколькими заместителями, выбранными из группы, состоящей из галогенида, гидрокси, циано, низшей алкильной группы и низшей алкоксигруппы. В некоторых вариантах осуществления, Ra обозначает нафтил, а Rb обозначает фенил, которые могут быть замещены одним или несколькими заместителями, выбранными из группы, состоящей из галогенида, гидрокси, циано, низшей алкильной группы и низшей алкоксигруппы.
В некоторых вариантах осуществления, это соединение выбрано из СОЕДИНЕНИЙ 1, 3, 4 и 5.
В других аспектах данное изобретение обеспечивает способы скрининга, т.е. способы, при помощи которых могут быть идентифицированы биологически активные соединения и/или может быть оценена их эффективность. Например, данное изобретение обеспечивает способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР с частью молекулы, содержащей СВР 1-111; (b) контактирования смеси стадии (а) с частью молекулы, содержащей β-катенин; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей β-катенин, стадии (b), с частью молекулы, содержащей СВР 1-111, стадии (а); и (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с частью молекулы, содержащей β-катенин, малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:СВР.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР стадии (d) со смесью, содержащей (1) часть молекулы, содержащую р300 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей р300 1-111 с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей р300 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:СВР.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР с частью молекулы, содержащей β-катенин; (b) контактирования смеси стадии (а) с частью молекулы, содержащей СВР 1-111; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей СВР 1-111, стадии (b), с частью молекулы, содержащей β-катенин, стадии (а); и (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей β-катенин, с частью молекулы, содержащей СВР 1-111, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:СВР.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР стадии (d) со смесью, содержащей (1) часть молекулы, содержащую р300 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей р300 1-111, с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей р300 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:СВР.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР, предусматривающий стадии (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР с частью молекулы, содержащей (1) β-катенин, ассоциированный с СВР 1-111; (b) определения, посредством анализа, диссоциирует ли указанная молекула стадии (а) СВР 1-111 от β-катенина; и (с) идентификации, после определения, что указанная малая молекула стадии (а) диссоциирует связывание β-катенина от СВР 1-110, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:СВР.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (d) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР стадии (с) со смесью, содержащей (1) часть молекулы, содержащую р300 1-111, и (2) β-катенин; (е) определения, посредством анализа, не ингибирует ли указанная молекула стадии (d) связывание указанной части молекулы, содержащей р300 1-111, с β-катенином; и (f) подтверждения, после определения, что указанная малая молекула стадии (d) не ингибирует связывание указанной части молекулы, содержащей р300 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:СВР.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:р300, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 с частью молекулы, содержащей р300 1-111; (b) контактирования смеси стадии (а) с частью молекулы, содержащей β-катенин; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей β-катенин, стадии (b), с частью молекулы, содержащей р300 1-111, стадии (а); и (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей р300 1-111, с частью молекулы, содержащей β-катенин, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:р300.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 стадии (d) со смесью, содержащей (1) часть молекулы, содержащую СВР 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей СВР 1-111, с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:р300.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:р300, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 с частью молекулы, содержащей β-катенин; (b) контактирования смеси стадии (а) с частью молекулы, содержащей р300 1-111; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей р300 1-111, стадии (b), с частью молекулы, содержащей β-катенин, стадии (а); (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей β-катенин, с частью молекулы, содержащей р300 1-111, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:р300.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 стадии (d) со смесью, содержащей (1) часть молекулы, содержащую СВР 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей СВР 1-111, с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:р300.
Данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:р300, предусматривающий стадии (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 с частью молекулы, содержащей (1) β-катенин, ассоциированный с р300 1-111; (b) определения, посредством анализа, диссоциирует ли указанная молекула стадии (а) р300 1-111 от β-катенина; и (с) идентификации, после определения, что указанная малая молекула стадии (а) диссоциирует связывание β-катенина от р300 1-110, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:р300.
Необязательно, вышеуказанный способ может дополнительно содержать стадии (d) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 стадии (с) со смесью, содержащей (1) часть молекулы, содержащую СВР 1-111, и (2) β-катенин; (е) определения, посредством анализа, не ингибирует ли указанная молекула стадии (d) связывание указанной части молекулы, содержащей СВР 1-111, с β-катенином; и (f) подтверждения, после определения, что указанная малая молекула стадии (d) не ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:р300.
В других аспектах данное изобретение обеспечивает последовательности нуклеиновых кислот и пептидов, где эти последовательности применимы в качестве, например, терапевтических средств, или, например, в способах скрининга. Таким образом, в различных примерных аспектах данное изобретение обеспечивает:
по существу очищенную и выделенную последовательность нуклеиновых кислот, содержащую SEQ ID NO:1, или последовательность, имеющую по меньшей мере 80% идентичность относительно SEQ ID NO:1, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, содержащую фрагмент SEQ ID NO:1, или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенный и выделенный пептид, содержащий SEQ ID NO:2, или пептид, имеющий по меньшей мере 80% идентичность относительно SEQ ID NO:2, при условии, что указанный пептид не является белком СВР;
по существу очищенный и выделенный пептид, содержащий фрагмент SEQ ID NO:2, или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую по существу из SEQ ID NO:1, или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:1, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую по существу из фрагмента SEQ ID NO:1, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенный и выделенный пептид, состоящий по существу из SEQ ID NO:2, или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:2, при условии, что указанный пептид не является белком СВР;
по существу очищенный и выделенный пептид, состоящий по существу из фрагмента SEQ ID NO:2, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую из SEQ ID NO:1, или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:1, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую из фрагмента SEQ ID NO:1, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок СВР;
по существу очищенный и выделенный пептид, состоящий из SEQ ID NO:2, или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:2, при условии, что указанный пептид не является белком СВР;
по существу очищенный и выделенный пептид, состоящий из фрагмента SEQ ID NO:2, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком СВР;
по существу очищенную и выделенную последовательность нуклеиновых кислот, содержащую SEQ ID NO:3, или последовательность, имеющую по меньшей мере 80% идентичность относительно SEQ ID NO:3, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, содержащую фрагмент SEQ ID NO:3, или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенный и выделенный пептид, содержащий SEQ ID NO:4, или пептид, имеющий по меньшей мере 80% идентичность относительно SEQ ID NO:4, при условии, что указанный пептид не является белком р300;
по существу очищенный и выделенный пептид, содержащий фрагмент SEQ ID NO:4, или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую по существу из SEQ ID NO:3, или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:3, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую по существу из фрагмента SEQ ID NO:3, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенный и выделенный пептид, состоящий по существу из SEQ ID NO:4, или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:4, при условии, что указанный пептид не является белком р300;
по существу очищенный и выделенный пептид, состоящий по существу из фрагмента SEQ ID NO:4, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую из SEQ ID NO:3, или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:3, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенную и выделенную последовательность нуклеиновых кислот, состоящую из фрагмента SEQ ID NO:3, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок р300;
по существу очищенный и выделенный пептид, состоящий из SEQ ID NO:4, или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:4, при условии, что указанный пептид не является белком р300;
по существу очищенный и выделенный пептид, состоящий из фрагмента SEQ ID NO:4, или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанный пептид не является белком р300.
Эти и родственные аспекты данного изобретения описаны более подробно ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1. СОЕДИНЕНИЕ 1 ингибирует транскрипцию β-катенин/TCF.
А(i) и А(ii). Структуры СОЕДИНЕНИЯ 1, СОЕДИНЕНИЯ 2, СОЕДИНЕНИЯ 3, СОЕДИНЕНИЯ 4 и СОЕДИНЕНИЯ 5.
В(i) и В(ii). СОЕДИНЕНИЕ 1 селективно ингибирует конструкцию β-катенина/TCF-репортерный ген с IC50 5 мкМ. Клетки SW480 (105), (фигура 1В(i)), трансфицировали конструкцией β-катенин/TCF-люцифераза. Клетки обрабатывали СОЕДИНЕНИЕМ 1 (1-64 мкМ). Спустя 24 часа после обработки получали лизаты и подвергали двойному люциферазному анализу. Эти данные представлены в другой форме на фигуре 1В(ii).
С. СОЕДИНЕНИЕ 1 не влияет на репортерную конструкцию NFAT. Стабильно трансфицированные клетки Jurkat, правая панель, с репортерной конструкцией NFAT (ядерного фактора активированных Т-клеток), стимулировали РМА (форболовым эфиром) (10 нг/мл)/иономицином (1 мкг/мл) и обрабатывали СОЕДИНЕНИЕМ 1 (0,781-50 мкМ). Спустя 24 часа после обработки получали лизаты и подвергали двойному люциферазному анализу. Все эксперименты выполняли в двух повторностях и величины строили в виде средних ± стандартное отклонение.
D. СВР является молекулярной мишенью СОЕДИНЕНИЯ 1. Ядерные экстракты клеток SW480 инкубировали с гранулами стрептавидин-агарозы, покрытыми СОЕДИНЕНИЕМ 2 (25 мкМ). Гранулы промывали 3 раза и элюат подвергали гель-электрофорезу и иммуноблоттингу с использованием анти-СВР-антител. Стрелки указывают на полосу, соответствующую по размеру и иммунореактивности СВР.
Е. 14С-меченое СОЕДИНЕНИЕ 1 связывается с СВР. СОЕДИНЕНИЕ 1 получали включением 14С-меченого тирозина. Клетки SW480 трансфицировали векторами, экспрессирующими полноразмерный β-катенин Xenopus laevis (2,2 мкг) или полноразмерный СВР мыши (1,1 мкг). 50 мкг ядерного лизата (набор NE-PER, Pierce) обрабатывали либо 20 мкМ 14С-меченым СОЕДИНЕНИЕМ 1 (7,16 × 104 имп/мин) с ДМСО (0,5%), либо 100 мкМ и 200 мкМ холодным (нерадиоактивным) СОЕДИНЕНИЕМ 1. Лизаты обессоливали с использованием колонок на 1 мл G-25 (Pharmacia) для удаления несвязанного 14С-меченого СОЕДИНЕНИЯ 1 и измеряли включение 14С-меченого СОЕДИНЕНИЯ 1.
Фигура 2. Первые 111 аминокислот СВР, но не р300, специфически связывают СОЕДИНЕНИЕ 1.
А. Схематическое представление СВР дикого типа и делеционных конструкций СВР.
В. СВР (1-111) содержит минимальный домен связывания СОЕДИНЕНИЯ 1. Показаны уровни экспрессии делеционных конструкций СВР в клетках SW480 (верхняя панель). 10 мкг общего белка подвергали гель-электрофорезу и подвергали иммуноблоттингу с использованием анти-His-антител. Лизаты целых клеток SW480, экспрессирующих делеционные конструкции СВР, связывали со стрептавидин-агарозными гранулами, покрытыми 100 мкМ СОЕДИНЕНИЕМ 2. Связанные фракции подвергали гель-электрофорезу и иммуноблоттингу с использованием анти-His-антител (нижняя панель). Стрелки указывают на конструкции, которые оставались связанными с покрытыми СОЕДИНЕНИЕМ 2 гранулами.
С. Избыток СОЕДИНЕНИЯ 1 конкурентно удаляет СВР (1-111), но не р300 (1-111). Делеционные конструкции СВР, СВР (1-111), СВР (1-211) и СВР (1-351) и делеционные конструкции р300, р300 (1-111), р300 (1-211) и р300 (1-351) трансфицировали в клетки SW480. Лизаты целых клеток инкубировали со стрептавидин-агарозными гранулами или со стрептавидин-агарозными гранулами, покрытыми 100 мкМ СОЕДИНЕНИЯ 2 (нижняя панель). Связывание конструкций СВР (1-111, 1-211 и 1-351) и конструкций р300 (1-111, 1-211 и 1-351) с гранулами стимулировали избытком СОЕДИНЕНИЯ 1 (150 мкМ).
D. СВР (1-111) связывается с СОЕДИНЕНИЕМ 1 независимым от фосфорилирования образом. СВР (1-111) или р300 (1-111) экспрессировали в E. coli и очищали с использованием Ni-NTA-агарозы (окрашенного Кумасси синим геля). Показан СВР (1-111) (вверху, справа). 1 и 3 мкл очищенных белков подвергали иммуноблоттингу с использованием анти-His-антител. Стрелки указывают на рекомбинантные белки, узнаваемые их соответствующими антителами. Увеличивающиеся количества очищенных СВР (1-111) (0,5, 1 и 3 мкл) и р300 (1-111) (1, 3 и 5 мкл) инкубировали со стрептавидин-агарозными гранулами, покрытыми 100 мкМ СОЕДИНЕНИЯ 2. Эти гранулы промывали и элюированные белки подвергали гель-электрофорезу с последующим иммуноблоттингом с использованием анти-His-антител. Стрелки указывают на белки на мембранах PVDF. Взаимодействия специфического связывания стимулировали с использованием избытка СОЕДИНЕНИЯ 1 (300 мкМ).
Е. Конструкция СВР Δ1-111 + NLS не способна спасать транскрипцию β-катенин/TCF, ингибированную СОЕДИНЕНИЕМ 1. Клетки SW480 трансфицировали (0,1-1) мкг экспрессирующих векторов, экспрессирующих либо полноразмерный СВР, либо СВР (Δ1-111 + NLS). Спустя 24 часа после трансфекции клетки обрабатывали СОЕДИНЕНИЕМ 1 (25 мкМ) или контролем (0,5% ДМСО). Спустя 24 часа после обработки получали лизаты и подвергали их двойному люциферазному анализу.
Фигура 3. СОЕДИНЕНИЕ 1 разрушает комплекс β-катенин/СВР, но не комплекс р300/β-катенин.
А. Плазмиды полноразмерного β-катенина Xenopus laevis (1,1, 2,2 и 3,3 мкг) или мышиного СВР (0,14, 0,28, 0,55, 1,1 и 2,2 мкг) котрансфицировали в клетки SW480 вместе с конструкцией, содержащей репортерный ген, β-катенин/TCF (1,1 мкг). Пустой вектор pcDNA3 использовали для уравнивания количества ДНК, используемого в каждой реакции. Двойные люциферазные анализы выполняли спустя 24 часа после обработки СОЕДИНЕНИЕМ 1. Все эксперименты выполняли в двух повторностях и величины выражали в виде средних ± стандартное отклонение.
В. СОЕДИНЕНИЕ 1 конкурирует с β-катенином за СВР. Клетки SW480 обрабатывали 5 или 10 мкМ СОЕДИНЕНИЯ 1 или контроля (0,5% ДМСО). Спустя 24 часа после обработки лизаты инкубировали с гранулами, покрытыми либо контрольным антителом, либо анти-СВР- или анти-р300-антителами. Коиммунопреципитированные белки подвергали гель-электрофорезу и иммуноблоттингу с использованием анти-β-катенин-антител.
С. СВР (1-111) является минимальным районом взаимодействия с β-катенином. Клетки SW480, трансфицированные рядом делеционных СВР, подвергали иммунопреципитации с использованием анти-β-катенин-антител, нанесенных в виде покрытия на Белок А-агарозные гранулы. Иммунные комплексы промывали и подвергали гель-электрофорезу с последующим иммуноблоттингом с использованием анти-His-антител. Стрелки указывают на конструкции, которые оставались связанными с этими гранулами.
D. СОЕДИНЕНИЕ 1 конкурирует с β-катенином за конструкции СВР, но не за конструкции р300. Как конструкции СВР (1-111, 1-211 и 1-351), так и конструкции р300 (1-111, 1-211 и 1-351) трансфицировали в клетки SW480 (нижняя панель). Спустя 48 часов после трансфекции получали лизаты целых клеток и подвергали их иммунопреципитации с использованием Белок А-агарозы-анти-β-катенин-антител, описанных выше (средняя панель). Иммунные комплексы промывали и подвергали гель-электрофорезу и иммуноблоттингу с использованием анти-His-антител. Стрелки указывают на связанные белки (верхняя панель). Для конкурентных анализов иммунные комплексы на этих гранулах стимулировали 50 мкМ СОЕДИНЕНИЕМ 1.
Е. Сопоставление последовательностей СВР и р300 с консенсусными мотивами связывания β-катенина (SEQ ID NO:47-55). Консенсусные последовательности заключены в “боксы”. Сопоставления выполняли с использованием программы BLAST для белковых последовательностей в базе данных NCBI.
F. Сопоставление последовательностей СВР 1-111 (СВР М1, SEQ ID NO:2) и р300 1-111 (р300 М1, SEQ ID NO:4).
Фигура 4. СОЕДИНЕНИЕ 1 уменьшает ядерный β-катенин.
А. Микроскопия иммунофлуоресценции β-катенина. Клетки логарифмической фазы SW480 (слева) и НСТ116 (справа) фиксировали и окрашивали либо против β-катенина в красный цвет (верхняя панель, А), либо против СВР в зеленый цвет (верхняя панель, В). Центральная панель представляет наложенные β-катенин и СВР в клетках SW480 (слева) и клетках НСТ116 (справа). Нижняя панель показывает перераспределение β-катенина в цитоплазму клеток SW480 (слева) и цитоплазматическую мембрану клеток НСТ116 (справа) после обработки СОЕДИНЕНИЕМ 1 (25 мкМ) в течение 24 часов.
В. Вестерн-блот-анализ β-катенина. 25 мкг общего белка из клеточных экстрактов клеток SW480 с обработкой 24 часа или без обработки 24 часа СОЕДИНЕНИЕМ 1 использовали для детектирования цитозольного и ядерного β-катенина.
Фигура 5. СОЕДИНЕНИЕ 1 ингибирует экспрессию циклина D1.
А. Уровни циклина D1 уменьшаются обработкой СОЕДИНЕНИЕМ 1. Вестерн-блот-анализ выполняли на 25 мкг лизатов целых клеток SW480, обработанных в течение 4, 8 или 24 часов либо 25 мкМ СОЕДИНЕНИЯ 1, либо контролем (0,5% ДМСО). Иммуноблоттинг выполняли с использованием анти-циклин D1-антител (Santa Cruz Biotechnology Inc.).
В. In vivo занятие промоторов cyclin D1 и c-myc СВР и р300. ChIP (см. материалы и способы) демонстрирует СВР- и р300-занятие промотора c-myc после обработки СОЕДИНЕНИЕМ 1. ChIP-анализы выполняли на промоторе c-myc из клеток SW480, который обрабатывали в течение 8 часов СОЕДИНЕНИЕМ 1 (25 мкМ) или контролем (0,5% ДМСО). Использовали СВР-специфические антитела (АС-26, любезный подарок от д-ра David Livingston, Harvard University, Boston, MA) для оценки занятия промотора СВР или р300 в присутствии обработки СОЕДИНЕНИЕМ 1 или контролем (ДМСО).
Фигура 6.
А. СОЕДИНЕНИЕ 1 задерживает клетки в фазе G1. FACS-анализ выполняли на клетках SW480 (нижняя панель) и НСТ116 (верхняя панель), обработанных в течение 24 часов СОЕДИНЕНИЕМ 1 (25 мкМ) (справа) или контролем (0,5% ДМСО) (слева). 5,5 х 105 клеток фиксировали и окрашивали иодидом пропидия (PI).
В. СОЕДИНЕНИЕ 1 селективно активирует каспазы в клеточных линиях карциномы ободочной кишки. Клетки SW480 и НСТ116 (105) (левая диаграмма) вместе с нормальными клетками ободочной кишки, CCD18Co (правая диаграмма) обрабатывали контролем (0,5% ДМСО) или СОЕДИНЕНИЕМ 1 (25 мкМ). Спустя 24 часа после обработки клетки лизировали и измеряли ферментативные активности каспазы 3/7. Относительные единицы флуоресценции (RFU) рассчитывали вычитанием унифицированных величин слепого опыта (контроля, без клеток) из величин обработанных проб (СОЕДИНЕНИЕ 1 или контроль) и строили в виде диаграммы.
Фигура 7. СОЕДИНЕНИЕ 1 уменьшает рост колоний в мягком агаре зависимым от дозы образом.
А. Увеличивающиеся концентрации 5-фторурацила (5-FU) (0,5-32 мкМ) и СОЕДИНЕНИЯ 1 (0,25-5 мкМ) добавляли к клеткам SW480 (5000 клеток на лунку) в трех повторностях лунок. Клетки промывали и суспендировали в среде для выращивания на мягком агаре. Количество колоний после 8 дней (колоний с диаметром более 60 мкм) считали и наносили на график в зависимости от концентрации соединений. Показаны среднее ± SE в трех повторностях. Количество колоний контроля в отсутствие соединения было 1637±71.
В. Схематическое представление действий СОЕДИНЕНИЯ 1. Без намерения связывания с теорией, заявители предполагают, что комплекс β-катенин/TCF регулирует экспрессию его следующих далее по ходу процесса генов-мишеней зависимым от коактиваторов образом. Более конкретно, предполагается, что ядерный комплекс β-катенин/TCF дифференциально ассоциируется с СВР или р300 и этот тримерный комплекс запускает экспрессию субпопуляции чувствительных к комплексу β-катенин/TCF генов. СОЕДИНЕНИЕ 1 специфически и селективно нацелено на комплекс β-катенин/TCF/СВР, но не на комплекс β-катенин/TCF/р300 и отрицательно регулирует экспрессию таких генов, как cyclin D1, axin2 и hnkd, которые зависят от СВР. Обработка СОЕДИНЕНИЕМ 1, через блокаду взаимодействия β-катенин/СВР, увеличивает количество комплексов β-катенин/TCF, доступных для экспрессии генов, промотор которых может использовать любой коактиватор (c-myc) или предпочтительно использовать р300 в качестве коактиватора (c-jun и fra-1).
Фигура 8 обеспечивает общую схему синтеза для получения химических агентов, применимых в практике данного изобретения.
Фигура 9 обеспечивает общую схему синтеза для получения химических агентов, применимых в практике данного изобретения.
Фигура 10. Анализ метаболизма СОЕДИНЕНИЯ 3.
А. Diod Array trace (запись с использованием диодной матрицы) (верхняя панель) и общий ионный ток (нижняя панель) для СОЕДИНЕНИЯ 3 и его метаболитов в крысе.
В. Diod Array trace (запись с использованием диодной матрицы) (верхняя панель) и общий ионный ток (нижняя панель) для СОЕДИНЕНИЯ 3 и его метаболитов в человеке.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение обеспечивает агенты, которые противодействуют β-катенин/TCF-опосредованной транскрипции, и связанные с ними способы. В одном аспекте данное изобретение обеспечивает способы, посредством которых субпопуляция β-катенин/TCF-чувствительных генов специфически отрицательно регулируется, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. В другом аспекте данное изобретение обеспечивает способы, посредством которых связывание между СВР и β-катенином разрушается, но связывание между структурно родственным коактиватором р300 и β-катенином не разрушается, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. В другом аспекте данное изобретение обеспечивает способы, посредством которых гены, которые стимулируются СВР, но не р300, селективно активируются, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. Кроме того, данное изобретение обеспечивает способы, при помощи которых гены, которые стимулируются р300, но не СВР, селективно активируются, в то время как в родственном аспекте данное изобретение обеспечивает соединения, применимые в данном способе. В другом аспекте данное изобретение обеспечивает способы, при помощи которых клетки карциномы лечат химическим агентом для остановки развития в G1-фазе клеточного цикла, где пролонгированное лечение этим химическим агентом индуцирует апоптоз, который не детектируется в нормальных клетках ободочной кишки (колоноцитах).
Более конкретные подробности этих способов и агентов обеспечены ниже. Однако, перед описанием этих подробностей обеспечены следующие определения для облегчения понимания данного описания читателем.
Определения
SEQ ID NO:1 является последовательностью нуклеиновой кислоты: tgaggaatca acagccgcca tcttgtcgcg gacccgaccg gggcttcgag cgcgatctac tcggccccgc cggtcccggg ccccacaacc gcccgcgctc gctcctctcc ctcgcagccg gcagggcccc cgacccccgt ccgggccctc gccggcccgg ccgcccgtgc ccggggctgt tttcgcgagc aggtgaaaat ggctgagaac ttgctggacg gaccgcccaa ccccaaaaga gccaaactca gctcgcccgg tttctcggcg aatgacagca cagattttgg atcattgttt gacttggaaa atgatcttcc tgatgagctg.
SEQ ID NO:2 является аминокислотной последовательностью: MAENLLDGPPNPKRAKLSSPGFSANDSTDFGSLFDLENDLPDELIPNGGELGLLNSGNLVPDAASKHKQLSELLRGGSGSSINPGIGNVSASSPVQQGLGGQAQGQPNSAN.
SEQ ID NO:3 является последовательностью нуклеиновой кислоты: ccttgtttgt gtgctaggct gggggggaga gagggcgaga gagagcgggc gagagtgggc aagcaggacg ccgggctgag tgctaactgc gggacgcaga gagtgcggag gggagtcggg tcggagagag gcggcagggg ccagaacagt ggcagggggc ccggggcgca cgggctgagg cgacccccag ccccctcccg tccgcacaca cccccaccgc ggtccagcag ccgggccggc gtcgacgcta ggggggacca ttacataacc cgcgccccgg ccgtcttctc ccgccgccgc ggcgcccgaa ctgagcccgg ggcgggcgct ccagcactgg.
SEQ ID NO:4 является аминокислотной последовательностью: MAENVVEPGPPSAKRPKLSSPALSASASDGTDFGSLFDLEHDLPDELINSTELGLTNGGDINQLQTSLGMVQDAASKHKQLSELLRSGSSPNLNMGVGGPGQVMASQAQQSSPGLGL.
Ингибитор с малой молекулой: термин “малая молекула” относится к химическому соединению, имеющему формульную массу менее чем приблизительно 5000 г/моль. Это соединение может быть органическим или неорганическим, может быть синтетического или природного происхождения и может быть классифицировано как, например, пептид, олигонуклеотид, пептидный миметик, олигонуклеотидный миметик, олигосахарид, олигосахаридный миметик, аналог или производное природного продукта или чисто синтетическое соединение, которое может включать в себя, например, одну или несколько ациклических, циклических, карбоциклических, гетероциклических, полициклических и/или ароматических групп. Термин “ингибитор” относится к соединениям, которые ингибируют, до статистически значимой степени, связывание между двумя полипептидами, описанными здесь, например, β-катенином и СВР или β-катенином и р300. Другими словами, в присутствии этого ингибитора связывание между двумя полипептидами уменьшается до статистически значимой степени в сравнении со связыванием, имеющим место в отсутствие этого ингибитора. Предпочтительно, это ингибирование является достаточным для достижения действия на клеточные свойства, например, терапевтической реакции у субъекта, который получал этот ингибитор с малой молекулой.
Взаимодействие β-катенин:СВР: каждый из β-катенина и СВР является хорошо известным полипептидом. См., например, Morin, P.J., Bioessays 21:1021-30 (1999) и Hecht et al., EMBO J. 19:1839-50 (2000). Взаимодействие между β-катенином и СВР было документировано и измерено. См., например, Takemaru et al., J. Cell. Biol. 149:249-54 (2000). Термин взаимодействие β-катенин:СВР относится к связыванию, которое происходит между этими двумя белками.
Предположительный: до того как малая молекула была испытана на активность, например, в качестве модулятора активируемой β-катенин/TCF транскрипции, эта малая молекула рассматривается как предположительный модулятор. Когда эта малая молекула демонстрирует модуляторную активность, тогда она может быть названа модулятором активируемой β-катенин/TCF транскрипции. Подобным образом, до того как малая молекула была испытана в качестве ингибитора белок-белкового взаимодействия, например, взаимодействия β-катенин:СВР, эта малая молекула может называться предположительным ингибитором взаимодействия β-катенин:СВР.
Контактирование: когда два вещества, например, химическое соединение, белок, олигонуклеотид и т.д., помещены оба в жидкую среду, например, воду или буфер, и не имеют ограничений, приложенных к их перемещению в этой среде, тогда эти два вещества контактируют друг с другом. Кроме того, когда два вещества помещены рядом друг с другом, так что эти два вещества соприкасаются друг с другом, тогда эти вещества контактируют друг с другом. В выполнении тестов (анализов), два вещества контактируют друг с другом, когда они, например, оба помещены в тест-среду.
β-катенин обозначает белок, который хорошо известен в данной области, см., например, Morin, P.J., Bioessays 21:1021-30 (1999); Gottardi et al., Curr. Biol. 11:R792-4 (2001); Huber et al., Cell 105:391-402 (2001). β-катенин был идентифицирован как в качестве медиатора клеточной адгезии в плазматической мембране, так и в качестве активатора транскрипции.
Термин “тест” (анализ) относится к процессу или процедуре, во время которой различные вещества (например, химикалии, ферменты и т.д.) контактируют друг с другом при выбранных условиях, которые будут, или не будут, вызывать появление детектируемого события. Определение, детектируется ли это событие, дает информацию о различных веществах (веществе) и/или выбранных условиях (условии).
Термин “ингибирует связывание”, “ингибирует взаимодействие”, “ингибирует образование комплекса” и т.п., каждый их которых относится к эффекту уменьшения, до статистически значимой степени, силы или степени или меры связывания между двумя белками. Сильное связывание может происходить, когда, например, два белка являются значимо более стабильными в форме комплекса в сравнении с их не находящимися в комплексе формами. Исследования белок-белкового связывания, как качественные, так и количественные, хорошо известны в данной области. Примеры, относящиеся к связыванию β-катенина, описаны в: Brantjes et al., Biol. Chem. 383:255-61 (2002, в отношении связывания β-катенина с членами семейства факторов Т-клеток (TCF)); Gottardi et al., Curr. Biol. 11:R792-4 (2001), в отношении описания структурных элементов β-катенина, которые взаимодействуют с партнерами связывания) и Takemaru et al., J. Cell Biol. 149:249-54 (2000, в отношении описания взаимодействия β-катенина с СВР).
Термин “белок СВР” относится к белку, который известен так же как CREB-связывающий белок, где CREB является аббревиатурой “связывания ц-АМФ-чувствительного элемента”. Этот белок хорошо известен в данной области, см., например, Takemaru et al., J. Cell Biol. 149:249-54 (2000) и Патент США № 6063583.
СВР 1-111 относится к первым 111 аминокислотам белка СВР, идентифицированным от N-конца СВР. Аминокислоты 1-111 для СВР, выделенного из человека, представлены выше в виде SEQ ID NO:2. Соответствующая последовательность нуклеиновой кислоты представлена выше в виде SEQ ID NO:1. Аминокислоты 1-111 для СВР, выделенного из мыши, представлены в виде SEQ ID NO:5 следующим образом: MAENLLDGPPNPKRAKLSSPGFSANDNTDFGSLFDLENDLPDELI PNGELSLLNSGNLVPDAASKHKQLSELLRGGSGSSINPGIGNVSASSPVQQGLGGQAQGQPNS TN. Соответствующая последовательность нуклеиновой кислоты из мыши представлена в виде SEQ ID NO:6 следующим образом: atggccgaga acttgctgga cggaccgccc aaccccaaac gagccaaact cagctcgccc ggcttctccg cgaatgacaa cacagatttt ggatcattgt ttgacttgga aaatgacctt cctgatgagc tgatccccaa tggagaatta agccttttaa acagtgggaa ccttgttcca gatgctgcgt ccaaacataa acaactgtca gagcttctta gaggaggcag cggctctagc atcaacccag ggataggcaa tgtgagtgcc agcagccctg tgcaacaggg ccttggtggc caggctcagg ggcagccgaa cagtacaaac.
р300 1-111 относится к первым 111 аминокислотам белка р300, идентифицированным от N-конца р300. Аминокислоты 1-111 для р300, выделенного из человека, идентифицированы выше в виде SEQ ID NO:4. Соответствующая последовательность нуклеиновой кислоты, которая кодирует этот пептид, представлена выше в виде SEQ ID NO:3.
Известно, что β-катенин природно взаимодействует, т.е. образует комплекс (комплексы) с большим количеством различных белков, в том числе р300 и СВР (см., например, Hecht et al., EMBO J. 19:1839-50 (2000). В присутствии множественных различных потенциальных партнеров связывания β-катенин будет связываться с этими потенциальными партнерами до различных степеней, в зависимости от силы связывания между β-катенином и потенциальным партнером связывания. Селективное ингибирование связывания β-катенина имеет место, когда степень связывания между β-катенином и по меньшей мере одним из этих партнеров связывания (первым партнером связывания) является уменьшенной относительно степени связывания между β-катенином и по меньшей мере другим партнером из этих партнеров связывания (вторым партнером связывания). Это относительное уменьшение связывания можно наблюдать в виде уменьшенного связывания между β-катенином и первым партнером связывания без влияния на связывание между β-катенином и вторым партнером связывания; или его можно наблюдать в виде уменьшенного связывания между β-катенином и первым партнером связывания с увеличенным связыванием между β-катенином и вторым партнером связывания; или его можно наблюдать в виде уменьшенного связывания между β-катенином и первым партнером связывания вместе с уменьшенным связыванием между β-катенином и вторым партнером связывания до тех пор, пока уменьшение связывания между β-катенином и первым партнером связывания является более высоким, чем уменьшение связывания между β-катенином и вторым партнером связывания.
Термин “белок р300” относится к белку, хорошо известному в данной области. См., например, Gusterson, R.J. et al., J. Biol. Chem. 2003 Feb 28; 278(9):6838-47; An and Roeder, J Biol Chem. 2003 Jan 17; 278(3):1504-10; Rebel, V.I. et al., Proc. Natl. Acad. Sci. USA 2002 Nov 12; 99(23):14789-94 и Патент США № 5658784, а также цитируемые в них ссылки.
Под “по существу очищенные” имеют в виду, что данные нуклеиновая кислота или полипептид являются отделенными от других нуклеиновых кислот или полипептидов и являются по существу не содержащими других нуклеиновых кислот или полипептидов, т.е. нуклеиновая кислота или полипептид является первичным и активным компонентом. Термин “выделенная” относится в данном контексте к молекуле, отделенной по существу от всех других молекул, нормально ассоциированных с ней в ее природном состоянии. По существу очищенной и выделенной молекулой является преобладающая молекула, присутствующая в препарате. По существу очищенная молекула может быть более чем на 60%, предпочтительно на 75%, более предпочтительно на 90% свободной и наиболее предпочтительно на 95% свободной от других молекул (исключая растворитель), присутствующих в природной смеси. Термин “выделенные” не включает в себя молекулы, присутствующие в их нативном состоянии.
Выражение “вероятность связывания с СВР в сравнении с р300” относится к вероятности молекулы β-катенина, которая связывается с СВР в сравнении с р300. Такая вероятность может быть выражена и/или измерена отношением количества молекул β-катенина, которые связываются с СВР, к количеству молекул β-катенина, которые связываются с р300, при конкретных условиях. Подобным образом, агентом, который “изменяет вероятность связывания β-катенина с СВР в сравнении с р300”, называют соединение, которое изменяет описанное выше отношение в присутствии этого соединения в реакционной смеси в сравнении с отношением, наблюдаемым, когда это соединение отсутствует в этой реакционной смеси.
Выражение “вероятность того, что клетка будет дифференцироваться, а не пролиферировать” относится к вероятности того, что клетка будет дифференцироваться, а не пролиферировать. Такая вероятность может быть выражена и/или измерена отношением количества клеток, которые дифференцируются, к количеству клеток, которые пролиферируют, при конкретных условиях. Агентом, который “увеличивает вероятность того, что клетка будет дифференцироваться, а не пролиферировать”, называют соединение, которое увеличивает отношение количества клеток, которые дифференцируются, к количеству клеток, которые пролиферируют, в присутствии этого соединения, в сравнении с тем же самым отношением в отсутствие этого соединения. Подобным образом, агентом, который “увеличивает вероятность того, что клетка будет пролиферировать, а не дифференцироваться”, называют соединение, которое увеличивает отношение количества клеток, которые пролиферируют, к количеству клеток, которые дифференцируются, в присутствии этого соединения, в сравнении с тем же самым отношением в отсутствие этого соединения.
Выражение “путь Wnt” относится к каскаду передачи сигнала, который может инициироваться связыванием белков Wnt (секретируемых гликопротеинов) с frizzled seven-трансмембранными рецепторами. Этот путь известен и охарактеризован в данной области и является предметом многочисленных статей и обзоров (см., например, Huelsken and Behrens, J. Cell Sci. 115:3977-8, 2002; Wodarz et al., Annu. Rev. Cell Dev. Biol. 14:59-88 (1998); Morin, P.J., Bioessays 21:1021-30 (1999); Moon et al., Science 296:1644-46 (2002); Oving et al., Eur. J. Clin. Invest. 32:448-57 (2002); Sakanaka et al., Recent Prog. Horm. Res. 55:225-36, 2000).
Выражение “активность пути Wnt” относится к активности по меньшей мере одного компонента этого пути. Например, активность пути Wnt, в некоторых вариантах осуществления, может относиться к активности β-катенина в индукции экспрессии генов-мишеней. Многие компоненты пути Wnt известны в данной области и включают в себя, но не ограничиваются ими, Cerberus (Cer), FrzB, Dickkopf (DKK), LRP, гетеротримерный G-белок, Dsh, казеинкиназу Iα (CKIα), GSK3β, βTrCP, ACP, Axin, CBP, p300, β-катенин, TCF, Froucho и т.д.
Соединением, которое “активирует путь Wnt”, называют соединение, которое приводит к индуцированной β-катенином экспрессии генов-мишеней, когда оно присутствует в системе, имеющей путь Wnt. Многие гены-мишени, экспрессия которых индуцируется β-катенином, известны в данной области и включают в себя, но не ограничиваются ими, Conductin, Myc, Twin, Cyclin D1, Nkd, Ubx, En-2, PPARδ, Xbra, ID2, Siamois, Xnr3, MMP7, TCF-1, survivin и т.д. Такие гены могут быть также названы “генами-мишенями пути Wnt/β-катенина”.
Выражение “селективно ингибирующие экспрессию генов-мишеней пути Wnt/β-катенина” относится к ингибированию экспрессии субпопуляции генов-мишеней пути Wnt/β-катенина, но не к ингибированию экспрессии других генов-мишеней пути Wnt/β-катенина. Хотя и не желая быть связанными с каким-либо конкретным механизмом, авторы данного изобретения рассуждают о том, что селективное ингибирование экспрессии генов может сопровождаться разрушением взаимодействия между β-катенином и некоторыми, но не всеми, его потенциальными партнерами связывания.
Агенты
В одном аспекте данное изобретение обеспечивает агенты, которые могут быть использованы в описанных выше способах. Кроме СОЕДИНЕНИЯ 1, другие агенты, применимые в способах данного изобретения, могут быть идентифицированы скринингом соединений общей формулы (I):
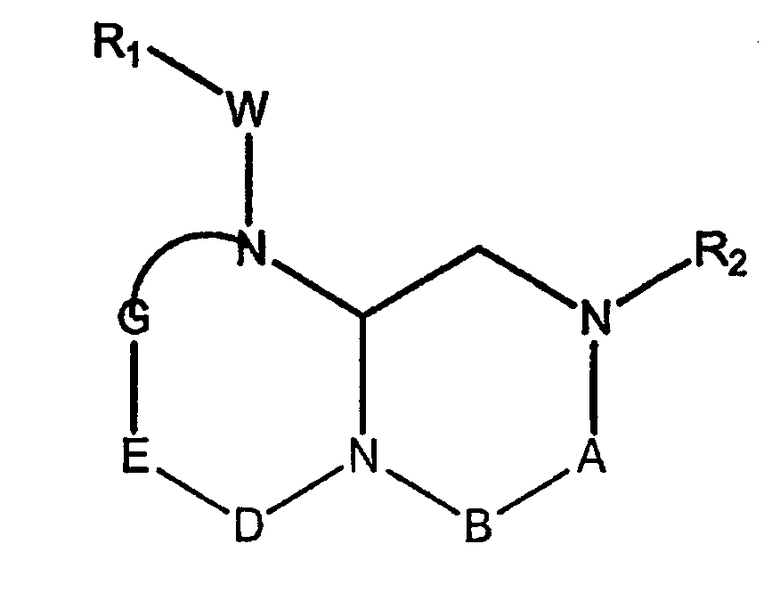
где А обозначает -(CHR3)- или -(С=О)-, В обозначает -(CHR4)- или -(С=О)-, D обозначает -(CHR5)- или -(С=О)-, Е обозначает -(ZR6)- или -(С=О)-, G обозначает -(XR7)n-, -(CHR7)-(NR8)-, -(С=О)-(XR9)- или -(С=О)-, W обозначает -Y(C=O)-, -(C=O)NH-, -(SO2)- или отсутствует, Y обозначает кислород или серу, Х и Z обозначают независимо азот или СН, n=0 или 1; и R1, R2, R3, R4, R5, R6, R7, R8 и R9 являются одинаковыми или различными и независимо выбраны из части боковой цепи аминокислоты, производного части боковой цепи аминокислоты или остатка молекулы, и их стереоизомеров.
В одном варианте осуществления, R1, R2, R3, R4, R5, R6, R7, R8 и R9 независимо выбраны из группы, состоящей из аминоС2-5алкила, гуанидиноС2-5алкила, С1-4алкилгуанидиноС2-5алкила, диС1-4алкилгуанидино-С2-5алкила, амидиноС2-5алкила, С1-4алкиламидиноС2-5алкила, диС1-4алкиламидиноС2-5алкила, С1-3алкокси, фенила, замещенного фенила (где заместители выбраны независимо из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бензила, замещенного бензила (где заместители на бензиле независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), нафтила, замещенного нафтила (где заместители независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), бис-фенилметила, замещенного бис-фенилметила (где заместители независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридила, замещенного пиридила (где заместители независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиридилС1-4алкила, замещенного пиридилС1-4алкила (где заместители пиридина независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), пиримидилС1-4алкила, замещенного пиримидилС1-4алкила (где заместители пиримидина независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), триазин-2-ил-С1-4алкила, замещенного триазин-2-ил-С1-4алкила (где заместители триазина независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазоС1-4алкила, замещенного имидазолС1-4алкила (где заместители имидазола независимо выбраны из одного или нескольких из амино, амидино, гуанидино, гидразино, амидазонила, С1-4алкиламино, С1-4диалкиламино, галогена, перфторС1-4алкила, С1-4алкила, С1-3алкокси, нитро, карбокси, циано, сульфурила или гидроксила), имидазолинилС1-4алкила, N-амидинопиперазинил-N-С0-4алкила, гидроксиС2-5алкила, С1-5алкиламиноС2-5алкила, С1-5диалкиламиноС2-5алкила, N-амидинопиперидинилС1-4алкила и 4-аминоциклогексилС0-2алкила.
В одном варианте осуществления, R1, R2, R6 в Е и R7, R8 и R9 в G являются одинаковыми или различными и представляют остаток этого соединения, а R3 в А, R4 в В или R5 в D выбраны из части боковой цепи аминокислоты или ее производного.
В другом варианте осуществления, R3 в А, R5 в D, R6 в Е и R7, R8 и R9 в G являются одинаковыми или различными и представляют остаток этого соединения, в то время как один или несколько из, и в одном аспекте все из, R1, R2 и R4 в В представляют боковую цепь аминокислоты. В этом случае термин “остаток соединения” обозначает любую часть, агент, соединение, носитель, молекулу, линкер, аминокислоту, пептид или белок, ковалентно присоединенные к структуре миметика с обращенной конформацией в положениях R3, R5, R6, R7, R8 и/или R9. Этот термин включает в себя также части боковых цепей аминокислот и их производные.
В данном контексте, термин “остаток этого соединения” обозначает любую часть, агент, соединение, носитель, молекулу, атом, линкер, аминокислоту, пептид или белок, ковалентно присоединенные к структуре миметика с обращенной конформацией. Этот термин включает в себя также части боковых цепей аминокислот и их производные. В одном аспекте данного изобретения, любое одно или несколько из положений R1, R2, R3, R4, R5, R6, R7, R8 и/или R9 могут представлять остаток этого соединения. В одном аспекте данного изобретения один или несколько из R1, R2 и R4 представляют часть боковой цепи аминокислоты или ее производное.
В данном контексте, термин “часть боковой цепи аминокислоты” представляет любую часть боковой цепи аминокислоты, присутствующей в природно встречающихся белках, в том числе части боковых цепей аминокислот, идентифицированные в таблице А. Другие природно встречающиеся части боковых цепей аминокислот данного изобретения включают в себя (но не ограничиваются ими) части боковых цепей аминокислот 3,5-дибромтирозина, 3,5-дииодтирозина, гидроксилизина, γ-карбоксиглутамата, фосфотирозина и фосфосерина. Кроме того, гликозилированные цепи боковых цепей аминокислот могут быть также использованы в практике данного изобретения, в том числе (но не только) гликозилированный треонин, серин и аспарагин.
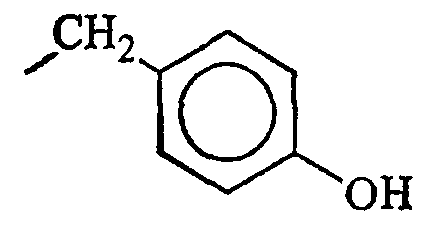
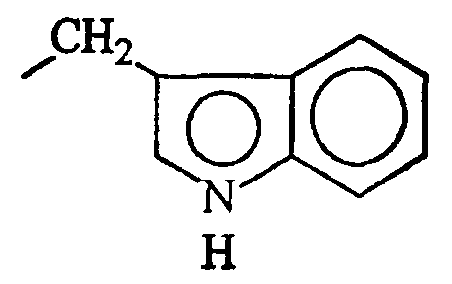
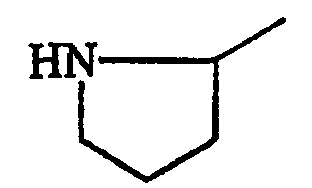
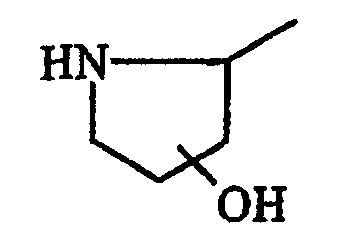
Кроме природно встречающихся частей боковых цепей аминокислот, части боковых цепей аминокислот данного изобретения включают в себя также различные их производные. В данном контексте, “производное” части боковой цепи аминокислоты включает в себя модификации и/или вариации частей боковых цепей природно встречающихся аминокислот. Например, части боковых цепей аминокислот аланина, валина, лейцина, изолейцина и фенилаланина могут быть обычно классифицированы как низшие алкильные, арильные или арилалкильные части молекулы. Производные частей боковых цепей аминокислот включают в себя другие имеющие прямую цепь или разветвленные циклические или нециклические, замещенные или незамещенные, насыщенные или ненасыщенные низшие алкильные, арильные или арилалкильные части молекулы.
В данном контексте, “низшие алкильные части” содержат 1-12 атомов углерода, “низшие арильные части” содержат 6-12 атомов углерода и “низшие аралкильные части” содержат 7-12 атомов углерода. Таким образом, в одном варианте осуществления, производное боковой цепи аминокислоты выбрано из С1-12алкила, С6-12арила и С7-12арилалкила, и в более предпочтительном варианте осуществления, из С1-7алкила, С6-10арила и С7-11арилалкила.
Производные боковых цепей аминокислот данного изобретения дополнительно включают в себя замещенные производные низших алкильных, арильных и арилалкильных частей, где этот заместитель выбран из (но не ограничивается ими) одной или нескольких из следующих химических групп: -ОН, -OR, -COOH, -COOR, -CONH2, -NH2, -NHR, -NRR, -SH, -SR, -SO2R, -SO2H, -SOR и галогена (в том числе F, Cl, Br и I), где в каждом случае R независимо выбран из имеющих прямую цепь или разветвленных, циклических или нециклических, замещенных или незамещенных, насыщенных или ненасыщенных низших алкильных, арильных или аралкильных частей. Кроме того, циклические низшие алкильные, арильные и арилалкильные части молекул данного изобретения включают в себя нафталин, а также гетероциклические соединения, такие как тиофен, пиррол, фуран, имидазол, оксазол, тиазол, пиразол, 3-пирролин, пирролидин, пиридин, пиримидин, пурин, хинолин, изохинолин и карбазол. Производные боковых цепей аминокислот дополнительно включают в себя гетероалкилпроизводные алкильной части низших алкильных и аралкильных частей, в том числе (но не только) алкил- и аралкилфосфонаты и силаны.
Репрезентативные части молекул R1, R2, R3, R4, R5, R6, R7, R8 и R9 конкретно включают в себя (но не ограничиваются ими) -ОН, -OR, -COR, -COOR, -CONH2, -CONR, -CONRR, -NH2, -NHR, -NRR, -SO2R и -COSR, где в каждом случае R имеет определенное выше значение.
В следующем варианте осуществления, кроме того, что они являются частью боковой цепи аминокислоты или ее производным (или остатком этого соединения в случае R1, R2, R3, R5, R6, R7, R8 и R9), R1, R2, R3, R4, R5, R6, R7, R8 и R9 могут быть линкером, облегчающим связывание этого соединения с другой частью молекулы или с другим соединением. Например, соединения данного изобретения могут быть связаны с одним или несколькими известными соединениями, такими как биотин, для применения в диагностическом анализе или скрининг-анализе. Кроме того, R1, R2, R3, R4, R5, R6, R7, R8 и R9 могут быть линкером, присоединяющим это соединение к твердому носителю (такому как носитель, используемый в твердофазном пептидном синтезе). В этом варианте осуществления, связывание с другой частью молекулы или с другим соединением или с твердым носителем происходит предпочтительно в положении R1, R2, R7 или R8 или R9 и более предпочтительно в положении R1 или R2.
В варианте осуществления, где А обозначает -(CHR3)-, В обозначает -(С=О)-, D обозначает -(CHR5)-, Е обозначает -(С=О)-, G обозначает -(XR7)n-, это миметическое соединение данного изобретения с обращенной конформацией имеет следующую формулу (II):
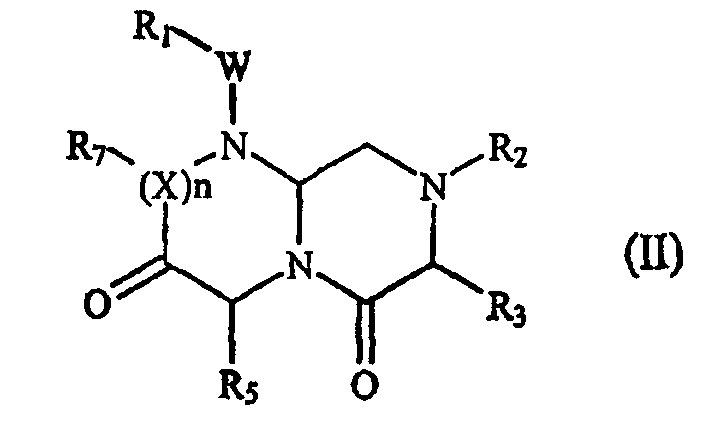
где R1, R2, R3, R5, R7, W, X и n имеют определенные выше значения. В предпочтительном варианте осуществления R1, R2 и R7 представляют остаток этого соединения, а R3 или R5 выбран из части боковой цепи аминокислоты.
В варианте осуществления, где А обозначает -(С=О)-, В обозначает -(CHR4)-, D обозначает -(С=О)-, Е обозначает -(ZR6)-, G обозначает -(С=О)-(XR9)-, это миметическое соединение с обращенной конформацией имеет следующую общую формулу (III):
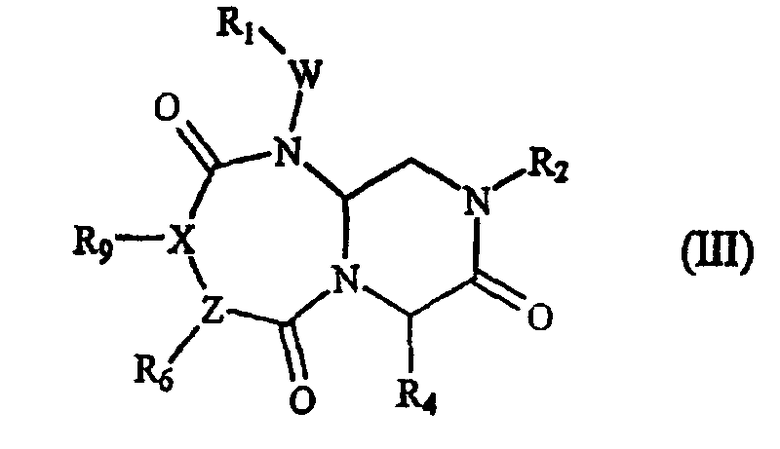
где R1, R2, R4, R6 R9, W и Х имеют определенные выше значения, Z обозначает азот или СН (когда Z обозначает СН, тогда Х обозначает азот). В предпочтительном варианте осуществления, R1, R2, R6 и R9 представляют остаток этого соединения, а R4 выбран из части боковой цепи аминокислоты.
В более специфическом варианте осуществления, где А обозначает -(С=О)-, В обозначает -(CHR4)-, D обозначает -(С=О)-, Е обозначает -(ZR6)-, G обозначает -(XR7)n-, это миметическое соединение с обращенной конформацией данного изобретения имеет следующую формулу (IV):
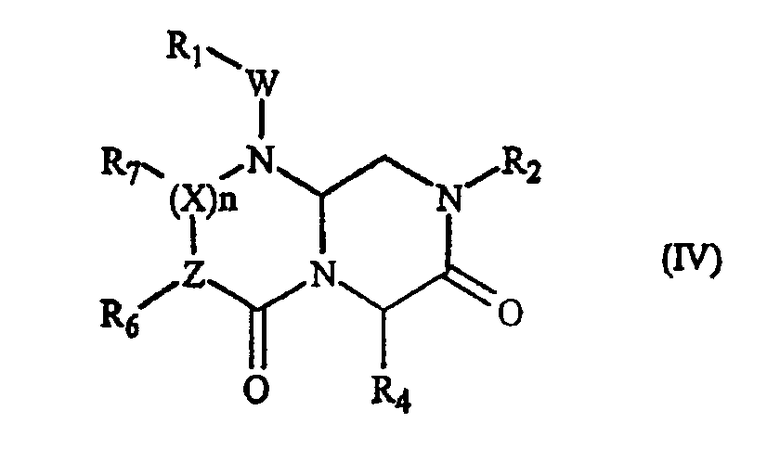
где R1, R2, R4, R6, R7, W, X и n имеют определенные выше значения, Z обозначает азот или СН (когда Z обозначает азот, тогда n равно нулю, и когда Z обозначает СН, тогда Х обозначает азот и n не равно нулю). В предпочтительном варианте осуществления, R1, R2, R6 и R7 представляют остаток данного соединения, а R7 выбран из части боковой цепи аминокислоты. В одном аспекте R6 или R7 выбран из части боковой цепи аминокислоты, когда Z и Х, оба, обозначают СН.
Эти соединения могут быть получены с использованием подходящих исходных составляющих молекул (далее называемых “составляющими компонентами”). Вкратце, в миметических структурах с обращенной конформацией, имеющих формулу (I), первый и второй составляющие компоненты связаны с образованием объединенного первого-второго промежуточного продукта, если необходимо, третий и/или четвертый составляющие компоненты связаны с образованием объединенного третьего-четвертого промежуточного продукта (или, если он доступен коммерчески, может быть использован единственный третий промежуточный продукт), затем объединенные первый-второй промежуточный продукт и третий-четвертый промежуточный продукт (или третий промежуточный продукт) связывают для получения первого-второго-третьего-четвертого промежуточного продукта (или первого-второго-третьего промежуточного продукта), который циклизуют с получением миметических структур с обращенной конформацией данного изобретения. Альтернативно, эти миметические структуры с обращенной конформацией формулы (I) могут быть получены последовательным связыванием индивидуальных составляющих компонентов либо ступенчатым способом в растворе, либо твердофазным синтезом, как это обычно практикуется в твердофазном пептидном синтезе.
Конкретные составляющие компоненты и их сборка для получения соединений данного изобретения иллюстрированы на фигуре 8. Например, “первый составляющий компонент” может иметь следующую формулу S1:
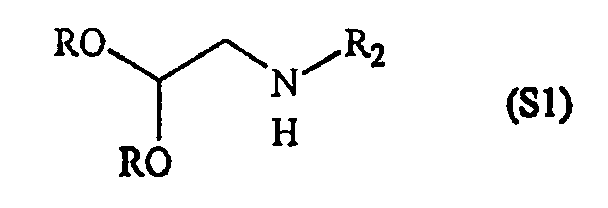
где R2 имеет определенное выше значение и R обозначает защитную группу, подходящую для применения в пептидном синтезе, где эта защитная группа может быть присоединена к полимерному носителю для создания возможности твердофазного синтеза. Подходящие R-группы включают в себя алкильные группы и, в предпочтительном варианте осуществления, R обозначает метильную группу. На фигуре 8 одна из групп R является полимерным (твердым) носителем, указанным как “Pol” на этой фигуре. Такие первые составляющие компоненты могут быть легко синтезированы восстановительным аминированием H2N-R2 с СН(OR)2-CHO или реакцией замещения между H2N-R2 и СН(OR)2-CH2-LG (где LG обозначает уходящую группу, например, галоген (Hal)).
“Второй составляющий компонент” может иметь следующую формулу S2:
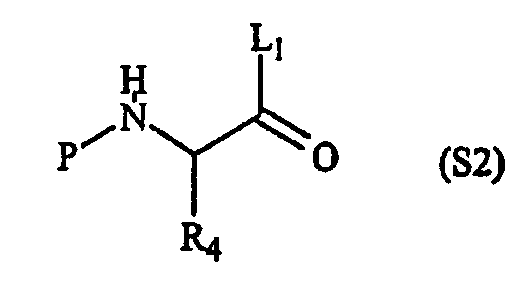
где Р обозначает аминозащитную группу, подходящую для применения в пептидном синтезе, L1 обозначает группу активации гидроксила или карбоксила и R4 имеет определенное выше значение. Предпочтительные защитные группы включают в себя трет-бутилдиметилсилил (TBDMS), трет-бутилоксикарбонил (ВОС), метоксикарбонил (МОС), 9Н-флуоренилметилоксикарбонил (FMOC) и аллилоксикарбонил (Alloc). N-защищенные аминокислоты являются коммерчески доступными; например, FMOC-аминокислоты доступны из различных источников. Для того чтобы этот второй составляющий компонент был реактивным с первым составляющим компонентом, L1 является группой активации карбоксила, и превращение карбоксильных групп в активированные карбоксильные группы может быть легко достигнуто способами активации карбоксильных групп, известными в данной области. Подходящие активированные группы карбоновых кислот включают в себя галогенангидриды, где L1 обозначает галогенид, такой как хлорид или бромид, ангидриды карбоновых кислот, где L1 обозначает ацильную группу, такую как ацетил, реактивные эфиры, такие как сложные эфиры N-гидроксисукцинимида и сложные пентафторфениловые эфиры, и другие активированные промежуточные продукты, такие как активный промежуточный продукт, образованный в реакции сочетания с использованием карбодиимида, такого как дициклогексилкарбодиимид (DCC). Таким образом, коммерчески доступные N-защищенные аминокислоты могут быть превращены в карбоксильные активированные формы способом, известным специалисту с квалификацией в данной области.
В случае азидопроизводного аминокислоты, служащего в качестве второго составляющего компонента, такие соединения могут быть получены из соответствующей аминокислоты реакцией, описанной Zaloom et al. (J. Org. Chem. 46:5173-76, 1981).
Альтернативно, первый составляющий компонент данного изобретения может иметь следующую формулу S1':
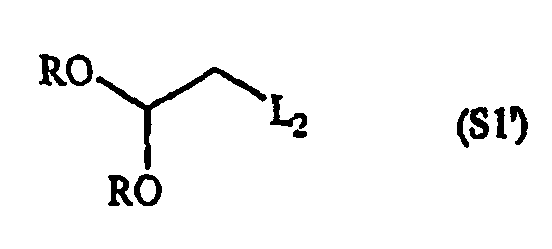
где R имеет определенное выше значение и L2 обозначает уходящую группу, такую как атом галогена или тозильная группа, а второй составляющий компонент данного изобретения может иметь следующую формулу S2':
где R2, R4 и Р имеют определенные выше значения.
“Третий составляющий компонент” данного изобретения может иметь следующую формулу S3:
где G, E, L1 и L2 имеют определенные выше значения. Подходящие третьи составляющие компоненты являются коммерчески доступными из различных источников или могут быть получены способами, хорошо известными в органической химии.
На фигуре 8 соединение формулы (1) имеет -(С=О)- для А, -(CHR4) для В, -(С=О)- для D и -(CR6)- для Е. Соединения формулы (1), в которых карбонильная группа находится в положении В и группа R находится в положении В, т.е. соединения, в которых А обозначает (CHR3)- и В обозначает -(С=О)-, могут быть получены способом, аналогичным способу, показанному на фигуре 8, как иллюстрировано на фигуре 9. Фигура 9 иллюстрирует также добавление четвертого составляющего компонента к промежуточному продукту из первого-второго-третьего компонентов, а не присоединение четвертого составляющего компонента к третьему составляющему компоненту перед реакцией с первым-вторым промежуточным компонентом. Кроме того, фигура 9 иллюстрирует получение соединений данного изобретения, в которых D обозначает (CHR5)- (а не -(С=О)-, как на фигуре 8) и Е обозначает -(С=О)- (а не -(CHR6)-, как на фигуре 8). Наконец, фигура 9 иллюстрирует получение соединений, в которых G обозначает NR7.
Таким образом, как иллюстрировано выше, миметические соединения с обращенной конформацией формулы (I) могут быть синтезированы реакцией первого составляющего компонента со вторым составляющим компонентом с получением объединенного первого-второго промежуточного продукта, с последующей реакцией объединенного первого-второго промежуточного продукта с третьим составляющим компонентом последовательно с получением объединенного первого-второго-третьего-четвертого промежуточного продукта и затем циклизацией этого промежуточного продукта с получением миметической структуры с обращенной конформацией.
Миметические структуры с обращенной конформацией формулы (III) и (IV) могут быть получены способами, аналогичными модульному синтезу компонентов, описанному выше, но с подходящими модификациями в отношении составляющих компонентов.
Например, соединения, применимые в данном изобретении, могут быть описаны общей формулой:
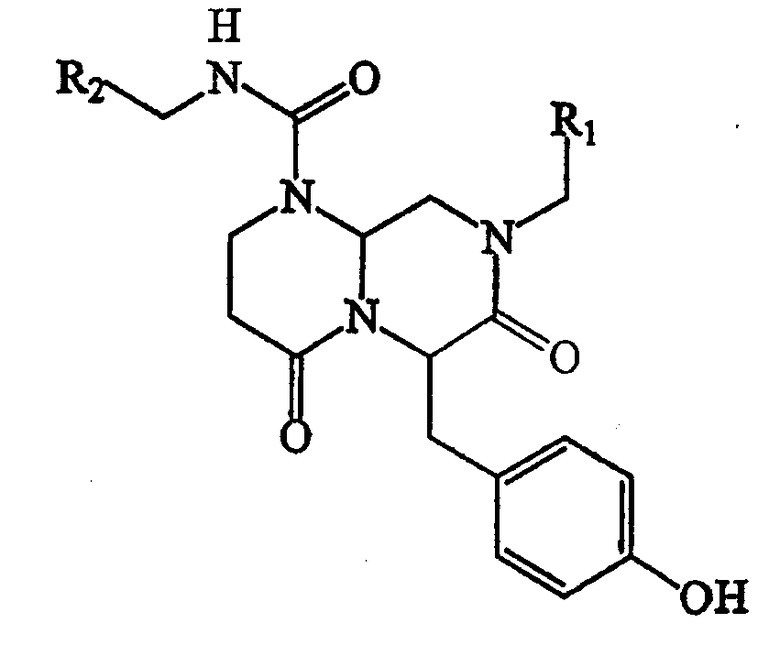
где R1 обозначает бициклическое арильное кольцо, имеющее 8-11 членов кольца, которое может иметь 1-3 гетероатома, выбранных из азота, кислорода и серы, и R2 обозначает моноциклическое арильное кольцо, имеющее 5-7 членов кольца, которое может иметь 1-2 гетероатома, выбранных из азота, кислорода или серы, и любое арильное кольцо в этом соединении может иметь один или несколько заместителей, выбранных из группы, состоящей из галогенида, гидрокси, циано, низшей алкильной группы или низшей алкоксигруппы.
Предпочтительно, R1 обозначает нафтильную, хинолинильную или изохинолинильную группу и R2 обозначает фенил, пиридил или пиперидил. Более предпочтительно, R1 обозначает нафтил, а R2 обозначает фенил.
В другом предпочтительном варианте осуществления, это соединение имеет следующую (6S,10R)-конфигурацию:
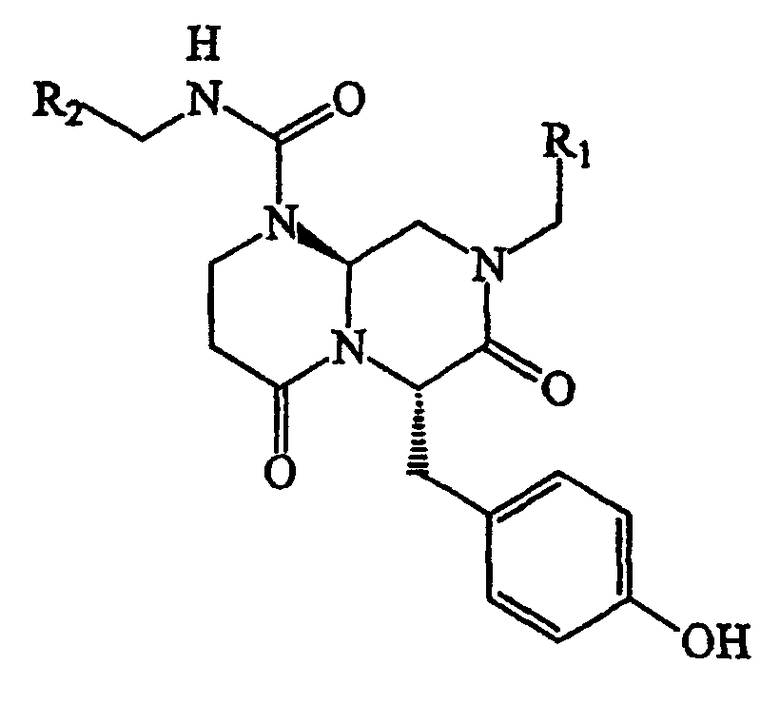
где R1 и R2 имеют определенные выше значения. В другом предпочтительном варианте осуществления, соединение общей формулы (I) имеет химическую структуру, показанную на фигуре 1А, где это соединение называют здесь СОЕДИНЕНИЕМ 1. Соединения, имеющие общую формулу (I), могут быть получены, как описано в Патенте США № 6184223, переуступленном Molecumetics Ltd. Предшествующее обсуждение представлено в отношении активности СОЕДИНЕНИЯ 1, однако, другие соединения формулы (I) могут быть подвергнуты скринингу на активность в данных способах.
Дополнительные примеры агентов, применимых в данном изобретении, могут быть найдены в PCT Publication No. WO 03/031448, U.S. Publication No. US20040072831, Заявках США с номерами 10/803179 и 10/826972, обе из которых озаглавлены “Миметики с обращенной конформацией и связанный с ними способ”.
Молекулы нуклеиновых кислот
В одном аспекте данное изобретение обеспечивает различные молекулы нуклеиновых кислот, кодирующие полипептиды, применимые в скрининге на агенты, которые селективно ингибируют взаимодействие между β-катенином и СВР в сравнении с взаимодействием между β-катенином и р300.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную молекулу нуклеиновой кислоты, содержащую SEQ ID NO:1 (или SEQ ID NO:6) или последовательность, имеющую по меньшей мере 80%, 85%, 90%, 95%, 98% или 99% идентичность относительно SEQ ID NO:1 (или SEQ ID NO:6), при условии, что указанная последовательность не кодирует полноразмерный белок СВР человека (или мыши). В данном контексте процентную идентичность двух нуклеиновых кислот определяют с использованием программ BLAST (Altschul et al., (J. Mol. Biol. 215:403-10, 1990) c их параметрами по умолчанию. Эти программы осуществляют алгоритм Karlin и Altschul (Proc. Natl. Acad. Sci. USA 87:2264-8, 1990), модифицированный, как описано Karlin и Altschul (Proc. Natl. Acad. Sci. USA 90:5873-7, 1993). Программы BLAST доступны, например, на web-сайте http://www.ncbi.nlm.nih.gov. В предпочтительном варианте осуществления, эта последовательность нуклеиновой кислоты кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, эта молекула нуклеиновой кислоты кодирует аминокислотную последовательность, которая содержит не более чем 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250 или 300 последовательных аминокислотных остатков, присутствующих в природно встречающейся последовательности СВР (например, СВР человека или СВР мыши). В некоторых вариантах осуществления, эта молекула нуклеиновой кислоты содержит SEQ ID NO:1 или SEQ ID NO:6.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, содержащую фрагмент SEQ ID NO:1 (или SEQ ID NO:6) или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует белок СВР. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 30, или по меньшей мере 60, или по меньшей мере 90, или по меньшей мере 120, или по меньшей мере 150, или по меньшей мере 180, или по меньшей мере 210, или по меньшей мере 240, или по меньшей мере 270, или по меньшей мере 300 нуклеотидов, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 300, или 270, или 240, или 210, или 180, или 150, или 120, или 90, или 60 нуклеотидов. Независимо, а также необязательно, этот фрагмент в данной последовательности нуклеотидов имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:1 (или SEQ ID NO:6). В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, состоящую по существу из SEQ ID NO:1 (или SEQ ID NO:6) или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:1 (или SEQ ID NO:6). В различных необязательных вариантах осуществления, эта последовательность имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно SEQ ID NO:1 (или SEQ ID NO:6). В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, состоящую по существу из фрагмента SEQ ID NO:1 (или SEQ ID NO:6) или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 30, или по меньшей мере 60, или по меньшей мере 90, или по меньшей мере 120, или по меньшей мере 150, или по меньшей мере 180, или по меньшей мере 210, или по меньшей мере 240, или по меньшей мере 270, или по меньшей мере 300 нуклеотидов, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 300, или 270, или 240, или 210, или 180, или 150, или 120, или 90, или 60 нуклеотидов. Независимо, а также необязательно, этот фрагмент в данной последовательности нуклеотидов имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:1 (или SEQ ID NO:6). В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, состоящую из SEQ ID NO:1 (или SEQ ID NO:6) или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:1 (или SEQ ID NO:6). В различных необязательных вариантах осуществления, эта последовательность имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно SEQ ID NO:1 (или SEQ ID NO:6). В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, состоящую из фрагмента SEQ ID NO:1 (или SEQ ID NO:6) или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 30, или по меньшей мере 60, или по меньшей мере 90, или по меньшей мере 120, или по меньшей мере 150, или по меньшей мере 180, или по меньшей мере 210, или по меньшей мере 240, или по меньшей мере 270, или по меньшей мере 300 нуклеотидов, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 300, или 270, или 240, или 210, или 180, или 150, или 120, или 90, или 60 нуклеотидов. Независимо, а также необязательно, этот фрагмент в данной последовательности нуклеотидов имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:1 (или SEQ ID NO:6). В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную молекулу нуклеиновой кислоты, содержащую SEQ ID NO:3 или последовательность, имеющую по меньшей мере 80%, 85%, 90%, 95%, 98% или 99% идентичность относительно SEQ ID NO:3, при условии, что указанная последовательность не кодирует полноразмерный белок р300 человека. В некоторых вариантах осуществления, эта последовательность нуклеиновой кислоты кодирует аминокислотную последовательность, которая содержит не более чем 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250 или 300 последовательных аминокислотных остатков, присутствующих в природно встречающейся последовательности р300 (например, р300 человека или р300 мыши). В некоторых вариантах осуществления, эта молекула нуклеиновой кислоты содержит SEQ ID NO:3.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, содержащую фрагмент SEQ ID NO:3 или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что указанная последовательность не кодирует полноразмерный белок р300. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 30, или по меньшей мере 60, или по меньшей мере 90, или по меньшей мере 120, или по меньшей мере 150, или по меньшей мере 180, или по меньшей мере 210, или по меньшей мере 240, или по меньшей мере 270, или по меньшей мере 300 нуклеотидов, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 300, или 270, или 240, или 210, или 180, или 150, или 120, или 90, или 60 нуклеотидов. Независимо, а также необязательно, этот фрагмент в данной последовательности нуклеотидов имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:3. В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, состоящую по существу из SEQ ID NO:3 или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:3. В различных необязательных вариантах осуществления, эта последовательность имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно SEQ ID NO:3. В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, состоящую по существу из фрагмента SEQ ID NO:3 или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 30, или по меньшей мере 60, или по меньшей мере 90, или по меньшей мере 120, или по меньшей мере 150, или по меньшей мере 180, или по меньшей мере 210, или по меньшей мере 240, или по меньшей мере 270, или по меньшей мере 300 нуклеотидов, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 300, или 270, или 240, или 210, или 180, или 150, или 120, или 90, или 60 нуклеотидов. Независимо, а также необязательно, этот фрагмент в данной последовательности нуклеотидов имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:3. В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, состоящую из SEQ ID NO:3 или последовательности, имеющей по меньшей мере 80% идентичность относительно SEQ ID NO:3. В различных необязательных вариантах осуществления, эта последовательность имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно SEQ ID NO:3. В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенную и выделенную последовательность нуклеотидов, состоящую из фрагмента SEQ ID NO:3 или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 30, или по меньшей мере 60, или по меньшей мере 90, или по меньшей мере 120, или по меньшей мере 150, или по меньшей мере 180, или по меньшей мере 210, или по меньшей мере 240, или по меньшей мере 270, или по меньшей мере 300 нуклеотидов, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 300, или 270, или 240, или 210, или 180, или 150, или 120, или 90, или 60 нуклеотидов. Независимо, а также необязательно, этот фрагмент в данной последовательности нуклеотидов имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:3. В предпочтительном варианте осуществления, эта последовательность нуклеотидов кодирует пептид, который связывается с β-катенином.
Молекулы нуклеиновых кислот по данному изобретению могут быть получены расщеплением молекул нуклеиновых кислот, кодирующих полноразмерные белки СВР и р300 рестрикционными ферментами (рестриктазами) или другими нуклеазами. Молекулы нуклеиновых кислот, кодирующие полноразмерные белки СВР или р300, могут быть выделены из геномной ДНК или кДНК в соответствии со способами, известными в данной области (см. Sambrook and Russel, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, 2001). Зонды нуклеиновых кислот, соответствующие району SEQ ID NO:1, 3 или 6, могут быть использованы для скрининга библиотек либо геномных ДНК, либо кДНК. Олигонуклеотид, подходящий для скрининга геномной библиотеки или библиотеки кДНК, обычно имеет длину 20-40 нуклеотидов и может быть помечен различными молекулами, которые облегчают детектирование (например, радионуклидом, ферментной меткой, белковой меткой, флуоресцентной меткой или биотином). Геномные библиотеки или библиотеки кДНК могут быть сконструированы в различных подходящих векторах, в том числе плазмиде, бактериофаге, дрожжевой искусственной хромосоме и космидных векторах. Альтернативно, эти библиотеки могут быть куплены из коммерческого источника (например, Clontech, Palo Alto, CA).
Для получения молекул нуклеиновых кислот данного изобретения могут быть использованы другие способы. Одним предпочтительным способом является выполнение полимеразной цепной реакции для амплификации желаемых районов молекул нуклеиновых кислот, кодирующих белки СВР и р300 (например, районов, кодирующих полипептид, содержащий первые 111 аминокислотных остатков СВР или р300). Подробные способы ПЦР-амплификации могут быть найдены, например, в Ausubel et al., Current Protocols in Molecular biology, Greene Publishing Associates and Wiley-Interscience, NY 1995.
Другим способом получения этих молекул нуклеиновых кислот является выполнение экспрессионного клонирования с использованием полипептидного зонда, способного связывать СВР 1-111 или р300 1-111. Этот зонд может содержать антитело против СВР 1-111, р300 1-111 или их фрагмента. Способы экспрессионного клонирования описаны в Sambrook и Russel, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, 2001; Ausubel et al., Current Protocols in Molecular biology, Greene Publishing Associates and Wiley-Interscience, NY 1995 и Blackwood и Eisenman, Methods in Enzymology 254: 229-40, 1995.
Полинуклеотиды данного изобретения могут быть также получены с использованием способов синтетической химии с использованием описанных здесь последовательностей. Вырожденность генетического кода позволяет вариировать нуклеотидную последовательность, которая кодирует аминокислотную последовательность, представленную в SEQ ID NO:1, 3 или 6. Все такие нуклеотидные последовательности находятся в рамках данного изобретения.
Последовательности нуклеиновых кислот, кодирующие фрагменты СВР или Р300, могут быть слиты с различными гетерологичными последовательностями, такими как последовательности, кодирующие аффинные метки (например, GST и His-метку), и последовательности, кодирующие сигнал секреции. Слияние с последовательностью, кодирующей аффинную метку, облегчает очистку кодируемого полипептида, делая возможным применение аффинной очистки посредством этой слитой метки. Слияние с последовательностью, кодирующей сигнал секреции, также облегчает очистку кодируемого полипептида, так как позволяет извлекать этот полипептид из лизата клеток, периплазматического пространства, флоэмы или из среды для выращивания или ферментационной среды. Сигналы секреции, подходящие для использования, являются широко доступными и хорошо известны в данной области (например, Heijne, J. Mol. Biol. 184:99-105, 1985).
Как описано выше, молекулы нуклеиновых кислот данного изобретения могут также содержать варианты (в том числе аллели) природных молекул нуклеиновых кислот, представленных в SEQ ID NO:1, 3 или 6. Такие варианты включают в себя природные варианты (например, вырожденные формы, полиморфизмы, сплайсинговые варианты или мутанты) и варианты, полученные генной инженерией, известной в данной области.
Полипептидные последовательности
В одном аспекте данное изобретение обеспечивает различные полипептидные молекулы, применимые в скрининге на агенты, которые селективно ингибируют взаимодействие между β-катенином и СВР в сравнении с взаимодействием между β-катенином и р300.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, содержащий SEQ ID NO:2 (или SEQ ID NO:5), или пептид, имеющий по меньшей мере 80%, 85%, 90%, 95%, 98% или 99% идентичность относительно SEQ ID NO:2 (или SEQ ID NO:5), при условии, что указанный пептид не является полноразмерным белком СВР (например, СВР человека или мыши). В данном контексте процентную идентичность двух пептидов определяют с использованием программ BLAST от Altschul et al., (J. Mol. Biol. 215:403-10, 1990) c их параметрами по умолчанию. Эти программы осуществляют алгоритм Karlin и Altschul (Proc. Natl. Acad. Sci. USA 87:2264-8, 1990), модифицированный, как описано в Karlin и Altschul (Proc. Natl. Acad. Sci. USA 90:5873-7, 1993). Программы BLAST доступны, например, на web-сайте http://www.ncbi.nlm.nih.gov. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, полипептидная молекула данного изобретения содержит аминокислотную последовательность, которая содержит не более чем 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250 или 300 последовательных аминокислотных остатков, присутствующих в природно встречающейся последовательности СВР (например, СВР человека или СВР мыши). В некоторых вариантах осуществления, эта полипептидная молекула содержит SEQ ID NO:2 или SEQ ID NO:5.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, содержащий фрагмент SEQ ID NO:2 или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что этот пептид не является полноразмерным белком СВР. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 10, или по меньшей мере 20, или по меньшей мере 30, или по меньшей мере 40, или по меньшей мере 50, или по меньшей мере 60, или по меньшей мере 70, или по меньшей мере 80, или по меньшей мере 90 аминокислотных остатков, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 100, или 90, или 80, или 70, или 60, или 50, или 40, или 30, или 20 аминокислотных остатков. Независимо, а также необязательно, этот фрагмент в данном пептиде имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:2. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, состоящий по существу из SEQ ID NO:2 или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:2. В различных необязательных вариантах осуществления, этот пептид имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:2. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, состоящий по существу из фрагмента SEQ ID NO:2 или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 10, или по меньшей мере 20, или по меньшей мере 30, или по меньшей мере 40, или по меньшей мере 50, или по меньшей мере 60, или по меньшей мере 70, или по меньшей мере 80, или по меньшей мере 90 аминокислотных остатков, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 100, или 90, или 80, или 70, или 60, или 50, или 40, или 30, или 20 аминокислотных остатков. Независимо, а также необязательно, этот фрагмент в данном пептиде имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:2. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, состоящий из SEQ ID NO:2 или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:2, при условии, что указанный пептид не является белком СВР. В различных необязательных вариантах осуществления, этот пептид имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:2. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, состоящий из фрагмента SEQ ID NO:2 или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 10, или по меньшей мере 20, или по меньшей мере 30, или по меньшей мере 40, или по меньшей мере 50, или по меньшей мере 60, или по меньшей мере 70, или по меньшей мере 80, или по меньшей мере 90 аминокислотных остатков, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 100, или 90, или 80, или 70, или 60, или 50, или 40, или 30, или 20 аминокислотных остатков. Независимо, а также необязательно, этот фрагмент в данном пептиде имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:2. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, содержащий SEQ ID NO:4, или пептид, имеющий по меньшей мере 80%, 85%, 90%, 95%, 98% или 99% идентичность относительно SEQ ID NO:4, при условии, что указанный пептид не является полноразмерным белком р300 человека. В некоторых вариантах осуществления, этот полипептид содержит аминокислотную последовательность, которая содержит не более чем 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250 или 300 последовательных аминокислотных остатков, присутствующих в природно встречающейся последовательности р300 (например, р300 человека или р300 мыши). В некоторых вариантах осуществления, этот полипептид содержит SEQ ID NO:4.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, содержащий фрагмент SEQ ID NO:4 или последовательность, имеющую по меньшей мере 80% идентичность относительно указанного фрагмента, при условии, что этот пептид не является полноразмерным белком р300. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 10, или по меньшей мере 20, или по меньшей мере 30, или по меньшей мере 40, или по меньшей мере 50, или по меньшей мере 60, или по меньшей мере 70, или по меньшей мере 80, или по меньшей мере 90 аминокислотных остатков, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 100, или 90, или 80, или 70, или 60, или 50, или 40, или 30, или 20 аминокислотных остатков. Независимо, а также необязательно, этот фрагмент в данном пептиде имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:4. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, состоящий по существу из SEQ ID NO:4 или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:4. В различных необязательных вариантах осуществления, этот пептид имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:4. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, состоящий по существу из фрагмента SEQ ID NO:4 или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 10, или по меньшей мере 20, или по меньшей мере 30, или по меньшей мере 40, или по меньшей мере 50, или по меньшей мере 60, или по меньшей мере 70, или по меньшей мере 80, или по меньшей мере 90 аминокислотных остатков, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 100, или 90, или 80, или 70, или 60, или 50, или 40, или 30, или 20 аминокислотных остатков. Независимо, а также необязательно, этот фрагмент в данном пептиде имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:4. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, состоящий из SEQ ID NO:4 или пептида, имеющего по меньшей мере 80% идентичность относительно SEQ ID NO:4, при условии, что указанный пептид не является белком СВР. В различных необязательных вариантах осуществления, этот пептид имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:4. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, данное изобретение обеспечивает по существу очищенный и выделенный пептид, состоящий по существу из фрагмента SEQ ID NO:4 или последовательности, имеющей по меньшей мере 80% идентичность относительно указанного фрагмента. В различных необязательных вариантах осуществления, этот фрагмент имеет по меньшей мере 10, или по меньшей мере 20, или по меньшей мере 30, или по меньшей мере 40, или по меньшей мере 50, или по меньшей мере 60, или по меньшей мере 70, или по меньшей мере 80, или по меньшей мере 90 аминокислотных остатков, тогда как независимо этот фрагмент имеет длину (когда возможно, на основе минимальной длины этого фрагмента) 100, или 90, или 80, или 70, или 60, или 50, или 40, или 30, или 20 аминокислотных остатков. Независимо, а также необязательно, этот фрагмент в данном пептиде имеет по меньшей мере 85%, или по меньшей мере 90%, или по меньшей мере 95% идентичность относительно фрагмента SEQ ID NO:4. В предпочтительном варианте осуществления, этот пептид связывается с β-катенином.
В некоторых вариантах осуществления, полипептиды данного изобретения содержат консервативные аминокислотные замены, т.е. замены сходным образом заряженных или незаряженных аминокислот SEQ ID NO:2 или 4. Консервативная аминокислотная замена включает в себя замену одной аминокислоты другой аминокислотой семейства аминокислот со структурно родственными боковыми цепями. Природно встречающиеся аминокислоты обычно подразделяют на четыре семейства: кислотные (аспартат, глутамат), основные (лизин, аргинин, гистидин), неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан) и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин) аминокислоты. Фенилаланин, триптофан и тирозин иногда классифицируют как ароматические аминокислоты. Не встречающиеся в природе аминокислоты могут быть также использованы для образования полипептидов данного изобретения.
Данное изобретение обеспечивает также слитые белки СВР или Р300, содержащие фрагменты СВР или Р300 или их гомологи, слитые с аминокислотными последовательностями, содержащими один или несколько гетерологичных полипептидов. Такие гетерологичные полипептиды могут соответствовать природно встречающимся полипептидам из любого источника или могут быть сконструированными рекомбинантно аминокислотными последовательностями. Слитые белки применимы для очистки, генерирования антител против аминокислотных последовательностей и для использования в различных системах анализа. Белки, обычно используемые в конструировании слитых белков, включают в себя β-галактозидазу, β-глюкуронидазу, зеленый флуоресцентный белок (GFP), автофлуоресцентные белки, в том числе синий флуоресцентный белок (BFP), глутатион-S-трансферазу (GST), люциферазу, пероксидазу хрена (HRP) и хлорамфениколацетилтрансферазу (САТ). Кроме того, в конструкциях слитых белков могут быть использованы эпитопные метки, в том числе гистидиновые (His) метки, FLAG-метки, метки гемагглютинина гриппа (НА), Myc-метки, VSV-G-метки и тиоредоксиновые (Trx) метки. Другие слитые конструкции включают в себя мальтозосвязывающий белок (МВР), S-метку, слияния Lex A - ДНК-связывающий домен (DBD), слияния GAL4 - ДНК-связывающий домен и слияния вирус простого герпеса (HSV) - белок ВР16.
Полипептиды данного изобретения могут быть получены различными способами, известными в данной области. Например, фрагмент СВР (или р300), содержащий SEQ ID NO:2 (или SEQ ID NO:4), может быть выделен биохимическими способами, такими как аффинная хроматография. Аффинные матриксы, которые могут быть использованы для полипептида СВР или р300, могут быть твердой фазой, имеющей присоединенные к ней моноклональные или поликлональные анти-СВР- или анти-р300-антитела, полученные против SEQ ID NO:2 или 4 или их фрагмента. Альтернативно, полипептиды, о которых известно, что они связывают СВР или р300 (например, β-катенин), могут быть использованы в качестве аффинных матриксов для выделения полипептидов СВР или р300 или их фрагмента.
Другие биохимические способы для выделения СВР, р300 или их фрагментов включают в себя препаративный гель-электрофорез, гель-фильтрацию, аффинную хроматографию, ионообменную и обращенно-фазовую хроматографию, хроматофокусирование, изоэлектрическое фокусирование и градиенты плотности сахарозы или глицерина (Deutscher, Methods in Enzymology: Guide to Protein Purification, Vol. 182, Academic Press, Inc., San Diego, Chapter 38, 1990; Balch et al., Methods in Enzymology, Vol. 257, Academic Press, Inc., San Diego, Chapter 8, 1995).
Полипептид по данному изобретению может быть также получен химическим синтезом, например, твердофазным способом синтеза пептидов (Merrifield et al., J. Am. Chem. Soc. 85:2149, 1964). Стандартные способы в растворе, хорошо известные в данной области, могут быть также использованы для синтеза полипептида, содержащего SEQ ID NO:2 или 4, или его гомолога (Bodanszky, Principles of Peptide Synthesis, Springer-Verlag, Berlin, 1984; Bodanszky, Peptide Chemistry, Springer-Verlag, Berlin, 1993). Только что синтезированный полипептид может быть выделен, например, высокоэффективной жидкостной хроматографией и может быть охарактеризован с использованием масс-спектрометрии или анализа аминокислотной последовательности.
Полипептид в соответствии с данным изобретением может быть также получен способами рекомбинантных ДНК. Нуклеиновые кислоты, кодирующие SEQ ID NO:2 или 4 или их гомологи, обеспеченные данным изобретением, могут быть клонированы в подходящий вектор для экспрессии. Такой вектор является коммерчески доступным или может быть сконструирован специалистами с квалификацией в данной области и содержит элементы экспрессии, необходимые для транскрипции и трансляции. Выбранный вектор может быть также использован в системе прокариотического или эукариотического хозяина, как это удобно, при условии, что элементы экспрессии и регуляторные элементы имеют совместимое происхождение. Рекомбинантный полипептид, продуцированный в клетке-хозяине или секретированный из этой клетки, может быть выделен с использованием, например, аффинной хроматографии с антителом против SEQ ID NO:2 или 4 или их фрагмента, ионообменной хроматографии, ВЭЖХ, гель-фильтрационной хроматографии, кристаллизации с использованием сульфата аммония, электрофокусирования или препаративного гель-электрофореза (см. в общем Ausubel et al., supra; Sambrook et al., supra). Выделенный очищенный белок обычно обнаруживают в виде единственной полосы на ДСН-ПААГ, окрашенном Кумасси синим.
Данное изобретение обеспечивает также слитые белки, содержащие SEQ ID NO:2 или 4 или их гомолог и гетерологичный полипептид. Такие слитые белки могут быть получены ковалентным связыванием двух белковых сегментов или стандартными процедурами, используемыми в области молекулярной биологии. Например, способы рекомбинантных ДНК могут быть использованы для получения слитых белков образованием ДНК-конструкции, которая содержит кодирующие последовательности, выбранные из SEQ ID NO:2 или 4, в правильной рамке считывания с нуклеотидами, кодирующими второй белковый сегмент, и экспрессией этой ДНК-конструкции в клетке-хозяине, как это известно в данной области. Многочисленные наборы для конструирования слитых белков являются доступными из компаний, которые снабжают исследовательские лаборатории инструментами для экспериментов, в том числе, например, Promega Corporation (Madison, WI), Stratagene (La Jolla, CA), Clontech (Mountain View, CA), Santa Cruz Biotechnology (Santa Cruz, CA), MBL International Corporation (MIC; Watertown, MA) и Quantum Biotechnologies (Montreal, Canada; 1-888-DNA-KITS).
Способы применения
Данное изобретение обеспечивает соединения формулы (I), которые ингибируют транскрипцию, индуцируемую субпопуляцией β-катенин/TCF. Например, как описано подробно в примере, СОЕДИНЕНИЕ 1 селективно блокирует взаимодействие β-катенина с СВР без ингибирования взаимодействия β-катенина с р300, который является близкородственным в отношении СВР. Обработка СОЕДИНЕНИЕМ 1 вызывает перераспределение β-катенина из ядра в цитоплазму, селективно ингибирует ассоциацию СВР с промоторами некоторых генов-мишеней (например, c-myc и cyclin D1) и, следовательно, ингибирует экспрессию этих генов. Кроме того, СОЕДИНЕНИЕ 1 селективно активирует апоптотические каспазы в трансформированных, но не в нормальных клетках ободочной кишки, вызывает остановку G1/S-фазы раковых клеток и уменьшает пролиферацию трансформированных колоректальных клеток. Таким образом, соединения данного изобретения могут иметь разнообразные применения, такие как лечение рака, уменьшение роста опухолей, увеличение апоптоза, модуляция индуцированной β-катенином экспрессии генов и т.п.
В одном аспекте данное изобретение обеспечивает способ селективного ингибирования взаимодействия β-катенин/СВР относительно взаимодействия β-катенин/р300, предусматривающий введение соединения в композицию, где эта композиция содержит β-катенин, СВР и р300, и это соединение селективно ингибирует взаимодействие β-катенин/СВР относительно взаимодействия β-катенин/р300.
В другом аспекте данное изобретение обеспечивает способ селективного ингибирования взаимодействия β-катенин/р300 относительно взаимодействия β-катенин/СВР, предусматривающий введение соединения в композицию, где эта композиция содержит β-катенин, СВР и р300, и это соединение селективно ингибирует взаимодействие β-катенин/р300 относительно взаимодействия β-катенин/СВР. Некоторые аналоги СОЕДИНЕНИЯ 1 являются селективными в отношении белкового комплекса β-катенин/р300.
Белок-белковое взаимодействие (например, взаимодействие между β-катенином и р300 и взаимодействие между β-катенином и СВР), а также действия агента на белок-белковое взаимодействие могут быть охарактеризованы и/или измерены любыми подходящими способами, известными в данной области. Такие способы могут включать в себя анализы связывания in vitro с использованием аффинно очищенных рекомбинантных белков β-катенина, СВР и р300 или их фрагментов. В некоторых вариантах осуществления, один белковый компонент может быть сначала иммобилизован на твердом носителе (например, планшете ELISA) для облегчения детектирования и измерения белок-белкового взаимодействия. Белок-белковое взаимодействие может быть также охарактеризовано с использованием анализов связывания in vivo, таких как иммунопреципитация и вестерн-блот-анализ, описанные в примерах.
В другом аспекте данное изобретение обеспечивает способ усиления перемещения β-катенина из ядра в цитозоль, предусматривающий введение соединения в клетку, где эта клетка содержит ядро и цитозоль и это ядро содержит β-катенин, и это соединение вызывает перемещение β-катенина из ядра в цитозоль. Перемещение β-катенина из ядра в цитозоль может быть детектировано с использованием анализа иммунофлуоресценции, как описано в примерах.
В другом аспекте данное изобретение обеспечивает способ селективного ингибирования экспрессии генов-мишеней пути Wnt/β-катенина, предусматривающий введение соединения в композицию, причем эта композиция содержит гены-мишени пути Wnt/β-катенина, причем это соединение вызывает изменение экспрессии генов-мишеней пути Wnt/β-катенина.
Как указано выше, данное изобретение обеспечивает способы воздействия на СВР-стимулируемую экспрессию генов и в предпочтительном варианте осуществления обеспечивает способы предпочтительного воздействия на СВР-стимулируемую экспрессию генов в сравнении с воздействием на р300-стимулируемую экспрессию генов. Данное изобретение обеспечивает также способы предпочтительного воздействия на р300-стимулируемую экспрессию генов в сравнении с воздействием на СВР-стимулируемую экспрессию генов. Данное изобретение является особенно замечательным ввиду структурного сходства между СВР и р300 и того факта, что многие специалисты с квалификацией в данной области рассматривают СВР и р300 как имеющие по существу эквивалентную биологическую функцию. Эта эффективность может быть применена, например, к воздействию на экспрессию сурвивина (блокирующего апоптоз белка в опухолевых клетках).
В одном аспекте данное изобретение обеспечивает способ модуляции индуцированной β-катенином экспрессии генов, предусматривающий контактирование композиции с агентом, где эта композиция содержит β-катенин, СВР и р300, где β-катенин имеет вероятность связывания с СВР в сравнении с р300, и этот агент контактирует с этой композицией в количестве, эффективном для изменения вероятности связывания β-катенина с СВР в сравнении с р300. В примерных аспектах эта модуляция может принимать форму увеличения связывания СВР с β-катенином, необязательно с уменьшением связывания р300 с β-катенином. Или эта модуляция может принимать форму увеличения связывания р300 с β-катенином, необязательно с уменьшением связывания СВР с β-катенином. Эта композиция может быть клеткой.
Экспрессия представляющих интерес генов и действия агента на экспрессию этих генов могут выполняться любыми подходящими способами, известными в данной области. Такие способы включают в себя использование микроматрицы кДНК, ОТ-ПЦР с праймерами для амплификации представляющих интерес генов и измерение репортерных активностей, запускаемых промоторами представляющих интерес генов, и ChIP-анализы.
В другом аспекте данное изобретение обеспечивает способ модуляции активности пути Wnt, предусматривающий:
(а) контактирование (i) композиции, содержащей компоненты пути Wnt, с (ii) соединением, которое активирует путь Wnt, для обеспечения активированного пути Wnt; и
(b) модуляцию активности пути Wnt химическим агентом, который полностью или по существу подавляет связывание между р300 и β-катенином, но вызывает малое подавление или отсутствие подавления связывания между СВР и β-катенином.
В другом аспекте данное изобретение обеспечивает способ усиления пролиферации клеток, предусматривающий:
(а) обеспечение популяции клеток в условиях, в которых часть этой популяции будет пролиферировать и часть этой популяции будет дифференцироваться; и
(b) добавление химического агента к этой популяции, где этот агент вызывает увеличение части клеток, которые пролиферируют, относительно части клеток, которые дифференцируются.
Пролиферация клеток и дифференцировка клеток могут быть охарактеризованы любыми подходящими способами, известными в данной области. Такие способы включают в себя проточный цитометрический анализ и анализы в мягком агаре, описанные в примерах.
В другом аспекте данное изобретение обеспечивает способ поддержания стволовой клетки в недифференцированном состоянии, предусматривающий контактирование этой стволовой клетки с агентом, который ингибирует дифференцировку клеток или стимулирует пролиферацию клеток, в количестве, эффективном для поддержания этой стволовой клетки в недифференцированном состоянии. В некоторых вариантах осуществления, этот агент способен уменьшать взаимодействие между β-катенином и р300 без подавления взаимодействия между β-катенином и СВР.
Терапия с использованием стволовых клеток предоставляет возможность лечения многих дегенеративных заболеваний, вызываемых преждевременной смертью или дисфункцией конкретных типов клеток и неспособностью организма заменять или восстанавливать их. Возможные терапевтические применения стволовых клеток включают в себя иммунологическое кондиционирование пациентов для трансплантации органов, лечение аутоиммунных заболеваний, таких как мышечная дистрофия, рассеянный склероз и ревматоидный артрит, восстановление поврежденных тканей, например, при инсульте, повреждении позвоночника и ожоге, лечение нейродегенеративного заболевания, такого как болезнь Lou Gehrig и неврологических состояний, таких как болезни Паркинсона, Гентингтона и Альцгеймера, лечение лейкоза, серповидноклеточной анемии, болезни сердца и диабета. Для большинства способов с использованием стволовых клеток эмбриональные стволовые клетки или взрослые стволовые клетки могут культивироваться in vitro, индуцироваться для дифференцировки в желаемый тип клеток и трансплантироваться пациенту. Для успешного культивирования стволовых клеток эти стволовые клетки должны поддерживаться в недифференцированном состоянии.
Для поддержания стволовых клеток в недифференцированном состоянии соединения данного изобретения, например, соединения, которые стимулируют пролиферацию клеток или ингибируют дифференцировку клеток, могут быть использованы на различных стадиях культивирования стволовых клеток. Например, такое соединение может быть использовано при выделении стволовых клеток из их ткани-источника. Альтернативно, оно может добавляться в культуральную среду после определенного периода культивирования. Оно может непрерывно присутствовать в культуральной среде для поддержания стволовых клеток в недифференцированном состоянии. Концентрация этого соединения может быть оптимизирована коррекцией количества этого соединения до уровня, при котором стволовые клетки поддерживаются в недифференцированном состоянии, или дифференцировка стволовых клеток уменьшается в сравнении со стволовыми клетками, культивируемыми в отсутствие этих соединений, а другие аспекты этой культуры клеток (например, коэффициент жизнеспособности клеток и скорость пролиферации клеток) не испытывают вредного воздействия.
Эти и другие способы данного изобретения могут практиковаться с использованием химического агента, такого как химический агент, идентифицированный здесь как СОЕДИНЕНИЕ 1, а также его аналоги.
Скрининг-анализы
Соединения формулы (I), а также другие агенты могут быть подвергнуты скринингу на активность, как описано здесь, и в соответствии со следующими способами.
Например, в одном аспекте данное изобретение обеспечивает способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР с частью молекулы, содержащей СВР 1-111; (b) контактирования смеси стадии (а) с частью молекулы, содержащей β-катенин; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей β-катенин, стадии (b), с частью молекулы, содержащей СВР 1-111, стадии (а); и (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с частью молекулы, содержащей β-катенин, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:СВР. Необязательно, этот способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР стадии (d) со смесью, содержащей (1) часть молекулы, содержащую р300 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей р300 1-111 с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей р300 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:СВР.
В другом аспекте данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР с частью молекулы, содержащей β-катенин; (b) контактирования смеси стадии (а) с частью молекулы, содержащей СВР 1-111; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей СВР 1-111, стадии (b), с частью молекулы, содержащей β-катенин, стадии (а); и (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей β-катенин, с частью молекулы, содержащей СВР 1-111, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:СВР. Необязательно, этот способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР стадии (d) со смесью, содержащей (1) часть молекулы, содержащую р300 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей р300 1-111, с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей р300 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:СВР.
В другом аспекте данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР, предусматривающий стадии (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР с частью молекулы, содержащей (1) β-катенин, ассоциированный с СВР 1-111; (b) определения, посредством анализа, диссоциирует ли указанная молекула стадии (а) СВР 1-111 от β-катенина; и (с) идентификации, после определения, что указанная малая молекула стадии (а) диссоциирует связывание β-катенина от СВР 1-110, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:СВР. Необязательно, этот способ может дополнительно содержать стадии (d) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:СВР стадии (с) со смесью, содержащей (1) часть молекулы, содержащую р300 1-111, и (2) β-катенин; (е) определения, посредством анализа, не ингибирует ли указанная молекула стадии (d) связывание указанной части молекулы, содержащей р300 1-111, с β-катенином; и (f) подтверждения, после определения, что указанная малая молекула стадии (d) не ингибирует связывание указанной части молекулы, содержащей р300 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:СВР.
В одном аспекте данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:р300, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 с частью молекулы, содержащей р300 1-111; (b) контактирования смеси стадии (а) с частью молекулы, содержащей β-катенин; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей β-катенин, стадии (b), с частью молекулы, содержащей р300 1-111, стадии (а); и (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей р300 1-111, с частью молекулы, содержащей β-катенин, этой малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:р300. Необязательно, этот способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 стадии (d) со смесью, содержащей (1) часть молекулы, содержащую СВР 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей СВР 1-111, с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:р300.
В другом аспекте данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:р300, предусматривающий стадии: (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 с частью молекулы, содержащей β-катенин; (b) контактирования смеси стадии (а) с частью молекулы, содержащей р300 1-111; (с) определения, посредством анализа, ингибирует ли указанная молекула стадии (а) связывание части молекулы, содержащей р300 1-111, стадии (b), с частью молекулы, содержащей β-катенин, стадии (а); (d) идентификации, после определения, что указанная малая молекула стадии (а) ингибирует связывание указанной части молекулы, содержащей β-катенин, с частью молекулы, содержащей р300 1-111, малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:р300. Необязательно, этот способ может дополнительно содержать стадии (е) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 стадии (d) со смесью, содержащей (1) часть молекулы, содержащую СВР 1-111, и (2) β-катенин; (f) определения, посредством анализа, не ингибирует ли указанная молекула стадии (е) связывание указанной части молекулы, содержащей СВР 1-111, с β-катенином; и (g) подтверждения, после определения, что указанная малая молекула стадии (е) не ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:р300.
В другом аспекте данное изобретение обеспечивает также способ идентификации имеющего малую молекулу ингибитора взаимодействия β-катенин:р300, предусматривающий стадии (а) контактирования предположительного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 с частью молекулы, содержащей (1) β-катенин, ассоциированный с р300 1-111; (b) определения, посредством анализа, диссоциирует ли указанная молекула стадии (а) р300 1-111 от β-катенина; и (с) идентификации, после определения, что указанная малая молекула стадии (а) диссоциирует связывание β-катенина от р300 1-110, малой молекулы стадии (а) в качестве ингибитора взаимодействия β-катенин:р300. Необязательно, вышеуказанный способ может дополнительно содержать стадии (d) контактирования идентифицированного имеющего малую молекулу ингибитора взаимодействия β-катенин:р300 стадии (с) со смесью, содержащей (1) часть молекулы, содержащую СВР 1-111, и (2) β-катенин; (е) определения, посредством анализа, не ингибирует ли указанная молекула стадии (d) связывание указанной части молекулы, содержащей СВР 1-111, с β-катенином; и (f) подтверждения, после определения, что указанная малая молекула стадии (d) не ингибирует связывание указанной части молекулы, содержащей СВР 1-111, с указанным β-катенином, что указанная малая молекула является селективным ингибитором взаимодействия β-катенин:р300.
Белок-белковое взаимодействие (например, взаимодействие между β-катенином и р300 и взаимодействие между β-катенином и СВР), а также действия агента на белок-белковое взаимодействие могут быть охарактеризованы и/или измерены любыми подходящими способами, известными в данной области. Например, подходящим способом анализа для способов данного изобретения является изотермическая титрационная калориметрия (ITC). ITC-эксперименты могут выполняться с использованием изотермического титрационного калориметра MicroCal MCS (MicroCal, Northampton MA), в основном, как рекомендовано изготовителем. Вкратце, фрагмент СВР С1 интенсивно диализуют против буфера для диализа, содержащего 50 мМ PIPES (рН 7,5) и 0,1 мМ ЭДТА. К пробе белка добавляют ДМСО до конечной концентрации 0,05% для соответствия разбавленной пробе лекарственного средства. Концентрацию белка определяют с использованием анализа белка Бредфорда (Bio-Rad laboratories, Hercules CA) с использованием гамма-глобулина бычьей плазмы в качестве стандарта (Bio-Rad). Вследствие ограничений растворимости ITC-эксперименты выполняют введением 5-15 мкл СВР С1 [223 мкМ] в ячейку для пробы, заполненную 23,3 мкМ предположительного имеющего малую молекулу ингибитора. Теплоту разбавления оценивают после насыщения этого предположительного имеющего малую молекулу ингибитора в ячейке для пробы и термодинамические параметры рассчитывают с использованием пакета программного обеспечения Origin 5.0 (MicroCal). Более высокая теплота разбавления свидетельствует о более сильном связывании между предположительным имеющим малую молекулу ингибитором и этим фрагментом СВР. Более сильное связывание между предположительным имеющим малую молекулу ингибитором и этим фрагментом СВР идентифицирует малую молекулу, которая может быть более эффективной в разрушении связывания СВР, например, связывания СВР с β-катенином.
Фармацевтические композиции и введение
Молекулы нуклеиновых кислот, пептиды и соединения в соответствии с данным изобретением могут быть включены в фармацевтические композиции, подходящие для введения. Такие композиции обычно содержат молекулу нуклеиновой кислоты, пептид или соединение и фармацевтически приемлемый носитель. “Фармацевтически приемлемым носителем” называют растворители, распределительные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и т.п., совместимые с фармацевтическим введением. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области. В эти композиции могут быть также включены дополнительные активные соединения.
Фармацевтическая композиция данного изобретения может вводиться парентерально, местно, перорально или локально для терапевтического лечения. Могут быть использованы различные водные носители, например, вода, забуференная вода, 0,4% солевой раствор, 0,3% глицин и т.п., и они могут включать в себя другие белки для усиления стабильности, такие как альбумин, липопротеин, глобулин и т.д. Полученная композиция может быть простерилизована общепринятыми, хорошо известными способами стерилизации. Эти растворы могут быть упакованы для использования или профильтрованы при асептических условиях и лиофилизированы, причем лиофилизированный препарат объединяют со стерильным раствором перед введением.
Пероральные композиции обычно включают в себя инертный разбавитель или годный в пищу носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для целей перорального терапевтического введения активное соединение может быть включено с эксципиентами и использовано в форме таблеток, пастилок или капсул. Фармацевтически совместимые связывающие агенты и/или адъювантные вещества могут быть включены в качестве части этой композиции. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любые из следующих ингредиентов или соединений сходной природы: связывающее вещество (например, микрокристаллическую целлюлозу, трагакант или желатин); эксципиент (например, крахмал или лактозу), дезинтегрирующий агент (например, альгиновую кислоту, примогель или кукурузный крахмал); лубрикант (например, стеарат магния или стеротес); глидант (например, коллоидальный диоксид кремния); подслащивающий агент (например, сахарозу или сахарин) или ароматизирующий агент (например, мяту перечную, метилсалицилат или апельсиновый ароматизатор).
Для введения ингаляцией соединения доставляются в форме аэрозольного спрея из находящегося под давлением контейнера или распределителя, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или распылитель.
Системное введение может быть также обеспечено трансмукозальными или трансдермальными способами. Для трансмукозального или трансдермального введения в приготовлении композиции используют смачивающие реагенты (пенетранты). Такие пенетранты обычно известны в данной области и включают в себя, например, для трансмукозального введения, детергенты, желчные кислоты и производные фусидовой кислоты. Трансмукозное введение может выполняться с использованием назальных спреев или суппозиториев. Для трансдермального введения активные соединения готовят в виде мазей, линиментов, гелей или кремов, обычно известных в данной области.
В одном варианте осуществления, активные соединения готовят с носителями, которые будут защищать это соединение против быстрого выведения из тела, например, в виде композиции регулируемого высвобождения, в том числе имплантатов и микроинкапсулированных систем доставки. Могут быть использованы биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Способы приготовления таких форм будут очевидными специалистам с квалификацией в данной области. Эти вещества могут быть также получены коммерчески из Alza Corporation и Nova Pharmaceuticals, Inc.
Особенно предпочтительно готовить пероральные или парентеральные композиции в единичной дозированной форме для легкости введения и однородности дозы. Единичной дозированной формой называют в данном контексте физически дискретные единицы, подходящие для отдельных доз для субъекта, получающего лечение; причем каждая единица содержит заранее определенное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта, вместе с требующимся фармацевтическим носителем. Спецификация для единичных дозированных форм данного изобретения диктуется уникальными характеристиками активного соединения и конкретным терапевтическим эффектом, который должен быть достигнут, и ограничениями, существующими в области получения лекарственных форм такого активного соединения для лечения индивидуумов, и прямо зависит от этих параметров.
Токсичность и терапевтическая эффективность таких соединений могут быть определены стандартными фармацевтическими процедурами в культурах клеток или экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной в 50% популяции). Отношение доз между токсичным и терапевтическим эффектами является терапевтическим индексом, и он может быть выражен в виде отношения LD50/ED50. Соединения, которые проявляют большие терапевтические индексы, являются предпочтительными. Хотя соединения, которые проявляют токсичные побочные действия, могут быть использованы, следует принимать меры для создания системы доставки, которая направляет такие соединения в участок пораженной ткани для минимизации потенциального повреждения в отношении неинфицированных клеток и тем самым уменьшения побочных эффектов.
Данные, полученные из анализов на культурах клеток и исследований на животных, могут быть использованы в приготовлении диапазона доз для использования в человеке. Доза таких соединений находится в диапазоне циркулирующих концентраций, которые включают в себя ED50 с малой токсичностью или с отсутствием токсичности. Эта доза может варьироваться в этом диапазоне в зависимости от используемой формы дозы и используемого способа введения. Для любого соединения, используемого в способе данного изобретения, терапевтически эффективная доза может быть приближенно определена сначала из анализов на культуре клеток. Доза может быть приготовлена в моделях животных для достижения диапазона циркулирующих концентраций в плазме, который включает в себя IC50 (т.е. концентрацию тест-соединения, которая дает полумаксимальное ингибирование симптомов), определенную в культуре клеток. Такая информация может быть использована для более точного определения применимых для человека доз. Уровни в плазме могут измеряться, например, высокоэффективной жидкостной хроматографией (ВЭЖХ).
Следующие примеры обеспечены для иллюстрации данного изобретения и не должны рассматриваться как его ограничение.
ПРИМЕРЫ ПОЛУЧЕНИЯ
ПРИМЕР ПОЛУЧЕНИЯ 1
Получение (N-Fmoc-N'-R3-гидразино)уксусной кислоты
(1) Получение N-Fmoc-N'-метилгидразина
Двухгорлую круглодонную колбу на 2 л снабжали стеклянной пробкой и трубкой с хлоридом кальция. Добавляли раствор сульфата метилгидразина (20 г, 139 ммоль, где R3 является метилом) в ТГФ (300 мл) и раствор DiBoc (33 г, 153 ммоль) в ТГФ. Насыщенный водный раствор бикарбоната натрия (500 мл) добавляли по каплям через капельную воронку на протяжении 2 часов с интенсивным перемешиванием. Спустя 6 часов медленно добавляли раствор Fmoc-Cl (39 г, 153 ммоль) в ТГФ. Полученную суспензию перемешивали в течение 6 часов при 0оС. Смесь экстрагировали этилацетатом (ЭА, 500 мл) и органический слой удерживали. Раствор сушили сульфатом натрия и упаривали в вакууме. Следующую стадию выполняли без очистки.
Двухгорлую круглодонную колбу на 1 л снабжали стеклянной пробкой и трубкой с хлоридом кальция. Раствор продукта из предыдущей стадии в МеОН (300 мл) добавляли и медленно добавляли концентрированную HCl (30 мл, 12 н.) через капельную воронку с перемешиванием на магнитной мешалке на бане со смесью воды со льдом и перемешивали в течение ночи. Эту смесь экстрагировали ЭА (1000 мл) и органический слой удерживали. Раствор сушили с использованием сульфата натрия и упаривали в вакууме. Остаток очищали перекристаллизацией с н-гексаном и ЭА с получением N-Fmoc-N'-метилгидразина (32,2 г, 83%). 1Н ЯМР (ДМСО-d6) δ 7,90-7,88 (д, J=6 Гц, 2Н), 7,73-7,70 (д, J=9 Гц, 2Н), 7,44-7,31 (м, 4Н), 4,52-4,50 (д, J=6 Гц, 2Н), 4,31-4,26 (т, J=6 Гц, 1Н), 2,69 (с, 1Н).
(2) Получение трет-бутилового эфира (N-Fmoc-N'-метилгидразино)уксусной кислоты
Двухгорлую круглодонную колбу на 1 л снабжали стеклянной пробкой и обратным холодильником, подсоединенным к трубке с хлоридом кальция. Добавляли раствор N-Fmoc-N'-метилгидразина (20 г, 75 ммоль) в толуоле (300 мл). Медленно добавляли раствор трет-бутилбромацетата (22 г, 111 ммоль) в толуоле (50 мл). Медленно добавляли Cs2CO3 (49 г, 149 ммоль). Медленно добавляли NaI (11 г, 74 ммоль) при сильном перемешивании. Реакционную смесь перемешивали при температуре дефлегмации на протяжении 1 дня. Смесь продуктов фильтровали и экстрагировали ЭА (500 мл). Раствор сушили над сульфатом натрия и упаривали в вакууме. Продукт очищали хроматографией с раствором гексан:ЭА = 2:1 с получением трет-бутилового эфира (N-Fmoc-N'-метилгидразино)уксусной кислоты (19,8 г, 70%).
1Н ЯМР (CDCl3-d) δ 7,78-7,75 (д, J=9 Гц, 2Н), 7,61-7,59 (д, J=6 Гц, 2Н), 7,43-7,26 (м, 4Н), 4,42-4,40 (д, J=6 Гц, 2Н), 4,23 (ш, 1Н), 3,57 (с, 2Н), 2,78 (с, 3Н), 1,50 (с, 9Н).
(3) Получение (N-Fmoc-N'-метилгидразино)уксусной кислоты
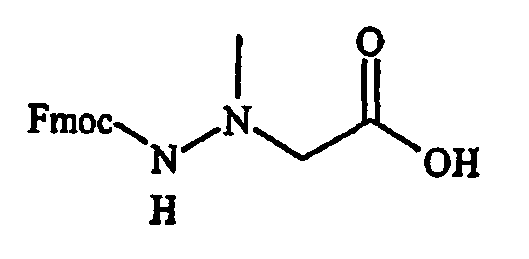
Двухгорлую круглодонную колбу на 1 л снабжали стеклянной пробкой и обратным холодильником, подсоединенным к трубке с хлоридом кальция. Добавляли раствор трет-бутилового эфира (N-Fmoc-N'-метилгидразино)уксусной кислоты (20 г, 52 ммоль). Медленно добавляли раствор HCl (150 мл, 4 М раствор в диоксане) при сильном перемешивании на бане со смесью воды со льдом. Реакционную смесь перемешивали при комнатной температуре на протяжении 1 дня. Раствор концентрировали полностью при пониженном давлении при 40оС. Добавляли насыщенный водный раствор NaHCO3 (100 мл) и водный слой промывали диэтиловым эфиром (100 мл). Добавляли по каплям медленно концентрированную HCl при 0оС (рН 2-3). Эту смесь экстрагировали и органический слой удерживали (500 мл, МС). Раствор сушили сульфатом натрия и упаривали в вакууме. Остаток очищали перекристаллизацией с н-гексаном и этилацетатом с получением (N-Fmoc-N'-метилгидразино)уксусной кислоты (12 г, 72%). 1Н ЯМР (ДМСО-d6) δ 12,38 (с, 1Н), 8,56 (ш, 1Н), 7,89-7,86 (д, J=9 Гц, 2Н), 7,70-7,67 (д, J=9 Гц, 2Н), 7,43-7,29 (м, 4Н), 4,29-4,27 (д, J=6 Гц, 2Н), 4,25-4,20 (т, J=6 Гц, 1Н), 3,47 (с, 2Н), 2,56 (с, 3Н).
ПРИМЕР ПОЛУЧЕНИЯ 2
Получение (N-Мос-N'-R7-гидразино)уксусной кислоты
(1) Получение этилового эфира (N'-метоксикарбонилгидразино)уксусной кислоты
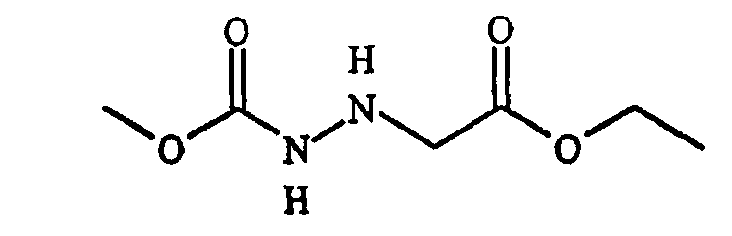
МОС-NH-NH2 (50 г, 0,55 моль) растворяли в ДМФ (300 мл) и затем в реакционный сосуд добавляли этилбромацетат (68 мл, 0,555 моль) и карбонат калия (77 г, 0,555 моль). Эту смесь нагревали до 50оС в течение 5 часов. После завершения реакции смесь фильтровали и разбавляли EtOAc и промывали солевым раствором (3 раза). Неочищенный продукт очищали колоночной хроматографией (элюент: гексан/EtOAc = 4/1) с получением 72 г бесцветного масла.
(2) Этиловый эфир [N-R7-N'-метоксикарбонилгидразино]уксусной кислоты
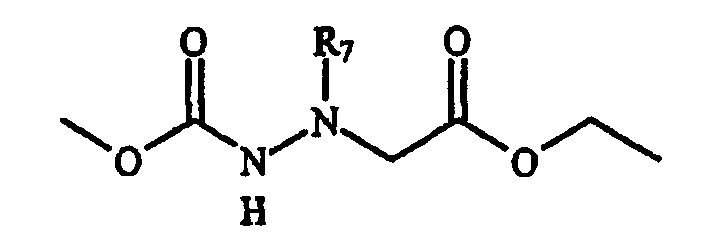
Этиловый эфир (10 г, 0,05 моль), карбонат калия (6,9 г, 0,05 моль) и R7-бромид (14,1 г, 0,06 моль) растворяли в ДМФ (200 мл) и эту смесь нагревали до 50 оС в течение 5 часов. После завершения реакции смесь фильтровали и разбавляли EtOAc и промывали солевым раствором (3 раза). Неочищенный продукт очищали хроматографией (элюент: гексан/EtOAc = 4/1).
(3) [N-R7-N'-метоксикарбонилгидразино]уксусная кислота
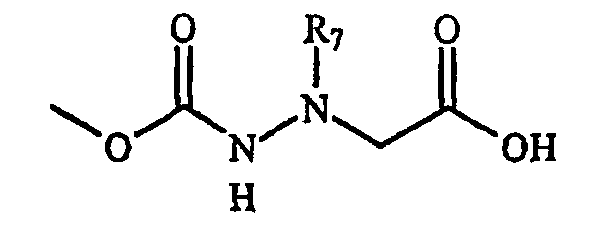
Алкилированный этиловый эфир (9,5 г, 0,03 моль) растворяли в смеси ТГФ/вода (1/1, мл) и добавляли 2 н. раствор NaOH (28,3 мл) при 0оС. Смесь перемешивали при комнатной температуре в течение 2 часов. После того как исходный эфир не детектировался на УФ, этот раствор разбавляли ЭА, затем разделяли. Водный слой подкисляли до рН 3~4 1 н. HCl и соединение экстрагировали ДХМ (3 раза). Объединенный органический слой сушили над MgSO4 и упаривали с получением желтого твердого вещества.
ПРИМЕР ПОЛУЧЕНИЯ 3
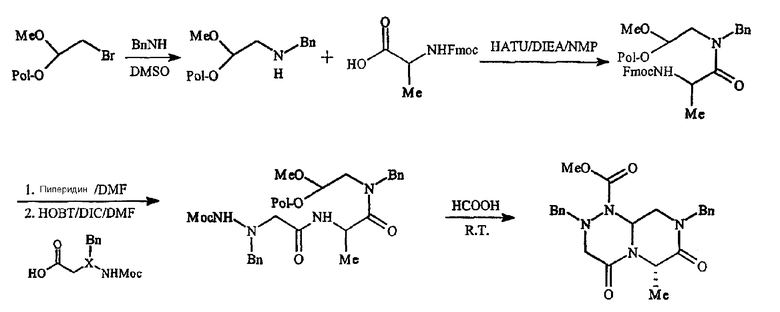
(1) Получение Nβ-Мос-Nα-бензилгидразиноглицина
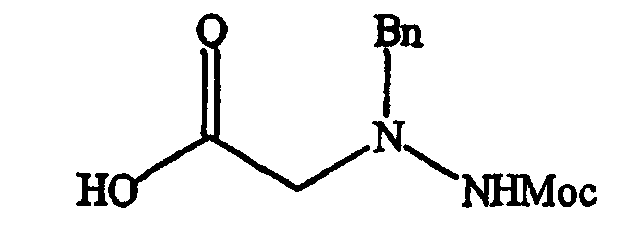
Это соединение получали в соответствии с описанной в литературе процедурой. (Chequillaume et al., Synlett 2000, 3, 331).
(2) Получение 1-метоксикарбонил-2,8-дибензил-6-метил-4,7-диоксогексагидропиразино[2,1-c][1,2,4]триазина
Бромацетальную смолу (60 мг, 0,98 ммоль/г) и раствор бензиламина в ДМСО (2,5 мл, 2 М) помещали во флакон с завинчивающейся крышкой. Реакционную смесь встряхивали при 60оС с использованием карусельной печи [Robbins Scientific] в течение 12 часов. Смолу собирали фильтрованием и промывали ДМФ, затем ДХМ с получением первого составляющего компонента.
Раствор Fmoc-аланина (4 экв, коммерчески доступного, второго составляющего компонента), HATU (PerSeptive Biosystems, 4 экв) и DIEA (4 экв) в NMP (Advanced ChemTech) добавляли к смоле. После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ.
К этой смоле добавляли 20% пиперидин в ДМФ. После встряхивания этой реакционной смеси в течение 8 минут при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ.
Раствор Nβ-Мос-Nα-бензилгидразиноглицина (4 экв, соединение (3) в препаративном примере 2, где R7 обозначает бензил, третий составляющий компонент), HOBT [Advanced ChemTech] (4 экв) и DIC (4 экв) в ДМФ добавляли к приготовленной, как описано выше, смоле. После встряхивания реакционной смеси в течение 3 часов при комнатной температуре, смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем МеОН. Смолу сушили в вакууме при комнатной температуре.
Эту смолу обрабатывали муравьиной кислотой (2,5 мл) в течение 18 часов при комнатной температуре. После удаления смолы фильтрованием, фильтрат конденсировали при пониженном давлении с получением продукта в виде масла. 1Н ЯМР (400 МГц, CDCl3) δ м.д.; 1,51 (д, 3Н), 2,99 (м, 1Н), 3,39 (д, 1Н), 3,69 (д, 1Н), 3,75 (м, 1Н), 3,82 (с, 3Н), 4,02 (д, 1Н), 4,24 (д, 1Н), 4,39 (д, 1Н), 4,75 (д, 1Н), 5,14 (кв, 1Н), 5,58 (дд, 1Н), 7,10-7,38 (м, 10Н).
ПРИМЕР ПОЛУЧЕНИЯ 4
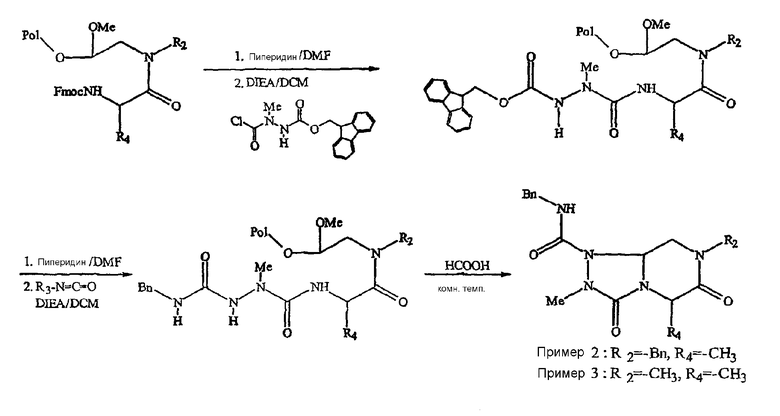
(1) Получение N'-Fmoc-N-метилгидразинокарбонилхлорида
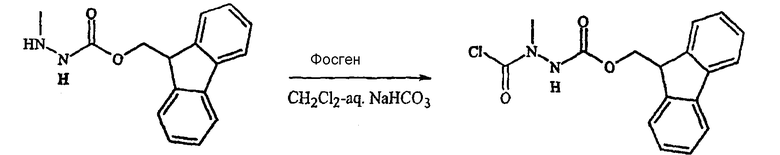
Охлажденную на льду двухфазную смесь 9Н-флуорен-9-илметилового эфира N-метилгидразинкарбоновой кислоты (107 мг, 0,4 ммоль) в 15 мл CH2Cl2 и 15 мл насыщенного водного раствора NaHCO3 быстро перемешивали при добавлении 1,93 М фосгена в толуоле (1,03 мл, 2 ммоль) в виде одной порции. Реакционную смесь перемешивали в течение 30 минут, органическую фазу собирали и водную фазу экстрагировали CH2Cl2. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме с получением 128 мг (97%) карбамоилхлорида в виде пенообразного твердого вещества. [Предостережение: пары фосгена являются очень токсичными. Используйте фосген в вытяжном шкафу]. Этот продукт использовали для следующего твердофазного синтеза без дополнительной очистки.
(2) Получение бензиламида 2,5-диметил-7-бензил-3,6-диоксогексагидро[1,2,4]триазоло[4,5-а]пиразин-1-карбоновой кислоты
Бромацетальную смолу (30 мг, 0,98 ммоль/г) и раствор бензиламина в ДМСО (1,5 мл, 2 М) помещали во флакон с завинчивающейся крышкой. Реакционную смесь встряхивали при 60оС с использованием карусельной печи [Robbins Scientific] в течение 12 часов. Смолу собирали фильтрованием и промывали ДМФ, затем ДХМ с получением первого составляющего компонента.
Раствор Fmoc-аланина (3 экв, второго составляющего компонента, коммерчески доступного), HATU (PerSeptive Biosystems, 3 экв) и DIEA (3 экв) в NMP (Advanced ChemTech) добавляли к смоле. После встряхивания реакционной смеси в течение 4 часов при комнатной температуре, смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ для присоединения таким образом второго составляющего компонента к первому составляющему компоненту.
К этой смоле добавляли 20% пиперидин в ДМФ. После встряхивания этой реакционной смеси в течение 8 минут при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ.
Раствор N'-Fmoc-N-метилгидразинокарбонилхлорида (объединенных третьего и четвертого составляющих компонентов, 5 экв), полученных в описанной выше стадии (1), DIEA (5 экв) в ДХМ добавляли к приготовленной, как описано выше, смоле. После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и ДМФ.
К этой смоле добавляли 20% пиперидин в ДМФ (10 мл на 1 г смолы). После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ.
Эту смолу обрабатывали смесью бензилизоцианата (4 экв) и DIEA (4 экв) в ДХМ в течение 4 часов при комнатной температуре. Затем смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем МеОН. Смолу сушили в вакууме при комнатной температуре.
Эту смолу обрабатывали муравьиной кислотой в течение 14 часов при комнатной температуре. После удаления смолы фильтрованием, фильтрат конденсировали при пониженном давлении с получением продукта в виде масла.
1Н ЯМР (400 МГц, CDCl3) δ м.д.; 1,48 (д, 3Н), 2,98 (с, 3Н), 3,18 (м, 1Н), 3,46 (м, 1Н), 4,37-4,74 (м, 5Н), 5,66 (дд, 1Н), 6,18 (м, 1Н), 7,10-7,40 (м, 10Н).
ПРИМЕР ПОЛУЧЕНИЯ 5
Получение бензиламида 2,5,7-триметил-3,6-диоксогексагидро[1,2,4]триазоло[4,5-a]пиразин-1-карбоновой кислоты
Указанное в заголовке соединение получают согласно процедуре, описанной в препаративном примере 4, но с реакцией бромацетальной смолы с раствором метиламина вместо бензиламина. 1Н ЯМР (400 МГц, CDCl3) δ м.д.; 1,48 (д, 3Н), 2,99 (с, 3Н), 3,03 (с, 3Н), 3,38 (м, 1Н), 3,53 (дд, 1Н), 4,36 (дд, 1Н), 4,52 (кв, 1Н), 4,59 (дд, 1Н), 5,72 (дд, 1Н), 6,19 (ш т, 1Н), 7,10-7,38 (м, 5Н).
ПРИМЕР ПОЛУЧЕНИЯ 6
Получение бензиламида 2-метил-5-(п-гидроксифенилметил)-7-нафтилметил-3,6-диоксогексагидро[1,2,4]триазоло[4,5-a]пиразин-1-карбоновой кислоты
Бромацетальную смолу (30 мг, 0,98 ммоль/г) и раствор нафтилметиламина в ДМСО (1,5 мл, 2 М) помещали во флакон с завинчивающейся крышкой. Реакционную смесь встряхивали при 60оС с использованием карусельной печи [Robbins Scientific] в течение 12 часов. Смолу собирали фильтрованием и промывали ДМФ, затем ДХМ с получением первого составляющего компонента.
Раствор Fmoc-Tyr(OBut)OH (3 экв), HATU (PerSeptive Biosystems, 3 экв) и DIEA (3 экв) в NMP (Advanced ChemTech) добавляли к смоле. После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ для присоединения таким образом второго составляющего компонента к первому составляющему компоненту.
К этой смоле добавляли 20% пиперидин в ДМФ. После встряхивания этой реакционной смеси в течение 8 минут при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ.
Раствор N'-Fmoc-N-метилгидразинокарбонилхлорида (5 экв), DIEA (5 экв) в ДХМ добавляли к смоле, полученной, как описано выше. После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и ДМФ.
К этой смоле добавляли 20% пиперидин в ДМФ (10 мл на 1 г смолы). После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ.
Эту смолу обрабатывали смесью бензилизоцианата (4 экв) и DIEA (4 экв) в ДХМ в течение 4 часов при комнатной температуре. Затем смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем МеОН. Смолу сушили в вакууме при комнатной температуре.
Эту смолу обрабатывали муравьиной кислотой в течение 14 часов при комнатной температуре. После удаления смолы фильтрованием фильтрат конденсировали при пониженном давлении с получением продукта в виде масла.
1Н ЯМР (400 МГц, CDCl3) δ м.д.; 2,80-2,98 (м, 5Н), 3,21-3,37 (м, 2Н), 4,22-4,52 (м, 2Н), 4,59 (т, 1Н), 4,71 (д, 1Н), 5,02 (дд, 1Н), 5,35 (д, 1Н), 5,51 (д, 1Н), 6,66 (т, 2Н), 6,94 (дд, 2Н), 7,21-8,21 (м, 12Н).
ПРИМЕР ПОЛУЧЕНИЯ 7
Получение бензиламида 2-метил-6-(п-гидроксифенилметил)-8-нафтил-4,7-диоксогексагидропиразино[2,1-c][1,2,4]триазин-1-карбоновой кислоты
Бромацетальную смолу (60 мг, 0,98 ммоль/г) и раствор нафтиламина в ДМСО (2,5 мл, 2 М) помещали во флакон с завинчивающейся крышкой. Реакционную смесь встряхивали при 60оС с использованием карусельной печи [Robbins Scientific] в течение 12 часов. Смолу собирали фильтрованием и промывали ДМФ, затем ДХМ.
Раствор Fmoc-Tyr(OBut)OH (4 экв), HATU (PerSeptive Biosystems, 4 экв) и DIEA (4 экв) в NMP (Advanced ChemTech) добавляли к смоле. После встряхивания реакционной смеси в течение 4 часов при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ.
К этой смоле добавляли 20% пиперидин в ДМФ. После встряхивания этой реакционной смеси в течение 8 минут при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ.
Раствор Nβ-Fmoc-Nα-бензилгидразиноглицина (4 экв), HOBT [Advanced ChemTech] (4 экв) и DIC (4 экв) в ДМФ добавляли к приготовленной, как описано выше, смоле. После встряхивания реакционной смеси в течение 3 часов при комнатной температуре смолу собирали фильтрованием и промывали ДМФ и затем ДХМ. К этой смоле добавляли 20% пиперидин в ДМФ (10 мл для 1 г смолы). После встряхивания реакционной смеси в течение 8 минут при комнатной температуре смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем ДМФ.
Эту смолу обрабатывали смесью бензилизоцианата (4 экв) и DIEA (4 экв) в ДХМ в течение 4 часов при комнатной температуре. Затем смолу собирали фильтрованием и промывали ДМФ, ДХМ и затем МеОН. После сушки смолы в вакууме при комнатной температуре смолу обрабатывали муравьиной кислотой (2,5 мл) в течение 18 часов при комнатной температуре. Смолу удаляли фильтрованием и фильтрат конденсировали при пониженном давлении с получением продукта в виде масла.
1Н ЯМР (400 МГц, CDCl3) δ м.д.; 2,73 (с, 3Н), 3,13 (д, 1Н), 3,21-3,38 (м, 3Н), 3,55 (д, 1Н), 3,75 (т, 1Н), 4,22 (дд, 1Н), 4,36 (дд, 1Н), 4,79 (д, 1Н), 5,22 (т, 1Н), 5,47 (м, 2Н), 6,68 (д, 2Н), 6,99 (д, 2Н), 7,21-8,21 (м, 12Н);
МС (m/z, ESI) 564,1 (МН+) 586,3 (MNa+).
ПРИМЕРЫ
Плазмиды
Делеционные конструкции СВР и р300 экспрессировали в коммерчески доступном векторе pTriEx-3 (Novagen, Madison, WI). Ряд делеций мышиного СВР генерировали при помощи ПЦР из плазмиды с полноразмерным мышиным СВР, любезным подарком д-ра Рихарда Гудмана из Vollum Institute, Portland, OR. Амплифицированные районы имеют сайт BamHI на 5'-конце и сайт NotI на 3'-конце для создания возможности клонирования в рамке считывания с ATG экспрессирующего вектора pTriEx-3. Для узнавания и очистки эти плазмиды клонировали также в рамке считывания с 6х-гистидиновой меткой и меткой вируса простого герпеса (HSV) на СООН-конце. Прямым праймером, используемым для клонирования укороченных на С-конце конструкций СВР, был 5'-GATATCTGAGCTCGTGGATCCGATGGCCGAGAACTTGCTG-3' (SEQ ID NO:7). Обратными праймерами, используемыми для СВР-С1 (1-334), -С2 (1-634), -С3 (1-1594), -С4 (1-2062), -С5 (1-2623), -С6 (1-3094), -С7 (1-3694), были: С1: 5'-CGTGTATACAGCTGTGCGGCC-GCGTTTGTACTGTTCGGCTG-3' (SEQ ID NO:8), С2: 5'-CGTGTATACAGCTGTGCGGCCGCTCC-ATTCATGACTTGAGC-3' (SEQ ID NO:9), С3: 5'-GCTGTATACAGCTGTGCGGCCGCGCGTTTTT-CAGGGTCTGC-3' (SEQ ID NO:10), С4: 5'-CGTGTATACAGCTGTGCGGCCGC AGCTGGTAAAGC-TGGCTG-3' (SEQ ID NO:11), С5: 5'-CGTGTATACAGCTGTG CGGCCGCATGTTGGAGAGAGGGC-AT-3' (SEQ ID NO:12), С6: 5'-CGTGTATACAGCTGTGCGGCCGCAGAACCTTGTAAA TCCTC-3' (SEQ ID NO:13), С7: 5'-CGTGTATACAGCTGTGCGGCCGCGCTGTAGTAGGCTGCATC-3' (SEQ ID NO:14). Укороченные на N-конце конструкции СВР получали со следующим обратным праймером: 5'-GTATACAGCTGTGCGGCCGCCAAACCCTCCACAA ACTTTTC-3' (SEQ ID NO:15). Прямыми праймерами для СВР-С8 (4081-7324), -С9 (4534-7324), -С10 (5074-7324), -С11 (5674-7324), -С12 (6286-7324), -С13 (6754-7324) были: С8: 5'-GATATCTGAGCTCG-TGGATCCGGAAGCTGGGGAGGTTT TT-3' (SEQ ID NO:16), С9: 5'-GATATCTGAGCTCGTGGAT-CCGAAGAAGATGC TGGACAAG-3' (SEQ ID NO:17), С10: 5'-GATATCTGAGCTCGTGGATCCGTCC AAATGGTCCACTCTG-3' (SEQ ID NO:18), С11: 5'-GATATCTGAGCTCGTGGAT CCGTCTCCTACCTCAGCACCA-3' (SEQ ID NO:19), С12: 5'-GATATCTGAGCTC GTGGATCCGAACATCCTTAA-ATCAAAC-3' (SEQ ID NO:20), С13: 5'-GATATCT GAGCCGTGGATCCGCAGCAGCAACGCATG-CAA-3' (SEQ ID NO:21). С использованием прямого праймера укороченных на С-конце конструкций и обратного праймера укороченных на N-конце конструкций был амплифицирован полноразмерный СВР мыши, и он был клонирован в вектор pTriEx-3. СВР (Δ1-111+NLS) генерировали при помощи ПЦР полноразмерного СВР с использованием следующего прямого, очищенного электрофорезом в ПААГ, праймера, содержащего сайт BamHI слева от последовательности NLS (подчеркнутой) СВР: 5'-ATCTGAGCTCGTGGATCCGGGACCGCCCAACCCCAAACGAGCCAAACTCCAGCCGAACAGTACAAACATGGCCAGCTTA-3' (SEQ ID NO:22), а используемым обратным праймером был праймер, используемый для генерирования укороченных на N-конце конструкций СВР, упомянутый выше. Инсерт клонировали в сайты BamHI-NotI плазмиды pTriEx-3.
Делеционные конструкции р300 генерировали при помощи ПЦР плазмиды р300 человека (CMVβ-р300-СНА), любезного подарка д-ра Дэвида Ливингстона (Harvard, MA). Продукты ПЦР клонировали в сайт HindIII-NotI вектора pTriEx-3. Прямой праймер для укороченных на С-конце конструкций р300 был: 5'-GACGGTACCGGTTCGAAGCTTA-TGGCCGAGAATGTGGT-3' (SEQ ID NO:23). Обратные праймеры для: р300-Р1 (1-334), р300-Р2 (1-634) и р300-Р3 (1-1054) являются следующими: Р1: 5'-CGTGTATACAGCTGTGCGGCCGC-CAAACCTAATC CAGGACT-3' (SEQ ID NO:24), Р2: 5'-CGTG-TATACAGCTGTGCGGCCGCGTTGC CAGCACTTCCCAT-3' (SEQ ID NO:25), Р3: 5'-CGTGTATACA-GCTGTGCGGCCG CGGCCTGTTCCCGGCGCTG-3' (SEQ ID NO:26).
Плазмиду β-катенин/TCF-репортер генерировали инсерцией 4 тандемных сайтов связывания TCF4 (CCAACCTTTGATCTTACCCCCTTTGATCTTACCCCCTTTGATCAG-GAATTCGGTTGGAAACTAGAATGGGGGAAACTAGAATGGGGGAAACTAGT CCTTAAG) (SEQ ID NO:27) в сайты XhoI-KpnI плазмиды pGL3 (Promega) слева от промотора SV40, запускающего экспрессию расположенного справа гена люциферазы.
Все праймеры покупали из Integrated DNA Technologies, Inc. (Coralville, IA). Рестрикционные ферменты, использованные для клонирования, подчеркнуты и были куплены из New England Biolabs, Beverly, MA.
Культура клеток
Клеточные линии ободочной кишки человека SW480 и НСТ116 и нормальные колоноциты CCD18Co (ATCC, Manassas, VA) выращивали в DMEM (Invitrogen Gibco-BRL, Baltimore, MD), дополненной 10% фетальной телячьей сывороткой, в атмосфере 5% СО2 при 37оС.
Трансфекция
Экспоненциально растущие клетки SW480 и НСТ116 (105) культивировали в 24-луночных планшетах или чашках 100 мм и трансфицировали 0,5 мкг β-катенин/TCF-репортер и увеличивающимися концентрациями эффекторных плазмид или 10 мкг экспрессирующих векторов, соответственно. Клетки трансфицировали с использованием FuGENE6 (Roche Molecular Biochemicals, Indianapolis, IN) или Superfect (Qiagen, Valencia, CA), как указано. Ядерные экстракты получали в соответствии с процедурой, описанной в наборе NE-PER (Pierce Biotechnology, Rockford, IL).
Люциферазные анализы
Люциферазные анализы для различных групп выполняли на 20 мкл клеточного лизата с использованием двойной системы анализа люциферазы (Promega), спустя 16-24 ч после трансфекции, как указано. Для нормализации использовали увеличивающиеся концентрации пустого экспрессирующего вектора pTriEx-3.
Анализы с использованием мягкого агара
Анализ образования колоний в мягком агаре проводили с клетками SW480 посредством некоторой модификации процедуры, описанной ранее (Moody et al., “A vasoactive intestinal peptide antagonist inhibits non-small cell lung cancer growth,” Proc. Natl. Acad. Sci. USA. 90:4345-49 (1993)).
Каждую лунку (35 мм) 6-луночной чашки (Nalge Nunc International, Roskide, Denmark) покрывали 1 мл 0,8% нижнего агара в среде DMEM, содержащей 10% фетальную телячью сыворотку. После его отверждения 1 мл среды DMEM, содержащей 0,4% верхний агар, 10% фетальную телячью сыворотку, соединение, концентрировали в 2 раза и в каждую лунку добавляли 5000 отдельных жизнеспособных клеток. Эти культуры инкубировали при 37оС в увлажненном термостате с 5% СО2. Колонии в мягком агаре подвергали мониторингу один раз в день и фотографировали после инкубирования в течение 8 дней. Колонии, имеющие диаметр >60 мкм, считали.
Иммунопреципитация
Клетки лизировали лизисным буфером, содержащим 20 мМ HEPES рН 7,9, 100 мМ NaCl, 0,5 мМ ЭДТА, 0,5% Нонидет Р-40, 6 мМ MgCl2, 5 мМ 2-меркаптоэтанол и 1 таблетку смеси ингибиторов протеаз Complete™ (Roche Molecular Biochemicals), в течение 30 минут на льду и осветляли центрифугированием. Лизаты целых клеток инкубировали с указанными антителами, для СВР-С1, антителом А-22 из Santa Cruz Biotechnology, Inc., для р300-Р1, антителом N-15 (Santa Cruz Biotechnology, Inc. Santa Cruz, CA) и для полноразмерного эндогенного β-катенина, моноклональным антителом (Transduction Laboratories, Lexington, KY), предварительно связанными с Белок А-агарозными гранулами (Pierce, Rockford, IL), в течение 1 часа при комнатной температуре. Иммунные комплексы промывали несколько раз в HBS (100-150 мМ NaCl, как указано, 10 мМ HEPES рН 7,9, 5 мМ 2-меркаптоэтанол и 1 таблетка смеси ингибиторов протеаз Complete™) и подвергали вестерн-блоттингу, см. ниже. Затем эти гранулы промывали семь раз буфером, содержащим (20 мМ HEPES рН 7,9, 500 мМ NaCl и 5 мМ 2-меркаптоэтанол, содержащий 1 таблетку смеси ингибиторов протеаз Complete™).
“Ниспадающие” анализы
25-100 мкМ биотинилированного СОЕДИНЕНИЯ 2 связывали в течение ночи при комнатной температуре с 100 мкл 50% суспензии стрептавидин-агарозных гранул (Amersham Pharmacia Biotech, Arlington Heights, IL) в буфере, содержащем 50% ДМСО и 50% связывающий белок буфер, РВВ (20 мМ Hepes рН 7,9, 20% глицерин, 0,05 мМ ЭДТА, 60 мМ NaCl, 6 мМ MgCl2, 0,1% Нонидет Р-40, 5 мМ 2-меркаптоэтанол и 1 таблетку смеси ингибиторов протеаз Complete™). Эти гранулы промывали 3х РВВ для удаления несвязанного СОЕДИНЕНИЯ 2. 100-200 мкл лизатов целых клеток, содержащих сверхэкспрессирующие плазмиды (см. раздел иммунопреципитации), инкубировали с этими гранулами в течение 3-4 часов при комнатной температуре или в течение ночи при 4оС. Затем эти гранулы промывали 3х в РВВ-буфере и затем элюированные белки подвергали электрофорезу в ДСН-ПААГ и Вестерн-блоттингу (см. ниже). В конкурентных анализах, избыток СОЕДИНЕНИЯ 1, как указано для каждого эксперимента, прединкубировали с этими лизатами в течение 1 часа при комнатной температуре.
ChIP-анализ
Анализы со сшиванием с формальдегидом и иммунопреципитацией хроматина клеток SW480 выполняли, как описано ранее (Barlev et al., “Acetylation of p53 activates transcription through recruitment of coactivators/histone acetyltransferases,” Mol. Cell 8:1243-54 (2001); El-Osta et al., “Analysis of Chromatin-immunopurified MeCP2-associated fragments,” Biochem. Biophys. Res. Commun. 289:733-37 (2001); Shang et al., “Formation of the androgen receptor transcription Complex,” Mol. Cell 9:601-10 (2002)). Праймеры, используемые для ПЦР промоторов c-myc и cyclin D1, являются следующими: прямой праймер c-myc: 5'-TGGTAGGCGCGCGTAGTTA-3' (SEQ ID NO:28) и обратный праймер: 5'-GGGCGGAGATTAGCGAGAG-3' (SEQ ID NO:29). Прямой праймер cyclin D1: 5'-TGCTTAACAACA-GTAACGT-3' (SEQ ID NO:30) и обратный праймер: 5'-GGGGCTCTTCCTGGGCAGC-3' (SEQ ID NO:31). Эти праймеры ChIP были сконструированы на приблизительно 20-30 пар оснований справа от домена связывания TCF4 с районом промотора вблизи сайта инициации транскрипции. Продукты ПЦР имеют размер приблизительно 200 пар оснований. Анти-СВР-антитело, АС-26, было любезным подарком д-ра Дэвида Ливингстона.
Вестерн-блот-анализ
Иммунные комплексы, полученные, как описано выше, разделяли электрофорезом в ДСН-ПААГ с последующим перенесением на мембраны иммобилон-Р (PVDF) из (Millipore, Bedford, MA). Эти мембраны блокировали 5% обезжиренным сухим молоком в TBST (15 мМ Трис-HCl, рН 7,4, 0,9% NaCl и 0,05% Твин 20) с последующим блоттингом с указанными антителами. Анти-His-антитело из Qiagen Inc. использовали для детектирования белков, произведенных в pTriEx-3. Вторичные антитела, конъюгированные с пероксидазой хрена (Santa Cruz Biotechnology Inc.), использовали для детектирования. Иммуноблоты анализировали с использованием набора для детектирования ECL (Amersham Pharmacia Biotech).
Иммунофлуоресценция
Иммунофлуоресценцию использовали для определения местоположения СВР и β-катенина в клетках SW480 и НСТ116, обработанных СОЕДИНЕНИЕМ 1 (25 мкМ) или контролем (0,5% ДМСО). Клетки в логарифмической фазе высевали и спустя 24 часа эти клетки обрабатывали СОЕДИНЕНИЕМ 1 или контролем. Спустя 24 часа после обработки клетки фиксировали. Покровные стекла инкубировали с антителами, индуцированными против СВР (А-22) (Santa Cruz Biotechnology) и β-катенина (Transduction Laboratories), соответственно. Предметные стекла исследовали с использованием конфокального микроскопа с лазерным сканированием Nikon PCM 2000 после нанесения вторичных антител, конъюгированных либо с FITC, либо с TRITC (Jackson ImmunoResearch, Westgrove, PA).
Проточный цитометрический анализ (FACS)
Для анализа FACS приблизительно 5 х 106 клеток из PNRI-обработанных или обработанных носителем клеток фиксировали 70% охлажденным этанолом и хранили при -20оС в течение по меньшей мере 30 минут. Эти клетки промывали один раз 1 х ЗФР и инкубировали с раствором иодида пропидия (флуоресцентного красителя) (85 мкг/мл иодида пропидия, 0,1% Нонидет Р-40, 10 мг/мл РНКазы) в течение 30 минут при комнатной температуре, 10000 окрашенных клеток для каждой пробы получали с использованием проточной цитометрии Beckman Coulter EPICS XL-MCL и процент клеток в различных фазах клеточного цикла определяли с использованием программы Expo32 ADC (Coulter Corporation, Miami, Florida, 33196).
Очистка белков
СВР (1-111) и р300 (1-111) экспрессировали в виде слитых белков с 6Х-His-метками и очищали аффинно из бактериальных лизатов с использованием их 6Х-His-меток. Трансформированные бактериальные осадки (культуры 1 л) ресуспендировали в 5-10 мл лизисного буфера (20 мМ Hepes рН 7,9, 150 мМ NaCl, 0,1% Нонидет Р-40, 5 мМ 2-меркаптоэтанол и 1 таблетка смеси ингибиторов протеаз Complete™). Клетки лизировали обработкой ультразвуком. Осветленные лизаты инкубировали в течение 1 часа при 4оС с 500 мкл Ni-NTA-агарозных гранул (Qiagen). Связанные белки элюировали 500 мкл буфера для элюции (20 мМ Hepes рН 7,9 и 150 мМ NaCl, 1 таблетка смеси ингибиторов протеаз Complete™, 5 мМ 2-меркаптоэтанол и 250 мМ имидазол). Элюированные белки замораживали в виде малых аликвот.
ПЦР-анализ с обратной транскрипцией реального времени
Набор RNeasy Midi (Qiagen) использовали для экстракции РНК и ОТ-ПЦР реального времени выполняли в соответствии с протоколом, обеспечиваемым с набором SYBR Green PCR Master Mix (Perkin Elmer Biosystems, Shelton, CT). Праймерами, используемыми для амплификации cyclin D1, axin2, hnkd, c-myc, c-jun и fra-1, были: прямой праймер cyclin D1: 5'-AGATCGAAGC-CCTGCTG-3' (SEQ ID NO:32) и обратный праймер: 5'-AGGGGGAAAGAGCAAAGG-3' (SEQ ID NO:33), приводившие к размеру продукта приблизительно 300 п.н.; прямой праймер axin2: 5'-GTGTGAGGTCCAC GGAAA-CT-3' (SEQ ID NO:34) и обратный праймер: 5'-CTCGGGAAATGAGGTA-GAGA-3' (SEQ ID NO:35); прямой праймер hnkd: 5'-CTGGCTGCTGCTACCACCA TTGCGT-3' (SEQ ID NO:36) и обратный праймер: 5'-CCAGGCCCAAATTGGG ACGT-3' (SEQ ID NO:37); прямой праймер c-myc: 5'-GAA-GAAATTCGAGCTG CTGC-3' (SEQ ID NO:38) и обратный праймер: 5'-CACATACAGTCCTGGATGAT-G-3' (SEQ ID NO:39); прямой праймер c-jun: 5'-AGATGCCCGGCGAGACACCG-3' (SEQ ID NO:40) и обратный праймер: 5'-AGCCCCCGACGGTCTCTTT-3' (SEQ ID NO:41); прямой праймер fra-1: 5'-ACC-CCGGCCAGGAG-TCATCCGGGCCC-3' (SEQ ID NO:42) и обратный праймер: 5'-AGGCGCCTCACAAAGCGAGGAGGG-TT-3' (SEQ ID NO:43). β-актин использовали для нормализации. Праймерами β-актина были: прямой праймер: 5'-ATCTGGCACCACACCTTCTACAATGAGCTGCG-3' (SEQ ID NO:44) и обратный праймер: 5'-CGTCATACTCCTCCTTGCYGATCCACA TCTGC-3'(SEQ ID NO:45). Каждый набор праймеров амплифицировали при 95оС в течение 10 минут и 40 циклов 95оС в течение 15 секунд и 60оС в течение 1 минуты.
Анализ активности каспазы-3
Клетки SW480, НСТ116 и CCD18Co высевали при 105 клеток на лунку (96-луночных планшетов) за 24 часа перед обработкой. 25 мкМ СОЕДИНЕНИЯ 1 или контроля (0,5% ДМСО) добавляли в каждую лунку. Спустя 24 часа после обработки клетки лизировали и активность каспазы измеряли с использованием набора для определения каспазы-3/7 (Apo-One Homogeneous caspase-3/7 assay, #G77905, Promega). Относительные единицы флуоресценции (RFU) получали вычитанием величин единиц слепого опыта (контроля, без клеток) из экспериментально измеренных величин.
Таблица 1 показывает результаты количественного анализа ПЦР с обратной транскрипцией (ОТ-ПЦР) реального времени клеток SW480, обработанных в течение 4, 8 или 24 часов либо СОЕДИНЕНИЕМ 1 (25 мкг), либо контролем (0,5% ДМСО). 1 мкг мРНК, для каждой временной точки, подвергали ОТ-ПЦР реального времени. Уровень эндогенной экспрессии cyclin D1, c-myc, fibronectin, hnkd, axin2, c-jun и BMP-4 измеряли относительно β-актина. Количественное определение Δцикла пороговых величин (CT) выполняли вычитанием средних величин каждого набора из соответствующих средних величин, полученных для β-актина. Все эксперименты выполняли в двух повторностях.
СОЕДИНЕНИЕ 1 противодействует β-катенин/TCF транскрипции действием на СВР
Вследствие мутации в АРС клетки карциномы ободочной кишки SW480 проявляют конститутивное перемещение β-катенина в ядро и, следовательно, высокую базовую транскрипцию β-катенин/TCF, как оценено репортерной системой TOPFLASH (Korinek et al., “Constitutive transcriptional activation by beta-catenin-Tcf complex in APC-/- colon carcinoma,” Science 275:1784-87 (1997)). Родственный репортер использовали для скрининга библиотеки малых молекул с шаблонами вторичной структуры (Ogbu et al., “Highly efficient and versatile synthesis of libraries of constrained b-strand mimetics.” Bioorg. Med. Chem. Lett. 8:2321-26 (1998); Eguchi et al., “Solid-phase synthesis and structural analysis of Bicyclic β-turn mimetics incorporating functionality at the i to i+3 positions,” Amer. Chem. Soci. 102:22031-32 (1999)) на ингибиторы опосредованной комплексом β-катенин/TCF транскрипции. Из начального скрининга авторы выбрали СОЕДИНЕНИЕ 1 (фигура 1А), которое имело IC50 5 мкМ (фигура 1В) и очень хорошую селективность в сравнении с рядом других СВР-зависимых репортеров, в том числе NFAT (фигура 1С), CRE и АР-1 (данные не показаны). СОЕДИНЕНИЕ 1 проявляет сходную активность в клетках НСТ116, которые являются дефектными в сайтах фосфорилирования β-катенина, но экспрессируют АРС дикого типа (данные не показаны).
Для определения молекулярной мишени (мишеней) СОЕДИНЕНИЯ 1 авторы дериватизировали его для использования в качестве аффинного реагента с получением СОЕДИНЕНИЯ 2 (фигура 1А). Ядерные экстракты получали из клеток SW480 после предобработки СОЕДИНЕНИЕМ 1 или носителем и затем инкубировали с СОЕДИНЕНИЕМ 2. Затем эти комплексы разделяли на стрептавидин-агарозных гранулах и подвергали гель-электрофорезу. Большая полоса, удерживаемая из ядерного экстракта клеток SW480 на аффинной колонке с СОЕДИНЕНИЕМ 2, имела среднюю молекулярную массу 225 КДа и была идентифицирована иммуноблоттингом как CREB-связывающий белок (СВР) (фигура 1D). СОЕДИНЕНИЕ 1 специфически элюировало СВР, связанный с СОЕДИНЕНИЕМ 2 (фигура 1D, сравните дорожку 7 с 8) и прединкубация ядерных экстрактов с СОЕДИНЕНИЕМ 1 (20 мкМ) перед аффинной хроматографией блокировала связывание СВР (фигура 1D, дорожка 9). Используемое антитело было специфическим в отношении СВР и не реагировало перекрестно с р300. Таким образом, эти результаты указывают на то, что СОЕДИНЕНИЕ 1 связывает СВР.
Ряд дополнительных исследований выполняли для дополнительной валидизации того, что СОЕДИНЕНИЕ 1 связывает СВР. 14С-меченую версию СОЕДИНЕНИЯ 1 синтезировали включением 14С-меченого тирозина в этом синтезе. Ядерные лизаты клеток SW480, нетрансфицированных или трансфицированных экспрессирующими векторами либо β-катенина, либо СВР, обрабатывали 14С-меченым СОЕДИНЕНИЕМ 1 либо с ДМСО, либо с “холодным” СОЕДИНЕНИЕМ 1 в течение ночи. Затем клеточные лизаты обессоливали с использованием колонок G-25 для удаления несвязанного 14С-меченого СОЕДИНЕНИЯ 1 и измеряли включение радиоактивности. Как видно на фигуре 1Е, ядерные лизаты, трансфицированные СВР, имели приблизительно в 4-6 раз увеличенное включение 14С-меченого СОЕДИНЕНИЯ 1 в сравнении с контролем (фигура 1Е, сравните дорожку 2 с 6), которое удалялось конкурентно “холодным” СОЕДИНЕНИЕМ 1 зависимым от дозы образом (фигура 1Е, сравните дорожку 6 с 7 и 8).
На основании этих данных делается вывод, что СОЕДИНЕНИЕ 1 связывает СВР. Таким образом, один аспект данного изобретения обеспечивает способ, предусматривающий объединение композиции, содержащей СВР, с агентом, где этот агент связывает СВР. Связывание СВР противодействует любой другой реакции связывания, которой в противном случае мог бы подвергаться СВР. Таким образом, данное изобретение обеспечивает способ лечения субъекта связыванием с СВР, предусматривающий введение эффективного количества агента субъекту, нуждающемуся в этом.
СОЕДИНЕНИЕ 1 специфически взаимодействует с первыми 111 аминокислотами СВР
Биотинилированный аналог, СОЕДИНЕНИЕ 2 (фигура 1А), использовали для определения минимального района СВР, необходимого для связывания СОЕДИНЕНИЯ 1. Клеточные лизаты, которые содержали сверхэкспрессируемые фрагменты СВР (фигура 2В, верхняя панель), инкубировали со стрептавидин-агарозными гранулами, предварительно связываемыми с СОЕДИНЕНИЕМ 2 в течение нескольких часов. Затем связанные белки элюировали из этих гранул и подвергали гель-электрофорезу и иммуноблоттингу с использованием анти-His-антител для детектирования связанного фрагмента (связанных фрагментов) СВР. Как показано (фигура 2В, нижняя панель), минимальным районом, с которым специфически связывалось СОЕДИНЕНИЕ 2, был район 1-111 аминокислот на NH2-конце СВР (сравните дорожки 2, 3 и 4 с другими). Как понятно из экспериментов по коиммунопреципитации, связывание не детектировали ни с одним из фрагментов р300, сверхэкспрессируемых в клетке SW480 (данные не показаны, см. ниже). Когда СВР (1-111), СВР (1-211) и СВР (1-351) вместе с р300 (1-111), р300 (1-211) и р300 (1-351) сверхэкспрессировали в клетках SW480 (фигура 2С, нижняя панель), избыток СОЕДИНЕНИЯ 1 в значительной степени конкурентно удалял связывание фрагментов СВР (фигура 2С, верхняя панель, сравните дорожки 4-6 с 7-9), но не оказывал какого-либо действия на связывание фрагментов р300 (фигура 2С, сравните дорожки 10-12 с 13-15). Таким образом, видно, что СОЕДИНЕНИЕ 1 связывает первые 111 аминокислот СВР, но не родственного белка, р300.
Для исключения возможности непрямой ассоциации между СВР и СОЕДИНЕНИЕМ 1, опосредуемой другим клеточным компонентом, и для тестирования на прямое связывание авторы аффинно очищали СВР (1-111) и р300 (1-111) с использованием 6х-His-меченых экспрессируемых E. coli белков (фигура 2D, справа). С использованием СОЕДИНЕНИЯ 2, связанного со стрептавидин-агарозными гранулами, авторы продемонстрировали специфическое связывание СВР (1-111), но не р300 (1-111) с СОЕДИНЕНИЕМ 2, которое конкурентно удалялось избытком СОЕДИНЕНИЯ 1 (фигура 2D, справа, сравните дорожки 3-5 с 6-8). Эти результаты подтверждают прямую ассоциацию между СВР (1-111) и СОЕДИНЕНИЕМ 1 in vitro. Поскольку СОЕДИНЕНИЕ 1, связанное с СВР, экспрессировали в E. coli, это снижает вероятность того, что СВР должен быть фосфорилированным киназами млекопитающего для связывания с СОЕДИНЕНИЕМ 1.
Дополнительное подтверждение решающей роли амино-конца СВР получали с использованием конструкции СВР (Δ1-111 + NLS). В то время как экспрессия полноразмерного СВР спасала ингибирование СОЕДИНЕНИЕМ 1 (25 мкМ) активности β-катенин/промотор TCF зависимым от дозы образом, экспрессия СВР (Δ1-111 + NLS) не оказывала этого действия (фиг.2Е).
Таким образом, в одном аспекте данное изобретение обеспечивает способ модуляции β-катенин-индуцированной экспрессии генов, предусматривающий контактирование композиции с агентом, где эта композиция содержит β-катенин, СВР и р300, и этот агент контактируют с данной композицией в количестве, эффективном для уменьшения связывания β-катенина с СВР при небольшом действии или при отсутствии действия на связывание β-катенина с р300.
СОЕДИНЕНИЕ 1 конкурирует с β-катенином за СВР
СВР является ограничивающим скорость фактором во многих транскрипционных событиях. Как видно на фигуре 3А, трансфекция увеличивающейся концентрацией СВР, но не β-катенина, увеличивала IC50 СОЕДИНЕНИЯ 1 (12,5 мкМ) зависимым от дозы образом. Анализы иммунопреципитации выполняли в клетках SW480 для определения, что СОЕДИНЕНИЕ 1 разрушает связывание β-катенина с СВР. Иммунопреципитация β-катенина СВР ингибировалась СОЕДИНЕНИЕМ 1 зависимым от концентрации образом (фигура 3В, сравните дорожки 2, 3 и 4, дорожка 1 является контролем, без добавления антител). Связывание СОЕДИНЕНИЯ 1 с СВР является очень специфическим, так как это соединение не препятствует связыванию β-катенина с р300 (фиг.3В, нижняя панель, сравните дорожки 2-4), несмотря на тот факт, что СВР и р300 являются высокогомологичными.
Для дополнительного подтверждения вышеупомянутого взаимодействия β-катенин/СВР клетки SW480 трансфицировали вышеописанными делеционными конструкциями СВР и р300 (фиг.2А). После последующего промывания гранул СВР (1-111), СВР (1-211) и СВР (1-351), а также р300 (1-111), р300 (1-211) и р300 (1-351) оставались специфически связанными с иммунопреципитированным β-катенином (фиг.3С, сравните дорожки 2-4 с 5-15). Эти исследования связывания ясно показывают, что первые 111 аминокислот NH2-концов как СВР, так и р300 связываются с β-катенином. Для подтверждения, что этот район перекрывает сайт связывания СВР СОЕДИНЕНИЯ 1, авторы оценивали связывание СВР (1-111), СВР (1-211) и СВР (1-351) и р300 (1-111), р300 (1-211) и р300 (1-351) с β-катенином в присутствии избытка СОЕДИНЕНИЯ 1. Фиг.3D, нижняя панель, показывает сравнимые уровни экспрессии этих фрагментов в клетках SW480. Экспонирование избытка СОЕДИНЕНИЯ 1 разительным образом удаляет конкурентно связывание фрагментов СВР с β-катенином, но не влияет на связывание фрагментов р300 с β-катенином (фиг.3D, верхняя панель, сравните дорожки 4-9 с 10-15). Из представленных данных видно, что СОЕДИНЕНИЕ 1 специфически связывается с амино-концом СВР (аминокислотами 1-111), различая между высокогомологичными коактиваторами, СВР и р300, и конкурентно удаляет взаимодействие β-катенина с СВР.
Эти исследования связывания ясно показывают, что первые 111 аминокислот как СВР, так и р300 являются минимальным районом взаимодействия с β-катенином. Сопоставление последовательностей этих районов показывает поразительные сходства с ранее опубликованными мотивами связывания β-катенина, обнаруженными в TCF, АРС и Е-кадгерине (фиг.3Е и 3F). Данные сопоставления последовательностей в сильной степени предполагают, что СВР, подобно другим взаимодействующим с β-катенином белкам, захватывает консервативный отрезок отрицательно заряженных аминокислот, требующихся для связывания β-катенина.
СОЕДИНЕНИЕ 1 уменьшает уровень ядерного β-катенина
Исследовали субклеточное распределение β-катенина и СВР для определения, влияет ли на локализацию каждого из них СОЕДИНЕНИЕ 1. Большая часть эндогенного β-катенина в клетках SW480 обнаружена в ядре, как и СВР (фиг.4А). Обработка СОЕДИНЕНИЕМ 1 вызывала перемещение β-катенина в цитоплазму клеток SW480, в которых экспрессия эндогенного Е-кадгерина является ограниченной (фиг.4А, сравните контроль, верхняя панель, с обработанными клетками, нижняя панель) (de Vries et al., “In vivo and in vitro invasion in relation to phenotypic characterisnics of human colorectal carcinoma cells,” Br. J. Cancer 71:271-77 (1995)). Обработка ингибитором ядерного транспорта лептомицином В устраняла индуцированный СОЕДИНЕНИЕМ 1 цитоплазматический транспорт β-катенина, что позволяет предположить, что ядерный экспорт β-катенина, наблюдаемый на фиг.4А, был обусловлен разрушением СОЕДИНЕНИЕМ 1 комплекса β-катенина/СВР (данные не показаны). Таким образом, авторы делают вывод, что разрушение связывания β-катенина с СВР приводит к уменьшенным ядерным уровням β-катенина. Индуцированное СОЕДИНЕНИЕМ 1 перемещение β-катенина из ядра в цитоплазму клеток SW480 наблюдали с использованием вестерн-блот-анализа (фиг.4В).
Дифференциальная регуляция и использование коактиватора генами-мишенями β-катенина
Ген cyclin D1 экспрессируется ненадлежащим образом во многих различных типах опухолей, и известно, что он является прямой мишенью пути Wnt/β-катенина (Shtutman et al., “The cyclin D1 gene is a target of the beta-catenin/LEF-1 pathway,” Proc. Natl. Acad. Sci. USA 96:5522-27 (1999); Tetsu et al., “Beta-catenin regulates expression of cyclin D1 in colon carcinoma cells,” Nature 398:422-26 (1999)). Для определения действия СОЕДИНЕНИЯ 1 на экспрессию этой прямой мишени пути β-катенин/TCF, ПЦР с обратной транскрипцией (ОТ-ПЦР) реального времени проводили на мРНК, экстрагированной из клеток, обработанных СОЕДИНЕНИЕМ 1 (25 мкМ) или контролем, при временных точках 4, 8 и 24 часа после обработки (таблица 1). Таблица 1 показывает результаты количественного анализа ПЦР с обратной транскрипцией (ОТ-ПЦР) реального времени клеток SW480, обработанных в течение 4, 8 или 24 часов либо СОЕДИНЕНИЕМ 1 (25 мкМ), либо контролем (0,5% ДМСО). 1 мкг мРНК, для каждой временной точки, подвергали ОТ-ПЦР реального времени. Уровни экспрессии эндогенных cyclin D1, с-myc, fibronectin, hnkd, axin2, c-jun и BMP-4 измеряли относительно β-актина. Количественное определение Δцикла пороговых величин (CT) выполняли вычитанием средних величин каждого набора из соответствующих средних величин, полученных для β-актина. Все эксперименты выполняли в двух повторностях.
ОТ-ПЦР реального времени
(часы)
СОЕДИНЕНИЕ 1
(25 мкМ)
24
3,1
8
0,8
8
1,0
24
-2,9
8
-1,4
8
-2,4
Ген β-актина использовали для нормализации этих данных. ΔЦикл пороговых величин (CT) выполняли вычитанием средних величин каждого набора из соответствующих средних величин, полученных для гена β-актина. Чем ниже количество мРНК в клетках, тем выше будет соответствующая величина ΔСТ. Как суммировано в таблице 1, наблюдали увеличение ΔСТ-величин для матрицы cyclin D1 в клетках, обработанных СОЕДИНЕНИЕМ 1, зависимым от времени образом, в сравнении с контрольными клетками. Оценивали также уровни белка циклина D1 в клетках. Клеточные лизаты обработанных целых клеток SW480 подвергали гель-электрофорезу и Вестерн-блот-анализу. Как показано на фигуре 5А, было явное уменьшение уровня циклина D1 после обработки СОЕДИНЕНИЕМ 1 (25 мкМ), начинающееся с 4 часов и увеличивающееся при 24 часах после обработки (сравните дорожки 1 с 2, 3 с 4 и 5 с 6).
Кроме того, выбирали субпопуляцию генов, которые, как было сообщено ранее в литературе, являются прямыми мишенями транскрипции β-катенин/TCF, для анализа ОТ-ПЦР реального времени. Среди этого набора уровни матриц для генов axin2 и human naked cuticle (hnkd) (Yan et al., “Elevated expression of axin2 and hnkd mRNA provides evidence that Wnt/beta-catenin signaling is activated in human colon tumors,” Proc. Natl. Acad. Sci. USA 98:14973-78 (2001)) отрицательно регулировались, как было понятно (таблица 1). Однако, для нескольких регулируемых β-катенин/TCF генов уровни матриц значимо увеличивались, например, c-myc (He et al., “Identification of c-MYC as а target of the APC pathway,” Science 291:1509-12 (1998)), с-jun и fra-1 (таблица 1) (Mann et al., “Target genes of beta-catenin-T-cell-factor/lymphoid-enhancer-factor signaling in human colorectal carcinomas,” Proc. Natl. Acad. Sci. USA 96:1603-08 (1999)). Таким образом, СОЕДИНЕНИЕ 1 ингибирует экспрессию только субпопуляции генов-мишеней β-катенина.
Обнаружение того, что СОЕДИНЕНИЕ 1 ингибировало экспрессию cyclin D1, но не c-myc, два известных гена пути передачи сигнала β-катенина, вместе со специфичностью СОЕДИНЕНИЯ 1 в отношении СВР, но не в отношении р300, позволяет предположить, что селективное использование р300 промотором с-myc может позволить избежать репрессии СОЕДИНЕНИЕМ 1. Для оценки применимости коактиватора при эндогенном промоторе с-myc выполняли анализы иммунопреципитации хроматина (ChIP) на клетках SW480, обработанных либо СОЕДИНЕНИЕМ 1 (25 мкМ), либо контролем (0,5% ДМСО). Как показано на фигуре 5В, промотор c-myc занят обоими коактиваторами СВР и р300 в обработанных контролем клетках, причем большая часть занята СВР. Обработка СОЕДИНЕНИЕМ 1 полностью и селективно блокирует ассоциацию СВР с промотором c-myc и одновременно увеличивается уровень ассоциированного р300. Подобно случаю с промотором c-myc, обработка СОЕДИНЕНИЕМ 1 полностью и селективно блокирует ассоциацию СВР с промотором cyclin D1 (фигура 5В, нижняя панель). В резком противоречии, р300 не может заменять СВР в отношении связывания с промотором гена cyclin D1. Это хорошо коррелирует с данными, полученными ОТ-ПЦР реального времени и Вестерн-блот-анализом (таблица 1 и фигура 5А). Таким образом, СОЕДИНЕНИЕ 1 селективно уменьшает ассоциацию СВР, но не р300 с субпопуляцией регулируемых β-катенином промоторов.
Для дополнительного исследования селективности СОЕДИНЕНИЯ 1 выполняли анализ микроматрицы кДНК с использованием Clontech Atlas Human Cancer 1.2 Array (#7851-1). Эти данные продемонстрировали, что СОЕДИНЕНИЕ 1 имело очень селективное действие на глобальную транскрипцию генов (Таблицы 2-5). После 8 часов обработки клеток SW480 25 мкМ СОЕДИНЕНИЕМ 1, ~2% анализированных генов положительно регулировались более чем в 2 раза, тогда как ~0,3% этих генов отрицательно регулировались на более чем 50% (таблицы 2-3).
Гены, положительно регулируемые 8-часовой обработкой 25 мкМ СОЕДИНЕНИЕМ 1 в клетках SW480
(GADD45)
(NGF-рецептор; NGFR)
липокалина (NGAL)
Гены, отрицательно регулируемые 8-часовой обработкой 25 мкМ СОЕДИНЕНИЕМ 1 в клетках SW480
циклин
поверхности Т-клеток
Гены, положительно регулируемые 24-часовой обработкой 25 мкМ СОЕДИНЕНИЕМ 1 в клетках SW480
(SAP2)
(GADD153)
(NGF-рецептор; NGFR)
фибробластов (FGFR1)
(GRP 78)
липокалина (NGAL)
класса I (HLAC)
Гены, отрицательно регулируемые 24-часовой обработкой 25 мкМ СОЕДИНЕНИЕМ 1 в клетках SW480
эпителиальных клеток
опухолей типа 1 (TRAP1)
CAF1)
(TUBA1)
СОЕДИНЕНИЕ 1 вызывает остановку G1/S-фазы и активирует активность каспазы.
Было показано, что ингибирование экспрессии гена циклина D1 вызывает остановку G1/S-фазы клеточного цикла (Shintani et al., “Infrequent alternations of RB pathway (Rb-p16INK4A-cyclin D1) in adenoid cystic carcinoma of salivary glands,” Anticancer Res. 20:2169-75 (2000)). Клетки НСТ116 (фигура 6А, верхняя панель) и SW480 (фигура 6А, нижняя панель) обрабатывали СОЕДИНЕНИЕМ 1 (25 мкМ) (фигура 6А, справа) или контролем (0,5% ДМСО) (фигура 6А, слева) в течение 24 часов. Затем эти клетки окрашивали иодидом пропидия (PI) и анализировали содержание ДНК при помощи FACS-цитофлуорометрии. Как и ожидалось, контрольные клетки (фигура 6А, слева) имели нормальный клеточный цикл, в то время как обработанные СОЕДИНЕНИЕМ 1 клетки (фигура 6А, справа) обнаруживали увеличенное накопление в G1/S-фазе клеточного цикла. Таким образом, можно видеть, что СОЕДИНЕНИЕ 1 вызывает задержку клеток в G1-фазе.
Каспазы являются цистеиновыми протеазами, которые обычно активируются в популяции клеток, запускаемые апоптотическими стимулами. Для оценки индукции апоптоза в клетках SW480, НСТ116 и колоноцитах дикого типа (клетках CCD18Co) эти клетки обрабатывали либо СОЕДИНЕНИЕМ 1 (25 мкМ), либо контролем (0,5% ДМСО) в течение 24 часов с последующим анализом на активность каспазы 3/7. Как показано на фигуре 6В, СОЕДИНЕНИЕ 1 специфически и значимо активировало путь каспазы-3/7 в клетках SW480 и НСТ116 в сравнении с клетками CCD18Co.
СОЕДИНЕНИЕ 1 уменьшает пролиферацию трансформированных колоректальных клеток
Анализы образования колоний в мягком агаре выполняли с использованием клеток SW480, обработанных СОЕДИНЕНИЕМ 1 (0,25-5 мкМ) и 5-фторурацилом (5FU) (0,5-32 мкМ). Как показано на фигуре 7А, СОЕДИНЕНИЕ 1 показывает зависимое от дозы уменьшение количества образованных колоний. Величина IC50 СОЕДИНЕНИЯ 1 и 5-FU была 0,87±0,11 мкМ и 1,98±0,17 мкМ, соответственно. Таким образом, СОЕДИНЕНИЕ 1 увеличивало активность каспазы и уменьшало рост in vitro колоректальных клеток, которые трансформированы посредством мутаций, которые активируют передачу сигнала β-катенина.
СОЕДИНЕНИЕ 4 и СОЕДИНЕНИЕ 5 уменьшают рост опухоли в модели мышей Min.
СОЕДИНЕНИЕ 4, СОЕДИНЕНИЕ 5 или носитель вводили в мышей дикого типа и мышей Min. СОЕДИНЕНИЕ 4 является также аналогом СОЕДИНЕНИЯ 1 (фигура 1А). Измеряли количество полипов, образованных в тонкой кишке и ободочной кишке этих мышей после различных обработок (таблица 6). Эти данные показали, что как СОЕДИНЕНИЕ 4, так и СОЕДИНЕНИЕ 5 при введении при приблизительно 300 мг/кг уменьшают количество полипов в мышах Min в сравнении с количеством полипов в контрольных мышах, обработанных только носителем.
Действия СОЕДИНЕНИЯ 4 и СОЕДИНЕНИЯ 5 на количество полипов в модели мышей Min
Цитотоксичность СОЕДИНЕНИЯ 3
Цитотоксичность СОЕДИНЕНИЯ 3 (аналога СОЕДИНЕНИЯ 1, фигура 1А) и других противораковых терапевтических средств измеряли с использованием раковых клеток разного происхождения. Эти результаты показывают, что СОЕДИНЕНИЕ 3 в концентрациях, более низких, чем концентрации других противораковых терапевтических средств, или сходных с концентрациями других противораковых средств (т.е. цисплатина, 5-FU, ADR (адриамицина)), вызывают смерть раковых клеток (таблица 7).
Цитотоксичность
Величины в таблице 7 представлены в мкг/мл.
Метаболизм СОЕДИНЕНИЯ 3 в крысе и человеке
Метаболизм СОЕДИНЕНИЯ 3 анализировали инкубированием соединения с микросомой печени крысы или человека в течение 5 минут - 1 часа, фракционированием экстрактов обработанной микросомы с использованием ВЭЖХ и подверганием этих фракций масс-спектрометрическому анализу. Результаты показаны на фигурах 10А и 10В. Несколько метаболитов (например, М1, М2, М3) наблюдали в обеих системах.
Исследование биодоступности СОЕДИНЕНИЯ 3, СОЕДИНЕНИЯ 4 и СОЕДИНЕНИЯ 5
Биодоступность СОЕДИНЕНИЯ 3, СОЕДИНЕНИЯ 4 и СОЕДИНЕНИЯ 5 исследовали в мыши и крысе. Структуры этих соединений показаны на фигуре 1А. Все эти соединения вводили (i.v. и p.o., 10 мг/кг) с использованием одного и того же носителя (а именно, 20% Твина 80). Биодоступность СОЕДИНЕНИЙ 3, 4 и 5 в мыши равна менее 2%, менее 2% и почти 0%, соответственно. Биодоступность СОЕДИНЕНИЯ 3 в крысе равна приблизительно 24%.
Обсуждение
Имеются возрастающие и приковывающие к себе внимание данные, что неправильная регуляция пути β-катенина участвует в развитии и прогрессировании рака (Morin P.J., “Beta-catenin signaling and cancer,” Bioessays 21:1021-30 (1999); Moon et al., “The promise and perils of Wnt signaling through beta-catenin,” Science 296:1644-46 (2002); Oving et al., “Molecular causes of colon cancer,” Eur. J. Clin. Invest. 32:448-57 (2002)). Здесь, авторы изобретения описывают обнаружение того, что соединения формулы (I) ингибируют транскрипцию подкомплекса β-катенин/TCF. Биологическая активность этих низкомолекулярных ингибиторов характеризуется при помощи скрининга репортерных генов с использованием химической библиотеки шаблонов вторичных структур в клетках карциномы ободочной кишки SW480, которые имеют мутации в гене АРС, приводящие к конститутивно повышенной транскрипции комплекса β-катенин/TCF. Аффинная хроматография с использованием биотинилированного аналога (СОЕДИНЕНИЯ 2) сделала возможной идентификацию коактиваторного белка, СВР, в качестве молекулярной мишени СОЕДИНЕНИЯ 1.
Было показано, что трансфекция СВР, но не β-катенина значимо увеличивает связывание 14С-меченого СОЕДИНЕНИЯ 1 с ядерными лизатами SW480. Для валидизации СВР в качестве молекулярной мишени СОЕДИНЕНИЯ 1 было показано, что трансфекция экспрессирующего СВР вектора могла перевешивать ингибирование СОЕДИНЕНИЕМ 1 генной конструкции β-катенин/TCF-репортер. Кроме того, СОЕДИНЕНИЕ 1 селективно блокировало взаимодействие β-катенина и СВР без подавления взаимодействия β-катенина с близкородственным коактиватором р300. Кроме того, СОЕДИНЕНИЕ 1 вызывало перераспределение β-катенина из ядра в цитоплазму в клетках SW480. Наконец, опосредованное СОЕДИНЕНИЕМ 1 ингибирование экспрессии циклина D1 приводит к остановке в G1/S клеточного цикла, а пролонгированная обработка вызывает активацию каспазы в клетках SW480 (или НСТ116), но не в нормальных колоноцитах, приводя к апоптозу трансформированных клеточных линий карциномы ободочной кишки. Таким образом, СОЕДИНЕНИЕ 1 является ингибитором пути β-катенина, а СВР является его клеточной мишенью.
Для дополнительного исследования селективности СОЕДИНЕНИЯ 1 выполняли анализ микроматрицы кДНК с использованием Clontech Atlas Human Cancer 1.2 Array (#7851-1). Эти данные продемонстрировали, что СОЕДИНЕНИЕ 1 имело очень селективное действие на глобальную транскрипцию генов (Таблицы 2-5). После 8 часов обработки клеток SW480 25 мкМ СОЕДИНЕНИЕМ 1, ~2% анализированных генов положительно регулировались более чем в 2 раза, тогда как ~0,3% этих генов отрицательно регулировались на более чем 50% (таблицы 2-3).
Промотор-зависимая селективность коактиватора способствует сложности пути β-катенин/TCF. Как и ожидалось, СОЕДИНЕНИЕ 1 ингибирует экспрессию генов cyclin D1, hnkd и axin 2 (Yan et al., “Elevated expression of axin2 and hnkd mRNA provides evidence that Wnt/beta-catenin signaling is activated in human colon tumors,” Proc. Natl. Acad. Sci. USA 98:14973-78 (2001)). Напротив, экспрессия c-myc (He et al., “Identification of c-MYC as а target of the APC pathway,” Science 281:1509-12 (1998)) и с-jun (Mann et al., “Target genes of beta-catenin-T-cell-factor/lymphoid-enhancer-factor signaling in human colorectal carcinomas,” Proc. Natl. Acad. Sci. USA 96:1603-08 (1999)) увеличивается вследствие дифференциального использования коактиваторов в пути β-катенин/TCF (таблица 1 и фигура 7В). С использованием анализов ChIP было продемонстрировано, что СОЕДИНЕНИЕ 1 селективно ингибирует ассоциацию СВР с эндогенными промоторами c-myc и cyclin D1 и что в обработанных клетках увеличивается занятие р300 промотора с-myc, но не промотора cyclin D1. Это очень хорошо коррелирует с данными, полученными в экспериментах со-IP с β-катенином, и данными ОТ-ПЦР реального времени для cyclin D1. СОЕДИНЕНИЕ 1, которое является селективным в отношении ингибирования взаимодействия β-катенин/СВР, и родственные аналоги, которые являются селективными в отношении β-катенина/р300 (Kahn et al., неопубликованные данные), обеспечивают новые химиогеномные инструменты для раскрытия механизмов, при помощи которых комплекс β-катенин/TCF активирует транскрипцию генов промотор-зависимым и коактиватор-специфическим образом (фигура 7В).
В литературе имеются значительные разногласия, касающиеся специфических контактных сайтов взаимодействия между β-катенином и коактиваторными белками СВР и р300. Это предположительно связано со случайной и обычно низкой-умеренной аффинностью связывания как СВР, так и р300 с β-катенином относительно многих белков-мишеней. Авторы изобретения ожидали, что они могли бы использовать специфичность связывания СОЕДИНЕНИЯ 1 в отношении СВР для прояснения этой ситуации. Исследования связывания СОЕДИНЕНИЯ 1 с фрагментами СВР привели к раскрытию минимального района взаимодействия на NH2-конце СВР (аминокислоты 1-111). Кроме того, СОЕДИНЕНИЕ 1 не связывается с гомологичной последовательностью в р300. СОЕДИНЕНИЕ 1 селективно блокировало взаимодействие между СВР (1-111) и β-катенином в клетках без подавления взаимодействия р300 (1-111)/β-катенин. Сопоставление последовательностей этого района показывает поразительные сходства с ранее опубликованными мотивами связывания β-катенина, обнаруженными в TCF, АРС и Е-кадгерине (фигура 5А) Huber et al., “The structure of the beta-catenin/E-cadherin complex and the molecular basis of diverse ligand recognition by beta-catenin,” Cell 105:391-402 (2001)). Как СВР (1-111), так и р300 (1-111) содержат ключевые отрицательно заряженные кнопки (DELIXXXXE) для взаимодействий с β-катенином (Graham et al., “Tcf4 can specifically recognize beta-catenin using alternative conformations,” Nat. Struct. Biol. 8:1048-52 (2001)). Мотив SXSSXS, где Х обозначает аминокислоту с неполярной алифатической группой R, обнаруженный в АРС и Е-кадгерине, также присутствует в СВР, SASSP (аминокислоты 89-93), но отсутствует в р300. Хотя дифференциальное связывание СОЕДИНЕНИЯ 1 с СВР (1-111) в сравнении с р300 (1-111) в клетках SW480 могло бы, в принципе, быть обусловлено дифференциальным фосфорилированием, применение известных ингибиторов GSK-3β (Nikoulina et al., “Inhibition of glycogen synthase kinase 3 improves insulin action and glucose metabolism in human skeletal muscle,” Diabetes 51:2190-98 (2002)) или PKC (Bollag et al., “Effects of the selective protein kinase C inhibitor, Ro 31-7549, on the proliferation of cultured mouse epidermal keratinocytes,” J. Invest. Dermatol. 100:240-46 (1993)) не оказывали видимого действия на связывание СОЕДИНЕНИЯ 1 (данные не показаны). Кроме того, очищенный рекомбинантный СВР (1-111), экспрессированный в E. coli, был способен связываться с СОЕДИНЕНИЕМ 1, что дополнительно свидетельствует против зависимого от коактиватора фосфорилирования как дискриминирующего фактора. Таким образом, с использованием СОЕДИНЕНИЯ 1 в качестве инструмента авторы специфически картировали минимальный район взаимодействия СВР с β-катенином в первых 111 аминокислотах СВР.
Дополнительная поддержка исследований авторов по картированию исходит из существования сайта связывания на СВР для рецепторов ретиноевой кислоты (RA), RXR/RAR, в тесной близости к мотиву связывания β-катенина на СВР (фигура 3F). Ранее было показано, что обработка RA ингибирует передачу сигнала β-катенин/TCF (Earswaran et al., “Cross-regulation of beta-catenin-LEF/TCF and retinoid signaling pathways,” Curr. Biol. 9:1415-18 (1999)). Консенсусный (LXXLL) (SEQ ID NO:46) сайт связывания RXR/RAR (LSELL) расположен в аминокислотных остатках 70-74 в предполагаемом авторами сайте связывания β-катенина как на СВР, так и на р300 (Minucci et al., “Retinoid receptors in health and disease: co-regulators and the chromatin connection,” Semin. Cell Dev. Biol. 10:215-25 (1999)).
СОЕДИНЕНИЕ 1 позволяет авторам решить также проблему промотор-зависимой коактиватор-селективности пути передачи сигнала β-катенина. Обработка СОЕДИНЕНИЕМ 1 не ингибирует взаимодействие р300 с β-катенином (фигура 3D), и фактически она действительно увеличивает образование комплексов β-катенин/р300 в обработанных клетках (фигура 3В). Как показано в сопоставлении последовательностей, хотя и имеется сходство в картированных мотивах связывания β-катенина, имеются различия между этими двумя коактиваторами, которые могут быть ответственными за наблюдаемую специфичность СОЕДИНЕНИЯ 1 в отношении СВР, но не в отношении р300. На основании этих исследований кажется, что взаимодействие между N-концевыми 111 аминокислотами СВР/р300 и β-катенином является необходимым для активации транскрипции β-катенин/TCF.
Несмотря на большую заинтересованность в обнаружении селективных имеющих малую молекулу ингибиторов транскрипции β-катенин/TCF, насколько известно авторам изобретения, СОЕДИНЕНИЕ 1 представляет первый пример прямого имеющего малую молекулу ингибитора этого пути. Несмотря на элегантные струтурные исследования по взаимодействию между β-катенином и TCF (Graham et al., “Crystal structure of beta-catenin/TCF complex,” Cell 103:885-96 (2000); Graham et al., “TCF4 can specifically recognize beta-catenin using alternative conformations,” Nat. Struct. Biol. 8:1048-52 (2001); Poy et al., “Structure of human Tcf4-beta-catenin complex,” Nat. Struct. Biol. 8:1053-57 (2001)), a priori привлекательный способ для ингибирования этого пути, возникают проблемы, касающиеся развития специфических ингибиторов, вследствие отличающихся партнеров, наряду с TCF (например, АРС и Е-кадгерина), которые также связываются с центральными повторами Arm (armadillo repeats) β-катенина (Huber et al., “The structure of beta-catenin/E-cadherin complex and the molecular basis of diverse ligand recognition by beta-catenin,” Cell 105:391-402 (2001)). Эта элегантная селективность СОЕДИНЕНИЯ 1, посредством его специфического ингибирования взаимодействия β-катенин/СВР, в противоположность высокогомологичному коактиватору р300 (который имеет до 96% идентичность на уровне аминокислот с СВР) обеспечила уникальный инструмент химиогеномики для исследования β-катенин/TCF-опосредованной транскрипции. Специфичность СОЕДИНЕНИЯ 1, его способность селективно активировать каспазы апоптоза в трансформированных, но не в нормальных колоноцитах, и его эффективность в анализе образования колоний в мягком агаре, - все являются обнадеживающими признаками в отношении его потенциальной терапевтической применимости в случае рака ободочной кишки. Кроме того, аналоги СОЕДИНЕНИЯ 1 обнаружили эффективность in vivo, с ограниченной токсичностью, в мышиных моделях рака (модели голых мышей, инъецированных клетками SW480 и модели мыши Min; Moser et al., “ApcMin: a mouse model for intestinal and mammary tumorigenesis,” Eur. J. Cancer A:1061-64 (1995); Kahn et al., неопубликованные данные), дополнительно валидизируя применение селективных ингибиторов транскрипции β-катенин/TCF/СВР для потенциального применения в химиотерапии рака, а также других гиперпролиферативных нарушений.
Все вышеописанные Патенты США, публикации заявок на патент США, заявки на патент США, зарубежные патенты, зарубежные заявки на патент и непатентные публикации, на которые делаются ссылки в этом описании.
Из предыдущего описания будет понятно, что, хотя конкретные варианты осуществления данного изобретения были описаны здесь для целей иллюстрации, различные модификации могут быть выполнены без отклонения от идеи и объема данного изобретения. Таким образом, данное изобретение не ограничивается ничем, за исключением прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИМЕТИКИ С ОБРАТНОЙ КОНФИГУРАЦИЕЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2342387C2 |
| КОМБИНАЦИЯ АНТАГОНИСТА PD-1, ИНГИБИТОРА ТИРОЗИНКИНАЗЫ VEGFR/FGFR/RET И ИНГИБИТОРА CBP/БЕТА-КАТЕНИНА ДЛЯ ЛЕЧЕНИЯ РАКА | 2020 |
|
RU2838452C1 |
| АГЕНТЫ, СВЯЗЫВАЮЩИЕ РЕЦЕПТОР "FRIZZLED", И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2579897C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С БЕЛКАМИ LRP5, И СПОСОБЫ ПРИМЕНЕНИЯ | 2020 |
|
RU2832155C2 |
| АНТАГОНИСТЫ WNT И СПОСОБЫ ЛЕЧЕНИЯ И ТЕСТИРОВАНИЯ | 2011 |
|
RU2593947C2 |
| ОТБОР БОЛЬНЫХ РАКОМ ДЛЯ ВВЕДЕНИЯ ИНГИБИТОРОВ СИГНАЛЬНОГО ПУТИ Wnt НА ОСНОВАНИИ СТАТУСА МУТАЦИИ RNF43 | 2013 |
|
RU2636000C2 |
| ПЕПТИДЫ В КОМБИНАЦИИ С ИНГИБИТОРАМИ ИММУННЫХ КОНТРОЛЬНЫХ ТОЧЕК ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ РАКА | 2020 |
|
RU2826955C2 |
| СПОСОБ ИНДУКЦИИ ДИФФЕРЕНЦИАЦИИ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК В КАРДИОМИОЦИТЫ | 2007 |
|
RU2433174C2 |
| ДОСТАВКА ГЕНОВ, ОПОСРЕДОВАННАЯ НАНОЧАСТИЦАМИ, ГЕНОМНАЯ КОРРЕКЦИЯ И ЛИГАНД-НАПРАВЛЕННАЯ МОДИФИКАЦИЯ В РАЗЛИЧНЫХ КЛЕТОЧНЫХ ПОПУЛЯЦИЯХ | 2014 |
|
RU2670512C2 |
| МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ FZD10, ЕГО ИСПОЛЬЗОВАНИЕ | 2017 |
|
RU2765431C2 |
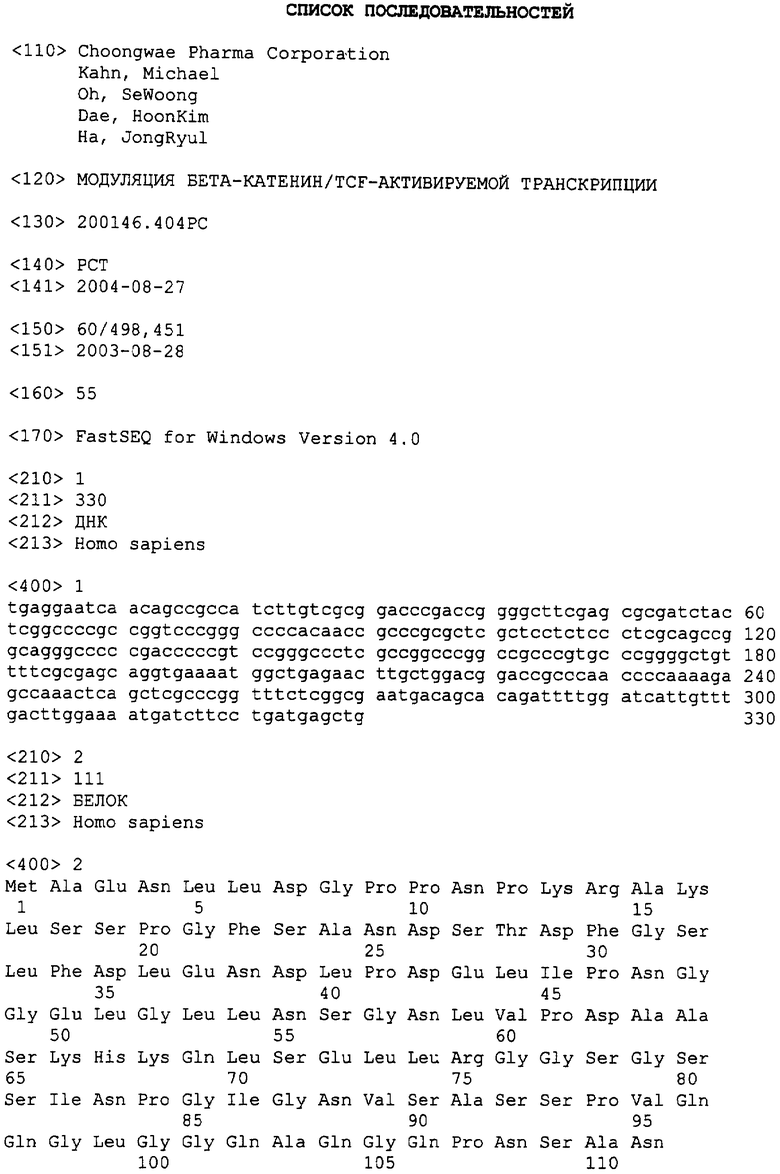











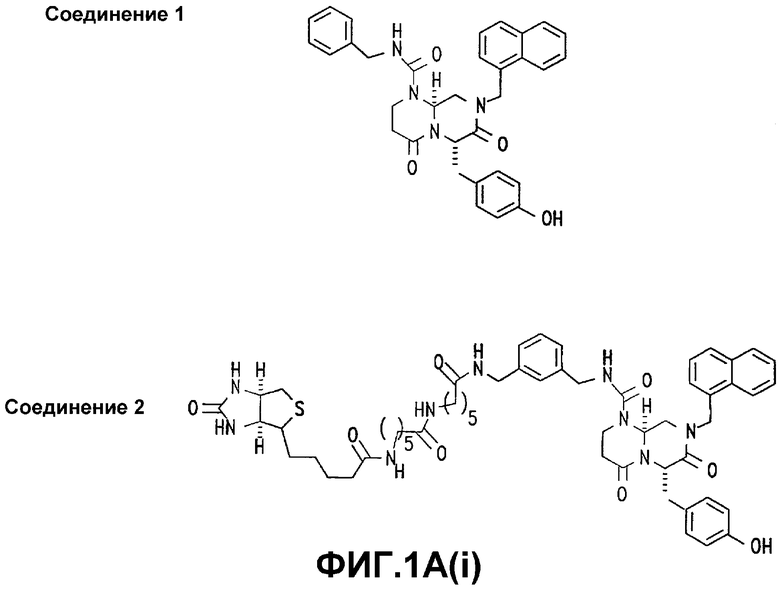
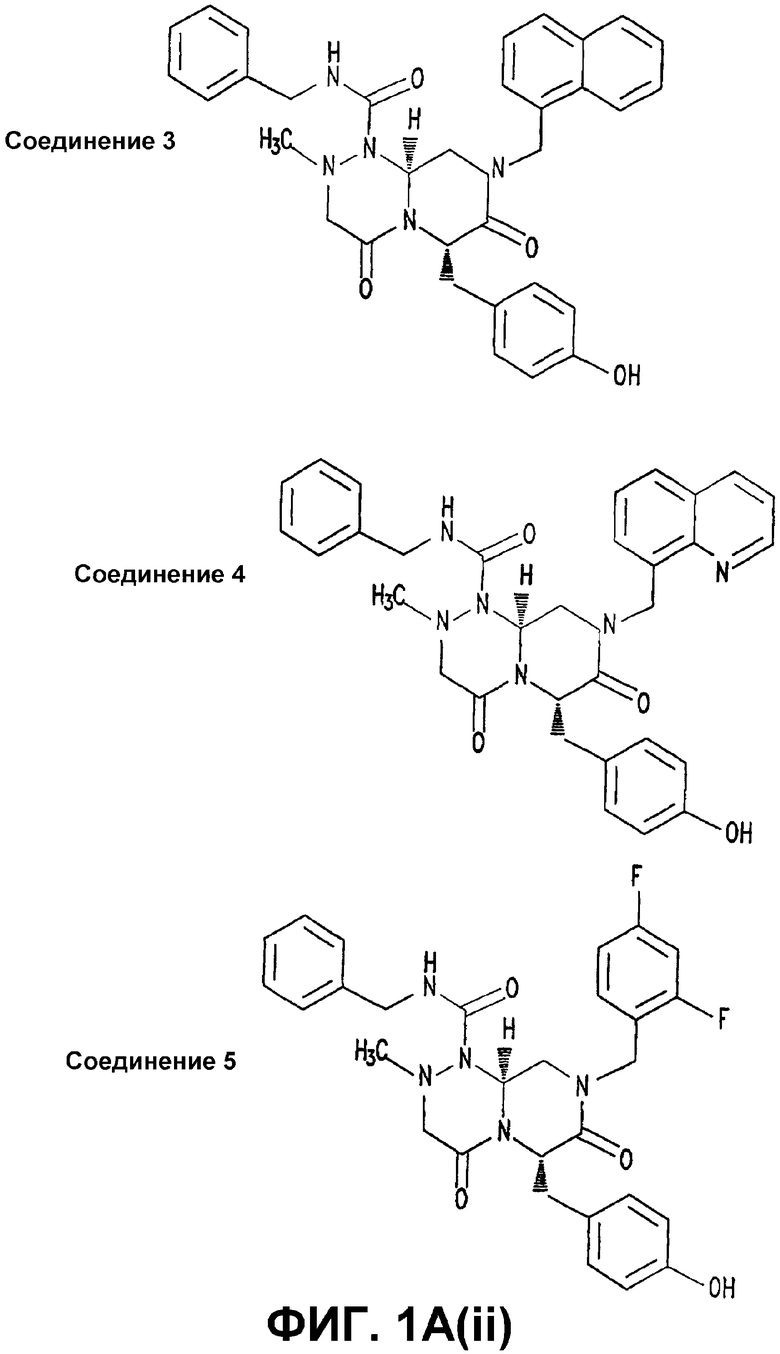
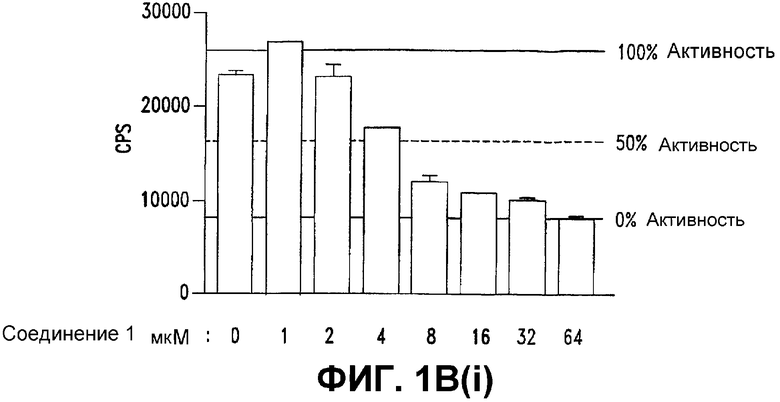
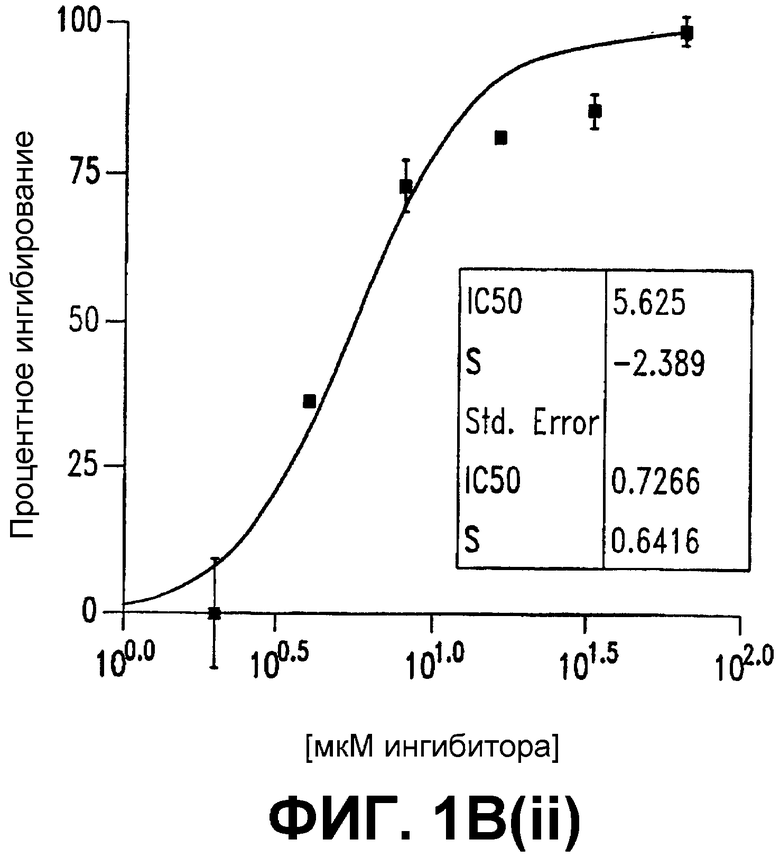
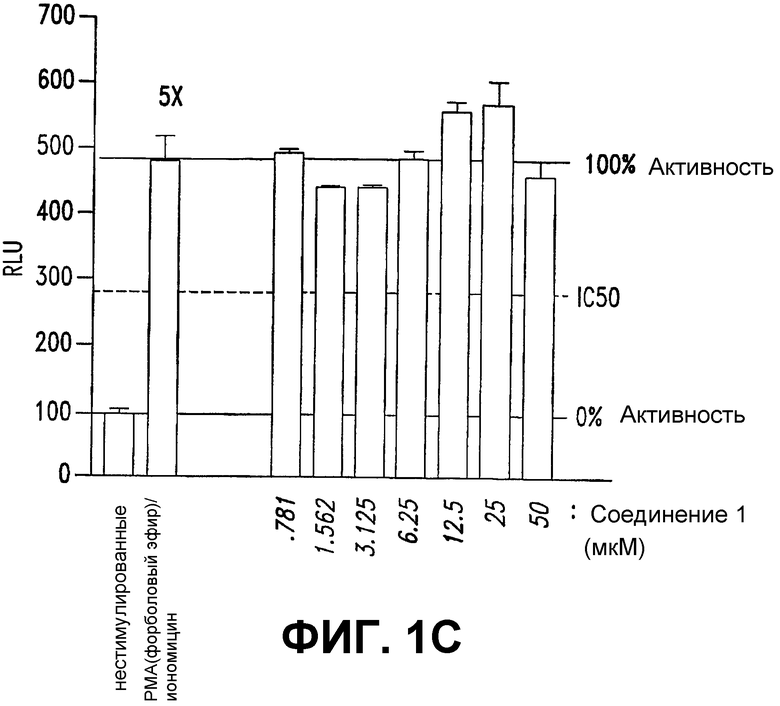
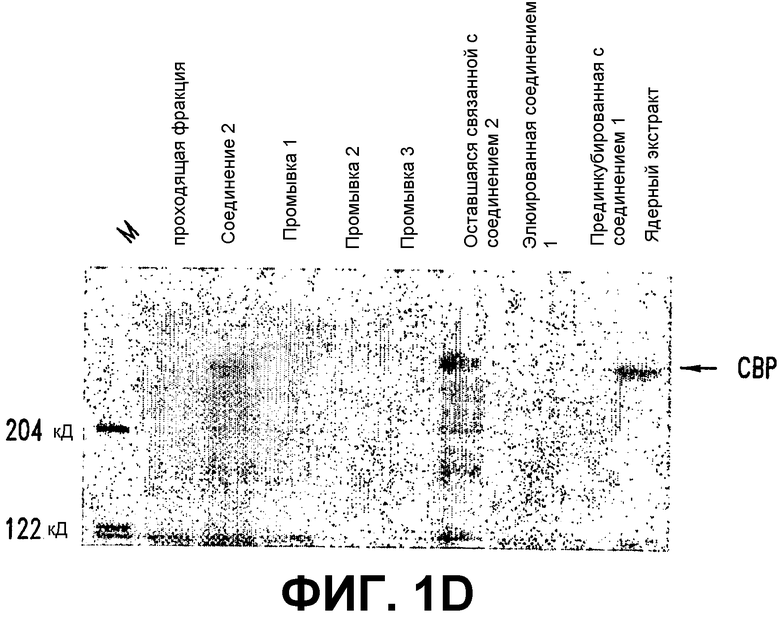
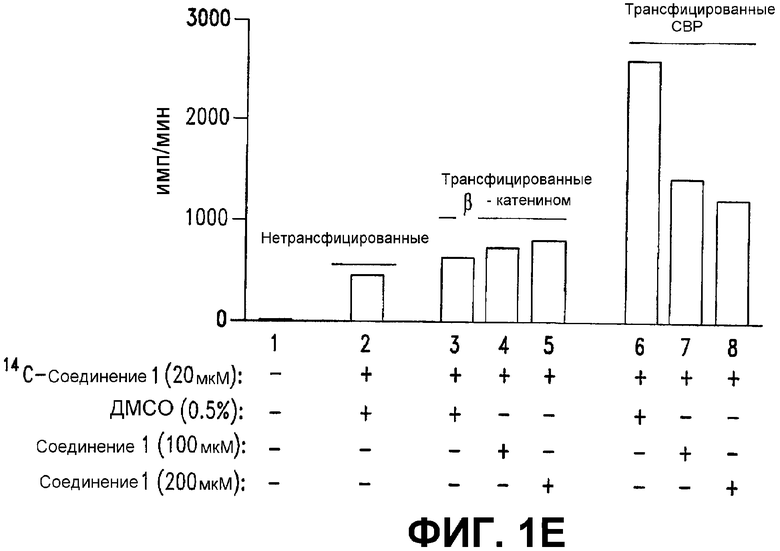
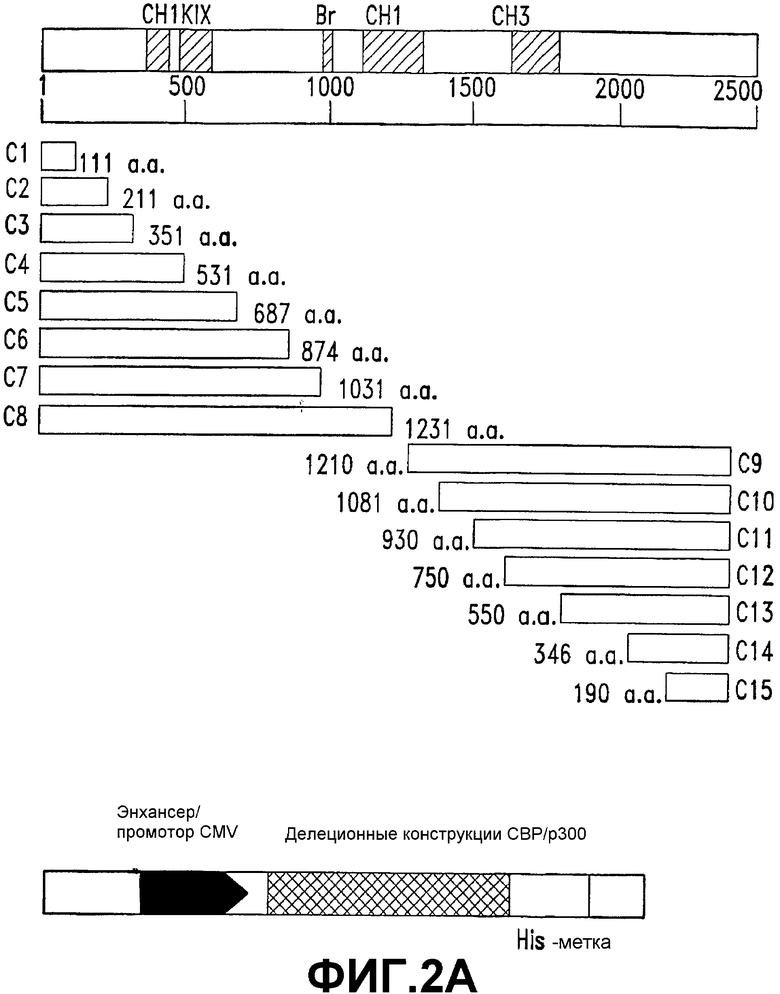
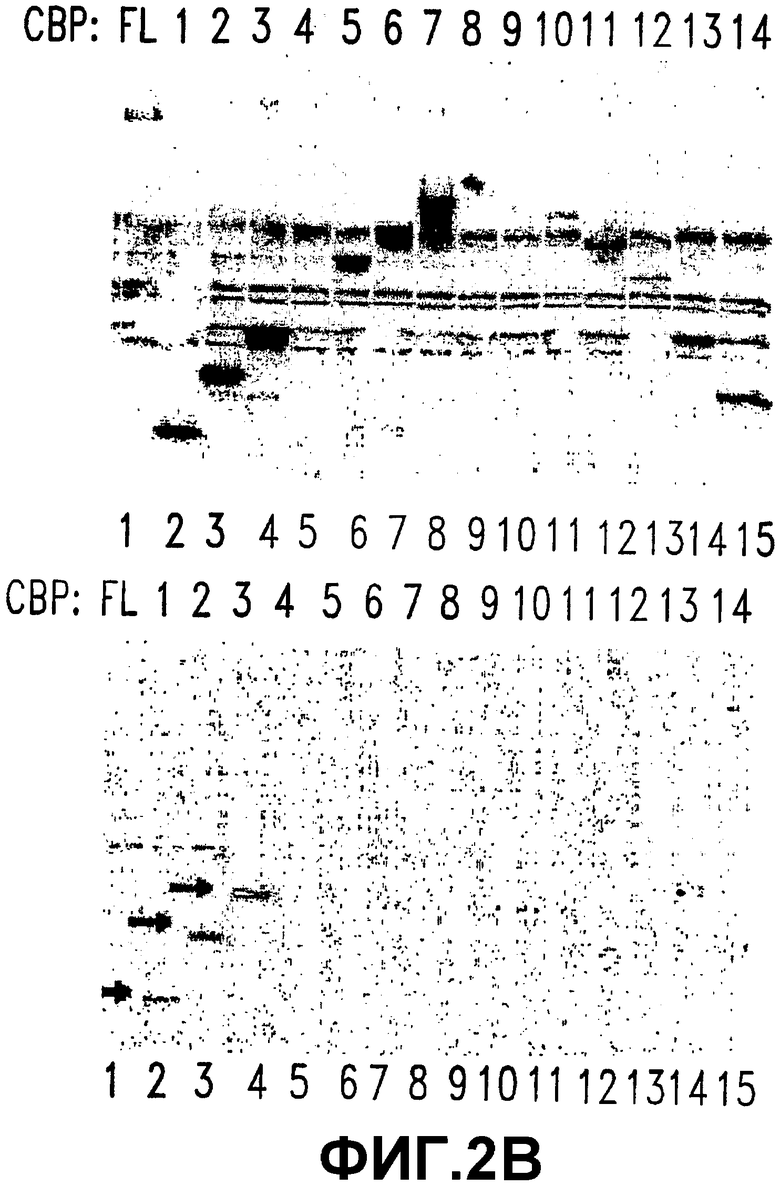
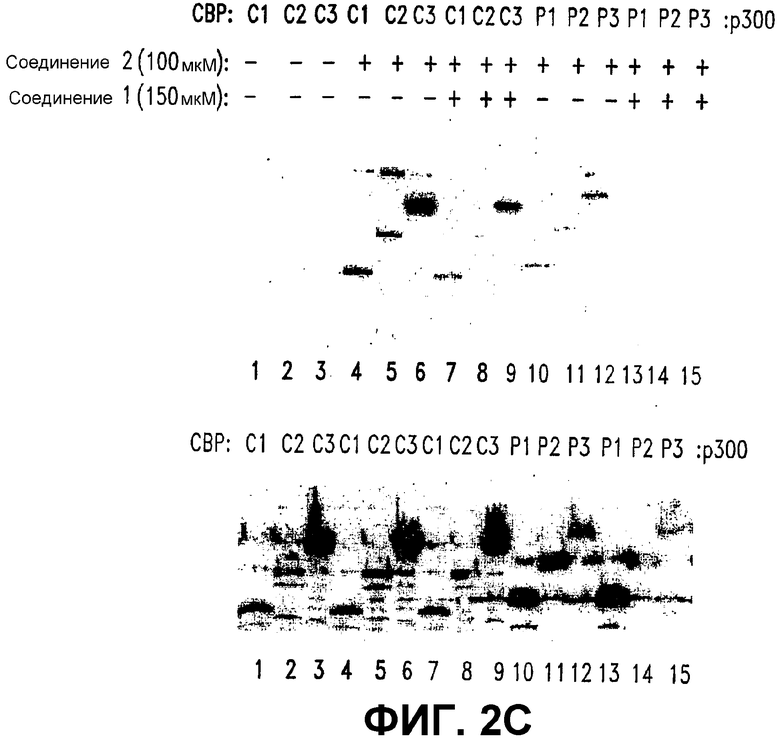
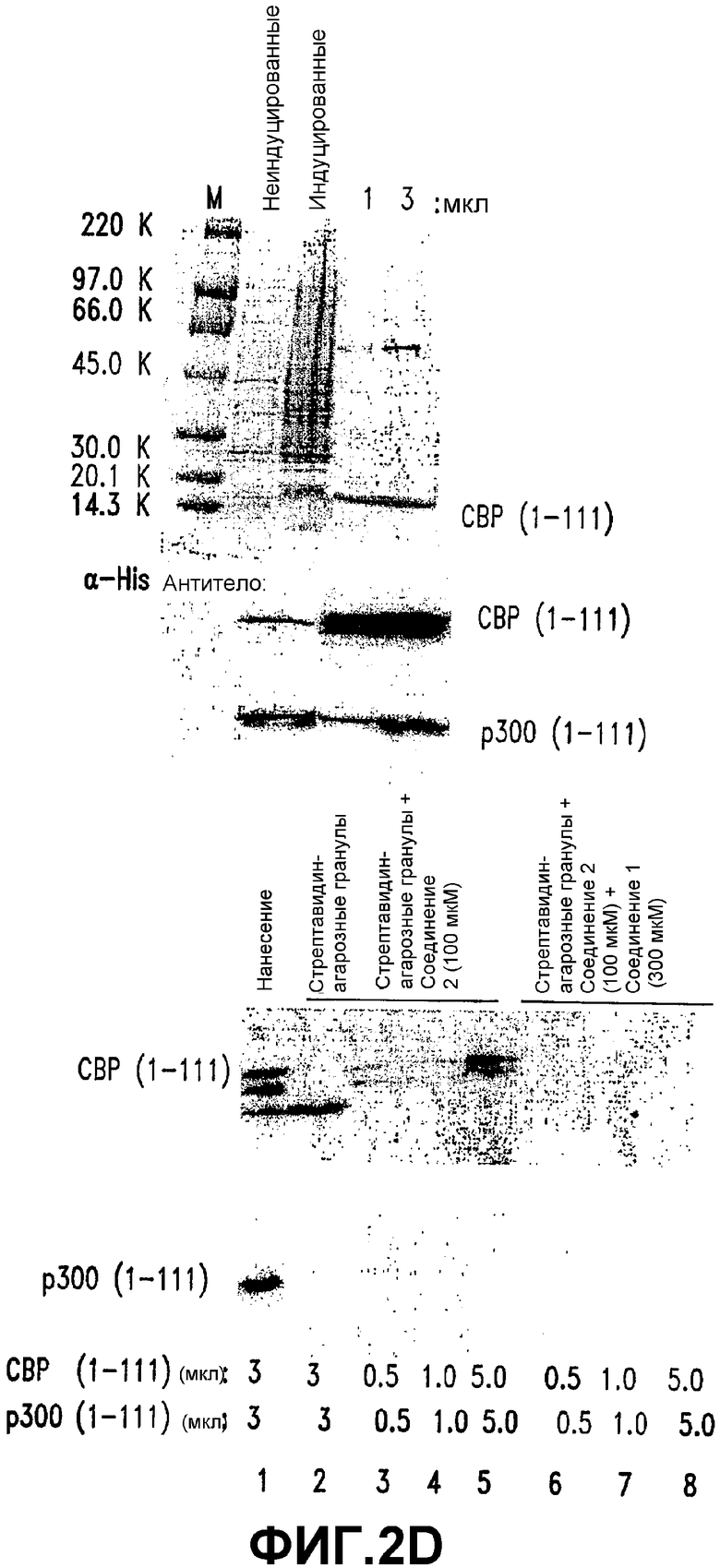
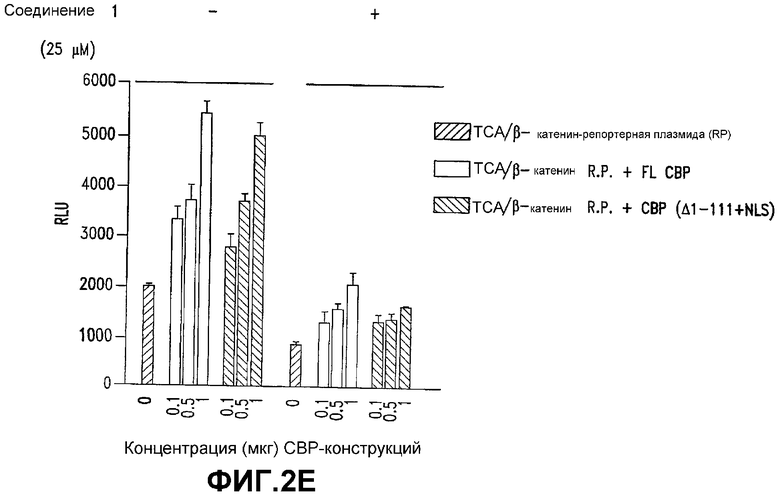
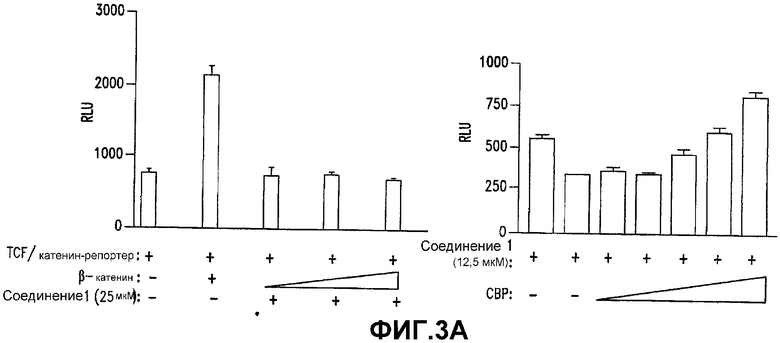
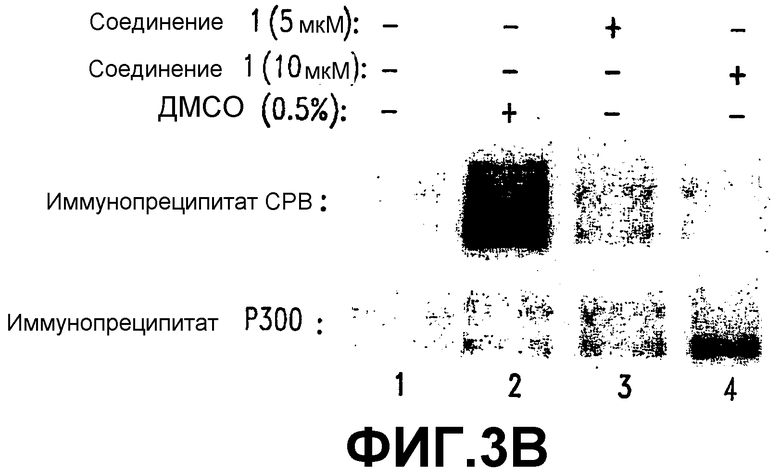
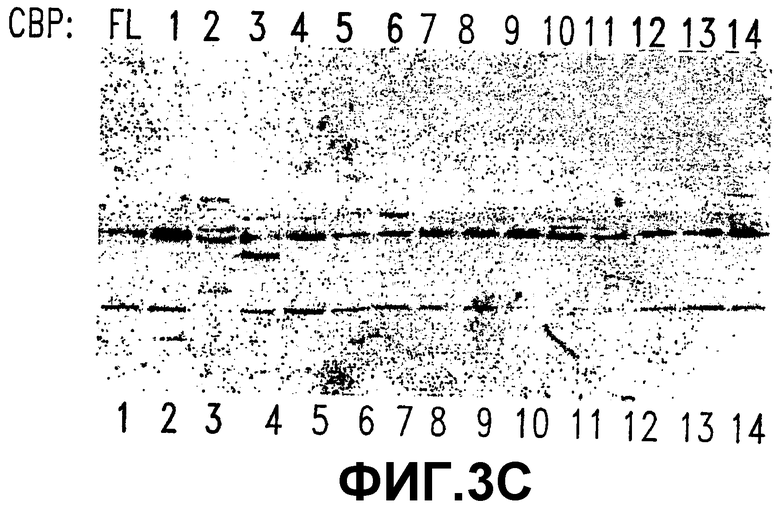
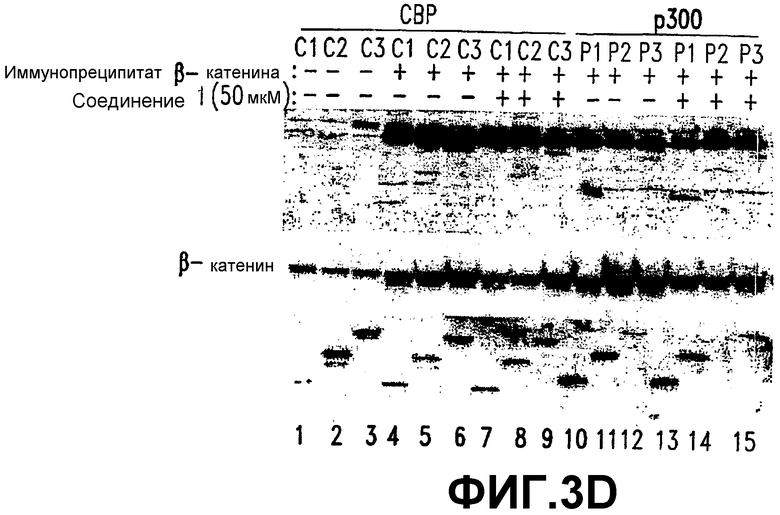
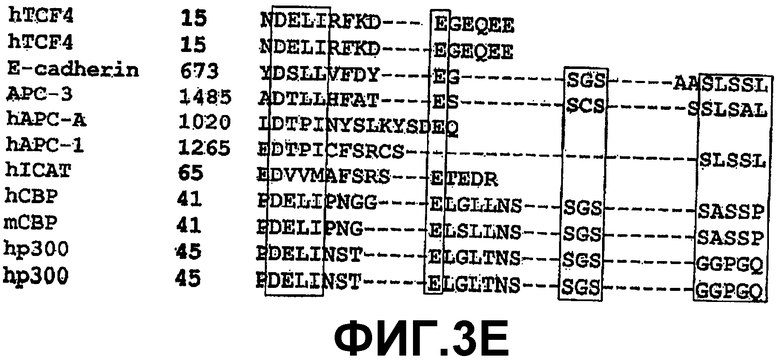
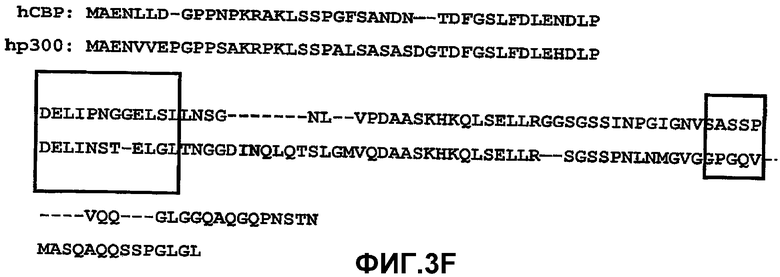
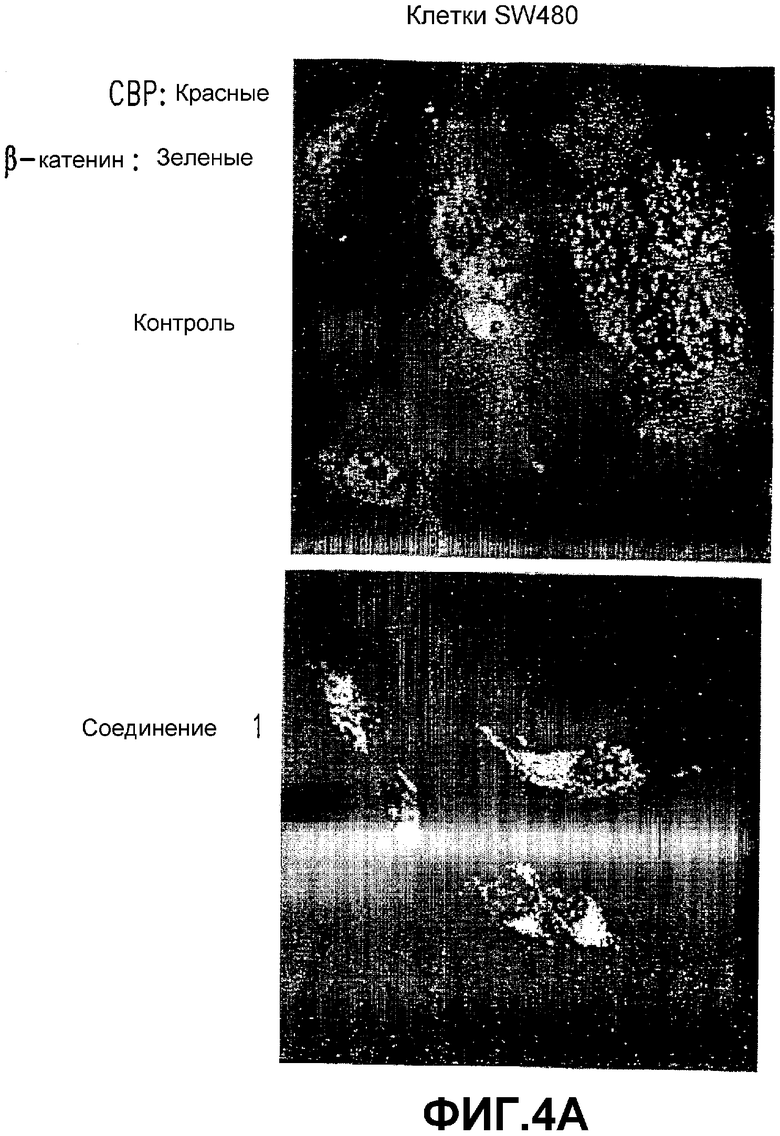
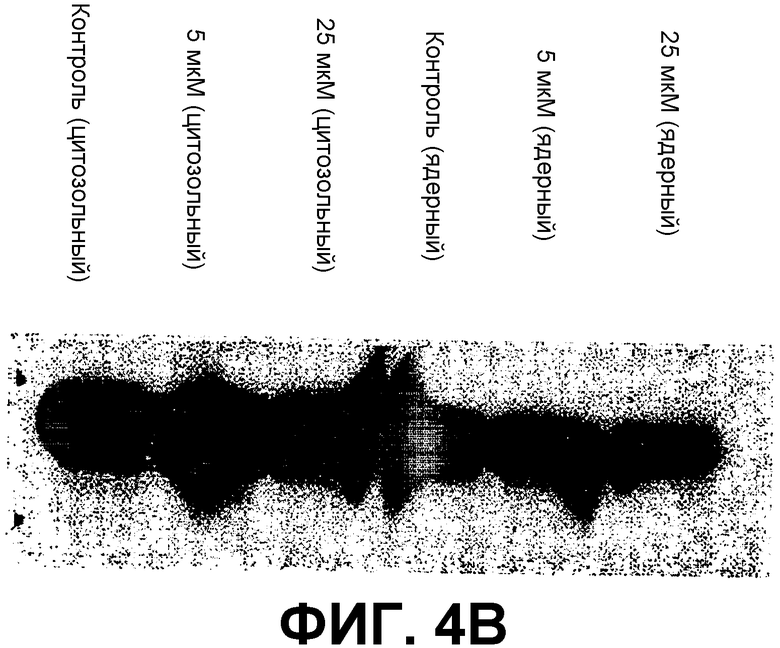
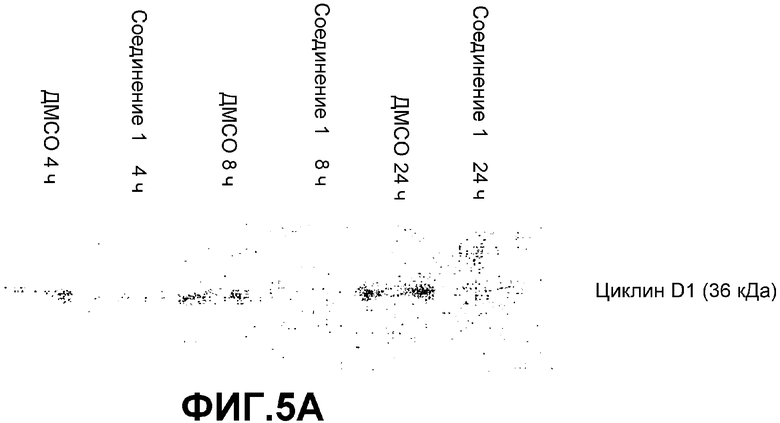
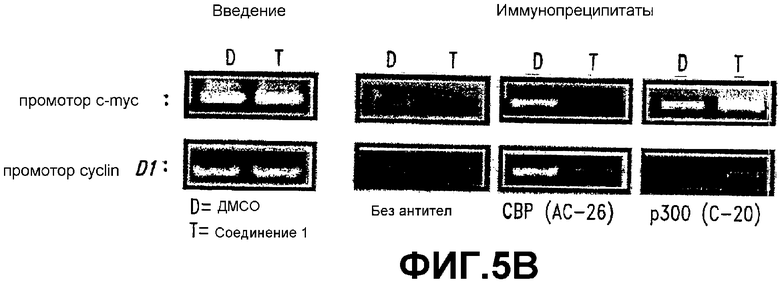
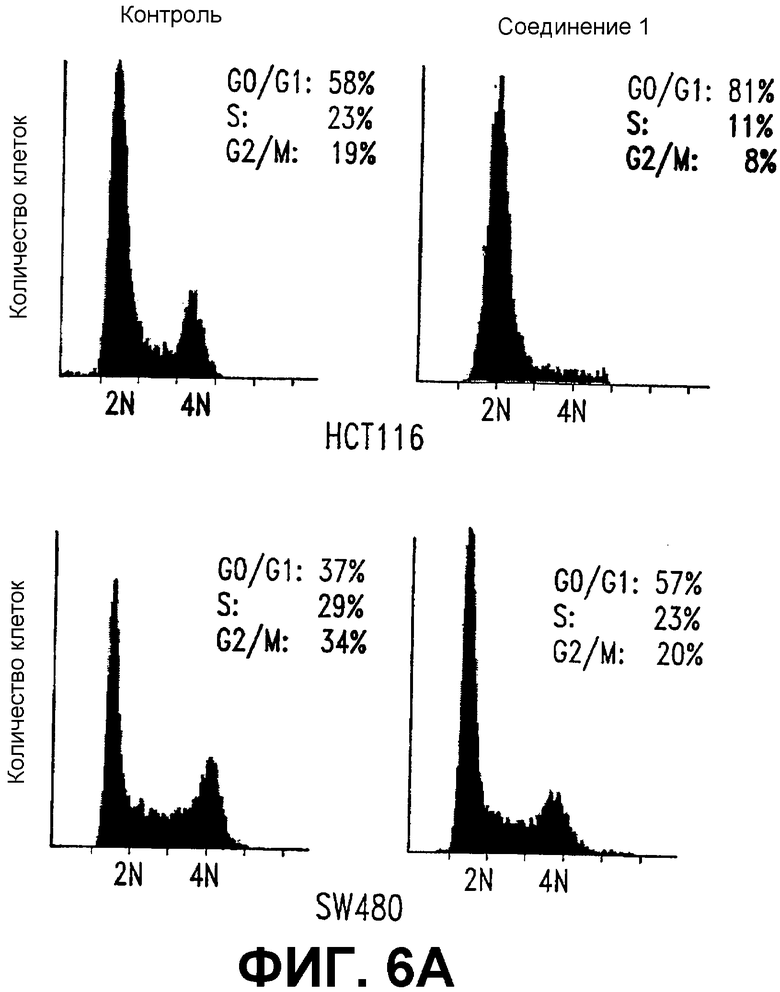
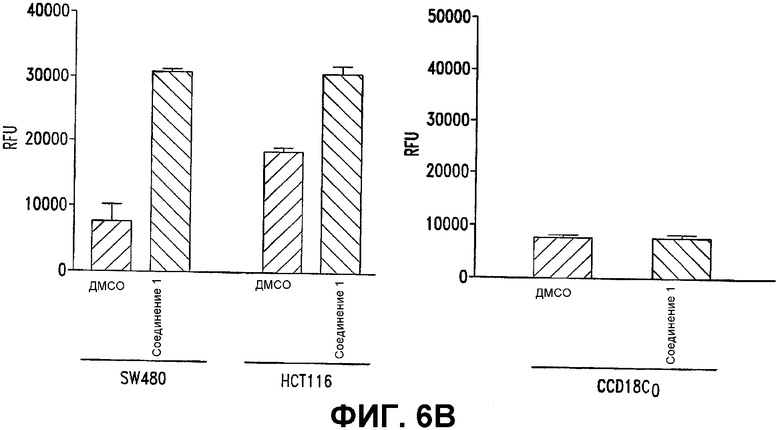
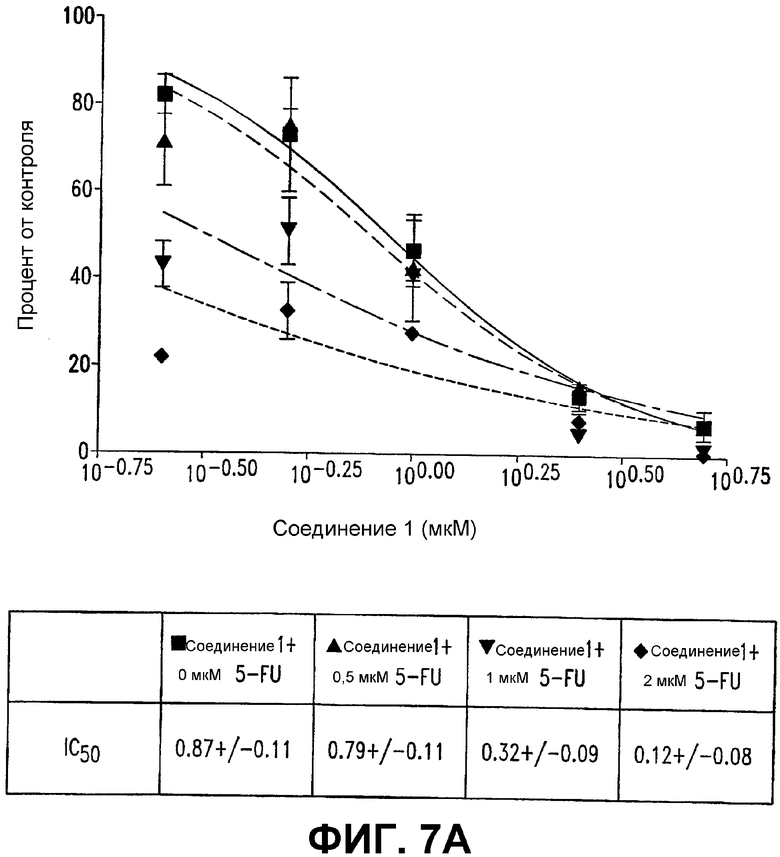
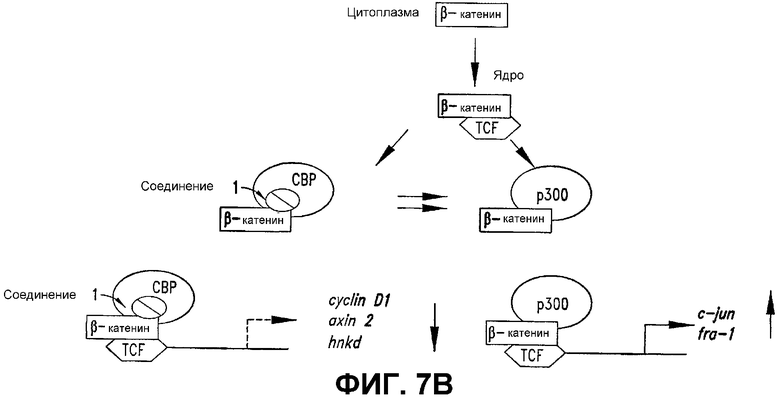
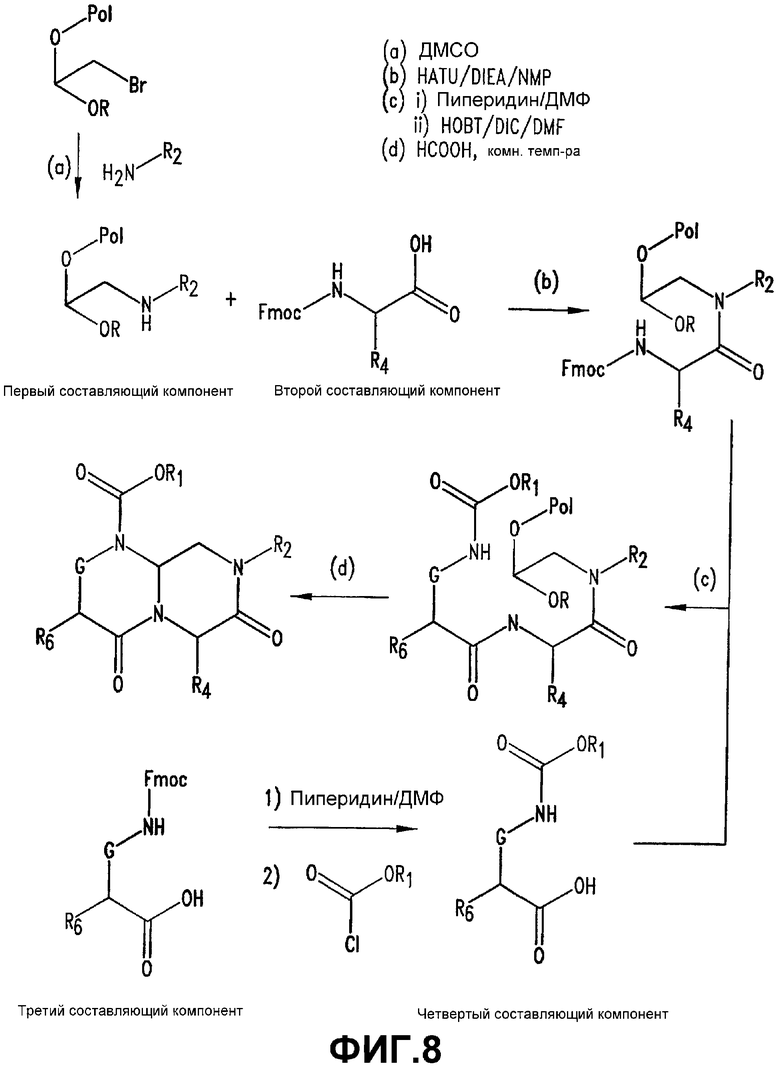
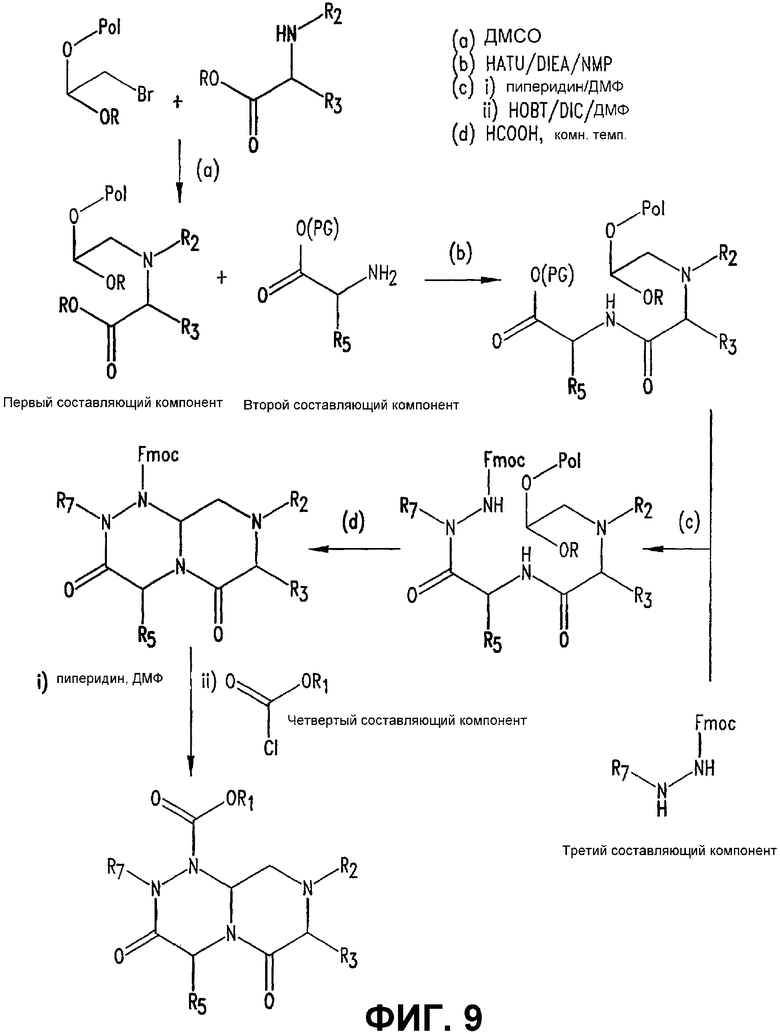
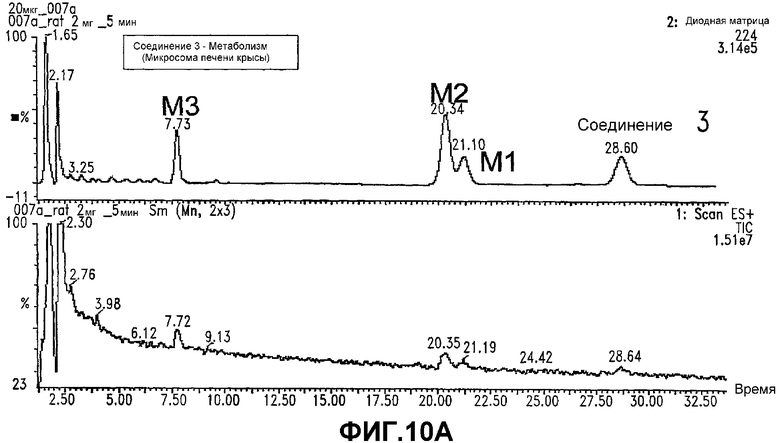
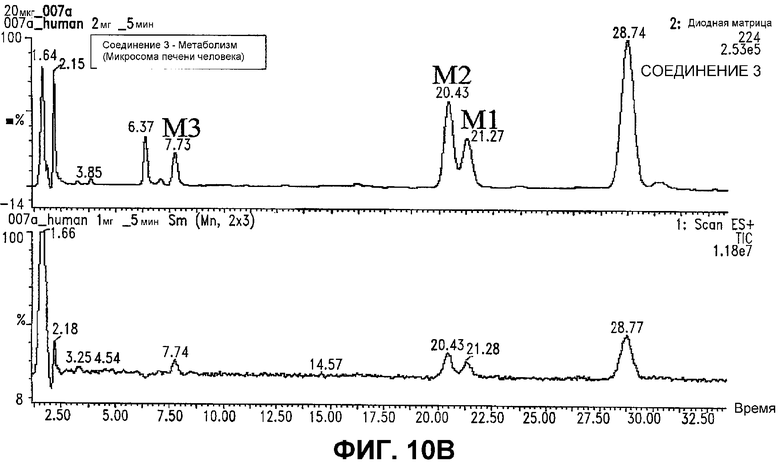
Изобретение относится к способу модуляции экспрессии гена-мишени, индуцируемой β-катенином, с использованием агента, который увеличивает связывание р300 с β-катенином и уменьшает связывание СВР с β-катенином, включающему приведение композиции, содержащей β-катенин, СВР и р300, где β-катенин имеет вероятность связывания с СВР в сравнении с р300, в контакт с агентом в количестве, эффективном для изменения вероятности связывания β-катенина с СВР в сравнении с р300, причем указанный агент является соединением, имеющим структуру, выбранную из формулы (I), или его стереоизомерами:
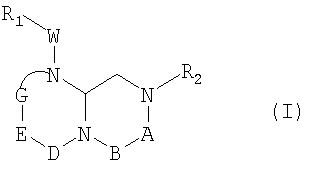
где А обозначает -(С=O)-, В обозначает -(CHR4)-, D обозначает -(С=O)-, Е обозначает -(ZR6)-, G обозначает -(XR7)n-, W обозначает -(C=O)NH-, X обозначает азот или СН, Z обозначает СН, n=0 или 1. Значения заместителей R1 и R2 указаны в формуле изобретения. Также изобретение относится к композиции для модуляции экспрессии гена-мишени, индуцируемой β-катенином. 2 н. и 7 з.п. ф-лы, 8 табл., 30 ил.
1. Способ модуляции экспрессии гена-мишени, индуцируемой β-катенином, с использованием агента, который увеличивает связывание р300 с β-катенином и уменьшает связывание СВР с β-катенином, включающий
приведение композиции, содержащей β-катенин, СВР и р300, где β-катенин имеет вероятность связывания с СВР в сравнении с р300, в контакт с агентом в количестве, эффективном для изменения вероятности связывания β-катенина с СВР в сравнении с р300,
причем указанный агент является соединением, имеющим структуру, выбранную из формулы (I), или его стереоизомерами:
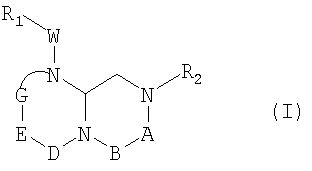
где А обозначает -(С=O)-, В обозначает -(CHR4)-, D обозначает -(С=O)-, Е обозначает -(ZR6)-, G обозначает -(XR7)n-, W обозначает -(C=O)NH-, X обозначает азот или СН, Z обозначает СН, n=0 или 1; R1 обозначает необязательно замещенный С6-12арилалкил или необязательно замещенный С6-12гетероарилалкил, содержащий один или два атома азота или кислорода; R2 обозначает необязательно замещенный С6-14арилалкил или необязательно замещенный С6-14гетероарилалкил, содержащий один или два атома азота или кислорода или серы; R4 обозначает бензил или бензил, замещенный гидроксилом, R6 обозначает водород, R7 обозначает водород или насыщенный или ненасыщенный С1-4алкил.
2. Способ по п.1, где композиция находится ex vivo.
3. Способ по п.1, где композицией является клетка млекопитающего.
4. Способ по п.3, где млекопитающее страдает от рака и количество является эффективным для лечения рака.
5. Способ по п.4, где раком является рак ободочной кишки.
6. Способ по п.1, где агентом является соединение 1, имеющее формулу
 .
.
7. Композиция для модуляции экспрессии гена-мишени, индуцируемой β-катенином, содержащая
агент, который увеличивает связывание р300 с β-катенином и уменьшает связывание СВР с β-катенином,
β-катенин, СВР и р300,
где β-катенин имеет вероятность связывания с СВР в сравнении с р300, и агент присутствует в композиции в количестве, эффективном для изменения вероятности связывания β-катенина с СВР в сравнении с р300,
причем указанный агент является соединением, имеющим структуру, выбранную из формулы (I), или его стереоизомерами:

где А обозначает -(С=O)-, В обозначает -(CHR4)-, D обозначает -(С=O)-, Е обозначает -(ZR6)-, G обозначает -(XR7)n-, W обозначает -(C=O)NH-, X обозначает азот или СН, Z обозначает СН, n=0 или 1; R1 обозначает необязательно замещенный С6-12арилалкил или необязательно замещенный С6-12гетероарилалкил, содержащий один или два атома азота или кислорода; R2 обозначает необязательно замещенный
С6-14арилалкил или необязательно замещенный С6-14гетероарилалкил, содержащий один или два атома азота или кислорода или серы; R4 обозначает бензил или бензил, замещенный гидроксилом, R6 обозначает водород, R7 обозначает водород или насыщенный или ненасыщенный С1-4алкил.
8. Композиция по п.7 в состоянии ex vivo.
9. Композиция по п.7, где агентом является соединение 1, имеющее формулу

| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| С.М.Hedgepeth et al., Activation of the Wnt Signaling Pathway: A Molecular Mechanism for Lithium Action | |||
| Developmental Biology, 1997, том 185, №1, стр.82-91 | |||
| F.J.T.Staal et al., Wnt signals are transmitted through N-terminally dephosphorylated β-catenin | |||
| EMBO Reports, 2002, том 3, №1, стр.63-68. | |||
Авторы
Даты
2010-03-10—Публикация
2004-08-27—Подача