ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к некоторым антраниламидам, их N-оксидам, солям и композициям, пригодным для сельскохозяйственных и несельскохозяйственных применений, включая перечисленные ниже применения, и к способу их применения для борьбы с беспозвоночными вредителями в сельскохозяйственной и несельскохозяйственной окружающей среде.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Борьба с беспозвоночными вредителями чрезвычайно важна для достижения высокой урожайности. Повреждения, наносимые беспозвоночными вредителями произрастающим и хранящимся сельскохозяйственным культурам, могут вызывать значительное снижение производительности и приводить тем самым к увеличению затрат потребителем. Борьба с беспозвоночными вредителями также важна в лесном хозяйстве, тепличном хозяйстве, декоративном растениеводстве, плодовом хозяйстве, при хранении продуктов питания и волокон, в животноводстве, при выращивании домашних животных, в здравоохранении и ветеринарии.Для этих целей коммерчески доступно множество продуктов, но потребность в новых соединениях, которые являлись бы более эффективными, более дешевыми, менее токсичными, более экологически безопасными или обладали бы различными способами действия, по-прежнему сохраняется.
В WO 01/070671 раскрыты применяемые в качестве артроподицидов производные N-ацилантраниловой кислоты формулы i

в которой, inter alia, A и B независимо представляют собой O или S; J представляет необязательно замещенное фенильное кольцо, 5- или 6-членное гетероароматическое кольцо, нафтильная кольцевая система или ароматическая 8-, 9- или 10-членная конденсированная гетеробициклическая кольцевая система; R1 и R3 независимо представляют собой H или необязательно замещенный C1-C6-алкил; R2 представляет собой H или C1-C6-алкил; каждый R4 независимо представляет собой H, C1-C6-алкил, C1-C6-галогеналкил, галоген или CN и n равно 1-4.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям формулы 1, их N-оксидам или солям
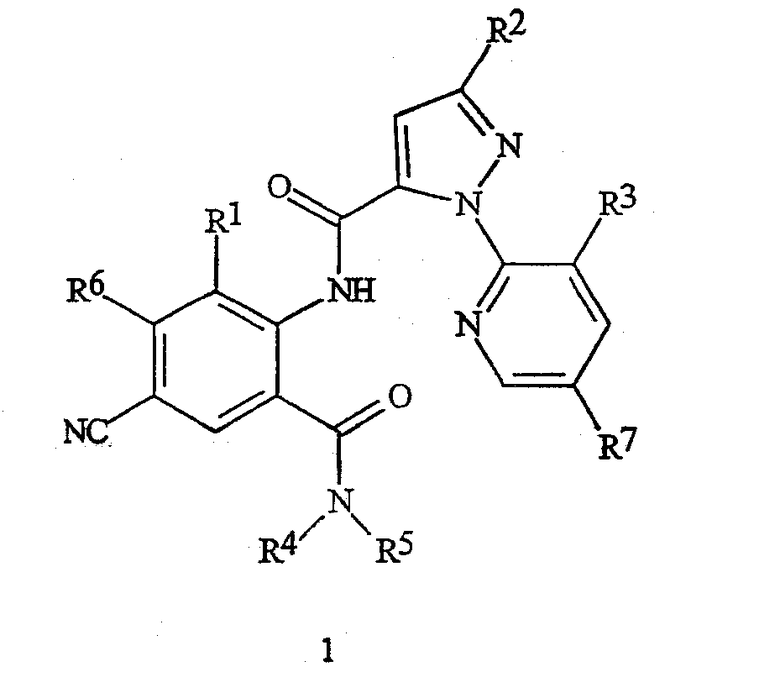
в которой
R1 представляет собой Me, Cl, Br или F;
R2 представляет собой F, Cl, Br, C1-C4-галогеналкил или C1-C4-галогеналкоксигруппу;
R3 представляет собой F, Cl или Br;
R4 представляет собой H, C1-C4-алкил, C3-C4-алкенил, C3-C4-алкинил, C3-C5-циклоалкил или C4-C6-циклоалкилалкил, каждый необязательно замещенный одним заместителем, выбираемым из группы, состоящей из галогена, CN, SMe, S(O)Me, S(O)2Me и OMe;
R5 представляет собой H или Me;
R6 представляет собой H, F или Cl;
R7 представляет собой H, F или Cl.
Настоящее изобретение также относится к композиции для борьбы с беспозвоночным вредителем, содержащей биологически эффективное количество соединения формулы 1 и, по крайней мере, один дополнительный компонент, выбираемый из группы, состоящей из поверхностно-активного вещества, твердого разбавителя и жидкого разбавителя, и необязательно эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или средства.
Настоящее изобретение также относится к способу борьбы с беспозвоночным вредителем, который включает контактирование беспозвоночного вредителя или его окружения с биологически эффективным количеством соединения формулы 1 (например, в виде описанной в этом документе композиции). Настоящее изобретение также относится к способу борьбы с беспозвоночным вредителем, который включает контактирование беспозвоночного вредителя или его окружения с биологически эффективным количеством композиции, содержащей биологически эффективное количество соединения формулы 1 и, по крайней мере, один дополнительный компонент, выбираемый из группы, состоящей из поверхностно-активного вещества, твердого разбавителя и жидкого разбавителя, причем упомянутая композиция дополнительно содержит эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или средства.
Настоящее изобретение также относится к распыляемой композиции, содержащей соединение формулы 1 и пропеллент, и к композиции для приманки, содержащей соединение формулы 1, одно или несколько питательных веществ, необязательный аттрактант и необязательное смачивающее средство. Настоящее изобретение также относится к устройству для борьбы с беспозвоночным вредителем, которое включает упомянутую композицию для приманки и приспособленную для заполнения ею оболочку, в котором оболочка имеет, по крайней мере, одно отверстие с достаточным для проникновения через него беспозвоночного вредителя размером, а беспозвоночный вредитель получает, таким образом, доступ извне к композиции для приманки и в котором оболочка дополнительно приспособлена для размещения внутри или около места потенциальной или известной активности беспозвоночного вредителя.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В приведенных выше перечислениях термин «алкил», используемый по отдельности или в составных терминах, таких как «алкилтио» или «галогеналкил», включает неразветвленный или разветвленный алкил, такой как метил, этил, н-пропил, изопропил или различные изомеры бутила. Термин «галоген», используемый по отдельности или в составных терминах, таких как «галогеналкоксигруппа», включает фтор, хлор, бром или йод. Кроме того, при использовании в составных терминах, таких как «галогеналкил» или «галогеналкоксигруппа», упомянутый алкил или алкоксигруппа могут быть частично или полностью замещены атомами галогена, которые могут быть одинаковыми или различными. Примеры «галогеналкила» включают F3C, ClCH2, CF3CH2 и CF3CCl2. Примеры «галогеналкоксигруппы» включают CF3O, HCF2O, CCl3CH2O, HCF2CH2CH2O и CF3CH2O.
Специалисту в данной области техники следует принимать во внимание, что не все азотсодержащие гетероциклы могут образовывать N-оксиды, так как для окисления до оксида требуется наличие свободной пары электронов у атома азота; специалист в данной области техники должен различать те азотсодержащие гетероциклы, которые могут образовывать N-оксиды. Специалист в данной области техники также должен осознавать, что третичные амины могут образовывать N-оксиды. Синтетические способы получения N-оксидов гетероциклов и третичных аминов очень хорошо известны специалисту в данной области техники, включая окисление гетероциклов и третичных аминов пероксикислотами, такими как перуксусная кислота и мета-хлорпербензойная кислота (MCPBA), перекисью водорода, алкилгидроперекисями, такими как гидроперекись трет-бутила, перборатом натрия и диоксиранами, такими как диметилдиоксиран. Эти способы получения N-оксидов были подробно описаны и отражены в обзорах литературы, смотри, например: T.L. Gilchrist in Comprehensive Organic Synthesis, vol. 7, pp. 748-750, S.V. Ley, Ed., Pergamon Press; M. Tisler and B. Stanovnik in Comprehensive Heterocyclic Chemistry, vol. 3, pp. 18-20, A.J. Boulton and A. McKillop, Eds., Pergamon Press; M.R. Grimmett and B.R.T. Keene in Advances in Heterocyclic Chemistry, vol. 43, pp. 149-161, A.R. Katritzky, Ed., Academic Press; M. Tisler and B. Stanovnik in Advances in Heterocyclic Chemistry, vol. 9, pp. 285-291, A.R. Katritzky and A.J. Boulton, Eds., Academic Press; и G.W.H. Cheeseman and E.S.G. Werstiuk in Advances in Heterocyclic Chemistry, vol. 22, pp. 390-392, A.R. Katritzky and A.J. Boulton, Eds., Academic Press.
Соединения по настоящему изобретению могут существовать в форме одного или нескольких стереоизомеров. Различные стереоизомеры включают энантиомеры, диастереоизомеры, атропоизомеры и геометрические изомеры. Специалисту в данной области техники следует принимать во внимание, что один стереоизомер может быть более активным и/или может обладать положительными эффектами, если его содержание будет увеличено относительно содержания другого стереоизомера (других стереоизомеров) или при отделении его от другого стереоизомера (других стереоизомеров). Дополнительно, специалисту в данной области техники известно, как разделить, обогатить и/или избирательно получить упомянутые стереоизомеры. Соответственно, настоящее изобретение относится к соединениям формулы 1, его N-оксидам и солям. Соединения по настоящему изобретению могут быть представлены смесью стереоизомеров отдельными стереоизомерами и в виде оптически активной формы.
Соли соединений по настоящему изобретению включают аддитивные соли неорганических или органических кислот, таких как бромистоводородная, хлористоводородная, азотная, фосфорная, серная, уксусная, масляная, фумаровая, молочная, малеиновая, малоновая, щавелевая, пропионовая, салициловая, винная, 4-толуолсульфоновая или валериановая кислоты. В композициях или способах по настоящему изобретению соли соединений по настоящему изобретению предпочтительно пригодны для описанных в этом документе сельскохозяйственных и/или несельскохозяйственных применений.
Раскрыты соединения формулы I, в которых
R4 представляет собой H или C1-C4-алкил, необязательно замещенный одним заместителем, выбираемым из группы, состоящей из CN, SMe и OMe;
R5 представляет собой H или Me;
R6 представляет собой H;
R7 представляет собой H.
Предпочтительными с точки зрения стоимости, простоты синтеза и/или биологической эффективности соединениями являются:
1) предпочтительные соединения формулы 1, в которой
R1 представляет собой Me или Cl;
R2 представляет собой Cl, Br, CF3, OCF2H, OCF3 или OCH2CF3;
R4 представляет собой H, Me, Et, изо-Pr, трет-Bu, CH2CN, CH(Me)CH2SMe или C(Me)2CH2SMe;
2) предпочтительные соединения формулы 1, в которой
R2 представляет собой Cl, Br, CF3 или OCH2CF3;
R4 представляет собой H, Me, Et или изо-Pr;
R5 представляет собой H.
Раскрыты предпочтительные соединения пунктов 1) и 2), в которых R6 представляет собой H и R7 представляет собой H.
Предпочтительными композициями по настоящему изобретению являются композиции, содержащие приведенные выше предпочтительные соединения. Предпочтительными способами применения являются способы применения приведенных выше предпочтительных соединений.
Соединения формулы 1 могут быть получены по одному или нескольким из следующих способов и вариантов, описанных в схемах 1-20. Значения R1, R2, R3, R4 и R5 в приведенных ниже соединениях формул 1-24 определены выше в кратком описании сущности изобретения, если не указано особо.
Соединения формулы 1 могут быть получены путем осуществления взаимодействия бензоксазинонов формулы 2 с амином формулы HNR4R5, как указано на схеме 1. Взаимодействие может осуществляться без разбавления или в различных подходящих растворителях, включая тетрагидрофуран, диэтиловый эфир, диоксан, толуол, дихлорметан или хлороформ, в оптимальных температурных условиях, колеблющихся в пределах от комнатной температуры до температуры кипения растворителя. Общая реакция бензоксазинонов с аминами с получением антраниламидов документально подтверждена в химической литературе. Для обзора химии бензоксазинонов см. Jakobsen et al., Bioorganic and Medicinal Chemistry 2000, 8, 2095-2103 и процитированные в этой работе ссылки. См. также G.M. Coppola, J. Heterocyclic Chemistry 1999, 36, 563-588.
Схема 1

Соединения формулы 1 могут быть также получены из их галогенантраниловых диамидов формулы 3 (в которой X представляет собой галоген, предпочтительно йод или бром) по способу сочетания, представленному на схеме 2. Соединения формулы 1 получают путем осуществления взаимодействия соединения формулы 3 с цианидом металла (например, с цианидом меди(I), цианидом цинка или цианидом калия), необязательно в присутствии или в отсутствие подходящего палладиевого катализатора (например, тетракис(трифенилфосфин)палладия(0) или дихлорбис(трифенилфосфин)палладия(II)) и необязательно в присутствии или в отсутствие металлогалогенида (например, йодида меди(I), йодида цинка или йодида калия), в подходящем растворителе, таком как ацетонитрил, N,N-диметилформамид или N-метилпирролидинон, необязательно при температуре, колеблющейся в пределах от комнатной температуры до температуры кипения растворителя. В случае применения в реакции сочетания палладиевого катализатора подходящим растворителем может также являться тетрагидрофуран или диоксан.
Схема 2

Цианобензоксазиноны формулы 2 могут быть получены по способу, указанному на схеме 3. Соединение формулы 2 получают путем осуществления взаимодействия галогенбензоксазинона формулы 4 (в которой X представляет собой галоген, предпочтительно йод или бром) с цианидом металла по способу сочетания, сходному с представленным выше на схеме 2 (необязательно в присутствии или в отсутствие палладиевого катализатора и необязательно в присутствии или в отсутствие металлогалогенида).
Схема 3

Цианобензоксазиноны формулы 2 могут быть также получены по способу, подробно представленному на схеме 4, путем сочетания пиразолкарбоновой кислоты формулы 5 с цианоантраниловой кислотой формулы 6. Это взаимодействие включает последовательное присоединение метансульфонилхлорида в присутствии третичного амина, такого как триэтиламин или пиридин, к пиразолкарбоновой кислоте формулы 5, с последующим присоединением цианоантраниловой кислоты формулы 6, с последующим повторным добавлением третичного амина и метансульфонилхлорида.
Схема 4

На схеме 5 отражен другой способ получения бензоксазинонов формулы 2, включающий сочетание изатового ангидрида формулы 7 с пиразольным хлорангидридом формулы 8. Для этой реакции подходят такие растворители, как пиридин или пиридин/ацетонитрил. Хлорангидриды формулы 8 доступны для получения из соответствующих кислот формулы 5 по известным способам, таким как хлорирование тионилхлоридом или оксалилхлоридом.
Схема 5

Как представлено на схеме 6, галогенантраниловые диамиды формулы 3 могут быть получены путем осуществления взаимодействия бензоксазинонов формулы 4, в которой X представляет собой галоген, с амином формулы HNR4R5 по способу, сходному с представленным выше на схеме 1. Условия проведения реакции сходны с таковыми, определенными в схеме 1.
Схема 6

Как представлено на схеме 7, галогенбензоксазиноны формулы 4 (в которой X представляет собой галоген) могут быть получены путем прямого сочетания пиридилпиразолкарбоновой кислоты формулы 5 с галогенантраниловой кислотой формулы 9 (в которой X представляет собой галоген) по способу, сходному с представленным на схеме 4. Это взаимодействие включает последовательное присоединение метансульфонилхлорида в присутствии третичного амина, такого как триэтиламин или пиридин, к пиразолкарбоновой кислоте формулы 5 с последующим присоединением галогенантраниловой кислоты формулы 9, с последующим повторным добавлением третичного амина и метансульфонилхлорида. Применение этого способа дает, как правило, хороший выход бензоксазинона.
Схема 7

Как представлено на схеме 8, галогенбензоксазинон формулы 4 может быть также получен путем сочетания изатового ангидрида формулы 10 (в которой X представляет собой галоген) с пиразольным хлорангидридом формулы 8 по способу, сходному с представленным на схеме 5.
Схема 8

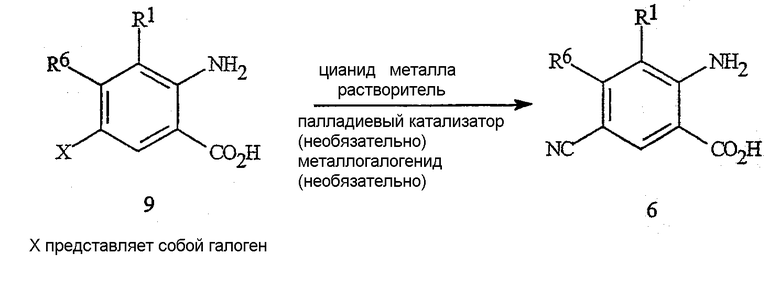
Цианоантраниловые кислоты формулы 6 могут быть получены из галогенантраниловых кислот формулы 9, как указано на схеме 9. Соединение формулы 6 получают путем осуществления взаимодействия галогенантраниловой кислоты формулы 9 (в которой X представляет собой галоген) с цианидом металла с применением той же методики сочетания, что и представленная на схеме 2 (необязательно в присутствии или в отсутствие палладиевого катализатора и необязательно в присутствии или в отсутствие металлогалогенида).
Схема 9
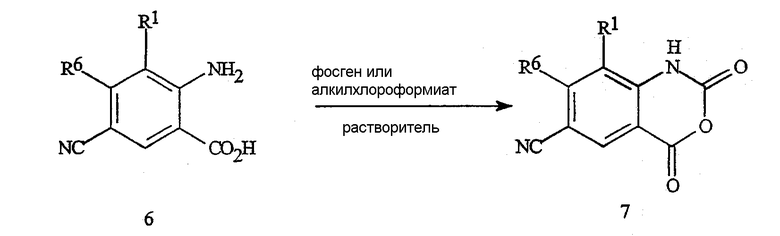
Как представлено на схеме 10, цианоизатовые ангидриды формулы 7 могут быть получены из цианоантраниловых кислот формулы 6 путем осуществления взаимодействия с фосгеном (или с эквивалентом фосгена, таким как трифосген) или с алкилхлороформиатом (например, метилхлороформиатом) в подходящем растворителе, таком как толуол или тетрагидрофуран.
Схема 10
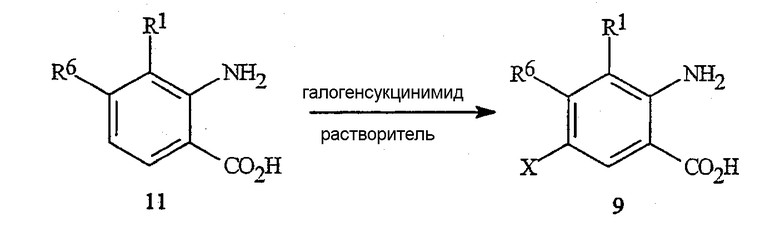
Как представлено на схеме 11, галогенантраниловые кислоты формулы 9 могут быть получены путем прямого галогенирования незамещенной антраниловой кислоты формулы 11 N-хлорсукцинимидом (NCS), N-бромсукцинимидом (NBS) или N-йодсукцинимидом (NIS), соответственно, в растворителях, таком как N,N-диметилформамид (DMF), с получением соответствующей галоген-замещенной кислоты формулы 9.
Схема 11
Как представлено на схеме 12, галогенизатовые ангидриды формулы 10 могут быть получены из галогенантраниловых кислот формулы 9 путем осуществления взаимодействия с фосгеном (или с эквивалентом фосгена, таким как трифосген) или с алкилхлороформиатом, например, метилхлороформиатом, в подходящем растворителе, таком как толуол или тетрагидрофуран.
Схема 12

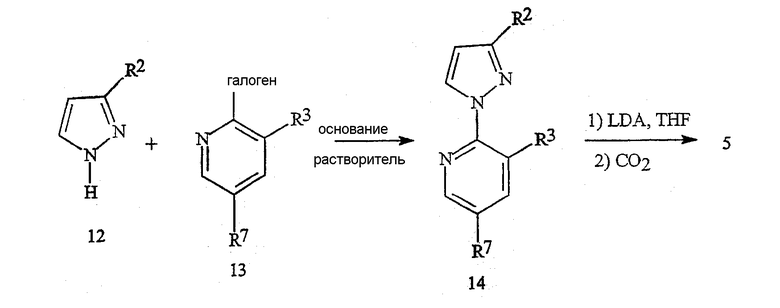
Пиридилпиразолкарбоновые кислоты формулы 5 могут быть получены по способу, указанному на схеме 13. Хорошие выходы 1-пиридилпиразола формулы 14 с удовлетворительной специфичностью для выбранного региоселективного химического процесса получают путем осуществления взаимодействия пиразола формулы 12 с 2-галогенпиридином формулы 13 в присутствии подходящего основания, такого как карбонат калия, в растворителе, таком как N,N-диметилформамид или ацетонитрил. Пиразолкарбоновую кислоту формулы 5 получали путем металлирования соединения формулы 14 диизопропиламидом лития (LDA) с последующим гашением литиевой соли двуокисью углерода.
Схема 13
Исходные пиразолы формулы 12, в которой R2 представляет собой CF3, Cl или Br, являются известными соединениями. Пиразол формулы 12, в которой R2 представляет собой CF3, может быть получен по описанной в литературе методике (J. Fluorine Chem. 1991, 53(1), 61-70). Пиразолы формулы 12, в которой R2 представляет собой Cl или Br, также могут быть получены по описанным в литературе методикам (H. Reimlinger and A. Van Overstraeten, Chem. Ber. 1966, 99(10), 3350-7). Подходящий альтернативный способ получения соединения формулы 12, в которой R2 представляет собой Cl или Br, отражен на схеме 14. Галогензамещенные производные формулы 16 (в которой R2 представляет собой Cl или Br) получают путем металлирования сульфамоилпиразола формулы 15 н-бутиллитием с последующим прямым галогенированием аниона либо гексахлорэтаном (если R2 представляет собой Cl), либо 1,2-дибромтетрахлорэтаном (если R2 представляет собой Br). Пиразолы формулы 12, в которой R2 представляет собой Cl или Br, соответственно, получают с хорошим выходом и чистотой путем удаления сульфамоильной группы трифторуксусной кислотой (TFA) при комнатной температуре.
Схема 14

В качестве альтернативы способу, представленному на схеме 13, пиразолкарбоновые кислоты формулы 5, в которой R2 представляет собой CF3, также могут быть получены по способу, указанному на схеме 15. Циклизованный продукт формулы 18 получают путем осуществления взаимодействия соединения формулы 17 (в которой R8 представляет собой C1-C4-алкил) с подходящим основанием в подходящем органическом растворителе после нейтрализации кислотой, такой как уксусная кислота.
Схема 15

Примером подходящего основания может без ограничения являться гидрид натрия, трет-бутоксид калия, димезилнатрия (CH3S(O)CH2-Na+), карбонаты или гидроксиды щелочного металла (такого как литий, натрий или калий), фториды или гидроксиды тетраалкиламмония (алкил = метил, этил или бутил) или 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфонин. Примером подходящего органического растворителя может без ограничения являться ацетон, ацетонитрил, тетрагидрофуран, дихлорметан, диметилсульфоксид или N,N-диметилформамид. Реакцию циклизации обычно осуществляют в диапазоне температур приблизительно от 0 до 120°C. Все эффекты растворителя, основания, температуры и времени добавления являются взаимосвязанными, и для минимизации образования побочных продуктов является важным подбор условий проведения реакции. Предпочтительным основанием является фторид тетрабутиламмония.
Соединение формулы 5 получают путем дегидратации соединения формулы 18 с получением соединения формулы 19 с последующим гидролизом группы эфира карбоновой кислоты до карбоновой кислоты. Дегидратацию осуществляют путем обработки каталитическим количеством подходящей кислоты. Примером выступающей в качестве подобного катализатора кислоты может без ограничения являться серная кислота. Взаимодействие, как правило, осуществляют с применением органического растворителя. Специалисту в данной области техники понятно, что реакции дегидратации могут осуществляться в широком разнообразии растворителей, например, в уксусной кислоте, как правило, в диапазоне температур приблизительно от 0 до 200°C, более предпочтительно приблизительно от 0 до 100°C. Эфиры карбоновых кислот формулы 19 могут быть преобразованы в карбоновые кислоты формулы 5 различными способами, включая нуклеофильное расщепление в безводных условиях или гидролитические способы, включая применение либо кислот, либо оснований (для обзора способов см. T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd ed., John Wiley & Sons, Inc., New York, 1991, pp. 224-269). Для способа, представленного на схеме 15, предпочтительными являются гидролитические способы, катализируемые основанием. Предпочтительные основания включают гидроксиды щелочных металлов (таких как литий, натрий или калий). Например, сложный эфир может быть растворен в смеси воды и спирта, такого как этанол. После обработки гидроксидом натрия или гидроксидом калия сложный эфир омыляют с получением натриевой или калиевой соли карбоновой кислоты. Карбоновую кислоту формулы 5 получают путем подкисления добавлением сильной кислоты, такой как соляная кислота или серная кислота.
Соединения формулы 17, в которой R2 представляет собой CF3, могут быть получены по способу, указанному на схеме 16. Гидразон формулы 21 получают путем обработки гидразинового соединения формулы 20 кетоном формулы CH3COR2 в растворителе, таком как вода, метанол или уксусная кислота.
Схема 16

в которой R2 представляет собой CF3 и R8 представляет собой C1-C4-алкил.
Специалисту в данной области техники следует понимать, что осуществление этого взаимодействия может потребовать катализа произвольной кислотой, а также может потребовать повышения температуры в зависимости от молекулярной схемы замещения гидразона формулы 21. Соединение формулы 17 получают путем осуществления взаимодействия гидразона формулы 21 с алкилхлороксалатом в подходящем органическом растворителе, например, без ограничения в дихлорметане или тетрагидрофуране, в присутствии акцептора кислоты, такого как триэтиламин. Взаимодействие обычно осуществляют при температуре приблизительно от 0 до 100°C. Гидразиновые соединения формулы 20 могут быть получены по стандартным методам, например, путем осуществления взаимодействия соответствующего галогенпиридина формулы 13 с гидразином.
В качестве альтернативы способу, представленному на схеме 13, пиразолкарбоновые кислоты формулы 5, в которой R2 представляет собой Cl или Br, могут быть также получены по способу, указанному на схеме 17. Соединение формулы 19, в которой R2 представляет собой Cl или Br, получают путем окисления соединения формулы 22, необязательно в присутствии кислоты. Соединение формулы 5 получают путем гидролиза группы эфира карбоновой кислоты до карбоновой кислоты.
Схема 17
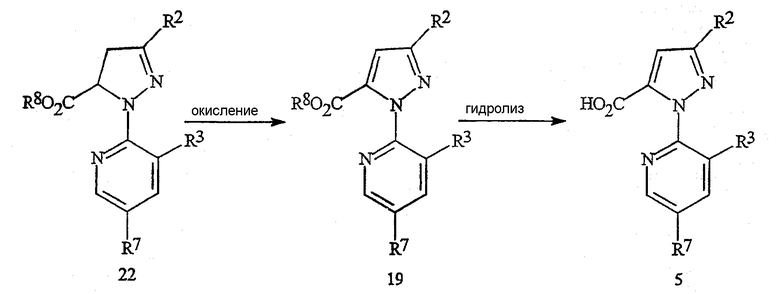
в которой R8 представляет собой C1-C4-алкил.
Окислителем для преобразования соединения формулы 22 в соединение формулы 19 может являться перекись водорода, органические перекиси, персульфат калия, персульфат натрия, персульфат аммония, моноперсульфат калия (например, Oxone®) или перманганат калия. Для полного преобразования следует применять, по крайней мере, один эквивалент окислителя по отношению к соединению формулы 22, предпочтительно приблизительно от одного до двух эквивалентов. Это окисление обычно осуществляют в присутствии растворителя. Растворителем может служить простой эфир, такой как тетрагидрофуран, пара-диоксан и тому подобное, органический сложный эфир, такой как этилацетат, диметилкарбонат, и тому подобное, или полярный апротонный органический растворитель, такой как N,N-диметилформамид, ацетонитрил, и тому подобное. Кислоты, пригодные для применения на стадии окисления, включают неорганические кислоты, такие как серная кислота, фосфорная кислота, и тому подобное, и органические кислоты, такие как уксусная кислота, бензойная кислота, и тому подобное. Может применяться от одного до пяти эквивалентов кислоты. Предпочтительным окислителем является персульфат калия, и окисление предпочтительно осуществляют в присутствии серной кислоты. Взаимодействие может быть осуществлено путем смешивания соединения формулы 22 в желаемом растворителе и, в случае использования, кислоты. Затем с подходящей скоростью может быть добавлен окислитель. Для достижения приемлемой продолжительности времени реакции до полного завершения реакции температуру реакции обычно варьируют приблизительно от 0°C до точки кипения растворителя. Способы, пригодные для преобразования сложного эфира формулы 19 в карбоновую кислоту формулы 5, уже представлены на схеме 15.
Соединения формулы 22, в которой R2 представляет собой галоген и R8 представляет собой C1-C4-алкил, могут быть получены из соответствующих соединений формулы 23, как представлено на схеме 18.
Схема 18
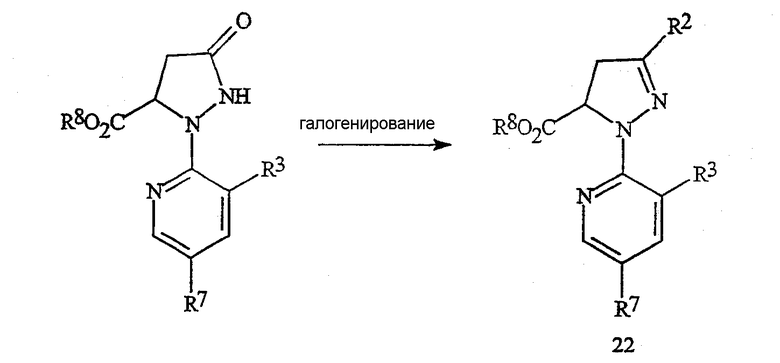
в которой R8 представляет собой C1-C4-алкил.
Соответствующее галогенированное соединение формулы 22 получают путем обработки соединения формулы 23 галогенирующим реагентом, обычно в присутствии растворителя. Возможными к применению галогенирующими реагентами являются оксигалогениды фосфора, тригалогениды фосфора, пентагалогениды фосфора, тионилхлорид, дигалогентриалкилфосфораны, дигалогендифенилфосфораны, оксалилхлорид и фосген. Предпочтительными являются оксигалогениды фосфора и пентагалогениды фосфора. Для достижения полного преобразования следует применять, по крайней мере, 0,33 эквивалента оксигалогенида фосфора относительно соединения формулы 23, предпочтительно приблизительно от 0,33 до 1,2 эквивалента. Для достижения полного преобразования следует применять, по крайней мере, 0,20 эквивалента пентагалогенида фосфора относительно соединения формулы 23, предпочтительно приблизительно от 0,20 до 1,0 эквивалента. Обычные для проведения галогенирования растворители включают галогенированные алканы, такие как дихлорметан, хлороформ, хлорбутан и тому подобное, ароматические растворители, такие как бензол, ксилол, хлорбензол и тому подобное, простые эфиры, такие как тетрагидрофуран, пара-диоксан, диэтиловый эфир и тому подобное, и полярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид и тому подобное. Необязательно может быть добавлено органическое основание, такое как триэтиламин, пиридин, N,N-диметиланилин и тому подобное. Добавление катализатора, такого как N,N-диметилформамид, также необязательно. Предпочтительным является процесс, в котором растворитель представляет собой ацетонитрил, а основание отсутствует. Обычно в случае применения в качестве растворителя ацетонитрила не требуется присутствие ни основания, ни катализатора. Предпочтительный процесс осуществляют путем смешивания соединения формулы 23 в ацетонитриле. Затем в течение приемлемого времени добавляют галогенирующий реагент и выдерживают смесь при желаемой температуре до момента окончания взаимодействия. Температура реакции составляет приблизительно от 20°C до точки кипения ацетонитрила, а продолжительность взаимодействия обычно не превышает двух часов. Затем реакционную массу нейтрализуют добавлением неорганического основания, такого как бикарбонат натрия, гидроксид натрия и тому подобное, или органического основания, такого как ацетат натрия. Желаемый продукт формулы 22 может быть выделен по методам, известным специалисту в данной области техники, включая кристаллизацию, экстракцию и дистилляцию.
Альтернативно, соединения формулы 22, в которой R2 представляет собой Br или Cl, могут быть получены путем обработки соответствующих соединений формулы 22, в которой R2 представляет собой другой галоген (например, Cl для получения соединения формулы 22, в которой R2 представляет собой Br) или сульфонильную группу, такую как пара-толуолсульфонат, бензолсульфонат и метансульфонат, бромистым водородом или хлористым водородом, соответственно. По этому способу R2-заместитель (галоген или сульфонат) соединения формулы 22 замещается Br или Cl из бромистого водорода или хлористого водорода, соответственно. Взаимодействие осуществляют в подходящем растворителе, таком как дибромметан, дихлорметан, уксусная кислота, этилацетат или ацетонитрил. Взаимодействие можно осуществлять при атмосферном давлении, близком к нему или при повышенном давлении в сосуде высокого давления. Галогенирующий реагент может добавляться к реакционной смеси, содержащей соединение формулы 23 и растворитель, в виде газа. Если R2 в исходном соединении формулы 22 представляет собой галоген, такой как Cl, взаимодействие предпочтительно осуществляют таким образом, что образующийся в процессе взаимодействия галогенводород удаляется путем барботирования и другими подходящими средствами. Альтернативно, перед взаимодействием с соединением формулы 23, без разбавления или в растворе, галогенирующий реагент может быть сначала растворен в инертном растворителе, в котором очень хорошо растворим (таком как уксусная кислота). Взаимодействие может быть осуществлено при температуре приблизительно от 0 до 100°C, более удобно при температуре около температуры окружающей среды (например, приблизительно от 10 до 40°C) и более предпочтительно при температуре приблизительно от 20 до 30°C. Добавление каталитического количества кислоты Льюиса (такой как трибромид алюминия для получения соединения формулы 22, в которой R2 представляет собой Br) может способствовать взаимодействию. Продукт формулы 22 выделяют по обычным способам, известным специалисту в данной области техники, включая экстракцию, дистилляцию и кристаллизацию.
Исходные соединения формулы 22, в которой R2 представляет собой сульфонатную группу, могут быть получены из соответствующих соединений формулы 23 по стандартным способам, таким как обработка сульфонилхлоридом (например, пара-толуолсульфонилхлоридом) и основанием, таким как третичный амин (например, триэтиламин) в подходящем растворителе, таком как дихлорметан.
В качестве альтернативы способу, представленному на схеме 13, пиразолкарбоновые кислоты формулы 5, в которой R2 представляет собой галогеналкоксигруппу, могут быть также получены по способу, указанному на схеме 19. Соединение формулы 23 окисляют до соединения формулы 24. Условия проведения реакции окисления описаны для преобразования соединения формулы 22 в соединение формулы 19 на схеме 17.
Схема 19

в которой R2 представляет собой галогеналкоксигруппу и R8 представляет собой C1-C4-алкил.
Затем промежуточный продукт формулы 24 алкилируют с получением соединения формулы 19 (в которой R2 представляет собой галогеналкоксигруппу) путем осуществления взаимодействия с подходящим галогеналкилирующим агентом, таким как галогенид или сульфонат галогеналкила. Взаимодействие осуществляют в присутствии, по крайней мере, одного эквивалента основания. Подходящие основания включают неорганические основания, такие как карбонаты, гидроксиды и гидриды щелочных металлов (таких как литий, натрий или калий), или органические основания, такие как триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5.4.0]ундец-7-ен. Взаимодействие, как правило, осуществляют в растворителе, который включает спирты, такие как метанол и этанол, галогенированные алканы, такие как дихлорметан, ароматические растворители, такие как бензол, толуол и хлорбензол, простые эфиры, такие как тетрагидрофуран, и полярные апротонные растворители, такие как ацетонитрил, N,N-диметилформамид, и тому подобное. Для применения с неорганическими основаниями предпочтительными являются спирты и полярные апротонные растворители. Предпочтительными являются карбонат калия в качестве основания и N,N-диметилформамид или ацетонитрил в качестве растворителя. Взаимодействие, как правило, осуществляют при температуре от 0 до 150°C, обычно от температуры окружающей среды до 100°C. Затем сложный эфир формулы 24 может быть преобразован в карбоновую кислоту формулы 5 по способам, уже описанным для преобразования соединения формулы 19 в соединение формулы 5 на схеме 15.
Соединения формулы 23 могут быть получены из соединений формулы 20, как указано на схеме 20. По этому способу гидразиновое соединение формулы 20 оставляют взаимодействовать с соединением формулы 25 (могут применяться эфир фумаровой кислоты, или эфир малеиновой кислоты, или их смесь) в присутствии основания и растворителя.
Схема 20

в которой R8 представляет собой C1-C4-алкил.
Применяемое на схеме 20 основание обычно представляет собой алкоксид металла, такой как метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, трет-бутоксид калия, трет-бутоксид лития и тому подобное. Могут применяться полярные протонные и полярные апротонные органические растворители, такие как спирты, ацетонитрил, тетрагидрофуран, N,N-диметилформамид, диметилсульфоксид и тому подобное. Предпочтительными растворителями являются спирты, такие как метанол и этанол. Особенно предпочтительно, когда применяемый спирт является тем же, что и применяемый для получения эфира фумаровой или малеиновой кислоты и алкоксидного основания. Взаимодействие обычно осуществляют путем смешивания соединения формулы 20 и основания в растворителе. Смесь может нагреваться или охлаждаться до требуемой температуры и в течение промежутка времени добавляют соединение формулы 25. Обычно применяют температуры реакции от 0°C до точки кипения растворителя. Для повышения значения точки кипения растворителя реакцию можно осуществлять при повышенном по сравнению с атмосферным давлении. Как правило, предпочтительными являются значения температуры приблизительно от 30 до 90°C. Затем реакционную смесь можно подкислить добавлением органической кислоты, такой как уксусная кислота и тому подобное, или неорганической кислоты, такой как соляная кислота, серная кислота и тому подобное. Требуемый продукт формулы 23 может быть выделен по методам, известным специалисту в данной области техники, включая кристаллизацию, экстракцию и дистилляцию.
Понятно, что некоторые реагенты и реакционные условия, описанные выше для получения соединений формулы 1, могут быть несовместимыми с определенными функциональными группами промежуточных продуктов. В этих случаях включение в синтез последовательностей реакций защита/снятия защиты или взаимных превращений функциональных групп будет способствовать получению желаемых продуктов. Применение и выбор защитных групп очевиден для специалиста в области химического синтеза (см., например, T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 2nd ed.; Wiley: New York, 1991). Специалист в данной области техники должен осознавать, что в некоторых случаях для завершения синтеза соединений формулы 1 после введения определенного реагента, как это отражено на любой отдельной схеме, может существовать необходимость проведения дополнительных рутинных стадий синтеза, не описанных подробно. Специалист в данной области техники также должен осознавать, что может существовать необходимость проведения комбинации стадий, проиллюстрированных выше на схемах, в порядке, отличном от конкретно указанной последовательности получения соединений формулы 1.
Без дополнительного уточнения считается, что специалист в данной области техники сможет использовать настоящее изобретение в полном объеме, используя предшествующее описание. Поэтому последующие примеры должны истолковываться лишь как пояснительные, а не как ограничивающие каким-либо образом раскрытие настоящего изобретения. Стадии в последующих примерах иллюстрируют методику для каждой стадии полного преобразования в процессе синтеза, и исходный материал для каждой стадии необязательно может быть получен в ходе конкретного процесса получения, чья методика описана в других примерах и стадиях. Проценты представлены по массе, за исключением смесей, применяемых в качестве растворителя для хроматографии, и особо указанных случаев. Части и проценты для смесей, применяемых в качестве растворителя для хроматографии, представлены по объему, если не указано особо. 1H-ЯМР спектры представлены в миллионных долях (м.д.) со сдвигом в более слабую область относительно тетраметисилана; «s» означает синглет, «d» означает дублет, «t» означает триплет, «q» означает квартет, «m» означает мультиплет, «dd» означает дублет дублетов, «dt» означает дублет триплетов, и «br s» означает уширенный синглет.
Пример 1
Получение 1-(3-хлор-2-пиридинил)-N-[4-циано-2-метил-6-(аминокарбонил)фенил]-3-(трифторметил)-1H-пиразол-5-карбоксамида
Стадия A: Получение 2-амино-3-метил-5-йодбензойной кислоты
К раствору 2-амино-3-метилбензойной кислоты (Aldrich, 5 г, 33 ммоль) в N,N-диметилформамиде (30 мл) добавляли N-йодсукцинимид (7,8 г, 34,7 ммоль) и выдерживали реакционную смесь в масляной бане при 75°C в течение ночи. Нагревание удаляли и медленно вливали реакционную смесь в воду со льдом (100 мл) с выпадением в осадок светло-серого твердого вещества. Твердое вещество фильтровали, четырежды промывали водой, а затем сушили в вакуумной печи при 70°C в течение ночи. Требуемый промежуточный продукт выделяли в виде светло-серого твердого вещества (8,8 г).
1Н ЯМР (ДМСО-d6): δ 7,86 (д, 1Н), 7,44 (д, 1Н), 2,08 (с, 3Н).
Стадия B: Получение 3-хлор-2-[3-(трифторметил)-1Н-пиразол-1-ил]пиридина
К смеси 2,3-дихлорпиридина (99,0 г, 0,67 моль) и 3-(трифторметил)пиразола (83 г, 0,61 моль) в безводном N,N-диметилформамиде (300 мл) добавляли карбонат калия (166,0 г, 1,2 моль) и нагревали реакционную смесь до 110-125°C в течение 48 часов. Реакционную смесь охлаждали до 100°C и фильтровали через диатомовое вспомогательное фильтровальное вещество Celite® для удаления твердых веществ. N,N-Диметилформамид и избыток дихлорпиридина удаляли путем перегонки при атмосферном давлении. В результате перегонки продукта при пониженном давлении (т.кип.=139-141°C, 7 мм рт.ст.) получали 113,4 г требуемого промежуточного продукта в виде прозрачного желтого масла.
1Н ЯМР (CDCl3): δ 8,45 (д, 1Н), 8,15 (с, 1Н), 7,93 (д, 1Н), 7,36 (т, 1Н), 6,78 (с, 1Н).
Стадия C: Получение 1-(3-хлор-2-пиридинил)-3-(трифторметил)-1H-пиразол-5-карбоновой кислоты
К раствору 3-хлор-2-[3-(трифторметил)-1Н-пиразол-1-ил]пиридина (т.е. полученного на стадии B пиразольного продукта) (105,0 г, 425 ммоль) в безводном тетрагидрофуране (700 мл) при -75°C через канюлю добавляли охлажденный до -30°C раствор диизопропиламида лития (425 ммоль) в безводном тетрагидрофуране (300 мл). Темно-красный раствор перемешивали в течение 15 минут, после чего раствор барботировали двуокисью углерода при -63°C до момента, когда раствор становился бледно-желтым, а экзотермический процесс прекращался. Реакционную смесь перемешивали в течение дополнительных 20 минут, а затем гасили добавлением воды (20 мл). Растворитель удаляли при пониженном давлении и распределяли реакционную смесь между диэтиловым эфиром и 0,5 н. водным раствором гидроксида натрия. Водные экстракты трижды промывали диэтиловым эфиром, фильтровали через диатомовое вспомогательное фильтровальное вещество Celite® для удаления твердого остатка, а затем подкисляли приблизительно до pH 4, после чего образовывалось оранжевое масло. Водную смесь энергично перемешивали и добавляли дополнительное количество кислоты для корректировки значения pH до 2,5-3. Оранжевое масло сгущали до зернистого твердого вещества, которое фильтровали, последовательно промывали водой и 1 н. соляной кислотой и сушили в вакууме при 50°C с получением 130 г указанного в заголовке продукта в виде не совсем белого твердого вещества. Продукт, полученный по сходной методике в другом опыте, имел т.пл.=175-176°C.
1Н ЯМР (ДМСО-d6): δ 7,61 (с, 1Н), 7,76 (дд, 1Н), 8,31 (д, 1Н), 8,60 (д, 1Н).
Стадия D: Получение 2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-6-йод-8-метил-4H-3,1-бензоксазин-4-она
К раствору метансульфонилхлорида (2,91 мл, 37,74 ммоль) в ацетонитриле (50 мл) при -5°C по каплям добавляли смесь 1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-карбоновой кислоты (т.е. полученного на стадии C продукта на основе карбоновой кислоты) (10,0 г, 34,31 ммоль) и триэтиламина (4,78 мл, 34,31 ммоль) в ацетонитриле (50 мл). Затем температуру реакции поддерживали на уровне 0°C на всем протяжении последовательного добавления реагентов. После перемешивания в течение 20 минут добавляли 2-амино-3-метил-5-йодбензойную кислоту (т.е. полученный на стадии A продукт) (9,51 г, 34,31 ммоль) и продолжали перемешивание в течение дополнительных 10 минут. Затем по каплям добавляли раствор триэтиламина (9,56 мл, 68,62 ммоль) в ацетонитриле (15 мл), перемешивали реакционную смесь в течение 30 минут, а затем добавляли метансульфонилхлорид (2,91 мл, 37,74 ммоль). Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Растворитель выпаривали при пониженном давлении и очищали твердый остаток хроматографией на силикагеле с получением 8,53 г указанного в заголовке соединения в виде желтого твердого вещества.
1Н ЯМР (CDCl3): δ 8,59 (дд, 1Н), 8,35 (д, 1Н), 7,97 (дд, 1Н), 7,86 (д, 1Н), 7,49 (м, 2Н), 1,79 (с, 3Н).
Стадия E: Получение 2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1H-пиразол-5-ил]-6-циано-8-метил-4H-3,1-бензоксазин-4-она
К раствору 2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-6-йод-8-метил-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии D бензоксазинонового продукта) (500 мг, 0,94 ммоль) в тетрагидрофуране (10 мл) при комнатной температуре последовательно добавляли йодид меди(I) (180 мг, 0,094 ммоль), тетракис(трифенилфосфин)палладий(0) (5,4 мг, 0,047 ммоль) и цианид меди(I) (420 мг, 4,7 ммоль). После нагревания реакционной смеси при кипении с обратным холодильником в течение ночи добавляли дополнительное количество цианида меди(I) (420 мг, 4,7 ммоль), йодида меди(I) (107 мг, 0,56 ммоль) и тетракис(трифенилфосфин)палладия(0) (325 мг, 0,28 ммоль) и продолжали нагревание при кипении с обратным холодильником в течение 1 часа. Реакционная смесь становилась черной, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Затем реакционную смесь разбавляли этилацетатом (20 мл) и фильтровали через Celite®, затем трижды промывали 10% водным раствором бикарбоната натрия и один раз соляным раствором. Органический экстракт сушили (MgSO4) и концентрировали при пониженном давлении с получением 410 мг указанного в заголовке соединения в виде неочищенного желтого твердого вещества.
1Н ЯМР (CDCl3): δ 8,59 (дд, 1Н), 8,33 (д, 1Н), 8,03 (дд, 1Н), 7,95 (д, 1Н), 7,56 (м, 2Н), 1,88 (с, 3Н).
Стадия F: Получение 1-(3-хлор-2-пиридин)-N-[4-циано-2-метил-6-(аминокарбонил)фенил]-3-(трифторметил)-1H-пиразол-5-карбоксамида
К раствору 2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1H-пиразол-5-ил]-6-циано-8-метил-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии E цианобензоксазинонового продукта) (200 мг, 0,46 ммоль) в тетрагидрофуране (5 мл) при комнатной температуре по каплям добавляли гидроксид аммония (0,5 мл, 12,8 ммоль). Затем реакционную смесь перемешивали в течение 5 минут, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Растворитель (тетрагидрофуран) выпаривали при пониженном давлении и очищали твердый остаток хроматографией на силикагеле с получением 620 мг указанного в заголовке соединения по настоящему изобретению в виде твердого вещества с т.пл.=200-202°C.
1Н ЯМР (CDCl3): δ 10,65 (с, 1Н), 8,43 (дд, 1Н), 7,9 (дд, 1Н), 7,67 (с, 1Н), 7,63 (с, 1Н), 7,45 (м, 1Н), 7,25 (с, 1Н), 6,21 (ушир. с, 1Н), 5,75 (ушир. с, 1Н), 2,26 (с, 3Н).
Пример 2
Получение 1-(3-хлор-2-пиридинил)-N-[4-циано-2-метил-6-[(метиламино)карбонил]фенил]-3-(трифторметил)-1H-пиразол-5-карбоксамида
Стадия A: Получение 1-(3-хлор-2-пиридинил)-N-[4-йод-2-метил-6-[(метиламино)карбонил]фенил]-3-(трифторметил)-1H-пиразол-5-карбоксамида
К раствору 2-[1-(3-хлор-2-пиридинил)-3-(трифторметил)-1Н-пиразол-5-ил]-6-йод-8-метил-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии D примера 1 бензоксазинонового продукта) (500 мг, 0,94 ммоль) в тетрагидрофуране (15 мл) по каплям добавляли метиламин (2,0M раствор в THF, 1,4 мл, 2,8 ммоль), перемешивали реакционную смесь в течение 3 часов, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Растворитель (тетрагидрофуран) выпаривали при пониженном давлении и очищали твердый остаток хроматографией на силикагеле с получением 400 мг указанного в заголовке соединения в виде желтого твердого вещества.
1Н ЯМР (CDCl3): δ 10,25 (с, 1Н), 8,45 (дд, 1Н), 7,85 (дд, 1Н), 7,55 (с, 1Н), 7,50 (с, 1Н), 7,46 (с, 1Н), 7,40 (м, 1Н), 6,15 (д, 1Н), 2,93 (д, 3Н), 2,12 (с, 3Н).
Стадия B: Получение 1-(3-хлор-2-пиридинил)-N-[4-циано-2-метил-6-[(метиламино)карбонил]фенил]-3-(трифторметил)-1Н-пиразол-5-карбоксамида
К раствору 1-(3-хлор-2-пиридинил)-N-[4-йод-2-метил-6-[(метиламино)карбонил]фенил]-3-(трифторметил)-1H-пиразол-5-карбоксамида (т.е. полученного на стадии A диамидного продукта) (410 мг, 0,72 ммоль) в тетрагидрофуране (8 мл) при комнатной температуре последовательно добавляли йодид меди(I) (24 мг, 0,126 ммоль), тетракис(трифенилфосфин)палладий(0) (70 мг, 0,060 ммоль) и цианид меди(I) (640 мг, 7,2 ммоль). Реакционную смесь нагревали при кипении с обратным холодильником в течение 4,5 часов. Проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Реакционную смесь разбавляли этилацетатом (20 мл) и фильтровали через Celite®, затем трижды промывали 10% водным раствором бикарбоната натрия и один раз соляным раствором. Органический экстракт сушили (MgSO4), концентрировали при пониженном давлении и очищали твердый остаток хроматографией на силикагеле с получением 114 мг указанного в заголовке соединения по настоящему изобретению в виде белого твердого вещества с т.пл.=214-216°C.
1Н ЯМР (CDCl3): δ 10,70 (с, 1Н), 8,46 (дд, 1Н), 7,87 (дд, 1Н), 7,57 (с, 2Н), 7,45 (м, 1Н), 7,31 (с, 1Н), 6,35 (д, 1Н), 2,98 (д, 3Н), 2,24 (с, 3Н).
Пример 3
Получение 3-хлор-1-(3-хлор-2-пиридинил)-N-[4-циано-2-метил-6-[(метиламино)карбонил]фенил]-1Н-пиразол-5-карбоксамида
Стадия A: Получение 3-хлор-N,N-диметил-1Н-пиразол-1-сульфонамида
К раствору N-диметилсульфамоилпиразола (188,0 г, 1,07 моль) в безводном тетрагидрофуране (1500 мл) при -78°C по каплям добавляли раствор 2,5M н-бутиллития (472 мл, 1,18 моль) в гексане, поддерживая температуру ниже -65°C. После завершения добавления реакционную смесь поддерживали при температуре -78°C в течение дополнительных 45 минут, после чего по каплям добавляли раствор гексахлорэтана (279 г, 1,18 моль) в тетрагидрофуране (120 мл). Реакционную смесь поддерживали при -78°C в течение 1 часа, нагревали до -20°C, а затем гасили добавлением воды (1 л). Реакционную смесь экстрагировали метиленхлоридом (4x500 мл), органические экстракты сушили над сульфатом магния и концентрировали. Неочищенный продукт дополнительно очищали хроматографией на силикагеле, используя в качестве элюента метиленхлорид, с получением 160 г указанного в заголовке продукта в виде желтого масла.
1Н ЯМР (CDCl3): δ 7,61 (с, 1Н), 6,33 (с, 1Н), 3,07 (д, 6Н).
Стадия B: Получение 3-хлорпиразола
К трифторуксусной кислоте (290 мл) по каплям добавляли 3-хлор-N,N-диметил-1H-пиразол-1-сульфонамид (т.е. полученный на стадии A хлорпиразольный продукт) (160 г) и перемешивали реакционную смесь при комнатной температуре в течение 1,5 ч, а затем концентрировали при пониженном давлении. Остаток помещали в гексан, нерастворимые твердые вещества отфильтровывали и выпаривали гексан с получением неочищенного продукта в виде масла. Неочищенный продукт дополнительно очищали хроматографией на силикагеле, используя в качестве элюента диэтиловый эфир/гексан (40/60), с получением 64,44 г указанного в заголовке продукта в виде желтого масла.
1Н ЯМР (CDCl3): δ 6,39 (с, 1Н), 7,66 (с, 1Н), 9,6 (уш. с, 1Н).
Стадия C: Получение 3-хлор-2-(3-хлор-1H-пиразол-1-ил)пиридина
К смеси 2,3-дихлорпиридина (92,60 г, 0,629 моль) и 3-хлорпиразола (т.е. полученного на стадии B продукта) (64,44 г, 0,629 моль) в N,N-диметилформамиде (400 мл) добавляли карбонат калия (147,78 г, 1,06 моль), а затем нагревали реакционную смесь до 100°C в течение 36 часов. Реакционную смесь охлаждали до комнатной температуры и медленно вливали в воду со льдом. Выпавшие в осадок твердые вещества фильтровали и промывали водой. Твердый отфильтрованный осадок помещали в этилацетат, сушили над сульфатом магния и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле, используя в качестве элюента 20% этилацетат/гексан, с получением 39,75 г указанного в заголовке продукта в виде белого твердого вещества.
1Н ЯМР (CDCl3): δ 6,43 (с, 1Н), 7,26 (м, 1Н), 7,90 (д, 1Н), 8,09 (с, 1Н), 8,41 (д, 1Н).
Стадия D: Получение 3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоновой кислоты
К раствору 3-хлор-2-(3-хлор-1Н-пиразол-1-ил)пиридина (т.е. полученного на стадии C пиразольного продукта) (39,75 г, 186 ммоль) в безводном тетрагидрофуране (400 мл) при -78°C по каплям добавляли раствор 2,0M диизопропиламида лития (93 мл, 186 ммоль) в тетрагидрофуране. Янтарный раствор барботировали двуокисью углерода в течение 14 минут, после чего раствор становился бледно-коричневато-желтым. Реакционную смесь подщелачивали добавлением 1 н. водного раствора гидроксида натрия и экстрагировали диэтиловым эфиром (2x500 мл). Водные экстракты подкисляли добавлением 6н соляной кислоты, а затем экстрагировали этилацетатом (3x500 мл). Этилацетатные экстракты сушили над сульфатом магния и концентрировали с получением 42,96 г указанного в заголовке продукта в виде не совсем белого твердого вещества. Продукт, полученный по той же методике в другом опыте, имел т.пл.=198-199°C.
1Н ЯМР (ДМСО-d6): δ 6,99 (с, 1Н), 7,45 (м, 1Н), 7,93 (д, 1Н), 8,51 (д, 1Н).
Стадия E: Получение 2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-йод-8-метил-4H-3,1-бензоксазин-4-она
К раствору метансульфонилхлорида (0,63 мл, 8,13 ммоль) в ацетонитриле (10 мл) при 0°C по каплям добавляли смесь 3-хлор-1-(3-хлор-2-пиридинил)-1H-пиразол-5-карбоновой кислоты (т.е. полученного на стадии D продукта на основе карбоновой кислоты) (2,0 г, 7,75 ммоль) и триэтиламина (1,08 мл, 7,75 ммоль) в ацетонитриле (5 мл). Затем реакционную смесь перемешивали в течение 15 минут при 0°C. Затем добавляли 2-амино-3-метил-5-йодбензойную кислоту (т.е. полученный на стадии A примера 1 продукт) (2,14 г, 7,75 ммоль) и продолжали перемешивание в течение дополнительных 5 минут. Затем по каплям добавляли раствор триэтиламина (2,17 мл, 15,15 ммоль) в ацетонитриле (5 мл), поддерживая температуру ниже 5°C. Реакционную смесь перемешивали в течение 40 минут при 0°C, а затем добавляли метансульфонилхлорид (0,63 мл, 8,13 ммоль). Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (3x50 мл). Объединенные этилацетатные экстракты последовательно промывали 10% водным раствором бикарбоната натрия (1x20 мл) и соляным раствором (1x20 мл), сушили (MgSO4) и концентрировали с получением 3,18 г указанного в заголовке продукта в виде неочищенного желтого твердого вещества.
1Н ЯМР (CDCl3): δ 8,55 (дд, 1Н), 8,33 (с, 1Н), 7,95 (дд, 1Н), 7,82 (д, 1Н), 7,45 (м, 1Н), 7,16 (с, 1Н), 1,77 (с, 3Н).
Стадия F: Получение 2-[3-хлор-1-(3-хлор-2-пиридинил)-1H-пиразол-5-ил]-6-циано-8-метил-4H-3,1-бензоксазин-4-она
К раствору 2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-йод-8-метил-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии E бензоксазинонового продукта) (600 мг, 1,2 ммоль) в тетрагидрофуране (15 мл) при комнатной температуре последовательно добавляли йодид меди(I) (137 мг, 0,72 ммоль), тетракис(трифенилфосфин)палладий(0) (416 мг, 0,36 ммоль) и цианид меди(I) (860 мг, 9,6 ммоль). Затем реакционную смесь нагревали при кипении с обратным холодильником в течение ночи. Реакционная смесь становилась черной, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Реакционную смесь разбавляли этилацетатом (20 мл) и фильтровали через Celite®, затем трижды промывали 10% водным раствором бикарбоната натрия и один раз соляным раствором. Органический экстракт сушили (MgSO4) и концентрировали при пониженном давлении с получением 397 мг указанного в заголовке соединения в виде неочищенного желтого твердого вещества.
1Н ЯМР (CDCl3): δ 8,50 (кв, 1Н), 8,22 (д, 1Н), 7,90 (дд, 1Н), 7,67 (д, 1Н), 7,45 (м, 1Н), 7,15 (с, 1Н), 1,79 (с, 3Н).
Стадия G: Получение 3-хлор-1-(3-хлор-2-пиридинил)-N-[4-циано-2-метил-6-(метиламино)карбонил]фенил]-1Н-пиразол-5-карбоксамида
К раствору 2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-циано-8-метил-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии F цианобензоксазинонового продукта) (100 мг, 0,25 ммоль) в тетрагидрофуране (5 мл) по каплям добавляли метиламин (2,0M раствор в THF, 0,5 мл, 1,0 ммоль), перемешивали реакционную смесь в течение 5 минут, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Растворитель (тетрагидрофуран) выпаривали при пониженном давлении и очищали твердый остаток хроматографией на силикагеле с получением указанного в заголовке соединения по настоящему изобретению в виде белого твердого вещества (52 мг), которое разлагалось в установке для плавления при температуре свыше 140°C.
1Н ЯМР (CDCl3): δ 10,55 (с, 1Н), 8,45 (дд, 1Н), 7,85 (дд, 1Н), 7,55 (д, 2Н), 7,40 (м, 1Н), 6,97 (д, 1Н), 6,30 (д, 1Н), 2,98 (д, 3Н), 2,24 (д, 3Н).
Пример 4
Получение 3-хлор-1-(3-хлор-2-пиридинил)-N-[4-циано-2-метил-6-(аминокарбонил)фенил]-1H-пиразол-5-карбоксамида
К раствору 2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-циано-8-метил-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии F примера 3 цианобензоксазинонового продукта) (100 мг, 0,25 ммоль) в тетрагидрофуране (5 мл) при комнатной температуре по каплям добавляли гидроксид аммония (0,5 мл, 12,8 ммоль). Затем реакционную смесь перемешивали в течение 5 минут, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Растворитель (тетрагидрофуран) выпаривали при пониженном давлении и очищали твердый остаток хроматографией на силикагеле с получением указанного в заголовке соединения по настоящему изобретению в виде белого твердого вещества (55 мг), которое разлагалось в установке для плавления при температуре свыше 255°C.
1Н ЯМР (CDCl3): δ 10,50 (с, 1Н), 8,45 (дд, 1Н), 7,85 (дд, 1Н), 7,66 (д, 1Н), 7,61 (с, 1Н), 7,41 (м, 1Н), 6,95 (с, 1Н), 6,25 (уш.с, 1Н), 5,75 (уш.с, 1Н), 2,52 (с, 3Н).
Пример 5
Получение 3-бром-1-(3-хлор-2-пиридил)-N-[4-циано-2-метил-6-[(метиламино)карбонил]фенил]-1Н-пиразол-5-карбоксамида
Стадия A: Получение 3-бром-N,N-диметил-1Н-пиразол-1-сульфонамида
К раствору N,N-диметилсульфамоилпиразола (44,0 г, 0,251 моль) в безводном тетрагидрофуране (500 мл) при -78°C по каплям добавляли раствор н-бутиллития (2,5M в гексане, 105,5 мл, 0,264 моль), поддерживая температуру ниже -60°C. Во время добавления образовывалось плотное твердое вещество. После завершения добавления реакционную смесь выдерживали в течение дополнительных 15 минут, после чего по каплям добавляли раствор 1,2-дибромтетрахлорэтана (90 г, 0,276 моль) в тетрагидрофуране (150 мл), поддерживая температуру ниже -70°C. Реакционная смесь становилась прозрачной оранжевой, а перемешивание продолжали в течение дополнительных 15 минут. Баню с охлаждением до -78°C удаляли и гасили реакционную смесь добавлением воды (600 мл). Реакционную смесь четырежды экстрагировали метиленхлоридом, органические экстракты сушили над сульфатом магния и концентрировали. Неочищенный продукт дополнительно очищали хроматографией на силикагеле, используя в качестве элюента метиленхлорид/гексан (50/50), с получением 57,04 г указанного в заголовке продукта в виде прозрачного бесцветного масла.
1Н ЯМР (CDCl3): δ 3,07 (д, 6Н), 6,44 (м, 1Н), 7,62 (м, 1Н).
Стадия B: Получение 3-бромпиразола
К трифторуксусной кислоте (70 мл) медленно добавляли 3-бром-N,N-диметил-1Н-пиразол-1-сульфонамид (т.е. полученный на стадии A бромпиразольный продукт) (57,04 г). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут, а затем концентрировали при пониженном давлении. Остаток помещали в гексан, нерастворимые твердые вещества отфильтровывали и выпаривали гексан с получением неочищенного продукта в виде масла. Неочищенный продукт дополнительно очищали хроматографией на силикагеле, используя в качестве элюента этилацетат/дихлорметан (10/90), с получением масла. Масло помещали в дихлорметан, нейтрализовали добавлением водного раствора бикарбоната натрия, трижды экстрагировали метиленхлоридом, сушили над сульфатом магния и концентрировали с получением 25,9 г указанного в заголовке продукта в виде белого твердого вещества с т.пл.=61-64°C.
1Н ЯМР (CDCl3): δ 6,37 (д, 1Н), 7,59 (д, 1Н), 12,4 (уш.с, 1Н).
Стадия C: Получение 2-(3-бром-1Н-пиразол-1-ил)-3-хлорпиридина
К смеси 2,3-дихлорпиридина (27,4 г, 185 ммоль) и 3-бромпиразола (т.е. полученного на стадии B продукта) (25,4 г, 176 ммоль) в безводном N,N-диметилформамиде (88 мл) добавляли карбонат калия (48,6 г, 352 ммоль) и нагревали реакционную смесь до 125°C в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и вливали в воду со льдом (800 мл). Выпадал осадок. Выпавшие в осадок твердые вещества перемешивали в течение 1,5 ч, фильтровали и промывали водой (2x100 мл). Твердый отфильтрованный осадок помещали в метиленхлорид и последовательно промывали водой, 1 н. соляной кислотой, насыщенным водным раствором бикарбоната натрия и соляным раствором. Затем органические экстракты сушили над сульфатом магния и концентрировали с получением 39,9 г розового твердого вещества. Неочищенное твердое вещество суспендировали в гексане и энергично перемешивали в течение 1 ч. Твердые вещества фильтровали, промывали гексаном и сушили с получением указанного в заголовке продукта в виде не совсем белого порошка (30,4 г) с чистотой свыше 94%, определенной по методу ЯМР. Этот материал использовали на стадии D без дополнительной очистки.
1Н ЯМР (CDCl3): δ 6,52 (с, 1Н), 7,30 (дд, 1Н), 7,92 (д, 1Н), 8,05 (с, 1Н), 8,43 (д, 1Н).
Стадия D: Получение 3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоновой кислоты
К раствору 2-(3-бром-1Н-пиразол-1-ил)-3-хлорпиридина (т.е. полученного на стадии C пиразольного продукта) (30,4 г, 118 ммоль) в безводном тетрагидрофуране (250 мл) при -76°C по каплям добавляли раствор диизопропиламида лития (118 ммоль) в тетрагидрофуране со скоростью, необходимой для поддержания температуры ниже -71°C. Реакционную смесь перемешивали в течение 15 минут при -76°C, затем барботировали ее двуокисью углерода в течение 10 минут, вызывая нагревание до -57°C. Реакционную смесь нагревали до -20°C и гасили добавлением воды. Реакционную смесь концентрировали, затем помещали в воду (1 л) и диэтиловый эфир (500 мл), а затем добавляли водный раствор гидроксида натрия (1 н., 20 мл). Водные экстракты промывали диэтиловым эфиром и подкисляли добавлением соляной кислоты. Выпавшие в осадок твердые вещества фильтровали, промывали водой и сушили с получением 27,7 г указанного в заголовке продукта в виде желтовато-коричневого твердого вещества. Продукт, полученный по сходной методике в другом опыте, имел т.пл.=200-201°C.
1Н ЯМР (ДМСО-d6): δ 7,25 (с, 1Н), 7,68 (дд, 1Н), 8,24 (д, 1Н), 8,56 (д, 1Н).
Стадия E: Получение 2-[3-бром-1-(3-хлор-2-пиридинил)-1H-пиразол-5-ил]-6-йод-8-метил-4H-3,1-бензоксазин-4-она
К раствору метансульфонилхлорида (0,54 мл, 6,94 ммоль) в ацетонитриле (15 мл) при 0°C по каплям добавляли смесь 3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-карбоновой кислоты (т.е. полученного на стадии D продукта на основе карбоновой кислоты) (2,0 г, 6,6 ммоль) и триэтиламина (0,92 мл, 6,6 ммоль) в ацетонитриле (5 мл). Реакционную смесь перемешивали в течение 15 минут при 0°C. Затем добавляли 2-амино-3-метил-5-йодбензойную кислоту (т.е. полученный на стадии A примера 1продукт) (1,8 г, 6,6 ммоль) и продолжали перемешивание в течение дополнительных 5 минут. Затем по каплям добавляли раствор триэтиламина (1,85 мл, 13,2 ммоль) в ацетонитриле (5 мл), поддерживая температуру ниже 5°C. Реакционную смесь перемешивали в течение 40 минут при 0°C, а затем добавляли метансульфонилхлорид (0,54 мл, 6,94 ммоль). Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (3x50 мл). Объединенные этилацетатные экстракты последовательно промывали 10% водным раствором бикарбоната натрия (1x20 мл) и соляным раствором (1x20 мл), сушили (MgSO4) и концентрировали с получением 2,24 г указанного в заголовке продукта в виде желтого твердого вещества.
1Н ЯМР (CDCl3): δ 8,55 (дд, 1Н), 8,33 (д, 1Н), 7,95 (дд, 1Н), 7,85 (с, 1Н), 7,45 (м, 1Н), 7,25 (с, 1Н), 1,77 (с, 3Н).
Стадия F: Получение 2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-циано-8-метил-4H-3,1-бензоксазин-4-она
К раствору 2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-йод-8-метил-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии E бензоксазиноновогопродукта) (600 мг, 1,1 ммоль) в тетрагидрофуране (15 мл) при комнатной температуре последовательно добавляли йодид меди(I) (126 мг, 0,66 ммоль), тетракис(трифенилфосфин)палладий(0) (382 мг, 0,33 ммоль) и цианид меди(I) (800 мг, 8,8 ммоль). Затем реакционную смесь нагревали при кипении с обратным холодильником в течение ночи. Реакционная смесь становилась черной, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Реакционную смесь разбавляли этилацетатом (20 мл) и фильтровали через Celite®, затем трижды промывали 10% водным раствором бикарбоната натрия и один раз соляным раствором. Органический экстракт сушили (MgSO4) и концентрировали при пониженном давлении с получением 440 мг указанного в заголовке соединения в виде неочищенного желтого твердого вещества.
1Н ЯМР (CDCl3): δ 8,55 (м, 1Н), 8,31 (д, 1Н), 7,96 (дд, 1Н), 7,73 (с, 1Н), 7,51 (м, 1Н), 7,31 (с, 1Н), 1,86 (с, 3Н).
Стадия G: Получение 3-бром-1-(3-хлор-2-пиридинил)-N-[4-циано-2-метил-6-[(метиламино)карбонил]фенил]-1Н-пиразол-5-карбоксамида
К раствору 2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-циано-8-метил-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии F цианобензоксазиноновогопродукта) (100 мг, 0,22 ммоль) в тетрагидрофуране (5 мл) по каплям добавляли метиламин (2,0M раствор в THF, 0,5 мл, 1,0 ммоль), перемешивали реакционную смесь в течение 5 минут, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Растворитель (тетрагидрофуран) выпаривали при пониженном давлении и очищали твердый остаток хроматографией на силикагеле с получением указанного в заголовке соединения по настоящему изобретению в виде белого твердого вещества (41 мг), которое разлагалось в установке для плавления при температуре свыше 180°C.
1Н ЯМР (CDCl3): δ 10,55 (с, 1Н), 8,45 (дд, 1Н), 7,85 (дд, 1Н), 7,57 (с, 2Н), 7,37 (м, 1Н), 7,05 (с, 1Н), 6,30 (д, 1Н), 2,98 (д, 3Н), 2,24 (с, 3Н).
Пример 6
Получение 3-бром-1-(3-хлор-2-пиридинил)-N-[4-циано-2-метил-6-(аминокарбонил)фенил]-1H-пиразол-5-карбоксамида
К раствору 2-[3-бром-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-циано-8-метил-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии F примера 5 цианобензоксазиноновогопродукта) (100 мг, 0,22 ммоль) в тетрагидрофуране (5 мл) при комнатной температуре по каплям добавляли гидроксид аммония (0,5 мл, 12,8 ммоль). Затем реакционную смесь перемешивали в течение 5 минут, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Растворитель (тетрагидрофуран) выпаривали при пониженном давлении и очищали твердый остаток хроматографией на силикагеле с получением указанного в заголовке соединения по настоящему изобретению в виде белого твердого вещества (36 мг) с т.пл. свыше 255°C.
1Н ЯМР (CDCl3): δ 10,52 (с, 1Н), 8,45 (дд, 1Н), 7,85 (дд, 1Н), 7,65 (с, 1Н), 7,60 (с, 1Н), 7,40 (м, 1Н), 7,05 (с, 1Н), 6,20 (уш.с, 1Н), 5,75 (уш.с, 1Н), 2,25 (с, 3Н).
Пример 7
Получение 3-хлор-1-(3-хлор-2-пиридинил)-N-[2-хлор-4-циано-6-[(метиламино)карбонил]фенил]-1Н-пиразол-5-карбоксамида
Стадия A: Получение 2-амино-3-хлор-5-йодбензойной кислоты
К раствору 2-амино-3-хлорбензойной кислоты (Aldrich, 5 г, 29,1 ммоль) в N,N-диметилформамиде (30 мл) добавляли N-йодсукцинимид (5,8 г, 26 ммоль) и нагревали реакционную смесь при 60°C в течение ночи. Нагревание удаляли, а затем медленно вливали реакционную смесь в воду со льдом (100 мл) с выпадением в осадок светло-коричневого твердого вещества. Твердое вещество фильтровали, промывали четыре раза водой и сушили в вакуумной печи при 70°C в течение ночи. Выделяли требуемый промежуточный продукт в виде светло-коричневого твердого вещества (7,2 г).
1Н ЯМР (ДМСО-d): δ 7,96 (д, 1Н), 7,76 (т, 1Н).
Стадия B: Получение 8-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1H-пиразол-5-ил]-6-йод-4H-3,1-бензоксазин-4-она
К раствору метансульфонилхлорида (0,31 мл, 4,07 ммоль) в ацетонитриле (10 мл) при 0°C по каплям добавляли смесь 3-хлор-1-(3-хлор-2-пиридинил)-1H-пиразол-5-карбоновой кислоты (т.е. полученного на стадии D примера 3 продукта на основе карбоновой кислоты) (1,0 г, 3,87 ммоль) и триэтиламина (0,54 мл, 3,87 ммоль) в ацетонитриле (5 мл). Затем реакционную смесь перемешивали в течение 15 минут при 0°C. Затем добавляли 2-амино-3-хлор-5-йодбензойную кислоту (т.е. полученный на стадии A продукт) (1,15 г, 3,87 ммоль) и продолжали перемешивание в течение дополнительных 5 минут. Затем по каплям добавляли раствор триэтиламина (1,08 мл, 7,74 ммоль) в ацетонитриле (5 мл), поддерживая температуру ниже 5°C. Реакционную смесь перемешивали в течение 40 минут при 0°C, а затем добавляли метансульфонилхлорид (0,31 мл, 4,07 ммоль). Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение ночи. Затем реакционную смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (3x50 мл). Объединенные этилацетатные экстракты последовательно промывали 10% водным раствором бикарбоната натрия (1x20 мл) и соляным раствором (1x20 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Твердый остаток очищали хроматографией на силикагеле с получением 575 мг указанного в заголовке соединения в виде неочищенного желтого твердого вещества.
1Н ЯМР (CDCl3): δ 8,55 (кв, 1Н), 8,39 (д, 1Н), 8,04 (д, 1Н), 7,94 (дд, 1Н), 7,45 (м, 1Н), 7,19 (с, 1Н).
Стадия C: Получение 8-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-циано-4H-3,1-бензоксазин-4-она
К раствору 8-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-йод-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии B бензоксазиноновогопродукта) (575 мг, 1,1 ммоль) в тетрагидрофуране (15 мл) при комнатной температуре последовательно добавляли йодид меди(I) (840 мг, 0,44 ммоль), тетракис(трифенилфосфин)палладий(0) (255 мг, 0,22 ммоль) и цианид меди(I) (500 мг, 5,5 ммоль). Затем реакционную смесь нагревали при кипении с обратным холодильником в течение ночи. Реакционная смесь становилась черной, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Реакционную смесь разбавляли этилацетатом (20 мл) и фильтровали через Celite®, затем трижды промывали 10% водным раствором бикарбоната натрия и один раз соляным раствором. Органический экстракт сушили (MgSO4) и концентрировали при пониженном давлении с получением 375 мг указанного в заголовке соединения в виде неочищенного желтого твердого вещества.
1Н ЯМР (CDCl3): δ 8,55 (кв., 1Н), 8,36 (д, 1Н), 7,95 (м, 2Н), 7,5 (м, 1Н).
Стадия D: Получение 3-хлор-1-(3-хлор-2-пиридинил)-N-[2-хлор-4-циано-6-[(метиламино)карбонил]фенил]-1Н-пиразол-5-карбоксамида
К раствору 8-хлор-2-[3-хлор-1-(3-хлор-2-пиридинил)-1Н-пиразол-5-ил]-6-циано-4H-3,1-бензоксазин-4-она (т.е. полученного на стадии C цианобензоксазиноновогопродукта) (187 мг, 0,446 ммоль) в тетрагидрофуране (5 мл) по каплям добавляли метиламин (2,0M раствор в THF, 0,5 мл, 1,0 ммоль), перемешивали реакционную смесь в течение 5 минут, а проведение тонкослойной хроматографии на силикагеле в этот момент подтверждало завершение реакции. Растворитель (тетрагидрофуран) выпаривали при пониженном давлении, и очищали твердый остаток хроматографией на силикагеле с получением 49 мг указанного в заголовке соединения по настоящему изобретению в виде белого твердого вещества с т.пл.=197-200°C.
1Н ЯМР (CDCl3): δ 10,05 (уш.с, 1Н), 8,45 (кв, 1Н), 7,85 (дд, 1Н), 7,70 (д, 1Н), 7,59 (д, 1Н), 7,38 (м, 1Н), 7,02 (с, 1Н), 6,35 (д, 1Н), 2,94 (д, 3Н).
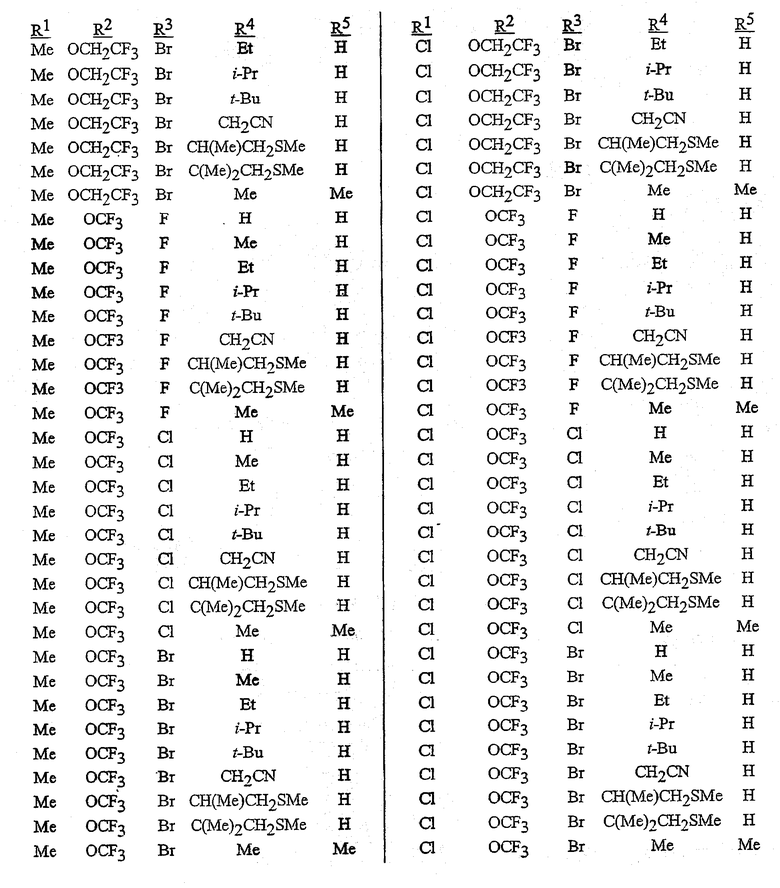
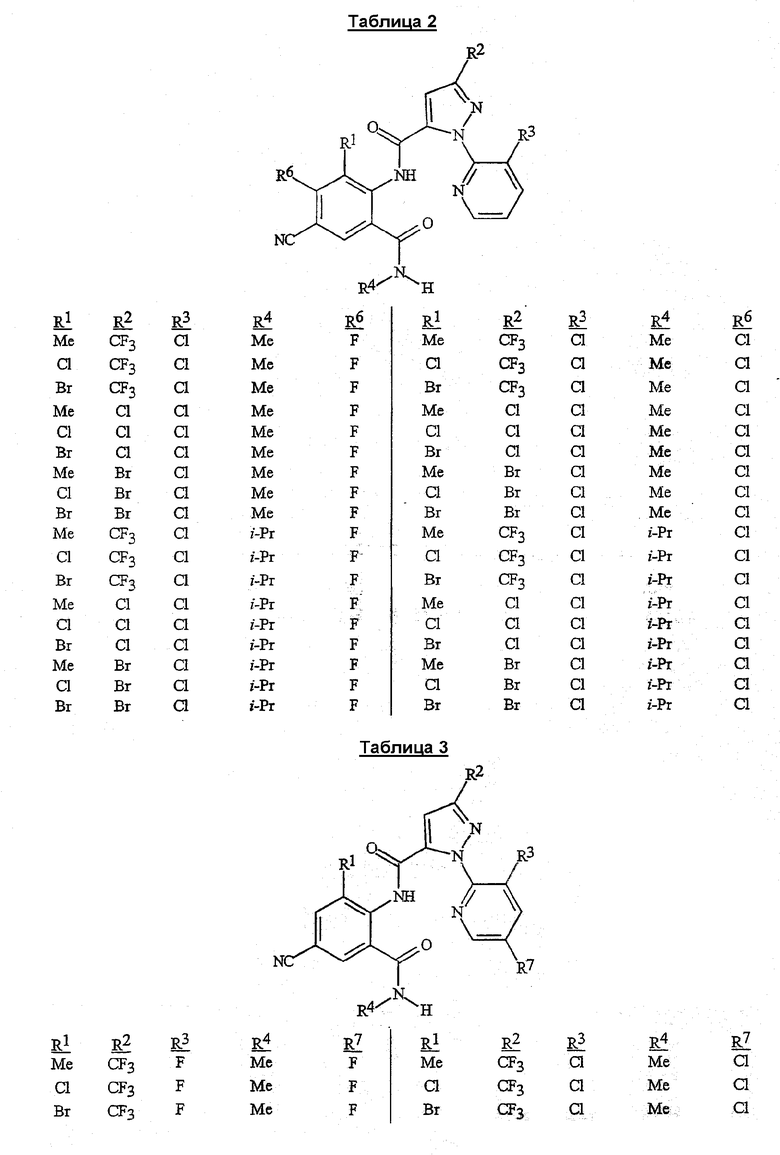
В сочетании с известными из уровня техники способами при помощи методик, описанных в этом документе, могут быть получены следующие соединения, представленные в таблице 1. В таблице используются следующие сокращения: «t» означает третичный, «s» означает вторичный, «n» означает нормальный, «i» означает изо-форму, «Me» означает метил, «Et» означает этил, «Pr» означает пропил, «i-Pr» означает изопропил, «Bu» означает бутил, и «CN» означает цианогруппу.




Композиция/Полезность
Соединения по настоящему изобретению, как правило, применяются в виде состава или композиции с носителем, подходящим для сельскохозяйственного или несельскохозяйственного применения и содержащим, по крайней мере, один из жидкого разбавителя, твердого разбавителя или поверхностно-активного вещества. Ингредиенты состава или композиции выбирают таким образом, чтобы они были совместимыми с физическими свойствами активного ингредиента, способом применения и факторами окружающей среды, таким как тип почвы, влажность и температура. Пригодные составы включают жидкости, такие как растворы (включая эмульгируемые концентраты), суспензии, эмульсии (включая микроэмульсии и/или суспензионные эмульсии) и тому подобное, которые необязательно могут быть загущены до состояния гелей. Пригодные составы включают твердые вещества, такие как присыпки, порошки, гранулы, шарики, таблетки, пленки и тому подобное, которые могут быть диспергируемыми в воде («способными впитывать влагу») или растворимыми в воде. Активный ингредиент может быть заключен в (микро)капсулу и дополнительно суспендирован или включен в твердый состав; альтернативно полный состав активного ингредиента может быть заключен в капсулу (или на него «нанесено покрытие»). Заключение в капсулу может контролировать или замедлять высвобождение активного ингредиента. Распыляемые композиции могут быть подходящим образом масштабированы и применяться в распыляемых объемах приблизительно от одного до нескольких сотен литров на гектар. Концентрированные композиции, прежде всего, применяются в качестве промежуточных продуктов для дальнейшего состава.
Композиции обычно содержат эффективные количества активного ингредиента, разбавитель и поверхностно-активное вещество в следующих приблизительных отношениях, которые составляют в сумме 100 мас.%.
Типичные твердые разбавители описаны в Watkins, et al., Handbook of Insecticide Dust Diluents and Carriers, 2nd Ed., Dorland Books, Caldwell, New Jersey. Типичные жидкие разбавители описаны в Marsden, Solvents Guide, 2nd Ed., Interscience, New York, 1950. В McCutcheon's Detergents and Emulsifiers Annual, Allured Publ. Corp., Ridgewood, New Jersey, а также в Sisely and Wood, Encyclopedia of Surface Active Agents, Chemical Publ. Co., Inc., New York, 1964, перечислены поверхностно-активные вещества и рекомендованные применения. Все композиции могут содержать незначительные количества добавок для снижения пенообразования, спекания, коррозии, роста микроорганизмов и тому подобное или загустители для увеличения вязкости.
Поверхностно-активные вещества включают, например, полиэтоксилированные спирты, полиэтоксилированные алкилфенолы, полиэтоксилированные сложные эфиры сорбитана и жирных кислот, диалкилсульфосукцинаты, алкилсульфаты, сульфонаты алкилбензола, органосиликоны, N,N-диалкилтаураты, сульфонаты лигнина, конденсаты сульфоната нафталина и формальдегида, поликарбоксилаты и полиоксиэтиленовые/полиоксипропиленовые блок-сополимеры. Твердые разбавители включают, например, глины, такие как бентонит, монтмориллонит, аттапульгит и каолин, крахмал, сахар, двуокись кремния, тальк, диатомовую землю, мочевину, карбонат кальция, карбонат и бикарбонат натрия и сульфат натрия. Жидкие разбавители включают, например, воду, N,N-диметилформамид, диметилсульфоксид, N-алкилпирролидон, этиленгликоль, пропиленгликоль, парафины, алкилбензолы, алкилнафталины, оливковое, касторовое, льняное, тунговое, кунжутное, кукурузное, арахисовое, хлопковое, соевое, рапсовое и кокосовое масла, сложные эфиры жирных кислот, кетоны, такие как циклогексанон, 2-гептанон, изофорон и 4-гидрокси-4-метил-2-пентанон, и спирты, такие как метанол, циклогексанол, деканол и тетрагидрофурфуриловый спирт.
Растворы, включая эмульгируемые концентраты, могут быть получены путем простого смешивания ингредиентов. Присыпки и порошки могут быть получены путем смешивания и обычно измельчения в молотковой мельнице или в струйной мельнице. Суспензии обычно получают путем влажного размола: см., например, патент США № 3060084. Гранулы и шарики могут быть получены путем распыления активного материала на предварительно отформованные гранулированные носители или по методам агломерации. См. Browning, "Agglomeration", Chemical Engineering, December 4, 1967, pp. 147-48, Perry's Chemical Engineer's Handbook, 4th Ed., McGraw-Hill, New York, 1963, pp. 8-57 и последующие и PCT Publication WO 91/13546. Шарики могут быть получены, как описано в патенте США № 4172714. Диспергируемые в воде и растворимые в воде гранулы могут быть получены, как раскрыто в патентах США №№ 4144050 и 3920442 и в патенте Германии № 3246493. Таблетки могут быть получены, как описано в патентах США № 5180587, 5232701 и 5208030. Пленки могут быть получены, как раскрыто в патенте Великобритании № 2095558 и в патенте США № 3299566.
Для дополнительной информации, касающейся области получения композиций, см. T.S. Woods, "The Formulator's Toolbox - Product Forms for Modern Agriculture" in Pesticide Chemistry and Bioscience, The Food-Environment Challenge, T. Brooks and T.R. Roberts, Eds., Proceedings of the 9th International Congress on Pesticide Chemistry, The Royal Society of Chemistry, Cambridge, 1999, pp. 120-133. См. также патент США № 3235361, от строки 16 колонки 6 до строки 19 колонки 7 и примеры 10-41; патент США № 3309192, от строки 43 колонки 5 до строки 62 колонки 7 и примеры 8, 12, 15, 39, 41, 52, 53, 58, 132, 138-140, 162-164, 166, 167 и 169-182; патент США № 2891855, от строки 66 колонки 3 до строки 17 колонки 5 и примеры 1-4; Klingman, Weed Control as a Science, John Wiley and Sons, Inc., New York, 1961, pp. 81-96; и Hance et al., Weed Control Handbook, 8th Ed., Blackwell Scientific Publications, Oxford, 1989.
В следующих примерах все проценты указаны по массе, а все композиции получали традиционными способами. Номера соединений соотносятся с соединениями в таблице индексов A.
Пример A (смачиваемый порошок)
Полиэтиленгликолевый простой эфир додецилфенола
Лигносульфонат натрия
Силикоалюминат натрия
Монтмориллонит (кальцинированный)
2,0%
4,0%
6,0%
23,0%
Пример B (гранула)
Пример C (отформованный выдавливанием шарик)
безводный сульфат натрия
неочищенный лигносульфонат кальция
алкилнафталинсульфонат натрия
кальций/магниевый бентонит
10,0%
5,0%
1,0%
59,0%
Пример D (эмульгируемый концентрат)
смесь растворимых в масле сульфонатов и полиоксиэтиленовых эфиров
изофорон
10,0%
70,0%
Пример E (гранула)
Целлюлоза
Лактоза
Кукурузная мука
2,5%
4,0%
93,0%
Соединения по настоящему изобретению характеризуются благоприятными типами продуктов распада в ходе метаболизма и/или в почве и обладают способностью бороться с рядом сельскохозяйственных и несельскохозяйственных беспозвоночных вредителей. Соединения по настоящему изобретению также характеризуются благоприятной листовой и/или почвенной системной доступностью в растениях, при которой наблюдается передвижение вещества в растении для защиты листвы и других частей растения, не вступающих в непосредственный контакт с инсектицидными композициями, содержащими соединения по настоящему изобретению. (В контексте раскрытия настоящего изобретения выражение «борьба с беспозвоночным вредителем» означает ингибирование развития беспозвоночного вредителя (включая гибель), которое вызывает значительное снижение поедания или другого вызываемого вредителем ущерба или повреждения; связанные выражения определяются аналогично). Используемый в раскрытии настоящего изобретения термин «беспозвоночный вредитель» включает в качестве вредителей важных с экономической точки зрения членистоногих, брюхоногих и нематоды. Термин «членистоногие» включает насекомых, клещей, паукообразных, скорпионов, сороконожек, многоножек, мокриц и сидячебрюхих. Термин «брюхоногие» включает улиток, слизней и других Stylommatophora. Термин «нематоды» включает всех гельминтов, таких как круглые черви, дирофиллярии и растительноядные нематоды (Nematoda), двуустки (Trematoda), Acanthocephala и ленточные черви (Cestoda). Специалисту в данной области техники следует понимать, что не все соединения в равной степени эффективны в отношении всех вредителей. Соединения по настоящему изобретению эффективны против важных с экономической точки зрения сельскохозяйственных и несельскохозяйственных вредителей. Термин «сельскохозяйственный» относится к производству полевых культур, применяемых для приема в пищу и производства волокон, и включает выращивание зерновых культур (например, пшеницы, овса, ячменя, ржи, риса, кукурузы), соевых бобов, овощных культур (например, салата-латук, капусты, томатов, бобов), картофеля, батата, винограда, хлопка и фруктовых плодовых культур (например, семечковых плодовых культур, косточковых плодовых культур и цитрусовых плодовых культур). Термин «несельскохозяйственный» относится к другим садоводческим культурам (например, лесным растениям, оранжерейным растениям, саженцам или декоративным растениям, не произрастающим в поле), дерну (коммерческому, для полей для гольфа, для применения близ жилых домов и мест отдыха и тому подобное), продуктам леса, здоровью людей (здравоохранению) и животных, внутренней структуре и торговым помещениям и сооружениям, домашнему хозяйству и связанным с хранением продуктов применениям или вредителям. Ввиду многообразия форм борьбы с беспозвоночными вредителями и экономической важности защита (от повреждения или ущерба, вызываемого беспозвоночными вредителями) сельскохозяйственных культур хлопка, кукурузы, соевых бобов, риса, овощных культур, картофеля, батата, виноградников и фруктовых деревьев путем борьбы с беспозвоночными вредителями является предпочтительными вариантами осуществления настоящего изобретения. Сельскохозяйственные и несельскохозяйственные вредители включают гусениц отряда Lepidoptera, таких как «походные черви», совки, пяденицы и гелиотины семейства Noctuidae (например, совка травяная (Spodoptera fugiperda J.E. Smith), совка малая (Spodoptera exigua Hübner), совка-ипсилон (Agrotis ipsilon Hufnagel), совка капустная (Trichoplusia ni Hübner), табачная листовертка (Heliothis virescens Fabricius)); сверлильщиков, чехликовых молей, выпускающих паутину гусениц, глобоидальных червяков, гусениц бабочки-капустницы и скелетирующих листья вредителей семейства Pyralidae (например, мотылек кукурузный (Ostrinia nubilalis Hübner), вредящая апельсинам Навель гусеница Amyelois transitella Walker, огневка Crambus caliginosellus Clemens, луговой мотылек (Herpetogramma licarsisalis Walker)); листоверток, листоверток-почкоедов, плодожорок и гусениц-вредителей плодов семейства Tortricidae (например, плодожорка яблонная (Cydia pomonella Linnaeus), листовертка виноградная (Endopiza viteana Clemens), плодожорка восточная персиковая (Grapholita molesta Busck)); и многих других важных с экономической точки зрения чешуекрылых (например, моль капустная (Plutella xylostella Linnaeus), розовый коробочный червь хлопчатника (Pectinophora gossypiella Saunders), непарный шелкопряд (Lymantria dispar Linnaeus)); нимф и взрослых особей отряда Blattodea, включая тараканов семейств Blattellidae и Blattidae (например, таракан черный (Blatta orientalis Linnaeus), азиатский таракан (Blatella asahinai Mizukubo), таракан рыжий (Blattella germanica Linnaeus), таракан Supella longipalpa Fabricius, таракан американский (Periplaneta americana Linnaeus), таракан Periplaneta brunnea Burmeister, таракан Leucophaea maderae Fabricius); поедающих листву гусениц и взрослых особей отряда Coleoptera, включая долгоносиков семейств Anthribidae, Bruchidae и Curculionidae (например, долгоносик хлопковый (Anthonomus grandis Boheman), долгоносик рисовый водяной (Lissorhoptrus oryzophilus Kuschel), долгоносик амбарный (Sitophilus granarius Linnaeus), долгоносик рисовый (Sitophilus oryzae Linnaeus)); огородных блошек, листоедов, повреждающих корни личинок, листогрызов, колорадских жуков и минирующих мушек семейства Chrysomelidae (например, колорадский жук (Leptinotarsa decemlineata Say), блошкаDiabrotica virgifera LeConte); жесткокрылых и других жуков семейства Scaribaeidae (например, хрущик японский (Popillia japonica Newman) и европейский хрущ (Rhizotrogus majalis Razoumowsky)); кожеедов семейства Dermestidae; проволочников семейства Elateridae; короедов семейства Scorytidae и хрущаков мучных семейства Tenebrionidae. В дополнение сельскохозяйственные и несельскохозяйственные вредители включают взрослых особей и личинок отряда Dermaptera, включая уховерток семейства Forficulidae (например, уховертка обыкновенная (Forficula auricularia Linnaeus), уховертка(Chelisoches morio Fabricius)); взрослых особей и нимф отрядов Hemiptera и Homoptera, таких как слепняки семейства Miridae, певчие цикады семейства Cicadidae, кобылочки (например, Empoasca spp.) семейства Cicadellidae, дельфациды семейств Fulgoroidae и Delphacidae, горбатки семейства Membracidae, настоящие листоблошки семейства Psyllidae, белокрылки семейства Aleyrodidae, настоящие тли семейства Aphididae, филлоксера семейства Phylloxeridae, мучнистые червецы семейства Pseudococcidae, червецы семейств Coccidae, Diaspididae и Margarodidae, клопы-кружевницы семейства Tingidae, щитники семейства Pentatomidae, клопы-наземники (например, Blissus spp.) и другие наземники семейства Lygaeidae, слюняницы семейства Cercopidae, клопы-ромбовики семейства Coreidae и красноклопы постельные и хлопковые семейства Pyrrhocoridae. Также в качестве сельскохозяйственных и несельскохозяйственных вредителей включены взрослые особи и личинки отряда Acari (клещи), такие как паутинные и красные клещики семейства Tetranychidae (например, клещ красный плодовый (Panonychus ulmi Koch), клещик паутинный двупятнистый (Tetranychus urticae Koch), клещик Tetranychus mcdanieli McGregor), плоские клещикисемейства Tenuipalpidae (например, цитрусовый плоский клещик(Brevipalpus lewisi McGregor)), галловые и почковые клещики семейства Eriophyidae и другие питающиеся листьями клещи и клещи, важные для здоровья человека и животного, т.е. пылевые клещи семейства Epidermoptidae, железницы семейства Demodicidae, зерновые клещи семейства Glycyphagidae, иксодовые клещи отряда Ixodidae, например, иксодовый клещ Ixodes scapularis Say, иксодовый клещIxodes holocyclus Neumann, иксодовый клещ изменчивый (Dermacentor variabilis Say), иксодовый клещ Amblyomma americanum Linnaeus и конские и чесоточные клещи семейств Psoroptidae, Pyemotidae и Sarcoptidae; взрослые и молодые особи отряда Orthoptera, включая кузнечиков, настоящих саранчовых и сверчков (например, кобылки (например, Melanoplus sanguinipes Fabricius, M. differentialis Thomas), саранчи американские (например, Schistocerca americana Drury), саранча пустынная (Schistocerca gregaria Forskal), саранча перелетная (Locusta migratoria Linnaeus), саранчи (Zonocerus spp.), сверчок домовой (Acheta domesticus Linnaeus), медведки (Gryllotalpa spp.)); взрослые и молодые особи отряда Diptera, включая молей минирующих, дергунов, пестрокрылок (Tephritidae), мушек шведских (например, Oscinella frit Linnaeus), личинок мух, мух комнатных (например, Musca domestica Linnaeus), мух комнатных малых (например, Fannia canicularis Linnaeus, F. femoralis Stein), жигалок обыкновенных (например, Stomoxys calcitrans Linnaeus), мух обыкновенных полевых, жигалок коровьих малых, мух мясных синих (например, Chrysomya spp., Phormia spp.) и других настоящих мух-вредителей, слепней (например, Tabanus spp.), оводов носоглоточных (например, Gastrophilus spp., Oestrus spp.), оводов бычьих (например, Hypoderma spp.), слепней оленьих (например, Chrysops spp.), кровососок овечьих (например, Melophagus ovinus Linnaeus) и других Brachycera, комаров кровососущих (например, Aedes spp., Anopheles spp., Culex spp.), мошек (например, Prosimulium spp., Simulium spp.), мокрецов, москитов, сциариди других Nematocera; взрослые и молодые особи отряда Thysanoptera, включая трипсов табачных (Thrips tabaci Lindeman), трипсов обыкновенных (Frankliniella spp.) и других питающихся листвой трипсов; насекомые вредители отряда Hymenoptera, включая муравьев (например, рыжий муравей-древоточец (Camponotus ferrugineus Fabricius), муравей-древоточец пенсильванский (Camponotus pennsylvanicus De Geer), фараонов муравей (Monomorium pharaonis Linnaeus), муравей огненный малый (Wasmannia auropunctata Roger), муравей огненный (Solenopsis geminata Fabricius), муравей огненный импортный красный (Solenopsis invicta Buren), муравей аргентинский (Iridomyrmex humilis Mayr), паратрехина (Paratrechina longicornis Latreille), муравей дерновый (Tetramorium caespitum Linnaeus), лазий светло-бурый (Lasius alienus Förster), муравей-ворTapinoma sessile Say), пчел (включая пчел-плотников), шершней, настоящих ос, роющих ос и настоящих пилильщиков (Neodiprion spp.; Cephus spp.); насекомые-вредители отряда Isoptera, включая термита желтоногого (Reticulitermes flavipes Kollar), термитаReticulitermes hesperus Banks, термита(Coptotermes formosanus Shiraki), термитаIncisitermes immigrans Snyder и других важных с экономической точки зрения термитов; насекомые-вредители отряда Thysanura, такие как чешуйница обыкновенная (Lepisma saccharina Linnaeus) и чешуйница домашняя (Thermobia domestica Packard); насекомые-вредители отряда Mallophaga, включая вошь головную (Pediculus humanus capitis De Geer), вошь платяную (Pediculus humanus humanus Linnaeus), пухоеда двухщетинкового куриного (Menacanthus stramineus Nitszch), пухоеда собачьего (Trichodectes canis De Geer), пухоеда куриного пестробрюхого (Goniocotes gallinae De Geer), вошь овечью (Bovicola ovis Schrank), вошь крупного рогатого скота коротконосую кровососущую (Haematopinus eurysternus Nitzsch), вошь крупного рогатого скота долгоносую кровососущую (Linognathus vituli Linnaeus) и других сосущих насекомых и пухоедов-вредителей, которые нападают на человека и животных; насекомые-вредители отряда Siphonoptera, включая блоху крысиную южную (Xenopsylla cheopis Rothschild), блоху кошачью (Ctenocephalides felis Bouche), блоху собачью (Ctenocephalides canis Curtis), блоху куриную (Ceratophyllus gallinae Schrank), блоху присасывающуюся (Echidnophaga gallinacea Westwood), блоху человеческую (Pulex irritans Linnaeus) и другие блохи, беспокоящие млекопитающих и птиц. Дополнительные охваченные беспозвоночные вредители включают пауков отряда Araneae, таких как коричневый паук-затворник (Loxosceles reclusa Gertsch & Mulaik) и паук «черная вдова» (Latrodectus mactans Fabricius), и сороконожек отряда Scutigeromorpha, таких как мухоловка обыкновенная (Scutigera coleoptrata Linnaeus). Соединения по настоящему изобретению также активны в отношении представителей классов Nematoda, Cestoda, Trematoda и Acanthocephala, включая важных с экономической точки зрения представителей отрядов Strongylida, Ascaridida, Oxyurida, Rhabditida, Spirurida и Enoplida, таких как без ограничения важные с экономической точки зрения сельскохозяйственные вредители (т.е. яванская галловая, нематоды рода Meloidogyne, нематоды рода Pratylenchus, нематоды рода Trichodorus и так далее) и наносящие вред здоровью животного и человека вредители (т.е. все важные с экономической точки зрения глисты, ленточные черви и круглые черви, такие как Strongylus vulgaris у лошадей, Toxocara canis у собак, Haemonchus contortus у овец, Dirofilaria immitis Leidy у собак, Anoplocephala perfoliata у лошадей, Fasciola hepatica Linnaeus у жвачных животных и так далее).
Соединения по настоящему изобретению обладают особенно высокой эффективностью в отношении вредителей отряда Lepidoptera (например, Alabama argillacea Hübner (гусеница совки хлопковой американской), Archips argyrospila Walker (листовертка плодовых деревьев), A. rosana Linnaeus (листовертка резаная) и другие виды Archips, Chilo suppressalis Walker (сверлильщик рисовый стеблевой), Cnaphalocrosis medinalis Guenee (листовертка рисовая), Crambus caliginosellus Clemens (огневка), Crambus teterrellus Zincken (огневка), Cydia pomonella Linnaeus (плодожорка яблонная), Earias insulana Boisduval (шиповатый червь), Earias vittella Fabricius (коробочный червь), Helicoverpa armigera Hübner (совка хлопковая), Helicoverpa zea Boddie (совка хлопковая коробочная), Heliothis virescens Fabricius (совка табачная), Herpetogramma licarsisalis Walker (луговой мотылек), Lobesia botrana Denis & Schiffermüller (листовертка гроздевая), Pectinophora gossypiella Saunders (розовый коробочный червь хлопчатника), Phyllocnistis citrella Stainton (моль цитрусовая), Pieris brassicae Linnaeus (белянка капустная), Pieris rapae Linnaeus (белянка репная), Plutella xylostella Linnaeus (моль капустная), Spodoptera exigua Hübner (совка малая), Spodoptera litura Fabricius (совка табачная, гусеница озимой совки, совка египетская хлопковая), Spodoptera frugiperda J.E. Smith (совка травяная), Trichoplusia ni Hübner (совка ни) и Tuta absoluta Meyrick (моль томатная)). Соединения по настоящему изобретению также обладают значительной с коммерческой точки зрения эффективностью в отношении представителей отряда Homoptera, включая Acyrthisiphon pisum Harris (тля гороховая), Aphis craccivora Koch (тля люцерновая), Aphis fabae Scopoli (тля бобовая), Aphis gossypii Glover (тля хлопковая, тля бахчевая), Aphis pomi De Geer (тля яблоневая), Aphis spiraecola Patch (тля таволговая), Aulacorthum solani Kaltenbach (тля картофельная обыкновенная), Chaetosiphon fragaefolii Cockerell (тля земляничная американская), Diuraphis noxia Kurdjumov/Mordvilko (тля злаковая русская), Dysaphis plantaginea Paaserini (тля яблоневая розовая), Eriosoma lanigerum Hausmann (тля яблоневая кровяная), Hyalopterus pruni Geoffroy (тля мучнистая сливовая), Lipaphis erysimi Kaltenbach (тля горчичная листовая), Metopolophium dirrhodum Walker (тля большая злаковая), Macrosipum euphorbiae Thomas (тля картофельная листовая), Myzus persicae Sulzer (тля картофельно-персиковая, тля персиковая зеленая), Nasonovia ribisnigri Mosley (тля цикориево-смородинная), Pemphigus spp. (тли корневые и тли галловые), Rhopalosiphum maidis Fitch (тля кукурузная листовая), Rhopalosiphum padi Linnaeus (тля черемуховая обыкновенная), Schizaphis graminum Rondani (тля злаковая обыкновенная), Sitobion avenae Fabricius (тля злаковая), Therioaphis maculata Buckton (тля клеверная), Toxoptera aurantii Boyer de Fonscolombe (тля чайная) и Toxoptera citricida Kirkaldy (тля цитрусовая); Adelges spp. (хермесов); Phylloxera devastatrix Pergande (филлоксеры гикори); Bemisia tabaci Gennadius (белокрылки табачной, белокрылки бататовой), Bemisia argentifolii Bellows & Perring (белокрылки), Dialeurodes citri Ashmead (белокрылки цитрусовой) и Trialeurodes vaporariorum Westwood (белокрылки тепличной); Empoasca fabae Harris (цикадки картофельной), Laodelphax striatellus Fallen (цикадки темной), Macrolestes quadrilineatus Forbes (цикадки), Nephotettix cinticeps Uhler (цикадки зеленой), Nephotettix nigropictus Stål (цикадка рисовая), Nilaparvata lugens Stål (дельфацида), Peregrinus maidis Ashmead (цикады кукурузной), Sogatella furcifera Horvath (дельфацида), Sogatodes orizicola Muir (дельфацида рисового), Typhlocyba pomaria McAtee (цикадки яблонной), Erythroneoura spp. (цикадок виноградных); Magicidada septendecim Linnaeus (цикады); Icerya purchasi Maskell (червеца австралийского желобчатого), Quadraspidiotus perniciosus Comstock (щитовки калифорнийской); Planococcus citri Risso (червеца виноградного мучнистого); Pseudococcus spp. (других червецов мучнистых); Cacopsylla pyricola Foerster (медянницы грушевой), Trioza diospyri Ashmead (листоблошки хурмовой). Эти соединения также обладают эффективностью в отношении представителей отряда Hemiptera, включая Acrosternum hilare Say (клоп-щитник зеленый), Anasa tristis De Geer (клоп-ромбовик печальный), Blissus leucopterus leucopterus Say (клоп-черепашка пшеничный североамериканский), Corythuca gossypii Fabricius (клоп хлопковый), Cyrtopeltis modesta Distant (клоп), Dysdercus suturellus Herrich-Schäffer (красноклоп хлопковый), Euchistus servus Say (клоп-щитник коричневый), Euchistus variolarius Palisot de Beauvois (клоп-щитник), Graptosthetus spp. (ряд наземников), Leptoglossus corculus Say (клоп-наземник), Lygus lineolaris Palisot de Beauvois (клоп травяной), Nezara viridula Linnaeus (клоп хлопково-огородный), Oebalus pugnax Fabricius (клоп), Oncopeltus fasciatus Dallas (клоп молочайный большой), Pseudatomoscelis seriatus Reuter (клоп). Другими отрядами насекомых, численность которых регулируется соединениями по настоящему изобретению, являются Thysanoptera (например, Frankliniella occidentalis Pergande (трипс), Scirthothrips citri Moulton (трипс цитрусовый), Sericothrips variabilis Beach (трипс) и Thrips tabaci Lindeman (трипс табачный); отряд Coleoptera (например, Leptinotarsa decemlineata Say (жук колорадский), жук Epilachna varivestis Mulsant и проволочники родов Agriotes, Athous или Limonius).
Для получения многокомпонентного пестицида, обладающего еще более широким спектром сельскохозяйственного или несельскохозяйственного применения, соединения по настоящему изобретению также могут быть смешаны с одним или несколькими другими биологически активными соединениями или средствами, включая инсектициды, фунгициды, нематоциды, антибактериальные средства, акарициды, регуляторы роста, такие как стимуляторы образования корня, хемостерилизаторы, семиохимикаты, средства для отпугивания насекомых, аттрактанты, феромоны, стимуляторы питания, другие биологически активные соединения или энтомопатогенные бактерии, вирусы или грибы. Поэтому настоящее изобретение также относится к композиции, содержащей биологически эффективное количество соединения формулы 1 и эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или средства, и может дополнительно содержать, по крайней мере, один из: поверхностно-активного вещества, твердого разбавителя или жидкого разбавителя. Примерами биологически активных соединений или средств, которые могут быть включены в один состав с соединениями по настоящему изобретению, являются: инсектициды, такие как абамектин, ацефат, ацетамиприд, ацетопрол, амидофлумет (S-1955), авермектин, азадирахтин, азинфос-метил, бифентрин, бифеназат, бистрифлурон, бупрофезин, карбофуран, хлорфенапир, хлорфлуазурон, хлорпирифос, хлорпирифос-метил, хромафенозид, клотианидин, цифлутрин, бета-цифлутрин, цигалотрин, лямбда-цигалотрин, циперметрин, циромазин, дельтаметрин, диафентиурон, диазинон, дифлубензурон, диметоат, динотефуран, диофенолан, эмамектин, эндосульфан, эсфенвалерат, этипрол, фенотикарб, феноксикарб, фенпропатрин, фенвалерат, фипронил, флоникамид, флуцитринат, тау-флувалинат, флуфенерин (UR-50701), флуфеноксурон, гамма-халотрин, галофенозид, гексафлумурон, имидаклоприд, индоксакарб, изофенфос, луфенурон, малатион, метальдегид, метамидофос, метидатион, метомил, метопрен, метоксихлор, метоксифенозид, метофлутрин, монокротофос, новалурон, новифлумурон (XDE-007), оксамил, паратион, паратион-метил, перметрин, форат, фозалон, фосмет, фосфамидон, пиримикарб, профенофос, профлутрин, протрифенбут, пиметрозин, пиридалил, пирипроксифен, ротенон, S1812 (Валент) спиносад, спиромезифен (BSN 2060), сульпрофос, тебуфенозид, тефлубензурон, тефлутрин, тербуфос, тетрахлорвинфос, тиаклоприд, тиаметоксам, тиодикарб, тиосультап-натрий, толфенпирад, тралометрин, трихлорфон и трифлумурон; фунгициды, такие как ацибензолар, S-метил, азоксистробин, беналази-M, бентиаваликарб, беномил, бластицидин-S, бордоская жидкость (трехосновный сульфат меди), боскалид, бромуконазол, бутиобат, карпропамид, каптафол, каптан, карбендазим, хлоронеб, хлороталонил, клотримазол, оксихлорид меди, соли меди, цимоксанил, циазофамид, цифлуфенамид, ципроконазол, ципродинил, диклоцимет, дикломезин, диклоран, дифеноконазол, диметоморф, димоксистробин, диниконазол, диниконазол-M, додин, эдифенфос, эпоксиконазол, этабоксам, фамоксадон, фенаримол, фенбуконазол, фенгексамид, феноксанил, фенпиклонил, фенпропидин, фенпропиморф, ацетат фенетина, гидроксид фенетина, флуазинам, флудиоксонил, флуморф, флуоксастробин, флухиноконазол, флусилазол, флутоланил, флутриафол, фолпет, фозетил-алюминий, фуралаксил, фураметапир, гуазатин, гексаконазол, гимексазол, имазалил, имибенконазол, иминоктадин, ипконазол, ипробенфос, ипродион, ипроваликарб, изоконазол, изопротиолан, касугамицин, крезоксим-метил, манкозеб, манеб, мефеноксам, мепанапирим, мепронил, металаксил, метконазол, метоминостробин/феноминостробин, метрафенон, миконазол, миклобутанил, нео-азозин (метанарсонат железа(III)), нуаримол, оризастробин, оксадиксил, окспоконазол, пенконазол, пенцикурон, пикобензамид, пикоксистробин, пробеназол, прохлораз, пропамокарб, пропиконазол, прохиназид, протиоконазол, пираклостробин, пириметанил, пирифенокс, пирохилон, хиноксифен, силтиофам, симеконазол, сипконазол, спироксамин, сера, тебуконазол, тетраконазол, тиадинил, тиабендазол, тифлузамид, тиофанат-метил, тирам, толилфлуанид, триадимефон, триадименол, триаримол, трициклазол, трифлоксистробин, трифлумизол, трифорин, тритиконазол, униконазол, валидамицин, винклозолин и зоксамид; нематоциды, такие как алдикарб, оксамил и фенамифос; антибактериальные средства, такие как стрептомицин; акарициды, такие как амитраз, хинометионат, хлорбензилат, цигексатин, дикофол, диенохлор, этоксазол, феназаквин, фенбутатиноксид, фенпропатрин, фенпироксимат, гекситиазокс, пропаргит, пиридабен и тебуфенпирад; и биологические средства, такие как Bacillus thuringiensis, включая ssp. aizawai и kurstaki, дельта-эндотоксин Bacillus thuringiensis, бакуловирус и энтомопатогенные бактерии, вирусы и грибы. Соединения по настоящему изобретению и содержащие их композиции могут применяться в отношении генетически трансформированных растений, способных экспрессировать белки, токсичные для беспозвоночных вредителей (такие как токсин Bacillus thuringiensis). Эффект введенных извне соединений для борьбы с беспозвоночными вредителями по настоящему изобретению может быть синергичным с действием эспрессируемых белков-токсинов.
Общей ссылкой для указанных сельскохозяйственных защитных средств является The Pesticide Manual, 12th Edition, C.D.S. Tornlin, Ed., British Crop Protection Council, Farnham, Surrey, U.K., 2000.
Предпочтительные инсектициды и акарициды для смешивания с соединениями по настоящему изобретению включают пиретроиды, такие как ацетамиприд, циперметрин, цигалотрин, цифлутрин, бета-цифлутрин, эсфенвалерат, фенвалерат и тралометрин; карбаматы, такие как фенотикарб, метил, оксамил и тиодикарб; неоникотиноиды, такие как клотианидин, имидаклоприд и тиаклоприд; блокаторы нейрональных натриевых каналов, такие как индоксакарб; обладающие инсектицидным действием макроциклические лактоны, такие как спиносад, абамектин, авермектин и эмамектин; антагонисты γ-аминомасляной кислоты (ГАМК), такие как эндосульфан, этипрол и фипронил; обладающие инсектицидным действием мочевины, такие как флуфеноксурон и трифлумурон; имитаторы ювенильных гормонов, такие как диофенолан и пирипроксифен; пиметрозин; и амитраз. Предпочтительные биологические средства для смешивания с соединениями по настоящему изобретению включают Bacillus thuringiensis и дельта-эндотоксин Bacillus thuringiensis, а также природные и генетически модифицированные вирусные инсектициды, включая представителей семейства Baculoviridae, а также насекомоядные грибы.
Наиболее предпочтительные смеси включают смесь соединения по настоящему изобретению с цигалотрином; смесь соединения по настоящему изобретению с бета-цифлутрином; смесь соединения по настоящему изобретению с эсфенвалератом; смесь соединения по настоящему изобретению с метомилом; смесь соединения по настоящему изобретению с имидаклопридом; смесь соединения по настоящему изобретению с тиаклопридом; смесь соединения по настоящему изобретению с индоксакарбом; смесь соединения по настоящему изобретению с абамектином; смесь соединения по настоящему изобретению с эндосульфаном; смесь соединения по настоящему изобретению с этипролом; смесь соединения по настоящему изобретению с фипронилом; смесь соединения по настоящему изобретению с флуфеноксуроном; смесь соединения по настоящему изобретению с пирипроксифеном; смесь соединения по настоящему изобретению с пиметрозином; смесь соединения по настоящему изобретению с амитразом; смесь соединения по настоящему изобретению с Bacillus thuringiensis aizawai или Bacillus thuringiensis kurstaki и смесь соединения по настоящему изобретению с дельта-эндотоксином Bacillus thuringiensis.
В определенных случаях комбинации с другими соединениями или средствами для борьбы с беспозвоночными вредителями, обладающими сходным спектром действия, но различающимися по способу действия, особенно благоприятны для регулирования устойчивости к действию соединения по настоящему изобретению. Поэтому композиции по настоящему изобретению могут дополнительно содержать биологически эффективное количество, по крайней мере, одного дополнительного соединения или средства для борьбы с беспозвоночными вредителями, обладающего сходным спектром действия, но различающегося по способу действия. Контактирование генетически модифицированного растения, экспрессирующего защищающее растение соединение (например, белок), или части растения с биологически эффективным количеством соединения по настоящему изобретению может также расширять спектр защиты растения и быть благоприятным для регулирования устойчивости к действию соединения по настоящему изобретению.
Борьба с беспозвоночными вредителями при сельскохозяйственных и несельскохозяйственных применениях осуществляется путем нанесения эффективного количества одного или нескольких соединений по настоящему изобретению на окружающую вредителей среду, включая сельскохозяйственный и/или несельскохозяйственный участок заражения, на требующий защиты участок или непосредственно на вредителей, с которыми ведется борьба. Поэтому настоящее изобретение дополнительно относится к способу борьбы с беспозвоночными при сельскохозяйственных и/или несельскохозяйственных применениях, включающему контактирование беспозвоночных или окружающей их среды с биологически эффективным количеством одного или нескольких соединений по настоящему изобретению или с композицией, содержащей эффективное количество, по крайней мере, одного из таких соединений и эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или средства. Примеры подходящих композиций, содержащих соединение по настоящему изобретению и эффективное количество, по крайней мере, одного дополнительного биологически активного соединения или средства, включают гранулированные композиции, в которых дополнительное биологически активное соединение содержится в той же грануле, что и соединение по настоящему изобретению, или в гранулах, отделенных от содержащих соединение по настоящему изобретению гранул.
Предпочтительным способом контакта является распыление. Альтернативно, гранулированная композиция, содержащая соединение по настоящему изобретению, может быть нанесена на листья растения или на почву. Соединения по настоящему изобретению могут также эффективно доставляться через поглощение растением содержащей соединение по настоящему изобретению композиции, происходящее при их контакте при нанесении пропитывающей почву жидкой композиции, при нанесении на почву гранулированной композиции, при обработке питомника или дезинфекции саженцев. Соединения также эффективны при местном нанесении композиции, содержащей соединение по настоящему изобретению, на участок заражения. Другие способы контакта включают нанесение соединения или композиции по настоящему изобретению путем прямого распыления и распыления на основе вытеснения пропеллентом, путем распыления с воздуха, в виде гелей, путем дражирования семян, микрокапсулирования, системного потребления, в виде приманок, ушных сережек, болюсов, распылителей, фумигантов, аэрозолей, порошков и многих других. Соединениями по настоящему изобретению могут также пропитываться материалы, применяемые для производства устройств для борьбы с беспозвоночными (например, противомоскитная сетка).
Соединение по настоящему изобретению может быть включено в состав композиции для приманки, которая потребляется беспозвоночным вредителем, или применяться в устройствах, таких как ловушки, стационарные ловушки и тому подобное. Такие композиции для приманки могут находиться в форме гранул, которые содержат (a) активный ингредиент, а именно соединение формулы 1, его N-оксид или соль, (b) одно или несколько питательных веществ, (c) необязательно аттрактант и (d) необязательно одно или несколько смачивающих средств. Раскрыты гранулы или композиции для приманки, содержащие приблизительно 0,001-5% активного ингредиента, приблизительно 40-99% питательного вещества и/или аттрактанта и необязательно приблизительно 0,05-10% смачивающих средств. Эти гранулы или композиции для приманки эффективны в борьбе с почвенными беспозвоночными вредителями в очень малых наносимых дозах, особенно в дозах активного ингредиента, которые являются летальными при поедании вместо прямого нанесения. Раскрыты некоторые питательные вещества, которые могут выступать и в качестве источника пищи, и в качестве аттрактанта. Питательные вещества включают углеводы, белки и липиды. Примерами питательных веществ являются овощная мука, сахар, крахмалы, животные жиры, растительное масло, экстракты из дрожжей и сухие вещества молока. Примерами аттрактантов являются пахучие и ароматические вещества, такие как экстракты из фруктов и растений, отдушки и другие компоненты растительного и животного происхождения, феромоны, и другие известные агенты, привлекающие требуемого беспозвоночного вредителя. Примерами смачивающих средств, т.е. сохраняющих влагу агентов, являются гликоли и другие многоатомные спирты, глицерин и сорбит. Раскрыта композиция для приманки (и способ применения такой композиции), применяемая для борьбы с беспозвоночными вредителями, включая, отдельно или в сочетаниях, муравьев, термитов и тараканов. Устройство для борьбы с беспозвоночными вредителями может включать композицию для приманки по настоящему изобретению и приспособленную для заполнения ею оболочку, которая имеет, по крайней мере, одно отверстие с достаточным для проникновения через него беспозвоночного вредителя размером, а беспозвоночный вредитель получает, таким образом, доступ извне к композиции для приманки, и где оболочка дополнительно приспособлена для размещения внутри или около места потенциальной или известной активности беспозвоночного вредителя.
Соединения по настоящему изобретению могут наноситься в чистом виде, но обычно наносятся в виде композиции, содержащей одно или несколько соединений вместе с подходящими носителями, разбавителями и поверхностно-активными веществами, и возможно в сочетании с пищей в зависимости от предполагаемого конечного назначения. Предпочтительный способ нанесения включает распыление водной дисперсии соединений или раствора соединений в рафинированном масле. Комбинации с инсектицидными маслами, концентратами инсектицидных масел, поверхностно-активными веществами, адъювантами, другими растворителями и синергически действующими средствами, такими как пиперонилбутоксид, обычно усиливают эффективность соединения. При несельскохозяйственном применении такие распыления могут производиться из аэрозольных контейнеров, таких как жестяной баллон, бутыль или другая емкость, или посредством накачивания, или путем высвобождения из герметизированного контейнера, например, аэрозольной тары. Такие распыляемые композиции могут принимать различные формы, например, распыленных жидкостей, мелкокапельных дымок, пен, паров или тумана. Поэтому такие распыляемые композиции могут дополнительно содержать пропелленты, пенообразователи, и так далее, в зависимости от обстоятельств. Раскрыта распыляемая композиция, содержащая соединение или композицию по настоящему изобретению и пропеллент. Примеры пропеллентов включают без ограничения метан, этан, пропан, изопропан, бутан, изобутан, бутен, пентан, изопентан, неопентан, пентен, гидрофторуглероды, хлорфторуглероды, диметиловый эфир и смеси представленных выше соединений. Раскрыта распыляемая композиция (и способ применения такой распыляемой композиции, освобождаемой из аэрозольного контейнера), применяемая для борьбы с беспозвоночным вредителем, включая, по отдельности или в сочетаниях, настоящих комаров, мошек, настоящих мух, оленьих мух, слепней, роющих ос, настоящих ос, шершней, клещей, пауков, муравьев, гнуса и тому подобное.
Норма применения, требуемая для эффективной борьбы (т.е. «биологически эффективное количество») зависит от таких факторов, как виды беспозвоночных, с которыми ведется борьба, жизненный цикл вредителя, жизненная стадия, его размер, расположение, время года, растение-носитель или животное-носитель, пищевое поведение, брачное поведение, влажность окружающей среды, температура и тому подобное. В обычных условиях норма применения приблизительно от 0,01 до 2 кг активного ингредиента на гектар является достаточной для борьбы с вредителями в агрономических экосистемах, хотя эффективными могут оказаться всего 0,0001 кг/гектар, а могут потребоваться и почти 8 кг/гектар. При несельскохозяйственных применениях эффективные нормы применения колеблются приблизительно от 1,0 до 50 мг/м2, хотя эффективными могут оказаться всего 0,1 мг/м2, а могут потребоваться и почти 150 мг/м2. Специалист в данной области техники легко способен определить биологически эффективное количество, необходимое для требуемого уровня борьбы с беспозвоночными вредителями.
Последующие тесты демонстрируют эффективность соединений по настоящему изобретению для борьбы с конкретными вредителями. «Эффективность для борьбы» представляет собой ингибирование развития беспозвоночного вредителя (включая гибель), которое обуславливает значительно меньшее поедание. Однако борьба с вредителями при помощи соединений по настоящему изобретению не ограничивается этими видами. Для описания соединения смотри таблицы индексов A, B и C. В таблицах индексов применяются следующие сокращения: «i» означает изо-форму, «t» означает третичный, «Me» означает метил, «Et» означает этил, «Pr» означает пропил, «i-Pr» означает изопропил, «c-Pr» означает циклопропил, «Bu» означает бутил, и «CN» означает цианогруппу. Сокращение «Пр.» означает пример, и за ним следует номер, указывающий пример получения соединения.



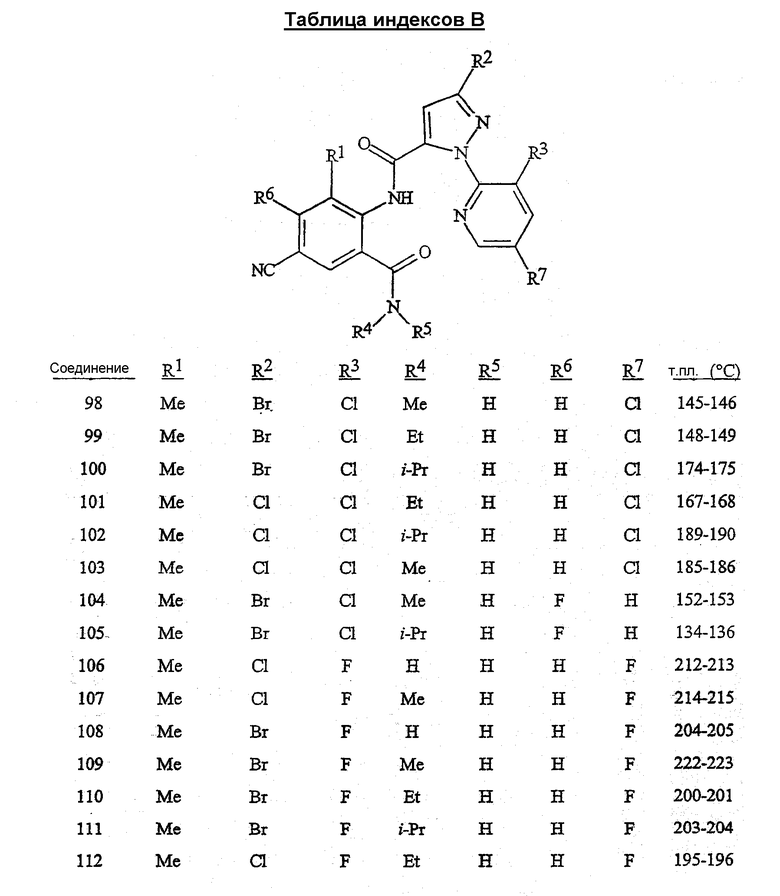
БИОЛОГИЧЕСКИЕ ПРИМЕРЫ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Тест A
Предназначенный для оценки эффективности борьбы с молью капустной (Plutella xylostella) образец для испытаний состоял из небольшого открытого контейнера с 12-14-суточными саженцами редиса внутри. Образец для испытаний предварительно заражали 10-15 новорожденными гусеницами на кусочке корма для насекомых, используя пробоотборник для удаления массы с кусочка затвердевшего корма для насекомых, на котором росло множество насекомых, и путем переноса массы, содержащей гусениц и корм. По мере высыхания корма в массе гусеницы перемещались на тестируемый саженец.
Приготавливали состав, состоящий из тестируемых соединений и раствора, содержащего 10% ацетона, 90% воды и 300 миллионных долей неионогенного поверхностно-активного вещества X-77® Spreader Lo-Foam Formula (Loveland Industries, Inc. Greeley, Colorado, USA), содержащего алкиларилполиоксиэтилен, свободные жирные кислоты, гликоли и изопропанол. Содержащие тестируемые соединения составы наносили в 1 мл жидкости через форсунку SUJ2 на основном корпусе 1/8 JJ (Spraying Systems Co. Wheaton, Illinois, USA), расположенную в 1,27 см (0,5 дюйма) над верхом каждого образца для испытания. Все экспериментальные соединения в этих тестах распыляли в количестве 50 миллионных долей в трех повторах. После распыления содержащего тестируемое соединение состава каждому образцу для испытаний давали высохнуть в течение 1 часа, а затем поверх него помещали черную защитную крышку. Образцы для испытаний инкубировали в течение 6 суток в вегетационной камере при 25°C и относительной влажности 70%. Затем визуально на основании съеденной листвы оценивали повреждение саженца.
Следующие из протестированных соединений показали степень защиты саженца от «очень хорошей» до «отличной» (повреждение саженца 20% или менее): 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 88, 89, 90, 91, 92, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 106, 108, 109, 110, 111 и 112.
Тест В
Предназначенный для оценки эффективности борьбы с совкой травяной (Spodoptera frugiperda) образец для испытаний состоял из небольшого открытого контейнера с 4-5-суточными саженцами кукурузы (маиса) внутри. Используя пробоотборник, образец для испытаний предварительно заражали 10-15 1-дневными гусеницами на кусочке корма для насекомых.
Получали содержащие тестируемые соединения составы и распыляли их в количестве 50 миллионных долей, как описано для теста A. Все нанесения производили в трех повторах. После распыления образцы для испытания инкубировали в вегетационной камере, а затем визуально оценивали, как описано для теста A.
Следующие из протестированных соединений показали степень защиты саженца от «очень хорошей» до «отличной» (повреждение саженца 20% или менее): 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 20, 21, 22, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 63, 64, 65, 66, 67, 68, 70, 73, 74, 76, 78, 88, 91, 92, 94, 95, 96, 98, 99, 100, 101, 102, 103, 106, 109, 110, 111 и 112.
Тест С
Предназначенный для оценки эффективности борьбы с тлей персиковой зеленой (Myzus persicae) посредством прямого и/или системного воздействия образец для испытаний состоял из небольшого открытого контейнера с 12-15-суточными саженцами редиса внутри. Образец для испытаний предварительно заражали путем переноса на тестируемый саженец 30-40 тлей на кусочке листа, отделенного от культурного растения (способ «рассеченного листа»). По мере высыхания листа тли перемещались на тестируемый саженец. После предварительного заражения почву в образце для тестирования покрывали слоем песка.
Приготавливали состав, состоящий из тестируемых соединений и раствора, содержащего 10% ацетона, 90% воды и 300 миллионных долей неионогенного поверхностно-активного вещества X-77® Spreader Lo-Foam Formula (Loveland Industries, Inc.), содержащего алкиларилполиоксиэтилен, свободные жирные кислоты, гликоли и изопропанол. Содержащие тестируемые соединения составы наносили в 1 мл жидкости через форсунку SUJ2 на основном корпусе 1/8 JJ (Spraying Systems Co.), расположенную в 1,27 см (0,5 дюйма) над верхом каждого образца для испытания. Все экспериментальные соединения в этом скрининговом исследовании распыляли в количестве 250 миллионных долей в трех повторах. После распыления содержащего тестируемое соединение состава каждому образцу для испытаний давали высохнуть в течение 1 часа, а затем поверх него помещали черную защитную крышку. Образцы для испытаний инкубировали в течение 6 суток в вегетационной камере при 19-21°C и относительной влажности 50-70%. Затем визуально оценивали гибель насекомых в каждом образце для испытаний.
Следующие из протестированных соединений приводили к гибели, по крайней мере, 80% насекомых: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 40, 41, 43, 44, 46, 47, 48, 49, 50, 51, 52, 53, 55, 56, 63, 65, 66, 67, 68, 69, 70, 73, 74, 76, 78, 88, 89, 90, 91, 92, 94, 95, 96, 98, 99, 100, 101, 102, 103, 106, 108, 109, 110, 111 и 112.
Тест D
Предназначенный для оценки эффективности борьбы с цикадкой картофельной (Empoasca fabae Harris) посредством прямого и/или системного воздействия образец для испытаний состоял из небольшого открытого контейнера с 5-6-суточными саженцами бобов Longio внутри (показывались первичные листки). Поверх почвы наносили белый песок и перед нанесением отделяли один из первичных листков. Приготавливали содержащий тестируемые соединения состав и распыляли в количестве 250 миллионных долей в трех повторах, как описано для теста С. После распыления содержащего тестируемое соединение состава каждому образцу для испытаний давали высохнуть в течение 1 часа, после чего заражали 5 цикадками картофельными (18-21-суточными особями). Поверх цилиндра помещали черную защитную крышку. Образцы для испытаний инкубировали в течение 6 суток в вегетационной камере при 19-21°C и относительной влажности 50-70%. Затем визуально оценивали гибель насекомых в каждом образце для испытаний.
Следующие из протестированных соединений приводили к гибели, по крайней мере, 80% насекомых: 1, 3, 4, 5, 6, 8, 10, 12, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 32, 33, 34, 35, 37, 38, 40, 41, 43, 44, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 63, 66, 67, 68, 70, 73, 76, 88, 89, 90, 94, 95, 98, 99, 101, 103, 106, 108, 109, 110, 111 и 112.
Тест E
Предназначенный для оценки эффективности борьбы с тлей хлопковой (бахчевой) (Aphis gossypii) посредством прямого и/или системного воздействия образец для испытаний состоял из небольшого открытого контейнера с 6-7-суточными саженцами хлопчатника внутри. Образец для испытаний предварительно заражали 30-40 тлями на кусочке листа в соответствии с описанным для теста C способом «рассеченного листа», а затем покрывали почву в образце для испытаний слоем песка.
Приготавливали содержащий тестируемые соединения состав и распыляли в количестве 250 миллионных долей, как описано для теста D. Нанесения производили в трех повторах. После распыления образцы для испытания инкубировали в вегетационной камере, а затем визуально оценивали, как описано для теста D.
Следующие из протестированных соединений приводили к гибели, по крайней мере, 80% насекомых: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 24, 25, 26, 27, 28, 29, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 46, 47, 48, 49, 50, 51, 52, 53, 55, 56, 63, 69, 71, 72, 74, 76, 78, 79, 81, 84, 88, 89, 90, 91, 92, 95, 96, 97, 98, 99, 100, 101, 102, 103, 106, 108, 109, 110, 111 и 112.
Тест F
Предназначенный для оценки эффективности борьбы с цикадой кукурузной (Peregrinus maidis) посредством прямого и/или системного воздействия образец для испытаний состоял из небольшого открытого контейнера с 3-4-суточными саженцами кукурузы (маиса) внутри. Перед нанесением поверх почвы наносили белый песок. Приготавливали содержащий тестируемые соединения состав и распыляли в количестве 250 миллионных долей в трех повторах, как описано для теста C. После распыления содержащего тестируемое соединение состава каждому образцу для испытаний давали высохнуть в течение 1 часа, после чего заражали 10-20 цикадами кукурузными (18-20-суточными особями) путем посыпания ими песка при помощи солонки. Поверх цилиндра помещали черную защитную крышку. Образцы для испытаний инкубировали в течение 6 суток в вегетационной камере при 19-21°C и относительной влажности 50-70%. Затем визуально оценивали гибель насекомых в каждом образце для испытаний.
Следующие из протестированных соединений приводили к гибели, по крайней мере, 80% насекомых: 1, 2, 3, 4, 5, 6, 7, 8, 10, 11, 12, 13, 18, 20, 24, 25, 26, 27, 28, 29, 32, 33, 35, 37, 38, 39, 40, 41, 43, 45, 46, 47, 48, 49, 50, 51, 53, 56, 88, 89, 90, 91, 94, 95, 108 и 109.
Тест G
Предназначенный для оценки эффективности борьбы с белокрылкой табачной (Bemisia tabaci) образец для испытаний состоял из растущих в среде Redi-earth® (Scotts Co.) 14-21-суточных саженцев хлопчатника, по крайней мере, с двумя настоящими листьями, зараженных личинками 2-й и 3-й возрастной стадии на нижней стороне листьев.
Тестовые соединения смешивали не более чем с 2 мл ацетона, а затем разбавляли водой до 25-30 мл. Содержащие тестируемое соединение составы наносили при помощи плоской пневмовоздушной форсунки (Spraying Systems 122440) при давлении 10 фунтов/дюйм2 (69 кПа). Над саженцами проводили распыление со стеканием на поворотный распылитель. Все экспериментальные соединения в этом скрининговом исследовании распыляли в количестве 250 миллионных долей в трех повторах. После распыления тестируемого соединения образцы для испытаний инкубировали в течение 6 суток в вегетационной камере при относительной влажности 50-60% и при температуре 28°C в дневное время и 24°C в ночное время. Затем листья удаляли и подсчитывали количество мертвых и живых личинок для расчета смертности.
Следующие из протестированных соединений приводили к гибели, по крайней мере, 80% насекомых: 2, 3, 4, 5, 7, 8, 9, 10, 24, 25, 26, 27, 28, 30, 32, 33, 34, 35, 38, 41, 46, 48, 49, 51, 52, 53, 66, 67, 70, 73, 88, 92 и 98.
Тест H
Образец для испытаний, предназначенный для оценки передвижения соединений в растениях и борьбы с тлей персиковой зеленой (Myzus persicae) и цикадкой картофельной (Empoasca fabae) после проникновения соединения через листву и его передвижения через растение, состоял из небольшого открытого контейнера с 12-15-суточными саженцами редиса (для теста с тлей персиковой зеленой) или 5-6-суточными саженцами бобов Longio (для теста с цикадкой картофельной).
Приготавливали состав, состоящий из тестируемых соединений и раствора, содержащего 10% ацетона, 90% воды и 600 миллионных долей неионогенного поверхностно-активного вещества X-77® Spreader Lo-Foam Formula (Loveland Industries, Inc.), содержащего алкиларилполиоксиэтилен, свободные жирные кислоты, гликоли и изопропанол. Содержащий тестируемые соединения состав в количестве 20 мкл наносили пипеткой на два более крупных фотосинтетически активных листа. Все экспериментальные соединения в этом скрининговом исследовании распыляли в количестве 1000 миллионных долей, а тесты были выполнены в трех повторах. После нанесения тестируемого соединения почву в каждом образце для тестирования покрывали слоем песка, давали образцу для тестирования высохнуть в течение 1 часа, а затем помещали поверх него черную защитную крышку. Образцы для испытаний инкубировали в вегетационной камере при 20°C и относительной влажности 50-70%.
Через 2 суток обработанные листья покрывали со всех сторон мелкой пластмассовой сеткой, оставляя нетронутым и прикрепленным к саженцу черешок листа для обеспечения нормального сосудистого движения и фотосинтеза. Затем саженцы заражали 20-30 тлями (редис) или 20 цикадками (бобы) и инкубировали в вегетационной камере в течение дополнительных 8 суток. Затем в каждом образце для испытаний визуально оценивали гибель насекомых, которые контактировали с необработанными тканями саженца и питались ими.
Полученный уровень смертности тли персиковой зеленой (% GPA M) и цикадки картофельной (% PLH M) представлен в таблице A.
Тест I
Образец для испытаний, предназначенный для оценки передвижения соединений в растениях и борьбы с тлей персиковой зеленой (Myzus persicae) и цикадкой картофельной (Empoasca fabae) после проникновения соединения через ксилему и его передвижения через растение, состоял из небольшого открытого контейнера с 12-15-суточными саженцами редиса (для теста с тлей персиковой зеленой) или 5-6-суточными саженцами бобов Longio (для теста с цикадкой картофельной).
Приготавливали состав, состоящий из тестируемых соединений и раствора, содержащего 10% ацетона, 90% воды и 600 миллионных долей неионогенного поверхностно-активного вещества X-77® Spreader Lo-Foam Formula (Loveland Industries, Inc.), содержащего алкиларилполиоксиэтилен, свободные жирные кислоты, гликоли и изопропанол. Содержащий тестируемые соединения состав в количестве 1 мл наносили пипеткой на почву у основания саженца. Все экспериментальные соединения в этом скрининговом исследовании распыляли в количестве 1000 миллионных долей, а тесты были выполнены в трех повторах. После нанесения тестируемого соединения каждому образцу для тестирования давали высохнуть в течение 1 часа. Почву в каждом образце для тестирования покрывали слоем песка, а затем помещали поверх него черную защитную крышку. Образцы для испытаний инкубировали в вегетационной камере при 20°C и относительной влажности 50-70%.
Через 2 суток саженцы заражали 20-30 тлями (редис) или 20 цикадками (бобы) и инкубировали в вегетационной камере в течение дополнительных 5 суток. Затем в каждом образце для испытаний визуально оценивали гибель насекомых, которые контактировали с необработанной листвой саженца и питались ею.
Полученный уровень смертности тли персиковой зеленой (% GPA M) и цикадки картофельной (% PLH M) представлен в таблице B.
Описываются цианоантраниламидные соединения формулы (I), их N-оксиды и соли

в которой R1 представляет собой Me, Cl, Br или F; R2 представляет собой F, Cl, Br, С1-С4-галогеналкил или С1-С4-галогеналкоксигруппу; R3 представляет собой F, Cl или Br; R4 представляет собой Н или С3-С4--алкил, С3-С4-алкенил, С3-С4-алкинил, С3-С5-циклоалкил или С4-С6-циклоалкилалкил, каждый необязательно замещенный одним заместителем, выбираемым из группы, состоящей из галогена, CN, SMe, S(O)Me, S(O)2Me и ОМе; R5 представляет собой Н или Me; R6 представляет собой Н, F или Cl; R7 представляет собой Н, F или Cl. Описываются также композиции для борьбы с беспозвоночными вредителями, распыляемая инсектицидная композиция, композиция для приманки, способ борьбы с беспозвоночными вредителями, а также устройство для борьбы с вредителями. Заявленные соединения демонстрируют высокую активность в отношении большинства вредителей. 7 н. и 7 з.п. ф-лы, 8 табл.

в которой
R1 представляет собой Me, Cl, Br или F;
R2 представляет собой F, Cl, Br, С1-С4-галогеналкил или C1-C4-галогеналкоксигруппу;
R3 представляет собой F, Cl или Br;
R4 представляет собой Н, С1-С4-алкил, С3-С4-алкенил, С3-С4-алкинил, С3-С5-циклоалкил или С4-С6-циклоалкилалкил, каждый необязательно замещенный одним заместителем, выбираемым из группы, состоящей из галогена, CN, SMe, S(O)Me, S(O)2Me и ОМе;
R5 представляет собой Н или Me;
R6 представляет собой Н, F или Cl; и
R7 представляет собой Н, F или Cl;
при условии, что когда R1 представляет собой Me, R2 представляет собой CF3, R3 представляет собой Cl, R5, R6 и R7 представляют собой Н, то R4 не представляет собой изопропил.
R1 представляет собой Me или Cl;
R2 представляет собой Cl, Br, CF3, OCF2H, OCF3 или OCH2CF3; и
R4 представляет собой Н, Me, Et, изо-Pr, трет-Bu, CH2CN, CH(Me)CH2SMe или C(Me)2CH2SMe.
R2 представляет собой Cl, Br, CF3, или OCH2CF3;
R4 представляет собой Н, Me, Et, изо-Pr; и
R5 представляет собой Н.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ПРОИЗВОДНЫЕ 1-(2-ПИРИДИЛ) ПИРАЗОЛА ИЛИ ИХ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1-(2-ПИРИДИЛ) ПИРАЗОЛА ИЛИ ИХ КИСЛОТНО-АДДИТИВНЫХ СОЛЕЙ (ВАРИАНТЫ), ИНСЕКТОАКАРИЦИДОНЕМАТОЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ БОРЬБЫ С НАСЕКОМЫМИ, КЛЕЩАМИ И НЕМАТОДАМИ | 1992 |
|
RU2088580C1 |
| КАРБАНИЛИДЫ И СРЕДСТВО ДЛЯ БОРЬБЫ С НАСЕКОМЫМИ И ПАТОГЕННЫМИ ГРИБАМИ НА ИХ ОСНОВЕ | 1997 |
|
RU2194704C2 |
Авторы
Даты
2009-01-10—Публикация
2004-01-21—Подача