Настоящее изобретение относится к применению в качестве субстрата для роста микроорганизмов бактериальной биомассы, в частности биомассы, названной здесь термином «бактериальный экстракт», происходящей по меньшей мере частично из бактериальной культуры, включающей в себя метанотрофную бактерию.
Микроорганизмы часто выращивают в промышленных и лабораторных масштабах, например, для продукции требуемых веществ из бактериальных штаммов, которые продуцируют такие вещества в природе или генетически модифицированы так, что продуцируют такие вещества, или с тем, чтобы определить природу бактериального загрязнения и т.д. Для этих целей микроорганизмы требуют питательных веществ, и в этом плане удобно использовать дрожжевые, мясные или растительные экстракты, которые широко доступны на рынке, например MRS (De Mann, Rogosa and Sharpe), PCA (агар для подсчета колоний на чашках), VRBD (фиолетово-красный желчный декстрозный агар), агар YM (дрожжевой плесневый агар), агаровая основа Baird-Parker, агар VRB (фиолетово-красный желчный агар), агар XLD (ксилозо-лизин-дезоксихолатный агар), CASO (казеиновый пептон - соевый пептон), TSB (трипсиновый соевый бульон) и NB (питательный бульон). Субстраты для роста на основе дрожжевого экстракта (содержащиеся, например, в MRS, VRBD, в агаре VRB, PCA, в агаровой основе Baird-Parker и в агаре XLD Agar) поставляются, среди прочих Merck и Difco. Такие дрожжевые экстракты обычно продуцируются с использованием биомассы от дрожжевых культур, которым позволяют подвергнуться автолизу, т.е. ферменты, встречающиеся в природе в дрожжевых клетках, действуют, разрушая клетки после клеточной гибели. Автолиз дрожжей в основном проходит медленно, и до достижения подходящей степени расщепления может понадобиться несколько суток. Соответственно, для ускорения процесса автолиза в основном используют добавки, которые действуют как инициаторы или стимуляторы автолиза, например тиольные средства. Применение таких добавок, конечно, добавляет затраты на коммерческую продукцию автолизатов дрожжей. К полученным в результате автолизатам могут быть добавлены дополнительные питательные вещества для оптимизации роста клеток конкретных микроорганизмов, и, действительно, банки-коллекции микроорганизмов в основном укажут, какая среда роста является наиболее подходящей для депонированного организма.
Поскольку различные микроорганизмы имеют различные питательные потребности, безусловно, имеет место текущая необходимость в альтернативных и улучшенных средах для роста микроорганизмов, в частности в ростовых средах, эффективных для выращивания тех микроорганизмов, которые имеют трудности роста in vitro (например, лактобациллы), и в ростовых средах «широкого спектра», которые могут подходить для применения с неизвестными микроорганизмами.
Авторы изобретения в настоящее время неожиданно обнаружили, что особенно эффективные среды для роста микроорганизмов могут продуцироваться с использованием биомассы, собранной от культуральной среды, включающей в себя метанотрофные бактерии, например биомассы, продуцированной, как описано в WO 01/60974.
В одном из аспектов настоящее изобретение относится к применению стерильной питательной композиции, происходящей из биомассы культуры бактерий, включающей в себя метанотрофные бактерии и необязательно содержащей дальнейшие питательные вещества в качестве среды для роста микроорганизмов.
Бактериальная культура, использованная для продукции биомассы, предпочтительно по меньшей мере на 50%, более предпочтительно по меньшей мере на 60%, особенно по меньшей мере на 70%, в частности, по меньшей мере на 75%, например на 75-95%, более предпочтительно по меньшей мере на 75-80% по массе состоит из метанотрофных бактерий (по отношению к общей массе бактерий).
В другом аспекте изобретение относится к способу культивирования микроорганизмов, который охватывает совмещение микроорганизма и его ростовой среды, отличающемуся тем, что указанная ростовая среда представляет собой или получена из стерильной питательной композиции, происходящей из биомассы культуры бактерий, включающей в себя метанотрофные бактерии, и необязательно с добавлением дальнейших питательных веществ.
В еще одном аспекте изобретение относится к субстрату для роста микроорганизма, включающему в себя стерильную питательную композицию, происходящую из биомассы культуры бактерий, включающей в себя метанотрофные бактерии, дополнительно содержащую по меньшей мере одно стерильное питательное вещество и необязательно содержащую разбавитель.
Биомасса, из которой получают среду или субстрат для роста, предпочтительно представляет собой биомассу, генерированную по меньшей мере из одного вида метанотрофных бактерий и по меньшей мере из одного вида гетеротрофных бактерий, предпочтительно растущего на той же культуральной среде, например, с использованием петлевого реактора с подводом метана, кислорода, аммиака и минеральных подкормок. Подходящие комбинации бактерий для генерирования биомассы описаны, например, в WO 01/60974, содержание которой включено сюда в качестве ссылки. Одной особенно подходящей комбинацией является Methylococcus capsulatus (Bath) (штамм NCIMB 11132), Ralstonia sp. DB3 (штамм NCIMB 13287), Aneurinibacillus sp. DB4 (штамм NCIMB 13288) и Brevibacillus agri DB5 (штамм NCIMB 13289) (каждый из данных микроорганизмов доступен в Norferm DA, Норвегия, в течение продолжительности действия патента).
Биомасса из бактериальной культуры может использоваться непосредственно (хотя в основном после обезвоживания и стерилизации), или она может быть вначале переработана с целью разрушения бактериальных клеток, например, путем гомогенизации, гидролиза или автолиза. Такие виды обработки описаны в WO01/60974 и Международных заявках на выдачу патента PCT/GB03/000610 и PCT/GB03/000640, поданных 12 февраля 2003 г., которые также включены в настоящее описание в качестве ссылки. (Копии этих двух Международных патентных заявок также поданы вместе с настоящей заявкой.) Хотя гомогенат, гидролизат и автолизат, особенно сухой гомогенат и, более конкретно, сухой автолизат бактериальной биомассы представляют собой предпочтительные материалы для получения сред для роста микроорганизма по изобретению, могут использоваться материалы-предшественники, полученные путем фильтрации (например, ультрафильтрации) гомогенизированной, автолизированной или гидролизованной биомассы, т.е. жидкий фильтрат сам по себе и остаток после фильтрации. Однако наиболее предпочтительным является сухой автолизат.
Среда для роста микроорганизмов может представлять собой сам продукт бактериальной биомассы или композицию, содержащую продукт биомассы и дополнительные составляющие, например жидкий или нежидкий носитель или разбавитель (такой как вода, гель (например, гель агара), или гелеобразующая жидкость), и такие материалы, как минералы, источники углерода (такие как сахара (например, моно-, ди-, олиго-, и полисахариды, особенно, моно- и дисахариды)), источники азота (например, нитраты, белки или фрагменты белков, соединения аммония, олигопептиды, аминокислоты (особенно незаменимые аминокислоты, например триптофан)), нуклеиновые кислоты и фрагменты нуклеиновой кислоты, липиды, и т.д. Особо предпочтительно, среда содержит глюкозу и добавленные нитратные и минеральные соли (например, соединения калия, кальция, магния, натрия, молибдена, железа, цинка, бора, кобальта, марганца и никеля), особенно глюкозу. Получаемая композиция может представлять собой стерильное твердое вещество (например, сыпучее вещество), полутвердое вещество или жидкость в готовой к употреблению или концентрированной форме. Особо предпочтительно, получаемая композиция является стерильным сухим сыпучим концентратом, который можно преобразовать в ростовую среду путем добавления воды или водной композиции гелеобразующего средства.
В случае если композиция содержит добавленную глюкозу, она предпочтительно характеризуется основанным на сухой массе отношением от 5:1 до 1:5 (особенно, от 2:1 до 1:2) по сравнению с происходящим из биомассы компонентом. В случае, если композиция содержит добавленные нитратные и минеральные соли, они предпочтительно характеризуются массовым отношением от 0,01:1 до 0,2:1 (особенно от 0,05:1 до 0,1:1) по сравнению с происходящим из биомассы компонентом. В случае, если получаемая композиция не содержит добавленной глюкозы и/или нитратных минеральных солей, предпочтительно, чтобы получение ростовой среды охватывало добавление одного или обоих таких компонентов в массовых отношениях, указанных выше.
Композиции по изобретению особенно подходят для применения в качестве субстратов для роста гетеротрофных микроорганизмов, особенно гетеротрофных водорослей, дрожжей или бактерий, в частности анаэробных бактерий, таких как лактобациллы (например, L. plantarum, L. acidophilus), аэробных бактерий, таких как E. coli, и водорослей, таких как Crypthecodinium cohnii.
Изобретение будет далее проиллюстрировано со ссылкой на следующие неограничивающие примеры и сопровождающие их чертежи.
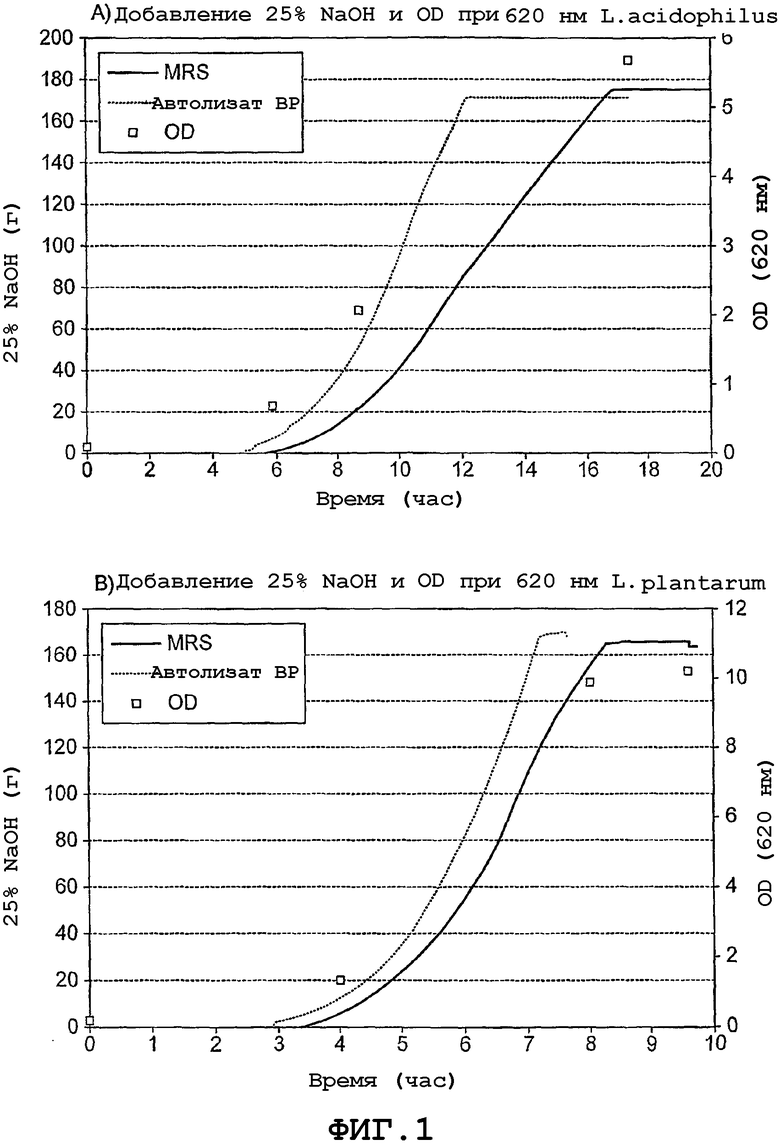
На фиг. 1 иллюстрируются результаты исследований по ферментации в ферментере A) L. acidophilus и B) L. plantarum на MRS (-) и на автолизате BP (...). Добавление 25% NaOH (g) и OD при 620 нм (для ферментации на MRS) относительно времени (h).
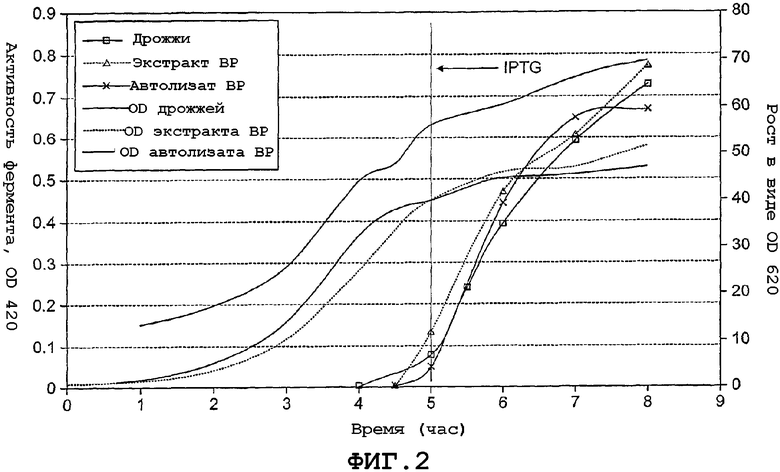
На фиг. 2 иллюстрируются данные исследований ферментации E. coli на дрожжевом экстракте, экстракте BP и автолизате BP.
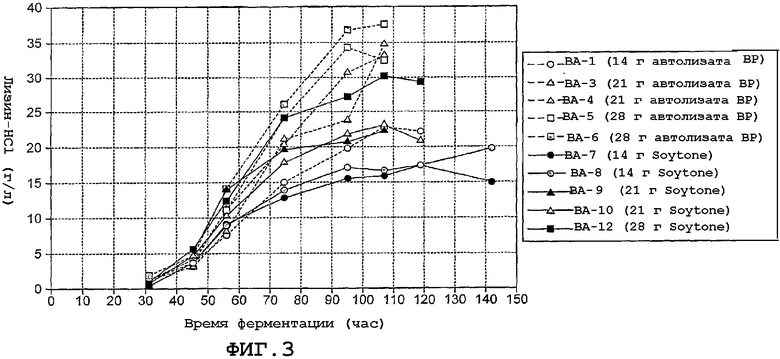
На фиг. 3 иллюстрируется продукция лизина в различных ферментациях как функция времени и типа и количества добавленных комплексных источников азота.
Пример 1
Экстракты биомассы
Метанотрофные и гетеротрофные бактерии (Methylococcus capsulatus (Bath) (штамм NCIMB 11132) Ralstonia sp. DB3 (штамм NCIMB 13287), Aneurinibacillus sp. DB4 (штамм NCIMB 13288) и Brevibacillus agri DB5 (штамм NCIMB 13289) - все поставляются Norferm DA, Норвегия) культивировали, как описано в W001/60974, и полученную в результате биомассу собирали и обрабатывали, как описано в WO01/60974 для продукции высушенного распылением гомогената (здесь и далее «гомогенат BP»), как описано в Международной заявке на выдачу патента № PCT/GB03/000610, для продукции высушенного распылением гидролизата (здесь и далее «гомогенат BP»), и, как описано в Международной заявке на выдачу патента № PCT/GB03/000640 (см., например, пример 1), для продукции автолизата (здесь и далее «экстракт BP»). Там, где стадии ультрафильтрации и упаривания «экстракта BP» после автолиза пропускают, продукт обозначается как «автолизат ВР». Получение такого продукта описано, например, в примерах 3 и 4 Международной заявки на выдачу патента № PCT/GB03/000640. Продукт, обозначаемый как «остаток BP», представляет собой обработанную сверхвысокой температурой биомассу, которая гомогенизирована. Продукт, обозначенный как «фильтрат BP», по существу соответствует продукту стадии ультрафильтрации «экстракта BP».
Все описанные выше материалы поставляются Norferm DA, Норвегия.
Среды для роста микроорганизмов продуцировали путем добавления гомогената BP, автолизата BP, экстракта BP, остатка BP и фильтрата BP к деминерализованной воде в концентрации 1 г/л. Данные среды затем использовали непосредственно или с добавлением 0,1 г/л глюкозы и/или 32,4 мл/л среды нитратно-минеральных солей (NMS).
NMS содержит
1,0 г KNO3,
0,2 г CaCl2·2H2O,
1,0 г MgSO4·7H2O,
0,1 мл раствора микроэлементов*,
0,1 мл раствора молибдата натрия (5 г/л NaMoO4·2H2O в деминерализованной воде),
0,1 мл раствора EDTA (45 г/л FeNaEDTA·2H2O в воде),
воду до 1 л.
Добавляли 10 мл/л стерильного фосфатного буфера (35,6 г Na2HP04·2H2O, 26,0 г KH2PO4 и вода до 1 л).
* 6,4 г ZnSO4·7H2О,
150 мг H3BO3,
600 мг CoSO4·7H2О,
130 мг MnCl2,
100 мг NiCl2·6H2О,
деминерализованная вода до 1 л.
Все среды перед использованием автоклавировали.
Также получали основанную на агаре среду для роста микроорганизмов, содержащую
32,2 г/л экстракта BP,
20,0 г/л глюкозы,
34 мл/л среды NMS,
14,0 г/л агара,
деминерализованную воду до 1 л.
Среду перед использованием автоклавировали.
Пример 2
Тесты роста микроорганизмов
Аэробные и анаэробные, грамположительные и грамотрицательные бактерии выращивали в колбе для встряхивания с использованием жидких ростовых сред по примеру 1 и в качестве контролей ростовых сред, рекомендованных для данных бактериальных штаммов. Осуществляли мониторинг оптической плотности культур в качестве индикатора полученного роста бактерий (т.е. «плато» или стационарной фазы с наивысшим числом клеток). Результаты приведены ниже в таблице 1.
+: Некоторые комбинации производного BP были так же эффективны, как контрольный субстрат.
+++: Некоторые комбинации производного BP были явно лучше, чем контрольный субстрат.
Для E. coli экстракт BP с добавлением глюкозы явно обеспечивали наилучший рост. Для L. plantarum все комбинации экстракта BP явно давали наилучший рост. Для P. aeruginosa все комбинации экстракта BP давали наилучший рост, в частности экстракт BP с добавлением глюкозы. Для B. subtilis экстракт BP с добавлением глюкозы и с добавлением глюкозы и NMS явно давали наилучший рост.
Пример 3
Жизнеспособность неизвестных бактерий
Агаровые гели (PCA, агар MRS и экстракт BP с агаром (пример 1) pH 6,0 и 7,1) засевали неизвестными микроорганизмами, взятыми из образца рубленого мяса. Культуры инкубировали в течение 72 часов при 25°C и фиксировали общий подсчет колоний на чашке. Для экстракта BP log(КОЕ/г) составлял от 5 примерно до 6,6, в то время как для MRS он составлял менее 1. Для PCA log(КОЕ/г) составлял примерно 6,7, т.е. немного выше.
Пример 4
Жизнеспособность Lactobacillus
Штаммы лактобацилл L. casei ssp. rhamnosus (штамм ATCC 7469), L. delbruekii ssp. lactis (штамм ATCC 7830), L. fermentum (штамм CCUG 30138), L. gasseri (штамм ATCC 19992) и L. plantarum (штамм ATCC 8014) выращивали при аэробных условиях на агаре MRS и агаре экстракта BP (пример 1). Во всех случаях жизнеспособность, измеренная как log (CFU/mL), была для экстракта BP той же самой или большей. Это было более выражено для L. delbruekii. Те же штаммы также выращивали на указанных средах в анаэробных условиях, и опять жизнеспособность для всех случаев экстракта BP была такой же или лучшей.
Пример 5
Продукция полиненасыщенных жирных кислот
Crypthecodinium cohnii (Seligo) Javornicky (штамм ATCC 30772) выращивали на культуральной среде, содержащей 9 г/л глюкозы, 25 г/л морской соли и 2 г/л дрожжевого экстракта (YE) или экстракта BP в деминерализованной воде. После двух суток инкубации клетки собирали и определяли содержание общих жирных кислот, сухую массу клеток (CDW) и содержание 22:6 (докозагексеновой кислоты). Результаты приведены в таблице 2.
В таблице 2 показано, что CDW и процентная доля полиненасыщенной жирной кислоты 22:6 была выше при использовании экстракта BP.
Пример 6
Рост Lactobacillus в среде, содержащей автолизат BP
Рост штаммов лактобацилл L. plantarum и L. acidophilus на среде с комплексными компонентами, замещенными автолизатом BP (пример 1), сравнивали с таковым с использованием стандартных сред MRS в колбах и в ферментациях.
Эксперименты в колбах
Lactobacillus выращивали в анаэробных колбах для сравнения свойств автолизата BP с таковыми существующих на рынке продуктов. Комплексные компоненты в средах MRS (см. таблицу 3) замещали автолизатом BP согласно таблице 4, так что общая концентрация азота оставалась постоянной.
Комплексные компоненты среды
Эксперименты в ферментере
Две ферментации проводили на каждом штамме; одну со стандартной средой MRS и одну, в которой комплексные компоненты в MRS замещали автолизатом BP (среда CA-4 в эксперименте в колбе).
Способы для экспериментов, проведенных в анаэробных флаконах
Инокуляция 1 мл материала для посева L. plantarum и L. acidophilus использовали для инокуляции 80 мл бульона MRS (Oxoid) и инкубировали при 37°С в течение 20 час. Для штамма L. acidophilus бульон MRS доводили до рН 5,5.
Условия культивирования. Комплексные среды-субстраты использовали по таблице 4, в то время как другие компоненты поддерживали на постоянном уровне (таблица 5). Все компоненты, кроме глюкозы, смешивали, рН доводили до 6,0 и 5,5 соответственно и автоклавировали при 121°С в течение 20 мин.
Два флакона инокулировали и один использовали в качестве контроля. Использовали 0,5 мл материала для инокуляции на колбу. Флаконы инокулировали на боку при 37°С при 100 об/мин в течение 20 час и 24 час соответственно. Образцы анализировали на предмет рН и КОЕ/мл.
Композиции сред для экспериментов в анаэробных колбах
Способы ферментаций
Инокуляция. Использовали те же условия, что и для экспериментов в колбах: 1 мл материала для посева L. plantarum и L. acidophilus использовали для инокуляции 80 мл бульона MRS (Oxoid), и инкубировали при 37°C в течение 20 час. Для штамма L. acidophilus pH бульона MRS доводили до 5,5.
Условия культивирования. Все эксперименты по ферментации проводили в 7,5 л ферментере Chemap. Серийные запуски по 7 л инокулировали 70 мл материала для инокуляции. Комплексные среды-субстраты использовали по MRS и CA-4 и оставшиеся компоненты поддерживали как в эксперименте в колбах, за исключением того, что (Na)3-цитрат (2,40 г/л) заменяли на (NH4)3-цитрат (2,00 г/л) (таблица 6). Все компоненты, кроме глюкозы, смешивали, pH доводили до 6,0 и 5,5 соответственно и автоклавировали при 121°С в течение 20 мин. Глюкозу автоклавировали отдельно.
Ферментации запускали при 37°C и pH поддерживали постоянным при pH 5,8 для L. plantarum и pH 5,5 для L. acidophilus с добавлением 25% NaOH. Ферментацию останавливали, прекращая добавление NaOH. Применяли меры предосторожности для минимизации смешивания воздуха со средой. Конечный продукт анализировали на предмет КОЕ на агаре MRS (Oxoid) и на контаминацию на кровяном агаре и TSA (Difco).
Компоненты среды для ферментаций
Результаты экспериментов в колбах
Эксперимент в колбе для продукции L. plantarum. Композиция сред касательно субстратов для роста (г/л), жизнеспособности
L. plantarum (КОЕ/мл) и pH после 20 час при 37°C.
Другие компоненты среды MRS не изменяли. pH среды доводили до 6,0. Для каждого эксперимента проводили две параллели.
Эксперимент в колбе для продукции L. acidophilus. Композиция сред касательно субстратов для роста (г/л), жизнеспособности
L. acidophilus (КОЕ/мл) и pH после 24 час при 37°C.
Другие компоненты среды MRS не изменяли, pH среды доводили до 5,5. Для каждого эксперимента проводили две параллели.
Результаты экспериментов в ферментерах
Для обоих штаммов КОЕ потребление гидроксида натрия указывает на равный или лучший рост на средах, содержащих автолизат BP, по сравнению с стандартными комплексными компонентами в MRS. Время ферментации для обоих штаммов было меньше на автолизате BP, чем на MRS. Результаты суммированы в таблице 9 и на фиг. 1. Ни в один момент времени не наблюдали какой-либо комбинации.
Итоги ферментаций на MRS (с комплексными компонентами среды: бактериологический пептон 10 (г/л), экстракт говядины 10 (г/л), дрожжевой экстракт 5 (г/л)) и с комплексными компонентами среды, замененными на автолизат BP, 32 (г/л)
Выводы: Эксперименты в колбах и по ферментации показали, по меньшей мере, эквивалентный или улучшенный рост на средах, которые включают в себя автолизат BP, а не стандартный MRS.
Пример 7
Ферментация E. coli с целью продукции β-галактозидазы
Цель данного исследования состояла в исследовании альтернативных автолизатов BP в качестве источника азота в ферментации E. coli. Экстракт BP и автолизат BP (пример 1) тестировали и сравнивали со стандартным дрожжевым экстрактом.
Способ
Насыщение кислородом поддерживали примерно около 20%. Температура составляла 37°C, а pH составлял 6,8. Изначально ферментацию проводили в серийном режиме с 50% источника углерода и 50% источника азота с добавлением минералов. При OD620 10 добавляли остаток источника азота в течение периода времени, равного одному часу. При уровнях глюкозы ниже 0,7 г л-1 культуру подкармливали глюкозой. Также глюкозу отслеживали посредством pH: 1) при pH > 6,8 повышали подпитку глюкозой и 2) при pH < 6,75 снижали подпитку глюкозой и добавляли NaOH.
Питание
1) В качестве источника углерода глюкоза, и
2) Источник азота
a. Дрожжевой экстракт
b. Экстракт BP
c. Автолизат BP (в концентрации в 1,5 раза выше, чем у дрожжевого экстракта и экстракта BP).
Через 4,5 часа добавляли ITPG (изопропил-бета-D-тиогалактопиранозид) в качестве индуктора галактозидазы.
Результаты показаны на фиг. 2 и подтверждают, что для данных трех источников азота продукция фермента была сходной.
Пример 8
Анализ автолизата BP в качестве комплексного источника азота
для гиперпродуцирующих L-лизин штаммов Corynebacterium glutamicum NRRL B-11470
Целью исследования было сравнение автолизата BP (пример 1) с гидролизатом сои (Bacto Soytone) в качестве комплексного источника азота для продукции лизина путем ферментации гиперпродуцирующего лизин мутанта C. glutamicum.
Сравнивали продукцию лизина в ферментациях, проводимых в 3-литровых стеклянных ферментерах с 1 литром среды с C. glutamicum NRRL B-11470. Композиция среды во всех ферментациях была одинаковой кроме комплексного источника азота, которым являлся автолизат BP или Soytone (14, 21 или 28 г на литр).
Результаты
Основные результаты ферментаций суммированы в таблице 10. Продукция лизина как функция времени ферментации также показана на фиг. 3.
В общем, скорость продукции лизина повышается с возрастающей концентрацией комплексного источника азота возможно потому, что с возрастающим добавлением источника азота повышается концентрация клеток. Однако скорость продукции значительно выше в культурах, к которым добавлен автолизат BP, чем в культурах, куда добавлено то же количество Soytone. Вследствие высокой концентрации частиц в автолизате BP было невозможно определить оптическую плотность в ферментациях с автолизатом BP. Поэтому авторы изобретения не имели оценки клеточной массы в данных ферментациях. Однако более высокая скорость продукции, возможно, является следствием более высокой концентрации клеток в ферментациях с автолизатом BP, чем в соответствующих ферментациях с Soytone.
Продукция лизина с C. glutamicum NRRL B-11470. Итоговые результаты ферментации
г глюкозы)
(г/л·ч)
(г/л·ч)
(г/л·ч)
В При расчетах принимали во внимание повышение в объеме во время ферментации (5-15%).
С Несмотря на факт, что микроскопическая оценка культуры в конце ферментации не выявила в культуре каких-либо контаминирующих организмов, аналитические результаты ясно показывали, что контаминирующий организм присутствует. Однако данный организм, как представляется, в значимой степени не воздействовал на продукцию лизина.
Е В данной ферментации измеренная концентрация лизина в последнем образце ниже, чем в предпоследнем образце. Причиной этого является то, что способ Chinard имеет довольно большое стандартное отклонение. Конечный волюметрический выход оценивали, основываясь главным образом, на предпоследнем образце.
.
Конечный выход лизина на единицу глюкозы был примерно одинаковым в большинстве ферментаций, 0,17-0,19 г лизина-HCl/г глюкозы, независимо от типа и количества комплексного источника азота. Возможно, выход немного выше, 0,21-0,22 г лизина-HCl/г глюкозы в ферментациях с добавлением 21 г автолизата BP на литр.
Выводы
В исследованиях ферментации ясно показано, что автолизат BP является хорошей альтернативной Soytone и, как представляется, превосходит Soytone в отношении скорости продукции в ферментерах. Повышенная скорость продукции, вероятно, имеет место вследствие более высокой концентрации клеток в ферментациях с автолизатом BP, чем в ферментациях с тем же количеством Soytone. Причина этого не известна, но может быть это имеет место потому, что автолизат BP вследствие бактериального происхождения соответствует требованиям клеток для роста лучше, чем Soytone, в отношении таких компонентов, как рибонуклеиновые кислоты, компоненты построения клеточной стенки, липиды и т.д.
Изобретение относится к биотехнологии. Субстрат для роста микроорганизмов содержит стерильную композицию питательных веществ, происходящую. из биомассы культуры бактерий, включающей метанотрофные и гетеротрофные бактерии, такие как Methylococcus capsulatus (Bath) (штамм NCIMB 11132), Ralstonia sp. DB3 (штамм NCIMB 13287) и Brevibacillus agri DBS (штамм NCIMB 13289), необязательно, в комбинации с Aneurinibacillus sp. DB4 (штамм NCIMB 13288). Дополнительно субстрат содержит по меньшей мере одно стерильное питательное вещество и необязательно разбавитель. Изобретение позволяет повысить скорость продуцирования. 3 н. и 15 з.п. ф-лы, 10 табл., 3 ил.
| ССССОЮЗНАЧ IOATriirHO'TDtJirE'^HAF;!b''i[jJlHOVTH/4 -В. А. Горелов | 0 |
|
SU290917A1 |
| 0 |
|
SU160974A1 | |
| КИСЛУХИНА О.В | |||
| и др | |||
| Ферментативный лизис микроорганизмов | |||
| - Алма-Ата: Рауна, 1990, с.3-81. | |||
Авторы
Даты
2009-01-10—Публикация
2003-04-17—Подача