Область, к которой относится изобретение
В общих чертах, настоящее изобретение относится к области биологии и химии. Более конкретно, настоящее изобретение относится к флуоресцирующим белкам.
Предшествующий уровень техники
Мечение представляющих интерес белков, клеток или организмов играет важную роль во многих областях биохимии, молекулярной биологии и клинической диагностики. Были разработаны и использованы различные метки, включая радиоактивные метки, хромогенные метки, флуоресцирующие метки, хемилюминесцентные метки и т.п., которые обладают различными свойствами и находят оптимальное применение. Однако в настоящее время не угасает интерес к разработке новых меток. Особый интерес представляет разработка новых белковых меток, включая флуоресцирующие белковые метки. Флуоресцирующие белки или флуоропротеины представляют собой белки, которые обнаруживают низкую, среднюю или интенсивную флуоресценцию при облучении светом с соответствующей длиной волны возбуждения. Флуоресцентные свойства этих белков обусловлены взаимодействием двух или более аминокислотных остатков белка, а не одним аминокислотным остатком. Как таковые флуоресцирующие белки не являются белками, способными флуоресцировать только благодаря остаткам, которые сами действуют как природные флуорофоры, то есть триптофан, тирозин и фенилаланин. Используемый здесь термин "флуоресцирующий белок" не включает люциферазы, такие как люцифераза Renilla.
Зеленый флуоресцирующий белок (GFP), его мутанты и гомологи хорошо известны в настоящее время благодаря их широкому применению в медико-биологических науках в качестве in vivo флуоресцирующих маркеров, подробно описанных Lippincott-Schwartz & Patterson in Science (2003) 300(5616):87-91). Было обнаружено, что GFP из гидроидной медузы Aequorea aequorea (синоним A. victoria), описанной Johnson et al. в работе J.Cell.Comp.Physiol. (1962), 60:85-104, является частью биолюминесцентной системы медуз, где GFP играет определенную роль как вторичный излучатель, преобразующий синий свет, излучаемый фотопротеином экворином, в зеленый свет. кДНК, кодирующая GFP A.victoria, была клонирована, как описано Prasher et al. (Gene (1992), 111(2):229-33). Было обнаружено, что этот ген может быть гетерологически экспрессирован практически в любом организме благодаря уникальной способности GFP самостоятельно образовывать флуорофор (Chalfie et al., Science 263 (1994), 802-805). Установление этого факта открывает широкие перспективы для применения GFP в биологии клетки в качестве генетически кодируемой флуоресцирующей метки.
GFP имеет широкий спектр применений, включая исследование экспрессии генов и локализации белков (Chalfie et al., Science 263 (1994), 802-805 и Heim et al., Proc. Natl. Acad. Sci. (1994), 91:12501-12504), в качестве средств для визуализации субклеточных органелл в клетках (Rizzuto et al., Curr. Biology (1995), 5:635-642), а также для визуализации транспорта белка по секреторному пути (Kaether & Gerdes, FEBS Letter (1995), 369:267-271).
Были проведены широкомасштабные исследования, направленные на улучшение свойств GFP и продуцирование реагентов GFP, используемых и оптимизированных для различных научных целей. Были разработаны новые варианты GFP, такие как ДНК "гуманизированного" GFP, белковый продукт которой на высоком уровне синтезируется в клетках млекопитающих (Haas et al., Current Biology (1996), 6:315-324; Yang et al., Nucleic Acids Research (1996), 24:4592-4593). Один из таких "гуманизированных" белков представляет собой "усиленный зеленый флуоресцирующий белок" (EGFP), то есть мутантный вариант GFP, имеющий две аминокислотных замены: F64L и S65T (Heim et al., Nature 373 (1995), 663-664). Другие мутации GFP приводят к образованию вариантов, излучающих синий, голубовато-зеленый и желто-зеленый свет.
Однако, несмотря на огромные преимущества GFP, могут быть использованы и другие флуоресцирующие белки, имеющие свойства, аналогичные свойствам GFP или отличающиеся от этих свойств. В частности, ценность новых флуоресцирующих белков заключается в их способности к переносу энергии флуоресцирующего резонансного излучения (FRET), на что указывают новые спектры, и к их способности к более сильному возбуждению. В 1999 г. гомологи GFP были клонированы из небиолюминисцентных видов Anthozoa (Matz et al., Nature Biotechnol. (1999) 17:969-973). Это открытие продемонстрировало, что такие белки не являются необходимым компонентом биолюминесцентного механизма. Из Anthozoa GFP-подобные белки обнаруживали сильно отличающиеся спектральные свойства, включая белки, флуоресцирующие в голубовато-зеленом, зеленом, желтом и красном диапазоне спектра, и хромопротеины, не флуоресцирующие в пурпурно-синем диапазоне спектра (СР) (Matz et al., Bioessays (2002), 24(10):953-959). Позже кДНК GFP-гомологов были клонированы из нескольких гидроидных медуз, включая Aequorea macrodactyla (GenBank, регистрационные номера AF435427-AF435433) и Aequorea coerulescens (Gurskaya et al., Biochem J. (2003), 373(Pt2):403-408). Таким образом, за 40-летнюю историю исследований GFP были выявлены GFP-подобные белки, принадлежащие только к двум классам Кишечнополостных (Cnidaria), Hydrozoa и Anthozoa.
Использование флуоресцирующих белков в качестве аналитических инструментов в молекулярной биологии послужило стимулом для поиска других флуоресцирующих белков с различными и улучшенными свойствами по сравнению с известными флуоресцирующими белками. Таким образом, целью по настоящему изобретению является получение новых флуоресцирующих белков, обладающих свойствами, пока еще не обнаруженными у известных флуоресцирующих белков, число которых и без того является ограниченным, а также получение ДНК, кодирующих флуоресцирующие белки, не имеющие недостатков, присущих известному GFP.
Описание сущности изобретения
Настоящее изобретение относится к молекулам нуклеиновой кислоты, кодирующим новые флуоресцирующие белки и их мутанты и производные. Указанная нуклеиновая кислота может быть выделена или синтезирована, либо она может присутствовать в ее неприродном окружении.
В некоторых своих вариантах настоящее изобретение относится к нуклеиновой кислоте, выделенной из видов веслоногих ракообразных (типа Arthropoda; подтипа Crustacea; класса Maxillopoda; подкласса Copepoda), или к ее мутантам или производным.
В некоторых вариантах осуществления изобретения нуклеиновая кислота по настоящему изобретению кодирует белок, который имеет аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26 или 28. В некоторых вариантах осуществления изобретения указанная нуклеиновая кислота кодирует гомолог, мутант, производное, миметик или фрагмент указанного белка.
В некоторых вариантах осуществления изобретения нуклеиновая кислота по настоящему изобретению имеет нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25 или 27, или последовательность, гомологичную этой нуклеотидной последовательности, по существу аналогичную или идентичную этой последовательности. Последовательности нуклеиновой кислоты, которые отличаются от последовательностей нуклеиновой кислоты по настоящему изобретению вследствие вырожденности их генетического кода или вследствие их гибридизации с ними, также входят в объем настоящего изобретения.
В других вариантах своего осуществления настоящее изобретение относится к белкам, которые кодируются рассматриваемыми нуклеиновыми кислотами или по существу аналогичными им нуклеиновыми кислотами, или к гомологам, производным или мутантам указанных белков, либо настоящее изобретение относится к гибридным белкам, содержащим белки по настоящему изобретению.
В объем по настоящему изобретению также входят фрагменты нуклеиновых кислот по настоящему изобретению и нуклеиновые кислоты, которые гибридизуются в жестких условиях с нуклеиновыми кислотами по настоящему изобретению.
В других вариантах своего осуществления настоящее изобретение относится к векторам, содержащим нуклеиновую кислоту по настоящему изобретению. Кроме того, настоящее изобретение относится к экспрессионным кластерам, содержащим нуклеиновую кислоту по настоящему изобретению и регуляторные элементы, необходимые для экспрессии указанной нуклеиновой кислоты в нужной клетке-хозяине.
В еще одном варианте своего осуществления настоящее изобретение относится к способам продуцирования флуоресцирующего белка по настоящему изобретению, предусматривающим экспрессию белка в подходящей клетке-хозяине и выделение белка из этой клетки. Указанный способ предусматривает (а) получение молекулы нуклеиновой кислоты по настоящему изобретению, кодирующей флуоресцирующий белок, функционально связанный с подходящими элементами регуляции экспрессии; (b) экспрессию указанного флуоресцирующего белка из указанной молекулы нуклеиновой кислоты и (с) выделение белка, по существу не содержащего других белков.
Кроме того, настоящее изобретение относится к антителам, специфически связывающимся с белками по настоящему изобретению или с их фрагментами.
Кроме того, настоящее изобретение относится к клеткам-хозяевам, стабильным клеточным линиям, трансгенным животным и трансгенным растениям, содержащим нуклеиновые кислоты, векторы или экспрессионные кластеры по настоящему изобретению.
В еще одном варианте своего осуществления настоящее изобретение относится к олигонуклеотидам или зондам, содержащим нуклеотидные последовательности, способные гибридизоваться с рассматриваемыми нуклеиновыми кислотами.
Настоящее изобретение также относится к способам, в которых используется флуоресцирующий белок по настоящему изобретению или нуклеиновая кислота, кодирующая этот белок.
В предпочтительном варианте своего осуществления настоящее изобретение относится к способу мечения биологической молекулы, где указанный способ предусматривает связывание указанной биологической молекулы с белком по настоящему изобретению.
В другом своем предпочтительном варианте настоящее изобретение относится к способу мечения клетки, где указанный способ предусматривает продуцирование белка по настоящему изобретению в клетке.
В другом своем предпочтительном варианте настоящее изобретение относится к способу мечения клеточной органеллы, где указанный способ предусматривает продуцирование белка по настоящему изобретению, присоединенного к подходящему субклеточному сигналу локализации в клетке.
В еще одном своем предпочтительном варианте настоящее изобретение относится к способу анализа биологической молекулы, клетки или клеточной органеллы, где указанный способ предусматривает детекцию флуоресцирующего сигнала, поступающего от белка по настоящему изобретению.
В другом своем предпочтительном варианте настоящее изобретение относится к способу анализа биологической молекулы, клетки или клеточной органеллы, где указанный способ предусматривает экспрессию молекулы нуклеиновой кислоты по настоящему изобретению в клетке.
Кроме того, настоящее изобретение относится к наборам, содержащим нуклеиновые кислоты, векторы или экспрессионные кластеры, включающие указанные нуклеиновые кислоты или белки по настоящему изобретению.
Краткое описание фигур
На фигуре 1 показано сопоставление последовательностей путем выравнивания последовательностей новых флуоресцирующих белков веслоногих ракообразных (Copepoda) с последовательностями GFP A. victoria и DsRed. Нумерация дана по GFP. Вводимые пробелы показаны точками. GFP Copepoda сравнивают с ppluGFP1: в их последовательностях остатки, идентичные соответствующим аминокислотам в ppluGFP1, показаны пунктиром.
На фигуре 2 проиллюстрированы спектры возбуждения (пунктирная линия) и спектры излучения (сплошная линия) ppluGFP1 дикого типа (ppluGFP2 имеет по существу аналогичные спектры).
На фигуре 3 проиллюстрированы спектры возбуждения (пунктирная линия) и спектры излучения (сплошная линия) laesGFP дикого типа.
На фигуре 4 проиллюстрированы спектры возбуждения (пунктирная линия) и спектры излучения (сплошная линия) pmeaGFP1 дикого типа.
На фигуре 5 проиллюстрированы спектры возбуждения (пунктирная линия) и спектры излучения (сплошная линия) pmeaGFP2 дикого типа.
На фигуре 6 проиллюстрированы спектры возбуждения (пунктирная линия) и спектры излучения (сплошная линия) pmedGFP1 дикого типа.
На фигуре 7 проиллюстрированы спектры возбуждения (пунктирная линия) и спектры излучения (сплошная линия) pmedGFP2 дикого типа.
На фигуре 8 проиллюстрированы спектры возбуждения (пунктирная линия) и спектры излучения (сплошная линия) pdae1GFP дикого типа.
На фигуре 9 проиллюстрированы спектры возбуждения (пунктирная линия) и спектры излучения (сплошная линия) CopCFP.
Подробное описание изобретения
Как уже было вкратце описано выше, настоящее изобретение относится к молекулам нуклеиновой кислоты, кодирующим флуоресцирующие белки и их мутанты, варианты и производные, а также белки и пептиды, кодируемые этими нуклеиновыми кислотами. Представляющие интерес молекулы нуклеиновой кислоты и белки выделены из видов веслоногих ракообразных (Copepoda). Представляющими интерес белками являются зеленые флуоресцирующие белки, ppluGFP1 (SEQ ID NO:2), ppluGFP2 (т.е. CopGFP, SEQ ID NO:4), laesGFP (SEQ ID NO:6), pmeaGFP1 (SEQ ID NO:8), pmeaGFP2 (SEQ ID NO:10), pdae1GFP (SEQ ID NO:16), pmedGFP1 (SEQ ID NO:12) и pmedGFP2 (SEQ ID NO:14). Интерес представляют также белки, которые являются по существу аналогичными вышеупомянутым конкретным белкам, или их производные, гомологи или мутанты. Настоящее изобретение также относится к фрагментам нуклеиновых кислот и к пептидам, кодируемым этими фрагментами, а также к антителам, специфичным к таким белкам и пептидам по настоящему изобретению. Кроме того, настоящее изобретение относится к клеткам-хозяевам, стабильным клеточным линиям и трансгенным организмам, содержащим вышеупомянутые молекулы нуклеиновой кислоты. Рассматриваемые композиции белков и нуклеиновых кислот могут быть использованы в различных целях, и они могут найти применение в различных способах, а в частности в способах мечения белков. И, наконец, настоящее изобретение относится к наборам для использования в указанных способах и целях.
Молекулы нуклеиновой кислоты
Настоящее изобретение относится к молекулам нуклеиновой кислоты, кодирующим флуоресцирующие белки из видов веслоногих ракообразных (Copepoda), производные, мутанты и гомологи этих белков, а также их фрагменты. Используемые здесь молекулы нуклеиновой кислоты представляют собой молекулы ДНК, такие как геномные молекулы ДНК или молекулы кДНК либо молекулы РНК, такие как молекулы мРНК. В частности, указанные молекулы нуклеиновой кислоты представляют собой молекулы кДНК, имеющие открытую рамку считывания, кодирующую флуоресцирующий белок Copepoda по настоящему изобретению или его фрагмент, и обладающие способностью в определенных условиях экспрессироваться в виде флуоресцирующего белка или фрагмента белка (пептида) по настоящему изобретению. Настоящее изобретение также охватывает нуклеиновые кислоты, которые являются гомологичными по существу аналогичными или идентичными нуклеиновым кислотам, кодирующим белки или фрагменты белков по настоящему изобретению, или которые происходят из указанных нуклеиновых кислот или являются их миметиками. Рассматриваемые нуклеиновые кислоты присутствуют в окружении, которое не является их природным окружением, например, эти нуклеиновые кислоты либо являются выделенными, либо присутствуют в повышенном количестве, либо присутствуют или экспрессируются in vitro или в клетке или организме, в которых они обычно не встречаются в природе.
Конкретные представляющие интерес молекулы нуклеиновой кислоты могут быть выделены из организма типа Arthropoda, предпочтительно подтипа Crustacea, более предпочтительно класса Maxillopoda, более предпочтительно подкласса Copepoda, еще более предпочтительно отряда Calanoida и наиболее предпочтительно семейства Pontellidae.
Конкретными представляющими интерес молекулами нуклеиновой кислоты являются молекулы нуклеиновой кислоты, кодирующие нижеследующие зеленые флуоресцирующие белки Copepoda (и их гомологи/производные/мутанты): белки ppluGFP1, ppluGFP2 из Pontellina plumata, laesGFP из Labidocera aestiva, белки pmeaGFP1 и pmeaGFP2 из сем. Pontella meadi Wheeler, белки pmeadGFP1 и pmedGFP2 из Pontella mediterranea, и белок pdae1GFP из неидентифицированного вида Pontellidae. Каждый из конкретных типов этих представляющих интерес молекул нуклеиновой кислоты более подробно обсуждается ниже в экспериментальной части. Особый интерес также представляют гомологи/мутанты/производные этих белков, такие как CopCFP, CopGFP-NA1-3, более подробно описанные ниже в экспериментальной части. Выведенные кодирующие последовательности кДНК дикого типа для этих белков представлены в SEQ ID NO:1, 3, 5, 7, 9, 11, 13, 15.
Также представляют интерес гомологи вышеописанных молекул нуклеиновой кислоты. Источником гомологичных нуклеиновых кислот может быть любой вид растений или животных, либо указанная последовательность может быть полностью или частично синтезированной, включая миметики нуклеиновой кислоты. В некоторых вариантах изобретения нуклеиновая кислота по настоящему изобретению имеет последовательность, идентичную соответствующим гомологам на нуклеотидном или аминокислотном уровнях, по крайней мере, примерно на 40%, а предпочтительно примерно на 50%, 55%, 60%, 65%, 70% или выше, а именно на 75%, 80%, 85%, 90%, 95% или выше. Эталонная последовательность обычно имеет длину, по крайней мере, примерно в 30 нуклеотидов, а обычно, по крайней мере, примерно в 60 нуклеотидов, и ее длина может достигать длины полноразмерной последовательности, выбранной для сравнения. Сходство последовательностей вычисляют исходя из эталонной последовательности. Алгоритмы для анализа последовательностей известны специалистам, например, такие как BLAST, описанный Altschul et al., J.Mol.Biol., 215, pp.403-10 (1990) (например, с использованием параметров по умолчанию, то есть параметров w=4 и Т=17).
Гомологи могут быть идентифицированы любым из имеющихся различных методов. Фрагмент кДНК по настоящему изобретению может быть использован в качестве гибридизационного зонда против кДНК-библиотеки, полученной из организма-мишени, с использованием условий низкой жесткости. Этот зонд может представлять собой большой фрагмент или один или несколько коротких вырожденных праймеров. Нуклеиновые кислоты, имеющие сходство, детектируют путем гибридизации в условиях низкой жесткости, например, при 50°С и 6×SSC (0,9 М хлорид натрия/0,9 М цитрат натрия) с последующей промывкой при 55°С в 1×SSC (150 мМ хлорид натрия/15 мМ цитрат натрия). Идентичность последовательности может быть определена путем гибридизации в условиях высокой жесткости, например, при 50°С или выше, при 0,1×SSC (15 мМ хлорид натрия/1,5 мМ цитрат натрия). Нуклеиновые кислоты, имеющие область, по существу идентичную рассматриваемым последовательностям, например аллельные варианты, генетически модифицированные варианты нуклеиновой кислоты и т.п., связываются с рассматриваемыми последовательностями в условиях гибридизации высокой жесткости. С использованием зондов, а в частности меченых зондов ДНК-последовательностей, можно выделить гомологичные или родственные гены.
Настоящее изобретение также относится к нуклеиновым кислотам, которые гибридизуются с вышеуказанными нуклеиновыми кислотами в жестких условиях, а предпочтительно в условиях высокой жесткости (то есть к нуклеиновым кислотам, комплементарным вышеописанным нуклеиновым кислотам). Примером гибридизации в жестких условиях является гибридизация при 50°С или выше, при 0,1×SSC (15 мМ хлорид натрия/1,5 мМ цитрат натрия). Другим примером условий гибридизации высокой жесткости является инкубирование при 42°С в растворе 50% формамида, 5×SSC, 50 мМ фосфата натрия (рН 7,6), 5% раствора Денхардта, 10% сульфата декстрана и 20 мкг/мл денатурированной фрагментированной ДНК спермы лосося, с последующей промывкой в 0,1×SSC примерно при 65°С. Другие условия гибридизации высокой жесткости известны специалистам и могут быть также использованы для идентификации нуклеиновых кислот по настоящему изобретению.
Настоящее изобретение также относится к нуклеиновым кислотам, кодирующим варианты, мутанты или производные белков по настоящему изобретению. Мутанты или производные могут быть генерированы на матричной нуклеиновой кислоте, выбранной из вышеупомянутых нуклеиновых кислот, путем модификации, делеции или добавления одного или нескольких нуклеотидов в матричной последовательности или их комбинации, с продуцированием матричной нуклеиновой кислоты. Указанные модификации, добавления или делеции могут быть введены любым известным методом (см., например, Gustin et al., Biotechniques (1993) 14:22; Barany, Gene (1985) 37:111-123; и Colicelli et al., Mol. Gen. Genet. (1985) 199:537-539, Sambrook, J.,, Molecular Cloning: A Laboratory manual (1989), CSH Press, pp.15.3-15.108), включая ПЦР с вероятностью ошибки, перетасовку генов, олигонуклеотид-направленный мутагенез, ПЦР полноразмерной последовательности, мутагенез для проведения ПЦР по определению половой принадлежности, in vivo мутагенез, кластерный мутагенез, рекурсивный статистический мутагенез, экспоненциальный статистический мутагенез, сайт-направленный мутагенез, неспецифический мутагенез, мутагенез при вторичной сборке генов, сайт-насыщенный мутагенез (GSSM), мутагенез при вторичной сборке, синтезированной путем лигирования (SLR) или их комбинации. Указанные модификации, добавления или делеции могут быть введены методом, предусматривающим рекомбинацию, рекомбинацию рекурсивной последовательности, мутагенез с помощью фосфотиоат-модифицированной ДНК, мутагенез с помощью урацил-содержащей матрицы, мутагенез с образованием дуплексов с брешами, мутагенез при репарации точковых несоответствий, мутагенез штамма-хозяина, дефицитного по репарации, химический мутагенез, радиогенный мутагенез, делеционный мутагенез, рестрикционно-селективный мутагенез, мутагенез при рестрикционной очистке, синтез искусственных генов, статистический мутагенез, создание химерных мультимеров нуклеиновых кислот и их комбинации. В некоторых вариантах осуществления изобретения флуоресцирующие белки, кодируемые мутантными или производными нуклеиновыми кислотами, обладают такими же флуоресцентными или биологическими свойствами, как и флуоресцирующие белки дикого типа. В других вариантах осуществления изобретения мутантные или производные нуклеиновые кислоты кодируют флуоресцирующие белки с измененными свойствами, описанными более подробно для мутантов CopCFP, CopCFP-NA1-3, см. ниже.
Кроме того, настоящее изобретение также относится к вырожденным вариантам нуклеиновых кислот, кодирующим белки по настоящему изобретению. Вырожденные варианты нуклеиновых кислот включают замены кодонов нуклеиновой кислоты другими кодонами, кодирующими те же самые аминокислоты. В частности, вырожденные варианты нуклеиновых кислот генерируют в целях усиления их экспрессии в клетке-хозяине. В этом варианте изобретения кодоны нуклеиновой кислоты, которые не являются предпочтительными или являются менее предпочтительными в генах данной клетки-хозяина, заменяют кодонами, более часто встречающимися в кодирующих последовательностях генов в данной клетке-хозяине, где указанные замененные кодоны кодируют ту же самую аминокислоту. Особый интерес представляют "гуманизированные" варианты нуклеиновых кислот по настоящему изобретению. Используемый здесь термин "гуманизированный" относится к заменам, сделанным в последовательности нуклеиновой кислоты для оптимизации кодонов для экспрессии белка в клетках млекопитающего (человека) (Yang et al., Nucleic Acids Research (1996) 24:4592-4593). См. также патент США №5795737, в котором описана гуманизация белков и описание которого вводится в настоящее описание посредством ссылки. Примеры представляющих интерес вырожденных вариантов более подробно описаны ниже в экспериментальной части.
Используемый здесь термин "кДНК" означает нуклеиновые кислоты, которые имеют одно и то же расположение элементов последовательности, присутствующих в нативных зрелых молекулах мРНК, где элементами последовательности являются экзоны и 5'- и 3'-некодирующие области. Обычно молекулы мРНК имеют смежные экзоны; при этом интроны, если они присутствуют, удаляются при сплайсинге ядерной РНК, в результате чего образуется непрерывная открытая рамка считывания, кодирующая данный белок.
Представляющая интерес геномная последовательность может содержать нуклеиновую кислоту, присутствующую между кодоном инициации и стоп-кодоном, определенными в указанных последовательностях, включая все интроны, которые обычно присутствуют в природной хромосоме. Представляющая интерес геномная последовательность может, кроме того, включать 5'- и 3'-нетранслируемые области, присутствующие в зрелой мРНК, а также последовательности, регулирующие транскрипцию и трансляцию, такие как промоторы, энхансеры и т.п., включающие примерно 1 т.п.н., а возможно даже фланкирующую геномную ДНК либо у 5'-, либо у 3'-конца транскрибируемой области.
Молекулы нуклеиновой кислоты по настоящему изобретению могут кодировать все рассматриваемые белки или их часть. Двухцепочечные или одноцепочечные фрагменты могут быть получены из ДНК-последовательности путем химического синтеза олигонуклеотидов стандартными методами, путем гидролиза рестриктирующими ферментами, путем ПЦР-амплификации и т.п. В большинстве случаев ДНК-фрагменты имеют длину, по крайней мере, примерно в 15 нуклеотидов, а обычно, по крайней мере, примерно в 18 нуклеотидов или примерно 25 нуклеотидов, и они могут иметь длину, по крайней мере, примерно в 50 нуклеотидов. В некоторых вариантах осуществления изобретения рассматриваемые молекулы нуклеиновой кислоты могут иметь длину примерно в 100, 200, 300, 400, 500, 600, 700 нуклеотидов или более. Рассматриваемые нуклеиновые кислоты могут кодировать фрагменты рассматриваемых белков или полноразмерных белков, так, например, рассматриваемые нуклеиновые кислоты могут кодировать полипептиды, имеющие длину примерно 25, 50, 75, 100, 125, 150, 200 аминокислот, вплоть до полноразмерного белка.
Рассматриваемые нуклеиновые кислоты могут быть выделены и получены по существу в очищенной форме. Термин "по существу очищенная форма" означает, что нуклеиновые кислоты имеют, по крайней мере, примерно 50%-ную чистоту, а в основном, по крайней мере, примерно 90%-ную чистоту, и обычно являются "рекомбинантными", т.е. фланкированными одним или несколькими нуклеотидами, с которыми они обычно не ассоциированы на природной хромосоме в природном организме-хозяине.
Нуклеиновые кислоты по настоящему изобретению, например, имеющие последовательности SEQ ID NO:1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25 или 27, соответствующие кДНК, полноразмерные гены и конструкции, могут быть синтезированы в соответствии с различными протоколами, известными специалистам. Соответствующие конструкции нуклеиновых кислот очищают стандартными методами рекомбинантных ДНК, описанными, например, в руководстве Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., (1989) Cold Spring Harbor Press, Cold Spring Harbor, NY, и в соответствии с директивами, утвержденными Департаментом Здравоохранения и социальной службы Соединенных Штатов при Национальном институте здравоохранения (NIH), для исследования рекомбинантных ДНК.
Настоящее изобретение также относится к нуклеиновым кислотам, кодирующим гибридные белки, содержащие белок по настоящему изобретению или его фрагменты, которые более подробно обсуждаются ниже.
Настоящее изобретение также относится к векторам и к другим конструкциям нуклеиновых кислот, содержащим рассматриваемые нуклеиновые кислоты. Подходящими векторами являются вирусные и невирусные векторы, плазмиды, космиды, фаги и т.п., а предпочтительно плазмиды, используемые для клонирования, амплификации, экспрессии, переноса и т.п. последовательности нуклеиновой кислоты по настоящему изобретению в соответствующем хозяине. Выбор соответствующего вектора хорошо известен специалистам, и многие из таких векторов являются коммерчески доступными. Для получения конструкций неполную или полноразмерную нуклеиновую кислоту встраивают в вектор обычно путем присоединения ДНК-лигазы к сайту расщепления рестриктирующими ферментами в данном векторе. Альтернативно, нужная нуклеотидная последовательность может быть встроена путем гомологичной рекомбинации in vivo, обычно путем присоединения гомологичных областей к вектору по концам нужной нуклеотидной последовательности. Гомологичные области присоединяют путем лигирования олигонуклеотидов или посредством полимеразной цепной реакции с использованием праймеров, содержащих, например, как гомологичную область, так и часть нужной нуклеотидной последовательности.
Настоящее изобретение также относится к экспрессионным кластерам или к системам, используемым inter alia для продуцирования рассматриваемых хромогенных или флуоресцирующих белков или их гибридных белков, или для репликации рассматриваемых молекул нуклеиновой кислоты. Экспрессионный кластер может присутствовать в виде внехромосомного элемента, либо он может быть интегрирован в геном клетки в результате введения указанного экспрессионного кластера в эту клетку. В целях осуществления экспрессии генный продукт, кодируемый нуклеиновой кислотой по настоящему изобретению, экспрессируют в любой подходящей экспрессионной системе, включая, например, бактериальные системы, дрожжевые системы, системы насекомых, системы амфибий или системы млекопитающих. В данном экспрессирующем векторе рассматриваемая нуклеиновая кислота функционально связана с регуляторной последовательностью, которая может включать промоторы, энхансеры, терминаторы, операторы, супрессоры и индукторы. Методы получения экспрессионных кластеров или систем, способных экспрессировать нужный продукт, известны специалистам.
Клеточные линии, стабильно экспрессирующие белки по настоящему изобретению, могут быть отобраны методами, известными специалистам (например, путем ко-трансфекции с селективным маркером, таким как dhfr, gpt, ген резистентности к неомицину и ген резистентности к гигромицину, что позволяет идентифицировать и выделять трансфецированные клетки, содержащие ген, интегрированный в геном.
Вышеописанные системы экспрессии могут быть использованы в прокариотических или в эукариотических хозяевах. Для продуцирования белка могут быть использованы клетки-хозяева, такие как E.coli, B. subtilis, S. cerevisiae, клетки насекомых в комбинации с бакуловирусными векторами, или клетки высших организмов, таких как позвоночные, например клетки COS 7, НЕК 293, СНО, ооциты Xenopus и т.п.
Если любая из вышеуказанных клеток-хозяев или других подходящих клеток-хозяев или организмов используется для репликации экспрессируемых нуклеиновых кислот по настоящему изобретению, то полученные в результате реплицированные нуклеиновые кислоты, экспрессированный белок или полипептид входят в объем настоящего изобретения как продукт клетки или организма-хозяина. Этот продукт может быть выделен соответствующими методами, известными специалистам.
Интерес представляют также промоторные последовательности геномных последовательностей по настоящему изобретению, где последовательность 5'-фланкирующей области может быть использована для промоторных элементов, включая сайты связывания энхансера, которые, например, обеспечивают регуляцию экспрессии в клетках/тканях, где экспрессируется рассматриваемый ген белка.
Настоящее изобретение также относится к небольшим ДНК-фрагментам рассматриваемых нуклеиновых кислот, которые могут быть использованы в качестве праймеров для ПЦР, зондов для скрининга гибридизации и т.п. Более крупные ДНК-фрагменты могут быть использованы для продуцирования кодируемого полипептида, описанного выше. Однако для использования в реакциях геометрической амплификации, таких как геометрическая ПЦР, может оказаться подходящей пара небольших ДНК-фрагментов, то есть праймеров. Точный состав праймерных последовательностей не имеют решающего значения для настоящего изобретения, однако в большинстве случаев праймеры должны гибридизоваться с рассматриваемой последовательностью в жестких условиях, известных специалистам. Предпочтительно выбирать такую пару праймеров, которая генерировала бы продукт амплификации, состоящий, по крайней мере, примерно из 50 нуклеотидов, а предпочтительно, по крайней мере, примерно из 100 нуклеотидов, либо продукт, имеющий полноразмерную последовательность нуклеиновой кислоты. Алгоритмы для отбора праймерных последовательностей в основном известны специалистам и поставляются с коммерчески доступными пакетами программ. Праймеры для амплификации гибридизируются с комплементарными цепями ДНК и служат затравкой по отношению друг к другу.
Молекулы нуклеиновой кислоты по настоящему изобретению могут быть также использованы для идентификации экспрессии гена в биологическом образце. Способ, в котором клетки зондируют на присутствие конкретных нуклеотидных последовательностей, таких как геномная ДНК или РНК, хорошо известен специалистам. Вкратце, ДНК или мРНК выделяют из клеточного образца. мРНК может быть амплифицирована с помощью ОТ-ПЦР с использованием обратной транскриптазы с образованием комплементарной ДНК-цепи и последующей амплификацией посредством полимеразной цепной реакции с использованием праймеров, специфичных для рассматриваемых ДНК-последовательностей. Альтернативно, образец мРНК выделяют с помощью гель-электрофореза, переносят на подходящий носитель, например нитроцеллюлозу, найлон и т.п., а затем зондируют фрагментом рассматриваемой ДНК, используемым в качестве зонда. Могут быть использованы и другие методы, такие как анализы на лигирование олигонуклеотидов, in situ гибридизация и гибридизация с ДНК-зондами, составляющими массив на твердом чипе. Детекция мРНК, гибридизирующейся с рассматриваемой последовательностью, является показателем экспрессии гена в образце.
Рассматриваемые нуклеиновые кислоты, включая фланкирующие промоторные области и кодирующие области, могут быть мутированы различными известными методами, используемыми специалистами для генерирования нужных изменений силы промотора или для изменения последовательности кодируемого белка или свойств кодируемого белка, включая флуоресцентные свойства кодируемого белка.
Белки
Настоящее изобретение также относится к флуоресцирующим белкам Copepoda, к их производным или мутантам, включая полноразмерные белки, а также к их частям или фрагментам. Настоящее изобретение также относится к вариантам природного белка, где указанные варианты являются гомологичными или по существу аналогичными природному белку, и к мутантам природных белков, более подробно описанных ниже.
Во многих вариантах осуществления изобретения рассматриваемые белки имеют максимальную оптическую плотность при длине волны в пределах примерно от 300 нм до 700 нм, обычно примерно от 350 нм до 550 нм, в основном примерно от 450 нм до 550 нм, а чаще всего примерно от 470 нм до 520 нм, например от 470 до 500 нм, а спектры излучения рассматриваемых белков обычно составляют в пределах от 400 нм до 700 нм, обычно примерно от 450 нм до 650 нм, а в основном примерно от 480 нм до 600 нм, а во многих вариантах осуществления изобретения спектры излучения составляют в пределах примерно от 480 нм до 550 нм, например от 490 до 520 нм или от 490 до 510 нм. Рассматриваемые белки обычно имеют максимальный коэффициент экстинкции, который составляет в пределах примерно от 25000 до 150000, а обычно примерно от 45000 до 120000, например от 50000 до 100000. Рассматриваемые белки обычно имеют длину примерно от 150 до 300 аминокислот, а обычно примерно от 200 до 300 аминокислотных остатков, а их молекулярная масса в основном составляет в пределах примерно от 15 до 35 кДа, а обычно примерно от 17,5 до 32,5 кДа.
В некоторых вариантах осуществления изобретения рассматриваемые белки дают яркую флуоресценцию, где термин "яркий" означает, что хромогенные и флуоресцирующие белки могут быть детектированы общеизвестными методами (например, путем визуального скрининга, спектрофотометрии, спектрофлуориметрии, флуоресцентной микроскопии, FACS-сортинга и т.п.). Яркость флуоресценции конкретных флуоресцирующих белков определяют по ее квантовому выходу, умноженному на максимальный коэффициент экстинкции. Яркость хромопротеинов может быть выражена по их максимальному коэффициенту экстинкции.
В некоторых вариантах осуществления изобретения рассматриваемые белки быстро подвергаются сборке после их экспрессии в клетке-хозяине. Термин "быстрая сборка" означает, что данные белки образуют свою третичную структуру, которая приводит к достижению их хромогенных или флуоресцентных свойств за короткий период времени. В этих вариантах изобретения период времени, за который достигается сборка белков, не превышает примерно 3 дней, обычно она не превышает примерно 2 дней, а в основном примерно 1 день.
Конкретно представляющими интерес белками являются флуоропротеины (и их гомологи, мутанты и производные) типа Arthropoda, предпочтительно подтипа Crustacea, более предпочтительно класса Maxillopoda, еще более предпочтительно подкласса Copepoda, еще более предпочтительно отряда Calanoida и наиболее предпочтительно семейства Pontellidae.
Конкретными представляющими интерес белками являются зеленые флуоресцирующие белки Copepoda (и их гомологи/производные/мутанты): белки ppluGFP1, ppluGFP2 из Pontellina plumata, laesGFP из Labidocera aestiva, белки pmeaGFP1 и pmeaGFP2 из сем. Pontella meadi, Wheeler, белки pmeadGFP1 и pmedGFP2 из Pontella mediterrania и белок pdae1GFP из неидентифицированного вида Pontellidae. Каждый из конкретных типов представляющих интерес белков более подробно обсуждается ниже в экспериментальной части. Аминокислотные последовательности этих белков дикого типа представлены в SEQ ID NO:2, 4, 6, 8, 10, 12, 14, 16. Особый интерес также представляют гомологи/мутанты/производные этих белков, такие как CopCFP, CopGFP-NA1, CopGFP-NA2, CopGFP-NA3, более подробно описаны ниже в экспериментальной части.
Настоящее изобретение также относится к гомологам или белкам, последовательность которых варьируется по сравнению с указанными выше аминокислотными последовательностями по настоящему изобретению, то есть SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26 или 28. Термин "гомолог" означает белок, имеющий последовательность, которая, по крайней мере, примерно на 50%, обычно, по крайней мере, примерно на 55%, а в основном, по крайней мере, примерно на 60% идентичны аминокислотным последовательностям SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, 20, 22, 24, 26 или 28, определенным с использованием MegAlign, алгоритма DNAstar clustal, описанного D.G. Higgins и Р.М.Sharp, "Fast and Sensitive multiple Sequence Alignment on a Microcomputer", CABIOS, 5 pp.151-3 (1989)(с использованием параметров: ktuple 1, штраф на пробел 3, окно 5, и сохранение диагоналей 5). Во многих вариантах осуществления изобретения представляющие интерес гомологи имеют гораздо большую идентичность последовательностей, которая составляет, например, 70%, 75%, 80%, 85%, 90% (например, 92%, 93%, 94%) или выше, например 95%, 96%, 97%, 98%, 99%, 99,5%, в частности для аминокислотной последовательности, обеспечивающей функциональные области белка.
Настоящее изобретение также относится к белкам по существу идентичным белку дикого типа, где термин "по существу идентичный" означает, что указанный белок имеет аминокислотную последовательность, идентичную последовательности белка дикого типа, по крайней мере, примерно на 60%, обычно, по крайней мере, примерно на 65%, а в основном, по крайней мере, примерно на 70%, где в некоторых случаях идентичность может быть гораздо выше, например 75%, 80%, 85%, 90%, 95% или выше.
Настоящее изобретение также относится к белкам, которые являются производными или мутантами вышеописанных природных белков. Мутанты и производные могут сохранять биологические свойства белков дикого типа (например, природных белков), либо они могут иметь биологические свойства, отличающиеся от свойств белков дикого типа. Термин "биологические свойства" белков по настоящему изобретению означает, но не ограничивается ими, спектральные свойства, такие как максимальная оптическая плотность, максимальное излучение, максимальный коэффициент экстинкции, яркость (например, по сравнению с белком дикого типа или с другим известным белком, таким как зеленый флуоресцирующий белок (GFP) из A. victoria) и т.п.; биохимические свойства, такие как in vivo и/или in vitro-стабильность (например, время полужизни); скорость созревания, тенденция к агрегации и тенденция к олигомеризации и другие подобные свойства. Мутациями являются замены одной аминокислоты, делеции или инсерции одной или нескольких аминокислот, N-концевые усечения или удлинения, С-концевые усечения или удлинения и т.п.
Мутанты и производные могут быть получены стандартными методами молекулярной биологии, подробно описанными в разделе "Молекулы нуклеиновой кислоты". В настоящей заявке также описано несколько мутантов. В соответствии с описанием, представленным в примерах, и с применением стандартных методов каждый специалист может легко получить дополнительные мутанты широкого ряда и протестировать их на изменение биологических свойств (например, биохимических, спектральных свойств и т.п.). Так, например, интенсивность флуоресценции может быть измерена с использованием спектрофотометра при возбуждении на различных длинах волн.
Производные могут быть также получены стандартными методами, которые предусматривают РНК-"корректировку", химическую модификацию, посттрансляционные и посттранскрипционные модификации и т.п. Так, например, производные могут быть получены такими способами, как модифицированное фосфорилирование, гликозилирование, ацетилирование или липидизация либо другие типы расщепления с образованием зрелых молекул и т.п.
Белки по настоящему изобретению, которые представляют собой природные белки, присутствуют в их неприродном окружении, например, они отделены от природного окружения. Так, например, в настоящем изобретении рассматриваются очищенные белки, где термин "очищенный" означает, что указанный белок присутствует в смеси, по существу не содержащей представляющих интерес нехромогенных или флуоресцирующих белков, где термин "по существу не содержащий" означает, что содержание указанных нехромогенных или флуоресцирующих белков или мутантов в указанной смеси составляет менее чем 90%, обычно менее чем 60%, а в основном менее чем 50%. Белки по настоящему изобретению могут также присутствовать в выделенной форме, что означает, что указанный белок по существу не содержит других белков и других природных биологических молекул, таких как олигосахариды, нуклеиновые кислоты и их фрагменты и т.п., где термин "по существу не содержит" в данном случае означает, что в композиции, содержащей данный выделенный белок, некоторые другие природные биологические молекулы составляют менее чем 70%, обычно менее чем 60%, а в основном менее чем 50%. В некоторых вариантах осуществления изобретения указанные белки присутствуют по существу в очищенной форме, где "по существу очищенная форма" означает, что чистота этого белка составляет, по крайней мере, 95%, обычно, по крайней мере, 97%, а в основном, по крайней мере, 99%.
Настоящее изобретение также относится к природным белкам, а также к их мутантам и производным, описанным выше. Особый интерес представляют биологически активные фрагменты и/или фрагменты, соответствующие функциональным доменам и т.п. Такими представляющими интерес фрагментами являются полипептиды, которые обычно имеют длину, по крайней мере, примерно 30 аминокислот, обычно, по крайней мере, примерно 50 аминокислот, предпочтительно, по крайней мере, примерно 75 или 100 аминокислот, либо они могут иметь длину, по крайней мере, 300 аминокислот или более, но в основном их длина не превышает примерно 250 аминокислот, где указанным фрагментом является участок из аминокислот, идентичный рассматриваемому белку и имеющий длину, по крайней мере, примерно 25 аминокислот, а обычно, по крайней мере, примерно 45 аминокислот, а во многих вариантах изобретения, по крайней мере, примерно 50 аминокислот. В некоторых вариантах осуществления изобретения рассматриваемые полипептиды имеют длину примерно в 25, 50, 75, 100, 125, 150, 200 или 250 аминокислот или являются полноразмерным белком. В некоторых вариантах осуществления изобретения фрагмент белка сохраняет все или по существу все специфические свойства белка дикого типа.
Рассматриваемые белки и полипептид могут быть получены из природных источников, либо они могут быть получены путем синтеза. Так, например, белки дикого типа могут происходить из биологических источников, экспрессирующих указанные белки, например из организмов вида Copepoda, таких как конкретные виды, перечисленные выше. Рассматриваемые белки могут быть также получены путем синтеза, например путем экспрессии кодирующей последовательности рекомбинантной нуклеиновой кислоты, кодирующей нужный белок в подходящем хозяине, как описано выше. При этом могут быть использованы любые стандартные процедуры очистки белков, где подходящие методы очистки белков описаны в руководстве по очистке белков (Guide to Protein Purification, Deuthser ed., Academic Press, 1990). Так, например, лизат может быть получен из природного источника и очищен с помощью ВЭЖХ, эксклюзионной хроматографии, гель-электрофореза, аффинной хроматографии и т.п.
Настоящее изобретение также относится к гибридным белкам, содержащим белок по настоящему изобретению, или к его фрагментам, присоединенным, например, к последовательности для деградации, к последовательности субклеточной локализации (например, сигналу ядерной локализации, сигналу доставки в пероксисому, последовательности доставки в аппарат Гольджи, последовательности доставки в митохондрии и т.п.), к сигнальному пептиду или к любому белку или полипептиду, представляющему интерес. Гибридные белки могут содержать, например, флуоресцирующий белок полипептида по настоящему изобретению и второй полипептид ("партнер-компонент гибридного белка"), присоединенный у N-конца и/или С-конца флуоресцирующего белка с сохранением рамки считывания. Партнерами гибридного белка являются, но не ограничиваются ими, полипептиды, которые могут связываться с антителами, специфичными к данному партнеру по связыванию (например, эпитопные метки), антитела или их связывающие фрагменты, полипептиды, которые обладают каталитической функцией или индуцируют клеточный ответ, лиганды или их рецепторы или их миметики и т.п. В таких гибридных белках партнер по связыванию обычно не ассоциируется в природе с флуоро/хромогенным белком, являющимся частью гибридного белка, и обычно он не является флуоресцирующим белком Copepoda по настоящему изобретению или его производным/фрагментом, то есть он не встречается в видах Copepoda.
Настоящее изобретение относится к антителам, которые специфически связываются с флуоресцирующими или хромогенным белками по настоящему изобретению. Подходящие антитела могут быть получены методами, известными специалистам. Так, например, поликлональные антитела могут быть получены, как описано в руководстве Harlow and Lane Antibodies: A Laboratory Manual, (1989) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, а моноклональные антитела могут быть получены, как описано в руководстве Goding Monoclonal Antibodies: Principles and Practice: Production and Application of Monoclonal Antibodies in Cell Biology, Biochemistry and Immunology; 3rd edition (1996) Academic Press. Интерес также представляют химерные антитела, включая гуманизированные антитела, а также одноцепочечные антитела, и фрагменты антител, такие как Fv, F(ab')2 и Fab.
Трансформанты
Нуклеиновые кислоты по настоящему изобретению могут быть использованы для генерирования трансформантов, включая трансгенные организмы или сайт-специфические модификации генов в клеточных линиях. Трансгенные клетки по настоящему изобретению включают одну или несколько нуклеиновых кислот по настоящему изобретению, присутствующих в качестве трансгена. В целях по настоящему изобретению может быть использована любая подходящая клетка-хозяин, включая прокариотические (например, Escherichia coli, Streptomyces sp., Bacillus subtilis, Lactobacillus acidophilus и т.п.) или эукариотические клетки-хозяева. Трансгенным организмом по настоящему изобретению может быть прокариотический или эукариотический организм, включая бактерии, цианобактерии, грибы, растения и животные, в которых одна или несколько клеток указанного организма содержат гетерологичную нуклеиновую кислоту по настоящему изобретению, вводимую путем ее встраивания человеку, например, трансгенными методами, хорошо известными специалистам.
Выделенная нуклеиновая кислота по настоящему изобретению может быть введена хозяину известными методами, например путем инфицирования, трансфекции, трансформации или трансконъюгирования. Методы переноса молекул нуклеиновой кислоты (то есть ДНК) в такие организмы хорошо известны специалистам и описаны в руководствах Sambrook et al. (Molecular Cloning: A Laboratory Manual, 3rd Ed., (2001) Cold Spring Harbor Press, Cold Spring Harbor, NY).
В одном из вариантов осуществления изобретения трансгенным организмом может быть прокариотический организм. Методы трансформации прокариотических хозяев хорошо описаны в литературе (например, см. Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd edition (1989) Cold Spring Harbor Laboratory Press and Ausubel et al., Current Protocols in Molecular Biology (1995) John Wiley & Sons, Inc.).
В другом варианте осуществления изобретения указанным трансгенным организмом могут быть грибы, например дрожжи. Дрожжи широко используются в качестве носителя для экспрессии гетерологичных генов (например, см. Goodey et al., Yeast biotechnology, D.R. Berry et al., eds, (1987) Allen & Unwin, London, pp.401-429, и King et al., Molecular and Cell Biology of Yeasts, E.F. Walton & G.T. Yarronton, eds, Blackie, Glasgow (1989) pp.107-133). Существует несколько типов дрожжевых векторов, включая интегрирующие векторы, для поддержания которых требуется рекомбинация с геномом хозяина, и автономно реплицирующиеся плазмидные векторы.
Другим организмом-хозяином является животное. Трансгенные животные могут быть получены трансгенными методами, хорошо известными специалистам и описанными в работах, таких как Pinkert, Transgenic Animal Technology: а Laboratory Handbook, 2nd edition (2203) San Diego: Academic Press; Gersenstein & Vinterstein, Manipulating the Mouse Embryo: A Laboratory Manual, 3rd ed, (2002) Nagy A. (Ed), Cold Spring Harbor Laboratory; Blau et al., Laboratory Animal Medicine, 2nd Ed., (2002) Fox J.G., Anderson L.C., Loew F.M., Quimby F.W. (Eds), American Medical Association, American Psychological Association; Gene Targeting: А Practical Approach by Alexandra L. Joyner (Ed.) Oxford University Press; 2nd edition (2000). Так, например, трансгенные животные могут быть получены путем гомологичной рекомбинации, где эндогенный локус является модифицированным. Альтернативно, конструкция нуклеиновой кислоты может быть произвольно интегрирована в геном. Векторами для стабильной интеграции являются плазмиды, ретровирусы и другие вирусы животных, YAC и т.п.
Нуклеиновая кислота может быть введена в клетку прямо или опосредованно посредством ее введения в клетку-предшественник путем направленной генетической манипуляции, такой как микроинжекция, или путем инфицирования рекомбинантным вирусом или рекомбинантным вирусным вектором и т.п. Термин генетическая манипуляция не включает классический кроссбридинг или in vitro оплодотворение, а означает лишь введение рекомбинантной молекулы нуклеиновой кислоты. Эта молекула нуклеиновой кислоты может быть интегрирована в хромосому, либо она может представлять собой внехромосомную реплицирующуюся ДНК.
ДНК-конструкции для гомологичной рекомбинации содержат, по крайней мере, часть нуклеиновой кислоты по настоящему изобретению, где указанный ген имеет нужные генетические модификации и включает области, гомологичные области локуса-мишени. ДНК-конструкции для произвольной интеграции необязательно должны включать области гомологии для опосредования рекомбинации. Обычно могут быть включены маркеры для позитивного и негативного отбора. Методы генерирования клеток, имеющих нужные генные модификации, образующиеся посредством гомологичной рекомбинации, известны специалистам. Описание различных методов трансфекции клеток млекопитающих можно найти у Keown et al., Meth. Enzymol. (1990) 185:527-537.
Для получения эмбриональных стволовых (ЭС) клеток может быть использована клеточная линия ЭС, либо эмбриональные клетки могут быть взяты непосредственно у хозяина, такого как мышь, крыса, морская свинка и т.п. Такие клетки культивируют на соответствующем питающем подслое в культуре фибробластов, либо их культивируют в присутствии фактора, ингибирующего лейкоз (LIF). Трансформированные эмбриональные стволовые клетки или эмбриональные клетки могут быть использованы для продуцирования трансгенных животных подходящим методом, описанным в литературе.
Трансгенными животными могут быть любые животные, не являющиеся человеком, включая млекопитающих, не являющихся человеком (например, мышей, крыс), птиц или амфибий и т.п., и эти животные могут быть использованы в функциональных исследованиях, в скрининге лекарственных средств и т.п. Репрезентативные примеры использования трансгенных животных описаны ниже.
Могут быть также продуцированы трансгенные растения. Методы получения клеток трансгенных растений и самих растений описаны в патентах США №№5767367, 5750870, 5739409, 5689049, 5689045, 5674731, 5656466, 5633155, 5629470, 5595896, 5576198, 5538879, 5484956, описание которых вводится в настоящее изобретение посредством ссылки. Методы получения трансгенных растений также описаны в работах Plant Biochemistry and Molecular Biology (eds. Lea & Leegood, John Wiley & Sons)(1993) pp.275-295 и Plant Biotechnology and Transgenic Plants (eds. Oksman-Caldentey & Barz), (2002) 719р.
Так, например, эмбриональные эксплантаты, содержащие соматические клетки, могут быть использованы для получения трансгенного хозяина. После сбора клеток или тканей представляющую интерес экзогенную ДНК вводят в клетки растений, используя при этом различные методы, применяемые для такого введения. В случае выделения протопластов имеется возможность использовать протоколы введения посредством ДНК-опосредованного переноса генов, которые предусматривают инкубирование протопластов с "оголенной" ДНК, такой как плазмиды, содержащие представляющую интерес экзогенную кодирующую последовательность в присутствии поливалентных катионов (например, ПЭГ или ПЭО), или электропорацию протопластов в присутствии "оголенной" ДНК, содержащей нужную экзогенную последовательность. Затем отбирают протопласты с успешно встроенной экзогенной ДНК и культивируют их посредством контактирования с соответствующим количеством стимулирующих факторов, таких как ауксины и цитокинины, присутствующих в соответствующем соотношении, в результате чего продуцируется каллюс и в конечном счете трансгенное растение.
Другими подходящими методами, которые могут быть использованы для продуцирования растений, являются такие методы, как методы "выстреливания генов" или методы опосредуемой агробактерией трансформации, известные специалистам.
Способы применения
Флуоресцирующие белки по настоящему изобретению (а также другие компоненты по настоящему изобретению, описанные выше) могут быть использованы в различных целях. Так, например, они могут быть использованы в способах мечения, анализа или детекции биологической молекулы, клетки или клеточной органеллы. Репрезентативное применение каждого из этих типов белков описано ниже, где такое описание приводится лишь в иллюстративных целях и не рассматривается как ограничение применения описанных белков по настоящему изобретению.
В предпочтительном варианте осуществления изобретения, относящемся к способу мечения биологической молекулы, клетки или клеточной органеллы, рассматриваемые белки могут быть использованы в качестве in vivo-меток (или репортерных молекул) в клетке и в анализах, применяемых в молекулярной биологии. Такими представляющими интерес анализами являются, но не ограничиваются ими, анализы на экспрессию генов, локализацию и со-локализацию белков, взаимодействия между белками, взаимодействия между белком и нуклеиновой кислотой, взаимодействия между нуклеиновыми кислотами, локализацию клеток и клеточных органелл и их взаимодействия и т.п. Флуоресцирующие белки по настоящему изобретению могут быть использованы в качестве биомолекулярных меток или в качестве меток клеточных органелл в живых и иммобилизованных клетках; в качестве маркеров в гибридных клетках или органеллах, в качестве маркеров целостности клеток или органелл, в качестве маркеров трансфекции (например, в качестве меток для отбора трансфецированных клеток, содержащих экспрессирующий вектор, кодирующий, по крайней мере, один флуоресцирующий белок по настоящему изобретению), в качестве зонда, действующего в режиме реального времени, при концентрациях, близких к физиологическим, и т.п.
Кроме того, рассматриваемые белки могут быть использованы в способе анализа биологической молекулы. Так, например, они могут быть использованы для идентификации и/или измерения уровня экспрессии нужного белка или полипептида в биологическом материале. Этот способ предусматривает: i) введение в клетку молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую флуоресцирующий белок по настоящему изобретению, где указанная молекула нуклеиновой кислоты функционально присоединена к последовательности регуляции экспрессии и находится под контролем такой последовательности регуляции экспрессии, которая регулирует экспрессию указанного представляющего интерес белка или полипептида; ii) экспрессию указанной нуклеиновой кислоты в подходящих условиях и iii) детекцию излучения флуоресценции флуоресцирующего белка как средство для измерения уровня экспрессии представляющего интерес белка.
В частности, рассматриваемые белки могут быть использованы для идентификации и/или измерения уровня экспрессии и/или определения локализации представляющего интерес белка или полипептида в биологическом материале. Этот способ предусматривает: i) введение в клетку молекулы нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую флуоресцирующий белок по настоящему изобретению, где указанная молекула нуклеиновой кислоты присоединена к последовательности, кодирующей представляющий интерес белок или полипептид, и функционально присоединена к последовательности регуляции экспрессии и находится под контролем такой последовательности регуляции экспрессии, которая регулирует экспрессию указанного представляющего интерес белка или полипептида; ii) культивирование указанной клетки в условиях, благоприятствующих экспрессии указанного представляющего интерес белка, и iii) детекцию излучения флуоресценции флуоресцирующего белка как средство для измерения уровня экспрессии/определения локализации представляющего интерес белка.
Эти представляющие интерес применения белков по настоящему изобретению предусматривают использование этих белков в методах переноса энергии флуоресцирующего резонансного излучения (FRET). В этих методах белки по настоящему изобретению служат в качестве доноров и/или акцепторов в комбинации со вторым флуоресцирующим белком или красителем, например с флуоресцирующим белком, описанным в работе Matz et al., Nature Biotechnology, 17:969-973 (1999); с мутантами зеленого флуоресцирующего белка со сдвигом флуоресценции в область красного диапазона из Aequorea victoria и описанными, например, в патентах США №№6066476, 6020192, 5985577, 5976796, 5968750, 5968738, 5958713, 5919445, 5874304, которые вводятся в настоящее изобретение посредством ссылки; с другими флуоресцирующими красителями, такими как кумарин и его производные, 7-амино-4-метилкумарин и аминокумарин; красители Bodipy, каскадный голубой; или флуоресцеин и его производные, такие как флуоресцеинизоцианат и орегоновый зеленый; родаминовые красители, такие как техасский красный, тетраметилродамин, эозины и эритрозины; цианиновые красители, такие как Су3 и Су5; макроциклические хелатные комплексы ионов лентанида, такие как квантовый краситель; и хемилюминесцентные красители, такие как люциферазы, включая красители, описанные в патентах США №№5843746, 5700673, 5674713, 5618722, 5418155, 5330906, 5229285, 5221623 и 5182202, которые вводятся в настоящее описание посредством ссылки.
Конкретными примерами анализов FRET, в которых могут быть использованы рассматриваемые флуоресцирующие белки, являются, но не ограничиваются ими, детекция взаимодействия между белками, такими как белки, присутствующие в двухкомпонентных гибридных системах млекопитающих; анализ на димеризацию фактора транскрипции, мультимеризацию мембранного белка и образование комплекса множества белков; анализ с использованием этих белков в качестве биосенсоров для ряда различных событий, где пептид или белок ковалентно связывается с флуоресцентной комбинацией FRET, включающей рассматриваемые флуоресцирующие белки, а связывающий пептид или белок представляет собой, например, протеазо-специфический субстрат для опосредованного каспазой расщепления, то есть пептид, который подвергается конформационному изменению после приема сигнала, приводящего к увеличению или снижению FRET, такой как РКА-регуляторный домен (сАМР-сенсор), сайт фосфорилирования (например, если этот сайт фосфорилирования имеется в пептиде, или если этот пептид обладает специфичностью связывания с фосфорилированным/дефосфорилированным доменом другого белка) либо пептид, который имеет Ca2+-связывающий домен. Кроме того, применения переноса энергии резонансной флуоресценции или FRET, где могут быть использованы белки по настоящему изобретению, включают, но не ограничиваются ими, применения, описанные в патентах США №№6008373, 5998146, 5981200, 5945526, 5945283, 5911952, 5869255, 5866336, 5863727, 5728528, 5707804, 5688648, 5439797, которые вводятся в настоящее изобретение посредством ссылки.
Флуоресцирующие белки по настоящему изобретению могут быть использованы в способах детекции влияния тестируемого вещества на регуляцию экспрессии и/или транслокацию одного или нескольких представляющих интерес белков в клетке. Альтернативно, они могут быть использованы в способе детекции экспрессии представляющего интерес белка и одновременно с этим активности последовательности регуляции экспрессии в ответ на действие тестируемого вещества. Флуоресцирующие белки могут быть также использованы в способе сравнения активности двух или более последовательностей регуляции экспрессии в клетке в ответ на действие тестируемого вещества. Такие способы могут быть осуществлены в присутствии и в отсутствие тестируемого вещества, влияние которого на данный процесс необходимо определить.
Флуоресцирующие белки по настоящему изобретению могут быть также использованы в целях автоматического скрининга массивов клеток, экспрессирующих флуоресцентные репортерные группы, с помощью визуализации под микроскопом и электронного анализа. Такой скрининг может быть применен для поиска лекарственных средств и в области функциональной геномики, где рассматриваемые белки используются в качестве маркеров целых клеток для детекции изменений в мультиклеточной реорганизации и миграции, например в образовании мультиклеточных трубочек (образовании кровеносных сосудов) эндотелиальными клетками, миграции клеток через систему включения флуорофоров (Fluoroblok Insert System) (Becton Dickinson Co.), залечивания ран или разрастания нейритов. Такой скрининг может быть также применен в тех случаях, когда белки по настоящему изобретению используются в качестве маркеров, связанных с пептидами (такими как нацеливающие последовательности) или белками, которые позволяют детектировать изменения внутриклеточной локализации и действуют в качестве индикатора клеточной активности, например, при передаче сигнала, такой как транслокация киназы и фактора транскрипции после стимуляции. Примерами являются протеинкиназа С, протеинкиназа А, фактор транскрипции NFkB и NFAT; белки клеточного цикла, такие как циклин А, циклин В1 и циклин Е; расщепление протеазой с последующим переносом отщепленного субстрата; фосфолипиды, а также маркеры внутриклеточных структур, такие как эндоплазматический ретикулум, аппарат Гольджи, митохондрии, пероксисомы, ядра, ядрышки, плазматическая мембрана, гистоны, эндосомы, лизосомы или микротрубочки.
Белки по настоящему изобретению могут быть также использованы в широкомасштабном скрининге для детекции со-локализации других флуоресцирующих гибридных белков с использованием маркеров локализации в качестве индикаторов переноса внутриклеточных флуоресцирующих белков/пептидов или в качестве отдельно взятых маркеров. Примерами такого применения, предусматривающего автоматический скрининг массива клеток, в котором могут быть использованы рассматриваемые флуоресцирующие белки, являются применения, описанные в патенте США №5989835, а также в заявках WO 0017624, WO 00/26408, WO 00/17643 и WO 00/03246, которые вводятся в описание изобретения посредством ссылки.
Флуоресцирующие белки по настоящему изобретению также могут быть использованы в крупномасштабных скрининг-анализах. Рассматриваемые флуоресцирующие белки представляют собой стабильные белки с временем полужизни более чем 24 часа. Настоящее изобретение также относится к дестабилизированным вариантам рассматриваемых флуоресцирующих белков с более коротким временем полужизни, которые могут быть использованы в качестве транскрипционных репортеров для поиска лекарственных средств. Так, например, белок по настоящему изобретению может быть присоединен к предполагаемой протеолитической сигнальной последовательности из белка с более коротким временем полужизни, такой как последовательность PEST из мышиного гена орнитин-декарбоксилазы, последовательность блока деструкции мышиного циклина В1 или последовательность убиквитина и т.п. Описание дестабилизированных белков и векторов, которые могут быть использованы для получения этих белков, можно найти, например, в патенте США №6130313, который вводится в настоящее изобретение посредством ссылки. Промоторы в путях передачи сигнала могут быть детектированы с использованием дестабилизированных вариантов рассматриваемых флуоресцирующих белков для скрининга лекарственных средств, а именно таких белков, как АР1, NFAT, NFkB, Smad, STAT, p53, E2F, Rb, myc, CRE, ER, GR и TRE и т.п.
Рассматриваемые белки могут быть использованы в качестве детекторов вторичного мессенджера путем присоединения этих белков к специфическим доменам, таким как СА-связывающий домен РКС-гамма, DAG-связывающий домен РКС-гамма, домен SH2 или домен SH3 и т.п.
Секретированные формы рассматриваемых белков, которые могут быть, в свою очередь, использованы в различных целях, могут быть получены путем присоединения секретированных лидерных последовательностей к рассматриваемым белкам.
Рассматриваемые белки могут быть также использованы для клеточного сортинга с возбуждением флуоресценции (FACS). В этих целях рассматриваемый флуоресцирующий белок используется в качестве метки для мечения популяции клеток, а затем полученную меченую популяцию клеток подвергают сортингу на клеточном сортере с возбуждением флуоресценции методами, известными специалистам. FACS-методы описаны в патентах США №№5968738 и 5804387, которые вводятся в настоящее описание посредством ссылки.
Рассматриваемые белки также могут быть использованы в качестве in vivo-меток в трансгенных животных. Так, например, экспрессия рассматриваемого белка может регулироваться тканеспецифическими промоторами, и такие методы могут быть использованы для исследований в генотерапии, таких как тестирование эффективности трансгенной экспрессии и т.п. Репрезентативное применение флуоресцирующих белков в трансгенных животных проиллюстрировано в заявке WO 00/02997, описание которой вводится в настоящее изобретение посредством ссылки.
Другими применениями белков по настоящему изобретению являются их использование в качестве маркеров после инъекции в клетки или в организм животных и их использование в целях калибровки для количественной оценки, а также в качестве маркеров или репортеров в кислородных биосенсорных устройствах для монитринга жизнеспособности клеток и в качестве маркеров или меток для животных, домашних питомцев, игрушек, пищевых продуктов и т.п.
Рассматриваемые флуоресцирующие белки могут быть также использованы в анализах на расщепление протеазой. Так, например, анализы на инактивированную расщеплением флуоресценцию могут быть разработаны с использованием рассматриваемых белков, где указанные рассматриваемые белки сконструированы так, чтобы они включали последовательность протеазоспецифического расщепления без какого-либо негативного влияния на флуоресцирующий характер данного белка. После расщепления флуоресцирующего белка активированной протеазой флуоресценция должна быстро снижаться в результате деструкции функционального хромофора. Альтернативно, активированная расщеплением флуоресценция может проявляться под действием белков по настоящему изобретению, где указанные белки сконструированы так, чтобы они содержали дополнительную спейсерную последовательность, расположенную в непосредственной близости от хромофора или внутри хромофора. Этот вариант имеет значительно более низкую флуоресцентную активность, поскольку части функционального хромофора разделены спейсером. Этот спейсер ограничен двумя идентичными протеазоспецифическими сайтами расщепления. После расщепления активированной протеазой спейсер может быть разрезан, а две остаточные "субъединицы" флуоресцирующего белка могут подвергаться повторной сборке с образованием функционального флуоресцирующего белка. Оба вышеуказанных метода могут быть применены в анализах различных типов протеаз, таких как каспазы и т.п.
Рассматриваемые белки могут быть также использованы в анализах для определения фосфолипидного состава биологических мембран. Так, например, гибридные белки, состоящие из белков по настоящему изобретению (или любой другой тип ковалентной или нековалентной модификации рассматриваемых белков), которые связываются со специфическими фосфолипидами и позволяют определить локализацию/визуализировать картину распределения фосфолипидов в биологических мембранах и тем самым определить со-локализацию мембранных белков в специфических фосфолипидных слоях, могут быть получены с использованием рассматриваемых белков.
Рассматриваемые флуоресцирующие белки могут быть также использованы в качестве биосенсоров в прокариотических и эукариотических клетках, таких как индикатор ионов Ca2+, индикатор рН, индикатор фосфорилирования или индикатор других ионов, таких как магний, натрий, калий, хлорид и галогениды. Способами применения флуоресцирующих белков в качестве биосенсоров также являются способы, описанные в патентах США №№5972638, 5824485 и 5650135 (а также в цитируемых там работах), которые вводятся в настоящее описание посредством ссылки.
Антитела по настоящему изобретению, описанные выше, могут быть также использованы в различных целях, включая идентификацию рассматриваемых белков от других флуоресцирующих белков.
Наборы
Настоящее изобретение также относится к наборам, используемым в одной или нескольких из вышеуказанных целей. В предпочтительных вариантах осуществления изобретения наборы могут быть использованы для мечения биологической молекулы. Обычно набор включает сам белок по настоящему изобретению или нуклеиновую кислоту, кодирующую этот белок, предпочтительно вместе с элементами для экспрессии рассматриваемых белков, например конструкцию, такую как вектор, содержащий нуклеиновую кислоту, кодирующую рассматриваемый белок. Настоящее изобретение также относится к средствам для получения компонентов таких наборов. Указанные средства могут включать кДНК из Copepoda и пару олигонуклеотидных праймеров для продуцирования нуклеиновой кислоты по настоящему изобретению, например с помощью ПЦР, либо указанные средства могут включать ряд фрагментов нуклеиновой кислоты, которые при их лигировании могут продуцировать нуклеиновую кислоту, кодирующую флуоресцирующий белок по настоящему изобретению и т.п. Компоненты набора обычно присутствуют в подходящей среде для хранения, такой как забуференный раствор, обычно в подходящем сосуде. В наборах могут также присутствовать антитела, специфичные к рассматриваемому белку. В некоторых вариантах осуществления изобретения данный набор содержит множество различных векторов, каждый из которых кодирует рассматриваемый белок, где указанные векторы созданы для экспрессии в различных средах и/или в различных условиях, например для конститутивной экспрессии, где указанный вектор включает сильный промотор для экспрессии в клетках млекопитающих, либо вектор не содержит промотора, а имеет сайт множественного клонирования для искусственного встраивания промотора и обеспечения соответствующей экспрессии и т.п.
Помимо вышеуказанных компонентов, наборы по настоящему изобретению, кроме того, включают инструкции по практическому осуществлению рассматриваемых методов. Такие инструкции могут присутствовать в рассматриваемых наборах в различных формах, одна или несколько из которых могут находиться в самом наборе.
Ниже приводятся примеры, которые носят лишь иллюстративный характер и не должны рассматриваться как ограничение изобретения.
Примеры
Пример 1
Клонирование кДНК флуоресцирующего белка из веслоногих ракообразных (Copepoda)
Несколько небольших образцов (длиной примерно 0,5-1 мм) Copepoda (типа Arthropoda, подтипа Crustacea, класса Maxillopoda, подкласса Copepoda, отряда Calanoida, семейства Pontellidae), которые дают яркое флуоресцирующее излучение в зеленом диапазоне спектра, были выбраны из образцов планктона.
Для исследования флуоресцирующих белков из видов веслоногих была использована стратегия на основе скрининга экспрессионной кДНК-библиотеки в E.coli. Полноразмерную РНК выделяли из одного организма с помощью набора РНК NucleoSpin II (Clontech). Образец амплифицированной кДНК получали с использованием набора для амплификации кДНК SMART (Clontech) и клонировали в вектор PCR-Script (Stratagene). Примерно 5×104 рекомбинантных клонов визуально скринировали под флуоресцентным стереомикроскопом. В результате было идентифицировано несколько близкородственных (идентичных более чем на 63%, см. таблицу) новых GFP-подобных белков: ppluGFP1 (SEQ ID NO:1 и 2) и ppluGFP2 (SEQ ID NO:3 и 4) из Pontellina plumata, laesGFP (SEQ ID NO: 5 и 6) из Labidocera aestiva, pmeaGFP1 (SEQ ID NO:7 и 8) и pmeaGFP2 (SEQ ID NO:9 и 10) из сем. Pontella meadi Wheeler; pmedGFP1 (SEQ ID NO:11 и 12) и pmedGFP2 (SEQ ID NO:13 и 14) из Pontella mediterranea и pdae1GFP (SEQ ID NO:15 и 16) из неидентифицированных видов веслоногих ракообразных (Copepoda). Аминокислотные последовательности GFP Copepoda приблизительно на 25% и на 18% идентичны аминокислотным последовательностям DsRed и GFP A. victoria соответственно (фигура 1).
Пример 2
Характеризация флуоресцирующих белков Copepoda
Кодирующие последовательности нуклеиновой кислоты флуоресцирующих белков Copepoda получали, как описано выше в примере 1, и клонировали в экспрессирующий вектор pQE30 (Qiagen) так, чтобы рекомбинантные белки содержали 6-гистидиновую метку на своем N-конце. После экспрессии в E.coli белки очищали на металлоаффинной смоле TALON (Clontech) и характеризовали.
Все белки продемонстрировали флуоресценцию в зеленом диапазоне спектра и имели похожие, но не идентичные пики в спектрах возбуждения-излучения при длине волны 482-495 и 502-507 нм соответственно (фигуры 2-8). В противоположность GFP А. victoria дикого типа новые белки имели лишь один пик поглощения-возбуждения, который, вероятно, соответствовал депротонированному состоянию хромофора.
ppluGFP2 был исследован более детально. Очищенный ppluGFP2 имел молярный коэффициент экстинкции 70000 M-1см-1 и квантовый выход флуоресценции 0,60. Для определения молярного коэффициента экстинкции оценивали концентрацию зрелого хромофора. Белок подвергали щелочной денатурации в равном объеме 2М NaOH. В этих условиях GFP-подобный хромофор поглощается при 446 нм, а его молярный коэффициент экстинкции составляет 44000 М-1см-1 (Ward W.W., Bioluminescence and Chemiluminescence (1981), Academic Press, 235-242). Затем измеряли спектры поглощения для нативного и денатурированного щелочью ppluGFP2. Молярный коэффициент экстинкции для белка в нативном состоянии оценивали по поглощению денатурированного белка. Для определения квантового выхода флуоресценцию ppluGFP2 сравнивали с флуоресценцией EGFP с равным поглощением и с квантовым выходом 0,60 (Patterson G. et al., J. Cell. Sci. (2001) 114:837-838).
Результаты анализа с помощью гель-фильтрации показали, что образец белка ppluGFP2 содержит мономерную фракцию, имеющую такую же подвижность, как и EGFP. Очищенные образцы белка (˜1 мг/мл) загружали на колонку с Сефадексом-100 (0,7 х 60 см) и элюировали раствором 50 мМ фосфатного буфера (рН 7,0) и 100 мМ NaCl. EGFP, HcRed1 и DcRed2 (Clontech) использовали в качестве мономерных, димерных и тетрамерных стандартов соответственно.
Пример 3
Получение мутантов и производных ppluGFP2
Кодирующую последовательность нуклеиновой кислоты ppluGFP2 дикого типа получали, как описано выше в примере 1. Для усиления экспрессии в клетках млекопитающих авторы по настоящему изобретению синтезировали "гуманизированный" вариант ppluGFP2 с использованием кодонов, оптимизированных для млекопитающих (SEQ ID NO:17 и 18). Для усиления экспрессии в Saccharomyces cerevisiae синтезировали вариант ppluGFP2, оптимизированный для дрожжей с использованием кодонов, оптимизированных для S. cerevisiae (SEQ ID NO:19 и 20).
"Гуманизированный" вариант ppluGFP2 подвергали сайт-направленному мутагенезу для получения вариантов белка, излучающих в голубовато-зеленом диапазоне спектра. Мутантную нуклеиновую кислоту, кодирующую белок с заменой Y58W, использовали для последующего неспецифического мутагенеза в целях увеличения скорости созревания и усиления яркости флуоресценции белка. При этом использовали набор для неспецифического ПЦР-мутагенеза Diversity PCR Random Mutagenesis Kit (CLONTECH) в условиях, оптимальных для 5-6 мутаций на 1000 п.н. Колонии E.coli, экспрессирующие мутантные белки, визуально скринировали под флуоресцентным стереомикроскопом SZX-12 (Olympus). Затем был охарактеризован самый яркий клон CopCFP. В целом, этот мутант содержал 3 замены: Y58W, H143R, I119T (SEQ ID NO:21 и 22). Спектры возбуждения-излучения этого белка имели пики при 417 и 477 нм соответственно (фигура 9).
Поскольку ppluGFP2 обнаруживал тенденцию к образованию агрегатов как в растворе in vitro, так и при его экспрессии только в долгоживущих клеточных культурах, авторами были генерированы удлиненные варианты этого белка с нарушенной способностью к агрегации. Гуманизированный вариант ppluGFP2 использовали в качестве матрицы для генерирования неагрегированных вариантов. Первый вариант (CopCFP-NA1, SEQ ID NO:23 и 24) содержит замену К5Е (нумерация соответствует нумерации дикого типа) и удлиненный отрицательно заряженный аминокислотный "хвост" у N-конца данного белка, который экранирует положительный заряд на внешней границе раздела полости белка ppluGFP2 и предупреждает взаимодействие заряда с другой молекулой белка ppluGFP2. Второй вариант (CopCFP-NA2, SEQ ID NO:25 и 26) содержит дополнительный "хвост" у С-конца. Третий вариант, CopGFP-NA3, включает все изменения, присутствующие в вариантах CopGFP-NA1 и CopGFP-NA2 (SEQ ID NO:27 и 28). Все варианты обнаруживали пониженную способность к агрегации в тестах in vivo и in vitro.
Пример 4
Получение поликлонального антитела
Кодирующие области нуклеиновых кислот ppluGFP2, полученных, как описано выше в примере 1, клонировали в экспрессирующий вектор pQE30 (Qiagen), так чтобы рекомбинантные белки содержали 6-гистидиновую метку на своем N-конце. После экспрессии в E.coli белки очищали на металло-аффинной смоле TALON (Clontech) в денатурирующих условиях. Кроликов иммунизировали и четыре раза с интервалами в один месяц проводили бустер-иммунизацию рекомбинантными полипептидами, эмульгированными в полном адъюванте Фрейнда. Через 10 или 11 дней после каждой иммунизации у животных брали кровь. Поликлональную антисыворотку тестировали на рекомбинантный белок с помощью ELISA и с помощью Вестерн-иммуноблоттинга.
Пример 5
Мечение клеток млекопитающих с использованием ppluGFP2
Для флуоресцирующего мечения эукариотических клеток гуманизированные варианты ppluGFP2, полученные, как описано выше в примере 3, клонировали в вектор pEGFP-С1 (CLONTECH) между рестрикционными сайтами AgeI и BglII (вместо EGFP-кодирующей области). При этом были использованы следующие клеточные линии: эпителиальные клетки 293Т почек человека, фибробласты мышиных эмбрионов 3Т3, подкожные мышиные фибробласты L929, эпителиальные клетки почек Африканской зеленой мартышки Vero и фибробласты почек Африканской зеленой мартышки COS1. Клетки трансфецировали с использованием реагента LipofectAMINE (Invitrogen) и тестировали через 20 часов после трансфекции. Для визуализации клеток использовали флуоресцентный микроскоп Olympus CK40, снабженный камерой с зарядовой связью (DP-50, Olympus). Экспрессия ppluGFP2 в различных клеточных линиях давала яркие сигналы в зеленом диапазоне спектра. Заметная флуоресценция наблюдалась через 24 часа после трансфекции. Какой-либо токсичности клеток не наблюдалось.
Пример 6
Мечение белков и анализ на локализацию белков с использованием ppluGFP2
Гуманизированные варианты ppluGFP2, полученные, как описано выше в примере 3, присоединяли к человеческому цитоплазматическому бета-актину и к человеческому ядерному белку, фибрилларину. Трансфекция эпителиальных клеток почек человека 293Т с плазмидами, экспрессирующими ppluGFP2-меченные гибридные конструкции, приводила к продуцированию яркой флуоресценции, которая давала картину, характерную для соответствующих партнеров по связыванию.
Пример 7
Мечение клеточных органелл с использованием ppluGFP2
Гуманизированные варианты ppluGFP2, полученные, как описано выше в Примере 3, присоединяли к нижеследующим сигналам субклеточной локализации, таким как последовательность для доставки в митохондрии (MTS) из субъединицы VIII цитохром-с-оксидазы человека; последовательность, кодирующая N-концевые 81 аминокислоту человеческой бета-1,4-галактозилтрансферазы (GT; Watzele & Berger (1990) Nucleic Acids. Res. 18:7174); последовательность сигнала 1 для доставки в пероксисому (Gould et al., J. Biol. Chem. (1989) 108:1657-1664; Gould et al., EMBO J. (1990) 9:85-90; Monosov et al., J. Histo. Cytochem. (1996) 44:581-589); и три копии сигнала ядерной локализации (NLS) крупного Т-антигена обезьяньего вируса 40, присоединенного у своего С-конца (Kalderon et al., Cell (1984) 39:499-509; Lanford et al., Cell (1986) 46:575-582).
Трансфекция эпителиальных клеток почек человека 293Т плазмидами, экспрессирующими ppluGFP2-меченные гибридные конструкции, приводила к эффективной транслокации данного белка в соответствующую органеллу клеток-хозяев. Флуоресценция явно детектировалась через 24 часа после трансфекции.
Все публикации и патентные заявки, цитируемые в настоящем описании, вводятся в настоящее описание посредством ссылки, как если бы каждая отдельная публикация или патентная заявка была конкретно и отдельно введена посредством ссылки. Цитирование любой публикации приводится в соответствии с контекстом и интерпретацией по настоящему изобретению и не должно истолковываться как признание любой такой публикации прототипом данного изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННЫЕ ЗЕЛЕНЫЕ ФЛУОРЕСЦЕНТНЫЕ БЕЛКИ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2006 |
|
RU2412250C2 |
| ФЛУОРЕСЦИРУЮЩИЕ БЕЛКИ И ХРОМОПРОТЕИНЫ ИЗ ВИДОВ HYDROZOA, НЕ ОТНОСЯЩИХСЯ К AEQUOREA, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2338785C2 |
| НОВЫЕ ФЛУОРЕСЦЕНТНЫЕ БЕЛКИ ИЗ ENTACMAEA QUADRICOLOR И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2395581C2 |
| МОДИФИЦИРОВАННЫЙ ГЕНЕТИЧЕСКИ КОДИРУЕМЫЙ ФОТОСЕНСИБИЛИЗАТОР | 2013 |
|
RU2599443C2 |
| БИОСЕНСОР ДЛЯ ДЕТЕКЦИИ ПЕРОКСИДА ВОДОРОДА В ЖИВЫХ КЛЕТКАХ, ОБЛАДАЮЩИЙ ПОВЫШЕННОЙ УСТОЙЧИВОСТЬЮ К ИЗМЕНЕНИЯМ pH | 2009 |
|
RU2434943C2 |
| ВЫДЕЛЕННАЯ НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ ОПЕРАТИВНО СЛИТЫЙ ИНТРАМОЛЕКУЛЯРНЫЙ ДИМЕР БЕЛКА KillerRed, КАССЕТА ЭКСПРЕССИИ, КЛЕТКА, ПРОДУЦИРУЮЩАЯ ХИМЕРНЫЙ БЕЛОК И СОДЕРЖАЩАЯ КАССЕТУ ЭКСПРЕССИИ, ВЫДЕЛЕННЫЙ ХИМЕРНЫЙ БЕЛОК | 2011 |
|
RU2491342C1 |
| ВЫДЕЛЕННАЯ НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ БЕЛОК KillerRed (ВАРИАНТЫ), ВЫДЕЛЕННЫЙ БЕЛОК (ВАРИАНТЫ), КАССЕТА ЭКСПРЕССИИ, КЛЕТКА, СОДЕРЖАЩАЯ КАССЕТУ ЭКСПРЕССИИ | 2011 |
|
RU2458129C1 |
| НОВЫЕ ХРОМОФОРЫ/ФЛУОРОФОРЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2002 |
|
RU2303600C2 |
| МОДИФИЦИРОВАННЫЙ БИОСЕНСОР ДЛЯ ДЕТЕКЦИИ ВНУТРИКЛЕТОЧНОЙ РН | 2014 |
|
RU2603060C2 |
| НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ ОСНОВАННЫЙ НА FRET ДАЛЬНЕ-КРАСНЫЙ БИОСЕНСОР ДЛЯ ИЗМЕРЕНИЯ АКТИВНОСТИ КАСПАЗЫ 3 ВНУТРИ КЛЕТОК | 2013 |
|
RU2535981C1 |












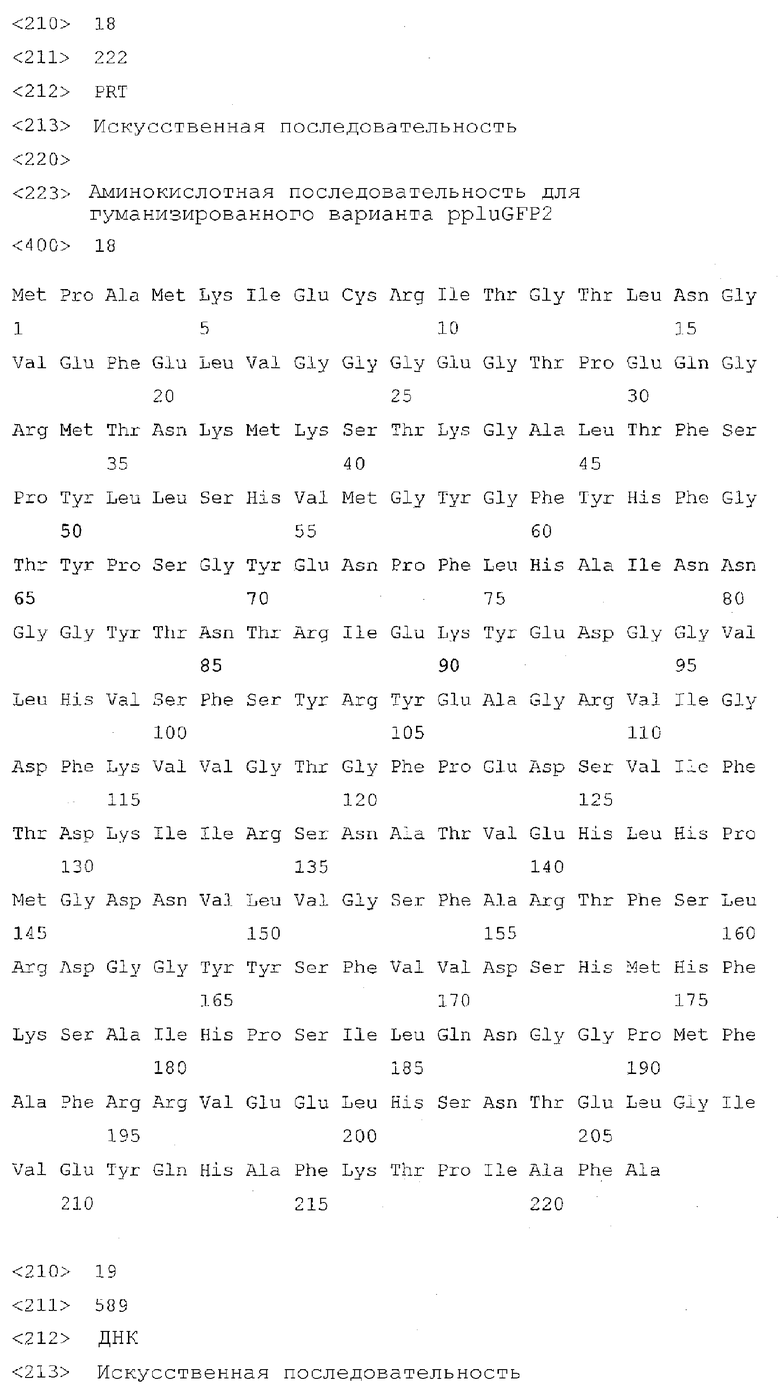









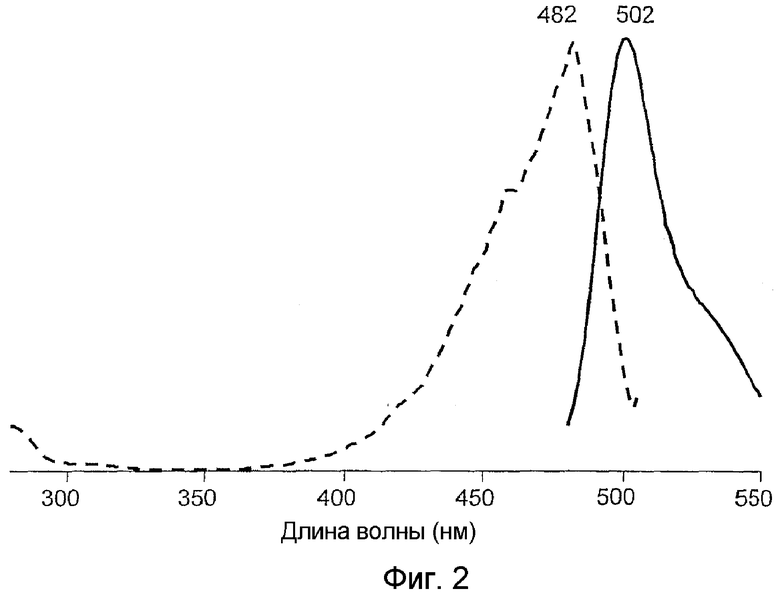
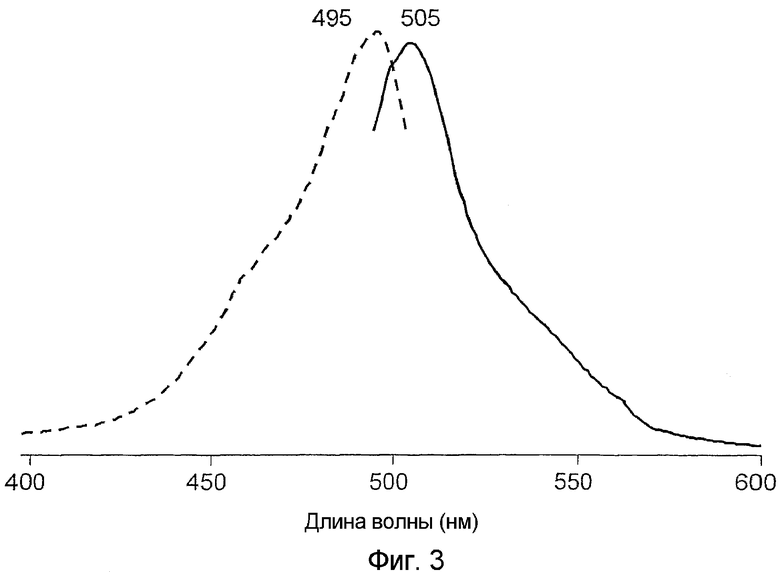
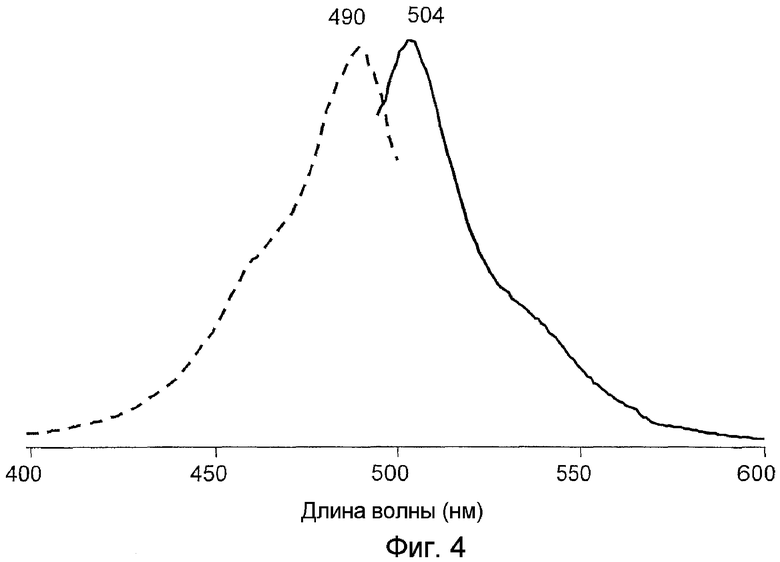
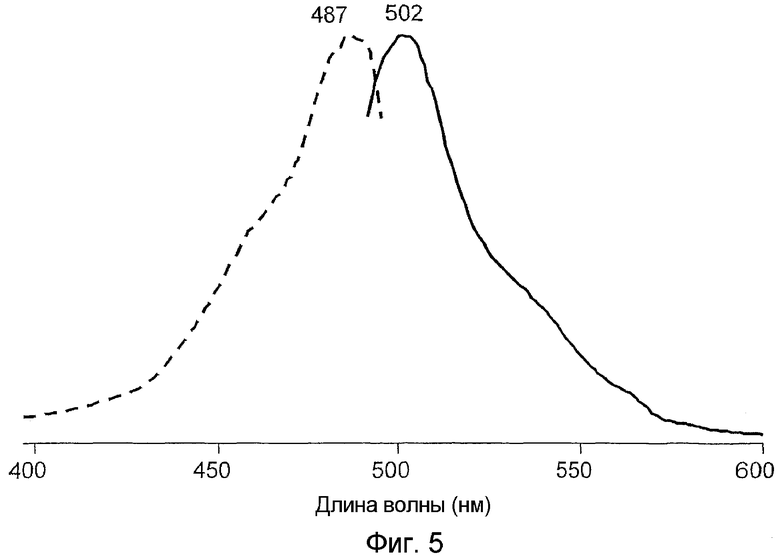
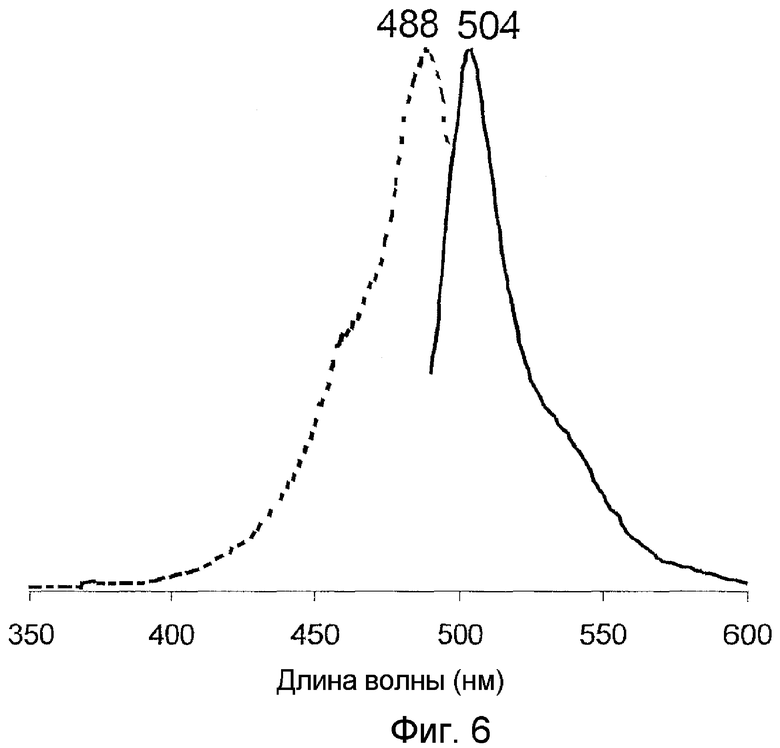
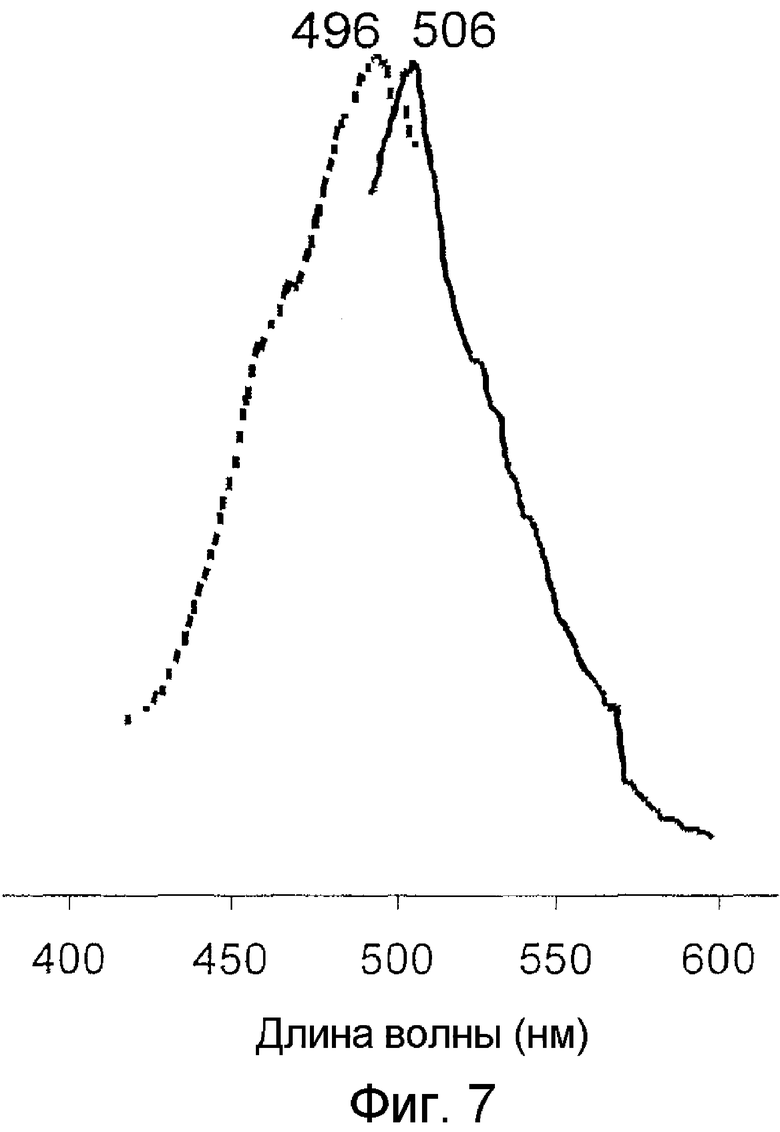
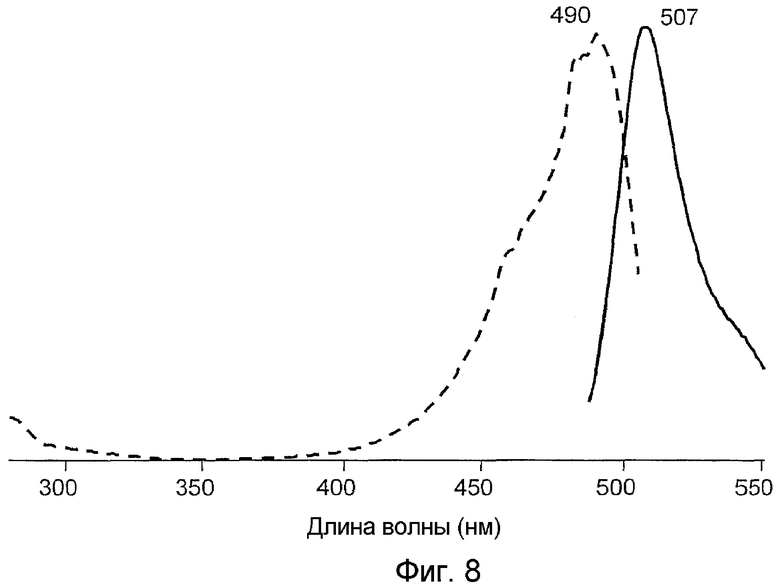
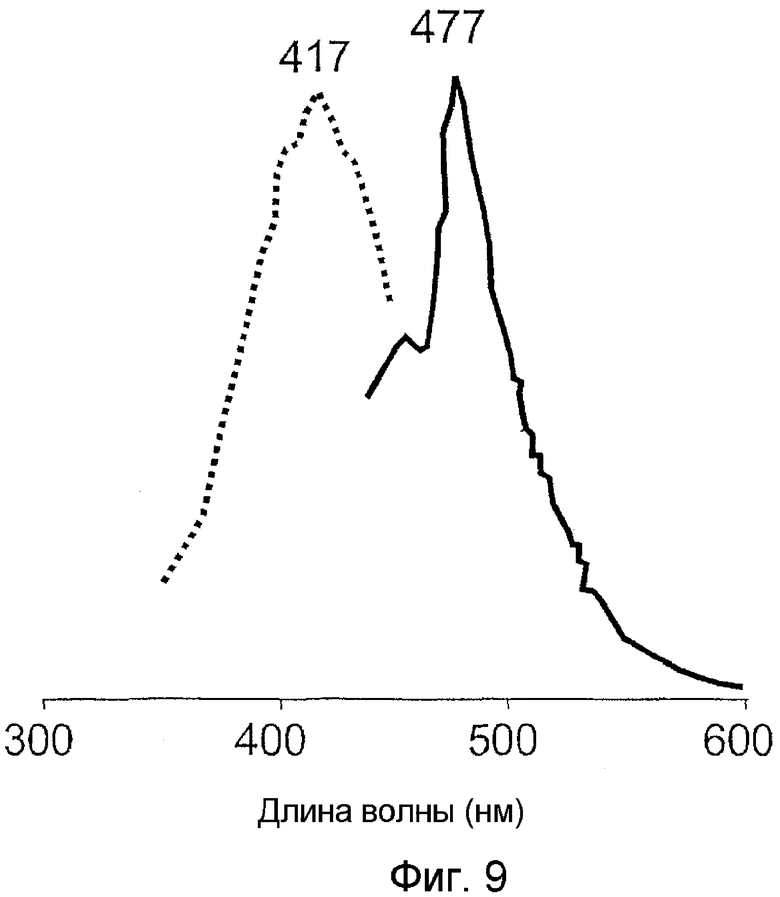
Изобретение относится к области генной инженерии и биотехнологии и может быть использовано для мечения биологических объектов. Выделена молекула нуклеиновой кислоты, которая кодирует флуоресцирующий белок, выбранный из флуоресцирующих белков представителей видов веслоногих ракообразных и флуоресцирующих мутантов указанных белков. Данную нуклеиновую кислоту функционально связывают с подходящими элементами регуляции экспрессии и используют в способе продуцирования флуоресцирующего белка. На основе этой выделенной нуклеиновой кислоты получены клонирующий и экспрессирующий векторы, а также экспрессирующая кассета. Клетка и стабильная клеточная линия, содержащие такую экспрессионную кассету, продуцируют флуоресцирующий белок. Флуоресцирующий белок, кодирующую его нуклеиновую кислоту и экспрессионные генетические конструкции, содержащие эту нуклеиновую кислоту, используют в наборе для мечения биологической молекулы. Флуоресцирующий белок используют также в способах мечения биологической молекулы, клетки или клеточной органеллы. Применение изобретения позволяет расширить арсенал средств для мечения биологических объектов. 12 н.п. ф-лы, 9 ил., 1 табл.
(b) нуклеиновой кислоты, характеризующейся нуклеотидной последовательностью, по существу, соответствующей нуклеотидной последовательности, представленной в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25 или 27; (c) нуклеиновой кислоты, гибридизующейся в жестких условиях с нуклеиновой кислотой (а) или (b), описанной выше; (d) нуклеиновой кислоты, кодирующей белок, имеющий последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности (а), описанной выше; (e) нуклеиновой кислоты, имеющей последовательность, которая по меньшей мере на 65% идентична нуклеотидной последовательности (b), описанной выше; (f) нуклеиновой кислоты, отличающейся от нуклеиновой кислоты (b), (с), (d) или (е), описанной выше, вследствие вырожденности ее генетического кода.
(а) белка, характеризующегося аминокислотной последовательностью, по существу, соответствующей аминокислотной последовательности, представленной в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 22, 24, 26 или 28; (b) белка, кодируемого молекулой нуклеиновой кислоты, характеризующейся нуклеотидной последовательностью, по существу, соответствующей нуклеотидной последовательности, представленной в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, 19, 21, 23, 25 или 27;
(c) белка, имеющего аминокислотную последовательность, которая по меньшей мере на 70% идентична аминокислотной последовательности (а) или (b), описанной выше.
Приоритеты по пунктам:
| УСТАНОВКА ДЛЯ ИЗМЕРЕНИЯ ОТКЛОНЕНИЙ РАДИУСОВ ВНУТРЕННЕЙ СФЕРЫ ЦВЕТНОГО КИНЕСКОПА | 0 |
|
SU196373A1 |
| Приспособление для перемещения моторной части газорежущего автомата типа „Автоскоп" | 1937 |
|
SU52735A1 |
| Складная пожарная (штурмовая) лестница | 1923 |
|
SU499A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| US 5976796 A, 02.11.1999 | |||
| US 6232107 A, 15.05.2001 | |||
| RU 2000131219 A, 27.10.2002. | |||
Авторы
Даты
2009-01-27—Публикация
2003-11-26—Подача