Изобретение относится к применению PAM (ассоциированный с Myc белок). Другие аспекты изобретения относятся к способу скрининга лекарственных средств и к способам лечения боли.
Боль представляет собой сложное субъективное ощущение, отражающее реальное или возможное повреждение тканей и эмоциональный ответ на него. Острая боль представляет собой физиологический сигнал, означающий возможное или реальное повреждение. Хроническая боль может быть либо соматогенной (органической), либо психогенной. Хронической боли часто сопутствуют или за ней следуют вегетативные признаки, которые часто приводят к депрессии.
Соматогенная боль может быть ноцицептивного, воспалительного или невропатического происхождения. Полагают, что ноцицептивная боль связана с непрерывной активацией соматических или висцеральных болевых чувствительных нервных волокон. Невропатическая боль возникает вследствие дисфункции нервной системы; полагают, что ей способствуют аберрантные соматосенсорные процессы периферической нервной системы, ЦНС или их обеих. (Для обзора механизмов боли см., например, Scholz and Woolf, 2002; Julius and Basbaum, 2001, Woolf and Mannion, 1999; Wood, J.D., 2000; Woolf and Salter, 2000.)
Хроническая боль приводит к страданию человека и к огромным социально-экономическим затратам. Существующие способы лечения боли крайне неудовлетворительны как в отношении эффективности, так и в отношении безопасности.
В настоящее время для лечения боли, как правило, применяют два класса анальгетиков: неопиоидные анальгетики, главным образом ацетаминофен и НПВЛС (нестероидные противовоспалительные лекарственные средства), и агонисты опиоидов (наркотики) (где "опиоид" является общим термином для природных и синтетических веществ, связывающихся со специфическими опиоидными рецепторами в ЦНС, оказывая действие в качестве агониста). К сожалению, оба класса анальгетиков, и опиоидные, и неопиоидные, обладают некоторыми нежелательными побочными эффектами. Наиболее серьезными побочными эффектами опиоидов являются возможность угнетения дыхательной системы и возникновение зависимости после длительного их приема (Schaible H.G., Vanegas H., 2000). С другой стороны, НПВЛС, большой класс не являющихся опиоидами анальгетиков, может вызывать множество осложнений желудочно-кишечного тракта, такие как язвы и кровотечение, а также оказывать отрицательное воздействие на почки (Schaible H.G., Vanegas H., 2000). Было установлено, что в США вследствие вызываемых общепринятыми НПВЛС тяжелых желудочно-кишечных осложнений ежегодно умирает приблизительно 16000 пациентов.
Ввиду серьезных недостатков методов лечения боли, известных в данной области, существует необходимость в новых классах модулирующих боль лекарственных средств. Особенно ввиду огромного разрыва между быстрым продвижением в понимании нейробиологии боли и неудовлетворенной клинической потребностью в эффективных способах лечения без побочных эффектов в данной области необходимы усилия, направленные на поиск новых объектов исследования для создания новых классов анальгетиков. Таким образом, целью настоящего изобретения является получение новых средств для разработки и получения нового класса модулирующих боль лекарственных средств.
Эта цель достигается благодаря применению PAM или его функциональных фрагментов или производных для получения модулирующих боль фармацевтических соединений.
Изобретение основано на открытиях авторов изобретения, впервые продемонстрировавших, что PAM участвует в ноцицептивных процессах и способен снижать боль. Термин функциональный в отношении PAM относится к способности PAM уменьшать внутриклеточные уровни цАМФ или взаимодействовать с AC; более предпочтительно оно относится к его способности ингибировать активность AC и даже более предпочтительно к его способности снижать боль.
Фрагмент PAM может быть любым полипептидом или полинуклеотидом, являющимся более коротким, чем соответствующая исходная молекула, например более коротким, чем PAM человека по одной из последовательностей с инвентарными номерам ACC 39928 (SEQ ID NO:1), NP_055872, NM_015057, AF075587 (SEQ ID NO:2), или короче, чем полинуклеотид с положения 24679861 до положения 24962245 последовательности с инвентарным номером NT_024524.11 (SEQ ID NO:3).
Производное PAM или фрагмент PAM может иметь любую модификацию аминокислотной или нуклеотидной последовательности с функцией PAM или модификацию любого другого типа, такую как химическая или биологическая модификация, например, приводящая к стабилизации полипептида или полинуклеотида (такую как фосфоротиоатные модификации), или обеспечивающая специфическую направленность полипептида или полинуклеотида на определенные клетки, или облегчающая ее проникновение в клетки или ее захват клеткой (такая как проходящие в клетку фосфопептиды или связывание с проходящими в клетку пептидными векторами, например, основанными на antennapedia/penetratin, TAT и последовательностях, основанных на сигнальных пептидах; или связывающиеся с частями лигандов для специфических транспортеров или импортеров).
PAM, или его фрагменты, или производные можно применять или в форме полипептида, или в форме полинуклеотида. Пригодными являются подходящие модификации или дополнения для обеспечения или облегчения ее направления к необходимому участку и ее вхождения в клетку. С другой стороны, для обеспечения ее направления к спинному мозгу возможно локальное применение, такое как интраспинальное применение с применением подходящих катетеров и тому подобное. Другие пригодные дополнения включают в себя соли, буферы или т.п. для ее стабилизации и тому подобное.
PAM, или его фрагменты, или производные, например, можно вводить в пригодный вектор, обеспечивающий внутриклеточную экспрессию и предпочтительно также направление в клетку. Клеточную типоспецифическую экспрессию можно обеспечить с применением подходящих промоторов/энхансеров, специфичных для нейронов генов, известных в данной области. Также возможно применение олигонуклеотидов PAM.
Настоящее изобретение основано на исследованиях авторов, впервые демонстрировавших, что PAM участвует в механизмах повышения чувствительности в спинном мозге и ганглиях задних корешков (DRG).
PAM (ассоциированный с Myc белок) представляет собой гигантский белок с массой 510 кДа. Белковая, геномная и кодирующая полинуклеотидные последовательности PAM известны в данной области и общедоступны, например, в базе данных NCBI (National Centre for Biotechnology Information; National Library of Medicine, Building 38A, Bethesda, MD 20894, USA; www.ncbi.nhm.nih.gov) под инвентарными номерами AAC39928 (кодирующая последовательность; SEQ ID NO:1), AF075587 (белковая последовательность; SEQ ID NO:2). Человеческий PAM расположен на хромосоме 13q22; его геномная последовательность общедоступна под номером NT_024524.11 (Старт: положение 24679861; Стоп: положение 24962245; SEQ ID NO:3). Альтернативно, белковая и кодирующая последовательности общедоступны под инвентарными номерами для белка KIAA0916 NP_055872 (белковая последовательность) и NM_015057 (кодирующая последовательность).
Для крысиного PAM общедоступны следующие кодирующие последовательности из EST-клонов:
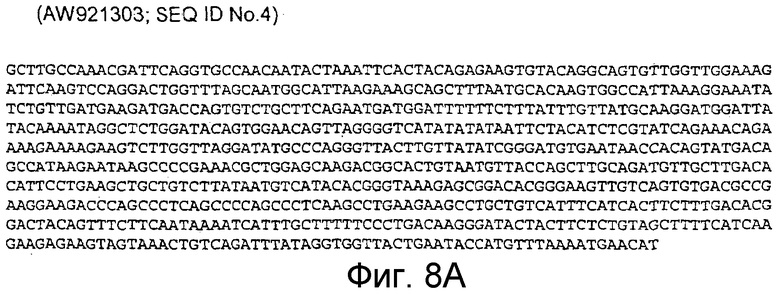
AW921303 (соответствует 960-1394 п.н. кДНК человека; SEQ ID NO:4)
AW918711 (соответствует 8188-8632 п.н. кДНК человека; SEQ ID NO:5)
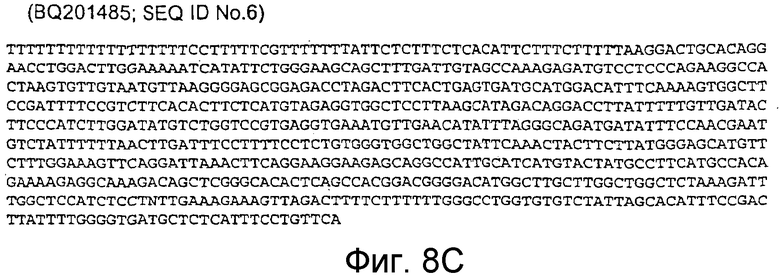
BQ201485 (соответствует 8966-9633 п.н. кДНК человека; SEQ ID NO:6)
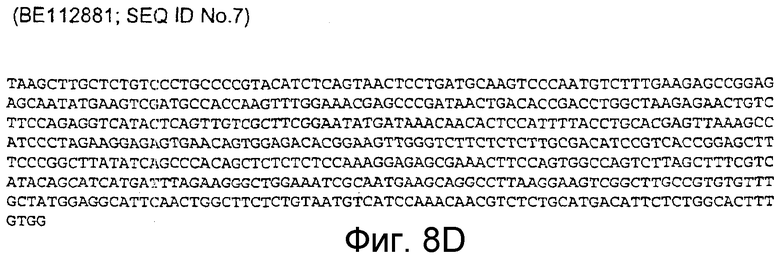
BE112881 (соответствует 10311-10830 п.н. кДНК человека; SEQ ID NO:7)
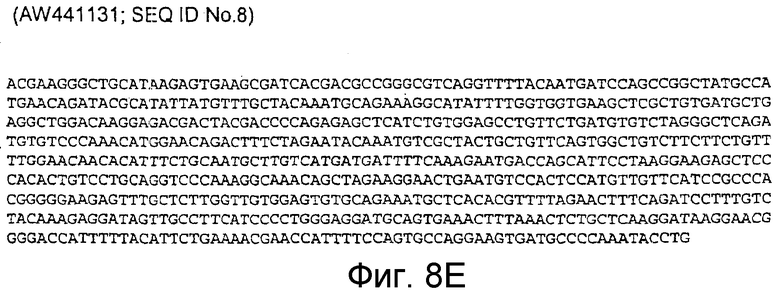
AW441131 (соответствует 13569-14152 п.н. кДНК человека; SEQ ID NO:8)
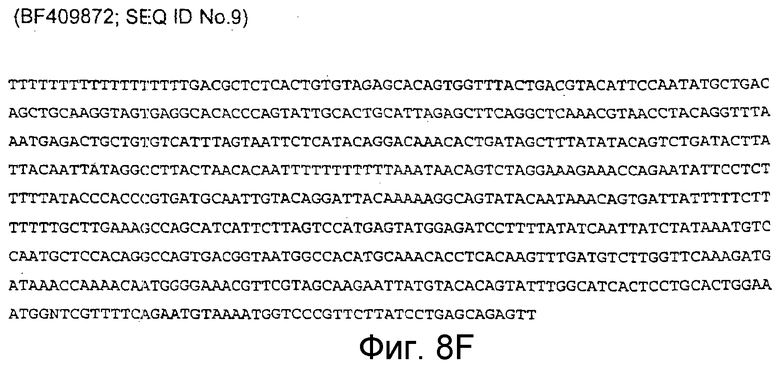
BF409872 (соответствует 13569-14807 п.н. кДНК человека; SEQ ID NO:9).
Исходно PAM идентифицировали по его способности специфически взаимодействовать с активирующим транскрипцию доменом на N-конце Myc (Guo Q., et al., 1998). Недавно PAM описан как мощный ингибитор активности AC (Scholich K., Pierre S., Patel T.B.: Protein associated with myc (PAM) is a potent inhibitor of adenylyl cyclase. J. Biol. Chem. 2001, Dec 14;276(50):47583-9.), но до настоящего времени доказательств его функционирования в обработке ноцицептивных сигналов и повышения ноцицептивной чувствительности не существовало.
Предпочтительнее полагают, что PAM играет роль в регуляции пресинаптического роста: известно, что мРНК PAM высоко экспрессирована в специфических анатомических областях, включающих в себя гиппокамп, зубчатую извилину и мозжечок. Экспрессия и PAM, и Myc в головном мозге взрослых крыс и мышей ограничена зрелыми клетками Пуркинье в мозжечке и зернистыми и пирамидальными клетками в гиппокампе (Ruppert C., et al., 1986; Yang H. et al., 2002). Однако ни для одного из этих типов клеток не известно, что он вовлечен в обработку болевых ощущений и повышение болевой чувствительности.
Показано, что гомологи PAM у Drosophila (highwire) и C. elegans (rpm-1) играют ключевую роль в организации пресинаптических окончаний (Zhen et al., 2000), регуляции синаптического роста (Wan et al.,2000), формировании синапсов и росте и направлении аксонов (Schaefer et al., 2000). Данные открытия привели к предположению, что highwire, rpm-1 и их гомолог у млекопитающих PAM могут действовать как негативные регуляторы синаптического роста (Chang et al., 2000; Jin Y. 2002). Таким образом, в мозжечке, гиппокампе и зубчатой извилине в течение основного периода формирования синапсов в этих структурах выявили значительное увеличение экспрессии PAM (Yang et al., 2002).
В течение развития головного мозга у грызунов экспрессия PAM запускается вскоре после рождения, повышается в течение первых двух недель, а затем экспрессия PAM остается повышенной в течение взрослого периода (Yang et al., 2002). До настоящего времени об экспрессии и регуляции PAM в спинном мозге и DRG и его функции в механизмах повышения чувствительности и регуляции боли ничего не было известно.
Ранее показано, что человеческий PAM представляет собой мощный регулятор путей передачи сигнала циклического АМФ (цАМФ) и ингибирует ферментативную активность некоторых изоформ аденилатциклазы (AC; E.C.4.6.1.1) при наномолярных концентрациях (Scholich et al. 2001).
Повсеместно присутствующая система вторичного мессенджера, циклицеского АМФ (цАМФ) представляет собой один из различных механизмов передачи сигнала, преобразующих внеклеточные стимулы во внутриклеточные сигналы и ответы. При внеклеточной стимуляции сопряженные с G-белками рецепторы (GPCR) модулируют связанные с плазматической мембраной ферменты или ионные каналы посредством связанных с ГТФ тримерных регуляторных белков (G-белков). Один из ферментов, активность которого регулируют GPCR, представляет собой аденилатциклазу (AC), образующий цАМФ фермент. Таким образом, поступающие внеклеточные стимулы воздействуют на внутриклеточную концентрацию внутриклеточного медиатора, циклического АМФ. Повышение уровней цАМФ воздействует на клетку посредством стимуляции протеинкиназы A (PKA), фосфорилирующей специфические внутриклеточные белки-мишени и, таким образом, изменяющей их активность.
Каждый тип клеток обладает характерным набором GPCR, модулируемых данными GPCR ферментов, специфических подклассов аденилатциклазы (AC) и белков-мишеней, которые, действуя совместно с более неспецифическими или часто встречающимися партнерами (такими как повсеместно присутствующий цАМФ), позволяют каждой клетке производить ее собственный характерный ответ на поступающие внеклеточные сигналы. Например, известно, что вторичный мессенджер циклический АМФ (цАМФ) играет главную роль в синаптической пластичности (Bailey et al., 1996; Xia et al., 1997; Brandon et al., 1997); с другой стороны, он вовлечен в метаболические процессы и клеточную пролиферацию. Таким образом, роль повсеместно распространенной системы мессенджера цАМФ и ее различных компонентов варьирует в зависимости от различных видов специализации различных типов тканей и клеток.
В дополнительном аспекте изобретение относится к применению PAM или его функциональных фрагментов или производных для модуляции боли. Данная модуляция предпочтительно представляет собой уменьшение или профилактику или полное подавление.
Кроме того, настоящее изобретение относится к применению PAM или его функциональных фрагментов или производных для идентификации модулирующих боль соединений. Модулирующие соединения предпочтительно представляют собой активирующие PAM соединения. Наиболее предпочтительно, чтобы они обладали способностью предотвращать, уменьшать или прекращать боль.
Например, соединения можно идентифицировать по их способности
a) активировать или усиливать функцию PAM (т.е. его способность уменьшать уровни внутриклеточного цАМФ взаимодействовать с другими факторами, подобными AC, и особенно с AC, ингибировать AC или его способности уменьшать восприятие боли) или
b) активировать PAM на уровне РНК (т.е. посредством активации транскрипции PAM или стабилизации транскрипта) или
c) активировать PAM на уровне белка (т.е. посредством активации трансляции PAM или его посттрансляционного процессинга; посредством модуляции посттрансляционной модификации PAM или посредством активации его стабилизации или ингибирования его разрушения).
По данному аспекту PAM (или его фрагмент, или производные) можно применять или как полипептид, или как олиго- или полинуклеотид.
В другом аспекте настоящее изобретение относится к способу уменьшения боли, включающему в себя введение индивидууму достаточного количества PAM или его функционального фрагмента или производного.
Соответственно, введение следует проводить способом, обеспечивающим направление PAM к участку действия (DRG или спинной мозг), например, посредством системного введения производных или препаратов PAM, направляющих себя к необходимому участку, или посредством местного (например, интраспинального) применения PAM, или его фрагментов, или производных.
В другом аспекте настоящее изобретение относится к способу скрининга фармацевтических средств, пригодных для модуляции и/или профилактики боли, включающему в себя стадии
a) получения двух образцов;
b) приведения одного образца, содержащего PAM, или его функциональный фрагмент, или производное, в контакт с соединением;
c) определения активности PAM в присутствии соединения;
d) измерения активности PAM в отсутствие соединения и
e) сравнения активности PAM из c) с активностью PAM из d).
PAM можно получать из любой доступной последовательности, подходящей для ее конкретной цели по различным аспектам настоящего изобретения. Предпочтительно PAM представляет собой человеческий PAM.
В различных аспектах настоящего изобретения также предпочтительно, если PAM представляют собой выделенные полипептиды или олиго- или полинуклеотиды. Термин «выделенные» в контексте различных аспектов настоящего изобретения означает, по меньшей мере, частично очищенные из природного источника или рекомбинантного PAM (которые, конечно, также могут являться очищенными или частично очищенными).
Анализ представляет собой аналитический способ любого типа для слежения за биологическим процессом. Для применения в скрининге лекарственных средств анализ должен являться воспроизводимым, а предпочтительно также расширяемым и надежным. Анализ предпочтительно пригоден для высокопроизводительного скрининга химических соединений на их способность модулировать (предпочтительно уменьшать) и/или предотвращать боль. Например, тип анализа зависит от типа применяемого PAM (или полипептида, или полинуклеотида) и "вывода", т.е. способа, которым определяют активность PAM (см. ниже).
Различные типы таких анализов, как правило, известны в данной области и коммерчески доступны у частных поставщиков. Пригодные виды анализа включают в себя радиоизотопный или флуоресцентный виды анализа, например виды флуоресцентного поляризационного анализа (такие как виды анализа, предоставляемые на коммерческих условиях Panvera, Perkin-Elmer life sciences (например, LANCE) или Packard BioScience (например, HTRF или ALPHAscreen™)) для измерения взаимодействия меченого партнера с немеченым партнером (например, PAM или его фрагменты могут являться мечеными, а измерять можно их взаимодействие с AC).
Более многочисленные примеры включают в себя основанные на применении клеток анализы, где клеточная линия стабильно (индуцируемо или нет; с хромосомы или эписомы) или транзиторно экспрессирует интересующий рекомбинантный белок. Данные виды анализа включают в себя, например, анализ с репортерным геном, где регуляцию определенного промотора или пути передачи сигнала участника каскада передачи сигнала измеряют по активности репортерного фермента, экспрессия которого находится под контролем указанного определенного промотора. Для данного типа анализа конструируют рекомбинантную клеточную линию, содержащую репортерный ген под контролем определенного промотора, который необходимо исследовать самого или который регулируется исследуемым сигнальным каскадом. Пригодные репортерные ферменты, как правило, известны в данной области и включают в себя люциферазу светляка, люциферазу Renilla (например, коммерчески доступная в Packard reagents), β-галактозидазу. Пригодность клеточных линий зависит от цели анализа, но они, как правило, включают в себя клеточные линии, которые легко трансфицировать и легко культивировать, например, такие как HeLA, COS, CHO, NIH-3T3 и т.д.
Анализы для измерения внутриклеточного уровня ионов включают в себя, например, анализы с применением FLIPR (планшет-ридера флуориметрического получения изображения, коммерчески доступного в Molecular Devices), где источник свечения аргонового лазера объединяют с охлажденной CCD-камерой, обеспечивая параллельное измерение в 384-луночных планшетах кратковременных сигналов ионов (таких как Ca2+ и т.д.) в клетках (например, в нервных клетках или других клетках (например, в клетках, рекомбинантно или естественным образом экспрессирующих определенные ионные каналы)). Например, анализы с применением FLIPR позволяют с применением определенных флуорохромов, таких как Fluo-3, Fluo-4, производить мониторинг внутриклеточного содержания кальция, или с применением наборов для анализа с применением специфичных для ф./р. BCECF или BCPCF FLIPR производить мониторинг внутриклеточного pH, или с применением, например, наборов для анализа с применением DiBAC или специфичных FLIPR проводить мониторинг изменений мембранного потенциала, или проводить мониторинг поляризации мембраны. Для мониторинга других внутриклеточных ионов, например цинка или натрия, можно применять другие известные в данной области красители. Как правило, специалистам в данной области известны другие типы анализа и другие типы вывода данных.
Для измерения уровней цАМФ пригодны, например, AlphaScreen, поляризация флуоресценции или технология HTRF.
Для определения активности ионных каналов (контролирующей, например, внутриклеточные концентрации ионов и которую, таким образом, можно применять для измерения внутриклеточной концентрации ионов) можно применять, например, чувствительные к мембранному потенциалу анализы и красители, такие как DiBAC или технологию с применением набора для анализа мембранного потенциала на FLIPR из Molecular Devices; измеряющий поляризацию митохондриальных мембран краситель JC-1 с применением технологии FLIPR; ионочувствительные красители, такие как Fluo-3, Fluo-4 или набор для анализа кальция из Molecular Devices, для измерения внутриклеточной концентрации кальция; чувствительные к натрию красители, например, из Molecular Probes, для измерения внутриклеточного натрия; основанные на способе фиксации потенциала анализы или основанное на атомно-адсорбционной спектроскопии измерение выхода иона рубидия для определения внутриклеточных концентраций калия и т.д. Специалистам в данной области известны дополнительные автоматические устройства и аналитические способы для выявления определенных изменений и состояний в клетках, и они включают в себя, например, детектор Acumen (основанное на флуоресценции лазерное сканирующее считывающее устройство, позволяющее производить трехмерную реконструкцию распределения подходящим образом меченных объектов) из ACUMEN bioscience.
Полипептид PAM предпочтительно представляет собой полипептид, содержащий соответствующую SEQ ID NO:2 последовательность или состоящий из нее или кодируемый полинуклеотидом, содержащим соответствующую SEQ ID NO:1 или 3 последовательность или состоящим из нее.
Полинуклеотид PAM предпочтительно представляет собой полинуклеотид, содержащий соответствующую SEQ ID NO:1 или 3 последовательность или состоящий из нее, или полинуклеотид, содержащий способную в строгих условиях гибридизоваться с указанными выше полинуклеотидами последовательность или состоящий из нее.
Жесткие условия являются характерными условиями реакции, влияющими на специфичность гибридизации или отжига двух одноцепочечных молекул нуклеиновой кислоты. Жесткость и, таким образом, специфичность реакции, среди прочего, зависит от температуры и буферных условий, применяемых для реакции. Например, жесткость и, таким образом, специфичность можно увеличить посредством увеличения температуры реакции и/или снижения ионной силы реакционного буфера. Например, условия с низкой жесткостью (и, таким образом, с низкой реакционной или гибридизационной специфичностью) имеют место, если гибридизацию проводят при комнатной температуре в растворе 2×SSC. Условия с высокой жесткостью включают в себя, например, реакцию гибридизации при 68°C в растворе 0,1×SSC и 0,1% SDS.
Под гибридизацией в жестких условиях в пределах различных аспектов настоящего изобретения предпочтительно подразумевают:
1) гибридизацию меченого зонда с образцом нуклеиновой кислоты для анализа при 65°C или, в случае олигонуклеотидных зондов, при температуре на 5°C ниже температуры отжига или плавления дуплекса, состоящего из олигонуклеотида и образца (температуры отжига и плавления далее подразумевают синонимами), в течение ночи в 50 мМ Tris pH 7,5, 1M NaCl, 1% SDS, 10% декстрансульфате, 0,5 мг/мл денатурированной ДНК спермы лосося или сельди;
2) отмывку в течение 10 минут в 2×SSC при комнатной температуре;
3) отмывку в течение 30 минут в 1×SSC/0,1% SDS при 65°C (или в случае олигонуклеотидов при температуре на 5°C ниже температуры отжига);
4) отмывку в течение 30 минут в 0,1×SSC/0,1% SDS при 65°C (или в случае олигонуклеотидов при температуре на 5°C ниже температуры отжига).
Олигонуклеотиды для применения в качестве зондов для гибридизации представляют собой полинуклеотиды, а предпочтительно фрагменты ДНК, с длиной от 15 до 30, а предпочтительно 20, нуклеотидов. Температуру отжига определяют по формуле Tm=2 × (число A+T) + 4 × (число G+C)°C.
Для получения 2×SSC или 0,1×SSC (или любой другой степени разведения SSC) раствор, например, 20×SSC разбавляют соответствующим образом. 20×SSC состоит из 3 М NaCl/0,3 М цитрата Na×2H2O.
Перед проведением реакции гибридизации полинуклеотиды, если желательно, после проведения электрофоретического разделения (в таком случае: "саузерн"-блот (ДНК) или "нозерн"-блот (РНК)) или без проведения электрофоретического разделения (в таком случае: слот- или дот-блот) переносят на подходящую мембрану, например нейлоновую или нитроцеллюлозную мембрану. Гибридизацию проводят с применением подходящим образом меченного зонда. Пригодные способы мечения представляют собой, например, радиоактивное мечение или мечение с применением флуоресцентных красителей. Зонд представляет собой одноцепочечный полирибо- или полидезоксирибонуклеотид, являющийся по природе одноцепочечным или, как правило, являющийся двухцепочечным, но сделанный одноцепочечным посредством денатурации. Данный зонд связывается с образцом ДНК или РНК (который также находится в одноцепочечном состоянии) посредством спаривания оснований.
Фрагменты PAM предпочтительно представляют собой фрагменты, содержащиеся в указанных выше последовательностях с ID NO:1, 2 или 3, а производные предпочтительно получают из указанных выше последовательностей с ID NO:1, 2 или 3 или из их фрагментов.
Функциональные фрагменты или их производные предпочтительно способны ингибировать активность аденилатциклазы (AC), более предпочтительно активность AC типа I, V или VI.
В предпочтительном варианте осуществления различных аспектов настоящего изобретения его функциональные фрагменты или производные содержат или включают аминокислоты 400-1400, предпочтительно 446-1062, 499-1065 или 1028-1231, более предпочтительно 1000-1300, еще более предпочтительно 1000-1100 и наиболее предпочтительно 1028-1065 последовательности человеческого PAM, предпочтительно последовательности человеческого PAM, соответствующей SEQ ID NO:2, в том случае, если их кодируют соответствующие нуклеотидные фрагменты, особенно если они входят в состав последовательностей SEQ ID NO:2 или 3.
Если функциональные фрагменты или их производные представляют собой полинуклеотиды, предпочтительно, если они содержат кодирующие указанные выше полипептидные фрагменты полинуклеотиды или состоят из них. Более конкретно, предпочтительно, если они содержат положения с 1482 по 3332 (кодирующие аминокислоты 446-1062), или с 1641 по 3341 (кодирующие аминокислоты 498-1066), или с 3228 по 3839 (кодирующие аминокислоты 1038-1231) cds человеческого PAM или состоят из них. Даже более предпочтительно, если cds человеческого PAM, из которой получены фрагменты, обладает последовательностью, соответствующей SEQ ID NO:2.
В одном из предпочтительных вариантов осуществления настоящего способа идентификации модулирующих боль соединений применяют клетки, экспрессирующие PAM, предпочтительно рекомбинантный PAM.
Клетки могут представлять собой клетки любого типа, например эукариотические или прокариотические одноклеточные организмы (такие как бактерии, например E. coli или дрожжи, например S. pombe или S. cerevisiae) или клеточные линии, полученные из многоклеточных организмов (такие как HeLa, COS, NIH-3T3, CHO и т.д.), где предпочтительны клеточные линии млекопитающих.
По другому предпочтительному варианту осуществления применяют модифицированные клетки с уменьшенной по сравнению с ее немодифицированным состоянием активностью PAM. Таким образом, можно тестировать способность химических соединений, тестируемых на способность модулировать (предпочтительно уменьшать) и/или предотвращать боль, увеличивать или восстанавливать сниженную или полностью нарушенную активность PAM.
Модификация может представлять собой модификацию любого типа (стабильную или транзиторную, предпочтительно стабильную), ведущую к активности PAM (т.е. его способности уменьшать уровни внеклеточного цАМФ, взаимодействовать с другими факторами, подобными AC, особенно AC, ингибировать AC или его способность снижать восприятие боли), стабильному уровню транскрипта PAM (т.е. посредством активации транскрипции PAM или стабилизации транскрипта) или стабильному уровню белка PAM (т.е. посредством активации трансляции PAM или его посттрансляционного процессинга; посредством модуляции посттрансляционной модификации PAM, или посредством активации его стабилизации, или посредством ингибирования его разрушения). Этого можно достигнуть, например, с применением доминантных негативных мутантов PAM, антисмысловых нуклеотидов, конструкций RNAi PAM, посредством образования функциональных или геномных нокаутов PAM (которые, например, можно индуцировать) или посредством других пригодных способов, известных в данной области. Для обзора указанных выше способов см., например: Current protocols in Molecular biology (2000) J.G. Seidman, Chapter 23, Supplement 52, John Wiley and Sons, Inc.; Gene Targeting: a practical approach (1995), Editor: A.L. Joyner, IRL Press; Genetic Manipulation of Receptor Expression and Function, 2000; Antisense Therapeutics, 1996; Scherr et al, 2003.
По предпочтительному варианту осуществления применяют клетки с нокаутом PAM. Пригодные клеточные линии для получения нокаутов хорошо известны в данной области и описаны, например, в Current protocols in Molecular Biology (2000) J.G. Seidman, Chapter 23, Supplement 52, John Wiley and Sons, Inc или Gene Targeting a practical approach. (1995) Ed. A.L. Joyner, IRL Press.
Активность PAM можно определять или непосредственно, например по его способности (или способности его фрагментов или производных) взаимодействовать с AC или инактивировать AC, или ее можно определять косвенно, например по его способности (или способности его фрагментов или производных) уменьшать уровни внутриклеточного цАМФ, модулировать концентрации ионов в нейронах или его способность модулировать, особенно уменьшать, восприятие боли. Пригодные способы уменьшения указанных выше параметров хорошо известны в данной области (см. также выше): например, уровни цАМФ можно измерять посредством HTRF или ALPHAscreen™, концентрации ионов, например, можно рассчитывать посредством фиксации потенциала или пригодных красителей, восприятие боли можно измерять, например, посредством формалинового теста или тестов механической или термической гипералгезии или посредством теста горячей пластинки и т.д.
В другом аспекте изобретение относится к способу идентификации модулирующего боль соединения, включающему в себя
a) выбор соединения, модулирующего активность PAM, в качестве тестируемого соединения; и
b) введение указанного тестируемого соединения субъекту для определения того, модулирует ли оно боль.
Субъект может представлять собой любого субъекта, способного ощущать боль, предпочтительно млекопитающего, или не являющегося человеком млекопитающего или человека (т.е. при изучении на пациентах).
Далее изобретение проиллюстрировано более подробно посредством примеров и фигур. Однако примеры не являются средством ограничения объема изобретения.
Примеры: исследование профиля экспрессии и функции PAM
1. Получение животных срезов:
Крыс Sprague Dawley дикого типа приобретали в Charles River Wiga GmbH (Sulzfeld, Германия). Животным до экспериментов предоставляли свободный доступ к пище и воде. Их содержали в помещениях с контролируемым климатом и светом (24±0,5°C). Каждое животное использовали только для одного эксперимента. Во всех экспериментах соблюдались этические рекомендации для исследователей в отношении находящихся в сознании животных, а процедуры одобрялись местным этическим комитетом. После умерщвления взрослых крыс фиксировали посредством перфузии 4% параформальдегида в 0,1 М фосфатно-солевом буфере (PBS, pH 7,2) в течение одного часа. Ткани нарезали с применением криостата в горизонтальной плоскости с толщиной 14-16 мкм. Срезы закрепляли на Superfrost Plus Slides (Fisher Scientific Co., Pittsburgh, PA) и до применения хранили при -80°C.
2. Получение рибонуклеотидных зондов:
Рибонуклеотидные зонды получали, как описано ранее (Yang et al., 2002). Антисмысловые и смысловые рибонуклеотидные зонды PAM крыс получали с применением полимераз T7 и T3, после линеаризации плазмиды Hind III (антисмысловой) и BamHI (смысловой) соответственно (см. Yang et al., 2002). В присутствии [35S] УТФ-αS (ICN, Irvine CA), линеаризованной кДНК PAM, NTP при 37°C в течение 1 часа проводили транскрипцию in vitro по рекомендациям производителя (Promega, Madison, WI). Транскрипты РНК очищали с применением набора RNA Probe Purification (Pequlab, Erlangen, Германия).
3. Гибридизация in situ:
Гибридизацию in situ проводили, как описано ранее (Yang et al. 2002): срезы фиксировали в 4% параформальдегиде в 0,1 М фосфатно-солевом буфере (pH,7,2), предварительно обрабатывали 0,25% уксусным ангидридом и 0,1 M триэтаноламином, промывали 0,2×SSC и денатурировали последовательно увеличивающимися концентрациями этилового спирта. Срезы в течение 2 часов при комнатной температуре предгибридизовали в растворе для предгибридизации (50% деионизированный формамид, 0,6 М хлорид натрия, 10 мМ Tris-HCl (pH 7,6), 50 мМ ЭДТА, 0,025% пирофосфат натрия, 0,02% фиколл, 0,02% БСА, 0,02% поливинилпирролидон, 10 мМ DTT и денатурированные нагреванием, гетерологичные нуклеиновые кислоты (0,005% дрожжевая тРНК, типа X, 0,05% тотальная дрожжевая РНК, типа I, 0,05% ДНК семенников лосося, типа III)); гибридизовали с рибонуклеотидными зондами в растворе для гибридизации (2,5×106 имп./мин./срез), 50% деионизированном формамиде и 50% буфере для гибридизации, содержащем 0,6 М хлорид натрия, 10 мМ Tris-HCl (pH 7,6), 50 мМ ЭДТА, 0,025% пирофосфат натрия, 0,02% фиколл, 0,02% БСА, 0,02% поливинилпирролидон, денатурированные нагреванием гетерологичные нуклеиновые кислоты (0,005% дрожжевая тРНК, типа X, 0,005% тотальная дрожжевая РНК, типа I, 0,05% ДНК семенников лосося, типа III), 100 мМ DTT, 0,0005% полиадениловая кислота, 10% декстрансульфат) при 50°C в течение ночи. Срезы промывали 2×, 1×, 0,5×SSC при RT (комнатная температура). После расщепления в 20 мкг/мл РНКазы A (Sigma, St. Louis, MO), срезы отмывали в 1× буфере РНКазы, 2×, 1×, 0,5×SSC при комнатной температуре и в 0,1×SSC в течение ночи при 45°C. Срезы обезвоживали последовательно увеличивающимися концентрациями этилового спирта, экспонируя на пленку Kodak Biomax MR (Kodak, Rochester, NY) в течение 3-7 суток при -80°C.
4. Получение антител и иммунофлуоресцентное окрашивание:
Антисыворотку коммерческим способом индуцировали у кроликов с применением пептидов, состоящих из аминокислотных остатков 135-153 и 4601-4614 человеческого PAM в соответствии с SEQ ID NO:1 соответственно (BioTrend, Cologne, Германия). Антисыворотку коммерческим способом получали в BioTrend, Cologne, Германия, по стандартным процедурам. Для слежения за распределением PAM в срезах спинного мозга и DRG срезы пропитывали 0,1% Triton X-100 в течение 5 минут. Срезы в течение 1 часа блокировали в 3% БСА в PBS, а затем инкубировали в течение 1 часа с антисывороткой к PAM (разведение 1:50). После этого в PBS, содержащем 3% БСА, проводили инкубацию с меченными FITC антителами козы к антителам кролика. Затем срезы отмывали PBS и размещали с применением fluoromount™.
5. ОТ-ПЦР:
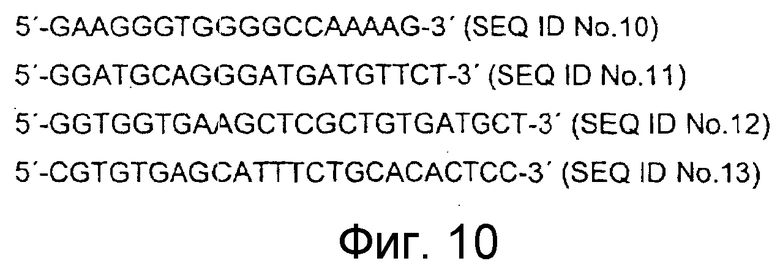
Полноразмерную РНК из спинного мозга и DRG крыс выделяли с применением экстракции с гуанидинизотиоцианатом/фенолом/хлороформом (Chomczynski and Sacchi 1987). 2 мкг тотальной РНК отжигали с 0,6 мМ каждого олиго-(dT)-праймера и в течение 30 минут при 37°C проводили обратную транскрипцию с применением обратной транскриптазы (Promega, Madison, WI). Затем кДНК сразу же применяли для амплификации. Олигонуклеотидные праймеры, применяемые для амплификации крысиного GADPH, представляли собой 5'-GAAGGGTGGGGCCAAAAG-3' (смысловой; SEQ ID NO:10) и 5'-GGATGCAGGGATGATGTTCT-3' (антисмысловой; SEQ ID NO:11; Trajkovic et al. 2000). Праймеры для амплификации изоформ AC выбирали как опубликовано у Bek et al. (Bek et al. 2001). Праймеры для крысиного PAM представляли собой 5'-GGTGGTGAAGCTCGCTGTGATGCT-3' (смысловой; SEQ ID NO:12) и 5'-CGTGTGAGCATTTCTGCACACTCC-3' (антисмысловой; SEQ ID NO:13). Продукт ПЦР соответствует нуклеотидам 13692-14064 кДНК человеческого PAM. Соответствующие крысиные последовательности получали из EST-клона AW441131 (SEQ ID NO:8). Для полуколичественной ПЦР применяли ДНК-полимеразу SAWDAY (Peqlab, Erlangen, Германия). После начальной стадии денатурации при 95°C в течение 5 минут проводили 30 циклов по 1 минуте при 95°C, 30 секунд при 55°C и 10 секунд при 72°C с последующей конечной стадией удлинения при 72°C в течение 10 минут. Количественную ПЦР проводили с применением системы и реагентов TaqMan™ (Applied Biosystems, Weiterstadt, Германия) по инструкциям производителя.
6. Очистка полноразмерного PAM:
Очистку PAM проводили, как описано ранее (Scholich et al. 2001) с некоторыми модификациями. В кратком изложении, клетки HeLa растили в среде DMEM с 10% эмбриональной телячьей сыворотки и 1% пенициллина/стрептомицина. Конфлюэнтные клетки из сорока 150-мм чашек собирали в 1×PBS, 1 мМ ЭДТА и в течение 5 минут осаждали при 400×g. Клетки ресуспендировали в буфере TED (50 мМ Tris-HCl, pH 8,0, 1 мМ ЭДТА, 1 мМ DTT), содержащем 125 мМ NaCl, 20 мкг/мл апротинина, 20 мкг/мл лейпептина, 1 мМ бензамидина, 5 мкг/мл соевого ингибитора трипсина, и лизировали 2×5 секунд ультразвуком. Гомогенат центрифугировали при 27000×g в течение 30 мин при 4°C, а супернатант помещали в колонку XK16 с Q-Sepharose (Amersham, Pharmacia, Piscataway, NJ) и элюировали в TED в градиенте NaCl 150-350 мМ по инструкциям производителя. Фракции анализировали посредством "вестерн"-блоттинга по стандартным процедурам; положительные фракции объединяли, а концентрацию NaCl доводили до 1 М. Затем белок помещали в колонку XK16 с Phenyl-Sepharose (Amersham, Pharmacia, Piscataway, NJ) и отмывали в 300 мМ NaCl в TED по инструкциям производителя. Проточные и отмытые фракции содержали PAM. Их объединяли и буфер заменяли на указанный выше буфер TED, содержащий 100 мМ NaCl, с применением Centricon 50 (Amicon, Beverly, MA) по инструкциям производителя. Затем белок помещали на колонку для FPLC Mono S 5/5 (Amersham, Pharmacia, Piscataway, NJ) и отмывали буфером для нанесения (100 мМ NaCl в TED) по инструкциям производителя. Проходящую фракцию собирали и наносили на колонку для FPLC Mono Q 5/5 (Amersham, Pharmacia, Piscataway, NJ). Белок элюировали в градиенте NaCl от 150 до 400 мМ в TED. Положительные фракции объединяли и заменяли буфер на 50 мМ Tris-HCl, pH 8,0, 1 мМ DTT с применением Centricon 50 (Amicon, Beverly, MA) и хранили при -80°C. Хранящийся PAM использовали в течение 3 недель.
7. Экспрессия и очистка рекомбинантного Gsα:
Помеченный гексагистидиновой меткой, конститутивно активный мутант Gsα (Gsα*) Q213L экспрессировали и очищали, как описано у Graziano et al., 1991. Для обеспечения максимальной активации Gsα* G-белок до применения в анализах активности AC в течение 30 минут инкубировали с 1 мкМ GTPγS в присутствии MgCl2 (25 мМ).
8. Анализы активности аденилатциклазы (анализы активности AC):
Образцы спинного мозга лизировали в 25 мМ Hepes, pH 7,4, 1 мМ ЭДТА, а клеточные мембраны получали, как описано у Kassis и Fishman. Аликвоты хранили при -80°C до использования. Анализы активности AC проводили в объеме 100 мкл в течение 15 мин при комнатной температуре в присутствии 100 мкМ MgCl2, как описано ранее (Patel et al., 2002). Для стимуляции ферментативной активности AC в мембранах HeLa (10 мкг белка) применяли Gsα* (80 нМ) или форсколин (100 мкМ).
9. Спинальная доставка смысловых или антисмысловых олигонуклеотидов PAM:
Крыс анестезировали кетамином (60 мг/кг в./б.) и мидазоламом (0,5-1 мг/кг в./б.). Над позвоночником от позвонка Th13 до L3 рассекали кожу. Мышечную ткань вокруг L2-3 удаляли. Остистый отросток L3 удаляли, а у L2 проводили ламинэктомию. Затем в перидуральное пространство вводили полиэтиленовые катетеры (ID 0,28 мм, OD 0,61 мм) так, чтобы наконечник катетера достигал Th9-10. Катетер фиксировали цианакрилатным клеем, выводили наружу в области шеи и зашивали кожу.
10. Инфузия олигонуклеотидов PAM:
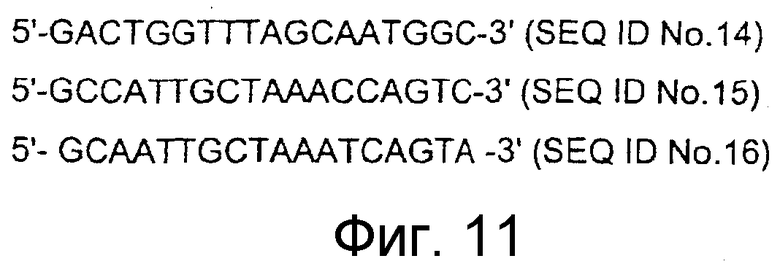
Последовательности олигодезоксинуклеотидов (ODN) выбирали из последовательности крысиного PAM, как изложено ниже. Смысловой: 5'-GACTGGTTTAGCAATGGC-3'(SEQ ID NO:14), антисмысловой: 5'-GCCATTGCTAAACCAGTC-3' (SEQ ID NO:15) и антисмысловой ODN, несущий три мутации (3M-as; мутации подчеркнуты): 5'-GCAATTGCTAAATCAGTA-3' (SEQ ID NO:16). Через трое суток после хирургического вмешательства крыс помещали в "свободно перемещающуюся систему" (CMA, Stockholm, Швеция) и в течение 100 часов с применением микроинфузионной помпы (CMA, Stockholm, Швеция) через катетер при скорости потока 0,05-0,1 мкл/мин проводили инфузию антисмысловых (n=5) или смысловых (n=5) олигонуклеотидов (2,5 мг/мл в искусственной цереброспинальной жидкости).
11. Формалиновый тест:
В пределах 15 минут после прекращения инфузии проводили формалиновый тест. 50 мкл 5% раствора формальдегида подкожно (п/к) инъецировали на дорзальную поверхность одной задней лапы. В течение одноминутных интервалов, до 60 минуты, начиная сразу после инъекции формалина, подсчитывали подергивания. Подергивания 5 мин интервалов суммировали как среднее количество подергиваний в минуту. Для сравнения болевого поведения между группами сумму подергиваний в течение двух фаз периода одночасового наблюдения подвергали обработке посредством t-теста Стьюдента. Величину α принимали за 0,05.
В конце формалинового теста крыс умерщвляли, вырезали поясничную область спинного мозга и ганглии задних корешков (DRG), образец замораживали в жидком азоте и хранили при -80°C до дальнейшего анализа. Для определения экспрессии PAM иммуногистохимически анализировали срезы спинного мозга с применением указанных выше антител к PAM.
12. Вызванное зимозаном воспаление:
Для индукции воспаления 2,5 мг зимозана A (Sigma, St. Louis, MO), суспендированного в 30 мкл 0,03 М фосфатно-солевого буфера (PBS, pH 7,5), подкожно инъецировали в среднюю подошвенную область правой задней лапы. Известно, что такая внутриподошвенная инъекция зимозана является достоверной моделью термической и механической гипералгезии у крыс (Meller and Gebhart 1997). Крыс через 24-96 часов после инъекции зимозана умерщвляли посредством сердечной пункции в условиях глубокой изофлурановой анестезии. Поясничную область спинного мозга и ганглии задних корешков (DRG) вырезали, образец замораживали в жидком азоте и хранили при -80°C до дальнейшего анализа.
13. Результаты
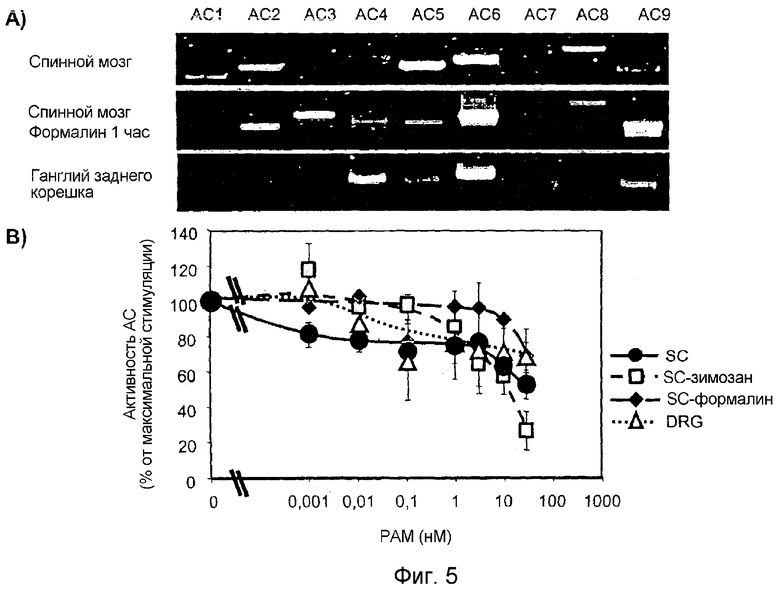
Указанные выше эксперименты авторов изобретения с применением ОТ-ПЦР, иммуногистохимии и гибридизации in situ, впервые демонстрируют, что PAM экспрессируется в сенсорных нейронах спинного мозга, а также ганглиях задних корешков (DRG) взрослых крыс. Посредством ОТ-ПЦР мРНК PAM на тех же уровнях выявляли в спинном мозге и ганглиях задних корешков в течение развития (E14-взрослый). Как показано посредством "вестерн"-блота и ОТ-ПЦР, экспрессия PAM повышается через 24-48 часов после обработки крыс зимозаном.
Главные изоформы аденилатциклазы, экспрессируемые в спинном мозге и DRG, представляют собой AC типа 5 и 6 и AC типа 4 и 6 соответственно. Больших изменений в экспрессии изоформ AC в спинном мозге после обработки зимозаном не выявили. Следовательно, стимулированная Gαs активность AC в мембранах препаратов из спинного мозга и DRG ингибировалась PAM. Следовательно, выявлено, что обработка антисмысловыми, но не смысловыми олигонуклеотидами к PAM увеличивает индуцированное формалином подергивание задних лап у взрослых крыс. Таким образом, накопление цАМФ в спинном мозге крыс, обработанных антисмысловыми олигонуклеотидами к PAM, увеличено по сравнению с контрольными крысами.
Добавление к лизатам спинного мозга очищенного PAM приводило к ингибированию стимулированной Gαs активности AC в лизатах спинного мозга контрольных и обработанных зимозаном животных (фиг. 5B). Активность AC, стимулированная 30 нМ Gαs, снижалась на 50% в лизатах спинного мозга контрольных животных и на 70% в лизатах, полученных от обработанных зимозаном крыс, в течение 96 часов.
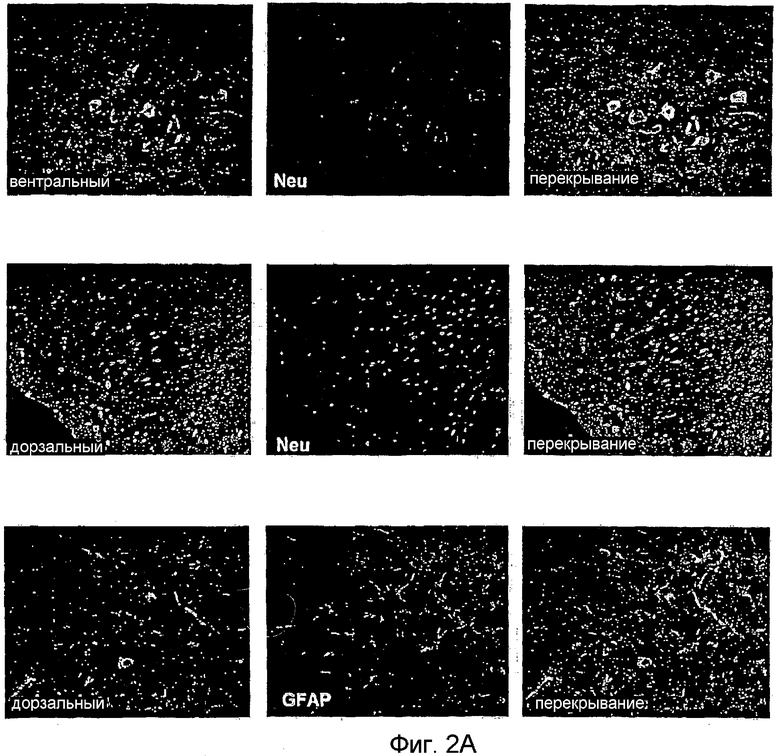
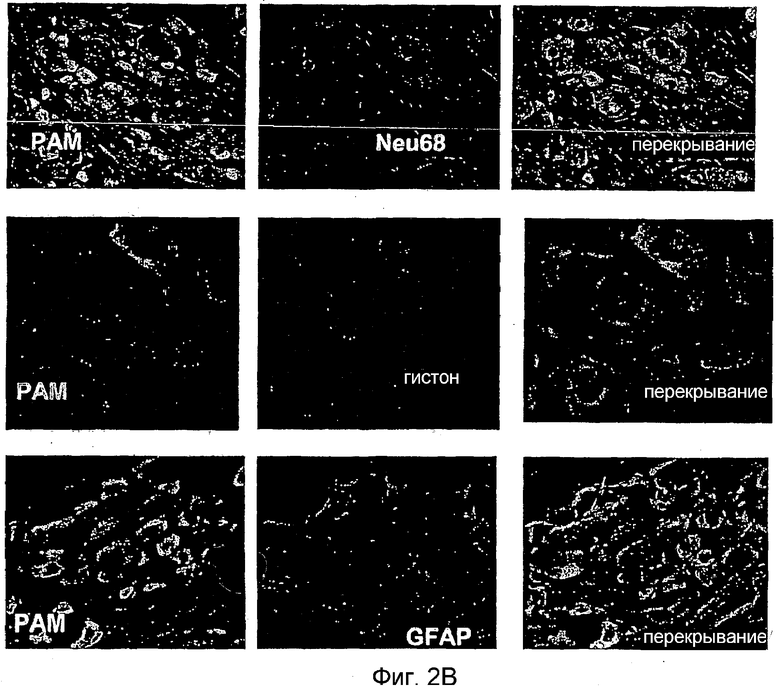
Для определения того, экспрессирован ли PAM в спинном мозге, вначале проводили гибридизацию in situ. Это приводило к выявлению четкого сигнала для мРНК PAM во всем объеме серого вещества, но не в белом веществе спинного мозга взрослых крыс (фиг. 1). Для более точного определения клеточной популяции, экспрессирующей PAM в спинном мозге, а также в DRG, с применением пептидов, соответствующих аминокислотным остаткам 135-153 и 4601-4614 человеческого PAM, получали антитела против PAM. Иммуногистохимический анализ выявил, что PAM совместно локализуется с иммунореактивностью против NeuN, но не с иммунореактивностью против GFAP (фиг. 2A). Более конкретно, экспрессию PAM преимущественно выявляли в нейронах спинного рода (фиг. 2A), тогда как не относящаяся к нейронам клеточная популяция демонстрировала очень слабую экспрессию PAM. Особенно высокую экспрессию PAM можно выявить в нейронах DRG (фиг. 2B). Здесь иммунореактивность против PAM располагалась в аксонах, а также в телах нейрональных клеток большого и малого диаметров (фиг. 2B). Вызывает интерес то, что PAM не выявили в ядрах клеток, что показано совместным окрашиванием антителом к гистонам (фиг. 2B). Как можно видеть в спинном мозге, экспрессию PAM не выявили в экспрессирующих GFAP клетках.
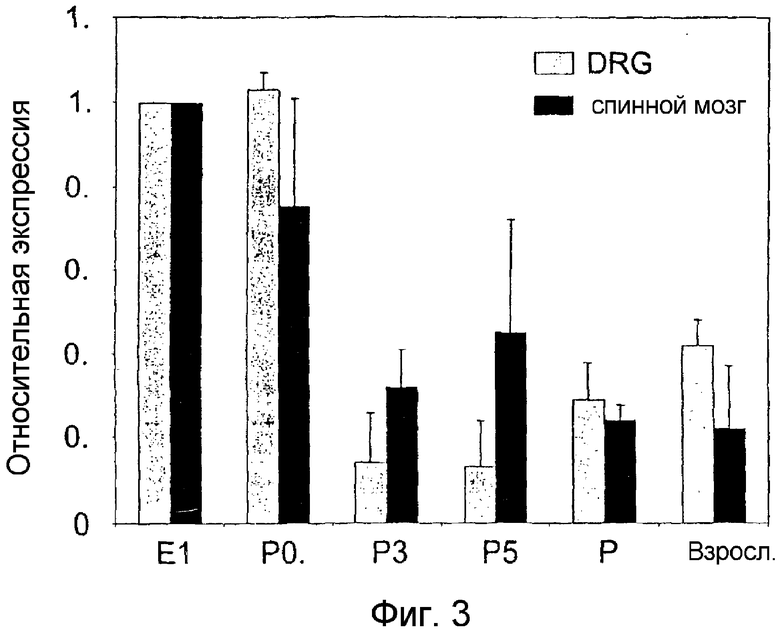
Так как экспрессия PAM в головном мозге в течение развития мышей и крыс регулируется различным образом (Yang et al. 2002), авторы настоящего изобретения также исследовали, изменяется ли в течение развития экспрессия мРНК PAM в спинном мозге и DRG крыс. С этой целью с применением количественной ОТ-ПЦР определяли экспрессию мРНК PAM. Выявили, что мРНК PAM высокоэкспрессирована в спинном мозге и DRG на поздних эмбриональных стадиях (E16) до момента вскоре после рождения (P0,5; фиг. 3). Представляет интерес то, что вскоре после рождения экспрессия уменьшалась до 30-40% от уровня эмбриональной экспрессии и затем оставалась постоянной на всем протяжении взрослого состояния (фиг. 3).
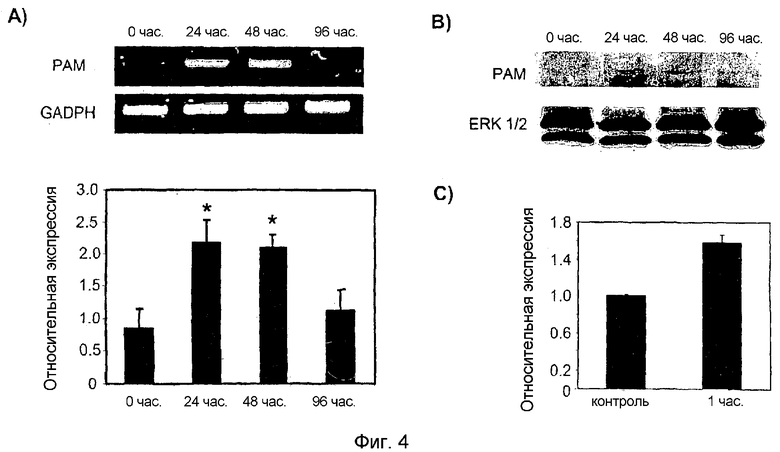
Затем проверяли, регулируется ли экспрессия PAM в спинном мозге ноцецептивной стимуляцией. Для этого проводили мониторинг экспрессии PAM в спинном мозге после инъекции зимозана и формалина в задние лапы взрослых крыс. Экспрессия мРНК PAM после обработки зимозаном после 24 и 48 часов повышалась приблизительно в два раза (фиг. 4A). Таким образом, через 24 часа после инъекции зимозана экспрессия PAM на уровне белка являлась повышенной и оставалась повышенной в течение 96 часов (фиг. 4B). Через 96 часов после инъекции зимозана экспрессия мРНК PAM снижалась. Данное уменьшение экспрессии мРНК PAM не отражалось на уровне белка (сравн. фиг. 4A и B). Особенно интересно то, что экспрессия мРНК PAM в спинном мозге крыс также повышалась через 1 час после инъекции формалина (фиг. 4C).
Так как известно, что PAM представляет собой мощный ингибитор аденилатциклаз типов 1, 5 и 6 (Scholich et al. 2001), исследовали способность PAM ингибировать активность AC в лизатах спинного мозга и DRG. В спинном мозге полуколичественной ОТ-ПЦР выявили две главных изоформы AC. Данные изоформы AC являлись изоформами типов 5 и 6 (фиг. 5A). Примечательно, что PAM ингибирует обе изоформы при наномолекулярных концентрациях (Scholich et al. 2001). Профиль экспрессии изоформ AC в спинном мозге через 24-96 часов после инъекции зимозана существенно не изменялся. Представляет интерес, что через 1 час после инъекции формалина выявляли сдвиг в экспрессии изоформ AC (фиг. 5A). Снижалась экспрессия мРНК AC типа 5 и повышалась экспрессия мРНК AC типов 3 и 9.
Как можно показать указанными выше экспериментами, добавление очищенного PAM к лизатам спинного мозга приводило к ингибированию стимулированной Gαs активности AC в препаратах спинного мозга. Добавление 30 нМ PAM снижало стимулированную Gαs активность AC в лизатах спинного мозга контрольных животных на 49% (фиг. 5B). Стимулированная Gαs активность AC в полученных у крыс через 96 часов после инъекции зимозана лизатах спинного мозга демонстрировала большую чувствительность к ингибированию PAM по сравнению с необработанными животными (70% ингибирования при 30 нМ; фиг. 5B). Напротив, ингибирование активности AC посредством PAM в лизатах спинного мозга животных, обработанных в течение 1 часа формалином, снижалось в меньшей степени (25% ингибирования при 30 нМ; фиг. 5B).
В DRG преимущественно экспрессируемыми изоформами AC являются AC типов 4 и 6 (фиг. 5A). Стимулированная Gαs активность AC в лизатах DRG по сравнению с лизатами спинного мозга в присутствии 30 нМ PAM снижалась на 32% (фиг. 5B).
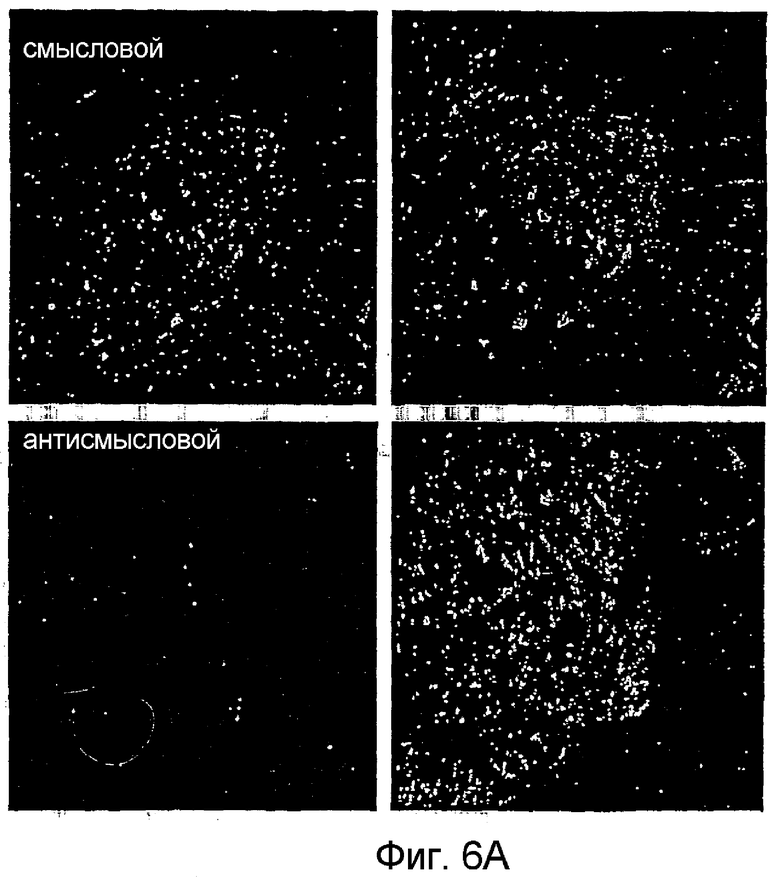
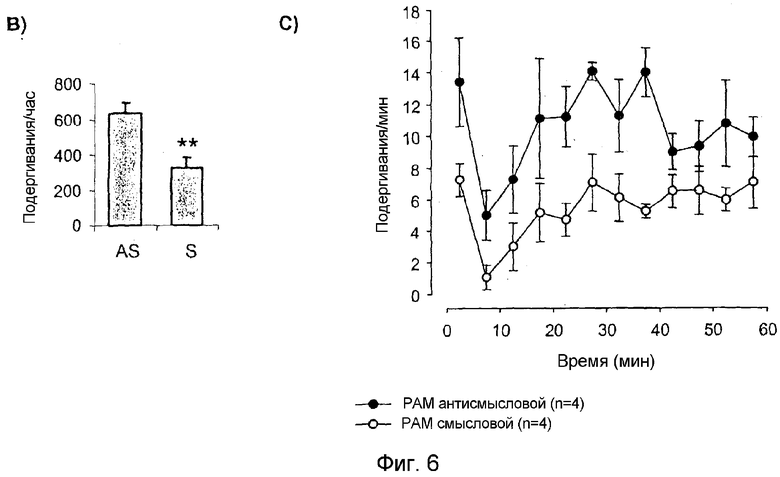
Для проверки возможной роли PAM в ноцицептивной передаче в спинном мозге животным перед проведением анализа с формалином посредством поясничных интратекальных катетеров проводили инфузию смысловых и антисмысловых олигонуклеотидов. Как выявляли с применением иммуногистохимии экспрессия PAM в нейронах спинного мозга снижалась (фиг. 6A). Инфузия антисмысловых олигонуклеотидов PAM вызывала значительное увеличение ноцицептивного ответа после инъекции формалина по сравнению с обработкой смысловым олигонуклеотидом PAM (p=0,007; фиг. 6B и C). Гипералгезия у обработанных антисмысловым олигонуклеотидом PAM крыс сопровождалась увеличенной лизательной и кусательной деятельностью. Так как PAM представляет собой ингибитор активности AC (Scholich et al. 2001), у обработанных смысловыми и антисмысловыми ODN крыс определяли базальную, стимулированную Gαs и форсколином активность AC в лизатах спинного мозга. Эксперименты показали значительное увеличение (20,7%) базальной активности AC у обработанных антисмысловыми олигонуклеотидами крыс (таблица 1). Напротив, значительных изменений в стимулированной Gαs и форсколином активности AC не выявили, что указывает на то, что общее количество AC при обработке посредством ODN не изменяется (таблица 1).
Указанные выше эксперименты показали, что PAM локализуется в телах и аксонах клеток нейронов спинного мозга и DRG (фиг. 2A,B). Только очень небольшое количество иммунореактивности выявляли в ядрах, позволяя предположить различные функции PAM в нейронах и линиях злокачественных клеток.
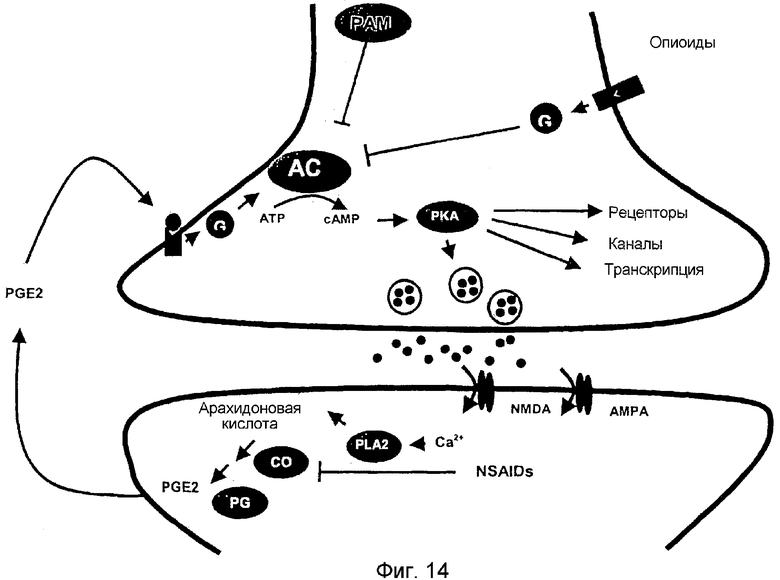
Повышение центральной чувствительности после длительной ноцицептивной стимуляции основывается на изменениях нейронов и синапсов в спинном мозге (Woolf and Costigan 1999; Woolf and Salter 2000; Ji and Woolf 2001). Открытие авторов настоящего изобретения того, что PAM экспрессирован в чувствительных нейронах спинного мозга и DRG, привело к вновь сформированной гипотезе, что PAM может быть вовлечен в изменения синапсов в течение обработки ноцицептивных сигналов в спинном мозге. Указанные выше открытия того, что после ноцицептивных стимулов повышается экспрессия PAM (фиг. 4A), поддерживают данную гипотезу о том, что PAM может играть роль в изменениях синапсов в течение обработки ноцицептивных сигналов в спинном мозге.
Кроме того, неожиданное открытие авторов настоящего изобретения того, что PAM экспрессирован в чувствительных нейронах спинного мозга и DRG, привело к вопросу о том, способен ли PAM также ингибировать активность AC в спинном мозге и DRG.
Указанные выше эксперименты впервые показали, что PAM представляет собой мощный ингибитор стимулированной Gαs активности AC в препаратах спинного мозга (фиг. 5B). После добавления 30 нМ PAM активность AC уменьшалась на 50%. Для достижения сравнимого ингибирования с применением α-субъединицы ингибиторного G-белка, Gαi, необходимо применять 200-800 нМ Gαi (Wittpoth et al. 1999). Ингибирующее действие PAM являлось даже более строгим в препаратах спинного мозга животных, обработанных за 96 часов зимозаном (фиг. 5B), и его можно объяснить увеличенными количествами эндогенного PAM в спинном мозге после инъекции зимозана (фиг. 4A, B). Ингибирование стимулированной Gαs активности AC в препаратах спинного мозга обработанных формалином животных (25% ингибирования) являлось менее резко выраженным по сравнению с контролем или обработанных зимозаном животных (50% и 75% соответственно).
Примечательно, что у обработанных в течение 1 часа формалином животных наблюдали сдвиг экспрессии изоформ AC (фиг. 5A). Экспрессия AC типов 3 и 9 повышается, тогда как экспрессия AC типа 5 снижается. До настоящего времени неизвестно, является ли PAM ингибитором AC типов 3 и 9. Следовательно, данные изоформы могут не ингибироваться PAM или тестируемые концентрации PAM являлись слишком низкими для достижения ингибирующего действия. Так как PAM представляет собой гигантский белок массой 510 кДа, технически невозможно тестировать концентрации PAM, большие чем 30 нМ. Однако по кривой доза-ответ, показанной на фигуре 5b, более высокие концентрации PAM могут приводить к более сильному ингибированию стимулированной Gαs активности AC в тестируемых препаратах спинного мозга.
Представляет интерес, что PAM являлся менее эффективным ингибитором ферментативной активности AC в препаратах DRG, чем в препаратах спинного мозга. Различные эффективности ингибирования PAM в препаратах спинного мозга и DRG вероятнее всего являются следствием наблюдаемого различия экспрессии изоформ AC. Основные изоформы AC, экспрессируемые в спинном мозге, представляют собой типы 5 и 6, которые оба сильно ингибирует PAM (фиг. 5A; (Scholich et al. 2001)). В DRG доминантными изоформами AC являются AC типа 4 и 6 (фиг. 5A). Неизвестно, ингибирует ли PAM AC типа 4, то ли данная изоформа не ингибируется PAM, то ли, опять, тестируемые концентрации PAM являлись слишком низкими для достижения ингибирующего действия. Однако по кривой доза-эффект, показанной на фигуре 5b, кажется вероятным, что более высокие концентрации PAM могут приводить к более сильному ингибированию стимулированной Gαs активности AC в препаратах DRG.
Однако наиболее неожиданным явилось обнаружение факта, что активность PAM оказывает влияние на болевое поведение тестируемых животных. Это впервые было показано в экспериментах авторов настоящего изобретения, продемонстрировавших значительное увеличение базальной активности AC (таблица 1) и, что более важно, значительное увеличение ноцицептивного ответа после инъекции формалина при сравнении с обработкой смысловыми олигонуклеотидами PAM (фиг. 6B и C), когда экспрессия эндогенного PAM в спинном мозге уменьшалась с введением животным антисмысловых олигонуклеотидов PAM (фиг. 6A).
14. Определение обезболивающего действия PAM
Приведенные выше доказательства обезболивающего действия PAM можно, например, подкрепить следующим гипотетическим экспериментом: обезболивающее действие PAM, например, формалиновой модели острой боли непосредственно можно быть определено с помощью интратекального применения, например, пептида, соответствующего аминокислотным остаткам с 1028 по 1065. Данный пептид соответствует минимальной области, выявленной как способная опосредовать взаимодействия PAM-аденилатциклаза, что определено посредством дрожжевой двухгибридной системы и анализов активности AC. Пептид можно применять в сочетании с bioporter lipofection reagent (коммерчески доступный в Peqlab, Германия). Данный подход мог бы позволить пептиду проникать в ткань и имитировать действия физиологического PAM в отношении AC.
Литература
Bailey C.H., Bartsch D., Kandel E.R.: Toward a molecular definition of long-term memory storage. Proc. Natl. Acad. Sci. U.S.A. 1996 Nov 26;93(24):13445-52.
Brandon E.P., Idzerda R.L., McKnight G.S.: PKA isoforms, neural pathways, and behaviour: making the connection. Curr. Opin. Neurobiol. 1997 Jun;7(3):397-403.
Bek M. J., Zheng S., Xu J., Yamaguchi I., Asico L. D., Sun X. G. and Jose P. A. (2001) Differential expression of adenylyl cyclases in the rat nephron. Kidney Int 60, 890-899.
Chang Q. and Balice-Gordon R. J. (2000) Highwire, rpm-1, and futsch: balancing synaptic growth and stability. Neuron 26, 287-290.
Chomczynski, P., Sacchi, N.: Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal. Biochem. 162, (1987) 156-159.
Graziano, M.P. Freissmuth M., Gilman A.G.: Purification of recombinant Gs alpha. Meth. Enz. (1991) 195: 192-215.
Graziano M. P., Freissmuth M. and Gilman A. G. (1991) Purification of recombinant Gs alpha. Methods Enzymol 195, 192-202.
Guo Q., Xie J., Dang C.V., Liu E.T., Bishop J.M.: Identification of a large Myc-binding protein that contains RCC1-like repeats. Proc. Natl. Acad. Sci. U.S.A. 1998 Aug 4;95(16):9172-7).
Jin Y. (2002) Synaptogenesis: insights from worm and fly. Curr Opin Neurobiol 12, 71-79.
Julius and Basbaum " Molecular mechanisms of nociception", Nature, volume 413, 13. September 2001, pp. 203-209.
Kassis, S., and Fishman, P. H. (1982) J Biol Chem 257(9), 5312-5318.
Meller S.T., Gebhart G.F. (1997) Intraplantar zymosan as a reliable, quantifiable model of thermal and mechanical hyperalgesia in the rat; Eur. J. Pain 1, 43-52.
Nair, B. G., Parikh, B., Milligan, G., and Patel, T. B. (1990) J Biol Chem 265(34), 21317-21322.
Patel T. B., Wittpoth C., Barbier A. J., Yigzaw Y. and Scholich K. (2002) Functional analyses of type V adenylyl cyclase. Methods Enzymol 345, 160-187.
Snyder S. H. (1985) Adenosine as a neuromodulator. Annu Rev Neurosci 8, 103-124.
Ruppert C., Goldowitz D., and Wille W. (1986), Proto-oncogene-c-mycis expressed in cerebellar neurons at different developmental stages, Embo J5, 1897-1901.
Schaefer A. M., Hadwiger G. D. and Nonet M. L. (2000) rpm-1, a conserved neuronal gene that regulates targeting and synaptogenesis in C. elegans. Neuron 26, 345-356.
Schaible H.G., Vanegas H.: How do we manage chronic pain? Baillieres Best. Pract. Res. Clin. Rheumatol. 2000 Dec; 14(4):797-811.
Scherr M., Morgan M.A., Eder M., Gene Silencing Mediated by Small Interfering RNAs in Mammalian Cells, Curr Med Chem. 2003, Feb; 10 (3): 245-256.
Scholich K., Pierre S., Patel T.B.: Protein associated with myc (PAM) is a potent inhibitor of adenylyl cyclase. J. Biol. Chem. 2001, Dec 14;276(50):47583-9.
Scholz and Woolf "Can we conquer pain", Nature neuroscience supplement, volume 5, November 2002, pp. 1062-1067.
Snyder S.H. (1985), Adenosine as a neuromodulator. Annual Reviews of Neuroscience 8, 103-104.
Trajkovic V, Samardzic T, Stosic-Grujicic S, Ramic Z, Mostarica Stojkovic M. Muramyl dipeptide potentiates cytokine-induced activation of inducible nitric oxide synthase in rat astrocytes. Brain Res. 2000 Nov 10;883(1):157-63.
Wan H. I., DiAntonio A., Fetter R. D., Bergstrom K., Strauss R. and Goodman C. S. (2000) Highwire regulates synaptic growth in Drosophila. Neuron 26, 313-329.
Wittpoth C., Scholich K., Yigzaw Y., Stringfield T.M. and Patel T.B. (1999) Regions on adenylyl cyclase that are necessary for inhibition of activity by beta gamma G(iα) subunits of heterotrimeric G proteins. Proc. Natl. Acad. Sci. USA 96, 7723-7730.
Wood, J.D. "Pathobiology of Visceral Pain: Molecular Mechanisms and Therapeutic Implications II. genetic approaches to pain therapy", American Journal of Physiological Gastrointestinal Liver Physiology, 2000, volume 278, G507-G512.
Woolf and Mannion "Neuropathic pain: aetiology, symptoms mechanisms, and management", The LANCET, volume 353, June 5, 1999, pp. 1959-1964.
Woolf J. and Salter M.W. "Neuronal Plasticity: Increasing the Gain in Pain", Science, volume 288, June 9, 2000, pp. 1765-1768.
Xia Z., Storm D.R.: Calmodulin-regulated adenylyl cyclases and neuromodulation. Curr. Opin. Neurobiol. 1997 Jun;7(3):391-6.
Yang H., Scholich K., Poser S., Storm D., Patel T.B., Goldowitz D.: Developmental expression of protein associated with myc (PAM) in the rodent brain. Brain Res Dev Brain Res 136, 2002, 35-42.
Zhen M., Huang X., Bamber B. and Jin Y. (2000) Regulation of presynaptic terminal organization by C. elegans RPM-1, a putative guanine nucleotide exchanger with a RING-H2 finger domain. Neuron 26,331-343.
Перечисленная выше литература полностью включена сюда в качестве ссылки.
Стандартная литература по лабораторным методам
Если не указано иначе, лабораторные методы выполняют или могут быть выполнены в соответствии со стандартными способами, перечисленными ниже в стандартной литературе:
Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual. Second edition. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY. 545 pp or Current Protocols in Molecular Biology.
Current Protocols in Molecular Biology; regularly updated, e.g. Volume 2000; John Wiley & Sons, Inc; Editors: Fred M. Ausubel, Roger Brent, Robert Eg. Kingston, David D. Moore, J.G. Seidman, John A. Smith, Kevin Struhl.
Current Protocols in Human Genetics; regularly updated, e.g. Volume 2003; John Wiley & Sons, Inc; Editors: Nicholas C. Dracopoli, Honathan L. Haines, Bruce R. Korf, Cynthia C. Morton, Christine E. Seidman, J.G. Seigman, Douglas R. Smith.
Current Protocols in Protein Science; regularly updated, e.g. Volume 2003; John Wiley & Sons, Inc; Editors: John E. Coligan, Ben M. Dunn, Hidde L. Ploegh, David W. Speicher, Paul T. Wingfield.
Molecular Biology of the Cell; third edition; Alberts, B., Bray, D., Lewis, J., Raff, M., Roberts, K., Watson, J.D.; Garland Publishing, Inc. New York & London, 1994.
Gene Targeting: a practical approach (1995), Editor: A.L. Joyner, IRL Press.
Genetic Manipulation of Receptor Expression and Function; D. Accili, Wiley-Liss., USA, 2000; ISBN: 0-471-35057-5.
Antisense Therapeutics, S. Agrawal, Humana Press, USA, 1996, ISBN: 0-89603-305-8.
Применяемые сокращения
AC - аденилатциклаза; Gsα - α-субъединица стимулирующего аденилатциклазу G-белка; Gsα* - постоянно активный мутант (Q213L) Gsα; Giα - α-субъединица ингибирующего G-белка Gi; Gβγ - βγ-субъединицы гетеротримерных G-белков; PAM - ассоциированный с Myc белок; RCC1 - регулятор конденсации хромосом; TED - 50 мМ Tris-HCl, pH 8,0, 1 мМ ЭДТА, 1 мМ DTT; ODN - олигодезоксинуклеотид; RT - комнатная температура.
Фигуры
Фигура 1: PAM высоко экспрессирован в нейронах спинного мозга. Гибридизация in situ с применением горизонтальных срезов спинного мозга, гибридизуемых со смысловыми или антисмысловыми зондами к крысиному PAM, как описано выше.
Фигура 2: PAM экспрессирован в нейронах DRG, а также в нейрональных клетках спинного мозга крысы.
Панель A: Иммуногистохимический анализ срезов спинного мозга крысы. Срезы окрашивали антителами к PAM (зеленые) и антителами к NeuN или GFAP (красные) для визуализации нейронов или глиальных клеток соответственно. Перекрывание обоих сигналов представлено на правых панелях. Объекты увеличены 20×.
Панель B: Иммуногистохимический анализ срезов DRG крысы. Срезы окрашивали антителами к PAM (зеленые) и антителами к Neu68, к гистонам или к GFAP (красные) для визуализации нейронов, ядер или глиальных клеток соответственно. Перекрывание обоих сигналов представлено на правых панелях. Объекты увеличены 40× за исключением окрашивания гистонов, которое увеличивали 63×.
Фигура 3: PAM дифференциально экспрессирован в DRG и спинном мозге в течение стадий развития. Для выявления PAM в РНК (40 нг) спинного мозга и DRG эмбрионов крыс на 16 сутки (E16), сутки после рождения 0,5 (P0,5), 3 (P3), 5 (P5), 9 (P9) и у взрослых крыс применяли количественную ОТ-ПЦР (Taqman™). Показано среднее ± SEM по меньшей мере 3 определений.
Фигура 4: у PAM повышена экспрессия в спинном мозге крыс после обработки зимозаном и формалином.
Панель A: анализ ОТ-ПЦР с РНК (40 нг) спинного мозга контрольных животных или обработанных зимозаном животных после 24 часов, 48 часов и 96 часов. На последней панели показано среднее ± SEM 7 экспериментов. T-тест Стьюдента: *p< 0,001.
Панель B: анализ "вестерн"-блот с применением 7% геля SDS-PAGE лизатов спинного мозга контрольных животных или обработанных зимозаном животных после 24 часов, 48 часов и 96 часов (40 мкг) с антителами к PAM и к ERK1/2.
Панель C: Анализ количественной ОТ-ПЦР с РНК (40 нг) спинного мозга контрольных животных или животных, обработанных в течение 1 часа формалином.
Фигура 5: PAM ингибирует стимулированную Gαs активность AC в лизатах спинного мозга.
Панель A: ОТ-ПЦР применяли для определения экспрессии РНК изоформ AC в спинном мозге и DRG (40 нг).
Панель B: Лизаты спинного мозга или DRG (10 мкг) анализировали на активность AC в присутствии 80 нМ Gαs, как описано в материалах и методах. Показано среднее ± SEM по меньшей мере 3 определений, проведенных в трех экземплярах.
Фигура 6: Интратекальное применение антисмысловых ODN к PAM увеличивает болевое поведение.
Панель A: Взрослым крысам интратекально вводили смысловые и антисмысловые ODN, как описано. После обработки формалином спинной мозг удаляли и подвергали иммуногистохимическому анализу с применением антител к PAM (зеленые) или к NeuN (красные).
Панель B: Формалиновый анализ животных, обработанных смысловыми и антисмысловыми ODN, как описано в разделе материалов. Показано общее количество подергиванием в течение 1 часа. Показано среднее ± SE, по меньшей мере, из 4 определений.
Панель C: Формалиновый анализ у животных, обработанных смысловыми и антисмысловыми ODN, как описано в разделе материалов. Показано количество подергиваний в течение 1 часа. Показано среднее ± SE, по меньшей мере, из 4 определений.
Фигура 7: Белковая, геномная и кодирующая нуклеотидные последовательности человеческого PAM согласно инвентарному номеру NCBI AAC39928 (белковая последовательность; SEQ ID NO:1), AF075587 (кодирующая последовательность; SEQ ID NO:2). Человеческий PAM расположен на хромосоме 13q22; его геномная последовательность общедоступна под NT_024524.11 (старт: положение 24679861; стоп: положение 24962245; SEQ ID NO:3);
На фигуре 7C показана непрерывная последовательность от положения 24679861 до положения 24962245.
Фигура 8: Кодирующая последовательность EST-клонов для крысиного PAM:
Фигура 8A: AW921303 (соответствует 960-1394 п.н. кДНК человека; SEQ ID NO:4)
Фигура 8B: AW918711 (соответствует 8188-8632 п.н. кДНК человека; SEQ ID NO:5)
Фигура 8C: BQ201485 (соответствует 8966-9633 п.н. кДНК человека; SEQ ID NO:6)
Фигура 8D: BE112881 (соответствует 10311-10830 п.н. кДНК человека; SEQ ID NO:7)
Фигура 8E: AW441131 (соответствует 13569-14152 п.н. кДНК человека; SEQ ID NO:8)
Фигура 8F: BF409872 (соответствует 13569-14807 п.н. кДНК человека). (SEQ ID NO:9).
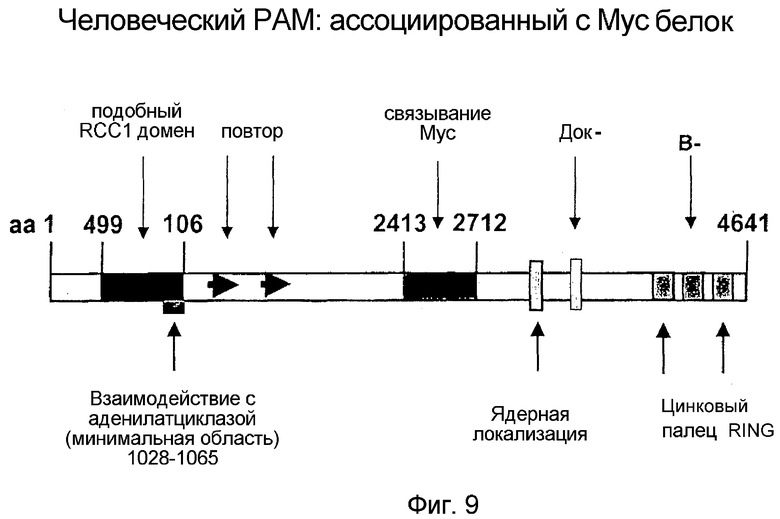
Фигура 9: Обзор доменной структуры человеческого PAM по Guo et al., 1988/Grossberger et al., JBC 1999 и Scholich et al., JBC 2001).
Фигура 10: Праймеры ПЦР для ОТ-ПЦР крысиного PAM.
Фигура 11: Антисмысловые олигодезоксинуклеотиды для ингибирования экспрессии крысиного PAM и контрольный олигонуклеотид.
Фигура 12: Различные полипептиды человеческого PAM для применения в контексте настоящего изобретения. Полипептиды представляют собой фрагменты, полученные из полипептида по SEQ ID NO:2.
Фигура 13: Различные полинуклеотиды человеческого PAM для применения в контексте настоящего изобретения.
Фигура 13A: последовательность кДНК, кодирующая фрагмент белка, соответствующий SEQ ID NO:17, содержащая нуклеотидные положения кДНК человеческого PAM с 1317 по 4366 (SEQ ID NO:24).
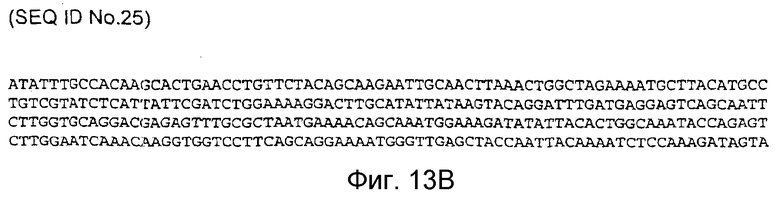
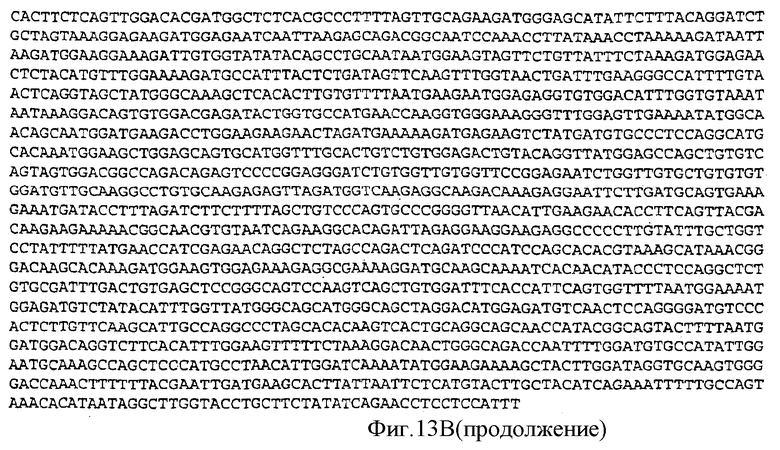
Фигура 13B: последовательность кДНК, кодирующая фрагмент белка, соответствующий SEQ ID NO:18, содержащая нуклеотидные положения кДНК человеческого PAM с 1482 по 3332 (SEQ ID NO:25).
Фигура 13C: последовательность кДНК, кодирующая фрагмент белка, соответствующий SEQ ID NO:19, содержащая нуклеотидные положения кДНК человеческого PAM с 1641 по 3341 (SEQ ID NO:26).
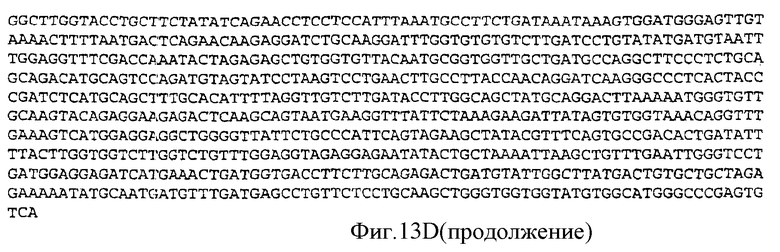
Фигура 13D: последовательность кДНК, кодирующая фрагмент белка, соответствующий SEQ ID NO:20, содержащая нуклеотидные положения кДНК человеческого PAM с 3142 по 4046 (SEQ ID NO:27).
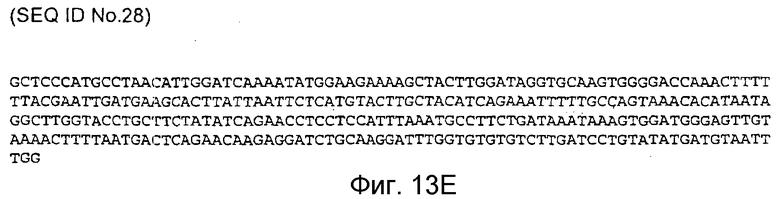
Фигура 13E: последовательность кДНК, кодирующая фрагмент белка, соответствующий SEQ ID NO:21, содержащая нуклеотидные положения кДНК человеческого PAM с 3142 по 3446 (SEQ ID NO:28).
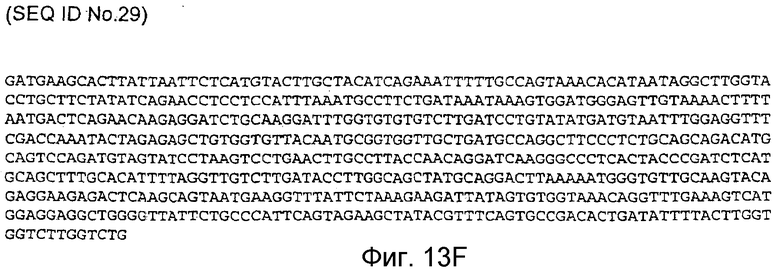
Фигура 13F: последовательность кДНК, кодирующая фрагмент белка, соответствующий SEQ ID NO:22, содержащая нуклеотидные положения кДНК человеческого PAM с 3228 по 3839 (SEQ ID NO:29).
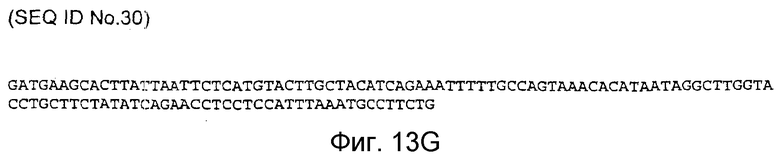
Фигура 13G: последовательность кДНК, кодирующая фрагмент белка, соответствующий SEQ ID NO:23, содержащая нуклеотидные положения кДНК человеческого PAM с 3228 по 3341 (SEQ ID NO:30).
Фигура 14: Обзор постулируемого пути передачи сигнала PAM в нейронах спинного мозга и DRG по указанным выше открытиям.
Таблица 1
Базальная активность AC в лизатах спинного мозга у обработанных антисмысловыми олигонуклеотидами крыс повышена. Лизаты спинного мозга (20 мкг) анализировали на их активность AC в присутствии или в отсутствие 80 нМ Gαs или 100 мкМ форсколина, как описано выше. Показана средняя активность AC ± SEM лизатов спинного мозга, по меньшей мере, из трех крыс на группу, каждая измерена дважды в трех экземплярах (ns = не значимо).
(пмоль/мин/кг)



























































































































































































| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ S1P | 2004 |
|
RU2362565C2 |
| ОЧИЩЕННЫЙ ИММУНОГЕННЫЙ БЕЛОК, ЕГО ФРАГМЕНТЫ И ПРОИЗВОДНЫЕ | 1999 |
|
RU2304585C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПОЛИКЛОНАЛЬНЫХ АНТИТЕЛ, АНТИСЫВОРОТКА, СОДЕРЖАЩАЯ ПОЛИКЛОНАЛЬНЫЕ АНТИТЕЛА, И СПОСОБЫ ИММУНИЗАЦИИ | 1999 |
|
RU2358982C2 |
| ВАРИАНТЫ ЭРИТРОПОЭТИНА | 2006 |
|
RU2430162C2 |
| ПОЛИНУКЛЕОТИД, МОДУЛИРУЮЩИЙ ПРОЛИФЕРАЦИЮ РАКОВЫХ КЛЕТОК (ВАРИАНТЫ), ПОЛИПЕПТИД, МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА-ХОЗЯИН, ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ПРОЛИФЕРАТИВНОГО ЗАБОЛЕВАНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРИМЕНЕНИЕ ПОЛИПЕПТИДА ДЛЯ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2002 |
|
RU2307666C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ТЕРАПИИ И ДИАГНОСТИКИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2001 |
|
RU2344831C2 |
| ЛИГАНД GITR И СВЯЗАННЫЕ С ЛИГАНДОМ GITR МОЛЕКУЛЫ И АНТИТЕЛА И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2369636C2 |
| ПРИМЕНЕНИЕ КАТЕПСИНА Н | 2010 |
|
RU2574005C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ И ДИАГНОСТИКИ РАКА ЛЕГКИХ | 2001 |
|
RU2311920C2 |
| ПОЛИПЕПТИД, ИМЕЮЩИЙ ФЕРМЕНТАТИВНУЮ АКТИВНОСТЬ ФОСФОДИЭСТЕРАЗЫ | 1998 |
|
RU2272841C2 |
















































































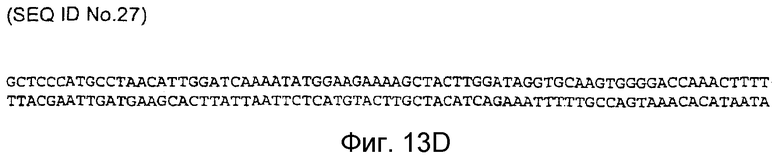
Изобретение относится к области медицины и касается применение РАМ, или его функциональных фрагментов, или производных для получения фармацевтических соединений для лечения боли. Сущность изобретения включает полипептид человека или его функциональный фрагмент, содержащий последовательность SEQ ID NO:2 или кодируемый полинуклеотидом, содержащим последовательность, соответствующую SEQ ID NO:1. Изобретение также включает способы уменьшения боли и скрининга соединений, которое может использоваться для модуляции или профилактики боли. Преимущество изобретения заключается в расширении области применения. 7 н. и 23 з. п. ф-лы, 14 ил., 1 табл.
а. получения первого образца, содержащего РАМ;
b. получение второго образца, содержащего РАМ и указанное соединение;
с. определение активности РАМ в указанном первом и указанном втором образце; и
d. сравнение активности РАМ в указанном первом образце, не содержащем указанное соединение, с указанным вторым образцом, содержащим указанное соединение.
а. выбор соединения, модулирующего активность РАМ, в качестве тестового соединения; и
b. введение указанного тестируемого соединения субъектам для определения того, может ли оно модулировать боль,
где РАМ представляет собой полипептид человека или его функциональный фрагмент, содержащий последовательность, соответствующую SEQ ID NO:2.
| IWAKIRI R., et al., A case of malignant lymphoma concomitant with multiple myeloma, Nippon Ronen Igakkai Zasshi, 2001, Sep; 38(5), 678-81 GALEOTTI N et al., Hypofunctionality ofGl proteins as aetiopathogenetic mechanism for migraine and cluster headache, Cephalalgia, 2001, Feb; 21(1), 38-45 ALEY КО | |||
| et al., Nitric oxide signaling and pain |
Авторы
Даты
2009-02-10—Публикация
2004-04-29—Подача