Данное изобретение относится к химерным полипептидам, где указанные полипептиды содержат модифицированный связывающий домен гормона роста, сцепленный с рецепторным связывающим доменом рецептора гормона роста, а также к тандемам/олигомерам указанных модифицированных связывающих доменов гормона роста.
Гормон роста (GH) является членом большого семейства гормонов, вовлеченных в регуляцию роста и развития млекопитающих. Человеческий GH представляет собой полипептид массой 22 кДа, который вовлечен в ряд биологических процессов, например клеточный рост, лактацию, активацию макрофагов и регуляцию энергетического обмена. GH последовательно взаимодействует с двумя мембранно-связанными рецепторами гормона роста (GHR) посредством двух отдельных сайтов на GH, называемых сайт 1 и сайт 2. Сайт 1 представляет собой сайт связывания с высоким сродством, а сайт 2 представляет собой сайт с низким сродством. Одна молекула GH связывает 1 GHR посредством сайта 1. Затем привлекается второй GHR посредством сайта 2 с образованием комплекса GHR:GH:GHR. Затем этот комплекс интернализуется и активирует каскад преобразования сигнала, приводя к изменению экспрессии генов.
Внеклеточный домен GHR существует в виде двух сцепленных доменов, каждый из которых имеет длину примерно 100 аминокислот (SD-100), причем С-концевой домен SD-100 (b) является ближайшим к клеточной поверхности, a N-концевой домен SD-100 (а) является наиболее отдаленным. Именно при связывании гормона с образованием тримерного комплекса GHR-GH-GHR происходит конформационное изменение этих двух доменов.
Модифицированные GH раскрыты в US 5849535, который включен путем ссылки. Модификация GH находится в обоих сайтах связывания, как в сайте 1, так и в сайте 2. Модификации сайта 1 продуцируют молекулу GH, которая обладает большим сродством к GHR по сравнению с GH дикого типа. Эти модифицированные молекулы GH действуют как агонисты. Существует также описание модификаций сайта 2, которые приводят в результате к созданию антагонистов GH. Дополнительные примеры модификаций GH, которые изменяют сродство к связыванию GH для сайта 1, раскрыты в US 5854026, US 6004931, US 6022711, US 6057292 и US 6136563, каждый из которых включен путем ссылки. Краткое описание модификаций сайта 1 представлено в таблице 1. Модификации сайта 2 также раскрыты,' в частности аминокислотный остаток G120, который при модификации на аргинин, лизин, триптофан, тирозин, фенилаланин или глутаминовую кислоту образует молекулу GH с антагонистическими свойствами.
Кроме того, модифицированный GH покрывают полиэтиленгликолем (ПЭГ) способом, известным как «пэгилирование», который обладает несколькими благоприятными эффектами. Во-первых, оболочка из ПЭГ увеличивает эффективную молекулярную массу GH с 22 кДа примерно до 40 кДа. Эффектом этого является снижение клубочковой фильтрации GH, посредством чего увеличивается период полувыведения GH in vivo, что уменьшает дозу, вводимую для получения желаемого эффекта. Кроме того, считают, что пэгилирование снижает как иммуногенность, так и токсичность белков, которые обработаны таким образом, см. Abuchowski et al J Biol Chem., 252,3578-3581 (1977).
Однако следствием пэгилирования является снижение сродства модифицированной молекулы GH к GHR. Это означает, что в противовес сниженному сродству необходима повышенная доза. Это нежелательно, поскольку противоречит благоприятному эффекту пэгилирования в отношении увеличения периода полувыведения модифицированного GH. Было бы желательно разработать модифицированную молекулу GH, которая не требует пэгилирования, но имеет увеличенный период полувыведения, а также обладает дополнительными преимуществами пониженной иммуногенности и отсутствия токсичности.
Согласно первому аспекту данного изобретения предложен химерный полипептид, содержащий:
(1) по меньшей мере один модифицированный связывающий домен гормона роста, где указанная модификация представляет собой добавление, делецию или замену по меньшей мере одного аминокислотного остатка, и
(2) связывающий гормон роста домен рецептора гормона роста.
В предпочтительном воплощении данного изобретения указанный полипептид модифицирован в сайте 1 связывающего домена гормона роста.
В следующем предпочтительном воплощении данного изобретения указанный полипептид модифицирован в сайте 2 связывающего домена гормона роста.
Еще в одном следующем предпочтительном воплощении данного изобретения указанный полипептид модифицирован как в сайте 1, так и в сайте 2 гормона роста.
Как описано выше, в данной области техники известны мутации сайта 1, которые увеличивают сродство гормона роста к его связывающему домену на рецепторе гормона роста. Такой модифицированный гормон роста действует как агонист. Если модификация сайта 1 комбинирована с модификацией сайта 2, где результатом последней модификации является неактивный или частично активный сайт связывания 2, тогда такая молекула является антагонистом. Модификация только сайта 2, которая использует сайт связывания 1 дикого типа, также создает антагонист.
В следующем предпочтительном воплощении данного изобретения предложен полипептид, содержащий связывающий домен сайта 1, который модифицирован путем аминокислотной замены, где указанная модификация выбрана из группы, состоящей из: замены гистидина 18 аланином или аспарагиновой кислотой, и/или гистидина 21 аспарагином, и/или глутамина 22 аланином, и/или фенилаланина 25 аланином, и/или аспарагиновой кислоты 26 аланином, и/или глутамина 29 аланином, и/или глутаминовой кислоты 167 аланином, и/или аспарагиновой кислоты 171 серином, и/или лизина 172 серином или аланином, и/или изолейцина 179 тирозином, последовательности, представленной на фиг.12.
Предпочтительно указанная модификация для увеличения сродства сайта 1 к его связывающему домену в GHR состоит из аминокислотных замен:
гистидина 18 аспарагиновой кислотой, гистидина 21 аспарагином, аргинина 167 аспарагином, аспарагиновой кислоты 171 аргинином, глутаминовой кислоты 174 серином и изолейцина 179 треонином, как представлено аминокислотной последовательностью GH на фиг.12.
В следующем предпочтительном воплощении данного изобретения указанная модификация для увеличения сродства сайта 1 к его связывающему домену в GHR состоит из аминокислотных замен: гистидина 18 аланином, глутамина 22 аланином, фенилаланина 25 аланином, аспарагиновой кислоты 26 аланином, глутамина 29 аланином, глутаминовой кислоты 65 аланином, лизина 168 аланином и глутаминовой кислоты 174 аланином, как представлено аминокислотной последовательностью GH на фиг.12.
В следующем предпочтительном воплощении данного изобретения указанная модификация сайта 2 находится в аминокислотном остатке 120 последовательности, представленной на фиг.12. Предпочтительно указанную модификацию сайта 2 комбинируют с модификациями сайта 1, как раскрыто здесь. Альтернативно GH модифицируют только по аминокислотному остатку глицин 120.
В предпочтительном воплощении данного изобретения указанная модификация сайта 2 представляет собой замену глицина на аминокислоту, выбранную из группы, состоящей из аргинина, аланина, лизина, триптофана, тирозина, фенилаланина и глутаминовой кислоты. Предпочтительно указанная замена представляет собой замену глицина 120 на аргинин, либо на лизин, либо на аланин.
В следующем предпочтительном воплощении данного изобретения связывающий гормон роста домен GHR представляет собой внеклеточный домен GHR. Более предпочтительно этот связывающий домен представляет собой С-концевой SD-100 домен для GH.
Альтернативно указанный связывающий домен представляет собой полноразмерный GHR.
В предпочтительном воплощении данного изобретения указанный химерный полипептид представляет собой слитый белок, где модифицированный GH представляет собой трансляционное слияние с GHR с сохранением рамки считывания, или его часть. Предпочтительно указанный слитый полипептид содержит модифицированный GH и С-концевой SD-100 домен GHR.
В альтернативном следующем предпочтительном воплощении данного изобретения модифицированный связывающий домен GH сцеплен посредством линкера со связывающим GH доменом GHR. Этот линкер может быть гибким.
Линкер может находиться при любом остатке в пределах внеклеточного домена рецептора, который может дать возможность гибкой связи модифицированного GH со свободным рецептором на клеточной поверхности. Предпочтительно эту связь образуют между остатком, близким к С-концу модифицированной молекулы GH,- и остатком, близким к N-концу GHR. Более предпочтительно эту связь образуют между остатком, близким к С-концу модифицированной молекулы GH, и остатком, близким к М-концу N-конца С-концевого SD-100. Более предпочтительно эту связь образуют по любому из остатков 126-128 N-конца С-концевого SD-100 GHR. В одном воплощении данного изобретения эту связь образуют по остатку 127 М-конца С-концевого SD-100. Предпочтительно линкер представляет собой пептид.
Кристаллическая структура комплекса GHR:GH:GHR выявила, что расстояние между С-концом GH (остаток 191) и М-концом С-концевого SD-100 (остаток 126-128) составляет 10. Эти данные предоставляют неоценимую информацию в отношении конструкции линкера.
Предпочтительно линкер представляет собой полипептид, который содержит от 5 до 30 аминокислотных остатков. Более предпочтительно линкер содержит от 10 до 20 аминокислотных остатков. Еще более предпочтительно линкер содержит по меньшей мере одну копию пептида:
Gly Gly Gly Gly Ser (далее называемый "Gly4Ser").
В одном воплощении данного изобретения длина линкера составляет 10 аминокислот и он содержит две копии линкера Gly4Ser. В альтернативном воплощении данного изобретения длина линкера составляет 15 аминокислот и он содержит три копии линкера Gly4Ser. Еще в одном альтернативном воплощении длина линкера составляет 20 аминокислот и он содержит четыре копии линкера Gly4Ser.
В предпочтительном воплощении данного изобретения указанный полипептид имеет происхождение от человеческого GH и человеческого GHR.
Согласно следующему аспекту данного изобретения предложена молекула нуклеиновой кислоты, которая кодирует полипептид по данному изобретению, выбранная из группы, состоящей из:
1) молекулы нуклеиновой кислоты, как представлено последовательностью нуклеиновой кислоты на фиг.13, и
2) молекулы нуклеиновой кислоты, которая гибридизуется с последовательностью нуклеиновой кислоты в (1).
Молекулы нуклеиновой кислоты, которые кодируют модифицированный гормон роста по данному изобретению, типично могут быть синтезированы с помощью молекулярных методик, известных в данной области техники и включающих в себя рекомбинантные методы, а также синтез молекул нуклеиновых кислот с использованием синтезаторов олигонуклеотидов.
В предпочтительном воплощении данного изобретения указанная молекула нуклеиновой кислоты гибридизуется в строгих условиях гибридизации.
Термин «строгие условия гибридизации», как его используют здесь, относится к параметрам, которые известны в данной области техники. Параметры гибридизации нуклеиновых кислот можно найти в ссылках, в которых компилированы такие методы, например Molecular Cloning: A Laboratory Manual, J. Sambrook et al., eds., Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989, или Current Protocols in Molecular Biology, F.M.Ausubel et al., eds., John Wiley & Sons, Inc., New York. Более конкретно строгие условия, как их используют здесь, относятся, например, к гибридизации при 65°С в буфере для гибридизации (3,5 × SSC, 0,02% Ficoll, 0,02% поливинилпирролидон, 0,02% бычий сывороточный альбумин, 2,5 мМ NaH2PO4 (рН 7), 0,5% ДСН, 2 мМ ЭДТА). SSC представляет собой 0,15 М хлорид натрия/0,015 M цитрат натрия, рН 7, ДСН представляет собой додецилсульфат натрия и ЭДТА представляет собой этилендиаминтетрауксусную кислоту. После гибридизации мембрану, на которую переносят ДНК, отмывают в 2 × SSC при комнатной температуре, а затем в 0,1-0,5 × SSC/0,1 × ДСН при температурах вплоть до 68°С.
Согласно следующему аспекту данного изобретения предложен вектор, содержащий молекулу нуклеиновой кислоты по данному изобретению.
В предпочтительном воплощении данного изобретения указанный вектор представляет собой экспрессирующий вектор, адаптированный для экспрессии рекомбинантного гена.
Типично указанная адаптация включает в себя, для примера и не для ограничения, обеспечение последовательностей регуляции транскрипции (промоторных последовательностей), которые опосредуют клетка/тканеспецифичную экспрессию. Эти промоторные последовательности могут быть клетка/тканеспецифичными, индуцибельными или конститутивными.
Промотор является общепризнанным термином в данной области техники и, в целях ясности включает в себя следующие признаки, которые предложены только для примера и не для ограничения. Энхансерные элементы представляют собой цис-активные последовательности нуклеиновых кислот, часто находящиеся в 5'-положении по отношению к сайту инициации транскрипции гена (энхансеры могут также находиться в 3'-положении по отношению к последовательности гена или даже располагаться в интронных последовательностях и, следовательно, являются независимыми от положения). Энхансеры действуют, увеличивая скорость транскрипции гена, с которым этот энхансер сцеплен. Энхансерная активность реагирует на транс-активный фактор транскрипции, который, как показано, специфично связывается с энхансерными элементами. Связывание/активность факторов транскрипции (см. Eukaryotic Transcription Factors, by David S Latchman, Academic Press Ltd, San Diego) реагируют на ряд окружающих сигналов, которые включают в себя, для примера и не для ограничения, промежуточные метаболиты и/или окружающие эффекторы.
Промоторные элементы также включают в себя так называемый ТАТА бокс и последовательности выбора инициации РНК-полимеразы (RIS), функция которых состоит в выборе сайта инициации транскрипции. Эти последовательности также связывают полипептиды, функция которых заключается, среди прочего, в облегчении выбора инициации транскрипции РНК-полимеразой.
Адаптации также включают в себя обеспечение селективных маркеров и последовательностей автономной репликации, причем и те, и другие способствуют сохранению указанного вектора либо в эукариотической клетке, либо в прокариотическом хозяине. Векторы, которые сохраняются автономно, называют эписомными векторами. Эписомные векторы являются желательными, поскольку эти молекулы могут включать в себя большие фрагменты ДНК (30-50 тысяч пар оснований (т.п.о.) ДНК). Эписомные векторы этого типа описаны в WO 98/07876, которая включена путем ссылки.
Адаптации, которые способствуют экспрессии кодируемых вектором генов, включают в себя обеспечение последовательностей терминации транскрипции/полиаденилирования. Эти адаптации также включают в себя обеспечение внутренних сайтов посадки рибосом (IRES, internal ribosome entry sites), функция которых заключается в максимизации экспрессии кодируемых вектором генов, организованных в бицистронные или мультицистронные экспрессионные кассеты.
Эти адаптации хорошо известны в данной области техники. Существует значительное количество опубликованной литературы в отношении конструирования экспрессирующих векторов и методик рекомбинантных ДНК в целом. См. Sambrook et al (1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory, Cold Spring Harbour, NY, и приведенные там ссылки; Marston, F (1987) DNA Cloning Techniques: A Practical Approach Vol III IRL Press, Oxford UK; DNA Cloning: F.M.Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994).
Согласно следующему аспекту данного изобретения предложено применение полипептида по данному изобретению в качестве фармацевтического препарата. В предпочтительном воплощении изобретения указанный полипептид предназначен для применения в производстве лекарства для лечения состояния, выбранного из группы, состоящей из гигантизма, акромегалии, рака (например, опухоли Вильмса, остеогенной саркомы, рака молочной железы, толстой кишки, простаты, щитовидной железы), диабетической ретинопатии, диабетической нефропатии и других осложнений диабета и избытка GH.
Полипептиды и композиции по изобретению можно вводить любым общепринятым путем, включая инъекцию или постепенную инфузию в течение периода времени. Введение может быть, например, пероральным, внутривенным, внутрибрюшинным, внутримышечным, внутриполостным, внутриглазным, подкожным или чрескожным. Фармацевтические композиции могут быть для удобства представлены в стандартной лекарственной форме и их можно приготовить любым из способов, хорошо известных в области фармацевтики.
При введении фармацевтические препараты по изобретению применяют в фармацевтически приемлемых количествах и в фармацевтически приемлемых композициях. Термин «фармацевтически приемлемый» означает нетоксичное вещество, которое не влияет на эффективность биологической активности активных ингредиентов. Такие препараты могут, как правило, содержать соли, забуферивающие агенты, консерванты, совместимые носители и, возможно, другие терапевтические агенты.
Композиции можно комбинировать, если желательно, с фармацевтически приемлемым носителем. Термин «фармацевтически приемлемый носитель» означает один или более чем один совместимый твердый или жидкий наполнитель, разбавитель или инкапсулирующее вещество, которые пригодны для введения человеку. Термин «носитель» обозначает органический или неорганический ингредиент, природный или синтетический, с которым комбинируют активный ингредиент для облегчения применения. Фармацевтические композиции могут содержать подходящие забуферивающие агенты, включая уксусную кислоту в виде соли, лимонную кислоту в виде соли, борную кислоту в виде соли и фосфорную кислоту в виде соли. Фармацевтические композиции также могут содержать, возможно, подходящие консерванты, такие как хлорид бензалкония, хлорбутанол, парабены и тимеросал.
Согласно еще одному аспекту данного изобретения предложена клетка, трансформированная или трансфицированная нуклеиновой кислотой или вектором по изобретению.
В предпочтительном воплощении изобретения указанная клетка представляет собой эукариотическую клетку. Предпочтительно указанная клетка выбрана из группы, состоящей из миксомицета (например, Dictyostelium spp), дрожжевой клетки (например, Saccharomyces cerevisiae, Pichia spp), клетки млекопитающего (например, яичника китайского хомячка), растительной клетки, клетки насекомого (например, Spodoptera spp).
В предпочтительном альтернативном воплощении указанная клетка представляет собой прокариотическую клетку, предпочтительно Escherichia coli или Bacillus spp.
Согласно следующему аспекту данного изобретения предложен способ производства полипептида по изобретению, при котором
1) берут клетку по изобретению,
2) инкубируют указанную клетку в условиях, приводящих к продуцированию полипептида по изобретению, и, возможно,
3) выделяют полипептид из клетки или культуральной среды клетки.
При предпочтительном способе по изобретению указанный полипептид обеспечивают сигналом секреции, чтобы облегчить очистку этого полипептида от указанной клетки. Еще более предпочтительно указанный полипептид обеспечивают меткой сродства, чтобы облегчить очистку этого полипептида от указанной клетки или культуральной среды клетки.
Согласно еще одному аспекту данного изобретения предложен способ лечения млекопитающего, предпочтительно человека, при котором указанному млекопитающему вводят полипептид по изобретению.
Согласно следующему аспекту данного изобретения предложен химерный полипептид, содержащий более чем два модифицированных связывающих домена гормона роста, где указанная модификация представляет собой добавление, делецию или замену по меньшей мере одного аминокислотного остатка.
В предпочтительном воплощении изобретения предложен химерный полипептид, содержащий множество модифицированных связывающих доменов гормона роста.
В следующем предпочтительном воплощении изобретения предложен химерный полипептид, содержащий по меньшей мере два модифицированных связывающие домена сайта 2 гормона роста.
В следующем предпочтительном воплощении изобретения предложен химерный полипептид, содержащий 3, 4, 5, 6, 7, 8, 9, 10 модифицированных связывающих доменов сайта 2 гормона роста.
Еще в одном предпочтительном воплощении изобретения указанный химерный полипептид содержит более двух модифицированных связывающих доменов гормона роста, сцепленных вместе посредством линкерной молекулы. Предпочтительно указанная линкерная молекула является такой, как описано выше.
Согласно еще одному аспекту изобретения указанный химерный полипептид, содержащий более двух модифицированных связывающих доменов гормона роста, дополнительно содержит по меньшей мере один связывающий гормон роста домен рецептора гормона роста.
Предпочтительно указанный химерный полипептид состоит из двух модифицированных связывающих доменов гормона роста и одного связывающего гормон роста домена рецептора гормона роста.
Предпочтительно указанный химерный полипептид состоит по меньшей мере из двух модифицированных связывающих доменов сайта 2 гормона роста.
Аспекты и воплощения, которые относятся к химерному полипептиду, содержащему связывающий домен гормона роста, сцепленный с рецепторным связывающим доменом, применимы к химерным полипептидам, содержащим более чем один связывающий домен или множество связывающих доменов гормона роста. Например, все векторы, содержащие нуклеиновые кислоты, кодирующие указанные химерные полипептиды, все фармацевтические композиции, содержащие указанные полипептиды, все клеточные линии, экспрессирующие указанные химерные полипептиды, все способы производства указанных полипептидов и все способы лечения, использующие указанные полипептиды, входят в объем данного изобретения в отношении данного вида химерного полипептида.
Далее воплощение изобретения будет описано только для примера и со ссылкой на приведенные ниже таблицу и графические материалы.
В таблице 1 представлено краткое изложение аминокислотных замен в сайте 1 и сайте 2 человеческого GH.
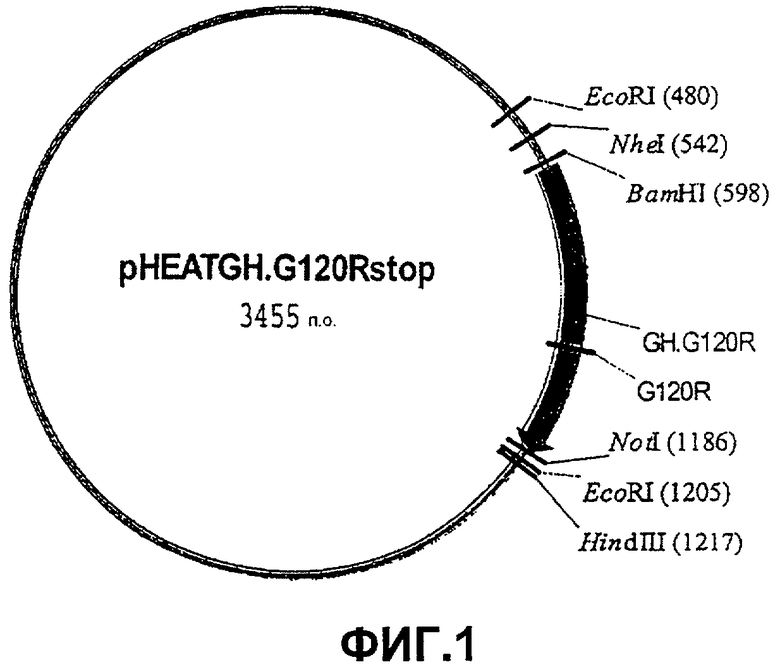
Фиг.1. Карта плазмиды pHEAT.GH.G120R, которая была сконструирована путем лигирования гена GH.G120R, синтезированного с помощью полимеразной цепной реакции (ПЦР), между сайтами рестрикции BamHI и NotI. Селективным маркером на этой плазмиде является AmpR.
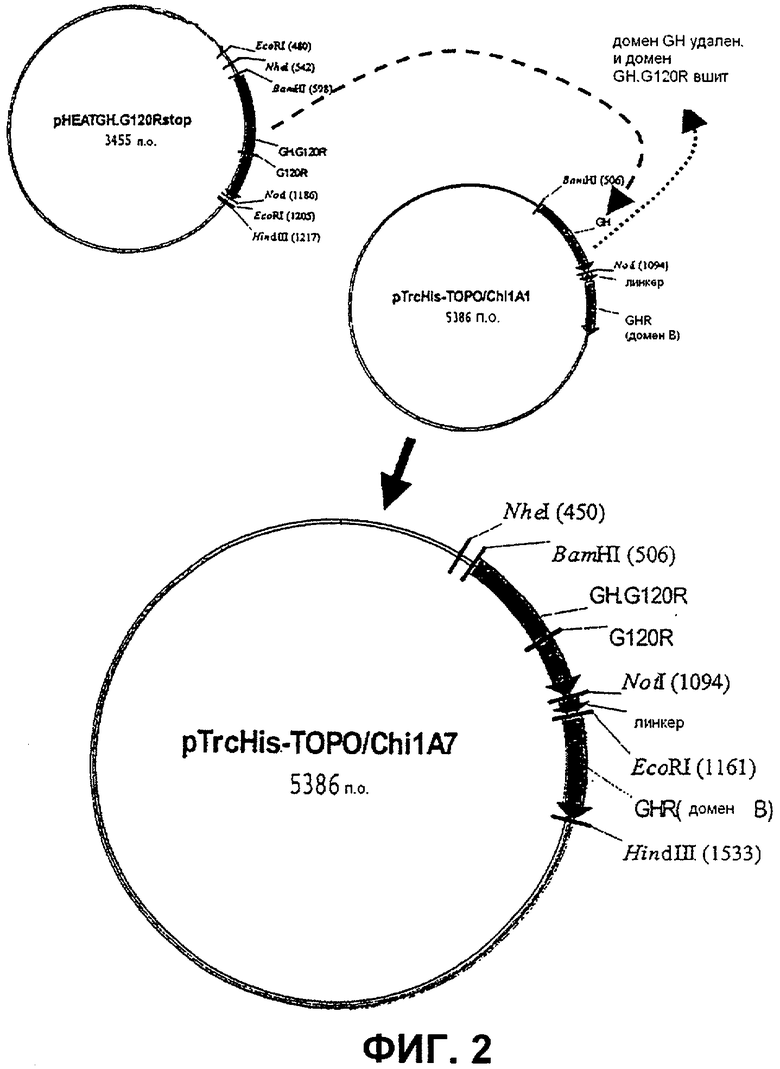
Фиг.2. Карта плазмиды pTrcHis-TOPO. 1A7, которая была сконструирована путем лигирования гена GH.G120R между сайтами BamHI и NotI в pTrcHis 1A1. Линкер представляет собой (643)4 и селективным маркером на этой плазмиде является AmpR.
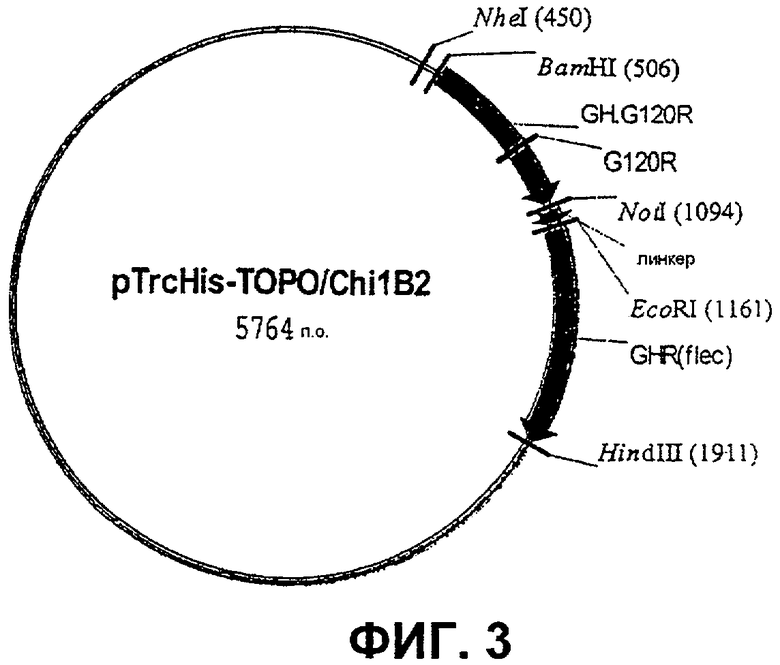
Фиг.3. Карта плазмиды pTrcHis-TOPO. 1B2, которая была сконструирована путем лигирования гена GH.G120R между сайтами BamHI и Nott в pTrcHis 1B1. Линкер представляет собой (G4S)4 и селективным маркером на этой плазмиде является AmpR.
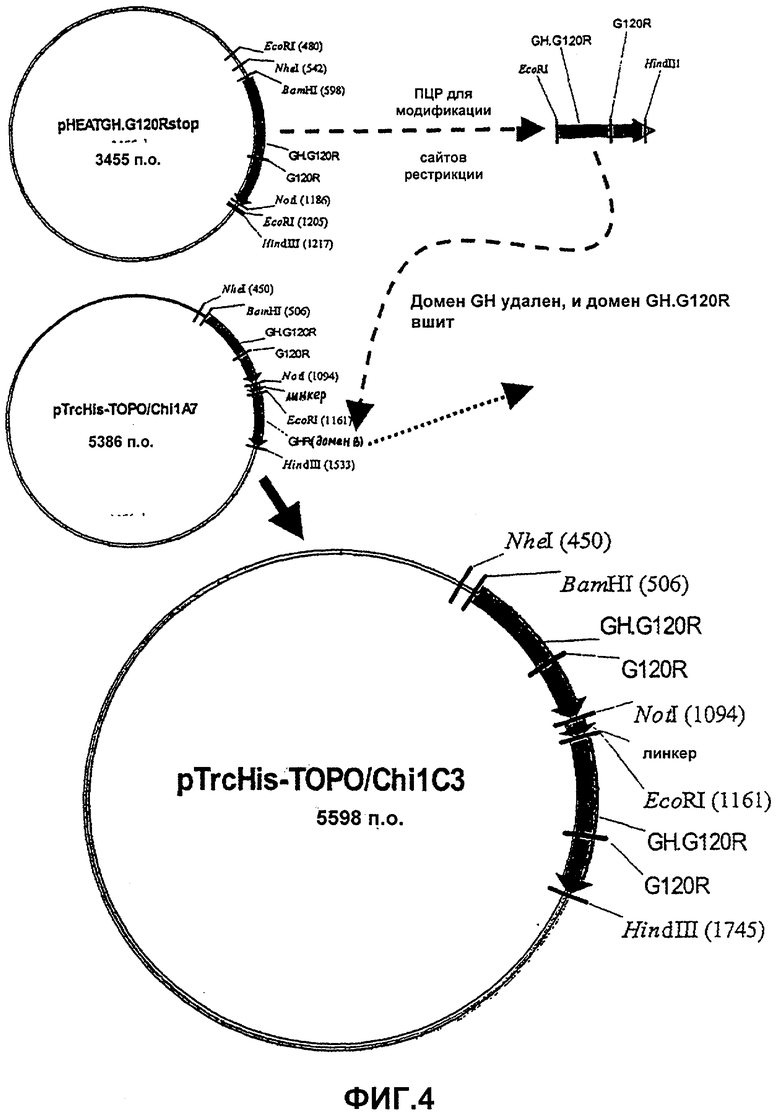
Фиг.4. Карта плазмиды pTrcHis-TOPO. 1C3, которая была сконструирована путем лигирования гена GH.G120R между сайтами EcoRI и HindIII в pTrcHis 1A7. Линкер представляет собой (G4S)4 и селективным маркером на этой плазмиде является AmpR.
Фиг.5. Последовательность гена GH.G120R, на которой показан стартовый кодон, метка 6xHis, релевантные сайты рестрикции, стоп-кодоны и мутация G120R (CGC). Актуальный компонент GH.G120R показан заглавными буквами и секвенированные районы показаны жирным шрифтом.
Фиг.6. Последовательность гена 1A7, на которой показан стартовый кодон, метка 6xHis, релевантные сайты рестрикции, стоп-кодоны и мутация G120R (CGC). Актуальный компонент GH.G120R-(G4S)4-GHR(b) показан заглавными буквами и секвенированные районы показаны жирным шрифтом.
Фиг.7. Последовательность гена 1B2, на которой показан стартовый кодон, метка 6xHis, релевантные сайты рестрикции, стоп-кодоны и мутация G120R (CGC). Актуальный компонент GH.G120R-(G4S)4-GHR(flec) показан заглавными буквами и секвенированные районы показаны жирным шрифтом.
Фиг.8. Последовательность гена 1C3, на которой показан стартовый кодон, метка 6xHis, релевантные сайты рестрикции, стоп-кодоны и мутация G120R (CGC). Актуальный компонент GH.G120R-(G4S)4-GH.G120R показан заглавными буквами и секвенированные районы показаны жирным шрифтом.
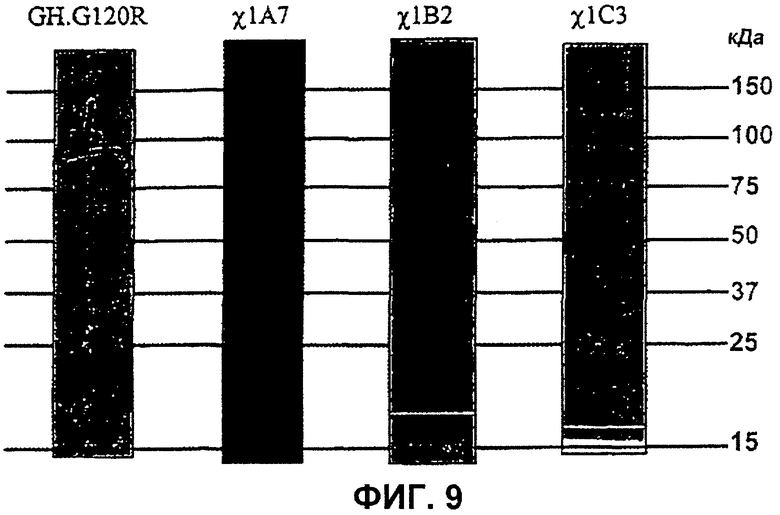
Фиг.9. Вестерн-блоты 15% гелей ДСН-ПААГ (ПААГ - электрофорез в полиакриламидном геле) с использованием антитела против человеческого GH в качестве первого антитела для исследования экспрессии GH.G120R, 1A7, 1B2 и 1C3. Экспрессию осуществляли с вектора pTrcHis в клетках Е. coli XL1 Blue или Е. coli SURE, эти образцы брали через 4 часа после индукции 1 мМ (конечная концентрация) изопропилтиогалактозидом (ИПТГ). Эти блоты показывают, что GH.G120R и 1С3 продуцируют единственную полосу, тогда как образцы 1А7 и 1 В2 содержат расщепленные продукты.
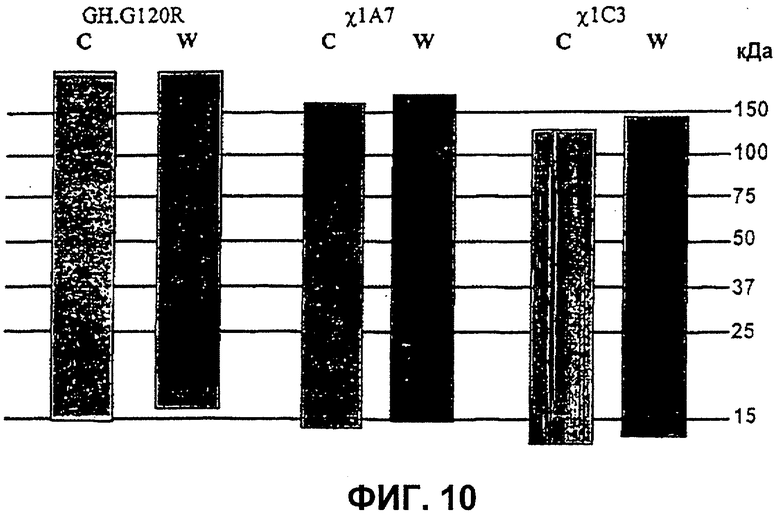
Фиг.10. Окрашенные кумасси [С] 15% гели ДСН-ПААГ очищенных GH.G120R, 1А7 и 1С3. Также показаны вестерн-блоты [W] этих образцов с использованием антитела против человеческого GH в качестве первого антитела. Гели, окрашенные кумасси, показывают, что чистота очищенных образцов белка составляет >95%, однако вестерн-блоты показывают, что только GH.G120R и 1С3 продуцируют единственную полосу, тогда как образец 1А7 содержит расщепленные продукты.
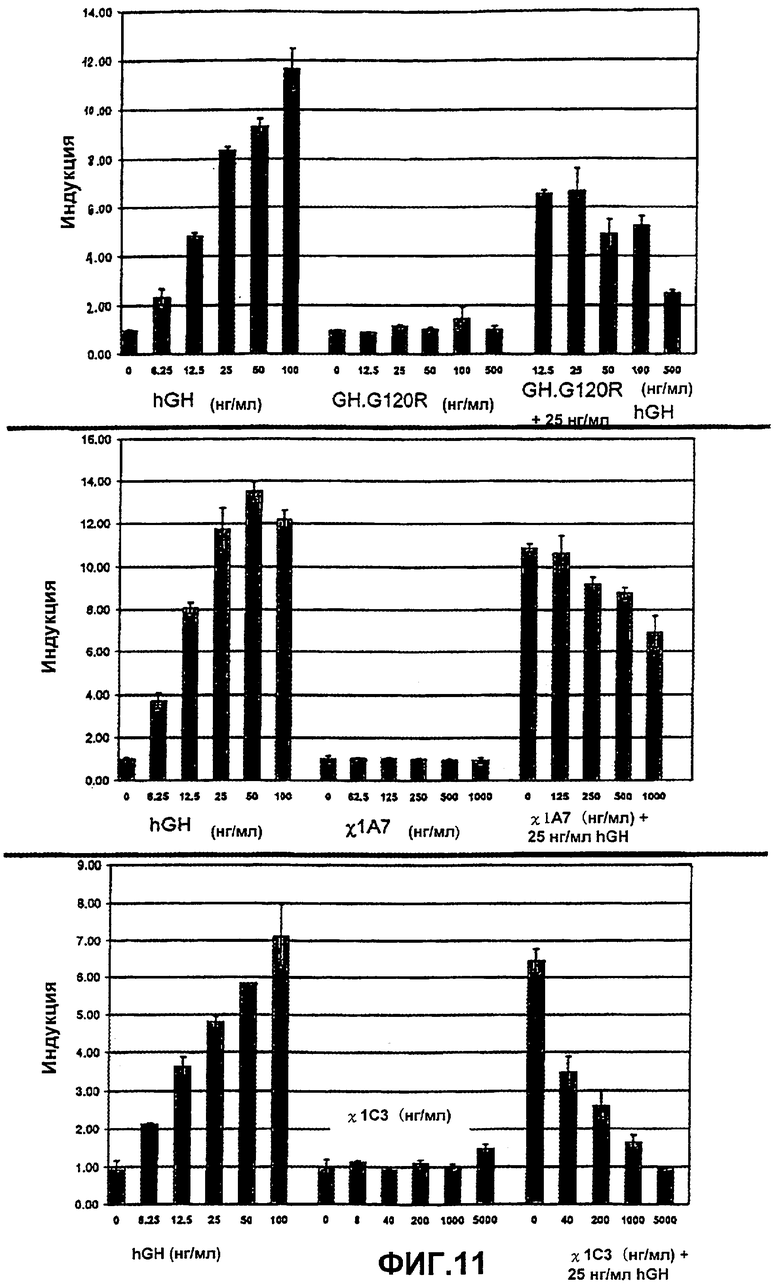
Фиг.11. Графики, показывающие результаты биоанализа GH из GH.G120R, 1А7 и 1С3. На каждом графике показана калибровочная кривая, анализ только с конструкцией при различных концентрациях и анализ с конструкцией при различных концентрациях с 25 нг/мл hGH. Эти графики показывают, что ни один из белков не обладает свойственной агонистической активностью, но все они обладают антагонистической активностью, причем GH.G120R является наиболее активным, а 1А7 является наименее активным.
На фиг.12 представлена аминокислотная последовательность немодифицированного GH.
На фиг.13 представлена последовательность нуклеиновой кислоты немодифицированного GH.
Материалы и методы
Способы конструирования GH, модифицированного в сайте 1 и/или сайте 2, раскрыты в US 5849535, US 5854026, US 6004931, US 6022711, US 6057292 и US 6136563, каждый из которых включен путем ссылки.
Конструкции ДНК
КОНСТРУИРОВАНИЕ АНТАГОНИСТА GH С МУТИРОВАННЫМ САЙТОМ 2 (GHa)
кДНК для человеческого GH (фиг.1) амплифицировали с помощью ПЦР из ткани человеческого гипофиза и клонировали в векторе pTrcHis-Topo (pTrcHis-TOPO-GHstop). Внеклеточный домен GHR амплифицировали с кДНК печени человека, используя ПЦР.
Конструкции антагонистов гормона роста (G120R)
Мутация G120R гормона роста
Ген гормона роста (GH) мутировали, используя способ мутации с использованием фагмидной ssДНК. Сначала ген GH субклонировали из pTrcHisGH в рТ7Т318 между сайтами BamHI и HindIII с получением рТ7Т318-GH. Затем эту плазмиду трансформировали в Е. coli CJ236 и получили однонитевую ДНК (ssДНК).
Затем ззДНК pT7T318-GH мутировали путем замены кодона для Gly120 GGC на CGC, используя праймер GH.(G120R)For (прямой) (таблица 1).
Затем двухнитевую ДНК (dsДНК) pT7T318-GH.G120R, полученную в результате процесса мутации, использовали для субклонирования GH.G120R в векторе рНЕАТ с получением pHEAT.GH.G120R (фиг.1).
Получение конструкций GH.G120R
χ 1А7 [GH.G120R-(G4S)4-GHR(b)]=GHa. сцепленный с доменом b GHR
Ген GH.G120R вырезали из pHEAT.GH.G120R (фиг.1), используя сайты рестрикции BamHI и NOtI. Затем этот ген лигировали вместо гена GH в pTrcHis χ 1A1 [GH-(G4S)4-GHR(b)] (фиг.2). Полученную в результате плазмиду трансформировали в Escherichia coli XL1 Blue и высевали на чашки с агаровой средой LB (0,3% глюкоза, 50 мкг/мл ампициллин, 12,5 мкг/мл тетрациклин).
χ 1В2 [GH.G120R-(G4S)4-GHRflec]=GHa, сцепленный с полноразмерным внеклеточным доменом GHR
Повторяли стратегию, использованную для конструирования гена χ1А7, однако вектором-реципиентом был pTrcHis χ 1B1 [GH-(G4S)4-GHRflec] (Фиг.3). Полученную в результате плазмиду трансформировали в Е. coli XL1 Blue и высевали на чашки с агаровой средой LB (0,3% глюкоза, 50 мкг/мл ампициллин, 12,5 мкг/мл тетрациклин).
χ 1С3 [GH.G120R-(G4S)4-GH.G120R]=GHa тандем
Реакцию ПЦР проводили на pTrcHisGH, используя праймеры DiGHEcoF1 и DiGHHinR1 (таблица 1). Затем продукт ПЦР подвергали ферментативному гидролизу EcoRI и HindIII, а затем лигировали вместо домена GHR(b) в pTrcHis χ 1A1 [GH-(G4S)4-GHR(b)] (фиг.4). Полученную в результате плазмиду трансформировали в рекомбинант-дефектный штамм E. coli SURE и высевали на чашки с агаровой средой LB (0,3% глюкоза, 50 мкг/мл ампициллин, 12,5 мкг/мл тетрациклин, 50 мкг/мл канамицин).
Результаты секвенирования
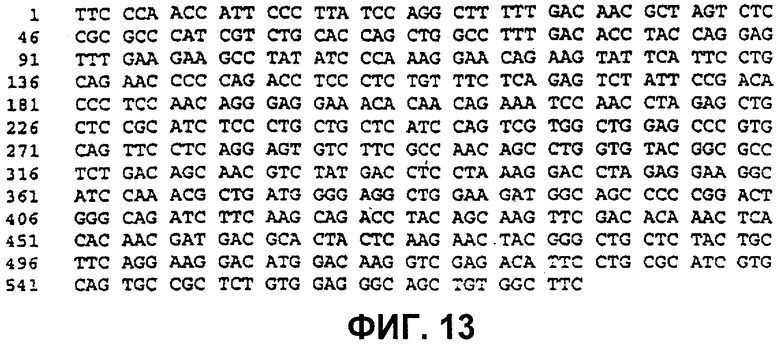
Плазмиды, содержащие конструированные гены, секвенировали. Последовательности этих генов и районы, секвенированные для GH.G120R, χ 1А7, χ 1В2 и χ 1С3, показаны на фиг.5-8 соответственно.
Исследования экспрессии
Отдельные колонии использовали для инокуляции 3 мл бульона LB (0,3% глюкоза, 50 мкг/мл ампициллин, 12,5 мкг/мл тетрациклин) для клеток Е. coli XL1 Blue и бульона LB (0,3% глюкоза, 50 мкг/мл ампициллин, 12,5 мкг/мл тетрациклин, 50 мкг/мл канамицин) для клеток Е. coli SURE. Эти клетки выращивали при встряхивании в течение ночи при 37°С.
Затем 4 мл среды 4YT, содержащей соответствующие антибиотики, инокулировали 200 мкл ночной LB культуры. Эти культуры выращивали в течение 3 часов, затем отбирали образцы по 1 мл (образцы Т0).
Затем 4YT культуры индуцировали ИПТГ до конечной концентрации 1 мМ, а затем дополнительно инкубировали в течение следующих 4 часов (образцы Т4).
Образцы Т0 и Т4 обрабатывали сразу после отбора. Сначала их центрифугировали для осаждения клеток, затем супернатант отбрасывали и осадок обрабатывали для проведения электрофореза в геле ДСН-ПААГ. На этих ПААГ гелях белок визуализировали либо с помощью окрашивания кумасси, либо с помощью вестерн-блоттинга, используя первое антитело против GH для зондирования конструкции.
Во всех случаях на окрашенных кумасси ПААГ гелях не выявили сверхэкспрессии конструкции. Однако эти конструкции наблюдали на вестерн-блотах (фиг.9). Эти блоты показали, что во всех случаях экспрессируется белок правильного размера.
Очистка
Как правило, белок очищали из 4×250 мл культур, выращенных в 4YT, содержащей соответствующие антибиотики, и индуцированных в течение 4-5 часов ИПТГ до конечной концентрации 1 мМ. Клетки собирали центрифугированием и подвергали лизису путем обработки лизоцимом и дезоксихолатом натрия с последующей обработкой ультразвуком.
Лизированные клетки центрифугировали для удаления клеточных обломков и супернатант сначала очищали, используя смолу Invitrogen ProBond (Ni-колонку). Белок элюировали, используя 5 мл 0,5 М имидазола.
Далее образец белка очищали путем разбавления элюента с Ni-колонки 10 раз в подходящем буфере, а затем пропускания его через ионообменную колонку MonoQ. Белок элюировали, используя солевой градиент 0-1 М NaCl более 20 мл при скорости 0,5 мл/мин; собирали фракции 0,5 мл. Затем эти фракции анализировали на наличие конструкции и фракции, содержащие конструкцию, объединяли.
Очищенный белок анализировали с помощью ДСН-ПААГ (окрашивание кумасси и вестерн-блоттинг) (фиг.10) и измеряли его концентрацию. Затем белок подвергали биоанализу.
В случаях χ 1А7 и χ 1В2, которые показали расщепленные продукты по вестерн-блоттингу, конструкции помещали в систему быстрой трансляции (Rapid Translation System, RTS) для транскрипции in vitro. Ранее исследования на χ 1A1 и χ 1В1 показали, что расщепление значительно уменьшалось при использовании системы RTS в сочетании с ингибиторами протеаз и факторами экспрессии (chaperone).
Биоанализ
Очищенные конструкции подвергали стандартному биоанализу GH Asterion. Полученные 293 Hi, которые стабильно экспрессируют рецептор гормона роста, стимулировали конструкцией, используя ряд доз. Готовили также второй планшет-дубликат, но добавляли 25 нг/мл GH через 30 мин после добавления конструкции для наблюдения антагонистической способности конструкции.
Все конструкции GH.G120R обладали антагонистической активностью (фиг.11).
Скрининг антагонистической активности
Известный биоанализ используют для скрининга антагонистической активности (9). Перманентную клеточную линию, экспрессирующую полноразмерный GHR, подвергают временной трансфекции люциферазным репортером, который связывает активированный Stat5 (9). Через двадцать четыре часа после этого клетки стимулируют GH в течение 6 часов с антагонистом или без антагониста. Затем эти клетки подвергают лизису и измеряют активность люциферазы (9).
Тестирование скорости метаболического очищения in vivo Крыс Sprague-Dawley анестезируют и имплантируют им канюли в бедренную и яремную вены. Через двое суток вводят химерный или тандемный GH путем внутривенной или подкожной инъекции. Образцы крови собирают через бедренную канюлю и с помощью радиоиммунологического анализа измеряют уровни химерного и тандемного или олигомерного белка. Фармакокинетические параметры оценивают, используя доступные компьютерные программы соответствия концентрации гормона и времени.
В таблице 1 представлено краткое изложение аминокислотных замен, осуществленных в сайте 1 GH. Модификации сайта 2 включают в себя замену G120 на любую аминокислоту: аргинин, аланин, лизин, триптофан, тирозин, фенилаланин или глутаминовая кислота.
Характеристика химерного антагониста гормона роста
Фармакокинетические исследования
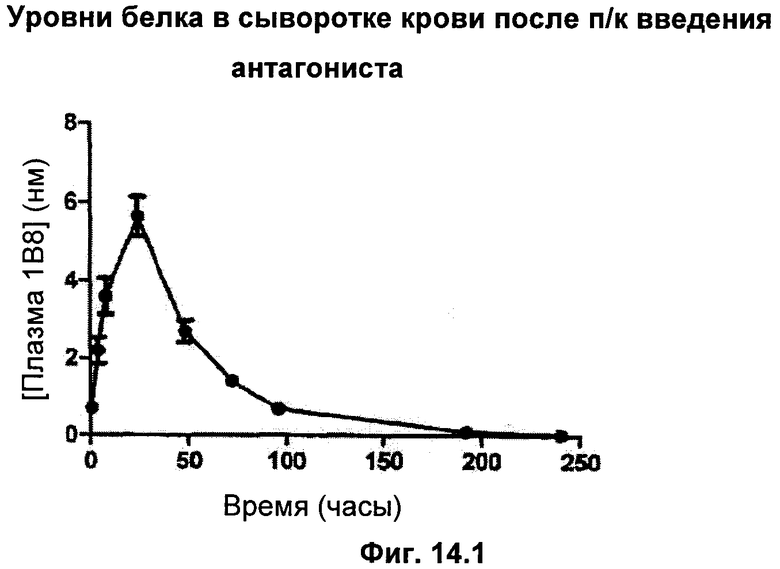
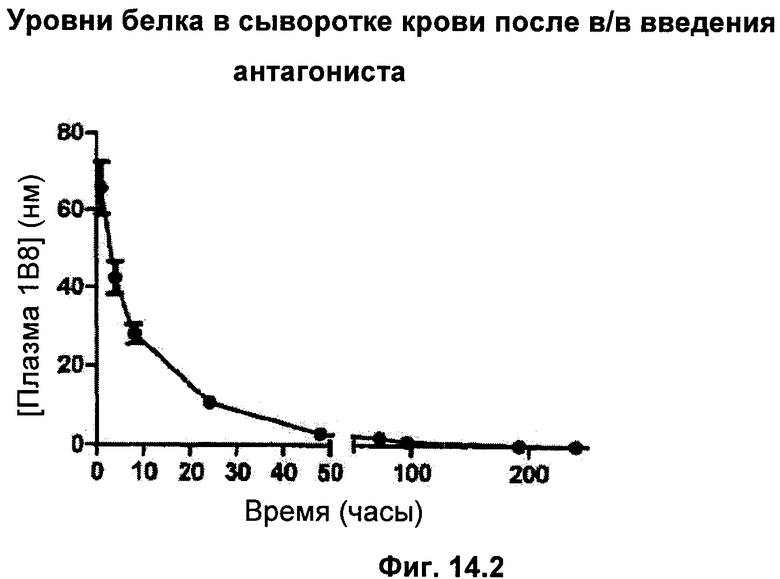
6 нормальным здоровым крысам давали однократную дозу в виде инъекции 1 нМ (75 мкг) белка либо подкожно (п/к, фиг.14.1), либо внутривенно (в/в, фиг.14.2). Контрольным крысам вводили только носитель. Образцы брали с временными интервалами в течение 10-дневного периода и анализировали на присутствие антагониста гормона роста с использованием специально разработанного ИФА (иммуноферментный) анализа GH. Анализ контрольных крыс с использованием ИФА GH не обнаружил антагониста гормона роста.
После п/к введения антагониста максимальный уровень белка в сыворотке крови наблюдался через 24 часа после инъекции. Антагонист мог все еще определяться в течение 10 дней после введения (фиг.14.1).
После в/в введения антагониста максимальный уровень белка в сыворотке крови наблюдался через 1 час после инъекции и затем резко уменьшался (фиг.14.2).
Очистка антагониста гормона роста
Клеточную линию СНО Flp-ln, экспрессирующую антагонист гормона роста в виде секретируемого продукта, выращивали в безбелковой среде до исчезновения клеток (т.е. жизнеспособность клеток <10%).
Среды затем собирали, концентрировали и осветляли перед аффинной очисткой. Для очистки приготавливали 20 мл NHS-активированной смолы Sepharose 4 Fast Flow, связанной с моноклональным антителом 5Е1 к человеческому гормону роста. Типично образец среды концентрировали в 10 раз перед очисткой со следующими добавками: 10 мМ бензамидина HCl, 0,1 мМ AEBSF, 1 мМ ЭДТА, 200 мкг/мл PMSF и 0,1% (об./об.) Tween 20, и разбавляли 1:1 буфером для связывания (25 мМ Трис HCl/150 мМ NaCl, pH 7,2).
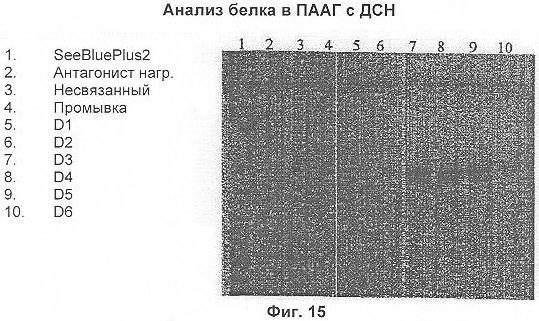
Вещество наносили на колонку при скорости потока 2 мл/мин. После промывки связанный белок элюировали при скорости потока 1 мл/мин с помощью 200 мМ глицина, pH 2,7, с последующей нейтрализацией 1 М Трис HCl, pH 9,0. Очищенные образцы затем анализировали в ПААГ с ДСН (см. фиг.15).
Анализ белка по методу Брэдфорда в образцах антагониста гормона роста после очистки.





Изобретение относится к области генной инженерии, конкретно к химерным полипептидам, содержащим антагонист рецептора гормона роста, и может быть использовано в медицине. Производят модификации в связывающем домене гормона роста путем замены аминокислотного остатка глицина в положении 120 и дополнительно модифицируют в сайте 1, где заменяют по меньшей мере один аминокислотный остаток, который увеличивает сродство гормона роста к его связывающему домену на рецепторе гормона роста. Затем конъюгируют его с лигандсвязывающим доменом рецептора гормона роста посредством пептидного линкера. Изобретение обеспечивает получение высокоэффективного антагониста рецептора гормона роста с увеличенным периодом полувыведения, пониженной иммуногенностью и отсутствием токсичности по сравнению с известными мутантными формами. 12 н. и 23 з.п. ф-лы, 16 ил., 1 табл.
1) по меньшей мере один связывающий домен гормона роста, модифицированный в сайте 2, где указанная модификация представляет собой замену аминокислотного остатка глицина 120 как представлено на фиг.12, обеспечивающую антагонистическую активность в отношении рецептора гормона роста, и где указанный химерный полипептид возможно модифицирован в сайте 1, где указанная модификация в сайте 1 представляет собой замену по меньшей мере одного аминокислотного остатка, которая увеличивает сродство гормона роста к его связывающему домену на рецепторе гормона роста; и
2) лиганд-связывающий домен рецептора гормона роста, связанные посредством пептидного линкера.
миксомицета, дрожжевой клетки, клетки млекопитающего, растительной клетки, клетки насекомого.
1) берут клетку по любому из пп.23-25 и инкубируют указанную клетку в условиях, приводящих к продуцированию указанного полипептида, и
2) выделяют полипептид из клетки или культуральной среды клетки.
| US 5849535, 15.12.1998 | |||
| WO 9724445 A, 10.07.1997 | |||
| СЛИТОЙ БЕЛОК И СПОСОБ ВЫДЕЛЕНИЯ СЛИТОГО БЕЛКА | 1993 |
|
RU2114119C1 |
Авторы
Даты
2009-02-10—Публикация
2002-12-06—Подача