Настоящее изобретение относится к полипептидам, которые содержат рецептор-связывающий домен цитокина и домен, который включает в себя сигнальную последовательность для присоединения гликозилфосфатидилинозитных (GPI) якорей; к способам получения указанных полипептидов; к молекулам нуклеиновых кислот, кодирующим указанные полипептиды и к терапевтическим композициям, содержащим указанные полипептиды.
GPI-якоря представляют собой посттрансляционные модификации у белков, которые добавляют гликозилфосфатидилинозит, который дает возможность этим белкам заякориваться на наружной стороне клеточных мембран. Обычно белки, которые имеют GPI-якорь, не имеют трансмембранного или цитоплазматического домена. GPI-якорные белки образуют многообразное семейство белков, которое включает в себя, в качестве примера, но не в качестве ограничения, мембраноассоциированные ферменты, молекулы адгезии и белки, которые покрывают наружную поверхность простейших паразитов, таких как Trypanosoma brucei spp. Почка включает в себя ряд примеров GPI-заякоренных белков, например уромодулин, карбонат-дегидрогеназа типа IV, щелочная фосфатаза, Thy-1, ВР-3, аминопептидаза Р и дипептидилпептидаза.
Все GPI-якорные белки первоначально синтезируются с трансмембранным якорем, который после прохождения через эндоплазматический ретикулум отщепляется и ковалентно связывается с предварительно образованным GPI-якорем с помощью специфического трансамидазного фермента. Модификация белков путем добавления GPI-якоря придает белку важные свойства, поскольку добавление липидной группировки позволяет белку встраиваться в клеточные мембраны и тем самым заякориваться.
Существует несколько общих требований для создания синтетической GPI-якорной последовательности. Они представляют собой гидрофобный район на С-конце молекулы (10-20 аминокислот), за которым не следует кластер основных остатков, "спейсерный домен" из 7-10 остатков, предшествующий гидрофобному району, и небольшие аминокислоты после спейсерного района, где происходит расщепление предшественника и присоединение якоря. GPI-якорь предварительно собирается и добавляется к образующемуся белку в эндоплазматическом ретикулуме. Сопровождающий эту стадию первоначальный С-концевой пептид удаляется так, что GPI-якорь ковалентно присоединяется к новой С-концевой аминокислоте на белке.
Лиганды, которые взаимодействуют с рецепторами с осуществлением подходящего биохимического ответа, известны как агонисты, а лиганды, которые предотвращают биохимический ответ или препятствуют ему, известны как антагонисты. В качестве примера, но не для ограничения, специфические факторы роста клеток представляют собой лиганды, которые действуют как агонисты и связывают рецепторы, локализованные в клеточных мембранах.
Большая группа факторов роста, которые называют цитокинами, вовлечена в ряд разнообразных клеточных функций. Они включают в себя, в качестве примера, но не для ограничения, модуляцию иммунной системы, регуляцию энергетического метаболизма и контроль роста и развития. Цитокины опосредуют свои эффекты через рецепторы, экспрессированные на клеточной поверхности клеток-мишеней.
Рецепторы семейства цитокиновых рецепторов обладают единственным трансмембранным доменом и у них отсутствует собственная ферментативная активность (Kishimoto et al., 1994). Когда цитокин связывается со своим распознаваемым рецептором, этот комплекс интернализируется и передача сигнала происходит через активацию сигнальных каскадов, которые включают в себя пути Jak/Stat и Mapk. За интернализацией следует стадия рециклинга, посредством которой рецепторная молекула регенерируется для дальнейшего использования в клетке. Пример вышеуказанного описан в отношении гормона роста (GH) и его связывания с рецептором гормона роста (GHR).
Известно, что одна молекула гормона роста (GH) ассоциирована с двумя рецепторными молекулами (Cunningham et al., 1991; de Vos et al., 1992; Sundstrom et al., 1996; Clackson et al., 1998). Это происходит с помощью двух уникальных рецептор-связывающих сайтов на GH и общего связывающего кармана на внеклеточном домене двух рецепторов. Сайт 1 на молекуле GH обладает более высоким сродством, чем сайт 2, и считается, что димеризация рецептора происходит последовательно, при этом один рецептор связывается с сайтом 1 на GH, за чем следует рекруитмент второго рецептора в сайт 2.
Внеклеточный домен GHR существует в виде двух связанных доменов, каждый приблизительно из 100 аминокислот (SD-100), С-концевого SD-100 домена, который расположен наиболее близко к клеточной поверхности, и N-концевого SD-100 домена, который является наиболее отдаленным. Конформационное изменение именно в этих двух доменах происходит при связывании гормона с образованием трехмерного комплекса GHR-GH-GHR.
Более того, усеченные рецепторы GH, у которых отсутствует цитоплазматический домен рецептора, действуют в качестве доминантных негативных ингибиторов передачи сигнала GH (Ross et al., 1997). Усеченный рецептор экспрессируется на высоком уровне на клеточной поверхности, поскольку у него отсутствует цитоплазматический домен, существенный для интернализации (Maamra et al., 1999). В присутствии GH усеченный рецептор гетеродимеризуется с полноразмерным рецептором и блокирует передачу сигнала, поскольку у него отсутствует цитоплазматический домен. Поскольку усеченный рецептор не интернализируется, он действует как доминантный негативный ингибитор, предотвращающий интернализацию GH рецепторного комплекса.
Авторы изобретения синтезировали варианты рецептора цитокина, которые содержат домен GPI-якорного белка. У этих вариантов отсутствует цитоплазматический домен и поэтому у них отсутствует способность к передаче сигнала. Обеспечение GPI-якорным доменом означает, что этот вариант встраивается в мембраны и действует как эффективный ингибитор передачи сигнала GH путем конкурирования за циркулирующий GH и связывания GH на клеточной поверхности в гетеродимерном комплексе, который состоит из рецептора, заякоренного химерным усеченным GPI, GH и нативного рецептора. В дополнение заякоренный усеченным GPI рецептор GH генерирует большое количество растворимого рецептора GH, который будет связывать GH.
Многие цитокины активируют свои соответствующие рецепторы посредством димеризации или олигомеризации, и данное изобретение относится к предоставлению цитокиновых рецепторов, которые модифицированы путем обеспечения полипептидным доменом, который содержит последовательность, которая модифицирована путем добавления гликозилфосфатидилинозита.
В соответствии с первым аспектом изобретения предложен химерный полипептид, содержащий:
1) лиганд-связывающий домен цитокинового рецептора; и
2) домен, который включает в себя сигнальную последовательность для присоединения гликозилфосфатидилинозита.
Предпочтительно указанный химерный полипептид состоит из внеклеточного домена цитокинового рецептора и домена, который включает в себя сигнальную последовательность для присоединения гликозилфосфатидилинозита.
Предпочтительно полипептид модифицирован путем добавления гликозилфосфатидилинозита.
Предпочтительно модифицированный полипептид представляет собой модулятор опосредованной цитокинами клеточной передачи сигнала.
Предпочтительно сигнальная последовательность для присоединения гликозилфосфатидилинозита выбрана из группы, состоящей из:
DKLVKCGGIS LLVQNTSWML LLLLSLSLLQ ALDFISL;
PSPTPTETAT PSPTPKPTST PEETEAPSSA TTLISPLSLI VIFISFVLLI;
LVPRGSIEGR GTSITAYNSE GESAEFFFLL ILLLLLVLV и
TSITAYKSE GESAEFFFLL ILLLLLVLV.
В предпочтительном воплощении изобретения указанный полипептид является антагонистом.
В данном изобретении используется высокое сродство цитокина к его рецептору и способность липофильного GPI-хвоста повторно встраиваться в плазматическую мембрану. Полипептид по настоящему изобретению представляет собой "химеру", содержащую лиганд-связывающий домен цитокинового рецептора и домен белка, который включает в себя сайт для добавления GPI-якоря. Химерная молекула будет состоять из внеклеточного гормонсвязывающего домена цитокина с С-концевым GPI-якорем.
Ожидается, что в кровотоке химерный белок будет формировать мицеллу из большого количества химерных белков с GPI-якорями в центре. При контакте с клеточной мембраной GPI будет повторно встраиваться в клеточную мембрану. Данное изобретение обладает важным преимуществом, состоящим в том, что связывание цитокина с этой химерой дает комплекс рецептор:гормон:химера. В случае GH это будет GHR:GH:химера. Этот комплекс не будет передавать сигнал, поскольку химера представляет собой усеченный рецептор и будет поэтому блокировать как рецепторную передачу сигнала, так и интернализацию рецептора.
В альтернативном предпочтительном воплощении изобретения указанная полипептидная химера действует как циркулирующий антагонист. Ожидается, что в кровотоке у мицеллярной молекулы GPI-якоря будут находиться в ее центре, а связывающий домен рецептора будет направлен наружу и, следовательно, будет способен связываться и антагонизировать действие гормона.
В альтернативном предпочтительном воплощении изобретения указанная полипептидная химера действует как антагонист после локальной или трансгенной экспрессии посредством генотерапии. Следует ожидать, что трансфекция или генотерапия может быть использована либо на клеточном уровне, либо на уровне целого организма. Таким образом, локальная экспрессия в клетках могла бы антагонизировать действие цитокинов либо инъекция ДНК в компартмент организма, такой как воспаленное колено, могла бы блокировать действия воспалительных цитокинов, таких как TNF (фактор некроза опухоли).
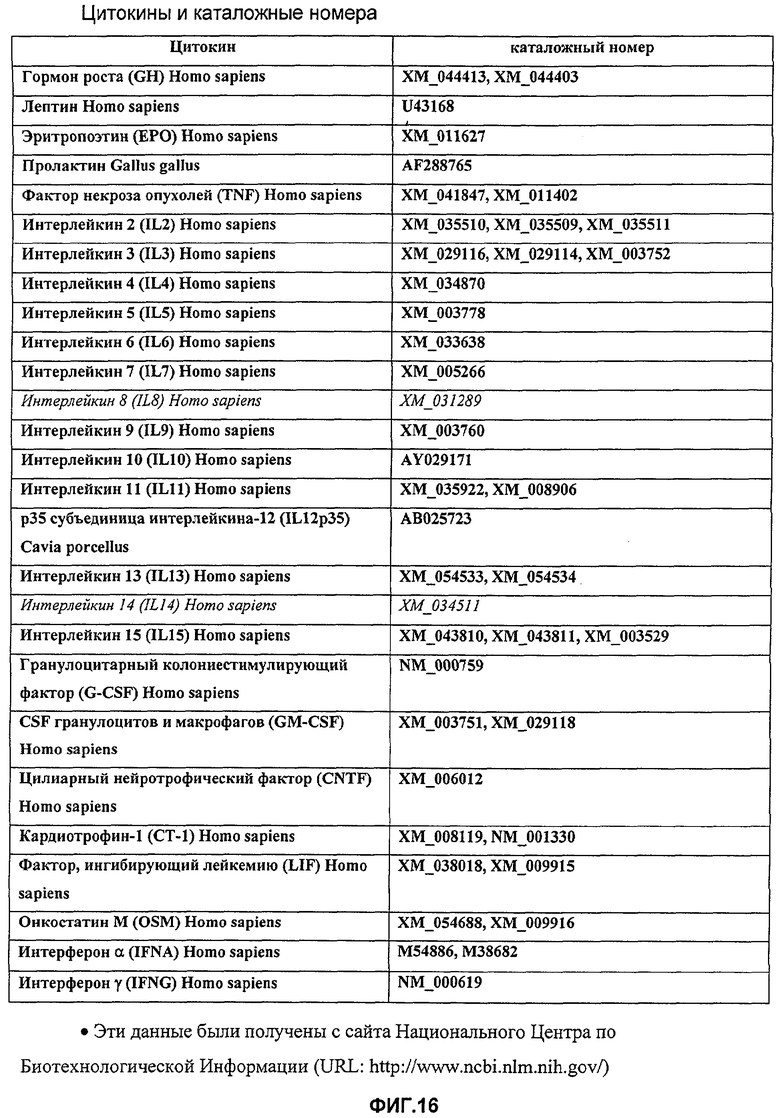
В предпочтительном воплощении изобретения лиганд-связывающий домен цитокинового рецептора получен из рецепторов, выбранных из группы, состоящей из гормона роста (GH); лептина; эритропоэтина; пролактина; TNF, интерлейкинов (IL) IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, гранулоцитарного колониестимулирующего фактора (G-CSF); гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF); цилиарного нейротрофического фактора (CNTF); кардиотрофина-1 (СТ-1); фактора, ингибирующего лейкемию (LIF); онкостатина М (OSM); интерферона, IFNα и IFNγ. IL-9, IL-10, IL-11, р35 субъединицы IL-12, IL-13, IL-15.
Предпочтительно лиганд-связывающий домен цитокинового рецептора получен из рецептора гормона роста.
В одном воплощении изобретения полипептид представляет собой слитый белок.
В дополнительном предпочтительном воплощении изобретения указанный полипептид содержит аминокислотную последовательность, показанную на Фиг.3, или Фиг.9, или Фиг.14, или Фиг.15.
В дополнительном предпочтительном воплощении изобретения предложен полипептид по настоящему изобретению, который модифицирован путем добавления, делеции или замены по меньшей мере одного аминокислотного остатка с получением варианта последовательности полипептида по настоящему изобретению.
Обычно варианты включают в себя химеры, которые модифицированы специфически для изменения признака полипептида, не связанного с его физиологической активностью. Например, цистеиновые остатки могут быть замещены или делегированы для предотвращения образования нежелательных дисульфидных связей. Подобным же образом некоторые аминокислоты могут быть изменены для усиления экспрессии химеры путем элиминации протеолиза протеазами в системе экспрессии.
Различные химеры экспрессируют и тестируют на одну или более чем одну активность для определения того, какая именно мутация обеспечивает вариант полипептида с желаемыми свойствами. В вариантах могут быть осуществлены дополнительные мутации, которые являются молчащими в отношении аминокислотной последовательности полипептида, но которые обеспечивают предпочтительные кодоны для трансляции в конкретном хозяине, например в дрожжах и миксомицетах, таких как Dictyostelium spp.
Специалисту в данной области также понятно, что в химерных полипептидах могут быть сделаны консервативные аминокислотные замены для получения функционально эквивалентных вариантов вышеупомянутых полипептидов, то есть вариантов, которые сохраняют функциональные способности химер. Как используется здесь, "консервативная аминокислотная замена" относится к аминокислотной замене, которая не изменяет характеристики относительного заряда или размера белка, в котором сделана данная аминокислотная замена.
Варианты могут быть получены в соответствии со способами изменения полипептидной последовательности, известными обычному специалисту в данной области, такими как способы, которые могут быть найдены в ссылках, в которых описаны такие способы, например Molecular Cloning: A Laboratory Manual, J, Sambrook, et al., eds., Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989, или Current Protocols in Molecular Biology, F.M. Ausubel, et al., eds., John Wiley & Sons, Inc., New York. Консервативные замены аминокислот включают в себя замены, сделанные среди аминокислот в рамках следующих групп: (а) М, I, L, V; (б) F, Y, W; (в) К, R, Н; (г) A, G; (д) S, Т; (е) Q, N; и (ж) Е, D.
Консервативные аминокислотные замены в аминокислотной последовательности химерных полипептидов для получения функционально эквивалентных вариантов этих полипептидов обычно осуществляют путем изменения нуклеиновой кислоты, кодирующей химеру. Такие замены могут быть осуществлены с помощью разнообразных способов, известных обычному специалисту в данной области. Например, аминокислотные замены могут быть сделаны с помощью ПЦР-направленной мутации, сайт-направленного мутагенеза в соответствии со способом Kunkel, Proc. Nat. Acad. Sci. U.S.A. 82: 488-492, 1985.
Альтернативно или предпочтительно указанная модификация включает в себя применение модифицированных аминокислот в получении рекомбинантных или синтетических форм химерных полипептидов по настоящему изобретению.
Специалисту в данной области должно быть понятно, что модифицированные аминокислоты включают в себя, в качестве примера, но не в качестве ограничения, 4-гидроксипролин, 5-гидроксилизин, N6-ацетиллизин, N6-метиллизин, N6,N6-диметиллизин, N6,N6,N6-триметиллизин, циклогексиаланин, D-аминокислоты, орнитин.
Включение модифицированных аминокислот может придавать полипептидам по изобретению полезные свойства. Например, включение модифицированных аминокислот может придавать химерному полипептиду повышенную in vivo стабильность, тем самым создавая возможность уменьшения эффективного количества полипептида, вводимого пациенту.
В соответствии с дополнительным аспектом изобретения предложена молекула нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты, которая кодирует полипептид по настоящему изобретению.
В предпочтительном воплощении изобретения указанная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, представленную на Фиг.3 или Фиг.9.
В предпочтительном воплощении изобретения предложена последовательность нуклеиновой кислоты, которая гибридизуется в строгих условиях гибридизации с последовательностью, представленной на Фиг.3 или Фиг.9.
В соответствии с дополнительным аспектом изобретения предложен полипептид, кодируемый молекулой нуклеиновой кислоты, представленной на Фиг.3 или Фиг.9.
В соответствии с еще одним дополнительным аспектом изобретения предложен вектор, включающий в себя молекулу ДНК, кодирующую полипептид в соответствии с любым предшествующим аспектом или воплощением изобретения.
В предпочтительном воплощении изобретения указанный вектор представляет собой вектор экспрессии, адаптированный для экспрессии эукариотического гена.
Типично указанная адаптация включает в себя обеспечение последовательностями контроля транскрипции (промоторные последовательности), которые опосредуют специфичную в отношении клетки/ткани экспрессию. Эти промоторные последовательности могут быть клетка/ткань специфичными, индуцируемыми или конститутивными.
Промотор является термином, известным в данной области техники и, для определенности, включает в себя следующие признаки, которые предложены только в качестве примера, но не в качестве ограничения. Энхансерные элементы представляют собой цис-действующие последовательности нуклеиновой кислоты, часто находящиеся 5' к сайту инициации транскрипции гена (энхансеры могут также находиться 3' к последовательности гена или даже локализоваться в интронных последовательностях и являться, следовательно, независимыми от положения). Энхансеры функционируют, увеличивая скорость транскрипции гена, с которым энхансер связан. Активность энхансера зависит от трансдействующих транскрипционных факторов (полипептидов), которые, как было показано, специфически связываются с энхансерными элементами. Связывание/активность транскрипционных факторов (смотри Eukaryotic Transcription Factors, by David S Latchman, Academic Press Ltd, San Diego) зависит от ряда сигналов окружающей среды, которые включают в себя, в качестве примера, но не в качестве ограничения, промежуточные метаболиты (например, глюкозу, липиды), эффекторы окружающей среды (например, свет, тепло).
Промоторные элементы также включают в себя так называемый ТАТА бокс и последовательности выбора инициации РНК полимеразы (RNA polymerase initiation selection sequences (RIS)), которые функционируют, выбирая сайт инициации транскрипции. Эти последовательности также связывают полипептиды, которые действуют, среди прочего, облегчая выбор инициации транскрипции РНК полимеразой.
Адаптации также включают в себя обеспечение селективными маркерами и последовательностями автономной репликации, которые облегчают поддержание указанного вектора в любой эукариотической клетке. Вектора, которые поддерживаются автономно, называют эписомальными векторами.
Адаптации, которые облегчают экспрессию генов, кодируемых вектором, включают в себя обеспечение последовательностями терминации транскрипции/полиаденилирования. Они также включают в себя обеспечение внутренними сайтами вхождения рибосомы (IRES), которые функционируют, максимально увеличивая экспрессию генов, кодируемых вектором, расположенных в бицистронных или мультицистронных экспрессионных кассетах.
Эти адаптации хорошо известны в данной области техники. Существует значительное количество опубликованной литературы, касающейся конструирования вектора экспрессии и методик рекомбинантной ДНК в целом.
Смотри Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory, Cold Spring Harbour, NY и ссылки там; Marston, F (1987) DNA Cloning Techniques: A Practical Approach Vol III IRL Press, Oxford UK; DNA Cloning: F M Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, lnc. (1994).
Специалисту в данной области должно быть очевидно, что векторы по изобретению могут представлять собой векторы генной терапии. Векторы генной терапии обычно основаны на вирусе. В качестве векторов для доставки экзогенных генов обычно используют ряд вирусов. Обычно используемые векторы включают в себя рекомбинантно модифицированные ДНК- и РНК-содержащие вирусы, покрытые или не покрытые оболочкой, предпочтительно выбранные из baculoviridiae, parvoviridiae, picornoviridiae, herpesviridiae, poxviridae, adenoviridiae или picornnaviridiae. Также могут быть использованы химерные векторы, в которых используются полезные элементы свойств каждого из родительских векторов (смотри, например, Feng, et al. (1997) Nature Biotechnology 15:866-870). Такие вирусные векторы могут быть дикого типа или могут быть модифицированы с помощью методик рекомбинантных ДНК так, чтобы быть дефицитными по репликации, реплицирующимися в зависимости от условий или компетентными по репликации.
Предпочтительные векторы получены из аденовирусных, аденоассоциированных вирусных и ретровирусных геномов. В наиболее предпочтительной практике изобретения векторы получены из генома человеческого аденовируса. Особо предпочтительные векторы получены из аденовирусов человека серотипов 2 или 5. Репликативная способность таких векторов может быть ослаблена (до точки, которая считается "дефицитной по репликации") путем модификаций или делеций в Е1а и/или Е1b кодирующих районах. Предпочтительны другие модификации вирусного генома для достижения конкретных характеристик экспрессии либо обеспечения возможности повторного введения или более низкого иммунного ответа.
Альтернативно вирусные векторы могут быть условно реплицирующимися или компетентными по репликации. Условно реплицирующиеся вирусные векторы используют для достижения селективной экспрессии в конкретных клеточных типах при отсутствии неблагоприятной инфекции широкого спектра. Примеры условно реплицирующихся векторов описаны в Pennisi, Е. (1996) Science 274:342-343; Russell, и S.J. (1994) Eur. J. of Cancer 30А (8): 1165-1171. Дополнительные примеры селективно реплицирующихся векторов включают в себя те векторы, в которых ген, существенный для репликации вируса, находится под контролем промотора, который активен только в конкретном клеточном типе или состоянии клетки, так что в отсутствие экспрессии такого гена вирус не будет реплицироваться. Примеры таких векторов описаны в Henderson, et al., патент США №5698443, выдан 16 декабря 1997, и Henderson, et al., патент США №5871726, выдан 16 февраля 1999, полные сведения которых включены здесь путем ссылки.
Кроме того, вирусный геном может быть модифицирован так, чтобы включать индуцибельные промоторы, посредством чего достигается репликация или экспрессия только при определенных условиях. Примеры индуцибельных промоторов описаны в научной литературе (смотри, например, Yoshida and Hamada (1997) Biochem. Biophys. Res. Comm. 230: 426-430; lida, et al. (1996) J. Virol. 70(9): 6054-6059; Hwang, et al. (1997) J. Virol 71(9): 7128-7131; Lee, et al. (1997) Mol. Cell. Biol. 17(9): 5097-5105; и Dreher, et al. (1997) J.Biol. Chem 272 (46); 29364-29371.
Векторы могут также быть невирусными и могут быть доступны из ряда коммерческих источников, легко доступных специалисту в данной области. Например, векторы могут представлять собой плазмиды, которые могут быть эписомальными или интегрирующими.
В дополнительном аспекте изобретения предложен способ получения полипептида по настоящему изобретению, при котором:
(1) выращивают клетку, трансфицированную вектором или нуклеиновой кислотой по настоящему изобретению, в условиях, подходящих для производства указанного полипептида; и
(2) очищают указанный полипептид от указанной клетки или окружающей среды ее роста.
В предпочтительном способе по изобретению указанный вектор кодирует сигнал секреции для облегчения очистки указанного полипептида и тем самым указанный рекомбинантный полипептид снабжен этим сигналом.
В еще одном дополнительном воплощении изобретения предложена клетка, трансфицированная вектором или нуклеиновой кислотой по изобретению.
Предпочтительно указанная эукариотическая клетка выбрана из группы, состоящей из грибной клетки, например, Saccharomyces cerevesiae, Pichia spp; клетки миксомицета (например, Dictyostelium spp); клетки насекомого (например, Spodoptera frugiperda); растительной клетки или клетки млекопитающего.
В дополнительном предпочтительном воплощении изобретения указанной эукариотической клеткой является Dictyostelium spp.
В соответствии с дополнительным аспектом изобретения предложено применение полипептида по настоящему изобретению в качестве фармацевтического средства. Предпочтительно указанный полипептид используют в фармацевтической композиции.
При введении полипептид по настоящему изобретению вводят в фармацевтически приемлемых препаратах. Такие препараты могут традиционно содержать фармацевтически приемлемые концентрации соли, буферных агентов, консервантов, совместимых носителей и возможно других терапевтических агентов.
Полипептид по настоящему изобретению можно вводить любым общепринятым путем, включая инъекцию. Введение может, например, быть пероральным, внутривенным, внутрибрюшинным, внутримышечным, внутриполостным, подкожным или чрескожным.
Фармацевтические композиции по настоящему изобретению вводят в эффективных количествах. "Эффективным количеством" является такое количество композиции, которое отдельно или вместе с дополнительными дозами дает желаемый ответ. Он может включать в себя только замедление развития заболевания временно, хотя более предпочтительно он включает в себя остановку развития заболевания постоянно. Это можно отслеживать с помощью традиционных способов или можно отслеживать в соответствии с диагностическими способами.
Дозы полипептида, вводимые субъекту, можно выбирать в соответствии с различными параметрами, в частности в соответствии с используемым способом введения и состоянием субъекта (то есть возраст, пол). При введении фармацевтические композиции по изобретению применяют в фармацевтически приемлемых количествах и в фармацевтически приемлемых композициях. Такие препараты могут традиционно содержать соли, буферные агенты, консерванты, совместимые носители и возможно другие терапевтические агенты. Такие соли, когда они используются в медицине, должны быть фармацевтически приемлемыми, однако не являющиеся фармацевтически приемлемыми соли могут удобным образом быть использованы для получения их фармацевтически приемлемых солей и они не исключены из объема изобретения. Такие фармакологически и фармацевтически приемлемые соли включают в себя, но не ограничены ими, соли, которые получены из следующих кислот: соляная, бромистоводородная, серная, азотная, фосфорная, малеиновая, уксусная, салициловая, лимонная, муравьиная, малоновая, янтарная и тому подобное. Также фармацевтически приемлемые соли могут быть получены в виде солей щелочных или щелочно-земельных металлов, как, например, солей натрия, калия или кальция.
Фармацевтические композиции при желании могут быть объединены с фармацевтически приемлемым носителем. Термин "фармацевтически приемлемый носитель", как он используется здесь, означает один или более чем один совместимый твердый или жидкий наполнитель, разбавитель или инкапсулирующее вещество, которые подходят для введения человеку. Термин "носитель" обозначает органический или неорганический ингредиент, природный или синтетический, с которым активный ингредиент объединен для облегчения применения. Компоненты фармацевтических композиций также могут быть смешаны с молекулами по настоящему изобретению и с любыми другими таким образом, чтобы отсутствовало взаимодействие, которое могло бы существенно снизить желаемую фармацевтическую эффективность.
Фармацевтические композиции могут содержать подходящие буферные агенты, включая уксусную кислоту в соли, лимонную кислоту в соли, борную кислоту в соли и фосфорную кислоту в соли.
Фармацевтические композиции также могут возможно содержать подходящие консерванты, такие как бензалкония хлорид, хлорбутанол, парабены и тимеросал.
Фармацевтические композиции могут удобным образом быть представлены в стандартной лекарственной форме и могут быть приготовлены с помощью любого из способов, хорошо известных в области фармации. Все способы включают в себя стадию объединения активного агента с носителем, который состоит из одного или более чем одного вспомогательного ингредиента. В целом, композиции готовят путем однородного и тщательного объединения активного соединения с жидким носителем, тонко диспергированным твердым носителем или ими обоими, а затем, если необходимо, формования продукта.
Композиции, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, таблетки, лепешки, каждая из которых содержит предопределенное количество активного соединения. Другие композиции включают в себя суспензии в водных жидкостях или неводных жидкостях, такие как сироп, эликсир или эмульсия.
Композиции, подходящие для парентерального введения, удобно представлять в виде стерильного водного или неводного препарата, который предпочтительно является изотоничным с кровью реципиента. Этот препарат может быть приготовлен в соответствии с известными способами с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-бутандиоле. К числу приемлемых растворителей, которые могут быть использованы, относятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие жиры. Для этой цели может быть использован любой мягкий нелетучий жир, включая синтетические моно- или диглицериды. Кроме того, в приготовлении инъецируемых препаратов могут быть использованы жирные кислоты, такие как олеиновая кислота. Технологию приготовления носителя, подходящего для перорального, подкожного, внутривенного, внутримышечного и так далее введений, можно найти в Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA.
В соответствии с дальнейшим аспектом изобретения предложено применение полипептида по изобретению для производства лекарственного средства для применения в лечении заболевания, выбранного из группы, состоящей из акромегалии; гигантизма; сахарного диабета, рака; анорексии; аутоиммунного и инфекционнного заболевании; воспалительных расстройств, включая ревматоидный артрит.
В предпочтительном воплощении изобретения указанное заболевание представляет собой акромегалию.
В дополнительном предпочтительном воплощении изобретения указанное заболевание представляет собой гигантизм.
В еще одном предпочтительном воплощении изобретения указанное заболевание представляет собой рак.
В изобретении также предложен способ лечения субъекта - человека или животного, при котором указанному субъекту вводят эффективное количество полипептидной фармацевтической композиции или лекарственного средства.
В изобретении также предложен способ снижения почечного клиренса молекулы, при котором формируют агент согласно любому воплощению изобретения. Размер мицелл уменьшает почечный клиренс.
Воплощение изобретения теперь будет описано только с помощью примера и со ссылкой на следующие фигуры.
На Фиг.1а-1и показана нуклеотидная последовательность вектора рАс6-LP-MCS-GPI, использованного для клонирования внеклеточного домена GHR для экспрессии в Dictyostelium.
На Фиг.2 показана часть сайта множественного клонирования рАс6-LP-MCS-GPI с клонированным в нем внеклеточным доменом GHR, новый вектор назван pAc6GHRGPI. Внеклеточный домен GHR представлен заглавными буквами.
На Фиг.3 показана слитая нуклеиновокислотная и аминокислотная последовательность GHRGPI из вектора pAc6GHRGPI. Нуклеотид для внеклеточного домена GHR представлен заглавными буквами, а аминокислотная последовательность - жирным шрифтом.
Фиг.4 иллюстрирует скрининг на GHRGPI в клеточных лизатах из клонов Dictyostelium, трансфицированных pAc6GHRGPI. Скрининг осуществляли с помощью вестерн-блоттинга с использованием моноклонального антитела к GHR, Mab5. Дорожка АХ2 представляет собой отрицательный контроль нетрансфицированных клеток, а дорожки 1-7 - разные клоны, подвергнутые скринингу. Дорожки 1, 2, 3 и 5 показывают положительную полосу при правильном размере, а дорожка 3 была выбрана для очистки GHRGPI.
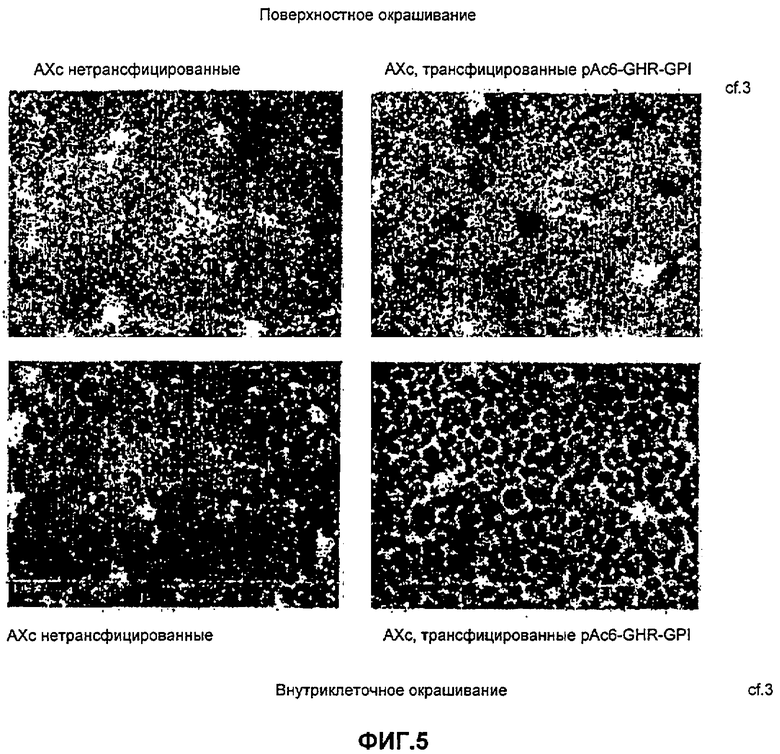
Фиг.5 иллюстрирует иммуноокрашивание на GHRGPI и показывает, что данный белок экспрессируется на клеточной поверхности Dictyostelium. Верхние панели показывают поверхностное окрашивание с отрицательным контролем слева из нетрансфицированных клеток, справа - клетки, трансфицированные pAc6GHRGPI, показывают положительное иммуноокрашивание на клеточной поверхности. В нижних панелях клетки были сделаны проницаемыми для изучения внутриклеточного окрашивания. Вновь отрицательный контроль находится слева, а положительный контроль справа показывает внутриклеточное окрашивание.
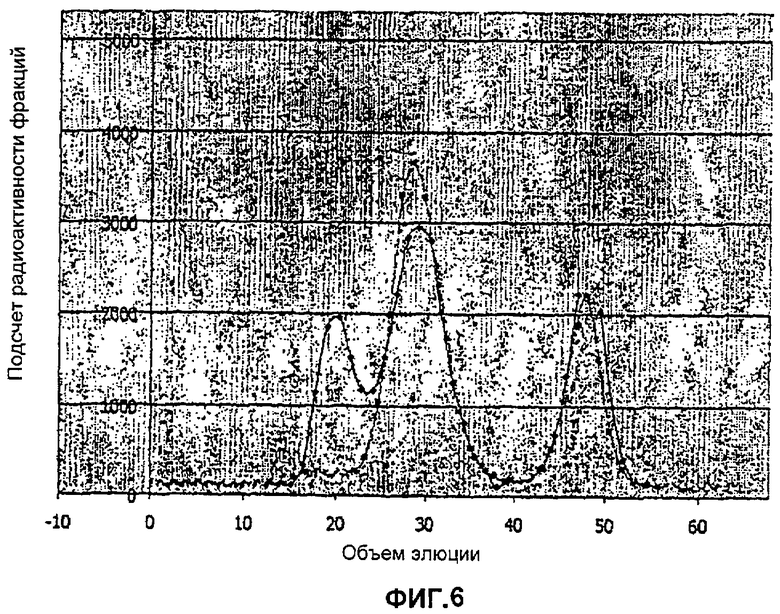
Фиг.6. Профиль элюции (Sephadex G100) иодированного GH отдельно и GHRGPI (очищенного из стабильных клонов Dictyostelium, экспрессирующих GHRGPI, идентифицированный на Фиг.5) с иодированным GH плюс или минус неподготовленный GH. GHR-GPI образует единственный комплекс приблизительно 60-65 кДа с 125 I-GH (голубая линия). Желтая линия представляет собой иодированный GH отдельно, а розовая линия - GHR-GPI в присутствии избытка неподготовленного GH. Этот результат показывает функциональное связывание GH очищенным GHRGPI.
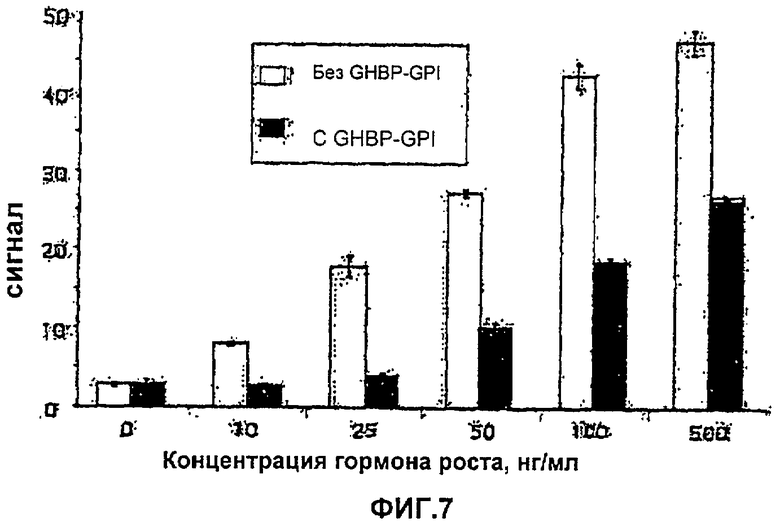
На Фиг.7 показан биоанализ для гормона роста в присутствии или в отсутствие очищенного GHRGPI. Клетки, экспрессирующие рецептор гормона роста, трансфицируют люциферазным репортером, активируемым передачей сигнала гормона роста. Клетки затем стимулировали увеличивающимися дозами гормона роста в присутствии или в отсутствие GHRGPI (приблизительно 10 нМ). В присутствии GHRGPI сигнал гормона роста был аннулирован при низких дозах гормона роста или был понижен при высоких дозах.
Фиг.8а и 8б представляют собой pCR-3GPI_Thy-1 вектор экспрессии млекопитающего с GPI сигналом млекопитающего.
Фиг.9 представляет собой нуклеотидную и аминокислотную последовательность GHRGPI якорного полипептида млекопитающего в pCR-3GPI_Thy-1 и названного pCR3GHRGPI. Внеклеточный домен GHR лигирован в BamHI и Ecorl сайт. Для аминокислотной последовательности жирный шрифт представляет собой внеклеточный домен GHR, подчеркнутый жирный курсив представляет собой GHR сигнал и подчеркнуто начало GPI сигнала, которое отщепляется.
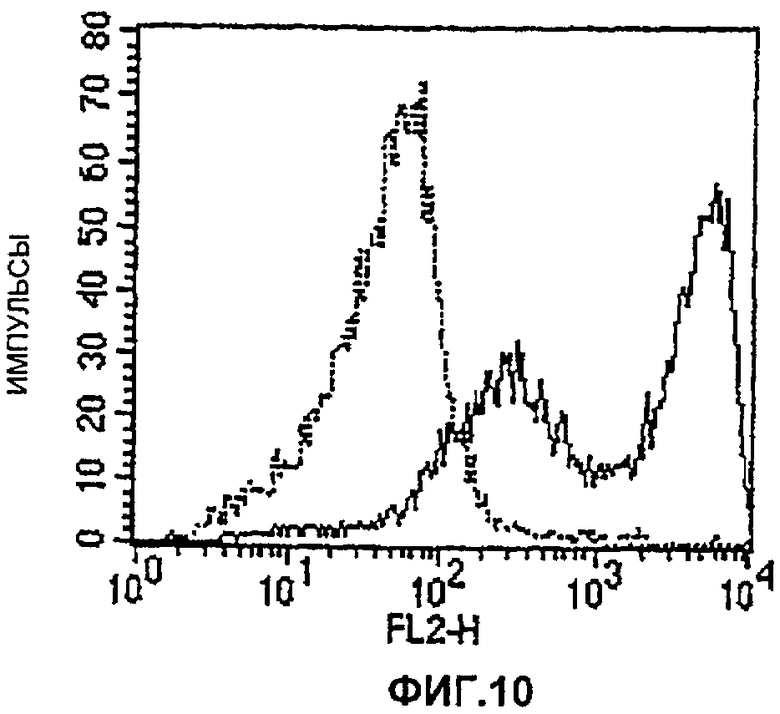
Фиг.10. Анализ клеток СНО с использованием FACS (клеточный сортер с возбуждением флуоресценции), трансфицированных только вектором (тонкая линия) и pCR3GHRGPI (толстая линия), иммуноокрашенных с помощью GHR специфического моноклонального антитела, демонстрирующий, что почти все клетки СНО экспрессируют GHRGPI на высоком уровне.
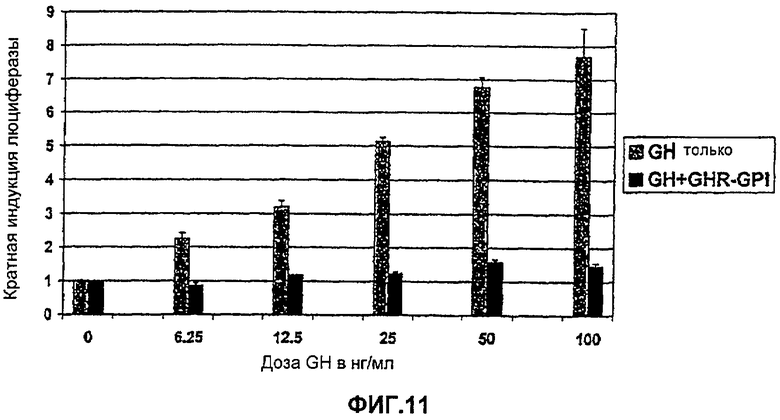
Фиг.11. GH активация Stat5 (кратная индукция люциферазы) в клетках НЕК293, экспрессирующих рецептор GH (только GH), и в клетках, трансфицированных GHRGPI плазмидой. Показывает, что трансгенная экспрессия GHRGPI (внеклеточный домен GHR, связанный с GPI) полностью подавляет передачу сигнала GH.
Фиг.12. Измерение растворимого рецептора GH (GHBP) в среде от клеток млекопитающих, подвергнутых трансфекции различными векторами. Результаты получены с помощью GHBP-LIFA (лиганд-иммунофункциональный анализ) и "<70" означает ниже самого нижнего стандарта анализа. Результаты демонстрируют, что экспрессия GHRGPI в клетках приводит к очень высоким уровням растворимого рецептора в среде.
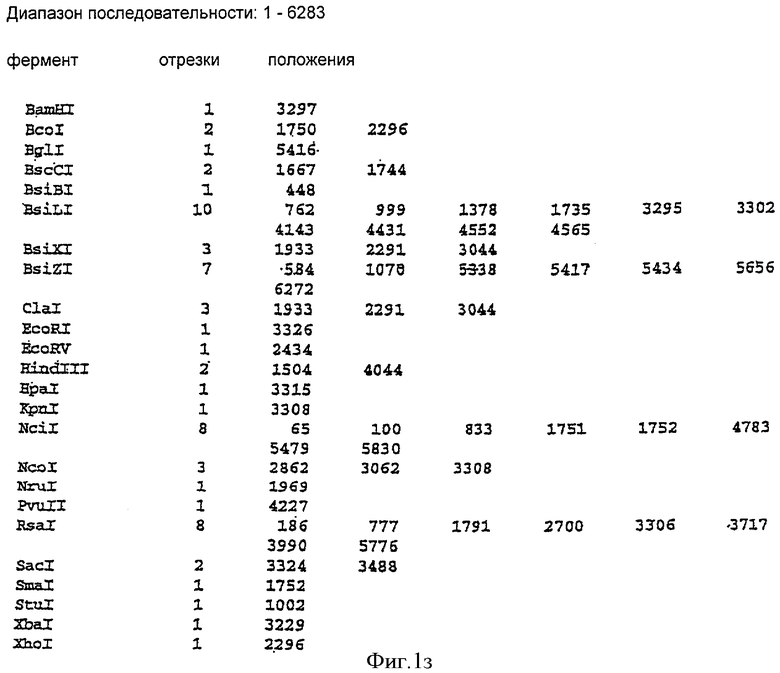
Фиг.13 представляет собой аминокислотную и нуклеотидную последовательность TNF рецептора типа 1. Белковая последовательность Р19438, сигнал - зеленым, а трансмембранная спираль - красным. Последовательность нуклеиновой кислоты Х55313 H.sapiens TNF-R m...[gi:37223]. 256-318 представляют собой сигнал, а 319-888 представляют собой внеклеточные домены.
Фиг.14 представляет собой аминокислотную последовательность рецептор TNF типа 1 - GPI слитого полипептида из вектора pCR3TNFGPI после клонирования внеклеточного домена рецептора TNF в вектор pCR-3GPI_Thy-1 (Фиг.8). Жирным шрифтом показан внеклеточный домен рецептора TNF, подчеркнутый жирный курсив представляет собой сигнал рецептора TNF и подчеркнуто начало GPI сигнала, который отщепляется.
Фиг.15 представляет собой аминокислотную последовательность продукта слияния рецептор лептина - GPI из pCR3ОbRGPI после клонирования внеклеточного домена рецептора лептина (ObR) в вектор pCR-3GPI_Thy-1 (Фиг.8). Курсивом показан сигнал ObR, жирным шрифтом - внеклеточный домен ObR, затем связь с GPI, затем подчеркнут сайт отщепления для GPI.
Фиг.16 представляет собой таблицу каталожных номеров цитокинов.
МАТЕРИАЛЫ И МЕТОДЫ
Очистка внеклеточного домена рецептора цитокина, слитого с GPI, из Dictyostelium и демонстрация антагонистичекой активности
Трансфекция и поддержание штаммов Dictyostelium
Dictyostelium трансфицировали с помощью кальциево-фосфатного способа или электропорации и поддерживали в культуральной среде с G418 для отбора стабильных клонов.
Клонирование и экспрессия химерных полипептидов
кДНК внеклеточного домена человеческого GHR (основания 98-834, каталожный номер Х06562) лигировали в вектор (рАс6-LP-MCS-GPI), содержащий промотор гена актина 6 Dictyostelium, кодирующий район сигнального пептида Dictyostelium, сайт множественного клонирования и сигнал (PSPTPTETAT PSPTPKPTST PEETEAPSSA TTLISPLSLI VIFISFVLLI) для GPI-якоря. Полученный вектор (рАс6-GHR-GPI) трансфицировали в клетки Dictyostelium.
Dictyostelium добавляет N и O-гликозилирования. Клоны, экспрессирующие GHR-GPI, затем отбирали с помощью иммуногистохимии и вестерн-блоттинга с использованием анти-GHR антитела Маb5. GHR-GPI очищали из клеточных лизатов с использованием GH аффинной колонки. Было показано, что очищенный GHR-GPI связывает GH и в биоанализе для GH передачи сигнала GHR-GPI действует как антагонист, ингибирующий передачу сигнала.
Вектор рАс6-LP-MCS-GPI (Фиг.1) расщепляли BamHI и EcoRI. Внеклеточный домен GHR из оснований 98-834 (каталожный номер Х06562) амплифицировали с помощью ПЦР с BamHI и EcoRI сайтами рестрикции 5' и 3' соответственно и затем лигировали в MCS (сайт множественного клонирования) рАс6-LP-MCS-GPI с получением следующего MCS: cag gat cca ttt...GHR 98-834......tac cga att cca (Фиг.2). Кодируемый GHR белок расположен от первого остатка после сигнального пептида млекопитающих до последнего остатка перед трансмембранным доменом. Полученный вектор был назван рАс6-GHR-GPI.
Очистка GHR-GPI
кДНК рАс6-GHR-GPI трансфицировали в клетки Dictyostelium и затем отбирали клоны и проводили скрининг с помощью вестерн-блоттинга с использованием Маb5, моноклонального антитела к внеклеточному домену человеческого GHR. Пять клонов дали четкий сигнал на 40 кДа, ожидаемый размер гликозилированного GHR-GPI (Фиг.4). Иммуноокрашивание одного клона четко идентифицировало GHR-GPI на клеточной поверхности (Фиг.5). Клеточный лизат в 0,1% Triton X100 затем очищали на GH аффинной колонке в PBS (забуференный фосфатами физиологический раствор)/0,1% Triton X100 (Na-фосфат 0,01 М, NaCl 0,15 М, 0,02% NaNO3, 0,1% Triton X-100 Ph 7,4). Примерная концентрация GHR-GPI составляла 120 мкг/мл или 3 мкМ. Функциональную активность очищенного GHRGPI подтверждали путем связывания иодированного GH (Фиг.6).
GH биоанализ
Принятый биоанализ использовали для скрининга на антагонистическую активность (Ross et al., 1997). Перманентную клеточную линию, экспрессирующую полноразмерный GHR, временно трансфицировали люциферазным репортером, который связывает активированный Stat5. Спустя двадцать четыре часа клетки стимулировали GH в течение 6 часов с антагонистом или без него. Клетки затем лизировали и измеряли люциферазную активность. Биоанализ осуществляли в присутствии или в отсутствие GHR-GPI в концентрации приблизительно 10 нМ (Фиг.7). GHR-GPI полностью блокировал передачу сигнала при низких концентрациях GH и вызывал приблизительно 50%-ное снижение передачи сигнала при более высоких концентрациях GH, подтверждая антагонистическое действие GHR-GPI на GH передачу сигнала.
Клонирование продукта слияния внеклеточного домена цитокинового рецептора с GPI в векторе экспрессии млекопитающих и демонстрация антагонистической активности при экспрессии в цитокин-отвечающей клеточной линии
GHR-GPI может действовать в качестве трансгенной терапии
Для демонстрации того, что GHR-GPI может действовать в качестве трансгенной терапии, авторы изобретения клонировали внеклеточный домен GHR выше по течению от сигнальной последовательности человеческого GPI в векторе экспрессии млекопитающих (Фиг.8-9). Эту конструкцию затем трансфицировали в клетки СНО и экспрессию демонстрировали с помощью FACS анализа с использованием моноклонального антитела, специфичного для человеческого GHR (Фиг.10). Уровень связывания на СНО клетках был чрезвычайно высоким. Чтобы протестировать, действует ли экспрессия GHR-GPI на клеточной поверхности в качестве антагониста, GHR-GPI трансфицировали в Hek293 клетки, экспрессирующие GHR дикого типа, и стимулировали GH. Эта совместная экспрессия GHR-GPI полностью блокировала GH передачу сигнала (Фиг.11). В дополнение, среду от клеток, трансфицированных GHR-GPI, анализировали на растворимый рецептор (GHBP), и были обнаружены высокие уровни (Фиг.12), обеспечивающие еще один механизм, с помощью которого трансгенная экспрессия продуктов слияния цитокин-GPI могла бы действовать как антагонист. Другие примеры цитокиновых рецепторов, которые могут быть экспрессированы в качестве GPI продуктов слияния, представляют собой рецепторы TNF и лептина (Фиг.13-16).
ССЫЛКИ
ARGETSINGER L.S. & CARTER-SU С. (1996) Growth hormone signalling mechanisms: involvement of the tyrosine kinase JAK2. [Review] [19 refs]. Hormone Research, 45 Suppl1, 22-24.
CHEN С., BRINKWORTH R. & WATERS M.J. (1997) The role of receptor dimerization domain residues in growth hormone signaling. Journal of Biological Chemistry, 272, 5133-5140.
CHEN W.Y., CHEN N.Y., YUN J., WAGNER Т.Е. & KOPCHICK J.J. (1994) In vitro and in vivo studies of antagonistic effects of human growth hormone analogs [published erratum appears in J Biol Chem 1994 Aug 12; 269(32):20806]. Journal of Biological Chemistry, 269,15892-15897.
CHEN W.Y., WHITE M.E., WAGNER Т.Е. & KOPCHICK J.J. (1991) Functional antagonism between endogenous mouse growth hormone (GH) and a GH analog results in dwarf transgenic mice. Endocrinology, 129, 1402-1408.
CHEN W.Y., WIGHT D.C., MEHTA B.V., WAGNER Т.Е. & KOPCHICK J.J. (1991) Glycine 119 of bovine growth hormone is critical for growth-promoting activity. Molecular Endocrinology, 5,1845-1852.
CHEN W.Y., WIGHT D.C., WAGNER Т.Е. & KOPCHICK J.J. (1990) Expression of a mutated bovine growth hormone gene suppresses growth of transgenic mice. Proceedings of the National Academy of Sciences of the United States of America, 87, 5061-5065.
CLACKSON Т., ULTSCH M.H., WELLS J.A. & DE VOS A.M. (1998) Structural and functional analysis of the 1:1 growth hormone:receptor complex reveals the molecular basis for receptor affinity. Journal of Molecular Biology, 277, 1111-1128.
CUNNINGHAM B.C., ULTSCH M., DE VOS A.M., MULKERRIN M.G., CLAUSER K.R. & WELLS J.A. (1991) Dimerization of the extracellular domain of the human growth hormone receptor by a single hormone molecule. Science, 254, 821-825.
DA COSTA C.R. & JOHNSTONE A.P. (1998) Production of the thyrotrophin receptor extracellular domain as a glycosylphosphatidylinositol-anchored membrane protein and its interaction with thyrotrophin and autoantibodies. Journal of Biological Chemistry, 273, 11874-11880.
DE VOS A.M., ULTSCH M. & KOSSIAKOFF A.A. (1992) Human growth hormone and extracellular domain of its receptor: crystal structure of the complex. Science, 255, 306-312.
FUH G., CUNNINGHAM B.C., FUKUNAGA R., NAGATA S., GOEDDEL D.V. & WELLS J.A. (1992) Rational design of potent antagonists to the human growth hormone receptor. Science, 256, 1677-1680.
KISHIMOTO Т., TAGA Т. & AKIRA S. (1994) Cytokine signal transduction. [Review] [92 refs]. Cell, 76, 253-262.
MAAMRA M., FINIDORI J., VON LADE S., SIMON S., JUSTICE S., WEBSTER J., DOWER & ROSS R. (1999) Studies with a growth hormone antagonist and dual-fluorescent confocal microscopy demonstrate that the full-length human growth hormone receptor, but not the truncated isoform, is very rapidly internalized independent of Jak2-Stat5 signaling. Journal of Biological Chemistry, 274, 14791-14798.
MELLADO M., RODRIGUEZ-FRADE J.M., KREMER L., VON KOBBE C., DE ANA A.M., MERIDA I. & MARTINEZ A. (1997) Conformational changes required in the human growth hormone receptor for growth hormone signaling. Journal of Biological Chemistry, 272, 9189-9196.
MULLER-NEWEN G., KOHNE C. & HEINRICH P.C. (1996) Soluble receptors for cytokines and growth factors. [Review] [58 refs]. International Archives of Allergy & Immunology, 111, 99-106.
ROSS R.J., ESPOSITO N., SHEN X.Y., VON LAUE S., CHEW S.L., DOBSON P.R., POSTEL-VINAY M.C. & FINIDORI J. (1997) A short isoform of the human growth hormone receptor functions as a dominant negative inhibitor of the full-length receptor and generates large amounts of binding protein. Molecular Endocrinology, 11, 265-273.
ROSS R.J.M., LEUNG K.C., MAAMRA M., BENNETT W., DOYLE N., WATERS M.J. & HO, k.k.y. (2000) Binding and functional studies with the growth hormone receptor antagonist, B2036-PEG (pegvisomant), reveal effects of pegylation. Journal of Clinical Endocrinology & Metabolism, In press.
SUNDSTROM M., LUNDQVIST Т., RODIN J., GIEBEL L.B., MILLIGAN D. & NORSTEDT G. (1996) Crystal structure of an antagonist mutant of human growth hormone, G120R, in complex with its receptor at 2.9 A resolution. Journal of Biological Chemistry, 271, 32197-32203.
THORNER M.0., STRASBURGER C.J., WU Z., STRAUME M., BIDLINGMAIER M., PEZZOLI S., ZIB K., SCARLETT J.C. & BENNETT W.F. (1999) Growth hormone (GH) receptor blockade with a PEG-modified GH (B2036-PEG) lowers serum insulin-like growth factor-l but does not acutely stimulate serum GH. Journal of Clinical Endocrinology & Metabolism, 84, 2098-2103.

















Изобретение относится к биотехнологии. Предложены варианты слитого белка, которые содержат внеклеточный домен человеческого рецептора гормона роста и домен, который включает в себя сигнальную последовательность для присоединения гликозилфосфатидилинозитовых (GPI) якорей. Изобретение также относится к способу получения и очистки данного слитого белка и фармацевтической композиции на его основе. Изобретение позволяет создать эффективное лекарственное средство для лечения акромегалии и гигантизма. 6 н. и 2 з.п. ф-лы, 16 ил.
(1) выращивание клетки, трансфицированной нуклеиновой кислотой или вектором, кодирующими слитый белок по любому из пп.1-3, в условиях, подходящих для производства указанного слитого белка; и
(2) очистку указанного слитого белка от указанной клетки или окружающей среды ее роста.
(1) выращивание клетки, трансфицированной нуклеиновой кислотой или вектором, кодирующими слитый белок по любому из пп.1 или 3, в условиях, подходящих для производства указанного слитого белка; и
(2) очистку указанного слитого белка от указанной клетки или окружающей среды ее роста.
Приоритеты: 13.10.2001; 16.01.2002; 14.08.2002 - все пункты формулы изобретения.
| WO 9900423 A1, 07.01.1999 | |||
| EP 0976764 A1, 02.02.2002. |
Авторы
Даты
2008-12-10—Публикация
2002-10-11—Подача