ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет в соответствии с § 119(e) раздела 35 Свода федеральных законов США на основании предварительной заявки на патент США № 61/984561, поданной 25 апреля 2014 года, которая включена в данный документ посредством ссылки во всей своей полноте.
ЗАЯВЛЕНИЕ В ОТНОШЕНИИ ПЕРЕЧНЯ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Перечень последовательностей, связанный с настоящей заявкой, предоставлен в виде файла в текстовом формате вместо бумажной копии и, тем самым, включен посредством ссылки в настоящее описание. Название текстового файла, содержащего перечень последовательностей, BLBD_027_01WO_ST25.txt. Текстовый файл размером 27 килобайт, был создан 24 апреля 2015 года и предоставляется на рассмотрение в электронном виде посредством EFS-Web одновременно с подачей настоящего описания.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область техники
Настоящее изобретение относится к улучшенным композициям и способам лечения рака или опухоли. Более конкретно, настоящее изобретение относится к улучшенным векторам, содержащим химерные антигенные рецепторы (CAR), к иммунным эффекторным клеткам, генетически модифицированным с помощью векторов для экспрессии таких CAR, и к применению таких композиций для эффективного лечения различных форм рака или опухолей.
Описание предшествующего уровня техники
Рак является серьезной проблемой здравоохранения по всему миру. На основании показателей по 2008-2010 годам у 40,76% мужчин и женщин, родившихся на сегодняшний день, будет диагностирована та или иная форма рака в то или иное время в течение их жизни. У мужчин в возрасте от 50 до 70 лет рак разовьется с вероятностью 20,37%, а у женщин с вероятностью 15,30%. На 1 января 2010 года в Соединенных Штатах насчитывалось приблизительно 13027914 живых мужчин и женщин, у которых в анамнезе был рак - 6078974 мужчин и 6948940 женщин. По оценкам, у 1660290 мужчин и женщин (854790 мужчин и 805500 женщин) в Соединенных Штатах будет диагностирован рак и 580,350 мужчин и женщин умрут от рака различных локализаций в 2013 году. Howlader et al. 2013.
Несмотря на то что были достигнуты успехи в выявлении, предупреждении и лечении рака, универсально успешную терапевтическую стратегию еще предстоит реализовать. Реакция различных форм рака на лечение является разнородной. Традиционные методы лечения форм рака, в том числе химиотерапия и лучевая терапия, имеют ограниченное применение в силу токсических побочных эффектов. Иммунотерапия с терапевтическими антителами также обеспечивает ограниченный успех, отчасти из-за неудовлетворительных фармакокинетических профилей, быстрой элиминации антител под действием сывороточных протеаз и клубочковой фильтрации, а также из-за ограниченного проникновения в локализацию опухоли и ограниченных уровней экспрессии целевого антигена на опухолевых клетках. Попытки применения генетически модифицированных клеток, экспрессирующих химерные антигенные рецепторы (CAR), также имели ограниченный успех из-за слабого in vivo размножения Т-клеток с CAR, быстрого исчезновения клеток после инфузии и не оправдывающей ожиданий клинической активности.
Таким образом, в данной области техники существует потребность в более эффективных композициях и способах лечения рака с клинической точки зрения.
КРАТКОЕ ОПИСАНИЕ
В настоящем изобретении в целом предусмотрены улучшенные векторные структуры для получения терапевтических T-клеток.
В различных вариантах осуществления предусмотрен полинуклеотид, содержащий промотор (MND) с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля, с сайтом связывания праймера, замещенным на последовательность из dl587rev, функционально связанный с химерным антигенным рецептором (CAR).
В конкретных вариантах осуществления CAR содержит внеклеточный домен, который связывает антиген, выбранный из группы, включающей фолатный рецептор альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, 'глипикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепь, Lewis-Y, каппа-цепь, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM и VEGFR2; трансмембранный домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD28, CD45, PD1 и CD152; один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD54 (ICAM), CD134 (OX40), CD137 (41BB), CD152 (CTLA4), CD273 (PD-L2), CD274 (PD-L1) и CD278 (ICOS); и домен передачи первичного сигнала CD3ζ.
В некоторых вариантах осуществления внеклеточный домен содержит антитело или антиген-связывающий фрагмент, которые связывают антиген.
В конкретных вариантах осуществления антитело или антиген-связывающий фрагмент, которые связывают полипептид легкой каппа-цепи, выбран из группы, включающей верблюжий Ig, IgNAR, Fab-фрагменты, Fab'-фрагменты, F(ab)'2-фрагменты, F(ab)'3-фрагменты, Fv, одноцепочечное Fv-антитело («scFv»), бис-scFv, (scFv)2, минитело, диатело, триатело, тетратело, стабилизированный дисульфидными связями Fv-белок («dsFv») и однодоменное антитело (sdAb, нанотело).
В дополнительных вариантах осуществления антитело или антиген-связывающий фрагмент, которые связывают полипептид легкой каппа-цепи, представляет собой scFv.
В определенных вариантах осуществления антитело представляет собой человеческое антитело, мышиное антитело или гуманизированное антитело.
В конкретных вариантах осуществления трансмембранный домен получен из CD8α.
В конкретных вариантах осуществления один или более доменов передачи костимулирующего сигнала выбраны из группы, включающей CD28, CD134 и CD137.
В некоторых вариантах осуществления CAR содержит два или более доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD134 и CD137.
В некоторых вариантах осуществления один или более доменов передачи костимулирующего сигнала представляют собой CD28.
В конкретных вариантах осуществления один или более доменов передачи костимулирующего сигнала представляют собой CD134.
В определенных вариантах осуществления один или более доменов передачи костимулирующего сигнала представляют собой CD137.
В конкретных вариантах осуществления CAR дополнительно содержит полипептид шарнирной области.
В дополнительных вариантах осуществления полипептид шарнирной области содержит шарнирную область из PD1, CD152 или CD8α.
В дополнительных вариантах осуществления полипептид шарнирной области содержит шарнирную область из PD1.
В дополнительных вариантах осуществления полипептид шарнирной области содержит шарнирную область из CD152.
В дополнительных вариантах осуществления полипептид шарнирной области содержит шарнирную область из CD8α.
В некоторых вариантах осуществления CAR дополнительно содержит спейсерную область.
В дополнительных вариантах осуществления полипептид спейсерной области содержит CH2- и CH3-области из IgG1.
В определенных вариантах осуществления CAR дополнительно содержит сигнальный пептид.
В конкретных вариантах осуществления сигнальный пептид содержит сигнальный полипептид тяжелой цепи IgG1, сигнальный полипептид CD8α или сигнальный пептид альфа-субъединицы рецептора GM-CSF человека.
В некоторых вариантах осуществления полинуклеотид кодирует CAR, изложенный под любой из SEQ ID NO: 2-3.
В различных вариантах осуществления предусмотрен вектор, содержащий полинуклеотид, кодирующий CAR, рассматриваемый в любом из предыдущих вариантов осуществления или в вариантах осуществления, рассмотренных в других частях данного документа.
В дополнительных вариантах осуществления вектор представляет собой вектор экспрессии.
В дополнительных вариантах осуществления вектор представляет собой вирусный вектор.
В конкретных вариантах осуществления вектор представляет собой ретровирусный вектор.
В конкретных вариантах осуществления вектор представляет собой лентивирусный вектор.
В дополнительных вариантах осуществления лентивирусный вектор выбран из группы, по существу состоящей из вируса иммунодефицита человека (HIV); вируса висна-маэди (VMV); вируса артрита-энцефалита коз (CAEV); вируса инфекционной анемии лошадей (EIAV); вируса иммунодефицита кошек (FIV); вируса иммунодефицита крупного рогатого скота (BIV) и вируса иммунодефицита обезьян (SIV).
В определенных вариантах осуществления CAR дополнительно содержит левый (5') ретровирусный LTR, Psi (ψ) сигнал упаковки, центральный полипуриновый тракт/ДНК-флэп (cPPT/FLAP), ретровирусный экспортный элемент; MND-промотор, функционально связанный с CAR по любому из пп. 1-19; и правый (3') ретровирусный LTR.
В дополнительных вариантах осуществления CAR дополнительно содержит гетерологичную последовательность полиаденилирования.
В дополнительных вариантах осуществления последовательность полиаденилирования представляет собой последовательность полиаденилирования бычьего гормона роста или сигнальную последовательность полиаденилирования β-глобина кролика.
В конкретных вариантах осуществления CAR дополнительно содержит посттранскрипционный регуляторный элемент вируса гепатита В (HPRE) и посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE).
В некоторых вариантах осуществления промотор 5' LTR замещен гетерологичным промотором.
В определенных вариантах осуществления гетерологичный промотор представляет собой промотор цитомегаловируса (CMV), промотор вируса саркомы Рауса (RSV) или промотор вируса обезьян 40 (SV40).
В дополнительных вариантах осуществления 5' LTR или 3' LTR представляет собой LTR лентивируса.
В дополнительных вариантах осуществления 3' LTR содержит одну или более модификаций.
В конкретных вариантах осуществления 3' LTR содержит одну или более делеций.
В определенных вариантах осуществления 3' LTR представляет собой самоинактивирующийся (SIN) LTR.
В конкретных вариантах осуществления полинуклеотид, который кодирует CAR, содержит оптимизированную последовательность Козак.
В различных вариантах осуществления предусмотрена иммунная эффекторная клетка, содержащая вектор, описываемый в любом из предыдущих вариантов осуществления или в вариантах осуществления, описанных в других частях данного документа.
В некоторых вариантах осуществления иммунная эффекторная клетка представляет собой T-лимфоцит.
В различных вариантах осуществления предусмотрена композиция, содержащая иммунную эффекторную клетку, рассматриваемую в любом из предыдущих вариантов осуществления или в вариантах осуществления, рассмотренных в других частях данного документа, а также физиологически приемлемый наполнитель.
В различных вариантах осуществления предусмотрен способ получения иммунной эффекторной клетки, включающий введение в иммунную эффекторную клетку вектора, рассматриваемого в данном документе, стимуляцию клеток и индукцию пролиферации клеток посредством приведения клеток в контакт с антителами, которые связывают CD3, и антителами, которые связывают CD28, с получением тем самым иммунной эффекторной клетки.
В дополнительных вариантах осуществления иммунные эффекторные клетки стимулируют и индуцируют к пролиферации до введения вектора.
В конкретных вариантах осуществления иммунные эффекторные клетки содержат T-лимфоциты.
В различных вариантах осуществления предусмотрен способ получения иммунной эффекторной клетки, содержащей полинуклеотид, рассмотренный в данном документе, включающий выделение CD34+ клеток из костного мозга, пуповинной крови или мобилизованных клеток периферической крови от субъекта и введение вектора, рассмотренного в данном документе в выделенные CD34+ клетки.
В дополнительных вариантах осуществления CD34+ клетки предварительно стимулируют с помощью одного или более цитокинов, выбранных из группы, включающей лиганд FLT3, TPO, SCF, IL-3 и IL-6, до введения вектора по любому из пп. 20-36.
В различных вариантах осуществления предусмотрен способ лечения рака у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества композиции, рассмотренной в данном документе.
В определенных вариантах осуществления рак выбран из группы, включающей опухоль Вильмса, саркому Юинга, нейроэндокринную опухоль, глиобластому, нейробластому, меланому, рак кожи, рак молочной железы, рак толстой кишки, рак прямой кишки, рак предстательной железы, рак печени, рак почки, рак поджелудочной железы, рак легкого, рак желчевыводящей системы, рак шейки матки, рак эндометрия, рак пищевода, рак желудка, рак головы и шеи, медуллярный рак щитовидной железы, рак яичника, глиому, лимфому, лейкоз, миелому, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический лимфолейкоз, хронический миелогенный лейкоз, лимфому Ходжкина, неходжкинскую лимфому и рак мочевого пузыря.
В конкретных вариантах осуществления рак представляет собой рак поджелудочной железы, и внеклеточный связывающий домен связывает эпитоп PSCA или MUC1.
В дополнительных вариантах осуществления рак представляет собой рак мочевого пузыря, и внеклеточный связывающий домен связывает эпитоп PSCA или MUC1.
В конкретных вариантах осуществления рак представляет собой мультиформную глиобластому, и внеклеточный связывающий домен связывает эпитоп EPHA2, EGFRvIII или CSPG4.
В конкретных вариантах осуществления рак представляет собой рак легкого, и внеклеточный связывающий домен связывает эпитоп PSCA или GD2.
В определенных вариантах осуществления рак представляет собой рак молочной железы, и внеклеточный связывающий домен связывает эпитоп CSPG4 или HER2.
В некоторых вариантах осуществления рак представляет собой меланому, и внеклеточный связывающий домен связывает эпитоп CSPG4 или GD2.
В различных вариантах осуществления предусмотрен способ лечения гемобластоза у субъекта, нуждающегося в этом, включающий введение субъекту терапевтически эффективного количества композиции, рассмотренной в данном документе.
В дополнительных вариантах осуществления гемобластоз представляет собой B-клеточное новообразование, выбранное из группы, включающей множественную миелому (MM), хронический лимфолейкоз (CLL) или неходжкинскую лимфому (NHL).
В конкретных вариантах осуществления MM выбрана из группы, включающей клинически выраженную множественную миелому, вялотекущую множественную миелому, плазмоцитарный лейкоз, несекреторную миелому, IgD-миелому, остеосклеротическую миелому, солитарную плазмацитому кости и экстрамедуллярную плазмацитому.
В определенных вариантах осуществления NHL выбрана из группы, включающей лимфому Беркитта, хронический лимфолейкоза/мелкоклеточную лимфоцитарную лимфому (CLL/SLL), диффузную В-крупноклеточную лимфому, фолликулярную лимфому, иммунобластную крупноклеточную лимфому, лимфобластную лимфому из B-клеток-предшественников и лимфому из клеток мантийной зоны.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ АСПЕКТОВ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 показана структура конструкции pMND-CD19-CAR (A) и конструкции pMND-каппаLC-CAR (B).
На фигуре 2 показана карта вектора для pMND-CD19-CAR.
На фигуре 3 показана карта вектора для pMND-каппаLC-CAR.
На фигуре 4 показано число копий вектора (VCN) для интегрированных лентивирусных частиц pMND-каппаLC-CAR. VCN определяли с помощью q-PCR через девять дней после трансдукции. Каждый кружок изображает индивидуальную культуру, полученную параллельно с соответствующими культурами немодифицированных Т-клеток (квадратик). Показаны данные для 12 индивидуальных культур, полученных от 6 доноров. Среднее значение и стандартное отклонение обозначены линией и «усами».
На фигуре 5 показана экспрессия каппаLC в Т-клетках, трансдуцированных с помощью pMND-каппаLC-CAR. Экспрессию CAR в Т-клетках определяли при помощи проточной цитометрии через 6-9 дней после трансдукции. Каждый кружок изображает индивидуальную культуру, полученную параллельно с соответствующими культурами немодифицированных Т-клеток (квадратик). Показаны данные для 12 индивидуальных культур, полученных от 6 доноров. Среднее значение и стандартное отклонение обозначены линией и «усами».
На фигуре 6 показана соизмеримая трансдукция и экспрессия CD19-CAR в Т-клетках, трансдуцированных с помощью лентивирусных векторов pMND- или pEF1α-CD19-CAR. Данные векторы применяли для трансдукции соответствующих параллельных культур первичных человеческих Т-клеток. Экспрессию CAR в Т-клетках определяли при помощи проточной цитометрии через 6 дней после трансдукции. Число копий вектора (VCN) интегрированных лентивирусных частиц определяли с помощью количественной ПЦР через девять после трансдукции.
На фигуре 7 показана специфическая реактивность в отношении опухоли у Т-клеток, модифицированных с помощью pMND-каппаLC-CAR. Модифицированные Т-клетки совместно культивировали с каппа+ клетками Дауди или каппа- клетками HDLM-2 в течение 24 часов. Опухолеспецифическое высвобождение IFN-γ анализировали при помощи ELISA. Показаны данные для 5 индивидуальных культур Т-клеток от 4 доноров.
На фигуре 8 показан регресс развившихся опухолей Дауди после адоптивного переноса Т-клеток, модифицированных с помощью pMND-каппаLC CAR. Модифицированные Т-клетки применяли для обработки мышей с развившимися опухолями Daudi. Опухолевую нагрузку после обработки отслеживали посредством визуализации in vivo по сравнению с необработанными контрольными животными. Представлены данные для двух независимых экспериментов.
На фигуре 9 показан антиген-специфический клиренс опухоли при помощи Т-клеток, экспрессирующих CAR. (A). Т-клетки, экспрессирующие CAR к BCMA, приводили к цитолизу опухолевых клеток, экспрессирующих BCMA, меченых при помощи сложного сукцинимидилового эфира карбоксифлуоресцеина (CFSE); флуоресценцию измеряли при помощи FACS. (B). Т-клетки, экспрессирующие CAR к BCMA, совместно культивировали с клетками K562 или клетками K562, модифицированными для экспрессии BCMA, и супернатанты собирали через 24 часа и анализировали высвобождение IFN-γ при помощи ELISA. (n=3).
КРАТКОЕ ОПИСАНИЕ ИДЕНТИФИКАТОРОВ ПОСЛЕДОВАТЕЛЬНОСТИ
В SEQ ID NO: 1 изложена полинуклеотидная последовательность промотора (MND) с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля, с сайтом связывания праймера, замещенным на последовательность из dl587rev.
В SEQ ID NO: 2 изложена полинуклеотидная последовательность конструкции, содержащей MND-промотор и CAR к CD19.
В SEQ ID NO: 3 изложена полинуклеотидная последовательность конструкции, содержащей MND-промотор и CAR к легкой каппа-цепи.
ПОДРОБНОЕ ОПИСАНИЕ
A. Обзор
Настоящее изобретение в целом относится к улучшенным композициям и способам лечения рака, в том числе без ограничения опухолей или форм рака печени, поджелудочной железы, легкого, молочной железы, мочевого пузыря, головного мозга, кости, щитовидной железы, почки, кожи и системы кроветворения. В частности, настоящее изобретение относится к адоптивной клеточной терапии иммунными эффекторными клетками, генетически модифицированными с помощью векторов, содержащих промотор (MND) с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля, с сайтом связывания праймера, замещенным на последовательность из dl587rev, функционально связанный с химерным антигенным рецептором.
Генетические подходы предлагают потенциальные средства усиления иммунного распознавания и элиминации раковых клеток. Одна перспективная стратегия представляет собой создание методами генной инженерии иммунных эффекторных клеток для экспрессии химерных антигенных рецепторов, которые перенаправляют цитотоксичность на опухолевые клетки. Однако существующие методы адоптивной клеточной иммунотерапии для лечения опухолей или форм рака не обладают стойкими достаточными уровнями экспрессии CAR в терапевтических клетках. Соответственно, такие методы терапии не являются оптимальными с клинической точки зрения и, таким образом, в данной области техники остается потребность в более эффективных способах терапии В-клеточных новообразований, которые щадили бы гуморальный иммунитет.
В улучшенных композициях и способах адоптивной клеточной терапии, раскрытых в данном документе, предусмотрены генетически модифицированные иммунные эффекторные клетки, которые можно легко размножить, которые проявляют долгосрочную персистенцию in vivo и обеспечивают стойкую и достаточную экспрессию полипептидов CAR. Не желая быть связанным какой-либо конкретной теорией, в настоящем изобретении рассмотрено, в частности, неожиданное наблюдение, что MND-промотор управляет стабильной экспрессией полипептидов CAR в T-клетках, находящихся в состоянии покоя, активированных и размножающихся, и что такая экспрессия является достаточной для эффективного перенаправления генетически модифицированных иммунных эффекторных клеток, рассмотренных в данном документе, чтобы вызвать цитотоксическую активность против опухолевой или раковой клетки.
В одном варианте осуществления полинуклеотид содержит MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, при этом CAR содержит внеклеточный домен, который связывает целевой антиген, трансмембранный домен и один или более внутриклеточных доменов передачи сигнала.
В одном варианте осуществления Т-клетка является генетически модифицированной с помощью вектора, содержащего MND-промотор, функционально связанный с CAR, рассмотренным в данном документе. Т-клетки, экспрессирующие CAR, в данном документе называют CAR-Т-клетки или CAR-модифицированные Т-клетки.
В различных вариантах осуществления генетически модифицированные CAR-Т-клетки, рассмотренные в данном документе, вводят пациенту с раком или опухолью.
При осуществлении настоящего изобретения на практике будут использоваться, если не указано иное, традиционные методы химии, биохимии, органической химии, молекулярной биологии, микробиологии, методики рекомбинантной ДНК, генетики, иммунологии и клеточной биологии, находящиеся в пределах компетенции специалистов в данной области, многие из которых описаны ниже с целью иллюстрации. Такие методики в полном объеме объясняются в литературе. См., например, Sambrook, et al., Molecular Cloning: A Laboratory Manual (3rd Edition, 2001); Sambrook, et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Maniatis et al., Molecular Cloning: A Laboratory Manual (1982); Ausubel et al., Current Protocols in Molecular Biology (John Wiley and Sons, дополнено в июле 2008); Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience; Glover, DNA Cloning: A Practical Approach, vol. I & II (IRL Press, Oxford, 1985); Anand, Techniques for the Analysis of Complex Genomes, (Academic Press, New York, 1992); Transcription and Translation (B. Hames & S. Higgins, Eds., 1984); Perbal, A Practical Guide to Molecular Cloning (1984); Harlow and Lane, Antibodies, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1998) Current Protocols in Immunology Q. E. Coligan, A. M. Kruisbeek, D. H. Margulies, E. M. Shevach and W. Strober, eds., 1991); Annual Review of Immunology; а также монографии в журналах, таких как Advances in Immunology.
Все публикации, патенты и патентные заявки, цитируемые в данном документе, тем самым включены посредством ссылки во всей своей полноте.
B. Определения
Если не определено иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое общеизвестно обычным специалистам в области техники, к которой относится настоящее изобретение. Хотя при осуществлении настоящего изобретения на практике или при его тестировании могут быть использованы любые способы и материалы, аналогичные или эквивалентные описанным в данном документе, предпочтительные варианты осуществления композиций, способов и материалов описаны в данном документе. Для целей настоящего изобретения ниже определены следующие термины.
Формы единственного и множественного числа, используемые в данном документе, обозначают один или несколько (т.е. по меньшей мере один) грамматических объектов предмета. В качестве примера, «элемент» означает один элемент или несколько элементов.
Используемый в данном документе термин «приблизительно» или «примерно» относится к количеству, уровню, значению, числу, частоте, процентной доле, измерению, размеру, величине, весу или длине, которые варьируют вплоть до 30, 25, 20, 25, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1% относительно эталонного количества, уровня, значения, числа, частоты, процентной доли, измерения, размера, величины, веса или длины. В конкретных вариантах осуществления термины «приблизительно» или «примерно», когда употребляются перед числовым значением, указывают на значение плюс или минус диапазон, составляющий 15%, 10%, 5% или 1%.
На протяжении настоящего описания, если контекст не требует иного, слова «содержат», «содержит» и «содержащий» следует понимать как подразумевающий включение указанной стадии, или элемента, или группы стадий или элементов, но не исключение любой другой стадии, или элемента, или группы стадий или элементов. Под «состоящий из» подразумевают включение и ограничение тем, что следует за фразой «состоящий из». Таким образом, фраза «состоящий из» указывает на то, что перечисленные элементы являются необходимыми или обязательными, и что никакие другие элементы не могут присутствовать. Под «по существу состоящий из» подразумевают включение любых элементов, перечисленные после данной фразы, и ограничение другими элементами, которые не препятствуют активности или действиям, указанным в настоящем раскрытии в отношении перечисленных элементов, или способствуют им. Таким образом, фраза «по существу состоящий из» указывает на то, что перечисленные элементы являются необходимыми или обязательными, но другие элементы являются необязательными и могут присутствовать или отсутствовать в зависимости от того, влияют ли они на активность или действие перечисленных элементов
Ссылка на протяжении настоящего описания на «один вариант осуществления», «вариант осуществления», «конкретный вариант осуществления», «сходный вариант осуществления», «определенный вариант осуществления», «дополнительный вариант осуществления» или «еще один вариант осуществления» или их комбинации означает, что конкретный признак, структура или характеристика, описанные в связи с данным вариантом осуществления, включены по меньшей мере в один из вариантов осуществления настоящего изобретения. Таким образом, появление всех вышеприведенных фраз в различных местах на протяжении настоящего описания не обязательно относится к одному варианту осуществления. Более того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом в одном или более вариантах осуществления.
C. Химерные антигенные рецепторы
В различных вариантах осуществления настоящего изобретения предусмотрены иммунные эффекторные клетки, полученные методами генной инженерии с помощью векторов, разработанных для экспрессии химерных антигенных рецепторов, которые перенаправляют цитотоксичность на опухолевые клетки. Такие полученные методами генной инженерии рецепторы в данном документе называют химерными антигенными рецепторами (CAR). CAR представляют собой молекулы, в которых объединена специфичность антитела к целевому антигену (например, опухолевому антигену) с внутриклеточным активирующим доменом Т-клеточного рецептора с получением химерного белка, который проявляет специфическую противоопухолевую клеточную иммунную активность. Используемый в данном документе термин «химерный» обозначает составленный из частей различных белков или ДНК из различных источников.
Векторы, рассмотренные в данном документе, содержат MND-промотор и полинуклеотид, кодирующий CAR. CAR, рассмотренные в данном документе, содержат внеклеточный домен, который связывается со специфическим целевым антигеном (также называемый связывающий домен или антиген-специфический связывающий домен), трансмембранный домен и внутриклеточный домен передачи сигнала. Сцепление антиген-связывающего домена CAR с его целевым антигеном на поверхности целевой клетки приводит к образованию кластеров из CAR и направляет стимул активации в CAR-содержащие клетки. Основной характеристикой CAR является их способность перенаправлять специфичность иммунной эффекторной клетки, запуская тем самым пролиферацию, продукцию цитокинов, фагоцитоз или продукцию молекул, которые могут опосредовать клеточную гибель клетки, экспрессирующей целевой антиген, независимым от главного комплекса гистосовместимости (MHC) способом, с использованием специфических в отношении клетки нацеливающих способностей моноклональных антител, растворимых лигандов или специфических в отношении клетки корецепторов.
В конкретных вариантах осуществления CAR содержит внеклеточный связывающий домен, включающий без ограничения антитело или его антиген-связывающий фрагмент, связанный лиганд или внеклеточный домен корецептора, который специфически связывает целевой антиген, выбранный из группы, включающей фолатный рецептор альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, 'глипикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепь, Lewis-Y, каппа-цепь, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM и VEGFR2; один или более шарнирных доменов или спейсерных доменов; трансмембранный домен, в том числе без ограничения трансмембранные домены из CD8α, CD4, CD45, PD1 и CD152; один или более внутриклеточных доменов передачи костимулирующего сигнала, в том числе без ограничения внутриклеточные домены передачи костимулирующего сигнала из CD28, CD54 (ICAM), CD134 (OX40), CD137 (41BB), CD152 (CTLA4), CD273 (PD-L2), CD274 (PD-L1) и CD278 (ICOS); и домен передачи первичного сигнала из CD3ζ или FcRγ.
1. Связывающий домен
В конкретных вариантах осуществления CAR, рассмотренные в данном документе, содержат внеклеточный связывающий домен, который специфически связывается с целевым полипептидом, например, целевым антигеном, экспрессируемым на опухолевой клетке. Используемые в данном документе термины «связывающий домен», «внеклеточный домен», «внеклеточный связывающий домен», «антиген-специфический связывающий домен» и «внеклеточный антиген-специфический связывающий домен» являются взаимозаменяемыми и предусматривают CAR с возможностью специфично связываться с целевым антигеном, представляющим интерес. Связывающий домен может содержать любой белок, полипептид, олигопептид или пептид, который обладает способностью специфически распознавать и связываться с биологической молекулой (например, рецептором клеточной поверхности или опухолевым белком, липидом, полисахаридом или другой целевой молекулой клеточной поверхности или их компонентом). Связывающий домен включает любого встречающегося в природе, синтетического, полусинтетического или полученного рекомбинантным путем партнера по связыванию для биологической молекулы, представляющей интерес.
Термины «аффинность специфического связывания», или «специфически связывает», или «специфически связанный», или «специфическое связывание», или «специфически нацеливает», используемые в данном документе, описывают связывание одной молекулы с другой с большей аффинностью связывания, чем фоновое связывание. Связывающий домен (или CAR, содержащий связывающий домен, или белок слияния, содержащий связывающий домен) «специфически связывается» с целевой молекулой, если он связывается или ассоциируется с целевой молекулой с аффинностью или Ka (т.е. равновесной константой ассоциации конкретного взаимодействия связывания в единицах 1/M), например, большей или равной приблизительно 105 M-1. В определенных вариантах осуществления связывающий домен (или белок слияния на его основе) связывается с мишенью с Ka, большей или равной приблизительно 106 M-1, 107 M-1, 108 M-1, 109 M-1, 1010 M-1, 1011 M-1, 1012 M-1 или 1013 M-1. Связывающими доменами (или одноцепочечными белками слияния на их основе) с «высокой аффинностью» называют связывающие домены с Ka, составляющей по меньшей мере 107 M-1, по меньшей мере 108 M-1, по меньшей мере 109 M-1, по меньшей мере 1010 M-1, по меньшей мере 1011 M-1, по меньшей мере 1012 M-1, по меньшей мере 1013 M-1 или более.
В качестве альтернативы аффинность можно определить как равновесную константу диссоциации (Kd) конкретного взаимодействия связывания в единицах M (например, от 10-5 M до 10-13 M или менее). Аффинность полипептидов связывающего домена и CAR-белков согласно настоящему раскрытию можно легко определить с применением традиционных методик, например, с помощью конкурентного ELISA (твердофазного иммуноферментного анализа), или анализов ассоциации связывания или замещения с применением меченых лигандов, или с применением устройства для поверхностного плазмонного резонанса, такого как Biacore T100, доступного от компании Biacore, Inc., Писктавей, Нью-Джерси, или технологии оптического биосенсора, такой как система EPIC или EnSpire, доступных от компании Corning и Perkin Elmer, соответственно (см. также, например, Scatchard et al. (1949) Ann. N.Y. Acad. Sci. 51:660; патенты США №№ 5283173; 5468614 или аналогичные).
В одном варианте осуществления аффинность специфического связывания приблизительно в 2 раза превышает аффинность фонового связывания, приблизительно в 5 раз превышает аффинность фонового связывания, приблизительно в 10 раз превышает аффинность фонового связывания, приблизительно в 20 раз превышает аффинность фонового связывания, приблизительно в 50 раз превышает аффинность фонового связывания, приблизительно в 100 раз превышает аффинность фонового связывания или приблизительно в 1000 раз превышает аффинность фонового связывания или больше.
В конкретных вариантах осуществления внеклеточный связывающий домен CAR содержит антитело или его антиген-связывающий фрагмент. Термин «антитело» относится к связывающему агенту, который представляет собой полипептид, содержащий по меньшей мере вариабельную область легкой цепи или тяжелой цепи иммуноглобулина, которая специфически распознает и связывает эпитоп антигена, такого как пептид, липид, полисахарид или нуклеиновая кислота, содержащий антигенную детерминанту, распознаваемую иммунной клеткой.
«Антиген (Ag)» относится к соединению, композиции или веществу, которое может стимулировать выработку антител или Т-клеточный ответ у животного, в том числе к композициям (таким как композиция, содержащая опухолеспецифический белок), которые инъецируют животному или поглощаются животным. Антиген реагирует с продуктами специфического гуморального или клеточного иммунитета, в том числе с теми, которые были индуцированы под действием гетерологичных антигенов, таких как раскрытые антигены. «Целевой антиген» или «целевой антиген, представляющий интерес» представляет собой антиген, для связывания которого предназначен связывающий домен CAR, рассмотренного в данном документе. В конкретных вариантах осуществления целевой антиген представляет собой эпитоп пептида, липида, полисахарида или нуклеиновой кислоты, с которым специфически связывается связывающий домен. В предпочтительных вариантах осуществления антиген представляет собой эпитоп полипептида фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2.
«Эпитоп» или «антигенная детерминанта» относится к области антигена, с которой связывается связывающий агент. Эпитопы могут быть образованы как из смежных аминокислот или несмежных аминокислот, сближенных за счет третичной структуры белка. Эпитопы, образованные из смежных аминокислот, как правило, сохраняются при воздействии денатурирующих растворителей, тогда как эпитопы, образованные третичной структурой, как правило, пропадают при обработке денатурирующими растворителями. Эпитоп, как правило, содержит по меньшей мере 3, чаще по меньшей мере 5, приблизительно 9 или приблизительно 8-10 аминокислот в уникальной пространственной конформации.
Антитела включают их антиген-связывающие фрагменты, такие как верблюжий Ig, IgNAR, Fab-фрагменты, Fab'-фрагменты, F(ab)'2-фрагменты, F(ab)'3-фрагменты, Fv, одноцепочечные Fv-белки («scFv»), бис-scFv, (scFv)2, минитела, диатела, триатела, тетратела, стабилизированные дисульфидными связями Fv-белки («dsFv») и однодоменное антитело (sdAb, нанотело) и части антител полной длины, ответственные за связывание антигена. Термин также включает полученные методами генной инженерии формы, такие как химерные антитела (например, гуманизированные мышиные антитела), гетероконъюгатные антитела (такие как, биспецифические антитела) и их антиген-связывающие фрагменты. См. также Pierce Catalog and Handbook, 1994-1995 (Pierce Chemical Co., Рокфорд, Иллинойс); Kuby, J., Immunology, 3rd Ed., W. H. Freeman & Co., New York, 1997.
Как будет понятно специалисту в данной области и как описано в других частях данного документа, полное антитело содержит две тяжелые цепи и две легкие цепи. Каждая тяжелая цепь состоит из вариабельной области и первой, второй и третьей константной области, в то время как каждая легкая цепь состоит из вариабельной области и константной области. Тяжелые цепи антитела млекопитающих классифицируют как α, δ, ε, γ и μ, а легкие цепи антитела млекопитающих классифицируют как λ или κ. Иммуноглобулины, содержащие тяжелые цепи α, δ, ε, γ и μ классифицируют как иммуноглобулин IgA, IgD, IgE, IgG и IgM. Полное антитело имеет Y-образную форму. Стебель Y состоит из второй и третьей константных областей (а в случае IgE и IgM, четвертой константной области) двух тяжелых цепей, связанных между собой, и дисульфидные связи (между цепями) образованы в шарнирной области. Тяжелые цепи γ, α и δ содержат константную область, состоящую из трех последовательных (расположенных в линию) доменов Ig, и шарнирную область для придания гибкости; тяжелые цепи μ и ε содержат константную область, состоящую из четырех доменов иммуноглобулина. Вторая и третья константные области называются «CH2-домен» и «CH3-домен», соответственно. Каждое плечо Y включает вариабельную область и первую константную область одной тяжелой цепи, связанные с вариабельной и константной областями одной легкой цепи. Вариабельные области легкой и тяжелой цепей отвечают за связывание антигена.
Вариабельные области легкой и тяжелой цепей содержат «каркасную область», прерываемую гипервариабельными участками, также называемыми «определяющими комплементарность участками» или «CDR». CDR можно определять или идентифицировать с помощью традиционных способов, например, с помощью последовательности по Kabat и др. (Wu, TT and Kabat, E. A., J Exp Med. 132(2):211-50, (1970); Borden, P. and Kabat E. A., PNAS, 84: 2440-2443 (1987); (см. Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Department of Health and Human Services, 1991, которая тем самым включена посредством ссылки), или с помощью структуры согласно Chothia и др. (Choithia, C. and Lesk, A.M., J Mol. Biol., 196(4): 901-917 (1987), Choithia, C. et al, Nature, 342: 877 - 883 (1989)).
Последовательности каркасных участков различных легких или тяжелых цепей относительно консервативны в пределах вида, такого как человек. Каркасный участок антитела, который представляет собой объединенные каркасные участки составляющих антитело легкой и тяжелой цепей, служит для регуляции положения и выравнивания CDR в трехмерном пространстве. Прежде всего CDR ответственны за связывание с эпитопом антигена. CDR каждой цепи, как правило, называются CDR1, CDR2 и CDR3, нумеруются последовательно, начиная с N-конца, а также, как правило, идентифицируются с помощью цепи, в которой конкретный CDR находится. Таким образом, CDR, расположенные в вариабельном домене тяжелой цепи антитела, называются CDRH1, CDRH2 и CDRH3, тогда как CDR, расположенные в вариабельном домене легкой цепи антитела, называются CDRL1, CDRL2 и CDRL3. Антитела с различной специфичностью (т.е. различными паратопами для различных антигенов) имеют разные CDR. Несмотря на то, что CDR варьируют от антитела к антителу, только ограниченное количество аминокислотных положений в пределах CDR непосредственно вовлечено в связывание антигена. Такие положения в пределах CDR называют определяющими специфичность остатками (SDR).
Ссылки на «VH» или «VH» относятся к вариабельной области тяжелой цепи иммуноглобулина, в том числе таковой антитела, Fv, ScFv, dsFv, Fab или другого фрагмента антитела, раскрываемого в данном документе. Ссылки на «VL» или «VL» относятся к вариабельной области легкой цепи иммуноглобулина, в том числе таковой антитела, Fv, ScFv, dsFv, Fab или другого фрагмента антитела, раскрываемого в данном документе.
«Моноклональное антитело» представляет собой антитело, вырабатываемое одним клоном В-лимфоцитов или клеткой, в которую были трансфицированы гены легкой и тяжелой цепи одного антитела. Моноклональные антитела получают с помощью способов, известных специалистам в данной области, например, посредством создания образующих антитела гибридных клеток путем слияния клеток миеломы с иммунными клетками селезенки. Моноклональные антитела включают гуманизированные моноклональные антитела.
«Химерное антитело» содержит каркасные остатки от одного вида, такого как человек, и CDR (которые в целом обуславливают связывание антигена) от другого вида, такого как мышь. В конкретных предпочтительных вариантах осуществления CAR, рассмотренные в данном документе, содержит антиген-специфический связывающий домен, который представляет собой химерное антитело или его антиген-связывающий фрагмент.
В некоторых предпочтительных вариантах осуществления антитело представляет собой гуманизированное антитело (такое как гуманизированное моноклональное антитело), которое специфически связывается с поверхностным белком опухолевой клетки. «Гуманизированное» антитело представляет собой иммуноглобулин, включающий человеческий каркасный участок и один или более CDR из не являющегося человеческим иммуноглобулина (например, мышиного, крысиного или синтетического). Не являющийся человеческим иммуноглобулин, из которого происходят CDR, называют «донором», а человеческий иммуноглобулин, из которого происходит каркас, называют «акцептором». В одном варианте осуществления все CDR представляют собой происходящие из донорного иммуноглобулина в гуманизированном иммуноглобулине. Константные участки могут и не присутствовать, однако, если они имеются, они должны быть практически идентичными константным участкам человеческих иммуноглобулинов, т.е. быть по меньшей мере на приблизительно 85-90%, на приблизительно 95% или более идентичными. Следовательно, все части гуманизированного иммуноглобулина, за исключением, возможно, CDR, практически идентичны соответствующим частям последовательностей встречающихся в природе человеческих иммуноглобулинов. Гуманизированные или другие моноклональные антитела могут иметь дополнительные консервативные аминокислотные замены, которые не оказывают существенного влияния на связывание антигена или другие функции иммуноглобулина. Гуманизированные антитела могут быть сконструированы при помощи методов генной инженерии (см., например, патент США № 5585089).
В конкретных вариантах осуществления внеклеточный связывающий домен CAR содержит антитело или его антиген-связывающий фрагмент, в том числе без ограничения верблюжий Ig (антитело верблюдовых (VHH)), IgNAR, Fab-фрагменты, Fab'-фрагменты, F(ab)'2-фрагменты, F(ab)'3-фрагменты, Fv, одноцепочечное Fv-антитело («scFv»), бис-scFv, (scFv)2, минитело, диатело, триатело, тетратело, стабилизированный дисульфидными связями Fv-белок («dsFv») и однодоменное антитело (sdAb, нанотело).
«Верблюжий Ig» или «VHH-антитело верблюдовых», используемые в данном документе, относятся к наименьшей известной антиген-связывающей единице из антитела, состоящего только из тяжелых цепей (Koch-Nolte, et al., FASEB J., 21: 3490-3498 (2007)). Термины «антитело, состоящее только из тяжелых цепей» или «антитело верблюдовых» относится к антителу, которое содержит два VH-домена и не содержит легких цепей (Riechmann L. et al., J. Immunol. Methods 231:25-38 (1999); WO94/04678; WO94/25591; патент США № 6005079).
«IgNAR» или «новый иммуноглобулиновый антигенный рецептор» относится к классу антител из иммунного спектра акул, которые состоят из гомодимеров из одного вариабельного домена нового антигенного рецептора (VNAR) и пяти константных доменов нового антигенного рецептора (CNAR). IgNAR представляют собой одни из самых маленьких известных иммуноглобулиновых белковых каркасов, и они являются высокостабильными и обладают характеристиками для эффективного связывания. Внутренняя стабильность может быть связана как с (i) лежащим в основе каркасом Ig, который представлен значительным количеством заряженных и гидрофильных находящихся на поверхности остатков, по сравнению с VH- и VL-доменами стандартного антитела, встречающимися в мышиных антителах; так и с (ii) стабилизирующими структурными особенностями в петлях определяющих комплементарность участков (CDR), в том числе дисульфидные мостики внутри петель и характер водородных связей внутри петель.
Расщепление антител папаином дает два идентичных антиген-связывающих фрагмента, называемых «Fab»-фрагменты, каждый с одним антиген-связывающим сайтом, и оставшийся «Fc»-фрагмент, название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает F(аb')2-фрагмент, который имеет два антиген-связывающих сайта, и все еще способен к перекрестному связыванию антигена.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный антиген-связывающий сайт. В одном варианте осуществления виды двуцепочечного Fv состоят из димера из одного вариабельного домена тяжелой цепи и одного вариабельного домена легкой цепи в прочной, нековалентной связи. В молекуле одноцепочечного Fv (scFv) один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи могут быть ковалентно связаны посредством гибкого пептидного линкера, так что легкая и тяжелая цепи могут объединяться в «димерную» структуру, аналогичную таковой у молекулы двуцепочечного Fv. Именно в этой конфигурации три гипервариабельных участка (HVR) каждого вариабельного домена взаимодействуют с образованием антиген-связывающего сайта на поверхности димера VH-VL. В совокупности эти шесть HVR обусловливают антиген-связывающую специфичность антитела. Однако даже один вариабельный домен (или половина Fv, содержащая только три HVR, специфических в отношении антигена) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем полный связывающий сайт.
Fab-фрагмент содержит вариабельные домены тяжелой и легкой цепи, а также содержит константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбокси-конце СН1-домена тяжелой цепи, включающими один или более цистеиновых остатков из шарнирной области антитела. Fab'-SH в данном документе обозначает Fab', в котором цистеиновый остаток(и) константных доменов имеет свободную тиольную группу. F(аb')2-фрагменты антитела первоначально были получены как пары из Fab'-фрагментов, которые имеют общие цистеиновые остатки шарнирной области. Также известны другие средства для химического связывания фрагментов антител.
Термин «диатела» относится к фрагментам антитела с двумя антиген-связывающими сайтами, при этом фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в одну полипептидную цепь (VH-VL). Путем использования линкера, который является слишком коротким, чтобы позволить образование пары между двумя доменами одной цепи, домены вынуждены образовывать пару с комплементарными доменами другой цепи и создавать два антиген-связывающих сайта. Диатела могут быть бивалентными или биспецифическими. Более полно диатела описаны, например, в EP 404097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); и Hollinger et al., PNAS USA 90: 6444-6448 (1993). Триатела и тетратела также описаны в Hudson et al., Nat. Med. 9:129-134 (2003).
«Однодоменное антитело», или «sdAb», или «нанотело» относится к фрагменту антитела, который состоит из вариабельной области тяжелой цепи антитела (VH-домен) или вариабельной области легкой цепи антитела (VL-домен) (Holt, L., et al., Trends in Biotechnology, 21(11): 484-490).
«Одноцепочечные Fv» или «scFv»-фрагменты антитела содержат VH- и VL-домены антитела, где указанные домены присутствуют в одной полипептидной цепи и в любой ориентации (например, VL-VH или VH-VL). Как правило, полипептид scFv дополнительно содержит полипептидный линкер между VH- и VL-доменами, который обеспечивает возможность scFv образовать требуемую структуру для связывания антигена. Обзор scFv см., например,  , в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York, 1994), pp. 269-315.
, в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York, 1994), pp. 269-315.
В предпочтительных вариантах осуществления CAR, рассмотренный в данном документе, содержит антиген-специфический связывающий домен, который представляет собой scFv и может быть мышиным, человеческим или гуманизированным scFv. Одноцепочечные антитела могут быть клонированы из генов V-области гибридом, специфических в отношении требуемой мишени. Получение таких гибридом стало традиционным. Методика, которую можно применять для клонирования вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL) была описана, например, в Orlandi et al., PNAS, 1989; 86: 3833-3837. В конкретных вариантах осуществления антиген-специфический связывающий домен представляет собой scFv, который связывает полипептид -или λ-легких цепей. В определенном варианте осуществления scFv связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2.
Пример гуманизированного антиген-специфического связывающего домена представляет собой вариабельную область иммуноглобулина, специфическую в отношении опухолевого антигена, которая содержит по меньшей мере один человеческий каркасный участок. Термин «человеческий каркасный участок» относится к каркасному участку дикого типа (т.е. встречающемуся в природе) вариабельной области человеческого иммуноглобулина, измененному каркасному участку вариабельной области человеческого иммуноглобулина, если менее чем приблизительно 50% (например, предпочтительно менее чем приблизительно 45%, 40%, 30%, 25%, 20%, 15%, 10%, 5% или 1%) аминокислот в участке удалены или замещены (например, одним или более аминокислотными остатками из каркасного участка иммуноглобулина, не являющегося человеческим, в соответствующих положениях), или измененному каркасному участку вариабельной области иммуноглобулина, не являющегося человеческим, если менее чем приблизительно 50% (например, менее чем 45%, 40%, 30%, 25%, 20%, 15%, 10% и 5%) аминокислот в участке удалены или замещены (например, в положениях находящихся на поверхности остатков и/или одним или более аминокислотными остатками из каркасного участка человеческого иммуноглобулина в соответствующих положениях), таким образом в одном аспекте иммуногенность является уменьшенной.
В определенных вариантах осуществления человеческий каркасный участок представляет собой каркасный участок дикого типа из вариабельной области человеческого иммуноглобулина. В других определенных вариантах осуществления человеческий каркасный участок представляет собой измененный каркасный участок из вариабельной области человеческого иммуноглобулина с аминокислотными делециями или заменами в одном, двух, трех, четырех или пяти положениях. В других вариантах осуществления человеческий каркасный участок представляет собой измененный каркасный участок из вариабельной области иммуноглобулина, не являющегося человеческим, с аминокислотными делециями или заменами в одном, двух, трех, четырех или пяти положениях.
В конкретных вариантах осуществления антиген-специфический связывающий домен содержит по меньшей мере один, два, три, четыре, пять, шесть, семь или восемь человеческих каркасных участков (FR), выбранных из человеческого FR1 легкой цепи, человеческого FR1 тяжелой цепи, человеческого FR2 легкой цепи, человеческого FR2 тяжелой цепи, человеческого FR3 легкой цепи, человеческого FR3 тяжелой цепи, человеческого FR4 легкой цепи и человеческого FR4 тяжелой цепи.
Человеческие FR, которые могут присутствовать в антиген-специфических связывающих доменах, также включают варианты примеров FR, представленных в данном документе, в которых одна или две аминокислоты примеров FR были замещены или удалены.
В определенных вариантах осуществления гуманизированный антиген-специфический связывающий домен содержит (a) гуманизированную вариабельную область легкой цепи, которая содержит человеческий FR1 легкой цепи, человеческий FR2 легкой цепи, человеческий FR3 легкой цепи и человеческий FR4 легкой цепи, и (b) гуманизированную вариабельную область тяжелой цепи, которая содержит человеческий FR1 тяжелой цепи, человеческий FR2 тяжелой цепи, человеческий FR3 тяжелой цепи и человеческий FR4 тяжелой цепи.
Антиген-специфические связывающие домены, предусмотренные в данном документе, также содержат один, две, три, четыре, пять или шесть CDR. Такие CDR могут представлять собой CDR, не являющиеся человеческими, или измененные CDR, не являющиеся человеческими, выбранные из CDRL1, CDRL2 и CDRL3 легкой цепи и CDRH1, CDRH2 и CDRH3 тяжелой цепи. В определенных вариантах осуществления антиген-специфический связывающий домен содержит (a) вариабельную область легкой цепи, которая содержит CDRL1 легкой цепи, CDRL2 легкой цепи и CDRL3 легкой цепи, а также (b) вариабельную область тяжелой цепи, которая содержит CDRH1 тяжелой цепи, CDRH2 тяжелой цепи и CDRH3 тяжелой цепи.
2. Линкеры
В определенных вариантах осуществления CAR, рассмотренные в данном документе, могут содержать линкерные остатки между различными доменами, например, между VH- и VL-доменами, добавленные для соответствующего разделения их в пространстве и обеспечения конформации молекулы. CAR, рассмотренные в данном документе, могут содержать один, два, три, четыре или пять или более линкеров. В конкретных вариантах осуществления длина линкера составляет от приблизительно 1 до приблизительно 25 аминокислот, от приблизительно 5 до приблизительно 20 аминокислот или от приблизительно 10 до приблизительно 20 аминокислот, или любой другой промежуточный отрезок из аминокислот. В некоторых вариантах осуществления линкер имеет длину 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более аминокислот.
Иллюстративные примеры линкеров включают глициновые полимеры (G)n; глицин-сериновые полимеры (G1-5S1-5)n, где n равняется целому числу, составляющему по меньшей мере один, два, три, четыре или пять; глицин-аланиновые полимеры; аланин-сериновые полимеры и другие гибкие линкеры, известные из уровня техники. Глициновые и глицин-сериновые полимеры являются относительно неструктурированными и, следовательно, могут служить нейтральным связующим между доменами белков слияния, таких как CAR, описанных в данном документе. Глицин обеспечивает значительно большее фи-пси пространство, чем аланин, и является намного менее ограниченным, чем остатки с более длинными цепями (см. Scheraga, Rev. Computational Chem. 11173-142 (1992)). Специалисту в данной области будет понятно, что структура CAR в конкретных вариантах осуществления может включать линкеры, которые являются полностью или частично гибкими, так что линкер может включать гибкий линкер, а также одну или более частей, обуславливающих менее гибкую структуру с обеспечением требуемой структуры CAR.
Другие примеры линкеров включают без ограничений следующие аминокислотные последовательности: GGG; DGGGS (SEQ ID NO: 4); TGEKP (SEQ ID NO: 5) (см., например, Liu et al., PNAS 5525-5530 (1997)); GGRR (SEQ ID NO: 6) (Pomerantz et al. 1995, выше); (GGGGS)n, где n = 1, 2, 3, 4 или 5 (SEQ ID NO: 7) (Kim et al., PNAS 93, 1156-1160 (1996.); EGKSSGSGSESKVD (SEQ ID NO:8) (Chaudhary et al., 1990, Proc. Natl. Acad. Sci. U.S.A. 87:1066-1070); KESGSVSSEQLAQFRSLD (SEQ ID NO:9) (Bird et al., 1988, Science 242:423-426), GGRRGGGS (SEQ ID NO:10); LRQRDGERP (SEQ ID NO:11); LRQKDGGGSERP (SEQ ID NO:12); LRQKd(GGGS)2 ERP (SEQ ID NO:13). В качестве альтернативы гибкие линкеры могут быть разработаны методами рационального дизайна с использованием компьютерной программы, способной моделировать как ДНК-связывающие сайты, так и пептиды сами по себе (Desjarlais & Berg, PNAS 90:2256-2260 (1993), PNAS 91:11099-11103 (1994), или с помощью способов фагового дисплея.
В конкретных вариантах осуществления CAR содержит scFV, который дополнительно содержит линкерную последовательность вариабельной области. «Линкерная последовательность вариабельной области» представляет собой аминокислотную последовательность, которая соединяет вариабельную область тяжелой цепи с вариабельной областью легкой цепи и обеспечивает спейсерную функцию, совместимую с взаимодействием двух связывающих субдоменов, так что полученный полипептид сохраняет специфическую аффинность связывания с той же целевой молекулой что и антитело, которое содержит такие же вариабельные области легкой и тяжелой цепей. В одном варианте осуществления линкерная последовательность вариабельной области имеет дину 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более аминокислот. В конкретном варианте осуществления линкерная последовательность вариабельной области содержит глицин-сериновый полимер (G1-5S1-5)n, где n равняется целому числу, составляющему по меньшей мере 1, 2, 3, 4 или 5. В другом варианте осуществления линкерная последовательность вариабельной области содержит аминокислотный линкер (G4S)3.
3. Спейсерный домен
В конкретных вариантах осуществления за связывающим доменом CAR следует один или более «спейсерных доменов», которыми называют область, отодвигающую антиген-связывающий домен от поверхности эффекторной клетки для обеспечения надлежащего контакта клетка/клетка, связывания антигена и активации (Patel et al., Gene Therapy, 1999; 6: 412-419). Шарнирный домен может быть получен из природного, синтетического, полусинтетического или рекомбинантного источника. В определенных вариантах осуществления спейсерный домен представляет собой часть иммуноглобулина, включающую без ограничения одну или более константных областей тяжелой цепи, например, CH2 и CH3. Спейсерный домен может включать аминокислотную последовательность из встречающейся в природе шарнирной области иммуноглобулина или измененной шарнирной области иммуноглобулина.
В одном варианте осуществления спейсерный домен содержит CH2 и CH3 из IgG1.
4. Шарнирный домен
За связывающим доменом CAR, как правило, следует один или более «шарнирных доменов», которые играют роль в регуляции положения антиген-связывающего домена, отодвигая его от поверхности эффекторной клетки для обеспечения надлежащего контакта клетка/клетка, связывания антигена и активации. CAR, как правило, содержит один или более шарнирных доменов между связывающим доменом и трансмембранным доменом (TM). Шарнирный домен может быть получен из природного, синтетического, полусинтетического или рекомбинантного источника. Шарнирный домен может включать аминокислотную последовательность из встречающейся в природе шарнирной области иммуноглобулина или измененной шарнирной области иммуноглобулина.
Термин «измененная шарнирная область» относится к (a) встречающейся в природе шарнирной области, которая содержит не более 30% аминокислотных изменений (например, до 25%, 20%, 15%, 10% или 5% аминокислотных замен или делеций), (b) части встречающейся в природе шарнирной области, длина которой составляет по меньшей мере 10 аминокислот (например, по меньшей мере 12, 13, 14 или 15 аминокислот), при этом содержит не более 30% аминокислотных изменений (например, до 25%, 20%, 15%, 10% или 5% аминокислотных замен или делеций), или (c) части встречающейся в природе шарнирной области, которая содержит коровую шарнирную область (длина которой составляет 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15, или по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислот). В определенных вариантах осуществления один или более цистеиновых остатков во встречающейся в природе шарнирной области иммуноглобулина могут быть замещены на один или более других аминокислотных остатков (например, один или более сериновых остатков). Измененная шарнирная область иммуноглобулина может альтернативно или дополнительно характеризоваться тем, что пролиновый остаток из шарнирной области иммуноглобулина дикого типа замещен другим аминокислотным остатком (например, сериновым остатком).
Другие иллюстративные шарнирные домены, пригодные для применения в CAR, описанных в данном документе, включают шарнирную область, полученную из внеклеточных областей мембранных белков 1 типа, таких как CD8α, CD4, CD28 и CD7, которые могут представлять собой шарнирные области дикого типа из этих молекул или могут быть измененными. В другом варианте осуществления шарнирный домен содержит шарнирную область CD8α.
5. Трансмембранный домен (TM)
«Трансмембранный домен» представляет собой часть CAR, которая объединяет внеклеточную связывающую часть и внутриклеточный домен передачи сигнала, а также заякоривает CAR в плазматической мембране иммунной эффекторной клетки. TM-домен может быть получен из природного, синтетического, полусинтетического или рекомбинантного источника. TM-домен может быть получен из (т.е. содержит по меньшей мере трансмембранную область(-и)) альфа, бета или зета цепи T-клеточного рецептора, эпсилон-CD3, зета-CD3, CD4, CD5, CD9, CD 16, CD22, CD28, CD33, CD37, CD45, CD64, CD80, CD86, CD 134, CD137, PD-1 и CD154. В конкретном варианте осуществления TM-домен является синтетическим и преимущественно содержит гидрофобные остатки, такие как лейцин и валин.
В одном варианте осуществления CAR, рассмотренный в данном документе, содержит TM-домен, полученный из CD8α. В другом варианте осуществления CAR, рассмотренный в данном документе, содержит TM-домен, полученный из CD8α, и короткий олиго- или полипептидный линкер длиной предпочтительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот, который связывает TM-домен и внутриклеточный домен передачи сигнала у CAR. Глицин-сериновый линкер является особенно подходящим линкером.
6. Внутриклеточный домен передачи сигнала
В конкретных вариантах осуществления CAR, рассмотренные в данном документе, содержат внутриклеточный домен передачи сигнала. «Внутриклеточным доменом передачи сигнала» называют часть CAR, которая участвует в передаче сообщения об эффективном связывании CAR с целевым антигеном во внутреннюю часть иммунной эффекторной клетки для запуска эффекторной функции клетки, например, активации, выработки цитокина, пролиферации и цитотоксической активности, в том числе высвобождения цитотоксических факторов в CAR-связанную целевую клетку, или других клеточных ответов, вызываемых связыванием антигена с внеклеточным доменом CAR.
Термин «эффекторная функция» относится к специализированной функции клетки. Эффекторная функция Т-клетки, например, может представлять собой цитолитическую активность, или вспомогательную, или активность, включающую секрецию цитокина. Таким образом, термин «внутриклеточный домен передачи сигнала» относится к части белка, который передает сигнал для запуска эффекторной функции и который обуславливает выполнение клеткой специализированной функции. Несмотря на то, что обычно можно использовать целый внутриклеточный домен передачи сигнала, во многих случаях не является необходимым применение целого домена. В тех случаях, когда применяют усеченную часть внутриклеточного домена передачи сигнала, такую усеченную часть можно применять вместо целого домена, при условии что он передает сигнал для запуска эффекторной функции. Термин внутриклеточный домен передачи сигнала подразумевает включение любой усеченной части внутриклеточного домена передачи сигнала, достаточный для передачи сигнала для запуска эффекторной функции.
Известно, что сигналы, генерируемые посредством только TCR, являются недостаточными для полной активации Т-клетки, и что также требуется повторный или костимулирующий сигнал. Таким образом можно сказать, что активация Т-клетки опосредуется двумя различными классами внутриклеточных доменов передачи сигнала: доменами передачи первичного сигнала, которые инициируют антиген-зависимую первичную активацию посредством TCR (например, комплекса TCR/CD3), и доменами передачи костимулирующего сигнала, которые действуют независимым от антигена образом с обеспечением вторичного или костимулирующего сигнала. В предпочтительных вариантах осуществления CAR, рассмотренный в данном документе, содержит внутриклеточный домен передачи сигнала, который содержит один или более «доменов передачи костимулирующего сигнала» и «домен передачи первичного сигнала».
Домены передачи первичного сигнала реагируют на первичную активацию комплекса TCR либо путем стимуляции, либо путем ингибирования. Домены передачи первичного сигнала, которые действуют стимулирующим образом, могут содержать мотивы передачи сигнала, которые известны как иммунорецепторные тирозиновые активирующие мотивы или ITAM.
Иллюстративные примеры ITAM-содержащих доменов передачи первичного сигнала, которые являются особенно применимыми в настоящем изобретении, включают таковые, полученные из TCRς, FcRγ, FcRβ, CD3γ, CD3δ, CD3ε, CD3ς, CD22, CD79a, CD79b и CD66d. В конкретных предпочтительных вариантах осуществления CAR содержит домен передачи первичного сигнала CD3ς и один или более доменов передачи костимулирующего сигнала. Внутриклеточные домены передачи первичного сигнала и передачи костимулирующего сигнала могут быть присоединены в любом порядке последовательно к карбоксильному концу трансмембранного домена.
CAR, рассмотренные в данном документе, содержат один или более доменов передачи костимулирующего сигнала для повышения эффективности и размножения Т-клеток, экспрессирующих CAR-рецепторы. Используемый в данном документе термин «домен передачи костимулирующего сигнала» или «домен костимуляции» относится к внутриклеточному домену передачи сигнала от костимулирующей молекулы. Костимулирующие молекулы представляют собой молекулы клеточной поверхности, не являющиеся антигенными рецепторами и Fc-рецепторами, которые обеспечивают вторичный сигнал, требуемый для эффективной активации и функционирования T-лимфоцитов после связывания с антигеном. Иллюстративные примеры таких костимулирующих молекул включают CD27, CD28, 4-1BB (CD137), OX40 (CD134), CD30, CD40, PD-1, ICOS (CD278), CTLA4, LFA-1, CD2, CD7, LIGHT и NKD2C, а также CD83. В одном варианте осуществления CAR содержит один или более доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD137 и CD134, а также домен передачи первичного сигнала CD3ς.
В другом варианте осуществления CAR содержит домены передачи костимулирующего сигнала CD28 и CD137, а также домен передачи первичного сигнала CD3ς.
В еще одном варианте осуществления CAR содержит домены передачи костимулирующего сигнала CD28 и CD134, а также домен передачи первичного сигнала CD3ς.
В одном варианте осуществления CAR содержит домены передачи костимулирующего сигнала CD137 и CD134, а также домен передачи первичного сигнала CD3ς.
В одном варианте осуществления CAR содержит домен передачи костимулирующего сигнала CD137, а также домен передачи первичного сигнала CD3ς.
В одном варианте осуществления CAR содержит домен передачи костимулирующего сигнала CD134, а также домен передачи первичного сигнала CD3ς.
В одном варианте осуществления CAR содержит домен передачи костимулирующего сигнала CD28, а также домен передачи первичного сигнала CD3ς.
В конкретных вариантах осуществления CAR, рассмотренные в данном документе, содержат антитело или его антиген-связывающий фрагмент, которые специфически связываются с полипептидом фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2, экспрессируемым на опухолевой клетке.
В одном варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; трансмембранный домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD45, PD1 и CD152; один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD54, CD134, CD137, CD152, CD273, CD274 и CD278; и домен передачи первичного сигнала CD3ς.
В другом варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен, выбранный из группы, включающей шарнир/CH2/CH3 IgG1 и CD8α, а также CD8α; трансмембранный домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD45, PD1 и CD152; один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD134 и CD137; а также домен передачи первичного сигнала CD3ς.
В еще одном варианте осуществления CAR содержит scFv, дополнительно содержащий линкер, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен, выбранный из группы, включающей шарнир/CH2/CH3 IgG1 и CD8α, а также CD8α; трансмембранный домен, содержащий TM-домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD45, PD1 и CD152, а также короткий олиго- или полипептидный линкер длиной предпочтительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот, который связывает TM-домен с внутриклеточным доменом передачи сигнала CAR; и один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD134 и CD137; а также домен передачи первичного сигнала CD3ς.
В конкретном варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен, содержащий полипептид шарнирной области PD1 или CD152; трансмембранный домен PD1 или CD152, содержащий полипептидный линкер из приблизительно 3 аминокислот; внутриклеточный домен передачи костимулирующего сигнала CD137; а также домен передачи первичного сигнала CD3ς.
В конкретном варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен, содержащий полипептид шарнирной области PD1 или CD152; трансмембранный домен PD1 или CD152, содержащий полипептидный линкер из приблизительно 3 аминокислот; внутриклеточный домен передачи костимулирующего сигнала CD134; а также домен передачи первичного сигнала CD3ς.
В конкретном варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен, содержащий полипептид шарнирной области PD1 или CD152; трансмембранный домен PD1 или CD152, содержащий полипептидный линкер из приблизительно 3 аминокислот; внутриклеточный домен передачи костимулирующего сигнала CD28; а также домен передачи первичного сигнала CD3ς.
В конкретном варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен, содержащий полипептид шарнир/CH2/CH3 IgG1 и полипептид CD8α; трансмембранный домен CD8α, содержащий полипептидный линкер из приблизительно 3 аминокислот; внутриклеточный домен передачи костимулирующего сигнала CD137; а также домен передачи первичного сигнала CD3ς.
В конкретном варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен, содержащий полипептид CD8α; трансмебранный домен CD8α, содержащий полипептидный линкер из приблизительно 3 аминокислот; внутриклеточный домен передачи костимулирующего сигнала CD134; а также домен передачи первичного сигнала CD3ζ.
В конкретном варианте осуществления CAR содержит scFv, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен, содержащий полипептид CD8α; трансмебранный домен CD8α, содержащий полипептидный линкер из приблизительно 3 аминокислот; внутриклеточный домен передачи костимулирующего сигнала CD28; а также домен передачи первичного сигнала CD3ζ.
Кроме того, структура векторов, рассмотренных в данном документе, позволяет улучшить размножение, долгосрочную персистенцию и цитотоксические свойства Т-клеток и стойкую экспрессию CAR на протяжении жизни клеток по сравнению с немодифицированными Т-клетками или Т-клетками, модифицированными другими векторами.
D. Полипептиды
В настоящем изобретении рассмотрены, в частности, полипептиды CAR или их фрагменты, клетки и композиции, содержащие таковые, а также векторы, которые экспрессируют полипептиды. В предпочтительных вариантах осуществления предусмотрен полипептид, содержащий один или более CAR, кодируемых полинуклеотидной последовательностью, изложенной под SEQ ID NO: 2 и 3.
«Полипептид», «фрагмент полипепида», «пептид» и «белок» используются взаимозаменяемо, если не указано иное, и в соответствии с общепринятым значением, т.е. последовательность из аминокислот. Полипептиды не ограничены определенной длиной, например, они могут содержать последовательность белка полной длины или фрагмент белка полной длины, и могут включать посттрансляционные модификации полипептида, например, гликозилирования, ацетилирования, фосфорилирования и т.п., а также другие модификации, известные из уровня техники, как встречающиеся, так и не встречающиеся в природе. В различных вариантах осуществления полипептиды CAR, рассмотренные в данном документе, содержат сигнальную (или лидерную) последовательность на N-терминальном конце белка, которая котрансляционно или посттрансляционно управляет переносом белка. Иллюстративные примеры подходящих сигнальных последовательностей (сигнальных пептидов), применимых в CAR, раскрытых в данном документе, включают без ограничения сигнальный полипептид тяжелой цепи IgG1, сигнальный полипептид CD8α или сигнальный пептид альфа-субъединицы рецептора GM-CSF человека. Полипептиды могут быть получены с помощью любой из множества хорошо известных методик рекомбинации и/или синтеза. Полипептиды, рассмотренные в данном документе, в частности, охватывают CAR по настоящему раскрытию или последовательности, которые имеют делеции, добавления, и/или замены одной или более аминокислот относительно CAR, раскрытого в данном документе.
«Выделенный пептид» или «выделенный полипептид» и т.п., используемые в данном документе, относятся к in vitro выделению и/или очистке пептидной или полипептидной молекулы из клеточного окружения, а также от связи с другими компонентами клетки, т.е. она не является в значительной степени связанной с in vivo веществами. Аналогично термин «выделенная клетка» относится к клетке, которая была получена из in vivo ткани или органа и практически не содержит внеклеточного матрикса.
Полипептиды включают «варианты полипептида». Варианты полипептида могут отличаться от встречающегося в природе полипептида одной или более заменами, делециями, добавлениями и/или вставками. Такие варианты могут быть встречающимися в природе или могут быть получены синтетическим путем, например, посредством модификации одной или более упомянутых выше полипептидных последовательностей. Например, в конкретных вариантах осуществления может быть необходимо улучшить аффинность связывания и/или другие биологические свойства CAR посредством введения одной или более замен, делеций, добавлений и/или вставок в связывающий домен, шарнир, TM-домен, домен передачи костимулирующего сигнала или домен передачи первичного сигнала полипептида CAR. Предпочтительно полипептиды по настоящему изобретению включают полипептиды, характеризующиеся по меньшей мере приблизительно 65%, 70%, 75%, 85%, 90%, 95%, 98% или 99% аминокислотной идентичностью с ними.
Полипептиды включают «фрагменты полипептида». Фрагментами полипептида называют полипептид, который может быть мономерным или мультимерным, характеризующийся амино-концевой делецией, карбокси-концевой делецией и/или внутренней делецией или заменой относительно встречающегося в природе или полученного рекомбинантным способом полипептида. В определенных вариантах осуществления фрагмент полипептида может содержать аминокислотную цепь, имеющую длину по меньшей мере от 5 до приблизительно 500 аминокислот. Следует иметь в виду, что в определенных вариантах осуществления фрагменты имеют длину по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 150, 200, 250, 300, 350, 400 или 450 аминокислот. Особенно пригодные фрагменты полипептида включают функциональные домены, в том числе антиген-связывающие домены или фрагменты антител. В случае антитела к каппа- или лямбда-легкой цепи, пригодные фрагменты включают без ограничения: CDR-участок, CDR3-участок тяжелой или легкой цепи; вариабельную область тяжелой или легкой цепи; часть цепи антитела или вариабельной области, в том числе два CDR, и т.п.
Полипептид также может быть слит в рамке считывания или конъюгирован с линкерной или другой последовательностью для облегчения синтеза, очистки или идентификации полипептида (например, поли-His), или для улучшения связывания полипептида с твердым носителем.
Как уже отмечалось выше, полипептиды по настоящему изобретению могут быть изменены различными путями, в том числе характеризоваться аминокислотными заменами, делециями, усечениями и вставками. Способы таких манипуляций общеизвестны из уровня техники. Например, варианты аминокислотной последовательности эталонного полипептида могут быть получены посредством мутаций ДНК. Способы мутагенеза и изменений нуклеотидной последовательности хорошо известны из уровня техники. См., например, Kunkel (1985, Proc. Natl. Acad. Sci. USA. 82: 488-492), Kunkel et al., (1987, Methods in Enzymol, 154: 367-382), патент США № 4873192, Watson, J. D. et al., (Molecular Biology of the Gene, Fourth Edition, Benjamin/Cummings, Menlo Park, Calif., 1987) и ссылочные документы, процитированные в них. Рекомендации, касающиеся подходящих аминокислотных замен, которые не влияют на биологическую активность представляющего интерес белка, можно найти в модели Dayhoff et al., (1978) Atlas of Protein Sequence and Structure (Natl. Biomed. Res. Found., Washington, D.C.).
В определенных вариантах осуществления вариант будет содержать консервативные замены. «Консервативной заменой» является та, при которой аминокислота замещена на другую аминокислоту, которая характеризуется аналогичными свойствами, вследствие чего специалист в области техники, связанной с химией пептидов, может ожидать, что вторичная структура и гидропатичная природа полипептида практически не изменятся. В структуре полинуклеотидов и полипептидов по настоящему изобретению можно выполнять модификации и тем не менее получать функциональную молекулу, которая кодирует вариантный или производный полипептид с необходимыми характеристиками. Когда необходимо изменить аминокислотную последовательность полипептида для создания эквивалентного, или даже улучшенного, вариантного полипептида по настоящему изобретению, специалист в данной области, например, может изменить один или более кодонов кодирующей ДНК-последовательности, например, в соответствии с таблицей 1.
ТАБЛИЦА 1 - Кодоны, кодирующие аминокислоты
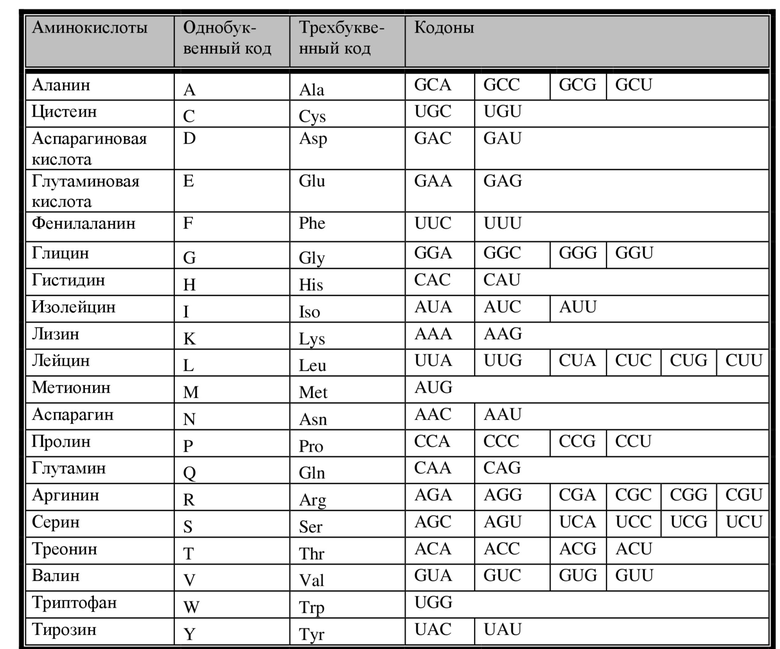
Рекомендации по определению того, какие аминокислотные остатки можно заменить, вставить или удалить без потери биологической активности, можно найти с использованием компьютерных программ, хорошо известных из уровня техники, таких как программное обеспечение DNASTAR™. Предпочтительно аминокислотные изменения в вариантах белка, раскрытых в данном документе, представляют собой консервативные аминокислотные изменения, т.е. замены на аналогично заряженные или незаряженные аминокислоты. Консервативное аминокислотное изменение предусматривает замену в пределах одного семейства аминокислот, которые имеют сходные боковые цепи. Встречающиеся в природе аминокислоты, как правило, подразделяют на четыре семейства: кислотные (аспартат, глутамат), основные (лизин, аргинин, гистидин), неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан) и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин) аминокислоты. Фенилаланин, триптофан и тирозин иногда классифицируют совместно как ароматические аминокислоты. Подходящие консервативные замены аминокислот в пептиде или белке известны специалистам в данной области, и, как правило, их можно выполнять без изменения биологической активности полученной молекулы. Специалистам в данной области будет понятно, что, как правило, одиночные аминокислотные замены в несущественных областях полипептида не изменяют существенным образом биологическую активность (см., например, Watson et al., Molecular Biology of the Gene, 4th Edition, 1987, The Benjamin/Cummings Pub. Co., p.224). Примеры консервативных замен описаны в предварительной заявке на патент США № 61/241647, раскрытие которой включено в данный документ посредством ссылки.
При выполнении таких изменений можно учитывать индекс гидропатичности аминокислот. Важность индекса гидропатичности аминокислот в обеспечении согласованной биологической функции белка в целом известна из уровня техники (Kyte and Doolittle, 1982, включенная в данный документ посредством ссылки). Каждой аминокислоте был присвоен индекс гидропатичности на основании ее гидрофобности и характеристик заряда (Kyte and Doolittle, 1982). Значения являются следующими: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин/цистеин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серин (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9); и аргинин (-4,5).
Из уровня техники известно, что определенные аминокислоты можно замещать на другие аминокислоты с аналогичным индексом или показателем гидропатичности и тем не менее получать белок с аналогичной биологической активностью, т.е. тем не менее получать белок, эквивалентый по биологической функции. При выполнении таких изменений замена аминокислот, индексы гидропатичности которых находятся в пределах ±2, является предпочтительной, находятся в пределах ±1, является особенно предпочтительной, и находятся в пределах ±0,5, является еще более предпочтительной. Также из уровня техники известно, что замену подобных аминокислот можно эффективно выполнять на основании гидрофильности.
Как подробно изложено в патенте США № 4554101, аминокислотным остаткам были присвоены следующие значения гидрофильности: аргинин (+3,0); лизин (+3,0); аспартат (+3,0 ± 1); глутамат (+3,0 ± 1); серин (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); треонин (-0,4); пролин (-0,5 ± 1); аланин (-0,5); гистидин (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5); триптофан (-3,4). Следует понимать, что аминокислоту можно заменять на другую аминокислоту, характеризующуюся аналогичным значением гидрофильности и тем не менее получать биологически эквивалентный, и в частности иммунологически эквивалентный, белок. При таких изменениях замена аминокислот, значения гидрофильности которых находятся в пределах ±2, является предпочтительной, находятся в пределах ±1, является особенно предпочтительной, и находятся в пределах ±0,5, является еще более предпочтительной.
Как было обозначено выше, аминокислотные замены могут быть основаны на относительном сходстве заместителей в боковой цепи аминокислот, например, сходстве их гидрофобности, гидрофильности, заряда, размера и т.п.
Варианты полипептида дополнительно включают гликозилированные формы, конъюгаты, образованные путем агрегации с другими молекулами, а также конъюгаты с образованием ковалентной связи с неродственными химическими фрагментами (например, пегилированные молекулы). Варианты с ковалентной связью можно получать путем связывания функциональных групп с группами, которые находятся в аминокислотной цепи, или с N- или C-концевым остатком, как известно из уровня техники. Варианты также включают аллельные варианты, видовые варианты и мутеины. Усечения или делеции областей, которые не влияют на функциональную активность белков, также приводят к образованию вариантов.
В одном варианте осуществления, в котором требуется экспрессия одного или более полипептидов, полинуклеотидные последовательности, кодирующие их, можно разделять с помощью последовательности IRES, как обсуждается в других частях данного документа. В другом варианте осуществления два или более полипептидов могут экспрессироваться как белок слияния, который содержит одну или более саморасщепляющихся полипептидных последовательностей.
Полипептиды по настоящему изобретению включают слитые полипептиды. В предпочтительных вариантах осуществления предусмотрены слитые полипептиды и полинуклеотиды, кодирующие слитые полипептиды, например, CAR. Слитыми полипептидами и белками слияния называют полипептид, который имеет по меньшей мере два, три, четыре, пять, шесть, семь, восемь, девять или десять, или большее количество полипептидных сегментов. Слитые полипептиды, как правило, присоединены C-концом к N-концу, хотя они также могут быть присоединены C-концом к C-концу, N-концом к N-концу или N-концом к C-концу. Полипептиды в белке слияния могут находиться в любом порядке или в определенном порядке. Слитые полипептиды или белки слияния могут также включать консервативно модифицированные варианты, полиморфные варианты, аллели, мутанты, подпоследовательности и межвидовые гомологи, при условии сохранения требуемой транскрипционной активности слитого полипептида. Слитые полипептиды можно получать с помощью способов химического синтеза или с помощью химического связывания двух фрагментов или, как правило, можно получать с помощью других стандартных методик. Лигированные последовательности ДНК, кодирующие слитый полипептид, функционально связаны с подходящими элементами контроля транскрипции или трансляции, как обсуждается в других частях данного документа.
В одном варианте осуществления партнер по слиянию содержит последовательность, которая способствует экспрессии белка (энхансер экспрессии), приводя к более высоким выходам по сравнению с нативным рекомбинантным белком. Другие партнеры по слиянию могут быть выбраны таким образом, чтобы увеличить растворимость белка, или чтобы обеспечить возможность направления белка в требуемые внутриклеточные компартменты, или чтобы облегчить транспорт белка слияния через клеточную мембрану.
Слитые полипептиды могут дополнительно содержать сигнал расщепления полипептида между каждым из полипептидных доменов, описанных в данном документе. Кроме того, сайт расщепления полипептида может быть помещен в последовательность любого линкерного пептида. Примеры сигналов расщепления пептида включают сайты распознавания для расщепления полипептида, такие как сайты расщепления для протеазы, сайты расщепления для нуклеазы (например, сайты распознавания для редкощепящего фермента, сайты распознавания для саморасщепляющихся рибозимов) и саморасщепляющиеся вирусные олигопептиды (см. deFelipe and Ryan, 2004. Traffic, 5(8); 616-26).
Подходящие сайты расщепления для протеазы и саморасщепляющиеся пептиды хорошо известны специалисту в данной области (см., например, в Ryan et al., 1997. J. Gener. Virol. 78, 699-722; Scymczak et al. (2004) Nature Biotech. 5, 589-594). Примеры сайтов расщепления для протеазы включают без ограничения сайты расщепления для NIa-протеаз потивируса (например, протеаз вируса гравировки табака), HC-протеаз потивируса, P1 (P35)-протеаз потивируса, NIa-протеаз бимовируса, RNA-2-кодируемых протеаз бимовируса, L-протеаз афтовируса, 2A-протеаз энтеровируса, 2A-протеаз риновируса, 3C-протеаз пикорнавируса, 24K-протеаз комовируса, 24K-протеаз неповируса, 3C-подобной протеазы RTSV (сферический вирус тунгро риса), 3C-подобной протеазы PYVF (вирус желтой пятнистости пастернака), гепарина, тромбина, фактора Xa и энтерокиназы. В одном варианте осуществления вследствие высокой точности расщепления предпочтительными являются сайты расщепления для протеазы TEV (вирус гравировки табака), например, EXXYXQ(G/S) (SEQ ID NO:14), например, ENLYFQG (SEQ ID NO:15) и ENLYFQS (SEQ ID NO:16), где X представляет собой любую аминокислоту (расщепление посредством TEV происходит между Q и G или Q и S).
В конкретном варианте осуществления саморасщепляющиеся пептиды включают полипептидные последовательности, полученные из 2A-пептидов потивируса и кардиовируса, FMDV (вируса ящура), вируса ринита лошадей типа A, вируса Thosea asigna и тешовируса свиней.
В определенных вариантах осуществления сайт саморасщепляющегося полипептида включает последовательность или домен 2A-сайта или 2A-подобного сайта (Donnelly et al., 2001. J. Gen. Virol. 82:1027-1041).
ТАБЛИЦА 2: Примеры 2A-сайтов включают следующие последовательности:
В предпочтительных вариантах осуществления полипептид, рассмотренный в данном документе, содержит полипептид CAR.
E. Полинуклеотиды
В конкретных вариантах осуществления предусмотрены полинуклеотиды, содержащие MND-промотор и полинуклеотид, кодирующий один или более CAR. В предпочтительных вариантах осуществления предусмотрен полинуклеотид, содержащий MND-промотор, функционально связанный с полинуклеотидом, кодирующим один или более CAR, изложенных под SEQ ID NO: 2 и 3. Используемые в данном документе термины «полинуклеотид» или «нуклеиновая кислота» относятся к матричной РНК (мРНК), РНК, геномной РНК (gRNA), плюс-нити РНК (РНК(+)), минус-нити РНК (РНК(-)), геномной ДНК (gDNA), комплементарной ДНК (кДНК) или рекомбинантной ДНК. Полинуклеотиды включают одно- и двухнитевые полинуклеотиды. Предпочтительно полинуклеотиды по настоящему изобретению включают полинуклеотиды или варианты, характеризующиеся по меньшей мере приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с любой из эталонных последовательностей, описанных в данном документе (см., например, Перечень последовательностей), при этом, как правило, вариант сохраняет по меньшей мере одну биологическую активность эталонной последовательности. В различных иллюстративных вариантах осуществления настоящего изобретения предусмотрены, в частности, полинуклеотиды, содержащие векторы экспрессии, вирусные векторы и плазмиды-переносчики, а также композиции и клетки, содержащие их.
В конкретных вариантах осуществления настоящего изобретения предусмотрены полинуклеотиды, которые кодируют по меньшей мере приблизительно 5, 10, 25, 50, 100, 150, 200, 250, 300, 350, 400, 500, 1000, 1250, 1500, 1750 или 2000 или более смежных аминокислотных остатков полипептида по настоящему изобретению, а также все полипептиды промежуточной длины. Нетрудно понять, что «промежуточной длины» в данном контексте означает любую длину между приведенными значениями, например, 6, 7, 8, 9 и т.д., 101, 102, 103 и т.д.; 151, 152, 153 и т.д.; 201, 202, 203 и т.д.
Используемые в данном документе термины «вариант полинуклеотида» и «вариант» и т.п. относятся к полинуклеотидам, проявляющим существенную идентичность последовательности с эталонной полинуклеотидной последовательностью, или к полинуклеотидам, которые гибридизуются с эталонной последовательностью в жестких условиях, которые определены ниже в данном документе. Данные термины включают полинуклеотиды, в которых один или более нуклеотидов были добавлены или удалены, или замещены другими нуклеотидами по сравнению с эталонным полинуклеотидом. При этом из уровня техники хорошо известно, что определенные изменения, в том числе мутации, добавления, делеции и замены, можно выполнять относительно эталонного полинуклеотида, при условии, что измененный полинуклеотид сохраняет биологическую функцию или активность эталонного полинуклеотида.
Перечисления «идентичности последовательности» или содержащие, например, «последовательность на 50% идентичная», используемые в данном документе, относятся к степени, в которой данные последовательности являются идентичными при попарном сравнении нуклеотидов или попарном сравнении аминокислот в окне сравнения. Таким образом, «процентное значение идентичности последовательности» можно рассчитать путем сравнения двух последовательностей, подвергнутых оптимальному выравниванию в окне сравнения, определения числа положений, в которых идентичное основание нуклеиновой кислоты (например, A, T, C, G, I) или идентичный аминокислотный остаток (например, Ala, Pro, Ser, Thr, Gly, Val, Leu, Ile, Phe, Tyr, Trp, Lys, Arg, His, Asp, Glu, Asn, Gln, Cys и Met) встречаются в обеих последовательностях, чтобы получить число совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнения (т.е. размер окна) и умножения результата на 100 с получением процентного значения идентичности последовательностей. Предусмотрены нуклеотиды и полинуклеотиды, характеризующиеся по меньшей мере приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичностью последовательности с любой из эталонных последовательностей, описанных в данном документе, как правило, при условии что вариант полипептида сохраняет по меньшей мере одну биологическую активность эталонного полипептида.
Термины, используемые для описания взаимосвязи последовательностей двух или более полинуклеотидов или полипептидов, включают следующие: «эталонная последовательность», «окно сравнения», «идентичность последовательности», «процентное значение идентичности последовательности» и «существенная идентичность». Длина «эталонной последовательности» составляет по меньшей мере 12, но чаще 15-18 и зачастую по меньшей мере 25 мономерных единиц, в том числе нуклеотидов и аминокислотных остатков. Поскольку каждый из двух полинуклеотидов может содержать (1) последовательность (т.е. только часть полной полинуклеотидной последовательности), которая сходна в двух полинуклеотидах, и (2) последовательность, которая отлична в двух полинуклеотидах, сравнение последовательности двух (или более) полинуклеотидов, как правило, выполняют путем сравнения последовательностей двух полинуклеотидов в «окне сравнения» для выявления и сравнения локальных областей сходства последовательностей. «Окно сравнения» относится к умозрительному сегменту по меньшей мере из 6 смежных положений, обычно от приблизительно 50 до приблизительно 100, чаще от приблизительно 100 до приблизительно 150, в котором последовательность сравнивают с эталонной последовательностью из того же количества смежных положений после того, как две последовательности подвергли оптимальному выравниванию. Окно сравнения может содержать приблизительно 20% или меньше добавлений или делеций (т.е. гэпов) по сравнению с эталонной последовательностью (которая не содержит добавлений или делеций) для оптимального выравнивания двух последовательностей. Оптимальное выравнивание последовательностей для выравнивания в окне сравнения можно проводить с помощью компьютеризированной реализации алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics версия 7.0, Genetics Computer Group, 575 Science Drive, Мэдисон, Висконсин, США) или посредством просмотра наилучшего выравнивания (т.е. приводящего к наиболее высокому процентному значению гомологии в окне сравнения), полученному с помощью любого из различных выбранных способов. Также можно упомянуть семейство программ BLAST, например, раскрытое в Altschul et al., 1997, Nucl. Acids Res. 25:3389. Подробное обсуждение анализа последовательностей можно найти в разделе 19.3 в Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons Inc, 1994-1998, Chapter 15.
Используемый в данном документе «выделенный полинуклеотид» относится к полинуклеотиду, который был очищен от последовательностей, которые фланкируют его во встречающемся в пироде состоянии, например, ДНК-фрагменту, который был освобожден от последовательностей, которые в норме расположены рядом с фрагментом. «Выделенный полинуклеотид» относится также к комплементарной ДНК (кДНК), рекомбинантной ДНК или другому полинуклеотиду, который не существует в природе и который был создан руками человека.
Термины, описывающие ориентацию полинуклеотидов, включают: 5' (в норме конец полинуклеотида со свободной фосфатной группой) и 3' (в норме конец полинуклеотида со свободной гидроксильной (OH) группой). Полинуклеотидные последовательности могут быть аннотировны в ориентации 5'-3' или в ориентации 3'-5'. В случае ДНК и мРНК нить 5'-3' обозначают как «смысловую», «плюс» или «кодирующую» нить, поскольку ее последовательность идентична последовательности предшественника матричной РНК (пре-мРНК) [за исключением урацила (U) в РНК, вместо тимина (T) в ДНК]. В случае ДНК и мРНК комплементарную нить 3'-5', которая представляет собой нить, транскрибируемую РНК-полимеразой, обозначают как «шаблон», «антисмысловая», «минус» или «некодирующая» цепь. Используемый в данном документе термин «обратная ориентация» относится к последовательности 5'-3', записанной в ориентации 3'-5', или последовательности 3'-5', записанной в ориентации 5'-3'.
Термины «комплементарный» и «комплементарность» относятся к полинуклеотидам (т.е. последовательности из нуклеотидов), состоящим во взаимосвязи по правилам спаривания оснований. Например, комплементарная цепь последовательности ДНК 5' A G T C A T G 3' представляет собой 3' T C A G T A C 5'. Последнюю последовательность часто записывают в виде обратно комплементарной с 5'-концом слева и 3'-концом справа 5' C A T G A C T 3'. Последовательность, которая эквивалентна своей обратно комплементарной последовательности, считается палиндромной последовательностью. Комплементарность может быть «частичной», при этом только некоторые основания нуклеиновой кислоты совпадают в соответствии с правилами спаривания оснований. Или же между нуклеиновыми кислотами может быть «полная» или «тотальная» комплементарность.
Более того, специалистам в данной области будет понятно, что из-за вырожденности генетического кода существует множество нуклеотидных последовательностей, которые кодируют полипептид, или его фрагмент, или вариант, как описано в данном документе. Некоторые из этих полинуклеотидов характеризуются минимальной гомологией с нуклеотидной последовательностью какого бы то ни было нативного гена. Тем не менее полинуклеотиды, которые отличаются вследствие различий в частоте использования кодонов особым образом рассматриваются в настоящем изобретении, например, полинуклеотиды, которые оптимизированы для выбора кодонов, оптимальных для человека и/или приматов. Кроме того, также могут использоваться аллели генов, содержащих полинуклеотидные последовательности, предусмотренные в данном документе. Аллели представляют собой эндогенные гены, которые изменены в результате одной или более мутаций, таких как делеции, добавления и/или замещения нуклеотидов.
Термин «кассета нуклеиновой кислоты», используемый в данном документе, относится к генетическим последовательностям в пределах вектора, которые могут экспрессировать РНК, а затем белок. Кассета нуклеиновой кислоты содержит промотор и ген, представляющий интерес, например, CAR. Кассета нуклеиновой кислоты ориентирована в пределах вектора с точки зрения положения и последовательного размещения таким образом, что нуклеиновая кислота в кассете может транскрибироваться в РНК и, при необходимости, транслироваться в белок или полипептид, который подвергается соответствующим посттрансляционным модификациям, необходимым для активности в трансформированной клетке, и также перемещается в соответствующий компартмент для биологической активности путем направления в соответствующие внутриклеточные компартменты или секреции во внеклеточные компартменты. Предпочтительно 3'- и 5'-концы кассеты приспособлены для беспрепятственной вставки в вектор, например, она содержит сайты для рестрикционной эндонуклеазы на каждом конце. В предпочтительном варианте осуществления настоящего изобретения кассета нуклеиновой кислоты содержит последовательность MND-промотора и химерного антигенного рецептора, рассмотренных в данном документе. Кассета может быть удалена и вставлена в плазмидный или вирусный вектор как отдельная единица.
В конкретных вариантах осуществления полинуклеотиды включают по меньшей мере один полинуклеотид, представляющий интерес. Используемый в данном документе термин «полинуклеотид, представляющий интерес» относится к полинуклеотиду, кодирующему полипептид (т.е. полипептид, представляющий интерес), вставленному в вектор экспрессии, экспрессию которого требуется осуществить. Вектор может содержать 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 полинуклеотидов, представляющих интерес. В определенных вариантах осуществления полинуклеотид, представляющий интерес, кодирует полипептид, который обеспечивает терапевтический эффект при лечении или предупреждении заболевания или нарушения. Полинуклеотиды, представляющие интерес, а также полипептиды, кодируемые ими, включают как полинуклеотиды, которые кодируют полипептиды дикого типа, так и их функциональные варианты и фрагменты. В конкретных вариантах осуществления функциональный вариант характеризуется по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95% или по меньшей мере 99% идентичностью с соответствующей эталонной полинуклеотидной или полипептидной последовательностью дикого типа. В определенных вариантах осуществления функциональный вариант или фрагмент характеризуются по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или по меньшей мере 90% биологической активностью относительно соответствующего полипептида дикого типа.
В одном варианте осуществления полинуклеотид, представляющий интерес, не кодирует полипептид, но служит в качестве шаблона для транскрипции miRNA, siRNA или shRNA, рибозима или других ингибиторных РНК. В различных других вариантах осуществления полинуклеотид содержит полинуклеотид, представляющий интерес, кодирующий CAR, и один или более дополнительных полинуклеотидов, представляющих интерес, в том числе без ограничения ингибиторную последовательность нуклеиновой кислоты, в том числе без ограничения: siRNA, miRNA, shRNA и рибозим.
Используемые в данном документе термины «siRNA» или «короткая интерферирующая РНК» относятся к короткой полинуклеотидной последовательности, которая опосредует процесс специфичного в отношении последовательности посттранскрипционного сайленсинга генов, ингибирования трансляции, ингибирования транскрипции или эпигентической RNAi у животных (Zamore et al., 2000, Cell, 101, 25-33; Fire et al., 1998, Nature, 391, 806; Hamilton et al., 1999, Science, 286, 950-951; Lin et al., 1999, Nature, 402, 128-129; Sharp, 1999, Genes & Dev., 13, 139-141; и Strauss, 1999, Science, 286, 886). В определенных вариантах осуществления siRNA содержит первую нить и вторую нить, которые имеют одинаковое число нуклеозидов; однако, первая и вторая нити смещены так, что два концевых нуклеозида на первой и второй нитях не спарены с остатком на комплементарной цепи. В некоторых случаях два таких неспаренных нуклеозида представляют собой остатки тимидина. siRNA должна включать область с достаточной степенью гомологии относительно целевого гена, и иметь достаточную длину в нуклеотидах, чтобы siRNA или ее фрагмент могли опосредовать отрицательную регуляцию целевого гена. Таким образом, siRNA включает область, которая по меньшей мере частично комплементарна целевой РНК. Полная комплементарность между siRNA и мишенью не является обязательной, но соответствие между ними должно быть достаточным для обеспечения возможности того, чтобы siRNA или продукт ее расщепления управляли специфичным в отношении последовательности сайленсингом, например, путем RNAi-расщепления целевой РНК. Комплементарность или степень гомологии с целевой нитью является наиболее критическим параметром для антисмысловой цепи. Несмотря на то, что зачастую требуется полная комплементарность, в частности антисмысловой цепи, в некоторых вариантах осуществления предусмотрены одно или более, но предпочтительно 10, 8, 6, 5, 4, 3, 2 или меньше несовпадений относительно целевой РНК. Несовпадения наиболее допустимы в концевых областях, и, если присутствуют, они предпочтительно находятся в концевой области или областях, например, в пределах 6, 5, 4 или 3 нуклеотидов на 5' и/или 3' конце. Смысловая цепь должна только быть в достаточной степени комплементарна антисмысловой цепи для поддержания общей двухнитевой природы молекулы.
Кроме того, siRNA может быть модифицирована или включать аналоги нуклеозидов. Однонитевые области siRNA могут быть модифицированы или включать аналоги нуклеозидов, например, неспаренная область или области «шпилечной» структуры, например, область, которая связывает две комплементарные области, может иметь модификации или аналоги нуклеозидов. Модификации также применимы для стабилизации одного или более 3'- или 5'-концов siRNA, например, защиты от действия экзонуклеаз, или для содействия введению антисмыслового siRNA-агента в RISC. Модификации могут включать C3 (или C6, C7, C12) амино-линкеры, тиольные линкеры, карбоксильные линкеры, ненуклеотидные спейсеры (C3, C6, C9, C12, с удаленными азотистыми основаниями, триэтиленгликоль, гексаэтиленгликоль), специальные биотиновые или флуоресцеиновые реагенты, которые являются фосфорамидитами, и которые характеризуются другой DMT-защищенной гидроксильной группой, что обеспечивает возможность множественного связывания в процессе синтеза РНК. Длина каждой нити siRNA может быть равна или меньше 30, 25, 24, 23, 22, 21 или 20 нуклеотидов. Длина нить предпочтительно составляет по меньшей мере 19 нуклеотидов. Например, длина каждой нити может составлять от 21 до 25 нуклеотидов. Предпочтительные siRNA имеют дуплексную область из 17, 18, 19, 20, 21, 22, 23, 24 или 25 пар нуклеотидов, и один или более «липких концов» из 2-3 нуклеотидов, предпочтительно один или два 3' «липких конца» из 2-3 нуклеотидов.
Используемые в данном документе термины «miRNA» или «микроРНК» относятся к малым некодирующим РНК из 20-22 нуклеотидов, обычно вырезанным из ~70 нуклеотидных структур-предшественников самогибридизирующейся РНК, известных как пре-miRNA. miRNA отрицательно регулируют свои мишени одним из двух способов в зависимости от степени комплементарности между miRNA и мишенью. Во-первых, miRNA, которая связывается с полной или практически полной комплементарностью с последовательностями мРНК, кодирующими белок, индуцирует путь РНК-опосредованной интерференции (RNAi). miRNA, которые оказывают свой регуляторный эффект посредством связывания с не полностью комплементарными сайтами в пределах 3'-нетранслируемых областей (UTR) их мРНК-мишеней, подавляют экспрессию целевых генов пост-транскрипционно, по-видимому, на уровне трансляции, посредством комплекса RISC, который схож или, возможно, идентичен тому, который используется в RNAi-пути. Что согласуется с контролем трансляции, miRNA, которые используют этот механизм, снижают уровни белка их целевых генов, но при этом уровни мРНК этих генов подвергаются лишь минимальному воздействию. miRNA охватывают как встречающиеся в природе miRNA, так и разработанные искусственно miRNA, которые могут специфически нацеливаться на любую последовательность мРНК. Например, в одном варианте осуществления специалист в данной области может разработать короткие шпилечные РНК-конструкции, экспрессируемые в виде первичных транскриптов miRNA (например, miR-30 или miR-21) человека. В ходе такой разработки в шпилечную конструкцию добавляют сайт процессинга под действием Drosha, и, как было показано, значительно повышают эффективность нокдауна (Pusch et al., 2004). Стебель шпильки состоит из 22 нуклеотидов dsRNA (например, антисмысловой цепи, которая характеризуется полной комплементарностью с требуемой мишенью) и 15-19-нуклеотидной петли из miR человека. Добавление miR-петли и miR30-фланкирующих последовательностей с одной или с обеих сторон шпильки приводит к более чем 10-кратному увеличению процессинга экспрессируемых шпилек под действием Drosha и Dicer, при сравнении с традиционными структурами shRNA без микроРНК. Увеличенный уровень процессинга под действием Drosha и Dicer обуславливает большую продукцию siRNA/miRNA и большую эффективность экспрессированных шпилек.
Используемые в данном документе термины «shRNA» или «короткая шпилечная РНК» относится к двухнитевой структуре, образованной одной самокомплементарной нитью РНК. Конструкции shRNA, содержащие нуклеотидную последовательность, идентичную части, либо кодирующей, либо некодирущей последовательности целевого гена, являются предпочтительными для ингибирования. Было обнаружено, что последовательности РНК с вставками, делециями и одиночными точечными мутациями относительно целевой последовательности также могут быть эффективными для ингибирования. Предпочтительной является идентичность последовательностей, составляющая более 90%, или даже идентичность последовательностей, составляющая 100%, между ингибирующей РНК и частью целевого гена. В определенных предпочтительных вариантах осуществления длина образующей дуплекс части shRNA составляет по меньшей мере 20, 21 или 22 нуклеотида, что, например, соответствует размеру продуктов РНК, получаемых в результате Dicer-зависимого расщепления. В определенных вариантах осуществления длина shRNA-конструкции составляет по меньшей мере 25, 50, 100, 200, 300 или 400 оснований. В определенных вариантах осуществления длина shRNA-конструкции составляет 400-800 оснований. shRNA-конструкции являются высокоустойчивыми к изменению последовательности петли и размера петли.
Используемый в данном документе термин «рибозим» относится к каталитически активной молекуле РНК, способной к сайт-специфическому расщеплению целевой мРНК. Были описаны несколько подтипов, например, рибозимы в виде «головки молотка» и «шпильки». Каталитическая активность и стабильность рибозимов может быть улучшена посредством замещения дезоксирибонуклеотидов на рибонуклеотиды в некаталитических основаниях. Поскольку для разрушения конкретных мРНК могут быть использованы рибозимы, которые расщепляют мРНК в сайт-специфических последовательностях распознавания, применение рибозимов в виде «головки молотка» является предпочтительным. Рибозимы в виде «головки молотка» расщепляют мРНК в положениях, определяемых фланкирующими областями, которые образуют комплементарные пары оснований с целевой мРНК. Единственным требованием является то, чтобы целевая мРНК имела следующую последовательность из двух оснований: 5'-UG-3'. Конструирование и получение рибозимов в виде «головки молотка» хорошо известны из уровня техники.
Предпочтительный способ доставки полинуклеотида, представляющего интерес, который представляет собой siRNA, miRNA, shRNA или рибозим, предусматривает одну или более регуляторных последовательностей, таких как, например, сильный конститутивный pol III, например, промотор U6 snRNA человека, промотор U6 snRNA мыши, промотор H1 РНК человека и мыши и промотор tRNA-val человека, или сильный конститутивный промотор pol II, описываемые в других частях данного документа.
Полинуклеотиды по настоящему изобретению, независимо от длины кодирующей последовательности как таковой, можно объединять с другими последовательностями ДНК, такими как промоторы и/или энхансеры, нетранслируемые области (UTR), последовательности Козак, сигналы полиаденилирования, дополнительные сайты для ферментов рестрикции, множественные сайты клонирования, сайты внутренней посадки рибосомы (IRES), сайты распознавания рекомбиназ (например, сайты LoxP, FRT и Att), стоп-кодоны, сигналы терминации транскрипции и полинуклеотиды, кодирующие саморасщепляющиеся полипептиды, эпитопные метки, как описано в других частях данного документа или как известно из уровня техники, так что их общая длина может значительно изменяться. В связи с этим предполагается, что может быть использован полинуклеотидный фрагмент практически любой длины, при этом общая длина предпочтительно ограничивается простотой получения и применения в предполагаемом протоколе рекомбинантной ДНК.
Полинуклеотиды могут быть получены, подвергнуты манипуляциям и/или экспрессированы с помощью любой из множества хорошо отработанных методик, известных и доступных из уровня техники. Чтобы экспрессировать требуемый полипептид, нуклеотидная последовательность, кодирующая данный полипептид, может быть встроена в соответствующий вектор. Примерами векторов являются плазмиды, автономно реплицирующиеся последовательности и мобильные генетические элементы. Дополнительные примеры векторов включают без ограничений плазмиды, фагмиды, космиды, искусственные хромосомы, такие как дрожжевая искусственная хромосома (YAC), бактериальная искусственная хромосома (BAC) или искусственная хромосома, полученная из P1 (PAC), бактериофаги, такие как фаг лямбда или фаг M13, а также вирусы животных. Примеры категорий вирусов животных, применимых в качестве векторов, включают без ограничений ретровирус (в том числе лентивирус), аденовирус, аденоассоциированный вирус, герпесвирус (например, вирус простого герпеса), поксвирус, бакуловирус, папилломавирус и паповавирус (например, SV40). Примерами векторов экспрессии являются векторы pClneo (Promega) для экспрессии в клетках млекопитающих; pLenti4/V5-DEST™, pLenti6/V5-DEST™ и pLenti6.2/V5-GW/lacZ (Invitrogen) для опосредованного лентивирусами переноса генов и экспрессии в клетках млекопитающих. В конкретных вариантах осуществления кодирующие последовательности химерных белков, раскрытые в данном документе, могут быть лигированы в такие векторы экспрессии для экспрессии химерного белка в клетках млекопитающих.
«Элементы контроля» или «регуляторные последовательности», присутствующие в векторе экспрессии, представляют собой такие нетранслируемые области вектора - точку начала репликации, кассеты для отбора, промоторы, энхансеры, сигналы инициации трансляции (последовательность Shine Dalgarno или последовательность Козак), интроны, последовательность полиаденилирования, 5' и 3'-нетранслируемые области-которые взаимодействуют с клеточными белками хозяина для осуществления транскрипции и трансляции. Такие элементы могут различаться по своей силе и специфичности. В зависимости от используемых векторной системы и хозяина можно использовать любое число подходящих элементов транскрипции и трансляции, в том числе универсальные промоторы и индуцируемые промоторы.
В конкретных вариантах осуществления вектор для применения при осуществлении настоящего изобретения на практике, в том числе без ограничения векторы экспрессии и вирусные векторы, будет включать экзогенные, эндогенные или гетерологичные последовательности контроля, такие как промоторы и/или энхансеры. «Эндогенная» последовательность контроля представляет собой последовательность, которая в природных условиях связана с данным геном в геноме. «Экзогенная» последовательность контроля представляет собой последовательность, которая помещена в непосредственное соседство с геном при помощи манипуляции с генами (т.е. методик молекулярной биологии), так что транскрипция данного гена обусловлена связанным энхансером/промотором. «Гетерологичная» последовательность контроля представляет собой экзогенную последовательность, которая происходит от иного вида, чем клетка, подвергаемая генетическим манипуляциям.
Термин «промотор», используемый в данном документе, относится к сайту распознавания полинуклеотида (ДНК или РНК), с которым связывается РНК-полимераза. РНК-полимераза инициирует и транскрибирует полинуклеотиды, функционально связанные с промотором. В конкретных вариантах осуществления промоторы, активные в клетках млекопитающих, содержат AT-богатую область, расположенную примерно на 25-30 оснований выше сайта инициации транскрипции, и/или другую последовательность, расположенную на 70-80 оснований выше начала транскрипции, область CNCAAT, где N может представлять собой любой нуклеотид.
Термин «энхансер» относится к сегменту ДНК, который содержит последовательности, способные обеспечивать усиленную транскрипцию и, в некоторых случаях, способные функционировать независимо от их ориентации относительно другой последовательности контроля. Энхансер может функционировать совместно или аддитивно с промоторами и/или другими энхансерными элементами. Термин «промотор/энхансер» относится к сегменту ДНК, который содержит последовательности, способные обеспечивать как промоторные, так и энхансерные функции.
Термин «функционально связанный» относится к непосредственному соседству, при котором описанные компоненты находятся во взаимосвязи, позволяющей им функционировать надлежащим им образом. В одном варианте осуществления термин относится к функциональной связи между последовательностью контроля экспрессии нуклеиновой кислоты (такой как промотор и/или энхансер) и второй полинуклеотидной последовательностью, например, полинуклеотидом, представляющим интерес, где последовательность контроля экспрессии обеспечивает транскрипцию нуклеиновой кислоты, соответствующей второй последовательности.
Используемый в данном документе термин «последовательность контроля конститутивной экспрессии» относится к промотору, энхансеру или промотору/энхансеру, который непрерывно или постоянно обеспечивает возможность транскрипции функционально связанной последовательности. Последовательность контроля конститутивной экспрессии может представлять собой «универсальный» промотор, энхансер или промотор/энхансер, который обеспечивает возможность экспрессии в самых различных типах клеток и тканей, или «специфический в отношении клетки», «специфический в отношении типа клеток», «специфический в отношении линии клеток» или «специфический в отношении ткани» промотор, энхансер или промотор/энхансер, который обеспечивает возможность экспрессии в ограниченном количестве типов клеток и тканей, соответственно.
Иллюстративные универсальные последовательности контроля экспрессии, подходящие для применения в конкретных вариантах осуществления настоящего изобретения, включают без ограничений немедленно-ранний промотор цитомегаловируса (CMV), вирусный промотор вируса обезьян 40 (SV40) (например, ранний или поздний), LTR-промотор вируса мышиного лейкоза Молони (MoMLV), LTR вирус саркомы Рауса (RSV), промотор вируса простого герпеса (HSV) (тимидинкиназа), H5, P7.5, а также P11-промоторы вируса коровьей оспы, промотор фактора элонгации 1-альфа (EF1a), фактор раннего ростового ответа 1 (EGR1), ферритин H (FerH), ферритин L (FerL), глицеральдегид-3-фосфатдегидрогеназу (GAPDH), фактор инициации трансляции эукариот 4A1 (EIF4A1), 70 кДа белок теплового шока 5 (HSPA5), 90 кДа белок теплового шока бета, представитель 1 (HSP90B1), 70 кДа белок теплового шока (HSP70), β-кинезин (β-KIN), локус ROSA 26 человека (Irions et al., Nature Biotechnology 25, 1477 - 1482 (2007)), промотор убиквитина C (UBC), промотор фосфоглицераткиназы-1 (PGK), промотор из энхансера цитомегаловируса/промотора куриного β-актина (CAG), промотор β-актина и промотор (MND) с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля, с сайтом связывания праймера, замещенным на последовательность из dl587rev (Challita et al., J Virol. 69(2):748-55 (1995)).
В конкретном варианте осуществления может быть необходима экспрессия полинуклеотида, содержащего CAR, за счет промотора, который обеспечивает стабильную и долгосрочную экспрессию CAR в Т-клетках и на уровне, достаточном для перенаправления Т-клеток на клетки, экспрессирующие целевой антиген. В предпочтительном варианте осуществления промотор представляет собой MND-промотор.
В одном варианте осуществления вектор по настоящему изобретению содержит MND-промотор, содержащий одну или более нуклеотидных вставок, делеций, замен или модификаций, которые повышают, понижают или стабилизируют активность MND-промотора.
Используемая в данном документе «условная экспрессия» может относиться к любому типу условной экспрессии, в том числе без ограничений индуцируемой экспрессии; репрессируемой экспрессии; экспрессии в клетках или тканях, характеризующихся конкретным физиологическим, биологическим или болезненным состоянием и т.д. Данное определение не предназначено для исключения специфической в отношении типа клеток или ткани экспрессии. В определенных вариантах осуществления настоящего изобретения предусмотрена условная экспрессия полинуклеотида, представляющего интерес, например, экспрессия контролируется путем воздействия на клетку, ткань, организм и т.д., с помощью средства обработки или условия, которые вызывают экспрессию полинуклеотида или которые вызывают повышение или понижение уровня экспрессии полинуклеотида, кодируемого полинуклеотидом, представляющим интерес.
Иллюстративные примеры индуцируемых промоторов/систем включают без ограничений промоторы, индуцируемые стероидами, такие как промоторы генов, кодирующих глюкокортикоидные или эстрогеновые рецепторы (индуцируемые путем обработки соответствующим гормоном), металлотиониновый промотор (индуцируемый путем обработки различными тяжелыми металлами), MX-1-промотор (индуцируемый интерфероном), мифепристон-регулируемая система «GeneSwitch» (Sirin et al., 2003, Gene, 323:67), кумат-индуцируемый генный переключатель (WO 2002/088346), тетрациклин-зависимые регуляторные системы и т.д.
Условную экспрессию также можно обеспечить с помощью сайт-специфической ДНК-рекомбиназы. В соответствии с определенными вариантами осуществления настоящего изобретения вектор содержит по меньшей мере один (как правило два) сайт(-а) для рекомбинации, опосредованной сайт-специфической рекомбиназой. Используемые в данном документе термины «рекомбиназа» или «сайт-специфическая рекомбиназа» включают вырезающие или интегративные белки, ферменты, кофакторы или ассоциированные белки, которые вовлекаются в реакции рекомбинации с участием одного или более сайтов рекомбинации (например, двух, трех, четырех, пяти, семи, десяти, двенадцати, пятнадцати, двадцати, тридцати, пятьдесяти и т.д.), которые могут быть белками дикого типа (см. Landy, Current Opinion in Biotechnology 3:699-707 (1993)) или их мутантами, производными (например, белками слияния, содержащими последовательности белка рекомбинации или их фрагменты), фрагментами и вариантами. Иллюстративные примеры рекомбиназ, подходящих для применения в конкретных вариантах осуществления настоящего изобретения, включают без ограничения Cre, Int, IHF, Xis, Flp, Fis, Hin, Gin, ФC31, Cin, Tn3-резольвазу, TndX, XerC, XerD, TnpX, Hjc, Gin, SpCCE1 и ParA.
Векторы могут содержать один или более сайтов рекомбинации для любой из самых разнообразных сайт-специфических рекомбиназ. Следует понимать, что целевой сайт для сайт-специфической рекомбиназы является дополнением к любому сайту(-ам), необходимому для интеграции вектора, например, ретровирусного или лентивирусного вектора. Используемые в данном документе термины «последовательность рекомбинации», «сайт рекомбинации» или «сайт сайт-специфической рекомбинации» относятся к конкретной последовательности нуклеиновой кислоты, которую рекомбиназа распознает и с которой связывается.
Например, одним сайтом рекомбинации для рекомбиназы Cre является loxP, который представляет собой последовательность из 34 пар оснований, содержащую два инвертированных повтора из 13 пар оснований (выступающих в роли сайтов связывания рекомбиназы), фланкирующих коровую последовательность из 8 пар оснований (см. ФИГ. 1 из Sauer, B., Current Opinion in Biotechnology 5:521-527 (1994)). Другие примеры loxP-сайтов включают без ограничений lox511 (Hoess et al., 1996; Bethke and Sauer, 1997), lox5171 (Lee and Saito, 1998), lox2272 (Lee and Saito, 1998), m2 (Langer et al., 2002), lox71 (Albert et al., 1995) и lox66 (Albert et al., 1995).
Подходящие сайты распознавания для FLP-рекомбиназы включают без ограничений FRT (McLeod, et al., 1996), F1, F2, F3 (Schlake and Bode, 1994), F4, F5 (Schlake and Bode, 1994), FRT(LE) (Senecoff et al., 1988), FRT(RE) (Senecoff et al., 1988).
Другими примерами последовательностей распознавания являются последовательности attB, attP, attL и attR, которые распознаются рекомбиназным ферментом λ-интегразой, например, phi-c31. ϕC31 SSR опосредует рекомбинацию только между гетеротипическими сайтами attB (длиной 34 п.н.) и attP (длиной 39 п.н.) (Groth et al., 2000). Каждый из attB и attP, названные из-за сайтов прикрепления фаговой интегразы на бактериальном или фаговом геномах, соответственно, содержит несовершенные инвертированные повторы, которые вероятно связываются гомодимерами ϕC31 (Groth et al., 2000). Сайты продукта, attL и attR, являются фактически не восприимчивыми к дальнейшей ϕC31-опосредованной рекомбинации (Belteki et al., 2003), что делает реакцию необратимой. Что касается катализа вставок, было обнаружено, что вставка ДНК, несущей attB, в геномный сайт attP происходит гораздо легче, чем вставка сайта attP в геномный сайт attB (Thyagarajan et al., 2001; Belteki et al., 2003). Таким образом, в типичных стратегиях в определенном локусе с помощью гомологичной рекомбинации размещают attP-несущий «сайт стыковки», который затем кооперируют с attB-несущей входящей последовательностью для вставки.
Используемый в данном документе «сайт внутренней посадки рибосомы» или «IRES» относится к элементу, который содействует непосредственной внутренней посадке рибосомы на кодон инициации, такой как ATG, цистрона (область, кодирующая белок), с обеспечением тем самым кэп-независимой трансляции гена. См., например, Jackson et al., 1990. Trends Biochem Sci 15(12):477-83) и Jackson and Kaminski. 1995. RNA 1(10):985-1000. В конкретных вариантах осуществления векторы, рассмотренные в настоящем изобретении, включают один или более полинуклеотидов, представляющих интерес, которые кодируют один или более полипептидов. В конкретных вариантах осуществления для достижения эффективной трансляции каждого из множества полипептидов полинуклеотидные последовательности можно отделять с помощью одной или более последовательностей IRES или полинуклеотидных последовательностей, кодирующих саморасщепляющиеся полипептиды.
Используемый в данном документе термин «последовательность Козак» относится к короткой нуклеотидной последовательности, которая в значительной степени облегчает начальное связывание мРНК с малой субъединицей рибосомы и усиливает трансляцию. Консенсусная последовательность Козак представляет собой (GCC)RCCATGG (SEQ ID NO:27), где R представляет собой пурин (A или G) (Kozak, 1986. Cell. 44(2):283-92, и Kozak, 1987. Nucleic Acids Res. 15(20):8125-48). В конкретных вариантах осуществления векторы, рассмотренные в настоящем изобретении, содержат полинуклеотиды, которые содержат консенсусную последовательность Козак и которые кодируют требуемый полипептид, например, CAR.
В некоторых вариантах осуществления настоящего изобретения в полинуклеотиде или клетке, содержащей полинуклеотид, используют «суицидальный» ген, в том числе индуцируемый «суицидальный» ген, для снижения риска прямой токсичности и/или неконтролируемой пролиферации. В конкретных аспектах «суицидальный» ген не является иммуногенным для хозяина, содержащего полинуклеотид или клетку. Конкретным примером «суицидального» гена, который можно использовать, является каспаза-9, или каспаза-8, или цитозиндезаминаза. Каспаза-9 может быть активирована с помощью специфического химического индуктора димеризации (CID).
В определенных вариантах осуществления векторы содержат генные сегменты, которые делают иммунные эффекторные клетки по настоящему изобретению, например, Т-клетки, восприимчивыми к негативной селекции in vivo. Под «негативной селекцией» подразумевают, что введенная клетка может быть элиминирована при изменении в in vivo состоянии индивидуума. Негативно селектируемый фенотип может возникнуть в результате вставки гена, который придает чувствительность к вводимому средству, например, соединению. Негативно селектируемые гены известны из уровня техники и включают, среди прочего, следующие гены: ген тимидинкиназы вируса простого герпеса типа I (HSV-I TK) (Wigler et al., Cell 11:223, 1977), который придает чувствительность к ганцикловиру; ген клеточной гипоксантинфосфорибозилтрансферазы (HPRT), ген аденинфосфорибозилтрансферазы (APRT) и ген бактериальной цитозиндезаминазы (Mullen et al., Proc. Natl. Acad. Sci. USA. 89:33 (1992)).
В некоторых вариантах осуществления генетически модифицированные иммунные эффекторные клетки, такие как Т-клетки, содержат полинуклеотид, дополнительно содержащий позитивный маркер, который обеспечивает селекцию клеток с негативно селектируемым фенотипом in vitro. Позитивно селектируемый маркер может представлять собой ген, который, будучи введенным в клетку-хозяина, экспрессирует доминантный фенотип, допускающий позитивную селекцию клеток, несущих данный ген. Гены этого типа хорошо известны из уровня техники и включают, среди прочего, ген гигромицин-В-фосфотрансферазы (hph), который придает устойчивость к гигромицину-B, ген аминогликозидфософотрансферазы (neo или aph) из Tn5, который кодирует устойчивость к антибиотику G418, ген дигидрофолатредуктазы (DHFR), ген аденозиндезаминазы (ADA) и ген множественной лекарственной устойчивости (MDR).
Предпочтительно позитивно селектируемый маркер и негативно селектируемый элемент связаны, так что утрата негативно селектируемого элемента обязательно сопровождается утратой позитивно селектируемого маркера. Еще более предпочтительным является слияние позитивного и негативного селектируемых маркеров, так что утрата одного неизбежно ведет к утрате другого. Примером слитого полинуклеотида, продуктом экспрессии которого является полипептид, который придает одновременно требуемые признаки для позитивной и негативной селекции, описанные выше, является слитый ген гигромицинфосфотрансферазы и тимидинкиназы (HyTK). Экспрессия этого гена дает полипептид, который придает устойчивость к гигромицину B для позитивной селекции in vitro, а также чувствительность к ганцикловиру для негативной селекции in vivo. См. Lupton S. D., et al, Mol. and Cell. Biology 1 1:3374- 3378, 1991. Кроме того, в предпочтительных вариантах осуществления полинуклеотиды по настоящему изобретению, кодирующие химерные рецепторы, находятся в ретровирусных векторах, содержащих слитый ген, в частности, придающий устойчивость к гигромицину B для позитивной селекции in vitro, а также чувствительность к ганцикловиру для негативной селекции in vivo, например, в ретровирусном векторе с HyTK, описанном в Lupton, S. D. et al. (1991), выше. См. также публикации PCT US91/08442 и PCT/US94/05601, от S.D. Lupton, описывающие применение бифункциональных селектируемых слитых генов, полученных путем слияния доминантных позитивных селектируемых маркеров с негативными селектируемыми маркерами.
Предпочтительные позитивные селектируемые маркеры происходят из генов, выбранных из группы, включающей hph, nco и gpt, а предпочтительные негативные селектируемые маркеры происходят из генов, выбранных из группы, включающей цитозиндезаминазу, HSV-I TK, VZV TK, HPRT, APRT и gpt. Особенно предпочтительные маркеры представляют собой бифункциональные селектируемые слитые гены, при этом позитивный селектируемый маркер происходит из hph или neo, а негативный селектируемый маркер происходит из цитозиндезаминазы, или гена или селектируемого маркера TK.
F. Вирусные векторы
В конкретных вариантах осуществления клетку (например, Т-клетку) трансдуцируют с помощью ретровирусного вектора, например, лентивирусного вектора, кодирующего CAR. Например, вектор содержит MND-промотор и кодирует CAR, который объединяет антиген-специфический связывающий домен антитела, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2, с внутриклеточным доменом передачи сигнала CD3ς, CD28, 4-1BB, Ox40 или любые их комбинации. Таким образом, эти трансдуцированные Т-клетки могут вызывать стабильный, долгосрочный и стойкий CAR-опосредованный T-клеточный ответ.
Ретровирусы представляют собой обычный инструмент для генной доставки (Miller, 2000, Nature. 357: 455-460). В конкретных вариантах осуществления ретровирус применяют для доставки полинуклеотида, кодирующего химерный антигенный рецептор (CAR), в клетку. Используемый в данном документе термин «ретровирус» относится к РНК-вирусу, который обратно транскрибирует свою геномную РНК в линейную двухнитевую ДНК-копию, а затем ковалентно интегрирует свою геномную ДНК в геном хозяина. После того как вирус интегрируется в геном хозяина, он называется «провирусом». Провирус служит в качестве шаблона для РНК-полимеразы II и управляет экспрессией молекул РНК, которые кодируют структурные белки и ферменты, необходимые для получения новых вирусных частиц.
Иллюстративные ретровирусы, подходящие для применения в конкретных вариантах осуществления, включают без ограничений: вирус мышиного лейкоза Молони (M-MuLV), вирус саркомы мышей Молони (MoMSV), вирус саркомы мышей Харви (HaMuSV), вирус опухоли молочной железы мышей (MuMTV), вирус лейкоза гиббонов (GaLV), вирус лейкоза кошек (FLV), спумавирус, вирус лейкоза мышей Френда, вирус стволовых клеток мышей (MSCV), вирус саркомы Рауса (RSV) и лентивирус.
Используемый в данном документе термин «лентивирус» относится к группе (или роду) сложных ретровирусов. Иллюстративные лентивирусы включают без ограничений: HIV (вирус иммунодефицита человека; в том числе HIV 1 типа и HIV 2 типа); вирус висна-маэди (VMV); вирус артрита-энцефалита коз (CAEV); вирус инфекционной анемии лошадей (EIAV); вирус иммунодефицита кошек (FIV); вирус иммунодефицита крупного рогатого скота (BIV) и вирус иммунодефицита обезьян (SIV). В одном варианте осуществления предпочтительными являются векторные остовы на основе HIV (т.е. цис-действующие элементы последовательности HIV). В конкретных вариантах осуществления лентивирус применяют для доставки в клетку полинуклеотида, содержащего MND-промотор и кодирующего CAR.
Ретровирусные векторы и, более конкретно, лентивирусные векторы могут применяться при осуществлении конкретных вариантов осуществления настоящего изобретения на практике. Соответственно, используемый в данном документе термин «ретровирус» или «ретровирусный вектор» подразумевает как включение «лентивируса» и «лентивирусных векторов», соответственно.
Используемый в данном документе термин «вектор» относится к молекуле нуклеиновой кислоты, способной переносить или транспортировать другую молекулу нуклеиновой кислоты. Переносимая нуклеиновая кислота обычно связана с векторной молекулой нуклеиновой кислоты, например, вставлена в нее. Вектор может содержать последовательности, которые управляют автономной репликацией в клетке, или может содержать последовательности, достаточные для обеспечения интеграции в ДНК клетки-хозяина. Применимые векторы включают, например, плазмиды (например, ДНК-плазмиды или РНК-плазмиды), транспозоны, космиды, бактериальные искусственные хромосомы и вирусные векторы. Применимые вирусные векторы включают, например, ретровирусы с дефектной системой репликации и лентивирусы.
Как будет очевидно специалисту в данной области, термин «вирусный вектор» широко используется для обозначения либо молекулы нуклеиновой кислоты (например, плазмиды-переносчика), которая включает элементы, происходящие из нуклеиновой кислоты вируса, которые, как правило, облегчают перенос молекулы нуклеиновой кислоты или ее интеграцию в геном клетки, либо вирусной частицы, которая опосредует перенос нуклеиновой кислоты. Вирусные частицы, как правило, будут включать различные вирусные компоненты и иногда также компоненты клетки-хозяина в дополнение к нуклеиновой кислоте(ам).
Термин «вирусный вектор» может относиться либо к вирусу или вирусной частице, способным переносить нуклеиновую кислоту в клетку, либо к самой переносимой нуклеиновой кислоте. Вирусные векторы и плазмиды-переносчики содержат структурные и/или функциональные генетические элементы, которые происходят преимущественно из вируса. Термин «ретровирусный вектор» относится к вирусному вектору или плазмиде, содержащим структурные или функциональные генетические элементы или их части, которые происходят преимущественно из ретровируса. Термин «лентивирусный вектор» относится к вирусному вектору или плазмиде, содержащим структурные или функциональные генетические элементы или их части, в том числе LTR, которые происходят преимущественно из лентивируса. Термин «гибридный вектор» относится к вектору, LTR или другой нуклеиновой кислоте, содержащим как ретровирусные например, лентивирусные, последовательности, так и вирусные последовательности, не являющиеся лентивирусными. В одном варианте осуществления гибридный вектор относится к вектору или плазмиде-переносчику, содержащим ретровирусные, например, лентивирусные, последовательности для обратной транскрипции, репликации, интеграции и/или упаковки.
В конкретных вариантах осуществления термины «лентивирусный вектор», «лентивирусный вектор экспрессии» могут использоваться в отношении лентивирусных плазмид-переносчиков и/или инфекционных лентивирусных частиц. Если в данном документе ссылаются на элементы, такие как сайты клонирования, промоторы, регуляторные элементы, гетерологичные нуклеиновые кислоты и т.д., следует понимать, что последовательности таких элементов представлены в форме РНК в лентивирусных частицах по настоящему изобретению и представлены в форме ДНК в ДНК-плазмидах по настоящему изобретению.
На каждом конце провируса находятся структуры, называемые «длинными концевыми повторами» или «LTR». Термин «длинный концевой повтор (LTR)» относится к доменам из пар оснований, расположенных на концах ретровирусных ДНК, которые в контексте их природных последовательностей представляют собой прямые повторы и содержат области U3, R и U5. LTR, как правило, обеспечивают функции, существенные для экспрессии ретровирусных генов (например, индукции, инициации и полиаденилирования генных транскриптов) и для репликации вируса. LTR содержит множество регуляторных сигналов, в том числе элементы контроля транскрипции, сигналы полиаденилирования и последовательности, необходимые для репликации и интеграции вирусного генома. Вирусный LTR разделен на три области, называемые U3, R и U5. U3-область содержит энхансерные и промоторные элементы. U5-область представляет собой последовательность между сайтом связывания праймера и R-областью и содержит последовательность полиаденилирования. R (повтор)-область фланкирована U3- и U5-областями. LTR состоит из U3-, R- и U5-областей и встречается на обоих 5'- и 3'-концах вирусного генома. Рядом с 5' LTR находятся последовательности, необходимые для обратной транскрипции генома (сайт связывания праймера тРНК) и для эффективной упаковки вирусной РНК в частицы (Psi-сайт).
Используемый в данном документе термин «сигнал упаковки» или «последовательность упаковки» относится к последовательностям, расположенным в пределах ретровирусного генома, которые необходимы для вставки вирусной РНК в вирусный капсид или частицу, см., например, Clever et al., 1995. J. of Virology, Vol. 69, No. 4; pp. 2101-2109. В некоторых ретровирусных векторах используется минимальный сигнал упаковки (также называемый psi [ψ]-последовательность), необходимый для заключения вирусного генома в капсид. Таким образом, используемые в данном документе термины «последовательность упаковки», «сигнал упаковки», «psi» и символ «ψ» применяются в отношении некодирующей последовательности, необходимой для заключения ретровирусных нитей РНК в капсид во время сборки вирусной частицы.
В различных вариантах осуществления векторы содержат модифицированные 5' LTR и/или 3' LTR. Каждый или оба LTR могут содержать одну или более модификаций, в том числе без ограничений одну или более делеций, вставок или замен. Зачастую модификации в 3' LTR осуществляют для повышения безопасности лентивирусных или ретровирусных систем, путем придания вирусам дефектности по репликации. Используемый в данном документе термин «дефектный по репликации» относится к вирусу, который не способен к полноценной, эффективной репликации, так что не происходит образования инфекционных вирионов (например, дефектное по репликации лентивирусное потомство). Термин «компетентный по репликации» относится к вирусу дикого типа или мутантному вирусу, который способен к репликации, так что вирусная репликация вируса приводит к образованию инфекционных вирионов (например, компетентное по репликации лентивирусное потомство).
Термин «самоинактивирующиеся» (SIN) векторы относится к дефектным по репликации векторам, например, ретровирусным или лентивирусным векторам, в которых область энхансер-промотор правого (3') LTR, известная как U3-область, была модифицирована (например, посредством делеции или замены) для предотвращения вирусной транскрипции после первого цикла вирусной репликации. Это происходит потому, что во время вирусной репликации U3-область правого (3') LTR используется как шаблон для U3-области левого (5') LTR, и, таким образом, вирусный транскрипт не может быть получен без энхансера-промотора в U3. В дополнительном варианте осуществления настоящего изобретения модифицируют 3' LTR, так что U5-область замещена, например, идеальной последовательностью поли-(A). Следует отметить, что модификации LTR, такие как модификации 3' LTR, 5' LTR, или как 3', так и 5' LTR, также включены в объем настоящего изобретения.
Дополнительное усиление безопасности обеспечивают замещением U3-области 5' LTR гетерологичным промотором для управления транскрипцией вирусного генома во время образования вирусных частиц. Примеры гетерологичных промоторов, которые могут быть использованы, включают, например, вирусный промотор вируса обезьян 40 (SV40) (например, ранний или поздний), промотор цитомегаловируса (CMV) (например, немедленно-ранний), промотор вируса мышиного лейкоза Молони (MoMLV), промотор вируса саркомы Рауса (RSV) и промотор вируса простого герпеса (HSV) (тимидинкиназа). Типичные промоторы способны обеспечивать высокие уровни транскрипции Tat-независимым образом. Такое замещение снижает возможность рекомбинации с получением компетентных по репликации вирусов, поскольку в системе продукции вируса отсутствует полная последовательность U3. В определенных вариантах осуществления гетерологичный промотор имеет дополнительные преимущества в контроле способа, посредством которого транскрибируется вирусный геном. Например, гетерологичный промотор может быть индуцируемым, так что транскрипция всего или части вирусного генома будет происходить только в присутствии индуцирующих факторов. Индуцирующие факторы включают без ограничений одно или более химических соединений или физиологических условий, таких как температура или pH, при которых культивируются клетки-хозяева.
В некоторых вариантах осуществления вирусные векторы содержат элемент TAR. Термин «TAR» относится к генетическому элементу «трансактивационного ответа», расположенному в R-области лентивирусных (например, HIV) LTR. Данный элемент взаимодействует с лентивирусным трансактиваторным (tat) генетическим элементом для усиления вирусной репликации. Однако данный элемент не является необходимым в вариантах осуществления, где U3-область 5' LTR замещена гетерологичным промотором.
«R-область» относится к области в пределах ретровирусных LTR, начинающейся от начала кэпирующей группы (т.е. точки начала транскрипции) и заканчивающейся непосредственно перед началом поли-А-тракта. R-область также определяют как фланкированную U3- и U5-областями. R-область играет важную роль во время обратной транскрипции, обеспечивая перенос растущей нити ДНК от одного конца генома к другому.
Используемый в данном документе термин «FLAP-элемент» относится к нуклеиновой кислоте, последовательность которой содержит центральный полипуриновый тракт и центральные последовательности терминации (cPPT и CTS) ретровируса, например, HIV-1 или HIV-2. Подходящие FLAP-элементы описаны в патенте США №6682907 и в Zennou, et al., 2000, Cell, 101:173. Во время обратной транскрипции HIV-1 центральная инициация плюс-нити ДНК в центральном полипуриновом тракте (cPPT) и центральная терминация в центральной последовательности терминации (CTS) приводит к образованию трехнитевой ДНК-структуры: центрального ДНК-флэпа HIV-1. Без желания быть связанными какой-либо теорией, ДНК-флэп может действовать как цис-активная детерминанта ядерного импорта лентивирусного генома и/или может повышать титр вируса. В конкретных вариантах осуществления ретровирусный или лентивирусный векторные остовы содержат один или более FLAP-элементов, расположенных в векторах выше или ниже гетерологичных генов, представляющих интерес. Например, в конкретных вариантах осуществления плазмида-переносчик содержит FLAP-элемент. В одном варианте осуществления вектор по настоящему изобретению содержит FLAP-элемент, выделенный из HIV-1.
В одном варианте осуществления ретровирусные или лентивирусные векторы-переносчики содержат один или более экспортных элементов. Термин «экспортный элемент» относится к цис-действующему посттранскрипционному регуляторному элементу, который регулирует транспорт РНК-транскрипта из ядра в цитоплазму клетки. Примеры РНК-экспортных элементов включают без ограничений элемент rev-ответа (RRE) вируса иммунодефицита человека (HIV) (см., например, Cullen et al., 1991. J. Virol. 65: 1053; и Cullen et al., 1991. Cell 58: 423) и посттранскрипционный регуляторный элемент вируса гепатита В (HPRE). Как правило, РНК-экспортный элемент расположен в пределах 3' UTR гена и может быть встроен в виде одной или множественных копий.
В конкретных вариантах осуществления экспрессию гетерологичных последовательностей в вирусных векторах повышают посредством внедрения в векторы посттранскрипционных регуляторных элементов, эффективных сайтов полиаденилирования и, необязательно, сигналов терминации транскрипции. Разнообразные посттранскрипционные регуляторные элементы могут увеличивать экспрессию гетерологичной нуклеиновой кислоты в белок, например, посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE; Zufferey et al., 1999, J. Virol., 73:2886); посттранскрипционный регуляторный элемент, присутствующий в вирусе гепатита В (HPRE) (Huang et al., Mol. Cell. Biol., 5:3864); и подобные (Liu et al., 1995, Genes Dev., 9:1766). В конкретных вариантах осуществления векторы по настоящему изобретению содержат посттранскрипционный регуляторный элемент, такой как WPRE или HPRE.
В конкретных вариантах осуществления векторы по настоящему изобретению лишены или не содержат посттранскрипционный регуляторный элемент, такой как WPRE или HPRE, поскольку в некоторых случаях такие элементы повышают риск клеточной трансформации и/или не увеличивают в существенной или значительной степени количество мРНК-транскрипта или не повышают стабильность мРНК. Следовательно, в некоторых вариантах осуществления векторы по настоящему изобретению лишены или не содержат WPRE или HPRE в качестве дополнительной меры безопасности.
Элементы, управляющие эффективной терминацией или полиаденилированием транскриптов гетерологичных нуклеиновых кислот, увеличивают экспрессию гетерологичных генов. Сигналы терминации транскрипции, как правило, находятся ниже сигнала полиаденилирования. В конкретных вариантах осуществления векторы содержат последовательность полиаденилирования за 3'-концом полинуклеотида, кодирующего полипептид, подлежащий экспрессии. Используемый в данном документе термин «сайт поли(А)» или «поли(А)-последовательность» описывает последовательность ДНК, которая управляет как терминацией, так и полиаденилированием растущей нити РНК-транскрипта с помощью РНК-полимеразы II. Последовательности полиаденилирования могут повышать стабильность мРНК путем добавления поли(А)-хвоста к 3'-концу кодирующей последовательности, и тем самым содействуя увеличению эффективности трансляции. Эффективное полиаденилирование рекомбинантного транскрипта необходимо, поскольку транскрипты, лишенные поли(А)-хвоста, являются нестабильными и легко подвергаются деградации. Иллюстративные примеры поли(А)-сигналов, которые могут быть использованы в векторе по настоящему изобретению, включают идеальную поли(A)-последовательность (например, AATAAA, ATTAAA, AGTAAA), поли(A)-последовательность бычьего гормона роста (BGHpA), поли(А)-последовательность β-глобина кролика (rβgpA) или другую подходящую гетерологичную или эндогенную поли(А)-последовательность, известную из уровня техники.
В определенных вариантах осуществления ретровирусный или лентивирусный вектор дополнительно содержит один или более инсуляторных элементов. Инсуляторные элементы могут способствовать защите последовательностей, экспрессируемых лентивирусом, например, терапевтических полипептидов, от эффектов сайтов интеграции, которые могут быть опосредованы цис-действующими элементами, присутствующими в геномной ДНК и приводящими к разрегулированию экспрессии перенесенной последовательности (т.е. эффект положения; см., например, Burgess-Beusse et al., 2002, Proc. Natl. Acad. Sci., USA, 99:16433; и Zhan et al., 2001, Hum. Genet., 109:471). В некоторых вариантах осуществления векторы-переносчики содержат один или более инсуляторных элементов в 3′ LTR, и после интеграции провируса в геном хозяина провирус содержит один или более инсуляторов как в 5′ LTR, так и в 3′ LTR за счет дупликации 3′ LTR. Инсуляторы, подходящие для применения по настоящему изобретению, включают без ограничений инсулятор куриного β-глобина (см. Chung et al., 1993. Cell 74:505; Chung et al., 1997. PNAS 94:575; и Bell et al., 1999. Cell 98:387, включенные в данный документ посредством ссылки). Примеры инсуляторных элементов включают без ограничений инсулятор из локуса β-глобина, такой как куриный HS4.
В соответствии с некоторыми конкретными вариантами осуществления настоящего изобретения большинство или все последовательности остовов вирусных векторов происходят из лентивируса, например, HIV-1. Однако следует понимать, что можно использовать или объединять множество источников ретровирусных и/или лентивирусных последовательностей, а также множество замен и изменений можно поместить в некоторые лентивирусные последовательности без ухудшения способности вектора-переносчика выполнять функции, описанные в данном документе. Более того, из уровня техники известно множество лентивирусных векторов, см. Naldini et al., (1996a, 1996b и 1998); Zufferey et al., (1997); Dull et al., 1998, патенты США №№6013516; и 5994136, многие из которых могут быть адаптированы для получения вирусного вектора или плазмиды-переносчика по настоящему изобретению.
В различных вариантах осуществления векторы по настоящему изобретению содержат промотор, функционально связанный с полинуклеотидом, кодирующим полипептид CAR. Векторы могут содержать один или более LTR, при этом каждый LTR содержит одну или более модификаций, таких как одна или более нуклеотидных замен, добавлений или делеций. Векторы могут дополнительно содержать один или более вспомогательных элементов для увеличения эффективности трансдукции (например, cPPT/FLAP), упаковки вируса (например, Psi (Ψ) сигнал упаковки, RRE) и/или другие элементы, которые повышают экспрессию терапевтического гена (например, поли(A)-последовательности), и могут необязательно содержать WPRE или HPRE.
В конкретном варианте осуществления вектор-переносчик по настоящему изобретению содержит левый (5') ретровирусный LTR, центральный полипуриновый тракт/ДНК-флэп (cPPT/FLAP), ретровирусный экспортный элемент, MND-промотор, функционально связанный с полинуклеотидом, кодирующим полипептид CAR, рассмотренный в данном документе, и правый (3') ретровирусный LTR, а также необязательно WPRE или HPRE.
В конкретном варианте осуществления вектор-переносчик по настоящему изобретению содержит левый (5') ретровирусный LTR, ретровирусный экспортный элемент, MND-промотор, функционально связанный с полинуклеотидом, кодирующим полипептид CAR, рассмотренный в данном документе, и правый (3') ретровирусный LTR, а также поли(A)-последовательность, а также необязательно WPRE или HPRE. В другом конкретном варианте осуществления настоящего изобретения предусмотрен лентивирусный вектор, содержащий левый (5') LTR, cPPT/FLAP, RRE, MND-промотор, функционально связанный с полинуклеотидом, кодирующим полипептид CAR, рассмотренный в данном документе, правый (3') LTR и последовательность полиаденилирования, а также необязательно WPRE или HPRE.
В определенном варианте осуществления настоящего изобретения предусмотрен лентивирусный вектор, содержащий левый (5') LTR HIV-1, Psi (Ψ) сигнал упаковки, cPPT/FLAP, RRE, MND-промотор, функционально связанный с полинуклеотидом, кодирующим полипептид CAR, рассмотренный в данном документе, правый (3') самоинактивирующийся (SIN) LTR HIV-1, последовательность полиаденилирования β-глобина кролика, а также необязательно WPRE или HPRE.
В другом варианте осуществления настоящего изобретения предусмотрен вектор, содержащий по меньшей мере один LTR, центральный полипуриновый тракт/ДНК-флэп (cPPT/FLAP), ретровирусный экспортный элемент и MND-промотор, функционально связанный с полинуклеотидом, кодирующим полипептид CAR, рассмотренный в данном документе, а также необязательно WPRE или HPRE.
В конкретном варианте осуществления настоящего изобретения предусмотрен вектор, содержащий по меньшей мере один LTR, cPPT/FLAP, RRE, MND-промотор, функционально связанный с полинуклеотидом, кодирующим полипептид CAR, рассмотренный в данном документе, и последовательность полиаденилирования, а также необязательно WPRE или HPRE.
В определенном варианте осуществления настоящего изобретения предусмотрен по меньшей мере один SIN LTR HIV-1, Psi (Ψ) сигнал упаковки, cPPT/FLAP, RRE; MND-промотор, функционально связанный с полинуклеотидом, кодирующим полипептид CAR, рассмотренный в данном документе, и последовательность полиаденилирования β-глобина кролика, а также необязательно WPRE или HPRE.
Специалисту в данной области будет понятно, что многие другие различные варианты осуществления могут быть смоделированы на основе существующих вариантов осуществления настоящего изобретения.
«Клетка-хозяин» включает клетки, подвергнутые трансфекции, инфицированию или трансдукции in vivo, ex vivo или in vitro с помощью рекомбинантного вектора или полинуклеотида по настоящему изобретению. Клетки-хозяева могут включать упаковывающие клетки, продуцирующие клетки и клетки, инфицированные вирусными векторами. В конкретных вариантах осуществления клетки-хозяева, инфицированные вирусным вектором по настоящему изобретению, вводят субъекту, нуждающемуся в терапии. В определенных вариантах осуществления термин «целевая клетка» используется взаимозаменяемо с термином «клетка-хозяин» и относится к клеткам требуемого типа, подвергнутым трансфекции, инфицированию или трансдукции. В предпочтительных вариантах осуществления целевая клетка представляет собой Т-клетку.
Для получения приемлемого титра вируса зачастую необходимо крупномасштабное получение вирусных частиц. Вирусные частицы получают посредством трансфекции вектора-переносчика в упаковывающую клеточную линию, которая содержит вирусные структурные и/или вспомогательные гены, например, гены gag, pol, env, tat, rev, vif, vpr, vpu, vpx или nef или другие ретровирусные гены.
Используемый в данном документе термин «упаковочный вектор» относится к вектору экспрессии или вирусному вектору, который лишен сигнала упаковки, и содержит полинуклеотид, кодирующий один, два, три, четыре или более вирусных структурных и/или вспомогательных генов. Обычно упаковочные векторы включены в упаковывающую клетку, и их вводят в клетку посредством трансфекции, трансдукции и инфекции. Способы трансфекции, трансдукции и инфекции хорошо известны специалистам в данной области Ретровирусный/лентивирусный вектор-переносчик по настоящему изобретению может быть введен в упаковывающую клеточную линию посредством трансфекции, трансдукции и инфекции с получением продуцирующей клетки или клеточной линии. Упаковочные векторы по настоящему изобретению могут быть введены в человеческие клетки или клеточные линии с помощью стандартных способов, в том числе, например, трансфекции с использованием фосфата кальция, липофекции или электропорации. В некоторых вариантах осуществления упаковочные векторы вводят в клетки совместно с доминантным селектируемым маркером, таким как неомицин, гигромицин, пуромицин, бластоцидин, зеоцин, тимидинкиназа, DHFR, глутаминсинтетаза или ADA, с последующей селекцией в присутствии соответствующего лекарственного средства и выделением клонов. Ген селектируемого маркера может быть физически связан с генами, закодированными в упаковочном векторе, например, посредством IRES или саморасщепляющихся вирусных пептидов.
Белки вирусной оболочки (env) определяют диапазон клеток-хозяев, которые в конечном итоге могут быть инфицированы и трансформированы посредством рекомбинантных ретровирусов, полученных из клеточных линий. В случае лентивирусов, таких как HIV-1, HIV-2, SIV, FIV и EIV, белки env включают gp41 и gp120. Предпочтительно вирусные белки env, экспрессируемые упаковывающими клетками по настоящему изобретению, закодированы в отдельном векторе из вирусных генов gag и pol, как было ранее описано.
Иллюстративные примеры происходящих из ретровирусов генов env, которые можно использовать в настоящем изобретении, включают без ограничений гены оболочек MLV, оболочки 10A1, оболочек BAEV, FeLV-B, RD114, SSAV, вируса Эбола, вируса Сэндай, FPV (вируса чумы домашней птицы) и вируса гриппа. Аналогично могут быть использованы гены, кодирующие оболочки РНК-вирусов (например, РНК-вирусов из семейств Picornaviridae, Calciviridae, Astroviridae, Togaviridae, Flaviviridae, Coronaviridae, Paramyxoviridae, Rhabdoviridae, Filoviridae, Orthomyxoviridae, Bunyaviridae, Arenaviridae, Reoviridae, Birnaviridae, Retroviridae), а также ДНК-вирусов (семейства Hepadnaviridae, Circoviridae, Parvoviridae, Papovaviridae, Adenoviridae, Herpesviridae, Poxviridae и Iridoviridae). Типичные примеры включают FeLV, VEE, HFVW, WDSV, SFV, вирус бешенства, ALV, BIV, BLV, EBV, CAEV, SNV, ChTLV, STLV, MPMV, SMRV, RAV, FuSV, MH2, AEV, AMV, CT10 и EIAV.
В других вариантах осуществления белки оболочки для псевдотипирования вируса по настоящему изобретению включают без ограничений белки из любого из следующих вирусов: вируса гриппа A, такого как H1N1, H1N2, H3N2 и H5N1 (птичий грипп), вируса гриппа B, вируса гриппа C, вируса гепатита A, вируса гепатита B, вируса гепатита C, вируса гепатита D, вируса гепатита E, ротавируса, любого вируса из группы норовирусов, кишечных аденовирусов, парвовируса, вируса лихорадки Денге, вируса оспы обезьян, вирусов порядка Mononegavirales, лиссавируса, такого как вирус бешенства, вирус летучих мышей острова Лагос, вирус Мокола, вирус Дювенхага, вирус европейских летучих мышей 1 и 2 типа и вирус австралийских летучих мышей, эфемеровируса, везикуловируса, вируса везикулярного стоматита (VSV), герпесвирусов, таких как вирус простого герпеса 1 и 2 типов, вирус ветряной оспы, цитомегаловирус, вирус Эпштейна-Барр (EBV), вирус герпеса человека (HHV), вирус герпеса человека 6 и 8 типа, вируса иммунодефицита человека (HIV), вируса папилломы, мышиного гаммагерпесвируса, аренавирусов, таких как вирус аргентинской геморрагической лихорадки, вирус боливийской геморрагической лихорадки, вирус Сабиа, ассоциированный с геморрагической лихорадкой, вирус венесуэльской геморрагической лихорадки, вирус лихорадки Ласса, вирус Мачупо, вирус лимфоцитарного хориоменингита (LCMV), Bunyaviridiae, таких как вирус конго-крымской геморрагической лихорадки, хантивирус, вирус, вызывающий геморрагическую лихорадку с почечным синдромом, вирус лихорадки Рифт-Валли, Filoviridae (филовирус), в том числе вируса геморрагической лихорадки Эбола и геморрагической лихорадки Марбург, Flaviviridae, в том числе вирус киасанурской лесной болезни, вирус омской геморрагической лихорадки, вирус, вызывающий клещевой энцефалит, и Paramyxoviridae, таких как вирус Хендра и вирус Нипах, вирусы Variola major и Variola minor (вирусы натуральной оспы), альфавирусов, таких как вирус венесуэльского энцефалита лошадей, вирус восточного энцефалита лошадей, вирус западного энцефалита лошадей, SARS-ассоциированного коронавируса (SARS-CoV), вируса Западного Нила и любого вируса, вызывающего энцефалит.
В одном варианте осуществления настоящего изобретения предусмотрены упаковывающие клетки, которые продуцируют рекомбинантный ретровирус, например, лентивирус, псевдотипированный с помощью гликопротеина VSV-G.
Используемые в данном документе термины «псевдотипировать» или «псевдотипирование» относятся к вирусу, белки оболочки которого были замещены на белки другого вируса, обладающего предпочтительными характеристиками. Например, HIV может быть псевдотипирован с помощью белков оболочки, представляющих собой G-белок вируса везикулярного стоматита (VSV-G), который обеспечивает возможность HIV инфицировать более широкий спектр клеток, поскольку белки оболочки HIV (кодируемые геном env) в норме нацеливают вирус на CD4+ клетки. В предпочтительном варианте осуществления настоящего изобретения белки оболочки лентивируса псевдотипированы с помощью VSV-G. В одном варианте осуществления настоящего изобретения предусмотрены упаковывающие клетки, которые продуцируют рекомбинантный ретровирус, например, лентивирус, псевдотипированный с помощью гликопротеина оболочки VSV-G.
Используемый в данном документе термин «упаковывающие клеточные линии» применяют при ссылке на клеточные линии, которые не содержат сигнал упаковки, но при этом стабильно или транзиентно экспрессируют вирусные структурные белки и ферменты репликации (например, gag, pol и env), которые необходимы для правильной упаковки вирусных частиц. Для получения упаковывающих клеток по настоящему изобретению можно использовать любую подходящую клеточную линию. Как правило, указанные клетки являются клетками млекопитающих. В конкретном варианте осуществления клетки, используемые для получения упаковывающей клеточной линии, являются человеческими клетками. Подходящие клеточные линии, которые можно использовать, включают, например, клетки CHO, клетки BHK, клетки MDCK, клетки C3H 10T1/2, клетки FLY, клетки Psi-2, клетки BOSC 23, клетки PA317, клетки WEHI, клетки COS, клетки BSC 1, клетки BSC 40, клетки BMT 10, клетки VERO, клетки W138, клетки MRC5, клетки A549, клетки HT1080, клетки 293, клетки 293Т, клетки B-50, клетки 3T3, клетки NIH3T3, клетки HepG2, клетки Saos-2, клетки Huh7, клетки HeLa, клетки W163, клетки 211 и клетки 211A. В предпочтительных вариантах осуществления упаковывающие клетки представляют собой клетки 293, клетки 293Т или клетки A549. В другом предпочтительном варианте осуществления клетки представляют собой клетки A549.
Используемый в данном документе термин «продуцирующая клеточная линия» относится к клеточной линии, которая способна продуцировать рекомбинантные ретровирусные частицы, содержащей упаковывающую клеточную линию и конструкцию вектора-переносчика, содержащую сигнал упаковки. Продукцию инфекционных вирусных частиц и исходных растворов вируса можно выполнять с применением традиционных методик. Способы получения исходных растворов вируса известны из уровня техники и проиллюстрированы, например, в Y. Soneoka et al. (1995) Nucl. Acids Res. 23:628-633, и N. R. Landau et al. (1992) J. Virol. 66:5110-5113. Инфекционные вирусные частицы можно собирать из упаковывающих клеток с применением традиционных методик. Например, инфекционные частицы можно собирать при помощи лизиса клеток и сбора супернатанта культуры клеток, как известно из уровня техники. В случае необходимости собранные вирусные частицы необязательно могут быть очищены. Подходящие методики очистки хорошо известны специалистам в данной области.
Доставка гена(ов) или другой полинуклеотидной последовательности с применением ретровирусного или лентивирусного вектора посредством вирусной инфекции, а не трансфекции, называется «трансдукцией». В одном варианте осуществления ретровирусные векторы трансдуцируют в клетку посредством инфекции и интеграции провируса. В определенных вариантах осуществления целевая клетка, например, Т-клетка, является «трансдуцированной», если она содержит ген или другую полинуклеотидную последовательность, доставленную в клетку посредством инфекции с помощью вирусного или ретровирусного вектора. В конкретных вариантах осуществления трансдуцированная клетка содержит один или более генов или других полинуклеотидных последовательностей, доставленных в клеточный геном с помощью ретровирусного или лентивирусного вектора.
В конкретных вариантах осуществления клетки-хозяева, трансдуцированные вирусным вектором по настоящему изобретению, который экспрессирует один или более полипептидов, вводят субъекту для лечения и/или предупреждения B-клеточного новообразования. Другие способы, связанные с применением вирусных векторов в генной терапии, которые могут быть использованы в соответствии с некоторыми вариантами осуществления настоящего изобретения, описаны, например, в Kay, M. A. (1997) Chest 111(6 Supp.):138S-142S; Ferry, N. and Heard, J. M. (1998) Hum. Gene Ther. 9:1975-81; Shiratory, Y. et al. (1999) Liver 19:265-74; Oka, K. et al. (2000) Curr. Opin. Lipidol. 11:179-86; Thule, P. M. and Liu, J. M. (2000) Gene Ther. 7:1744-52; Yang, N. S. (1992) Crit. Rev. Biotechnol. 12:335-56; Alt, M. (1995) J. Hepatol. 23:746-58; Brody, S. L. and Crystal, R. G. (1994) Ann. N.Y. Acad. Sci. 716:90-101; Strayer, D. S. (1999) Expert Opin. Investig. Drugs 8:2159-2172; Smith-Arica, J. R. and Bartlett, J. S. (2001) Curr. Cardiol. Rep. 3:43-49; и Lee, H. C. et al. (2000) Nature 408:483-8.
G. Генетически модифицированные клетки
В конкретных вариантах осуществления настоящего изобретения рассмотрены клетки, генетически модифицированные для экспрессии CAR, рассмотренных в данном документе, для применения в лечении форм рака. Используемый в данном документе термин «полученный методами генной инженерии» или «генетически модифицированный» относится к добавлению дополнительного генетического материала в форме ДНК или РНК в общий генетический материал клетки. Термины «генетически модифицированные клетки», «модифицированные клетки» и «перенаправленные клетки» используют взаимозаменяемо. Используемый в данном документе термин «генная терапия» относится к введению дополнительного генетического материала в форме ДНК или РНК в общий генетический материал клетки, что восстанавливает, корректирует или модифицирует экспрессию гена или служит для экспрессии терапевтического полипептида, например, CAR.
В конкретных вариантах осуществления векторы, содержащие MND-промотор и кодирующие CAR, рассмотренные в данном документе, вводятся и экспрессируются в иммунных эффекторных клетках, тем самым перенаправляют их специфичность на целевой антиген, представляющий интерес. «Иммунная эффекторная клетка» представляет собой любую клетку иммунной системы, которая характеризуется одной или более эффекторными функциями (например, цитолитической активностью цитотоксической клетки, секрецией цитокинов, индукцией ADCC и/или CDC).
Иммунные эффекторные клетки по настоящему изобретению могут быть аутологичными/аутогенными («своими») или неаутологичными («не своими», например, аллогенными, сингенными или ксеногенными).
«Аутологичные», как используется в данном документе, относится к клеткам от того же субъекта.
«Аллогенные», как используется в данном документе, относится к клеткам того же вида, которые генетически отличны при сравнении с данной клеткой.
«Сингенные», как используется в данном документе, относится к клеткам другого субъекта, которые генетически идентичны при сравнении с данной клеткой.
«Ксеногенные», как используется в данном документе, относится к клеткам другого вида при сравнении с данной клеткой. В предпочтительных вариантах осуществления клетки по настоящему изобретению являются аллогенными.
Иллюстративные иммунные эффекторные клетки, используемые с векторами, содержащими CAR, рассмотренные в данном документе, включают T-лимфоциты. Термины «Т-клетка» или «T-лимфоцит» приняты в данной области техники и подразумевают включение тимоцитов, незрелых T-лимфоцитов, зрелых T-лимфоцитов, покоящихся T-лимфоцитов или активированных T-лимфоцитов. Т-клетка может представлять собой T-хелперную клетку (Th), например, T-хелперную клетку 1 типа (Th1) или T-хелперную клетку 2 типа (Th2). Т-клетка может представлять собой хелперную Т-клетку (HTL; CD4+ Т-клетку), CD4+ Т-клетку, цитотоксическую Т-клетку (CTL; CD8+ Т-клетку), CD4+CD8+ Т-клетку, CD4-CD8- Т-клетку или любую другую субпопуляцию Т-клеток. Другие иллюстративные популяции Т-клеток, подходящие для применения в конкретных вариантах осуществления, включают наивные Т-клетки и Т-клетки памяти.
Как будет понятно специалисту в данной области, векторы, содержащие MND-промотор и кодирующие CAR, можно вводить в другие клетки, которые также могут быть использованы как иммунные эффекторные клетки. В частности, иммунные эффекторные клетки также включают NK-клетки, NKТ-клетки, нейтрофилы и макрофаги. Иммунные эффекторные клетки также включают предшественников эффекторных клеток, где такие клетки-предшественники можно индуцировать к дифференциации в иммунные эффекторные клетки in vivo или in vitro. Таким образом, в конкретных вариантах осуществления иммунная эффекторная клетка включает предшественников иммунных эффекторных клеток, таких как гемопоэтические стволовые клетки (HSC), входящие в популяцию CD34+ клеток, полученных из пуповинной крови, костного мозга или мобилизованных клеток периферической крови, которые после введения субъекту дифференцируются в зрелые иммунные эффекторные клетки, или которые можно индуцировать in vitro к дифференциации в зрелые иммунные эффекторные клетки.
Используемые в данном документе иммунные эффекторные клетки, полученные методами генной инженерии для включения вектора, содержащего MND-промотор, и кодирующего антиген-специфический CAR, можно называть «антиген-специфические перенаправленные иммунные эффекторные клетки».
Используемый в данном документе термин «CD34+-клетка» относится к клетке, экспрессирующей на своей клеточной поверхности CD34-белок. Используемый в настоящем документе «CD34» относится к гликопротеину клеточной поверхности (например, белку сиаломуцину), который зачастую действует как фактор межклеточной адгезии и участвует в попадании Т-клеток в лимфатические узлы. Популяция CD34+-клеток состоит из гемопоэтических стволовых клеток (HSC), которые после введения в пациента дифференцируются и участвуют в образовании всех ростков кроветворения, в том числе Т-клеток, NK-клеток, NKТ-клеток, нейтрофилов и клеток моноцитарной/макрофагальной клеточной линии.
В настоящем изобретении предусмотрены способы получения иммунных эффекторных клеток, которые экспрессируют CAR, рассмотренный в данном документе. В одном варианте осуществления способ предусматривает трансфекцию или трансдукцию иммунных эффекторных клеток, выделенных из индивидуума, вследствие чего иммунные эффекторные клетки экспрессируют один или более CAR, описанных в данном документе. В определенных вариантах осуществления иммунные эффекторные клетки выделяют из индивидуума и генетически модифицируют без дальнейших манипуляций in vitro. Такие клетки затем можно напрямую повторно вводить индивидууму. В дополнительных вариантах осуществления иммунные эффекторные клетки сначала активируют и стимулируют к пролиферации in vitro, перед тем как подвергнуть генетической модификации для экспрессии CAR. В связи с этим иммунные эффекторные клетки можно культивировать до и/или после того как их подвергли генетической модификации (т.е. они являются трансдуцированными или трансфицированными для экспрессии CAR, рассмотренного в данном документе).
В конкретных вариантах осуществления до проведения in vitro манипуляций или генетической модификации иммунных эффекторных клеток, описанных в данном документе, источник клеток получают из субъекта. В конкретных вариантах осуществления CAR-модифицированные иммунные эффекторные клетки содержат Т-клетки. Т-клетки можно получать из различных источников, в том числе без ограничений мононуклеарных клеток периферической крови, костного мозга, ткани лимфатического узла, пуповинной крови, ткани тимуса, ткани из очага инфекции, асцитов, плеврального выпота, ткани селезенки и опухолей. В определенных вариантах осуществления Т-клетки можно получать из дозы крови, собранной у субъекта с применением любой из целого ряда методик, известных специалисту в данной области, например, с помощью осаждения, например, разделения с помощью FICOLL™. В одном варианте осуществления клетки из циркулирующей крови индивидуума получают посредством афереза. Продукт афереза, как правило, содержит лимфоциты, в том числе Т-клетки, моноциты, гранулоциты, B-клетки, другие ядерные белые кровяные клетки, красные кровяные клетки и тромбоциты. В одном варианте осуществления клетки, собранные посредством афереза, можно промывать для удаления фракции плазмы и для помещения клеток в подходящий буфер или среду для последующей обработки. Клетки можно промывать при помощи PBS или другого подходящего раствора, не содержащего кальций, магний и большинство, если не все прочие двухвалентные катионы. Как будет понятно рядовым специалистам в данной области, стадию промывки можно выполнять при помощи способов, известных специалистам в данной области, таких как с помощью полуавтоматической проточной центрифуги. Например, Cobe 2991 Cell Processor, Baxter CytoMate и т.п. После промывки клетки можно ресуспендировать в различных биосовместимых буферах или других солевых растворах, содержащих или не содержащих буфер. В определенных вариантах осуществления нежелательные компоненты из образца после афереза можно удалять в культуральной среде для непосредственного ресуспендирования клеток.
В определенных вариантах осуществления Т-клетки выделяют из мононуклеарных клеток периферической крови (PBMC) посредством лизиса эритроцитов и истощения моноцитов, например, путем центрифугирования в градиенте PERCOLL™. Специфические субпопуляции Т-клеток, экспрессирующие один или более следующих маркеров: CD3, CD28, CD4, CD8, CD45RA и CD45RO, можно дополнительно выделять при помощи методик позитивной или негативной селекции. В одном варианте осуществления специфическую субпопуляцию Т-клеток, экспрессирующих CD3, CD28, CD4, CD8, CD45RA и CD45RO, дополнительно выделяют при помощи методик позитивной или негативной селекции. Например, обогащение популяции Т-клеток посредством негативной селекции можно осуществлять при помощи комбинации антител, направленных на поверхностные маркеры, характерные для негативно селектируемых клеток. Один способ для применения в данном документе представляет собой сортировку клеток и/или селекцию посредством негативной магнитной иммуноадгезии или проточной цитометрии, при которых используют смесь моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие для негативно селектируемых клетках. Например, для обогащения в отношении CD4+-клеток посредством негативной селекции смесь моноклональных антител обычно включает антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8. Проточную цитометрию и сортировку клеток можно также применять для выделения клеточных популяций, представляющих интерес, для применения в настоящем изобретении.
PBMC можно направленно генетически модифицировать при помощи векторов, содержащих MND-промотор, находящийся в функциональной связи для экспрессии полинуклеотида, кодирующего CAR, рассмотренного в данном документе. В определенных вариантах осуществления после выделения PBMC T-лимфоциты дополнительно выделяют и в некоторых вариантах осуществления, как цитотоксические, так и хелперные T-лифоциты можно сортировать на субпопуляции наивных, клеток памяти и эффекторных Т-клеток либо перед, либо после генетической модификации и/или размножения.
CD8+ клетки можно получать с применением стандартных способов. В некоторых вариантах осуществления CD8+ клетки дополнительно сортируют на наивные, центральные клетки памяти и эффекторные клетки посредством идентификации антигенов клеточной поверхности, которые ассоциированы с каждым из данных типов CD8+ клеток.
В определенных вариантах осуществления наивные CD8+ T-лимфоциты характеризуются экспрессией фенотипических маркеров наивных Т-клеток, в том числе CD62L, CCR7, CD28, CD3, CD 127 и CD45RA.
В конкретных вариантах осуществления Т-клетки памяти присутствуют в субпопуляциях как CD62L+, так и CD62L- CD8+ лимфоцитов периферической крови. PBMC сортируют на фракции CD62L-CD8+ и CD62L+CD8+после окрашивания с помощью антител к CD8 и CD62L. В некоторых вариантах осуществления на центральных Т-клетках памяти экспрессируются фенотипические маркеры CD45RO, CD62L, CCR7, CD28, CD3 и CD127, и они являются негативными по гранзиму B. В некоторых вариантах осуществления центральные Т-клетки памяти представляют собой CD45RO+, CD62L+, CD8+ Т-клетки.
В некоторых вариантах осуществления эффекторные Т-клетки являются негативными по CD62L, CCR7, CD28 и CD127, и позитивными по гранзиму B и перфорину.
В определенных вариантах осуществления CD4+ Т-клетки дополнительно сортируют на субпопуляции. Например, CD4+ T-хелперные клетки можно сортировать на наивные, центральные клетки памяти и эффекторные клетки посредством идентификации клеточных популяций, которые имеют антигены клеточной поверхности. CD4+ лимфоциты можно получать с помощью стандартных способов. В некоторых вариантах осуществления наивные CD4+ T-лимфоциты представляют собой CD45RO-, CD45RA+, CD62L+ CD4+ Т-клетки. В некоторых вариантах осуществления центральные CD4+ клетки памяти являются CD62L-позитивными и CD45RO-позитивными. В некоторых вариантах осуществления эффекторные CD4+ клетки являются CD62L- и CD45RO-негативными.
Иммунные эффекторные клетки, такие как Т-клетки, можно генетически модифицировать с последующим выделением с применением стандартных способов, или иммунные эффекторные клетки можно активировать и размножать (или дифференцировать в случае клеток-предшественников) in vitro перед тем, как проводить их генетическую модификацию. В конкретном варианте осуществления иммунные эффекторные клетки, такие как Т-клетки, генетически модифицируют с помощью химерных антигенных рецепторов, рассмотренных в данном документе (например, трансдуцируют с помощью вирусного вектора, содержащего MND-промотор и нуклеиновую кислоту, кодирующую CAR), а затем активируют и размножают in vitro. В различных вариантах осуществления Т-клетки можно активировать и размножать до или после генетической модификации для экспрессии CAR с помощью способов, описанных, например, в патентах США №№6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041 и в публикации заявки на патент США №20060121005.
Как правило, Т-клетки размножают путем приведения в контакт с поверхностью, характеризующейся прикрепленным к ней средством, которое стимулирует сигнал, ассоциированный с CD3-TCR-комплексом, и лигандом, который стимулирует костимулирующую молекулу на поверхности Т-клеток. Популяции Т-клеток можно стимулировать путем приведения в контакт с антителом к CD3 или его антиген-связывающим фрагментом, или антителом к CD2, иммобилизованным на поверхности, или путем приведения в контакт с активатором протеинкиназы С (например, бриостатином) в сочетании с кальциевым ионофором. Костимуляция вспомогательных молекул на поверхности Т-клеток также рассматривается.
В конкретных вариантах осуществления PBMC или выделенные Т-клетки приводят в контакт со стимулирующим средством и костимулирующим средством, таким как антитела к CD3 и CD28, как правило, присоединенными к грануле или другой поверхности, в среде для культивирования с соответствующими цитокинами, такими как IL-2, IL-7 и/или IL-15. Для стимуляции пролиферации либо CD4+ Т-клеток, либо CD8+ Т-клеток можно применять антитело к CD3 и антитело к CD28, а также можно использовать другие способы, общеизвестные из уровня техники в области техники (Berg et al., Transplant Proc. 30(8):3975-3977, 1998; Haanen et al., J. Exp. Med. 190(9): 13191328, 1999; Garland et al., J. Immunol Meth. 227( 1 -2):53-63, 1999). Примеры антитела к CD28 включают 9.3, B-T3, XR-CD28 (Diacione, Безансон, Франция). Антитело к CD3 и антитело к CD28, прикрепленные к одной грануле, выступают в роли «суррогатной» антиген-презентирующей клетки (APC). В других вариантах осуществления Т-клетки можно активировать и стимулировать к пролиферации с помощью питающих клеток, а также соответствующих антител и цитокинов, посредством таких способов, как описано в US6040177; US5827642 и WO2012129514.
В других вариантах осуществления искусственные APC (aAPC) получают путем разработки клеток K562, U937, 721.221, T2 и C1R, которые предназначены для стабильной экспрессии и секреции целого ряда костимулирующих молекул и цитокинов. В конкретном варианте осуществления применяют aAPC в виде K32 или U32, предназначенные для выставления одной или более стимулирующих молекул на основе антитела на клеточной поверхности AAPC. Экспрессия различных комбинаций генов на aAPC обеспечивает возможность точного определения требований для активации человеческих T-клеток, так что aAPC можно адаптировать для оптимального размножения субпопуляций T-клеток со специфическими требованиями в отношении ростовой среды и имеющих различные функции. aAPC поддерживают ex vivo рост и долгосрочное размножение функциональных человеческих CD8 Т-клеток, не требующие добавления экзогенных цитокинов, в отличие от применения природных APC. Популяции Т-клеток можно размножать при помощи aAPC, экспрессирующих различные костимулирующие молекулы, в том числе без ограничений CD137L (4-1BBL), CD134L (OX40L) и/или CD80 или CD86. Наконец, aAPC обеспечивают эффективную платформу для размножения генетически модифицированных Т-клеток и для поддержания экспрессии CD28 на CD8-Т-клетках. aAPC, предусмотренные в WO 03/057171 и US 2003/0147869, включены тем самым посредством ссылки во всей своей полноте.
В одном варианте осуществления CD34+ клетки трансдуцируют с помощью конструкции нуклеиновой кислоты в соответствии с настоящим изобретением. В определенных вариантах осуществления трансдуцированные CD34+ клетки дифференцируются в зрелые иммунные эффекторные клетки in vivo после введения субъекту, как правило, субъекту, из которого данные клетки были изначально выделены. В другом варианте осуществления CD34+ клетки можно стимулировать in vitro до воздействия или после того, как их повергают генетической модификации с помощью CAR, как описано в данном документе, при помощи одного или более следующих цитокинов: лиганда Flt-3 (FLT3), фактора стволовых клеток (SCF), фактора роста и дифференцировки мегакариоцитов (TPO), IL-3 и IL-6 в соответствии со способами, описанными ранее (Asheuer et al., 2004; Imren, et al., 2004).
В настоящем изобретении предусмотрена популяция модифицированных иммунных эффекторных клеток для лечения рака, при этом модифицированные иммунные эффекторные клетки содержат CAR, раскрываемый в данном документе. Например, популяцию модифицированных иммунных эффекторных клеток получают из мононуклеарных клеток периферической крови (PBMC), полученных от пациента с диагностированным B-клеточным новообразованием, описанным в данном документе (аутологичные доноры). PBMC образуют гетерогенную популяцию T-лимфоцитов, которые могут представлять собой CD4+, CD8+ или CD4+ и CD8+.
PBMC также могут включать другие цитотоксические лимфоциты, такие как NK-клетки или NKТ-клетки. Вектор экспрессии, содержащий промотор, например, MND-промотор, и кодирующую последовательность CAR, рассмотренного в данном документе, можно вводить в популяцию человеческих донорных Т-клеток, NK-клеток или NKТ-клеток. Успешно трансдуцированные Т-клетки, которые несут вектор экспрессии, можно отсортировать с применением проточной цитометрии для выделения CD3-позитивных Т-клеток, а затем дополнительно размножить для увеличения количества этих Т-клеток, экспрессирующих белок CAR, в дополнение к активации клеток с применением антител к CD3 и/или антител к CD28 и IL-2 или любых других способов, известных из уровня техники, описываемых в других частях данного документа. Стандартные процедуры применяют для криоконсервации Т-клеток, экспрессирующих белок CAR, для хранения T-клеток и/или препарата для применения у субъекта-человека. В одном варианте осуществления in vitro трансдукцию, культивирование и/или размножение Т-клеток проводят в отсутствие продуктов животного происхождения, не являющихся человеческими, таких как фетальная телячья сыворотка и фетальная бычья сыворотка. Поскольку гетерогенная популяция PBMC является генетически модифицированной, полученные трансдуцированные клетки представляют собой гетерогенную популяцию модифицированных клеток, содержащих антиген-специфический нацеленный CAR, рассматриваемый в данном документе.
В дополнительном варианте осуществления при генетической модификации донорной популяции иммунных эффекторных клеток можно использовать смесь, например, одного, двух, трех, четырех, пяти или более, различных векторов экспрессии, где каждый вектор кодирует белок различного химерного антигенного рецептора, рассматриваемого в данном документе. Полученные модифицированные иммунные эффекторные клетки образуют смешанную популяцию модифицированных клеток, при этом определенная доля модифицированных клеток экспрессирует несколько различных белков CAR.
В одном варианте осуществления настоящего изобретения предусмотрен способ хранения генетически модифицированных иммунных эффекторных клеток, экспрессирующих мышиный, человеческий или гуманизированный белок CAR, включающий криоконсервирование иммунных эффекторных клеток, так что клетки сохраняют жизнеспособность после оттаивания. Фракцию иммунных эффекторных клеток, экспрессирующих белки CAR, можно криоконсервировать при помощи способов, известных из уровня техники, чтобы обеспечить постоянный источник таких клеток для будущего лечения пациентов, пораженных раком. При необходимости криоконсервированные трансформированные иммунные эффекторные клетки можно оттаивать, выращивать и размножать для увеличения количества таких клеток.
Используемое в данном документе «криоконсервирование» относится к сохранению клеток путем охлаждения до температур ниже нуля, таких как (обычно) 77 K или -196°C. (температура кипения жидкого азота). Для того чтобы предотвратить разрушение сохраняемых клеток в процессе замораживания при низких температурах или в ходе нагревания до комнатной температуры, зачастую используют криопротекторные средства. Криопротекторные средства и оптимальные скорости охлаждения могут защитить клетки от повреждения. Криопротекторные средства, которые можно использовать, включают без ограничений диметилсульфоксид (DMSO) (Lovelock and Bishop, Nature, 1959; 183: 1394-1395; Ashwood-Smith, Nature, 1961; 190: 1204-1205), глицерин, поливинилпирролидин (Rinfret, Ann. N.Y. Acad. Sci., 1960; 85: 576) и полиэтиленгликоль (Sloviter and Ravdin, Nature, 1962; 196: 48). Предпочтительная скорость охлаждения составляет 1°-3°C/минута. После по меньшей мере двух часов Т-клетки достигают температуры -80°C и их можно поместить непосредственно в жидкий азот (-196°C) для постоянного хранения, например, в криогенный сосуд для долгосрочного хранения.
H. Композиции и составы
Композиции, рассмотренные в данном документе, могут содержать один или более полипептидов, полинуклеотидов, векторов, их содержащих, генетически модифицированных иммунных эффекторных клеток и т.д., рассматриваемых в данном документе. Композиции включают без ограничений фармацевтические композиции. «Фармацевтической композицией» называют композицию, составленную в фармацевтически приемлемых или физиологически приемлемых растворах для введения в клетку или животному либо отдельно, либо в комбинации с одним или более иными видами терапии. Следует также иметь в виду, что, при желании, композиции по настоящему изобретению можно также вводить в комбинации с другими средствами, такими как, например, цитокины, факторы роста, гормоны, малые молекулы, химиотерапевтические средства, пролекарства, лекарственные средства, антитела или другие различные фармацевтически активные средства. Для других компонентов, которые также можно включать в композиции, практически не существует ограничений, при условии, что дополнительные средства не оказывают отрицательного влияния на способность композиции доставлять предусмотренное терапевтическое средство.
Фраза «фармацевтически приемлемый» используется в данном документе для обозначения тех соединений, материалов, композиций и/или готовых лекарственных форм, которые, в рамках медицинских показаний, пригодны для применения в контакте с тканями человека и животных, при этом не вызывают чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соизмеримых с приемлемым соотношением польза/риск.
Используемый в настоящем документе «фармацевтически приемлемый носитель, разбавитель или наполнитель» включает без ограничений адъювант, носитель, наполнитель, скользящее средство, подсластитель, разбавитель, консервант, краситель/окрашивающее средство, усилитель вкуса и запаха, поверхностно-активное вещество, смачивающее средство, диспергирующее средство, суспендирующее средство, стабилизатор, изотоническое средство, растворитель, поверхностно-активное вещество или эмульгатор, который был одобрен Управлением по контролю качества пищевых продуктов и лекарственных средств США как пригодный для применения у человека или домашних животных. Примеры фармацевтически приемлемых носителей включают без ограничений сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; трагакант; солод; желатин; тальк; масло какао, воски, животные и растительные жиры, парафины, силиконы, бентониты, кремниевую кислоту, окись цинка; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные средства, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы и любые другие совместимые вещества, используемые в фармацевтических составах.
В конкретных вариантах осуществления композиции по настоящему изобретению содержат некоторое количество генетически модифицированных иммунных эффекторных клеток, рассмотренных в данном документе. Используемый в данном описании термин «количество» относится к «количеству, эффективному для» или «эффективному количеству» генетически модифицированной терапевтической клетки, например, Т-клетки, для достижения полезного или требуемого профилактического или терапевтического результата, в том числе клинических результатов.
«Профилактически эффективное количество» относится к количеству генетически модифицированной терапевтической клетки, эффективному для достижения требуемого профилактического результата. Обычно, но не обязательно, поскольку профилактическую дозу применяют у субъектов до появления заболевания или на его ранней стадии, профилактически эффективное количество меньше терапевтически эффективного количества.
«Терапевтически эффективное количество» генетически модифицированной терапевтической клетки может меняться в зависимости от таких факторов, как стадия заболевания, возраст, пол и вес индивидуума, а также от способности стволовых и клеток-предшественников вызывать требуемый ответ у индивидуума. Терапевтически эффективное количество также представляет собой количество, при котором любые токсические или вредные эффекты вируса или трансдуцированных терапевтических клеток перевешиваются терапевтически благоприятными эффектами. Термин «терапевтически эффективное количество» включает количество, которое является эффективным для «лечения» субъекта (например, пациента). Если указано терапевтическое количество, точное количество композиций по настоящему изобретению, которое следует ввести, может определить лечащий врач с учетом индивидуальных различий в возрасте, весе, размере опухоли, степени инфекции или метастазов и состоянии пациента (субъекта). В целом можно указать, что фармацевтическую композицию, содержащую Т-клетки, описанные в данном документе, можно вводить в дозе 102-1010 клеток/кг массы тела, предпочтительно 105-106 клеток/кг массы тела, включая все целые значения в пределах этих диапазонов. Количество клеток будет зависеть от способа конечного применения, для которого предназначена данная композиция, а также от типа клеток, включенных в нее. Для способов применений, предусмотренных в данном документе, количество клеток на литр объема или менее, может составлять 500 мл или менее, даже 250 мл или 100 мл или менее. Следовательно, плотность требуемых клеток, как правило, превышает 106 клеток/мл и обычно превышает 107 клеток/мл, как правило, составляет 108 клеток/мл или больше. Клинически значимое количество иммунных клеток можно распределить на несколько инфузий, которые совокупно равны или превышают 105, 106, 107, 108, 109, 1010, 1011 или 1012 клеток. В некоторых аспектах настоящего изобретения, в частности, если все вводимые клетки будут перенаправлены на конкретный целевой антиген (например, κ- или λ-легкие цепи), можно вводить сниженные количества клеток в диапазоне 106/кг (106-1011 на пациента). Композиции на основе клеток, экспрессирующих CAR, можно вводить несколько раз при дозировках в пределах указанных диапазонов. Клетки могут быть аллогенными, сингенными, ксеногенными или аутологичными относительно пациента, проходящего лечение. При необходимости, для усиления индукции иммунного ответа лечение может также включать введение митогенов (например, PHA) или лимфокинов, цитокинов и/или хемокинов (например, IFN-γ, IL-2, IL-12, TNF-альфа, IL-18 и TNF-бета, GM-CSF, IL-4, IL-13, Flt3-L, RANTES, MIP1α и т.д.), описываемых в данном документе.
Как правило, композиции, содержащие клетки, активированные и размноженные, как описано в данном документе, можно использовать в лечении и предупреждении заболеваний, которые возникают у индивидуумов с ослабленным иммунитетом. В частности, композиции, содержащие CAR-модифицированные Т-клетки, рассмотренные в данном документе, применяют в лечении рака. CAR-модифицированные Т-клетки по настоящему изобретению можно вводить либо отдельно, либо в виде фармацевтической композиции в комбинации с носителями, разбавителями, наполнителями и/или с другими компонентами, такими как IL-2 или другие цитокины или популяции клеток. В конкретных вариантах осуществления фармацевтические композиции, рассмотренные в данном документе, содержат некоторое количество генетически модифицированных Т-клеток в комбинации с одним или более фармацевтически или физиологически приемлемыми носителями, разбавителями или наполнителями.
Фармацевтические композиции по настоящему изобретению, содержащие популяцию CAR-экспрессирующих иммунных эффекторных клеток, таких как Т-клетки, могут содержат буферы, такие как нейтральный забуференный солевой раствор, фосфатный буферный солевой раствор и т.п.; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие средства, такие как ЭДТА или глутатион; адъюванты (например, гидроксид алюминия) и консерванты. Композиции по настоящему изобретению предпочтительно составлены для парентерального введения, например, внутрисосудистого (внутривенного или внутриартериального), внутрибрюшинного или внутримышечного введения.
Жидкие фармацевтические композиции, будь-то растворы, суспензии или другие аналогичные формы, могут включать одно или более из следующего: стерильные разбавители, такие как вода для инъекций, солевой раствор, предпочтительно физиологический раствор, раствор Рингера, изотонический раствор хлорида натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или суспендирующей среды, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие средства, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и средства для регулирования тоничности, такие как хлорид натрия или декстроза. Препарат для парентерального введения может быть заключен в ампулах, одноразовых шприцах или флаконах с многократными дозами, изготовленных из стекла или пластика. Инъецируемая фармацевтическая композиция предпочтительно является стерильной.
В конкретном варианте осуществления композиции, рассмотренные в данном документе, содержат эффективное количество CAR-экспрессирующих иммунных эффекторных клеток отдельно или в комбинации с одним или более терапевтическими средствами. Таким образом, композиции на основе CAR-экспрессирующих иммунных эффекторных клеток можно вводить отдельно или в комбинации с другими известными способами лечения рака, такими как лучевая терапия, химиотерапия, трансплантация, иммунотерапия, гормональная терапия, фотодинамическая терапия и т.д. Композиции также можно вводить в комбинации с антибиотиками. Такие терапевтические средства могут быть приняты в данной области техники в качестве стандартного лечения конкретного болезненного состояния, описанного в данном документе, такого как конкретная форма рака. Примеры предусмотренных терапевтических средств включают цитокины, факторы роста, стероиды, NSAID, DMARD, противовоспалительные средства, химиотерапевтические средства, радиотерапевтические средства, терапевтические антитела или другие активные и вспомогательные средства.
В определенных вариантах осуществления композиции, содержащие CAR-экспрессирующие иммунные эффекторные клетки, раскрытые в данном документе, можно вводить в сочетании с любым количеством химиотерапевтических средств. Иллюстративные примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и циклофосфамид (CYTOXAN™); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, в том числе алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламиновую смолу; азотистые иприты, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамин оксида гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урациловый иприт; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин, ранимустин; антибиотики, такие как аклациномизины, актиномицин, антрамицин, азасерин, блеомицины, кактиномицин, калихемицин, карабицин, карминомицин, карцинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; средства, угнетающие функции коры надпочечников, такие как аминоглутетимид, митотан, трилостан; добавку для восполнения фолиевой кислоты, такую как фолиниевая кислота; ацеглатон; альдофосфамида гликозид; аминолевулиновую кислоту; амсакрин; бестрабуцил; бисантрен; эдатрексат; дефофамин; демеколцин; диазиквон; элформитин; эллиптиниума ацетат; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидамин; митогуазон; митоксантрон; мопидамол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK®; разоксан; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2, 2',2''-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («Ara-C»); циклофосфамид; тиотепу; таксоиды, например, паклитаксел (TAXOL® Bristol-Myers Squibb Oncology, Принстон, Нью-Джерси) и доксетаксел (TAXOTERE®., Rhne-Poulenc Rorer, Антони, Франция); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митомицин C; митоксантрон; винкристин; винорелбин; навельбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифторметиломитин (DMFO); производные ретиноевой кислоты, такие как Targretin™ (бексаротен), Panretin™ (алитретиноин); ONTAK™ (денилейкин дифтитокс); эсперамицины; капецитабин; а также фармацевтически приемлемые соли, кислоты и производные любого из вышеуказанного. Также в это определение включены антигормональные средства, которые регулируют или ингибируют действие гормонов на опухоли, такие как антиэстрогены, включающие, например, тамоксифен, ралоксифен, 4(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен (Фарестон); и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также фармацевтически приемлемые соли, кислоты и производные любого из вышеуказанного.
Целый ряд других терапевтических средств можно использовать в сочетании с композициями, описанными в данном документе. В одном варианте осуществления композицию, содержащую CAR-экспрессирующие иммунные эффекторные клетки, вводят с противовоспалительным средством. Противовоспалительные средства или препараты включают без ограничений стероиды и глюкокортикоиды (в том числе бетаметазон, будесонид, дексаметазон, гидрокортизона ацетат, гидрокортизон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон), нестероидные противовоспалительные средства (NSAIDS), в том числе аспирин, ибупрофен, напроксен, метотрексат, сульфасалазин, лефлуномид, лекарственные препараты против TNF, циклофосфамид и микофенолат.
Другие примеры NSAID выбраны из группы, включающей ибупрофен, напроксен, напроксен-натрий, ингибиторы Cox-2, такие как VIOXX® (рофекоксиб) и CELEBREX® (целекоксиб) и сиалилаты. Примеры обезболивающих средств выбраны из группы, включающей ацетаминофен, оксикодон, трамадол или пропоксифена гидрохлорид. Примеры глюкокортикоидов выбраны из группы, включающей кортизон, дексаметазон, гидрокортизон, метилпреднизолон, преднизолон или преднизон. Примеры модификаторов биологического ответа включают молекулы, направленные против маркеров клеточной поверхности (например, CD4, CD5 и т.д.), ингибиторы цитокинов, такие как антагонисты TNF (например, этанерцепт (ENBREL®), адалимумаб (HUMIRA®) и инфликсимаб (REMICADE®)), ингибиторы хемокинов и ингибиторы молекул адгезии. Модификаторы биологического ответа включают моноклональные антитела, а также рекомбинантные формы молекул. Примеры DMARD включают азатиоприн, циклофосфамид, циклоспорин, метотрексат, пеницилламин, лефлуномид, сульфасалазин, гидроксихлорохин, препарат золота (пероральный (ауранофин) и внутримышечный) и миноциклин.
Иллюстративные примеры терапевтических антител, пригодных для комбинации с CAR-модифицированными Т-клетками, рассмотренными в данном документе, включают без ограничений абаговомаб, адекатумумаб, афутузумаб, алемтузумаб, альтумомаб, аматуксимаб, анатумомаб, арцитумомаб, бавитуксимаб, бектумомаб, бевацизумаб, биватузумаб, блинатумомаб, брентуксимаб, кантузумаб, катумаксомаб, цетуксимаб, цитатузумаб, циксутумумаб, кливатузумаб, конатумумаб, даратумумаб, дрозитумаб, дулиготумаб, дусигитумаб, детумомаб, дацетузумаб, далотузумаб, эркомексимаб, элотузумаб, энситуксимаб, эртумаксомаб, этарацизумаб, фариетузумаб, фиклатузумаб, фигитумумаб, фланвотумаб, футуксимаб, ганитумаб, гемтузумаб, гирентуксимаб, глембатумумаб, ибритумомаб, иговомаб, имгатузумаб, индатуксимаб, инотузумаб, интетумумаб, ипилимумаб, иратумумаб, лабетузумаб, лексатумумаб, линтузумаб, лорвотузумаб, лукатумумаб, мапатумумаб, матузумаб, милатузумаб, минретумомаб, митумомаб, моксетумомаб, нарнатумаб, наптумомаб, нецитумумаб, нимотузумаб, нофетумомаб, окаратузумаб, офатумумаб, оларатумаб, онартузумаб, опортузумаб, ореговомаб, панитумумаб, парсатузумаб, партитумаб, пемтумомаб, пертузумаб, пинтумомаб, притумумаб, ракотумомаб, радретумаб, рилотумумаб, ритуксимаб, робатумумаб, сатумомаб, сибротузумаб, силтуксимаб, симтузумаб, солитомаб, такатузумаб, таплитумомаб, тенатумомаб, тепротумумаб, тигатузумаб, тозитумомаб, трастузумаб, тукотузумаб, ублитуксимаб, велтузумаб, ворсетузумаб, вотумумаб, залутумумаб, CC49 и 3F8.
В определенных вариантах осуществления композиции, описанные в данном документе, вводят в сочетании с цитокином. Под используемым в данном документе «цитокином» подразумевают общий термин, обозначающий белки, высвобождаемые одной популяцией клеток, которые действуют на другую клетку как межклеточные медиаторы. Примерами таких цитокинов являются лимфокины, монокины и традиционные полипептидные гормоны. В число цитокинов включены гормоны роста, такие как человеческий гормон роста, N-метионил человеческий гормон роста и гормон роста крупного рогатого скота; паратиреоидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликулостимулирующий гормон (FSH), тиреостимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста гепатоцитов; фактор роста фибробластов; пролактин; плацентарный лактоген; фактор некроза опухолей-альфа и -бета; мюллерова ингибирующая субстанция; мышиный гонадотропин-ассоциированный пептид; ингибин; активин; фактор роста эндотелия сосудов; интегрин; тромбопоэтин (TPO); факторы роста нервов, такие как NGF-бета; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF-альфа и TGF-бета; инсулиноподобный фактор роста-I и -II; эритропоэтин (EPO); остеоиндуцирующие факторы; интерфероны, такие как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSF), такие как макрофагальный-CSF (M-CSF); гранулоцитарно-макрофагальный-CSF (GM-CSF) и гранулоцитарный-CSF (G-CSF); интерлейкины (IL), такие как IL-1, IL-1 альфа, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; IL-15, фактор некроза опухолей, такой как TNF-альфа или TNF-бета; и другие полипептидные факторы, в том числе LIF и kit-лиганд (KL). Используемый в данном документе термин «цитокин» включает белки из природных источников или из культуры рекомбинантных клеток, а также биологически активные эквиваленты цитокинов с нативной последовательностью.
I. Целевые клетки и антигены
В настоящем изобретении предусмотрены, в частности, генетически модифицированные иммунные эффекторные клетки, перенаправленные на целевую клетку, например, на опухолевую или раковую клетку, и которые содержат CAR со связывающим доменом, который связывается с целевыми антигенами на клетках. Используемый в данном документе термин «рак» относится, в целом, к классу заболеваний или состояний, при которых аномальные клетки бесконтрольно делятся и способны инвазировать в близлежащие ткани. Раковые клетки также могут распространяться в другие части организма через кровеносную и лимфатическую системы. Существует несколько основных типов рака. Карцинома представляет собой рак, который начинается в коже или в тканях, выстилающих или покрывающих внутренние органы. Саркома представляет собой рак, который начинается в кости, хряще, жировой ткани, мышечной ткани, кровеносных сосудах или другой соединительной или поддерживающей ткани. Лейкоз представляет собой рак, который начинается в кроветворной ткани, такой как костный мозг, и вызывает появление большого количества аномальных клеток крови и поступление их в кровь. Лимфома и множественная миелома представляют собой формы рака, которые начинаются в клетках иммунной системы. Формы рака центральной нервной системы представляют собой формы рака, которые начинаются в тканях головного и спинного мозга.
Используемый в данном документе термин «злокачественный» относится к раку, при котором группа опухолевых клеток проявляет одно или более из неконтролируемого роста (т.е. деления сверх пределов нормы), инвазии (т.е. внедрения в прилегающие ткани и их разрушения) и метастазирования (т.е. распространения в другие участки организма посредством лимфы или крови). Используемый в данном документе термин «метастазировать» относится к распространению рака из одной части организма в другую. Опухоль, образованная распространившимися клетками, называется «метастатическая опухоль» или «метастаз». Метастатическая опухоль состоит из клеток, аналогичных клеткам исходной (первичной) опухоли.
Используемый в данном документе термин «доброкачественный» или «незлокачественный» относится к опухолям, которые могут увеличиваться в размере, но не распространяются в другие части организма. Доброкачественные опухоли являются самоограничивающимися и обычно не склонны к инвазии или метастазированию.
«Раковая клетка» или «опухолевая клетка» относится к отдельной клетке раковой опухоли или ткани. Опухолью, в целом, называют вздутие или патологическое изменение, образованное вследствие аномального роста клеток, которое может быть доброкачественным, предраковым или злокачественным. Большинство форм рака образуют опухоли, но некоторые, например, лейкозы, не обязательно образуют опухоли. Для тех форм рака, которые образуют опухоли, термины раковая (клетка) и опухолевая (клетка) используются взаимозаменяемо. Количество опухоли у индивидуума представляет собой «опухолевую нагрузку», которую можно измерить как число, объем или вес опухоли.
В одном варианте осуществления целевая клетка экспрессирует антиген, например, целевой антиген, который практически не встречается на поверхности других нормальных (требуемых) клеток. В одном варианте осуществления целевая клетка представляет собой клетку паренхимы поджелудочной железы, клетку протока поджелудочной железы, клетку печени, клетку миокарда, клетку скелетной мышцы, остеобласт, скелетный миобласт, нейрон, клетку эндотелия сосудов, пигментную клетку, гладкомышечную клетку, глиальную клетку, жировую клетку, остеоцит, хондроцит, клетку панкреатического островка, клетку ЦНС, клетку ПНС, клетку печени, липоцит, клетку почки, клетку легкого, клетку кожи, клетку яичника, фолликулярную клетку, эпителиальную клетку, иммунную клетку или эндотелиальную клетку.
В определенных вариантах осуществления целевая клетка представляет собой часть ткани поджелудочной железы, нервной ткани, ткани сердца, костного мозга, мышечной ткани, костной ткани, кожной ткани, ткани печени, волосяного фолликула, ткани сосудов, жировой ткани, легочной ткани и почечной ткани.
В конкретном варианте осуществления целевая клетка представляет собой опухолевую клетку. В другом конкретном варианте осуществления целевая клетка представляет собой раковую клетку, такую как клетка у пациента с раком. Примеры клеток, которые можно уничтожить при помощи раскрытых способов, включают клетки следующих опухолей: гемобластоза, такого как лейкоз, в том числе острый лейкоз (такой как острый лимфоцитарный лейкоз, острый миелоцитарный лейкоз, а также миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный и эритролейкоз), хронические лейкозы (такие как хронический миелоцитарный (гранулоцитарный) лейкоз и хронический лимфоцитарный лейкоз), истинная полицитемия, лимфома, болезнь Ходжкина, неходжкинская лимфома, множественная миелома, макроглобулинемия Вальденстрема, болезнь тяжелых цепей).
В другом варианте осуществления клетка представляет собой клетку солидной опухоли, такой как формы саркомы или карциномы, фибросаркома, миксосаркома, липосаркома, хондросаркома, остеогенная саркома и другие саркомы, синовиома, мезотелиома, саркома Юинга, лейомиосаркома, рабдомиосаркома, карцинома толстой кишки, рак поджелудочной железы, рак молочной железы, рак яичника, рак предстательной железы, печеночно-клеточный рак, рак легкого, колоректальный рак, плоскоклеточный рак, базальноклеточный рак, аденокарцинома (например аденокарцинома поджелудочной железы, толстой кишки, яичника, легкого, молочной железы, желудка, предстательной железы, шейки матки или пищевода), карцинома потовых желез, карцинома сальной железы, папиллярная карцинома, папиллярные аденокарциномы, медуллярная карцинома, бронхогенный рак, почечно-клеточный рак, гепатома, карцинома желчного протока, хориокарцинома, опухоль Вильмса, рак шейки матки, опухоль яичка, карцинома мочевого пузыря, опухоли ЦНС (такие как глиома, астроцитома, медуллобластома, краниофарингиома, эпендимома, пинеалома, гемангиобластома, невринома слухового нерва, олигодендроглиома, менангиома, меланома, нейробластома и ретинобластома).
В одном варианте осуществления рак выбран из группы, включающей опухоль Вильмса, саркому Юинга, нейроэндокринную опухоль, глиобластому, нейробластому, меланому, рак кожи, рак молочной железы, рак толстой кишки, рак прямой кишки, рак предстательной железы, рак печени, рак почки, рак поджелудочной железы, рак легкого, рак желчевыводящей системы, рак шейки матки, рак эндометрия, рак пищевода, рак желудка, рак головы и шеи, медуллярный рак щитовидной железы, рак яичника, глиому, лимфому, лейкоз, миелому, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический лимфолейкоз, хронический миелогенный лейкоз, лимфому Ходжкина, неходжкинскую лимфому и рак мочевого пузыря.
В одном варианте осуществления целевая клетка представляет собой злокачественную клетку печени, поджелудочной железы, легкого, молочной железы, мочевого пузыря, головной мозга, кости, щитовидной железы, почки, кожи и системы кроветворения. В другом варианте осуществления целевая клетка представляет собой клетку в раке печени, раке поджелудочной железы, раке легкого, раке молочной железы, раке мочевого пузыря, раке головного мозга, раке кости, раке щитовидной железы, раке почки, раке кожи или раке системы кроветворения.
В одном варианте осуществления целевой антиген представляет собой эпитоп полипептида фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2.
J. Способы терапии
Генетически модифицированные Т-клетки, рассмотренные в данном документе, обеспечивают улучшенные способы адоптивной иммунотерапии для применения в лечении различных опухолей и форм рака. В конкретных вариантах осуществления специфичность первичной Т-клетки перенаправлена на опухолевые или раковые клетки при помощи генетической модификации первичной Т-клетки с помощью CAR, рассмотренного в данном документе. В различных вариантах осуществления вирусный вектор применяют для генетической модификации иммунной эффекторной клетки с помощью полинуклеотида, содержащего MND-промотор и кодирующего CAR, содержащий антиген-специфический связывающий домен, который связывает полипептид фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2; шарнирный домен; трансмембранный домен, содержащий TM домен, полученный из полипептида, выбранного из группы, включающей CD8α; CD4, CD45, PD1 и CD152, а также короткий олиго- или полипептидный линкер длиной предпочтительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот, который связывает TM-домен с внутриклеточным доменом передачи сигнала CAR; и один или более внутриклеточных доменов передачи костимулирующего сигнала, выбранных из группы, включающей CD28, CD134 и CD137; а также домен передачи первичного сигнала CD3ζ.
В одном варианте осуществления в настоящем изобретении предусмотрен тип клеточной терапии, при которой Т-клетки генетически модифицируют для экспрессии CAR, который нацеливается на раковые клетки, экспрессирующие целевой антиген, и CAR-Т-клетки вводят реципиенту, нуждающемуся в этом. Введенные клетки способны уничтожить опухолевые клетки в реципиенте. В отличие от терапии на основе антител CAR-Т-клетки способны реплицироваться in vivo, что приводит к долгосрочной персистенции, которая может обеспечить длительную терапию рака.
В одном варианте осуществления CAR-Т-клетки по настоящему изобретению могут подвергаться активному in vivo размножению Т-клеток и могут персистировать в течение длительного периода времени. В другом варианте осуществления CAR-Т-клетки по настоящему изобретению превращаются в специфические Т-клетки памяти, которые могут реактивироваться для ингибирования любого дополнительного образования или роста опухоли.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, применяют при лечении солидных опухолей или форм рака, в том числе без ограничений рака печени, рака поджелудочной железы, рака легкого, рака молочной железы, рака мочевого пузыря, рака головного мозга, рака кости, рака щитовидной железы, рака почки или рака кожи.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, который содержит антиген-специфический связывающий домен, который связывает эпитоп PSCA или MUC1, применяют при лечении рака поджелудочной железы.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, который содержит антиген-специфический связывающий домен, который связывает эпитоп EPHA2, EGFRvIII или CSPG4, применяют при лечении мультиформной глиобластомы.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, который содержит антиген-специфический связывающий домен, который связывает эпитоп PSCA или MUC1, применяют при лечении рака мочевого пузыря.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, который содержит антиген-специфический связывающий домен, который связывает эпитоп PSCA или GD2, применяют при лечении рака легкого.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, который содержит антиген-специфический связывающий домен, который связывает эпитоп CSPG4 или HER2, применяют при лечении рака молочной железы, например, трижды негативного рака молочной железы.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, который содержит антиген-специфический связывающий домен, который связывает эпитоп GD2 или CSPG4, применяют при лечении меланомы.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, применяют при лечении гемобластозов, в том числе без ограничений лейкоза, в том числе острого лейкоза (например, ALL, AML и миелобластного, промиелоцитарного, миеломоноцитарного, моноцитарного и эритролейкоза), хронических лейкозов (например,CLL, SLL, CML, HCL), истинной полицитемии, лимфомы, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы, макроглобулинемии Вальденстрема и болезни тяжелых цепей.
В конкретных вариантах осуществления композиции, содержащие иммунную эффекторную клетку, генетически модифицированную с помощью вектора, содержащего MND-промотор, функционально связанный с полинуклеотидом, кодирующим CAR, применяют при лечении В-клеточных новообразований, в том числе без ограничений множественной миеломы (MM), неходжкинской лимфомы (NHL) и хронического лимфоцитарного лейкоза (CLL).
Множественная миелома представляет собой B-клеточное новообразование с морфологией зрелых плазматических клеток, характеризующееся злокачественным перерождением одного клона этих типов клеток. Эти плазматические клетки пролиферируют в BM и могут инвазировать в прилегающую кость и иногда кровь. Вариантные формы множественной миеломы включают клинически выраженную множественную миелому, вялотекущую множественную миелому, плазмоцитарный лейкоз, несекреторную миелому, IgD-миелому, остеосклеротическую миелому, солитарную плазмацитому кости и экстрамедуллярную плазмацитому (см., например, Braunwald, et al. (eds), Harrison's Principles of Internal Medicine, 15th Edition (McGraw-Hill 2001)).
Неходжкинская лимфома охватывает большую группу форм рака лимфоцитов (белых кровяных клеток). Неходжкинские лимфомы могут возникать в любом возрасте и часто характеризуются увеличенными размерами лимфатических узлов, лихорадкой и потерей веса. Существует множество типов неходжкинской лимфомы. Например, неходжкинскую лимфому можно подразделять на агрессивные (быстрорастущие) и вялотекущие (медленнорастущие) типы. Несмотря на то, что неходжкинские лимфомы могут происходить из В-клеток и Т-клеток, используемые в данном документе термины «неходжкинская лимфома» и «В-клеточная неходжкинская лимфома» используются взаимозаменяемо. В-клеточные неходжкинские лимфомы (NHL) включают лимфому Беркитта, хронический лимфолейкоз/мелкоклеточную лимфоцитарную лимфому (CLL/SLL), диффузную В-крупноклеточную лимфому, фолликулярную лимфому, иммунобластную крупноклеточную лимфому, лимфобластную лимфому из B-клеток-предшественников и лимфому из клеток мантийной зоны. Лимфомы, возникающие после трансплантации костного мозга или стволовых клеток, как правило, представляют собой В-клеточные неходжкинские лимфомы.
Хронический лимфоцитарный лейкоз (CLL) представляет собой вялотекущий (медленнорастущий) рак, который вызывает медленное увеличение количества незрелых белых кровяных клеток, называемых B-лимфоциты или B-клетки. Раковые клетки распространяются через кровь и костный мозг, и также могут поражать лимфатические узлы или другие органы, такие как печень и селезенка. В конечном итоге CLL вызывает поражение костного мозга. Иногда на более поздних стадиях заболевания данное заболевание называют мелкоклеточная лимфоцитарная лимфома.
В конкретных вариантах осуществления предусмотрены способы, включающие введение терапевтически эффективного количества CAR-экспрессирующих иммунных эффекторных клеток, рассмотренных в данном документе, или содержащей их композиции пациенту, нуждающемуся в этом, отдельно или в комбинации с одним или более терапевтическими средствами. В определенных вариантах осуществления клетки по настоящему изобретению применяют при лечении пациентов с риском развития рака. Таким образом, в настоящем изобретении предусмотрены способы лечения или предупреждения рака, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества CAR-модифицированных Т-клеток по настоящему изобретению.
Используемые в данном документе термины «индивидуум» и «субъект» часто используются взаимозаменяемо и относятся к любому животному, у которого обнаружен симптом рака, который можно подвергать лечению с помощью векторов для генной терапии, терапевтических средств на основе клеток и способов, раскрытых в других частях данного документа. Подходящие субъекты (например, пациенты) включают лабораторных животных (таких как мышь, крыса, кролик или морская свинка), сельскохозяйственных животных и домашних животных или питомцев (таких как кошка или собака). Включены отличные от человека приматы и, предпочтительно, пациенты-люди. Типичными субъектами являются пациенты-люди, у которых есть рак, у которых был диагностирован рак, или которые подвержены риску развития рака.
Используемый в данном документе термин «пациент» относится к субъекту, у которого было диагностирован конкретный рак, который можно лечить с помощью векторов для генной терапии, терапевтических средств на основе клеток и способов, раскрытых в других частях данного документа.
Используемое в данном документе «лечение» или «осуществление лечения» включает любой положительный или необходимый эффект в отношении симптомов или патологических признаков заболевания или патологического состояния, и может включать даже небольшое уменьшение одного или более измеряемых маркеров заболевания или состояния, подлежащего лечению, например, рака. Лечение может необязательно подразумевать либо уменьшение или ослабление симптомов заболевания или состояния, либо отсрочку прогрессирования заболевания или состояния. «Лечение» необязательно означает полное устранение или излечение заболевания или состояния, или связанных с ними симптомов.
Используемые в данном описании «предупреждать» и аналогичные слова, такие как «предупрежденный», «предупреждение» и т.д., обозначают подход для предупреждения, ингибирования или снижения вероятности возникновения или рецидива заболевания или состояния, например, рака. Он также относится к отсрочке манифестации или рецидива заболевания или состояния или к отсрочке появления или рецидива симптомов заболевания или состояния. Используемые в данном документе «предупреждение» и аналогичные слова также включают снижение интенсивности, эффекта, симптомов и/или бремени заболевания или состояния до манифестации или рецидива заболевания или состояния.
«Усиливать», или «содействовать», или «увеличивать», или «повышать» в целом называют способность композиции, рассмотренной в данном документе, например, генетически модифицированной Т-клетки или вектора, кодирующего CAR, продуцировать, способствовать или вызывать более сильную физиологическую реакцию (т.е. последующие эффекты) по сравнению с реакцией, вызванной либо носителем, либо контрольной молекулой/композицией. Измеряемая физиологическая реакция может включать повышение размножения, активации, персистенции Т-клеток и/или повышение их способности вызывать цитолиз раковых клеток, наряду с прочим, очевидным из понимания в уровне техники и описания в данном документе. «Повышенное» или «увеличенное» количество, как правило, представляет собой «статистически значимое» количество, и может включать повышение, которое в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, 500, 1000 раз) (включая все целые числа и десятичные знаки между ними, превышающие 1, например, 1,5, 1,6, 1,7, 1,8 и т.д.) превышает реакцию, обусловленную носителем или контрольной композицией.
«Уменьшать», или «понижать», или «облегчать», или «снижать», или «ослаблять» в целом называют способность композиции, рассмотренной в данном документе, продуцировать, способствовать или вызывать более слабую физиологическую реакцию (т.е. последующие эффекты) по сравнению с реакцией, вызванной либо носителем, либо контрольной молекулой/композицией. «Пониженное» или «уменьшенное» количество, как правило, представляет собой «статистически значимое» количество, и может включать уменьшение, которое в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, 500, 1000 раз) (включая все целые числа и десятичные знаки между ними, превышающие 1, например, 1,5, 1,6, 1,7, 1,8 и т.д.) меньше по сравнению с реакцией (эталонной реакцией), обусловленной носителем, контрольной композицией, или реакцией в конкретной клеточной линии.
«Поддерживать», или «сохранять», или «поддержание», или «без изменений», или «без существенных изменений», или «без существенного снижения» в целом называют способность композиции, рассмотренной в данном документе, продуцировать, способствовать или вызывать более слабую физиологическую реакцию (т.е. последующие эффекты) в клетке по сравнению с реакцией, обусловленной либо носителем, либо контрольной молекулой/композицией, или реакцией в конкретной клеточной линии. Соизмеримая реакция представляет собой реакцию, которая существенно не отличается или измеримо отличается от эталонной реакции.
В одном варианте осуществления способ лечения рака у субъекта, нуждающегося в этом, включает введение эффективного количества, например терапевтически эффективного количества, композиции, содержащей генетически модифицированные иммунные эффекторные клетки, рассмотренные в данном документе. Количество и частоту введения будут определять в зависимости от таких факторов, как состояние пациента, а также тип и тяжесть заболевания пациента, хотя соответствующие дозировки можно определить при помощи клинических испытаний.
В определенных вариантах осуществления может быть необходимо вводить субъекту активированные Т-клетки, а затем последовательно осуществлять забор крови (или выполнять аферез), активировать полученные из нее Т-клетки в соответствии с настоящим изобретением, и осуществлять реинфузию этих активированных и размноженных Т-клеток пациенту. Этот процесс можно осуществлять множество раз через каждые несколько недель. В определенных вариантах осуществления Т-клетки можно активировать из крови, взятой в количестве от 10 cм3 до 400 cм3. В определенных вариантах осуществления Т-клетки активируют из крови, взятой в количестве 20 cм3, 30 cм3, 40 cм3, 50 cм3, 60 cм3, 70 cм3, 80 cм3, 90 cм3, 100 cм3, 150 cм3, 200 cм3, 250 cм3, 300 cм3, 350 cм3 или 400 cм3 или более. Не привязываясь к какой-либо теории, применение такого протокола множественного взятия крови/множественной реинфузии может служить для отбора определенных популяций Т-клеток.
Введение композиций, рассмотренных в данном документе, можно осуществлять любым удобным способом, в том числе путем аэрозольной ингаляции, инъекции, приема внутрь, переливания, имплантации или трансплантации. В предпочтительном варианте осуществления композиции вводят парентерально. Используемые в данном документе фразы «парентеральное введение» и «введенный парентерально» относятся к способам введения, отличным от энтерального и местного введения, которые обычно осуществляют путем инъекции и которые включают без ограничений внутрисосудистую, внутривенную, внутримышечную, внутриартериальную, интратекальную, внутрикапсульную, внутриглазничную, внутриопухолевую, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, подкапсулярную, субарахноидальную, интраспинальную и внутригрудинную инъекцию и инфузию. В одном варианте осуществления композиции, рассмотренные в данном документе, вводят субъекту путем непосредственной инъекции в опухоль, лимфатический узел или очаг инфекции.
В одном варианте осуществления субъекту, нуждающемуся в этом, вводят эффективное количество композиции для усиления клеточного иммунного ответа на рак у субъекта. Иммунный ответ может включать клеточные иммунные ответы, опосредованные цитотоксическими Т-клетками, способными приводить к цитолизу инфицированных клеток, регуляторными Т-клетками, а также реакции с хелперными Т-клетками. Также могут быть индуцированы гуморальные иммунные ответы, опосредованные в первую очередь хелперными Т-клетками, способными активировать B-клетки, что приводит к выработке антител. Можно использовать целый ряд методик для анализа типа иммунных ответов, индуцируемых композициями по настоящему изобретению, которые хорошо описаны в уровне техники; например, Current Protocols in Immunology, под ред. John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober (2001) John Wiley & Sons, NY, N.Y.
В случае опосредованного T-клетками цитолиза клеток связывание CAR-лиганда инициирует передачу сигнала с помощью CAR в Т-клетку, что приводит к активации целого ряда путей передачи сигнала в Т-клетке, что индуцирует Т-клетку к выработке или высвобождению белков, способных индуцировать апоптоз целевой клетки посредством различных механизмов. Такие опосредованные Т-клетками механизмы включают (без ограничений) перенос внутриклеточных цитотоксических гранул из Т-клетки в целевую клетку, Т-клеточную секрецию противовоспалительных цитокинов, которые могут индуцировать цитолиз клеток непосредственно (или опосредованно путем рекрутинга киллерных эффекторных клеток), и усиление экспрессии лигандов рецепторов смерти (например, FasL) на поверхности Т-клеток, которые индуцируют апоптоз целевой клетки после связывания со своим когнатным рецептором смерти (например, Fas) на целевой клетке.
В одном варианте осуществления настоящего изобретения предусмотрен способ лечения субъекта, у которого был диагностирован рак, включающий извлечение иммунных эффекторных клеток из субъекта, генетическую модификацию указанных иммунных эффекторных клеток с помощью вектора, содержащего нуклеиновую кислоту, кодирующую CAR, рассматриваемый в данном документе, с получением тем самым популяции модифицированных иммунных эффекторных клеток, и введение модифицированных иммунных эффекторных клеток тому же субъекту. В предпочтительном варианте осуществления иммунные эффекторные клетки включают Т-клетки.
В определенных вариантах осуществления настоящего изобретения также предусмотрены способы стимуляции иммуномодулирующего ответа, опосредованного иммунными эффекторными клетками, в отношении популяции целевых клеток у субъекта, включающие стадии введения субъекту популяции иммунных эффекторных клеток, экспрессирующих конструкцию нуклеиновой кислоты, кодирующую молекулу CAR.
Способы введения композиций на основе клеток, описанных в данном документе, включают любой способ, который является эффективным либо для повторного введения ex vivo генетически модифицированных иммунных эффекторных клеток, которые непосредственно экспрессируют CAR по настоящему изобретению в субъекте, либо для повторного введения генетически модифицированных предшественников иммунных эффекторных клеток, которые при введении в субъекта дифференцируются в зрелые иммунные эффекторные клетки, экспрессирующие CAR. Один способ включает трансдукцию Т-клеток периферической крови ex vivo с помощью конструкции нуклеиновой кислоты в соответствии с настоящим изобретением и возврат трансдуцированных клеток в субъекта.
В определенных вариантах осуществления фолатный рецептор альфа, 5T4, αvβ6-интегрин, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, FRα, GD2, GD3, 'глипикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепь, Lewis-Y, каппа-цепь, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM или полинуклеотиды VEGFR2, полипептиды, фрагменты полипептидов или антитела к ним представляют собой часть сопутствующего диагностического способа, как правило, служащего для оценки того, будет ли субъект или популяция субъектов положительно реагировать на специфическое терапевтическое лечение.
Используемый в данном документе термин «сопутствующий диагностический» относится к диагностическому тесту, который связан с конкретным CAR или терапиейпосредством иммунных эффекторных клеток. В конкретном варианте осуществления диагностические способы и наборы предусматривают определение уровней экспрессии полипептида или полинуклеотида фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2 в биологическом образце, что тем самым позволяет быстро идентифицировать пациентов, подходящих для лечения в соответствии с настоящим изобретением.
Например, данное терапевтическое средство для лечения рака (например, содержащее CAR или генетически модифицированные иммунные эффекторные клетки, экспрессирующие CAR, рассмотренные в данном документе) можно будет идентифицировать как подходящее для субъекта или определенной популяции субъектов на основании того, характеризуется ли субъект(-ы) наличием одного или более выбранных биомаркеров для данного заболевания или состояния. Примеры биомаркеров включают сывороточные/тканевые маркеры, а также маркеры, которые могут быть идентифицированы с помощью методик медицинской визуализации. В определенных вариантах осуществления полипептидный фрагмент (или его соответствующий полинуклеотид) фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2 могут сами по себе обеспечивать сывороточный и/или тканевый биомаркер, который можно использовать для измерения результатов лечения с помощью лекарственного средства или для оценки целесообразности применения лекарственного средства у конкретного субъекта или конкретной популяции субъектов. В определенных аспектах идентификация поддающегося лечению показания, при котором экспрессируется полипептидная или соответствующая полинуклеотидная последовательность фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2 может включать определение дифференциальной экспрессии такой последовательности или у выбранного субъекта, в выбранной ткани, или иначе, как описано в данном документе и известно из уровня техники.
В конкретном варианте осуществления способы, рассмотренные в данном документе, включают измерение или количественную оценку уровня пре-мРНК, мРНК или белковой экспрессии полипептида фолатного рецептора альфа, 5T4, αvβ6-интегрина, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, в том числе ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, FRα, GD2, GD3, 'глипикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда-цепи, Lewis-Y, каппа-цепи, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM или VEGFR2 в раковой опухоли субъекта. В одном варианте осуществления субъекта идентифицируют как имеющего конкретный рак, поддающийся лечению с помощью композиций, рассмотренных в данном документе, если экспрессия маркера в 10 раз, 25 раз, 50 раз, в 100 раз или в 1000 раз выше или больше в биологическом образце, чем экспрессия маркера в контрольном образце или в известном стандарте. В конкретном варианте осуществления субъекта идентифицируют как имеющего показание, поддающееся лечению, если экспрессия биомаркера в биологическом образце является обнаруживаемой, и экспрессия маркера в контрольном образце или известном стандарте при использовании того же способа ниже уровня обнаружения.
Наличие, отсутствие или относительные уровни белковой экспрессии биомаркера в потенциальном раковой опухоли можно анализировать с помощью, например, гистохимических методик, иммунологических методик, электрофореза, вестерн-блот анализа, FACS-анализа, проточной цитометрии и т.п. Кроме того, наличие, отсутствие или относительные уровни экспрессии РНК биомаркера можно обнаружить, например, при помощи методик ПЦР, нозерн-блот-анализа, использования подходящих олигонуклеотидных зондов и т.п.
Все публикации, патентные заявки и выданные патенты, цитируемые в настоящем описании, включены в данный документ посредством ссылки, как если бы каждая отдельная публикация, патентная заявка или выданный патент были конкретно и индивидуально указаны как включенные посредством ссылки.
Хотя вышеизложенное изобретение было довольно подробно описано для иллюстрации и примера в целях ясности понимания, среднему специалисту в данной области будет очевидно в свете идей настоящего изобретения, что в него могут быть внесены определенные изменения и модификации без отступления от сущности или объема прилагаемой формулы изобретения. Следующие примеры предусмотрены только в качестве иллюстрации, но не в качестве ограничения. Специалисты в данной области без труда смогут выявить целый ряд второстепенных параметров, которые можно было бы изменить или модифицировать, чтобы получить по существу такие же результаты.
ПРИМЕРЫ
ПРИМЕР 1
КОНСТРУИРОВАНИЕ CAR
1. CD19-специфический CAR (pMND-CD19 CAR)
Разрабатывали CD19-специфические CAR, содержащие MND-промотор, функционально связанный с scFv-антителом к CD19, шарнирный и трансмембранный домен из CD8α и домены костимуляции CD137, за которыми расположен внутриклеточный домен передачи сигнала из CD3ζ-цепи. Фигура 1A. CD19-CAR содержит последовательность сигнального пептида (SP) CD8α для экспрессии на поверхности иммунных эффекторных клеток. Полинуклеотидная последовательность pMND-CD19-CAR изложена под SEQ ID NO: 2 и карта вектора показана на фигуре 2. В таблице 3 показаны обозначение, индивидуальный код в Genbank, название источника и библиографическая ссылка для различных нуклеотидных сегментов лентивирусного вектора pMND-CD19-CAR.
Таблица 3.
2. CAR, специфический в отношении легкой кaппa-цепи (кaппaLC) (pMND-каппа-CAR)
Разрабатывали CAR, специфические в отношении легкой кaппa-цепи, содержащие MND-промотор, функционально связанный с scFv-антителом к легкой кaппa-цепи, шарнирный и трансмембранный домен из CD8α и домены костимуляции CD137, за которыми расположен внутриклеточный домен передачи сигнала из CD3ζ-цепи. Фигура 1B. КаппаLC -CAR содержит последовательность сигнального пептида (SP) CD8α для экспрессии на поверхности иммунных эффекторных клеток. Полинуклеотидная последовательность pMND-каппаLC-CAR изложена под SEQ ID NO: 3 и карта вектора показана на фигуре 3. В таблице 4 показаны обозначение, индивидуальный код в Genbank, название источника и библиографическая ссылка для различных нуклеотидных сегментов лентивирусного вектора pMND-легкая каппа-цепь-CAR.
Таблица 4.
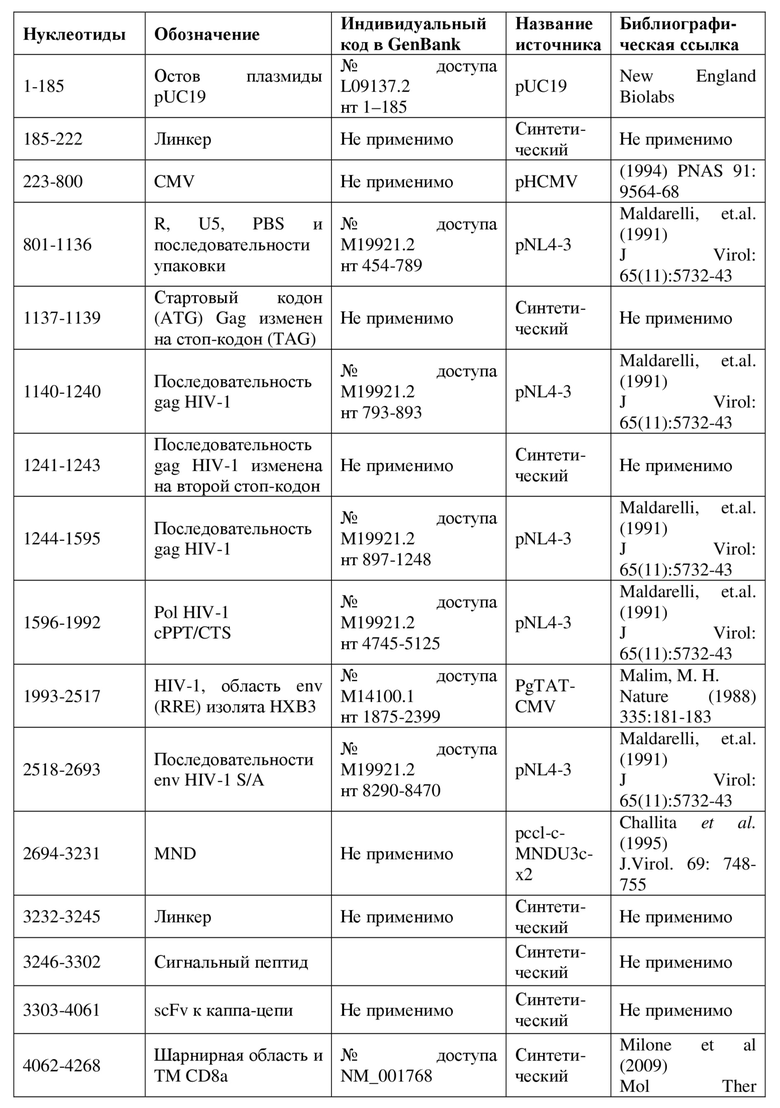
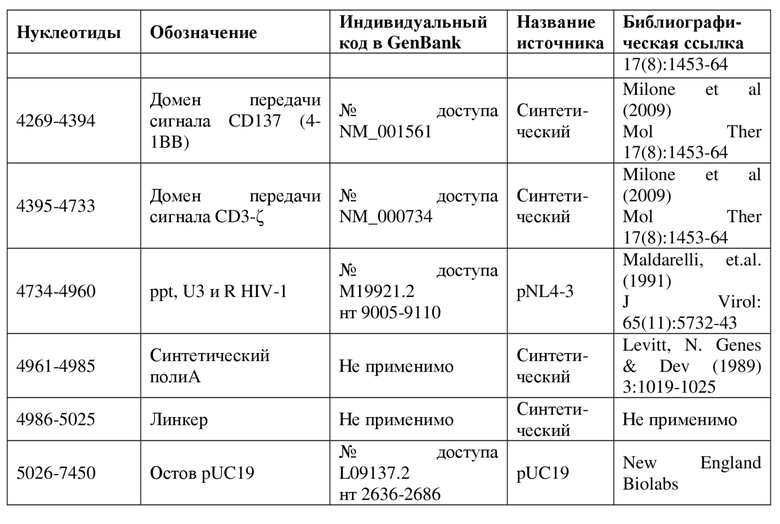
ПРИМЕР 2
ТРАНСДУКЦИЯ Т-КЛЕТОК
Супернатанты с лентивирусным вектором (LV) получали в клетках HEK 293Т, как описано в литературе (Naldini et al., 1996, Dull et al., 1998 и Zufferey et al., 1998). Транзиентную трансфекцию с помощью 5 плазмид (HPV 275, кодирующая gag-pol HIV, ΨN 15, кодирующая белок оболочки VSV-G, p633, кодирующая белок rev HIV, HPV601, кодирующая белок tat HIV и вектор экспрессии CAR) применяли, как описано в публикации согласно PCT №WO2012/170911. Затем супернатанты с LV концентрировали либо посредством ультрацентрифугирования, либо при помощи ионообменной колонки с последующей тангенциальной поточной фильтрацией (TFF), составляли в среде SCGM (CellGenix Inc., Германия) и криоконсервировали при <-70°C во криофлаконах для однократного применения. Инфекционные титры определяли с применением анализа проточной цитометрии трансдуцированных клеток остеосаркомы человека (HOS) (Kutner et al., 2009, Nature Protocols 4:495-505). Для трансдукции человеческих T-лимфоцитов первичные человеческие Т-клетки выделяли из крови здоровых доноров-добровольцев после лейкафереза с помощью негативной селекции с применением наборов RosetteSep (Stem Cell Technologies). Т-клетки культивировали в RPMI 1640, дополненной 10% FCS, 100 Ед/мл пенициллина, 100 г/мл стрептомицина сульфатом, 10 мM Hepes, и стимулировали с помощью магнитных гранул, покрытых антителом к CD3/антителом к CD28 при соотношении клетки : гранулы 1:3. В случае CD8 Т-клеток человеческий IL-2 (Chiron) добавляли через день до конечной концентрации 30 МЕ/мл. Примерно через 24 часа после активации Т-клетки трансдуцировали с помощью лентивирусных векторов при MOI, составляющей 5. Трансдукцию Т-клеток оценивали с помощью полимеразной цепной реакции с применением праймеров, специфичных в отношении вирусного вектора, и с помощью проточной цитометрии через 7-10 дней после трансдукции.
ПРИМЕР 3
VCN В T-КЛЕТКАХ, ТРАНСДУЦИРОВАННЫХ С ПОМОЩЬЮ CAR
Определяли число копий вектора в случае трансдукции первичных человеческих Т-клеток с помощью лентивируса pMND-каппаLC-CAR. Мононуклеарные клетки периферической крови (PBMC) собирали от нормальных доноров и активировали при помощи культивирования с антителами, специфичными в отношении CD3 и CD28 (Miltenyi Biotec), в среде, содержащей IL-2 (CellGenix). После активации культуры PBMC трансдуцировали с помощью лентивирусных векторов или оставляли без обработки. Культуры поддерживали для обеспечения разрастания и размножения Т-клеток (7-10 дней). Во время сбора культуры содержали Т-клетки, которые размножились до уровня примерно 2 log.
Число копий вектора (VCN) интегрированных лентивирусных частиц определяли с помощью количественной ПЦР через девять после трансдукции. Среднее значение VCN для 12 уникальных культур от 6 доноров составляло 3.1. Фигура 4.
ПРИМЕР 4
ЭКСПРЕССИЯ CAR В ТРАНСДУЦИРОВАННЫХ T-КЛЕТКАХ
Определяли экспрессию химерных антигенных рецепторов, специфичных в отношении каппа-цепи, экспрессируемых за счет MND-промотора (pMND-kappaLC-CAR), на клеточной поверхности первичных человеческих Т-клеток. Мононуклеарные клетки периферической крови (PBMC) собирали от нормальных доноров и активировали при помощи культивирования с антителами, специфичными в отношении CD3 и CD28 (Miltenyi Biotec), в среде, содержащей IL-2 (CellGenix). После активации культуры PBMC трансдуцировали с помощью лентивирусных векторов или оставляли без обработки. Культуры поддерживали для обеспечения разрастания и размножения Т-клеток (7-10 дней). Во время сбора культуры содержали Т-клетки, которые размножились до уровня примерно 2 log.
Экспрессию каппаLC определяли с помощью проточной цитометрии с применением антител, специфичных в отношении мышиного Ig (BD Biosciences), которые присутствуют только на Т-клетках, модифицированных pMND- каппаLC CAR. Проточную цитометрию осуществляли на 6-9 дни после трансдукции. Средний уровень экспрессии каппаLC в 12 уникальных культурах от 6 доноров составлял 35,6%. Фигура 5.
ПРИМЕР 5
MND-ПРОМОТОР ОБЕСПЕЧИВАЕТ ЭКСПРЕССИЮ CAR В Т-КЛЕТКАХ НА УРОВНЕ, СОИЗМЕРИМЫМ С ТАКОВОЙ, ОБЕСПЕЧИВАЕМОЙ EF1А-ПРОМОТОРОМ
Экспрессия CD19-CAR на модифицированных Т-клетках, обеспечиваемая MND-промотором, была соизмерима с экспрессией CD19-CAR, обеспечиваемой EF1α-промотором. Мононуклеарные клетки периферической крови (PBMC) собирали от нормальных доноров и активировали при помощи культивирования с антителами, специфичными в отношении CD3 и CD28 (Miltenyi Biotec), в среде, содержащей IL-2 (CellGenix). После активации культуры PBMC трансдуцировали с помощью лентивирусных векторов или оставляли без обработки. Культуры поддерживали для обеспечения разрастания и размножения Т-клеток (7-10 дней). Во время сбора культуры содержали Т-клетки, которые размножились до уровня примерно 2 log. По окончании культивирования трансдукцию Т-клеток оценивали с помощью количественной полимеразной цепной реакции (qPCR) с применением праймеров, специфичных в отношении вирусных частиц. Экспрессию CD19-CAR определяли через шесть дней после трансдукции посредством проточной цитометрии с применением антител, специфичных в отношении мышиных Ig (BD Biosciences), которые присутствуют только на Т-клетках, модифицированных с помощью CD19 CAR. Как экспрессия CD19-CAR, так и VCN были соизмеримы в случае различных конструкций. Фигура 6.
ПРИМЕР 6
АНТИГЕН-СПЕЦИФИЧЕСКАЯ РЕАКТИВНОСТЬ CAR-T-КЛЕТОК
Определяли антиген-специфическую реактивность Т-клеток с pMND-каппаLC-CAR. Мононуклеарные клетки периферической крови (PBMC) собирали от нормальных доноров и активировали при помощи культивирования с антителами, специфичными в отношении CD3 и CD28 (Miltenyi Biotec), в среде, содержащей IL-2 (CellGenix). После активации культуры PBMC трансдуцировали с помощью лентивирусных векторов или оставляли без обработки. Культуры поддерживали для обеспечения разрастания и размножения Т-клеток (7-10 дней). Во время сбора культуры содержали Т-клетки, которые размножились до уровня примерно 2 log.
По окончании культивирования реактивность в отношении опухоли оценивали по высвобождению интерферона-гамма (IFNγ). Т-клетки, модифицированные с помощью pMND-каппаLC-CAR, секретируют IFNγ после совместного культивирования с каппа+ клетками Дауди (экспрессируют каппаLC). В отличие от этого, совместное культивирование Т-клеток, модифицированных с помощью pMND-каппаLC-CAR, с каппа-негативными клетками HDLM-2, приводило к высвобождению IFNγ в количестве, соизмеримом с таковым при культивировании Т-клеток отдельно. Высвобождение IFNγ определяли с применением наборов для ELISA через 24 часа после совместного культивирования с каппа-позитивными клетками Дауди или каппа-негативными клетками HDLM-2. Фигура 7.
ПРИМЕР 7
ПРОТИВООПУХОЛЕВАЯ ФУНКЦИЯ CAR-T-КЛЕТОК
Определяли противоопухолевую функцию CAR-T-клеток, сконструированных для экспрессии pMND-каппаLC-CAR. Мононуклеарные клетки периферической крови (PBMC) собирали от нормальных доноров и активировали при помощи культивирования с антителами, специфичными в отношении CD3 и CD28 (Miltenyi Biotec), в среде, содержащей IL-2 (CellGenix). После активации культуры PBMC трансдуцировали с помощью лентивирусных векторов или оставляли без обработки. Культуры поддерживали для обеспечения разрастания и размножения Т-клеток (7-10 дней). Во время сбора культуры содержали Т-клетки, которые размножились до уровня примерно 2 log.
2×106 клеток Дауди, меченых с помощью гена люциферазы светлячка, имплантировали NOD scid-мышам с нокаутом по гамма-цепи рецептора IL-2 (NSG) посредством внутривенной инъекции. Через три, шесть и девять дней после инъекции опухолевых клеток в мышей 1×107 Т-клеток, модифицированных с помощью MND-каппаLC-CAR, адоптивно переносили мышам и рост опухоли отслеживали при помощи биолюминесценции с применением системы визуализации Xenogen-IVIS. Опухолевая нагрузка у мышей, которым вводили модифицированные CAR-Т-клетки, снижалась по сравнению с опухолевой нагрузкой у необработанных мышей. Фигура 8.
ПРИМЕР 8
ПОЛУЧЕНИЕ ФУНКЦИОНАЛЬНОГО ЛЕКАРСТВЕННОГО ПРЕПАРАТА, СОДЕРЖАЩЕГО CAR-T-КЛЕТКИ
Т-клетки, экспрессирующие CAR к BCMA, получали, как описано в примере 1, выше. Такие CAR-Т-клетки демонстрировали антиген-специфический клиренс опухоли. Т-клетки, экспрессирующие CAR к BCMA, совместно культивировали в течение 4 часов с клетками K562 или клетками K562, модифицированными для экспрессии BCMA. Опухолевые клетки, экспрессирующие антиген, метили при помощи сложного сукцинимидилового эфира карбоксифлуоресцеина (CFSE) и флуоресценцию измеряли при помощи FACS. Т-клетки, экспрессирующие CAR к BCMA, приводили к цитолизу клеток K562, экспрессирующих BCMA (фигура 9A), и высвобождали IFN-γ (фигура 9B). (n=3).
В целом в нижеследующей формуле изобретения используемые термины не должны толковаться как ограничивающие формулу изобретения конкретными вариантами осуществления, раскрытыми в настоящем описании и формуле изобретения, но должны быть истолкованы как включающие все возможные варианты осуществления вместе с полным объемом эквивалентов, которые такая формула изобретения охватывает. Соответственно, формула изобретения не ограничивается настоящим раскрытием.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> БЛУБЁРД БИО Инк.
<120> ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С MND-ПРОМОТОРОМ
<130> BLBD-027/01WO
<150> US 61/984561
<151> 2014-04-25
<160> 27
<170> PatentIn версия 3.5
<210> 1
<211> 399
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Промотор (MND) с энхансером вируса миелопролиферативной
саркомы, с удаленным участком отрицательного контроля, с сайтом
связывания праймера, замещенным на последовательность из
dl587rev
<400> 1
tttatttagt ctccagaaaa aggggggaat gaaagacccc acctgtaggt ttggcaagct 60
aggatcaagg ttaggaacag agagacagca gaatatgggc caaacaggat atctgtggta 120
agcagttcct gccccggctc agggccaaga acagttggaa cagcagaata tgggccaaac 180
aggatatctg tggtaagcag ttcctgcccc ggctcagggc caagaacaga tggtccccag 240
atgcggtccc gccctcagca gtttctagag aaccatcaga tgtttccagg gtgccccaag 300
gacctgaaat gaccctgtgc cttatttgaa ctaaccaatc agttcgcttc tcgcttctgt 360
tcgcgcgctt ctgctccccg agctcaataa aagagccca 399
<210> 2
<211> 7425
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полинуклеотидная последовательность конструкции, содержащей
MND-промотор и CAR, связывающий CD19
<400> 2
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accatcatat gccagcctat ggtgacattg attattgact agttattaat agtaatcaat 240
tacggggtca ttagttcata gcccatatat ggagttccgc gttacataac ttacggtaaa 300
tggcccgcct ggctgaccgc ccaacgaccc ccgcccattg acgtcaataa tgacgtatgt 360
tcccatagta acgccaatag ggactttcca ttgacgtcaa tgggtggagt atttacggta 420
aactgcccac ttggcagtac atcaagtgta tcatatgcca agtacgcccc ctattgacgt 480
caatgacggt aaatggcccg cctggcatta tgcccagtac atgaccttat gggactttcc 540
tacttggcag tacatctacg tattagtcat cgctattacc atggtgatgc ggttttggca 600
gtacatcaat gggcgtggat agcggtttga ctcacgggga tttccaagtc tccaccccat 660
tgacgtcaat gggagtttgt tttggcacca aaatcaacgg gactttccaa aatgtcgtaa 720
caactccgcc ccattgacgc aaatgggcgg taggcgtgta cggtgggagg tctatataag 780
cagagctcgt ttagtgaacc gggtctctct ggttagacca gatctgagcc tgggagctct 840
ctggctaact agggaaccca ctgcttaagc ctcaataaag cttgccttga gtgctcaaag 900
tagtgtgtgc ccgtctgttg tgtgactctg gtaactagag atccctcaga cccttttagt 960
cagtgtggaa aatctctagc agtggcgccc gaacagggac ttgaaagcga aagtaaagcc 1020
agaggagatc tctcgacgca ggactcggct tgctgaagcg cgcacggcaa gaggcgaggg 1080
gcggcgactg gtgagtacgc caaaaatttt gactagcgga ggctagaagg agagagtagg 1140
gtgcgagagc gtcggtatta agcgggggag aattagataa atgggaaaaa attcggttaa 1200
ggccaggggg aaagaaacaa tataaactaa aacatatagt tagggcaagc agggagctag 1260
aacgattcgc agttaatcct ggccttttag agacatcaga aggctgtaga caaatactgg 1320
gacagctaca accatccctt cagacaggat cagaagaact tagatcatta tataatacaa 1380
tagcagtcct ctattgtgtg catcaaagga tagatgtaaa agacaccaag gaagccttag 1440
ataagataga ggaagagcaa aacaaaagta agaaaaaggc acagcaagca gcagctgaca 1500
caggaaacaa cagccaggtc agccaaaatt accctatagt gcagaacctc caggggcaaa 1560
tggtacatca ggccatatca cctagaactt taaattaaga cagcagtaca aatggcagta 1620
ttcatccaca attttaaaag aaaagggggg attggggggt acagtgcagg ggaaagaata 1680
gtagacataa tagcaacaga catacaaact aaagaattac aaaaacaaat tacaaaaatt 1740
caaaattttc gggtttatta cagggacagc agagatccag tttggaaagg accagcaaag 1800
ctcctctgga aaggtgaagg ggcagtagta atacaagata atagtgacat aaaagtagtg 1860
ccaagaagaa aagcaaagat catcagggat tatggaaaac agatggcagg tgatgattgt 1920
gtggcaagta gacaggatga ggattaacac atggaaaaga ttagtaaaac accatagctc 1980
tagagcgatc ccgatcttca gacctggagg aggagatatg agggacaatt ggagaagtga 2040
attatataaa tataaagtag taaaaattga accattagga gtagcaccca ccaaggcaaa 2100
gagaagagtg gtgcagagag aaaaaagagc agtgggaata ggagctttgt tccttgggtt 2160
cttgggagca gcaggaagca ctatgggcgc agcgtcaatg acgctgacgg tacaggccag 2220
acaattattg tctggtatag tgcagcagca gaacaatttg ctgagggcta ttgaggcgca 2280
acagcatctg ttgcaactca cagtctgggg catcaagcag ctccaggcaa gaatcctggc 2340
tgtggaaaga tacctaaagg atcaacagct cctggggatt tggggttgct ctggaaaact 2400
catttgcacc actgctgtgc cttggaatgc tagttggagt aataaatctc tggaacagat 2460
ttggaatcac acgacctgga tggagtggga cagagaaatt aacaattaca caagcttggt 2520
aggtttaaga atagtttttg ctgtactttc tatagtgaat agagttaggc agggatattc 2580
accattatcg tttcagaccc acctcccaac cccgagggga cccgacaggc ccgaaggaat 2640
agaagaagaa ggtggagaga gagacagaga cagatccatt cgattagtga acggatccat 2700
cgattagtcc aatttgttaa agacaggata tcagtggtcc aggctctagt tttgactcaa 2760
caatatcacc agctgaagcc tatagagtac gagccataga tagaataaaa gattttattt 2820
agtctccaga aaaagggggg aatgaaagac cccacctgta ggtttggcaa gctaggatca 2880
aggttaggaa cagagagaca gcagaatatg ggccaaacag gatatctgtg gtaagcagtt 2940
cctgccccgg ctcagggcca agaacagttg gaacagcaga atatgggcca aacaggatat 3000
ctgtggtaag cagttcctgc cccggctcag ggccaagaac agatggtccc cagatgcggt 3060
cccgccctca gcagtttcta gagaaccatc agatgtttcc agggtgcccc aaggacctga 3120
aatgaccctg tgccttattt gaactaacca atcagttcgc ttctcgcttc tgttcgcgcg 3180
cttctgctcc ccgagctcaa taaaagagcc cacaacccct cactcggcgc gacgcgtcat 3240
agccaccatg gccttaccag tgaccgcctt gctcctgccg ctggccttgc tgctccacgc 3300
cgccaggccg gacatccaga tgacacagac tacatcctcc ctgtctgcct ctctgggaga 3360
cagagtcacc atcagttgca gggcaagtca ggacattagt aaatatttaa attggtatca 3420
gcagaaacca gatggaactg ttaaactcct gatctaccat acatcaagat tacactcagg 3480
agtcccatca aggttcagtg gcagtgggtc tggaacagat tattctctca ccattagcaa 3540
cctggagcaa gaagatattg ccacttactt ttgccaacag ggtaatacgc ttccgtacac 3600
gttcggaggg gggaccaagc tggagatcac aggtggcggt ggctccggcg gtggtgggtc 3660
tggtggcggc ggaagcgagg tgaaactgca ggagtcagga cctggcctgg tggcgccctc 3720
acagagcctg tccgtcacat gcactgtctc aggggtctca ttacccgact atggtgtaag 3780
ctggattcgc cagcctccac gaaagggtct ggagtggctg ggagtaatat ggggtagtga 3840
aaccacatac tataattcag ctctcaaatc cagactgacc atcatcaagg acaactccaa 3900
gagccaagtt ttcttaaaaa tgaacagtct gcaaactgat gacacagcca tttactactg 3960
tgccaaacat tattactacg gtggtagcta tgctatggac tactggggtc aaggaacctc 4020
ggtcaccgtc tcctcaacca cgacgccagc gccgcgacca ccaacaccgg cgcccaccat 4080
cgcgtcgcag cccctgtccc tgcgcccaga ggcgtgccgg ccagcggcgg ggggcgcagt 4140
gcacacgagg gggctggact tcgcctgtga tatctacatc tgggcgccct tggccgggac 4200
ttgtggggtc cttctcctgt cactggtgat caccctttac tgcaaacggg gcagaaagaa 4260
actcctgtat atattcaaac aaccatttat gagaccagta caaactactc aagaggaaga 4320
tggctgtagc tgccgatttc cagaagaaga agaaggagga tgtgaactga gagtgaagtt 4380
cagcaggagc gcagacgccc ccgcgtacca gcagggccag aaccagctct ataacgagct 4440
caatctagga cgaagagagg agtacgatgt tttggacaag agacgtggcc gggaccctga 4500
gatgggggga aagccgagaa ggaagaaccc tcaggaaggc ctgtacaatg aactgcagaa 4560
agataagatg gcggaggcct acagtgagat tgggatgaaa ggcgagcgcc ggaggggcaa 4620
ggggcacgat ggcctttacc agggtctcag tacagccacc aaggacacct acgacgccct 4680
tcacatgcag gccctgcccc ctcgctaatg acaggtacct ttaagaccaa tgacttacaa 4740
ggcagctgta gatcttagcc actttttaaa agaaaagggg ggactggaag ggctaattca 4800
ctcccaaaga agacaagatc tgctttttgc ctgtactggg tctctctggt tagaccagat 4860
ctgagcctgg gagctctctg gctaactagg gaacccactg cttaagcctc aataaagctt 4920
gccttgagtg cttcaatgtg tgtgttggtt ttttgtgtgt cgaaattcta gcgattctag 4980
cttggcgtac cagcctatgg cgctcacaat tccacacaac atacgagccg gaagcataaa 5040
gtgtaaagcc tggggtgcct aatgagtgag ctaactcaca ttaattgcgt tgcgctcact 5100
gcccgctttc cagtcgggaa acctgtcgtg ccagctgcat taatgaatcg gccaacgcgc 5160
ggggagaggc ggtttgcgta ttgggcgctc ttccgcttcc tcgctcactg actcgctgcg 5220
ctcggtcgtt cggctgcggc gagcggtatc agctcactca aaggcggtaa tacggttatc 5280
cacagaatca ggggataacg caggaaagaa catgtgagca aaaggccagc aaaaggccag 5340
gaaccgtaaa aaggccgcgt tgctggcgtt tttccatagg ctccgccccc ctgacgagca 5400
tcacaaaaat cgacgctcaa gtcagaggtg gcgaaacccg acaggactat aaagatacca 5460
ggcgtttccc cctggaagct ccctcgtgcg ctctcctgtt ccgaccctgc cgcttaccgg 5520
atacctgtcc gcctttctcc cttcgggaag cgtggcgctt tctcatagct cacgctgtag 5580
gtatctcagt tcggtgtagg tcgttcgctc caagctgggc tgtgtgcacg aaccccccgt 5640
tcagcccgac cgctgcgcct tatccggtaa ctatcgtctt gagtccaacc cggtaagaca 5700
cgacttatcg ccactggcag cagccactgg taacaggatt agcagagcga ggtatgtagg 5760
cggtgctaca gagttcttga agtggtggcc taactacggc tacactagaa gaacagtatt 5820
tggtatctgc gctctgctga agccagttac cttcggaaaa agagttggta gctcttgatc 5880
cggcaaacaa accaccgctg gtagcggtgg tttttttgtt tgcaagcagc agattacgcg 5940
cagaaaaaaa ggatctcaag aagatccttt gatcttttct acggggtctg acgctcagtg 6000
gaacgaaaac tcacgttaag ggattttggt catgagatta tcaaaaagga tcttcaccta 6060
gatcctttta aattaaaaat gaagttttaa atcaatctaa agtatatatg agtaaacttg 6120
gtctgacagt taccaatgct taatcagtga ggcacctatc tcagcgatct gtctatttcg 6180
ttcatccata gttgcctgac tccccgtcgt gtagataact acgatacggg agggcttacc 6240
atctggcccc agtgctgcaa tgataccgcg agacccacgc tcaccggctc cagatttatc 6300
agcaataaac cagccagccg gaagggccga gcgcagaagt ggtcctgcaa ctttatccgc 6360
ctccatccag tctattaatt gttgccggga agctagagta agtagttcgc cagttaatag 6420
tttgcgcaac gttgttgcca ttgctacagg catcgtggtg tcacgctcgt cgtttggtat 6480
ggcttcattc agctccggtt cccaacgatc aaggcgagtt acatgatccc ccatgttgtg 6540
caaaaaagcg gttagctcct tcggtcctcc gatcgttgtc agaagtaagt tggccgcagt 6600
gttatcactc atggttatgg cagcactgca taattctctt actgtcatgc catccgtaag 6660
atgcttttct gtgactggtg agtactcaac caagtcattc tgagaatagt gtatgcggcg 6720
accgagttgc tcttgcccgg cgtcaatacg ggataatacc gcgccacata gcagaacttt 6780
aaaagtgctc atcattggaa aacgttcttc ggggcgaaaa ctctcaagga tcttaccgct 6840
gttgagatcc agttcgatgt aacccactcg tgcacccaac tgatcttcag catcttttac 6900
tttcaccagc gtttctgggt gagcaaaaac aggaaggcaa aatgccgcaa aaaagggaat 6960
aagggcgaca cggaaatgtt gaatactcat actcttcctt tttcaatatt attgaagcat 7020
ttatcagggt tattgtctca tgagcggata catatttgaa tgtatttaga aaaataaaca 7080
aataggggtt ccgcgcacat ttccccgaaa agtgccacct gggactagct ttttgcaaaa 7140
gcctaggcct ccaaaaaagc ctcctcacta cttctggaat agctcagagg ccgaggcggc 7200
ctcggcctct gcataaataa aaaaaattag tcagccatgg ggcggagaat gggcggaact 7260
gggcggagtt aggggcggga tgggcggagt taggggcggg actatggttg ctgactaatt 7320
gagatgagct tgcatgccga cattgattat tgactagtcc ctaagaaacc attcttatca 7380
tgacattaac ctataaaaat aggcgtatca cgaggccctt tcgtc 7425
<210> 3
<211> 7450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Полинуклеотидная последовательность конструкции, содержащей
MND-промотор и CAR, связывающий легкую каппа-цепь
<400> 3
tcgcgcgttt cggtgatgac ggtgaaaacc tctgacacat gcagctcccg gagacggtca 60
cagcttgtct gtaagcggat gccgggagca gacaagcccg tcagggcgcg tcagcgggtg 120
ttggcgggtg tcggggctgg cttaactatg cggcatcaga gcagattgta ctgagagtgc 180
accatcatat gccagcctat ggtgacattg attattgact agttattaat agtaatcaat 240
tacggggtca ttagttcata gcccatatat ggagttccgc gttacataac ttacggtaaa 300
tggcccgcct ggctgaccgc ccaacgaccc ccgcccattg acgtcaataa tgacgtatgt 360
tcccatagta acgccaatag ggactttcca ttgacgtcaa tgggtggagt atttacggta 420
aactgcccac ttggcagtac atcaagtgta tcatatgcca agtacgcccc ctattgacgt 480
caatgacggt aaatggcccg cctggcatta tgcccagtac atgaccttat gggactttcc 540
tacttggcag tacatctacg tattagtcat cgctattacc atggtgatgc ggttttggca 600
gtacatcaat gggcgtggat agcggtttga ctcacgggga tttccaagtc tccaccccat 660
tgacgtcaat gggagtttgt tttggcacca aaatcaacgg gactttccaa aatgtcgtaa 720
caactccgcc ccattgacgc aaatgggcgg taggcgtgta cggtgggagg tctatataag 780
cagagctcgt ttagtgaacc gggtctctct ggttagacca gatctgagcc tgggagctct 840
ctggctaact agggaaccca ctgcttaagc ctcaataaag cttgccttga gtgctcaaag 900
tagtgtgtgc ccgtctgttg tgtgactctg gtaactagag atccctcaga cccttttagt 960
cagtgtggaa aatctctagc agtggcgccc gaacagggac ttgaaagcga aagtaaagcc 1020
agaggagatc tctcgacgca ggactcggct tgctgaagcg cgcacggcaa gaggcgaggg 1080
gcggcgactg gtgagtacgc caaaaatttt gactagcgga ggctagaagg agagagtagg 1140
gtgcgagagc gtcggtatta agcgggggag aattagataa atgggaaaaa attcggttaa 1200
ggccaggggg aaagaaacaa tataaactaa aacatatagt tagggcaagc agggagctag 1260
aacgattcgc agttaatcct ggccttttag agacatcaga aggctgtaga caaatactgg 1320
gacagctaca accatccctt cagacaggat cagaagaact tagatcatta tataatacaa 1380
tagcagtcct ctattgtgtg catcaaagga tagatgtaaa agacaccaag gaagccttag 1440
ataagataga ggaagagcaa aacaaaagta agaaaaaggc acagcaagca gcagctgaca 1500
caggaaacaa cagccaggtc agccaaaatt accctatagt gcagaacctc caggggcaaa 1560
tggtacatca ggccatatca cctagaactt taaattaaga cagcagtaca aatggcagta 1620
ttcatccaca attttaaaag aaaagggggg attggggggt acagtgcagg ggaaagaata 1680
gtagacataa tagcaacaga catacaaact aaagaattac aaaaacaaat tacaaaaatt 1740
caaaattttc gggtttatta cagggacagc agagatccag tttggaaagg accagcaaag 1800
ctcctctgga aaggtgaagg ggcagtagta atacaagata atagtgacat aaaagtagtg 1860
ccaagaagaa aagcaaagat catcagggat tatggaaaac agatggcagg tgatgattgt 1920
gtggcaagta gacaggatga ggattaacac atggaaaaga ttagtaaaac accatagctc 1980
tagagcgatc ccgatcttca gacctggagg aggagatatg agggacaatt ggagaagtga 2040
attatataaa tataaagtag taaaaattga accattagga gtagcaccca ccaaggcaaa 2100
gagaagagtg gtgcagagag aaaaaagagc agtgggaata ggagctttgt tccttgggtt 2160
cttgggagca gcaggaagca ctatgggcgc agcgtcaatg acgctgacgg tacaggccag 2220
acaattattg tctggtatag tgcagcagca gaacaatttg ctgagggcta ttgaggcgca 2280
acagcatctg ttgcaactca cagtctgggg catcaagcag ctccaggcaa gaatcctggc 2340
tgtggaaaga tacctaaagg atcaacagct cctggggatt tggggttgct ctggaaaact 2400
catttgcacc actgctgtgc cttggaatgc tagttggagt aataaatctc tggaacagat 2460
ttggaatcac acgacctgga tggagtggga cagagaaatt aacaattaca caagcttggt 2520
aggtttaaga atagtttttg ctgtactttc tatagtgaat agagttaggc agggatattc 2580
accattatcg tttcagaccc acctcccaac cccgagggga cccgacaggc ccgaaggaat 2640
agaagaagaa ggtggagaga gagacagaga cagatccatt cgattagtga acggatccat 2700
cgattagtcc aatttgttaa agacaggata tcagtggtcc aggctctagt tttgactcaa 2760
caatatcacc agctgaagcc tatagagtac gagccataga tagaataaaa gattttattt 2820
agtctccaga aaaagggggg aatgaaagac cccacctgta ggtttggcaa gctaggatca 2880
aggttaggaa cagagagaca gcagaatatg ggccaaacag gatatctgtg gtaagcagtt 2940
cctgccccgg ctcagggcca agaacagttg gaacagcaga atatgggcca aacaggatat 3000
ctgtggtaag cagttcctgc cccggctcag ggccaagaac agatggtccc cagatgcggt 3060
cccgccctca gcagtttcta gagaaccatc agatgtttcc agggtgcccc aaggacctga 3120
aatgaccctg tgccttattt gaactaacca atcagttcgc ttctcgcttc tgttcgcgcg 3180
cttctgctcc ccgagctcaa taaaagagcc cacaacccct cactcggcgc gacgcgttag 3240
ccaccatgga gtttgggctg agctggcttt ttcttgtggc tattttaaaa ggtgtccagt 3300
gcgatgttat gctgacccaa actccactct ccctgcctgt cagtcttgga gatcaagcct 3360
ccatctcttg cagatctagt cagagcattt tacatagtac tggagacacc tatttagaat 3420
ggtacctgca gaaaccaggc cagtctccaa agctcctgat caacaaagtt tccaatcgat 3480
tgtctggggt cccagacagg ttcagtggca gtggatcagg gacagatttc acactcaaga 3540
tcagcagagt ggaggctgag gatctgggag tttattactg ctttcaaggt tcacatgttc 3600
cgtggacgtt cggtggaggc accaagctgg aaatcaaacg ggctgatgct gcaccaactg 3660
tatccatctt cccaggtggc ggtggctcgg gcggtggtgg gtcgggtggc ggcggatcac 3720
aggtgaagct tcagcagtca ggacctagcc tggtgaagcc tggggcttca gtgaagatgt 3780
cctgcaaggc ttctggatac accttcactg acttctacat gaagtgggtg aagcagagcc 3840
atggaaagag ccttgagtgg attggagata ttaatcctaa cattggtgat actttctaca 3900
accagaaatt caagggcaag gccacattga ctgtcgacaa atcctccagc acagcctaca 3960
tgcagctcaa cagcctgaca tctgaggact ctgcagtcta tttctgttca gttgggtact 4020
tcgatgtctg gggcgcaggg accacggtca ccgtctcctc aaccacgacg ccagcgccgc 4080
gaccaccaac accggcgccc accatcgcgt cgcagcccct gtccctgcgc ccagaggcgt 4140
gccggccagc ggcggggggc gcagtgcaca cgagggggct ggacttcgcc tgtgatatct 4200
acatctgggc gcccttggcc gggacttgtg gggtccttct cctgtcactg gtgatcaccc 4260
tttactgcaa acggggcaga aagaaactcc tgtatatatt caaacaacca tttatgagac 4320
cagtacaaac tactcaagag gaagatggct gtagctgccg atttccagaa gaagaagaag 4380
gaggatgtga actgagagtg aagttcagca ggagcgcaga cgcccccgcg taccagcagg 4440
gccagaacca gctctataac gagctcaatc taggacgaag agaggagtac gatgttttgg 4500
acaagagacg tggccgggac cctgagatgg ggggaaagcc gagaaggaag aaccctcagg 4560
aaggcctgta caatgaactg cagaaagata agatggcgga ggcctacagt gagattggga 4620
tgaaaggcga gcgccggagg ggcaaggggc acgatggcct ttaccagggt ctcagtacag 4680
ccaccaagga cacctacgac gcccttcaca tgcaggccct gccccctcgc taatgacagg 4740
tacctttaag accaatgact tacaaggcag ctgtagatct tagccacttt ttaaaagaaa 4800
aggggggact ggaagggcta attcactccc aaagaagaca agatctgctt tttgcctgta 4860
ctgggtctct ctggttagac cagatctgag cctgggagct ctctggctaa ctagggaacc 4920
cactgcttaa gcctcaataa agcttgcctt gagtgcttca atgtgtgtgt tggttttttg 4980
tgtgtcgaaa ttctagcgat tctagcttgg cgtaccagcc tatggcgctc acaattccac 5040
acaacatacg agccggaagc ataaagtgta aagcctgggg tgcctaatga gtgagctaac 5100
tcacattaat tgcgttgcgc tcactgcccg ctttccagtc gggaaacctg tcgtgccagc 5160
tgcattaatg aatcggccaa cgcgcgggga gaggcggttt gcgtattggg cgctcttccg 5220
cttcctcgct cactgactcg ctgcgctcgg tcgttcggct gcggcgagcg gtatcagctc 5280
actcaaaggc ggtaatacgg ttatccacag aatcagggga taacgcagga aagaacatgt 5340
gagcaaaagg ccagcaaaag gccaggaacc gtaaaaaggc cgcgttgctg gcgtttttcc 5400
ataggctccg cccccctgac gagcatcaca aaaatcgacg ctcaagtcag aggtggcgaa 5460
acccgacagg actataaaga taccaggcgt ttccccctgg aagctccctc gtgcgctctc 5520
ctgttccgac cctgccgctt accggatacc tgtccgcctt tctcccttcg ggaagcgtgg 5580
cgctttctca tagctcacgc tgtaggtatc tcagttcggt gtaggtcgtt cgctccaagc 5640
tgggctgtgt gcacgaaccc cccgttcagc ccgaccgctg cgccttatcc ggtaactatc 5700
gtcttgagtc caacccggta agacacgact tatcgccact ggcagcagcc actggtaaca 5760
ggattagcag agcgaggtat gtaggcggtg ctacagagtt cttgaagtgg tggcctaact 5820
acggctacac tagaagaaca gtatttggta tctgcgctct gctgaagcca gttaccttcg 5880
gaaaaagagt tggtagctct tgatccggca aacaaaccac cgctggtagc ggtggttttt 5940
ttgtttgcaa gcagcagatt acgcgcagaa aaaaaggatc tcaagaagat cctttgatct 6000
tttctacggg gtctgacgct cagtggaacg aaaactcacg ttaagggatt ttggtcatga 6060
gattatcaaa aaggatcttc acctagatcc ttttaaatta aaaatgaagt tttaaatcaa 6120
tctaaagtat atatgagtaa acttggtctg acagttacca atgcttaatc agtgaggcac 6180
ctatctcagc gatctgtcta tttcgttcat ccatagttgc ctgactcccc gtcgtgtaga 6240
taactacgat acgggagggc ttaccatctg gccccagtgc tgcaatgata ccgcgagacc 6300
cacgctcacc ggctccagat ttatcagcaa taaaccagcc agccggaagg gccgagcgca 6360
gaagtggtcc tgcaacttta tccgcctcca tccagtctat taattgttgc cgggaagcta 6420
gagtaagtag ttcgccagtt aatagtttgc gcaacgttgt tgccattgct acaggcatcg 6480
tggtgtcacg ctcgtcgttt ggtatggctt cattcagctc cggttcccaa cgatcaaggc 6540
gagttacatg atcccccatg ttgtgcaaaa aagcggttag ctccttcggt cctccgatcg 6600
ttgtcagaag taagttggcc gcagtgttat cactcatggt tatggcagca ctgcataatt 6660
ctcttactgt catgccatcc gtaagatgct tttctgtgac tggtgagtac tcaaccaagt 6720
cattctgaga atagtgtatg cggcgaccga gttgctcttg cccggcgtca atacgggata 6780
ataccgcgcc acatagcaga actttaaaag tgctcatcat tggaaaacgt tcttcggggc 6840
gaaaactctc aaggatctta ccgctgttga gatccagttc gatgtaaccc actcgtgcac 6900
ccaactgatc ttcagcatct tttactttca ccagcgtttc tgggtgagca aaaacaggaa 6960
ggcaaaatgc cgcaaaaaag ggaataaggg cgacacggaa atgttgaata ctcatactct 7020
tcctttttca atattattga agcatttatc agggttattg tctcatgagc ggatacatat 7080
ttgaatgtat ttagaaaaat aaacaaatag gggttccgcg cacatttccc cgaaaagtgc 7140
cacctgggac tagctttttg caaaagccta ggcctccaaa aaagcctcct cactacttct 7200
ggaatagctc agaggccgag gcggcctcgg cctctgcata aataaaaaaa attagtcagc 7260
catggggcgg agaatgggcg gaactgggcg gagttagggg cgggatgggc ggagttaggg 7320
gcgggactat ggttgctgac taattgagat gagcttgcat gccgacattg attattgact 7380
agtccctaag aaaccattct tatcatgaca ttaacctata aaaataggcg tatcacgagg 7440
ccctttcgtc 7450
<210> 4
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 4
Asp Gly Gly Gly Ser
1 5
<210> 5
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 5
Thr Gly Glu Lys Pro
1 5
<210> 6
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 6
Gly Gly Arg Arg
1
<210> 7
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 7
Gly Gly Gly Gly Ser
1 5
<210> 8
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 8
Glu Gly Lys Ser Ser Gly Ser Gly Ser Glu Ser Lys Val Asp
1 5 10
<210> 9
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 9
Lys Glu Ser Gly Ser Val Ser Ser Glu Gln Leu Ala Gln Phe Arg Ser
1 5 10 15
Leu Asp
<210> 10
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 10
Gly Gly Arg Arg Gly Gly Gly Ser
1 5
<210> 11
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 11
Leu Arg Gln Arg Asp Gly Glu Arg Pro
1 5
<210> 12
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 12
Leu Arg Gln Lys Asp Gly Gly Gly Ser Glu Arg Pro
1 5 10
<210> 13
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Гибкий пептидный линкер
<400> 13
Leu Arg Gln Lys Asp Gly Gly Gly Ser Gly Gly Gly Ser Glu Arg Pro
1 5 10 15
<210> 14
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательности расщепления полипептида
<220>
<221> ИНОЙ_ПРИЗНАК
<222> (2)..(3)
<223> Xaa = любая аминокислота
<220>
<221> ИНОЙ_ПРИЗНАК
<222> (5)..(5)
<223> Xaa = любая аминокислота
<220>
<221> ИНОЙ_ПРИЗНАК
<222> (7)..(7)
<223> Xaa представляет собой Gly или Ser
<400> 14
Glu Xaa Xaa Tyr Xaa Gln Xaa
1 5
<210> 15
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательности расщепления полипептида
<400> 15
Glu Asn Leu Tyr Phe Gln Gly
1 5
<210> 16
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательности расщепления полипептида
<400> 16
Glu Asn Leu Tyr Phe Gln Ser
1 5
<210> 17
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 17
Leu Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn
1 5 10 15
Pro Gly Pro
<210> 18
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 18
Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn
1 5 10 15
Pro Gly Pro
<210> 19
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 19
Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly Pro
1 5 10
<210> 20
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 20
Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly
1 5 10 15
Pro
<210> 21
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 21
Gln Leu Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser
1 5 10 15
Asn Pro Gly Pro
20
<210> 22
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 22
Ala Pro Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly
1 5 10 15
Asp Val Glu Ser Asn Pro Gly Pro
20
<210> 23
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 23
Val Thr Glu Leu Leu Tyr Arg Met Lys Arg Ala Glu Thr Tyr Cys Pro
1 5 10 15
Arg Pro Leu Leu Ala Ile His Pro Thr Glu Ala Arg His Lys Gln Lys
20 25 30
Ile Val Ala Pro Val Lys Gln Thr
35 40
<210> 24
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 24
Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro
1 5 10 15
Gly Pro
<210> 25
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 25
Leu Leu Ala Ile His Pro Thr Glu Ala Arg His Lys Gln Lys Ile Val
1 5 10 15
Ala Pro Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly
20 25 30
Asp Val Glu Ser Asn Pro Gly Pro
35 40
<210> 26
<211> 33
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический саморасщепляющийся полипептид
<400> 26
Glu Ala Arg His Lys Gln Lys Ile Val Ala Pro Val Lys Gln Thr Leu
1 5 10 15
Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly
20 25 30
Pro
<210> 27
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Консенсусная последовательность Козак
<400> 27
gccrccatgg 10
<---
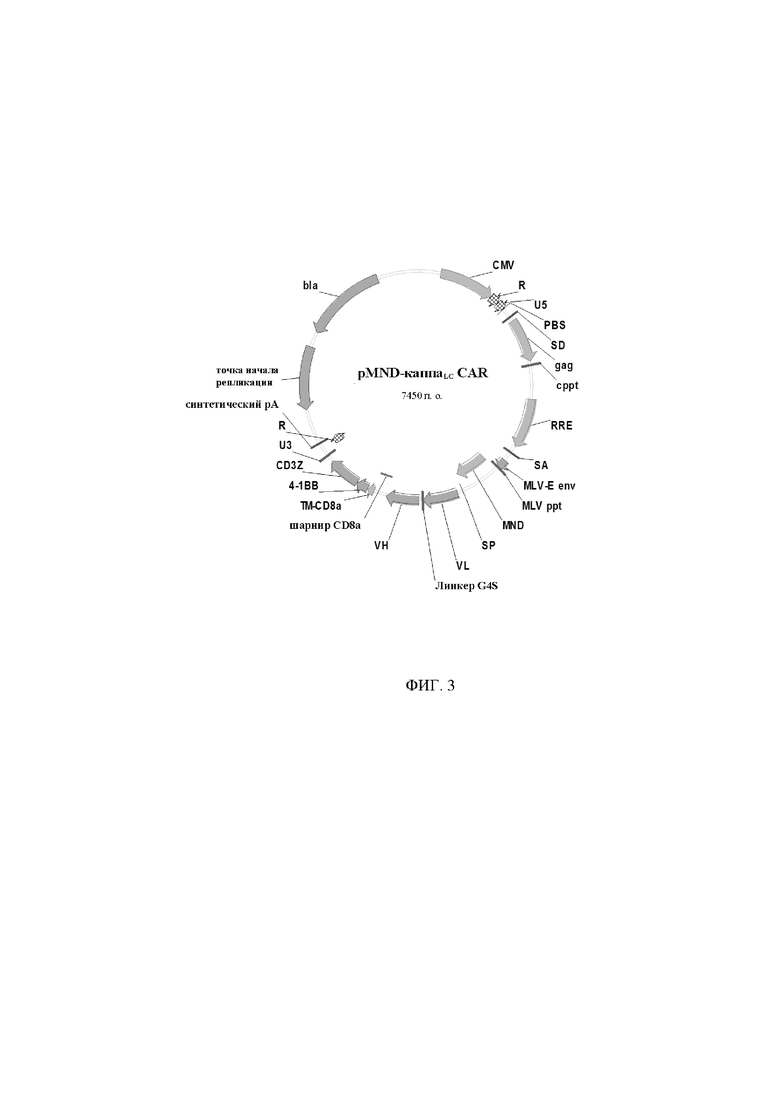

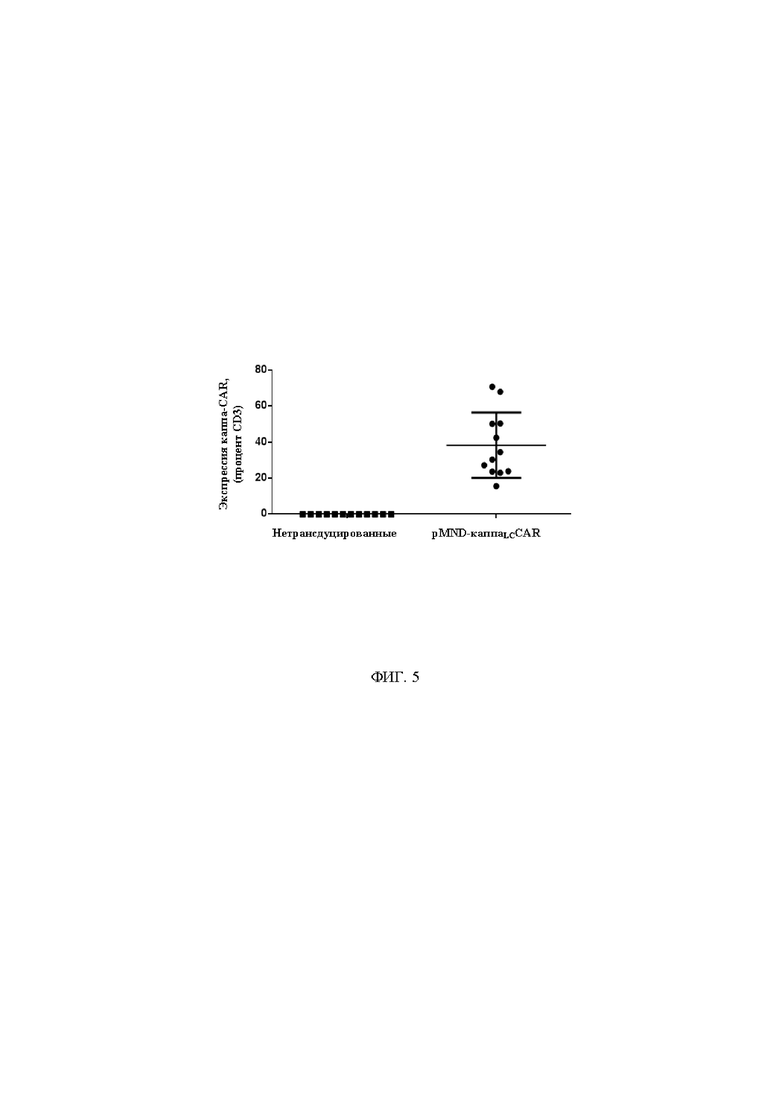
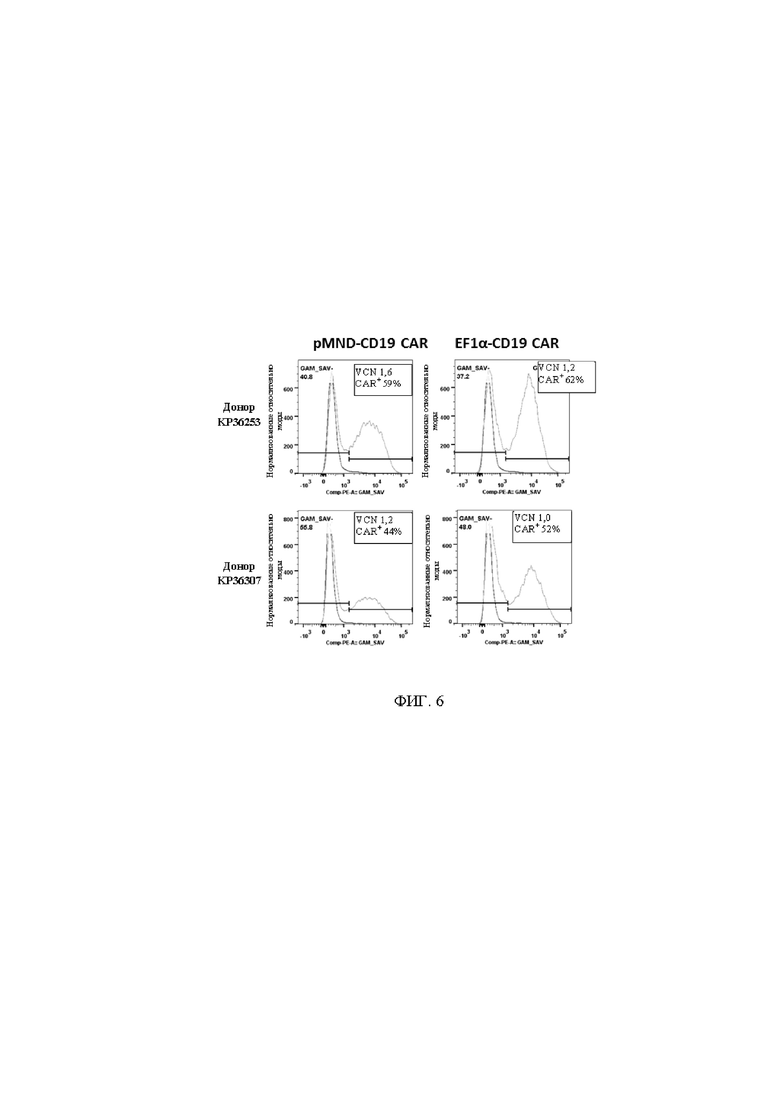


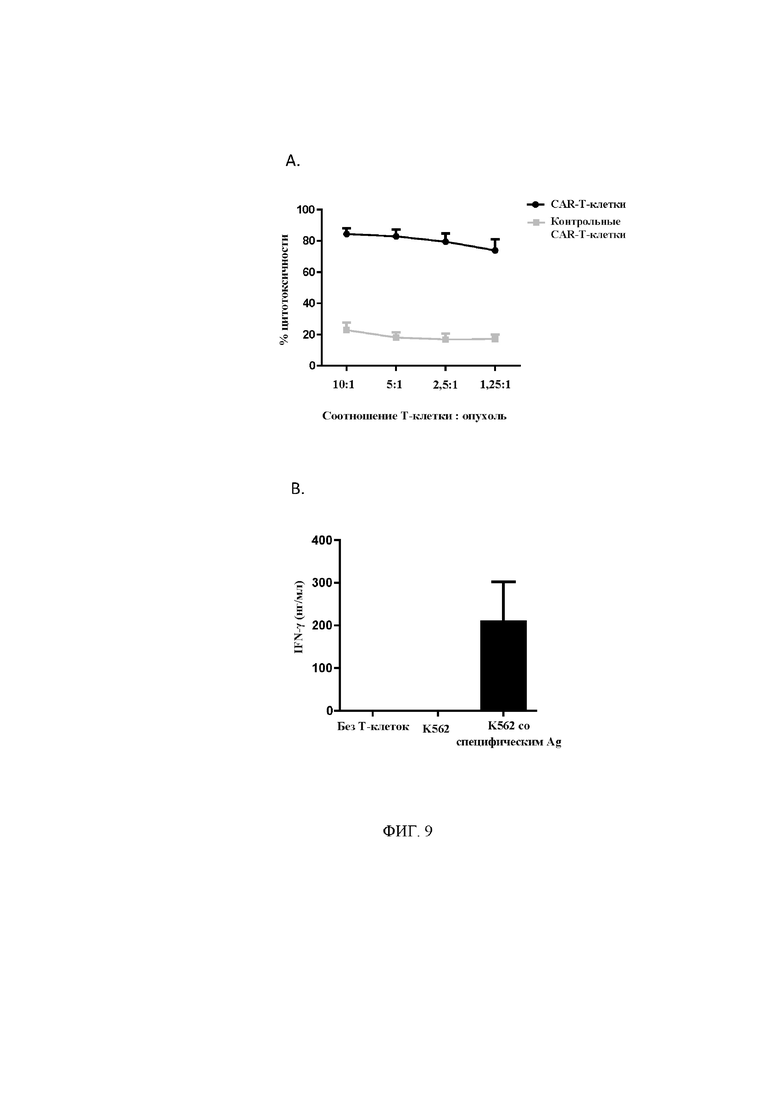
Изобретение относится к области биохимии, в частности к способу in vitro образования иммунных эффекторных клеток, которые экспрессируют химерный антигенный рецептор (CAR). Изобретение позволяет эффективно получать эффекторные иммунные клетки. 2 н. и 13 з.п. ф-лы, 9 ил., 4 табл., 8 пр.
1. Способ in vitro образования иммунных эффекторных клеток, которые экспрессируют химерный антигенный рецептор (CAR), предусматривающий
(a) введение в иммунные эффекторные клетки лентивирусного вектора, содержащего левый (5') лентивирусный LTR, который содержит гетерологичный промотор цитомегаловируса (CMV), сигнал упаковки Psi (ψ), центральный полипуриновый тракт/ДНК-флэп (cPPT/FLAP), элемент rev-ответа (RRE); (3') лентивирусный самоинактивирующийся (SIN) LTR; синтетическую последовательность полиаденилирования и полинуклеотид, содержащий промотор (MND) с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля, с сайтом связывания праймера, замещенным на последовательность из dl587rev, функционально связанный с нуклеиновой кислотой, кодирующей CAR, где CAR содержит одноцепочечный вариабельный фрагмент (scFv), который связывает антиген созревания В-клеток (BMCA), шарнирную область CD8α, трансмембранный домен CD8α, домен передачи костимулирующего сигнала CD137 и домен передачи первичного сигнала CD3ζ; и
(b) стимулирование клеток и индуцирование клеток для обеспечения их пролиферации посредством приведения клеток в контакт с антителами, которые связываются с CD3, и антителами, которые связываются с CD28; за счет чего обеспечивается образование иммунных эффекторных клеток, которые экспрессируют CAR.
2. Способ по п. 1, где scFv является человеческим, мышиным или гуманизированным.
3. Способ по п. 1, где лентивирусный вектор дополнительно содержит сигнальный пептид.
4. Способ по п. 3, где сигнальный пептид содержит сигнальный полипептид тяжелой цепи IgG1, сигнальный полипептид CD8α или сигнальный пептид альфа-субъединицы рецептора GM-CSF человека.
5. Способ по п. 1, где полинуклеотид, который кодирует CAR, содержит оптимизированную последовательность Козак.
6. Способ по п. 1, где лентивирусный вектор дополнительно содержит посттранскрипционный регуляторный элемент вируса гепатита В (HPRE) или посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE).
7. Способ по п. 1, где иммунные эффекторные клетки стимулируют и индуцируют к пролиферации до введения вектора.
8. Способ по п. 1, где иммунные эффекторные клетки содержат T-лимфоциты или NK-клетки.
9. Способ in vitro получения иммунной эффекторной клетки, предусматривающий
(a) выделение CD34+ клеток из выделенного костного мозга, пуповинной крови или мобилизованной периферической крови от субъекта; и
(b) введение лентивирусного вектора в выделенные CD34+ клетки;
где лентивирусный вектор содержит левый (5') лентивирусный LTR, который содержит гетерологичный промотор цитомегаловируса (CMV), сигнал упаковки Psi (ψ), центральный полипуриновый тракт/ДНК-флэп (cPPT/FLAP), элемент rev-ответа (RRE); (3') лентивирусный самоинактивирующийся (SIN) LTR; синтетическую последовательность полиаденилирования и полинуклеотид, содержащий промотор (MND) с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля, с сайтом связывания праймера, замещенным на последовательность из dl587rev, функционально связанный с нуклеиновой кислотой, кодирующей химерный антигенный рецептор (CAR),
где CAR содержит одноцепочечный вариабельный фрагмент (scFv), который связывает антиген созревания В-клеток (BMCA), шарнирную область CD8α, трансмембранный домен CD8α, домен передачи костимулирующего сигнала CD137 и домен передачи первичного сигнала CD3ζ.
10. Способ по п. 9, где scFv является человеческим, мышиным или гуманизированным.
11. Способ по п. 9, где лентивирусный вектор дополнительно содержит сигнальный пептид.
12. Способ по п. 11, где сигнальный пептид содержит сигнальный полипептид тяжелой цепи IgG1, сигнальный полипептид CD8α или сигнальный пептид альфа-субъединицы рецептора GM-CSF человека.
13. Способ по п. 9, где полинуклеотид, который кодирует CAR, содержит оптимизированную последовательность Козак.
14. Способ по п. 9, где лентивирусный вектор дополнительно содержит посттранскрипционный регуляторный элемент вируса гепатита В (HPRE) или посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE).
15. Способ по п. 9, где указанные CD34+ клетки предварительно стимулируют с помощью одного или более цитокинов, выбранных из группы, состоящей из лиганда FLT3, TPO, SCF, IL-3 и IL-6, до введения лентивирусного вектора.
| LI M et al., Optimal promoter usage for lentiviral vector-mediated transduction of cultured central nervous system cells | |||
| J Neurosci Methods | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| HALENE S et al., Improved expression in hematopoietic and lymphoid cells in mice after transplantation of bone marrow | |||
Авторы
Даты
2023-07-06—Публикация
2015-04-24—Подача