Настоящее изобретение относится к способам комбинированной терапии рака яичников с применением 9-оксоакридин-10-уксусной кислоты, и/или ее солей и ее сложных эфиров в комбинации с одним или более химиотерапевтическим агентом.
Предшествующий уровень техники.
Рак яичников (РЯ) развивается из клеток гормонозависимой ткани, и клетки этой опухоли также имеют на своей поверхности рецепторы к эстрогенам и прогестинам. Однако все попытки применения прогестинов, антиэстрогенов и ингибиторов ароматазы не приводили к каким либо значимым клиническим эффектам (Shuk-Mei Но, Estrogen, Progesterone and Epithelial Ovarian Cancer, Reproductive Biology and Endocrinology 2003; vol.1, p.73-80). Химиотерапия остается одним из основных способов этого заболевания. Продолжается поиск новых веществ, усиливающих ее эффективность.
Хорошо известно также применение иммуномодуляторов в терапии распространенного рака яичников, как, впрочем, и рака других локализаций.
Одной из групп иммуномодулирующих средств цитокинового ряда являются интерфероны, обладающие противовирусной и противоопухолевой активностью. Например, известен способ монотерапии рака яичников путем интраперитонеальной перфузии гамма-интерферона (патент США 5268169). Также известен способ комбинированного лечения рака яичников с помощью комплексных соединений платины, таксанов и гамма-интерферона (заявка США US 2004/0191218). Присоединение гамма-интерферона к полихимиотерапии РЯ (цисплатин + циклофосфамид) увеличивало количество пациентов с трехлетним периодом без прогрессии с 38% до 51%. (А randomized phase III trial of cisplatin/cyclophosphamide plus or minus interferon-gamma in the first-line therapy of ovarian cancer: update analysis. Program and abstracts of the 31st Annual Meeting of the Society of Gynecologic Oncologists; February 5-9, 2000; San Diego, California. Abstract 2).
При РЯ предложено внутрибрюшинное ведение альфа интерферона совместно с карбоплатином (Frasci, G., Tortoriello, A., et al. Carboplatin and alpha-2b interferon intraperitoneal combination as first-line treatment of minimal residual ovarian cancer. A pilot study, European Journal of Cancer, 1994; vol.30A, pp.946-50).
Однако впоследствии такая терапия не показала какой-либо эффективности при РЯ (М.Bruzzone, A.Rubagotti et al., Intraperitoneal Carboplatin with or without Interferon-a in Advanced Ovarian Cancer Patients with Minimal Residual Disease at Second Look: A Prospective Randomized Trial of 111 Patients. Gynecologic Oncology, 1997, vol.65, pp.499-505).
Для эффективного влияния на клиническое течение РЯ необходимо внутрибрюшинно вводить очень большие дозы интерферона. Поэтому указанный способ терапии малоприменим на практике из-за значительного количества побочных эффектов интерферонов.
Таким образом, остается актуальной задача повышения эффективности лечения и разработки новых способов терапии рака яичников.
Среди иммуномодулирующих препаратов, применяемых в медицине, широко используются производные акридинов, например 9-оксоакридин-10-уксусная кислота и ее соли.
Кроме того, некоторые производные акридинов проявляют свои противоопухолевые свойства, в частности, путем ингибирования фермента теломеразы. Так, например, предложено применение производных акридина для усиления эффективности противопухолевых препаратов (патент США 5604237).
9-оксоакридин-10-уксусная кислота представляет собой вещество, имеющее структурную формулу
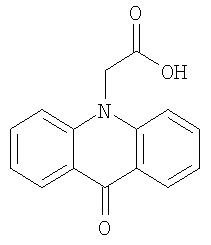
По другой номенклатуре она также может быть названа как 10-(карбоксиметил)-9(10Н)акридон, в базе CAS имеет номер 38609-97-1, международное непатентованное название - криданимод (cridanimod).
Следует указать, что под аббревиатурой СМА в контексте данной заявки, если отдельно не указано иного или это не следует из контекста, понимается как сама 9-оксоакридин-10-уксусной кислота, так и ее фармацевтически приемлемые соли и/или ее сложные эфиры.
Производные 9-оксоакридин-10-уксусной кислоты были предложены в 1971 году сотрудниками компании Хоффман Ла Рош Инк в качестве мощных противовирусных средств (патент США №3681360).
В настоящее время препараты на основе 9-оксоакридин-10-уксусной кислоты и ее фармацевтически приемлемых солей предлагаются для лечения и профилактики широкого круга заболеваний. В частности, известны такие ее свойства, как иммуномодулирующие, интерфероногенные, антибактериальные, антипромоторные и радиопротективные.
Фактор NF кВ относится к числу специфических цитоплазменных белков, активирующихся в эукариотических клетках в ответ на неблагоприятные воздействия, в частности химиопрепараты и радиацию. При этом неактивная форма этого белка находится в комплексе со своим ингибитором. При активации (фосфорилировании специфическим киназами) комплекс распадается и белок NF кВ транслоцируется в ядро, запуская работу генов-мишеней. Активация этих генов ассоциирована с пролиферацией, ангиогенезом, суппрессией апоптоза, что является ключевым звеном в развитии устойчивости опухолевых клеток к химиотерапии. Вещества, ингибирующие активность фактора NF кВ, могут производить свое ингибирующее действие на любой ступени активации этого фактора: связывать фактор NF кВ; ингибировать транслокацию фактора NF кВ в ядро; ингибировать регуляцию фактора NF кВ транскрипции YY1; ингибировать промоцию апоптоза, ингибировать экспрессию генов, зависимых от фактора NF кВ; ингибировать образование комплекса NF кВ с другими факторами, регулирующими активность NF кВ. Поиск синтетических ингибиторов NF кВ, в том числе среди известных науке веществ, ведется широким фронтом. Так, например, способностью ингибировать NF кВ обладает дигидроксиметилэпоксихиномицин (DHMEQ) (структурный аналог антибиотика эпоксихиномицина-С и его производные (заявка WO 2006/060819), куркумин, его поизводные (заявка WO 03/090681), а также другие соединения.
Задачей настоящего изобретения является разработка эффективных способов терапии рака яичников.
Подробное описание изобретения
Авторами данного изобретения неожиданно было обнаружено, что применение препаратов 9-оксоакридин-10-уксусной кислоты и/или ее фармацевтически приемлемых солей и ее сложных эфиров при лечении рака яичников, за счет резкого подавления активации NF кВ в опухолевых клетках, позволяет резко усилить эффективность химиотерапевтического воздействия на опухолевые клетки рака яичника. Несмотря на то что 9-оксоакридин-10-уксусная кислота не обладает какой-либо значительной собственной цитостатической активностью, установлено, что торможение роста рака яичников с помощью обычной для таких случаев химиотерапии в присутствии 9-оксоакридин-10-уксусной кислоты и/или ее солей является значительно более эффективным, чем в ее отсутствие.
Известно, что 9-оксоакридин-10-уксусная кислота обладает интерферон-индуцирующими свойствами. Однако авторами данного изобретения в культуральных экспериментах установлено, что в среде инкубации не происходит значимого увеличения уровня интерферонов, и новое свойство СМА при воздействии на раковые клетки рака яичника не обусловлено и не опосредовано интерферонами. Авторами установлено, что в отношении торможения роста злокачественных опухолей яичников в опытах in vivo 9-оксоакридин-10-уксусная кислота продолжает проявлять дозозависимый эффект в дозировках, превышающих максимальную интерферон-индуцирующую дозу, то есть порога дозы 9-оксоакридин-10-уксусной кислоты, при превышении которого дальнейшего увеличения уровня тканевых и сыворточных интерферонов не происходит. Более того, в тех ситуациях, когда система выброса интерферонов уже истощена (это наблюдается при повторном введении любого индуктора интерферонов, в том числе 9-оксоакридин-10-уксусной кислоты), 9-оксоакридин-10-уксусная кислота и/или ее фармацевтически приемлемые соли и ее сложные эфиры продолжают оказывать дозозависимое влияние на торможение роста опухоли в комбинации с химиотерапией. Это торможение обусловлено как с снижением пролиферативной активности клеток, так и усилением процесса гибели опухолевых клеток путем апоптоза.
Таким образом, авторами данного изобретения обнаружено новое свойство 9-оксоакридин-10-уксусной кислоты, механизм которого не до конца изучен. Однако реализация этого механизма приводит к снижению уровня активного фактора NF кВ, что открывает новую область для применения 9-оксоакридин-10-уксусной кислоты и/или ее фармацевтически приемлемых солей и ее сложных эфиров.
Как было установлено авторами настоящего изобретения, при воздействии СМА и/или ее солей и ее сложных эфиров на клетки рака яичника человека СМА, ее соли и ее сложные эфиры, ингибируют активность фактора NF кВ. При этом параллельное или последующее цитостатическое/цитолитическое воздействие химиопрепаратов на клетки рака яичника резко усиливается. Такие химиопрепараты могут представлять собой, в том числе, комплексные соединения платины (в частности, цисплатин, карбоплатин, оксалиплатин); антиметаболиты (в частности, метотрексат, 5-фторурацил, фторафур, 6-меркаптопурин, алтретамин, гемцитабин); алкилирующие агенты (в частности, циклофосфамид, хлорамбуцил, мелфалан); противоопухолевые антибиотики (в частности, доксорубицин, эпирубицин, митоксантрон); таксаны (в частности, паклитаксел, доцетаксел); ингибиторы топоизомеразы I (в частности, топотекан, иринотекан).
На основании новых открытых свойств СМА авторы настоящего изобретения предлагают способ лечения рака яичников с помощью комбинации химиотерапевтических препаратов и 9-оксоакридин-10-уксусной кислоты, и/или ее фармацевтически приемлемых солей, и/или ее сложных эфиров, что позволяет резко усилить эффективность химиотерапии.
В частности, настоящее изобретение обеспечивает способ лечения рака яичников посредством введения 9-оксоакридин-10-уксусной кислоты и/или ее солей и/или ее сложных эфиров, при котором 9-оксоакридин-10-уксусную кислоту и/или ее соли и/или ее сложные эфиры вводят в комбинации с одним или более химиотерапевтическим агентом.
Также заявляются предпочтительные схемы применения СМА и ее солей и ее сложных эфиров при лечении рака яичников.
Далее согласно изобретению заявляются варианты указанного способа с применением химиотерапевтических агентов разных классов. При этом предпочтительные классы химиопрепаратов и их представители для реализации заявленного способа представляют собой: комплексные соединения платины (в частности, цисплатин, карбоплатин, оксалиплатин); антиметаболиты (в частности, метотрексат, 5-фторурацил, фторафур, 6-меркаптопурин, алтретамин, гемцитабин); алкилирующие агенты (в частности, циклофосфамид, хлорамбуцил, мелфалан); противоопухолевые антибиотики (в частности, доксорубицин, эпирубицин, митоксантрон); таксаны (в частности, паклитаксел, доцетаксел); ингибиторы топоизомеразы I (в частности, топотекан, иринотекан).
Заявленный способ комбинированного лечения можно использовать:
- как самостоятельный вид лечения рака яичников,
- в составе комплексной терапии, например, как неоадъювантное или адъювантное медикаментозное лечение при хирургическом удалении опухолевых очагов.
Как было дополнительно установлено в процессе работы над изобретением, снижение эстрогенной стимуляции, которая имеет место в организме за счет действия эндогенных эстрогенов (как гонадного, так и внегонадного происхождения), с помощью гормональных средств и воздействий, способствует еще большему угнетению активности фактора NF кВ при воздействии СМА, ее солей и ее сложных эфиров на клетки опухоли яичника.
Таким образом, согласно изобретению дополнительно заявляется способ лечения рака яичников, при котором наряду с введением 9-оксоакридин-10-уксусной кислоты и/или ее соли и/или ее сложного эфира в комбинации с одним или более химиотерапевтическим агентом, дополнительно вводят одно или несколько средств гормональной терапии, снижающих эстрогенное воздействие на злокачественную опухоль яичников.
Термин «эстрогенное воздействие» означает воздействие, которое осуществляется через активацию цитозольных эстрогеновых рецепторов и реализуется запуском эстроген-индуцируемых генов в клетке.
Вещества и средства, снижающие эстрогенное воздействие могут осуществлять свое действие либо блокируя эстрогеновый рецептор (как, например, антиэстрогены), либо снижая концентрацию эстрогеновых рецепторов (как, например, прогестины), либо снижая как гонадную, так и внегонадную конверсию андрогенов в эстрогены (например, ингибиторы фермента ароматазы), либо снижая гонадный синтез эстрогенов (как, например, агонисты или антагонисты лютеинизирующего гормона рилизинг-гормона (ЛГРГ)). При этом агонисты ЛГРГ (например, бузерелин; гозерелин) вызывают десенситизацию гипофиза и изменяют его функцию, а антагонисты ЛГРГ (например, цетрореликс, абареликс, ганиреликс), в отличие от агонистов ЛГРГ, вызывают полную блокаду мембранных рецепторов ЛГРГ клеток гипофиза. И в первом, и во втором случае снижается продукция фолликулостимулирующего гормона, что приводит к подавлению гонадной продукции эстрогенов и снижению уровня эстрогенов в крови. К подобному результату приводит и овариэктомия (хирургическая абляция).
Соответственно, согласно изобретению предлагаются варианты вышеуказанного способа, при котором в качестве гормонотерапевтических средств, снижающих эстрогенное воздействие на злокачественную опухоль яичников, предлагаются средства, выбранные из группы, включающей: антиэстроген, прогестин, ингибитор ароматазы, ЛГРГ-антагонист, ЛГРГ-агонист.
Термин "лечить" или "лечение" в данном описании определен как применение или введение (назначение) состава субьекту (например, человеку, например пациенту или человеку с риском возникновения патологии, например рака яичников). В целом, лечение обеспечивают субьекту, имеющему патологию (например, злокачественную опухоль, в частности рак яичников), симптом патологии, повышенный риск патологии или предрасположенность к патологии, с целью вылечить, исцелить, облегчить, уменьшить, изменить, исправить, повысить качество, чтобы улучшить течение или повлиять на патологию, признаки патологии или предрасположенность к патологии. Лечение может включать назначение или применение состава одного или в комбинации со вторым агентом. Термин "в комбинации" в этом контексте означает, что различные агенты применяют одновременно или последовательно. Если агенты применяют последовательно, в момент начала применения второго агента в области воздействия в эффективных концентрациях предпочтительно обнаруживается первый из двух агентов.
Новые выявленные свойства СМА, ее солей и ее сложных эфиров изменять экспрессию фактора NF кВ и усиливать цитостатическое действие химиопрепаратов на клетки рака яичника человека не известны авторам из доступных источников информации. Также авторам не известны попытки лечения рака яичников с помощью комбинации химиотерапевтических агентов и СМА, ее солей и ее сложных эфиров.
В контексте настоящего изобретения термин «фармацевтически приемлемая соль» относится к солям, которые сохраняют вышеописанные свойства 9-оксоакридин-10-уксусной кислоты и которые не являются биологически или каким-либо иным образом неприемлемыми. Фармацевтически приемлемые соли могут быть получены присоединением неорганических или органических оснований.
Соли с неорганическими основаниями включают в себя, например, соли натрия, калия, лития, аммония, кальция и магния.
Соли с органическими основаниями включают в себя, но не ограничиваются солями первичных, вторичных, третичных и четвертичных аминов, такими как амины, замещенные одним, двумя или тремя заместителями, такими как: алкил, алкенил, циклоалкил, циклоалкенил, арил, гетероарил или гетероциклил, которые в свою очередь могут быть замещенными, смешанные ди- и три-амины, где, по меньшей мере, один из заместителей на амине отличается и выбран из группы, включающей в себя алкил, замещенный алкил, алкенил, замещенный алкенил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, гетероарил, гетероциклил и т.п. Сюда также включают амины, у которых два или три заместителя вместе с атомом азота, к которому они присоединены, образуют гетероциклил или гетероарил.
Конкретные примеры подходящих аминов включают, в частности, изопропиламин, триметиламин, диэтиламин, три(изопропил)амин, три(м-пропил)амин, этаноламин, 2-диметиламиноэтанол, трометамин, лизин, аргинин, гистидин, кофеин, прокаин, холин, бетаин, этилендиамин, глюкозамин, N-алкилглюкамин, теобромин, пурины, пиперазин, пиперидин, морфолин, N-этилпиперидин и тому подобное.
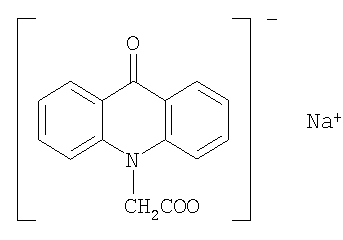
Примером соли 9-оксоакридин-10-уксусной кислоты со щелочным металлом является натриевая соль:
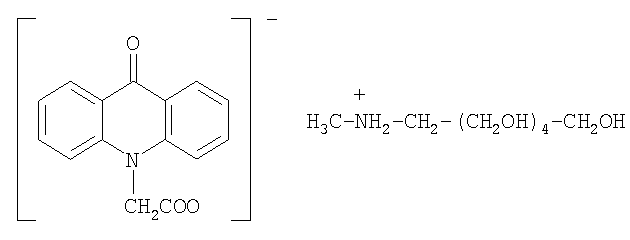
Примером соли с аминосоединением является соль с 1-дезокси-1-(метиламино)-D-глюцитолом (меглюмином):
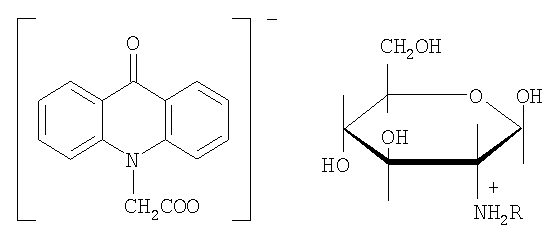
Другими примерами солей с различными сложными четвертичными аммониевыми основаниями являются соли с аминозамещенными углеводами, например с 2-дезокси-2-амино(или 2-алкиламино)-D-глюкозой, где R представляет собой Н или низший алкил:
с 1-дезокси-1-метиламино-D-глюкозой:
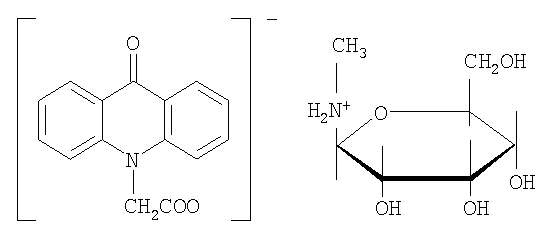
а также соли с различными сложными эфирами углеводов и алифатических аминоспиртов, например
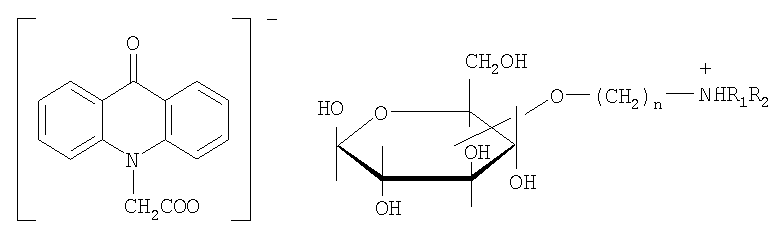
где R1, R2 представляют собой независимо алкил, арил, гетерил.
Примерами подходящих катионов также являются, в частности, катионы: 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозы:
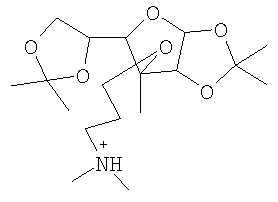
а также катионы:
1-дезокси-1-(этиламино)-D-глюцитола (то есть эглюмина),
1-дезокси-1-(пропиламино)-D-глюцитола,
1-дезокси-1-(бутиламино)-D-глюцитола,
1-дезокси-1-(метиламино)-L-глюцитола,
1-дезокси-1-(этиламино)-L-глюцитола,
1-дезокси-1-(пропиламино)-L-глюцитола и
1-дезокси-1-(бутиламино)-L-глюцитола.
Под сложными эфирами 9-оксоакридин-10-уксусной кислоты подразумевают соединения, образованные в результате замещения атома водорода в ОН-группе кислоты органической группой R.
Примерами подходящих сложных эфиров являются сложные эфиры 9-оксоакридин-10-уксусной кислоты с низшими алкилами (а именно с (C1-С12)алкилами, в частности этиловый, пропиловый, изопропиловый, бутиловый и амиловый эфиры), а также с холином и другими липофильными спиртами.
После быстрого проникновения через биологические мембраны эти соединения далее легко гидролизуются "in vivo" до свободной 9-оксоакридин-10-уксусной кислоты.
Согласно изобретению предпочтительными солями 9-оксоакридин-10-уксусной кислоты для реализации заявленного способа являются: натриевая, меглюминовая, эглюминовая соли и соль с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой.
Далее согласно изобретению предлагается применение 9-оксоакридин-10-уксусной кислоты, и/или ее солей, и/или ее сложных эфиров для получения лекарственного препарата для лечения рака яичников в комбинации с химиотерапевтическим агентом.
Согласно изобретению предпочтительный химиотерапевтический агент выбирают из группы, включающей: комплексные соединения платины (в частности, цисплатин, карбоплатин, оксалиплатин);. антиметаболиты (в частности, метотрексат, 5-фторурацил, фторафур, 6-меркаптопурин, алтретамин, гемцитабин); алкилирующие агенты (в частности, циклофосфамид, хлорамбуцил, мелфалан); противоопухолевые антибиотики (в частности, доксорубицин, эпирубицин, митоксантрон); таксаны (в частности, паклитаксел, доцетаксел); ингибиторы топоизомеразы I (в частности, топотекан, иринотекан).
Согласно изобретению предпочтительные соли 9-оксоакридин-10-уксусной кислоты для получения лекарственного препарата для лечения рака яичников в комбинации с химиотерапевтическим агентом выбирают из группы, включающей в себя натриевую, меглюминовую, эглюминовую и соль с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой.
Наряду с применением 9-оксоакридин-10-уксусной кислоты, и/или ее соли, и/или ее сложного эфира для получения такого лекарственного препарата в качестве других компонентов можно применять различные наполнители, вспомогательные вещества, в том числе солюбилизаторы, например аминосахара (или аминоспирты), и их сложные эфиры, циклодекстраны, например гидроксипропил-β-циклодекстрин, эмульгаторы, например, твины; загустители; светофильтры; например метиленовый синий; комплексообразователи; стабилизаторы, например трилон Б; пролонгаторы, например микроцеллюлоза или поливинилпирролидон; корригенты, например сорбит; красители; консерванты, а также буферные системы на основе неорганических и органических веществ, обеспечивающие поддержание определенного рН. Такой препарат может быть приготовлен в виде раствора для парентерального введения, или таблеток, или таблеток, покрытых кишечно-растворимым покрытием, или порошка, или гранулята, в капсулах или пакетах, или в виде суппозиториев, или в виде аэрозоля или раствора для ингаляций, или в виде пролонгированной формы с замедленным высвобождением активного вещества, например в виде пролонгированной формы для перорального введения или полостного введения на основе твердой или полутвердой полимерной матрицы.
Далее настоящее изобретение обеспечивает набор для лечения рака яичников, включающий 9-оксоакридин-10-уксусную кислоту, и/или ее соль, и/или ее сложный эфир в терапевтически эффективном количестве и химиотерапевтический агент.
Предпочтительно соль 9-оксоакридин-10-уксусной кислоты выбрана из группы, включающей натриевую, меглюминовую, эглюминовую и соль с 3-О-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой.
Предпочительно химиотерапевтический агент в наборе для лечения рака яичников, включающем 9-оксоакридин-10-уксусную кислоту, и/или ее соль, и/или ее сложный эфир в терапевтически эффективном количестве и химиотерапевтический агент, представляет собой вещество, выбранное из группы, включающей: комплексные соединения платины (в частности, цисплатин, карбоплатин, оксалиплатин); антиметаболиты (в частности, метотрексат, 5-фторурацил, фторафур, 6-меркаптопурин, алтретамин, гемцитабин); алкилирующие агенты (в частности, циклофосфамид, хлорамбуцил, мелфалан); противоопухолевые антибиотики (в частности, доксорубицин, эпирубицин, митоксантрон); таксаны (в частности, паклитаксел, доцетаксел); ингибиторы топоизомеразы I (в частности, топотекан, иринотекан). Единичные дозированные формы в наборах могут быть представлены таблетками, каспсулами или суспензиями для перорального приема; ампулами или шприц-тюбиками, содержащими стерильный раствор для инъекций; свечами для ректального или интравагинального введения; порошками для приготовления суспензий и растворов.
В целом, все средства по изобретению альтернативно могут включать в себя, состоять или по существу состоять из любых подходящих компонентов, раскрытых в данном описании, и такие средства, в том числе комбинация, по изобретению могут дополнительно или альтернативно быть приготовлены так, что из них исключен какой-либо компонент, материал, ингредиент или объект, который был использован в препарате, известном из уровня техники, или который не является необходимым для достижения технического результата данного изобретения.
То же самое относится и к способам по изобретению, которые альтернативно могут включать в себя, состоять или по существу состоять из любых подходящих стадий, раскрытых в данном описании, и такие способы по изобретению могут дополнительно или альтернативно исключать какую-либо стадию или объект, который использован в способе, известном из уровня техники, или который не является необходимым для достижения технического результата данного изобретения.
Далее изобретение поясняется конкретными примерами, не ограничивающими данное изобретение.
Материалы и методы
В проведенных авторами экспериментах и клинических исследованиях использовались, в том числе, коммерческие препараты солей СМА, представленные на рынке, например натриевая соль СМА (препарат Неовир, Фармсинтез, Россия), меглюминовая соль СМА (препарат Циклоферон, НТФФ Полисан, Россия), соль СМА с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой (препарат Анандин, Медитэр, Россия), а также коммерчески доступная СМА (Sigma, США, кат. №17927, каталог 2005 года).
Сложные эфиры и некоторые другие соли СМА были синтезированы известными, сравнительно простыми методами (см., например: Inglot A.D. et al., Archivum Immunologiae et Therapiae Experimentalis, 1985, vol.33, pp.275-285; патент РФ №2135474; патент РФ №2036198; патент РФ №2033413). В культуральных исследованиях in vitro протонированную СМА и сложные эфиры СМА перед внесением в культуру предварительно растворялись в диметилсульфоксиде (ДМСО).
Наборы для лечения рака яичников, включающие 9-оксоакридин-10-уксусную кислоту, и/или ее соль, и/или ее сложный эфир в терапевтически эффективном количестве и химиотерапевтический агент, приготавливались, например, следующим путем:
(a) приготовление готовой лекарственной формы (ампул, и/или свечей, и/или таблеток, и/или капсул) СМА, и/или ее солей, и/или ее сложных эфиров.
(b) приготовление одной из готовых лекарственных форм химиотерапевтического агента.
c) фасовка готовых лекарственных форм, приготовленных в соответствии пп.(а) и (b) в блистеры из полиэтилентрифталата (ПЭТ).
d) фасовка блистеров, приготовленных по п.(с) в одну потребительскую индивидуальную упаковку из картона вместе с инструкцией по применению.
В отдельных случаях, например, для введения ректального или интравагинального введения в клинике готовились свечи, содержащие СМА или ее фармацевтически приемлемую соль или сложный эфир СМА, на основе широко применяемых для этих целей суппозиторных масс, таких как Витепсол (Witepsol W 35, Е 75, фирма Condea Chemie GmbH), так, как это проиллюстрировано примерами.
Эксперименты по влиянию СМА на уровень активного фактора NF кВ в клетках рака яичника человека проводили с использованием первичной культуры человеческих клеток, полученных из асцитической жидкости женщин больных раком яичника, III стадии, подтвержденным морфологически. Для этого асцитическую жидкость центрифугировали при 1000g в течение 10 мин при 22°С и дважды отмывали в среде Игла. Затем клетки ресуспендировали и культивировали в модифицированной по Дульбекко среде Игла, с добавлением 4 мМ L-глютамина, 1.5 г/л натрия бикарбоната, 4.5 г/л глюкозы, 10% эмбриональной телячьей сыворотки, 100 МЕ/мл натриевой соли пенициллина и 100 мкг/мл стрептомицина сульфата в 5% атмосфере CO2 при 37°С. После 4 недель культивирования опухолевые клетки рака яичника составляли не менее 90%. Все описанные эксперименты проводили с клетками 6-8 пересева.
Уровень активного фактора NF кВ в клеточном экстракте определяли с помощью StressXpress NF кВ, р50 ELISA Kit (фирма StressGen, каталожный номер EKS-445) на люминисцентном спектрофотометре СМ 2203 (Солар, Беларусь). Изменения активного фактора NF кВ выражали в процентах к контролю, то есть уровню конституциональной (вне всяких воздействий) активности NF кВ в клетках опухоли.
Также проводились эксперименты по изменению пролиферативной активности и активности фактора NF кВ в клетках линий человеческого рака яичника OVCAR-3 (номер НТВ-161 в коллекции АТСС) и SK-OV-3 (номер НТВ-77 в коллекции АТСС) под действием СМА и химиопрепаратов. Использовали коммерчески доступные химические и фармацевтические препараты противоопухолевых и гормональных агентов.
Способность СМА, ее солей и ее сложных эфиров, в том числе в комбинации с химиотерапевтическим агентами и/или гормональными средствами, ингибировать пролиферативную активность опухолевых клеток оценивали путем определения количества бромдезоксиуридина (БрДУ), включающегося в ДНК клеток при инкубации. Для этого клетки инкубировали в присутствии вышеупомянутых исследуемых веществ или их комбинаций в течение 24 часов. В отдельных экспериментах клетки предварительно инкубировали с СМА в течение 12 часов, отмывали, а уже затем подвергали воздействию химиопрепаратов в течение 12 часов.
После этого в среду добавлялся БрДУ до концентрации 10 мкМ и клетки инкубировали еще 24 часа. Затем клетки фиксировали и инкубировали с антителами к БрДУ 2 часа при комнатной температуре. При последующем прибавлении тетраметилбензидина интенсивность появляющейся окраски оценивали спектрофотометрически. Интенсивность окраски прямо при использовании этого метода прямо коррелирует с количеством вновь синтезированной ДНК. Все результаты по оценке пролиферации представлялись как процент ингибиции синтеза ДНК от контроля (контроль - включение БрДУ без воздействия каких-либо агентов - принимался за 100%).
Для изучения другого возможного механизма влияния СМА на чувствительность клеток к химиотерапии оценивался уровень интерферонов в культуральной среде биологическим методом. Определение уровня интерферона производили путем титрования проб на монослойной культуре мышиных клеток L-929 (номер CCL-1 в коллекции АТСС). В качестве тест-вируса использовали вирус везикулярного стоматита (штамм Индиана, коллекции ГИСК им. Л.А. Тарасевича, рег. №11/82).
Клетки L-929 (2×105-3×105 кл./мл) выращивали в 96-луночных плоскодонных планшетах при 37°С в термостате с 5% CO2 в среде Игла с 10% эмбриональной телячьей сыворотки, до образования полного монослоя (24-48 ч). Перед титрованием среду культивирования удаляли и в лунки вносили разведения культуральной среды и референса-стандарта мышиного альфа-интерферона (кат. номер 12100-1, PBL Biomedical Laboratories, Piscataway, NJ), которые готовили на среде Игла. На каждое разведение каждого образца использовали не менее 4 лунок. Клетки с пробами инкубировали в термостате в течение еще 24 ч, после чего пробы удаляли и в лунки вносили тест-вирус в дозе 100 ТЦД50. За единицу активности (ЕА) интерферона принимали величину, обратную конечному разведению референса-интерферона или, соответственно, тестируемого образца культуральной среды, при котором наблюдалась 50% защита клеток от ЦПД 100 вируса (цитопатической дозы тест-вируса, уничтожающей 100% клеток в контроле).
ПРИМЕР 1. Влияние СМА. ее солей и ее сложных эфиров на уровень активного фактора NF кВ в клетках рака яичника человека.
Клетки рака яичника пациенток, полученных как это описано в тексте, инкубировали в присутствии различных концентраций (от 1×10-10 до 1×10-13 М) СМА, ее солей и ее сложных эфиров. В экспериментах использовали СМА (СМА-ОН), натриевую (NaCMA), меглюминовую (MegCMA), эглюминовую соль СМА (EgСМА), соль СМА с 3-O-(N,N-диметиламино-н-пропил)-1,2:5,6-ди-O-изопропилиден-α,D-глюкофуранозой (АминопропилСМА), этиловый (EtCMA) и пропиловый эфир СМА (PropСМА). После инкубации в течение 8 часов клетки отделяли от культуральной жидкости центрифугированием. В культуральной жидкости определяли уровень интерферона. В экстракте ядер опухолевых клеток исследовали уровень активного фактора NF кВ. Уровень интерферона в культуральной жидкости выражали в Единицах Активности (ЕА)/мл. Результаты измерений уровня активного фактора NF кВ выражали в процентах по отношению к контролю (клетки, инкубированные без каких-либо воздействий).
Результаты экспериментов представлены в таблице 1.
Снижение содержания активной формы фактора NF кВ в опухолевых клетках под действием СМА
В числителе - изменение уровня активного фактора NF кВ (в процентах от контроля), в знаменателе - уровень интерферона в среде культивирования (в Единицах Активности (ЕА)).
Как следует из анализа представленных результатов СМА, ее соли и ее сложные эфиры, оказывают прямое дозозависимое влияние на конституциональный уровень активного фактора NF кВ в опухолевых клетках, ингибируя его. При этом индукция интерферонов не происходит или происходит в очень слабой степени, вне связи с уровнем ингибиции активного NF кВ. Таким образом СМА, ее соли и ее сложные эфиры являются эффективными ингибиторами фактора NF кВ и указанная активность не имеет отношения к интерфероноиндуцирующим свойствам этих соединений.
ПРИМЕР 2. Влияние СМА ее солей и ее сложных эфиров на уровень активации фактора NF кВ в клетках рака яичника человека в ответ на воздействие химиотерапевтического агента.
Эксперименты проводили по схеме, описанной в Примере 1. При этом использовались клетки человеческой карциномы яичника OVCAR-3. Клетки инкубировали в среде RPMI 1640 с 10% эмбриональной телячьей сыворотки при 37°С. Использовали комплексные соединения платины (цисплатин и другие), антрациклиновые антибиотики (доксорубицин и другие), антиметаболиты (5-фтороурацил (5-ФУ) и другие) и алкилирующие соединения (циклофосфамид и другие).
В среду культивирования одновременно с СМА, ее солями и ее сложными эфирами (в концентрации 1×10-12 М) вносили соответствующие химиотерапевтические агенты или носитель (контроль содержания активного NF кВ).
Через 8 часов культивирования клетки отделялись центрифугированием. В получаемом затем лизате ядер оценивали уровень активного фактора NF кВ.
Результаты измерений уровня активного фактора NF кВ выражали в процентах по отношению к контролю (клетки, инкубированные без каких-либо воздействий).
Результаты экспериментов представлены в Таблице 2.
1×10-12 М
Из данных, представленных в таблице 2, следует, что СМА препятствует активации фактора NF кВ, вызываемой химиотерапевтическими агентами.
ПРИМЕР 3. Влияние СМА, ее солей и ее сложных эфиров на пролиферативную активность клеток рака яичника человека при воздействии химиотерапевтическими агентами различных классов и их комбинациями.
Клетки человеческого рака яичника SK-OV-3 инкубировали в течение 24 часов в присутствии химиотерапевтических агентов различных классов (или их сочетаний) в комбинации с СМА (1×10-13 М). Затем определяли пролиферативную активность с помощью БрДУ так, как это описано в тексте. Результаты измерений пролиферативной активности выражали в процентах по отношению к контролю (клетки, инкубированные без каких-либо воздействий).
Результаты экспериментов представлены в Таблице 3.
В числителе - уровень пролиферативной активности в отсутствие СМА, в знаменателе - в присутствии СМА. Как следует из результатов экспериментов, представленных в таблице 3, присутствие СМА приводило к резкому усилению чувствительности клеток рака яичника человека к антипролиферативному действию химиотерапевтических агентов и их комбинаций. При этом сам по себе СМА не влиял на пролиферативную активность опухолевых клеток.
ПРИМЕР 4. Влияние солей и ее сложных эфиров СМА на пролиферативную активность клеток рака яичника человека при воздействии химиотерапевтическими агентами различных классов и их комбинациями.
Клетки человеческого рака яичника SK-OV-3 инкубировали в течение 4 часов с СМА (1×10-12 М) или носителем (контроль носителя). Затем клетки трижды отмывали от СМА в среде и инкубировали 24 часа в присутствии химиотерапевтических агентов различных классов (или их сочетаний) или носителем (контроль носителя). Затем определяли пролиферативную активность с помощью БрДУ так, как это описано в тексте. Результаты измерений пролиферативной активности выражали в процентах по отношению к контролю (клетки, инкубированные без каких-либо воздействий).
Результаты экспериментов представлены в Таблице 4.
В числителе - уровень пролиферативной активности без предварительного воздействия СМА, в знаменателе - при предварительном воздействии СМА. Как следует из результатов экспериментов, представленных в таблице 4, предварительное воздействие СМА резко усиливало чувствительность клеток к последующему антипролиферативному действию химиотерапевтических агентов и их комбинаций. При этом СМА сам по себе не влиял на пролиферативную активность опухолевых клеток.
ПРИМЕР 5. Влияние солей и сложных эфиров СМА на пролиферативную активность клеток рака яичника человека при воздействии химиотерапевтическими агентами и гормонотерапевтическими агентами различных классов и их комбинациями.
Клетки человеческого рака яичника SK-OV-3 инкубировали в течение 24 часов в присутствии химиотерапевтических агентов и гормонотерапевтических агентов различных классов (или их сочетаний) в комбинации с СМА (1×10-13 М). Затем определяли пролиферативную активность с помощью БрДУ так, как это описано в тексте. Результаты измерений пролиферативной активности выражали в процентах по отношению к контролю (клетки, инкубированные без каких-либо воздействий).
Результаты экспериментов представлены в Таблице 5.
В числителе - уровень пролиферативной активности в отсутствие СМА, в знаменателе - в присутствии СМА. Как следует из результатов экспериментов, представленных в таблице 5, присутствие СМА приводило к резкому усилению чувствительности клеток рака яичника человека к антипролиферативному действию химиотерапевтических агентов и их комбинаций. При этом добавление препаратов, снижающих воздействие эстрогенов, в значительной степени усиливало этот эффект СМА. При этом сам по себе СМА не влиял на пролиферативную активность опухолевых клеток.
ПРИМЕР 6. Клиническая эффективность СМА в составе комбинированной химиотерапии рака яичника.
Обследовались 18 больных раком яичника III стадии по FIGO с морфологически верифицированным диагнозом. Перед началом терапии больные были разделены на 2 равные группы. Все больные получили по 6 курсов комбинированной терапии: таксаном (докситаксел, в дозе 75 мг/м2 внутривенно в течение 1 часа, один раз каждые 3 недели), и комплексным соединением платины (карбоплатин 2-часовая инфузия в дозе AUC 5 (AUC - площадь под кривой «концентрация в крови/время после начала инфузии»), один раз каждые 3 недели). Для расчета дозы карбоплатины использовали формулу Кальверта: доза карбоплатина (мг) = (необходимая AUC) × (скорость гломерулярной фильтрации + 25). Скорость клубочковой фильтрации определялась как клиренс креатинина у больного.
Вторая группа дополнительно получала натриевую соль СМА в виде 12,5% стерильного раствора в дозе 14 мг/кг внутривенно, каждый третий день на протяжении всего лечения. Общий ответ на терапию (все случаи частичных и полных ответов на лечение) в первой группе составил 55,6% (5 из 9 пациентов), а во второй 77,8% (7 из 9 пациентов).
Таким образом, включение СМА в схему комбинированной химиотерапии рака яичников приводит к резкому увеличению клинической эффективности химиотерапии и заявляемый способ улучшает показатели лечения.
ПРИМЕР 7. Клиническая эффективность СМА в составе комбинированной химиогормонотерапии рака яичника, не чувствительного к первой линии химиотерапии.
Пациентка, 55 лет, страдающая раком яичника (стадия III), получила 3 курса лечения комплексным соединением платины (цисплатином) - 2-часовая инфузия в дозе 80 мг/м2, один раз каждые 3 недели. Однако эффекта терапии не наблюдалось. Пациентке был проведено лечение вариантом заявленного способа. Для этого был назначен карбоплатин в дозе 400 мг/м2 один раз каждые 3 недели (внутривенно), а также антиэстроген торемифен в дозе 60 мг/день перорально в течение первого месяца курса терапии с последующим увеличением дозы до 80 мг/день до конца всего курса лечения (15 недель). На протяжении всего курса (1 первого дня до конца терапии) больная получала внутримышечно препарат СМА по 500 мг через день (в виде стерильного раствора меглюминовой соли (препарат Циклоферон, Полисан, Россия). При исследовании к концу периода лечения установлена частичная ремиссия, что было подтверждено повторным обследованием еще через 2 месяца. Таким образом, заявляемый способ высокоэффективен при лечении рака яичника, не чувствительного к первой линии химиотерапии.
ПРИМЕР 8. Клиническая эффективность СМА в составе комбинированной химиогормонотерапии рака яичника.
Пациентка, 68 лет, страдающая раком яичника (стадия IV), получила 7 курсов комбинированной терапии таксаном и комплексным соединением платины: паклитаксел в дозе 175 мг/м2 внутривенно в течение 3 ч, один раз каждые 3 недели, и цисплатин - 2-часовая инфузия в дозе 100 мг/м2, один раз каждые 3 недели. Достигнутая стабилизация продолжалась около 7 месяцев, однако затем появились признаки прогрессирования заболевания, сывороточный уровень СА-125 (биохимического онкомаркера коррелирующего с ростом опухоли) увеличился с 15 до 35 ЕД/мл. Для дальнейшего лечения был применен вариант заявляемого способа, для чего вместе с комбинированной химиотерапией второго ряда (липосомальный доксорубицин (Келикс Шеринг-Плау, США) в дозе 25 мг/м2 1 день и гемцитабин 800 мг/м 2 1 и 8 дни каждые 3 недели) 2 раза в день ректально вводили свечи, содержащие по 250 мг СМА на протяжении всего лечения, а также препарат, блокирующий действие эстрогенов (антиэстроген тамоксифен), в дозе 40 мг/день на протяжении всего курса лечения. При исследовании через 9 недель установлена стабилизация процесса, что было подтверждено повторным обследованием еще через 2 месяца, уровень СА125 снизился до 10 ЕД/мл. Таким образом, вариант заявляемого способа высокоэффективен, как лечение «второй линии» при раке яичника.
ПРИМЕР 9. Клиническая эффективность СМА в составе комбинированной химиотерапии рака яичника второй линии.
Больная РЯ, 64 года с рецидивом заболевания после химиотерапии с применением комплексного соединения платины (цисплатина) получила 4 цикла химиотерапии ингибитором топоизомеразы I топотеканом (Гикамтин, Смит Кляйн Бичем, Великобритания) в дозе 1,5 мг/м2. Каждый курс представлял собой 30-минутную внутривенную инфузию, ежедневно, в течение 5 дней. Интервал между курсами составлял 21 день. Одновременно больная получала СМА внутривенно капельно в дозе 100 мг/кг веса в виде натриевой соли (препарат Неовир, Фармсинтез, Россия) в 100 мл стерильного физиологического раствора. Введение препарата СМА проводилось непосредственно перед началом каждой инфузии топотекана. В перерывах между курсами больной проводили внутримышечные введения СМА виде меглюминовой соли (препарат Циклоферон, Полисан, Россия) в дозе 10 мг/кг 1 раз в два дня. После 4-го курса у больной зарегистрирована полная ремиссия. Таким образом, заявленный способ эффективен как 2-я линии химиотерапии (в частности, при комбинации СМА и ингибитора топоизомеразы I) при развитии рецидива РЯ после химиотерапии комплексными соединениями платины.
ПРИМЕР 10. Набор для лечения рака яичников, включающий СМА и химиотерапевтический агент.
Набор для лечения рака яичников, включающий натриевую соль 9-оксоакридин-10-уксусной кислоты и химиотерапевтический агент (из группы комплексных соединений платины) карбоплатин, приготавливался следующим образом:
a). Приготавливали готовую лекарственную форму (раствор для парентерального введения) натриевой соли 9-оксоакридин-10-уксусной кислоты. Для этого в 900 мл воды для инъекций растворяли 2,5 г цитрата натрия, а затем 125 г субстанции (порошка) натриевой соли 9-оксоакридин-10-уксусной кислоты (Фармсинтез, Россия). рН полученного раствора доводили до 7,8 добавлением лимонной кислоты. Полученный раствор фильтровали через мембранный фильтр с диаметром пор 0,22 мкм. Доводили объем раствора до 1000 мл для инъекций. В стерильных условиях раствор разливали в 10 мл флаконы темного стекла типа I (по Европейской Фармакопее). Флаконы стерильно укупоривали и закатывали алюминиевыми колпачками. Получали флаконы, содержащие 10 мл 12,5% раствора натриевой соли 9-оксоакридин-10-уксусной кислоты для парентерального введения.
b). Приготавливали готовую лекарственную форму препарата карбоплатин (то есть цис-диамино (1,1-циклобутандикарбоксилато-) платина). Для этого к 1000 мг субстанции (порошка) карбоплатина (Yunnan Gejiu Biochemical Pharmaceutical Factory, Китай) добавляли 1000 мг маннитола (SPI Pharma, США) и приливали до 100 мл воды для инъекций. В стерильных условиях перемешивали компоненты до полного растворения, фильтровали через мембранный фильтр 0,22 мкм и разливали во флаконы по 10 мл. Получали флаконы, объемом 10 мл, содержащие 100 мг карбоплатина каждый (для парентерального введения).
c). Помещали полученные флаконы с раствором натриевой соли 9-оксоакридин-10-уксусной кислоты в блистеры из полиэтилентрифталата (ПЭТ) по 5 флаконов.
d). Помещали полученные флаконы с раствором карбоплатина также в блистеры из ПЭТ по 5 флаконов.
e). Помещали по 2 полученных блистера с флаконами с раствором натриевой соли 9-оксоакридин-10-уксусной кислоты и по 1 полученному блистеру с флаконами с раствором карбоплатины вместе с инструкцией по применению в картонную коробку (индивидуальную упаковку).
Изобретение, включающее три объекта, относится к медицине, в частности к онкологии и гинекологии, и касается способа лечения рака яичников 9-оксоакридин-10-уксусной кислотой (А), и/или ее солью, и/или сложным эфиром в комбинации с одним или более химиотерапевтическим агентом, а также создания препарата А и набора указанных лекарственных средств для лечения данной патологии. Способ осуществляют путем введения больным раком яичников А, и/или соли, и/или сложного эфира в комбинации с одним или более химиотерапевтическим агентом в количестве, эффективном для потенцирования действия указанного химиотерапевтического агента. При этом (А), и/или ее соль, и/или сложный эфир в комбинации с одним или более химиотерапевтическим агентом могут быть использованы в виде препарата или в виде набора. Использование А, и/или ее солей, и/или сложных эфиров обеспечивает подавление белка NF-kappaB и, как следствие, усиление чувствительности клеток рака яичника к антипролиферативному действию химиотерапевтических агентов и их комбинаций. 3 н. и 19 з.п. ф-лы, 5 табл.
| МАКАРОВ О.В | |||
| и др | |||
| Иммунотерапия злокачественных новообразований яичников аутологичными препаратами в послеоперационном периоде | |||
| Consilium-medicum, 1999, т.1, №2, он-лайн [Найдено в Интернет на http://old.consilium-medicum.com/media/gynecology/n2/45.shtml 20.12.2007] | |||
| СПОСОБ ИНДИВИДУАЛЬНОГО ПОДБОРА ЛЕЧЕБНЫХ СРЕДСТВ ДЛЯ ОПРЕДЕЛЕННОГО БОЛЬНОГО | 2001 |
|
RU2189587C1 |
| US 5604237, 18.02.1997 | |||
| MABUCHI S | |||
| et al | |||
| Inhibition | |||
Авторы
Даты
2009-02-20—Публикация
2007-03-29—Подача