Настоящее изобретение относится к комбинации, содержащей ингибитор mTOR (киназа «мишень для рапамицина у млекопитающих») и одно или несколько фармацевтических действующих веществ; к фармацевтическим композициям, содержащим указанную комбинацию; способам лечения с применением комбинации; процессам приготовления комбинации; и товарной упаковке, содержащей комбинацию.
Предпосылки создания изобретения
Рапамицин и производные рапамицина являются ингибиторами активности mTOR и обладают целым рядом различных видов биологической активности. Известно, что различные комбинации действующих веществ могут повышать противоопухолевую активность. В связи с этим сохраняется необходимость в создании новых комбинаций рапамицина и производных рапамицина, прежде всего 40-O-(2-гидроксиэтил)рапамицина.
Краткое изложение сущности изобретения
Одним из объектов изобретения является комбинация, которая содержит:
(а) ингибитор mTOR; и
(б) одно или несколько фармацевтических действующих веществ.
Другим объектом настоящего изобретения являются фармацевтические композиции, содержащие:
(а) ингибитор mTOR;
(б) фармацевтическое действующее вещество; и
(в) фармацевтически приемлемый носитель.
Еще одним объектом настоящего изобретения является также товарная упаковка или продукт, содержащие:
(а) фармацевтический препарат ингибитора mTOR; и
(б) фармацевтический препарат фармацевтического действующего вещества, предназначенный для одновременного, совместного, раздельного или последовательного применения.
Компоненты (а) и (б) комбинации можно применять вместе, один после другого или раздельно в виде одной объединенной стандартной дозы лекарственного средства или в виде двух различных стандартных доз лекарственного средства. Стандартная доза лекарственного средства может также представлять собой фиксированную комбинацию.
Комбинации, предлагаемые в настоящем изобретении, представляют собой фиксированные комбинации, в которых ингибитор mTOR и одно или несколько фармацевтических действующих веществ находятся в одном и том же препарате; наборы, в которых ингибитор mTOR и одно или несколько фармацевтических действующих веществ находятся в различных препаратах в одной и той же упаковке, например, в сочетании с инструкциями по совместному применению; и свободные комбинации, в которых ингибитор mTOR и одно или несколько фармацевтических действующих веществ упакованы отдельно, но снабжены инструкцией по совместному или последовательному применению.
Следующим объектом настоящего изобретения является:
- фармацевтическая упаковка, содержащая ингибитор mTOR и одно или несколько фармацевтических действующих веществ наряду с инструкциями по их совместному применению;
- фармацевтическая упаковка, содержащая ингибитор mTOR наряду с инструкциями по его совместному применению с одним или несколькими фармацевтическими действующими веществами;
- фармацевтическая упаковка, содержащая одно или несколько фармацевтических действующих веществ наряду с инструкциями по его(их) совместному применению с ингибитором mTOR; которая представляет собой товарную упаковку или продукт.
Следующим объектом настоящего изобретения является способ предупреждения или лечения пролиферативных заболеваний или заболеваний, которые ассоциированы или инициируются устойчивым ангиогенезом у млекопитающего, прежде всего у человека, с помощью комбинации, содержащей:
(а) ингибитор mTOR; и
(б) одно или несколько фармацевтических действующих веществ.
Следующим объектом настоящего изобретения является применение комбинации, фармацевтической композиции или товарной упаковки, предлагаемых в настоящем изобретении, для изготовления лекарственного средства, предназначенного для предупреждения или лечения пролиферативных заболеваний или заболеваний, которые ассоциированы или инициируются устойчивым ангиогенезом у млекопитающего.
Краткое описание чертежей
На чертежах показано:
на фиг.1 - процент ингибирования А549-клеток при использовании 81-точечной (9×9) матрицы доз комбинации 40-O-(2-гидроксиэтил)рапамицина и винорелбина;
на фиг.2 - синергетическое действие для каждой конкретной дозы по сравнению действием, полученным на основе аддитивной модели Лоэва (Loewe), для комбинации 40-O-(2-гидроксиэтил)рапамицина и винорелбина, на А549-клетках;
на фиг.3 - контур изоболограммы 30%-ного ингибирования А549-клеток комбинацией 40-O-(2-гидроксиэтил)рапамицина и винорелбина;
на фиг.4 - процент ингибирования А549-клеток при использовании 81-точечной (9×9) матрицы доз комбинации 40-O-(2-гидроксиэтил)рапамицина и 8-фенил-2-(морфолин-4-ил)хромен-4-она;
на фиг.5 - синергетическое действие для каждой конкретной дозы по сравнению действием, полученным на основе аддитивной модели Лоэва, для комбинации 40-O-(2-гидроксиэтил)рапамицина и 8-фенил-2-(морфолин-4-ил)хромен-4-она на А549-клетках;
на фиг.6 - контур изоболограммы 25%-ного ингибирования А549-клеток комбинацией 40-O-(2-гидроксиэтил)рапамицина и 8-фенил-2-(морфолин-4-ил)хромен-4-она.
Подробное описание изобретения
I. Ингибитор mTOR
Подробное описание ингибитора
Понятие «ингибитор mTOR» в контексте настоящего описания относится (но не ограничиваясь только ими) к соединениям, белкам или антителам, которые оказывают направленное воздействие/ингибируют активность представителей семейства киназ mTOR.
Ингибиторами активности mTOR являются, например, рапамицин формулы
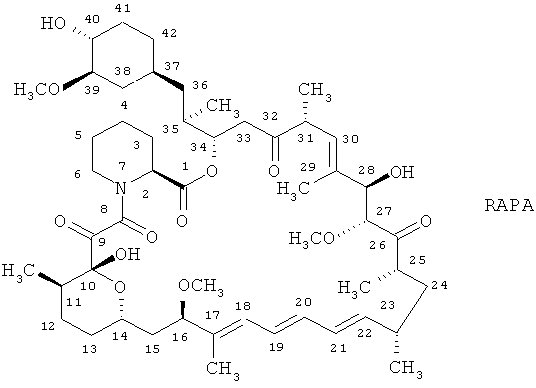
и производные рапамицина, такие, например, как
40-O-замещенные производные рапамицина, например,
40-O-алкильные производные рапамицина, такие как 40-O-гидроксиалкильные производные рапамицина, такие как 40-O-(2-гидрокси)этилрапамицин (эверолимус),
32-дезоксопроизводные рапамицина и 32-гидроксипроизводные рапамицина, такие как 32-дезоксорапамицин,
16-O-замещенные производные рапамицина, такие как 16-пент-2-инилокси-32-дезоксорапамицин, 16-пент-2-инилокси-32-(S- или R-)-дигидрорапамицин, 16-пент-2-инилокси-32-(S- или R)-дигидро-40-O-(2-гидроксиэтил)рапамицин,
производные рапамицина, ацилированные на атоме кислорода в положении 40, например, 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин (который обозначают также как CCI779),
производные рапамицина, замещенные в положении 40, гетероциклилом, например, 40-эпи(тетразолил)рапамицин (который обозначают также как АВТ578),
так называемые рапалоги, например, описанные в WO 98/02441 или WO 01/14387, такие, например, как 40-O-фосфосодержащие производные рапамицина, например, 40-O-диметилфосфинилрапамицин, включая АР23573, и
40-O-алкоксиалкильные производные рапамицина, такие как соединения, описанные под названием биолимус (биолимус А9), включая 40-0-(2-этокси)этилрапамицин, и соединения, описанные под названием TAFA-93, АР 23464, АР 23675 или АР 23841;
предпочтительно 40-O-(2-гидрокси)этилрапамицин, CCI779, АВТ578 или АР 23573,
наиболее предпочтительно 40-O-(2-гидрокси)этилрапамицин (эверолимус).
В одном из вариантов осуществления настоящего изобретения предпочтительная группа производных рапамицина включает соединение формулы
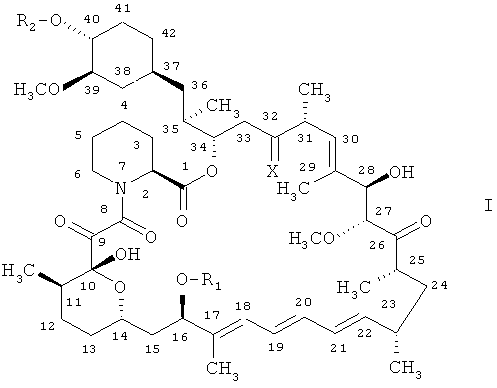
в которой
R1 обозначает СН3 или С3-С6алкинил,
R2 обозначает Н или -СН2-СН2-ОН и
Х обозначает =O, (Н,Н) или (Н,ОН),
при условии, что R2 не обозначает Н, когда Х обозначает =O и R1 обозначает СН3.
Предпочтительными соединениями являются 32-дезоксорапамицин, 16-пент-2-инилокси-32-дезоксорапамицин, 16-пент-2-инилокси-32(S)-дигидрорапамицин, 16-пент-2-инилокси-32(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин и более предпочтительно 40-O-(2-гидрокси)этилрапамицин.
Установлено, что соединения формулы I благодаря их обнаруженной активности, например способности связываться с макрофилином-12 (который известен также как FK-506-связывающий белок или FKBP-12), можно применять в качестве иммуносупрессора, например, при лечении острого отторжения аллотрансплантата, а также обладают эффективными антипролиферативными свойствами, что делает возможным их применение для химиотерапии рака, прежде всего плотных опухолей, прежде всего запущенных плотных опухолей.
II. Фармацевтические действующие вещества
Понятие «фармацевтические действующие вещества» в широком смысле относится к множеству фармацевтических действующих веществ, обладающих различными механизмами действия. Комбинации некоторых из них с ингибиторами mTOR могут обеспечивать более эффективное лечение рака. Как правило, фармацевтические действующие вещества классифицируют по их механизму действия. Целый ряд доступных веществ являются антиметаболитами путей развития различных опухолей или взаимодействуют с ДНК опухолевых клеток. Известны также вещества, которые ингибируют ферменты, такие как топоизомераза I и топоизомераза II, или которые представляют собой антимитотические вещества.
Понятие «фармацевтическое действующее вещество» обозначает прежде всего любое фармацевтическое действующее вещество, отличное от ингибитора mTOR или его производного. К ним относятся (но не ограничиваясь только ими):
I. стероид;
II. ингибитор аденозинкиназы;
III. адъювант;
IV. антагонист коркового вещества надпочечника;
V. ингибитор AKT-пути;
VI. алкилирующий агент;
VII. ингибитор ангиогенеза;
VIII. антиадроген;
IX. антиэстроген;
X. агент против гиперкальциемии;
XI. антиметаболит;
XII. индуктор апоптоза;
XIII. ингибитор aurora-киназы;
XIV. ингибитор Брутоновской тирозинкиназы (ВТК);
XV. ингибитор кальцинеурина;
XVI. ингибитор СаМ-киназы II;
XVII. ингибитор тирозинфосфатазы CD45;
XVIII. ингибитор фосфатазы CDC25;
XIX. ингибитор СНК-киназы;
XX. вещество, контролирующее регуляцию генистеина, оломуцина и/или тирфостинов;
XXI. ингибитор циклооксигеназы;
XXII. ингибитор киназы cRAF;
XIII. ингибитор циклинзависимой киназы;
XXIV. ингибитор цистеиновой протеазы;
XXV. интеркалятор ДНК;
XXVI. вещество, расщепляющее цепь ДНК;
XXVII. ингибитор Е3-лигазы;
XXVIII. эндокринный гормон;
XXIX. соединения, оказывающие направленное воздействие, снижающие или ингибирующие активность семейства эпидермальных факторов роста;
XXX. ингибитор тирозинкиназы EGFR, PDGFR;
XXXI. ингибитор фарнезилтрансферазы;
XXXII. ингибитор Flk-1-киназы;
XXXIII. ингибитор киназы 3 гликогенсинтазы (GSK3);
XXXIV. ингибитор гистондеацетилазы (HDAC);
XXXV. ингибитор HSP90;
XXXVI. ингибитор 1-каппа-В-альфа-киназы (IKK);
XXXVII. ингибитор инсулиновой рецепторной тирозинкиназы;
XXXVIII. киназный ингибитор N-концевой киназы c-Jun (JNK);
XXXIX. вещество, связывающее микротрубочки;
XL. ингибитор активируемой митогеном протеин-(МАР)-киназы;
XLI. ингибитор MDM2;
XLII. ингибитор МЕК;
XLIII. ингибитор матриксной металлопротеиназы (ММР);
XLIV. ингибитор тирозинкиназы NGFR;
XLV. ингибитор р38-МАР-киназы, включая ингибитор SAPK2/р38-киназы;
XLVI. ингибитор тирозинкиназы р56;
XLVII. ингибитор тирозинкиназы PDGFR;
XLVIII. ингибитор фосфатидилинозитол-3-киназы;
XLIX. ингибитор фосфатазы;
L. соединения платины;
LI. ингибитор протеинфосфатазы, включая ингибитор РР1 и РР2 и ингибитор тирозинфосфатазы;
LII. ингибитор РКС и ингибитор дельта-киназы РКС;
LIII. ингибитор синтеза полиаминов;
LIV. ингибитор протеосомы;
LV. ингибитор РТР1В;
LVI. ингибитор протеинтирозинкиназы, включая ингибитор семейства тирозинкиназ SRC; ингибитор тирозинкиназы Syk; и ингибитор тирозинкиназ JAK-2 и/или JAK-3;
LVII. ретиноид;
LVIII. ингибитор элонгации РНК-полимеразой II;
LIX. ингибитор сериновой/треониновой киназы;
LX. ингибитор биосинтеза стеролов;
LXI. ингибитор топоизомеразы;
LXII. ингибитор тирозинкиназы VEGFR;
LXIII. агонист гонадорелина;
LXIV. соединение, индуцирующее процессы клеточной дифференцировки;
LXV. бисфосфонат;
LXVI. ингибитор гепараназы;
LXVII. модификатор биологического ответа;
LXVIII. ингибитор теломеразы;
LXIX. медиаторы, такие как ингибиторы катехол-O-метилтрансферазы;
LXX. иммуносупрессорное моноклональное антитело, например, моноклональное антитело к рецепторам лейкоцитов;
LXXI. соматостатин или аналог соматостатина;
LXXII. антагонисты рецептора гормона роста;
LXXIII. моноклональные антитела, которые можно применять для лечения лейкоза (AML);
LXXIV. антитела к карциноэмбриональному антигену (СЕА);
LXXV. ингибитор фосфодиэстеразы;
LXXVI. вакцина против рака;
LXXVII. ингибиторы кинезинового белка митотического веретена (Kinesin Spindle Protein) (KSP);
LXXVIII. ингибиторы нескольких рецепторных тирозинкиназ, ассоциированных с ростом опухолей и ангиогенезом;
LXXIX. синтетические нестероидные эстрогены;
LXXX. цитотоксические антинеопластические вещества;
LXXXI. рекомбинантная связывающая молекула, имеющая по меньшей мере часть внеклеточного домена CTLA4, или ее мутант.
Понятие «стероид» в контексте настоящего описания относится к преднизону.
Понятие «ингибитор аденозинкиназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует метаболизм нуклеотидных оснований, нуклеозидов, нуклеотидов и нуклеиновых кислот. Например, ингибитор аденозинкиназы включает (но не ограничиваясь только ими) 5-йодотуберцидин, который имеет также название 5-йод-7-β-D-рибофуранозил-7Н-пирроло[2,3-d]пиримидин-4-амин.
Понятие «адъювант» в контексте настоящего описания относится к соединению, которое усиливает связь 5-FU-TS, а также к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует щелочную фосфатазу. Примерами адъюванта являются (но не ограничиваясь только ими) леуковорин и левамизол.
Понятие «антагонист коркового вещества надпочечника» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность коркового вещества надпочечника и изменяет периферический метаболизм кортикостероидов, что приводит к снижению уровня 17-гидроксикортикостероидов. Примером антагониста коркового вещества надпочечника является (но не ограничиваясь только им) митотан.
Понятие «ингибитор AKT-пути» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует клеточную пролиферацию. Akt, которую обозначают также как протеинкиназа В (РКВ), сериновая/треониновая киназа, представляет собой имеющий решающее значение фермент в некоторых путях трансдукции сигнала, которые связаны с диабетом. Основная роль Akt в клетках состоит в усилении опосредуемой фактором роста выживаемости клеток и блокаде связанной с апоптозом гибели клеток. Мишенью ингибитора AKT-пути является (но не ограничиваясь только ей) Pi3K/AKT. Примерами ингибиторов AKT-пути являются (но не ограничиваясь только ими) дегуелин, который известен также как 13,13а-дигидро-9,10-диметокси-3,3-диметил-3Н-бис[1]бензопирано[3,4-b:6'5'е]пиран-7(7аН)-он, (7aS, 13aS); трицирибин, который известен также как 1,5-дигидро-5-метил-1-β-D-рибофуранозил-1,4,5,6,8-пентаазааценафтилен-3-амид, и КР372-1 (QLT394).
Понятие «алкилирующий агент» в контексте настоящего описания относится к соединению, которое вызывает алкилирование ДНК и приводит к расщеплению молекул ДНК, а также перекрестно сшитых двух цепей, оказывая тем самым воздействие на репликацию ДНК и транскрипцию РНК. Примерами алкилирующих агентов являются (но не ограничиваясь только ими) хлорамбуцил, хлорметин, циклофосфамид, ифосфамид, мелфалан, эстрамустин; нитрозомочевины, такие как кармустин, фотемустин, ломустин, стрептозоцин (стрептозотоцин, STZ), BCNU; глиадел; дакарбазин, мехлорэтамин, например, в форме гидрохлорида, прокарбазин, например, в форме гидрохлорида, тиотепа, темозоломид, азотные производные горчичного газа (иприта), митомицин, алтретамин, бусульфан, эстрамустин, урамустин. Циклофосфамид можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком CYCLOSTIN®; ифосфамид в виде HOLOXAN®, темозоломид в виде TEMODAR®, азотный аналог горчичного газа в виде MUSTARGEN®, эстрамустин в виде EMYCT®, стрептозоцин в виде ZANOSAR®.
Понятие «ингибитор ангиогенеза» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует образование новых кровеносных сосудов. Мишенями ингибитора ангиогенеза являются (но не ограничиваясь только ими) метионинаминопептидаза-2 (MetAP-2), воспалительный белок-1 макрофагов (MIP-1 альфа), CCL5, TGF-бета, липооксигеназа, циклооксигеназа и топоизомераза. Косвенными мишенями ингибитора ангиогенеза являются (но не ограничиваясь только ими) р21, р53, CDK2 и синтез коллагена. Примерами ингибитора ангиогенеза являются (но не ограничиваясь только ими) фумагиллин, который известен также как моно[(3R,4S,5S,6R)-5-метокси-4-[(2R,3R)-2-метил-3-(3-метил-2-бутенил)оксиранил]-1-оксаспиро[2.5]окт-6-иловый]эфир (2Е,4Е,6Е,8Е)-2,4,6,8-декатетраендиоевой кислоты; шиконин, который известен также как 5,8-дигидрокси-2-[(1R)-1-гидрокси-4-метил-3-пентенил]-1,4-нафталиндион; траниласт, который известен также как 2-[[3-(3,4-диметоксифенил)-1-оксо-2-пропенил]амино]бензойная кислота (9CI); урсоловая кислота; сурамин; бенгамид или его производное, TNP-470 и талидомид.
Понятие «антиандроген» в контексте настоящего описания относится к соединению, которое блокирует действие андрогенов из надпочечников и яичек, стимулирующих рост здоровых и злокачественных тканей предстательной железы. Примерами антиандрогенов являются (но не ограничиваясь только ими) нилутамид; бикалутамид (CASODEX™), который можно использовать в составе фармацевтической композиции, описанной в US 4636505.
Понятие «антиэстроген» в контексте настоящего описания относится к соединению, которое оказывает антагонистическое действие на активность эстрогенов на уровне их рецепторов. Примерами антиэстрогенов являются (но не ограничиваясь только ими), например, атаместан, экземестан, форместан, аминоглутетимид, роглетимид, пиридоглутетимид, трилостан, тестолактон, кетоконазол, ворозол, фадрозол, анастрозол, летрозол, торемифен; бикалутамид; флутамид; тамоксифен, тамоксифена цитрат; фулвестрант, ралоксифен, ралоксифена гидрохлорид. Тамоксифен можно использовать, например, в виде его имеющегося на рынке препарата, такого, например, как NOLVADEX®; а ралоксифена гидрохлорид можно использовать, например, в виде его имеющегося на рынке препарата, такого, например, как EVISTA®. Фулвестрант можно использовать в составе фармацевтической композиции, описанной в US 4659516, или его можно использовать в виде его имеющегося на рынке препарата, такого, например, как FASLODEX™. Комбинацию, предлагаемую в изобретении, которая содержит в качестве фармацевтического действующего вещества антиэстроген, наиболее предпочтительно применять для лечения опухолей, позитивных по рецептору эстрогена, например рака молочной железы.
Понятие «антигиперкальциемическое средство» в контексте настоящего описания относится к соединениям, которые применяют для лечения гиперкальциемии. Примерами антигиперкальциемических средств являются (но не ограничиваясь только ими) гидрат нитрата галлия(III); и динатриевая соль памидроната.
Понятие «антиметаболит» в контексте настоящего описания относится к соединению, которое ингибирует или нарушает синтез ДНК, что приводит к гибели клеток. Примерами антиметаболитов являются (но не ограничиваясь только ими) деметилирующие ДНК вещества и антагонисты фолиевой кислоты, например, метотрексат, пеметрексед (перметрексед, Alimta®, ралтитрексед); пурины, например, 6-меркаптопурин, кладрибин, клофарабин; флударабин, тиогуанин, 6-тиогуанин, неларабин (соединение 506), тиазофурин (ингибирует пулы инозинмонофосфатдегидрогеназы и гуанозинтрифосфата), пентостатин (дезоксикоформицин); цитарабин; флексуридин; фторурацил; 5-фторурацил (5-FU), флоксуридин (5-FUdR), капецитабин; гемцитабин; гемцитабина гидрохлорид; гидроксимочевина (например, Hydrea®); деметилирующие ДНК вещества, такие как 5-азацитидин (Vidaza®) и децитабин; фторметилена дезоксицитидин (FmdC), 5-аза-2'-дезоксицитидин, троксацитабин (аналог L-изомера цитозина), эдатрексат. Капецитабин и гемцитабин можно использовать в виде их имеющихся на рынке препаратов, таких как XELODA® и GEMZAR®.
Понятие «индуктор апоптоза» в контексте настоящего описания относится к соединению, которое индуцирует обычные серии событий в клетке, которые приводят к ее гибели. Индуктор апоптоза, предлагаемый в настоящем изобретении, может избирательно индуцировать Х-связанный ингибирующий апоптоз белок млекопитающих XIAP. Индуктор апоптоза, предлагаемый в настоящем изобретении, может осуществлять понижающую регуляцию BCL-xL. Примерами индукторов апоптоза являются (но не ограничиваясь только ими) 2-[[3-(2,3-дихлорфенокси)пропил]амино]этанол (9CI); гамбоговая кислота; эмбелин, известный также под названием 2,5-дигидрокси-3-ундецил-2,5-циклогексадиен-1,4-дион; и триоксид мышьяка (TRISENOX®).
Понятие «ингибитор aurora-киназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует поздние стадии клеточного цикла от митотической G2/М-точки рестрикции, включая все стадии до митотической точки рестрикции и позднего митоза. Примером ингибитора auora-киназы является (но не ограничиваясь только им) бинуклеин 2, который известен также как N'-[l-(3-хлор-4-фторфенил)-4-циан-1Н-пиразол-5-ил]-N,N-диметилметанимидамид.
Понятие «ингибитор Брутоновской тирозинкиназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует развитие человеческих или мышиных В-клеток. Примером ингибитора ВТК является (но не ограничиваясь только ею) терреиновая кислота.
Понятие «ингибитор кальцинеурина» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует путь Т-клеточной активации. Мишенью ингибиторов кальцинеурина является протеинфосфатаза 2В. Примерами ингибиторов кальцинеурина являются (но не ограничиваясь только ими) циперметрин, который обозначают также как циан(3-феноксифенил)метиловый эфир 3-(2,2-дихлорэтенил)-2,2-диметилциклопропанкарбоновой кислоты; дельтаметрин, который обозначают также как
(S)-циан(3-феноксифенил)метиловый эфир (1R,3R)-3-(2,2-дибромэтенил)-2,2-диметилциклопропанкарбоновой кислоты; фенвалерат, который обозначают также как циан(3-феноксифенил)метиловый эфир 4-хлор-α-(1-метилэтил)бензолуксусной кислоты; и тирфостин 8.
Понятие «ингибитор СаМ-киназы II» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует СаМ-киназы. СаМ-киназы представляют собой семейство структурно родственных ферментов, которое включает киназу фосфорилазы, киназу легкой цепи миозина и СаМ-киназы I-IV. СаМ-киназа II, представляющая собой один из наиболее хорошо изученных многофункциональных ферментов, обнаружена в высоких концентрациях в нейронных синапсах, и в некоторых областях головного мозга ее концентрация может составлять вплоть до 2% от общего содержания белка. Активация СаМ-киназы II связана с памятью и процессами обучения в нервной системе позвоночных. Мишенью ингибитора СаМ-киназы II является СаМ-киназа II. Примерами ингибиторов СаМ-киназы II являются (но не ограничиваясь только ими) 4-[(2S)-2-[(5-изохинолинсульфонил)метиламино]-3-оксо-3-(4-фенил-1-пиперазинил)пропил]фениловый эфир 5-изохинолинсульфоновой кислоты и N-[2-[[[3-(4-хлорфенил)-2-пропенил]метил]амино]метил]фенил]-N-(2-гидроксиэтил)-4-метоксибензолсульфонамид.
Понятие «ингибитор тирозинфосфатазы CD45» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует дефосфорилирование регуляторных pTyr-остатков на представителях Src-семейства протеинтирозинкиназ, что способствует лечению различных воспалительных и иммунных нарушений. Примером ингибитора тирозинфосфатазы CD45 является (но не ограничиваясь только ею) [[2-(4-бромфенокси)-5-нитрофенил]гидроксиметил]фосфиновая кислота.
Понятие «ингибитор фосфатазы CDC25» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует сверхэкспрессирующиеся в опухолях дефосфорилированные циклинзависимые киназы. Примером ингибитора фосфатазы CDC25 является 2,3-бис[(2-гидроксиэтил)тио]-1,4-нафталиндион.
Понятие «ингибитор киназы CHK» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует сверхэкспрессию антиапоптозного белка Bcl-2. Мишенями ингибитора киназы СНК являются CHK1 и/или CHK2. Примером ингибитора киназы СНК является (но не ограничиваясь только им) дебромгимениалдисин.
Примерами «вещества, контролирующего регуляцию генистеина, оломуцина и/или тирфостинов» являются (но не ограничиваясь только ими) даидзеин, который известен также как, 7-гидрокси-3-(4-гидроксифенил)-4Н-1-бензопиран-4-он; изооломоуцин и тирфостин 1.
Понятие «ингибитор циклооксигеназы» в контексте настоящего описания (но не ограничиваясь только ими), например, ингибиторы Сох-2. Понятие «ингибитор СОХ-2» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует фермент сох-2 (пиклооксигеназа-2). Примерами ингибиторов СОХ-2 являются (но не ограничиваясь только ими) 1H-индол-3-ацетамид 1-(4-хлорбензоил)-5-метокси-2-метил-N-(2-фенилэтил)-5-алкилзамещенной 2-ариламинофенилуксусной кислоты и его производные, такие как целекоксиб (CELEBREX), рофекоксиб (VIOXX®), эторикоксиб, вальдекоксиб; или 5-алкил-2-ариламинофенилуксусная кислота, например, 5-метил-2-(2'-хлор-6'-фторанилино)фенилуксусная кислота, лумиракоксиб; и целекоксиб.
Понятие «ингибитор cRAF-киназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует повышающую регуляцию Е-селектина и молекулы-1 сосудистой адгезии, индуцируемую TNF. Raf-киназы играют важную роль в качестве регулирующих внеклеточные сигналы киназ при клеточной дифференцировке, пролиферации и апоптозе. Мишенью ингибиторов cRAF-киназы является (но не ограничиваясь только ею) RAF1. Примерами ингибиторов cRAF-киназы являются (но не ограничиваясь только ими) 3-(3,5-дибром-4-гидроксибензилиден)-5-йод-1,3-дигидроиндол-2-он; и 3-(диметиламино)-N-[3-[(4-гидроксибензоил)амино]-4-метилфенил]бензамид. Ингибиторы RAF-киназы включают соединения, описанные в WO 2005/028444 или WO 00/09495.
Понятие «ингибитор циклинзависимой киназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует циклинзависимую киназу, которая играет роль в регуляции клеточного цикла у млекопитающих. Процесс клеточного цикла регулируется сериями последовательных событий, которые включают активацию и последующую инактивацию циклинзависимых киназ (Cdk) и циклинов. Cdk представляют собой группу сериновых/треониновых киназ, которые образуют активные гетеродимерные комплексы посредством связывания с их регуляторными субъедицами, т.е. циклинами. Примерами мишеней ингибитора циклинзависимой киназы являются (но не ограничиваясь только ими) CDK, AHR, CDK1, CDK2, CDK5, CDK4/6, GSK3бета и ERK. Примерами ингибиторов циклинзависимой киназы являются (но не ограничиваясь только ими), N9-изопропилоломоуцин; оломоуцин; пурваланол В, который известен также как 2-хлор-4-[[2-[[(1R)-1-(гидроксиметил)-2-метилпропил]амино]-9-(1-метилэтил)-9Н-пурин-6-ил]амино]бензойная кислота; роасковитин; индирубин, который известен также как 3-(1,3-дигидро-3-оксо-2Н-индол-2-илиден)-1,3-дигидро-2Н-индол-2-он; кенпауллон, который известен также как 9-бром-7,12-дигидроиндол[3,2-d][1]бензазепин-6(5Н)-он; пурваланол А, который известен также как (2R)-2-[[6-[(3-хлорфенил)амино]-9-(1-метилэтил)-9Н-пурин-2-ил]амино]-3-метил-1-бутанол, и индирубин-3'-монооксим.
Понятие «ингибитор цистеиновой протеазы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует цистеиновую протеазу, которая играет основную роль в клеточном обмене и апоптозе у млекопитающих. Примером ингибитора цистеиновой протеазы является (но не ограничиваясь только им) N-[(1S)-3-фтор-2-оксо-1-(2-фенилэтил)пропил]амино]-2-оксо-1-(фенилметил)этил]-4-морфолинкарбоксамид.
Понятие «интеркалятор ДНК» в контексте настоящего описания относится к соединению, которое связывается с ДНК и ингибирует синтез ДНК, РНК и белков. Примерами интеркаляторов ДНК являются (но не ограничиваясь только ими) пликамицин и дактиномицин.
Понятие «вещество, расщепляющее цепь ДНК» в контексте настоящего описания относится к соединению, которое вызывает разрезание цепи ДНК и приводит к ингибированию синтеза ДНК, ингибированию синтеза РНК и белков. Примером вещества, расщепляющего цепь ДНК, является (но не ограничиваясь только им) блеомицин.
Понятие «ингибитор Е3-лигазы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует Е3-лигазу, которая ингибирует перенос цепей убикитина на белки, что делает их мишенью для расщепления в протеосоме. Примером ингибитора Е3-лигазы является (но не ограничиваясь только им) N-((3,3,3-трифтор-2-трифторметил)пропионил)сульфаниламид.
Понятие «эндокринный гормон» в контексте настоящего описания относится к соединению, которое главным образом оказывает воздействие на щитовидную железу, вызывая подавление гормонов у мужчин, результатом чего является снижение уровней тестостерона вплоть до гормональной кастрации. У женщин ингибируется синтез в яичниках и эстрогена, и андрогена. Примерами эндокринных гормонов являются (но не ограничиваясь только ими) леупролид и мегестрол, а также мегестрола ацетат.
Понятие «соединения, оказывающие направленное воздействие, ослабляющие или ингибирующие активность семейства эпидермальных факторов роста» в контексте настоящего описания относится к соединению, которое обеспечивает направленное воздействие, ослабляет или ингибирует активность рецепторных тирозинкиназ семейства эпидермальных факторов роста (EGFR, ErbB2, ErbB3, ErbB4 в виде гомо- или гетеродимеров), соединения, которые обеспечивают направленное воздействие, ослабляет или ингибируют активность семейства эпидермальных факторов роста, представляют собой прежде всего соединения, белки или антитела, которые ингибируют представителей рецепторных тирозинкиназ EGF, например, рецептора EGF, ErbB2, ErbB3 и ErbB4, или связываются с EGF или с родственными EGF лигандами, и они прежде всего представляют собой соединения, белки или моноклональные антитела, которые в целом и конкретно описаны в WO 97/02266, например, соединения, описанные в ЕР 0564409, WO 99/03854, ЕР 0520722, ЕР 0566226, ЕР 0787722, ЕР 0837063, US 5747498, WO 98/10767, WO 97/30034, WO 97/49688, WO 97/38983 и прежде всего в WO 96/30347, например, соединение, обозначенное как СР 358774, в WO 96/33980, например, соединение ZD 1839; и в WO 95/03283, например, соединение ZM 105180, например, включая ингибитор тирозинкиназ с двойной активностью (ErbB1 и ErbB2) лапатиниб (GSK572016), например, лапатиниба дитосилат; панитузумаб, трастузумаб (HERCEPTIN®), цетуксимаб, иресса, OSI-774, CI-1033, EKB-569, GW-2016, E1.1, Е2.4, Е2.5, Е6.2, Е6.4, Е2.11, Е6.3 или Е7.6.3, и 7Н-пирроло-[2,3-(1]пиримидиновые производные, которые описаны в WO 03/013541, ватаналиб, эрлотиниб и гефитиниб. Эрлотиниб можно использовать в виде его имеющегося на рынке препарата, такого, например, как TARCEVA®, а гефитиниб в виде IRESSA®, можно применять человеческие моноклональные антитела к рецептору эпидермального фактора роста, включая ABX-EGFR. Мишенями ингибитора киназы EGFR являются (но не ограничиваясь только ими) гуанилилциклаза (GC-C) и HER2. Другими примерами ингибиторов киназы EGFR являются (но не ограничиваясь только ими) залутумумаб, тирфостин 23, тирфостин 25, тирфостин 47, тирфостин 51 и тирфостин AG 825. Мишенями ингибиторов тирозинкиназы EGFR являются EGFR, РТК и тубулин. Другими примерами ингибитора тирозинкиназы EGFR являются (но не ограничиваясь только ими) (2Е)-2-циан-3-(3,4-дигидроксифенил)-N-фенил-2-пропенамид; тирфостин Ag 1478; лавендустин А; и (αZ)-α-[(3,5-дихлорфенил)метилен]-3-пиридинацетонитрил (9CI). Примером ингибитора тирозинкиназы EGFR, PDGFR является (но не ограничиваясь только им) тирфостин 46.
Понятие «ингибитор фарнезилтрансферазы» в контексте настоящего описания к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует белок Ras, который обычно характеризуется аномальной активностью при раке. Мишенью ингибитора фарнезилтрансферазы является (но не ограничиваясь только им) RAS. Примерами ингибиторов фарнезилтрансферазы являются (но не ограничиваясь только ими) гидроксифарнезилфосфиновая кислота; (2S)-1-метилэтиловый эфир 2-[[(2S)-2-[[(2S,3S)-2-[[(2R)-2-амино-3-меркаптопропил]амино]-3-метилпентил]окси]-1-оксо-3-фенилпропил]амино]-4-(метилсульфонил)масляной кислоты; манумицин A; L-744,832 или DK8G557, типифарниб (R115777), SCH66336 (лонафарниб) и BMS-214662.
Понятие «ингибитор Flk-1-киназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность Flk-1-тирозинкиназы. Мишенью ингибитора Flk-1-киназы является (но не ограничиваясь только им) KDR. Примером ингибитора Flk-1-киназы является (но не ограничиваясь только им) 2-циан-3-[4-гидрокси-3,5-бис(1-метилэтил)фенил]-N-(3-фенилпропил)-(2Е)-2-пропенамид.
Понятие «ингибитор киназы 3 гликогенсинтазы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует киназу-3 гликогенсинтазы (GSK-3). Киназа-3 гликогенсинтазы (GSK-3; киназа I тау-белка), высококонсервативная повсеместно экспрессирующаяся сериновая/треониновая протеинкиназа, участвует в каскадах трансдукции сигналов множества клеточных процессов, она представляет собой протеинкиназу, которая, как установлено, участвует в регуляции разнообразных наборов клеточных функций, включая синтез белков, клеточную пролиферацию, клеточную дифференцировку, сборку/разборку на части микротрубочек и апоптоз. Примером ингибитора GSK3 является (но не ограничиваясь только им) индирубин-3'-монооксим.
Понятие «ингибитор гистондеацетилазы (HDAC)» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует гистондеацетилазу и которое обладает антипролиферативной активностью. К ним относятся (но не ограничиваясь только ими) соединения, описанные в WO 02/22577, прежде всего N-гидрокси-3-[4-[[(2-гидроксиэтил)[2-(1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамид и Н-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамид и их фармацевтически приемлемые соли. К ним относятся также субероиланилидгидроксамовая кислота (SAHA); пиридин-3-илметиловый эфир[4-(2-аминофенилкарбамоил)бензил]карбаминовой кислоты и их производные; масляная кислота, пироксамид, трихостатин А, оксамфлатин, апицидин, депсипептид; и трапоксин. Другими примерами являются депудецин; трапоксин, НС-токсин (токсин из Helmintjsporium carbonum), который представляет собой циклический тетрапептид (цикло[пролилалинилаланил-2-амино-8-оксо-9,10-эпоксидеканоил]); натрия фенилбутират, субероилбисгидроксамовая кислота, трихостатин A, BMS-27275, пироксамид, FR-901228 и валпроевая кислота.
Понятие «ингибитор HSP90» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует присущую HSP90 АТФазную активность; расщепляет, оказывает направленное воздействие, ослабляет или ингибирует белки-клиенты» HSP90 через убикитиновый протеосомный путь. Потенциальные опосредованные мишени ингибитора HSP90 представляют собой FLT3, BCR-ABL, CHK1, CYP3A5*3 и/или NQ01*2. Соединения, которые оказывают направленное воздействие, ослабляют или ингибируют присущую HSP90 АТФазную активность, прежде всего представляют собой соединения, белки или антитела, которые ингибируют АТФазную активность HSP90, например, 17-аллиламино-17-деметоксигелданамицин (17AAG), т.е. производное гелдамицина; другие родственные гелдамицину соединения; радицикол и ингибиторы HDAC. Другими примерами ингибиторов HSP90 являются гелданамицин, 17-деметокси-17-(2-пропениламино) (9CI); и гелданамицин. Нилотиниб является примером ингибитора тирозинкиназы BCR-ABL.
Понятие «ингибитор 1-каппа-В-альфа-киназы (IKK)» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует NF-каппаВ. Примером ингибитора IKK является (но не ограничиваясь только им) 3-[(4-метилфенил)сульфонил]-(2Е)-2-пропеннитрил.
Понятие «ингибитор инсулиновой рецепторной тирозинкиназы» в контексте настоящего описания относится к соединению, которое модулирует различные виды активности фосфатидинилинозитол-3-киназы, ассоциированного с микротрубочками белка, 86-киназ. Примерами ингибиторов инсулиновой рецепторной тирозинкиназы являются (но не ограничиваясь только ими) гидроксил-2-нафталенилметилфосфоновая кислота и LY294002.
Понятие «киназный ингибитор N-концевой киназы c-Jun (JNK)» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует N-концевую киназу Jun. N-концевая киназа Jun (JNK), контролируемая серином протеинкиназа, участвует в фосфорилировании и активации c-Jun и ATF2 и играет важную роль в метаболизме, росте, клеточной дифференцировке и апоптозе. Мишенью ингибитора киназы JNK является (но не ограничиваясь только им) DNMT (ДНК-метилтрансфераза). Ингибиторами киназы JNK являются (но не ограничиваясь только ими), пиразолантрон и/или эпиналлокатехина галлат.
Понятие «вещество, связывающее микротрубочки» в контексте настоящего описания относится к соединению, действие которого заключается в нарушении сети микротрубочек, что является важным для клеточной функции на этапах митоза и интерфазы. Примерами веществ, связывающих микротрубочки, являются (но не ограничиваясь только ими) алкалоиды барвинка, например, винбластин, винбластина сульфат; винкристин, винкристина сульфат; виндесин; винорелбин; таксаны, например, доцетаксел; паклитаксел; дискодермолиды; кохицин и эпотилоны и их производные, например, эпотилон В или его производное. Паклитаксел можно использовать в виде его имеющегося на рынке препарата TAXOL®; доцетаксел в виде TAXOTERE®; винбластина сульфат в виде VINBLASTIN R.P®; а винкристина сульфат в виде FARMISTIN®. К ним относятся также генерики паклитаксела, а также различные лекарственные формы паклитаксела. Генериками паклитаксела являются (но не ограничиваясь только ими) бетаксолола гидрохлорид. Различными лекарственными формами паклитаксела являются (но не ограничиваясь только ими) паклитаксел в виде альбуминовых наночастиц, которые имеются на рынке в виде препаратов, выпускаемых под товарным знаком ABRAXANE®; ONXOL®, CYTOTAX®. Дискодермолид можно получать, например, с помощью метода, описанного в US 5010099. Под объем изобретения подпадают также производные эпотолина, описанные в US 6194181, WO 98/10121, WO 98/25929, WO 98/08849, WO 99/43653, WO 98/22461 и WO 00/31247. Наиболее предпочтительными являются эпотолин А и/или В.
Понятие «ингибитор активируемой митогеном протеин-(МАР)-киназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активируемый митогеном белок. Активируемые митогеном протеин-(МАР)-киназы представляют собой группу протеинсериновых/треониновых киназ, которые активируются в ответ на различные внеклеточные стимулы и опосредуют трансдукцию сигнала от клеточной поверхности к ядру. Они регулируют несколько физиологических и патологических состояний клетки, включая воспаление, гибель клеток в результате апоптоза, онкогенную трансформацию, инвазию опухолевых клеток и метастазы. Примером ингибитора МАР-киназы является (но не ограничиваясь только им) N-[2-[[[3-(4-хлорфенил)-2-пропенил]метил]амино]метил]фенил]-N-(2-гидроксиэтил)-4-метоксибензолсульфонамид.
Понятие «ингибитор MDM2» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует взаимодействие MDM2 и супрессора опухоли р53. Примером ингибитора MDM2 является (но не ограничиваясь только им) транс-4-иод-4'-боранилхалкон.
Понятие «ингибитор МЕК» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует киназную активность МАР-киназы, т.е. МЕК. Мишенью ингибитора МЕК является (но не ограничиваясь только ею) ERK. Косвенной мишенью ингибитора МЕК является (но не ограничиваясь только им) циклин D1. Примерами ингибиторов МЕК являются (но не ограничиваясь только ими) сорафениб, например, Nexavar® (сорафениба тозилат), бис[амино[2-аминофенил)тио]метилен]бутандинитрил.
Понятие «ингибитор ММР» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует класс протеаз, которые избирательно катализируют гидролиз полипептидных связей, включая ферменты ММР-2 и ММР-9, которые участвуют в ускорении потери тканевой структуры вокруг опухолей и облегчают рост, ангиогенез и метастазы опухолей. Мишенью ингибитора ММР является (но не ограничиваясь только ею) полипептиддеформилаза. Примерами ингибиторов ММР являются (но не ограничиваясь только ими) актинонин, который известен также как N4-гидрокси-N1-[(1S)-1-[[(2S)-2-(гидроксиметил)-1-пирролидинил]карбонил]-2-метилпропил]-2-пентил-(2R)-бутандиамид; эпииаллокатехина галлат; коллагеновые ингибиторы типа пептидомиметиков и непептидомиметиков; производные тетрациклина, например, относящийся к пептидомиметикам гидроксаматный ингибитор батимастат; и его обладающие биологической доступностью при оральном введении аналоги маримастат, приномастат, метастат, неовастат, таномастат, ТАА211, MMI270B, BMS-279251, BAY 12-9566 или AAJ996.
Понятие «ингибитор тирозинкиназы NGFR» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует зависящее от фактора роста нерва фосфорилирование тирозина p140c-trk. Мишенями ингибиторов тирозинкиназы NGFR являются (но не ограничиваясь только ими) HER2, FLK1, FAK, TrkA, и/или TrkC. Косвенным направленным воздействием является ингибирование экспрессии RAF1. Примером ингибитора тирозинкиназы NGFR является (но не ограничиваясь только им) тирфостин AG 879.
Понятие «ингибитор р38-МАР-киназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует р38-МАРК, являющуюся представителем семейства МАРК. Представителем семейства МАРК является сериновая/треониновая киназа, которая активируется фосфорилированием остатков тирозина и треонина. Эта киназа фосфорилируется и активируется в результате различных клеточных вызывающих стресс и воспалительных стимулов, и, вероятно, может участвовать в регуляции важных клеточных ответов, таких как апоптоз и воспалительные реакции. Примером ингибитора р38-МАР-киназы является (но не ограничиваясь только им) 4-[4-(4-фторфенил)-5-(4-пиридинил)-1Н-имидазол-2-ил]фенол. Примером ингибитора SAPK2/р38-киназы является (но не ограничиваясь только им) 3-(диметиламино)-М-[3-[(4-гидроксибензоил)амино]-4-метилфенил]бензамид.
Понятие «ингибитор тирозинкиназы р56» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует тирозинкиназу р56, представляющую собой фермент, который относится к специфическому для лимфоидной ткани src-семейству тирозинкиназ, которые имеют решающее значение для Т-клеточного развития и активации. Мишенью ингибитора тирозинкиназы р56 является (но не ограничиваясь только ею) Lck. Lck ассоциирована с цитоплазматическими доменами CD4, CD8 и бета-цепью рецептора IL-2, и, вероятно, может принимать участие в самый ранних стадиях опосредуемой TCR Т-клеточной активации. Примерами ингибиторов тирозинкиназы р56 являются (но не ограничиваясь только ими) дамнакантал, известный также как 9,10-дигидро-3-гидрокси-1-метокси-9,10-диоксо-2-антраценкарбоксальдегид, и/или тирфостин 46.
Понятие «ингибитор тирозинкиназы PDGFR» в контексте настоящего описания относится к соединениям, которые оказывают направленное воздействие, ослабляет или ингибируют активность рецепторных тирозинкиназ C-kit (представители семейства PDGFR), таким как соединения, которые оказывают направленное воздействие, ослабляет или ингибируют активность семейства рецепторных тирозинкиназ c-Kit, прежде всего к соединениям, которые ингибируют рецептор c-Kit, PDGF играет основную роль в регулировании клеточной пролиферации, хемотаксиса и выживании здоровых клеток, а также в различных болезненных состояниях, таких как рак, атеросклероз и фиброзное заболевание. Семейство PDGF состоит из димерных изоформ (PDGF-AA, PDGF-BB, PDGF-AB, PDGF-CC и PDGF-DD), которые оказывают свое воздействие на клетку путем дифференцированного связывания с двумя рецепторными тирозинкиназами. PDGFR-α и PDGFR-β имеют молекулярные массы ~170 и 180 кДа соответственно. Примерами мишеней ингибиторов тирозинкиназы PDGFR являются (но не ограничиваясь только ими) PDGFR, FLT3 и/или c-KIT. Примерами ингибиторов тирозинкиназы PDGFR являются (но не ограничиваясь только ими) тирфостин AG 1296; тирфостин 9; 2-амино-4-(1Н-индол-5-у1)-1,3-бутадиен-1,1,3-трикарбонитрил, иматиниб и иресса.
Понятие «ингибитор фосфатидинилинозитол-3-киназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность PI-3-киназы. Установлено, что активность PI-3-киназы повышается в ответ на многочисленные гормональные или связанные с фактором роста стимулы, включая инсулин, тромбоцитарный фактор роста, инсулиноподобный фактор роста, эпидермальный фактор роста, колониестимулирующий фактор и гепатоцитарный фактор роста, и она участвует в процессах, которые связаны с ростом и трансформацией клеток. Примером мишени фосфатидинилинозитол-3-киназы является (но не ограничиваясь только ею) Pi3K. Примерами ингибиторов фосфатидинилинозитол-3-киназ являются (но не ограничиваясь только ими) вортманнин, который известен также как (1S,6bR,9aS,11R,11bR)-11-(ацетилокси)-1,6b,7,8,9а,10,11,11b-октагидро-1-(метоксиметил)-9а,11b-диметил-3Н-фуро[4,3,2-де]индено[4,5-h]-2-бензопиран-3,6,9-трион; 8-фенил-2-(морфолин-4-ил)хромен-4-он; и/или кверцетин, например, кверцетина дигидрат.
Понятие «ингибитор фосфатазы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность фосфатазы. Фосфатазы обеспечивают удаление фосфорильной группы и возвращение белка в его исходное дефосфорилированное состояние. Таким образом цикл фосфорилирования-дефосфорилирования можно рассматривать как молекулярный процесс «включения/выключения» («on-off»). Примерами ингибиторов фосфатаз являются (но не ограничиваясь только ими) кантаридиновая кислота; кантаридин; и (Е)-N-[4-(2-карбоксиэтенил)бензоил]глицил-L-α-глутамил-L-лейцинамид.
Понятие «соединение платины» в контексте настоящего описания относится к соединению, которое содержит платину и ингибирует синтез ДНК в результате образования перекрестного сшивания между цепями и внутри цепей молекул ДНК. Примерами соединений платины являются (но не ограничиваясь только ими) карбоплатин; цисплатин; оксалиплатин; цисплатина; сатраплатин и такие соединения платины, как ZD0473 BBR3464. Карбоплатин можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком CARBOPLAT®; а оксалиплатин в виде ELOXATIN®.
Понятие «ингибитор протеинфосфатазы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность протеинфосфатазы. Понятие «ингибитор РР1 или РР2» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность протеинфосфатаз Ser/Thr. Фосфатазы типа I, к которому относится РР1, могут ингибироваться двумя термостабильными белками, известными как ингибитор-1 (I-1) и ингибитор-2 (I-2). Они главным образом участвуют в дефосфорилировании □-субъединицы киназы фосфорилазы. Тип II фосфатаз подразделяют на обладающие спонтанной активность (РР2А), Са2+-зависимые (РР2В) и Mg2+-зависимые (РР2С) классы фосфатаз. Примерами ингибиторов РР1 и РР2А являются (но не ограничиваясь только ими) кантаридиновая кислота и/или кантаридин. Понятие «ингибитор тирозинфосфатазы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность тирозинфосфатазы. Относительно недавно в семейство фосфатаз включены протеин-тирозинфосфатазы (РТР). Они удаляют фосфатные группы из фосфорилированных остатков тирозина белка. РТР обладают различными структурными особенностями и играют важную роль в регуляции клеточной пролиферации, дифференцировки, клеточной адгезии и подвижности, а также функции цитоскелета. Примерами мишеней ингибиторов тирозинфосфатазы являются (но не ограничиваясь только ими) щелочная фосфатаза (ALP), гепараназа, РТРаза и/или фосфатаза простатической кислоты. Примерами ингибиторов тирозинфосфатазы являются (но не ограничиваясь только ими) L-P-бромтетрамизола оксалат; (5R)-4-гидрокси-5-(гидроксиметил)-3-(1-оксогексадецил)-2(5Н)-фуранон (9CI); и бензилфосфоновая кислота.
Понятие «ингибитор РКС» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность протеинкиназы С, а также ее изозимов. Протеинкиназа С (РКС) представляет собой повсеместно распространенный зависимый от фосфолипидов фермент, который участвует в трансдукции сигнала, ассоциированного с клеточной пролиферацией, дифференцировкой и апоптозом. Примерами мишеней ингибиторов РКС являются (но не ограничиваясь только ими) МАРК и/или NF-каппаВ. Примерами ингибиторов РКС являются (но не ограничиваясь только ими) 3-[1-[3-(диметиламино)пропил]-1Н-индол-3-ил]-4-(1Н-индол-3-ил)-1-Н-пирроло-2,5-дион; бисиндолилмалеимид IX; сфингозин, известный также как (2S,3R,4Е)-2-амино-4-октадецен-1,3-диол; стауроспорин, известный также как (9S,10R,11R,13R)-2,3,10,11,12,13-гексагидро-10-метокси-9-метил-11-(метиламино)-9,13-эпокси-1Н,9Н-дииндоло[1,2,3-gh:3',2',1'-lm]пирроло[3,4-j][1,7]бензодиазонин-1-он, тирфостин 51; и гиперицин, известный также как стереоизомер 1,3,4,6,8,13-гексагидрокси-10,11-диметилфенантро[1,10,9,8-опкра]перилен-7,14-диона, UCN-01, сафингол, BAY 43-9006, бриостатин 1, перифозин; илмофозин; RO 318220, RO 320432; GO 6976; Isis 3521; и LY333531/LY379196.
Понятие «ингибитор дельта-киназы РКС» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность дельта-изозима РКС. Дельта-изозимы представляют собой обычные изозимы РКС и являются Са2+-зависимыми. Примером ингибитора дельта-киназы РКС является (но не ограничиваясь только им) роттлерин, который известен также как (2Е)-1-[6-[(3-ацетил-2,4,6-тригидрокси-5-метилфенил)метил]-5,7-дигидрокси-2,2-диметил-2Н-1-бензопиран-8-ил]-3-фенил-2-пропен-1-он.
Понятие «ингибитор синтеза полиаминов» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует полиамины спермидина. Полиамины спермидина и спермина имеют жизненно важное значение для клеточной пролиферации, хотя их точный механизм действия пока остается неясным. Для опухолевых клеток характерен измененный гомеостаз полиаминов, что выражается в повышенной активности ферментов биосинтеза и увеличенных пулах полиаминов. Примерами ингибиторов синтеза полиаминов являются (но не ограничиваясь только ими) DMFO, известный также как (-)-2-дифторметилорнитин; N1, N12-диэтилспермин · 4HCl.
Понятие «ингибитор протеосомы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует протеосому. Примерами мишеней ингибиторов протеосомы являются (но не ограничиваясь только ими) образующая O(2)(-) НАДФН-оксидаза, NF-каппаВ и/или фарнезилтрансфераза, геранилгеранилтрансфераза I. Примерами ингибиторов протеосомы являются (но не ограничиваясь только ими) аклациномицин А; глиотоксин; PS-341; MLN 341; бортезомиб (Velcade®).
Понятие «ингибитор РТР1В» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует РТР1В, ингибитор протеинтирозинкиназы. Примером ингибитора РТР1В является (но не ограничиваясь только им) (E)-N-[4-(2-карбоксиэтенил)бензоил]глицил-L-α-глутамил-L-лейцинамид.
Понятие «ингибитор протеинтирозинкиназы» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность протеинтирозинкиназы. Протеинтирозинкиназы (РТК) играют основную роль в регуляции клеточной пролиферации, дифференцировки, метаболизма, миграции и выживания. Их классифицируют как рецепторные РТК и нерецепторные РТК. Рецепторные РТК содержат одну полипептидную цепь с трансмембранным сегментом. Внеклеточный конец этого сегмента содержит обладающий высокой аффинностью лигандсвязывающий домен с цитоплазматическим концом, который содержит каталитическое ядро и регуляторные последовательности. Примерами мишеней ингибиторов тирозинкиназ являются (но не ограничиваясь только ими) ERK1, ERK2, Брутоновская тирозинкиназа (Btk), JAK2, ERK 1/2, PDGFR и/или FLT3. Примерами косвенных мишеней являются (но не ограничиваясь только ими) ТНРальфа, NO, PGE2, IRAK, iNOS, ICAM-1 и/или Е-селектин. Примерами ингибиторов тирозинкиназ являются (но не ограничиваясь только ими) тирфостин AG 126; тирфостин Ag 1288; тирфостин Ag 1295; гелдамицин; и генистеин.
К нерецепторным тирозинкиназам относятся представители семейств Src, Tec, JAK, Fes, Abl, FAK, Csk и Syk. Они локализованы в цитоплазме, а также в ядре. Они характеризуются различной киназной регуляцией, фосфорилированием субстрата и функцией. Нарушение регуляции этих киназ связано также с некоторыми болезнями человека.
Понятие «ингибитор семейства тирозинкиназ SRC» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность SRC. Примерами ингибиторов семейства тирозинкиназ SRC являются (но не ограничиваясь только ими) РР1, который известен также как 1-(1,1-диметилэтил)-3-(1-нафталенил)-1Н-пиразоло[3,4-4]пиримидин-4-амин; и РР2, который известен также как 3-(4-хлорфенил)-1-(1,1-диметилэтил)-1Н-пиразоло[3,4-d]пиримидин-4-амин.
Понятие «ингибитор тирозинкиназы Syk» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует активность Syk. Примерами мишенями ингибиторов тирозинкиназы Syk являются (но не ограничиваясь только ими) Syk, STAT3 и/или STAT5. Примером ингибитора тирозинкиназы Syk является (но не ограничиваясь только им) пицеатаннол, который известен также как 4-[(1Е)-2-(3,5-дигидроксифенил)этенил]-1,2-бензолдиол.
Понятие «ингибитор тирозинкиназы Янус (JAK-2 и/или JAK-3)» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует тирозинкиназу Янус. Установлено, что ингибиторы тирозинкиназы Янус представляют собой средства против лейкоза с антитромботическим, антиаллергическим и иммуносупрессорным свойствами. Мишенями ингибиторов тирозинкиназы JAK-2 и/или JAK-3 являются (но не ограничиваясь только ими) JAK2, JAK3, STAT3. Косвенной мишенью ингибиторов тирозинкиназ JAK-2 и/или JAK-3 является (но не ограничиваясь только ею) CDK2. Примерами ингибиторов тирозинкиназ JAK-2 и/или JAK-3 являются (но не ограничиваясь только ими) тирфостин AG 490 и 2-нафтилвинилкетон.
Соединения, которые оказывают направленное воздействие, ослабляют или ингибируют активность представителей семейства с-Abl и их слитых генных продуктов включают, например, PD 180970; AG 957; или NSC 680410.
Понятие «ретиноид» в контексте настоящего описания относится к соединениям, которые оказывают направленное воздействие, ослабляют или ингибируют зависящие от ретиноида рецепторы. Их примерами являются (но не ограничиваясь только ими) изотретиноин, третиноин, алитретиноин, бексаротрен, например, включая соединение, которое взаимодействует с реагирующими на ретиноевую кислоту элементами на ДНК, такое как (13-цис-ретиноевая кислота).
Понятие «ингибитор элонгации РНК-полимеразой II» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует стимулируемую инсулином ядерную или цитозольную p70S6-киназу в СНО-клетках; оказывает направленное воздействие, ослабляет или ингибирует транскрипцию, осуществляемую с участием РНК-полимеразы, что может зависеть от казеиновой киназы II; и оказывает направленное воздействие, ослабляет или ингибирует разрушение пузырьков в зародышевых (терминальных) коровьих ооцитах. Примером ингибитора элонгации РНК-полимеразой II является (но не ограничиваясь только им) 5,6-дихлор-1-бета-D-рибофуранозилбензимидазол.
Понятие «ингибитор сериновой/трениновой» киназы» в контексте настоящего описания относится к соединению, которое ингибирует сериновые/треониновые киназы. Примером мишени ингибитора сериновой/треониновой киназы является (но не ограничиваясь только ею) dsPHK-зависимая протеинкиназа (PKR). Примерами косвенных мишеней ингибитора сериновой/треониновой киназы являются (но не ограничиваясь только ими) МСР-1, NF-kappaB, е1F2альфа, СОХ2, RANTES, IL8, CYP2A5, IGF-1, CYP2B1, CYP2B2, CYP2H1, ALAS-1, HIF-1, эритропоэтин и/или CYP1A1. Примером ингибитора сериновой/треониновой киназы является (но не ограничиваясь только им) 2-аминопурин, известный также как 1Н-пурин-2-амин.
Понятие «ингибитор биосинтеза стеролов» контексте настоящего описания относится к соединению, которое ингибирует биосинтез стеролов, таких как холестерин. Примерами мишеней ингибитора биосинтеза стеролов являются (но не ограничиваясь только ими) эпоксидаза сквалена и CYP2D6. Примером ингибитора биосинтеза стеролов является (но не ограничиваясь только им) тербинадин.
Понятие «ингибитор топоизомеразы» включает ингибитор топоизомеразы I и топоизомеразы II. Примерами ингибиторов топоизомеразы I являются (но не ограничиваясь только ими) топотекан, гиматекан, иринотекан, камптотецин и его аналоги, 9-нитрокамптотецин и макромолекулярный конъюгат камптотецина PNU-166148 (соединение А1 в WO 99/17804); 10-гидроксикамптотецина ацетат; этопозид; идарубицина гидрохлорид; иринотекана гидрохлорид; тенипозид; топотекан, топотекана гидрохлорид; доксорубицин; эпирубицин, эпирубицина гидрохлорид; 4'-эпидоксорубицин, митоксантрон, митоксантрона гидрохлорид; даунорубицин, даунорубицина гидрохлорид, валрубицин и дасатиниб (BMS-354825). Иринотекан можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком CAMPTOSAR®. Топотекан можно использовать, например, в виде его имеющегося на рынке препарата, например, препарата, выпускаемого под товарным знаком HYCAMTIN®.
Под «ингибитором топоизомеразы II» в контексте настоящего описания подразумевают (но не ограничиваясь только ими) антрациклины, такие доксорубицин, включая его липосомный препарат, например, CAELYX®, даунорубицин, включая его липосомный препарат, например, DAUNOSOME®, эпирубицин, идарубицин и неморубицин; антрахиноны митоксантрон и лозоксантрон и подофиллотоксины этопозид и тенипозид. Этопозид можно использовать в виде его имеющегося на рынке препарата ETOPOPHOS®; тенипозид в виде VM 26-BRISTOL®; доксорубицин в виде ADRIBLASTIN® или ADRIAMYCIN®; эпирубицин в виде FARMORUBICIN®, идарубицин в виде ZAVEDOS®; и митоксантрон в виде NOVANTRON®.
Понятие «ингибитор тирозинкиназы VEGFR (рецепторной тирозинкиназы, тирозинкиназного рецептора VEGF)» в контексте настоящего описания относится к соединению, которое оказывает направленное воздействие, ослабляет или ингибирует известные ангиогенные факторы роста и цитокины, которые принимают участие в модуляции нормального и патологического ангионенеза. Семейство VEGF (VEGF-A, VEGF-B, VEGF-C, VEGF-D) и соответствующие им рецепторные тирозинкиназы [VEGFR-1 (Flt-1), VEGFR-2 (Flk-1, KDR) и VEGFR-3 (Flt-4)] играют первостепенную и исключительную роль в регуляции множества точек процессов ангиогенеза и лимфоангиогенеза. Примером ингибитора трирозинкиназы VEGFR является (но не ограничиваясь только им) 3-(4-диметиламинобензилиденил)-2-индолинон.
Соединения, которые оказывают направленное воздействие, ослабляют или ингибируют активность VEGFR, прежде всего соединения, белки или антитела, которые ингибируют рецепторную тиразинкиназу VEGF, ингибируют VEGF-рецептор или связываются с VEGF, и представляют собой прежде всего соединения, белки или моноклональные антитела в целом и конкретно описанные в WO 98/35958, например, 1-(4-хлоранилино)-4-(4-пиридилметил)фталазин или его фармацевтически приемлемую соль, например, сукцинат, или описанные в WO 00/09495, WO 00/27820, WO 00/59509, WO 98/11223, WO 00/27819 и ЕР0769947; например, описанные у М.Prewett и др., Cancer Research 59, 1999, cc.5209-5218, F.Yuan и др., Proc. Natl. Acad. Sci. USA,. 93, декабрь 1996 г., cc.14765-14770, Z.Zhu и др., Cancer Res. 58, 1998, cc.3209-3214 и J.Mordenti и др., в: Toxicologic Pathology, т.27, №.1, 1999, cc.14-21; в WO 00/37502 и WO 94/10202; ангиостатин, описанный у М.S.O'Reilly и др., Cell 79, 1994, cc.315-328; эндостатин, описанный у М.S.O'Reilly и др., Cell 88, 1997, cc.277-285; амиды антраниловой кислоты; ZD4190; ZD6474 (вандетаниб); SU5416; SU6668, AZD2171 (Recentin®); или антитела к VEGF, например антитело к VEGF-альфа танибизумаб (Lucentis®), или антитела к рецептору VEGF, например RhuMab (бевацизумаб, Avastin®). Под антителом подразумевают интактные моноклональные антитела, поликлональные антитела, мультиспецифические антитела, образованные по меньшей мере из двух интактных антител, и фрагменты антител, если они обладают требуемой биологической активностью. Примером ингибитора VEGF-R2 является, например, акситиниб.
Под понятием «агонист гонадорелина» подразумевают, например, такие соединения, как абареликс, гозерелин, гозерелина ацетат (ZOLADEX®).
Под понятием «соединение, индуцирующее процессы клеточной дифференцирован» подразумевают такие соединения, как ретиноевая кислота, альфа-, гамма- или 8-токоферол или альфа-, гамма- или 8-токотриенол.
Под понятием «бисфосфонаты» в контексте настоящего описания подразумевают (но не ограничиваясь только ими) этидроновую кислоту, клодроновую кислоту, тилудроновую кислоту, памидроновую кислоту, алендроновую кислоту, ибандроновую кислоту, ризедроновую кислоту и золедроновую кислоту.
Понятие «ингибитор гепараназы» относится к соединению (но не ограничиваясь только ими), которое предупреждает расщепление гепарансульфата, включая (но не ограничиваясь только им) PI-88.
Под понятием «модификатор биологического ответа» подразумевают (но не ограничиваясь только ими) лимфокины или интерфероны, например, интерферон альфа.
Под понятием «ингибитор теломеразы» подразумевают ингибиторы теломеразной активности, включая (но не ограничиваясь только им) теломестатин. Теломераза привлекает большой интерес в качестве мишени при поиске обладающих противораковой активностью средств, поскольку активность теломеразы присутствует в большинстве злокачественных клеток.
Под понятием «медиаторы, такие как ингибиторы катехол-O-метилтрансферазы» подразумевают (но не ограничиваясь только им) энтакапон.
Под понятием «иммуносупрессорное моноклональное антитело, например моноклональное антитело к рецепторам лейкоцитов или их лигандам» подразумевают (но не ограничиваясь только ими) антитела к
- CD20, такие как ритуксимаб (Rituxan®, ибритумомаба тиуксетан, конъюгированный с 111In или 90Y (Zevalin®), 131I-тозитимумаб (Bexxar®)), офтумумаб, окрелизумаб, hA20 (Immunomedics),
- CD22, такие как эпратузумаб, инотизумаба озогамицин (СМС544), CAT-3888,
- CD33, такое как гемтузумаб (Mylotarg®),
- CD52, например, алемтузумаб (Campath-I®),
- CD11a, например, эфализумаб (Raptiva®), и
- CD3, например, висиллзумаб.
Под понятием «соматостатин или аналог соматостатина» подразумевают (но не ограничиваясь только им) октреотид (Sandostatin® или Sandostatin LAR®).
Под понятием «антагонисты рецептора гормона роста» подразумевают (но не ограничиваясь только ими) пегвисомант, филгастим или пэгфилгастим или интерферон альфа.
Под понятием «моноклональные антитела, которые можно применять для лечения лейкоза (AML)» подразумевают (но не ограничиваясь только ими) алемтузумаб (Campath®), ритуксимаб/Rituxan®), гемтузумаб (озогамицин, Mylotarg®), эпратузумаб.
Под понятием «антитела к карциноэмбриональному антигену (СЕА)» подразумевают (но не ограничиваясь только ими) лапетузумаб, например, лапетузумаб-иттрий90, KSB-303, MFECP1, MFE-23.
Под понятием «ингибитор фосфодиэстеразы» подразумевают (но не ограничиваясь только им) анагрелид (Agrylin®, Xagrid®).
Под понятием «вакцина против рака» подразумевают вакцины, которые можно применять для лечения/предупреждения рака, и оно включает (но не ограничиваясь только ею) вакцину MDX-1379.
Под понятием «ингибиторы кинезинового белка митотического веретена (KSP)» подразумевают (но не ограничиваясь только им) испинесиб.
Под понятием «ингибиторы нескольких рецепторных тирозинкиназ, ассоциированных с ростом опухолей и ангиогенезом» подразумевают (но не ограничиваясь только им) сунитиниб (SU11248).
Под понятием «синтетические нестероидные эстрогены» подразумевают (но не ограничиваясь только им) диэтилстибестрол (DBS, Stilboestrol®)).
Под понятием «цитотоксические антинеопластические вещества» подразумевают (но не ограничиваясь только ими) алтретамин, амсакрин, аспарагиназу (Elspar®), пэгаспаргазу (ПЭГ-L-аспарагиназу, Oncaspar®)), денилеукина дифтитокс (Ontak®)) и масопрокол.
Под понятием «рекомбинантная связывающая молекула, имеющая по меньшей мере часть внеклеточного домена CTLA4, или ее мутант, или анти-CLA4 агент», например, включающая по меньшей мере внеклеточный фрагмент CTLA4 или ее мутанта, который соединен с последовательностью, не относящейся к белку CTLA4, такая как CTLA4Ig (например, обозначенная как АТСС 68629) или ее мутант, подразумевают (но не ограничиваясь только им) LEA29Y (белатацепт); под анти-CTLA4 агентом подразумевают (но не ограничиваясь только ими) ипилимумаб, тицилимумаб.
В каждом случае при упоминании заявок на патент или научных публикаций в настоящее изобретение в качестве ссылки на эти публикации включены прежде всего соответствующие заявляемые соединения и конечные продукты, которые получены согласно описанным в примерах методам, конечные продукты, которые являются объектами изобретения, фармацевтические препараты и формулы изобретения. Включены также соответствующие соли, стереоизомеры, а также соответствующие кристаллические модификации, например сольваты и полиморфы, например, описанные в указанных публикациях. Соединения, которые применяют в качестве действующих веществ в комбинациях, предлагаемых в настоящем изобретении, соответственно можно получать и применять согласно описанному в процитированных документах.
Данные о структуре действующих веществ, обозначенных кодовыми номерами, непатентованными названиями или торговыми наименованиями, можно получить в последнем издании стандартного справочника «The Merck Index» либо в базах данных, например в международных патентных базах данных, например в IMS World Publications, в Интернете или в упомянутых выше и ниже публикациях. Их соответствующее содержание включено в настоящее описание в качестве ссылки.
Следует понимать, что при ссылках на компоненты (а) и (б) подразумевают также фармацевтически приемлемые соли любого из действующих веществ. Если действующие вещества, представляющие собой компоненты (а) и/или (б) имеют, например, по меньшей мере один основный центр, то они могут образовывать кислотно-аддитивные соли. Можно получать также при необходимости соответствующие кислотно-аддитивные соли, которые имеют дополнительный основный центр. Действующие вещества, которые имеют кислотную группу, например, СООН, могут образовывать соли присоединения оснований. Действующие вещества, представляющие собой компоненты (а) и/или (б) или их фармацевтически приемлемые соли можно применять в форме сольвата, такого как гидрат, или других сольватов, образовавшихся при использовании применяемых для кристаллизации растворителей. 40-O-(2-гидроксиэтил)рапамицин является наиболее предпочтительным компонентом (а) комбинации.
III. Комбинации
Настоящее изобретение относится к комбинации:
(а) ингибитора mTOR; и
(б) фармацевтического действующего вещества.
Предпочтительным вариантом осуществления настоящего изобретения является комбинация, включающая:
(а) ингибитор mTOR; и
(б) одно или несколько фармацевтических действующих веществ, выбранных из группы, включающей стероид; ингибитор аденозинкиназы; адъювант; антагонист коркового вещества надпочечника; ингибитор AKT-пути; алкилирующий агент; ингибитор ангиогенеза; антиадроген; антиэстроген; агент против гиперкальциемии; антиметаболит; индуктор апоптоза; ингибитор aurora-киназы; ингибитор Брутоновской тирозинкиназы (BTK); ингибитор кальцинеурина; ингибитор СаМ-киназы II; ингибитор тирозинфосфатазы CD45; ингибитор фосфатазы CDC25; ингибитор киназы CHK; вещество, контролирующее регуляцию генистеина, оломуцина и/или тирфостинов; ингибитор циклооксигеназы; ингибитор cRAF-киназы; ингибитор циклинзависимой киназы; ингибитор цистеиновой протеазы; интеркалятор ДНК; вещество, расщепляющее цепь ДНК; ингибитор Е3-лигазы; эндокринный гормон; соединения, оказывающие направленное воздействие, снижающие или ингнбирующие активность семейства эпидермальных факторов роста; ингибитор тирозинкиназы EGFR, PDGFR; ингибитор фарнезилтрансферазы; ингибитор Flk-1-киназы; ингибитор киназы 3 гликогенсинтазы (GSK3); ингибитор гистондеацетилазы (HDAC); ингибитор HSP90; ингибитор 1-каппа-В-альфа-киназы (IKK); ингибитор инсулиновой рецепторной тирозинкиназы; киназный ингибитор N-концевой киназы c-Jun (JNK); вещество, связывающее микротрубочки; ингибитор активируемой митогеном протеин-(МАР)-киназы; ингибитор MDM2; ингибитор МЕК; ингибитор матриксной металлопротеиназы (ММР); ингибитор тирозинкиназы NGFR; ингибитор р38-МАР-киназы, включая ингибитор SAPK2/р38-киназы; ингибитор тирозинкиназы р56; ингибитор тирозинкиназы PDGFR; ингибитор фосфатидилинозитол-3-киназы; ингибитор фосфатазы; соединения платины; ингибитор протеинфосфатазы, включая ингибитор РР1 и РР2 и ингибитор тирозинфосфатазы; ингибитор РКС и ингибитор дельта-киназы РКС; ингибитор синтеза полиаминов; ингибитор протеосомы; ингибитор РТР1 В; ингибитор протеинтирозинкиназы, включая ингибитор семейства тирозинкиназ SRC; ингибитор тирозинкиназы Syk; и ингибитор тирозинкиназ JAK-2 и/или JAK-3; ретиноид; ингибитор элонгацией РНК-полимеразой II; ингибитор сериновой/треониновой киназы; ингибитор биосинтеза стеролов; ингибитор топоизомеразы; и ингибитор тирозинкиназы VEGFR; агонист гонадорелина; соединение, индуцирующее процессы клеточной дифференцировки; бисфосфонат; ингибитор гепараназы; модификатор биологического ответа; ингибитор теломеразы; медиаторы, такие как ингибиторы катехол-O-метилтрансферазы; иммуносупрессорное моноклональное антитело, например, моноклональное антитело к рецепторам лейкоцитов, соматостатин или аналог соматостатина; антагонисты рецептора гормона роста; моноклональные антитела, которые можно применять для лечения лейкоза (AML); антитела к карциноэмбриональному антигену (СЕА); ингибитор фосфодиэстеразы; вакцину против рака; ингибиторы кинезинового белка митотического веретена (KSP); ингибиторы нескольких рецепторных тирозинкиназ, ассоциированных с ростом опухолей и ангиогенезом; синтетические нестероидные эстрогены; цитотоксические антинеопластические вещества и рекомбинантную связывающую молекулу, имеющая по меньшей мере часть внеклеточного домена CTLA4, или ее мутант.
Другим предпочтительным вариантом осуществления настоящего изобретения является комбинация, включающая:
(а) ингибитор mTOR; и
(б) одно или несколько фармацевтических действующих веществ, выбранных из группы, включающей:
преднизон; 5-лодотуберцидин; леуковорин; левамизол; митотан; дегуелин; трицирибин; KP372-1 (QLT394), хлорамбуцил; хлорметин, циклофосфамид, ифосфамид, мелфалан, эстрамустин; кармустин; фотемустин, ломустин, стрептозоцин, стрептозотоцин, дакарбазин; прокарбазин; прокарбазина гидрохлорид, мехлорэтамин, мехлорэтамина гидрохлорид, тиотепа; темозоломид; митомицин; алтретамин; бусульфан; нитрозомочевину; эстрамустин, урамустин, глиадел; азотные производные горчичного газа, фумагиллин; шиконин; траниласт; урсоловая кислота; сурамин; бенгамид, TNP-470, талидомид, нилутамид; бикалутамид; торемифен; летрозол; тестолактон; анастрозол; бикалутамид; флутамид; тамоксифен, тамоксифена цитрат; экземестан; фулвестрант; ралоксифен; ралоксифена гидрохлорид; атаместан, форместан, аминоглутетимид, роглетимид, пиридоглутетимид, трилостан, кетоконазол, ворозол, фадрозол, гидрат нитрата галлия(III); динатриевая соль памидроната; 6-меркаптопурин; цитарабин; флударабин; флексуридин; фторурацил; 5-фторурацил, флоксуридин, капецитабин; ралтитрексед; метотрексат; кладрибин; гемцитабин; гемцитабина гидрохлорид; тиогуанин, 6-тиогуанин, гидроксимочевинц; 5-азацитидин, децитабин; эдатрексат; перметрексед, пеметрексед, клофарабин; неларабин, тиазофурин, пентостатин, дезоксикоформицин; фторметилена дезоксицитидин, 5-аза-2'-дезоксицитидин, троксацитабин, 2-[[3-(2,3-дихлорфенокси)пропил]амино]этанол; гамбоговую кислоту; эмбелин; триоксид мышьяка; бинуклеин 2; терреиновую кислоту; циперметрин; дельтаметрин; фенвалерат; тирфостин 8; 4-[(2S)-2-[(5-изохинолинсульфонил)метиламино]-3-оксо-3-(4-фенил-1-пиперазинил)пропил]фениловый эфир 5-изохинолинсульфоновой кислоты; N-[2-[[[3-(4-хлорфенил)-2-пропенил]метил]амино]метил]фенил]-N-(2-гидроксиэтил)-4-метоксибензолсульфонамид; [[2-(4-бромфенокси)-5-нитрофенил]гидроксиметил]фосфиновая кислота; 2,3-бис[(2-гидроксиэтил)тио]-1,4-нафиалиндион; дебромгимениалдисин; даидзеин; изооломоуцин, тирфостин 1, 1Н-индол-3-ацетамид 1-(4-хлорбензоил)-5-метокси-2-метил-N-(2-фенилэтил)-5-алкилзамещенной 2-ариламинофенилуксусной кислоты и его производные, целекоксиб, рофекоксиб, эторикоксиб, вальдекоксиб; 5-алкил-2-ариламинофенилуксусную кислоту, 5-метил-2-(2'-хлор-6'-фторанилино)фенилуксусную кислоту, лумиракоксиб; 3-(3,5-дибром-4-гидроксибензилиден)-5-йод-1,3-дигидроиндол-2-он; и бензамид 3-(диметиламино)-N-[3-[(4-гидроксибензоил)амино]-4-метилфенила]; N9-изопропилоломоуцин; оломоуцин; пурваланол В, роасковитин; индирубин, кенпауллон, пурваланол А, индирубин-3'-монооксим, N-[(1S)-3-фтор-2-оксо-1-(2-фенилэтил)пропил]амино]-2-оксо-1-(фенилметил)этил]-4-морфолинкарбоксамид, пликамицин; дактиномицин; блеомицин; N-((3,3,3-трифтор-2-трифторметил)пропионил)сульфаниламид; леупролид; мегестрол, мегестрола ацетат; лапатиниб, лапатиниба дитосилат; панитузумаб, трастузумаб, цетуксимаб, иресса, OSI-774, CI-1033, EKB-569, GW-2016, 7Н-пирроло-[2,3-d]пиримидин, ватаналиб, эрортиниб, гефитиниб, залутумумаб, тирфостин 23, тирфостин 25, тирфостин 47, тирфостин 51 и тирфостин AG 825, 2-(2Е)-2-циан-3-(3,4-дигидроксифенил)-Н-фенил-2-пропенамид; тирфостин Ag 1478; лавендустин А; (αZ)-α-[(3,5-дихлорфенил)метилен]-3-пиридинацетонитрил (9CI), тирфостин 46, гидроксифарнезилфосфоновую кислоту; (2S)-1-метилэтиловый эфир 2-[[(2S)-2-[[(2S,3S)-2-[[(2R)-2-амино-3-меркаптопропил]амино]-3-метилпентил]окси]-1-оксо-3-фенилпропил]амино]-4-(метилсульфонил)масляной кислоты; манумицин A; L-744,832, DK8G557, типифарниб, лонафарниб, BMS-214662, 2-циан-3-[4-гидрокси-3,5-бис(1-метилэтил)фенил]-N-(3-фенилпропил)-(2Е)-2-пропенамид; индирубин-3'-монооксим; N-гидрокси-3-[4-[[(2-гидроксиэтил)[2-(1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамид, N-гидрокси-3-[4-[[[2-(2-метил-1Н-индол-3-ил)этил]амино]метил]фенил]-2Е-2-пропенамид; субероиланилидгидроксамовую кислоту; пиридин-3-илметиловый эфир[4-(2-аминофенилкарбамоил)бензил]карбаминовой кислоты и их производные; масляную кислоту, пироксамид, оксамфлатин, апицидин, депсипептид; трапоксин, депудецин; трапоксин, циклический тетрапептид (цикло[пролил-алинилаланил-2-амино-8-оксо-9,10-эпоксидеканоил]); НС-токсин, натрия фенилбутират, субероил-бисгидроксамовая кислота, трихостатин А, BMS-27275, пироксамид, FR-901228, валпроевую кислоту, гелдамицин, производные гелданамицина; 17-аллиламино-17-деметоксигелданамицин (17AAG), 17-деметокси-17-(2-пропениламино)гелданамицин, радицикол, нилотиниб, 3-[(4-метилфенил)сульфонил]-(2Е)-2-пропеннитрил, гидроксил-2-нафталенилметилфосфоновую кислоту; LY 294002, пиразолантрон; эпиналлокатехина галлат; винбластин, винбластина сульфат; винкристин, винкристина сульфат; виндесин; винорелбин; доцетаксел; паклитаксел; дискрдермолиды; кохицин и эпотилоны и их производные, эпотилон В или его производные; N-[2-[[[3-(4-хлорфенил)-2-пропенил]метил]амино]метил]фенил]-N-(2-гидроксиэтил)-4-метоксибензолсульфонамид; транс-4-йод-4'-боранилхалкон; сорафениб, сорафениба тозилат, бутандинитрил, бис[амино[2-аминофенил)тио]метилен]бутандинитрил, актинонин, эпиналлокатехина галлат; батимастат; маримастат, приномастат, метастат, неовастат, таномастат, ТАА211, MMI270B, BMS-279251, BAY12-9566, AAJ996, MMI270B; тирфостин AG 879; 4-[4-(4-фторфенил)-5-(4-пиридинил)-1Н-имидазол-2-ил]фенол; 3-(диметиламино)-Н-[3-[(4-гидроксибензоил)амино]-4-метилфенил]бензамид; 9,10-дигидро-3-гидрокси-1-метокси-9,10-диоксо-2-антраценкарбоксальдегид; тирфостин 46; тирфостин AG 1296; тирфостин 9; 2-амино-4-(1Н-индол-5-у1)-1,3-бутадиен-1,1,3-трикарбонитрил; иматиниб, IRESSA®, вортманнин, кверцетин, кверцетина дегидрат, кантаридиновую кислоту; кантаридин; и (E)-N-[4-(2-карбоксиэтенил)бензоил]глицил-L-α-глутамил-L-лейцинамид; карбоплатин; цисплатин; оксалиплатин; цисплатину; сатраплатин ZD 0473, BBR3464, L-P-бромтетрамизола оксалат; (5R)-4-гидрокси-5-(гидроксиметил)-3-(1-оксогексадецил)-2(5Н)-фуранон; бензилфосфоновую кислоту; 3-[1-[3-(диметиламино)пропил]-1Н-индол-3-ил]-4-(1Н-индол-3-ил)-1-Н-пирроло-2,5-дион; бисиндолилмалеимид IX; сфингозин, стауроспорин, тирфостин 51; гиперицин, UCN-01, сафингол, BAY 43-9006, бриостатин 1, перифозин; илмофозин; RO 318220, RO 320432; GO 6976; Isis 3521; LY333531/LY379196, роттлерин; DMFO; аклацитомицин А; глиотоксин; PS-341; MLN 341; бортезомиб, Velcade®; (Е)-N-[4-(2-карбоксиэтенил)бензоил]глицил-L-α-глутамил-L-лейцинамид; тирфостин AG 126; тирфостин Ag 1288; тирфостин Ag 1295; гелдамицин; генистеин, РР1; РР2; пицеатаннол, тирфостин AG 490; 2-нафтилвинилкетон; PD180970; AG957; NSC 680410, изотретиноин, третиноин, алитретиноин, бексаротрен, изотретиноин (13-цис-ретиноевая кислота), 5,6-дихлор-1-бета-В-рибофуранозилбензимидазол; 2-аминопурин; тербинадин; гиматекан, иринотекан, камптотецин, 9-нитрокамптотецин PNU-166148, 10-гидроксйкамптотецина ацетат; этопозид; идарубицин, идарубицина гидрохлорид; иринотекан, иринотекана гидрохлорид; тенипозид; топотекан, топотекана гидрохлорид; доксорубицин; эпирубицин, эпирубицина гидрохлорид; 4'-эпидоксорубицин, митоксантрон, митоксантрона гидрохлорид; даунорубицин, даунорубицина гидрохлорид, валрубицин, дасатиниб, BMS-354825, доксорубицин, CAELYX®, DAUNOSOME®, неморубицин; митоксантрон; лозоксантрон; этопозид; тенипозид; 3-(4-диметиламинобензилиденил)-2-индолинон, 1-(4- хлоранилино)-4-(4-пиридилметил)фталазин, ангиостатин, ZD 4190; ZD 6474, вандетаниб; SU5416; SU6668, AZD2171, Recentin®; танибизумаб, бевацизумаб, Avastin®; абареликс, гозерелин, гозерелина ацетат, ретиноевую кислоту, альфа-, гамма или 8-токоферол или альфа-, гамма- или 8-токотриенол; этидроновую кислоту, клодроновую кислоту, тилудроновую кислоту, памидроновую кислоту, алендроновую кислоту, ибандроновую кислоту, ризедроновую кислоту и золедроновую кислоту, PI-88, интерферон альфа, теломестатин, энтакапон, ритуксимаб, ибритумомаба тиуксетан, конъюгированный с 111In или 90Y, 131I-тозитимумаб, офтумумаб, окрелизумаб, hA20 от фирмы Immunomedics, эпратузумаб, инотизумаб озогамицин, CAT-3888, гемтузумаб, алемтузумаб, эфализумаб, висиллзумаб, октреотид, Sandostatin®, Sandostatin LAR®), пегвисомант, филгастим или пэгфилгастим, алемтузумаб, эпратузумаб, лапетузумаб, лапетузумаб-иттрий 90, KSB-303, MFECP1, MFE-23, анагрелид, MDX-1379, испинесиб, сунитиниб, диэтилстибестрол, алтретамин, амсакрин, аспарагиназу, пэгаспаргазу, денилеукина дифтиток, масопрокол, LEA29Y, белатацепт; ипилимумаб и тицилимумаб.
Предпочтительным вариантом осуществления настоящего изобретения является комбинация, включающая:
(а) ингибитор mTOR формулы I; и
(б) одно или несколько фармацевтических действующих веществ, выбранных из группы, включающей стероид, алкилирующий агент; антиметаболит; вещество, связывающее микротрубочки; ингибитор фосфатидинилинозитол-3-киназы; соединение платины; ингибитор синтеза полиаминов; ингибитор семейства тирозинкиназ SRC; и ингибитор топоизомеразы.
Другим предпочтительным вариантом осуществления настоящего изобретения является комбинация, включающая:
(а) ингибитор mTOR формулы I; и
(б) одно или несколько фармацевтических действующих веществ, выбранных из группы, включающей преднизон, тиотепа; N1,N12-диэтилспермин · 4HCl, 8-фенил-2-(морфолин-4-ил)хромен-4-он, 3-(4-хлорфенил)-1-(1,1-диметилэтил)-1Н-пиразоло[3,4-d]пиримидин-4-амин (9CI), цитарабин; кладрибин; виндесина сульфат; винорелбин; карбоплатин; идарубицина гидрохлорид; и митоксантрона гидрохлорид.
Предпочтительным вариантом осуществления настоящего изобретения является комбинация, включающая:
(а) 40-O-(2-гидроксиэтил)рапамицин; и
(б) одно или несколько фармацевтических действующих веществ, выбранных из группы, включающей стероид, алкилирующий агент; антиметаболит; вещество, связывающее микротрубочки; ингибитор фосфатидинилинозитол-3-киназы; соединение платины; ингибитор синтеза полиаминов; ингибитор семейства тирозинкиназ SRC; и ингибитор топоизомеразы.
Другим предпочтительным вариантом осуществления настоящего изобретения является комбинация, включающая:
(а) 40-O-(2-гидроксиэтил)рапамицин; и
(б) одно или несколько фармацевтических действующих веществ, выбранных из группы, включающей преднизон, тиотепа; N1,N12-диэтилспермин·4HCl, 8-фенил-2-(морфолин-4-ил)хромен-4-он, 3-(4-хлорфенил)-1-(1,1-диметилэтил)-1Н-пиразоло-[3,4-d]пиримидин-4-амин, цитарабин; кладрибин; виндесина сульфат; винорелбин; карбоплатин; идарубицина гидрохлорид; и митоксантрона гидрохлорид.
Любую комбинацию компонентов (а) и (б), способ лечения теплокровного животного, заключающийся в том, что вводят эти два компонента, фармацевтическую композицию, содержащую эти два компонента, которая предназначена для одновременного, раздельного или последовательного применения, применение комбинации для замедления развития или лечения пролиферативного заболевания или для приготовления фармацевтического препарата для этих целей или поступающий в продажу продукт, который содержит указанную комбинацию компонентов (а) и (б), которые все упомянуты или указанны выше, далее обозначают также как КОМБИНАЦИЯ, ПРЕДЛАГАЕМАЯ В ИЗОБРЕТЕНИИ (т.е. это понятие относится к каждому из вариантов осуществления изобретения, которым, таким образом, можно при необходимости заменять указанное понятие).
Следующим объектом настоящего изобретения является применение комбинации, предлагаемой в настоящем изобретении.
IV. Введение
Одновременное введение можно, например, осуществлять в форме одной фиксированной комбинации, которая содержит два или большее количество действующих веществ, или путем одновременного введения двух или большего количества действующих веществ в виде независимых препаратов. Последовательное применение (введение) предпочтительно обозначает введение одного (или нескольких) компонента(ов) комбинации в один момент времени, других компонентов в другой момент времени, т.е. в хронологическом порядке, предпочтительно таким образом, чтобы комбинация проявляла более высокую эффективность, чем эффективность индивидуальных соединений при их независимом введении (прежде всего обладала синергетическим действием). Раздельное применение (введение) предпочтительно означает введение компонентов комбинации независимо друг от друга в различные моменты времени, предпочтительно означает, что компоненты (а) и (б) вводят так, чтобы измеряемые уровни в крови обоих соединений одновременно (в один и тот же момент времени) не перекрывались.
Кроме того, возможны комбинации двух или большего количества последовательных, раздельных или одновременных введений, предпочтительно таким образом, чтобы комбинация представляющих собой лекарственные средства компонентов обладала совместным терапевтическим действием, превышающим действие, обнаруженное, когда комбинацию представляющих собой лекарственные средства компонентов применяют независимо с временными интервалами столь длительными, чтобы не проявлялось взаимное влияние на их терапевтическую эффективность, наиболее предпочтительным является синергетическое действие.
Понятие «замедление развития» в контексте настоящего описания относится к введению комбинации пациентам на предшествующей стадии или на ранней фазе первого обнаружения болезни или рецидива болезни, подлежащей лечению, где у пациентов диагностирована предшествующая форма соответствующей болезни или где пациенты находятся в состоянии, например, в процессе медицинского лечения, или состоянии, которое является результатом осложнения, при котором есть вероятность развития соответствующей болезни.
«Совместная терапевтическая активность» или «совместное терапевтическое действие» означает, что соединения можно применять раздельно (в хронологическом порядке, прежде всего в определенные последовательные моменты времени) через такие временные интервалы, что они все еще обладают предпочтительно для теплокровного животного, прежде всего человека, подлежащего лечению (предпочтительно синергетическим) взаимодействием (совместное терапевтическое действие). Имеет ли место это взаимодействие можно среди прочего определять по уровням в крови, свидетельствующих о том, что оба соединения присутствуют в крови человека, подлежащего лечению, в течение по меньшей мере определенных интервалов времени.
«Фармацевтически эффективное» предпочтительно относится к количеству, которое является терапевтическим или в более широком смысле является также профилактически эффективным в отношении развития пролиферативного заболевания.
V. Товарная упаковка
Понятие «торговая упаковка» или «продукт» или «фармацевтическая упаковка» в контексте настоящего описания означает прежде всего «состоящий из компонентов набор» в том смысле, что указанные выше компоненты (а) и (б) можно применять в виде независимых дозируемых форм или в виде различных фиксированных комбинаций с использованием различных количеств компонентов (а) и (б), т.е. одновременно или в различные моменты времени. Кроме того, эти понятия включают товарную упаковку, которая содержит (прежде всего в сочетании) в качестве действующих веществ компоненты (а) и (б) вместе с инструкциями по одновременному, последовательному (в хронологическом порядке, предпочтительно в определенные последовательные моменты времени) или (что является менее предпочтительным) их раздельному применению для замедления развития или лечения пролиферативного заболевания. Компоненты, состоящие из компонентов набора, затем можно, например, вводить одновременно или в хронологическом порядке, т.е. в различные моменты времени и одинаковыми или различными временными интервалами для каждого компонента, состоящего из компонентов набора. Наиболее предпочтительно временные интервалы выбирают таким образом, чтобы действие на подлежащее лечению заболевание при совместном применении компонентов было выше, чем действие, которое можно получать при индивидуальном применении любого из компонентов (а) и (б) комбинации (что можно определять стандартными методами). Соотношение общих количеств компонента (а) комбинации и компонента (б) комбинации, подлежащих введению в виде комбинированного препарата, может варьироваться, например, для того, чтобы удовлетворять потребностям подлежащей лечению субпопуляции пациентов или потребностям конкретного пациента, различные потребности могут быть связаны с конкретным заболеванием, возрастом, полом, весом тела и т.д. пациентов. Предпочтительно получают по меньшей мере одно благоприятное действие, например, общее повышение действия комбинации компонентов (а) и (б), прежде всего достижение действия, превышающего аддитивное, для чего можно использовать более низкие дозы каждого из входящих в комбинацию лекарственных средств соответственно по сравнению с переносимостью в случае лечения только индивидуальными лекарственными средствами без использования их комбинации, получение дополнительных благоприятных действий, например снижение побочных воздействий или объединенный терапевтический эффект при использовании неэффективных доз одного или обоих партнеров (компонентов) (а) и (б), и наиболее предпочтительно получение выраженного синергизма при использовании компонентов комбинации (а) и (б).
Как в случае применения комбинации компонентов (а) и (б), так и товарной упаковки, также можно использовать любое сочетание одновременного, последовательного или раздельного применения, т.е. компоненты (а) и (б) можно вводить одновременно в один и тот же момент времени с последующим введение только одного компонента, снижая тем самым токсичность для хозяина, либо в хронологическом порядке, например, в течение более 3-4 недель с ежедневным введением в более поздний момент времени и последовательно с другим компонентом или комбинацией обоих компонентов в еще более поздний момент времени (согласно последовательному курсу лечения с использованием комбинации лекарственных средств для получения оптимального противоракового действия) или т.п.
КОМБИНАЦИЮ, ПРЕДЛАГАЕМУЮ В ИЗОБРЕТЕНИИ, можно применять также в сочетании с другими видами лечения, такими, например, как общепринятые виды лечения, применяемые для предупреждения или лечения пролиферативных заболеваний, например, хирургическое вмешательство, гипертермия и/или лучевая терапия.
VI. Фармацевтические композиции и препараты
Фармацевтические композиции, предлагаемые в настоящем изобретении, можно получать общепринятыми методами, и они пригодны для энтерального, такого как оральное или ректальное, и парентерального введения млекопитающим, включая человека, содержат в терапевтически эффективном количестве ингибитор VEGF и по меньшей мере одно фармацевтическое действующее вещество индивидуально или в сочетании с одним или несколькими фармацевтически приемлемыми носителями, прежде всего пригодными для энтерального или парентерального введения.
Фармацевтические композиции содержат действующее вещество в концентрации от примерно 0,00002 до примерно 100%, прежде всего (например, в случае разведении для инфузии, готовых к применению) от 0,0001 до 0,2%, или, например, а случае концентратов для инъекции или инфузии или прежде всего парентеральных составов, от примерно 0,1 до примерно 95%, предпочтительно от примерно 1 до примерно 90%, более предпочтительно от примерно 20 до примерно 60% (в каждом случае мас.%).
Фармацевтические композиции, предлагаемые в изобретении, могут, например, представлять собой стандартные дозы, например, в форме ампул, пузырьков, драже, таблеток, мешков для инфузии или капсул.
Эффективная доза каждого из компонентов комбинации, применяемых в препарате, предлагаемом в настоящем изобретении, может варьироваться в зависимости от конкретного применяемого соединения или фармацевтических композиций, пути введения, состояния, подлежащего лечению, и серьезности состояния, подлежащего лечению. Обычный лечащий врач, клиницист или ветеринар легко может определить эффективное количество каждого из действующих веществ, необходимое для предупреждения, лечения или ингибирования развития состояния.
Однако, в целом, удовлетворительные результаты для крупных млекопитающих, например, людей, получают с использование указанных суточных доз, находящихся в пределах
- от примерно 0,0001 до примерно 1,5 г, например, от 0,001 до 1,5 г;
- от примерно 0,001 до примерно 20 мг/кг веса тела, например, от 0,01 до 20 мг/кг веса тела,
например, при введении в виде разделенных доз вплоть до 4 раз в день.
В комбинации, предлагаемой в настоящем изобретении, рапамицин или производное рапамицина можно вводить при необходимости в дозах, которые, например, известны для соединений, предлагаемых в настоящем изобретении, с помощью любого пути введения, например, энтерально, например, орально или парентерально. Например, эверолимус можно вводить, например, орально, в дозах от 0,1 вплоть до 15 мг, в частности от 0,1 до 10 мг, например 0,1, 0,25, 0,5, 0,75, 1, 2,5, 5 или 10 мг, более предпочтительно от 0,5 до 10 мг, например в форме (диспергируемых) таблеток; которые, например, содержат эверолимус в форме твердой дисперсии; например, недельная доза может включать вплоть до 70 мг, например от 10 до 70 мг, в частности от 30 до 50 мг, например, в зависимости от заболевания, подлежащего лечению.
Фармацевтические препараты для комбинированной терапии, которые предназначены для энтерального или парентерального введения, представляют собой, например, препараты в виде стандартных доз лекарственного средства, такие как таблетки с сахарным покрытием, капсулы или суппозитории, а также ампулы. Если не указано иное, то эти формы получают общепринятыми методами, например, с помощью общепринятых процессов смешения, грануляции, нанесения сахарного покрытия, растворения или лиофилизации. Следует учитывать, что количество в стандартной дозе компонента комбинации в индивидуальной дозе не обязательно само по себе должно представлять собой эффективное количество, поскольку для достижения необходимого эффективного количества можно использовать несколько стандартных доз лекарственного средства. Специалист в данной области можетопределять соответствующие фармацевтически эффективные количества компонентов комбинации.
Предпочтительно соединения или их фармацевтически приемлемые соли вводят в виде оральной фармацевтической формы в виде таблетки, капсулы или сиропа; или при необходимости в виде парентеральных инъекций.
Для приготовления композиций для орального введения можно применять любые фармацевтически приемлемые среды, такие как вода, гликоли, масла, спирты, корригенты, консерванты, красители. Фармацевтически приемлемые носители включают крахмалы, сахара, микрокристаллические целлюлозы, разбавители, гранулирующие вещества, замасливатели, связующие агенты, разрыхлители.
Для парентерального введения действующего вещества пригодны растворы действующих веществ, а также суспензии, и прежде всего изотонические водные растворы или суспензии, такие растворы или суспензии можно приготавливать перед применением, например, в случае лиофилизированных композиций, которые содержат действующее вещество индивидуально или в сочетании с фармацевтически приемлемым носителем, например, маннитом. Фармацевтические композиции могут быть стерильными и/или могут содержать эксципиенты, например, консерванты, стабилизаторы, смачивающие и/или эмульгирующие агенты, солюбилизаторы, соли для регулирования осмотического давления и/или буферы, и их приготавливают с помощью хорошо известных методов, например, с помощью общепринятых процессов растворения или лиофилизации. Растворы или суспензии могут содержать повышающие вязкость субстанции, такие как натриевая соль карбоксиметилцеллюлозы, карбоксиметилцеллюлозу, декстран, поливинилпирролидон или желатин. Суспензии в масле содержат масляный компонент, такой как растительные, синтетические или полусинтетические масла, пригодные для инъекции.
Придающий изотоничность агент можно выбирать из известных в данной области соединений, таких, например, как маннит, декстроза, глюкоза и хлорид натрия. Формы для инфузии можно разводить водной средой. Количество водной среды, применяемой в качестве разбавителя, выбирают в зависимости от требуемой концентрации действующего веществ в растворе для инфузии. Растворы для инфузии могут содержать другие эксципиенты, которые обычно применяют в составах, подлежащих внутривенному введению, такие как антиоксиданты.
Настоящее изобретение относится также к «комбинированному препарату», который в контексте настоящего описания относится, прежде всего, к «состоящему из компонентов набору» в том смысле, что указанные выше компоненты (а) и (б) комбинации можно дозировать независимо друг от друга или применять в виде различных фиксированных комбинаций с различными количествами компонентов (а) и (б) комбинации, т.е. одновременно или в различные моменты времени. Затем компоненты состоящего из компонентов набора можно, например, вводить одновременно или в хронологическом порядке, т.е. в различные моменты времени и с равными или различными интервалами для любого компонента, состоящего из компонентов набора. Соотношение общих количеств компонента (а) комбинации и компонента (б) комбинации, подлежащих введению в виде комбинированного препарата, может варьироваться, например, для того, чтобы удовлетворять потребностям подлежащей лечению субпопуляции пациентов или потребностям конкретного пациента, с учетом серьезности любых побочных действий, характерных для пациента.
Настоящее изобретение относится, прежде всего, к комбинированному препарату, который содержит:
(а) одну или несколько стандартных доз лекарственных форм ингибитора mTOR; и
(б) одну или несколько стандартных доз лекарственных форм фармацевтического действующего вещества.
VII. Болезни, подлежащие лечению
Композиции, предлагаемые в настоящем изобретении, можно применять для лечения пролиферативных заболеваний или заболеваний, которые ассоциированы или инициируются постоянным ангиогенезом.
Пролиферативное заболевание представляет собой главным образом опухолевое заболевание (или рак) (и/или любые метастазы). Композиции, предлагаемые в изобретении, наиболее целесообразно применять для лечения опухоли, представляющей собой рак молочной железы, рак мочеполовой системы, рак легкого, желудочнокишечный рак, эпидермоидный рак, меланому, глиому, рак яичника, рак поджелудочной железы, нейробластому, рак головы и/или шеи или рак мочевого пузыря, или в более широком смысле почечный рак, рак головного мозга или рак желудка.
В частности, композиции, предлагаемые в изобретении, наиболее целесообразно применять для лечения:
(I) опухоли молочной железы; опухоли легкого, например, мелкоклеточного или немелкоклеточного рака легкого; меланомы; или
(II) пролиферативного заболевания, невосприимчивое к лечению другими химиотерапевтическими средствами; или
(III) опухоли, невосприимчивой к лечению другими химиотерапевтическими средствами из-за устойчивости к нескольким лекарственным средствам.
При упоминании опухоли, связанной с опухолью болезни, рака или карциномы альтернативно или дополнительно подразумевают также метастазы в исходный орган или ткань и/или в любую другую область вне зависимости от локализации опухоли и/или метастазов.
Композиции обладают избирательной токсичностью или обладают более высокой токсичностью в отношении быстро пролиферирующих клеток, чем в отношении здоровых клеток, прежде всего человеческих раковых клеток, например злокачественных опухолей, соединение обладает выраженным антипролиферативным действием и стимулирует дифференцировку, например прекращает клеточный цикл и апоптоз.
Ниже изобретение проиллюстрировано на примерах.
В приведенных ниже примерах описаны комбинации, содержащие 40-O-(2-гидроксиэтил)рапамицин, которые обладают синергетическим действием. Для оценки всех комбинаций в качестве компонентов исследования использовали три (3) различные клеточные линии, предоставленные в рамках данной совместной работы: А549, модель немелкоклеточной карциномы легкого; SKOV-3, модель рака яичника; и SKMEL-28, модель злокачественной меланомы.
В одном примере обнаружено синергетическое действие 40-O-(2-гидроксиэтил)рапамицина и винорелбин на А549-клетках. При использовании этой комбинации обнаружено повышение максимального действия по сравнению с активностью любого из агентов при их индивидуальном применении.
В другом примере обнаружено синергетическое действие 40-O-(2-гидроксиэтил)рапамицина и 8-фенил-2-(морфолин-4-ил)хромен-4-она на А549-клетках. Обнаружено выраженное потенциирование активности 8-фенил-2-(морфолин-4-ил)хромен-4-она при добавлении 40-O-(2-гидроксиэтил)рапамицина.
Все предназначенные для оценки комбинации приготавливали одинаковым образом.
Условия анализов и протоколы
День 1: Получение клеток
Клетки культивировали в колбах типа Т-175 в полной среде (RPMI-1640, 10% ФБС, 1% Penn/Strep) при 37°С и 5% CO2. Клетки отделяли от колб путем кратковременной обработки 0,25% трипсина. Трипсин инактивировали средами или количество клеток соответствующим образом регулировали. Затем клетки высевали в 384-луночные титрационные микропаншеты (35 мкл) из расчета 1500 (А549) или 3000 (SKOV-3, SKMEL-28) клеток/лунку с помощью высокоскоростного автоматического дозатора типа Multidrop за 16-24 ч до добавления соединения с целью осуществления общего скрининга. Засеянные планшеты инкубировали (37°С / 5% СО2) в течение ночи для восстановления и повторного прикрепления.
День 2: Добавление соединений
Планшеты для разбавлений представляли собой полипропиленовые 384-луночные планшеты, содержащие по 100 мкл/лунку полной среды, не содержащей клеточную культуру. Соединения добавляли (по 1 мкл) в планшеты для разбавлений с помощью устройства типа Mini-Trak для создания разведения 1:101 и затем перемешивали. Для получения кривых «доза-ответ» (дозовой зависимости) для индивидуального вещества аликвоты по 5 мкл из планшета для разбавления добавляли в планшет для анализа для построения по 11 точкам кривой дозовой зависимости (конечный объем 40 мкл). Конечное разведение составляло ~1:808, при этом общая концентрация растворителя составляла ~0,1%. Для создания матриц комбинаций добавляли аликвоты по 4,5 мкл из планшетов для разбавления из ортогонально титрованных мастер-планшетов в один и тот же планшет для анализа, создавая матрицы «доза-ответ» (конечный объем 44 мкл). Конечное разведение каждого соединения составляло ~1:988, при этом общая концентрация растворителя составляла ~0,2%. После добавления соединений планшеты инкубировали при 37°С/5% СО2 в течение 72 ч.
День 5: Оценка жизнеспособности клеток
5%-ный раствор предназначенного для определения жизнеспособности красителя CellTiter-Blue (фирма Promega) в полной среде вносили в планшеты для анализа с помощью высокоскоростного автоматического дозатора типа Multidrop или 384-луночного пипеттора. Краситель добавляли в соответствующем объеме до получения конечной концентрации красителя 2,5%. Реакционные смеси, в которых оценивали жизнеспособность, инкубировали в течение 4-6 ч в зависимости от типа клеток при 37°С / 5% CO2, давая восстановиться красителю, предназначенному для определения жизнеспособности. Планшетам давали охладиться до комнатной температуры в течение 1 ч перед измерением с помощью планшет-ридера типа Wallac Victor-V интенсивности флуоресценции при 590 нм после возбуждения при длине волны 540 нм.
ОС-критерии (критерии качества)
Первичный QC-статус планшетов
Для автоматического контроля качества использовали cHTS-форматы для планшетов, включающие группы лунок для позитивного и негативного внутрипланшетного контроля, которые использовали для автоматического контроля качества. Во всех планшетах для анализов автоматически определяли уровень QC с помощью LIM (лабораторная информационная система для контроля качества) после сбора данных. Запросы автоматического контроля качества делали на основе Z-фактора, рассчитанного с использованием внутрипланшетных контролей согласно стандартной формуле для фактора: Z=1-3(_V+_U)/(V-U), где V, U обозначают средние контрольные уровни для наполнителя (вариант с обработкой) и сред (вариант без обработки), _V, _U обозначают соответствующие оценки стандартного отклонения. Пороги Z-фактора устанавливали эмпирически для того, чтобы сгруппировать планшеты в три класса: автоматически принятые (Z>0,6), автоматически отвергнутые (Z<0,4) и неопределенные планшеты, которые следует оценивать визуально (0,4<Z<0,6). При необходимости QC-статус принятых планшетов можно переопределять на основе визуальной оценки качества планшета, контролей переноса или других вторичных QC-критериев. Планшеты, отвергнутые автоматически или в результате визуальной оценки, исключали из дальнейшего анализа и планировали повторение соответствующих им режимов.
Контроли переноса
Применяемое в качестве позитивного контроля соединение (Gentian Violet) включали во все мастер-планшеты. Это обеспечивало визуальный контроль для осуществлявших скрининг исследователей, подтверждающий, что соединение перенесено и из колонок и из рядов мастер-планшетов в планшет для анализа.
Вторичный QC
Вторичный QC включал дополнительную проводимую вручную оценку качества данных, в том числе: визуальную оценку качества планшетов и контролей переноса, выявление выбросов данных и оценку соответствующей для клеточной линии эффективности индивидуальных агентов. Планшетам, имеющим статус принятых на основе первичного QC, для которых обнаружен несоответствующий планшетный градиент, присваивали статус отвергнутых и подготавливали для повторения. Планшеты оценивали также визуально для выявления случайных «плохих» лунок или «выбросов» данных, которые сильно отличались от ближайших соседних данных (в пределах одного и того же типа обработки). Эти «выбросы» данных помечали в базе данных и исключали из последующих анализов. И, наконец, матрицы «доза-ответ», содержащие данные об активности индивидуальных агентов, не согласующиеся с полученными в последующем эксперименте данными, помечали, как имеющие статус отвергнутых, и подготавливали для повторения. Блоки данных, не достигающих порога отсечки, помечали в базе данных, исключали из последующего анализа и при необходимости подготавливали для повторения
Оценка антипролиферативной активности
Мерой эффективности было ингибирование жизнеспособности клеток при оценке с помощью анализа жизнеспособности с использованием красителя аламарового синего относительно уровня жизнеспособности без обработки (обработка только наполнителем). На основе уровней жизнеспособности при отсутствии обработки и при обработке U и Т, рассчитывали относительное ингибирование I=1-T/U. Ингибирование находилось в пределах от 0% при отсутствии обработки до 100%, когда Т=0.
Каждый уровень Т при обработке сравнивали с медианным уровнем в отсутствие обработки (только среда) U±σU, который определяли для каждого планшета путем оценки медианного уровня красителя аламарового синего (и связанной с ним неопределенности, как описано выше) между необработанными контрольными лунками, упорядочение расположенными на планшете. Применяя правила распространения (расширения) квадратичных ошибок для выражения I, оцененная квадратичная ошибка σI~(σU/U)sqrt(1-I).
Уровень оценки ошибок дополнительно повышали для учета вариаций между повторными блоками комбинаций, а также минимального уровня предполагаемой относительной неопределенности, составляющего _min~3%. Таким образом, для ингибирования оценка квадратичной ошибки составляет σI~sqrt{(σU/U)2(1-I)+σrep2+σmin 2.
Оценка медиан и ошибок
Медианы применяли вместо средних значений с целью снижения влияния случайных выбросов (резко выделяющихся значений) на согласованные результаты. Хотя медианы более робастны (нечувствительны) в отношении выбросов, они являются более чувствительными к статистическому шуму, повышая отклонения на ~30%. Стандартные отклонения оценивали на основе абсолютного отклонения медиан (MAD), где для нормального распределения отклонение для выборки σdat~1,5 MAD. В результате квадратичную ошибку для самой медианы определяли как σmed~σdat/sqrt(N-1), для N экспериментальных данных.
Кривые дозовой зависимости для индивидуальных агентов
Активность индивидуального агента характеризовали на основе аппроксимации сигмовидной функцией следующего вида:
I=Imax/[1+(C/EC50)σ] с использованием метода наименьших квадратов с применением алгоритма нелинейной оптимизации (downhill simplex algorithm). В этом уравнении С обозначает концентрацию, ЕС50 обозначает эффективную концентрацию, при использовании которой ингибирование составляет 50%, а σ обозначает сигмовидность. Неопределенность для каждого аппроксимированного параметра оценивали, начиная с диапазона, в котором изменение приведенного хи-квадрат χ2 составляло менее единицы или менее минимального приведенного χ2, если минимум превышал единицу, что позволяло учитывать заниженные ошибки σI. Для гарантии того, что определена оптимальная концентрация, рассчитывали ЕС50 и максимальный эффективный уровень в каждом из предложенных анализов пролиферации. Применяли 384-луночные планшеты для создания дубликатов кривых дозовой зависимости с использованием 12-ступечатых разведении при факторе разведения (соотношении доз) f=2, 3 или 4, для охвата диапазона, составляющего 3-7 порядков величины.
Выбор оптимальных концентраций
При создании изобретения использовали кривую, полученную для индивидуального агента, для определения серийных разведений для каждого соединения, предназначенного для использования в скрининге комбинаций. При использовании фактора разведения 2, 3 или 4, в зависимости от сигмовидности кривой для индивидуального агента, отобирали 5 уровней доз, где находящаяся посередине концентрация была близка к аппроксимированному значению ЕС50. Для соединений с необнаруживаемой активностью индивидуального агента при создании изобретения использовали f=4, начиная с наиболее высокой концентрации, которую удалось получить.
Матрицы комбинаций доз и эталонные модели (референс-модели)
cHTS-скрининг позволяет получать матрицы доз, которые содержат все пары комбинаций двух индивидуальных агентов в сериях концентраций, включая нулевую концентрацию. Каждая матрица доз содержит внутренние копии кривых для индивидуальных агентов, которые применяли в качестве эталона для оценки совместного действия. Дубликаты матриц доз можно объединять путем усреднения соответствующих экспериментальных данных и, если серии концентраций являются различными, то соответствующие значения получают с использованием двухлинейной интерполяции. Квадратичные ошибки рассчитывали для каждого уровня ингибирования с помощью указанных выше формул. Совместное действие наиболее легко характеризовать путем сравнения ингибирования для каждой экспериментальной точки с данными, полученными с помощью референс-модели комбинированного действия, полученной на основе кривых для индивидуальных агентов. Как правило, применяли три модели: (1) модель на основе наиболее эффективного индивидуального агента (highest single agent model) IHSA(CX,CY)=max(IX,IY) представляет собой простую референс-модель, где CX, Y обозначают концентрации Х и Y соединения, и IX, Y обозначают коэффициенты ингибирования индивидуальных агентов при концентрациях CX, Y; (2) независимость по Блиссу (Bliss independence) IBliss(CX,CY)=IX+IY-IXIY представляет собой статистическое ожидание для независимых конкурирующих ингибиторов; и (3) аддитивность по Лоэву (Loewe additivity), где ILoewe(CX,CY) представляет собой ингибирование, удовлетворяющее формуле (СХ/ЕСХ)+(CY/ECY)=1, и ECX, Y обозначают эффективные концентрации, при которых достигается Iloewe, для кривых индивидуальных агентов. Аддитивность по Лоэву является общепринятым эталоном синергетического действия [4], поскольку представляет собой комбинированный ответ, получаемый, когда Х и Y обозначают одно и то же соединение. Как IHSA, так и IBliss можно легко рассчитать на основе коэффициентов IX, Y, но для определения ILoewe требуется осуществлять интерполирование и численное нахождение корней.
Отбор комбинаций для 9×9-Re-теста
При отборе требуемых для онкологии комбинаций для повторных анализов с использованием матриц доз размером 9×9 с высоким разрешением (9×9-Re-тест) оценивали три важных фактора: (1) значительное синергетическое действие, превышающее действие, даваемое аддитивной моделью; (2) активность субстанций, при которой достигается синергетическое действие; и (3) достаточный сдвиг эффективности. Применяли «коэффициент синергизма», представляющий собой S=log fX log fY_Idata (Idata-ILoewe), просуммированный по всем парам концентраций неодинаковых агентов, где log fX, Y представляют собой натуральные логарифмы факторов разведения, применяемых для каждого индивидуального агента. Это позволяет эффективно рассчитывать объем между поверхностями измеренных и аддитивных по Лоэву ответов, взвешенных для учета высокого ингибирования и скорректированных с учетом вариации факторов разведения. Эта объемная оценка позволяет выделять общее синергетическое или антагонистическое действие комбинации, тем самым минимизируя влияния выпадающих выбросов данных и позволяя идентифицировать комбинации, обладающие робастным синергизмом в широком диапазоне концентраций и высокими уровнями синергизма. S является положительным для большинства синергетических комбинаций и отрицательным в случае антагонизма. В тех случаях, если синергизм, так и антагонизм присутствуют при различных концентрациях, то при высоких уровнях ингибирования действует весовой коэффициент. Для каждого коэффициента синергизма рассчитывают неопределенность σS на основе ошибок измерений значений Idata и распространения стандартной ошибки. Балл синергизма и его погрешность используют для определения соответствующего предельного значения для отбора. Например, комбинации с S>2_S являются статистически значимыми с уровнем значимости ~95% в предположении нормального закона распределения. Для обеспечения достаточного сдвига эффективности коэффициент комбинированного действия CI=(СХ/ЕСХ)+(CY/ECY) для выбранного уровня действия является достаточно малым для того, чтобы синергизм рассматривался как имеющий практическое значение. В качестве ориентира для назначения предельного значения можно использовать полученные в экспериментах in vitro значения CI для применяемых в настоящее время в клинических условиях комбинаций (CI~0,5-0,7).
Ниже в таблице перечислены комбинации соединений с 40-O-(2-гидроксиэтил)рапамицина, для которых обнаружен наиболее высокий уровень синергизма
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ НЕЙРОЭНДОКРИННЫХ ОПУХОЛЕЙ | 2006 |
|
RU2487711C2 |
| КОМБИНАЦИИ ИНГИБИТОРА HSP90 | 2009 |
|
RU2519673C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО РАПАМИЦИНА | 2013 |
|
RU2659725C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО РАПАМИЦИНА | 2013 |
|
RU2665138C2 |
| КОМБИНАЦИЯ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 2002 |
|
RU2322981C2 |
| КОМБИНАЦИИ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ ДЛЯ ЛЕЧЕНИЯ РАКА | 2007 |
|
RU2449788C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНОГО РАПАМИЦИНА | 2011 |
|
RU2483727C1 |
| ИНГИБИРОВАНИЕ ИЛИ ПРОФИЛАКТИКА НАРУШЕННОЙ РЕГУЛЯЦИИ АНГИОГЕНЕЗА С ПОМОЩЬЮ ПРОИЗВОДНЫХ РАПАМИЦИНА И ФАРМАЦЕВТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ ПРОИЗВОДНОЕ РАПАМИЦИНА | 2006 |
|
RU2445093C2 |
| ЛЕЧЕНИЕ РАКА | 2005 |
|
RU2325906C2 |
| ЛЕЧЕНИЕ ТУБЕРОЗНОГО СКЛЕРОЗА | 2007 |
|
RU2473343C2 |

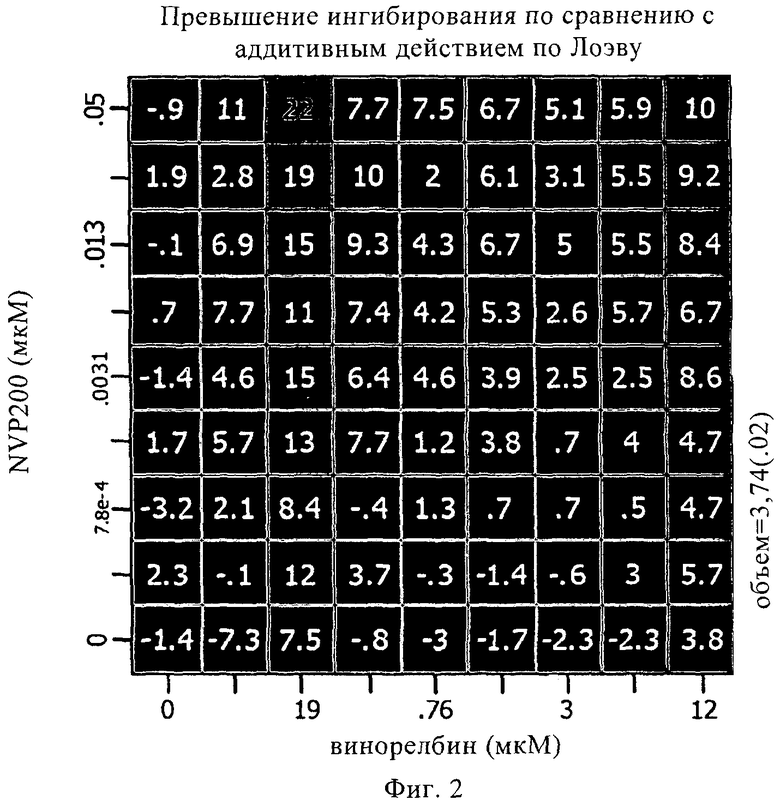
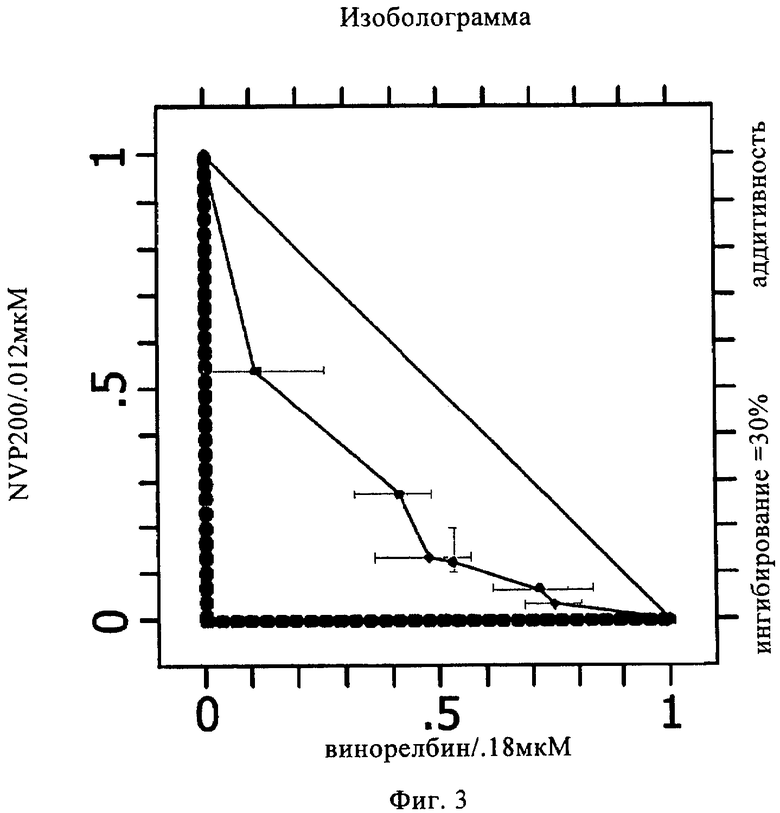
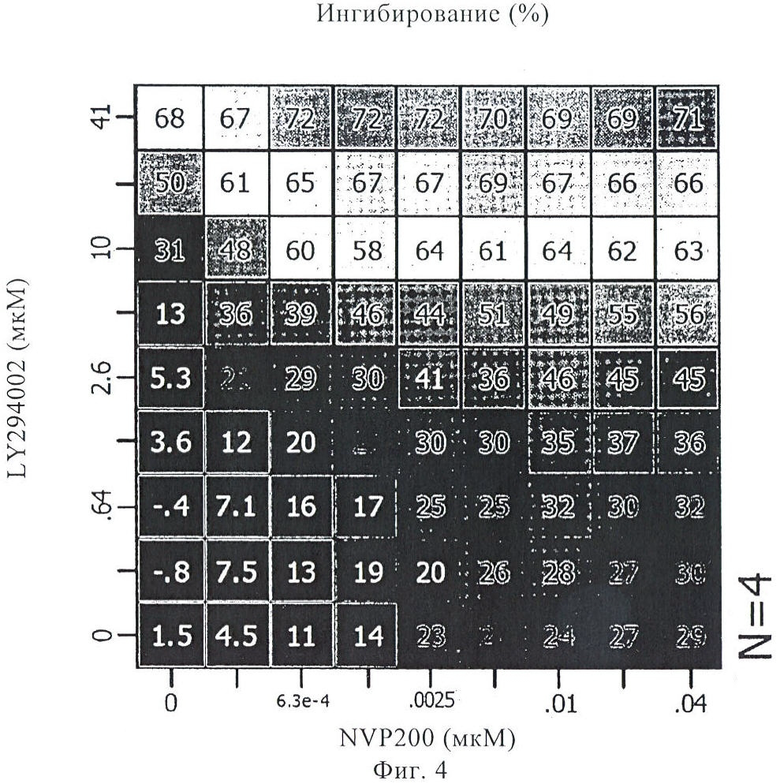
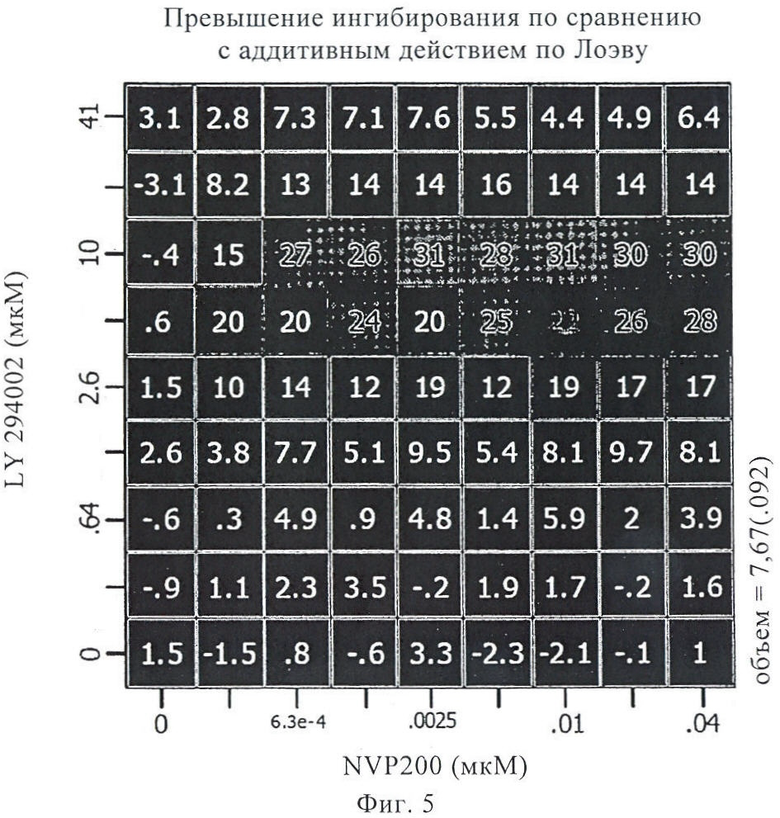
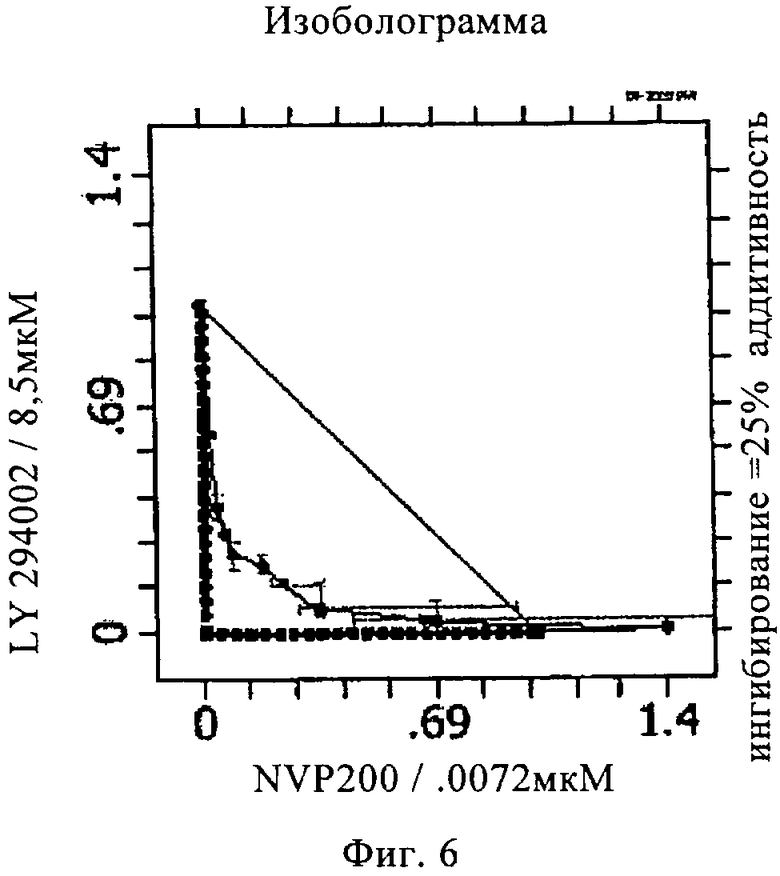
Изобретение относится к комбинации, содержащей ингибитор mTOR эверолимус и винорелбин, предназначенной для одновременного, совместного, раздельного или последовательного введения. Изобретение также относится к способу предупреждения или лечения пролиферативного заболевания. 6 н. и 2 з.п. ф-лы, 6 ил., 2 табл., 5 пр.
1. Фармацевтическая комбинация для предупреждения или лечения рака яичника, карциномы легкого и меланомы, включающая эверолимус и винорелбин.
2. Комбинация по п.1, где эверолимус представляет собой соединение формулы

в которой
R1 обозначает метил,
R2 обозначает -CH2-CH2-ОН и
Х обозначает =O.
3. Фармацевтическая композиция для предупреждения или лечения рака яичника, карциномы легкого и меланомы, включающая комбинацию по любому из пп.1 и 2.
4. Товарная упаковка для предупреждения или лечения рака яичника, карциномы легкого и меланомы, содержащая комбинацию по любому из пп.1 и 2.
5. Товарная упаковка по п.4, в которой стандартная доза представляет собой фиксированную комбинацию.
6. Применение комбинации по любому из пп.1 и 2 для приготовления лекарственного средства, предназначенного для предупреждения или лечения рака яичника, карциномы легкого и меланомы.
7. Применение фармацевтической композиции по п.3 для приготовления лекарственного средства, предназначенного для предупреждения или лечения рака яичника, карциномы легкого и меланомы.
8. Способ предупреждения или лечения рака яичника, карциномы легкого и меланомы, заключающийся в том, что применяют фармацевтическую композицию по п.3.
| СПОСОБ ПОЛУЧЕНИЯ DL-АЛЬФА-ТОКОФЕРОЛА ИЛИ ЕГО АЦЕТАТА | 1994 |
|
RU2098416C1 |
| WO 2005080593 А2, 01.09.2005 | |||
| ПЕРЕКОМПОНУЕМАЯ АВТОМАТИЧЕСКАЯ ЛИНИЯ | 1995 |
|
RU2080975C1 |
| YUK | |||
| Приспособление для отопления печей нефтью | 1922 |
|
SU458A1 |
Авторы
Даты
2012-04-20—Публикация
2007-04-05—Подача