Область техники, к которой относится изобретение
Настоящее изобретение относится к кристаллическому моногидрату L-малата азитромицина, состоящего из одной молекулы азитромицина, двух молекул L-яблочной кислоты и одной молекулы H2O, способу его получения и содержащей его фармацевтической композиции.
Описание известного уровня техники
Азитромицин, 9-дезоксо-9a-аза-9a-метил-9a-гомоэритромицин A (номенклатура лекарственных средств, принятых в США (USAN)) формулы (II), описанный ранее в патентах США №№ 4517359 и 4474768, является полусинтетическим макролидным антибиотиком, относящимся к подклассуазалидов, применяемых для лечения бронхиальной инфекции, инфекции, передающейся при половом контакте, и дерматологической инфекции (см. H.A. Kirst and G.D. Sildes, Antimicrob. Agents Chemother. 1989, 33, 1419-1422).
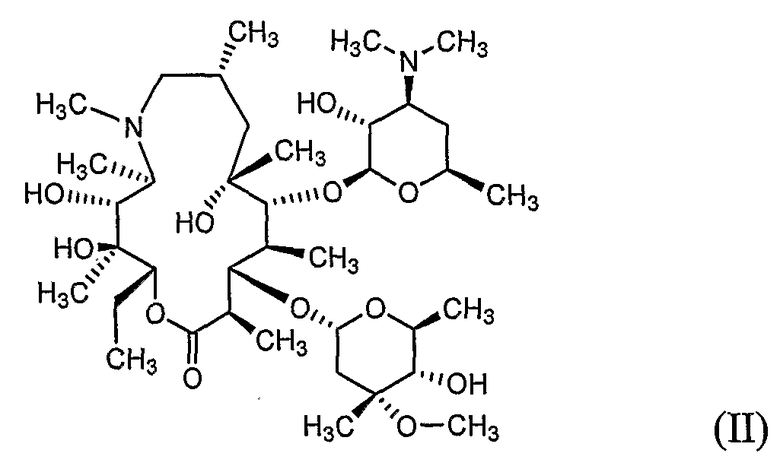
Азитромицин, описанный в указанных выше патентах, находится в виде высокогигроскопичной и неустойчивой кристаллическойбезводной формы или в форме моногидрата и не пригоден для использования в фармацевтическом препарате.
Для решения этой проблемы в европейском патенте EP 0298605 описан негигроскопичный кристаллический дигидрат азитромицина. В европейском патенте EP 0984020 и публикации заявки PCT № WO 2002/085898 описана форма азитромицина, сольватированная нетоксичным спиртом.
Однако дигидрат азитромицина обладает низкой растворимостью в воде, которая при 37°C составляет 1,1 мг/мл, что при введении фармацевтической композиции, например, в виде капсулы или таблетки, содержащей высокую дозу, неблагоприятно сказывается на скорости высвобождения лекарственного средства и на всасывании in vivo. Таким образом, чтобы увеличить скорость всасывания лекарственного средства in vivo, его используют вместе с солюбилизатором, например, когда необходимо введение путем инъекции.
Азитромицин содержит две группы третичного амина и, следовательно, для улучшения растворимости может быть преобразован в форму кислотно-аддитивной соли. Например, в патенте США № 4474768 описаны кислотно-аддитивные соли азитромицина с органической или неорганической кислотой, например с хлористоводородной кислотой. Также сообщалось о различных солях азитромицина с хлористоводородной кислотой, йодистоводородной кислотой, уксусной кислотой, L-аспарагиновой кислотой и лактобионовой кислотой (см. S. Djokic et al., J. Chem. Research (S), 1988, 152-153 или J. Chem. Research (M), 1988, 1239-1261). Более того, в публикациях патентов CN №№ 1123279, 1157824, 1205338 и 1334541 описаны соли азитромицина с глутаминовой кислотой, аспарагиновой кислотой, молочной кислотой, лимонной кислотой, уксусной кислотой, глюкуроновой кислотой, N-ацетилцистеином, метилсерной кислотой, аскорбиновой кислотой и серной кислотой.
Однако большинство из указанных выше солей являются аморфными веществами, полученными удалением растворителя, используемого на стадии образования соли, путем сушки вымораживанием, распылительной сушки или вакуумной перегонки. В европейском патенте EP 0677530 предложен аморфный дигидрохлорид азитромицина, полученный осаждением. Такие аморфные соли, помимо проблемы, возникающей из-за включения меняющихся количеств остаточной воды или органического растворителя, являются гигроскопичными и неустойчивыми. Соответственно, они непригодны для фармацевтического применения.
В публикации PCT № WO 2004/106355 предложена кристаллическая соль азитромицина с лимонной кислотой, то есть гидроцитрат азитромицина. Однако оказывается затруднительным поддерживать на постоянном уровне содержание воды в указанной соли в условиях влажной окружающей среды.
Авторы настоящего изобретения предприняли попытку получить улучшенную кислотно-аддитивную соль азитромицина и обнаружили кристаллическую соль азитромицина, обладающую значительно лучшей устойчивостью, негигроскопичностью и растворимостью, чем известный дигидрат азитромицина.
Сущность изобретения
Основной задачей настоящего изобретения является получение кислотно-аддитивной соли азитромицина, обладающей высокой растворимостью, устойчивостью и негигроскопичностью, а также разработка способа ее получения.
Согласно одному аспекту настоящего изобретения предложен кристаллический моногидрат L-малата азитромицина формулы (I):

В настоящем изобретении дополнительно предлагается фармацевтическая композиция для лечения микробной инфекции, содержащая в качестве активного ингредиента моногидрат L-малата азитромицина формулы (I).
Краткое описание чертежей
Указанная выше задача и отличительные признаки настоящего изобретения будут очевидны из нижеследующего описания изобретения, рассматриваемого совместно с сопровождающими его чертежами, на которых соответственно показаны:
ФИГ.1: рентгеновская порошковая дифрактограмма (XPRD) кристаллического моногидрата L-малата азитромицина согласно изобретению;
ФИГ.2: инфракрасный (ИК) спектр поглощения кристаллического моногидрата L-малата азитромицина согласно изобретению;
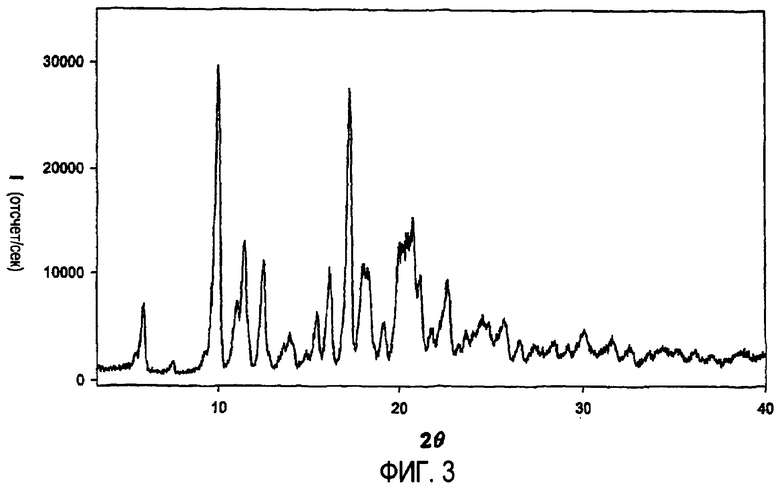
ФИГ.3: XPRD спектр безводного L-малата азитромицина;
ФИГ.4: ИК спектр поглощения безводного L-малата азитромицина;
ФИГ.5: зависящие от времени изменения содержания воды (%) в кристаллическом моногидрате L-малата азитромицина согласно изобретению;
ФИГ.6: зависящие от времени изменения количества активного азитромицина (%) в моногидрате L-малата азитромицина согласно изобретению по сравнению с дигидратом азитромицина; и
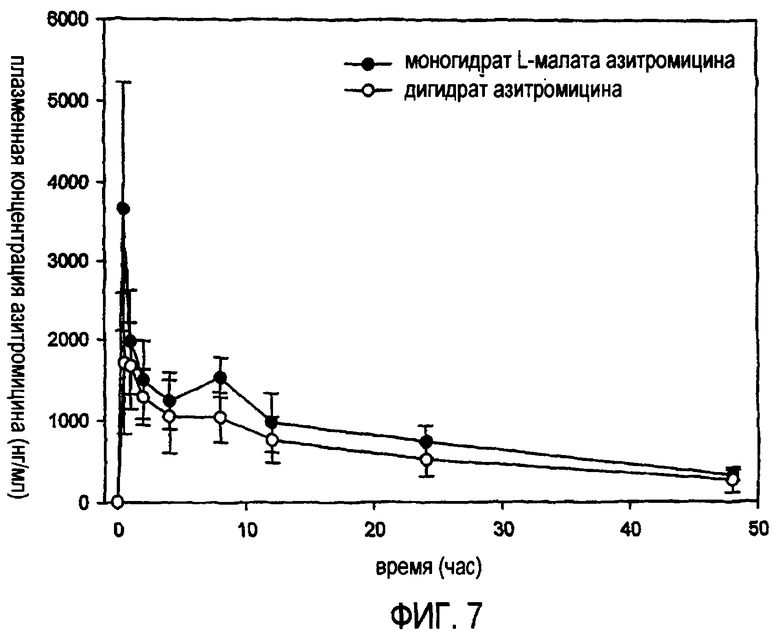
ФИГ.7: фармакокинетический профиль in vivo моногидрата L-малата азитромицина согласно изобретению по сравнению с дигидратом азитромицина.
Подробное описание изобретения
Моногидрат L-малата азитромицина формулы (I) по настоящему изобретению может быть получен a) путем взаимодействия азитромицина формулы (II) с яблочной кислотой формулы (III) в водном органическом растворителе, или b) перекристаллизацией безводного L-малата азитромицина формулы (IV) из водного органического растворителя:



В частности, соединение формулы (I) согласно изобретению может быть получено способом, включающим нижеследующие стадии: суспендирование азитромицина формулы (II) в водном органическом растворителе; последующее добавление яблочной кислоты формулы (III); нагревание смеси до температуры, находящейся в интервале от комнатной температуры до температуры кипения используемого растворителя; охлаждение полученного прозрачного раствора до температуры, находящейся в интервале от 0°C до комнатной температуры, и отфильтровывание и сушку осажденных кристаллов.
Азитромицин формулы (II), используемый в настоящем изобретении, может быть в безводной форме, в форме моногидрата, дигидрата или сольвата.
Яблочная кислота формулы (III), используемая в настоящем изобретении, может быть L-яблочной кислотой, DL-яблочной кислотой рацемата, или их смесью, среди которых L-яблочная кислота является предпочтительной.
В соответствии с приведенным выше способом по настоящему изобретению только L-яблочная кислота стереохимически избирательно взаимодействует с хиральной молекулой азитромицина с получением моногидрата L-малата азитромицина формулы (I), даже когда в рацемической смеси используют DL-яблочную кислоту. Хотя каждую соль азитромицина с D- или D,L-яблочной кислотой можно получить другим способом, например используя неводный органический растворитель, такую соль получают в безводной форме.
Поэтому для моногидрата L-малата азитромицина формулы (I) L-малат означает соль L-(-)-яблочной кислоты, чей асимметричный атом углерода предпочтительно имеет S-конфигурацию.
В настоящем изобретении L-яблочную кислоту предпочтительно используют в количестве, составляющем 2-2,5 молярных эквивалента в расчете на 1 молярный эквивалент азитромицина.
Водные органические растворители, которые могут быть использованы в настоящем изобретении, включают водный ацетон, метилэтилкетон, метилизобутилкетон, этанол, 1-пропанол, 2-пропанол, 1-бутанол, тетрагидрофуран, 1,4-диоксан, метилацетат и этилацетат, предпочтительно ацетон и 2-пропанол; и предпочтительно содержание воды составляет 2-10% по объему.
В настоящем изобретении водный органический растворитель предпочтительно используют в количестве, составляющем 3-20 мл, предпочтительно 4-10 мл в расчете на 1 г азитромицина.
Альтернативно, моногидрат L-малата азитромицина может быть получен перекристаллизацией безводногоL-малата азитромицина из водного органического растворителя, приведенного выше.
Моногидрат L-малата азитромицина формулы (I) согласно изобретению, полученный таким образом, образует кристаллическую структуру, которая состоит из одной молекулы азитромицина, двух молекул L-малата и одной молекулы H2O, как может быть показано на ФИГ.1 и 2. В частности, рентгеновский дифракционный спектр (XRD) соединения согласно изобретению (ФИГ.1) демонстрирует основные пики, имеющие величины I/Io, составляющие, по меньшей мере, 10% (I представляет собой интенсивность каждого пика; I0 представляет собой интенсивность самого высокого пика), при значениях 2θ±0,2, равных 9,6; 10,6; 11,2; 12,0; 12,4; 14,3; 14,6; 15,0; 16,6; 17,5; 18,1; 18,6; 19,3; 19,7; 20,2; 20,5; 21,4; 22,6; 23,6; 24,0; 24,6; 27,1; 27,7 и 34,4. Спектр инфракрасного (ИК) поглощения соединения согласно изобретению демонстрирует значительные пики поглощения на волновых числах (см-1) 3411, 3059, 2971, 1742, 1716, 1619, 1594, 1493, 1457, 1345, 1286, 1177, 1112, 1080, 1056, 1013, 1001, 900, 773 и 637 (ФИГ.2). Кроме того, кристаллический моногидрат L-малата азитромицина согласно изобретению демонстрирует температуру плавления в интервале 173-176°C, что свидетельствует об устойчивости при нагревании.
Кристаллическая структура предложенного в настоящем изобретении моногидрата L-малата азитромицина отличается от кристаллической структуры безводной соли, которую можно получить путем сушки и дегидратирования моногидратной формы при пониженном давлении (1,0 мм рт. ст.) и температуре 100°C или выше в течение нескольких часов; или путем взаимодействия азитромицина с L-яблочной кислотой в неводном органическом растворителе, как показано на XRD спектре (ФИГ.3) и на ИК спектре поглощения (ФИГ.4). Безводная форма демонстрирует температуру плавления в интервале 180-184°C.
В отличие от обычной аморфной соли, получаемой удалением растворителя вакуумной перегонкой, сушкой вымораживанием или распылительной сушкой или путем осаждения, кристаллический моногидрат L-малата азитромицина по настоящему изобретению является негигроскопичным, как следует из результатов, приведенных в таблице 1, которые были получены после хранения в течение 24 часов при 40°C и относительной влажности 75%.
Получение кислотно-аддитивной соли азитромицина
b) Дисперсное осаждение может быть проведено путем добавления изопропилового эфира в раствор 2-пропанола
c) Моногидрат L-малата по настоящему изобретению
d) БезводныйL-малат
e) БезводныйDL-малат
f) БезводныйD-малат
Кроме того, предложенный в настоящем изобретении кристаллический моногидрат L-малата азитромицина формулы (I) имеет значительно более высокую растворимость в воде, чем известный дигидратазитромицина, который является единственным фармацевтическим ингредиентом, используемым до настоящего времени в данной области техники, и, таким образом, он (моногидрат) обладает значительно улучшенным фармакокинетическим профилем азитромицина, подходящим для составления улучшенной композиции для лечения разнообразных микробных инфекций.
Соответственно, в настоящем изобретении предложена фармацевтическая композиция для лечения микробной инфекции, содержащая в качестве активного ингредиента моногидрат L-малата азитромицина формулы (I).
Примеры микробной инфекции включают внебольничную пневмонию, относящуюся к инфекции, вызываемой Streptococcus pneumoniae, Haemophilus influenzae, Mycoplasma pneumoniae или Chlamydiapneumoniae; фарингит и тонзиллит, относящиеся к инфекции, вызываемой Streptococcus pyogenes; хроническое обструктивное легочное заболевание и острый отит, относящиеся к инфекции, вызываемой Haemophilus influenzae, MoraxellacatarrhalisилиStreptococcus pneumoniae; неосложненные кожные инфекции, относящиеся к инфекции, вызываемой Staphylococcusaureus, Streptococcus pyogenes или Streptococcus agalactiae; инфекции мочеполового пути, относящиеся к инфекции, вызываемой Neisseria gonorroeae или Chlamydia trachomatis; и диссеминированное заболевание комплексом mycobacterium avium(MAC), относящееся к инфекции, вызываемой Mycobacterium avium.
Предложенная в настоящем изобретении фармацевтическая композиция, содержащая в качестве активного ингредиента кристаллический моногидрат L-малата азитромицина, может быть введена различными путями, включая пероральное применение, применение в виде инъекции и офтальмологическое применение.
При пероральном введении фармацевтическая композиция по настоящему изобретению может быть в виде таблеток, капсул, суспензий, порошков и тому подобное, вводимых в разовой дозе или в разделенных дозах. Такая композиция может содержать фармацевтически приемлемые носители, разбавители или эксципиенты, такие как связующие агенты, наполняющие агенты, буферирующие агенты, смазывающие агенты, дезинтегрирующие агенты, подслащивающие агенты, ароматизаторы, поверхностно-активные вещества и покрывающие вещества.
Примеры дезинтегрирующих агентов включают крахмалы, желатинированный крахмал, натриевый гликолят крахмала, карбоксиметилцеллюлозу натрия, кроскармеллозу натрия, микрокристаллическую целлюлозу, альгинаты, смолы, поверхностно-активные вещества, шипучие композиции, водный силикат алюминия и поперечно сшитый поливинилпирролидон. Примеры связующего агента включают камедь; производные целлюлозы, такие как метилцеллюлоза, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза и гидроксиэтилцеллюлоза; желатин, глюкозу, декстрозу, ксилит, полиметакрилат, поливинилпирролидон, сорбит, крахмал, желатинированный крахмал, ксантановую смолу, альгинаты, алюмосиликат магния, полиэтиленгликоль и бентонит.
Примеры наполняющих агентов включают лактозу, безводную лактозу, моногидрат лактозы, сахарозу, декстрозу, маннит, сорбит, крахмал, производные целлюлозы, такие как микрокристаллическая целлюлоза, и фосфат кальция, карбонат кальция и сульфат кальция в безводной форме или в форме дигидрата. Примеры смазывающего агента включают стеарат магния, тальк, полиэтиленгликоль, полимер этиленоксида, лаурилсульфат натрия или магния, олеат натрия, стеарилфумарат натрия, DL-лейцин и коллоидный диоксид кремния. Примеры ароматизаторов включают экстракты и синтетическое или натуральное душистое масло, полученное из масел, цветов, разных сортов фруктов и их смеси.
Примеры покрывающих агентов включают гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу и сополимер акриловой кислоты и метакриловой кислоты, который может обеспечить легкое глотание, контроль высвобождения, а также улучшение формы и вкуса препарата. Примеры подслащивающих агентов включают аспартам, сахарин, сахарин натрия, цикламат натрия, ксилит, маннит, сорбит, лактозу и сахарозу. Примеры буферирующего агента включают лимонную кислоту, цитрат натрия, гидрокарбонат натрия, двухосновный фосфат натрия, оксид магния, карбонат кальция и гидроксид магния. Примеры поверхностно-активного вещества включают лаурилсульфат натрия, полисорбат и т.д.
Фармацевтическая композиция для перорального введения может быть составлена в виде разделенных доз, содержащих 50-700 мг азитромицина, или в виде разовой дозы, содержащей 700-3500 мг азитромицина, и она предпочтительно содержит кристаллический моногидрат L-малата азитромицина формулы (I) в количестве 20-80 мас.ч. в расчете на 100 мас.ч. композиции. Например, 500 мг (100%) фармацевтической композиции, содержащей 250 мг (50,0%) азитромицина, могут быть составлены из 345,53 мг (69,1%) моногидрата L-малата азитромицина формулы (I) и 154,47 мг (30,9%) соответствующих добавок, таких как носители, разбавители или эксципиенты.
Фармацевтическая композиция по настоящему изобретению для стерильного введения путем инъекции может быть получена непосредственным заполнением флаконов кристаллическим моногидратом L-малата азитромицина согласно изобретению и фармацевтически приемлемым носителем в стерильных условиях, или заполнением флаконов аморфным порошком, полученным путем растворения кристаллического моногидрата L-малата азитромицина и фармацевтически приемлемого носителя в стерильной воде с последующей сушкой вымораживанием. Композицию перед введением растворяют в стерильной воде. Предпочтительно, когда фармацевтическая композиция для введения путем инъекции содержит кристаллический моногидрат L-малата азитромицина формулы (I) в количестве от 50 до 250 мг/мл.
Для офтальмологического введения фармацевтическая композиция по настоящему изобретению может быть получена в виде 0,05-1,0% водного раствора моногидрата L-малата азитромицина в изотоническом физиологическом растворе, фосфорной кислоте или боратном буферном растворе или с таким антиоксидантом, как сульфит натрия или гидросульфит натрия, или без антиоксиданта.
Настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако следует понимать, что настоящее изобретение не ограничивается конкретными примерами.
ПРИМЕРЫ
Пример 1: Получение моногидрата L-малата азитромицина из L-яблочной кислоты
100,00 г дигидрата азитромицина (127 ммоль) растворяли в 1000 мл 95% 2-пропанола и добавляли 34,1 г L-яблочной кислоты (254 ммоль), имеющей оптическую чистоту 99,7% ee(ошибка в пределах допустимости), с последующим перемешиванием полученного раствора в течение ночи при комнатной температуре, а затем в течение 2 часов при температуре 0-5°C. Образовавшийся осадок отфильтровывали, промывали холодным 2-пропанолом и сушили при 45°C с получением 118,3 г указанного в заголовке соединения (выход: 90%)в виде белого кристаллического вещества.
Т.пл: 173˜175°C
Удельное вращение, [α]D 20: -32,8° (c=1, метанол)
Содержание влаги (прибор для титрования Карла Фишера): 1,80% (рассчитанное значение для моногидрата - 1,74%)
Оптическая чистота яблочной кислоты после образования соли (по ВЭЖХ): 99,9% ee L-яблочной кислоты
Относительное содержание азитромицина (по ВЭЖХ): 74,6% (из расчета на одну молекулу, 72,35%)
Относительное содержание L-яблочной кислоты (титрование 0,1 н. KOH): 25,8% (из расчета на две молекулы, 25,91%)
ИК (KBr, см-1): 3411, 3059, 2971, 1742, 1716, 1619, 1594, 1493, 1457, 1345, 1286, 1177, 1112, 1080, 1056, 1013, 1001, 900, 773, 637
Полученная рентгеновская порошковая дифрактограммакристаллического моногидрата L-малата азитромицина, (ФИГ.1) показывает, что моногидрат L-малата азитромицина является кристаллом, имеющим отчетливые характеристические основные пики (пики, имеющие величины I/I0 и d, составляющие, по меньшей мере, 10%).
Примеры 2-6: Получение моногидрата L-малата азитромицина из L-яблочной кислоты
Повторяли методику примера 1, за исключением того, что для получения указанного в заголовке соединения использовали азитромицин, L-яблочную кислоту и растворитель, указанные в таблице 3.
Температура плавления, XPRD и спектр ИК поглощения полученных соединений были аналогичны приведенным в примере 1.
Пример 7: Получение моногидрата L-малата азитромицина из безводногоL-малата азитромицина
50,0 г безводного L-малата азитромицина (содержание влаги 0,4%) растворяли при нагревании в 400 мл 95% 2-пропанола и полученный раствор перемешивали в течение ночи при комнатной температуре, а затем в течение 2 часов при температуре 0-5°C. Образовавшийся осадок отфильтровывали, промывали холодным 2-пропанолом и сушили при 45°C с получением 43,1 г указанного в заголовке соединения (выход: 85%) в виде белого кристалла.
Т.пл.: 173˜175°C
Содержание влаги (прибор для титрования Карла Фишера): 1,83% (рассчитанное значение для моногидрата - 1,74%)
Результаты XPRD и ИК спектра поглощения для полученных соединений были аналогичны результатам примера 1.
Пример 8: Получение моногидрата L-малата азитромицина из DL-яблочной кислоты
100,0 г дигидрата азитромицина (127 ммоль) растворяли в 1000 мл 95% 2-пропанола и добавляли 34,1 г DL-яблочной кислоты (254 ммоль, оптическая чистота 1,7% ee в пользу L-яблочной кислоты), с последующим перемешиванием полученного раствора в течение ночи при комнатной температуре, а затем в течение 2 часов при температуре 0-5°C. Образовавшийся осадок отфильтровывали, промывали холодным 2-пропанолом и сушили при 45°C с получением 61,8 г белого кристаллического порошка (выход: 47%).
Т.пл.: 170˜174°C
Удельное вращение, [α]D 20: -33,7° (c=1, метанол)
Содержание влаги (прибор для титрованияКарла Фишера): 1,85%
Оптическая чистота яблочной кислоты после образования соли (ВЭЖХ): 80,0% ee в пользу L-яблочной кислоты
56,0 г кристаллических порошков, полученных выше, перекристаллизовывали из 95% 2-пропанола с получением 45,2 г указанного в заголовке соединения (выход: 80%).
Т.пл.: 172˜175°C
Удельное вращение, [α]D 20: -33,0° (c=1, метанол)
Содержание влаги (прибор для титрования Карла Фишера): 1,81%
Оптическая чистота яблочной кислоты (ВЭЖХ): 98,9% ee L-яблочной кислоты
XPRD и ИК спектры поглощения соединения, полученного таким образом, были аналогичны полученным в примере 1.
Ссылочный пример 1: Получение безводногоL-малата азитромицина
Способ A
10,0 г моногидрата L-малата азитромицина, полученного в одном из примеров 1-8, сушили при пониженном давлении (1 мм рт.ст.) при 100°C в течение 10 часов, получая указанное в заголовке соединение в виде белого порошка.
Способ В
37,5 г безводногоазитромицина (50 ммоль, содержание влаги 0,2%) растворяли в 400 мл безводного 2-пропанола и добавляли 13,4 г L-яблочной кислоты (100 ммоль), с последующим перемешиванием полученного раствора в течение ночи при комнатной температуре, а затем в течение 2 часов при температуре 0-5°C. Образовавшийся осадок отфильтровывали, промывали холодным 2-пропанолом и сушили при 45°C с получением 47,3 г указанного в заголовке соединения (выход: 93%) в виде белого кристаллического вещества.
Т.пл.: 182˜184°C
Удельное вращение, [α]D 20: -32,8° (c=1, метанол)
Содержание влаги (прибор для титрованияКарла Фишера): 0,4% или менее (после сушки)
ИК (KBr, см-1): 3415, 3057, 2980, 2932, 2884, 1736, 1607, 1462, 1386, 1326, 1177, 1084, 1060, 1000, 939, 895, 726, 637.
Соединение L-малата азитромицина, полученное выше, подвергали рентгеноструктурному анализу, и результат показал, что соединение имеет кристаллическую структуру, имеющую основные пики I/Iо величин, составляющих, по меньшей мере, 10%, при значениях 2θ±0,2,равных 6,0; 10,0; 11,0; 11,4; 12,5; 13,9; 15,5; 16,2; 17,3; 18,0; 19,2; 20,0; 20,5; 20,8; 21,2; 22,6; 24,5; 25,7. Его безводная форма была подтверждена результатами измерения содержания влаги.
Безводный L-малат азитромицина, полученный таким образом, выдерживали 10 часов при 40°C и относительной влажности 75%, и обнаружили, что содержание влаги увеличилось приблизительно до 2,0%. То есть безводный L-малат азитромицина преобразовался в гидратную форму.
Ссылочный пример 2: Получение безводного D-малата азитромицина
10,0 г дигидрата азитромицина (12,7 ммоль) растворяли в 100 мл безводного 2-пропанола и добавляли 3,41 г D-яблочной кислоты (25,4 ммоль), имеющей оптическую чистоту 98,2% ee, с последующим перемешиванием в течение ночи при комнатной температуре, а затем в течение 2 часов при температуре 0-5°C. Образовавшийся осадок отфильтровывали, промывали холодным 2-пропанолом и сушили при 45°C, получая 10,4 г указанного в заголовке соединения (выход 79%) в виде белого кристаллического вещества.
Т.пл.: 160˜163°C
Удельное вращение, [α]D 20: -39,5° (c=1, метанол)
Оптическая чистота D-яблочной кислоты после образования соли (ВЭЖХ): 98,9% ee
Содержание влаги (прибор для титрования Карла Фишера): 0,4% или менее (после сушки)
ИК (KBr, см-1): 3427, 2974, 2937, 2882, 1735, 1598, 1466, 1385, 1179, 1171, 1080, 1060, 1013, 1002, 899, 726.
Соединение D-малата азитромицина, полученное выше, подвергали рентгеноструктурному анализу, и результат показал, что соединение имеет кристаллическую структуру, демонстрирующую основные пики (величины I/Iо, составляющие, по меньшей мере, 10%) при значениях 2θ±0,2,равных 5,7; 9,9; 10,9; 11,3; 12,3; 15,9; 17,1; 17,8; 18,2; 19,9; 20,6; 22,2. Его безводная форма была подтверждена результатами измерения содержания влаги. Однако, выдерживая в течение 10 часов при 40°C и относительной влажности 75%, обнаруживали увеличение содержания влаги на 8% или выше.
Безводный D-малат азитромицина, полученный выше, не преобразуется в форму гидрата в условиях водного растворителя, используемого в примерах 1-8.
Ссылочный пример 3: Получение безводного DL-малата азитромицина
10,0 г дигидрата азитромицина (12,7 ммоль) растворяли в 100 мл безводного 2-пропанола и добавляли 3,41 г DL-яблочной кислоты (25,4 ммоль, оптическая чистота 1,7% ee в пользу L-яблочной кислоты), с последующим перемешиванием в течение ночи при комнатной температуре, а затем в течение 2 часов при температуре 0-5°C. Образовавшийся осадок отфильтровывали, промывали холодным 2-пропанолом и сушили в печи при 40°C, получая 10,3 г указанного в заголовке соединения (выход 78%) в виде белого кристаллического порошка.
Т.пл.: 169˜172°C
Удельное вращение, [α]D 20: -35,5° (c=1, метанол)
Оптическая чистота яблочной кислоты (ВЭЖХ) 3,4% ee L-яблочной кислоты
Содержание влаги (прибор для титрованияКарла Фишера): 0,5% или менее (после сушки)
ИК (KBr, см-1): 3410, 2973, 2937, 2882, 1736, 1603, 1458, 1385, 1170, 1076, 1060, 1016, 1008, 895, 641
Соединение DL-малата азитромицина, полученное выше, подвергали рентгеноструктурному анализу, который показал кристаллическую структуру, имеющую основные пики (величины I/I0, составляющие, по меньшей мере, 10%) при значениях 2θ±0,2, равных5,9; 9,9; 10,9; 11,3; 12,4; 16,0; 17,2; 17,9; 19,9; 20,6; 22,5; 24,4. Кроме того, измерения содержания влаги показали безводную форму. Однако, выдерживая в течение 10 часов при 40°C и относительной влажности 75%, содержание влаги в образце повышают до 6% или выше.
Между тем, в условиях водного растворителя вместо безводного DL-малата азитромицина, полученного выше, кристаллизовался негигроскопичный моногидрат L-малата азитромицина, как показано в примере 8.
Экспериментальный пример 1: Тест на растворимость в воде
Моногидрат L-малата азитромицина по настоящему изобретению и дигидрат азитромицина растворяли до насыщения соответственно в деионизированной воде и в буферном растворе фосфорной кислоты (pH 7). Растворимость в воде каждого из насыщенных растворов анализировали методом ВЭЖХ в соответствии с методикой, описанной в US Pharmacopoeia, для определения количества растворенного азитромицина. Результаты приведены в таблице 4.
Как показано в таблице 4, растворимость моногидрата L-малата азитромицина согласно изобретению значительно увеличена по сравнению с растворимостью известного дигидрата азитромицина, что означает, что соль азитромицина согласно изобретению более предпочтительна для применения in vivo.
Экспериментальный пример 2: Тест на негигроскопичность
Моногидрат L-малата азитромицина согласно изобретению непрерывно выдерживали при 25 или 40°C и относительной влажности 40-90% на протяжении более 15 дней. Содержание влаги в соли согласно изобретению, измеренное с помощью прибора для титрования Карла Фишера при времени хранения 0, 3, 7 и 15 дней, приведено в таблице 5 и на ФИГ.5.
Как показано в таблице 5, моногидрат L-малата азитромицина согласно изобретению был в значительной степени негигроскопичен, сохраняя исходное содержание влаги, главным образом, в условиях низкой влажности.
Экспериментальный пример 3: Тест на термоустойчивость
Измеряли зависящую от времени устойчивость моногидрата L-малата азитромицина согласно изобретению при высокой температуре и сравнивали ее с устойчивостью известного дигидрата азитромицина.
В частности, моногидрат L-малата азитромицина по настоящему изобретению и дигидрат азитромицина хранили в герметизированном состоянии в условиях напряжения при 60°C и относительной влажности 75% соответственно, и остающееся количество активного азитромицина после 7, 14, 21 и 28 дней измеряли методом ВЭЖХ в соответствии с методикой, описанной в US Pharmacopoeia. Результаты приведены в таблице 6 и на ФИГ.6.
Как показано в таблице 6, дигидрат азитромицина в течение 28 дней претерпевал значительную деградацию, тогда как моногидрат L-малата азитромицина согласно изобретению отличался высокой устойчивостью.
Экспериментальный пример 4: Измерение зависящих от времени изменений концентрации азитромицина в крови (фармакокинетический тест)
Фармакокинетические воздействия in vivo моногидрата L-малата азитромицина согласно изобретению, обладающего повышенной растворимостью в воде, тестировали, используя гончих собак, и сравнивали с воздействием in vivo дигидрата азитромицина.
В частности, двенадцать Marshall гончих собак (Beijing, средняя масса: 9,5±0,5 кг) разделяли на две группы, состоящие, каждая, из шести собак. Каждую из разделенных собак подвергали голоданию в течение 16 часов и затем перорально вводили содержащуюся в желатиновой капсуле разовую дозу, составляющую 20 мг/кг, моногидрата L-малата азитромицина согласно изобретению (тестируемая группа) или дигидрата азитромицина (контрольная группа). После введения периодически осуществляли заборы крови с последующим отделением плазмы. Образцы азитромицина, экстрагированные из плазмы, подвергали ЖХ/МС/МС анализу для измерения в ней количества азитромицина и расчета фармакокинетических параметров. Результаты приведены в таблице 7 и на ФИГ.7
** Tmax являетсявременем, при котором достигается Cmax
*** AUC0-время является площадью под кривой «концентрация-время» от времени 0 до времени последней измеряемой концентрации
Как показано в таблице 7, моногидрат L-малата азитромицина согласно изобретению обнаруживает улучшенные фармакокинетические параметры по сравнению с дигидратом азитромицина. Например, значение Cmax моногидрата L-малата согласно изобретению было приблизительно в два раза выше, чем Cmax дигидрата. Следовательно, моногидрат L-малата азитромицина по настоящему изобретению имеет высокую начальную концентрацию в крови, что является эффективным для лечения инфекций, вызываемых резистентными патогенными микроорганизмами.
Моногидрат L-малата азитромицина по настоящему изобретению может быть получен отдельно или в комбинации с фармацевтически приемлемыми добавками в соответствии с любым из общепринятых способов, используемых для приготовления мягких или твердых капсул, таблеток, суспензий, порошков и растворов.
Нижеследующие примеры получения предназначены для дополнительной иллюстрациинастоящегоизобретения, не ограничивая при этом его объем.
Пример получения 1: Капсула с азитромицином
Желатиновую капсулу получали, используя следующие ингредиенты:
Пример получения 2: Таблетка азитромицина
Таблетку получали, используя следующие ингредиенты:
Пример получения 3: Порошок азитромицина для перорального введения в виде суспензии
Порошок для перорального введения получали, используя следующие ингредиенты:
Как обсуждалось выше, моногидрат L-малата азитромицина в соответствии с настоящим изобретением обладает значительно более высокой растворимостью в воде, чем известный дигидрат азитромицина, так же как и хорошей термостойкостью и негигроскопичностью. Дополнительно, соль согласно изобретению превосходит известную соль по показателям фармацевтического воздействия в экспериментах на животных. Соответственно, моногидрат L-малата азитромицина по настоящему изобретению может быть преимущественно использован для лечения различных микробных инфекций.
Хотя изобретение описано относительно конкретных вариантов осуществления, следует понимать, что специалисты в данной области техники могут вносить в изобретение различные модификации и изменения, которые также входят в объем изобретения, определяемого прилагаемой формулой изобретения.




Изобретение относится к кристаллическому моногидрату L-малата азитромицина формулы (I), обладающему высокой устойчивостью, растворимостью и негигроскопичностью. Изобретение относится также к фармацевтической композиции для лечения микробной инфекции на основе соединения формулы (I) и к способу получения соединения формулы (I), включающему а) взаимодействие азитромицина с яблочной кислотой в водном органическом растворителе или b) перекристаллизацию безводного L-малата азитромицина из водного органического растворителя. 3 н. и 12 з.п. ф-лы, 7 табл., 7 ил.







| КЛАТРАТ ГИДРАТА АЗИТРОМИЦИНА С 1,2-ПРОПИЛЕНГЛИКОЛЕМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2002 |
|
RU2253654C2 |
| ЭТАНОЛЯТ АЗИТРОМИЦИНА, ПРОЦЕСС ПОЛУЧЕНИЯ И СОДЕРЖАЩИЕ ЕГО ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ | 1999 |
|
RU2240124C2 |
| US 4474768, 02.10.1984 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Частотный дискриминатор | 1980 |
|
SU984020A1 |
| EP 1498141 A1, 19.01.2005 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| СПОСОБ ПРОИЗВОДСТВА ИНСТАНТ-ПОРОШКА ДЛЯ ЦИКОРНО-ВИНОГРАДНОГО НАПИТКА | 2008 |
|
RU2369255C1 |
| АЗИТРОМИЦИН В ФОРМЕ МОНОГИДРАТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2279439C2 |
| SU 1287755 A3, 30.01.1987. | |||
Авторы
Даты
2009-03-10—Публикация
2006-06-05—Подача