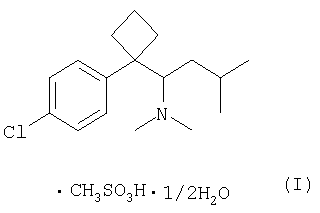
Настоящее изобретение относится к фармацевтической композиции, предназначенной для лечения или профилактики ожирения, включающей кристаллический полугидрат кислотно-аддитивной соли сибутрамина.
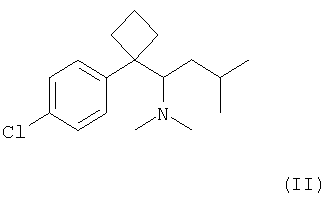
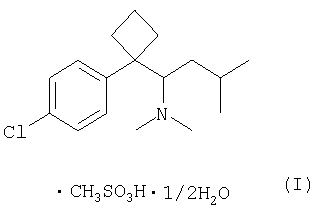
Сибутрамин, N,N-диметил-1-[(1-(4-хлорфенил)-циклобутил]-3-метилбутиламин формулы (II);
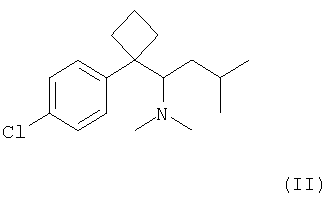
может использоваться для профилактики или лечения депрессии, болезни Паркинсона и ожирения (см. GB Patent №2098602, Korean Patent Publication №90-00274 и 99-164435, а также International Publication № WO 88/06444). Кроме этого, сибутрамин может использоваться для снижения резистентности к инсулину и повышению резистентности к сахару, а также для профилактики или лечения таких заболеваний, как подагра, гиперурикемия, гиперлипемия, остеоартрит, состояние тревоги, расстройство сна, сексуальные нарушения, синдром хронической усталости и холелитиаз (см. US Patent №№6174925, 5459164, 6187820, 6162831, 6232347, 6355685, 6365631, 6376554, 6376551 и 6376552).
Поскольку сибутрамин имеет низкую температуру плавления, в фармацевтических целях его используют в виде кислотно-аддитивной соли.
В GB Patent №2098302 и Korean Patent Publication №90-00274 раскрываются способы получения сибутрамина и его безводного гидрохлорида в качестве фармацевтически применимой кислотно-аддитивной соли. Однако безводный гидрохлорид сибутрамина представляет собой высокогигроскопичное соединение. Соответственно использование безводного гидрохлорида сибутрамина в фармацевтической композиции затруднительно.
Для решения указанных проблем был разработан негигроскопичный моногидрат гидрохлорида сибутрамина формулы (IV) (см. GB Patent №2184122 и Korean Patent Publication №94-08913), предназначенный для лечения ожирения.
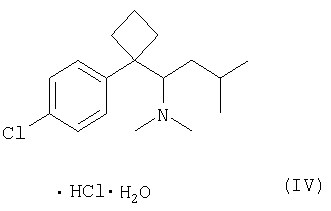
Однако моногидрат гидрохлорида сибутрамина формулы (IV), преназначенный для лечения ожирения, например, Meridia и Reductil, обладает относительно низкой растворимостью в воде, например, 2,9 мг/мл при рН 5,2, что не удовлетворяет низшему пределу желательной растворимости активного ингредиента фармацевтической композиции (см. Merck Index, 13th Ed, p.1522).
Соответственно, имеется потребность в разработке новой соли или гидрата кристаллического сибутрамина, подходящего для использования в фармацевтической композиции. Авторы настоящего изобретения предприняли попытку разработки полугидрата метансульфоната сибутрамина, обладающего высокой растворимостью в воде и являющегося негигроскопичным веществом, устойчивым в условиях высоких температур и высокой влажности.
Таким образом, цель настоящего изобретения состоит в создании фармацевтической композиции, предназначенной для лечения или профилактики ожирения, включающей кислотно-аддитивную соль сибутрамина, обладающую высокой растворимостью в воде и устойчивостью в условиях высоких температур и высокой влажности.
Другой целью настоящего изобретения является разработка способа получения указанного вещества.
Указанные выше и другие цели настоящего изобретения станут очевидными из совместного рассмотрения следующего ниже описания изобретения и прилагаемых фигур, соответственно изображающих следующее:
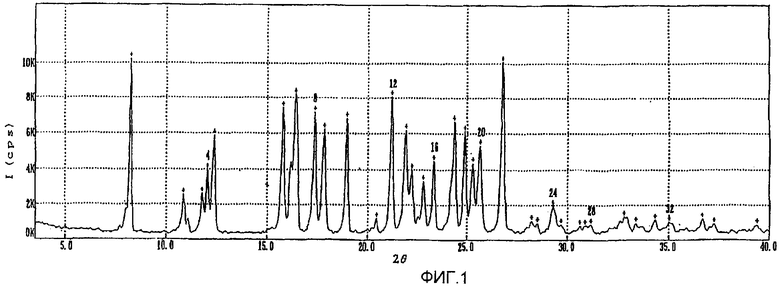
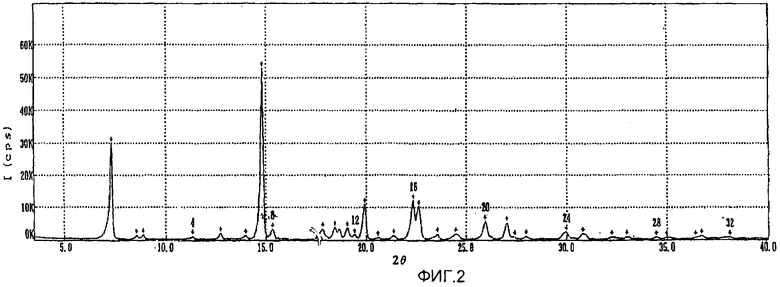
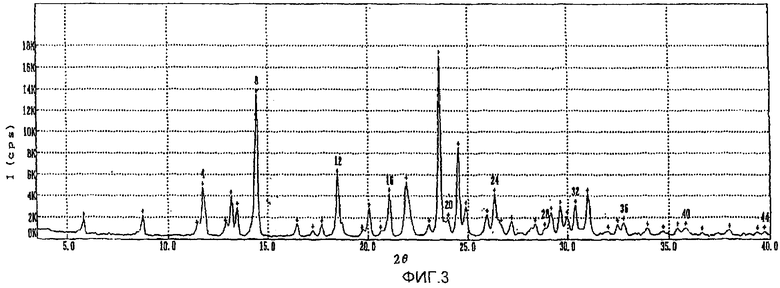
фиг.1-3: спектры порошковой рентгеновской дифракции кристаллического полугидрата метансульфоната сибутрамина формулы (I) настоящего изобретения, безводного метансульфоната сибутрамина формулы (II) и моногидрата метансульфоната сибутрамина формулы (IV), соответственно;
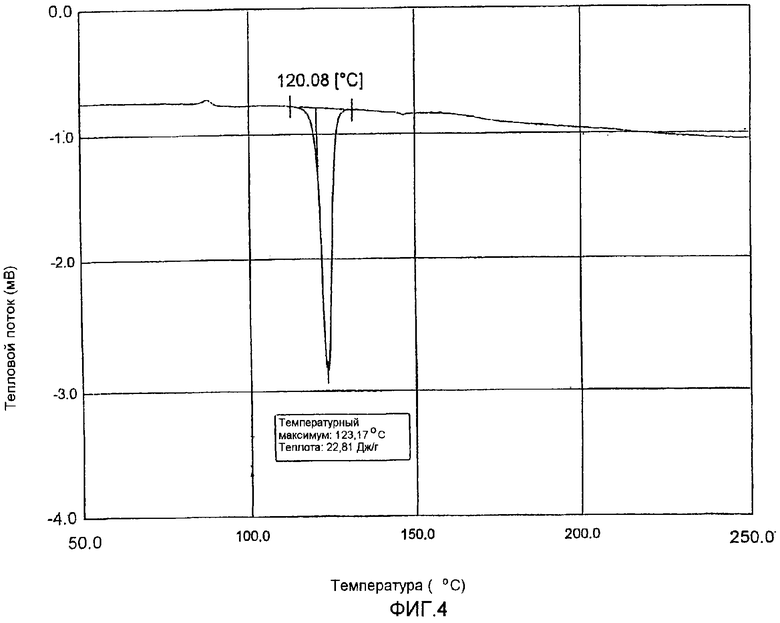
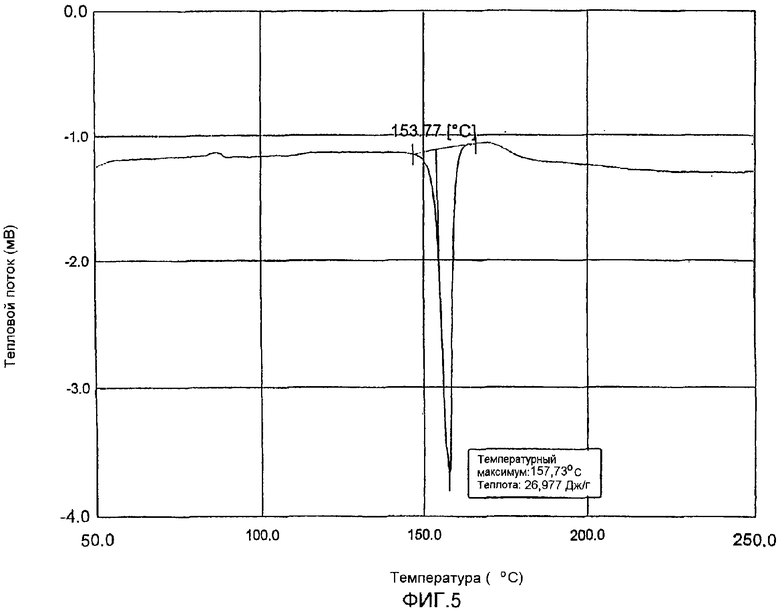
фиг.4 и 5: термограммы дифференциальной сканирующей калориметрии кристаллического полугидрата метансульфоната сибутрамина формулы (I) настоящего изобретения и безводного метансульфоната сибутрамина формулы (II), соответственно.
Настоящее изобретение раскрывает фармацевтическую композицию для лечения или профилактики ожирения, содержащую новый кристаллический полугидрат метансульфоната сибутрамина формулы (I), обладающий высокой растворимостью в воде и высокой стабильностью в условиях повышенной влажности/температуры.
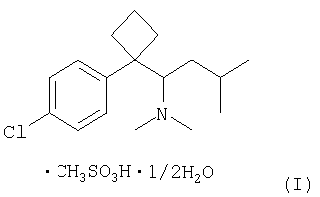
Кроме этого, настоящее изобретение представляет кристаллический полугидрат метансульфоната сибутрамина формулы (I), а также способ его получения.
Если не оговорено особо, то используемый в тексте описания термин «сибутрамин» относится к рацемическому сибутрамину.
Кристаллический полугидрат метансульфоната сибутрамина формулы (I) обладает высокой растворимостью в воде, устойчивостью в условиях высокой влажности/температуры и является негигроскопичным веществом, что делает его подходящим соединением для использования в фармацевтической композиции.
В рентгенограмме кристаллического полугидрата метансульфоната сибутрамина формулы (I) настоящего изобретения наблюдаются основные пики со следующими значениями 2θ:
8,2±0,2, 10,8±0,2, 11,7±0,2, 12,0±0,2, 12,3±0,2, 15,8±0,2, 16,4±0,2, 17,4±0,2, 17,8±0,2, 19,0±0,2, 21,2±0,2, 21,9±0,2, 22,2±0,2, 22,8±0,2, 23,3±0,2, 24,4±0,2, 24,9±0,2, 25,3±0,2, 25,6±0,2 и 26,8±0,2.
Настоящее изобретение также представляет два способа получения кристаллического полугидрата метансульфоната сибутрамина формулы (I).
Согласно первому аспекту изобретения, кристаллический полугидрат метансульфоната сибутрамина формулы (I) может быть получен взаимодействием сибутрамина формулы (II) с раствором метансульфокислоты в смеси органического растворителя с водой (далее в тексте, «способ 1»).

Согласно способу 1 метансульфокислота может использоваться а количестве 1-2 мольных эквивалента, предпочтительно 1-1,2 мольных эквивалента, в расчете на 1 моль сибутрамина формулы (II). Обычно метансульфокислоту по каплям добавляют к субстрату, который может представлять собой чистый сибутрамин или его раствор в органическом растворителе.
В качестве органического растворителя может использоваться простой эфир, сложный эфир, кетон или их смесь. Сложный эфир может выбираться из группы, состоящей из этилацетата, н-пропилацетата, изопропилацетата и н-бутилацетата; простой эфир может быть выбран из группы, состоящей из диэтилового эфира, диизопропилового эфира и трет-бутилметилового эфира; а кетон может быть выбран из группы, состоящей из ацетона, метилэтилкетона, и метилизобутилкетона. В том случае, когда используют смесь кетона и простого эфира, соотношение между кетоном и простым эфиром, предпочтительно, составляет 1:0,5-1:1,5, более предпочтительно, 1:2-1:3.
В рассматриваемом способе вода может использоваться в количестве 0,5-5 мольных эквивалентов в расчете на 1 моль сибутрамина формулы (II), а реакцию проводят при температуре в интервале от 0°С до температуры кипения растворителя, предпочтительно при 15-35°С, в течение 0,5-5 часов после добавления метансульфокислоты.
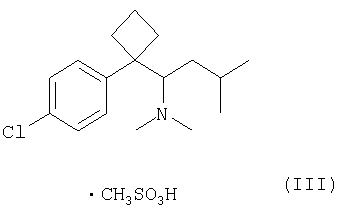
Согласно другому аспекту изобретения, кристаллический полугидрат метансульфоната сибутрамина формула (I) может быть получен (i) взаимодействием сибутрамина формулы (II) с метансульфокислотой в среде безводного органического растворителя с образованием безводного метансульфоната сибутрамина формулы (III); и (ii) взаимодействием метансульфоната сибутрамина формула (III) с водой в среде органического растворителя (далее «способ 2»).

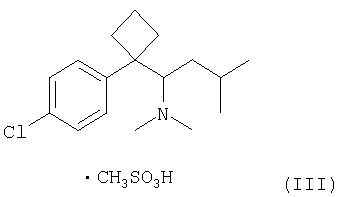
В способе 2 метансульфокислоту можно использовать в количестве 1-2 мольных эквивалента, предпочтительно 1-1,2 мольных эквивалента в расчете на 1 моль сибутрамина формула (II). Обычно метансульфокислоту по каплям добавляют к чистому сибутрамину формулы (II) или его раствору в органическом растворителе.
В качестве органического растворителя может использоваться сложный эфир, кетон, простой эфир, толуол или их смесь. Сложный эфир может выбираться из группы, состоящей из этилацетата, н-пропилацетата, изопропилацетата, и н-бутилацетата; кетон выбирают из группы, состоящей из ацетона, метилэтилкетона и метилизобутилкетона; простой эфир выбирают из группы, состоящей из этилового эфира, изопропилового эфира и трет-бутилметилового эфира.
В том случае, когда органический растворитель представляет собой смесь кетона и простого эфира, соотношение между кетоном и простым эфиром, предпочтительно, составляет 1:0,5-1:1,5, более предпочтительно, 1:2-1:3.
В способе 2 вода может использоваться в количестве 0,5-5 мольных эквивалентов в расчете на 1 моль сибутрамина формулы (II), а реакцию проводят при температуре в интервале от 0°С до температуры кипения растворителя, предпочтительно при 15-35°С, в течение 0,5-5 часов после добавления метансульфокислоты. Предпочтительно, чтобы безводный метансульфонат сибутрамина формулы (III) взаимодействовал с водой в течение времени от 2 часов до 5 дней.
Кристаллический полугидрат метансульфоната сибутрамина формулы (I), полученный 1-м или 2-м способом, обладает высокой растворимостью в воде, не является гигроскопичным материалом и характеризуется высокой устойчивостью в условиях высокой влажности/температуры.
Было проведено сравнительное исследование с целью выяснения возможности получения кристаллического полугидрата метансульфоната сибутрамина из энантиомеров сибутрамина, (+)- и (-)-сибутрамина. Однако было установлено, что кристаллический полугидрат метансульфоната сибутрамина не может быть получен из (+)- и (-)-сибутрамина.
Было проведено специальное исследование, направленное на выяснение возможности получения кристаллического полугидрата метансульфоната сибутрамина из (+)- и (-)-сибутрамина, выделенного из рацемического сибутрамина. Рацемический сибутрамин подвергали оптическому расщеплению с получением (+)- и (-)-сибутрамина в соответствии со способом, описанным в US Patent Publication US №2002/0006963, 2002/0006964 или International Patent Publication № WO 00/10551. После этого как (+)-, так и (-)-сибутрамин подвергали обработке согласно способу настоящего изобретения с целью установления возможности получения из них кристаллического полугидрата метансульфоната.
Было установлено, что способ настоящего изобретения не обеспечивает получения кристаллического полугидрата метансульфоната из (-)- или (+)-сибутрамина. Соответственно, специалисту в данной области трудно заранее предположить возможность получения кристаллического полугидрата метансульфоната сибутрамина.
Настоящее изобретение представляет фармацевтическую композицию для лечения ожирения и родственных заболеваний, содержащую в качестве активного ингредиента кристаллический полугидрат метансульфоната сибутрамина формулы (I) и фармацевтически применимый носитель, разбавитель, наполнитель или другие добавки.
Предпочтительную фармацевтическую композицию настоящего изобретения применяют в виде пероральной рецептуры в форме таблетки или капсулы.
Таблетки могут быть приготовлены смешиванием активного ингредиента с носителем, разбавителем или наполнителем. Примерами носителя, наполнителя и разбавителя, используемого в фармацевтической композиции настоящего изобретения, могут служить дезинтегратор (например, крахмал, сахар и манит); наполнитель или разбавитель (например, фосфат кальция и производные силиката); связующее вещество (например, карбоксиметилцеллюлоза и ее производные, желатин, и поливинилпирролидон); а также смазывающий материал (например, тальк, стеарат кальция и стеарат магния, а также полиэтиленгликоль(ли)).
В соответствие с традиционным способом, твердые или мягкие капсулы, содержащие активный ингредиент, могут быть изготовлены в отсутствии или с использованием такой добавки, как носитель, разбавитель и наполнитель.
Предпочтительное эффективное количество кристаллического полугидрата метансульфоната сибутрамина формулы (I) в фармацевтической композиции настоящего изобретения составляет 1-50 массовых частей в расчете на 250 массовых частей композиции.
Так, например, может быть получена фармацевтическая композиция, содержащая 10 мг кристаллического полугидрата метансульфоната сибутрамина формулы (I), 115 мг кристаллической целлюлозы, 115 мг лактозы, 5 мг диоксида кремния и 5 мг стеарата магния. Однако следует иметь в виду, что реально применяемое количество активного ингредиента определяют с учетом релевантных факторов, включающих состояние пациента, его возраст и массу, а также тяжесть симптомов заболевания; в связи с чем указанные выше дозировки композиции никоим образом не рассматриваются, как ограничивающие область изобретения.
Кристаллический полугидрат метансульфоната сибутрамина настоящего изобретения может использоваться для лечения или профилактики ожирения.
Следующие ниже примеры, не ограничивающие область изобретения, приведены для дополнительной его иллюстрации.
Препаративный пример 1:
Получение моногидрата гидрохлорида сибутрамина формулы (IV)
Безводный гидрохлорид сибутрамина получали по способу, описанному в GB Patent №2098602, или Korean Patent Publication №90-00274, и 10 г полученного продукта растворяли в кипящей смеси ацетона (110 мл) и воды (1,2 мл), фильтровали в горячем состоянии и перегоняли с целью концентрации фильтрата в соответствии со способом, раскрытым в GB Patent №2184122 или Korean Patent Publication №94-08913.
Полученный концентрат охлаждали и фильтровали с образованием кристаллов, который сушили в вакууме с получением 9,2 г указанного в заголовке соединения (Выход: 87%).
Препаративный пример 1:
Получение моногидрата гидрохлорида сибутрамина формулы (I) способом 1
1-1) Методика 1
30,0 г сибутрамина формулы (II) растворяли в 120 мл изопропилацетата, добавляли 1,94 мл воды, после чего по каплям добавляли 10,9 г метансульфокислоты. Реакционную смесь перемешивали в течение 1 часа, охлаждали до 0°С, снова перемешивали в течение 2 часов и затем фильтровали с образованием кристаллов. Полученные кристаллы последовательно промывали 30 мл изопропилацетата и 30 мл изопропилового эфира, и затем сушили при 50°С с получением 38,46 г указанного в заглавии соединения в виде белого твердого вещества (Выход: 92,5%).
Температура плавления: 164˜165°С (усадка примерно при 130°С).
Содержание воды: 2,35% (теоретическое значение: 2,34%); и
1Н-ЯМР (δ, DMSO-d6): 8,5 (1Н, уш.с.), 7,7˜7,2 (4Н, дд), 3,7 (1Н, т), 2,8 (3Н, д), 2,5 (2Н, д), 2,4 (3Н, с), 2,3 (2Н, д), 2,1 (3Н, д), 1,9 (1Н, м), 1,7˜1,6 (2Н, м), 1,3 (2Н, т), 1,0 (6Н, т).
1-2) Методика 2
10,0 г сибутрамина формулы (II) растворяли в смеси из 40 мл этилацетата и 40 мл третбутилметилового эфира, добавляли 0,97 мл воды, после чего по каплям добавляли 3,8 г метансульфокислоты. Реакционную смесь перемешивали в течение 1 часа, охлаждали до 0°С, снова перемешивали в течение 2 часов и затем фильтровали с образованием кристаллов. Полученные кристаллы последовательно промывали 30 мл изопропилацетата и 30 мл изопропилового эфира, и затем сушили при 50°С с получением 12,1 г указанного в заглавии соединения в виде белого твердого вещества (Выход: 88%). Полученный продукт содержал 2,38% воды (теоретическое значение: 2,34%), имел ту же температуру плавления и тот же спектр 1Н-ЯМР, что приведены в методике 1-1).
1-3) Методика 3
11,7 г указанного в заголовке соединения получали повторением методики, описанной выше в 1-2) (выход: 85%) за исключением того, что использовали 30 мл ацетона и 60 мл трет-бутилметилового эфира вместо 40 мл этилацетата и 40 мл трет-бутилметилового эфира. Содержание воды в указанном в заглавии соединении составило 2,27% (Теоретическое значение: 2,34%), причем его температура кипения и спектр 1Н-ЯМР были такими же, что и в методике 1-1).
Пример 2:
Получение подугидрата метансульфоната сибутрамина формулы (I) способом 2
2-1) Получение безводного метансульфоната сибутрамина формулы (III) (стадия 1 способа 2)
2-1-1) Методика 1
10,0 г сибутрамина формулы (II) растворяли в 70 мл ацетона и затем при комнатной температуре по каплям добавляли 3,75 г метансульфокислоты. Реакционную суспензию перемешивали в течение 1 часа, охлаждали до 0°С, снова перемешивали в течение 2 часов и затем фильтровали с образованием кристаллов. Полученные кристаллы промывали 30 мл эфира и затем сушили при 50°С с получением 11,7 г указанного в заглавии вещества в виде белого твердого материала (Выход: 88%).
Температура плавления: 164˜165°С
Содержание воды: 0,2% и
1Н-ЯМР (δ, DMSO-d6): 8,5 (1Н, уш.с.), 7,5 (4Н, дд), 3,7 (1Н, т), 2,8 (3Н, д), 2,5 (2Н, д), 2,4 (3Н, с), 2,3 (2Н, д), 2,1 (3Н, д), 1,9 (1Н, м), 1,7˜1,6 (2Н, м), 1,4 (2Н, т), 1,0 (6Н, т).
2-1-2) Методика 2
10,0 г сибутрамина формулы (II) растворяли в 80 мл толуола и затем при комнатной температуре по каплям добавляли 3,75 г метансульфокислоты. Реакционную суспензию перемешивали в течение 2 часов, охлаждали до 0°С, снова перемешивали в течение 2 часов и затем фильтровали с образованием кристаллов. Полученные кристаллы промывали 20 мл эфира и затем сушили при 50°С с получением 12,8 г указанного в заглавии вещества в виде белого твердого материала (Выход: 95%). Содержание воды в указанном в заглавии соединении составило 0,1%, причем его температура кипения и спектр 1Н-ЯМР были такими же, что наблюдались выше в 2-1-1).
2-1-3) Методика 3
12,5 г указанного в заголовке соединения в виде белого твердого вещества получали повторением методики, списанной выше в 2-1-2) (Выход: 93%) за исключением того, что вместо толуола использовали изопропилацетат. Содержание воды в полученном продукте составило 2,27% (Теоретическое значение: 2,34%), причем его температура кипения и спектр 1Н-ЯМР были такими же, что и в методике 2-1-1).
2-2) Получение полугидрата метансульфоната сибутрамина формулы (I) (стадия 2 способа 2)
2-2-1) Методика 1
5,0 г безводного метансульфоната сибутрамина формулы (III), полученного по любому из пунктов 2-1-1) или 2-1-3), растворяли в смеси из 50 мл эфира и 25 мл ацетона, после чего добавляли 0,72 мл воды. Реакционную смесь перемешивали в течение 18 часов при комнатной температуре и затем фильтровали с образованием кристаллов. Полученные кристаллы промывали 10 мл смеси из эфира и ацетона (2:1, об/об), сушили при 50°С с получением 3,89 г указанного в заглавии соединения в виде белого твердого материала (Выход: 76%). Содержание воды в полученном соединении составило 2,30% (теоретическое значение: 2,34%), причем его температура кипения и спектр 1Н-ЯМР были такими же, что наблюдались выше в 1-1).
2-2-2) Методика 2
10,0 г безводного метансульфоната сибутрамина формулы (III), полученного по любому из пунктов 2-1-1) или 2-1-3), растворяли в смеси из 100 мл эфира и 40 мл метилизобутилкетона, после чего в смесь добавляли 1,44 мл воды. Реакционную смесь перемешивали в течение 24 часов при комнатной температуре и затем фильтровали с образованием кристаллов. Полученные кристаллы промывали 30 мл смеси из эфира и метилэтилкетона (2:1, об/об), сушили при 50°С с использованием теплого воздуха с получением 7,5 г указанного в заглавии соединения в виде белого твердого материала (Выход: 73%). Содержание воды в полученном соединении составило 2,32% (теоретическое значение: 2,34%), причем его температура кипения и спектр 1Н-ЯМР были такими же, что наблюдались в пункте 1-1).
Пример 3:
Качественный анализ структуры кристаллического полугидрата метансульфоната сибутрамина формулы (I)
Из данных порошковой рентгеновской дифракции и термограммы дифференциальной сканирующей калориметрии следует, что структура полугидрата метансульфоната сибутрамина формулы (I) отличается от моногидрата гидрохлорида сибутрамина формулы (IV) (см. фиг.1-5).
Порошковая рентгенограмма полугидрата метансульфоната сибутрамина формулы (I) содержит характеристические пики (фиг.1, представленные в Таблице 1. В Таблице 1 обозначения «2θ», «d» и «I/Iо» относятся к углам дифракции, расстоянию между гранями кристалла и относительной интенсивности пика, ответственно.
Экспериментальный пример 1:
Растворимость в воде
Полугидрат метансульфоната сибутрамина формулы (I) и моногидрат гидрохлорида сибутрамина растворяли до точки насыщения при рН 5,2 и затем анализировали методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с целью определения растворенного количества вещества (в расчете на безводный сибутрамин). Полученные результаты представлены в Таблице 2.
Полугидрат метансульфоната сибутрамина формулы (I)
2500
Как следует из Таблицы 2, полугидрат метансульфоната сибутрамина формулы (I) обладает существенно более высокой растворимостью в воде, чем моногидрат гидрохлорида сибутрамина формулы (IV).
Экспериментальный пример 2:
Устойчивость в условиях высокой влажности температуры
В этом эксперименте сравнивали термостабильность кристаллического полугидрата метансульфоната сибутрамина формулы (I) и моногидрата гидрохлорида сибутрамина формулы (IV) в ходе длительного хранения. Количества не претерпевшего изменений кристаллического полугидрата метансульфоната формулы (I) и моногидрата гидрохлорида сибутрамина формулы (IV) при 60°С через 1, 2, 3 и 6 месяцев приведены в Таблице 3.
Из представленных выше результатов следует, что кристаллический полугидрат сибутрамина обладает такой же стабильностью, что и моногидрат гидрохлорида сибутрамина.
Экспериментальный пример 3:
Тест на отсутствие гигроскопичности
Каждое из веществ, представляющее собой кристаллический полугидрат метансульфоната сибутрамина формулы (I), моногидрат гидрохлорида сибутрамина (IV) и безводный метансульфонат сибутрамина, подвергали воздействию высокой температуры/влажности, при 40°С и относительной влажности 75%, в течение 1, 2 и 5 дней и их влагосодержание измеряли с использованием анализатора влажности Kaal-Fisher. Полученные результаты представлены в Таблице 4.
Аналогичные серии экспериментов проводили при 40°С и относительной влажности 10% с целью выяснения устойчивости соответствующих соединений в относительно сухих условиях.
Содержание воды (% масс)
Как следует из Таблицы 4, кристаллический полугидрат метансульфоната сибутрамина формулы (I) не проявляет гигроскопичности в условиях высокой влажности, при этом он не выделяет кристаллизационную воду в сухих условиях.
Экспериментальный пример 4:
Влияние на потерю массы
В эксперименте использовали 16 Zuker крыс (fa/fa) с избыточной массой и такое же количество тощих Zuker крыс Fa/Fa), которых подразделяли на группу, принимавшую лекарство, и контрольную группу (по 8 крыс в каждой группе) и перед испытанием измеряли массу каждой крысы. Ежедневно, в течение 21 дня, на каждой крысе из групп, получающих лекарство, применяли 3 мг/кг кристаллического полугидрата метансульфоната сибутрамина, в то время, как животным из контрольной группы вводили индифферентное связующее вещество. В течение испытательного периода крысы имели свободный доступ к пище с высоким содержанием жиров, после чего определяли средние массы животных из группы, принимавшей лекарство, и контрольной группы с целью подсчета увеличения и потери массы.
избыточной массой
29,6
20,4
Как следует из данных, представленных в Таблице 5, группа, принимавшая кристаллический полугидрат метансульфоната формулы (I), демонстрировала заметную потерю массы по сравнению с контрольной группой. Таким образом, продемонстрировано, что кристаллический полугидрат метансульфоната формулы (I) полезен в лечении или профилактике ожирения.
Сравнительный пример:
Неудавшееся получение полугидрата метансульфоната (+)- и (-)- сибутрамина
(1) Оптическое расщепление сибутрамина формулы (II) (получение (+)- и (-)-сибутрамина формулы (II))
12,3 г рацемического сибутрамина растворяли в 85 мл этилацетата и в смесь добавляли раствор L-DBTA в 85 мл этилацетата. Реакционную смесь нагревали с обратным холодильником, охлаждали до комнатной температуры и отфильтровывали с образованием кристаллов (в пределах ошибки около 85%). После этого, полученные кристаллы суспендировали в 120 мл этилацетата и смесь нагревали с обратным холодильником с получением твердого вещества. Твердое вещество перекристаллизовывали из 450 мл изопропилового спирта с получением L-DBTA соли (-)-сибутрамина (в пределах ошибки: ≥99,3). L-DBTA соль (-)-сибутрамина нейтрализовали насыщенным раствором бикарбоната натрия и затем экстрагировали хлороформом с получением (-)-сибутрамина в виде свободного основания.
Фильтрат, полученный фильтрацией после реакции с L-DBTA, нейтрализовали до рН 8,5 с помощью гидроксида натрия и затем экстрагировали хлороформом с получением (+)-сибутрамина, представляющего собой практически чистый (+)-изомер. Для получения кристаллов добавляли D-DBTA и полученные кристаллы перекристаллизовывали из 450 мл изопропилового спирта с получением D-DBTA соли (+)-сибутрамина (в пределах ошибки ≥99,3%). D-DBTA соль (-)-сибутрамина нейтрализовали до рН 8,5 с помощью насыщенного раствора бикарбоната натрия и затем экстрагировали хлороформом с образованием (+)-сибутрамина в виде свободного основания.
(2) Получение метансульфоната (+) и (-)-сибутрамина
(+)- и (-)-сибутрамин в виде свободных оснований, полученных выше в (1), обрабатывали по методике, описанной в пункте 2-1-2) Примера 2 с получением соответствующего безводного метансульфоната.
Метансульфонат (+)-сибутрамина: т.пл. 156,5˜157,5°С, содержание воды 0,30%;
Метансульфонат (-)-сибутрамина: т.пл. 156,5˜157,5°С, содержание воды 0,05%.
(3) Попытка получения полугидрата метансульфоната (+)- и (-)-сибутрамина
Безводный метансульфонат (+)- и (-)-сибутрамина, полученный в (2), обрабатывали по той же методике, что описана в пункте 2-2) Примера 2. Однако образование кристаллов не наблюдалось.
С целью индукции кристаллообразования растворитель для метансульфоната (+)- или (-)-сибутрамина заменяли на толуол. Однако полученные кристаллы имели такую же температуру плавления и то же содержание воды, что и кристаллы безводного метансульфоната (+)- и (-)-сибутрамина, полученные выше в (2), соответственно.
Кроме этого, каждый безводный метансульфонат (+)- и (-)-сибутрамина выдерживали в течение 1 дня при комнатной температуре и относительной влажности 75%. Каждый из образцов расплавлялся за 2 часа, и за 1 день превращался в прозрачную жидкость.
Полученные результаты показывают, что полугидрат метансульфоната сибутрамина не может быть получен из любого энантиомера.
Хотя настоящее изобретение описано со ссылкой на специальные воплощения, очевидно, что специалист в данной области сможет произвести различные модификации и изменения настоящего изобретения, которые охватываются областью изобретения, определенной в прилагаемой формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЛЬ И ПОЛИМОРФ ФЕНИЛ-ПИРИМИДОНОВОГО СОЕДИНЕНИЯ, ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2018 |
|
RU2761213C2 |
| НОВЫЕ КОМПЛЕКСЫ АГОМЕЛАТИНА И СУЛЬФОКИСЛОТ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, КОТОРЫЕ ИХ СОДЕРЖАТ | 2014 |
|
RU2673080C2 |
| ПАРОКСЕТИН ХОЛАТ ИЛИ СОЛИ ПРОИЗВОДНЫХ ХОЛЕВОЙ КИСЛОТЫ И КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПАРОКСЕТИН И ХОЛЕВУЮ КИСЛОТУ ИЛИ ПРОИЗВОДНЫЕ ХОЛЕВОЙ КИСЛОТЫ | 2004 |
|
RU2337919C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТИАЗОЛЬНОГО ПРОИЗВОДНОГО | 2016 |
|
RU2738937C2 |
| (S)-(-)-АМЛОДИПИНА КАМЗИЛАТ ИЛИ ЕГО ГИДРАТ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ИХ | 2007 |
|
RU2403241C1 |
| КРИСТАЛЛИЧЕСКИЙ КЛОПИДОГРЕЛЬ НАФТАЛИНСУЛЬФОНАТ ИЛИ ЕГО ГИДРАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2004 |
|
RU2328501C1 |
| ФЕНИЛАМИНОПИРИМИДИН ИЛИ ПОЛИМОРФНАЯ ФОРМА СОЛИ ФЕНИЛАМИНОПИРИМИДИНА | 2016 |
|
RU2712226C2 |
| ПРОИЗВОДНЫЕ 6-МЕТОКСИ-1Н-БЕНЗОТРИАЗОЛ-5-КАРБОКСАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2141958C1 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА И СОЛЕВАЯ ФОРМА ИНГИБИТОРА TGF-βRI И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2018 |
|
RU2750702C1 |
| КРИСТАЛЛ ПРОИЗВОДНОГО 1,3,5-ТРИАЗИНА ИЛИ ЕГО СОЛЬВАТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2020 |
|
RU2837449C1 |
Изобретение относится к области фармакологии и касается фармацевтической композиции для лечения или профилактики ожирения, включающей кристаллический полугидрат метансулфоната сибутрамина, кристаллического полугидрата метансулфоната сибутрамина, способа его получения и применения. Продукт обладает улучшенной растворимостью. 5 н. и 7 з.п. ф-лы, 5 ил., 5 табл.
8,2±0,2, 10,8±0,2, 11,7±0,2, 12,0±0,2, 12,3±0,2, 15,8±0,2, 16,4±0,2, 17,4±0,2, 17,8±0,2, 19,0±0,2, 21,2±0,2, 21,9±0,2, 22,2±0,2, 22,8±0,2, 23,3±0,2, 24,4±0,2, 24,9±0,2, 25,3±0,2, 25,6±0,2 и 26,8±0,2.

8,2±0,2, 10,8±0,2, 11,7±0,2, 12,0±0,2, 12,3±0,2, 15,8±0,2, 16,4±0,2, 17,4±0,2, 17,8±0,2, 19,0±0,2, 21,2±0,2, 21,9±0,2, 22,2±0,2, 22,8±0,2, 23,3±0,2, 24,4±0,2, 24,9±0,2, 25,3±0,2, 25,6±0,2 и 26,8±0,2.
с метансульфокислотой, растворенной в смеси воды и органического растворителя, выбранного из группы, состоящей из сложного эфира, простого эфира, кетона и их смеси, в котором метансульфокислоту и воду используют в количестве 1-2 мольных эквивалентов и 0,5-5 мольных эквивалентов соответственно в расчете на 1 моль сибутрамина формулы (II).

и (ii) контактирования метансульфоната формулы (III)
с водой в среде органического растворителя, выбранного из группы, состоящей из сложного эфира, простого эфира, кетона и их смеси, причем воду используют в количестве 0,5-5 мольных эквивалента в расчете на 1 моль безводного метансульфоната сибутрамина формулы (III).
Приоритет по пунктам:
| ГЛИКОКОНЪЮГАТЫ 20(S)-КАМПТОТЕЦИНА | 1998 |
|
RU2184122C2 |
| US 4814352 A, 21.03.1989 | |||
| US 4806570 A, 21.02.1989 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2007-01-10—Публикация
2003-09-25—Подача