ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение в общем относится к грануле, покрытой энтеросолюбильной оболочкой, содержащей иксабепилон. Предусмотрен также способ приготовления этой гранулы, покрытой энтеросолюбильной оболочкой. Предусмотрен также способ лечения рака или других пролиферативных заболеваний с применением гранулы, покрытой энтеросолюбильной оболочкой.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Иксабепилон представляет собой макроциклическое соединение, имеющее следующую структуру:

Иксабепилон проявляет действие, стабилизирующее микроканальцы, подобно таксолу TAXOL® и поэтому обладает цитотоксической активностью против быстро пролиферирующих клеток, таких, которые образуются при раковых и других гиперпролиферативных клеточных болезнях (см. Angew. Chem. Int. Ed. Engl., Vol.35, No. 13/14, 1996 и D.M.Bollag, Exp. Opin. Invest. Drugs, 6 (7): 867-873, 1997).
Однако прежде чем иксабепилон может быть применен для лечения болезней у пациентов, на его основе должна быть получена фармацевтическая композиция, которая может быть введена пациенту, например, в виде лекарственной формы, пригодной для орального введения, введения через слизистую оболочку (например путем назального, подъязычного, вагинального, буккального или ректального введения), парентерального (например, подкожного, внутривенного, инъекции болюса, внутримышечного или внутриартериального) или трансдермального введения. Особенно предпочтительными являются составы для перорального введения, так как их более удобно и легко вводить, чем другие составы. Кроме того, пероральный путь введения позволяет избежать боли и дискомфорта, свойственных парентеральному введению. Пациенты также предпочитают пероральное введение, оно приводит к лучшей переносимости пациентом схем приема лекарств.
Пероральное введение включает прохождение иксабепилона через желудок, где он подвергается действию желудочных жидкостей с низким рН и затем попадает в тонкую кишку, где иксабепилон абсорбируется потоком крови. Время прохождения через желудок составляет примерно два часа. Величина рН в желудке равна примерно 1-3. Тонкая кишка включает двенадцатиперстную кишку, тощую кишку и подвздошную кишку, величина рН в этих областях составляет от примерно 5 до примерно 7,2. Однако иксабепилон лабилен в кислой среде при максимальной стабильности в водном растворе в интервале рН между 7 и 8,5. Таким образом, иксабепилон подвержен разложению, распаду или дезактивации в водном растворе, особенно в кислых растворах, таких как находящиеся в желудке. При пероральном введении биодоступность иксабепилона зависит от минимизации иксабепилона в кислых условиях, наблюдающихся при прохождении через желудок.
В патенте США №6576651 описан способ перорального введения иксабепилона. Способ включает оральное введение иксабепилона и орального введения одного или более фармацевтически приемлемых буферов, нейтрализующих кислоту. Буфер, нейтрализующий кислоту, может быть введен до, одновременно или после введения иксабепилона. Описанный способ позволяет осуществить доставку иксабепилона млекопитающему, при этом удается снизить или избежать распада, разложения или дезактивации иксабепилона в желудочно-кишечной системе, особенно под действием желудочной жидкости в желудке. Кроме того, онкологические пациенты часто вынуждены принимать другие лекарственные средства, для некоторых из которых могут быть нежелательными щелочные условия в желудке. Поэтому желательны оральная лекарственная форма и способ перорального введения иксабепилона, который не требует нейтрализации кислоты в желудке.
Один способ защиты иксабепилона от контакта с содержимым желудка состоит в снабжении частиц иксабепилона энтеросолюбилъным покрытием. Иксабепилон обычно получают в виде мелкого порошка, и до нанесения энтеросолюбильного покрытия мелкие частицы иксабепилона нуждаются в гранулировании для получения больших частиц, содержащих лекарство. Однако иксабепилон представляет собой активное лекарство, и любой сухой процесс с участием иксабепилона, включая способ сухого гранулирования, потребует специальных предосторожностей в процессе получения лекарственной формы. Например, могут потребоваться установка для локализации и производственное оборудование с особым техническим контролем для уменьшения количества или устранения пыли, образующейся во время стадий "сухого" процесса. Такие установка и оборудование требуют планирования и больших капиталовложений. Необходимо создание лекарственной формы, которая может быть приготовлена способом, который сводит к минимуму наличие сухого иксабепилона.
Мокрый способ получения гранулы иксабепилона с энтеросолюбильным покрытием может уменьшить или устранить образование пыли из сухого иксабепилона. Однако иксабепилон склонен к распаду, разложению или дезактивации в присутствии воды и/или при нагревании. Необходим мокрый способ, в частности водный способ, получения гранулы, содержащей энтеросолюбильную оболочку и содержащей иксабепилон.
В соответствии с данным изобретением предусмотрен способ получения гранулы с энтеросолюбильной оболочкой, который позволяет снизить или устранить пыление порошка иксабепилона. Кроме того, предусмотрена гранула с энтеросолюбильной оболочкой, которая пригодна для орального введения иксабепилона без совместного введения буфера, нейтрализующего кислоту.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к грануле с энтеросолюбильной оболочкой, включающей частицу с покрытием, содержащую основную частицу и слой активного ингредиента, расположенный на основной частице, при этом слой активного ингредиента содержит иксабепилон или его фармацевтически приемлемую соль, сольват, клатрат, гидрат или его пролекарство и одно или более связующих, а также энтеросолюбильное покрытие, инкапсулирующее частицу с покрытием.
Предусмотрен также способ получения гранулы с энтеросолюбильной оболочкой, капсулы, содержащей гранулы с энтеросолюбильной оболочкой, а также способ лечения рака или других пролиферативных заболеваний, включающий пероральное введение гранулы с энтеросолюбилъной оболочкой пациенту, нуждающемуся в этом.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
При описании данного изобретения применяются следующие определения различных терминов.
Термин "иксабепилон" охватывает иксабепилон или его фармацевтически приемлемую соль, сольват, клатрат, гидрат или его пролекарство, этот термин используется по всему описанию.
Используемый в данном описании термин "в основном не содержащая влаги" относится к композиции, содержащей менее примерно 4% по весу воды, предпочтительно менее примерно 3% по весу воды и более предпочтительно менее примерно 2% по весу воды в расчете на вес композиции. Примеры количеств, подпадающих под определение "в основном не содержащая воды", включают содержание воды от нуля до примерно менее 4% по весу, предпочтительно от нуля до примерно менее 3% по весу и более предпочтительно от нуля до менее примерно 2% по весу в расчете на вес композиции.
Получение, композиция и применение иксабепилона описаны в патенте США №6365749 В1, патенте США №6518421 В1, патенте США №6576651 В1, патенте США №6605599 В1, патенте США №6686380 В1; в заявке США на патент №20030073677 А1, в заявке США на патент №20040024032 А1 и в заявке США на патент №2004026254 А1.
Данное изобретение относится к грануле с энтеросолюбильной оболочкой, содержащей иксабепилон, которая пригодна для перорального введения пациенту. Гранула с энтеросолюбильным покрытием включает частицу с покрытием, которая содержит слой активного ингредиента, расположенный на основной частице; и энтеросолюбильное покрытие, инкапсулирующее частицу с покрытием. Слой активного ингредиента содержит иксабепилон и по меньшей мере одно связующее. Энтеросолюбильное покрытие способно защитить иксабепилон, который имеет тенденцию к распаду, разложению или дезактивации во время воздействия кислых условий, желудочных жидкостей с низкими величинами рН, обычно встречающихся во время прохода через желудок в кишечник. Энтеросолюбильное покрытие способно свести к минимуму или предотвратить действие кислоты на слой активного ингредиента в желудке. Это предохраняет иксабепилон от высвобождения в желудке или кислоту в желудке от проникновения через слой активного ингредиента. При попадании гранулы с энтеросолюбильной оболочкой в тонкую кишку энтеросолюбильное покрытие частично или полностью растворяется в среде с более высоким значением рН в кишечнике, что приводит к высвобождению иксабепилона и его попаданию в поток крови пациента.
Гранула с энтеросолюбильным покрытием содержит частицу с покрытием, инкапсулированную в энтеросолюбильном покрытии. Частица с покрытием содержит основную частицу, которая является зародышевой частицей для нанесения слоя активного ингредиента. Основная частица выполнена из фармацевтически приемлемого материала, который способен нести слой активного ингредиента. Обычно основная частица содержит, например, фармацевтически инертный материал, такой как, например, сахар, крахмал, микрокристаллическую целлюлозу, лактозу или их сочетание. Основная частица может также содержать один или несколько активных ингредиентов. Основная частица обычно имеет сферическую или полусферическую форму, хотя предусмотрены и другие формы. Средние диаметры основных частиц обычно находятся в пределах от примерно 0,1 мм до примерно 5 мм. Примеры подходящих основных частиц включают Nu-Pareil™ Sugar Spheres NF (Chr. Hansen, Inc., WI), Celphere™, представляющие собой сферы из микрокристаллической целлюлозы (Asahi Kasei Kogyo Kabushiki Kaisha Corp., Japan). Обычно гранула с энтеросолюбильной оболочкой содержит, например, от примерно 10 до примерно 80 вес.% основной частицы, предпочтительно от примерно 15 до примерно 70 вес.% основной частицы и более предпочтительно от примерно 20 до примерно 65 вес.% основной частицы в расчете на вес гранулы с энтеросолюбильной оболочкой. Предпочтительно, чтобы основная частица в основном не содержит влаги. Более предпочтительно, чтобы основная частица содержала менее 3 вес.% воды в расчете на вес основной частицы.
Частица с покрытием содержит слой активного ингредиента, расположенный на основной частице. Слой активного ингредиента наносится на основную частицу и может образовать поверхностный слой на поверхности основной частицы, абсорбироваться основной частицей, или же может происходить и то, и другое. Слой активного ингредиента может быть полностью или частично распределен на, в и/или под поверхностью основной частицы. Предпочтительно, чтобы слой активного ингредиента равномерно располагался на поверхности основной частицы.
Слой активного ингредиента содержит иксабепилон или его фармацевтически приемлемую соль, сольват, клатрат, гидрат и его пролекарство. Помимо иксабепилона слой активного ингредиента может содержать по меньшей мере один дополнительный активный агент, такой как противораковый агент. По одному из вариантов слой активного ингредиента может содержать смесь иксабепилона и его фармацевтически приемлемой соли, сольвата, клатрата, гидрата или его пролекарства. Например, слой активного ингредиента может включать смесь иксабепилона и клатрата иксабепилона. Подходящие количества иксабепилона включают, например, количество в пределах от примерно 0,1 вес.% до примерно 10 вес.%, предпочтительно от примерно 0,2 вес.% до примерно 5 вес.% и более предпочтительно от примерно 0,5 вес.% до примерно 4 вес.% в расчете на вес гранулы с энтеросолюбильной оболочкой.
Слой активного ингредиента также содержит связующее. Связующее может быть применено для повышения адгезии иксабепилона к основной частице и/или для обеспечения когезии слоя активного ингредиента. Материалы, пригодные в качестве связующих, включают, например, крахмал, желатин, сахара, такие как сахароза, глюкоза, декстроза, молассы, лактоза; природные и синтетические смолы, такие как смола акации, альгинат натрия, метилцеллюлоза, карбоксиметилцеллюлоза и поливинилпирролидон (PVP) и сополимеры винилпирролидона, такие как поливинилпирролидон/поливинилацетат (PVP-PVA); целлюлозы, такие как этилцеллюлоза, гидроксипропилделлюлоза или гидроксипропилметилцеллюлоза; полиэтиленгликоль и воски. Например, подходящие коммерчески доступные материалы включают целлюлозные кристаллитные материалы Avicel РН 101, Avicel RC 591 и Avical™ CL 611 (FMC Corp., PA). В слое активного ингредиента могут быть применены одно или несколько разных связующих. Один или несколько возможных ингредиентов, которые могут быть включены в состав слоя активного ингредиента, представляют собой, например, буферы, антивспенивающие агенты и пластификаторы. Гранула с энтеросолюбильной оболочкой может содержать, например, от примерно 2 до примерно 80 вес.% слоя активного ингредиента, предпочтительно от примерно 10 до примерно 70 вес.% слоя активного ингредиента и более предпочтительно от примерно 20 до примерно 60 вес.% слоя активного ингредиента в расчете на вес гранулы с энтеросолюбильной оболочкой. Предпочтительно, чтобы слой активного ингредиента в основном не содержал влаги.
Гранула с энтеросолюбильной оболочкой имеет энтеросолюбильное покрытие, в котором инкапсулирована частица с покрытием. Энтеросолюбильное покрытие является нерастворимым или имеет низкую растворимость в кислых растворах, характерных для желудочных жидкостей, встречающихся в желудке, величина рН при этом менее примерно 3. При более высоком значении рН, таком, которое встречается в тонкой кишке, энтеросолюбильная оболочка растворяется, приводя к высвобождению иксабепилона. Примеры более высоких значений рН, которые наблюдаются в тонкой кишке, включают значения рН более примерно 4,5, предпочтительно более примерно 5 и наиболее предпочтительно, чтобы величины рН находились в пределах от примерно 5 до примерно 7,2.
Подходящие материалы для образования энтеросолюбильной оболочки включают, например, полимеры для получения энтеросолюбильных покрытий, такие как, например, гидроксипропилметилцеллюлозы фталат, поливинилацетатфталат, ацетатфталат целлюлозы, сополимеры акриловой кислоты, ацетатсукцинат гидроксипропилметилцеллюлозы и сополимеры метакриловой кислоты. Одним из примеров подходящих сополимеров метакриловой кислоты является Eudragit™ L-30-D 55 в виде водной дисперсии этого сополимера, который представляет собой анионный сополимер, полученный на основе метакриловой кислоты и этилакрилата с отношением свободных карбоксильных групп к группам этилового эфира, равным примерно 1:1, и со средним молекулярным весом, равным примерно 250000, и поставляется в виде водной дисперсии, содержащей 30% по весу твердого вещества. Водная дисперсия сополимера Eudragit™ L-30-D 55 поставляется Röhm-Pharma Co., Germany.
Гранула с энтеросолюбильной оболочкой может содержать, например, от примерно 5 до примерно 55 вес.% энтеросолюбильного покрытия, предпочтительно от примерно 10 до примерно 45 вес.% энтеросолюбильного покрытия и более предпочтительно от примерно 15 до примерно 40 вес.% энтеросолюбильного покрытия в расчете на вес энтеросолюбильной оболочки. Предпочтительно, чтобы энтеросолюбильное покрытие в основном не содержало влаги.
Энтеросолюбильное покрытие может содержать другие материалы, такие как пластификаторы, красители, антивспенивающие агенты и агенты, предотвращающие адгезию. Гранула с энтеросолюбильным покрытием может содержать один или несколько подслоев, которые расположены между основной частицей и слоем активного ингредиента или слоем активного ингредиента и энтеросолюбильной оболочкой. Подслой может быть применен для сведения к минимуму контакта между иксабепилоном, содержащимся в слое активного ингредиента, и энтеросолюбильным покрытием, содержащим кислотные группы, например, в сополимере метакриловой кислоты. Например, гранула с энтеросолюбильной оболочкой может содержать от примерно 0,1 до примерно 10 вес.% подслоя, предпочтительно от примерно 0,5 до примерно 5 вес.% подслоя и более предпочтительно от примерно 2 до примерно 4 вес.% подслоя в расчете на вес гранулы с энтеросолюбильной оболочкой. Подходящие материалы для получения подслоя включают крахмал, желатин, сахара, такие как сахароза, глюкоза, декстроза, молассы и лактоза; природные и синтетические смолы, такие как смола акации, альгинат натрия, метилцеллюлоза, карбоксиметилцеллюлоза и полимеры и сополимеры винилпирролидона (PVP), такие как сополимеры PVP-PVA; целлюлозы, такие как этилцеллюлоза, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза; полиэтиленгликоль и воски. Подслой может также содержать один или несколько пластификаторов, таких как полиэтиленгликоль, пропиленгликоль, триэтилцитрат, триацитин, диэтилфталат, трибутилсебацинат или их сочетания.
По одному из вариантов гранула с энтеросолюбильной оболочкой содержит подслой, расположенный между слоем активного ингредиента и энтеросолюбильным покрытием. В этом варианте гранула с энтеросолюбильной оболочкой может содержать от примерно 0,1 до примерно 10 вес.% подслоя, предпочтительно от примерно 0,5 до примерно 5 вес.% подслоя и, более предпочтительно, от примерно 2 до примерно 4 вес.% подслоя в расчете на вес гранулы с энтеросолюбильной оболочкой. Предпочтительно, чтобы подслой по существу не содержал влаги.
Гранула с энтеросолюбильной оболочкой может содержать другие компоненты, такие как ароматизаторы, консерванты и красители, если это является необходимым или желательным.
По одному из вариантов, не ограничивающих данное изобретение, гранула с энтеросолюбильным покрытием по существу не содержит влаги. Предпочтительно, чтобы гранула с энтеросолюбильным покрытием содержала менее примерно 4 вес.% воды, предпочтительно менее примерно 3 вес.% воды и более предпочтительно менее 2 вес.% воды в расчете на вес гранулы с энтеросолюбильной оболочкой.
Гранула с энтеросолюбильной оболочкой может контактировать с гидрофобным материалом, таким как тальк, стеарат магния или коллоидная двуокись кремния, для образования гидрофобного слоя на поверхности гранулы с энтеросолюбильной оболочкой. Гидрофобный слой нужен для уменьшения агломерации отдельных гранул с энтеросолюбильной оболочкой и/или для уменьшения статического электричества во время обработки гранул с энтеросолюбильной оболочкой.
По одному из вариантов изобретения гранула с энтеросолюбильной оболочкой содержит частицу с покрытием и энтеросолюбильное покрытие, инкапсулирующее частицу с покрытием.
По другому варианту изобретения гранула с энтеросолюбильной оболочкой содержит: частицу с покрытием, включающую основную частицу, подслой, расположенный на основной частице, и слой активного ингредиента, расположенный на подслое, а также энтеросолюбильную оболочку, в которой инкапсулирована частица с покрытием.
По третьему варианту изобретения гранула с энтеросолюбильной оболочкой включает: частицу с покрытием, подслой, расположенный на частице с покрытием, и энтеросолюбильное покрытие, в котором инкапсулирована частица с покрытием.
Согласно четвертому варианту изобретения гранула с энтеросолюбильным покрытием включает: частицу с покрытием, содержащую основную частицу, первый подслой, расположенный на основной частице, и слой активного ингредиента, расположенный на этом подслое, второй подслой, расположенный на частице с покрытием, и энтеросолюбильное покрытие, в котором инкапсулирована частица с покрытием.
Согласно пятому варианту изобретения гранула, содержащая энтеросолюбильное покрытие, включает: частицу с покрытием, в которой основная частица содержит также второй фармацевтически активный ингредиент, энтеросолюбильное покрытие, в котором инкапсулирована частица с покрытием.
Гранула с энтеросолюбильной оболочкой по изобретению может содержать первый подслой, расположенный между основной частицей и слоем активного ингредиента, и второй подслой, расположенный между частицей с покрытием и энтеросолюбильным покрытием. Вторым фармацевтически активным ингредиентом может быть иксабепилон или его фармацевтически активная соль, сольват, клатрат, гидрат или его пролекарство. Или же второй фармацевтически активный ингредиент может быть другим активным агентом, таким как второй противораковый агент.
Гранулы с энтеросолюбильной оболочкой могут быть получены способом, при котором уменьшено воздействие влаги, тепла или сочетания влаги и тепла на иксабепилон. Такой способ обеспечивает высокую активность и хорошую однородность активного фармацевтического агента, так как иксабепилон склонен к распаду, разложению в присутствии воды и особенно сочетания влаги и тепла.
По одному из аспектов данного изобретения предусмотрен способ получения гранулы с энтеросолюбильной оболочкой, включающий:
а) получение основных частиц;
б) нанесение смеси активного ингредиента и связующего на основные частицы, при этом смесь на основе активного ингредиента содержит:
i) иксабепилон или его фармацевтически приемлемую соль, сольват, клатрат, гидрат или его пролекарство и
ii) растворитель, воду или их смесь;
в) сушку основных частиц, на которые нанесена смесь на основе активного ингредиента с целью получения частиц с покрытием и
г) нанесение энтеросолюбильного покрытия на частицы с покрытием с целью получения гранул с энтеросолюбильной оболочкой.
Согласно способу получения гранул с энтеросолюбильной оболочкой по данному изобретению смесь на основе активного ингредиента может также содержать связующее, что позволяет осуществить совместное нанесение одной смеси. Или же смесь активного ингредиента и раствор, содержащий связующее, могут быть предварительно смешаны сразу же перед нанесением. Смесь на основе активного ингредиента содержит иксабепилон в растворителе, воде или их смеси. Смесь на основе активного ингредиента может представлять собой раствор, содержащий иксабепилон, растворенный в растворителе, воде или их смеси. Или же смесь на основе активного ингредиента может быть суспензией активного агента, содержащей частицы иксабепилона, диспергированные в растворителе, воде или их смеси.
Подходящие растворители включают, например, спирты, такие как метанол, этанол, н-пропанол и изопропанол, и ацетон. Смесь на основе активного ингредиента может быть приготовлена путем смешения иксабепилона с растворителем, водой или их смесью. В смесь на основе активного ингредиента может быть включено связующее. Иксабепилон и возможное связующее могут быть соединены в любом порядке с растворителем, водой или их смесью. Обычно требуется перемешивание для минимизации любых локализованных концентраций иксабепилона или возможного связующего в растворителе, воде или их смеси. Смешение может быть проведено при помощи механического устройства, такого как магнитная или подвесная мешалка.
По одному из вариантов гранула с энтеросолюбильным покрытием по данному изобретению получается путем нанесения суспензии активного ингредиента и связующего на основные частицы. Предпочтительно, чтобы суспензия активного ингредиента являлась водной суспензией активного ингредиента, содержащая частицы иксабепилона, диспергированные в водной среде. Водная среда содержит более примерно 50 вес.% воды и, возможно, один или несколько смешивающихся с водой растворителей в расчете на вес водной среды.
Предпочтительно, чтобы водная среда содержала по меньшей мере около 65 вес.% воды, более предпочтительно по меньшей мере около 75 вес.% воды и наиболее предпочтительно по меньшей мере около 85 вес.% воды в расчете на вес водной среды. Водная суспензия частиц иксабепилона обеспечивает уменьшение контакта между водной средой и иксабепилоном по сравнению с раствором иксабепилона и таким образом приводит к уменьшению скорости распада или разложения иксабепилона. Водная суспензия активного ингредиента может быть приготовлена путем смешения частиц иксабепилона и, возможно, связующего в воде и, возможно, смешивающемся с водой растворителе. Частицы иксабепилона и возможного связующего могут быть соединены с водой и/или с возможным смешивающимся с водой растворителем в любом порядке. Обычно для диспергирования частиц иксабепилона и минимизации любых локализованных концентраций частиц иксабепилона или возможного связующего требуется перемешивание. Подходящие размеры частиц иксабепилона составляют, например, менее примерно 1000 мкм, предпочтительно менее примерно 500 мкм и более предпочтительно менее примерно 250 мкм. Частицы иксабепилона могут быть аморфными или кристаллическими. Предпочтительными являются кристаллические частицы иксабепилона. Примеры кристаллических форм иксабепилона, таких как Форма А или Форма В, описаны в патенте США №6689802. Суспензия активного ингредиента может содержать от примерно 1 до примерно 50 вес.% частиц иксабепилона, предпочтительно от примерно 2 до примерно 30 вес.% частиц иксабепилона и более предпочтительно от примерно 3 до примерно 20 вес.% частиц иксабепилона в расчете на вес суспензии активного ингредиента. Предпочтительно, чтобы величина рН суспензии активного ингредиента находилась в пределах от примерно 6 до примерно 9, более предпочтительно в пределах от примерно 6,5 до примерно 8 и наиболее предпочтительно в пределах от примерно 6,5 до примерно 7,5. Суспензия активного ингредиента может содержать другие компоненты, такие как буферные вещества, диспергирующие агенты, такие как поверхностно-активные вещества или низкомолекулярные полимеры, антивспенивающие агенты и агенты, регулирующие величину рН, такие как кислоты и основания.
Связующее может быть в виде раствора или дисперсии в воде.
По одному из вариантов смесь на основе активного ингредиента может содержать, например, от примерно 1 до примерно 30 вес.% по меньшей мере одного связующего, предпочтительно от примерно 2 до примерно 20 вес.% по меньшей мере одного связующего или более предпочтительно от примерно 3 до примерно 10 вес.% по меньшей мере одного связующего в расчете на вес смеси на основе активного ингредиента.
Смесь на основе активного ингредиента и раствор связующего могут быть нанесены на основные частицы при помощи спрея или потока на основные частицы, находящиеся в движении. Предпочтительно, чтобы условия находились под контролем, чтобы свести к минимуму агломерацию основных частиц. Растворитель и/или вода затем удаляются из смеси на основе активного ингредиента с получением частиц с покрытием, содержащих слой активного ингредиента, расположенный на основных частицах.
Энтеросолюбильное покрытие может быть нанесено на частицы с покрытием путем нанесения состава для энтеросолюбильного покрытия в виде спрея или потока на находящиеся в движении частицы с покрытием. Смесь для получения энтеросолюбильного покрытия может представлять собой раствор или суспензию. Предпочтительно контролировать условия процесса для того, чтобы свести к минимуму агломерацию частиц. Смесь для энтеросолюбильного покрытия содержит материал, образующий это покрытие, в водном или неводном растворителе или в их смеси. Подходящие растворители включают, например, спирты, такие как метанол и изопропанол, и ацетон. Могут быть применены смеси растворителей или смеси воды и одного или нескольких смешивающихся с водой растворителей.
Материал, образующий энтеросолюбильное покрытие, может быть растворен в растворителе с получением раствора или же может быть в виде дисперсии частиц с получением суспензии, такой как водная дисперсия сополимера. Обычно смесь для энтеросолюбильного покрытия может содержать, например, от примерно 5 до примерно 50 вес.% материала, образующего энтеросолюбильное покрытие, и предпочтительно от примерно 10 до примерно 40 вес.% материала, образующего энтеросолюбильное покрытие, в расчете на вес смеси для энтеросолюбильного покрытия.
Во время и/или после нанесения смеси для энтеросолюбильного покрытия может быть применена сушка для удаления растворителя. По одному из вариантов условия сушки предусматривают температуру осушающего воздуха на входе, равную от примерно 20°С до примерно 70°С, величину относительной влажности воздуха на входе менее примерно 50%, температуру слоя продукта, находящуюся в пределах от примерно 20°С до примерно 40°С, и применение потока воздуха, достаточного для удаления пара свободной воды.
Для распыления суспензии активного агента на основные частицы и/или для распыления смеси для энтеросолюбилъного покрытия на частицы с покрытием могут быть использованы устройства для распыления в жидком слое, тангенциальный распылитель или вращающийся распылитель лоткового типа.
Устройство для нанесения покрытия в жидком слое представляет собой аппарат, который может разжижать частицы, такие как гранулы, с одновременным их распылением и сушкой пленочного покрытия. Разжижающий воздух нагревается до нужной температуры, и поток воздуха подается со скоростью, подходящей для соответствующего разжижения и сушки.
Лотковая машина для нанесения покрытия представляет собой устройство, в котором частицы обрабатываются в лотке при распылении с образованием пленочного покрытия. Одновременно воздух с соответствующей температурой и скоростью потока проходит через слой частиц для сушки нанесенного пленочного покрытия.
Согласно одному аспекту данного изобретения предусмотрена капсула, содержащая множество гранул с энтеросолюбильным покрытием, которая пригодна для перорального введения иксабепилона. Капсулу получают путем наполнения оболочки капсулы, такой как оболочка желатиновой капсулы, гранулами с энтеросолюбильной оболочкой. Капсулу легче проглотить при пероральном введении гранул с энтеросолюбильным покрытием.
Капсула может включать по меньшей мере один гидрофобный материал для уменьшения агломерации отдельных гранул с энтеросолюбильным покрытием в капсуле и/или для уменьшения статического электричества во время загрузки гранул с энтеросолюбильной оболочкой в капсулу. Обычно количество такого гидрофобного материала предпочтительно поддерживать на таком уровне, который является достаточным для предотвращения слипания частиц после растворения оболочки капсулы, но не слишком высоким, чтобы вызывать замедление растворения.
Примеры подходящих гидрофобных материалов включают тальк, стеарат магния, стеариновую кислоту, глицерилбегенат, гидрированное хлопковое масло, тримиристин, трипламитан, тристеарин и коллоидную двуокись кремния. Примеры коммерчески доступных гидрофобных материалов включают Lubrital™ (Penwest Pharmaceutical Co., NJ), Dynasan™ 114, Dynasan™ 116 и Dynasan™ 118 (Sasol North America, TX) и Compritol™ 888 ATO (Gattefosse Co., France). Предпочтительным гидрофобным материалом является тальк.
ПРИМЕНЕНИЕ
Иксабепилон применяется в качестве агента, стабилизирующего микроканальцы. Иксабепилон пригоден для лечения различных видов рака и других пролиферативных заболеваний, включая, но без ограничения, следующие:
- карциному, включая карциному мочевого пузыря, груди, толстой кишки, почек, печени, легких, яичника, поджелудочной железы, желудка, шейки матки, щитовидной железы и кожи, включая плоскоклеточный рак;
- гемопоетические опухоли лимфатической системы, включая лейкоз, острый лимфоцитарный лейкоз, острый лимфобластоз, лимфому В-клеток, лимфому Т-клеток, лимфому Ходжкина, лимфому не-Ходжкина, лимфому "волосатых" клеток, лимфому Беркитта;
- гемопоетические опухоли миелоидной системы, включая острый и хронический миелогенные лейкозы и промиелоцитный лейкоз;
- другие опухоли, в том числе меланому, семиному, тератокарциному, нейробластому и глиому;
- опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и шванномы;
- опухоли мезенхинного происхождения, в том числе фибросаркома, рабдомиосаркома и остеосаркома и
- другие опухоли, в том числе меланома, ксеродерма пигментная, кератоакантома, семинома, фолликулярный рак щитовидной железы и тератокарцинома.
Иксабепилон пригоден для лечения пациентов, которые до этого подвергались лечению от рака, а также тех пациентов, которых не лечили от рака. Способы и композиции по данному изобретению, использующие гранулы с энтеросолюбильной оболочкой, могут применяться при лечении рака медикаментами первого ряда и второго ряда. Кроме того, гранулы с энтеросолюбильной оболочкой пригодны для лечения рефракторного или резистентного рака.
Иксабепилон будет ингибировать развитие кровеносных сосудов, влияя тем самым на рост опухолей и обеспечивая лечение опухолей и расстройств, связанных с опухолями. Эти свойства полезны также при лечении других состояний, отвечающих на действие агентов, предотвращающих развитие кровеносных сосудов, включая, но без ограничения, некоторые формы слепоты, связанные с ретинальным новообразованием кровеносных сосудов, артрит, особенно воспалительный артрит, рассеянный склероз, рестеноз и псориаз.
Иксабепилон индуцирует или ингибирует апоптоз, процесс физиологической гибели клеток, критический для нормального развития и гомеостаза.
Изменения апоптозных путей участвуют в патогенезе разнообразных болезней у людей. Заявленные соединения в качестве модуляторов апоптоза полезны при лечении различных болезней у людей с аберрацией апоптоза, в том числе, но без ограничения, рака и предраковых нарушений, болезней, связанных с иммунным ответом, вирусных инфекций, болезней почек и дегенеративных заболеваний костно-мышечной системы.
Гранулы с энтеросолюбильной оболочкой могут быть вместе или вводиться совместно с другими терапевтическими агентами, которые выбирают из-за их приемлемости при лечении вышеуказанных состояний. Гранулы с энтеросолюбильной оболочкой могут сочетаться с агентами для предотвращения тошноты, гиперчувствительности и раздражения желудка, такими как противорвотные средства и Н1- и Н2-антигистаминные средства. Вышеуказанные терапевтические агенты при применении в комбинации с иксабепилоном могут вводиться в количествах, указанных в Physicians′ Desk Reference (PDR) или определенных специалистом в данной области.
Кроме того, гранулы с энтеросолюбильной оболочкой могут быть введены в комбинации с другими противораковыми и цитотоксическими агентами и методами лечения, используемыми при лечении рака или других пролиферативных заболеваний. Введение гранул с энтеросолюбильной оболочкой можно проводить до, во время или после введения других противораковых агентов, цитотоксичных агентов и/или применения методов лечения рака или других пролиферативных болезней. Особенно полезны комбинации с противораковыми и цитотоксическими лекарствами, когда выбранное второе лекарство действует иначе или на другой фазе клеточного цикла, например, S-фазе, по сравнению с иксабепилоном, который проявляет свое действие на G2 - М-фазе. Примеры классов противораковых и цитотоксических агентов включают, но без ограничения, алкилирующие агенты, такие как мустины, алкилсульфонаты, нитрозомочевины, этиленимины и триазены; антиметаболиты, такие как антагонисты фолатов, аналоги пурина и аналоги пиримидина; антибиотики, такие как антрациклины, блеомицины, митомицин, дактиномицин и пликамицин; ферменты, такие как L-аспарагиназа; ингибиторы фарнезил - протеин - трансферазы; гормональные агенты, такие как глюкокортикоиды, эстрогены/антиэстрогены, андрогены/антиандрогены, прогестины и антагонисты гормона, высвобождающего лютеинизирующий гормон, октреотида ацетат, агенты, разрушающие микроканальцы, такие как экстеинасцидины или их аналоги и производные; агенты, стабилизирующие микроканальцы, такие как паклитаксел (TAXOL®), доцетаксел (TAXOTERE®); продукты растительного происхождения, такие как алкалоиды винка, эпиподофиллотоксины и таксаны; ингибиторы топоизомеразы; ингибиторы пренил - протеин - трансферазы и смешанные агенты, такие как гидроксимочевина, прокарбазин, митотан, гексаметилмеламин, координационные комплексы платины, такие как цисплатин и карбоплатин, и другие агенты, применяемые в качестве противораковых и цитотоксических агентов, такие как модификаторы биологического ответа, факторы роста, иммуномодуляторы и моноклональные антитела. Гранулы с энтеросолюбильной оболочкой могут быть применены в сочетании с радиационной терапией.
Представительные примеры этих классов противораковых и цитотоксических агентов включают, но без ограничения, мехлорэтамина гидрохлорид, циклофосфамид, хлорамбуцил, мефалан, ифосфамид, бусульфан, кармустин, ломустин, семустин, стрептозоцин, тиотепу, дакарбазин, метотрексат, тиогуанин, меркаптопурин, флударабин, пентастатин, кладрибин, цитарабин, флуороурацил, доксорубицин (включая его соль, такие как доксорубицина гидрохлорид), даунорубицин, идарубицин, беомицина сульфат, митомицин С, актиномицин D, сафрацины, сафрамицины, хинокарцины, дискодермолиды, винкристин, винбластин, винорелбина тартрат, этопозид (включая его соли, такие как этопозида фосфат), тенипозид, паклитаксел, тамоксифен, эстрамустин, натриевую соль эстрамустина фосфата, флутамид, бусерелин, лейпролид, птеридины, динес (diynesis), левамизол, афлакон, интерферон, интерлейкины, алдеслейкин, филграстим, сарграмостим, ритуксимаб, BCG, третиноин, иринотекана гидрохлорид, бетаметозон, капецитабин, гемцитабина гидрохлорид, алтретамин и топотеку и их аналоги и производные.
Другие примеры этих классов противораковых и цитотоксических агентов включают, но без ограничения, цисплатин, карбоплатин, карминомицин, аминоптерин, метотрексат, метоптерин, эктеинасцидин 743, порфиромицин, 5-флуорурацил (5-FU), 6-меркалтопурин, гемцитабин, цитозина арабинозид, паклитаксел, доксорубицин, даунорубицин, митомипин С, подофиллотоксин или производные подофиллотоксина, такие как этопозид, этопозида фосфат или тенипозид, мелфалан, винбластин, винкристин, лейрозидин, виндестин и лейрозин. Очевидно, что иксабепилон может быть введен в сочетании с конкретными противораковыми и цитотоксическими агентами, относящимися к этим классам агентов, например, иксабепилон может быть введен в сочетании с любыми 5-FU агентами и/или их пролекарствами, включая, но без ограничения, капецитабин (XELODA®).
Другими примерами противораковых и других цитотоксических агентов являются следующие вещества: ингибиторы циклинзависимых киназ, такие как описанные в заявке WO 99/24416, и ингибиторы пренил - протеин - трансферазы, такие как описанные в заявках WO 97/30992 и WO 98/54966.
Не желая ограничиться каким-либо механизмом или какой-либо морфологией, ожидают, что гранулы с энтеросолюбильной оболочкой, которые содержат иксабепилон, могут быть применены также для лечения состояний, отличающихся от рака или других пролиферативных болезней. Такие состояния включают, но без ограничения, вирусные инфекции, такие как вызванные вирусом герпеса, покс-вирусом, вирусом Эпштейна-Бара, вирусом Синдбиса и аденовирусом; аутоиммунные болезни, такие как системная красная волчанка, иммуноопосредованный гломерулонефрит, ревматоидный артрит, псориаз, воспалительные заболевания кишечника и аутоиммунный сахарный диабет; нейродегенеративные болезни, такие как болезнь Альцгеймера, деменция, связанная со СПИД′ом, болезнь Паркинсона, боковой амиотрофический склероз, пигментная ретинопатия, спинальная мышечная атрофия, мозжечковая дегенерация; СПИД; миелодисплазийные синдромы; апластическая анемия, инфаркты миокарда, связанные с ишемической болезнью; удар и повреждения при реперфузии; рестеноз, аритмия, атеросклероз, болезни печени, вызванные токсинами или алкоголем; гематологические заболевания, такие как хроническая анемия и апластическая анемия; дегенеративные заболевания скелетно-мышечной системы, такие как остеопороз и артрит; риносинусит, чувствительный к аспирину; муковисцидоз, рассеянный склероз; заболевания почек и боль при раке.
Эффективное количество иксабепилона может быть определено специалистом в данной области, для человека при лечении рака или других пролиферативных болезней оно равно от примерно 1 до 500 мг/м2 и может вводиться в виде одной дозы или в виде отдельных разделенных доз, например, от 1 до 4 раз в день. Например, метастазный рак груди можно лечить путем введения дозы до 40 мг/м2 иксабепилона один раз в день каждый 21 день. Следует иметь в виду, что величина конкретных доз и частота приема для любого конкретного пациента могут меняться и зависят от различных факторов, включая метаболическую стабильность и время действия иксабепилона, вида, возраста, веса, общего состояния здоровья, пола, питания субъекта и метода и времени введения, скорости экскреции, комбинации лекарств и степени серьезности конкретного состояния.
Предпочтительные субъекты для лечения включают животных, наиболее предпочтительно млекопитающих, таких как люди, и домашние животные, например, собаки, кошки и т.п., подверженные вышеуказанным заболеваниям.
Обычно иксабепилон вводят до тех пор, пока не получат ответ от пациента, например, уменьшение размера опухоли, или пока не будет достигнута доза, приводящая к токсичности. Специалисту в данной области легко определить момент получения ответа от пациента или момент достижения токсичной дозы. Обычно доза иксабепилона, ограниченная токсичностью, приводит, но без ограничения, к появлению усталости, арталгии/миалгии, анорексии, гиперчувствительности, нейтропении, тромбоцитопении или нейротоксичности.
Как обсуждалось выше, гранулы с энтеросолюбильной оболочкой вводят перорально. Способ по данному изобретению охватывает протоколы дозирования, такие как прием один или два раза в день ежедневно. Пероральное введение может быть ежедневным непрерывно, еженедельным или может быть прерывающимся, например, перерыв между введением может быть равным 3-4 нед.
По одному из вариантов ежедневно вводят дозу от примерно 1 до примерно 50 мг/м2.
По другому варианту дозу от примерно 2 до 150 мг/м2 вводят еженедельно, например, ежедневно в течение 2 дней, затем в течение 5 дней не осуществляют перорального введения гранул с энтеросолюбильным покрытием.
По еще одному варианту дозу, равную от примерно 10 до 300 мг/м2, вводят в течение промежутка времени, равного от примерно 3 до примерно 4 недель, например, 1 день и затем в течение 20 дней не вводят гранулы с энтеросолюбильным покрытием.
ПРИМЕРЫ
Ниже приведены следующие примеры, не ограничивающие, а только иллюстрирующие данное изобретение.
Пример 1
Приготовление суспензии активного ингредиента
Получали суспензию активного ингредиента, представляющего собой иксабепилон [1S-[1R*,3R*(Е),7R*,10S*,11R*,12R*,16S*]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2(2-метил-4-тиазолил)этенил]-4-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион. Сначала смешивали 2,783 г трис-порошка (трис(гидроксиметил аминометана)), 500 мл воды и IN HCl с получением 0,046 М раствора трис-буфера, имеющего величину рН, равную 8,1. Затем готовили смесь 43,5 г раствора трис-буфера (43,5 г) и 2,5 г порошка Opadry™ Clear Coat (Colorcon, Inc., PA) в качестве связующего. К этой смеси добавляли 4 г иксабепилона в виде кристаллов и перемешивали в течение примерно 30 мин с получением суспензии активного ингредиента. Суспензию активного ингредиента пропускали через сито 60 меш для удаления возможных агломератов.
Получение частиц с покрытием
Частицы с покрытием получали путем нанесения суспензии активного ингредиента на основные частицы. Основные частицы представляли собой сахарные гранулы 18/20 меш (Sugar Spheres, NF частицы (Chr. Hansen, Inc., WI)) с диаметром частиц более 0,85 мм и менее 1 мм.
Суспензию активного ингредиента наносили на основные частицы путем распыления при помощи устройства для нанесения в жидком слое, которое было использовано как система Wuster spray coating. Эта система для нанесения покрытия распылением включала Aeromatic - Fielder MP - MICRO™ устройство (Nitro Inc., Maryland), снабженное наконечником для распыления (0,8 мм).
В это устройство загружали 90 г сахарных гранул и затем предварительно нагревали их до температуры, равной примерно 50°С, в течение нескольких минут. Суспензию активного ингредиента наносили на основные частицы при следующих параметрах: скорость распыления 1,1 г/мин при давлении атомизации 1,8 бар (180 кПа), температура на входе 68°С, температура на выходе 32°С, температура слоя продукта 32°С и скорость вентилятора 4 м3/ч. В процессе нанесения суспензию активного ингредиента медленно перемешивали.
После окончания нанесения суспензии активного ингредиента конечную температуру на входе поддерживали до тех пор, пока температура слоя продукта не достигла 40°С.
Полученные частицы с покрытием содержали 2,75 вес.% иксабепилона в расчете на вес самой частицы с покрытием.
Нанесение подслоя
На частицы с покрытием наносили подслой. Раствор для получения подслоя готовили путем соединения 5 г порошка Opadry™ Clear Coat и 95 г воды и перемешивания до получения прозрачного раствора.
В процессе нанесения подслоя применяли устройство для нанесения в жидком слое, использовавшееся при получении частиц с покрытием. Это устройство, которое содержало 80 г частиц с покрытием, предварительно нагревали до температуры, равной примерно 50°С, в течение нескольких минут. Подслой наносили, используя метод нанесения и параметры нанесения и сушки, описанные выше для получения частиц с покрытием. Во время процесса нанесения раствор для получения подслоя медленно перемешивали. После завершения процесса нанесения подслоя конечную температуру на входе поддерживали до тех пор, пока температура слоя продукта не достигла 40°С. Полученные частицы с покрытием, включающие подслой, содержали около 2 вес.% подслоя в расчете на общий вес полученных частиц с покрытием.
Нанесение энтеросолюбильного покрытия
Энтеросолюбильное покрытие наносили на частицы с покрытием, содержащие подслой. Раствор для получения энтеросолюбильного покрытия готовили путем фильтрования дисперсии полимера Eudragit™ L30D55 (Röhm GmbH and Co., Darmstadt, Germany) через сито 60 меш. Дисперсия полимера Eudragit™ L30D55 представляет собой водную суспензию, содержащую сополимер метакриловой кислоты. Отфильтрованную дисперсию полимера Eudragit (200 г) разбавляли 89,5 г воды. Затем к этой разбавленной дисперсии полимера Eudragit добавляли 9 г диэтилфталата, затем 9,5 г 1 N раствора NaOH. Величина рН полученного раствора для нанесения энтеросолюбильной оболочки была равна 5,0±0,1.
В процессе нанесения энтеросолюбильного пленочного покрытия применяли то же устройство для нанесения в жидком слое, что и при получении частиц с покрытием. Это устройство, в котором содержалось 70 г частиц с покрытием, предварительно нагревали до температуры около 50°С в течение нескольких минут. Раствор для энтеросолюбильного покрытия наносили, используя следующие параметры нанесения и сушки:
наконечник распылителя 0,8 мм,
скорость распыления 1,1 г/мин,
давление атомизации 1,8 бар,
температура на входе 65°С,
температура на выходе 30°С,
температура слоя продукта 30°С,
скорость вентилятора 3,5 м3/ч.
В процессе нанесения раствор для получения энтеросолюбильного покрытия медленно перемешивали. После завершения процесса нанесения подслоя конечную температуру на входе поддерживали до тех пор, пока температура слоя продукта не достигла 40°С. Полученные гранулы с энтеросолюбильной оболочкой имели средний диаметр частиц, равный 1 мм.
В Таблице 1 указан состав гранул с энтеросолюбильным покрытием, полученных в этом примере. В композиции содержание каждого ингредиента указано в % в расчете на общий вес гранулы, содержащей энтеросолюбильную оболочку.
Пример 2
Получение суспензии активного ингредиента
Получали суспензию активного ингредиента, представляющего собой иксабепилон [1S-[1R*,3R*(Е),7R*,10S*,11R*,12R*,16S*]]-7,11-дигидрокси-8,8,10,12,16-пентаметил-3-[1-метил-2(2-метил-4-тиазолил)этенил]-А-аза-17-оксабицикло[14.1.0]гептадекан-5,9-дион. Сначала смешивали 2,7832 г трис-порошка (трис(гидроксиметил)аминометана)), 484,5 г воды и 12,7 г IN HC1 с получением 0,046 М раствора трис-буфера, затем добавляли 4 г иксабепилона в виде кристаллов и перемешивали. К этой смеси добавляли 2,4 г порошка Opadry™ Clear Coat (Colorcon, Inc., PA) в качестве связующего и перемешивали в течение примерно 30 мин с получением суспензии активного ингредиента. Суспензию активного ингредиента пропускали через сито 60 меш для удаления агломератов.
Получение частиц с покрытием на основе лекарства
Частицы с покрытием получали путем нанесения суспензии активного ингредиента на основные частицы. Основные частицы представляли собой гранулы из сахара (14/18 меш) (Sugar Spheres, NF частицы (Chr. Hansen, Inc., WI)) с диаметром частиц более 1 мм и менее 1,4 мм.
Суспензию активного ингредиента наносили на основные частицы путем распыления при помощи устройства для нанесения в жидком слое, которое было использовано как система Wuster spray coating. Эта система для нанесения покрытия распылением включала Aeromatic - Fielder MP - MICRO™ устройство (Nitro Inc., Maryland), снабженное наконечником для распыления (0,8 мм). В устройство загружали 70 г сахарных гранул и затем предварительно нагревали до 30-50°С. Суспензию активного ингредиента наносили на основные частицы при следующих параметрах нанесения и сушки:
скорость распыления 1,0-1,2 г/мин при давлении атомизации 1,8 бар (180 кПа),
температура на входе 65-70°С,
температура на выходе 28-32°С,
температура слоя продукта 27-32°С,
скорость вращения вентилятора 3,8-4,2 м3/час.
В процессе нанесения суспензию активного ингредиента медленно перемешивали. После окончания нанесения суспензии активного ингредиента конечную температуру на входе поддерживали до тех пор, пока температура слоя продукта не достигла 38-42°С. Другая альтернатива состоит в немедленном продолжении распыления состава для образования подслоя и сушке в конце процесса.
Нанесение подслоя
На частицы с покрытием на основе лекарства наносили подслой. Раствор для получения подслоя готовили путем смешения 8 г порошка Opadry™ Clear Coat и 92 г воды и перемешивания до получения прозрачного раствора.
В процессе нанесения подслоя применяли устройство для нанесения в жидком слое, использовавшееся при получении частиц с покрытием. Частицы с покрытием на основе лекарства (65 г) нагревали в устройстве для нанесения до температуры около 30-50°С. В процессе нанесения подслоя применяли устройство для нанесения в жидком слое, использовавшееся при получении частиц с покрытием. Это устройство, которое содержало 80 г частиц с покрытием, предварительно нагревали до температуры, равной примерно 50°С, в течение нескольких минут. Подслой наносили, используя метод нанесения и параметры нанесения и сушки, описанные выше для получения частиц с покрытием. Во время процесса нанесения раствор для получения подслоя медленно перемешивали. После завершения процесса нанесения подслоя конечную температуру на входе поддерживали до тех пор, пока температура слоя продукта не достигла 38-42°С.
Нанесение энтеросолюбильного покрытия
Энтеросолюбильное покрытие наносили на частицы с покрытием, содержащие подслой. Раствор для получения энтеросолюбильного покрытия готовили путем фильтрования дисперсии полимера Eudragit™ L30D55 (Röhm GmbH and Co., Darmstadt, Germany) через сито 60 меш. Дисперсия полимера Eudragit™ L30D55 представляет собой водную суспензию, содержащую сополимер метакриловой кислоты. Отфильтрованную дисперсию полимера Eudragit (133,34 г) разбавляли 55,61 г воды. Затем к этой разбавленной полимерной дисперсии Eudragit добавляли 6 г диэтилфталата и затем 5,05 г 1 N раствора NaOH. Величина рН полученного раствора для нанесения энтеросолюбильной оболочки была равна 5,0±0,1.
В процессе нанесения энтеросолюбильного пленочного покрытия применяли то же устройство для нанесения в жидком слое, что и при получении частиц с покрытием. Это устройство, в котором содержалось 65 г частиц с подслоем, предварительно нагревали до температуры 30-50°С. Раствор для энтеросолюбильного покрытия наносили, используя следующие параметры нанесения и сушки:
наконечник распылителя 0,8 мм,
скорость распыления 1,1 г/мин,
давление атомизации 1,8 бар,
температура на входе 65-70°С,
температура на выходе 30-36°С,
температура слоя продукта 28-32°С,
скорость вентилятора 3,9-4,1 м3/ч.
В процессе нанесения раствор для получения энтеросолюбильного покрытия медленно перемешивали. После окончания нанесения раствора для получения энтеросолюбильного покрытия поддерживали температуру на входе равной конечной температуре до тех пор, пока температура слоя продукта не достигнет 38-42°С. Полученные гранулы с энтеросолюбильной оболочкой имели величину среднего диаметра частиц, равную 1,4 мм.
В Таблице 2 приведен состав гранул с энтеросолюбильной оболочкой, полученных в этом примере. Состав указан в вес.% каждого ингредиента в расчете на общий вес гранулы с энтеросолюбильной оболочкой.
Пример 3
Гранулы с энтеросолюбильной оболочкой, содержащие иксабепилон, получали, как описано ниже.
В Таблице 3 приведен состав гранулы с энтеросолюбильной оболочкой.
Все покрытия получали на установке Aeromatic - Fielder Type MP Micro в ожиженном слое, снабженной распылителем, распылителем, расположенным в донной части. Схема получения покрытий: загрузка (50-90 г), расположение в колонне (1 см), диаметр сопла для распыления (0,8 мм), давление атомизации (1,8 бар), скорость распыления (0,9-1,1 г/мин), скорость вентилятора (3,5-4,0 м3/ч), температура на входе (58-72°С), температура слоя (30-33°С). В конце каждой стадии нанесения покрытия продукт высушивали до тех пор, пока температура слоя не достигала примерно 40°С.
Размер сахарных гранул составлял 18/20 меш. Использовались следующие растворы и суспензии для нанесения покрытий.
Предварительное буферированное покрытие на основе Opadry: это был 8%-ный (вес/вес) раствор Opadry® Clear (YS-1-19025-А) в 0,046 М трис-буфере (рН 8,1±0,1). Наносили до получения привеса, равного примерно 4%.
Подслой на основе Opadry: это был 8%-ный (вес/вес) раствор Opadry® Clear в MilliQ воде. Наносили до получения привеса, равного примерно 4%.
Буферированное покрытие на основе лекарства: это был 5%-ный (вес/вес) Opadry® Clear в 0,046 М трис-буфере (рН 8,1±0,1) содержал 12% (вес/вес) иксабепилона. Наносили до получения привеса, равного примерно 3,7%.
Небуферированное покрытие на основе лекарства: это был 5%-ный (вес/вес) Opadry Clear в MilliQ воде, содержал 12% (вес/вес) иксабепилона. Наносили до получения привеса, равного примерно 3,7%.
Энтеросолюбильное покрытие: это был 66,67% (вес/вес) раствор Eudragit® L30D55 (30% твердых веществ), 3% диэтилфталата в MilliQ воде, рН суспензии доводили до 5,0±0,1 при помощи 1 N NaOH. Наносили до получения привеса, равного примерно 35%.
Гранулы с энтеросолюбильной оболочкой, полученные в примерах 3.1-3.5, помещали в пробирки из сцинтилляционного стекла и хранили при 40°С в течение 8 нед. Затем анализировали гранулы с энтеросолюбильной оболочкой методом ЖХВР, используя следующие условия.
Колонка - УМС - Pack Pro С8, 150*4.6 мм, 3 мм. S/N.
Подвижная фаза А: 10 мМ NH4ОАс в смеси вода: ацетонитрил (90:10) (NH4OAc, Sigma).
Подвижная фаза В: 10 мМ NE4ОАс в смеси вода: ацетонитрил (30:70) (CAN:ЕМ Science).
Скорость истечения: 1,5 мл/мин.
Обнаружение: УФ при длине волны 240 нм.
Объем инжекции: 10 мл.
Раствор для промывки иглы: вода: ацетонитрил (50:50).
Температура колонки: комнатная.
Температура образца: 4°С.
Разбавитель: ацетонитрил (ЕМ Science).
Стандартный раствор: (0,2 мг/мл, иксабепилон, чистота 99,2%).
Стандартный раствор готовили путем взвешивания ˜50,0 мг иксабепилона, помещения его в колбу объемом 250 мл с последующим добавлением 100 мл разбавителя. Смесь обрабатывали ультразвуком в течение примерно 5 мин или до растворения твердых веществ.
Гранулы с энтеросолюбильной оболочкой были приготовлены для анализа с применением Tablet Process Workstation (Caliper Lifescience, Hopkinton, MA). Приготовление образца: (0,2 мг/мл).
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПОКРЫТАЯ ЭНТЕРОСОЛЮБИЛЬНОЙ ОБОЛОЧКОЙ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1998 |
|
RU2197227C2 |
| ТАБЛЕТКА С ЭНТЕРОСОЛЮБИЛЬНЫМ ПОКРЫТИЕМ И СПОСОБ ПРИГОТОВЛЕНИЯ | 1998 |
|
RU2201217C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КАЛЬЦИЕВУЮ СОЛЬ РОЗУВАСТАТИНА | 2012 |
|
RU2602911C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ РИЗЕДРОНАТА | 2005 |
|
RU2381791C2 |
| ЛЕКАРСТВЕННЫЕ ФОРМЫ НА ОСНОВЕ БИСФОСФОНАТОВ | 2005 |
|
RU2359678C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С НАБУХАЮЩИМ ПОКРЫТИЕМ | 2004 |
|
RU2375048C2 |
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ВКЛЮЧАЮЩИЕ В СЕБЯ ТВЕРДЫЕ РАСТВОРЫ СЛАБООСНОВНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2007 |
|
RU2434630C2 |
| ХРОНОТЕРАПЕВТИЧЕСКАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2571067C2 |
| ТВЕРДЫЕ ТАБЛЕТКИ И КАПСУЛЫ МОДИФИЦИРОВАННОГО ВЫСВОБОЖДЕНИЯ БЕНЗОНАТАТА | 2014 |
|
RU2673239C2 |
| КОМПОЗИЦИИ С МОДИФИЦИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ, СОДЕРЖАЩИЕ КОМПЛЕКСЫ ЛЕКАРСТВЕННОЕ ВЕЩЕСТВО - ИОНООБМЕННАЯ СМОЛА | 2007 |
|
RU2435569C2 |
Предложена гранула с энтеросолюбильной оболочкой, содержащая иксабепилон, имеющий структуру (А). Предусмотрена также капсула, содержащая множество гранул с энтеросолюбильной оболочкой. Гранула включает частицу с покрытием, содержащую основную частицу и слой активного ингредиента, полностью или частично распределенный на или в основной частице. Слой активного ингредиента содержит иксабепилон структуры (А) и связующее. Предложены также варианты способа получения гранулы с энтеросолюбильной оболочкой. Изобретение позволяет снизить или устранить пыление порошка иксабепилона и обеспечивает оральное введение иксабепилона без совместного введения буфера, нейтрализующего кислоту. 6 н. и 8 з.п. ф-лы, 4 табл.

а) частицу с покрытием, содержащую
i) основную частицу и
ii) слой активного ингредиента, полностью или частично распределенный на или в основной частице, при этом слой активного ингредиента содержит
1) соединение, имеющее формулу
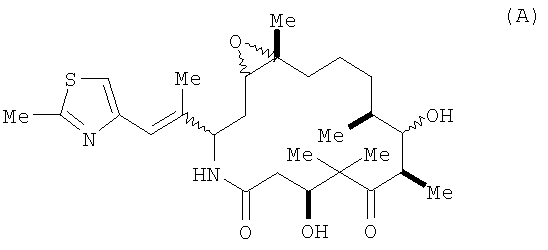
или его фармацевтически приемлемые сольват или гидрат и
2) по меньшей мере одно связующее и
б) энтеросолюбильную оболочку, в которой инкапсулирована частица с покрытием.

или его фармацевтически приемлемые сольват или гидрат в растворителе, воде или их смеси, возможно в присутствии связующего, и нанесение энтеросолюбильной оболочки на частицы с покрытием с получением гранул с энтеросолюбильной оболочкой.
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| US 6537579 B1, 25.03.2003. | |||
Авторы
Даты
2009-03-20—Публикация
2005-11-17—Подача