ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Данное изобретение относится к хронотерапевтическим фармацевтическим композициям и способу их получения.
УРОВЕНЬ ТЕХНИКИ
Пероральные системы с контролируемым высвобождением являются наиболее популярными системами доставки лекарственных веществ в силу очевидных преимуществ, обеспечиваемых пероральным путем введения лекарственных веществ. Это обеспечивает пролонгированное действие лекарственного вещества, высвобождаемого в течение увеличенного временного интервала, в течение которого концентрация в плазме поддерживается в пределах терапевтического окна.
При определенных болезненных состояниях требуется, чтобы высвобождение лекарственного вещества происходило после некоторой временной задержки. Лекарственное вещество не должно высвобождаться в течение первых 2-6 часов. После этой задержки, для достижения желаемого терапевтического воздействия, лекарственное вещество либо должно высвобождаться в виде последовательности отдельных доз, либо должно обладать пролонгированным высвобождением.
Состояния, при которых требуется такой профиль высвобождения, включают:
а) физиологические функции, которые следуют циркадному ритму и имеют следствием увеличения и уменьшения уровня гормонов, таких как ренин, альдостерон, кортизол и т.п.;
б) заболевания, которые проявляют хронофармакологическую зависимость, такие как ревматоидный артирит, гастроэзофагеальная рефлюксная болезнь, бронхиальная астма, инфаркт миокарда, стенокардия, гипертензия и т.п.
Такие разновидности систем доставки лекарственных веществ, которые высвобождают биологически активные ингредиенты в ритме, который идеально соответствует биологическим требованиям, накладываемым терапией данного заболевания, называются хронотерапевтическими системами доставки лекарственных веществ и включают системы доставки лекарственных веществ с контролируемым по времени высвобождением и сайт-специфические системы доставки.
К настоящему времени исследователи установили, что временная последовательность при приеме лекарственного средства может влиять на то, как организм человека реагирует на данное лекарственное средство. Наука о лечении человеческого организма с учетом естественных вариаций циркадного ритма называется хронотерапией. В основе хронотерапии лежит доставка требуемого количества лекарственного средства в требуемое место приложения действия в наиболее подходящий для данного заболевания или состояния период времени.
Основной задачей хронотерапии при таких показаниях, как ревматоидный артрит, секреция желудочного сока, астма и сердечно-сосудистые заболевания, является доставка лекарственного вещества в требуемых концентрациях в периоды времени с наивысшей потребностью в таком веществе, и в меньших концентрациях, когда потребность снижается. В основе нашего циркадного ритма лежит цикл сон-бодрствование, и на него оказывает влияние наше генетическое строение, а он, тем самым, влияет на функции нашего организма в течение дня и ночи (24-часовой период).
Артриты представляют собой группу состояний c поражением суставов в организме. Артриты являются основной причиной нетрудоспособности людей старше сорока пяти лет. Существуют различные формы артрита, при этом каждая из них имеет различные причины. Наиболее распространенной формой артрита является остеоартрит (дегенеративная болезнь суставов), который развивается в результате травмы сустава, инфекции сустава или с возрастом. Имеющиеся к настоящему времени свидетельства указывают на то, что в ранее развитие остеоартрита могут давать вклад анатомические отклонения. Другими формами артрита являются ревматоидный артрит и псориатический артрит. Септический артрит вызывается инфекцией суставов. Подагрический артрит вызывается отложением кристаллов мочевой кислоты в суставе, вызывающем воспаление.
Ревматоидный артрит (РА) является хроническим, системным аутоиммунным заболеванием, которое, в большинстве случаев, вызывает воспаление и разрушение тканей в суставах (артрит) и синовиальных влагалищах в сочетании с анемией. Он также может вызвать диффузное воспаление легких, перикарда, плевры и глазной склеры, а также узловые поражения, наиболее часто в поверхностной фасции, расположенной под кожей. Он может представлять собой болезненное состояние, вызывающее потерю трудоспособности, что может привести к практически полной утрате подвижности и способности к активной деятельности. Он диагностируется главным образом по симптомам и признакам, но также с помощью анализов крови (особенно с помощью так называемого анализа на ревматоидный фактор) и рентгеноскопии. Диагностирование и долговременное лечение обычно осуществляются ревматологами, специалистами по заболеваниям суставов и соединительных тканей. Клиническая практика ревматологов указывает на то, что РА пациенты могут испытывать боли в суставах, отеки суставов, утреннюю скованность и нарушения способности к активной деятельности в утренние часы, при этом в отношении артрита наблюдались хронобиологические профили артритных болей. Люди с остеоартритом часто испытывают более сильные боли по ночам и менее сильные - утром, тогда как для людей с ревматоидным артритом болевые ощущения достигают максимума утром и в течение дня снижаются. Проведенные ранее исследования на животных показали, что воспаление суставов у крыс варьирует в течение 24 ч периода, и эти наблюдения подтверждаются пациентами и терапевтами.
Потенциальные лекарственные вещества-кандидаты для лечения артрита включают НПВС и кортикостероиды. Предпочтительно, дозирование должно быть распределено по времени таким образом, чтобы наивысший уровень концентрации лекарственного вещества в крови совпадал с максимумом болевых ощущений. Для остеоартрита оптимальным временем для приема НПВС является полдень или середина второй половины дня. Для ревматоидного артрита оптимальным временем для приема НПВС является время после вечернего приема пиши.
US20050276853 (патентообразователь Penwest pharmaceuticals) относится к хрононотерапевтической фармацевтической композиции, содержащей ядро из активного ингредиента и задерживающую высвобождение оболочку, содержащую природную или синтетическую смолу, которая наносится на поверхность ядра путем прессования.
US6346268 (заявитель Duramed pharmaceuticals) относится к лекарственной форме, представляющей собой депо лекарственного вещества, которая содержит активный ингредиент и трехкомпонентную композицию матричного типа, контролирующую скорость высвобождения. Тремя компонентами композиции матричного типа, используемыми в данном изобретении, являются рН-зависимый желирующий полимер в качестве альгинантного компонента, энтеросолюбильный полимерный компонент и рН-независимый желирующий полимер.
US20060099260 (заявитель Biokey Inc.) относится к фармацевтической композиции содержащей ядро, содержащее бупропион, и оболочку, содержащую фармацевтически приемлемый рН-независимый полимер и поверхностно-активное вещество.
По мнению специалистов в данной области сегодня имеется потребность в пероральных композициях с контролируемым высвобождением, которые обладают возможностью доставки лекарственного вещества (веществ) класса НПВС таким образом, чтобы скорость высвобождения и профиль концентрации лекарственного вещества в плазме соответствовали бы физиологическим и хронотерапевтическим требованиям. И, несмотря на имеющиеся источники предшествующего уровня техники, упомянутые выше, все еще имеется потребность в изобретении, которое могло бы контролировать симптомы артрита, было бы простым в изготовлении, экономичным и которое соответствовало бы потребности в хронотерапевтической системе доставки лекарственного вещества.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Задачей данного изобретения является предоставление хронотерапевтической фармацевтической композиции, которая эффективно контролирует течение заболеваний, проявляющих хронологическую зависимость.
Один из аспектов изобретения относится к хронотерапевтической фармацевтической композиции, содержащей, по меньшей мере, один активный ингредиент, покрытый агентами или полимерами, которые являются рН-независимыми. Данная композиция также содержит гидрофильные агенты, которые смешаны с покрытым активным ингредиентом. Активный ингредиент начинает высвобождаться после некоторой временной задержки, после которой следует контролируемое высвобождение активного ингредиента в соответствии с циркадным ритмом организма. Временная задержка активного ингредиента с отсроченным пролонгированным действием составляет 4-6 часов, за которой следует контролируемое высвобождение активного ингредиента в течение временного периода до 24 часов. Композиция также имеет энтеросолюбильную оболочку из рН-зависимых полимеров.
Другой аспект данного изобретения относится к способу получения дозированной формы в виде таблетки из хронотерапевтической фармацевтической композиции, содержащей активный ингредиент, рН-независимый агент и гидрофильный агент. Способ включает покрытие активных ингредиентов рН-независимым агентом. Затем покрытый активный ингредиент смешивают с гидрофильными агентами и прессуют в таблетки. На прессованные таблетки наносят дополнительную энтеросолюбильную оболочку для получения хронотерапевтической композиции.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет собой график, демонстрирующий профиль растворения согласно данным Таблицы 1.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Согласно одному из вариантов осуществления настоящего изобретения, хронотерапевтическая фармацевтическая композиция содержит по меньшей мере один активный ингредиент, рН-независимый агент и гидрофильный агент. Только активный ингредиент покрывают рН-независимым агентом или рН-независимым полимером. Гидрофильный агент формирует матрикс вокруг покрытого активного ингредиента. Концентрация активного ингредиента находится в диапазоне от 1 мг до 1000 мг. Композиция обеспечивает начальную временную задержку до 4-6 часов, после которой следует контролируемое высвобождение активного ингредиента до 24 часов.
Активный ингредиент хронотерапевтической фармацевтической композиции принадлежит к классу нестероидных противовоспалительных лекарственных веществ (НПВС, NSAID). НПВС выбирают из группы, состоящей из напроксена, лорноксикама, диклофенака, ибупрофена и их солей. Предпочтительным НПВС, используемым в хронотерапевтической фармацевтической композиции, является напроксен.
Напроксен представляет собой производное пропионовой кислоты, относящейся к группе нестероидных противовоспалительных лекарственных веществ на основе арилуксусных кислот. Химическим названием напроксена и напроксена натрия являются “(S)-6-метокси-α-метил-2-нафталенуксусная кислота” “(S)-6-метокси-α-метил-2-нафталенуксусная кислота, натриевая соль”, соответственно. Напроксен и напроксен натрия имеют следующие структуры, представленные, соответственно, формулой I
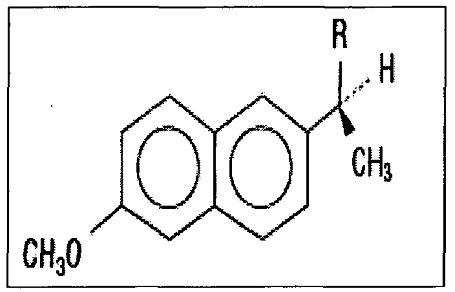
Формула I
Напроксен (R=-COOH)
Напроксен натрия (R=-COONa)
Напроксен представляет собой нестероидное противовоспалительное средство (НПВС), обычно используемое для облегчения средней и сильной боли, жара, воспаления и ригидности, вызываемых такими состояниями, как остеоартрит, ревматоидный артрит, псориатический артрит, подагра, анкилозирующий спондилоартрит, менструальные боли, тендинит, бурсит, и для лечения дисменореи. Он действует путем подавления активности ферментов как СОХ-1, так и СОХ-2. Растворимость напроксена зависит от рН фактора, т.е. при кислых рН он является слаборастворимым, и хорошо растворимым - при щелочных рН. Согласно BCS (биофармацевтической системы классификации) он относится к лекарственному веществу класса II (с низкой растворимостью и высокой проницаемостью).
рН независимый агент или рН независимый полимер выбирают из группы, состоящей из гидроксипропилметилцеллюлозы (НРМС), гидроксипропилцеллюлозы (НРС), поливинилпирролидона (PVP), метилцеллюлозы, гуаровой смолы, ксантановой смолы, гуммиарабика, дисперсии гидроксиэтилцеллюлозы и сополимера этилакрилата и метилакрилата (Eudragit® NE 30 D), этилцеллюлозы, дисперсии поливинилацетата (Kollicoat® SR 30D) или их комбинаций и других аналогичных материалов, известных специалистам в данной области.
Гидрофильный агент или набухающий полимер выбирают из группы, состоящей из полиэтиленоксида, простых эфиров целлюлозы, гуара, производных гуара, смолы плодоворожкового дерева, псиллиума, гуммиарабика, камеди гхатти, камеди карайи, трагакантовой камеди, каррагенана, агара, альгинатов, ксантана, склероглюкана, декстрана, пектина, крахмала, хитина и хитозана, гидроксиэтилцеллюлозы (НЕС), гидроксипропилцеллюлозы (НРС), карбоксиметилцеллюлозы (СМС), карбоксиметилгидроксиэтилцеллюлозы (СМНЕС), гидроксипропилгидроксиэтилцеллюлозы (НРНЕС), метилцеллюлозы (МС), метилгидроксипропилцеллюлозы (МНРС), метилгидроксиэтилцеллюлозы (МНЕС), карбоксиметилметилцеллюлозы (СММС), гидрофобно модифицированной карбоксиметилцеллюлозы (НМСМС) или их комбинаций, или других аналогичных материалов, известных специалистам в данной области.
Согласно другому варианту осуществления настоящего изобретения, хронотерапевтическая фармацевтическая композиция содержит по меньшей мере один активный ингредиент, рН-независимый агент или рН-независимый полимер и гидрофильный агент. Только активный ингредиент покрывают рН-независимым полимером. Концентрация активного ингредиента находится в пределах от 1 мг до 1000 мг. Композиция обеспечивает начальную временную задержку до 4-6 часов, после которой следует контролируемое высвобождение активного ингредиента до 24 часов. Композиция также содержит энтеросолюбильный полимер оболочки. Энтеросолюбильный полимер оболочки также обладает возможностью задерживать высвобождение активного ингредиента. рН-зависимые полимеры выбирают из группы, состоящей из шеллака, сополимеров метакриловой кислоты (Eudragit® S или L), ацетата фталат целлюлозы, фталата гидроксипропилметилцеллюлозы, ацетата сукцинат гидроксипропилметилцеллюлозы, ацетата тримеллитат целлюлозы и фталата поливинилацетата (Opadry® кишечный белый OY-P-7171) или их комбинаций и аналогичных материалов, известных специалистам в данной области.
Согласно другому варианту осуществления настоящего изобретения, предоставляется способ получения дозированной формы в виде таблетки из хронотерапевтической фармацевтической композиции, содержащей активный ингредиент, покрытый рН-независимым агентом, и гидрофильный агент. Данный способ включает стадии покрытия активного ингредиента рН-независимым агентом. Покрытие активного ингредиента осуществляется методом псевдоожиженного слоя. Затем покрытые активные ингредиенты смешивают с набухающими и быстро желирующими агентами. После этого смешанную композицию прессуют в таблетки. Затем прессованные таблетки дополнительно покрывают энтеросолюбильным полимером оболочки, получая хронотерапевтическую фармацевтическую композицию.
Согласно другому варианту осуществления настоящего изобретения хронотерапевтическая фармацевтическая композиция дополнительно содержит фармацевтически приемлемые вспомогательные вещества.
Другой вариант осуществления настоящего изобретения относится к применению хронотерапевтической композиции для лечения заболеваний, которые проявляют хронофармакологическую зависимость. Эти заболевания представляют собой артриты, гастроэзофагеальную рефлюксную болезнь, бронхиальную астму, инфаркт миокарда, стенокардию, гипертензию.
Другой вариант осуществления настоящего изобретения относится к способу лечения заболеваний, которые проявляют хронофармакологическую зависимость, содержащему введение терапевтически эффективного количества данной композиции субъекту.
Фармацевтическую композицию предоставляют в форме таблетки и вводят перорально один раз в сутки. Активные ингредиенты в таблетке до прессования находятся либо в форме пеллета и/или в форме гранулы. Можно использовать любые другие дозированные формы данной композиции; она также может находиться в форме капсулы, заполненной гранулами или минитаблетками.
Данная технология обеспечивает два подхода: i) начальное отсроченное высвобождение, т.е. временную задержку до 4-6 часов, ii) последующее контролируемое высвобождение до 24 часов.
В настоящем изобретении активный ингредиент покрыт и смешан с гидрофильным агентом, формирующим матрикс, и спрессован в таблетки. Прессованные таблетки затем дополнительно покрывают энтеросолюбильными задерживающими высвобождение рН-зависимыми агентами. Хронотерапевтическая композиция содержит две оболочки, одна из которых наносится на активный ингредиент, а другая наносится на прессованную таблетку. Когда лекарственное вещество в виде твердых частиц или покрытый активный ингредиент прессуют с гидрофильным агентом, формирующим матрикс, высвобождение лекарственного вещества из такой системы осуществляется через твердые частицы оболочки, а затем через матрикс, окружающий покрытые частицы. Гидрофильные агенты предоставляют дополнительный барьер, обеспечивая равномерное действие и увеличенную временную задержку. Преимуществом изобретения является то, что бифазное высвобождение лекарственного вещества вместе с задерживающей высвобождение оболочкой обеспечивает эффективную задержку высвобождения лекарственного вещества, препятствуя его преждевременному высвобождению из системы. Данная система обеспечивает высвобождение лекарственного вещества и, следовательно, уменьшенную вариацию профиля концентрации лекарственного вещества в плазме от субъекта к субъекту. Композиция представляет собой двойную систему с контролируемым высвобождением, таким образом обеспечивая требуемую временную задержку и контролируемое высвобождение активного ингредиента. Способ получения таких композиций является простым и экономически целесообразным.
Хронотерапевтическая фармацевтическая композиция и способ ее получения более подробно описаны ниже в примерах осуществления изобретения.
ОПРЕДЕЛЕНИЕ ТЕРМИНОВ
Используемый здесь термин “задержанное высвобождение” означает высвобождение активного ингредиента с задержкой на 4-6 часов (временная задержка), при которой количество высвобождаемого лекарственного вещества должно составлять менее 10% от заявленного содержания.
Используемый здесь термин “активный ингредиент” относится к классу нестероидных противовоспалительных средств (НПВС).
Используемый здесь термин “вспомогательные вещества” означает компонент фармацевтического продукта, который не является активным ингредиентом, например наполнители, разбавители, носители, подщелачиватели, пластификаторы, антиадгезивы, глиданты, связующие вещества, растворители и т.п. Наполнители, используемые при изготовлении фармацевтической композиции, являются безопасными, нетоксичными и приемлемыми для фармацевтического использования.
Используемый здесь термин “разбавитель” или “наполнитель” означает инертные вещества, используемые в качестве наполнителей для получения желаемого объема и реологических свойств. Такие соединения включают, в виде примера, а не ограничения, двухосновный фосфат кальция, микрокристаллическую целлюлозу, маннит, прежелатинизированный крахмал, сахарозу, целлюлозу в порошке, осажденный карбонат кальция, крахмал, лактозу, глюкозу и их комбинации, и другие аналогичные материалы, известные специалистам в данной области.
Используемый здесь термин “связующее вещество” означает агенты, используемые при изготовлении гранул активного ингредиента путем смешивания его с разбавителем/наполнителем. Такие соединения включают, в виде примера, а не ограничения, поливинилпирролидон, гидроксипропилцеллюлозу (НРС), прежелатинизированный крахмал, крахмал, гидроксипропилметилцеллюлозу (НРМС), кросповидон и гидроксиэтилцеллюлозу (нес), и их комбинации, а также другие аналогичные материалы, известные специалистам в данной области.
Используемый здесь термин “глидант” означает агенты, используемые в лекарственной форме для улучшения реологических свойств. Такие соединения включают, в качестве примера, а не ограничения, коллоидный диоксид кремния, силикат кальция, силикат магния, кукурузный крахмал, тальк, их комбинации и другие аналогичные материалы, известные специалистам в данной области.
Используемый здесь термин “рН-независимый агент” или “рН-независимый полимер” означает полимеры, которые обладают одинаковой активностью во всем диапазоне рН, т.е. не демонстрируют никаких изменений в определенном диапазоне рН.
Используемый здесь термин “гидрофильный агент” или “набухающие полимеры” означает полимеры, которые обладают явно выраженной аффинностью, благодаря своей химической структуре, к водным растворителям, в которых они набухают, а не растворяются.
Используемый здесь термин “энтеросолюбильный полимер оболочки” означает полимеры, используемые для определения термина “рН-зависимая” оболочка, которая устойчива к растворению в кислой среде желудка и растворяется в среде тонкой кишки.
Большинство из этих вспомогательных веществ более подробно описано у, например, Howard C. Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, (7th Ed. 1999); Alfonso R. Gennaro et al., Remington: The Science and Practice of Pharmacy, (20th Ed. 2000); и A. Kibbe, Handbook of Pharmaceutical Excipients, (3rd Ed. 2000), содержание которых включено в данное описание во всей полноте в качестве ссылки.
Приведенные ниже примеры даны с целью иллюстрации изобретения. Эти примеры не следует рассматривать как ограничивающие объем настоящего изобретения. Возможны различные модификации, не уводящие в сторону от объема и сущности данного изобретения.
ПРИМЕР 1
Используемые в этих примерах агенты и их количество в мг на единичную дозу лекарственной формы композиции приведены ниже в таблицах.
Стадия 1: Изготовление гранул напроксена с помощью процессора с псевдоожиженным слоем (FBP)
Процедура:
1. Напроксен, дигидрат двухосновного фосфата кальция и коллоидный диоксид кремния взвешивали и пропускали через сито с ячейками размером #40 согласно стандартам американского общества по испытания материалов (ASTM).
2. Вышеуказанную смесь переносили в процессор с псевдоожиженным слоем и тщательно перемешивали в течение 2 мин.
3. Взвешивали требуемое количество поливинилпирролидона К30 и добавляли ДМ воду, продолжая перемешивать до получения конечного 25% мас./об. водного раствора в качестве связующего раствора.
4. Перемешанную смесь, полученную на этапе 2, гранулировали в процессоре с псевдоожиженным слоем, используя связующий раствор, приготовленный на этапе 3.
5. Полученные гранулы сушили в процессоре с псевдоожиженным слоем до получения 2-3% содержания влаги.
Стадия II: Покрытие полученных на стадии I гранул напроксена 30 мас.% дисперсией полиакрилатов (Eudragit® NE 30D), до 5% увеличения массы полимера, используя FBP
Процедура:
1. Взвешивали требуемое количество Eudragit® NE 30D.
2. Взвешивали требуемое количество талька и просеивали через сито с ячейками размера #60 (ASTM).
3. Взвешивали требуемое количество ДМ воды и добавляли туда приготовленный на этапе 2 тальк при перемешивании (чтобы избежать образования пены).
4. После получения однородной дисперсии, полученной на этапе 3, в нее медленно добавляли Eudragit® NE 30D и перемешивали в течение 30 мин. Конечная дисперсия содержала 20% (мас./об.) твердых веществ.
5. Эту дисперсию использовали для нанесения оболочки на гранулы напроксена.
6. Гранулы размером #60 согласно ASTM пропускали через сито, а оставшиеся гранулы размером #80 согласно ASTM использовали для нанесения на них оболочки, используя Eudragit® NE 30D (рН-независмый полимер).
Стадия III: Прессование таблеток с хронотерапевтическим высвобождением лекарственного вещества напроксена (500 мг) и нанесение энтеросолюбильной оболочки
Процедура:
1. Взвешивали необходимое количество гранул напроксена, покрытых 5 мас.% Eudragit® NE 30D.
2. Смешивали гранулы, приготовленные на этапе 1, с дигидратом двухосновного фосфата кальция, полиэтиленоксидом и альганот натрия, пропущенными через сито с ячейками размером #40, согласно ASTM.
3. На смесь, приготовленную на этапе 2, наносили лубрикант в виде стеарата магния и прессовали в таблетки.
4. Затем на прессованные таблетки наносили энтеросолюбильную оболочку, содержащую фталат поливинилацетата (Opadry ® кишечный, белый OY-P-7171).
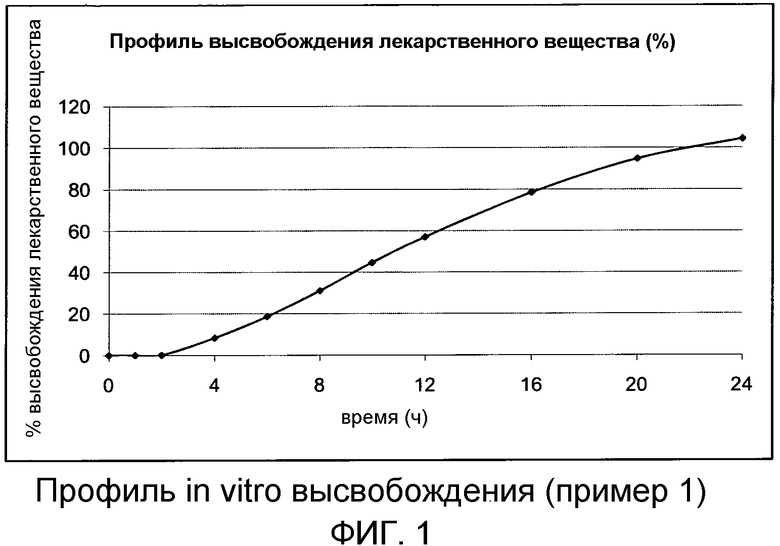
После чего тестировали профиль растворения хронотерапевтической фармацевтической композиции напроксена в следующих условиях: USP тип II, 1000 мл, 75 об/мин, 0-2 ч в 0,1 н HCl и 2-24 ч в фосфатном буфере, рН 6,8. Профили растворения приведены ниже в таблице 1, которые показаны в виде графика на Фиг.1.
Профиль растворения
Изобретение относится к медицине и заключается в хронотерапевтической фармацевтической композиции, содержащей активный ингредиент, покрытый pH-независимым агентом, и гидрофильный агент, формирующий матрикс вокруг покрытого активного ингредиента. Активный ингредиент выбран из НПВС напроксена, лорноксикама, диклофенака или ибупрофена. pH-независимый агент выбран из гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, поливинилпирролидона, метилцеллюлозы, ксантановой смолы, дисперсии гидроксиэтилцеллюлозы и сополимера этилакрилата и метилакрилата. Гидрофильный агент выбран из полиэтиленоксида и альгинатов. Изобретение относится также к способу получения дозированной формы и способу лечения артрита. Технический результат заключается в задержке высвобождения активного ингредиента от 4 до 6 часов, за которой следует контролируемое высвобождение активного ингредиента в течение 24 часов. 3 н. и 7 з.п. ф-лы, 1 пр., 1 табл., 1 ил.
1. Хронотерапевтическая фармацевтическая композиция, содержащая:
по меньшей мере один активный ингредиент, покрытый pH-независимым агентом; и
гидрофильный агент, формирующий матрикс вокруг указанного покрытого активного ингредиента;
где активный ингредиент представляет собой НПВС, выбранный из группы, состоящей из напроксена, лорноксикама, диклофенака, ибупрофена и их солей;
pH-независимый агент выбран из гидроксипропилметилцеллюлозы (НРМС), гидроксипропилцеллюлозы (НРС), поливинилпирролидона (PVP), метилцеллюлозы, ксантановой смолы, дисперсии гидроксиэтилцеллюлозы и сополимера этилакрилата и метилакрилата, или их комбинаций; и
гидрофильный агент выбран из полиэтиленоксида, альгинатов или их комбинаций; и
где композиция обеспечивает начальную временную задержку высвобождения активного ингредиента от 4 до 6 часов, за которой следует контролируемое высвобождение активного ингредиента в течение 24 ч периода.
2. Композиция по п. 1, где НПВС предпочтительно представляет собой напроксен натрия.
3. Композиция по п. 1, где композиция дополнительно содержит энтеросолюбильную оболочку.
4. Композиция по п. 3, где энтеросолюбильная оболочка представляет собой pH-зависимый полимер.
5. Композиция по п. 1, где композиция находится в форме таблеток, гранул или капсул.
6. Композиция по п. 1, где композиция дополнительно содержит фармацевтически приемлемые вспомогательные вещества.
7. Композиция по п. 1, где концентрация активного ингредиента находится в пределах от 1 мг до 1000 мг.
8. Композиция по п. 1, где композиция используется для лечения заболевания, демонстрирующего хронофармакологическую зависимость, при этом указанное заболевание представляет собой артрит.
9. Способ получения дозированной формы в виде таблетки из хронотерапевтической композиции по любому из пп. 1-7, где способ включает стадии на которых:
активный ингредиент покрывают pH-независимым агентом;
смешивают покрытый активный ингредиент с гидрофильным агентом; и
прессуют данную смесь покрытого активного ингредиента с гидрофильным агентом в таблетки и, когда необходимо, покрывают таблетку энтеросолюбильной оболочкой.
10. Способ лечения заболевания, демонстрирующего хронофармакологическую зависимость, при этом указанное заболевание представляет собой артрит, включающий введение терапевтически эффективного количества композиции по п. 1.
| US 20070036856 A1, 15.02.2007 | |||
| Способ получения адамантил-1-альдегида | 1972 |
|
SU438249A1 |
| WO 2008122993 A1, 16.10.2008 | |||
| US 20040043996 A1, 04.03.2004 | |||
| КОФЕИНСОДЕРЖАЩИЕ КОМПОЗИЦИИ ПРОДОЛЖИТЕЛЬНОГО ДЕЙСТВИЯ | 1995 |
|
RU2144353C1 |
| GB 1598458 A, 23.09.1981 | |||
| Регистр лекарственных средств России Энциклопедия лекарств, ред | |||
| Г.Л | |||
| ВЫШКОВСКИЙ, "РЛС-2003", Выпуск 10, 2003, стр | |||
| ПАРОПЕРЕГРЕВАТЕЛЬ ДЛЯ ЛОКОМОБИЛЬНЫХ КОТЛОВ | 1912 |
|
SU277A1 |
Авторы
Даты
2015-12-20—Публикация
2010-01-21—Подача