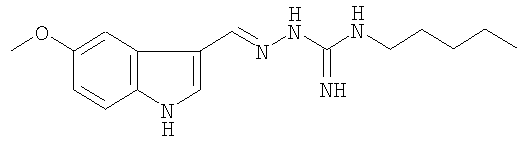
Настоящее изобретение относится к стабильной модификации частичного агониста 5-НТ4-рецептора, гидромалеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида, называемого в настоящем изобретении гидромалеатом тегасерода (I):
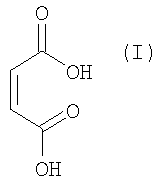
Изобретение также относится к фармацевтическим композициям, включающим модификацию настоящего изобретения, к применению указанной модификации в медицине, а также к способам их получения. Такие фармацевтические композиции особенно подходят для лечения состояний, для которых показано применение частичного агониста 5-НТ4-рецептора, например желудочно-кишечные расстройства (ЖК-расстройства), которые поражают желудочно-кишечный тракт на всем протяжении - от рта до ануса. К таким ЖК-расстройствам могут относиться, но ими не ограничиваются, изжога, вздутие живота, послеоперационная кишечная непроходимость, абдоминальные боль и дискомфорт, чувство быстрого насыщения, боль в эпигастральной области, тошнота, рвота, урчание, срыгивание, кишечная псевдонепроходимость, анальное недержание, синдром раздраженного кишечника (СРК), гастроэзофагеальная рефлюксная болезнь (ГЭРБ), функциональная диспепсия, хронические запор или диарея, гастропарез, например диабетический гастропарез, язвенный колит, болезнь Крона, язвы, гастроинтестинальная гиперактивность, расслабляющее воздействие на клетки гладкой мускулатуры кишечника и связанная с этим висцеральная боль.
Европейский патент 0505322 описывает семейство аминогуанидиновых производных, включая тегасерод и его фармацевтически приемлемые соли в качестве агонистов 5-НТ4-рецептора. Фармацевтически приемлемые соли включают кислотно-аддитивные соли, особенно гидрохлорид, гидробромид, гидрофторид, сульфат или бисульфат, фосфат или гидрофосфат, ацетат, бесилат, цитрат, фумарат, глюконат, лактат, малеат, малонат, малат, месилат, сукцинат и тартрат. Предпочтительной формой соли для медицинского применения является гидромалеат.
Было установлено, что вещество гидромалеат тегасерода может существовать в нескольких модификациях или сольватах (кристаллическая форма и модификация в настоящем изобретении являются взаимозаменяемыми). Поэтому цель настоящего изобретения заключается в предоставлении двух определенных модификаций гидромалеата тегасерода, называемых в настоящем изобретении модификациями А и Б, и трех определенных сольватов, а именно ацетонового, изопропанольного и этанольного сольватов. В частности предлагается модификация А, которая по своим ценным свойствам превосходит другую кристаллическую форму Б и сольваты. Другая цель настоящего изобретения заключается в предоставлении способа получения модификации А, в значительной степени свободной от других форм гидромалеата тегасерода. Кроме того, целью настоящего изобретения является предоставление фармацевтических составов, включающих модификацию А гидромалеата тегасерода. Также эксперименты по кристаллизации с этанолом, ацетоном, изопропанолом, метанолом и смесью ацетон/гексан в отношении 1:1 вызывают образование сольватов.
Кристаллические модификации А и Б и сольваты гидромалеата тегасерода различаются по своей термодинамической стабильности, по своим физическим параметрам, например характеру поглощения при инфракрасной абсорбционной спектрометрии (ИК), сигналу фазового перехода при дифференциальной сканирующей калориметрии (ДСК), порошковой рентгенограмме, и по способам их получения.
Модификация А представляет собой кристаллическую форму, имеющую улучшенные свойства, например хорошо выраженная стабильность при нагревании и повышенная стабильность в присутствии воды. Модификацию Б при определенных условиях, например при нагревании или в присутствии водосодержащих органических растворителей, можно полностью или частично перевести в модификацию А. Таким образом, модификация А характеризуется большей термодинамической стабильностью, чем модификация Б. Подобным образом сольваты, например ацетоновый сольват, можно трансформировать в модификацию А путем приведения в равновесие с водой.
Изобретение относится к кристаллической модификации А, ее получению и ее применению в фармацевтических препаратах. Предпочтительно изобретение включает кристаллическую модификацию А с полиморфной чистотой более 90%, более предпочтительно 95%, более предпочтительно 96%, более предпочтительно 97%, более предпочтительно 98%, более предпочтительно 99%, установленной, например, на основании порошковой дифракции рентгеновских лучей, спектроскопии комбинационного рассеяния и ИК-спектра. Изобретение относится предпочтительно к высокой степени чистой форме модификации А гидромалеата тегасерода. Под используемым в настоящем изобретении понятием «в высокой степени чистая», подразумевается, что примерно менее 5% и, предпочтительно, примерно менее 2 мас.% в препарате, например, в качестве чистого лекарственного вещества или в фармацевтической композиции, составляет не модификация А гидромалеата тегасерода (а другая форма гидромалеата тегасерода, например, модификация Б или любой из сольватов), принимая за 100% общую массу гидромалеата тегасерода в препарате, например, в качестве чистого лекарственного вещества или в фармацевтической композиции.
Кристаллическая модификация А гидромалеата тегасерода имеет сигнал плавления примерно при 190°С при оценке методом ДСК. В инфракрасном (ИК) спектре модификация А отличается от модификации Б преимущественно по форме и относительной интенсивности многих полос в областях 3000-4000 см-1, вблизи 1150 см-1 и 800-1000 см-1. Характерной особенностью является отчетливая полоса при 3415 см-1, которая не представлена в ИК-спектре модификации А, но присутствует в спектре модификации Б. В области 4000-600 см-1 у модификации А в числе других обнаружены следующие полосы [см-1]: 3410-3100 (ν N-H / ν (N-H)+); 2990-2872 (νasy/vasy алифатической группы СН2/СН3 νNH2 +; 2830 (ν CH группы ОСН3); 1710 (sh) (ν C=O соединения RCOOH (hml)); 1669/1629/1583 (ν C=N / ν C=C индола, ν C=O (R-COO-) и δ-NH); 1488 (ν C=O (R-COO-) / δas (CH) алифатическая); 1150-1028 (ν C-O); 860-810 (δ-CH o.o.p. ароматическая). Для регистрации каждого из ИК-спектров можно, например, использовать прибор FT IR 1725-Х (фирмы Perkin Elmer).
Модификация А имеет порошковую рентгенограмму с характеристическими пиками. Модификация А отличается от модификации Б присутствием значимых пиков (см. представленную ниже табл. 1). Все характеристические пики суммированы в табл.1 и показаны на фиг.1. Измерения проводят, например на дифрактометре, например Scintag 2000 (Санта-Клара, США) с использованием медного излучения Кα (45 кВ, 40 мА).
Характерной для модификации А является термограмма при дифференциальной сканирующей калориметрии (ДСК). В ней обнаруживается эндотермический пик плавления при температуре около 190°С. Энтальпия плавления эндотермического сигнала составляет 130 Дж/г ±5 Дж/г. Измерение проводят на приборе Perkin Elmer DSC 7 в изогнутой кювете со скоростью нагрева 10 К/мин. Обычно количество образца примерно равно 2 мг. Типичной отличительной чертой термограммы модификации А в сравнении с модификацией Б и ацетоновым и этанольным сольватами является отсутствие в ней другого термического сигнала (см. представленную ниже табл.1а):
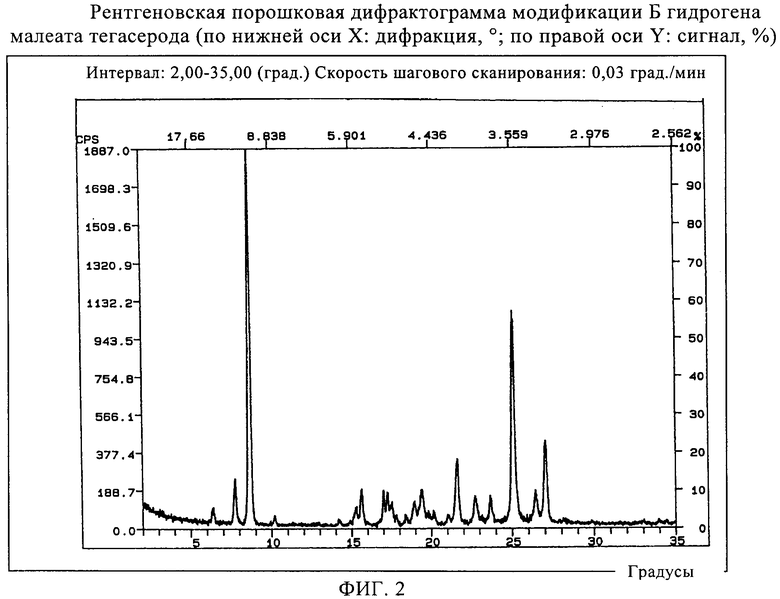
Модификация Б имеет порошковую рентгенограмму с иными, по сравнению с модификацией А, характеристическими дифракционными пиками. Она отличается от модификации А при анализе порошковой рентгенограммы тем, что не показывает характеристического пика при 8,7°. ИК-спектр модификации Б показывает иную, по сравнению с модификацией А, картину в областях 3415 см-1 (отчетливо выраженный, одиночный сигнал), 1150 см-1 (менее интенсивный сигнал) и 800-1000 см-1 (более интенсивные сигналы). Характерной для модификации Б также является термограмма, полученная методом дифференциальной сканирующей калориметрии. В дополнение к эндотермическому пику примерно при 190°С в ней также прослеживаются пик при 97°С и сигналы плавления/кристаллизации примерно при 181°С. Установлено, что модификация Б переходит в модификацию А под воздействием нагревания (соответственно сигналу примерно при 190°С). Измерение выполнено в соответствии с вышеприведенным описанием.
Модификация А имеет значительные преимущества по сравнению с модификацией Б, а также этанольным и ацетоновым сольватами.
Таким образом, было обнаружено, например, что модификация А является более стабильной при нагревании и более стабильной в присутствии воды. Оба свойства модификации А имеют преимущества, например, при производстве таблеток. Например, процесс высушивания при производстве таблеток можно проводить при более высокой температуре. Более того, тот факт, что модификация А более стабильна в присутствии воды, означает, что при получении тегасерода можно применять технологию влажного гранулирования и что таблетки, содержащие модификацию А, проявляют большую стабильность к увлажнению. Это является преимуществом, поскольку из-за плохой растворимости гидромалеата тегасерода был разработан состав (см. WO 00/10526), в котором использовано высокое количество гигроскопических разрыхлителей (>15%). Такое высокое количество разрыхлителя притягивает воду внутрь таблетки и, в случае, если определенная модификация нестабильна в присутствии воды, требуются особые средства упаковки. Более того, неожиданно обнаружено, что способ, включающий на стадии кристаллизации или рекристаллизации гидромалеата тегасерода определенное количество воды и органического растворителя, имеет преимущество перед таковым, описанным в ЕР 0505322 предшествующего уровня техники.
Изобретение относится к модификации А гидромалеата тегасерода, имеющей, согласно данным, представленным в табл.2, характерную кристаллическую структуру, установленную посредством рентгеновского анализа монокристаллов.
Изобретение относится к модификации А гидромалеата тегасерода, имеющей характерную порошковую рентгенограмму, показанную в табл. 1 или на фиг.1.
Изобретение относится к модификации А гидромалеата тегасерода, имеющей в термограмме, полученной методом дифференциальной сканирующей калориметрии, единственный сигнал плавления примерно при 190°С. Энтальпия плавления эндотермического сигнала составляет примерно 130 Дж/г.
Изобретение относится к модификации А гидромалеата тегасерода, у которой в инфракрасном спектре отсутствует следующее поглощение (метод пропускания в таблетках KBr): отчетливая одиночная полоса при 3415 см-1.
В настоящем изобретении также предусматривается способ получения модификации А гидромалеата тегасерода.
Модификацию А гидромалеата тегасерода можно получать путем кристаллизации или рекристаллизации любой формы, или смесей любых форм гидромалеата тегасерода в растворе, содержащем, например, воду и подходящий растворитель.
Предпочтительный вариант осуществления настоящего изобретения относится к способу получения модификации А гидромалеата тегасерода, включающему стадию кристаллизации любой формы, или смесей любых форм гидромалеата тегасерода в растворе, содержащем органический растворитель и воду.
Более предпочтительный вариант осуществления настоящего изобретения относится к способу получения модификации А гидромалеата тегасерода, включающему стадию кристаллизации любой формы или смесей любых форм гидромалеата тегасерода в растворе, содержащем воду и сложный ацетатный эфир, например н-бутилацетат, изобутилацетат или этилацетат и воду; предпочтительно этилацетат и воду.
Более предпочтительный вариант осуществления настоящего изобретения относится к способу получения модификации А гидромалеата тегасерода в соответствии с вышеизложенным описанием, в котором в упомянутом растворе, содержащем воду и органический растворитель, вода составляет от 0,01 до 5 мас.% в пересчете на общую массу раствора, более предпочтительно от 0,1 до 4 мас.%, еще более предпочтительно от 1 до 3 мас.%. Наиболее предпочтительно, вода присутствует ровно в таком количестве, в котором она растворима в упомянутом органическом растворителе, например, вода составляет примерно 2,8 мас.% от общей массы раствора, включающего воду и этилацет.
Более того, кристаллизацию можно, например, проводить при температуре примерно от 10°С до температуры кипения упомянутого раствора, включающего воду и органический растворитель, например, для 2,8 мас.% водно-этилацетатного раствора - при температуре от 10 до 75°С, предпочтительно примерно при 70°С.
Получение кристаллизованной модификации А гидромалеата тегасерода и очистку таким способом полученной модификации можно проводить в соответствии с известными методами.
Изобретение также относится к модификации Б гидромалеата тегасерода, включающей характерную порошковую рентгенограмму, показанную в табл.1, предпочтительно имеющей характерную порошковую рентгенограмму, показанную в табл.1.
Изобретение относится к модификации Б гидромалеата тегасерода, имеющей в термограмме, полученной методом дифференциальной сканирующей калориметрии, кроме сигнала плавления при 190°С (как у модификации А) один дополнительный эндотермический пик при 97°С (очень слабый) и сигналы плавления/кристаллизации примерно при 180°С (слабые).
Изобретение относится к модификации Б гидромалеата тегасерода, имеющей в инфракрасном спектре следующее поглощение (метод пропускания в таблетках KBr): отчетливую одиночную полосу при 3415 см-1.
Изобретение также относится к фармацевтическим препаратам, содержащим модификации А или Б (или смеси А и Б) гидромалеата тегасерода. Изобретение относится, в частности, к соответствующим фармацевтическим препаратам для лечения синдрома раздраженного кишечника, гастроэзофагеальной рефлюксной болезни, функциональной диспепсии, хронических запора или диареи и их слабовыраженных симптомов. Изобретение относится к использованию модификаций А или Б гидромалеата тегасерода для приготовления фармацевтических препаратов, особенно для лечения синдрома раздраженного кишечника, гастроэзофагеальной рефлюксной болезни, функциональной диспепсии, хронических запора или диареи и их слабовыраженных симптомов.
Модификации А или Б (или смеси А и Б) гидромалеата тегасерода можно применять, например, в форме фармацевтических препаратов, которые содержат терапевтически эффективное количество действующего ингредиента, если желательно вместе с неорганическими или органическими, твердыми или жидкими фармацевтически пригодными носителями, которые приемлемы для энтерального, например перорального, или парентерального введения. Более того, модификации А и Б гидромалеата тегасерода можно применять в форме препаратов, которые можно вводить парентерально или в виде инфузионных растворов. Фармацевтические препараты могут быть стерилизованными и/или могут включать наполнители, например консерванты, стабилизаторы, увлажнители и/или эмульгаторы, солюбилизаторы, соли для регулирования осмотического давления и/или буферы. Настоящие фармацевтические препараты включают примерно от 0,1 до 100%, в особенности примерно от 1% до примерно 50%, лиофилизатов примерно до 100% действующего ингредиента.
Изобретение также относится к применению модификаций А и Б гидромалеата тегасерода в качестве лекарственного средства, предпочтительно в форме фармацевтических препаратов. Дозировка может зависеть от различных факторов, например способа введения, вида, возраста и/или индивидуального состояния. Дозы для ежедневного введения составляют примерно от 0,0016 до примерно 16 мг/кг в случае перорального введения и предпочтительно примерно от 1,2 до примерно 120 мг, более предпочтительно примерно 12 мг, например, два раза в сутки по 6 мг для представителя теплокровного вида, имеющего массу тела примерно 70 кг.
Краткое описание чертежей
фиг.1 представляет рентгеновскую порошковую дифрактограмму модификации А гидромалеата тегасерода (по нижней оси X: дифракция, °; по правой оси Y: сигнал, %);
фиг.2 представляет рентгеновскую порошковую дифрактограмму модификации Б гидромалеата тегасерода (по нижней оси X: дифракция, °; по правой оси Y: сигнал, %);
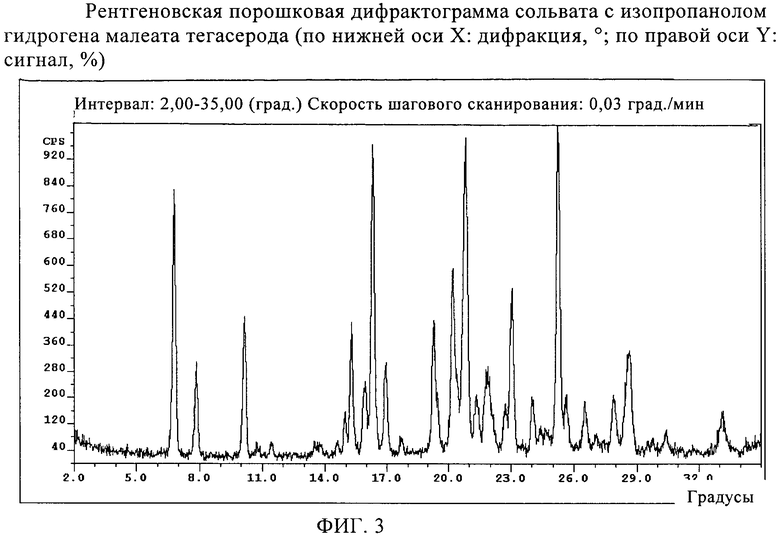
фиг.3 представляет рентгеновскую порошковую дифрактограмму изопропанольного сольвата гидромалеата тегасерода (по нижней оси X: дифракция, °; по правой оси Y: сигнал, %);
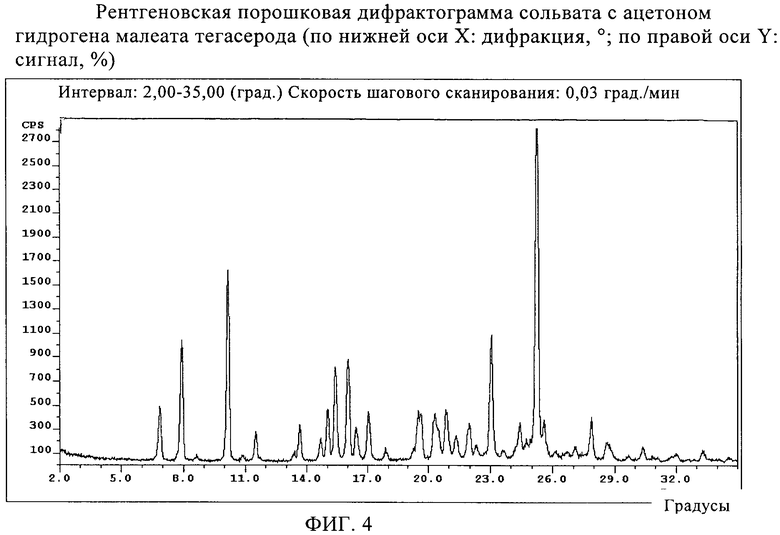
фиг.4 представляет рентгеновскую порошковую дифрактограмму ацетонового сольвата гидромалеата тегасерода (по нижней оси X: дифракция, °; по правой оси Y: сигнал, %);
фиг.5 представляет рентгеновскую порошковую дифрактограмму этанольного сольвата гидромалеата тегасерода (по нижней оси X: дифракция, °; по правой оси Y: сигнал, %).
Получение модификации А, смесей А+Б, модификации Б и изопропанольного сольвата, ацетонового сольвата, этанольного сольвата проводят, например, согласно описанию в приведенных ниже примерах осуществления изобретения.
Примеры
Пример 1: Получение 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида
Получение гидробромида S-додецилизотиосемикарбазида
Заполняют приемлемый реакционный аппарат приблизительно 860 л безводного этанола.
Затем, при перемешивании, добавляют 96 кг (1056 молей) тиосемикарбазида и 306 кг (1210 молей) 1-бромдодекана.
Реакционную смесь нагревают до 68-70°С и перемешивают при данной температуре в течение 15-20 ч. Окончание реакции контролируют методом ТСХ (требование: <0,1% мас./об. тиосемикарбазида в реакционной смеси). В том случае, если результат не соответствует требованию, реакцию продолжают и повторяют тестирование методом ТСХ с интервалом в 4 ч.
Затем смесь разбавляют, добавляя приблизительно 384 л безводного этанола, и охлаждают до 38-42°С.
Смесь постепенно охлаждают приблизительно до -10°С. Перемешивают ее при данной температуре в течение, по меньшей мере, 2 ч. Суспензию переносят на фильтр и собирают твердую фазу.
Продукт реакции промывают несколькими порциями холодного безводного этанола. Фильтрат и промывной раствор отбрасывают.
Продукт реакции (гидробромид S-додецилизотиосемикарбазида) высушивают при температуре, не превышающей 50°С, при пониженном давлении.
Получение гидробромида 3-(5-метокси-1Н-индол-3-илметилен)-N-пентилкарбазимидамида
Заполняют приемлемый реакционный аппарат безводным этанолом, приблизительно в количестве 340 л.
При перемешивании добавляют:
- 63,3 кг (186 молей) гидробромида S-додецилизотиосемикарбазида и
- 24,8 кг (284 моля) 1-пентиламина.
Реакционную смесь нагревают до 60-64°С и перемешивают при данной температуре в течение по меньшей мере 6 ч. Окончание реакции контролируют методом ТСХ (требование: <0,1% мас./об. гидробромида S-додецилизотиосемикарбазида в реакционной смеси). В том случае, если результат не соответствует требованию, реакцию продолжают и повторяют тестирование методом ТСХ с интервалом 4 ч. Затем смесь охлаждают до 20-25°С.
При пониженном давлении во время перемешивания добавляют приблизительно 5 кг хлористого водорода (газа) до получения рН 1-4. Контролируют рН.
Несколькими порциями добавляют 30,1 кг (172 моля) 5-метоксииндол-3-карбальдегида.
Между добавлениями в реакционную смесь можно внести в качестве затравки кристаллы гидробромида 3-(5-метокси-1H-индол-3-илметилен)-N-пентилкарбазимидамида.
Затем добавляют 35 л безводного этанола и снова проверяют рН (требование: рН 1-4; в противном случае вводят дополнительно газообразный хлористый водород). Перемешивают реакционную смесь в течение примерно 1 ч.
После этого смесь нагревают до 38-42°С и добавляют приблизительно 395 л трет-бутилметилового простого эфира.
Далее смесь охлаждают до 0-5°С и перемешивают при данной температуре в течение примерно 1,5 ч.
Затем суспензию переносят на фильтр и собирают твердую фазу. Ополаскивают сосуд и трубки подачи и промывают осадок несколькими порциями достаточного количества холодной смеси трет-бутилметилового эфира/безводного этанола, 3:1 (об./об.).
Фильтрат и промывной раствор отбрасывают и продукт реакции высушивают при температуре, не превышающей 60°С, при пониженном давлении.
Получение 3-(5-метокси-1Н-индол-3-ил-метилен)-N-пентилкарбазимидамида
Заполняют приемлемый сосуд приблизительно 1045 л изопропилацетата и 114 л метанола.
При перемешивании добавляют:
- 135,6 кг (354 моля) гидробромида 3-(5-метокси-1H-индол-3-илметилен)-N-пентилкарбазимидамида.
Смесь охлаждают до 15-20°С и, поддерживая данную температуру, добавляют в нее смесь приблизительно 120 л воды и 93 кг гидроксида натрия, 30% водный раствор. Перемешивают реакционную смесь до растворения твердых компонентов, затем смесь переносят в сепаратор и дают фазам расслоиться. Водную фазу отбрасывают. По усмотрению, можно повторить экстракцию органической фазы смесью воды/гидроксида натрия, 30% раствор.
Органическую фазу переносят в другой сосуд. Промывают первый сосуд, сепаратор и трубки подачи достаточным количеством смеси изопропилацетата/метанола, 9:1 (об./об.).
Органическую фазу объединяют с промывным раствором и упаривают при пониженном давлении до объема примерно 330 л.
Концентрат охлаждают до 25-30°С, и, при необходимости, вносят в раствор в качестве затравки кристаллы 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида.
После этого продукт охлаждают до 0-2°С и перемешивают при данной температуре в течение, по меньшей мере, 1 ч.
Суспензию переносят на фильтр и собирают твердую фазу. Ополаскивают сосуд и трубки подачи и промывают осадок несколькими порциями достаточного количества холодного изопропилацетата.
Затем дополнительно промывают осадок несколькими порциями достаточного количества воды.
Отбрасывают фильтрат и промывной раствор и высушивают 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамид при температуре, не превышающей 70°С, при пониженном давлении.
Пример 2: Получение модификации А малеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида
60,3 г 3-(5-Метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида растворяют в смеси 1167 г этилацетата и насыщают водой, т.е. 33 г (т.е. 2,8 мас.% воды в пересчете на общую массу смеси; смесь = кристаллизационный раствор), при 60-65°С при перемешивании. Полученный раствор охлаждают до 50-55°С и добавляют к нему 1,2 г активированного угля. Раствор фильтруют и затем промывают с использованием 120 г смеси этилацетата/воды (2,8 мас.% воды в пересчете на общую массу смеси). Затем при 50-55°С на протяжении 20-30 мин добавляют раствор А, содержащий 23,9 г малеиновой кислоты и 35,8 г воды. Происходит образование суспензии. Суспензию перемешивают в течение 15-30 мин при 50-55°С и затем перемешивают еще в течение 2 ч при 68-70°С. После этого, в течение 1,5-2 ч суспензию охлаждают до 20-25°С. Полученный продукт (= модификации А гидромалеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида) отделяют фильтрованием и промывают 120 г атилацетата. После высушивания под вакуумом при 55-60°С в течение 18 ч получают примерно 80,8 г продукта.
Пример 3: Получение смеси модификации А и модификации Б, модификации Б ацетонового сольвата и этанольного сольвата малеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида
Смесь модификации А и модификации Б
30,0 г 3-(5-Метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида растворяют в 450 мл ацетона при 20-30°С. Добавляют 0,6 г активированного угля и перемешивают суспензию в течение 30 мин. Суспензию фильтруют и промывают 30 мл ацетона. Фильтрат нагревают до 50-54°С и в течение 15 мин добавляют к нему 11,55 г малеиновой кислоты в 80 мл ацетона. Образуется суспензия, которую перемешивают еще 15 мин. Суспензию охлаждают до 0-5°С и перемешивают при данной температуре в течение 2 ч. Полученный продукт (= смеси модификации А и модификации Б гидромалеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида) отделяют фильтрованием и промывают 70 мл ацетона при 0-5°С. После высушивания под вакуумом при 80°С получают примерно 39,6 г продукта.
Модификация Б
Полученный выше продукт кристаллизуют из тетрагидрофурана и метанола. Затем проводят рекристаллизацию с использованием этанола и простого эфира при 90°С.
Ацетоновый сольват
Полученный выше продукт кристаллизуют при 60°С путем быстрой кристаллизации (например, выпариванием) из горячего насыщенного раствора ацетона. Высушивают на воздухе.
Этанольный сольват
Полученный выше продукт кристаллизуют при 60°С путем быстрой кристаллизации (например, выпариванием) из горячего насыщенного раствора этанола. Высушивают на воздухе.
Изопропанольный сольват
Полученный выше продукт кристаллизуют при 60°С путем быстрой кристаллизации (например, выпариванием) из горячего насыщенного раствора изопропанола. Высушивают на воздухе.
Пример 4: Состав двухмиллиграммовой таблетки модификации А можно приготовить согласно описанию, представленному ниже
а) Приготовление гранулированного материала
Стадия предварительного смешивания:
1. 4,432 кг модификации А гидромалеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида и 28,688 кг моногидрата лактозы смешивают с использованием интенсивного смесителя (Colette Gral® 300 1 или Fielder®; положение регулятора скорости смесителя: 1; положение регулятора скорости ножа: 1) приблизительно в течение 1,5 мин или с использованием смесителя свободного падения (Turbula®, Soneco® или Röhnrad®)
2. Затем предварительную смесь, полученную на стадии 1, просеивают (гранулятор с вибратором, например, Frewitt® или Erweka®; размер ячейки 0,8 мм).
3. Предварительную смесь разделяют на две части по 16,560 кг.
Получение раствора для грануляции
4. Вывешивают приблизительно 40 кг очищенной воды.
5. 3,600 кг метилгидроксипропилцеллюлозы в виде трех партий добавляют к очищенной воде, подготовленной на стадии 4, и перемешивают до растворения.
6. 1,440 кг полоксамера 188 добавляют к раствору, полученному на стадии 5, во время перемешивания до растворения.
Стадия грануляции:
7. Взвешивают 28,800 кг кросповидона, 10,080 кг моногидрата лактозы и 4,320 кг моностеарата глицерина.
8. Одну часть предварительной смеси, полученной на стадии 3, добавляют к эксципиентам, подготовленным на стадии 7, и полученный продукт перемешивают с помощью интенсивного смесителя, например, Colette Gral® 300 1 или Fielder® (положение регулятора скорости смесителя: 1; положение регулятора скорости ножа: 1) в течение приблизительно 2 мин.
9. Смесь, полученную на стадии 8, увлажняют раствором для грануляции, полученным на стадии 6, во время перемешивания в интенсивном смесителе, например, типа Colette Gral® 300 1 или Fielder® (положение регулятора скорости смесителя: 1; положение регулятора скорости ножа: 0; скорость накачки: 4 кг/мин), приблизительно в течение 12 мин.
10. Взвешивают приблизительно 2 кг очищенной воды.
11. Сосуд, используемый на стадии 6, промывают очищенной водой, подготовленной на стадии 10, и данную промывную воду добавляют во время перемешивания к смеси, полученной на стадии 9.
12. Полученную массу гранулируют при перемешивании с использованием интенсивного смесителя Colette Gral® 300 1 или Fielder® (положение регулятора скорости смесителя: 1; положение регулятора скорости ножа: 1) в течение приблизительно 2,5 мин.
Стадия сушки:
13. Гранулят, полученный на стадии 12, сушат в воздушной сушилке с псевдоожиженным слоем (например, Glatt® или Aeromatic®) в течение приблизительно 65 мин (температура входящего воздуха приблизительно 70°С) до достижения потери влаги при сушке (loss on drying, LOD), требуемой для смеси для таблетирования, например до LOD≤4,4%.
14. Гранулят сортируют путем просеивания (размер ячеек 0,8 мм) с использованием гранулятора с вибрирующим ситом, например, Frewitt® или Erweka®.
15. Повторяют стадии 4-14 с использованием другой части смеси, полученной на стадии 3.
б) Приготовление смеси для таблетирования
16. Просеивают 8,640 кг полиэтиленгликоля 4000 и 5,760 кг моностеарата глицерина (гранулятор с вибратором, например, типа Frewitt® или Erweka®; размер ячеек: 0,8 мм).
17. Ингредиенты, полученные на стадии 16, добавляют к общей массе гранулированного продукта и смешивают с помощью смесителя свободного падения, например, Soneco® или Röhnrad®, в течение приблизительно 20 мин (10 об/мин), получая требуемую конечную смесь для таблетирования.
в) Стадия прессования
18. Смесь для таблетирования, полученную на стадии 17, прессуют в таблетки, используя давление прессования, равное 11, 14 или 17 кН, на роторной таблетирующей машине, например, Fette®, Korsh®, Kelian® или Coarty® (температура <20°С; OB (относительная влажность) <40%).
Пример 5: Композиция двухмиллиграммовой таблетки (1 мг основания соответствует 1,385 мг модификации А гидромалеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида)
Пример 6: Состав шестимиллиграммовой таблетки модификации А можно приготовить согласно описанному ниже технологическому процессу
А) Получение гранулированного продукта
Получение раствора для грануляции
1. Взвешивают приблизительно 40 кг очищенной воды.
2. 3,600 кг метилгидроксипропилцеллюлозы в виде трех партий добавляют к очищенной воде, подготовленной на стадии 1, во время перемешивания до растворения.
3. 1,440 кг полоксамера 188 добавляют к раствору, полученному на стадии 2, во время перемешивания до растворения (танк для перемешивания с мешалкой).
Стадия грануляции:
4. Отвешивают 4,787 кг модификации А гидромалеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида и 28,800 кг кросповидона, 21,853 кг моногидрата лактозы и 4,320 кг моностеарата глицерина.
5. Ингредиенты, подготовленные на стадии 4, перемешивают с помощью интенсивного смесителя, например, Colette Gral® 300 1 или Fielder® (положение регулятора скорости смесителя: 1; положение регулятора скорости ножа: 1) в течение приблизительно 2 мин.
6. Смесь, полученную на стадии 5, увлажняют раствором для грануляции, полученным на стадии 3, во время перемешивания с помощью интенсивного смесителя, например, Colette Gral® 300 1 или Fielder® (положение регулятора скорости смесителя: 1; положение регулятора скорости ножа: 0; скорость накачки примерно 4 кг/мин), приблизительно в течение 12 мин.
7. Взвешивают примерно 2 кг очищенной воды.
8. Сосуд, используемый на стадии 3, промывают очищенной водой, подготовленной на стадии 7, и данную промывную воду добавляют к смеси, полученной на стадии 6, во время перемешивания.
9. Полученную массу гранулируют при перемешивании с использованием интенсивного смесителя, например, типа Colette Gral® 300 1 или Fielder® (положение регулятора скорости смесителя: 1; положение регулятора скорости ножа: 1) в течение приблизительно 2,5 мин.
Стадия сушки:
10. Гранулят, полученный на стадии 9, сушат в воздушной сушилке с псевдоожиженным слоем, например, типа Glatt® или Aeromatic® в течение приблизительно 65 мин (температура входящего воздуха примерно 70°С) до достижения потери влаги при сушке (LOD) требуемой для смеси для таблетирования, т.е. до LOD≤4,4%.
11. Гранулят сортируют путем просеивания (размер ячеек 0,8 мм) с помощью гранулятора с вибрирующим ситом (Frewitt® или Erweka®).
12. Повторяют стадии 1-11.
б) Получение смеси для таблетирования
13. Просеивают 8,640 кг полиэтиленгликоля 4000 и 5,760 кг моностеарата глицерина с помощью гранулятора с вибрирующим ситом, например, Frewitt® или Erweka® (размер ячеек 0,8 мм).
14. Ингредиенты, полученные на стадии 13, добавляют к общей массе гранулированного продукта и данную смесь перемешивают с помощью смесителя свободного падения, например, типа Soneco® или Röhnrad®, в течение приблизительно 20 мин (10 об/мин), получая требуемую конечную смесь для таблетирования.
в) Стадия прессования
15. Смесь для таблетирования, полученную на стадии 14, прессуют в таблетки, используя давления прессования, равные 13, 16 или 19 кН, на роторной таблетирующей машине, например, Fette®, Korsh®, Kelian® или Coarly® (температура <200°С, OB (относительная влажность) <40%).
Пример 7: Композиция шестимиллиграммовой таблетки (1 мг основания соответствует 1,385 мг модификации А гидромалеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида)
Пример 8: Составы модификации А гидромалеата 3-(5-метокси-1H-индол-3-ил-метилен)-N-пентилкарбазимидамида
Шестимиллиграммовые таблетки готовят с применением уплотнения вальцовкой (см. также пример 4 в WO 03/053432):
Композиции готовят путем смешивания малеата тегасерода, лактозы, кросповидона, аэросила и глицерилбегената. Полученную смесь уплотняют вальцовкой и размалывают. Таблетки формируют путем прессования.
Пример 9: Другие композиции (прямое прессование)
Другие композиции можно получить путем
(i) приготовления смеси малеата тегасерода (приготовленного по вышеизложенному описанию), разбавителя и смазывающего вещества,
(ii) просеивания смеси
(iii) добавления разрыхлителя, скользящего агента, смазывающего агента и необязательно связующего, и перемешивания просеянной на стадии (ii) смеси и
(iv) формирования таблеток путем прямого прессования.
Часть скользящего агента можно добавлять в смесь, получаемую на стадии (i), остаток - в конечную смесь, получаемую на стадии (iii), или можно добавлять общее количество смазывающего агента в конечную смесь, получаемую на стадии (iii).
Полученные на стадии (iii) порошковые смеси прессуют либо на однопуансонном прессе (Korsh ЕКО), 6-позиционном роторном прессе (Korsh PH106), 17-позиционном роторном прессе (Korsh РН 230) либо на 43-позиционном роторном прессе (типа Fette PT2090).
Все компоненты можно вместе перемешать, просеять и снова перемешать. После этого таблетки формируют путем прямого прессования.
Шестимиллиграммовые таблетки готовят методом прямого прессования.
Предварительную смесь готовят путем смешения малеата тегасерода, гидроксипропилметилцеллюлозы, части глицерилбегената и части лактозы. Данную предварительную смесь смешивают с оставшимися эксципиентами, за исключением глицерилбегената. В полученную смесь вводят смазывающий агент - оставшуюся часть глицерилбегената.
Конечную смесь прессуют с использованием роторного пресса (Korsh РН 343 или Fette PT2090), оснащенного 7-мм круглыми верхними пуансонами.


Настоящее изобретение относится к кристаллическим формам гидромалеата тегасерода, их использованию в фармацевтических композициях, пригодных для лечения синдрома раздраженного кишечника, гастроэзофагеальной рефлюксной болезни, функциональной диспепсии, хронических запоров или диареи, и к их получению. Технический результат - получение новой стабильной кристаллической формы гидромалеата тегасерода, отличающейся стабильностью при нагревании и в присутствии воды. 9 н. и 7 з.п. ф-лы, 3 табл., 5 ил.
| АМИНОГУАНИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1992 |
|
RU2095347C1 |
| Автомобильное ведущее колесо | 1927 |
|
SU10526A1 |
| ЕР 1321142, 25.06.2003 | |||
| GRAUL A | |||
| ET AL | |||
| Drags of future, 1999, Vol.24, №1, 38-44 | |||
| RIVKIN A | |||
| ET AL | |||
| Clinical therapeutics, 2003, Vol.25, №7, 1952-1974. | |||
Авторы
Даты
2009-03-20—Публикация
2004-07-23—Подача