Соединения согласно изобретению соответствуют общей формуле (I):
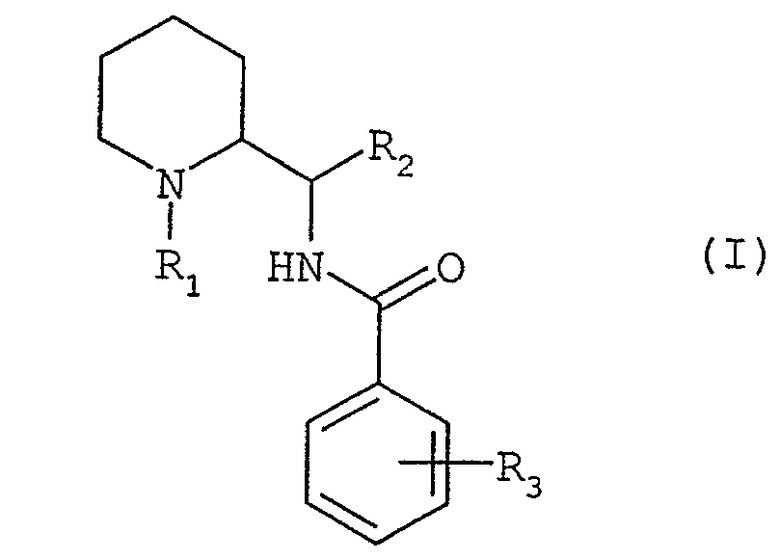
в которой:
R1 представляет собой либо атом водорода, либо прямую или разветвленную группу (С1-С7)алкил, возможно замещенную одним или несколькими атомами фтора, либо группу (С3-С7)циклоалкил, либо группу (С3-С7)циклоалкил(С1-С3)алкил, либо группу фенил(С1-С3)алкил, возможно замещенную одной или двумя метоксигруппами, либо группу (С2-С4)алкенил, либо группу (С2-С4)алкинил;
R2 представляет собой группу пиридинил, фуранил, тиенил, тиазолил или оксазолил, возможно замещенную одним или несколькими заместителями, выбранными из атомов галогена и групп: трифторметил, прямой или разветвленный (С1-С6)алкил и (С1-С6)алкоксил;
R3 представляет собой либо атом водорода, либо один или несколько заместителей, выбранных из атомов галогена и групп: трифторметил, прямой или разветвленный (С1-С6)алкил, (С3-С7)циклоалкил, (С1-С6)алкоксил, фенил, циано, ацетил, бензоил, (С1-С6)тиоалкил, (С1-С6)алкилсульфонил, карбоксил или (С1-С6)алкоксикарбонил, либо группу общей формулы NR4R5 или SO2NR4R5 или CONR4R5, в которых R4 и R5 обозначают каждый, независимо друг от друга, атом водорода или прямой или разветвленный (С1-С6)алкил или (С3-С7)циклоалкил, или R4 и R5 образуют вместе с атомом азота, с которым они соединены, цикл пирролидина, пиперидина или морфолина.
Соединения формулы (I) могут содержать один или несколько ассиметричных атомов углерода. В этой связи они могут находиться в форме энантиомеров или трео- или эритро-диастереоизомеров. Указанные энантиомеры, диастереоизомеры и их смеси, включая рацемические смеси, составляют часть изобретения.
Соединения формулы (I) могут существовать в форме оснований или кислотно-аддитивных солей. Такие аддитивные соли составляют часть изобретения.
Эти соли преимущественно получают при взаимодействии с фармацевтически приемлемыми кислотами, однако соли других кислот, пригодные, например, для очистки и выделения соединений формулы (I), также составляют часть изобретения.
Соединения формулы (I) могут существовать также в форме гидратов или сольватов, а именно в форме ассоциатов или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть изобретения.
Соединения согласно изобретению обладают конкретной активностью, заключающейся в специфическом ингибировании переносчиков глицина glyt 1 и/или glyt 2.
Соединения формулы (I) конфигурации трео или эритро, в которых R1 отличен от атома водорода, могут быть получены по способу, иллюстрированному схемой 1, приведенной ниже
Схема 1
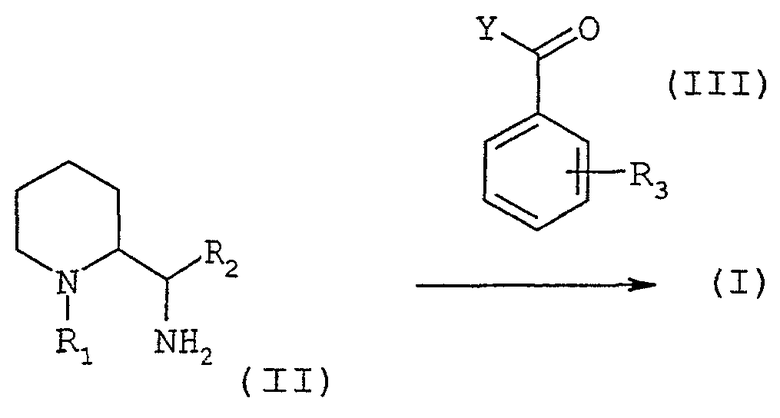
Осуществляют реакцию сочетания между диамином общей формулы (II), в которой R1 и R2 определены выше (где R1 отличен от атома водорода), и активированной кислотой или хлорангидридом кислоты общей формулы (III), в которой Y обозначает активированную группу ОН или атом хлора, и R3 определен выше, с использованием методов, известных специалисту.
Диамин общей формулы (II) может быть получен способом, иллюстрированным нижеприведенной схемой 2
Схема 2
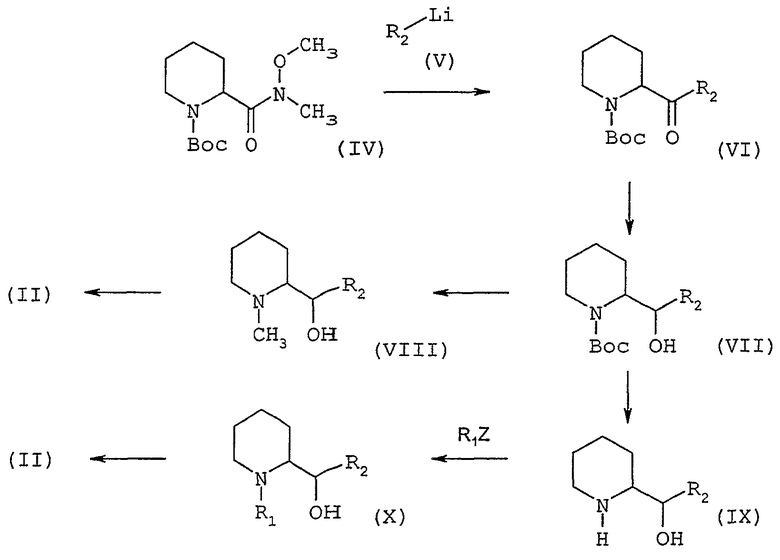
Подвергают взаимодействию амид Вейнреба формулы (IV), в которой Вос обозначает группу 1,1-диметилэтоксикарбонил, с литийсодержащим гетероциклическим соединением общей формулы (V), в которой R2 определен выше, в эфирном растворителе, таком как диэтиловый эфир, при температуре в интервале от -90° до -30°С; получают кетон общей формулы (VI), который восстанавливают до спирта конфигурации трео общей формулы (VII) с помощью восстановителя, такого как K-Selectride® или L-Selectride® (три-втор-бутилборгидрид калия или лития), в эфирном растворителе, таком как тетрагидрофуран, при температуре в интервале от -78°С до температуры окружающей среды. Затем карбамат общей формулы (VII) может быть восстановлен до N-метиламиноспирта конфигурации трео общей формулы (VIII) при действии смешанным гидридом, таким как двойной гидрид алюминия и лития, в эфирном растворителе, таком как тетрагидрофуран, в интервале температур от температуры окружающей среды до температуры кипения с обратным холодильником. Затем превращают в две стадии трео-спирт общей формулы (VIII) в промежуточный диамин общей формулы (II), в которой R1 обозначает метильную группу, в форме трео или в форме смеси эритро-трео в зависимости от природы гетероциклического соединения, следующим образом: сначала превращают спиртовую группу в нуклеофобную группу, например метансульфонатную, при действии метилсульфонилхлорида, в хлорсодержащем растворителе, таком как дихлорметан, в присутствии основания, такого как триэтиламин, при температуре от 0°С до температуры окружающей среды, затем нуклеофобную группу подвергают взаимодействию с жидким аммиаком при -50°С в спирте, таком как этанол, в закрытой среде, такой как автоклав, при температуре от -50°С до температуры окружающей среды. Можно также снять защитную группу с карбамата общей формулы (VII) с помощью сильного основания, такого как водный раствор едкого калия, в спирте, таком как метанол, для получения трео-аминоспирта общей формулы (IX), а затем осуществить N-алкилирование с помощью галогенпроизводного формулы R1Z, в которой R1 определен выше, но при условии, что он не является водородом, и Z является атомом водорода, в присутствии основания, такого как карбонат калия, в полярном растворителе, таком как N,N-диметилформамид, при температуре от температуры окружающей среды до 100°С. Полученный таким образом спирт общей формулы (X) обрабатывают затем так, как описано выше в отношении спирта общей формулы (VIII).
Соединения общей формулы (I), в которой R1 обозначает атом водорода, могут быть получены исходя из соединения общей формулы (I), в которой R1 представляет собой:
- либо фенилметильную группу, возможно замещенную, путем снятия защитной группы с атома азота пиперидинового кольца, например, с помощью окисляющего агента или кислоты Льюиса, такой как трибромид бора, или путем гидрогенолиза,
- либо алкенильную группу, предпочтительно аллильную, путем снятия защитной группы с атома азота пиперидинового кольца, например, комплексом палладия 0,
и получают соединение общей формулы (I), в которой R1 обозначает атом водорода.
Кроме того, хиральные соединения общей формулы (I), соответствующие энантиомерам (1R,2R)-(1S,2S)-(1S,2R) и (1R,2S) различных эритро/трео диастереоизомеров, могут быть получены путем разделения рацемических соединений методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на хиральной колонке или путем расщепления рацемического амина общей формулы (II) с использованием хиральной кислоты, такой как винная кислота, камфорсульфоновая кислота, дибензоилвинная кислота, N-ацетиллейциновая кислота, путем фракционной и предпочтительной перекристаллизации диастереоизомерной соли из растворителя спиртового типа либо путем энантиоселективного синтеза согласно схеме 2 с использованием хирального амида Вейнреба общей формулы (IV).
Рацемический или хиральный амид Вейнреба формулы (IV) может быть получен согласно аналогично методу, описанному в Eur. J. Med. Chem., 35, (2000), 979-988 и в J. Med. Chem., 41, (1998), 591-601. Литийсодержащие гетероциклы общей формулы (V) могут быть получены согласно методам, известным специалисту и аналогично методам, описанным в J.O.C., 62, (1997), 5484-5496 и Tetrahedron Letters, 35, (1994), 3673-3674.
Галогенпроизводные соединения формулы R1Z являются коммерчески доступными продуктами.
Некоторые кислоты или хлорангидриды кислот общей формулы (III) являются коммерчески доступными продуктами или, если они являются новыми соединениями, могут быть получены аналогично методам, которые описаны в патентах ЕР-0556672, US-3801636 и в J.Chem. Soc., (1927), 25, Chem. Pharm. Bull., (1992), 1789-1792, Aust. J. Chem., (1984), 1938-1950, J.O.C., (1980), 527.
Нижеследующие примеры иллюстрируют получение некоторых соединений согласно изобретению. Элементные микроанализы, ИК-спектры и ВЭЖХ на хиральной колонке подтверждают структуру и энантиометрическую чистоту полученных соединений.
Номера, указанные в скобках в названиях примеров, соответствуют номерам первой колонки таблицы, приведенной ниже.
В названиях соединений тире “-“ входит в состав слова, а тире “_” используется только для переноса в конце строки; его следует удалить, если перенос отсутствует, и не заменять ни обычным тире, ни пропуском.
ПРИМЕР 1. (СОЕДИНЕНИЕ № 2)
Гидрохлорид 2-хлор-N-[(1-метилпиперидин-2-ил)-3-тиенилметил]-3-трифторметилбензамида 1:1.
1.1. 1,1-диметилэтил-2-(3-тиенилкарбонил)пиперидин-1-карбоксилат
В колбу емкостью 100 мл вводят в атмосфере аргона 1,8 г (10,8 ммоль) 3-бромтиофена, растворенного в 20 мл безводного диэтилового эфира, и охлаждают среду до -40°С. Затем медленно добавляют 4,8 мл (12 ммоль) 2,5М раствора бутиллития в циклогексане и оставляют смесь при этой температуре на 2 часа.
С помощью переносной иглы вводят литиевое гетероциклическое соединение в раствор 1,5 г (5,5 ммоль) 1,1-диметилэтил-2-(N-метокси-N-метилкарбамоил)пиперидин-1-карбоксилата в 50 мл безводного диэтилового эфира, охлажденный до температуры -20°С, и оставляют смесь при перемешивании в течение 2 часов до достижения температуры окружающей среды.
После гидролиза насыщенным водным раствором хлорида аммония отделяют водную фазу и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, фильтруют, концентрируют при пониженном давлении и очищают остаток путем хроматографии на колонке с силикагелем, элюируя смесью этилацетата с циклогексаном.
Получают 1,2 г соединения в виде бесцветного масла, которое используется как таковое на следующей стадии.
1.2. 1,1-диметилэтил-трео-[гидрокси(3-тиенил)метил]пиперидин-1-карбоксилат
В колбу емкостью 250 мл вводят в атмосфере аргона 1,2 г (4 ммоль) 1,1-диметилэтил-2-(3-тиенилкарбонил)-пиперидин-1-карбоксилата в 40 мл безводного тетрагидрофурана, охлаждают раствор до -78°С, прикапывают 12 мл (12 ммоль) 1М раствора L-Selectride® (три-втор-бутилборгидрид лития) в тетрагидрофуране и перемешивают смесь при -78°С в течение 5 часов.
Медленно гидролизуют на холоду с помощью 7 мл воды и 7 мл 35%-ного водного раствора перекиси водорода и оставляют смесь при перемешивании на 2 часа до достижения температуры окружающей среды.
Разбавляют смесь водой и этилацетатом, разделяют фазы и экстрагируют водную фазу этилацетатом. После промывки объединенных органических фаз, сушки над сульфатом натрия, фильтрации и выпаривания остаток очищают хроматографией на колонке с силикагелем, элюируя смесью этилацетата с циклогексаном. Получают 1 г продукта в виде бесцветного масла, которое используют как таковое на следующей стадии.
1.3. трео-(1-метилпиперидин-2-ил)-(3-тиенил)метанол
В двухгорлую колбу емкостью 50 мл вводят в атмосфере азота 0,63 г (16,6 ммоль) двойного гидрида алюминия и лития в 10 мл безводного тетрагидрофурана, кипятят смесь с обратным холодильником, добавляют 1 г (3,3 ммоль) раствора 1,1-диметилэтил-трео-[гидрокси(3-тиенил)метил]-пиперидин-1-карбоксилата в 35 мл тетрагидрофурана и выдерживают смесь при кипячении с обратным холодильником в течение 2 часов.
Смесь охлаждают, медленно гидролизуют 0,1М раствором двойного тартрата калия и натрия и оставляют смесь при перемешивании в течение ночи. Фильтруют и промывают осадок тетрагидрофураном, затем концентрируют фильтрат при пониженном давлении. Получают 0,6 г маслянистого бесцветного продукта.
1.4. (1-метилпиперидин-2-ил)-(3-тиенил)метанамин
В колбу емкостью 50 мл вводят в атмосфере азота 0,6 г (2,8 ммоль) трео-(1-метилпиперидин-2-ил)-(3-тиенил)метанола и 0,4 мл (2,8 ммоль) триэтиламина в 10 мл безводного дихлорметана, охлаждают среду до 0°С, добавляют 0,22 мл (2,8 ммоль) метансульфонилхлорида, оставляют смесь на 1 час для постепенного доведения ее до температуры окружающей среды и концентрируют смесь при пониженном давлении. В автоклав, снабженный магнитной мешалкой и охлажденный до -50°С, вводят жидкий аммиак, добавляют раствор сырого, только что приготовленного метансульфоната в 30 мл абсолютного этанола, закрывают автоклав и поддерживают перемешивание в течение 48 часов. Выливают смесь в колбу, концентрируют досуха, разбавляют остаток водой и дихлорметаном, разделяют фазы и экстрагируют водную фазу дихлорметаном. После промывки объединенных органических фаз, сушки над сульфатом натрия, фильтрации и испарения растворителей выделяют 0,5 г амина в виде маслянистого соединения, которое используют как таковое на следующей стадии.
1.5. Гидрохлорид 2-хлор-N-[(1-метилпиперидин-2-ил)-(3-тиенил)метил]-3-трифторметилбензамида 1:1
В колбу емкостью 50 мл вводят при 0°С 0,25 г (1,17 ммоль) (1-метилпиперидин-2-ил)-(3-тиенил)метанамина и 0,26 мл (1,4 ммоль) триэтиламина, растворенного в 20 мл дихлорметана. Затем добавляют раствор 0,34 г (1,4 ммоль) хлорангидрида 2-хлор-3-трифторметилбензойной кислоты в 10 мл дихлорметана и оставляют смесь при перемешивании на 2 часа для достижения температуры окружающей среды.
Смесь обрабатывают водой, экстрагируют несколько раз дихлорметаном. После промывки органических фаз водой, затем 1N водным раствором едкого натра, сушки над сульфатом магния, фильтрации и испарения растворителя под уменьшенным давлением остаток очищают с помощью хроматографии на колонке с силикагелем, элюируя смесью дихлорметана с метанолом. Получают 0,23 г маслянистого продукта, которое выделяют в форме гидрохлорида из 0,1N раствора хлористоводородной кислоты в пропан-2-оле.
В заключение выделяют 0,11 г гидрохлорида в виде твердого продукта белого цвета, состоящего из смеси диастереоизомеров трео/эритро с соотношением 83/17.
Температура плавления 124-126°С
ПРИМЕР 2 (СОЕДИНЕНИЕ №6)
Гидрохлорид трео-2-хлор-3-метил-N-[(1-аллилпиперидин-2-ил)-3-пиридинилметил]бензамида 1:1
2.1. 1,1-диметилэтил-2-(3-пиридинилкарбонил)пиперидин-1-карбоксилат
В колбу емкостью 500 мл вводят в атмосфере аргона 14,5 г (91,8 ммоль) 3-бромпиридина, растворенного в 100 мл безводного диэтилового эфира, и охлаждают среду до -78°С. Затем медленно добавляют 40,4 мл (100,9 ммоль) 2,5М раствора бутиллития в циклогексане и оставляют смесь при этой температуре на 0,5 часа.
Добавляют раствор 10 г (36,7 ммоль) 1,1-диметилэтил-2-(N-метокси-N-метилкарбамоил)пиперидин-1-карбоксилата в 50 мл безводного диэтилового эфира, охлажденного до -78°С, и оставляют смесь на 2 часа при перемешивании до достижения температуры окружающей среды.
После гидролиза насыщенным водным раствором хлорида аммония отделяют водную фазу и экстрагируют этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, фильтруют, концентрируют при пониженном давлении и очищают остаток путем хроматографии на колонке с силикагелем, элюируя смесью этилацетата с циклогенксаном.
Получают 5,5 г соединения в виде бесцветного масла, которое используется как таковое на следующей стадии.
2.2. 1,1-диметилэтил-трео-[гидрокси(3-пиридинил)метил]пиперидин-1-карбоксилат
В колбу емкостью 500 мл вводят в атмосфере аргона 5,4 г (18,6 ммоль) 1,1-диметилэтил-2-(3-пиридинилкарбонил)-пиперидин-1-карбоксилата в 220 мл безводного тетрагидрофурана, охлаждают раствор до -78°С, прикапывают 55,8 мл (55,8 ммоль) 1М раствора L-Selectride® (три-втор-бутилборгидрид лития) в тетрагидрофуране и перемешивают смесь при -78°С в течение 3 часов.
Смесь медленно гидролизуют на холоду с помощью 67 мл воды и 67 мл 35%-ного водного раствора перекиси водорода и оставляют смесь при перемешивании на 2 часа до достижения температуры окружающей среды.
Разбавляют водой и этилацетатом, разделяют фазы и экстрагируют водную фазу этилацетатом. После промывки объединенных органических фаз, сушки над сульфатом натрия, фильтрации и выпаривания остаток очищают хроматографией на колонке с силикагелем, элюируя смесью этилацетата с циклогексаном. Получают 4,13 г продукта в виде бесцветного масла, которое используют как таковое на следующей стадии.
2.3. трео-3-пиридинил-(2-пиперидин-2-ил)метанол
В колбу емкостью 50 мл вводят раствор 0,5 г (1,71 ммоль) 1,1-диметилэтил-трео-[гидрокси(3-пиридинил)метил]пиперидин-1-карбоксилата в 6 мл этанола, добавляют водный раствор гидроокиси калия, приготовленный из 0,5 г гидроокиси калия в виде таблеток и 3 мл воды, и кипятят смесь с обратным холодильником в течение 2 часов.
Смесь охлаждают, испаряют растворитель при пониженном давлении, добавляют воду и экстрагируют смесь несколько раз дихлорметаном.
После промывки объединенных органических фаз, сушки над сульфатом магния, фильтрации и выпаривания растворителя при пониженном давлении получают 0,3 г твердого продукта белого цвета, которое используют как таковое на следующей стадии.
2.4. трео-1-аллилпиперидин-2-ил(3-пиридинил)метанол
В колбу емкостью 50 мл, снабженную магнитной мешалкой и системой циркуляции аргона, вводят 0,3 г (1,56 ммоль) трео-3-пиридинил-(2-пиперидин-2-ил)метанола и 10 мл ацетонитрила. В полученную суспензию вводят 0,32 г карбоната калия и 0,17 мл (1,2 экв.) аллилбромида. Суспензию перемешивают при 25°С в течение 6 часов. Добавляют 10 мл воды и 10 мл этилацетата, декантируют и экстрагируют водную фазу три раза при помощи 10 мл этилацетата, промывают объединенные органические фазы при помощи 50 мл воды, затем 500 мл насыщенного раствора хлорида натрия. Сушат над сульфатом натрия, фильтруют и удаляют растворители при пониженном давлении. Получают 0,22 г масла желтого цвета, которое очищают хроматографией на силикагеле (колонка с 120 г наполнителя и градиентом элюирования от 2% до 10% метанола в дихлорметане в течение 30 минут). Выделяют 0,10 г продукта в виде масла желтого цвета.
2.5. трео-(1-аллилпиперидин-2-ил)-(3-пиридинил)метиламин
В колбу емкостью 50 мл вводят в атмосфере азота 0,71 г (3,05 ммоль) трео-(1-аллилпиперидин-2-ил)-(3-пиридинил)метанола и 0,43 мл (3,05 ммоль) триэтиламина в 15 мл безводного дихлорметана, охлаждают среду до 0°С, добавляют 0,23 мл (3,05 ммоль) метансульфонилхлорида, оставляют смесь на 1 час для постепенного доведения ее до температуры окружающей среды и концентрируют смесь при пониженном давлении. В автоклав, снабженный магнитной мешалкой и охлажденный до -50°С, вводят жидкий аммиак, добавляют раствор сырого, только что приготовленного метансульфоната в 30 мл абсолютного этанола, закрывают автоклав и поддерживают перемешивание в течение 48 часов. Выливают смесь в колбу, концентрируют досуха, разбавляют остаток водой и дихлорметаном, разделяют фазы и экстрагируют водную фазу дихлорметаном. После промывки объединенных органических фаз, сушки над сульфатом натрия, фильтрации и выпаривания выделяют 0,57 г амина в виде маслянистого соединения, которое используют как таковое на следующей стадии.
2.6. Гидрохлорид трео-2-хлор-3-метил-N-[(1-аллилпиперидин-2-ил)-(3-пиридинил)метил]бензамида 1:1
В колбу емкостью 50 мл последовательно вводят в 10 мл дихлорметана 0,22 г (1,28 ммоль) 2,3-дихлорбензойной кислоты, 0,25 г (1,29 ммоль) гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида и 0,17 г (1,29 ммоль) гидроксибензотриазола и перемешивают смесь в течение 1 часа при температуре окружающей среды.
Добавляют 0,3 г (1,29 ммоль) трео-(1-аллилпиперидин-2-ил)-(3-пиридинил)метиламина, растворенного в 4 мл дихлорметана, и продолжают перемешивание в течение 15 часов.
Смесь обрабатывают водой, экстрагируют несколько раз дихлорметаном. После промывки органических фаз водой, затем 1N водным раствором едкого натра, сушки над сульфатом магния, фильтрации и испарения растворителя при пониженном давлении остаток очищают с помощью хроматографии на колонке с силикагелем, элюируя смесью дихлорметана с метанолом. Получают 0,15 г маслянистого продукта, которое выделяют в виде гидрохлорида из 0,1N раствора хлористоводородной кислоты в пропан-2-оле.
В заключение выделяют 0,10 г гидрохлорида в виде твердого продукта белого цвета.
Температура плавления 149-151°С.
Нижеследующая таблица иллюстрирует химическую структуру и физические свойства некоторых соединений согласно изобретению.
В колонке “Соль“ знак “-” обозначает соединение в форме основания, а “HCl” обозначает гидрохлорид.
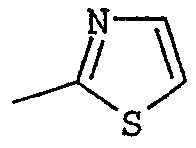
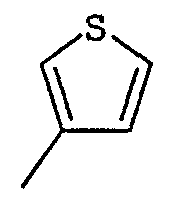
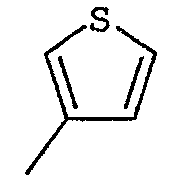
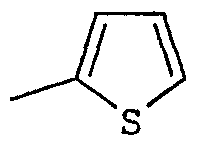
Соединения согласно изобретению были подвергнуты серии фармакологических испытаний, которые показали себя интересными как вещества, обладающие терапевтической активностью.
Изучение переноса глицина в клетках SK-N-MC, экспрессирующих нативный переносчик glyt 1 человека
Захват [14С]глицина изучался на клетках SK-N-MC (нейро-эпителиальные клетки человека), экспрессирующих нативный переносчик glyt 1 человека, путем измерения включенной радиоактивности в присутствии или в отсутствие исследуемого соединения. Клетки культивировали в монослое в течение 48 часов на планшетках, предварительно обработанных фибронектином в концентрации 0,02%. В день эксперимента культуральную среду удаляли и клетки промывали буфером Krebs-HEPES (4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота) с рН 7,4. По истечении 10-минутной предварительной инкубации при 37°С в присутствии либо буфера (контрольная партия), либо исследуемого соединения при различных концентрациях или в присутствии 10 mM глицина (определение неспецифического захвата) добавляли 10 мкМ [14C]глицина (специфическая активность 112 mCi/ммоль). Инкубацию продолжали в течение 10 минут при 37°С, реакцию останавливали путем 2 промывок буфером Krebs-HEPES с рН 7,4. Количество включенной метки измеряли после добавления 100 мкл сцинтилляционной жидкости и перемешивания в течение 1 часа. Подсчет производился на счетчике Microbeta Tri-luxTM. Эффективность соединения определялась по значению CI50, означающему концентрацию соединения, при которой снижается на 50% специфический захват глицина, выражаемый разностью между уровнем радиоактивности, включенной в контрольную партию и в партию, которая содержала глицин в количестве 10 мМ.
В соответствии с тестом наиболее активные соединения согласно изобретению имели значение CI50 около 0,001 при концентрации 1 мкМ.
Изучение переноса глицина в гомогенате клеток спинного мозга мыши
Захват [14C]глицина переносчиком glyt 2 изучался в гомогенате клеток спинного мозга мыши путем измерения включенной радиоактивности в присутствии или в отсутствие исследуемого соединения.
После умерщвления животных (самцы мышей породы OF1 Iffa Crédo весом 20-25 г в день эксперимента) быстро извлекали спинной мозг у каждого животного, взвешивали и помещали на лед. Образцы гомогенизировали в буфере Krebs-HEPES (4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота) с рН 7,4 из расчета 25 мл/г ткани.
Предварительно инкубировали 50 мкл гомогената в течение 10 минут при 25°С в присутствии буфера Krebs-HEPES с рН 7,4 и исследуемого соединения при различных концентрациях или в присутствии 10 мМ глицина для определения неспецифического захвата. Затем добавляли [14C]глицин (специфическая активность = 112 mCi/ммоль) в течение 10 минут при 25°С до конечной концентрации 10 мкМ. Реакцию останавливали фильтрованием в вакууме и определяли радиоактивность путем сцинтилляции твердой пробы на счетчике Microbeta Tri-luxTM.
Эффективность соединения определялась по значению CI50, означающему концентрацию соединения, при которой снижается на 50% специфический захват глицина, выраженный разностью в уровнях радиоактивности, включенной в контрольную партию и в партию, которая получала глицин в количестве 10 мМ.
В соответствии с тестом наиболее активные соединения согласно изобретению имели значение CI50 ниже 1 мкМ.
Как следует из изложенного, соединения согласно изобретению являются специфическими ингибиторами переносчиков глицина glyt 1 и/или glyt 2.
Следовательно, соединения согласно изобретению могут быть использованы для получения лекарственных средств, в частности ингибиторов переносчиков глицина glyt1 и/или glyt2.
Таким образом, согласно одному из аспектов изобретение относится к лекарственным средствам, которые содержат соединение формулы (I) или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или же гидрат или сольват соединения формулы (I).
Соединения согласно изобретению могут быть использованы, в частности для лечения нарушений, связанных с деменцией, психозов, в частности, шизофрении (дефицитная (негативная) и продуктивная форма), и острых или хронических экстрапирамидальных симптомов, вызванных нейролептическими средствами, для лечения различных форм страха, приступов паники, фобий, компульсивных навязчивых состояний, для лечения различных форм депрессии, включая психотическую депрессию, для лечения нарушений, обусловленных злоупотреблением алкоголя или прекращением принятия алкоголя, нарушений сексуального поведения, нарушений приема пищи и для лечения мигрени.
Они могут также использоваться для лечения болезненных мышечных контрактур в ревматологии и при острой спинальной патологии, для лечения спастических контрактур мозгового и спинномозгового происхождения, для симптоматического лечения острых и подострых болей легкой и умеренной интенсивности, для лечения интенсивных и/или хронических болей, нейрогенных и непрекращающихся болей, для лечения болезни Паркинсона и симптомов болезни Паркинсона нейродегенеративного происхождения или вызванных нейролептиками, для лечения первичных и вторичных генерализованных эпилепсий, очаговых эпилепсий с простой или сложной симптоматикой, смешанных форм и других эпилептических синдромов в сочетании с другим антиэпилептическим лечением, или в монотерапии, для лечения апное во сне и в качестве нейропротектора.
Настоящее изобретение относится также к фармацевтическим композициям, содержащим эффективную дозу, по меньшей мере, одного соединения согласно изобретению, в форме фармацевтически приемлемого основания или соли или сольвата, в смеси, при необходимости, с одним или несколькими подходящими эксципиентами.
Указанные эксципиенты выбирают в зависимости от фармацевтической формы или желаемого метода введения.
Фармацевтические композиции согласно изобретению могут быть таким образом предназначены для перорального приема, для введения под язык, для подкожного, внутримышечного, внутривенного введения, для топического нанесения, для внутритрахеального, назального, трансдермального, ректального, внутриглазного введения.
Разовыми вводимыми формами могут быть, например, таблетки, желатиновые капсулы, гранулы, порошки, растворы или суспензии для приема через рот или путем инъекций, чрескожные наклейки (пластыри), свечи. Для топического нанесения можно предусмотреть помады, лосьоны и глазные капли.
В качестве примера разовая вводимая форма соединения согласно изобретению, представленная в виде таблетки, может включать следующие компоненты:
Указанные разовые формы составлены таким образом, чтобы ежедневная доза введения составила от 0,01 до 20 мг активного начала на 1 кг веса пациента в зависимости от галеновой формы.
Однако возможны особые случаи, когда требуется более высокая или более низкая доза; такие дозы входят в объем данного изобретения. В соответствии с существующей практикой подходящая доза для каждого пациента устанавливается врачом с учетом способа введения лекарства, веса пациента и ответа пациента.
Настоящее изобретение в соответствии с другим его аспектом относится к способу лечения патологий, указанных выше, включающему введение пациенту эффективного количества соединения согласно изобретению или одной из его фармацевтически приемлемой соли, или гидрата или сольвата.
Изобретение относится к новым соединениям общей формулы (I):
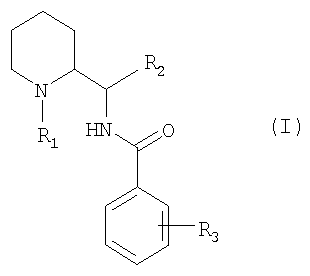
в которой: R1 представляет собой либо прямой или разветвленный (С1-С7)алкил, либо (С2-С4)алкенил; R2 представляет собой пиридинил, тиенил, тиазолил; R3 представляет собой один или несколько заместителей, выбранных из атомов галогена и следующих групп: трифторметил, прямой или разветвленный (С1-С6)алкил; в форме свободного основания или аддитивной соли с кислотой.
Изобретение также относится к лекарственному средству, к фармацевтической композиции, а также к применению.
Технический результат - получение новых биологически активных соединений, обладающих активностью в отношении специфических ингибиторов переносчиков глицина glyt 1 и/или glyt 2. 5 н. и 1 з.п. ф-лы, 1 табл.
1. Соединение общей формулы (I):
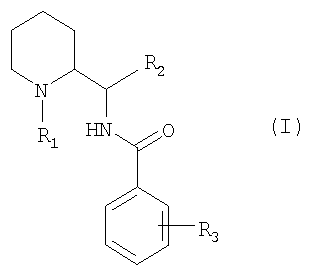
в которой:
R1 представляет собой либо прямой или разветвленный (С1-С7)алкил, либо (С2-С4)алкенил;
R2 представляет собой пиридинил, тиенил, тиазолил;
R3 представляет собой один или несколько заместителей, выбранных из атомов галогена и следующих групп: трифторметил, прямой или разветвленный (С1-С6)алкил; в форме свободного основания или аддитивной соли с кислотой.
2. Соединение по п.1, отличающееся тем, что оно выбрано из следующих соединений:
N-[(1-Аллил-пиперидин-2-ил)-пиридин-3-ил-метил]-2-хлор-3-трифторметил-бензамид;
2-Хлор-N-[(1-метил-пиперидин-2-ил)-тиофен-3-ил-метил]-3-трифторметил-бензамид;
2-Метил-N-[(1-метил-пиперидин-2-ил)-тиофен-3-ил-метил]-3-трифторметил-бензамид;
N-[(1-Аллил-пиперидин-2-ил)-пиридин-3-ил-метил]-2-хлор-3-метил-бензамид;
2-Метил-N-[(1-метил-пиперидин-2-ил)-тиофен-2-ил-метил]-3-трифторметил-бензамид;
2-Хлор-N-[(1-метил-пиперидин-2-ил)-тиофен-2-ил-метил]-3-трифторметил-бензамид;
2-Хлор-N-(пиперидин-2-ил-пиридин-3-ил-метил)-3-трифторметил-бензамид;
2-Хлор-N[циклогексил-(1-метил-пиперидин-2-ил)-метил]-3-трифторметил-бензамид;
Метиловый эфир (2-хлор-3-трифторметил-бензоиламино)-пиперидин-2-ил-уксусной кислоты;
2-Хлор-N-[циклогексил-(1-метил-пиперидин-2-ил)-метил]-3-трифторметил-бензамид;
Метиловый эфир (2-хлор-3-трифторметил-бензоиламино)-пиперидин-2-ил-уксусной кислоты.
3. Лекарственное средство, которое обладает активностью в отношении специфических ингибиторов переносчиков глицина glyt 1 и/или glyt 2, отличающееся тем, что оно содержит соединение по п.1 или аддитивную соль этого соединения с фармацевтически приемлемой кислотой.
4. Фармацевтическая композиция, которая обладает активностью в отношении специфических ингибиторов переносчиков глицина glyt 1 и/или glyt 2, отличающаяся тем, что она содержит соединение согласно изобретению по п.1 или фармацевтически приемлемую соль этого соединения, а также фармацевтически приемлемый эксципиент.
5. Применение соединения формулы (I) по п.1 для получения лекарственного средства, предназначенного для лечения поведенческих нарушений, связанных с деменцией, психозов, различных форм страха, приступов паники, фобий, компульсивных навязчивых состояний, различных форм депрессии, нарушений, обусловленных злоупотреблением алкоголя или прекращением принятия алкоголя, нарушений сексуального поведения, нарушений приема пищи и для лечения мигрени.
6. Применение соединений формулы (I) по п.1 для получения лекарственного средства, предназначенного для лечения контрактур, боли, болезни Паркинсона и симптомов болезни Паркинсона, эпилепсий, смешанных форм и других эпилептических синдромов в сочетании с другим антиэпилептическим лечением, или при монотерапии, для лечения апное во сне и в качестве нейропротектора.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| RU 2000124676 А, 27.08.2002. | |||
Авторы
Даты
2009-04-10—Публикация
2004-10-15—Подача